CATABOLISMO DEGLI SCHELETRI CARBONIOSI
|
|
|
- Aniello Moroni
- 5 anni fa
- Visualizzazioni
Transcript
1 CATABOLISMO DEGLI SCHELETRI CARBONIOSI Si distinguono amminoacidi chetogenici e glucogenici. Gli amminoacidi glucogenici formano ossalacetato che il fegato usa in gluconeogenesi; gli amminoacidi chetogenici sono convertiti in acetil-coa. Alcuni amminoacidi sono sia chetogenici che glucogenici come il triptofano o la treonina. La cellula può possedere due vie metaboliche per ossidare lo scheletro carbonioso dell amminoacido. Un amminoacido come il triptofano può presentare atomi di carbonio che danno origine a glucosio e ai corpi chetonici. Porzioni diverse della molecola hanno destini diversi. È importante sapere il punto di ingresso degli amminoacidi nel ciclo di Krebs per classificarli come chetogenici o glucogenici. Nel metabolismo degli amminoacidi, sia nel catabolismo sia nell anabolismo, hanno un ruolo importante i coenzimi del trasporto di unità monocarboniose: la biotina, il tetraidrofolato e la S- adenosilmetionina. La biotina partecipa al trasferimento di unità di carbonio nello stato più ossidato, sotto forma di CO 2. Trasferimento di CO2 87
2 Il tetraidrofolato partecipa al trasferimento di unità monocarboniose in uno stato più ridotto, rispetto alla biotina, sotto forma di aldeide, gruppo metilico e gruppo metilenico CH2OH. È costituito da 3 porzioni: 6metilpterina, p-aminobenzoato e glutammato. I due atomi che servono per svolgere la sua funzione di catalisi sono i due atomi di azoto (5 e 10 della 6metilpterina). Per sintetizzare questo composto si parte dalla vitamina acido folico. L acido folico deve essere ridotto da una diidrofolato reduttasi, consumando NADPH, prima a diidrofolato e poi a tetraidrofolato. Quest ultimo partecipa a una serie di metabolismi. Il tetraidrofolato prevalentemente trasporta unità carboniose in forma di aldeide e metilene. Poche sono le reazioni all interno delle quali riesce a trasferire il gruppo metilico. Ci sono due reazioni che caricano sul tetraidrofolato le unità monocarboniose: 1. L enzima serina idrossimetiltransferasi usa come cofattore il piridossalfosfato per trasferire la serina sul tetraidrofolato che si lega all azoto 5 e 10. Il carbonio entra a far parte del coenzima e il gruppo alcolico è liberato sotto forma di H 2 O. La serina diventa glicina. Si forma il N 5, N 10 metilene-tetraidrofolato. Attraverso una reazione irreversibile catalizzata dal N 5, N 10 metilene-tetraidrofolato reduttasi, con impiego di NAD +, si può ottenere la forma che trasporta carbonio più ridotto, il N 5 metil-tetraidrofolato. 88
3 2. Recupera l unità monocarboniosa dal formiato con consumo di ATP. L enzima N 10 - formiltetraidrofolato sintetasi carica un gruppo formile sull azoto 10 del tetraidrofolato formando l N 10 -formil-tetraidrofolato. Una ciclo idrolasi successivamente lo trasforma in N 5, N 10 metenil-tetraidrofolato (forma intermedia), con liberazione di un H 2 O che può essere trasformato in N 5 -formimino-tetraidrofolato da una ciclo deaminasi tramite l aggiunta di un NH 4 +. L N 5, N 10 metenil-tetraidrofolato può inoltre essere convertito in N 5,N 10 metilenetetraidrofolato da una N 5, N 10 metilene-tetraidrofolato deidrogenasi; oppure può essere convertito in N 5 -formil-tetraidrofolato da una cicloidrolasi (via minoritaria). Questo composto può ritornare indietro, in quanto tutte queste reazioni sono reversibili, con l enzima N 5, N 10 metenil-tetraidrofolato e ATP. Se manca acido folico nella dieta, diminuisce la concentrazione di tetraidrofolato, le reazioni precedenti sono compromesse. 89
4 La S-adenosilmetionina partecipa al trasferimento di -CH 3. E formata dall adenosina che è legata covalentemente alo zolfo della metionina. Trasferimento di -CH3 Nella cellula viene sintetizzata a partire da metionina e ATP. È una reazione rarissima in quanto viene rotto il legame esterico. L ATP perde tutti e tre i gruppi fosfato. La sintesi di S-adenosil-metionina è catalizzata dall enzima metionina adenosil transferasi. Lo zolfo acquista una carica positiva netta. Il gruppo metilico che il coenzima cede è l ultimo. La S-adenosil-metiotina partecipa a una serie di reazioni ed è usata dagli enzimi metiltransferasi. Una volta che ha ceduto il gruppo metilico si trasforma in S-adenosil-omocisteina. La cellula ora può eliminare S-adenosil-omocisteina e si rigenera S-adenosil-metionina partendo da metionina e adenosina (processo molto costoso) oppure può rigenerare S-adenosil-metionina partendo da Sadenosilomocisteina (processo privilegiato). 90
5 Come si ricicla l S-adenosil-metionina? L omocisteina può essere substrato di una idrolasi che rimuove l adenosina, liberando acqua, e forma la S-adenosil-omocisteina. Può diversamente essere metilata ricevendo un gruppo metilico dal tetraidrofolato in forma N 5 - metiltetraidrofolato con l intervento del coenzima B12 e dell enzima metionina sintasi. Degradazione degli amminoacidi a PIRUVATO Gli amminoacidi che vengono degradati a piruvato sono la treonina, il triptofano, l alanina, la glicina, la serina e la cisteina. Via secondaria nell'uomo - Il triptofano: non tutti i suoi carboni vanno a formare piruvato, ma solo quello del gruppo carbossilico, il carbonio α e il primo carbonio della catena R. Essi vengono rimossi attraverso 4 reazioni dall anello aromatico e si forma in alanina. - L alanina: viene trasformata in piruvato tramite l alanina aminotransferasi che rimuove il gruppo amminico e si ottiene l αchetoacido. - La cisteina: per convertirla in piruvato bisogna rimuovere il gruppo tiolico (-SH) tramite un idrolasi e il gruppo amminico (NH 2 ) tramite una amminotransferasi. - La serina: le cellule hanno una serina deidratasi, che è un enzima che usa PLP, ed è uno dei pochi amminoacidi che nel suo catabolismo perde il gruppo amminico direttamente come ione ammonio. La serina deidratasi catalizza due eventi: la rimozione del gruppo amminico che si trasforma in gruppo chetonico e la rimozione del gruppo ossidrilico. Così facendo i tre carboni diventano piruvato. 91
6 - La glicina: subisce tre diverse reazioni, due delle quali portano alla formazione di piruvato e la terza porta alla formazione di un altro composto. 1. La glicina viene convertita in serina aggiungendo CH 2 OH tramite l enzima serina idrossimetil transferasi ed è un enzima che trasferisce il gruppo metilenico, a spese del tetraidrofolato, sullo scheletro della glicina trasformando in serina usando PLP. 2. L enzima di clivaggio della glicina utilizza NADP +, rompe la glicina in gruppo carbossilico che viene liberato in CO 2 e in gruppo amminico liberato come ione ammonio e un gruppo metilenico che viene trasferito sul tetraidrofolato. 3. La terzia via di degradazione della glicina porta alla formazione di ossalato attraverso la formazione dell intermedio gliossalato attraverso l enzima amino acido ossidasi (a funzione mista) che usa ossigeno molecolare e libera il gruppo amminico della glicina come NH 3 o come NH 4 +. Degradazione degli amminoacidi a ACETILCOA Gli amminoacidi che vengono degradati a acetilcoa sono il triptofano, la lisina, la fenilalanina, la tirosina, la isoleucina e la leucina. - Il triptofano, attraverso varie reazioni, viene trasformato in alanina che produce piruvato. I quattro carboni in rosa entrano a far parte dell αchetoadipato (intermedio in cui vengono trasformati anche 4 atomi di lisina) che poi viene ossidato a glutarilcoa che viene decarbossilato acetilcoa. - La fenilalanina deve essere essere convertita in tirosina. Servono molte reazioni per rompere l anello aromatico, una struttura particolarmente stabile. Quasi tutti gli enzimi coinvolti nella degradazione della fenilalanina sono ritrovati mutati in una serie di reazioni metaboliche importanti: fenilchetunuria, tirosinemia I, II, III e alcaptonuria. 1. La fenilalanina viene degradata e la tirosina viene sintetizzata: la fenilalanina viene convertita in tirosina tramite l enzima fenilalanina idrossilasi che deve ricorrere a due coenzimi, il NADH e la tetraidrobiopterina. La tetraidrbiopterina ha la funzione di raccogliere gli equivalenti riducenti dal NADH e cederli alla fenilalanina idrossilasi che inserisce un ossigeno nell anello della tirosina e un ossigeno invece è usato per diventare acqua. 2. La tirosina viene deaminata da una tirosina amminotransferasi e il gruppo amminico della tirosina viene passato sul glutammato. Il composto ottenuto è il p-idrossifenilpiruvato. 3. Avviene dunque una deidrogenazione: usando ossigeno molecolare si introduce un secondo gruppo ossidrilico sull anello aromatico. Il gruppo carbossilico viene eliminato sotto forma di CO 2 e contemporaneamente il carbonio chetonico viene ossidato a gruppo carbossilico. La molecola ottenuta è l omogentisato 92
7 4. L omogentisato è substrato di un altra diossigenasi che permette l apertura dell anello aromatico. Si ottiene il maleilacetoacetato. Questo composto ha un doppio legame cis che deve diventare trans attraverso le isomerasi. 5. Si ottiene il fumaril acetoacetato. Una liasi, il fumaril acetoacetasi, rompe il Krebs, mentre l acetoacetato diventerà acetoacetilcoa. - La leucina: può produrre acetoacetato che diventa poi acetoacetil-coa e poi acetil-coa o può produrre direttamente acetilcoa. - L isoleucina: produce acetil-coa e propionil-coa. 93
8 Degradazione degli amminoacidi a αchetoglutarato Gli amminoacidi che vengono degradati a αchetoglutarato sono l arginina, l istidina, il glutammato, la glutammina. - L arginina: nel fegato essa sfrutta l enzima del circolo dell urea, l arginasi. Quando è in eccesso per il ciclo dell urea viene degradata. Il primo passaggio della degradazione dell ornitina è la rimozione del gruppo amminico in posizione δ. L enzima δ ammino transferasi usa l αchetoglutarato come accettore e genera glutammato. Il carbonio 5 viene ossidato e diventa aldeide. Si è formato così la glutammato γ-semialdeide. Questo prodotto viene ossidato a glutammato dalla glutammato demialdeide deidrogenasi con l impiego di NADP o NAD. - La prolina: tramite due reazioni giunge all intermedio glutammato γ-semialdeide. - L istidina: attraverso quattro reazioni giunge a glutammato. Nella prima viene rimosso il gruppo -NH 2, nella seconda e nella terza vengono aggiunte due molecole di acqua, nella quarta viene trasferito il gruppo formimminico sul tetraidrossifolato. - La glutammina: viene convertita in glutammato tramite l enzima glutaminasi. - Il glutammato: viene convertito in αchetoglutarato dall enzima glutammato deidrogenasi. a 94
9 Degradazione degli amminoacidi a SUCCINILCOA Gli amminoacidi che vengono degradati a succinilcoa sono la metionina, treonina, valina e isoleucina. Degradazione degli amminoacidi a catena ramificata Gli amminoacidi a catena ramificata sono la valina, l isoleucina e la leucina. Essi sono principalmente metabolizzati nel fegato. Le vie extraepatiche sono diverse: l amminotransferasi specifica trasforma questi amminoacidi in αchetoacidi; la deidrogenasi insieme alla piruvato e alla αchetoglutarato deidrogenasi usa NAD, aggiunge CoA e decarbossila. Questo complesso usa i coenzimi TPP, lipoato e FAD. Mutazioni a carico di questa deidrogenasi: la sua assenza causa la mattia urine da sciroppo d acero. Tessuti extraepatici 70/71 95
10 Degradazione degli amminoacidi a OSSALACETATO Gli amminoacidi che vengono degradati a ossalacetato sono l asparagina e l aspartato. L asparagina viene trasformata in aspartato dalla asparaginasi. L aspartato poi viene trasformato in ossalacetato dall aspartato aminotranferasi. 96
11 BIOSINTESI DEI COMPOSTI AZOTATI Enzimi essenziali glutammina sintetasi e glutammina ammidotransferasi. I donatori di N sono la glutammato in reazioni amminotransferasiche e la glutammina in reazioni ammidotransferasiche. La glutammina sintetasi, enzima multimerico, si trova al centro delle vie di degradazioni degli amminoacidi e della via che porta alla sintesi di tuti i composti azotati. La quantità di glutammina presente deve essere regolata in modo da soddisfare tutte le esigenze dell organismo. Esistono due tipi di regolazione: - Allosterica: con ampia serie di composti che agiscono come modulatori regolativi sulla glutammina sintetasi. È additiva: se sono tutti presenti, l enzima è fermo, se ce ne sono uno o due l enzima risulta inibito e funziona più lentamente ma non è completamento spento. Regola in maniera fine la sintesi della glutammina. I regolatori allosterici sono alcuni amminoacidi come la glicina, l alanina, l istidina, il triptofano, l AMP e CTP, la glucosammina 6-fosfato (un glucosamminoglicani), il carbamoil fosfato. Il carbamoil fosfato è presente nella cellula in due pool: uno è il punto di partenza del ciclo dell urea, uno è il punto di partenza della sintesi delle pirimidine. 97
12 - Covalente: la glutammina sintetasi viene adenilato, ovvero viene aggiunto un AMP all enzima. Questa modificazione influirà sulla struttura tridimensionale dell enzima e quindi sulla sua attività. Anche l adenilazione deve essere regolata: l enzima viene inattivato da un adenilazione, viene poi attivato tramite una deanilazione. Questo processo viene catalizzato dall adenil transferasi (AT), che esiste in associazione con una proteina P II. A sua volta P II può presentare uno stato senza modificazione covalente e quando il complesso AT- P II è formato promuove l adenilazione dell enzima bersaglio. Nella cellula il complesso AT- P II può venir uridilato, ovvero P II può essere coniugato con UMP. Quando il complesso è uridilato, l enzima rimuove l adenilazione della glutammina sintetasi. Esiste un enzima, l uridiltransferasi, che è responsabile della uridilazione di P II. Se l uridil transfersi è attivo si ha l adenilazione della proteina, se è inattivo non funziona. L uridil transferasi è inibita da fosfato inorganico e glutammina, che sono i prodotti finali della sintesi della glutammina. L uridilazione è invece attivata dai precursori dell intero processo, ovvero ATP e αchetoglutarato (precursore a monte della sintesi del glutammato). Noi non possiamo conservare forme di composti azotati. 6/ 98
13 Meccanismo catalitico La glutammina cede il suo azoto ammidico durante le reazioni attraverso le glutammina ammidotransferasi. Esse si differenziano in base alla specificità per il substrato. La glutammina cede il gruppo NH 2 che viene liberato sotto forma di NH 3 e quando viene accettato dai donatori può essere accettato sia come gruppo amminico che come gruppo imminico o ammidico. Il primo domino catalitico è il sito di legame per la glutammina, il secondo dominio è specifico per il tipo di substrato che accetterà il gruppo amminico della glutammina. Le due porzioni del sito attivo sono legate da un canale per l ammoniaca. La seconda porzione è specifica per il substrato che accetterà l azoto. All interno del primo sito attivo (quello il cui si lega la glutammina), l amminoacido fondamentale è una cisteina che funziona con un meccanismo di catalisi covalente. Si forma un legame covalente tra il carbonio ammidico in γ della catena R e il tiolo fornito dalla cisteina. Si forma il legame e contemporaneamente grazie all ingresso di un protone esce ammoniaca. Sono entrati i donatori e l ammoniaca attraversa il canale e si sposta nella seconda parte del sito attivo dove avviene la reazione tra l ammoniaca e il substrato. Si formeranno le ammine o le immine. Abbiamo l ingresso dell acqua nel sito attivo che permette l idrolisi del legame tioestere liberando il glutammato. Dal sito attivo si libera il prodotto ottenuto. 99
14 Meccanismo d azione della famiglia delle glutammina ammidotransferasi 100
15 BIOSINTESI DEGLI AMMINOACIDI Dei 20 amminoacidi che servono per la sintesi proteica, l uomo ne sintetizza solamente 11. Gli altri sono detti essenziali e sono introdotti con l alimentazione: lisina, isoleucina, leucina, treonina, valina, triptofano, fenilalanina, metionina e istidina. A seconda delle condizioni fisiologiche dell organismo si possono aggiungere altri non essenziali. I carboni sono forniti da una serie di composti: il ribosio 5-fosfato fornisce istidina, il 3- fosfoglicerato fornisce i carboni per la serina che poi porta alla sintesi di glicina e cisteina, il 3- fosfoglicerato può diventare eritrosio 4-fosfato dal quale si ottengono gli scheletri per il triptofano, la fenilalanina e la tirosina. Il piruvato è usato per la sintesi di alanina, valina, leucina e isoleucina. L αchetoglutarato fornisce lo scheletro per il glutammato da cui si ottiene glutammina, prolina e arginina. L ossalacetato fornisce aspartato che dà asparagina, metionina, treonina e lisina. 101
16 Sintesi di serina Il 3-fosfoglierato viene ossidato dalla fosfoglicerato deidrogenasi, producendo un NADH, e si ottiene il 3 fosfoidrossipiruvato. Su questo αchetoacido una fosfoserina amminotransferasi trasferisce il gruppo amminico, preso dal glutammato, e si ottiene 3-fosfoserina. Per ottenere la serina bisogna defosforilare il 3-fosfoserina attraverso una fosfoserina fosfatasi. Sintesi di glicina La glicina si ottiene dalla serina tramite una serina idrossi metiltransferasi. La glicina si ottiene rimuovendo la catena laterale della serina trasferita al tetraidrofosfato in forma metilenica. Esiste anche una via alternativa per la sintesi della glicina che avviene nel fegato. Questa via parte dalla CO 2, dall NH 3 e dal gruppo metilenico formato dal tetraidrofolato. 102
17 Sintesi della cisteina La cisteina viene sintetizzata tramite due reazioni a partire dalla condensazione di omocisteina e serina. Dalla condensazione di queste due molecole si forma la cistationina, un omosolfuro. L enzima cistationina γ liasi porta avanti due reazioni: l idrolisi della cistationina, che rompe il legame tra zolfo e il carbonio dell omocisteina, e si ottiene la cisteina; viene eliminato il gruppo amminico liberato sotto forma di NH 4 + e si forma l αchetobutirrato. L omοcisteina proviene dall Αdomet. L αchetobutirrato può essere ossidato dalla βossidazione ed entrare nel ciclo di Krebs. L αchetoglutarato fornisce atomi di carbonio per sintetizzare il glutammato tramite transaminasi. Dal glutammato si può sintetizzare glutammina, prolina e arginina. Sintesi di prolina La prolina è un imminoacido. Per azione di una glutammato chinasi il glutammato viene fosforilato e si produce γ-glutamil fosfato. Esso viene deidrogenato da una glutammato deidrogenasi: viene ridotto il gruppo carbossilico, in posizione γ appena fosforilato, in un aldeide e il fosfato viene liberato come inorganico. Si forma la γ-semialdeide. Questo composto è molto instabile, reagisce subito e si forma la Δ 1 pirrolina-5-carbossilato con un doppio legame. Questa struttura viene ridotta a prolina tramite l enzima pirrolina carbossilato riduttasi. Può anche qui usare sia NADH che NADPH. 23/ 103
18 Sintesi di arginina Può essere sintetizzata partendo dalla glutammato γ semialdeide che può essere substrato dell enzima ornitina δ-amminotransferasi. Questo enzima recupera il gruppo amminico del glutammato e lo lega in posizione δ alla γ semialdeide ottenendo l ornitina. L ornitina porta alla sintesi di arginina attraverso il ciclo dell urea. Questa sintesi avverrà soprattutto nel fegato. L arginina può essere anche sintetizzata tramite uno scambio di intermedi tra cellule dell intestino e cellule dei tubuli renali: le cellule dell intestino usando ammoniaca libera, bicarbonato e ATP possono produrre carbamil fosfato che produce a sua volta la citrullina; oppure possono intraprendere la via metabolica che da glutammato produce ornitina e poi citrullina. La citrullina viene messa in circolo e recuperata dalle cellule dei tubuli renali che la trasformano ad arginina. Le cellule renali mancano di arginasi, quindi l arginina viene messa in circolo a disposizione degli altri tessuti o viene usata dal rene stesso. 104
19 L ossalacetato produce l aspartato che a sua volta dà origine ad altri amminoacidi quali la metionina, la lisina, la treonina e l asparagina. Nell uomo però l aspartato produce solamente l asparagina in quanto gli altri amminoacidi sono essenziali. Il piruvato dà origine all alanina, la valina, la leucina, la isoleucina. Nell uomo viene usato nell uomo solo per la sintesi di alanina. Sintesi di alanina L enzima alanina amminotransferasi partendo da glutammato e piruvato per ottenere alanina e αchetoglutarato. CH3 Alanina CH3 Piruvato 105
20 Sintesi di aspartato Si ottiene per transaminazione usando l aspartato amminotransferasi. Il gruppo NH 3 + è ceduto dal glutammato per fare aspartato e αchetoglutarato. Sintesi di asparagina Il gruppo amminico dell asparagina è donato dalla glutammina. L asparagina si ottiene dall aspartato tramite l asparaginasi sintetasi. Sintesi di tirosina La tirosina si ottiene dalla fenilalanina che viene introdotta con l alimentazione. La fenilalanina viene degradata a tirosina dalla fenilalanina idrossilasi che usa il tetraidropiobterina. COMPOSTI DERIVANTI DAGLI AMMINOACIDI Sintesi di creatina La creatina svolge un ruolo importante nell omeostasi del muscolo scheletrico. Può esistere nella sua forma fosforilata che conserva energia nel muscolo sotto forma di fosfocreatina. Per sintetizzare la creatina si parte dalla glicina e dall arginina. La glicina fornisce tutti i suoi acidi, l arginina fornisce solo l urea (gruppo guanidinico). Attraverso l amidinotransferasi si forma la guanidinoacetato in quanto l enzima prende l urea dall arginina e la lega al gruppo amminico della glicina. Introducendo un gruppo -CH 3 tramite metilazione con l enzima metiltransferasi si ottiene la creatina. Il gruppo metilico è fornito dall Sadenosil metionina. La creatina può essere fosforilata, a livello del substrato, dalla creatina chinasi e diventare fosfocreatina. Queste reazione è reversibile in base alla presenza maggiore di ATP o ADP. La creatina viene eliminata come creatinina e viene filtrata completamente a livello renale. 106
21 Sintesi di glutatione (γ glutamil cistinil glicina) La sintesi di glutatione avviene soprattutto nel globulo rosso. Il glutatione elimina i radicali dell ossigeno. Il glutatione è formato dalla γ-glutammato, dalla cisteina e dalla glicina. Si parte dal glutammato e tramite l enzima γ-glutammil cistein sintetasi si uniscono il glutammato e la cisteina. Il gruppo carbossilico in γ del glutammato si lega al gruppo amminico in α della cisteina (si forma un legame ammidico). Si ottiene così la γ-gluamil-cisteina. Su questo composto la glutatione sintetasi inserisce la glicina per formare il glutatione finale. Il legame peptidico si forma tra il gruppo carbossilico in α della cisteina e il gruppo amminico in α della glicina. Nelle cellule il glutatione partecipa al ciclo del γglutammile ed è utilizzato nel rene per il trasporto degli amminoacidi. Esiste la γ-glutamiltranspeptidasi, un enzima di membrana, che prende il glutatione sul lato citosolico e un amminoacido sul lato extracellulare e trasferisce il γ glutammile dal glutatione all amminoacido formando un γ-glutamil amminoacido e una cisteinilisina. La cisteinilisina si separa successivamente in cisteina e lisina; mentre il γ-glutamil amminoacido viene trasportato nella cellula tramite un trasportatore di amminoacidi. Quando l amminoacido arriva nella cellula, viene rimosso il γ-glutammile sotto forma di 5- idrossiprolina e viene riconvertito in glutammato che viene poi usato dalle cellule per risintetizzare il glutatione. Questo trasporto è importante a livello renale per trasportare gli amminoacidi. 107
22 BIOSINTESI AMMINE BIOATTIVE Le ammine bioattive sono ammine che hanno una funzione nel nostro organismo e sono la dopamina, la noradrenlaina, l adrenalina, il GABA, l istamina, la serotonina, la melatonina e l ossido nitrico. Sintesi di dopamina, norepinefrina e epinefrina La via metabolica che porta alla loro sintesi è unica. Sono sintetizzati in sequenza uno dopo l altro a partire dall amminoacido tirosina. 1. La tirosina viene idrossilata dall enzima tirosina idrossilasi, un ossigenasi mista che usa la tetraidrobiopterina e l ossigeno molecolare come coenzimi. Si aggiunge un gruppo ossidrilico sull anello aromatico e si ottiene la dopa. 2. La dopa viene decarbossilata tramite l enzima decarbossilasi, specifico per gli amminoacidi, aromatici e usa il piridossalfosfato (PLP) come coenzima. Si ottiene la dopamina con eliminazione di una CO 2. Una malattia degenerativa, come il morbo di Parkinson, è causato dalla diminuzione della dopa e della dopamina. 3. Avviene un altra idrossilazione grazie all enzima è β idrossilasi. Questo enzima è un ossigenasi a funzione mista che impiega l ascorbato e ossigeno molecolare come coenzimi. Viene inserito un gruppo -OH sul carbonio β. Si ottiene la norepinefrina o noradrenalina. 4. L ultima reazione che porta alla sintesi di epinefrina (o adrenalina) è una metilazione a livello del gruppo amminico attraverso l enzima feniletanolammina N-metiltransferasi. Il donatore del gruppo metilico è l S-adenosilmetionina. Queste due molecole sono prodotte e rilasciate dalla midollare del surrene. La norepinefrina è un neurotrasmettitore. 108
23 Sintesi di GABA (acido γ ammino butirrico) Viene prodotto dal glutammato che viene decarbossilato dall enzima glutammato decarbossilasi che usa PLP. Viene rimosso il gruppo carbossilico in α dell amminoacido. Sintesi di istamina Viene prodotta a partire dall istidina che viene decarbossilata dall enzima istidina decarbossilasi che impiega PLP come cofattore. Viene rimosso il gruppo carbossilico in α e si ottiene l istamina. L istamina è prodotta durante le reazioni allergiche. 109
24 Sintesi di serotonina e melatonina La serotonina è l ormone della felicità. La melatonina serve a regolare i ritmi circadiani (ciclo sonnoveglia). 1. L anello aromatico del triptofano viene idrossilato dalla triptofano idrossilasi che impiega come cofattori l ossigeno molecolare e la tetraidrobiopterina. Si ottiene il 5-idrossitriptofano. 2. Il 5-idrossi-triptofano viene decarbossilato da una decarbossilasi specifica per gli amminoacidi aromatici e si ottiene la serotina. 3. La serotina viene acetilata attraverso attraverso l acetilcoa formando N-acetilserotonina. 4. Il gruppo ossidrilico inserito precedentemente deve essere metilato. Il gruppo metilico è ceduto dalla S-adenosinmationina ad opera della S-adenosinmetionina transferasi. Si forma così la melatonina. 110
25 Sintesi di NO (ossido nitrico) L ossido nitrico è un ormone sintetizzato a partire dall arginina. Gli enzimi impiegati nella sua sintesi sono gli ossido nitrico sintasi. 1. Il gruppo NH 2 + dell arginina viene rimosso e il suo azoto darà origine all azoto del NO. Avviene l ossidazione dell azoto e del carbonio. Il donatore di equivalenti riducenti è il NADPH e l ossigeno molecolare è utilizzato per inserire atomi di ossigeno. 2. Si forma l idrossiarginina su cui agisce NADPH per formare citrullina e NO (ha un elettrone spaiato, è un radicale). Il NO entra per diffusione nelle cellule bersaglio. 111
Metabolismo degli Ammino Acidi
 Metabolismo degli Ammino Acidi R 1 C C - R 2 C C - N 3 Transaminasi R 1 C C - R 2 C C - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due a-cheto acidi.
Metabolismo degli Ammino Acidi R 1 C C - R 2 C C - N 3 Transaminasi R 1 C C - R 2 C C - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due a-cheto acidi.
FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI
 FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI ZIMOGENI ATTIVATI NEL LUME INTESTINALE DURANTE LA DIGESTIONE DELLE PROTEINE ESOGENE Tripsina, chimotripsina,
FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI ZIMOGENI ATTIVATI NEL LUME INTESTINALE DURANTE LA DIGESTIONE DELLE PROTEINE ESOGENE Tripsina, chimotripsina,
Metabolismo degli Ammino Acidi
 Metabolismo degli Ammino Acidi R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due α-cheto acidi. Amminotransferasi
Metabolismo degli Ammino Acidi R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due α-cheto acidi. Amminotransferasi
FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI
 FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI ZIMOGENI ATTIVATI NEL LUME INTESTINALE DURANTE LA DIGESTIONE DELLE PROTEINE ESOGENE Tripsina, chimotripsina,
FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI ZIMOGENI ATTIVATI NEL LUME INTESTINALE DURANTE LA DIGESTIONE DELLE PROTEINE ESOGENE Tripsina, chimotripsina,
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi Gli amminoacidi derivati in gran parte dalla degradazione delle proteine della dieta o intracellulari possono essere ossidati per generare energia. La quantità di energia
Metabolismo degli amminoacidi Gli amminoacidi derivati in gran parte dalla degradazione delle proteine della dieta o intracellulari possono essere ossidati per generare energia. La quantità di energia
PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE (a)
 Università di Roma Tor Vergata - Scienze della Nutrizione Umana Biochimica della Nutrizione Prof.ssa Luciana Avigliano 2011 PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE (a) amminoacidi proteine
Università di Roma Tor Vergata - Scienze della Nutrizione Umana Biochimica della Nutrizione Prof.ssa Luciana Avigliano 2011 PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE (a) amminoacidi proteine
Il metabolismo dei lipidi
 Il metabolismo dei lipidi Digestione, assorbimento e trasporto dei lipidi Concetti chiave I triacilgliceroli sono demoliti dalle lipasi e i prodotti derivanti dalla loro scissione sono assorbiti dall intestino.
Il metabolismo dei lipidi Digestione, assorbimento e trasporto dei lipidi Concetti chiave I triacilgliceroli sono demoliti dalle lipasi e i prodotti derivanti dalla loro scissione sono assorbiti dall intestino.
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi 1 2 Glicina, Serina, Alanina e Cisteina sono degradate a piruvato 3 Il glutammato è un amminoacido glucogenico glutammato H O H O - OOC-C-CH 2 -CH 2 -C-NH 2 NH 3 glutammina
Metabolismo degli amminoacidi 1 2 Glicina, Serina, Alanina e Cisteina sono degradate a piruvato 3 Il glutammato è un amminoacido glucogenico glutammato H O H O - OOC-C-CH 2 -CH 2 -C-NH 2 NH 3 glutammina
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
 METABOLISMO DEGLI AMMINOACIDI 1.Quali tra i seguenti sono amminoacidi semiessenziali: -Arginina e istidina -valina e treonina -fenilalanina e metionina -glicina e alanina Cosa si intende per semi essenziali?
METABOLISMO DEGLI AMMINOACIDI 1.Quali tra i seguenti sono amminoacidi semiessenziali: -Arginina e istidina -valina e treonina -fenilalanina e metionina -glicina e alanina Cosa si intende per semi essenziali?
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
La fissazione dell azoto
 La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
Biochimica e Biologia per le professioni sanitarie, McGraw-Hill
 Biochimica e Biologia per le professioni sanitarie, McGrawHill Tab. 20.1 Amminoacidi essenziali per l uomo Arginina Istidina Isoleucina Leucina Lisina Metionina Fenilalanina Treonina Triptofano Valina
Biochimica e Biologia per le professioni sanitarie, McGrawHill Tab. 20.1 Amminoacidi essenziali per l uomo Arginina Istidina Isoleucina Leucina Lisina Metionina Fenilalanina Treonina Triptofano Valina
TRANSAMINASI E CICLO DELL UREA
 TRANSAMINASI E CICLO DELL UREA L energia metabolica ottenuta dagli amminoacidi, sia derivati dalle proteine della dieta, sia dalle proteine dei tessuti, varia notevolmente a seconda del tipo di tessuto
TRANSAMINASI E CICLO DELL UREA L energia metabolica ottenuta dagli amminoacidi, sia derivati dalle proteine della dieta, sia dalle proteine dei tessuti, varia notevolmente a seconda del tipo di tessuto
CICLO DI KREBS (o DELL ACIDO CITRICO)
 CICLO DI KREBS (o DELL ACIDO CITRICO) È un processo ossidativo che ha un ruolo centrale nel metabolismo energetico delle cellule eucariotiche. Avviene nella matrice mitocondriale. È alimentato soprattutto
CICLO DI KREBS (o DELL ACIDO CITRICO) È un processo ossidativo che ha un ruolo centrale nel metabolismo energetico delle cellule eucariotiche. Avviene nella matrice mitocondriale. È alimentato soprattutto
Nella Biosfera viene mantenuto un un equilibrio tra l azoto totale inorganico e quello organico
 Gli a.a. oltre ad essere i costituenti delle proteine giocano numerosi ruoli metabolici: precursori di ormoni, vitamine, coenzimi, porfirine, pigmenti e neurotrasmettitori L esistenza di 20 a.a. nelle
Gli a.a. oltre ad essere i costituenti delle proteine giocano numerosi ruoli metabolici: precursori di ormoni, vitamine, coenzimi, porfirine, pigmenti e neurotrasmettitori L esistenza di 20 a.a. nelle
ricerca Lista di lavoro del Progetto Enzimi - Wikipedia https://it.wikipedia.org/wiki/progetto:bi o/enzimi/lista_nomi_accettati/4
 ricerca Lista di lavoro del Progetto Enzimi - Wikipedia https://it.wikipedia.org/wiki/progetto:bi o/enzimi/lista_nomi_accettati/4 Il destino dello scheletro carbonioso dipende dallo STATO METABOLICO e
ricerca Lista di lavoro del Progetto Enzimi - Wikipedia https://it.wikipedia.org/wiki/progetto:bi o/enzimi/lista_nomi_accettati/4 Il destino dello scheletro carbonioso dipende dallo STATO METABOLICO e
Capitolo 6 La respirazione cellulare
 Capitolo 6 La respirazione cellulare Introduzione alla respirazione cellulare 6.1 La respirazione polmonare rifornisce le nostre cellule di ossigeno ed elimina diossido di carbonio La respirazione polmonare
Capitolo 6 La respirazione cellulare Introduzione alla respirazione cellulare 6.1 La respirazione polmonare rifornisce le nostre cellule di ossigeno ed elimina diossido di carbonio La respirazione polmonare
I mammiferi sono privi dell enzima nitrogenasi, in grado di fissare l azoto atmosferico N2 NH3.
 Le proteine della dieta vengono scisse, nello stomaco e nell intestino, da diversi enzimi (pepsina, chimotripsina, carbossipeptidasi, elastasi) e i singoli amminoacidi sono assorbiti dalla parete intestinale.
Le proteine della dieta vengono scisse, nello stomaco e nell intestino, da diversi enzimi (pepsina, chimotripsina, carbossipeptidasi, elastasi) e i singoli amminoacidi sono assorbiti dalla parete intestinale.
Biosintesi degli aminoacidi
 Biosintesi degli aminoacidi Per l uomo la fonte principale di gruppi NH 4 + sono gli AA contenuti nelle proteine della dieta Parte di NH 4 + che si genera dalla degradazione degli AA viene riciclata e
Biosintesi degli aminoacidi Per l uomo la fonte principale di gruppi NH 4 + sono gli AA contenuti nelle proteine della dieta Parte di NH 4 + che si genera dalla degradazione degli AA viene riciclata e
Prima di essere ossidati. gli ACIDI GRASSI devono essere attivati. (cioè legati al CoA) e poi entrare nel mitocondrio
 Prima di essere ossidati gli ACIDI GRASSI devono essere attivati (cioè legati al CoA) e poi entrare nel mitocondrio L enzima acil CoA sintetasi (= acido grasso tiokinasi) sta sulla membrana mitocondriale
Prima di essere ossidati gli ACIDI GRASSI devono essere attivati (cioè legati al CoA) e poi entrare nel mitocondrio L enzima acil CoA sintetasi (= acido grasso tiokinasi) sta sulla membrana mitocondriale
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. DiSTABiF. Corso di Laurea in Scienze Biologiche. Insegnamento di. Anno Accademico
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Prof. Antimo Di Maro Anno Accademico 2016-17 Lezione 14 Ciclo di Krebs L ossidazione
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Prof. Antimo Di Maro Anno Accademico 2016-17 Lezione 14 Ciclo di Krebs L ossidazione
Via finale comune per l ossidazione di tutti i combustibili metabolici che entrano nella via come molecola di acetil CoA
 Via finale comune per l ossidazione di tutti i combustibili metabolici che entrano nella via come molecola di acetil CoA C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O Processi molecolari in cui è coinvolto il consumo
Via finale comune per l ossidazione di tutti i combustibili metabolici che entrano nella via come molecola di acetil CoA C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O Processi molecolari in cui è coinvolto il consumo
TCA cycle (ciclo di Krebs)
 TCA cycle (ciclo di Krebs) Come abbiamo detto la glicoli produce due molecole di ATP e due di NADH per ogni molecola di glucosio. La maggior parte dell energia potenziale contenuta nella molecola di glucosio
TCA cycle (ciclo di Krebs) Come abbiamo detto la glicoli produce due molecole di ATP e due di NADH per ogni molecola di glucosio. La maggior parte dell energia potenziale contenuta nella molecola di glucosio
METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI
 METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI Glicolisi: Glucosio Glucosio Piruvato Piruvato Gluconeogenesi La Glicolisi (dal greco glykys dolce e lysis scissione) E` la via metabolica che
METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI Glicolisi: Glucosio Glucosio Piruvato Piruvato Gluconeogenesi La Glicolisi (dal greco glykys dolce e lysis scissione) E` la via metabolica che
CICLO DI KREBS (o DELL ACIDO CITRICO)
 CICLO DI KREBS (o DELL ACIDO CITRICO) È un processo ossidativo che ha un ruolo centrale nel metabolismo energetico delle cellule eucariotiche. Avviene nella matrice mitocondriale. È alimentato soprattutto
CICLO DI KREBS (o DELL ACIDO CITRICO) È un processo ossidativo che ha un ruolo centrale nel metabolismo energetico delle cellule eucariotiche. Avviene nella matrice mitocondriale. È alimentato soprattutto
Modulo 14 Il ciclo di Krebs
 Modulo 14 Il ciclo di Krebs Il destino ossidativo del piruvato In condizioni aerobie il piruvato viene decarbossilato ad acetato. L acetato è ossidato ulteriormente nel ciclo dell acido citrico. Una serie
Modulo 14 Il ciclo di Krebs Il destino ossidativo del piruvato In condizioni aerobie il piruvato viene decarbossilato ad acetato. L acetato è ossidato ulteriormente nel ciclo dell acido citrico. Una serie
Una panoramica del ciclo dell acido ciclico
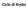 Ciclo di Krebs Una panoramica del ciclo dell acido ciclico Concetti chiave Il ciclo dell acido citrico, o ciclo di Krebs, o ciclo degli acidi tricarbossilici (TCA), è un processo catalitico a 8 tappe che
Ciclo di Krebs Una panoramica del ciclo dell acido ciclico Concetti chiave Il ciclo dell acido citrico, o ciclo di Krebs, o ciclo degli acidi tricarbossilici (TCA), è un processo catalitico a 8 tappe che
Catabolismo degli aminoacidi
 Catabolismo degli aminoacidi Gli amminoacidi che non vengono utilizzati per la sintesi proteica sono catabolizzati in modo da ricavare l energia in essi contenuta. 10-15% dell energia necessaria all organismo
Catabolismo degli aminoacidi Gli amminoacidi che non vengono utilizzati per la sintesi proteica sono catabolizzati in modo da ricavare l energia in essi contenuta. 10-15% dell energia necessaria all organismo
Ossidazione degli amminoacidi e produzione dell urea
 Ossidazione degli amminoacidi e produzione dell urea Gli amminoacidi sono, con gli zuccheri ed i lipidi, la terza classe di molecole che, attraverso la degradazione ossidativa, contribuiscono significativamente
Ossidazione degli amminoacidi e produzione dell urea Gli amminoacidi sono, con gli zuccheri ed i lipidi, la terza classe di molecole che, attraverso la degradazione ossidativa, contribuiscono significativamente
Aerobiosi C A T A B O L I S M O. Lez 4A. Schema generale del metabolismo dei glucidi
 Schema generale del metabolismo dei glucidi -1- Aerobiosi In condizioni aerobiche il piruvato prodotto dalla glicolisi e dalla degradazione di alcuni aminoacidi è ossidato a H 2 O e CO 2 nella respirazione
Schema generale del metabolismo dei glucidi -1- Aerobiosi In condizioni aerobiche il piruvato prodotto dalla glicolisi e dalla degradazione di alcuni aminoacidi è ossidato a H 2 O e CO 2 nella respirazione
I LIPIDI. Circa il 95% dei lipidi introdotti con la dieta è rappresentato da trigliceridi
 Metabolismo Lipidi I LIPIDI Circa il 95% dei lipidi introdotti con la dieta è rappresentato da trigliceridi In media il 40% o anche più dell energia richiesta giornalmente dall uomo nei paesi industrializzati
Metabolismo Lipidi I LIPIDI Circa il 95% dei lipidi introdotti con la dieta è rappresentato da trigliceridi In media il 40% o anche più dell energia richiesta giornalmente dall uomo nei paesi industrializzati
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
AGISCONO NEL SISTEMA NAVETTA 2 ISOFORME DELL ENZIMA: UNA FORMA MITOCONDRIALE ( MEMBRANA MIT. INTERNA) FAD-dipendente
 METABOLISMO AEROBIO I NADH prodotti durante la glicolisi nel citosol, in condizioni aerobiche (respirazione mitocondriale attiva), possono trasferire elettroni all interno del mitocondrio attraverso i
METABOLISMO AEROBIO I NADH prodotti durante la glicolisi nel citosol, in condizioni aerobiche (respirazione mitocondriale attiva), possono trasferire elettroni all interno del mitocondrio attraverso i
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2015-16 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2015-16 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Svolgono funzioni biologiche di fondamentale importanza e possono essere divise in 7 gruppi principali:
 Svolgono funzioni biologiche di fondamentale importanza e possono essere divise in 7 gruppi principali: proteine strutturali (collagene, cheratine); proteine catalitiche (enzimi); proteine di trasporto
Svolgono funzioni biologiche di fondamentale importanza e possono essere divise in 7 gruppi principali: proteine strutturali (collagene, cheratine); proteine catalitiche (enzimi); proteine di trasporto
BIOSINTESI DI AMMINOACIDI E NUCLEOTIDI
 BIOSINTESI DI AMMINOACIDI E NUCLEOTIDI La biosintesi degli amminoacidi ha molto in comune con quella dei nucleotidi, perché entrambe le classi di composti contengono azoto, ma anche perché le due vie di
BIOSINTESI DI AMMINOACIDI E NUCLEOTIDI La biosintesi degli amminoacidi ha molto in comune con quella dei nucleotidi, perché entrambe le classi di composti contengono azoto, ma anche perché le due vie di
AcetilCoA carbossilasi
 AcetilCoA carbossilasi Acido grasso sintasi (FAS) (FAS II) (FAS I) Proteina trasportatrice di acili (ACP) 7 Acetil-CoA + 7 CO 2 + 7ATP 7 malonil-coa + 7ADP + 7 Pi Acetil-CoA + 7 malonil-coa + 14
AcetilCoA carbossilasi Acido grasso sintasi (FAS) (FAS II) (FAS I) Proteina trasportatrice di acili (ACP) 7 Acetil-CoA + 7 CO 2 + 7ATP 7 malonil-coa + 7ADP + 7 Pi Acetil-CoA + 7 malonil-coa + 14
Biosintesi dei carboidrati
 Biosintesi dei carboidrati Gluconeogenesi: sintesi di glucosio da precursori non saccaridici La riserva di glucosio dell organismo (glucosio + glicogeno) è sufficiente per circa 1 giorno. La via gluconeogenetica
Biosintesi dei carboidrati Gluconeogenesi: sintesi di glucosio da precursori non saccaridici La riserva di glucosio dell organismo (glucosio + glicogeno) è sufficiente per circa 1 giorno. La via gluconeogenetica
AcetilCoA carbossilasi
 AcetilCoA carbossilasi Acido grasso sintasi (FAS) (FAS II) (FAS I) Proteina trasportatrice di acili (ACP) 7 Acetil-CoA + 7 CO 2 + 7ATP 7 malonil-coa + 7ADP + 7 Pi Acetil-CoA + 7 malonil-coa + 14
AcetilCoA carbossilasi Acido grasso sintasi (FAS) (FAS II) (FAS I) Proteina trasportatrice di acili (ACP) 7 Acetil-CoA + 7 CO 2 + 7ATP 7 malonil-coa + 7ADP + 7 Pi Acetil-CoA + 7 malonil-coa + 14
Respirazione cellulare: processi molecolari medianti i quali le cellule consumano O 2 e producono CO 2
 AVVERTENZA Il presente materiale didattico è messo a disposizione degli studenti per facilitare la comprensione degli argomenti trattati nel corso delle lezioni e lo studio individuale Non sostituisce
AVVERTENZA Il presente materiale didattico è messo a disposizione degli studenti per facilitare la comprensione degli argomenti trattati nel corso delle lezioni e lo studio individuale Non sostituisce
Metabolismo degli aminoacidi
 Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Aminoacidi come precursori di amine con funzione regolativa
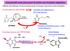 Aminoacidi come precursori di amine con funzione regolativa Dalla decarbossilazione di alcuni amminoacidi si ottengono importanti amine biologiche Decarbossilazione dell ISTIDINA ISTIDINA DECARBOSSILASI
Aminoacidi come precursori di amine con funzione regolativa Dalla decarbossilazione di alcuni amminoacidi si ottengono importanti amine biologiche Decarbossilazione dell ISTIDINA ISTIDINA DECARBOSSILASI
Metabolismo degli Ammino Acidi
 Metabolismo degli Ammino Acidi (La proteina stimola la secrezione della gastrina che stimola la secrezione di l e pepsinogeno) R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi)
Metabolismo degli Ammino Acidi (La proteina stimola la secrezione della gastrina che stimola la secrezione di l e pepsinogeno) R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi)
INTRODUZIONE AL METABOLISMO
 INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
Cap.21 CATABOLISMO DEI LIPIDI
 Cap.21 CATABOLISMO DEI LIPIDI Glucosio= forma di energia immediatamente disponibile LIPIDI= Deposito energetico utilizzabile da tutti i tessuti, tranne cervello e globuli rossi Rispetto ai carboidrati,
Cap.21 CATABOLISMO DEI LIPIDI Glucosio= forma di energia immediatamente disponibile LIPIDI= Deposito energetico utilizzabile da tutti i tessuti, tranne cervello e globuli rossi Rispetto ai carboidrati,
Cap.16 GLICOLISI. Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP H 2 O 2 NAD + 2 NADH + 2H +
 Cap.16 GLICOLISI Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP 2 + 2 H 2 O 2 NAD + 2 NADH + 2H + Via metabolica in 10 tappe (reazioni) La glicolisi può
Cap.16 GLICOLISI Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP 2 + 2 H 2 O 2 NAD + 2 NADH + 2H + Via metabolica in 10 tappe (reazioni) La glicolisi può
INTRODUZIONE AL METABOLISMO. dal gr. metabolè = trasformazione
 INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
Protidi. Metabolismo
 Protidi Metabolismo CONTINUO RICAMBIO PROTEICO Serve energia sia per la sintesi che per la degradazione: 15-20 % del bilancio energetico La continua demolizione e sintesi è fondamentale per degradare e
Protidi Metabolismo CONTINUO RICAMBIO PROTEICO Serve energia sia per la sintesi che per la degradazione: 15-20 % del bilancio energetico La continua demolizione e sintesi è fondamentale per degradare e
Gluconeogenesi. Sintesi de-novo di glucosio
 Gluconeogenesi Sintesi de-novo di glucosio La gluconeogenesi garantisce il mantenimento dei livelli di glucosio nel sangue anche per molto tempo dopo l assorbimento e la completa ossidazione del glucosio
Gluconeogenesi Sintesi de-novo di glucosio La gluconeogenesi garantisce il mantenimento dei livelli di glucosio nel sangue anche per molto tempo dopo l assorbimento e la completa ossidazione del glucosio
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Catabolismo di proteine
 Catabolismo di proteine Digestione di proteine dalla dieta Turn-over di proteine endogene Digiuno prolungato DIGESTIONE DI PROTEINE ESOGENE L organismo ricava la maggior parte degli aminoacidi di cui ha
Catabolismo di proteine Digestione di proteine dalla dieta Turn-over di proteine endogene Digiuno prolungato DIGESTIONE DI PROTEINE ESOGENE L organismo ricava la maggior parte degli aminoacidi di cui ha
Catabolismo di proteine
 Catabolismo di proteine Digestione di proteine dalla dieta Turn-over di proteine endogene Digiuno prolungato DIGESTIONE DI PROTEINE ESOGENE L organismo ricava la maggior parte degli aminoacidi di cui ha
Catabolismo di proteine Digestione di proteine dalla dieta Turn-over di proteine endogene Digiuno prolungato DIGESTIONE DI PROTEINE ESOGENE L organismo ricava la maggior parte degli aminoacidi di cui ha
2 a reazione della glicolisi: isomerizzazione del glucosio 6-fosfato in fruttosio 6-fosfato
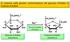 2 a reazione della glicolisi: isomerizzazione del glucosio 6-fosfato in fruttosio 6-fosfato Glucosio 6-fosfato isomerasi Glucosio 6-fosfato anomero α Fruttosio 6-fosfato anomero α Glucosio 6-fosfato Fruttosio
2 a reazione della glicolisi: isomerizzazione del glucosio 6-fosfato in fruttosio 6-fosfato Glucosio 6-fosfato isomerasi Glucosio 6-fosfato anomero α Fruttosio 6-fosfato anomero α Glucosio 6-fosfato Fruttosio
Energia e metabolismi energetici
 Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
Permette la sintesi di Adenosilmetionina. folato e alla vit B12. monocarboniose. Metionina SAM SAdenosilomocisteina
 Metionina cisteina: Permette la sintesi di Adenosilmetionina un importante trasportatore di trasportatore gruppi metilici che insieme al folato e alla vit B12 costituisce il pool delle unità il unità monocarboniose.
Metionina cisteina: Permette la sintesi di Adenosilmetionina un importante trasportatore di trasportatore gruppi metilici che insieme al folato e alla vit B12 costituisce il pool delle unità il unità monocarboniose.
Metabolismo. Metabolismo. Il complesso di tutte le reazioni organiche di trasformazioni tra energia e materia viene definito come metabolismo.
 Metabolismo Dr. Augusto Innocenti, PhD Biologo Nutrizionista Prof. a contratto Università di Parma Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Metabolismo
Metabolismo Dr. Augusto Innocenti, PhD Biologo Nutrizionista Prof. a contratto Università di Parma Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Metabolismo
Cap.19. Ciclo di Krebs. o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico
 Cap.19 Ciclo di Krebs o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico Acetil-CoA OSSIDAZIONE DEL GLUCOSIO C 6 H 12 O 6 (glucosio) + 6O 2.. 6CO 2 + 6H 2 O I tappa: GLICOLISI 2 + 2 H 2 O II
Cap.19 Ciclo di Krebs o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico Acetil-CoA OSSIDAZIONE DEL GLUCOSIO C 6 H 12 O 6 (glucosio) + 6O 2.. 6CO 2 + 6H 2 O I tappa: GLICOLISI 2 + 2 H 2 O II
METABOLISMO OSSIDATIVO
 METABOLISMO OSSIDATIVO IDROLISI DEI LIPIDI LIPASI Fosfolipidi Fosfolipasi β ossidazione degli acidi grassi NEL CITOPLASMA: attivazione dell acido grasso Consumo di 2 ATP ΔG idrolisi ATP = -35,9 kj mol
METABOLISMO OSSIDATIVO IDROLISI DEI LIPIDI LIPASI Fosfolipidi Fosfolipasi β ossidazione degli acidi grassi NEL CITOPLASMA: attivazione dell acido grasso Consumo di 2 ATP ΔG idrolisi ATP = -35,9 kj mol
Gli enzimi e la catalisi
 Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
Catabolismo degli acidi grassi e chetogenesi
 Catabolismo degli acidi grassi e chetogenesi Metabolismo dei lipidi Adipociti del grasso bianco Tappa di preparazione all ossidazione degli acidi grassi La membrana mitocondriale interna è impermeabile
Catabolismo degli acidi grassi e chetogenesi Metabolismo dei lipidi Adipociti del grasso bianco Tappa di preparazione all ossidazione degli acidi grassi La membrana mitocondriale interna è impermeabile
(2 x) (2 x) (2 x) Il NADH prodotto in questa reazione DEVE essere ri-ossidato affinché la glicolisi non si fermi. Gliceraldeide 3-fosfato deidrogenasi
 Il NADH prodotto in questa reazione DEVE essere ri-ossidato affinché la glicolisi non si fermi (2 x) (2 x) Gliceraldeide 3-fosfato Fosfato inorganico Gliceraldeide 3-fosfato deidrogenasi Reazione di ossidoriduzione:
Il NADH prodotto in questa reazione DEVE essere ri-ossidato affinché la glicolisi non si fermi (2 x) (2 x) Gliceraldeide 3-fosfato Fosfato inorganico Gliceraldeide 3-fosfato deidrogenasi Reazione di ossidoriduzione:
Esempi di quiz di biochimica. 1. E un disaccaride: A) galattosio B) lattosio C) cellulosa D) fruttosio
 Esempi di quiz di biochimica 1. E un disaccaride: A) galattosio B) lattosio C) cellulosa D) fruttosio 2. Il glicogeno è un: A) disaccaride B) polisaccaride C) monosaccaride D) amino zucchero 3. E un composto
Esempi di quiz di biochimica 1. E un disaccaride: A) galattosio B) lattosio C) cellulosa D) fruttosio 2. Il glicogeno è un: A) disaccaride B) polisaccaride C) monosaccaride D) amino zucchero 3. E un composto
Laboratorio Fitness & Wellness
 Laboratorio Fitness & Wellness Anno Accademico 2015/2016 Ewan Thomas, MSc Principi di Bioenergetica e Biomeccanica Metabolismo Catabolismo Processi di degradazione che permettono di liberare energia Anabolismo
Laboratorio Fitness & Wellness Anno Accademico 2015/2016 Ewan Thomas, MSc Principi di Bioenergetica e Biomeccanica Metabolismo Catabolismo Processi di degradazione che permettono di liberare energia Anabolismo
fornire energia chimica in vettori attivati ATP e NADH e NADPH e FADH.
 Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
Ossidazione dell α-chetoglutarato: questa reazione porta alla formazione di un legame TIOESTERE ad alta energia e alla produzione di NADH
 Ossidazione dell α-chetoglutarato: questa reazione porta alla formazione di un legame TIOESTERE ad alta energia e alla produzione di NADH TPP Lipoammide FAD α-chetoglutarato Complesso dell αchetoglutarato
Ossidazione dell α-chetoglutarato: questa reazione porta alla formazione di un legame TIOESTERE ad alta energia e alla produzione di NADH TPP Lipoammide FAD α-chetoglutarato Complesso dell αchetoglutarato
METABOLISMO DEI NUCLEOTIDI
 METABOLISMO DEI NUCLEOTIDI SOSTANZE UBIQUITARIE COSTITUISCONO UNITA MONOMERICHE ACIDI NUCLEICI NUCLEOSIDI TRIFOSFATI (ATP) SONO PRODOTTI TERMINALI RICCHI DI ENERGIA MAGGIOR PARTE DELLE VIE METABOLICHE
METABOLISMO DEI NUCLEOTIDI SOSTANZE UBIQUITARIE COSTITUISCONO UNITA MONOMERICHE ACIDI NUCLEICI NUCLEOSIDI TRIFOSFATI (ATP) SONO PRODOTTI TERMINALI RICCHI DI ENERGIA MAGGIOR PARTE DELLE VIE METABOLICHE
GLUCOSIO. Vena porta DIGESTIONE DEI DISACCARIDI. Enzimi parete intestinale
 DIGESTIONE DELL AMIDO AMIDO Amilasi salivare DESTRINE Amilasi pancreatica MALTOSIO Enzimi parete intestinale GLUCOSIO Vena porta DIGESTIONE DEI DISACCARIDI DISACCARIDI Enzimi parete intestinale MONOSACCARIDI
DIGESTIONE DELL AMIDO AMIDO Amilasi salivare DESTRINE Amilasi pancreatica MALTOSIO Enzimi parete intestinale GLUCOSIO Vena porta DIGESTIONE DEI DISACCARIDI DISACCARIDI Enzimi parete intestinale MONOSACCARIDI
catabolismo anabolismo
 Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
Seminario. Ciclo di Krebs 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A
 Seminario PASSO PER PASSO 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A Il ciclo dell acido citrico inizia con la reazione di condensazione di un unità con 4
Seminario PASSO PER PASSO 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A Il ciclo dell acido citrico inizia con la reazione di condensazione di un unità con 4
GLICOLISI ADP ATP. Condizioni aerobiche. Condizioni anaerobiche ATP
 GLICOLISI È la parte iniziale del processo di degradazione ossidativa dei carboidrati. Durante la loro ossidazione l energia immagazzinata nel loro scheletro carbonioso è utilizzata per produrre ATP e
GLICOLISI È la parte iniziale del processo di degradazione ossidativa dei carboidrati. Durante la loro ossidazione l energia immagazzinata nel loro scheletro carbonioso è utilizzata per produrre ATP e
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio. GLUCONEOGENESI (sintesi da precursori non glucidici)
 DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
Il metabolismo cellulare
 Il metabolismo cellulare 1 Il metabolismo cellulare CATABOLISMO Processo esoergonico (per produrre energia) Nutriliti NAD FAD NADP e - +H + ANABOLISMO Processo endoergonico Biopolimeri (x es. proteine)
Il metabolismo cellulare 1 Il metabolismo cellulare CATABOLISMO Processo esoergonico (per produrre energia) Nutriliti NAD FAD NADP e - +H + ANABOLISMO Processo endoergonico Biopolimeri (x es. proteine)
Alle proteine è legato il concetto di principio elementare plastico per eccellenza Ruolo svolto dalle proteine:
 Alle proteine è legato il concetto di principio elementare plastico per eccellenza Ruolo svolto dalle proteine: 1. Componenti strutturali essenziali 2. Enzimi 3. Ormoni 4. Proteine plasmatiche 5. Trasporto
Alle proteine è legato il concetto di principio elementare plastico per eccellenza Ruolo svolto dalle proteine: 1. Componenti strutturali essenziali 2. Enzimi 3. Ormoni 4. Proteine plasmatiche 5. Trasporto
CLASSIFICAZIONE ENZIMI
 CLASSIFICAZIONE ENZIMI nome raccomandato nome sistematico reazione catalizzata Classe di enzima Reazione catalizzata 1. Ossidoreduttasi Ossido-riduzione 2. Transferasi Trasferimento di gruppi funzionali
CLASSIFICAZIONE ENZIMI nome raccomandato nome sistematico reazione catalizzata Classe di enzima Reazione catalizzata 1. Ossidoreduttasi Ossido-riduzione 2. Transferasi Trasferimento di gruppi funzionali
Fegato e metabolismo lipidico
 Fegato e metabolismo lipidico LIPIDI : Acidi grassi liberi o esterificati ad Acil gliceroli ( mono, di, tri) Fosfolipidi e colesterolo FONTI : Grassi della dieta Depositati sotto forma di goccioline (tessuto
Fegato e metabolismo lipidico LIPIDI : Acidi grassi liberi o esterificati ad Acil gliceroli ( mono, di, tri) Fosfolipidi e colesterolo FONTI : Grassi della dieta Depositati sotto forma di goccioline (tessuto
AMINOACIDI Struttura. Funzione. Classificazione. Proprietà
 AMINOACIDI Struttura Funzione Classificazione Proprietà 1 STRUTTURA Composti caratterizzati dalla presenza di un gruppo aminico (NH 2 ) e di un gruppo acido (COOH) legati al medesimo carbonio (C). In soluzione
AMINOACIDI Struttura Funzione Classificazione Proprietà 1 STRUTTURA Composti caratterizzati dalla presenza di un gruppo aminico (NH 2 ) e di un gruppo acido (COOH) legati al medesimo carbonio (C). In soluzione
CHETOGENESI (PRODUZIONE DI CORPI CHETONICI)
 CHETOGENESI (PRODUZIONE DI CORPI CHETONICI) Bassa glicemia (es.: digiuno) o di Diabete mellito non trattato (insufficiente captazione insulino-dipendente di glucosio) La glicolisi è inibita ma la β-ossidazione
CHETOGENESI (PRODUZIONE DI CORPI CHETONICI) Bassa glicemia (es.: digiuno) o di Diabete mellito non trattato (insufficiente captazione insulino-dipendente di glucosio) La glicolisi è inibita ma la β-ossidazione
Capitolo 4: Le proteine: ossidazione degli amminoacidi, produzione dell urea e biosintesi degli amminoacidi
 Capitolo 4: Le proteine: ossidazione degli amminoacidi, produzione dell urea e biosintesi degli amminoacidi proteine della dieta nucleotidi, ammine biologiche amminoacidi proteine intracellulari ciclo
Capitolo 4: Le proteine: ossidazione degli amminoacidi, produzione dell urea e biosintesi degli amminoacidi proteine della dieta nucleotidi, ammine biologiche amminoacidi proteine intracellulari ciclo
Lattato. Glicolisi. Piruvato
 Lattato Glicolisi Piruvato REAZIONI MITOCONDRIALI DEL PIRUVATO + Piruvato Deidrogenasi + CO 2 + H 2 O ATP ADP + Pi Piruvato Carbossilasi + 2 H + ossalacetato La Piruvato Carbossilasi è una proteina Mitocondriale
Lattato Glicolisi Piruvato REAZIONI MITOCONDRIALI DEL PIRUVATO + Piruvato Deidrogenasi + CO 2 + H 2 O ATP ADP + Pi Piruvato Carbossilasi + 2 H + ossalacetato La Piruvato Carbossilasi è una proteina Mitocondriale
IL METABOLISMO. Dal carbonio agli OGM Capitolo 2
 IL METABOLISMO Dal carbonio agli OGM Capitolo 2 IL METABOLISMO L'insieme delle trasformazioni chimiche ed energetiche che si verificano nelle cellule di un organismo vivente e ne garantiscono la conservazione,
IL METABOLISMO Dal carbonio agli OGM Capitolo 2 IL METABOLISMO L'insieme delle trasformazioni chimiche ed energetiche che si verificano nelle cellule di un organismo vivente e ne garantiscono la conservazione,
09/05/17. REGOLAZIONE ALLOSTERICA determinano cambiamenti di velocità delle vie
 1 FASE DI ASSORBIMENTO due quattro ore successive ad un pasto a. Aumento glucosio ematico, a.a. Ed trigliceridi b. Aumento secrezione insulina diminuzione glucagone c. Aumento sintesi del glicogeno, proteine
1 FASE DI ASSORBIMENTO due quattro ore successive ad un pasto a. Aumento glucosio ematico, a.a. Ed trigliceridi b. Aumento secrezione insulina diminuzione glucagone c. Aumento sintesi del glicogeno, proteine
Gluconeogenesi sintesi di glucosio da precursori non glucidici
 GLUCONEOGENESI Gluconeogenesi sintesi di glucosio da precursori non glucidici Precursori: Lattato, ossalacetato, glicerolo Amminoacidi (scheletro carbonioso) Usa le reazioni glicolitiche in direzione
GLUCONEOGENESI Gluconeogenesi sintesi di glucosio da precursori non glucidici Precursori: Lattato, ossalacetato, glicerolo Amminoacidi (scheletro carbonioso) Usa le reazioni glicolitiche in direzione
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
da: Nelson & Cox (IV Ed.)
 da: Nelson & Cox (IV Ed.) L acetil CoA carbossilasi è un enzima regolato allostericamente e covalentemente. Esso determina la velocità di biosintesi degli acidi grassi nei tessuti animali. Figura 16.7
da: Nelson & Cox (IV Ed.) L acetil CoA carbossilasi è un enzima regolato allostericamente e covalentemente. Esso determina la velocità di biosintesi degli acidi grassi nei tessuti animali. Figura 16.7
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH. ) ed un gruppo carbossilico ( COOH) nella stessa molecola
 Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Capitolo B2 Il metabolismo energetico: dal glucosio all ATP
 Capitolo B2 Il metabolismo energetico: dal glucosio all ATP Quesiti e problemi 1 Le funzioni del metabolismo cellulare sono: ricavare energia utile per la cellula attraverso la degradazione di sostanze
Capitolo B2 Il metabolismo energetico: dal glucosio all ATP Quesiti e problemi 1 Le funzioni del metabolismo cellulare sono: ricavare energia utile per la cellula attraverso la degradazione di sostanze
PIRUVATO DEIDROGENASI E CICLO DI KREBS
 PIRUVATO DEIDROGENASI E CICLO DI KREBS COMPLESSO DELLA PIRUVATO DEIDROGENASI Una volta completato il processo della glicolisi, il prodotto finale, ossia il piruvato, deve andare incontro al Ciclo di Krebs.
PIRUVATO DEIDROGENASI E CICLO DI KREBS COMPLESSO DELLA PIRUVATO DEIDROGENASI Una volta completato il processo della glicolisi, il prodotto finale, ossia il piruvato, deve andare incontro al Ciclo di Krebs.
ENERGIA LIBERA DI GIBBS (G)
 METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Il trasporto del glucosio
 Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
Idratazione (introduciamo un gruppo OH sul Cβ) per mezzo della enoil-coa idratasi
 β-ossidazione di un Ac. Grasso Saturo con n PARI di atomi di carbonio Deidrogenazione FAD-dipendente del legame Cα- Cβ per mezzo della Acil-CoA deidrogenasi che è legata alla membrana mitocondriale interna)
β-ossidazione di un Ac. Grasso Saturo con n PARI di atomi di carbonio Deidrogenazione FAD-dipendente del legame Cα- Cβ per mezzo della Acil-CoA deidrogenasi che è legata alla membrana mitocondriale interna)
Esercitazione Esempi di domande del 1 test
 Esercitazione Esempi di domande del 1 test Esempio 1. Gli enzimi opposti glicogeno fosforilasi e glicogeno sintasi sono regolati in maniera opposta da una serie di effettori. Quali? Come avviene la regolazione
Esercitazione Esempi di domande del 1 test Esempio 1. Gli enzimi opposti glicogeno fosforilasi e glicogeno sintasi sono regolati in maniera opposta da una serie di effettori. Quali? Come avviene la regolazione
Esempi di funzioni svolte dalle proteine
 Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
scaricato da www.sunhope.it
 CICLO DEGLI ACIDI TRICARBOSSILICI o CICLO DELL ACIDO CITRICO o CICLO DI KREBS scaricato da www.sunhope.it IL CICLO DI KREBS È LA VIA OSSIDATIVA FINALE DEL CATABOLISMO DI GLUCIDI LIPIDI PROTEINE IL CICLO
CICLO DEGLI ACIDI TRICARBOSSILICI o CICLO DELL ACIDO CITRICO o CICLO DI KREBS scaricato da www.sunhope.it IL CICLO DI KREBS È LA VIA OSSIDATIVA FINALE DEL CATABOLISMO DI GLUCIDI LIPIDI PROTEINE IL CICLO
