Catabolismo di proteine
|
|
|
- Silvano Neri
- 8 anni fa
- Visualizzazioni
Transcript
1 Catabolismo di proteine Digestione di proteine dalla dieta Turn-over di proteine endogene Digiuno prolungato
2 DIGESTIONE DI PROTEINE ESOGENE L organismo ricava la maggior parte degli aminoacidi di cui ha bisogno dalle proteine alimentari Per utilizzare questi aminoacidi, le proteine devono essere digerite, cioè idrolizzate negli aminoacidi costituenti Meno di 1/10 delle proteine ingerite con una dieta equilibrata viene eliminata senza essere stata digerita
3 ORMONI GASTROENTERICI Ormoni polipeptidici prodotti da cellule endocrine dell apparato gastrointestinale: gastrina, secretina, colecistochinina (CCK), peptide inibitore gastrico (GIP) La secrezione è regolata da: nutrienti, fattori propri del lumen (ph, [ Ca ++ ], ecc.), ormoni e neurotrasmettitori
4 ORMONI GASTROENTERICI Controllano importanti funzioni degli organi addetti all assorbimento e alla digestione dei nutrienti: Secrezione di acqua, enzimi, elettroliti ed ormoni Motilità delle pareti Afflusso di sangue
5 ORMONI GASTROENTERICI 1. Gastrina Ormone formato da 17 residui aminoacidici Prodotto dalla mucosa gastrica Stimola la secrezione di HCl (cellule parietali) e pepsinogeno (cellule adelomorfe) La secrezione di gastrina è stimolata da aminoacidi e proteine parzialmente digerite 2. Secretina Ormone formato da 27 residui aminoacidici Prodotto dalla mucosa dell intestino tenue Stimola la secrezione di HCO 3 - da parte del pancreas al fine di neutralizzare l acidità
6 ORMONI GASTROENTERICI 3. Colecistochinina (CCK) Ormone formato da 33 residui aminoacidici Prodotto dal tratto iniziale dell intestino tenue Stimola lo svuotamento della colecisti, la secrezione di enzimi pancreatici e di HCO 3-, aumentando quindi l effetto della secretina La secrezione di colecistochinina è stimolata da monogliceridi, acidi grassi e alcuni aminoacidi 4. Peptide inibitore gastrico (GIP) Ormone formato da 42 residui AA Prodotto nell intestino tenue Stimola la secrezione pancreatica di insulina La secrezione di GIP è stimolata da nutrienti
7 Proteine introdotte con la dieta Enzimi proteoli-ci: Proteasi gastriche Proteasi pancrea/che Amminopep/dasi intes/nali Pepsina Tripsina Chimotripsina Carbossipep/dasi
8
9 Il pancreas esocrino secerne enzimi digestivi (amilasi, lipasi, fosfolipasi, tripsina, chimotripsina, carbossipeptidasi) e bicarbonato
10 Gli zimogeni pancreatici - Questi enzimi digestivi vengono secreti dal pancreas esocrino sotto forma di precursori inattivi, detti zimogeni. - La secrezione è stimolata dalla colecistochinina - Gli zimogeni attraverso il dotto pancreatico arrivano nell intestino tenue, dove vengono attivati. - L attivazione avviene mediante scissione proteolitica del precursore inattivo.
11 Attivazione di zimogeni pancreatici -LA TRIPSINA è l attivatore comune di tutti gli zimogeni pancreatici -Il tripsinogeno viene convertito in tripsina dall enteropeptidasi, enzima proteolitico secreto da cellule intestinali
12 Attivazione di zimogeni pancreatici
13 Proteasi pancreatiche TRIPSINA Endopeptidasi (ph 7-8) Idrolizza legami peptidici con il gruppo carbossilico di aminoacidi basici quali Lys, Arg È particolarmente attiva sui prodotti di degradazione della pepsina CHIMOTRIPSINA: Idrolizza legami peptidici con il gruppo carbossilico di Phe, Trp, Tyr CARBOSSIPEPTIDASI A e B: idrolizzano i legami peptidici tra gli amminoacidi all'altezza del residuo C terminale. Questi enzimi pancreatici digeriscono in frammenti più piccoli i peptidi generati nello stomaco dalla pepsina
14 Ingresso di una proteina nello stomaco: stimola la secrezione di GASTRINA (mucosa gastrica) ----> HCl e PEPSINOGENO ph > antisettico e denaturante pepsinogeno ----> pepsina PEPSINA : gruppo carbossilico Phe,Trp,Tyr Nell intestino tenue il ph basso induce la secrezione di SECRETINA che stimola il pancreas a rilasciare bicarbonato che neutralizza l HCl Dal duodeno (parte alta del tenue) viene rilasciata nel sangue la COLECISTOCHININA ----> enzimi pancreatici e bile dalla cistifellea
15 Il ph del lume gastrico: Denatura le proteine (distrugge la struttura terziaria rompendo ponti disulfuro e legami idrogeno) Uccide la maggior parte dei batteri e microrganismi Attiva il pepsinogeno in pepsina
16 Stomaco: gastrina Intestino: secretina colecistochinina
17 Turn- over di proteine endogene Emivita variabile Proteine a lunga vita > 200 h proteine strutturali, emoglobina, citocromo c Proteine a breve vita < 2 h enzimi, ormoni, anticorpi Le proteine difettose sono degradate più rapidamente
18 Turn- over di proteine endogene Svolge tre funzioni importan/: - fornisce aminoacidi - rimuove proteine anomale - rimuove enzimi e falori trascrizionali in eccesso (regolazione del metabolismo) Avviene ad opera di sistemi specializza/: A) MECCANISMO LISOSOMIALE (sistema di degradazione non seleevo. Proteine di membrana, extracellulari, emivita lunga) B) MECCANISMO CITOPLASMATICO ATP- DIPENDENTE (sistema di degradazione altamente seleevo)
19 L ubiquitina etichetta le proteine destinate alla degradazione Proteina (76 aa) ubiquitaria altamente conservata negli eucarioti Gly C-terminale dell ubiquitina si lega ai gruppi amminici di residui di Lys della proteina da degradare L energia è fornita dall idrolisi dell ATP
20 Sono necessari 3 enzimi (E1, E2, E3) per l azione dell ubiquitina E1 à attiva l ubiquitina E2 à si lega all ubiquitina E3 à lega l ubiquitina alla proteina bersaglio Molte molecole di ubiquitina sulla proteina da degradare
21 La degradazione della proteina avviene ad opera di proteasi specifiche in un complesso detto Proteasoma 26S, formato da una struttura di forma cilindrica -20se rivestita alle estremità da un cappuccio -19s I complessi 19S svolgono la funzione di riconoscimento della proteina ubiquitinata e di svolgimento della stessa, che penetra nella cavità del cilindro 20 S dove è degradata. La proteina viene degradata in aa L ubiquitina viene riciclata
22 DEGRADAZIONE OSSIDATIVA DEGLI AA Gli amminoacidi, derivati dalla degradazione delle proteine della dieta o delle proteine intracellulari rappresentano l ultima classe di biomolecole la cui ossidazione contribuisce alla generazione di energia metabolica nella cellula
23 DEGRADAZIONE OSSIDATIVA DEGLI AA Gli aminoacidi sono degradati se: Non sono necessari per la sintesi di nuove proteine Se la dieta è ricca di proteine e gli aminoacidi sono in eccesso rispetto alle richieste biosintetiche Durante il digiuno o nel diabete mellito quando non sono disponibili i carboidrati
24 SCHEMA GENERALE METABOLISMO PROTEINE PROTEINE aminoacidi - NH 2 Catene carboniose Acetoace-l- CoA (AA Chetogene/ci) piruvato Intermedi Ciclo Krebs (AA Glicogene/ci)
25 Importanza di NH 3 Sintesi glutammato Sintesi di amminoacidi Sintesi glutammina Sintesi carbamil fosfato Sintesi di nucleotidi purinici Sintesi di amminoacidi Sintesi di arginina Sintesi di nucleotidi pirimidinici Un eccesso di NH 3 è tossico
26 Tossicità dell ammoniaca variazioni del ph intracellulare (ph ) sottrazione degli intermedi del ciclo di Krebs (alfa-chetoglutarato) NH 4+ + a-chetoglutarato NAD(P)H NAD(P) + glutammato carenza di glutammato glutammato +NH ATP glutammina+ ADP Un eccesso di NH 3 consuma alfa-chetoglutarato ATP Glutammato eccesso di NH 3 à danno cerebrale
27 Destino del gruppo amminico REAZIONI DI DISTACCO DEL GRUPPO α-nh 2 A) TRANSAMINAZIONE (PLP) B) DEAMINAZIONE OSSIDATIVA
28 Reazione di transaminazione (trasferimento del gruppo aminico ad un a-chetoacido accettore) COOH HC-N H H + COOH C=O PLP COOH C=O COOH HC-N H H R 1 Aminotransferasi R 2 R 1 R 2 α-aminoacido 1 α-chetoacido 2 α-chetoacido 1 α-aminoacido 2 Aa donatore Chetoacido accettore reazione reversibile
29 TRANSAMINAZIONE
30 Il gruppo prostetico delle transaminasi è il piridossalfosfato PLP Derivato della vitamina B6 (PMP) Interconversione Piridossal fosfato PLP Piridossammina fosfato PMP
31 Meccanismo a ping-pong della reazione di transaminazione Prima metà della reazione AA 1 + E-PLP α-chetoacido 1 + E PMP Seconda metà della reazione E PMP + α-chetoacido 2 PLP AA 2 + E-PLP somma AA 1 + α-chetoacido 2 α-chetoacido 1 + AA 2 Meccanismo catalitico a ping-pong Il 1 substrato si lega all enzima Il 2 substrato si lega all enzima solo dopo che il 1 si è allontanato sotto forma di prodotto
32 Meccanismo catalitico della reazione di transaminazione
33
34 Transaminazione La maggior parte delle transaminasi utilizza come chetoacido Alfa-chetoglutarato glutammato Biosintesi AA Via anabolica Deamminazione ossidativa NH 4 + urea Via catabolica
35 DEAMMINAZIONE OSSIDATIVA Glutammico deidrogenasi - Biosintesi AA - Ciclo urea La glutammico deidrogenasi (PM ; 6 subunità uguali) è presente nella matrice mitocondriale Glutammico deidrogenasi à enzima allosterico - Reazione di transaminazione - Ciclo acido citrico - gluconeogenesi Attivato à ADP GDP carica energetica bassa Inibito à ATP GTP carica energetica alta
36 La glutammina trasporta ammoniaca dai tessuti al fegato La L-glutamina rappresenta la principale forma di trasporto non tossica dell ammoniaca È normalmente presente in circolo ad una concentrazione superiore agli altri aminoacidi. L azoto aminico della glutamina viene rilasciato sotto forma di ammoniaca solo a livello dei mitocondri epatici e, in misura minore, renali. Nelle cellule Nel fegato
37 L alanina trasporta ammoniaca dal muscolo al fegato Il ciclo del glucosio-alanina L alanina serve come trasportatore dell ammoniaca e dello scheletro carbonioso del piruvato dal muscolo al fegato. L ammoniaca viene escreta e il piruvato è usato per produrre glucosio che ritorna al muscolo.
38 Riepilogando:
39 Riepilogando: muscolo tessuti extraepatici
40 Ciclo dell urea L urea viene sintetizzata nel fegato, secreta nel circolo sanguigno, sequestrata dal rene e quindi escreta Il ciclo è composto da 5 reazioni (2 mitocondriali e 3 citoplasmatiche)
41 Ciclo dell urea Nel fegato Il ciclo dell urea avviene in due compartimenti diversi L ornitina svolge un ruolo simile a quello dell ossalacetato nel ciclo di Krebs Vengono consumate 3 molecole di ATP Il ciclo dell urea è collegato al ciclo di Krebs 1 2 ATP + HCO NH 4 + à carbamilfosfato mitocondrio citosol urea ornitina 5 ornitina arginina 2 citrullina aspartato citrullina ATP argininsuccinato fumarato ciclo di Krebs
42 Sintesi di carbamil fosfato 2 ATP consumati Reazione regolata tappa limitante del ciclo Carbamil fosfato sintetasi I Enzima allosterico L enzima Carbamil fosfato sintetasi I, mitocondriale, è diversa dalla carbamil fosfato sintetasi II, citosolica che agisce nella biosintesi delle pirimidine
43 4 tappe 1= ornitina transcarbamilasi 2= argininsuccinato sintetasi 3= argininsuccinato liasi 4= arginasi
44 1= ornitina transcarbamilasi 2= argininsuccinato sintetasi 3= argininsuccinato liasi 4= arginasi
45 Il ciclo dell urea è collegato al ciclo dell acido citrico Il collegamento con il ciclo dell ac. citrico riduce il dispendio energetico La comunicazione è assicurata dal trasporto di intermedi chiave tra mitocondri e citosol
46 Il flusso di atomi di azoto attraverso il ciclo dell urea varia con la composizione della dieta. Regolazione a lungo termine: velocità di sintesi degli enzimi del ciclo Regolazione a breve termine: attivazione allosterica della carbamil fosfato sintetasi I
47 AA glucogenici Destino dello scheletro carbonioso α-chetoglutarato Succinil CoA Fumarato Ossalacetato Piruvato Ciclo acido citrico AA chetogenici Acetoacetil CoA Acetil CoA Ciclo acido citrico Corpi chetonici Sintesi acidi grassi
48 Biosintesi amminoacidi Dopo C,H,O, l azoto è l elemento più abbondante: Presente in aminoacidi e nucleotidi Biosintesi aminoacidi e nucleotidi hanno varie condivisioni 1) entrambi contengono azoto 2) Aa interi (o parte della molecola) sono incorporati nei nuclei purinici o pirimidinici 3) Reazioni chimiche in comune (trasferimento unità monocarboniose e di gruppi amminici)
49 L ammoniaca viene incorporata nelle biomolecole attraverso il glutammato e la glutammina Funzione sia nel catabolismo che nelle biosintesi Glu e Gln : concentrazione di molto superiore rispetto agli altri aa Le vie di produzione di Gln e Glu sono simili in tutti gli organismi
50 GLUTAMMATO SINTASI (solo batteri e piante): amminazione riduttiva dell a -chetoglutarato a-chetoglutarato + Gln + NADPH + H + ---> 2 Glu + NADP+ N. B. negli animali il Glu viene formato dalle reazioni di transaminazione dell a-chetoglutarato che raccoglie i gruppi amminici nel catabolismo degli aa
51 Via alternativa e minore di formazione del Glu: L-glutammato deidrogenasi (catabolismo aa): a-chetoglutarato + NH NADPH + H + ---> Glu + NADP + + H 2 O K M per ione ammonio molto alta
52 BIOSINTESI GLUTAMMINA 1)Glu + ATP ---> γ-glutamil fosfato + ADP 2) γ-glutamil fosfato + NH4 + --> Gln + Pi + H + somma Glu + NH4 + + ATP ---> Gln + ADP + Pi + H + Enzima: GLUTAMMINA SINTETASI
53 GLUTAMMINA SINTETASI Presente in tutti gli organismi PRINCIPALE SITO DI REGOLAZIONE DEL METABOLISMO DELL AZOTO -Ruolo chiave nel metabolismo aa: RIMOZIONE AMMONIACA LIBERA TOSSICA PER I TESSUTI CONVERSIONE IN Gln e TRASPORTO NEL SANGUE
54 Regolazione allosterica i principali modulatori allosterici (inibitori): -Alanina, Glicina, Serina e -6 prodotti finali di vie che dipendono dalla Gln Inibizione retroattiva cumulativa
55 Biosintesi amminoacidi Amminoacidi essenziali Nell uomo la metà dei 20 aminoacidi standard non può essere sintetizzata. Questi aminoacidi devono essere introdotti con la dieta Aminoacidi essenziali Isoleucina Leucina Lisina Me/onina Fenilalanina Treonina Triptofano Valina Arginina Amminoacidi non essenziali Possono essere sintetizzati a partire da intermedi delle vie metaboliche Glicolisi, ciclo acido citrico, via pentoso fosfato Arginina (nell adulto), alanina, asparagina, aspartato, cisteina, glutammato, glutammina, glicina, prolina, serina, tirosina
56 La formazione degli aa avviene a partire da precursori della: Glicolisi, Via dei pentoso fosfato Ciclo di Krebs
57 Amminoacidi non essenziali Precursore Alfa-chetoglutarato Ossalacetato Piruvato 3-fosfoglicerato transaminazione transaminazione transaminazione AA Glutammato à Glutammina Arginina Prolina Aspartato à Asparagina Alanina Serina à Glicina Cisteina Eritroso- 4-P Tirosina
58 Regolazione delle vie di sintesi di aminoacidi La prima reazione è di solito una reazione irreversibile catalizzata da un enzima allosterico Il meccanismo di regolazione di solito è l inibizione a feedback del primo enzima della via biosintetica Le varie vie di sintesi sono altamente coordinate mediante meccanismi di regolazione trasversali La regolazione della biosintesi risponde prontamente alle necessità della cellula
59 Molecole che derivano dagli aa Porfirine coenzimi nucleotidi ammine biologiche Eme vit. B12 *purinici (asp, gly, gln) *neurotrasmettitori (glicina) *pirimidinici (asp, gln) *ormoni *poliammine Neurotrasmettitori tirosina dopammina noradrenalina adrenalina glutammato GABA (acido γ-amminobutirrico) triptofano serotonina Ammine biologiche istidina istamina vasodilatazione reazione allergica
Catabolismo di proteine
 Catabolismo di proteine Digestione di proteine dalla dieta Turn-over di proteine endogene Digiuno prolungato DIGESTIONE DI PROTEINE ESOGENE L organismo ricava la maggior parte degli aminoacidi di cui ha
Catabolismo di proteine Digestione di proteine dalla dieta Turn-over di proteine endogene Digiuno prolungato DIGESTIONE DI PROTEINE ESOGENE L organismo ricava la maggior parte degli aminoacidi di cui ha
Il metabolismo dell azoto
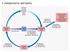 Il metabolismo dell azoto La fissazione dell azoto Radici di una leguminosa e il simbionte Rhizobium leguminosarum. Microrganismi azotofissatori : ad es. batteri appartenenti ai generi Clostridium e Azotobacter.
Il metabolismo dell azoto La fissazione dell azoto Radici di una leguminosa e il simbionte Rhizobium leguminosarum. Microrganismi azotofissatori : ad es. batteri appartenenti ai generi Clostridium e Azotobacter.
Nella Biosfera viene mantenuto un un equilibrio tra l azoto totale inorganico e quello organico
 Gli a.a. oltre ad essere i costituenti delle proteine giocano numerosi ruoli metabolici: precursori di ormoni, vitamine, coenzimi, porfirine, pigmenti e neurotrasmettitori L esistenza di 20 a.a. nelle
Gli a.a. oltre ad essere i costituenti delle proteine giocano numerosi ruoli metabolici: precursori di ormoni, vitamine, coenzimi, porfirine, pigmenti e neurotrasmettitori L esistenza di 20 a.a. nelle
CATABOLISMO AMMINOACIDI
 CATABOLISMO AMMINOACIDI 1 Catabolismo aminoacidi Digestione di proteone dalla dieta Turnover delle proteine Digiuno prolungato 2 Digestione delle proteine dalla dieta L organismo ricava la maggior parte
CATABOLISMO AMMINOACIDI 1 Catabolismo aminoacidi Digestione di proteone dalla dieta Turnover delle proteine Digiuno prolungato 2 Digestione delle proteine dalla dieta L organismo ricava la maggior parte
Metabolismo degli Ammino Acidi
 Metabolismo degli Ammino Acidi R 1 C C - R 2 C C - N 3 Transaminasi R 1 C C - R 2 C C - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due a-cheto acidi.
Metabolismo degli Ammino Acidi R 1 C C - R 2 C C - N 3 Transaminasi R 1 C C - R 2 C C - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due a-cheto acidi.
Fegato e metabolismo lipidico
 Fegato e metabolismo lipidico LIPIDI : Acidi grassi liberi o esterificati ad Acil gliceroli ( mono, di, tri) Fosfolipidi e colesterolo FONTI : Grassi della dieta Depositati sotto forma di goccioline (tessuto
Fegato e metabolismo lipidico LIPIDI : Acidi grassi liberi o esterificati ad Acil gliceroli ( mono, di, tri) Fosfolipidi e colesterolo FONTI : Grassi della dieta Depositati sotto forma di goccioline (tessuto
Metabolismo degli Ammino Acidi
 Metabolismo degli Ammino Acidi R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due α-cheto acidi. Amminotransferasi
Metabolismo degli Ammino Acidi R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due α-cheto acidi. Amminotransferasi
Capitolo 4: Le proteine: ossidazione degli amminoacidi, produzione dell urea e biosintesi degli amminoacidi
 Capitolo 4: Le proteine: ossidazione degli amminoacidi, produzione dell urea e biosintesi degli amminoacidi proteine della dieta nucleotidi, ammine biologiche amminoacidi proteine intracellulari ciclo
Capitolo 4: Le proteine: ossidazione degli amminoacidi, produzione dell urea e biosintesi degli amminoacidi proteine della dieta nucleotidi, ammine biologiche amminoacidi proteine intracellulari ciclo
Amminoacidi: l eliminazione dell azoto
 Amminoacidi: l eliminazione dell azoto P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006 Gli aa. Non sono conservati nell organismo, quelli che eccedono
Amminoacidi: l eliminazione dell azoto P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006 Gli aa. Non sono conservati nell organismo, quelli che eccedono
PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE (a)
 Università di Roma Tor Vergata - Scienze della Nutrizione Umana Biochimica della Nutrizione Prof.ssa Luciana Avigliano 2011 PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE (a) amminoacidi proteine
Università di Roma Tor Vergata - Scienze della Nutrizione Umana Biochimica della Nutrizione Prof.ssa Luciana Avigliano 2011 PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE (a) amminoacidi proteine
N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi
 Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI
 METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI Glicolisi: Glucosio Glucosio Piruvato Piruvato Gluconeogenesi La Glicolisi (dal greco glykys dolce e lysis scissione) E` la via metabolica che
METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI Glicolisi: Glucosio Glucosio Piruvato Piruvato Gluconeogenesi La Glicolisi (dal greco glykys dolce e lysis scissione) E` la via metabolica che
Metabolismo dei composti azotati: aminoacidi e nucleotidi
 Metabolismo dei composti azotati: aminoacidi e nucleotidi Metabolismo degli aminoacidi I composti azotati L azoto contenuto nella cellula è presente soprattutto negli AMINOACIDI delle proteine e nelle
Metabolismo dei composti azotati: aminoacidi e nucleotidi Metabolismo degli aminoacidi I composti azotati L azoto contenuto nella cellula è presente soprattutto negli AMINOACIDI delle proteine e nelle
Digestione e assorbimento delle proteine
 Digestione e assorbimento delle proteine Metabolismo delle proteine Le proteine sono formate da catene di α- aminoacidi della serie L uniti tra loro dal legame peptidico Le proteine sono composte da 20
Digestione e assorbimento delle proteine Metabolismo delle proteine Le proteine sono formate da catene di α- aminoacidi della serie L uniti tra loro dal legame peptidico Le proteine sono composte da 20
Degradazione delle proteine della dieta. Catabolismo degli aminoacidi
 Degradazione delle proteine della dieta Catabolismo degli aminoacidi LE PROTEINE DELLA DIETA SONO DEGRADATE ENZIMATICAMENTE AD AMINOACIDI LIBERI L ingresso di una proteina nello stomaco stimola la mucosa
Degradazione delle proteine della dieta Catabolismo degli aminoacidi LE PROTEINE DELLA DIETA SONO DEGRADATE ENZIMATICAMENTE AD AMINOACIDI LIBERI L ingresso di una proteina nello stomaco stimola la mucosa
INTRODUZIONE AL METABOLISMO. dal gr. metabolè = trasformazione
 INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
Metabolismo degli aminoacidi
 Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Metabolismo. Metabolismo. Il complesso di tutte le reazioni organiche di trasformazioni tra energia e materia viene definito come metabolismo.
 Metabolismo Dr. Augusto Innocenti, PhD Biologo Nutrizionista Prof. a contratto Università di Parma Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Metabolismo
Metabolismo Dr. Augusto Innocenti, PhD Biologo Nutrizionista Prof. a contratto Università di Parma Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Metabolismo
METABOLISMO DEGLI AMMINOACIDI
 PRINCIPI NUTRITIVI METABOLISMO DEGLI AMMINOACIDI Nel corso della digestione le proteine vengono degradate in amminoacidi. Contrariamente ai carboidrati, gli amminoacidi non vengono immagazzinati, ma vengono
PRINCIPI NUTRITIVI METABOLISMO DEGLI AMMINOACIDI Nel corso della digestione le proteine vengono degradate in amminoacidi. Contrariamente ai carboidrati, gli amminoacidi non vengono immagazzinati, ma vengono
 METABOLISMO DEGLI AMMINOACIDI 1.Quali tra i seguenti sono amminoacidi semiessenziali: -Arginina e istidina -valina e treonina -fenilalanina e metionina -glicina e alanina Cosa si intende per semi essenziali?
METABOLISMO DEGLI AMMINOACIDI 1.Quali tra i seguenti sono amminoacidi semiessenziali: -Arginina e istidina -valina e treonina -fenilalanina e metionina -glicina e alanina Cosa si intende per semi essenziali?
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio. GLUCONEOGENESI (sintesi da precursori non glucidici)
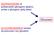 DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
dieta vengono convertiti in composti dei corpi chetonici.
 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Metabolismo degli Ammino Acidi
 Metabolismo degli Ammino Acidi (La proteina stimola la secrezione della gastrina che stimola la secrezione di l e pepsinogeno) R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi)
Metabolismo degli Ammino Acidi (La proteina stimola la secrezione della gastrina che stimola la secrezione di l e pepsinogeno) R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi)
PROTIDI: LE PROTEINE E GLI AMMINOACIDI
 PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
Attenzione: Lunedì 15 la lezione sarà dalle 14 alle 16 (al posto di L. Migliore)
 Attenzione: Lunedì 15 la lezione sarà dalle 14 alle 16 (al posto di L. Migliore) La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato
Attenzione: Lunedì 15 la lezione sarà dalle 14 alle 16 (al posto di L. Migliore) La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato
Digestione e assorbimento dei lipidi. β-ossidazione degli acidi grassi
 Digestione e assorbimento dei lipidi β-ossidazione degli acidi grassi I grassi della dieta sono assorbiti nell intestino tenue Il diametro della particella dei chilomicroni varia da circa 100 a circa 500
Digestione e assorbimento dei lipidi β-ossidazione degli acidi grassi I grassi della dieta sono assorbiti nell intestino tenue Il diametro della particella dei chilomicroni varia da circa 100 a circa 500
Complesso della piruvato deidrogenasi (1) Stechiometria della reazione finale
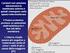 Ciclo di Krebs 1 Complesso della piruvato deidrogenasi (1) Stechiometria della reazione finale 2 Complesso della piruvato deidrogenasi (2) FAD Diidrolipoil deidrogenasi Piruvato decarbossilasi E 3 Diidrolipoil
Ciclo di Krebs 1 Complesso della piruvato deidrogenasi (1) Stechiometria della reazione finale 2 Complesso della piruvato deidrogenasi (2) FAD Diidrolipoil deidrogenasi Piruvato decarbossilasi E 3 Diidrolipoil
Vittoria Patti MACROMOLECOLE BIOLOGICHE. 4. proteine
 Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
METABOLISMO DEI COMPOSTI AZOTATI
 METABOLISMO DEI COMPOSTI AZOTATI CATABOLISMO DEI COMPOSTI AZOTATI Tutti gli organismi possono convertire l NH 3 in composti organici azotati, sono invece molti di meno gli organismi che possono sintetizzare
METABOLISMO DEI COMPOSTI AZOTATI CATABOLISMO DEI COMPOSTI AZOTATI Tutti gli organismi possono convertire l NH 3 in composti organici azotati, sono invece molti di meno gli organismi che possono sintetizzare
scaricato da www.sunhope.it
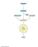 CICLO DEGLI ACIDI TRICARBOSSILICI o CICLO DELL ACIDO CITRICO o CICLO DI KREBS scaricato da www.sunhope.it IL CICLO DI KREBS È LA VIA OSSIDATIVA FINALE DEL CATABOLISMO DI GLUCIDI LIPIDI PROTEINE IL CICLO
CICLO DEGLI ACIDI TRICARBOSSILICI o CICLO DELL ACIDO CITRICO o CICLO DI KREBS scaricato da www.sunhope.it IL CICLO DI KREBS È LA VIA OSSIDATIVA FINALE DEL CATABOLISMO DI GLUCIDI LIPIDI PROTEINE IL CICLO
Metabolismo degli amminoacidi. Ciclo dell urea
 Metabolismo degli amminoacidi Ciclo dell urea Biosintesi di amminoacidiporfirine, creatina, carnitina, ormoni, nucleotidi Gli amminoacidi possono subire una degradazione ossidativa in 3 diverse situazioni
Metabolismo degli amminoacidi Ciclo dell urea Biosintesi di amminoacidiporfirine, creatina, carnitina, ormoni, nucleotidi Gli amminoacidi possono subire una degradazione ossidativa in 3 diverse situazioni
Apparato endocrino. Controllo della glicemia. Il pancreas endocrino. Università degli Studi di Perugia
 Università degli Studi di Perugia Dipartimento di Medicina Sperimentale Sezione di Fisiologia e Biochimica Apparato endocrino Controllo della glicemia Il pancreas endocrino 1 Insulina: struttura e biosintesi
Università degli Studi di Perugia Dipartimento di Medicina Sperimentale Sezione di Fisiologia e Biochimica Apparato endocrino Controllo della glicemia Il pancreas endocrino 1 Insulina: struttura e biosintesi
Capitolo 6 La respirazione cellulare
 Capitolo 6 La respirazione cellulare Introduzione alla respirazione cellulare 6.1 La respirazione polmonare rifornisce le nostre cellule di ossigeno ed elimina diossido di carbonio La respirazione polmonare
Capitolo 6 La respirazione cellulare Introduzione alla respirazione cellulare 6.1 La respirazione polmonare rifornisce le nostre cellule di ossigeno ed elimina diossido di carbonio La respirazione polmonare
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi Gli amminoacidi derivati in gran parte dalla degradazione delle proteine della dieta o intracellulari possono essere ossidati per generare e energia. La quantità di energia
Metabolismo degli amminoacidi Gli amminoacidi derivati in gran parte dalla degradazione delle proteine della dieta o intracellulari possono essere ossidati per generare e energia. La quantità di energia
Il FEGATO Cardarera, cap.3
 Il FEGATO Cardarera, cap.3 2.5% della massa corporea 1,6-1.8 Kg nel maschio 1.3-1.4 Kg nella femmina Tramite la vena porta, è il primo organo a ricevere il sangue arricchito di nutrienti assorbiti dall
Il FEGATO Cardarera, cap.3 2.5% della massa corporea 1,6-1.8 Kg nel maschio 1.3-1.4 Kg nella femmina Tramite la vena porta, è il primo organo a ricevere il sangue arricchito di nutrienti assorbiti dall
Digestione delle proteine: 6 fasi
 orletto a spazzola Digestione delle proteine: 6 fasi 1. Idrolisi gastrica del legame peptidico 2. Digestione a peptidi più piccoli da parte delle proteasi pancreatiche nel lume dell intestino tenue 3.
orletto a spazzola Digestione delle proteine: 6 fasi 1. Idrolisi gastrica del legame peptidico 2. Digestione a peptidi più piccoli da parte delle proteasi pancreatiche nel lume dell intestino tenue 3.
Indice generale 1. Introduzione alla biochimica 2. Acqua, ph, acidi, basi, sali, tamponi
 Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
Il ciclo degli acidi tricarbossilici o ciclo dell acido citrico
 Il ciclo degli acidi tricarbossilici o ciclo dell acido citrico Dalla glicolisi alla fosforilazione ossidativa NAD + e NADP + Sono coinvolti nelle reazioni di trasferimento dell idruro H: -. Tutte le reazioni
Il ciclo degli acidi tricarbossilici o ciclo dell acido citrico Dalla glicolisi alla fosforilazione ossidativa NAD + e NADP + Sono coinvolti nelle reazioni di trasferimento dell idruro H: -. Tutte le reazioni
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 32
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 32 La degradazione delle proteine Concetti chiave: La digestione delle proteine avviene ad opera di specifiche proteasi. Per
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 32 La degradazione delle proteine Concetti chiave: La digestione delle proteine avviene ad opera di specifiche proteasi. Per
L integrazione proteica nelle diverse fisiopatologie
 Università degli Studi di Napoli Federico II Corso di Laurea in Scienze della Nutrizione Umana Corso di: Chimica degli Alimenti L integrazione proteica nelle diverse fisiopatologie Prof. Gian Carlo Tenore
Università degli Studi di Napoli Federico II Corso di Laurea in Scienze della Nutrizione Umana Corso di: Chimica degli Alimenti L integrazione proteica nelle diverse fisiopatologie Prof. Gian Carlo Tenore
SECREZIONE PANCREATICA
 SECREZIONE PANCREATICA Il pancreas esocrino secerne ioni bicarbonato ed enzimi nei dotti che convergono nel dotto pancreatico; questo si unisce al dotto biliare comune proveniente dal fegato prima di entrare
SECREZIONE PANCREATICA Il pancreas esocrino secerne ioni bicarbonato ed enzimi nei dotti che convergono nel dotto pancreatico; questo si unisce al dotto biliare comune proveniente dal fegato prima di entrare
Regolazione ormonale del metabolismo energetico. Lezione del 11 marzo 2014
 Regolazione ormonale del metabolismo energetico Lezione del 11 marzo 2014 Effetti fisiologici e metabolici dell adrenalina: preparazione all azione EFFETTO IMMEDIATO EFFETTO COMPLESSIVO Effetto fisiologico
Regolazione ormonale del metabolismo energetico Lezione del 11 marzo 2014 Effetti fisiologici e metabolici dell adrenalina: preparazione all azione EFFETTO IMMEDIATO EFFETTO COMPLESSIVO Effetto fisiologico
Attività cellulare altamente coordinata svolta da sistemi multienzimatici, con i seguenti scopi: ottenere energia chimica dall ambiente attraverso la
 Metabolismo Attività cellulare altamente coordinata svolta da sistemi multienzimatici, con i seguenti scopi: ottenere energia chimica dall ambiente attraverso la degradazione di nutrienti operare la sintesi
Metabolismo Attività cellulare altamente coordinata svolta da sistemi multienzimatici, con i seguenti scopi: ottenere energia chimica dall ambiente attraverso la degradazione di nutrienti operare la sintesi
FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI
 FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI Berg et al., BIOCHIMICA 6/E, Zanichelli editore S.p.A. Copyright 2007 PROTEINE INGERITE CON GLI ALIMENTI
FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI Berg et al., BIOCHIMICA 6/E, Zanichelli editore S.p.A. Copyright 2007 PROTEINE INGERITE CON GLI ALIMENTI
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa.
 La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
Amilasi salivare e pancreatica (Cl - ) Amilosio degradato in maltotriosio e maltosio (destrine)
 Assorbimento dei glucidi Dieta: polisaccaridi (amido, glicogeno), Disaccaridi (lattosio, saccarosio) Demolizione ad opera di endoglicosidasi presenti nel cavo orale e nel lume intestinale mediante idrolisi
Assorbimento dei glucidi Dieta: polisaccaridi (amido, glicogeno), Disaccaridi (lattosio, saccarosio) Demolizione ad opera di endoglicosidasi presenti nel cavo orale e nel lume intestinale mediante idrolisi
(o dotto di Santorini)
 Pancreas Il pancreas è una ghiandola a funzione mista. (o dotto di Santorini) Papilla di Vater Sfintere di Oddi Dotto di Wirshung (regola rilascio e impedisce reflusso) Il pancreas esocrino secerne tutti
Pancreas Il pancreas è una ghiandola a funzione mista. (o dotto di Santorini) Papilla di Vater Sfintere di Oddi Dotto di Wirshung (regola rilascio e impedisce reflusso) Il pancreas esocrino secerne tutti
Regolazione di secrezione e motilità 1. Nervoso 1.1 SNC (riflessi lunghi - locali o cefalici) 1.2 Enterico (riflessi corti - locali)
 Regolazione di secrezione e motilità 1. Nervoso 1.1 SNC (riflessi lunghi - locali o cefalici) 1.2 Enterico (riflessi corti - locali) 2. Endocrini e Paracrini Secrezioni 1. Muco (mucose e caliciformi)
Regolazione di secrezione e motilità 1. Nervoso 1.1 SNC (riflessi lunghi - locali o cefalici) 1.2 Enterico (riflessi corti - locali) 2. Endocrini e Paracrini Secrezioni 1. Muco (mucose e caliciformi)
Apparato digerente. Quantità Secrezione. Composizione. giornaliera (L) Saliva Amilasi, bicarbonato. Succo gastrico Succo pancreatico
 Apparato digerente Quantità Secrezione giornaliera (L) ph Composizione Saliva 1 6.5 Amilasi, bicarbonato Succo gastrico Succo pancreatico 1-3 1.5 Pepsinogeno, HCl, fattore intrinseco 1 7-8 Tripsinogeno,
Apparato digerente Quantità Secrezione giornaliera (L) ph Composizione Saliva 1 6.5 Amilasi, bicarbonato Succo gastrico Succo pancreatico 1-3 1.5 Pepsinogeno, HCl, fattore intrinseco 1 7-8 Tripsinogeno,
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
La quantità di glu presente nei liquidi extracellulari è di circa 20g, 80kcal.
 I principali nutrienti metabolici sono il glucosio e gli acidi grassi. In circostanze normali il glucosio è l unico nutriente che possa essere utilizzato dal cervello. E anche utilizzato preferenzialmente
I principali nutrienti metabolici sono il glucosio e gli acidi grassi. In circostanze normali il glucosio è l unico nutriente che possa essere utilizzato dal cervello. E anche utilizzato preferenzialmente
SOLUZIONI DEGLI ESERCIZI
 Niccolò Taddei - Biochimica Capitolo 8 IL METABOLISMO DEI COMPOSTI AZOTATI 1 Gli amminoacidi sono coinvolti prevalentemente in processi plastici di sintesi e di degradazione, grazie ai quali le cellule
Niccolò Taddei - Biochimica Capitolo 8 IL METABOLISMO DEI COMPOSTI AZOTATI 1 Gli amminoacidi sono coinvolti prevalentemente in processi plastici di sintesi e di degradazione, grazie ai quali le cellule
Come le cellule traggono energia dal cibo: produzione di ATP
 Come le cellule traggono energia dal cibo: produzione di ATP L energia è contenuta nei legami chimici delle molecole nutritive; la cellula estrae questa energia e la conserva nell ATP: respirazione cellulare
Come le cellule traggono energia dal cibo: produzione di ATP L energia è contenuta nei legami chimici delle molecole nutritive; la cellula estrae questa energia e la conserva nell ATP: respirazione cellulare
Gli organismi multicellulari si devono adattare ad un ambiente esterno che cambia continuamente. A tale scopo operano due sistemi, il sistema nervoso
 Gli organismi multicellulari si devono adattare ad un ambiente esterno che cambia continuamente. A tale scopo operano due sistemi, il sistema nervoso ed il sistema endocrino. Il sistema nervoso gestisce
Gli organismi multicellulari si devono adattare ad un ambiente esterno che cambia continuamente. A tale scopo operano due sistemi, il sistema nervoso ed il sistema endocrino. Il sistema nervoso gestisce
MACROMOLECOLE. Polimeri (lipidi a parte)
 MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
Regolazione della Glicolisi
 Regolazione della Glicolisi Enzimi regolati della glicolisi: 1) esochinasi. da: Champe La esochinasi: ha bassa Km per Glu 0,2mM: questo assicura la captazione anche di poche molecole di glucosio, presenti
Regolazione della Glicolisi Enzimi regolati della glicolisi: 1) esochinasi. da: Champe La esochinasi: ha bassa Km per Glu 0,2mM: questo assicura la captazione anche di poche molecole di glucosio, presenti
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. DiSTABiF. Corso di Laurea in Scienze Biologiche. Insegnamento di. Anno Accademico 2014-15
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Prof. Antimo Di Maro Anno Accademico 2014-15 Lezione 16 Degradazione dei lipidi
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Prof. Antimo Di Maro Anno Accademico 2014-15 Lezione 16 Degradazione dei lipidi
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH. ) ed un gruppo carbossilico ( COOH) nella stessa molecola
 Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Corso di Formazione in Dietologia e Nutrizione
 Corso di Formazione in Dietologia e Nutrizione La dieta equilibrata: Alimentazione dell adulto 2 P Marina Mariani Che cosa sono i macronutrienti Proteine Lipidi Glucidi Cosa sono i macronutrienti Per vivere
Corso di Formazione in Dietologia e Nutrizione La dieta equilibrata: Alimentazione dell adulto 2 P Marina Mariani Che cosa sono i macronutrienti Proteine Lipidi Glucidi Cosa sono i macronutrienti Per vivere
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio. GLUCONEOGENESI (sintesi da precursori non glucidici)
 DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) 1 2 Il glucosio viene trasportato all interno della cellula
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) 1 2 Il glucosio viene trasportato all interno della cellula
6 H 2. con G=-686 kcal/mole di H 12 O 6 O + 6 CO O 2. glucosio La respirazione avviene in tre stadi principali; ognuno di questi
 La respirazione La respirazione è un processo di ossidoriduzione nel quale i riducenti sono molecole organiche altamente ridotte e ricche di energia e gli ossidanti sono molecole inorganiche come O 2 Il
La respirazione La respirazione è un processo di ossidoriduzione nel quale i riducenti sono molecole organiche altamente ridotte e ricche di energia e gli ossidanti sono molecole inorganiche come O 2 Il
Connessioni. Le cellule cardiache sono unite tra loro da parti più ispessite del sarcolemma dette: Gap - junction
 Muscolo cardiaco Le fibrocellule cardiache sono simili alle fibrocellule muscolari di tipo I (fibre rosse), ma si differenziano, infatti: Sono più piccole Non sono polinucleate Minor massa fibrillare (50%
Muscolo cardiaco Le fibrocellule cardiache sono simili alle fibrocellule muscolari di tipo I (fibre rosse), ma si differenziano, infatti: Sono più piccole Non sono polinucleate Minor massa fibrillare (50%
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
COSA DOBBIAMO RICORDARE: 19. FUNZIONE OMEOSTATICA DEL RENE
 COSA DOBBIAMO RICORDARE: 19. FUNZIONE OMEOSTATICA DEL RENE 1. La Concentrazione delle urine 2. La creazione del gradiente osmotico nella midollare del rene da parte del meccanismo controcorrente: acquaporine
COSA DOBBIAMO RICORDARE: 19. FUNZIONE OMEOSTATICA DEL RENE 1. La Concentrazione delle urine 2. La creazione del gradiente osmotico nella midollare del rene da parte del meccanismo controcorrente: acquaporine
LIPIDI COMPLESSI E LIPOPROTEINE
 LIPIDI COMPLESSI E LIPOPROTEINE Principali lipidi assunti con la dieta Fosfolipidi e colesterolo (membrane) Triacilgliceroli (olii e grassi) Le cellule importano ACIDI GRASSI e GLICEROLO SATURI MONOINSATURI
LIPIDI COMPLESSI E LIPOPROTEINE Principali lipidi assunti con la dieta Fosfolipidi e colesterolo (membrane) Triacilgliceroli (olii e grassi) Le cellule importano ACIDI GRASSI e GLICEROLO SATURI MONOINSATURI
INSULINA RECERE REC INS T U T L O INA RE OR
 INSULINA RECERE REC INSULINA TTORE OR Lipidi Sono un gruppo eterogeneo di composti con una caratteristica comune: l isolubilità in acqua Lipidi di riserva (triacilgliceroli o trigliceridi e cere) Lipidi
INSULINA RECERE REC INSULINA TTORE OR Lipidi Sono un gruppo eterogeneo di composti con una caratteristica comune: l isolubilità in acqua Lipidi di riserva (triacilgliceroli o trigliceridi e cere) Lipidi
(2 x) (2 x) (2 x) Il NADH prodotto in questa reazione DEVE essere ri-ossidato affinché la glicolisi non si fermi. Gliceraldeide 3-fosfato deidrogenasi
 Il NADH prodotto in questa reazione DEVE essere ri-ossidato affinché la glicolisi non si fermi (2 x) (2 x) Gliceraldeide 3-fosfato Fosfato inorganico Gliceraldeide 3-fosfato deidrogenasi Reazione di ossidoriduzione:
Il NADH prodotto in questa reazione DEVE essere ri-ossidato affinché la glicolisi non si fermi (2 x) (2 x) Gliceraldeide 3-fosfato Fosfato inorganico Gliceraldeide 3-fosfato deidrogenasi Reazione di ossidoriduzione:
Compito di Biochimica Prova di autovalutazione
 Compito di Biochimica Prova di autovalutazione 1) L andamento dell interazione tra emoglobina e ossigeno è di tipo: a) iperbolico b) rettilineo c) rettilineo, a diversa inclinazione a seconda della concentrazione
Compito di Biochimica Prova di autovalutazione 1) L andamento dell interazione tra emoglobina e ossigeno è di tipo: a) iperbolico b) rettilineo c) rettilineo, a diversa inclinazione a seconda della concentrazione
METABOLISMO DEL GLICOGENO
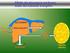 METABOLISMO DEL GLICOGENO GLICOGENO: Polisaccaride di riserva del regno animale Organi principali: FEGATO MUSCOLO SCHELETRICO Glicogeno Glucosio Glucosio-6P Via del pentoso fosfato Glucosio Fruttosio-6P
METABOLISMO DEL GLICOGENO GLICOGENO: Polisaccaride di riserva del regno animale Organi principali: FEGATO MUSCOLO SCHELETRICO Glicogeno Glucosio Glucosio-6P Via del pentoso fosfato Glucosio Fruttosio-6P
Ruolo del fegato nella nutrizione
 Ruolo del fegato nella nutrizione Centro di distribuzione dei nutrienti per tutti gli altri organi Annulla le fluttuazioni del metabolismo determinate dall assunzione intermittente del cibo Funge da deposito
Ruolo del fegato nella nutrizione Centro di distribuzione dei nutrienti per tutti gli altri organi Annulla le fluttuazioni del metabolismo determinate dall assunzione intermittente del cibo Funge da deposito
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Il ciclo di Krebs e la fosforilazione ossidativa
 Il ciclo di Krebs e la fosforilazione ossidativa La respirazione cellulare Sono i processi molecolari in cui è coinvolto il consumo di O 2 e la formazione di CO 2 e H 2 O da parte della cellula. E suddivisa
Il ciclo di Krebs e la fosforilazione ossidativa La respirazione cellulare Sono i processi molecolari in cui è coinvolto il consumo di O 2 e la formazione di CO 2 e H 2 O da parte della cellula. E suddivisa
Catena di trasporto degli elettroni (catena respiratoria) e Fosforilazione ossidativa
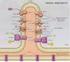 Catena di trasporto degli elettroni (catena respiratoria) e Fosforilazione ossidativa NADH e FADH2 (accettori universali di e-) formati nella glicolisi e nel ciclo di Krebs (e nell ossidazione degli acidi
Catena di trasporto degli elettroni (catena respiratoria) e Fosforilazione ossidativa NADH e FADH2 (accettori universali di e-) formati nella glicolisi e nel ciclo di Krebs (e nell ossidazione degli acidi
Formazione dei chilomicroni
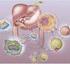 Formazione dei chilomicroni I triacilgliceroli forniscono il combustibile per i lunghi voli migratori del Piviere minore. I triacilgliceroli sono riserve di energia molto concentrate essendo ridotti ed
Formazione dei chilomicroni I triacilgliceroli forniscono il combustibile per i lunghi voli migratori del Piviere minore. I triacilgliceroli sono riserve di energia molto concentrate essendo ridotti ed
Gastroenterologia Seconda Università degli Studi di Napoli
 1 Il cammino di un panino: breve vademecum per conoscere la digestione Gastroenterologia Seconda Università degli Studi di Napoli Alessandro Federico, Dolores Sgambato, Vittorio Ormando 2 EXPO 2015 Dipartimento
1 Il cammino di un panino: breve vademecum per conoscere la digestione Gastroenterologia Seconda Università degli Studi di Napoli Alessandro Federico, Dolores Sgambato, Vittorio Ormando 2 EXPO 2015 Dipartimento
2 INCONTRO: LA PRODUZIONE DI ENERGIA NELLA CELLULA
 INCONTRO: LA PRODUZIONE DI ENERGIA NELLA CELLULA 1 INTRODUZIONE 1 L energia chimica Esistono diversi tipi di energia e una tra queste è l energia chimica: un tipo di energia che possiedono tutte le molecole
INCONTRO: LA PRODUZIONE DI ENERGIA NELLA CELLULA 1 INTRODUZIONE 1 L energia chimica Esistono diversi tipi di energia e una tra queste è l energia chimica: un tipo di energia che possiedono tutte le molecole
I più comuni polisaccaridi sono: AMIDO CELLULOSA GLICOGENO DESTRINA
 GLICOGENO POLISACCARIDI La maggior parte dei carboidrati che si ritrovano in natura sono polimeri ad alto peso molecolare chiamati polisaccaridi L u n i t à m o n o s a c c a r i d i c a p i ù frequente
GLICOGENO POLISACCARIDI La maggior parte dei carboidrati che si ritrovano in natura sono polimeri ad alto peso molecolare chiamati polisaccaridi L u n i t à m o n o s a c c a r i d i c a p i ù frequente
STOMACO.
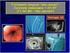 STOMACO FONTE : RUGARLI Medicina Interna Lo stomaco è la parte più espansa di tutto il canale alimentare; la sua notevole capacità contenitiva (1000-1500 ml) e le peculiari modalità di svuotamento attribuiscono
STOMACO FONTE : RUGARLI Medicina Interna Lo stomaco è la parte più espansa di tutto il canale alimentare; la sua notevole capacità contenitiva (1000-1500 ml) e le peculiari modalità di svuotamento attribuiscono
Il metabolismo cellulare
 Il metabolismo cellulare L obesità è problema sanitario e sociale Tessuto adiposo bianco e bruno È tutta una questione di energia: Se si assumono più molecole energetiche di quelle che ci servono per costruire
Il metabolismo cellulare L obesità è problema sanitario e sociale Tessuto adiposo bianco e bruno È tutta una questione di energia: Se si assumono più molecole energetiche di quelle che ci servono per costruire
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Idratazione (introduciamo un gruppo OH sul Cβ) per mezzo della enoil-coa idratasi
 β-ossidazione di un Ac. Grasso Saturo con n PARI di atomi di carbonio Deidrogenazione FAD-dipendente del legame Cα- Cβ per mezzo della Acil-CoA deidrogenasi che è legata alla membrana mitocondriale interna)
β-ossidazione di un Ac. Grasso Saturo con n PARI di atomi di carbonio Deidrogenazione FAD-dipendente del legame Cα- Cβ per mezzo della Acil-CoA deidrogenasi che è legata alla membrana mitocondriale interna)
COMUNICAZIONE INTERCELLULARE
 COMUNICAZIONE INTERCELLULARE TRASFERIMENTO DIRETTO DI SEGNALI CHIMICI E ELETTRICI ATTRAVERSO GIUNZIONI COMUNICANTI COMUNICAZIONE CHIMICA LOCALE (SOSTANZE PARACRINE E AUTOCRINE) COMUNICAZIONE A LUNGA DISTANZA
COMUNICAZIONE INTERCELLULARE TRASFERIMENTO DIRETTO DI SEGNALI CHIMICI E ELETTRICI ATTRAVERSO GIUNZIONI COMUNICANTI COMUNICAZIONE CHIMICA LOCALE (SOSTANZE PARACRINE E AUTOCRINE) COMUNICAZIONE A LUNGA DISTANZA
Fonte diretta di Energia è l ATP.
 Una cellula compie tre tipi di lavoro: -Lavoro meccanico: movimenti muscolari.. -Lavoro di trasporto: trasporto contro gradiente -Lavoro chimico: assemblaggio di polimeri da monomeri Fonte diretta di Energia
Una cellula compie tre tipi di lavoro: -Lavoro meccanico: movimenti muscolari.. -Lavoro di trasporto: trasporto contro gradiente -Lavoro chimico: assemblaggio di polimeri da monomeri Fonte diretta di Energia
INDICE PARTE I CHIMICA. Autori Introduzione
 INDICE Autori Introduzione XI XIII PARTE I CHIMICA Capitolo 1 STRUTTURA DELL ATOMO 3 1.1 Teorie atomiche 3 1.2 Costituenti dell atomo 4 1.3 Numeri quantici 4 1.4 Tipi di orbitali 5 1.5 Aufbau 6 1.6 Sistema
INDICE Autori Introduzione XI XIII PARTE I CHIMICA Capitolo 1 STRUTTURA DELL ATOMO 3 1.1 Teorie atomiche 3 1.2 Costituenti dell atomo 4 1.3 Numeri quantici 4 1.4 Tipi di orbitali 5 1.5 Aufbau 6 1.6 Sistema
L ossidazione completa del glucosio da parte dell O 2. può essere suddivisa in due semi-reazioni
 L ossidazione completa del glucosio da parte dell O 2 C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O può essere suddivisa in due semi-reazioni C 6 H 12 O 6 + 6 O 2 6 CO 2 + 24 H + + 24 e - (si ossidano gli atomi
L ossidazione completa del glucosio da parte dell O 2 C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O può essere suddivisa in due semi-reazioni C 6 H 12 O 6 + 6 O 2 6 CO 2 + 24 H + + 24 e - (si ossidano gli atomi
Prof. Maria Nicola GADALETA DISPENSA N. 23
 Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Biologia Terza edizione Capitolo 6:
 D. SADAVA et al. Biologia Terza edizione Capitolo 6: Energia, enzimi e metabolismo D. Sadava et al., BIOLOGIA 3/E, Zanichelli editore S.p.A. Copyright 2009 6 1 6 2 Metabolismo Il metabolismo (dal greco
D. SADAVA et al. Biologia Terza edizione Capitolo 6: Energia, enzimi e metabolismo D. Sadava et al., BIOLOGIA 3/E, Zanichelli editore S.p.A. Copyright 2009 6 1 6 2 Metabolismo Il metabolismo (dal greco
Anatomia biochimica di un mitocondrio
 Anatomia biochimica di un mitocondrio Le involuzioni(creste)aumentano considerevolmente l area della superficie della membrana interna. La membrana interna di un singolo mitocondrio può avere anche più
Anatomia biochimica di un mitocondrio Le involuzioni(creste)aumentano considerevolmente l area della superficie della membrana interna. La membrana interna di un singolo mitocondrio può avere anche più
Digestione, assorbimento e metabolismo
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Digestione, assorbimento e metabolismo H 2 O + CO 2 + Q ATP Q ADP+P i W Biomol. + O 2 Sintesi Biomol. O 2 Energia Organismo ATP
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Digestione, assorbimento e metabolismo H 2 O + CO 2 + Q ATP Q ADP+P i W Biomol. + O 2 Sintesi Biomol. O 2 Energia Organismo ATP
GHIANDOLE ANNESSE ALL APPARATO APPARATO DIGERENTE. Fegato, Pancreas, Cistifellea
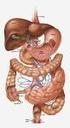 GHIANDOLE ANNESSE ALL APPARATO APPARATO DIGERENTE Fegato, Pancreas, Cistifellea Gli organi Fegato. Secerne la bile (emulsionante dei grassi) e proteine del sangue (fibrinogeno, albumine) Metabolizzazione
GHIANDOLE ANNESSE ALL APPARATO APPARATO DIGERENTE Fegato, Pancreas, Cistifellea Gli organi Fegato. Secerne la bile (emulsionante dei grassi) e proteine del sangue (fibrinogeno, albumine) Metabolizzazione
Gluconeogenesi. Le reazioni irreversibili della glicolisi sono aggirate attraverso l azione di enzimi differenti. Fegato e reni
 Gluconeogenesi Il glucosio può essere sintetizzato a partire da precursori più semplici, i precursori possono essere vari a seconda della specie vivente, nei mammiferi sono: piruvato, lattato, amminoacidi,
Gluconeogenesi Il glucosio può essere sintetizzato a partire da precursori più semplici, i precursori possono essere vari a seconda della specie vivente, nei mammiferi sono: piruvato, lattato, amminoacidi,
METABOLISMO delle PROTEINE
 METABOLISMO delle PROTEINE - Amminoacidi - Nucleotidi AZOTO essenziale per la vita In natura -N 2 atmosferico (N.B. N N triplo legame, molta energia per scinderlo) - ione nitrato NO 3 presente nel suolo
METABOLISMO delle PROTEINE - Amminoacidi - Nucleotidi AZOTO essenziale per la vita In natura -N 2 atmosferico (N.B. N N triplo legame, molta energia per scinderlo) - ione nitrato NO 3 presente nel suolo
