ph = log 1/[H + ] = log [H + ]
|
|
|
- Giacinta Mura
- 9 anni fa
- Visualizzazioni
Transcript
1 ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = ph urina Produzione H nell organismo mmol/dì H 2 O H 2 CO 3 H HCO 3 Non costituisce guadagno di H perché è volatile Acidi fissi (0.2%): Acido solforico (metabolismo proteico: metionina, cisteina, cistina) Acido fosforico (metabolismo fosfolipidi) Acido cloridrico (conversione Cloruro di ammonio in Urea) Acido lattico Corpi chetonici (Acido acetoacetico, βidrossibutirrico, acetone) Consumo H Reazioni metaboliche Ossidazione anioni (citrato, lattato, acetato) Bilancio adulto in dieta mista 1 meq/kg/dì di H Richiede: Tamponamento immediato Eliminazione renale 1
2 Dieta: Acidi grassi Aminoacidi Assunzione H, acido lattico, chetoacidi Plasma ph Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione: Eliminazione H Rene: H Sistemi di regolazione del ph Risposta immediata Sistemi tampone dei liquidi corporei si combinano istantaneamente con acidi e basi per impedire variazioni consistenti del ph Risposta rapida Sistema respiratorio Viene regolata in pochi minuti la ventilazione e quindi l eliminazione di Risposta lenta Rene elimina gli acidi o le basi in eccesso 2
3 Potere tampone: Quantità (moli) di acido o base che occorre aggiungere ad 1l di soluzione tampone per variare il ph di 1 unità Equazione di HendersonHasselbalch permette di calcolare il ph di una soluzione tampone ed è descritta dalla cinetica della reazione: K1 HA H A All equilibrio K1 = K2 K2 Per la Legge dell azione di massa: K1 [HA] = K2 [H ] [A ] K1 K2 = [H ] [A ] K1 [HA] [H ] [A ] K = [HA] K2 [H ] = K [A ] = K costante di equilibrio [HA] [HA] log [H ] = log K log [A ] ph = pk log [A ] [HA] Rappresentazione grafica dell equazione di HendersonHasselbalch Curva di titolazione di un acido debole Aggiunta di H HA pk = 6,5 Rimozione di H A A ph Quando il valore del ph è uguale al valore del pk, le concentrazioni di HA ed A sono uguali. Il sistema tampone è più efficiente nella parte centrale della curva (entro oscillazioni di 1 unità di ph in più o in meno del valore di pk) Il tampone è tanto più efficace quanto più: il suo pk è vicino al ph desiderato è presente in elevate concentrazioni 3
4 Sistema tampone del Bicarbonato E formato dalla coppia tampone HCO 3 / H 2 CO 3 e rappresenta il tampone più importante del LEC Quando viene aggiunto un acido forte come HCl, l H liberato viene tamponato da HCO 3 con formazione di H 2 CO 3 secondo la reazione: H HCO 3 K1 H 2 CO 3 H 2 O Quando viene aggiunta una base forte come NaOH, l OH liberato si combina con H 2 CO 3 formando HCO 3. La concentrazione di H 2 CO 3 diminuisce e la reazione è spostata verso sinistra. Secondo l equazione di HendersonHasselbalch: ph = pk log [HCO 3 ] /[H 2 CO 3 ] dove H 2 CO 3 può essere sostituito da L aumento della concentrazione di HCO 3 determina aumento del ph, spostando l equilibrio acidobase verso l alcalosi, mentre un aumento di abbassa il ph spostando l equilibrio acidobase verso l acidosi K2 ph = pk log [HCO 3 ] /1.2mmol/l pk = 6.1 ph = 6.1 log 24mmol/l /1.2mmol/l ph = 6.1 log 20 (1.3) = 7.4 Punto al quale normalmente opera nell organismo questo sistema tampone Aggiunta di H % tampone sotto forma di H 2 CO 3 e pk = 6, % tampone sotto forma di HCO 3 Aggiunta di OH ph Curva di titolazione del sistema bicarbonato Il sistema tampone non sembra essere particolarmente efficiente perché pk è 6.1 e il ph è 7.4, cioè la parte del tampone sotto forma di HCO 3 è 20 volte > di quella sotto forma di. Inoltre la concentrazione di HCO 3 e è bassa. 4
5 Il sistema tampone Bicarbonato è il sistema tampone extracellulare più potente dell organismo, perché rappresenta un sistema aperto nel quale è controllata dalla respirazione e HCO 3 dal rene. ph = 6.1 log 24mmol/l /1.2mmol/l L aggiunta di 5 mmol HCl in un sistema chiuso: ph = 6.1 log (24 5)/(1.2 5) ph = 6.1 log 19/6.5 = 6.6 L aggiunta di 5 mmol HCl in un sistema aperto, in cui è costantemente controllata: ph = 6.1 log 19/1.2 = 7.3 Sistema tampone del Fosfato HPO 4 2 /H 2 PO 4 pk = 6.8 E meno efficace perché: meno concentrato (12 meq/l) la forma acida non può essere eliminata come la E comunque essenziale per la regolazione del ph del liquido extracellulare e del liquido tubulare renale perché: il fosfato è enormemente concentrato nei tubuli renali il liquido tubulare ha un ph più vicino al pk del tampone Sistema tampone delle Proteine Le proteine sono i sistemi tampone più abbondanti dell organismo. La loro capacità tampone è legata all esistenza di gruppi imidazolici dell istidina (pk = ) e αaminici (pk = ). Nei globuli rossi l Emoglobina ha una importante funzione tampone. 5
6 Tamponi intracellulari Il ph intracellulare è leggermente inferiore a quello del LEC, ma segue, anche se lentamente, le sue variazioni, perché diffonde nelle cellule e H entra con anioni organici e in scambio con il K. I sistemi tampone intracellulari contribuiscono ad impedire variazioni del ph del LEC, anche se agiscono lentamente e sono rappresentati dalle proteine e dai fosfati inorganici (ATP, ADP, AMP Glucosio1 monofosfato e 2,3DPG). Basi tampone totali: Somma di tutti gli anioni (essenzialmente proteinati e bicarbonati) con effetto tampone La concentrazione totale delle basi tampone nel sangue, ammonta a circa 48 mmol/l e non si modifica al variare della p (se p aumenta, al corrispondente aumento di HCO 3, segue una diminuzione dei proteinati che tamponano l H ) La concentrazione totale delle basi tampone è un buon indice per il riconoscimento delle alterazioni dell equilibrio acidobase dovute ad aumento o diminuzione degli acidi fissi nel sangue Un aumento della concentrazione delle basi tampone, rispetto al normale, viene definito come eccesso di basi (BE). In caso di riduzione si parla di BE negativo 6
7 Il principio isoidrico: Quando varia la concentrazione di H del LEC, cambia, contemporaneamente, l equilibrio di tutto il sistema tampone Ogni condizione che altera l equilibrio di uno dei sistemi tampone cambia anche l equilibrio di tutti gli altri. La regolazione respiratoria dell equilibrio acidobase La seconda linea di difesa dalle alterazioni dell equilibrio acidobase è costituita dal controllo polmonare della concentrazione di Aumento di p significa diminuzione del ph, diminuzione di p aumento del ph. Regolando la p attraverso variazioni della ventilazione, i polmoni possono regolare il ph: Se il ph diminuisce la ventilazione è stimolata e la conseguente riduzione di p riporta il ph vicino ai valori normali Se il ph aumenta il centro respiratorio viene depresso, la ventilazione si riduce e il conseguente aumento di p riporta il ph vicino ai valori normali 7
8 I reni ripristinano l equilibrio acidobase in condizioni di alterazione attraverso: Riassorbimento di tutto l HCO 3 filtrato (acidosi) o di quantità minori di HCO 3 filtrato (alcalosi) Secrezione di quantità maggiori (acidosi) o minori (alcalosi) di H Produzione di nuovi HCO 3 (acidosi) Per mantenere l equilibrio acidobase i reni devono: Eliminare con le urine una quantità di ioni H (4400 meq/dì) equivalente a quella prodotta Impedire la perdita con le urine di HCO 3 riassorbendolo quasi totalmente (filtrato 4320 meq/dì) 8
9 Sia il riassorbimento del carico filtrato di HCO 3 che l escrezione di H vengono attuati mediante la secrezione di H da parte dei nefroni. In un giorno i nefroni secernono nel liquido tubulare 4400 meq/dì di H che non vengono tutti escreti con le urine ma in gran parte usati per il recupero del carico filtrato di HCO 3 Solo 80 meq/dì di H secreti vengono escreti con le urine, rendendo le urine acide, ph 44,5. Con un ph urinario di 4, può essere escreto solo 1 meq/l di H libero, mentre il resto è eliminato con i tamponi urinari (tampone fosfato e ammoniaca/ione ammonio) Riassorbimento degli HCO meq/dì 10% 432 meq/dì > 4.9% 215 meq/dì 1 meq/dì 9
10 Il riassorbimento degli HCO 3 filtrati avviene grazie alla secrezione di ioni H Modalità di screzione di H e riassorbimento di HCO 3 nel tubulo prossimale Cellule tubulari Filtrazione HCO 3 H H HCO 3 Sangue Na ATP K Anidrasi carbonica H 2 CO 3 H 2 O Na H 2 CO 3 H 2 O Liquido interstiziale Per ogni ione H secreto nel lume, uno ione HCO 3 viene riassorbito e passa nel sangue Lume tubulare 10
11 Riassorbimento HCO 3 : Aumenta se diminuisce il volume del LEC L aumentato livello di Angiotensina II ed Aldosterone provoca maggiore riassorbimento di Na In conseguenza dell aumentato riassorbimento di Na aumenta la secrezione di H Meccanismo alla base dell alcalosi da riduzione del LEC (Terapia con diuretici, vomito) In condizioni normali la velocità di secrezione tubulare degli ioni H è di circa 4400 meq/dì (4320 meq/dì di HCO 3 sono presenti nel tubulo) Gli H in eccesso (80 meq/dì) vengono escreti con l urina in combinazione con altri tamponi urinari. Infatti poiché il ph dell urina non può scendere sotto 4.5 (0.03 meq/l), solo una piccola parte degli H eccedenti può essere escreta in forma ionizzata. Se gli 80 meq/dì di H in eccesso fossero eliminati in forma ionizzata, sarebbe necessaria l escrezione di 2667 litri/dì di urina L escrezione nell urina di abbondanti quantitativi di ioni H si ottiene grazie alla presenza di tamponi urinari (sistema del fosfato e sistema dell ammoniaca) 11
12 Quando si ha un eccesso di HCO 3 rispetto ad H nell urina (alcalosi metabolica) gli HCO 3 in eccesso non possono essere riassorbiti e vengono escreti (compensazione dell alcalosi) Quando si ha un eccesso di H rispetto ad HCO 3 (acidosi), HCO 3 viene completamente riassorbito e gli H in eccesso passano nell urina, dove sono tamponati da fosfato ed ammoniaca ed escreti in forma di sali (compensazione dell acidosi) Il sistema tampone del fosfato: pk = 6.8 Cellule tubulari Filtrazione Na ATP K Na HPO 4 2 HCO 3 H H HPO 4 2 Sangue Liquido interstiziale Anidrasi carbonica H 2 CO 3 H 2 PO 4 H 2 O NaH 2 PO 4 Per ogni ione H secreto nel lume che si combina con un tampone Lume tubulare diverso dall HCO 3, un nuovo ione HCO 3 viene immesso nel sangue 12
13 In condizioni normali la maggior parte del fosfato filtrato è riassorbita, solo 3040 meq/dì sono utilizzabili come tampone urinario In condizioni di acidosi il sistema tampone prevalente è quello dell NH 3 Escrezione NH 3 nel tubulo prossimale Liquido interstiziale Glutamina Cellule tubulo prossimale Glutamina NH 3 2HCO 3 2NH 4 Lume tubulare Glutamina Cl Sangue Na ATP K NH 4 NH 4 Na NH 4 Cl Per ogni molecola di glutamina metabolizzata nei tubuli prossimali 2NH 4 vengono secreti nel tubulo e 2HCO 3 di nuova formazione vengono immessi nel sangue 1) Riassorbito nell ansa di Henle, in scambio con K e poi rientra nel lume del tubulo collettore come NH 3 2) Escreto con le urine 13
14 Escrezione NH 3 nei tubuli collettori NH 3 Cellule intercalari Sangue Na ATP K HCO 3 Anidrasi carbonica H 2 CO 3 H 2 O H H Liquido interstiziale Per ogni NH 4 escreto nell urina un nuovo HCO 3 viene immesso nel sangue NH 3 H ATP NH 3 H K Cl Cl NH 4 Lume tubulare Nell acidosi il metabolismo renale della glutamina viene stimolato, perché aumenta la sintesi della glutaminasi Nell acidosi cronica aumenta notevolmente l escrezione di NH 4 che diventa il meccanismo prevalente per l eliminazione di acido 14
15 Ruolo delle cellule intercalate del nefrone distale nell acidosi e nell alcalosi In caso di acidosi le cellule intercalate di tipo A secernono H e riassorbono HCO 3 (pompa ATPasi H e pompa ATPasi H /K membrana apicale) In caso di alcalosi le cellule intercalate di tipo B riassorbono H ed eliminano HCO 3 (pompa ATPasi H e pompa ATPasi H /K membrana basolaterale) L acidosi stimola l inserimento della pompa ATPasi H /K nella membrana apicale. La pompa rappresenta il punto di contatto tra H e K che può creare alterazioni nella kaliemia, parallele a quelle dell equilibrio acidobase. Acidosi associata ad iperkaliemia Alcalosi associata ad ipokaliemia Secrezione di H (5%) a livello delle cellule intercalate di tipo A in caso di acidosi Liquido interstiziale Cellule intercalate Lume tubulare Sangue Cl K HCO 3 Anidrasi carbonica H 2 CO 3 H 2 O H H H ATP ATP Per ogni ione H secreto nel lume, uno ione HCO 3 viene riassorbito e passa nel sangue Cl H H K H Escrezione nell urina 15
16 La secrezione di H è stimolata da Aldosterone: Azione diretta sulle cellule intercalate (meccanismo non ancora chiarito) Azione indiretta, il riassorbimento di Na a livello delle cellule principali aumenta il voltaggio negativo del lume, che favorisce la secrezione di H da parte delle cellule intercalate Riassorbimento di H a livello delle cellule intercalate di tipo B in caso di alcalosi Liquido interstiziale Cellule intercalate Lume tubulare Cl Cl H ATP H HCO 3 H HCO 3 Sangue ATP H K Anidrasi carbonica H 2 CO 3 H 2 O Per ogni ione H riassorbito uno ione HCO 3 viene secreto ed escreto nell urina K Escrezione nell urina 16
17 Acido netto escreto L escrezione di HCO 3 (U HCO3 x V) indica la rapidità con cui i reni rimuovono HCO 3 dal sangue (o immettono H nel sangue) La quantità di HCO 3 di nuova formazione è uguale alla quantità di H secreti nel tubulo ed associati a tamponi diversi da HCO 3 (quantità di NH 4 escreto acidità titolabile, valutata con NaOH fino a ph 7.4) Acido netto escreto = NH 4 escreto Acido titolabile urinario HCO 3 escreto 17
Rene ed equilibrio acido-base
 Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Plasma ph Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca
 Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
Equilibrio acido-base
 Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio
 Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Equilibrio acido base
 Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
Escrezione renale di Na + e sua regolazione
 Escrezione renale di e sua regolazione L escrezione di dipende dal carico filtrato (e quindi dalla VFG) e dal carico riassorbito Il riassorbimento di avviene in tutti i segmenti del nefrone e nel nefrone
Escrezione renale di e sua regolazione L escrezione di dipende dal carico filtrato (e quindi dalla VFG) e dal carico riassorbito Il riassorbimento di avviene in tutti i segmenti del nefrone e nel nefrone
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra ). La stabilità del ph è insidiata da
 Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE
 LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE 1 ALDOSTERONE Ormone steroideo rilasciato dalla corticale surrenale l aldosterone stimola: riassorbimento di Na +
LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE 1 ALDOSTERONE Ormone steroideo rilasciato dalla corticale surrenale l aldosterone stimola: riassorbimento di Na +
Tamponi biologici per il controllo del ph
 Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da
 Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
EQUILIBRIO ACIDO - BASE
 EQUILIBRIO ACIDO BASE Le reazioni metaboliche sono molto sensibili a cambiamenti del ph: il ph dei liquidi dell organismo è mantenuto entro un range di valori molto stretto. ph intracellulare è generalmente
EQUILIBRIO ACIDO BASE Le reazioni metaboliche sono molto sensibili a cambiamenti del ph: il ph dei liquidi dell organismo è mantenuto entro un range di valori molto stretto. ph intracellulare è generalmente
Sistema urinario: la funzione renale
 Sistema urinario: la funzione renale FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici, i reni ne regolano la concentrazione plasmatica
Sistema urinario: la funzione renale FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici, i reni ne regolano la concentrazione plasmatica
Rene ed equilibrio acido base. La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica. Principali funzioni renali
 Rene ed equilibrio acido base La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica Savi Umberto Scuola di Specializzazione in Nefrologia S.C. di Nefrologia e Dialisi Cattinara
Rene ed equilibrio acido base La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica Savi Umberto Scuola di Specializzazione in Nefrologia S.C. di Nefrologia e Dialisi Cattinara
Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali:
 Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali: 1) Secerne Idrogenioni; 1a) Riassorbe il Bicarbonato Filtrato; 1b) Produce Nuovo Bicarbonato. 4320 meq/die
Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali: 1) Secerne Idrogenioni; 1a) Riassorbe il Bicarbonato Filtrato; 1b) Produce Nuovo Bicarbonato. 4320 meq/die
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE 1 I tamponi fisiologici del ph 1 - Il sistema acido carbonico-bicarbonato: H 2 CO 3 H + + HCO 3 pka = 6.1 ph = 6.1 + log [HCO 3 ] [H 2 CO 3 ] 2 - Il sistema fosfato:
L EQUILIBRIO ACIDO-BASE NEL SANGUE 1 I tamponi fisiologici del ph 1 - Il sistema acido carbonico-bicarbonato: H 2 CO 3 H + + HCO 3 pka = 6.1 ph = 6.1 + log [HCO 3 ] [H 2 CO 3 ] 2 - Il sistema fosfato:
Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia
 Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia Obiettivi Produzione e bilancio degli idrogenioni Regolazione respiratoria e renale del ph Riassorbimento del bicarbonato e secrezione
Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia Obiettivi Produzione e bilancio degli idrogenioni Regolazione respiratoria e renale del ph Riassorbimento del bicarbonato e secrezione
ph = log 1/[H+] = - log [H+]
![ph = log 1/[H+] = - log [H+] ph = log 1/[H+] = - log [H+]](/thumbs/34/16948015.jpg) ph = log 1/[H+] = log [H+] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = inizio 7,36 max 6.8) ph superiori = alcalosi (limite ph inizio 7,44 max 7.8) ph intracellulare
ph = log 1/[H+] = log [H+] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = inizio 7,36 max 6.8) ph superiori = alcalosi (limite ph inizio 7,44 max 7.8) ph intracellulare
Sodio. L introduzione giornaliera con la dieta di sodio (200 meq/l) è maggiore del nostro fabbisogno (20 meq/l): è necessaria l escrezione urinaria
 Sodio L introduzione giornaliera con la dieta di sodio (200 meq/l) è maggiore del nostro fabbisogno (20 meq/l): è necessaria l escrezione urinaria E elemento principale per il controllo dell osmolalità
Sodio L introduzione giornaliera con la dieta di sodio (200 meq/l) è maggiore del nostro fabbisogno (20 meq/l): è necessaria l escrezione urinaria E elemento principale per il controllo dell osmolalità
I tre sistemi per la regolazione del ph
 I tre sistemi per la regolazione del ph Se vuoi finalmente capire quali sono e come funzionano i sistemi per la regolazione del ph questo breve articolo fa proprio al caso tuo. In questo articolo parleremo
I tre sistemi per la regolazione del ph Se vuoi finalmente capire quali sono e come funzionano i sistemi per la regolazione del ph questo breve articolo fa proprio al caso tuo. In questo articolo parleremo
LEZIONE 28: RIASSORBIMENTO E SECREZIONE TUBULARE
 LEZIONE 28: RIASSORBIMENTO E SECREZIONE TUBULARE 1 2 capillare peritubulare 80% >19% : riassorbito 20% Frazione di filtrazione riassorbimento = movimento di soluti filtrati e di acqua dal lume tubulare
LEZIONE 28: RIASSORBIMENTO E SECREZIONE TUBULARE 1 2 capillare peritubulare 80% >19% : riassorbito 20% Frazione di filtrazione riassorbimento = movimento di soluti filtrati e di acqua dal lume tubulare
Funzioni. Regola composizione ionica plasmatica Volume plasmatico Osmolarità ph Rimuove I prodotti di scarto
 La Funzione Renale Funzioni Regola composizione ionica plasmatica Volume plasmatico Osmolarità ph Rimuove I prodotti di scarto Il Nefrone Distinguiamo un tubulo renale (trasporto) ed un corpuscolo renale
La Funzione Renale Funzioni Regola composizione ionica plasmatica Volume plasmatico Osmolarità ph Rimuove I prodotti di scarto Il Nefrone Distinguiamo un tubulo renale (trasporto) ed un corpuscolo renale
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante di dissociazione
L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante di dissociazione
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi Lezione 24 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante
L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi Lezione 24 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante
2.Controllo dell equilibrio acido-base - II. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 2.Controllo dell equilibrio acidobase II Carlo Capelli Fisiologia Facoltà di Scienze Motorie Università di Verona 1. Tampone bicarbonatoco 2 E il sistema tampone fisiologico più importante [ CO 2] = PCO
2.Controllo dell equilibrio acidobase II Carlo Capelli Fisiologia Facoltà di Scienze Motorie Università di Verona 1. Tampone bicarbonatoco 2 E il sistema tampone fisiologico più importante [ CO 2] = PCO
EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI
 EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI SOMMARIO ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO ACIDO-BASE EGA (EMOGAS-ANALISI) ANALISI) ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO
EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI SOMMARIO ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO ACIDO-BASE EGA (EMOGAS-ANALISI) ANALISI) ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO
DISORDINI DELL EQUILIBRIO ACIDO - BASE
 DISORDINI DELL EQUILIBRIO ACIDO - BASE Equilibrio acido-base e potassio Nel tubulo distale e dotto collettore il riassorbimento del bicarbonato è legato a quello del potassio Il riassorbimento del bicarbonato
DISORDINI DELL EQUILIBRIO ACIDO - BASE Equilibrio acido-base e potassio Nel tubulo distale e dotto collettore il riassorbimento del bicarbonato è legato a quello del potassio Il riassorbimento del bicarbonato
In base all equazione di Henderson-Hasselbalch
 Alterazioni dell equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Si ha acidosi quando il rapporto HCO 3 /CO 2 diminuisce, causando una diminuzione del ph.
Alterazioni dell equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Si ha acidosi quando il rapporto HCO 3 /CO 2 diminuisce, causando una diminuzione del ph.
equilibrio acido base
 Alterazioni dell equilibrio equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [ ] [CO 2 ] Si ha acidosi quando, per diminuzione del rapporto /CO 2 il ph diminuisce. L acidosi
Alterazioni dell equilibrio equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [ ] [CO 2 ] Si ha acidosi quando, per diminuzione del rapporto /CO 2 il ph diminuisce. L acidosi
Trasporto dei gas respiratori nel sangue
 Trasporto dei gas respiratori nel sangue La soluzione dei gas nei liquidi C Legge di Henry acq P gas S gas C acq = quantità di gas disciolta nella fase acquosa P gas = pressione parziale del gas nella
Trasporto dei gas respiratori nel sangue La soluzione dei gas nei liquidi C Legge di Henry acq P gas S gas C acq = quantità di gas disciolta nella fase acquosa P gas = pressione parziale del gas nella
L'EQUILIBRIO ACIDO-BASE
 L'EQUILIBRIO ACIDO-BASE La concentrazione nell'organismo degli ioni H+ è finemente regolata perché quasi tutte le attività enzimatiche sono influenzate sostanzialmente dalle variazioni di ph. Quindi l'attività
L'EQUILIBRIO ACIDO-BASE La concentrazione nell'organismo degli ioni H+ è finemente regolata perché quasi tutte le attività enzimatiche sono influenzate sostanzialmente dalle variazioni di ph. Quindi l'attività
acqua, CO 2, O 2, sali e ioni H +
 Legge dell Equilibrio di Massa Se la quantità di una sostanza nell organismo deve rimanere costante, ad ogni sua acquisizione deve corrispondere una perdita di eguale entità acqua, CO 2, O 2, sali e ioni
Legge dell Equilibrio di Massa Se la quantità di una sostanza nell organismo deve rimanere costante, ad ogni sua acquisizione deve corrispondere una perdita di eguale entità acqua, CO 2, O 2, sali e ioni
Trasporto epiteliale
 Trasporto epiteliale Rivestono le cavità e le superfici corporee: interfaccia tra gli spazi interni dell organismo e l ambiente Semplice rivestimento o funzione di regolazione (es:osmoregolazione) Trasporto
Trasporto epiteliale Rivestono le cavità e le superfici corporee: interfaccia tra gli spazi interni dell organismo e l ambiente Semplice rivestimento o funzione di regolazione (es:osmoregolazione) Trasporto
Tamponi Biologici. AO/Febbraio 2016
 Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
17/05/2010. Equilibrio idrico. Variazioni del volume ematico indicono risposte omeostatiche
 Equilibrio idrico Variazioni del volume ematico indicono risposte omeostatiche 1 Ruolo del rene nel bilancio idrico Variazioni dell osmolarità attraverso la midollare 2 Scambio per controcorrente nella
Equilibrio idrico Variazioni del volume ematico indicono risposte omeostatiche 1 Ruolo del rene nel bilancio idrico Variazioni dell osmolarità attraverso la midollare 2 Scambio per controcorrente nella
Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento.
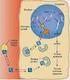 Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento. Lungo i tubuli renali viene riassorbita la maggior parte dei soluti e il
Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento. Lungo i tubuli renali viene riassorbita la maggior parte dei soluti e il
45. Fisiologia dell'equilibrio acido-base
 Lezioni di Patologia generale Capitolo 45. Fisiologia dell'equilibrio acido-base 1465 45. Fisiologia dell'equilibrio acido-base III edizione ebook Luigi Barbieri (opzionale) 45. Fisiologia dell'equilibrio
Lezioni di Patologia generale Capitolo 45. Fisiologia dell'equilibrio acido-base 1465 45. Fisiologia dell'equilibrio acido-base III edizione ebook Luigi Barbieri (opzionale) 45. Fisiologia dell'equilibrio
Omeostasi idro-elettrolitica
 Omeostasi idro-elettrolitica Riassorbimento idrico isoosmotico o obbligatorio Riassorbimento idrico non-isoosmotico o facoltativo Il bilancio idrico richiede l azione integrata di molteplici sistemi 1
Omeostasi idro-elettrolitica Riassorbimento idrico isoosmotico o obbligatorio Riassorbimento idrico non-isoosmotico o facoltativo Il bilancio idrico richiede l azione integrata di molteplici sistemi 1
Riassorbimento dell acqua lungo il nefrone
 Riassorbimento dell acqua lungo il nefrone La quota escreta di acqua varia fra 0.25% (0.5 L/giorno, massima antidiuresi) ed il 13% (24 L/giorno, massima diuresi), attestandosi in condizioni normali intorno
Riassorbimento dell acqua lungo il nefrone La quota escreta di acqua varia fra 0.25% (0.5 L/giorno, massima antidiuresi) ed il 13% (24 L/giorno, massima diuresi), attestandosi in condizioni normali intorno
Emogasanalisi in t.i.
 Emogasanalisi in t.i. 9 volte su 10 6 volte su 10 100 e più alterati rispetto ai v.n. interpretazioni inesatte diagrammi, nomogrammi, equazioni e sistemi di valutazione 100 anni dall equazione di Handerson
Emogasanalisi in t.i. 9 volte su 10 6 volte su 10 100 e più alterati rispetto ai v.n. interpretazioni inesatte diagrammi, nomogrammi, equazioni e sistemi di valutazione 100 anni dall equazione di Handerson
L anatomia dell apparato urinario
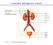 L anatomia dell apparato urinario Le funzioni del rene Secrezione (escrezione) Equilibrio idrico (controllo della pressione arteriosa) Equilibrio salino (controllo della composizione elettrolitica) Endocrina
L anatomia dell apparato urinario Le funzioni del rene Secrezione (escrezione) Equilibrio idrico (controllo della pressione arteriosa) Equilibrio salino (controllo della composizione elettrolitica) Endocrina
La eliminazione dei protoni nelle urine permette il ripristino di bicarbonato nel circolo sistemico.
 ESCREZIONE URINARIA DI ACIDI : 1-1,5 meq/l Es. produzione endogena di ac. solforico o cloridrico, formazione di sodio solfato o cloruro, eliminazione urinaria di ammonio legato ai sali. La eliminazione
ESCREZIONE URINARIA DI ACIDI : 1-1,5 meq/l Es. produzione endogena di ac. solforico o cloridrico, formazione di sodio solfato o cloruro, eliminazione urinaria di ammonio legato ai sali. La eliminazione
PSEUDOIPERKALEMIA o IPERPOTASSIEMIA SPURIA. Il paziente non ha problemi cardiaci ma iperpotassiemia
 PSEUDOIPERKALEMIA o IPERPOTASSIEMIA SPURIA Il paziente non ha problemi cardiaci ma iperpotassiemia Cause: Prolungato utilizzo del laccio emostatico Rottura delle cellule, durante il prelievo di sangue
PSEUDOIPERKALEMIA o IPERPOTASSIEMIA SPURIA Il paziente non ha problemi cardiaci ma iperpotassiemia Cause: Prolungato utilizzo del laccio emostatico Rottura delle cellule, durante il prelievo di sangue
Fisiologia Renale 4. Equilibrio acido-base: Fisiologia e fisiopatologia
 Fisiologia Renale 4. Equilibrio acido-base: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Tamponi fisiologici
Fisiologia Renale 4. Equilibrio acido-base: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Tamponi fisiologici
Alterazione della capacità tampone nell'organismo. Alterazione capacità tampone rev. 0 - data: 5 luglio
 Alterazione della capacità tampone nell'organismo Alterazione capacità tampone rev. 0 - data: 5 luglio 2008 1 Il ph fisiologico dell'organismo è compreso tra 7.38 e 7.44 Nel liquido extracellulare sono
Alterazione della capacità tampone nell'organismo Alterazione capacità tampone rev. 0 - data: 5 luglio 2008 1 Il ph fisiologico dell'organismo è compreso tra 7.38 e 7.44 Nel liquido extracellulare sono
Fisiologia Renale 8. Bilancio idro-elettrolitico III. Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona
 Fisiologia Renale 8. Bilancio idro-elettrolitico III Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona Obiettivi Bilancio del sodio e regolazione del volume extracellulare
Fisiologia Renale 8. Bilancio idro-elettrolitico III Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona Obiettivi Bilancio del sodio e regolazione del volume extracellulare
Anatomia funzionale del rene
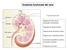 Anatomia funzionale del rene Funzione dei reni: Regolazione del volume del liquido extracellulare Regolazione dell osmolarità Mantenimento del bilancio idrico Regolazione omeostatica del ph Escrezione
Anatomia funzionale del rene Funzione dei reni: Regolazione del volume del liquido extracellulare Regolazione dell osmolarità Mantenimento del bilancio idrico Regolazione omeostatica del ph Escrezione
OSMOREGOLAZIONE DEI LIQUIDI CORPOREI
 OSMOREGOLAZIONE DEI LIQUIDI CORPOREI Lezione 25 1 Distribuzione dei liquidi corporei L H 2 O contenuta nel corpo è circa il 60% del peso totale ed è così ripartita: 67% 33% EXTRACELLULARE 33% INTRACELLULARE
OSMOREGOLAZIONE DEI LIQUIDI CORPOREI Lezione 25 1 Distribuzione dei liquidi corporei L H 2 O contenuta nel corpo è circa il 60% del peso totale ed è così ripartita: 67% 33% EXTRACELLULARE 33% INTRACELLULARE
CHIRURGIA III ED EMERGENZE MEDICO - CHIRURGICHE. Sezione di Anestesia e Rianimazione Dir. Prof. Carlo Alberto Volta
 CHIRURGIA III ED EMERGENZE MEDICO - CHIRURGICHE Sezione di Anestesia e Rianimazione Dir. Prof. Carlo Alberto Volta Equilibrio acido-base Ph normale: 7.35-7.45 Acidemia per ph < 7.35 Alcalemia per ph >
CHIRURGIA III ED EMERGENZE MEDICO - CHIRURGICHE Sezione di Anestesia e Rianimazione Dir. Prof. Carlo Alberto Volta Equilibrio acido-base Ph normale: 7.35-7.45 Acidemia per ph < 7.35 Alcalemia per ph >
1. Controllo dell equilibrio acido-base. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 1. Controllo dell equilibrio acido-base Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Misura dell acidità di una soluzione Definizione di acido: qualsiasi sostanza chimica che
1. Controllo dell equilibrio acido-base Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Misura dell acidità di una soluzione Definizione di acido: qualsiasi sostanza chimica che
FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua
 FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie Università degli Studi Verona Obiettivi Funzioni
FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie Università degli Studi Verona Obiettivi Funzioni
Equilibri acido-base, ph e sistemi tampone
 Equilibri acido-base, ph e sistemi tampone Tiziana Bellini Dipartimento di Scienze Biomediche Chirurgico Specialistiche Facoltà di Medicina Farmacia e Prevenzione Università di Ferrara Cos è un acido?
Equilibri acido-base, ph e sistemi tampone Tiziana Bellini Dipartimento di Scienze Biomediche Chirurgico Specialistiche Facoltà di Medicina Farmacia e Prevenzione Università di Ferrara Cos è un acido?
 Trigliceridi Colesterolo Esteri del Colesterolo Fosfolipidi Trasporti attraverso le membrane Diffusione facilitata: Scambio dei cloruri o Scambio Cl - /HCO - 3 Cl - HCO3
Trigliceridi Colesterolo Esteri del Colesterolo Fosfolipidi Trasporti attraverso le membrane Diffusione facilitata: Scambio dei cloruri o Scambio Cl - /HCO - 3 Cl - HCO3
CONTROLLO DELL OSMOLALITA DEI LIQUIDI CORPOREI
 CONTROLLO DELL OSMOLALITA DEI LIQUIDI CORPOREI Il rene è responsabile del controllo dell escrezione di acqua. Altre vie che consentono l eliminazione di acqua dall organismo includono sudorazione, feci
CONTROLLO DELL OSMOLALITA DEI LIQUIDI CORPOREI Il rene è responsabile del controllo dell escrezione di acqua. Altre vie che consentono l eliminazione di acqua dall organismo includono sudorazione, feci
EQUILIBRI DEI SISTEMI TAMPONE ACIDO-BASE
 EQUILIBRI DEI SISTEMI TAMPONE ACIDO-BASE E importante per poter controllare l andamento di una reazione mantenere costante il ph di una soluzione. Ad esempio il ph del plasma può variare, senza influenzare
EQUILIBRI DEI SISTEMI TAMPONE ACIDO-BASE E importante per poter controllare l andamento di una reazione mantenere costante il ph di una soluzione. Ad esempio il ph del plasma può variare, senza influenzare
SOLUZIONE TAMPONE. Soluzione il cui ph non è modificato dall aggiunta di modiche quantità di acido o di base forti
 SOLUZIONE TAMPONE Soluzione il cui ph non è modificato dall aggiunta di modiche quantità di acido o di base forti Una soluzione tampone è costituita da Acido debole in presenza della propria base coniugata
SOLUZIONE TAMPONE Soluzione il cui ph non è modificato dall aggiunta di modiche quantità di acido o di base forti Una soluzione tampone è costituita da Acido debole in presenza della propria base coniugata
In acqua pura o in soluzione acquosa, si ha sempre il seguente equilibrio: + +
 Ionizzazione dell Acqua e ph In acqua pura o in soluzione acquosa, si ha sempre il seguente equilibrio: + + L acqua è una sostanza anfiprotica, cioè può sia donare che accettare protoni (ioni H + ). Costante
Ionizzazione dell Acqua e ph In acqua pura o in soluzione acquosa, si ha sempre il seguente equilibrio: + + L acqua è una sostanza anfiprotica, cioè può sia donare che accettare protoni (ioni H + ). Costante
Riassorbimento tubulare
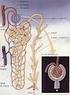 Riassorbimento tubulare Riassorbimento Secrezione Qtr = Qf- Qe Qts = Qe Qf Qtr = VFG*P UV Qts = UV VFG*P Le urine si formano mediante tre processi: Filtrazione glomerulare Riassorbimento di acqua e soluti
Riassorbimento tubulare Riassorbimento Secrezione Qtr = Qf- Qe Qts = Qe Qf Qtr = VFG*P UV Qts = UV VFG*P Le urine si formano mediante tre processi: Filtrazione glomerulare Riassorbimento di acqua e soluti
Unidirezionalità del trasporto di una sostanza è assicurata dalla polarizzazione morfologica e funzionale delle cellule epiteliali
 Unidirezionalità del trasporto di una sostanza è assicurata dalla polarizzazione morfologica e funzionale delle cellule epiteliali Lume tubulare (lato apicale, microvilli) Lume interstiziale/capillare
Unidirezionalità del trasporto di una sostanza è assicurata dalla polarizzazione morfologica e funzionale delle cellule epiteliali Lume tubulare (lato apicale, microvilli) Lume interstiziale/capillare
I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg
 LEZIONE RENE 6 I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg BL 4.2mM 150mM BILANCIO DEL POTASSIO 4 moli di K nei compartimenti liquidi Liquido intracellulare
LEZIONE RENE 6 I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg BL 4.2mM 150mM BILANCIO DEL POTASSIO 4 moli di K nei compartimenti liquidi Liquido intracellulare
Equilibrio Acido-Base: interpretazione dati emogasanalitici
 Equilibrio Acido-Base: interpretazione dati emogasanalitici Dott.ssa M. Martino Corso di medicina generale Anno 2010 L EMOGASANALISI è stata definita dall OMS come l esame in assoluto con il miglior rapporto
Equilibrio Acido-Base: interpretazione dati emogasanalitici Dott.ssa M. Martino Corso di medicina generale Anno 2010 L EMOGASANALISI è stata definita dall OMS come l esame in assoluto con il miglior rapporto
PRINCIPALI SISTEMI TAMPONE
 SISTEMI TAMPONE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE -------------------------------------------------------------------------------------------------------------- 3 2 PRINCIPALI SISTEMI TAMPONE
SISTEMI TAMPONE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE -------------------------------------------------------------------------------------------------------------- 3 2 PRINCIPALI SISTEMI TAMPONE
DEBOLE MEDIA FORTE FARMACI DIURETICI AD INTENSITÀ D AZIONE
 FARMACI DIURETICI AD INTENSITÀ D AZIONE a) osmotici mannitolo (Isotol), glicerina b) inibitori dell anidrasi carbonica acetazolamide (Diamox) c) risparmiatori di spironolattone (Aldactone, Spirolang),
FARMACI DIURETICI AD INTENSITÀ D AZIONE a) osmotici mannitolo (Isotol), glicerina b) inibitori dell anidrasi carbonica acetazolamide (Diamox) c) risparmiatori di spironolattone (Aldactone, Spirolang),
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE
 FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
Il sistema urinario. Regolazione della concentrazione di sali e acqua, del volume e osmolarità del sangue
 Il sistema urinario Regolazione della concentrazione di sali e acqua, del volume e osmolarità del sangue Funzioni dei reni Regolazione del volume del liquido extracellulare e plasmatico per evitare che
Il sistema urinario Regolazione della concentrazione di sali e acqua, del volume e osmolarità del sangue Funzioni dei reni Regolazione del volume del liquido extracellulare e plasmatico per evitare che
SOLUZIONI TAMPONE SOLUZIONI TAMPONE
 SOLUZIONI TAMPONE Le soluzioni tampone (o tamponi) sono costituite da: un acido debole e un suo sale (tampone acido) oppure una base debole e un suo sale (tampone basico) Una soluzione di un acido debole
SOLUZIONI TAMPONE Le soluzioni tampone (o tamponi) sono costituite da: un acido debole e un suo sale (tampone acido) oppure una base debole e un suo sale (tampone basico) Una soluzione di un acido debole
EQUILIBRIO ACIDO - BASE
 EQUILIBRIO ACIDO - BASE da appunti del dott. Claudio Italiano, internista ospedaliero Che significa? Vuol dire che l organismo ha un suo equilibrio, detto omeòstasi, cioè il sangue deve necessariamente
EQUILIBRIO ACIDO - BASE da appunti del dott. Claudio Italiano, internista ospedaliero Che significa? Vuol dire che l organismo ha un suo equilibrio, detto omeòstasi, cioè il sangue deve necessariamente
Anatomia funzionale del rene
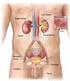 Anatomia funzionale del rene Funzione dei reni: Regolazione del volume del liquido extracellulare Regolazione dell osmolarità Mantenimento del bilancio idrico Regolazione omeostatica del ph Escrezione
Anatomia funzionale del rene Funzione dei reni: Regolazione del volume del liquido extracellulare Regolazione dell osmolarità Mantenimento del bilancio idrico Regolazione omeostatica del ph Escrezione
ELIMINAZIONE DEI FARMACI. L eliminazione di un farmaco avviene per escrezione e/o per biotrasformazione.
 ELIMINAZIONE DEI FARMACI L eliminazione di un farmaco avviene per escrezione e/o per biotrasformazione. Possono essere escreti: il farmaco immodificato i suoi metaboliti Le principali vie di escrezione
ELIMINAZIONE DEI FARMACI L eliminazione di un farmaco avviene per escrezione e/o per biotrasformazione. Possono essere escreti: il farmaco immodificato i suoi metaboliti Le principali vie di escrezione
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei Mantenere costanti volume ed osmolarità dei liquidi corporei è essenziale per l omeostasi. Questo è possibile solo se assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei Mantenere costanti volume ed osmolarità dei liquidi corporei è essenziale per l omeostasi. Questo è possibile solo se assunzione ed eliminazione di H 2
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Trasporto di O 2 nel sangue
 Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Funzioni del Rene. Escrezione prodotti di scarto del metabolismo (urea, creatinina, acido urico) e di sostanze estranee (farmaci, additivi alimentari)
 Il sistema urinario Funzioni del Rene Corticale Nefroni Escrezione prodotti di scarto del metabolismo (urea, creatinina, acido urico) e di sostanze estranee (farmaci, additivi alimentari) Midollare Pelvi
Il sistema urinario Funzioni del Rene Corticale Nefroni Escrezione prodotti di scarto del metabolismo (urea, creatinina, acido urico) e di sostanze estranee (farmaci, additivi alimentari) Midollare Pelvi
Raffaele Alvisi 14 gennaio 1916
 Raffaele Alvisi 14 gennaio 1916 Alterazioni del ph = Alterazioni dell equilibrio Acido-Base X 1 2 3 4 5 6 7 8 9 Conoscenze o Capacità Acquisite SI/NO Il clinico sospetta e dimostra l alterazione dell equilibrio
Raffaele Alvisi 14 gennaio 1916 Alterazioni del ph = Alterazioni dell equilibrio Acido-Base X 1 2 3 4 5 6 7 8 9 Conoscenze o Capacità Acquisite SI/NO Il clinico sospetta e dimostra l alterazione dell equilibrio
Bilancio Sodio e Potassio
 Bilancio Sodio e Potassio Sodio E l elemento fondamentale per: Controllo osmolalità Mantenimento volume del LEC Mantenimento Pressione arteriosa L introduzione giornaliera di sodio con la dieta (200 meq/l)
Bilancio Sodio e Potassio Sodio E l elemento fondamentale per: Controllo osmolalità Mantenimento volume del LEC Mantenimento Pressione arteriosa L introduzione giornaliera di sodio con la dieta (200 meq/l)
Il processo di ultrafiltrazione è interamente passivo e dipende sostanzialmente da tre fattori:
 Il processo di ultrafiltrazione è interamente passivo e dipende sostanzialmente da tre fattori: 1) Dalla differenza netta di pressione tra il lume del capillare ed il lume della capsula di Bowman; 2) dalla
Il processo di ultrafiltrazione è interamente passivo e dipende sostanzialmente da tre fattori: 1) Dalla differenza netta di pressione tra il lume del capillare ed il lume della capsula di Bowman; 2) dalla
Le Quattro Funzioni principali di eliminazione nel rene: I -Ultrafiltrazione (capsula di Bowman) II -Diffusione (riassorbimento) III -Secrezione per:
 Escrezione I Farmaci previa o meno biotrasformazione (metabolismo) possono essere escreti dal rene (urine), dal fegato e intestino (bile e feci), dal polmone (aria espirata), ma anche col latte materno,
Escrezione I Farmaci previa o meno biotrasformazione (metabolismo) possono essere escreti dal rene (urine), dal fegato e intestino (bile e feci), dal polmone (aria espirata), ma anche col latte materno,
www.slidetube.it Il nefrone è costituito dal corpuscolo renale e dal tubulo
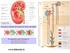 Il nefrone è costituito dal corpuscolo renale e dal tubulo Il corpuscolo renale è formato da : a) il glomerulo arterioso b) la capsula di Bowman www.slidetube.it Zona corticale Zona midollare Dall arteria
Il nefrone è costituito dal corpuscolo renale e dal tubulo Il corpuscolo renale è formato da : a) il glomerulo arterioso b) la capsula di Bowman www.slidetube.it Zona corticale Zona midollare Dall arteria
Eliminare dall organismo prodotti di rifiuto e sostanze tossiche idrosolubili(soprattutto prodotti azotati e creatinina);
 Funzioni del rene Eliminare dall organismo prodotti di rifiuto e sostanze tossiche idrosolubili(soprattutto prodotti azotati e creatinina); Regolare il volume e la composizione del liquido extracellulare;
Funzioni del rene Eliminare dall organismo prodotti di rifiuto e sostanze tossiche idrosolubili(soprattutto prodotti azotati e creatinina); Regolare il volume e la composizione del liquido extracellulare;
