COMPOSTI DI COORDINAZIONE
|
|
|
- Michelina Lentini
- 9 anni fa
- Просмотров:
Транскрипт
1 CMPSTI DI CRDIAZIE Gli elementi di transizione hanno proprietà che variano relativamente poco andando da sinistra a destra lungo la tavola periodica; hanno inoltre la caratteristica di avere orbitali d incompleti. Questi elementi sono tutti metalli: presentano le usuali caratteristiche metalliche e, tranne alcuni di quelli all inizio della transizione, hanno densità > 7,5 g cm -1 (metalli pesanti). A causa delle piccole differenze di energia tra gli elettroni del livello n e gli elettroni nel livello (n-1)d, hanno la possibilità di assumere molti stati di ossidazione fra 0 e +8, con caratteristiche ioniche agli stati di ossidazione più bassi (Fe +, Cr 3+ ) e ioni ossigenati con legami covalenti agli stati più alti (Mn - 4, Cr = 7, Fe = 4 ). Proprio per l accessibilità di svariati stati di ossidazione, molti elementi di transizione hanno proprietà catalitiche. Inoltre, i loro ioni sono spesso colorati (in particolare quelli con un numero dispari di elettroni d) perché, sempre a causa dei numerosi livelli energetici sia pieni che vuoti, ad energie poco diverse, hanno la possibilità di assorbire ed emettere luce visibile. A causa del loro elevato campo elettrico e della presenza di orbitali d incompleti, questi ioni possono dar luogo a composti di coordinazione, o complessi. Uno ione complesso è costituito da un atomo metallico centrale, con carica positiva, che coordina attorno a sé, secondo definite geometrie, un numero definito di molecole polari o di anioni (leganti). Il numreo di leganti coordinati va di solito da a 6, ma può arrivare a 1. Il fenomeno della coordinazione cambia il comportamento sia del metallo che del legante. Ad esempio: se ioni Fe + si trovano in soluzione in presenza di ioni H -, si può avere il fenomeno della precipitazione dell idrossido poco solubile Fe(H), che ha K s = 1,6 x i cianuri, in soluzione, presentano idrolisi dello ione C -, che forma HC + H - con K b = 1,6 x e consegue che, mettendo in soluzione insieme ioni Fe + e ioni C -, si dovrebbe osservare precipitazione dell idrossido di ferro. In realtà ciò non si osserva, mentre la reazione che avviene è esclusivamente la formazione dello ione complesso esacianoferrato (II): Fe C - = [Fe(C) 6 ] 4- aq In questo caso il H di formazione del legame dativo tra Fe e C è di circa 00 kj mol -1. La K di equilibrio per la reazione di decomposizione di questo complesso, ossia la K della reazione [Fe(C) 6 ] 4- aq = Fe C - è detta costante di instabilità, K inst, e nel caso dell esacianoferrato (II) vale Lo ione esacianoferrato (II) ha coordinazione ottaedrica. Un composto ionico contenente questo ione complesso può essere, ad esempio, il potassio esacianoferrato (II), di formula K 4 [Fe(C) 6 ]. Il ferro in questi complessi è diamagnetico, mentre lo ione Fe + è paramagnetico, in quanto ha configurazione 3d 5 4s 1. In un atomo o ione isolato di un metallo di transizione, i cinque orbitali d hanno tutti la stessa energia, mentre non è così quando l atomo è circondato da leganti. In base alla teoria degli orbitali molecolari, gli orbitali energeticamente vicini interagiscono fra loro di più rispetto a quelli molto diversi tra loro. Inoltre, l effetto dell interazione sui livelli energetici è diverso a seconda che l orbitale interessato punti verso il legante oppure no.
2 I complessi metallici possono essere a basso spin oppure ad alto spin in base al tipo di legante e alla conseguente tendenza (come spiegato nel seguito) ad accoppiare o meno, negli orbitali d a più bassa energia, gli elettroni di valenza. in un complesso ottaedrico i sei leganti interagiscono più fortemente con gli orbitali d che si sviluppano lungo gli assi x, y e z, ossia d z e d x y, mentre interagiscono più debolmente con gli orbitali d xy, d xz e d yz, che hanno posizioni intermedie fra gli assi. Di conseguenza, gli orbitali che interagiscono di più vengono spostati ad energie più alte (vengono destabilizzati per repulsione da parte del campo elettrico dei leganti) più degli altri. e g t g Si ha così la possibilità di salti di energia nello ione complesso. Solitamente il valore di in uno ione complesso sta tra 150 e 300 kj/mol, corrispondente all energia di radiazioni con lunghezze d onda comprese fra 800 e 400 nm, per lo più facenti parte dello spettro visibile. Il valore di dipende dall entità del campo elettrico del legante; per quelli più comuni la serie è Br - < Cl - < F - < H < H 3 < - < C - I leganti a campo elettrico maggiore, come C -, generano maggiori valori di, assorbono quindi a lunghezze d onda inferiori (verso il violetto) e la colorazione appare gialla; al contrario, i primi leganti della serie danno inferiori, assorbono λ maggiori (verso il rosso) e appaiono colorati in verde. Inoltre, se è basso, gli elettroni tenderanno a distribuirsi il più possibile spaiati, anche sui livelli di maggior energia, generando i cosiddetti complessi ad alto spin, come [Co(F) 6 ] 3- (Fig.1a)
3 Figura 1 b a Se invece è alto, gli elettroni avranno maggior convenienza energetica nell appaiarsi ai livelli più bassi, lasciando liberi quelli alti (Fig.1b), dando luogo a complessi a basso spin. Secondo questo modello, el complesso esacianoferrato (II) a basso spin, gli orbitali del metallo destinati ad ospitare i leganti danno luogo a coordinazione ottaedrica conseguente a ibridizzazione d sp 3 : E orbitali 3d, 4s e 4p di Fe + orbitali 3d, 4s e 4p di Fe + dopo spostamento degli elettroni tre orbitali 3d pieni; ibridizzazione d sp 3 fra due degli orbitali 3d, il 4s e i tre 4p. In questo modo si forma un complesso ottaedrico a basso spin. el caso dell esafluorocobalto (III), invece: Co 3+ mantiene gli elettroni spaiati. on ci sono orbitali 3d vuoti. L ibridizzazione avviene tra gli orbitali 4s, 4p e due dei 4d, mentre i 3d sono tutti occupati. Quando il complesso si forma, la carica totale è distribuita sugli atomi più esterni, mentre quelli interni sono quasi del tutto privi di carica. Infatti, se si considera il composto come ionico, il metallo dovrebbe avere carica ositiva e i leganti dovrebbero essere anioni; se, d altra parte, si considera il composto come formato mediante legami dativi da legante a metallo, ciò dovrebbe portare a carica negativa sul metallo e positiva sul
4 legante: il carattere di questi legami è invece misto e come risultato il metallo è quasi totalmente privo di carica. ltre alla coordinazione ottaedrica, si può avere anche il caso in cui il metallo coordini 4 leganti, e questo si può avere con due diverse geometrie: quella tetraedrica e quella planare quadrata. Il discorso è analogo a quello fatto per il caso della coordinazione ottaedrica, ma in questo caso i livelli si spostano in modo diverso: t d xy d xz d yz d x - y d z Coordinazione tetraedrica d x - y d xy d z d xz d yz Coordinazione planare quadrata i complessi ottaedrici sono più comuni di quelli tetraedrici perché la formazione di più legami li rende più stabili. La coordinazione tetraedrica è meno comune di quella planare quadrata. Il colore di molti composti di coordinazione deriva dall eccitazione degli elettroni dagli orbitali t g a quelli e g vuoti. Come già indicato, l energia assorbita hν per questa transizione corrisponde all energia di separazione. Il colore osservato è quello complementare alla λ della luce assorbita. I leganti, come detto, possono essere sia anioni che molecole neutre provviste di doppietti elettronici, come H 3, H, C. Vi sono poi leganti polidentati, dotati cioè di più di un gruppo in grado di coordinarsi al metallo. Fra questi:
5 H H H H H H H Ca + H H H l EDTA, o acido etilendiamminotetraacetico, in figura; è un legante esadentato, nel senso che può coordinare al metallo sia i quattro ossigeni, anche sotto forma di anioni acetato, che i doppietti dei due atomi di azoto. In questo modo una sola molecola di EDTA si può coordinare in forma ottaedrica intorno ad uno ione metallico, sequestrandolo in maniera estremamente stabile. Leganti di questo tipo vengono chiamati chelanti. L EDTA è usato nei detergenti perché, essendo in grado di coordinare ioni come Ca + e Mg +, può ridurrre la durezza dell acqua e migliorare l efficacia della detergenza (vedi Equilibri di precipitazione e Durezza delle acque). Si usa anche come antidoto nei casi di avvelenamento da alcuni metalli pesanti. Fra i chelanti, in natura sono molto importanti quelli di tipo porfirinico, presenti in strutture come l emoglobina e la clorofilla. La struttura in figura è l anello della porfirina, che, con leggere modificazioni, è presente nella clorofilla, dove coordina uno ione Mg +, e nell emoglobina, dove coordina uno ione di ferro.
6 ell emoglobina il ferro ha coordinazione planare quadrata all interno del gruppo eme, e può coordinare perpendicolarmente una molecola di, trasportandola nei vari tessuti periferici. Là dove vi è un alta concentrazione di (polmoni) l ossigeno si lega al ferro, mentre là dove tale pressione è più bassa viene rilasciato e al suo posto si lega C, che deve venir smaltita. Piuttosoto simili sono i leganti di tipo ftalocianinico, come il colorante blu in figura: Queste sostanze trovano ampia applicazione come coloranti tessili. Gli eteri corona possono a loro volta complessare ioni metallici attraverso i doppietti degli atomi di etere [18]-corona-6 diametro cavità interna,6-3,å complessa ioni K +, di diametro,66 Å etere [15]-corona-5 complessa ioni a +, di diametro 1,90 Å etere [15]-corona-5 complessa ioni Li +, di diametro 1,36 Å In questo modo, ioni metallici possono essere solubilizzati in solventi non acquosi.
Esercizi sui Complessi Metallici
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Complessi Metallici Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizi
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Complessi Metallici Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizi
Composti di coordinazione
 Composti di coordinazione Nelle molecole di un COMPOSTO DI COORDINAZIONE l atomo centrale e legato ad un numero di atomi superiore al suo numero di ossidazione. Lo studio dei composti di coordinazione
Composti di coordinazione Nelle molecole di un COMPOSTO DI COORDINAZIONE l atomo centrale e legato ad un numero di atomi superiore al suo numero di ossidazione. Lo studio dei composti di coordinazione
Composti di coordinazione
 Composti di coordinazione detti anche ioni complessi o complessi di coordinazione sono costituiti da un metallo (generalmente uno ione ione) di transizione coordinato (legato) da uno o più leganti (molecole
Composti di coordinazione detti anche ioni complessi o complessi di coordinazione sono costituiti da un metallo (generalmente uno ione ione) di transizione coordinato (legato) da uno o più leganti (molecole
Roberta Pierattelli. Metalli in Biologia. Qualche richiamo di chimica generale e inorganica
 Roberta Pierattelli Metalli in Biologia Qualche richiamo di chimica generale e inorganica Le proprietà periodiche n =1 n =2 n =3 n =4 n =5 n =6 n =7 Il numero del gruppo corrisponde alla somma degli elettroni
Roberta Pierattelli Metalli in Biologia Qualche richiamo di chimica generale e inorganica Le proprietà periodiche n =1 n =2 n =3 n =4 n =5 n =6 n =7 Il numero del gruppo corrisponde alla somma degli elettroni
ASSORBIMENTO UV-VIS. Atomo
 ASSRBIMET UV-VIS 1 Atomo Molecola E 3 E 2 Livelli elettronici (interazioni UV) A Tipi di vibrazione molecolare: E 1 E 0 sottolivelli vibrazionali (interazioni IR) sottolivelli rotazionali (interazioni
ASSRBIMET UV-VIS 1 Atomo Molecola E 3 E 2 Livelli elettronici (interazioni UV) A Tipi di vibrazione molecolare: E 1 E 0 sottolivelli vibrazionali (interazioni IR) sottolivelli rotazionali (interazioni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici. Capitolo 10
 Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Formazione di complessi
 Formazione di complessi Struttura degli ioni complessi Gli ioni complessi sono formati da un catione metallico legato ad anioni come OH -, Cl -, CN -, SCN -, o a molecole neutre come H 2 O, NH 3., detti
Formazione di complessi Struttura degli ioni complessi Gli ioni complessi sono formati da un catione metallico legato ad anioni come OH -, Cl -, CN -, SCN -, o a molecole neutre come H 2 O, NH 3., detti
DISSOLUZIONE DEI SALI IN ACQUA
 1 DISSLUZINE DEI SALI IN ACQUA 1. La dissoluzione di un sale è un equilibrio. 2. Diversi Sali hanno diverse solubilità (K ps ). 3. La solubilità dipende dall energia del reticolo ionico (U) e dall entalpia
1 DISSLUZINE DEI SALI IN ACQUA 1. La dissoluzione di un sale è un equilibrio. 2. Diversi Sali hanno diverse solubilità (K ps ). 3. La solubilità dipende dall energia del reticolo ionico (U) e dall entalpia
Capitolo 11 I legami chimici
 Capitolo 11 I legami chimici ai capito? pag. 55 a4, b3, c1, d Mg deve perdere elettroni per assumere la configurazione di Ne e ogni atomo di cloro può acquistare solo 1 elettrone. Ba + Ba + + ; Ba pag.
Capitolo 11 I legami chimici ai capito? pag. 55 a4, b3, c1, d Mg deve perdere elettroni per assumere la configurazione di Ne e ogni atomo di cloro può acquistare solo 1 elettrone. Ba + Ba + + ; Ba pag.
ORBITALE ATOMICO. Forma
 L ATOMO ORBITALE ATOMICO n (numero quantico principale) Energia e Dimensione l (numero quantico azimutale) Forma m l (numero quantico magnetico) Orientazione nello spazio l dipende da n assume n valori:
L ATOMO ORBITALE ATOMICO n (numero quantico principale) Energia e Dimensione l (numero quantico azimutale) Forma m l (numero quantico magnetico) Orientazione nello spazio l dipende da n assume n valori:
H 2 O 2 (aq) 2e - + O 2 (g) H + (aq) MnO 2 (s) +2e H + (aq Mn 2+ (aq) +2 H 2 O (l).
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico-elettronico: H 2 2 (aq) + Mn 2 (s) + H + (aq) Mn 2+ (aq) + 2 (g) + H 2 (l). Calcolare la massa di Mn 2 (s) necessaria per
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico-elettronico: H 2 2 (aq) + Mn 2 (s) + H + (aq) Mn 2+ (aq) + 2 (g) + H 2 (l). Calcolare la massa di Mn 2 (s) necessaria per
Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole
 Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole Secondo questa teoria l elettrone può essere descritto come fosse un
Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole Secondo questa teoria l elettrone può essere descritto come fosse un
Il legame chimico. Lezioni 17-20
 Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
La struttura elettronica dei complessi
 La struttura elettronica dei complessi La struttura degli atomi polielettronici presenta, rispetto all atomo di H, una maggiore complessità dovuta alla repulsione interelettronica La descrizione di un
La struttura elettronica dei complessi La struttura degli atomi polielettronici presenta, rispetto all atomo di H, una maggiore complessità dovuta alla repulsione interelettronica La descrizione di un
Chimica Inorganica e Laboratorio
 Chimica Inorganica e Laboratorio Le diapositive seguenti sono tratte dai lucidi utilizzati in aula per le lezioni del corso di Chimica Inorganica e Laboratorio. Nelle diapositive impiegate a lezione possono
Chimica Inorganica e Laboratorio Le diapositive seguenti sono tratte dai lucidi utilizzati in aula per le lezioni del corso di Chimica Inorganica e Laboratorio. Nelle diapositive impiegate a lezione possono
1. L energia di legame. 2. I gas nobili e a regola dell ottetto. 3. Il legame covalente. 4. Il legame covalente dativo. 5. Il legame covalente polare
 Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Comportamento dei metalli alcalini in ammoniaca liquida (P.E. 33 C) i metalli alcalini sono molto solubili in ammoniaca liquida (130 g di Cs in 40
 Comportamento dei metalli alcalini in ammoniaca liquida (P.E. 33 C) i metalli alcalini sono molto solubili in ammoniaca liquida (130 g di Cs in 40 g di NH 3, ossia 2,34 molecole NH 3 / 1 atomo Cs), dando
Comportamento dei metalli alcalini in ammoniaca liquida (P.E. 33 C) i metalli alcalini sono molto solubili in ammoniaca liquida (130 g di Cs in 40 g di NH 3, ossia 2,34 molecole NH 3 / 1 atomo Cs), dando
Teoria VSEPR Geometria molecolare
 Teoria VSEPR Geometria molecolare la teoria VSEPR la forma delle molecole Massima distanza possibile! Teoria della repulsione delle coppie di elettroni di valenza VSEPR Struttura delle molecole Le regioni
Teoria VSEPR Geometria molecolare la teoria VSEPR la forma delle molecole Massima distanza possibile! Teoria della repulsione delle coppie di elettroni di valenza VSEPR Struttura delle molecole Le regioni
I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo
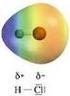 La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
LA STRUTTURA DELLE MOLECOLE. Le Molecole Poliatomiche
 LA STRUTTURA DELLE MOLECOLE Le Molecole Poliatomiche LE MOLECOLE POLIATOMICE Le molecole poliatomiche sono quelle molecole che sono composte da più di due atomi e contengono nella maggior parte dei casi
LA STRUTTURA DELLE MOLECOLE Le Molecole Poliatomiche LE MOLECOLE POLIATOMICE Le molecole poliatomiche sono quelle molecole che sono composte da più di due atomi e contengono nella maggior parte dei casi
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
1. L energia di legame
 legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
COMPOSTI DI COORDINAZIONE
 COMPOSTI DI COORDINAZIONE Teoria di Werner I metalli, specie quelli di transizione, presentano due tipi di valenza Valenza primaria: numero di elettroni che l atomo cede nella formazione dello ione metallico
COMPOSTI DI COORDINAZIONE Teoria di Werner I metalli, specie quelli di transizione, presentano due tipi di valenza Valenza primaria: numero di elettroni che l atomo cede nella formazione dello ione metallico
Gruppo 10 Nickel Ni (1751)
 Gruppo 10 ickel i (1751) Proprietà i Pd Pt Z 28 46 78 umero di isotopi 5 6 6 naturali Massa atomica 58.69 106.42 195.08 onfigurazione [Ar]3d 8 4s 2 [Kr]4d 10 [Xe]4f 14 5d 9 6s 1 elettronica Aspetto Metallo
Gruppo 10 ickel i (1751) Proprietà i Pd Pt Z 28 46 78 umero di isotopi 5 6 6 naturali Massa atomica 58.69 106.42 195.08 onfigurazione [Ar]3d 8 4s 2 [Kr]4d 10 [Xe]4f 14 5d 9 6s 1 elettronica Aspetto Metallo
Configurazione elettronica e Tavola periodica. Lezioni 13-16
 Configurazione elettronica e Tavola periodica Lezioni 13-16 Orbitali possibili Gusci e sottogusci Gli elettroni che occupano orbitali con lo stesso valore di numero quantico principale n si dice che sono
Configurazione elettronica e Tavola periodica Lezioni 13-16 Orbitali possibili Gusci e sottogusci Gli elettroni che occupano orbitali con lo stesso valore di numero quantico principale n si dice che sono
Il Legame Ionico. Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B -
 Il Legame Ionico Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B - A + B - Le coppie di ioni si attraggono elettrostaticamente Il
Il Legame Ionico Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B - A + B - Le coppie di ioni si attraggono elettrostaticamente Il
PROVA 1. Dati i composti con formula HI e NaNO 2 :
 PROVA 1 Dati i composti con formula HI e NaNO 2 : 1) Denominare i composti 2) Determinare le valenze o i numeri di ossidazione di tutti gli elementi nei due composti 3) Indicare quale legame esiste per
PROVA 1 Dati i composti con formula HI e NaNO 2 : 1) Denominare i composti 2) Determinare le valenze o i numeri di ossidazione di tutti gli elementi nei due composti 3) Indicare quale legame esiste per
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A Prova scritta del corso di Chimica A-K Compito prova
 CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2012-2013 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2012-2013 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
La struttura di ioni e molecole
 La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
L equilibrio dell acqua
 L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame
 IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
Configurazioni elettroniche e periodicità
 Configurazioni elettroniche e periodicità Le configurazioni elettroniche dei vari elementi sono una funzione periodica del numero atomico Z. Gli elementi che appartengono allo stesso gruppo nella tavola
Configurazioni elettroniche e periodicità Le configurazioni elettroniche dei vari elementi sono una funzione periodica del numero atomico Z. Gli elementi che appartengono allo stesso gruppo nella tavola
Legami Chimici. Insegnamento di Chimica Generale CCS CHI e MAT
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Legami Chimici Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/ Esercizio 1 e 2
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Legami Chimici Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/ Esercizio 1 e 2
LEGAME COVALENTE: TEORIA DEGLI ORBITALI MOLECOLARI
 LEGAME COVALENTE: TEORIA DEGLI ORBITALI MOLECOLARI Il legame covalente e la geometria delle molecole possono essere descritti dalla teoria del legame di valenza: i legami risultano dalla condivisione di
LEGAME COVALENTE: TEORIA DEGLI ORBITALI MOLECOLARI Il legame covalente e la geometria delle molecole possono essere descritti dalla teoria del legame di valenza: i legami risultano dalla condivisione di
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2
 ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
Il legame chimico ATOMI MOLECOLE
 Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
2. Quanti elettroni sono scambiati nella reazione redox: 2Fe + O 2 (g) + 4H 3 O + = 2Fe H 2 O a. 2 b. 3 c. 4
 1. La f.e.m o forza elettromotrice è indice della tendenza della reazione ad avvenire fino al raggiungimento dell equilibrio, più elevata è la f.e.m e: a. più il sistema è vicino dall equilibrio b. più
1. La f.e.m o forza elettromotrice è indice della tendenza della reazione ad avvenire fino al raggiungimento dell equilibrio, più elevata è la f.e.m e: a. più il sistema è vicino dall equilibrio b. più
LEGAME IONICO e TAVOLA PERIODICA
 LEGAME IONICO e TAVOLA PERIODICA BLOCCO s Tutti gli elementi di uno stesso gruppo hanno la stessa configurazione elettronica di valenza. Gli elementi del medesimo gruppo mostrano le medesime proprietà
LEGAME IONICO e TAVOLA PERIODICA BLOCCO s Tutti gli elementi di uno stesso gruppo hanno la stessa configurazione elettronica di valenza. Gli elementi del medesimo gruppo mostrano le medesime proprietà
Anno Accademico parte seconda A. CERIOTTI
 Anno Accademico 2011-12 parte seconda A. CERIOTTI CuCO 3 Cu(O) 2 + 2 Cu + 4 PF 6 + 16 C 3 C 4 [Cu(C 3 C) 4 ][PF 6 ] + 3 2 O + CO 2 Legante acetonitrile: C-C 3 Stato di ossidazione formale: Cu (+1) Configurazione
Anno Accademico 2011-12 parte seconda A. CERIOTTI CuCO 3 Cu(O) 2 + 2 Cu + 4 PF 6 + 16 C 3 C 4 [Cu(C 3 C) 4 ][PF 6 ] + 3 2 O + CO 2 Legante acetonitrile: C-C 3 Stato di ossidazione formale: Cu (+1) Configurazione
CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A Prova scritta del corso di Fondamenti di Chimica A-K Compito prova
 CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A. 2012-2013 Prova scritta del corso di Fondamenti di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI
CORSO DI LAUREA IN INGEGNERIA GESTIONALE A.A. 2012-2013 Prova scritta del corso di Fondamenti di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI
METALLI: bassa energia di ionizzazione bassa affinità elettronica. NON METALLI: elevata energia di ionizzazione elevata affinità elettronica
 METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
Lezione 3 - Legame chimico
 Lezione 3 - Legame chimico Generalità sul legame chimico Strutture di Lewis Elettronegatività e legame chimico Il legame covalente Gli orbitali molecolari e Il legame ionico Il legame metallico Orbitali
Lezione 3 - Legame chimico Generalità sul legame chimico Strutture di Lewis Elettronegatività e legame chimico Il legame covalente Gli orbitali molecolari e Il legame ionico Il legame metallico Orbitali
PROVA 1. Dati i composti con formula KBr e HClO 2 :
 PROVA 1 Dati i composti con formula KBr e HClO 2 : 1) Individuare a quale categoria di composti appartengono (ossidi,anidridi,idrossidi,acidi,sali) 2) Determinare le valenze o i numeri di ossidazione di
PROVA 1 Dati i composti con formula KBr e HClO 2 : 1) Individuare a quale categoria di composti appartengono (ossidi,anidridi,idrossidi,acidi,sali) 2) Determinare le valenze o i numeri di ossidazione di
COMPETENZE ABILITÀ CONOSCENZE. descrivere la. Comprendere ed applicare analogie relative ai concetti presi in analisi. struttura.
 ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
1) A che cosa è dovuta la elevata viscosità del mercurio elementare (allo stato liquido)?
 1) A che cosa è dovuta la elevata viscosità del mercurio elementare (allo stato liquido)? A. ai legami ad idrogeno tra gli atomi di mercurio B. alle interazioni tipo London tra gli atomi di mercurio C.
1) A che cosa è dovuta la elevata viscosità del mercurio elementare (allo stato liquido)? A. ai legami ad idrogeno tra gli atomi di mercurio B. alle interazioni tipo London tra gli atomi di mercurio C.
Legame Chimico. Legame Chimico
 Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Le proprietà periodiche degli elementi
 Le proprietà periodiche degli elementi 1 2 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 3 Numerazione gruppi
Le proprietà periodiche degli elementi 1 2 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 3 Numerazione gruppi
IBRIDAZIONE e GEOMETRIA MOLECOLARE
 IBRIDAZIONE e GEOMETRIA MOLECOLARE Esempio: struttura della molecola del metano CH 4 1s 2s 2p Configurazione elettronica del C Per esempio il carbonio può utilizzare la configurazione in cui un elettrone
IBRIDAZIONE e GEOMETRIA MOLECOLARE Esempio: struttura della molecola del metano CH 4 1s 2s 2p Configurazione elettronica del C Per esempio il carbonio può utilizzare la configurazione in cui un elettrone
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU)
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
Esercizi sulle Geometrie Molecolari
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Geometrie Molecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Geometrie Molecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Distorsioni dalla geometria ideale. in complessi a leganti diversi aventi proprietà di legame molto
 Distorsioni dalla geometria ideale in complessi a leganti diversi aventi proprietà di legame molto differenti (in posizioni distanti nella serie spettrochimica), es. trans-ml 4 L es. fac-ml L distorsione
Distorsioni dalla geometria ideale in complessi a leganti diversi aventi proprietà di legame molto differenti (in posizioni distanti nella serie spettrochimica), es. trans-ml 4 L es. fac-ml L distorsione
I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di energia.
 LEGAME COVALENTE H. +.H d H:H Lewis (oppure H-H Kekulè) 1s 1s 1s 2 1s 2 I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di
LEGAME COVALENTE H. +.H d H:H Lewis (oppure H-H Kekulè) 1s 1s 1s 2 1s 2 I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Cr Mn Fe Co Ni Cu Zn. Chimica Inorganica Biologica Vita ed Energia
 Vita ed Energia I processi chimici alla base della chimica della vita sono due: Uso dell E solare per produrre materia e O 2 da CO 2 e H 2 O Produzione di E mediante ossidazione di materia con formazione
Vita ed Energia I processi chimici alla base della chimica della vita sono due: Uso dell E solare per produrre materia e O 2 da CO 2 e H 2 O Produzione di E mediante ossidazione di materia con formazione
Appunti di Stechiometria per Chimica Numero d ossidazione
 Appunti di Stechiometria per Chimica Numero d ossidazione Si definisce numero d ossidazione la carica complessiva di un atomo (differenza tra protoni ed elettroni dell atomo), ottenuta assegnando, solo
Appunti di Stechiometria per Chimica Numero d ossidazione Si definisce numero d ossidazione la carica complessiva di un atomo (differenza tra protoni ed elettroni dell atomo), ottenuta assegnando, solo
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I - (aq) + NO 3
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
