UNIVERSITÀ DEGLI STUDI DI SIENA
|
|
|
- Tito Bartoli
- 8 anni fa
- Visualizzazioni
Transcript
1 UNIVERSITÀ DEGLI STUDI DI SIENA Dottorato di Ricerca in Medicina Molecolare XXII CICLO Coordinatore: Prof. Vincenzo Sorrentino IDENTIFICAZIONE DI NUOVI GENI MUSCOLO- SPECIFICI: STUDIO DELL ISOFORMA YIP1B Relatore: Prof. Vincenzo Sorrentino Correlatore: Dott.ssa Virginia Barone Dottoranda: Dott.ssa Elisa Mazzoli Anno Accademico
2 Sommario Riassunto 1 1 Introduzione Il tessuto muscolare Il muscolo scheletrico Reticolo sarcoplasmatico, tubuli T e triade Organizzazione del reticolo sarcoplasmatico durante lo 12 sviluppo 1.5 Rapporti tra reticolo endoplasmatico e reticolo sarcoplasmatico 1.6 Localizzazione dell apparato di Golgi nella fibra muscolare Il traffico vescicolare nelle cellule mononucleate Il traffico vescicolare nel muscolo scheletrico La famiglia di proteine YIP in lievito La famiglia di proteine YIP nei mammiferi Scopo della tesi 37 3 Materiali e metodi Colture cellulari Miociti primari Esperimenti di immunofluorescenza Esperimenti di immunofluorescenza su cellule Esperimenti di immunofluorescenza su sezioni di tessuto 42 I
3 3.2.3 Esperimenti di immunofluorescenza su diaframma Microscopia confocale Preparazione di lisati cellulari e di tessuto Lisati cellulari Lisati di tessuto Preparazione di microsomi da cellule e da tessuto Quantizzazione proteica con il metodo Bradford Elettroforesi in gel di poliacrilammide (SDS-PAGE) Western blot Clonaggi Trasfezioni Trasfezione transiente in cellule Trasfezione transiente in vivo mrna interference Estrazione RNA totale Preparazione del cdna (RT-PCR) Real-Time PCR Produzione e purificazione di anticorpi policlonali 53 Trattamento degli animali 54 4 Risultati Identificazione di nuovi geni espressi nel muscolo striato Espressione dei membri della famiglia YIP1 in diversi tessuti Espressione delle due isoforme di Yip1 in cellule C2C Validazione dell anticorpo anti-yip1b mediante Western blot Analisi dell espressione di Yip1B nei tessuti e in C2C Localizzazione sub-cellulare di Yip1B Localizzazione di Yip1B in cellule C2C12 64 II
4 4.5.2 Localizzazione di Yip1B in miociti primari Localizzazione di Yip1B in fibre muscolari adulte Espressione di Yip1B durante il differenziamento cellulare 71 delle C2C Espressione di Yip1B e Yip1A durante lo sviluppo muscolare 72 embrionale Analisi mediante Real-time PCR Analisi mediante Western blot Analisi mediante esperimenti di immunofluorescenza Espressione di Yip1B in fibre rigeneranti Effetto dell overespressione di Yip1B e Yip1A in C2C12 77 indifferenziate 4.10 Knock-down di Yip1B 78 5 Discussione 84 6 Bibliografia 87 III
5 Riassunto Il sistema di membrane interne delle fibre muscolari scheletriche, che comprende il reticolo endo/sarcoplasmatico, i tubuli T e l apparato di Golgi, presenta una precisa organizzazione spaziale rispetto al sarcomero. Infatti nel reticolo sarcoplasmatico si possono distinguere due regioni strutturalmente e funzionalmente differenti: la porzione longitudinale, dove ci sono proteine specializzate per la ricattura del calcio, e la porzione di reticolo giunzionale, in corrispondenza dei tubuli T, dove sono presenti le proteine per il rilascio di calcio. Anche l apparato di Golgi ha una distribuzione particolare: esso appare costituito da poche cisterne impilate l una sull altra disperse lungo la fibra e intorno ai nuclei. In questo contesto i meccanismi responsabili della localizzazione delle proteine residenti nel reticolo sarcoplasmatico non sono ancora noti. Allo scopo di studiare questi meccanismi, in laboratorio è stato isolato un cdna codificante una proteina chiamata Yip1B, omologa alla proteina Yip1p di lievito. Diversi studi presenti in letteratura hanno mostrato che in lievito Yip1p è una proteina importante per la biogenesi delle vescicole di trasporto rivestite da COPII gemmanti dall ER e per la loro competenza alla fusione con l apparato di Golgi. Nei mammiferi l omologo di Yip1p è presente come due isoforme: Yip1A e Yip1B. Allo scopo di verificare e quantificare l espressione di Yip1A e Yip1B nel muscolo scheletrico sono stati effettuati esperimenti di Real-Time PCR su diversi tessuti. Yip1A è espressa in modo ubiquitario, ad esclusione del muscolo scheletrico adulto, mentre Yip1B è espressa esclusivamente nel muscolo striato. E stata poi analizzata l espressione di entrambe le isoforme di Yip1 durante lo sviluppo embrionale e post-natale del muscolo. Dati di Real-Time PCR hanno evidenziato una riduzione dell espressione di Yip1A con il progredire dello sviluppo e quindi del differenziamento muscolare, e un contemporaneo aumento 1
6 dei livelli d espressione di Yip1B, la cui espressione proteica compare circa al 16 giorno di vita embrionale. Per studiare la localizzazione sub-cellulare e per meglio comprendere la funzione di Yip1B sono stati prodotti anticorpi policlonali contro la porzione idrofilica di Yip1B. Grazie ad esperimenti di Western blot, è stato visto che l antisiero prodotto é in grado di riconoscere la proteina endogena nel muscolo striato, in cellule C2C12 differenziate, ma non in C2C12 non differenziate e in altri tessuti, a conferma che si tratta di una proteina muscolo-specifica. Inoltre la proteina è presente in maggiori quantità nella frazione microsomiale dei muscoli scheletrici, a conferma della sua associazione con la membrana. Esperimenti di immunofluorescenza nel muscolo scheletrico hanno rivelato che la proteina Yip1B è localizzata ai poli del nucleo e in file di strutture puntiformi lungo la fibra e co-localizza parzialmente con il marcatore del cis- Golgi GM130. Dati presenti in letteratura dimostrano che l over-espressione dell isoforma Yip1A e soprattutto della sua porzione N-terminale, comporta la frammentazione dell apparato di Golgi. Per verificare se anche Yip1B possiede le stesse proprietà e per indagare quale porzione possa essere responsabile di questo effetto, sono stati trasfettati in cellule tre vettori d espressione contenenti diverse porzioni del gene. I risultati mostrano che l over-espressione della forma intera e della porzione N- terminale provocano la frammentazione dell apparato di Golgi, fenomeno che però non si verifica esprimendo la porzione di divergenza delle due isoforme composta dai primi 80 amminoacidi. Studi di knock-down sia in vitro che in vivo hanno infine dimostrato che il silenziamento di Yip1B non altera la distribuzione del marcatore del cis-golgi GM130, indicando che la diminuzione della proteina ha un effetto diverso rispetto alla sua over-espressione. 2
7 INTRODUZIONE 1 Introduzione 1.1 Il tessuto muscolare Nei Mammiferi sono presenti due tipi di tessuto muscolare: il tessuto muscolare liscio e il tessuto muscolate striato. Il tessuto muscolare liscio (fig. 1.1a) è costituito da unità morfologicamente distinte, dette fibrocellule muscolari lisce presenti a livello delle tonache muscolari degli organi cavi e dei vasi sanguigni, e poiché innervato dal sistema nervoso vegetativo, la sua contrazione è al di fuori del controllo volontario. Il tessuto muscolare striato, così chiamato a causa della distribuzione delle proteine contrattili che gli conferiscono un aspetto striato al microscopio ottico, si divide in muscolo striato cardiaco e scheletrico. Il tessuto muscolare cardiaco (fig. 1.1b) o miocardio è responsabile della contrazione del cuore ed è formato da singoli elementi mononucleati uniti tra loro da giunzioni di membrana. Il miocardio è in grado di generare autonomamente lo stimolo alla contrazione grazie al nodo seno-atriale dal quale si propagano gli impulsi elettrici che generano il battito cardiaco. Il ritmo cardiaco è invece influenzato dall attività del sistema nervoso autonomo e da stimoli ormonali. Il tessuto muscolare scheletrico (fig. 1.1c) costituisce la muscolatura scheletrica di tutto l organismo; essa è un sincizio formato dalla fusione, durante lo sviluppo muscolare, di elementi mononucleati detti mioblasti che fondendosi formano la fibra muscolare o miofibra. Il muscolo scheletrico è un muscolo volontario in quanto riceve terminazioni nervose dal sistema nervoso centrale. 3
8 INTRODUZIONE (a) (b) (c) Fig 1.1 Tipologie di muscolo nei mammiferi (Adattata da Il muscolo scheletrico Nel muscolo scheletrico le fibre muscolari sono disposte parallelamente e circondate esternamente da una guaina connettivale detta epimisio. Da questa si dipartono verso l interno della struttura muscolare dei setti, che rappresentano il perimisio, che vanno a circondare ciascun fascio di fibre. Dal perimisio si dipartono dei setti più sottili che circondano ogni singola miofibra, formando l endomisio, che contiene capillari e assoni (fig.1.2). 4
9 INTRODUZIONE Fig.1.2 Rappresentazione schematica della sezione longitudinale del muscolo scheletrico Sotto l endomisio si trova il sarcolemma, ossia la membrana plasmatica, che racchiude il citoplasma (sarcoplasma) della miofibra. Compresi tra il sarcolemma e l endomisio troviamo le cellule satelliti, mioblasti quiescenti in grado di conferire al tessuto le capacità rigenerative. E interessante notare che dal lato citoplasmatico del sarcolemma il citoscheletro è molto sviluppato ed ha un ruolo fondamentale nel mantenerne l integrità della miofibra durante gli stress meccanici della contrazione. In particolare è presente una proteina citoscheletrica, la distrofina che è il componente principale di un complesso proteico multimerico chiamato dystrophin glicoprotein complex (DGC); l alterazione o l assenza di distrofina o di uno dei componenti del complesso DGC comporta l insorgenza di diverse forme di distrofia muscolare (Blake et al., 2002). Immediatamente sotto la membrana plasmatica sono presenti numerosi nuclei e all interno del sarcoplasma troviamo gruppi di mitocondri, numerosi 5
10 INTRODUZIONE piccoli apparati di Golgi, gocce lipidiche e granuli di glicogeno per il fabbisogno energetico della miofibra, e la mioglobina, che rappresenta un importante riserva d ossigeno. E inoltre presente un esteso reticolo endoplasmatico specializzato detto reticolo sarcoplasmatico, che sarà trattato in dettaglio nel paragrafo successivo. La maggior parte del citoplasma della miofibra è occupata dalle miofibrille, lunghe strutture cilindriche con un diametro compreso tra 1 e 3 m, disposte lungo l asse maggiore della fibra, responsabili del fenomeno contrattile. Ciascuna miofibrilla presenta ad un esame al microscopio a luce polarizzata una striatura trasversale dovuta all alternanza di bande chiare e scure. Le bande scure sono birifrangenti o anisotrope, da qui il nome di bande A, mentre le bande chiare che appaiono isotrope sono dette bande I. Ciascuna banda I è divisa in due parti uguali da una linea più scura trasversale detta disco Z. Al centro della banda A è presente una zona più chiara detta banda H attraversata centralmente da una linea trasversale, la linea M. Il tratto compreso tra due dischi Z prende il nome di sarcomero e rappresenta l unità strutturale e funzionale del tessuto muscolare scheletrico (fig. 1.3). Le miofibrille sono costituite a loro volta da miofilamenti disposti longitudinalmente e compenetranti tra loro: i miofilamenti spessi di miosina e i miofilamenti sottili costituiti principalmente da actina. I miofilamenti spessi occupano l intera banda A e sono caratterizzati da due fasci di molecole di miosina disposti in modo opposto e uniti al centro del filamento; questa porzione in cui i filamenti hanno un diametro maggiore costituisce la banda H. La miosina ha una struttura esamerica formata da 2 catene pesanti e da 2 coppie di catene leggere. Le catene pesanti si avvolgono tra loro a formare la coda della molecola C-terminale mentre le porzioni N- terminali si avvolgono separatamente e si associano con le catene leggere a formare le teste della miosina, in cui si concentra l attività ATPasica responsabile della contrazione muscolare. 6
11 INTRODUZIONE Fig. 1.3 Rappresentazione schematica dell organizzazione delle miofibrille in una fibra muscolare scheletrica (Adattata da I miofilamenti sottili si dispongono in numero di 6 intorno a ciascun filamento spesso e occupano l intera banda I, parte della banda A, arrivando fino ai limiti della banda H, e si ancorano a livello del disco Z. Sono formati da monomeri di G-actina che polimerizza a formare una doppia elica di F- actina, a sua volta circondata dalla doppia elica di tropomiosina, a cui sono legate a intervalli regolari le 3 sub-unità della troponina. Tropomiosina e troponina cooperano tra loro, in un meccanismo Ca 2+ dipendente, per regolare l associazione e lo scivolamento reciproco dei filamenti spessi e sottili, che è alla base del meccanismo della contrazione muscolare. Durante la contrazione, infatti, i filamenti sottili di actina scorrono su quelli spessi di miosina con una conseguente riduzione della lunghezza delle bande I e della banda H (Rosati et al., 2007). 7
12 INTRODUZIONE Esistono diversi tipi di fibre muscolari scheletriche che sono principalmente distinte in base alle isoforme delle catene pesanti della miosina: I, IIA, IIB, IIX. In linea più generale le fibre sono distinte in base alla velocità di contrazione: si può affermare che le fibre a contrazione lenta contengono miosina di tipo I, le fibre a contrazione veloce contengono miosina di tipo IIB e IIX, le fibre intermedie contengono miosina di tipo IIA (Schiaffino e Reggiani, 1996). E infine da tenere presente che fibre muscolari con diversa velocità di contrazione, possiedono anche differenze nel tipo di metabolismo, resistenza alla fatica ed altre proprietà. 1.3 Reticolo sarcoplasmatico, tubuli T e triade Il reticolo sarcoplasmatico (RS) rappresenta una forma specializzata di reticolo endoplasmatico e nella fibra muscolare occupa circa il 10% del volume cellulare. La sua funzione principale è quella di regolare la concentrazione del Ca 2+ intracellulare durante la contrazione muscolare. Il reticolo sarcoplasmatico è un complesso sistema di endomembrane che circonda ciascuna miofibrilla e che instaura con le sue diverse zone dei precisi rapporti spazio-funzionali. E costituito da 2 domini morfologicamente e funzionalmente distinti: il reticolo sarcoplasmatico longitudinale, specializzato nel recupero del calcio, e il reticolo sarcoplasmatico giunzionale, che ha la funzione di rilascio del calcio (fig 1.4). Il RS longitudinale è formato da una rete di tubuli disposti in modo longitudinale rispetto all asse maggiore della fibra localizzati, nei mammiferi, a livello della banda A e della parte centrale della banda I. Questa porzione di reticolo è specializzata nel recupero di ioni calcio dal sarcoplasma grazie alla presenza di proteine integrali di membrana che fungono da pompe ioniche: le Ca 2+ ATPasi SERCA. I tubuli del RS longitudinale confluiscono in porzioni dilatate di reticolo, dette cisterne terminali localizzate in corrispondenza della giunzione tra la banda A e la banda I, a costituire il RS giunzionale (Franzini-Armstrong, 2004). 8
13 INTRODUZIONE Fig.1.4 Localizzazione del reticolo sarcoplasmatico in relazione alle diverse zone della miofibrilla (Adattata da Nel lume del RS giunzionale è presente la calsequestrina, una proteina che lega ioni calcio con elevata capacità ma con moderata affinità, che ha quindi la funzione di aumentare la capacità d immagazzinamento del calcio nel RS per poi renderlo disponibile per la contrazione muscolare (Beard et al., 2004). Tra due cisterne terminali adiacenti è presente un invaginazione della membrana plasmatica, denominata tubulo traverso o tubulo T, che porta alla formazione di una struttura specializzata detta triade, costituita da due cisterne terminali che fiancheggiano un tubulo T. Questa struttura rende possibile un accoppiamento tra il segnale nervoso che arriva alla membrana plasmatica (e quindi ai tubuli T) e il rilascio del calcio dal RS (ed in particolare dalle cisterne terminali), fenomeno che è chiamato accoppiamento eccitazione-contrazione (EC coupling). Nei tubuli T sono presenti infatti i recettori della diidropiridina (DHPR), dei canali del calcio voltaggio-dipendenti che si trovano a diretto contatto con i recettori della rianodina (RyR1 la principale isoforma presente 9
14 INTRODUZIONE nel muscolo scheletrico), un canale di rilascio del Ca 2+ localizzato nelle cisterne terminali del reticolo sarcoplasmatico. Queste due molecole formano le unità di rilascio del calcio (fig. 1.5) e rappresentano i siti in cui avviene l EC coupling (Flucher and Franzini-Armstrong, 1996). Fig.1.5 Struttura di un unità di rilascio del calcio nelle fibre di muscolo scheletrico adulto (Adattata da Protasi F., 2002). Durante l EC coupling si ha la depolarizzazione della membrana plasmatica dovuta all impulso nervoso, che viene trasmessa fino ai tubuli T. Qui le molecole di DHPR funzionano da sensori di voltaggio e stimolano in modo calcio-indipendente l apertura dei canali del calcio RyR1 permettendo la fuoriuscita del calcio immagazzinato nel reticolo sarcoplasmatico. Il calcio liberato è quindi in grado di legarsi alle proteine contrattili ed attivare la 10
15 INTRODUZIONE contrazione muscolare (Dulhunty, 2006). Dopo l eccitazione, il rilassamento del muscolo avviene grazie al trasporto ATP-dipendente del Ca 2+ dal citosol al lume del reticolo sarcoplasmatico, trasporto effettuato dalle Ca 2+ ATPasi SERCA presenti nel reticolo longitudinale (MacLennan, 1990). Oltre a DHPRs e RYRs, altre proteine sono presenti a livello della triade e partecipano al meccanismo dell EC coupling. Tra queste troviamo la calsequestrina, che, come detto in precedenza, è localizza a livello delle cisterne terminali. La calsequestrina va incontro a modificazioni strutturali dipendenti dalle variazioni della concentrazione di calcio. Un aumento della concentrazione di calcio comporta infatti la sua polimerizzazione ed il suo ancoraggio alla membrana del RS (fig. 1.6); inoltre cambia la sua conformazione anche durante l EC coupling, cambiamento che permette il rilascio del calcio. L ancoraggio alla membrana del RS avviene probabilmente indirettamente, ossia mediante due altre proteine presenti a livello del reticolo giunzionale: la triadina e la giuntina (fig. 1.6). Si tratta di due proteine transmembrana contenenti siti di legame sia per la calsequestrina che per RyR la cui funzione specifica non è stata ancora completamente chiarita (Beard et al., 2004). Un altra proteina di ancoraggio presente a livello della triade è la giuntofilina una proteina transmembrana fondamentale per la stabilizzazione del complesso giunzionale che fa da ponte molecolare tra i tubuli T e il reticolo sarcoplasmatico (Takeshima et al., 2000). 11
16 INTRODUZIONE Fig. 1.6 Modello dei cambiamenti strutturali che avvengono nella calsequestrina in funzione della concentrazione di calcio (da Beard N.A. et al., 2004) 1.4 Organizzazione del reticolo sarcoplasmatico durante lo sviluppo Il muscolo scheletrico origina dai somiti, delle masse di mesoderma disposte ai lati della corda dorsale, costituiti da una parte miogenica posta nella regione dorso-mediale del somite: il miotomo. Le cellule del miotomo si differenziano in mioblasti che fondendosi e allungandosi formano i miotubi, dei sincizi cellulari multinucleati dai quali si formeranno le fibre muscolari adulte. Subito dopo la fusione dei mioblasti ha inizio la sintesi delle proteine contrattili e il loro assemblaggio in miofibrille, che evolvono in un modello di differenziamento a tre stadi: inizialmente si formano le premiofibrille caratterizzate dalla presenza di Z-bodies, piccoli aggregati di alfa-actinina a cui sono attaccati i filamenti di actina e di miosina, quest ultima ancora di tipo non muscolare; successivamente si formano le miofibrille nascenti nelle 12
17 INTRODUZIONE quali compaiono anche filamenti di miosina di tipo muscolare. Nell ultimo stadio di miofibrilla matura scompare la miosina non muscolare, gli Z- bodies si fondono formando la linea Z e i filamenti di miosina muscolare si dispongono a formare la banda A (Sanger et al., 2002). Durante la formazione delle miofibrille avviene anche la maturazione del reticolo sarcoplamatico. Il reticolo sarcoplasmatico subisce una serie di modificazioni graduali che iniziano nella vita embrionale e continuano fino alle prime settimane di vita post-natale. Nella vita embrionale le proteine tipiche del reticolo sarcoplasmatico adulto sono distribuite in clusters posizionati in modo casuale lungo la fibra in via di sviluppo. Ogni cluster è costituito da tutte le componenti della triade, come RyR e triadina, e le proteine del tubulo T come il DHPR, suggerendo quindi che i meccanismi responsabili della formazione e del mantenimento di questa struttura sono presenti sin dai primi stadi dello sviluppo (Takekura, 2001). E possibile quindi ipotizzare che tali meccanismi includano eventi multipli quali l instaurarsi di contatti diretti tra le proteine del citoscheletro e della membrana plasmatica e la segregazione di diverse proteine in domini distinti del RS (Rossi et al., 2008). Il DHPR, ad esempio, al 14 e 15 giorno di vita embrionale (E14-E15) nel ratto, si presenta sotto forma di piccoli clusters distribuiti all interno della fibra ma principalmente concentrati alla periferia della stessa; al giorno E16 i clusters risultano longitudinalmente allineati e una frazione più piccola comincia ad allinearsi anche in direzione trasversale. Al 17 giorno di sviluppo embrionale cominciano a formare delle bande trasversali a livello della giunzione tra la banda A ed I e dall E18 queste doppie bande diventano ben allineate, come nella fase adulta. Anche le pompe del calcio SERCA fanno la loro comparsa allo stadio E14 sotto forma di clusters distribuiti in modo casuale nell intera fibra e a E16 cominciano ad allinearsi a livello del disco Z. Questa distribuzione viene mantenuta fino allo stadio adulto ma intorno al 5 giorno di vita postatale (D5) si aggiunge un bandeggio meno marcato a livello della banda M (Giacomello e Sorrentino, 2009). 13
18 INTRODUZIONE I meccanismi coinvolti nell organizzazione del reticolo sarcoplasmatico rispetto alle diverse zone del sarcomero durante lo sviluppo non è però ancora ben chiara. Ad esempio la comparsa delle prime strutture triadiche avviene prima della comparsa e dell allineamento delle miofibrille (Flucher et al., 1994), ma per il mantenimento dei rapporti tra le diverse regioni del reticolo sarcoplasmatico sembra invece sia molto importante l associazione con l apparato miofibrillare. E stato infatti proposto il coinvolgimento di due proteine, l ankirina 1.5 e l oscurina, nell assemblaggio del RS intorno al sarcomero. Essendo l oscurina associata alle miofibrille ed in grado di interagire con l ankirina 1.5 localizzata nel reticolo sarcoplasmatico, è stato ipotizzato un loro possibile ruolo nel mantenimento di connessioni stabili tra il RS e le miofibrille (Bagnato et al., 2003). Inoltre l ankirina 1.5 è una delle prime proteine del RS a concentrarsi in particolari zone del reticolo poste intorno alle miofibrille durante lo sviluppo e questo sembra suggerire un suo ruolo nelle successive fasi dell assemblaggio del reticolo sarcoplasmatico (Giacomello and Sorrentino 2009). 1.5 Rapporti tra reticolo endoplasmatico e reticolo sarcoplasmatico Nelle cellule eucariotiche il reticolo endoplasmatico (ER) rappresenta un sistema di membrane di forma tubulare e di cisterne appiattite suddiviso in due sub-compartimenti: il reticolo endoplasmatico ruvido, così chiamato per la presenza sulla sua membrana di numerosi ribosomi, dove avviene la sintesi proteica, e il reticolo endoplasmatico liscio, privo di ribosomi, in cui avvengono diversi processi metabolici come la sintesi di lipidi e che svolge la funzione di deposito di calcio. Nel reticolo endoplasmatico liscio sono presenti anche zone specializzate che costituiscono il reticolo endoplasmatico di transizione, così chiamato in quanto contiene i siti di uscita dall ER (ER exit sites o ERES) da cui gemmano le vescicole di trasporto contenenti 14
19 INTRODUZIONE proteine e lipidi di nuova sintesi destinati all apparato di Golgi (Alberts et al., 2004). Nel muscolo scheletrico la distribuzione di questi compartimenti del reticolo endoplasmatico all interno del reticolo sarcoplasmatico non è ancora ben nota. Alcuni lavori di Metsikkö e colleghi hanno cercato di chiarire la distribuzione di marcatori tipici del reticolo endoplasmatico all interno del RS delle fibre muscolari scheletriche. Esperimenti di immunofluoerescenza con l uso di anticorpi diretti contro diverse proteine tipiche del reticolo endoplasmatico ruvido hanno evidenziato una distribuzione perinucleare e un evidente bandeggio. In particolare, due proteine luminali dell ER, la disulfide isomerasi (PDI) e BIP, che svolgono la funzione di chaperon molecolari, e la riboforina II (RibII, una proteina di membrana associata al macchinario della glicosilazione) mostrano una distribuzione perinucleare e un bandeggio che occupa l intera banda I e la giunzione di questa con la banda A (Rahkila et al., 1997). La stessa distribuzione si riscontra anche per la proteina associata al complesso del traslocone, la proteina di membrana TRAP. Comparando questa distribuzione a quella della proteina SERCA residente all interno del reticolo sarcoplasmatico longitudinale e alla calsequestrina presente a livello delle cisterne terminali, si nota una sovrapposizione dei differenti segnali che non risulta però completa (fig. 1.7). Sembra quindi che la localizzazione delle proteine dell ER sia differente da quella delle proteine del RS, ma che tali proteine risiedano comunque all interno del sistema di membrane del reticolo sarcoplasmatico (Kaisto and Metsikkö, 2003). 15
20 INTRODUZIONE Fig. 1.7 Distribuzione dei marcatori del reticolo endoplasmatico e del reticolo sarcoplasmatico di una fibra di ratto. (da Kaisto T. and Metsikkö K., 2003). Nello stesso lavoro è stata individuata anche la posizione occupata dalle vescicole di trasporto rivestite dal complesso molecolare COPII, mediante l uso di un anticorpo diretto contro la sub-unità Sec23. Tale marcatore si localizza a livello della regione perinucleare, in strutture puntiformi lungo la miofibra ma principalmente presenta un bandeggio a livello della linea Z; inoltre, come emerge dalla doppia colorazione con anticorpi contro calsequestrina, non mostra nessuna colocalizzazione con quest ultima che rappresenta un marcatore delle cisterne terminali (fig. 1.8). 16
21 INTRODUZIONE Fig 1.8 Distribuzione del marcatore degli ER exit sites (sec23) e delle cisterne terminali (CSQ) in una fibra di ratto. (da Kaisto T. and Metsikkö K., 2003). Gli autori hanno quindi proposto un modello di localizzazione del reticolo endoplasmatico ruvido all interno del reticolo sarcoplasmatico: la porzione di ER ruvido in cui avvengono i processi di traslocazione, glicosilazione e folding sarebbe localizzato a livello delle cisterne terminali, mentre la porzione di reticolo in cui si ha la formazione delle vescicole di trasporto e quindi i siti di uscita dall ER, il cosiddetto reticolo endoplasmatico di transizione, si troverebbe a livello della linea Z (fig.1.9). In un lavoro più recente dello stesso gruppo è stata inoltre proposta l esistenza di microdomini lipidici contenti proteine residenti nell ER all interno del reticolo sarcoplasmatico, indicando che probabilmente si tratta di un sistema di membrane continuo (Kaakinen et al., 2008). Tuttavia l organizzazione e i rapporti tra questi due compartimenti non sono ancora chiari; in particolare non è noto come le proteine del RS una volta prodotte nell ER raggiungano la loro localizzazione definitiva nelle regioni specializzate dell SR, e più in generale come sia organizzato il trasporto di membrana tra il reticolo endoplasmatico e l apparato di Golgi nelle fibre muscolari scheletriche. Questo argomento sarà ripreso in uno dei paragrafi successivi. 17
22 Proteine tipiche del reticolo endoplasmatico ruvido Proteine tipiche del reticolo endoplasmatico di transizione Fig. 1.9 Rappresentazione schematica della distribuzione delle proteine tipiche del reticolo endoplasmatico all interno del reticolo sarcoplasmatico. (adattata da Kaisto e Metsikkö, 2003). 1.6 Localizzazione dell apparato di Golgi nella fibra muscolare L apparato di Golgi nelle cellule eucariotiche è composto da membrane che formano una serie di cisterne appiattite impilate l una sull altra in una struttura relativamente compatta che svolge un ruolo centrale nel traffico cellulare. Il Golgi viene suddiviso in 3 regioni: il cis-golgi più vicino al reticolo endoplasmatico, il medial-golgi centrale e il trans-golgi posto dal lato della membrana plasmatica. Nelle cellule muscolari indifferenziate, i mioblasti, il Golgi presenta ancora questa forma compatta, ma con il procedere del differenziamento, e quindi con la fusione dei diversi mioblasti, assume una conformazione peculiare delle cellule muscolari. Infatti il Golgi da compatto assume l aspetto di una struttura frammentata che si dispone intorno al
23 INTRODUZIONE nucleo e che con il progredire del differenziamento comincia a disporsi anche lungo i miotubi (Lu et al., 2001). In una fibra muscolare adulta queste strutture frammentate si riducono di dimensioni andando a costituire delle strutture puntiformi che si distribuiscono in modo differente nella fibra di tipo veloce e in quella di tipo lento. Nelle fibre a composizione lenta, come il soleo, l apparato di Golgi si dispone in strutture puntiformi lungo il perimetro dei nuclei e in file distribuite lungo l intera fibra; nelle fibre veloci occupa invece i poli del nucleo e si distribuisce in modo più casuale lungo la fibra formando delle file più corte contenenti da 1 a 3 strutture puntiformi (fig. 1.10); le fibre a composizione intermedia mostrano una distribuzione del Golgi che presenta entrambe le disposizioni (Ralston et al., 1999). Fig 1.10 Apparato di Golgi in una fibra di tipo lento (riquadri a sinistra) e in una ti tipo veloce (riquadri a destra). I due riquadri superiori rappresentano la superficie della fibra. La scala colorata nei due riquadri inferiori indica i diversi piani a cui sono state acquisite le immagini: il rosso indica la superficie, il blu la sezione più interna della fibra. (da Ralston E. et al., 1999). L uso della microscopia elettronica ha evidenziato la presenza di piccoli apparati del Golgi composti da tre o quattro cisterne impilate distribuiti lungo l intera fibra, corrispondenti alle strutture puntiformi osservate con immunofluorescenza. 19
24 INTRODUZIONE La diversa distribuzione dell apparato di Golgi nei diversi tipi di fibre sembra dovuta alla diversa attività neurale imposta dal motoneurone. Le proprietà delle fibre lente e veloci sono infatti in parte il risultato dell innervazione: l innervazione di una fibra lenta con un impulso tipico di un motoneurone veloce comporta la trasformazione della fibra da lenta a veloce e viceversa (Pette, 2001). L applicazione di uno stimolo opposto a quello proprio della fibra comporta anche una riorganizzazione della distribuzione del Golgi: ad esempio una fibra veloce denervata e stimolata con un impulso lento assumerà una distribuzione del Golgi tipico di una fibra lenta (Ralston et al., 2001). 1.7 Il traffico vescicolare nelle cellule mononucleate I processi di secrezione e di endocitosi sono meccanismi complessi che procedono attraverso diversi stadi quali la formazione di vescicole di trasporto contenenti molecole cargo specifiche, il loro trasporto e la loro fusione ad una membrana bersaglio specifica. Il processo endocitotico permette l ingresso di macromolecole dall esterno della cellula attraverso la membrana plasmatica mediante la formazione di vescicole spesso rivestite di clatrina contenenti recettori specifici per le macromolecole che devono essere inglobate nella cellula; in questo modo si viene a creare un sistema molto selettivo di internalizzazione cellulare. Una parte di queste macromolecole viene degradata nei lisosomi passando prima per gli endosomi precoci e poi tardivi, due compartimenti di membrana che fungono da sedi di smistamento. Negli endosomi precoci avviene anche il riciclaggio dei recettori della membrana plasmatica mediante un trasporto vescicolare. Nella via biosintetica-secretoria le proteine sono smistate nella cellula e secrete attraverso il passaggio dall ER all apparato di Golgi fino alla membrana plasmatica mediante vescicole di trasporto che continuamente 20
25 INTRODUZIONE gemmano e si fondono con le diverse membrane interessate (fig. 1.11). Il flusso di membrana tra i diversi compartimenti è costantemente bilanciato con vie di recupero nella direzione opposta, portando membrane e proteine specifiche al compartimento d origine (Alberts et al., 2004). Le proteine neo-sintetizzate, solubili e di membrana, entrano in questa via passando dal reticolo endoplasmatico ruvido che rappresenta il primo compartimento ad essere coinvolto nella via biosintetica-secretoria. Le proteine destinate ad altre sedi della cellula passano poi nel reticolo endoplasmatico liscio, così chiamato perché privo di ribosomi, dove avviene l esportazione verso l apparato di Golgi. La fuoriuscita delle proteine avviene in zone specializzate del reticolo liscio dette siti d uscita dall ER (ER Exit Sites o ERES) o reticolo endoplasmatico di transizione. Qui le proteine vengono selettivamente immagazzinate in vescicole di trasporto rivestite dal complesso molecolare COPII in modo diretto (per quanto riguarda le proteine di membrana) o indirettamente (come nel caso di proteine solubili) mediante l interazione con specifici recettori transmembrana come ad esempio la proteina ERGIC53 (Derby and Gleeson, 2007). Fig 1.11 Schematizzazione del pathway biosintetico-secretorio ed endocitotico che avviene tra il reticolo endoplasmatico e la membrana plasmatica. (da /ywwy/zbsw(E)/edetail7.htm) 21
26 INTRODUZIONE Questo rappresenta il modello classico di formazione e trasporto delle vescicole secretorie. Inoltre è stato visto che le molecole di grandi dimensioni, come ad esempio il procollagene, gemmano dall ER mediante la formazione di strutture tubulari e non di vescicole (Mironov et al., 2003), in modo indipendente dal rivestimento COPII. Il traffico vescicolare tra il reticolo endoplasmatico e l apparato di Golgi (early secretory pathway) ha inizio quindi con la formazione delle vescicole di trasporto rivestite da COPII, complesso che oltre a selezionare le proteine che devono essere trasportate fuori dall ER, contribuisce alla deformazione della membrana indispensabile per la formazione delle vescicole stesse. COPII rappresenta un complesso molecolare costituito da 5 sub-unità proteiche: Sar1, Sec23, Sec24, Sec13 e Sec31. L assemblaggio di COPII ha inizio quando Sec12, una proteina che svolge la funzione di fattore di scambio del nucleotide guanilico (GEF), converte Sar1 (una proteina G facente parte della famiglia delle proteine ARF) dalla forma legata a GDP a quella legata a GTP; questa reazione permette il legame di Sar1-GTP alla membrana dell ER (Barlowe et al., 1994). A questo punto Sar1 permette il reclutamento di altre due proteine del complesso: l eterodimero Sec23/Sec24 portando alla formazione del complesso di pre-budding. Tale complesso è già in grado di reclutare le proteine cargo nella zona di formazione delle vescicole (Kuehn et al., 1998). Successivamente si ha il reclutamento di un altro eterodimero formato dalle proteine Sec13/Sec31 che comporta la polimerizzazione del rivestimento e la deformazione della membrana (Matsuoka et al., 1998), (fig.1.12). Per quanto riguarda il reclutamento delle proteine cargo, sembra che tale processo sia dovuto principalmente alla sub-unità Sec24. Questa sembra essere presente come isoforme multiple (tre in lievito e quattro negli eucarioti superiori) e questo probabilmente aumenta la varietà di cargo che possono essere esportati dall ER. Quello che si è visto è che Sec24 è in grado di riconoscere domini di sequenza specifici presenti all estremità C-terminale delle proteine transmembrana che devono uscire dall ER. Sono state 22
27 INTRODUZIONE identificate tre tipologie di domini: uno è il motivo di-acidico Asp-X-Glu, l altro è formato da due ingombranti residui idrofobici ed è per questo identificato come motivo di-idrofobico (Barlowe, 2003). La terza classe invece è rappresentata dai domini di-basici che sono localizzati in prossimità del dominio transmembrana e che sembrano interagire direttamente con la subunità Sar1 invece che con Sec24 (Giraudo and Maccioni, 2003). Fig 1.12 Schematizzione della formazione delle vescicole rivestite dal complesso molecolare COPII a livello dei siti di uscita dall ER. (da Mancias J.D. and Goldberg J., 2005) Esistono anche numerose proteine solubili che sono efficientemente esportate fuori dall ER ma che non prendono contatto diretto con le proteine di COPII. Sono stati elaborati due modelli, che non si escludono l un l altro, per spiegare il reclutamento di tali proteine: uno di questi è il modello di esportazione mediato da recettori in cui diverse proteine transmembrana, presenti nella membrana della vescicola ricoperta da COPII in formazione, riconoscono e quindi concentrano le proteine solubili a livello di questi siti di esportazione. Tali proteine recettrici sono state identificate in ERGIC53, p24 o Erv29p in lievito (Tang et al., 2005). Il secondo modello, detto bulk flow, 23
28 INTRODUZIONE rappresenta invece un processo passivo cioè un trasporto continuo in cui le proteine non hanno bisogno di un segnale di riconoscimento per i recettori per essere inglobate nella vescicola. Questo rappresenta un trasporto per default e presuppone che la concentrazione di queste proteine sia simile tra i siti di uscita dall ER e il resto del lume endoplasmatico (Barlowe, 2003). Una volta gemmate dall ER, le vescicole di trasporto si fondono prima di raggiungere l apparato di Golgi formando delle strutture tubulari ( vesicular tubular cluster o VTC) che formano il compartimento intermedio (ERGIC), posto tra gli ERES e il Golgi, che manca negli eucarioti inferiori come i lieviti (fig. 1.13). Fig Schematizzazione dell early secretory pathway che avviene tra l ER, l ERGIC e l apparato di Golgi. (da Il compartimento intermedio rappresenta una stazione di smistamento per le proteine derivanti dall ER che da qui o vengono trasportate al Golgi mediante il traffico anterogrado, o vengono riportate indietro mediante il traffico retrogrado (Appenzeller-Herzog and Hauri, 2006). Il traffico retrogrado che avviene nell ERGIC è mediato da vescicole di trasporto rivestite dal complesso COPI. Tale complesso è formato da 7 sub-unità (α, β, 24
29 INTRODUZIONE γ, δ, β, ε, ζ-cop) il cui assemblaggio è controllato da Arf1, una piccola GTPasi della superfamiglia delle proteine Ras. Quando la sub-unità Sec7 del fattore di scambio del nucleotide guanilico GBF1 catalizza lo scambio del GDP con il GTP, Arf1-GTP subisce un cambiamento conformazionale che lo lega in modo più saldo alla membrana e recluta le diverse sub-unità di COPI. Arf1 legato al GDP si trova infatti già ancorato alla membrana mediante il dimero p23/p24 e p24 svolge anche la funzione di aiutare la polimerizzazione del rivestimento e la successiva deformazione della membrana (fig 1.14). Fig 1.14 Schematizzione della formazione delle vescicole rivestite dal complesso molecolare COPI nel traffico retrogrado (da Beck R. et al., 2009). Per quanto riguarda il trasporto anterogrado, il ruolo di COPI non è stato ancora completamente chiarito. COPI ha sicuramente un ruolo importante nel traffico retrogrado sia dall ERGIC e dal Golgi all ER sia tra le diverse cisterne del Golgi. Il traffico retrogrado rappresenta una via di recupero per le proteine residenti nell ER, ma anche per tutte quelle proteine importanti per la gemmazione delle vescicole che devono essere necessariamente restituite al 25
30 INTRODUZIONE reticolo endoplasmatico. Generalmente queste proteine contengono delle sequenze di riconoscimento indispensabili per il loro impacchettamento nelle vescicole COPI e quindi per il loro ritorno nell ER. Per esempio, per quanto riguarda le proteine solubili coinvolte nel folding o nell assemblaggio proteico, è stato visto che molte sono caratterizzate dalla presenza di una sequenza di ritenzione all estremità C-terminale, KDEL, responsabile del recupero delle proteine che devono tornare all ER. Grazie a questa sequenza le proteine si legano a recettori specifici posti sia a livello dell ERGIC che dell apparato di Golgi, che interagendo con COPI permettono la loro cattura e il loro ritorno al reticolo endoplasmatico. Molte proteine di membrana residenti nell ER contengono invece la sequenza KKXX all estremità C-terminale che le lega direttamente al complesso COPI e vengono quindi prontamente impacchettate all interno delle vescicole (Beck et al., 2009). Alcune proteine che sono prive di tali motivi (come la Shiga toxin) vengono trasportate mediante il traffico retrogrado COPI-indipendente. Le informazioni riguardo alla macchina molecolare che opera in questo traffico sono molto poche, quello che è noto è che sembra essere coinvolta la Rab6 (White, 1999). Oltre che una stazione di smistamento, il compartimento dell ERGIC sembra importante anche nel controllare la qualità delle proteine secretorie, essendo caratterizzato dalla presenza di diverse proteine chaperon (Breuza et al., 2004): quindi probabilmente le proteine con conformazione errata potranno essere ri-inviate all ER mediante il traffico retrogrado, per poi essere degradate dal sistema di degradazione associato all ER (Appenzeller-Herzog and Hauri, 2006). Il traffico vescicolare sia retrogrado che anterogrado tra il reticolo endoplasmatico e l apparato di Golgi avviene lungo i microtubuli del citoscheletro e con un meccanismo dipendente dall interazione tra due proteine motrici: la dineina e la dinactina. La dineina lega i microtubuli, mentre è stato visto che la dinactina è in grado di legarsi al rivestimento 26
31 INTRODUZIONE vescicolare COPII (Watson et al., 2005), COPI (Chen et al., 2005) e al compartimento intermedio (Roghi and Allan, 1999). Altro aspetto importante del traffico vescicolare è rappresentato dall abilità delle vescicole di trasporto di legarsi e poi fondersi con il compartimento cellulare di destinazione. Il riconoscimento e quindi il legame tra le diverse membrane interessate avviene grazie a tre classi proteiche: le proteine di tethering, le proteine SNARE e le Rab GTPasi. Le prime sono proteine che formano ponti tra una determinata vescicola e la sua specifica membrana target prima della fusione, permettendo quindi il riconoscimento. Sembra tuttavia che svolgano anche altre funzioni come l assemblaggio del complesso SNARE, la selezione del cargo, l attacco al citoscheletro e l assemblaggio dei complessi di rivestimento vescicolare (Lupashin and Sztul, 2005,) come per il fattore di tethering p115 che controlla il traffico tra ER e Golgi a livello di diversi siti: durante la formazione delle vescicole COPII, a livello dell ERGIC e del Golgi (Appenzeller-Herzog and Hauri, 2006). Le proteine SNARE, oltre a fornire una specificità di legame, permettono il contatto fisico tra le due membrane che devono fondersi. Queste proteine si suddividono in v-snare poste sulla membrana della vescicola e in t-snare presenti invece sulla membrana bersaglio. Il loro legame specifico porta alla formazione di complessi stabili che bloccano insieme le due membrane e ne permettono la successiva fusione (Hong, 2005), (fig. 1.15). Le Rab GTPasi fanno parte della superfamiglia delle proteine RAS e hanno la funzione di reclutare sulle membrane numerose proteine effettrici coinvolte in diverse funzioni del traffico vescicolare come la gemmazione delle vescicole, il loro trasporto, il riconoscimento e la fusione con le membrane accettrici. Si tratta di proteine che nello stato legante il GDP sono libere nel citosol e inattive grazie al legame con le proteine GDI (GDPdissociation inhibitor) che inibisce la dissociazione del GDP. La dissociazione del GDI dalla proteina Rab è catalizzata dal GDI-displacement factor (GDF) che permette il legame della Rab alla membrana.una volta legata, la Rab passa 27
32 INTRODUZIONE nella sua forma attiva legante il GTP grazie ad un fattore di scambio del nucleotide guanilico (GEF) ed è ora in grado di legare la specifica proteina effettrice (fig. 1.15). La Rab torna nel suo stato inattivo legante il GDP grazie all azione di una proteina GAP che catalizza l idrolisi del GTP (Grosshans et al., 2006). Fig Rappresentazione schematica del ciclo delle proteine SNARE e delle Rab GTPasi. (da Alberts B. et al., 2004). 1.8 Il traffico vescicolare nel muscolo scheletrico Il differenziamento miogenico dei mioblasti in fibre muscolari adulte comporta una massiccia riorganizzazione nella distribuzione degli organelli cellulari e la comparsa di nuove strutture cellulari, come il reticolo sarcoplasmatico. In questa profonda riorganizzazione anche il traffico vescicolare subisce delle modificazioni nel muscolo, rispetto alle cellule mononucleate. Ad oggi non è ancora completamente chiarito come le proteine tipiche del reticolo sarcoplasmatico raggiungano la loro sede 28
33 INTRODUZIONE definitiva dopo esser state prodotte all interno del reticolo endoplasmatico, e come sia localizzato il reticolo endoplasmico canonico all interno del RS. Questo aspetto è stato in parte analizzato in un lavoro di Rahkila e colleghi (1997) nel quale è stata studiata la localizzazione di diverse proteine coinvolte nel traffico vescicolare tra ER e Golgi nelle fibre muscolari scheletriche di ratto. Esperimenti di immunofluorescenza con anticorpi diretti contro la proteina p58 (omologa alla proteina ERGIC53 umana), un marcatore del compartimento intermedio, hanno evidenziato una distribuzione perinucleare, un evidente striatura longitudinale e un bandeggio trasversale che occupa l intera banda I. L uso di anticorpi diretti contro la Rab1, coinvolta nel traffico tra l ER e l apparato di Golgi, ha evidenziato una distribuzione simile a quella di p58. In un lavoro precedente dello stesso gruppo è stato visto che anche β- COP, una delle sub-unità di COPI, che è localizzata nell apparato di Golgi e che partecipa al traffico retrogrado tra quest ultimo e l ER, nel muscolo è presente nella regione perinucleare, bandeggia a livello della banda I ed ha una striatura longitudinale spesso caratterizzata da strutture puntiformi più intense presumibilmente riconducibili ai gruppi di cisterne del Golgi. La distribuzione dei diversi compartimenti coinvolti nel traffico vescicolare tra ER e Golgi è stata verificata anche grazie all analisi del traffico della proteina G, prodotta dal virus della stomatite vescicolare (VSV), nella sua forma mutata temperatura-sensibile tso45, il cui traffico tra i vari compartmenti può essere seguito modulando la temperatura. Alla temperatura di 39 C, che non permette il folding della proteina G, questa si trova bloccata nell ER ruvido a livello della giunzione tra la banda A e la banda I; quando la temperatura viene abbassata a 32 C, temperatura permissiva per il folding della proteina, e la gemmazione delle vescicole bloccata con il dinitrofenolo, questa localizza negli ER exit sites distribuendosi sia a livello della linea Z che nella regione perinucleare. Se la temperatura viene portata a 20 C la proteina viene trasportata all apparato di Golgi andando a localizzarsi nella regione perinucleare e in strutture puntiformi lungo la fibra (Rahkila et al., 1996). Con esperimenti di doppia marcatura è emerso che le strutture longitudinali di p58 29
34 INTRODUZIONE e Rab1 seguono il corso dei microtubuli, così come anche il marcatore del cis- Golgi GM130 evidenzia delle strutture puntiformi che colocalizzano con i microtubuli longitudinali. Anche il traffico retrogrado sembra sia associato ai microtubuli in quanto il trattamento con brefeldina A (che comporta la ridistribuzione delle proteine del Golgi all ER) delle fibre infettate con il VSV, comporta il ritorno della proteina G dal Golgi all ER, con una distribuzione che segue quella dei microtubuli. Sembra quindi che il traffico vescicolare tra ER/RS e l apparato di Golgi avvenga nella fibra muscolare, come nelle cellule mononucleate, lungo i microtubuli (Rahkila et al., 1997). In un altro lavoro, effettuato su fibre di muscolo scheletrico e in cellule mioblastiche, è stato visto che per un corretto targeting della calsequestrina nelle cisterne terminali del RS c è bisogno di un attiva uscita dall ER, probabilmente mediata dalla gemmazione di vescicole rivestite di COPII: sembra quindi ci sia bisogno di un trasporto mediato da vescicole per il sorting della calsequestrina. Inoltre, poiché la distruzione del Golgi non comporta un alterazione della localizzazione di questa proteina nel RS, è stato ipotizzato che molto probabilmente questo apparato non è coinvolto nel targeting della calsequestrina (Nori et al, 2004). Molte proteine sono mantenute all interno del lume del reticolo sarco/endoplasmatico mediante la sequenza KDEL, ma molte proteine del RS, tra le quali la calsequestrina, non contengono questo segnale di ritenzione. E stato ipotizzato che tale proteina sia mantenuta all interno del reticolo grazie alla sua capacità di polimerizzazione, che rappresenterebbe quindi un meccanismo di ritenzione (Gatti et al., 2001; Houle et al., 2006). Un altra proteina residente nel reticolo sarcoplasmatico che non presenta nessuna sequenza caratteristica di ritenzione è la pompa del calcio ATPasica SERCA. In un lavoro di Newton e colleghi è stata dimostrata la presenza, all interno dell isoforma SERCA1, di due motivi transmembrana (M1 e M2) all interno della regione N-terminale che svolgono il ruolo di segnali di recupero. Infatti la ritenzione della proteina nel reticolo sarcoplasmatico non è assoluta, in quanto è stato visto che una buona parte della proteina si ritrova 30
35 INTRODUZIONE anche nell ERGIC, ma non prosegue il suo cammino lungo il pathway di secrezione, ed infatti non raggiunge il trans-golgi (Newton et al., 2003). Sembra quindi che SERCA1 sia mantenuta nel RS tramite un processo di recupero dall ERGIC, come ipotizzato anche per altre due proteine di membrana residenti nel reticolo sarcoplasmatico, il fosfolambano e la sarcolipina. (Butler et al., 2007). 1.9 La famiglia di proteine Yip in lievito La famiglia di proteine Yip rappresenta un insieme di piccole proteine di membrana, capaci di interagire con le proteine Rab e con gli altri membri della famiglia Yip stessa, che si sono conservate durante l evoluzione; infatti le ritroviamo in tutti gli organismi eucarioti, dai lieviti alle piante fino agli animali più evoluti come i mammiferi. Il primo membro della famiglia ad essere stato identificato è Yip1p di lievito quale interattore delle Rab GTPasi Ypt1p e Ypt31p (Yang et al., 1998). Successivamente sono stati individuati altri membri di questa famiglia: Yip2p o Yop1p (Calero et al., 2001), Yip3p (Calero and Collins, 2002), Yip4p e Yip5p (Calero et al., 2002) e Yif1p che forma un complesso con Yip1p (Matern et al., 2000) (fig. 1.16). Fig Membri della famiglia di proteine YIP in lievito. (Adattata da Pfeffer e Aivazian, 2004). 31
36 INTRODUZIONE Si tratta di proteine caratterizzate da un estremità N-terminale idrofilica, probabilmente sufficiente per il legame con le Rab GTPasi, seguita da 4-5 regioni idrofobiche molto conservate, che rappresentano i domini transmembrana (Shakoori et al., 2003). Yip1p rappresenta il membro della famiglia fin ora meglio studiato. Si localizza a livello dell apparato di Golgi, e poichè è in grado di legarsi alle Rab GTPasi coinvolte nel traffico tra l ER e l apparato di Golgi, probabilmente è richiesta per il trasporto vescicolare a livello dell early secretory pathway. Infatti in un lavoro di Barrowman e colleghi (2003), è stato visto che anticorpi diretti contro Yip1p o Yif1p, che formano un complesso, bloccano il trasporto vescicolare verso l apparato di Golgi, ma questo effetto non si presenta se gli anticorpi sono aggiunti dopo la formazione delle vescicole. Gli autori di questo lavoro hanno quindi concluso che il complesso Yip1p-Yif1p è richiesto per produrre vescicole secretorie competenti per la fusione con l apparato di Golgi. In un altro lavoro, è stato visto che anticorpi diretti contro Yip1p non permettono la gemmazione dall ER delle vescicole rivestite da COPII, ma non ostacolano la fusione di queste con l apparato di Golgi (Heidtman et al., 2003). Tale risultato è in parte contrastante con quello del lavoro precedente, ma può essere spiegato con l ipotesi che altri membri della famiglia possono svolgere la stessa funzione di Yip1p e Yif1p. Il complesso Yip1p-Yif1p ha anche un terzo interattore: Yos1p, una proteina di membrana che si localizza a livello del reticolo endoplasmatico, dell apparato di Golgi e delle vescicole di trasporto ricoperte da COPII, distribuzione che ha fatto quindi ipotizzare un suo coinvolgimento nel traffico tra ER e apparato di Golgi; questa ipotesi è sostenuta anche dal fatto che il silenziamento di Yos1p comporta difetti nella secrezione caratteristici del blocco del trasporto tra questi due compartimenti (Heidtman et al., 2005). La capacità di Yip1p-Yif1p di interagire con due proteine Rab ha portato ad ipotizzare un possibile ruolo di questo complesso come GDF (GDI displacement factor), che permette la dissociazione del GDI dalla proteina Rab e il legame della Rab alla membrana. Questa ipotesi è stata incoraggiata 32
37 INTRODUZIONE dalla scoperta che la proteina umana PRA1, omologa alla Yip3p di lievito, è in grado di dissociare il complesso Rab9-GDI per il reclutamento della Rab9 sulla membrana degli endosomi (Sivars et al., 2003); Yip3p però agisce a livello del trans-golgi e ha una limitata omologia con la sequenza di Yip1p o Yip1f. In un lavoro di Chen e colleghi è stato visto che una serie di proteine Rab che agiscono a livello dell apparato di Golgi, sono necessarie per lo svolgimento delle funzioni di Yip1p e mutazioni di Yip1p diminuiscono la capacità di interazione con le Rab. Gli autori hanno quindi ipotizzato un modello che vede Yip1p agire in un pathway comune che coinvolge sia COPII che le Rab, quest ultime necessarie in una fase successiva alla gemmazione vescicolare, (Chen et al., 2004). La Rab1 oltre ad avere un ruolo nella fusione delle vescicole COPII con l apparato di Golgi (Cao and Barlowe, 2000) sembra sia coinvolta anche nella fusione delle vescicole COPI con il reticolo endoplasmatico, e quindi nel traffico retrogrado tra l apparato di Golgi e l ER (Kamena et al., 2008). Un ruolo simile del suo interattore Yip1p non è stato però ancora dimostrato, ma evidenze del coinvolgimento del suo omologo di mammifero, Yip1A, nel traffico retrogrado derivano da un lavoro recente di Kano e colleghi, che verrà preso in esame nel paragrafo successivo. Nonostante le numerose informazioni riguardanti la famiglia di proteine Yip di lievito raccolte in questi ultimi anni, il loro ruolo nel trasporto vescicolare non è ancora chiaro e ulteriori studi saranno necessari per chiarirne la funzione La famiglia di proteine YIP nei mammiferi La famiglia di proteine YIP nei mammiferi è composta da un numero maggiore di proteine, 16 nell uomo e 14 nel topo, e la maggior parte di esse ha un espressione ubiquitaria, ma la loro funzione è per lo più sconosciuta (fig.1.17). Ad esse, nel lavoro di Shakoori e colleghi (2003), è stato attribuito anche il nome di FinGERs, Five-pass transmembrane proteins localizing in 33
38 INTRODUZIONE the Golgi apparatus and in the ER, in quanto colocalizzano con il marcatore del cis-golgi GM130 e alcune mostrano una distribuzione cellulare simile a quella dell ER. In questo lavoro è stato osservato che l over-espressione di tali proteine comporta la disgregazione dell apparato di Golgi, e questo può avvenire o come diretta conseguenza dell accumulo della proteina nell ER, che quindi comporterebbe un blocco del traffico anterogrado, o come effetto sul mantenimento della struttura del Golgi dovuto all alterazione del processo di riconoscimento e/o fusione delle vescicole con l apparato di Golgi. Fig Membri della famiglia di proteine YIP nei mammiferi. (Adattata da Pfeffer S. and Aivazian D., 2004). Il componente della famiglia Yip1A (FinGER5 o YIPF5. NCBI Ref Seq NM_023311) rappresenta l omologo di mammifero di Yip1p. Yip1A condivide circa il 31% di omologia nucleotidica con Yip1p ed ha un espressione ubiquitaria. Yip1A possiede un isoforma espressa solo nel 34
39 INTRODUZIONE muscolo striato, chiamata Yip1B (FinGER9 o YIPF7. NCBI Ref Seq NM_023784), con la quale condivide circa il 61% di omologia; la regione di divergenza risiede principalmente all estremità N-terminale a livello dei primi 80 amminoacidi (fig. 1.18). Entrambe le isoforme sono caratterizzate, come Yip1p di lievito, da una regione idrofilica all N-terminale e da una regione C- terminale idrofobica, contenete domini multipli potenzialmente in grado di attraversare le membrane cellulari. E stato dimostrato che Yip1A si localizza a livello dei siti di uscita dal reticolo endoplasmatico (ERES) ed è in grado di legare Sec23 e Sec24, che rappresentano due delle sub-unità del complesso molecolare COPII (Tang et al., 2001). Inoltre è stato riportato che l overespressione del dominio idrofobico all N-terminale di Yip1A comporta il blocco del traffico tra l ER e l apparato di Golgi della proteina G del virus della stomatite vescicolare (VSVG) e causa la frammentazione e la dispersione dell apparato di Golgi. Questi risultati fanno presuppore che Yip1A sia coinvolta nella regolazione del traffico vescicolare tra ER e apparato di Golgi, a livello degli ERES, come dimostrato per l omologo di lievito Yip1p. Fig Allineamento delle sequenze amminoacidiche di Yip1A e Yip1B di topo con Yip1p di lievito. (Adattata da Tang B.L. et al., 2001). Tuttavia in un altro studio è stato riportato che il knockdown di Yip1A o del suo interattore Yif1A non altera in alcun modo il traffico vescicolare anterogrado tra ER e Golgi, ma provoca la frammentazione dell apparato di 35
40 INTRODUZIONE Golgi in piccoli stacks circondati da numerose strutture vescicolari (Yoshida et al., 2008). Gli autori hanno invece ipotizzato un ruolo nel traffico retrogrado tra cis-golgi ed ERGIC, e tra quest ultimo e l ER. Questa ipotesi è in contrasto con i risultati ottenuti da Tang e colleghi (2001), ed è in contrasto con quanto visto in lievito; tuttavia in un lavoro molto recente tale ipotesi è stata riconsiderata, in quanto si è visto che il silenziamento di Yip1A comporta il rallentamento del trasporto retrogrado della tossina Shiga, dal Golgi all ER, e contemporaneamente non altera il trasporto anterogrado della VSVG. Inoltre la regione N-terminale di Yip1A inibisce il trasporto retrogrado COPI-indipendente, ma non quello COPIdipendente o quello anterogrado (Kano et al., 2009). 36
41 2 Scopo della tesi Il sistema di membrane interne delle cellule del muscolo scheletrico, che comprende il reticolo endo/sarcoplasmatico, i tubuli T e l apparato di Golgi, presenta una precisa organizzazione spaziale rispetto al sarcomero. All interno del reticolo endo/sarcoplasmatico, il reticolo endoplasmatico di transizione è localizzato a livello del disco Z, in strutture puntiformi lungo la fibra e nella regione perinucleare, il reticolo endoplasmatico canonico è localizzato nell intera banda I e nella giunzione A-I (dove si trovano le triadi), mentre l apparato di Golgi si presenta distribuito in strutture puntiformi lungo la fibra e intorno ai nuclei. I meccanismi molecolari alla base dell organizzazione spaziale e funzionale di questo complesso sistema di membrane interne della fibra muscolare, non sono ancora molto conosciuti. Allo scopo di identificare nuovi geni coinvolti nello sviluppo e nel mantenimento di quest organizzazione di membrane nel muscolo striato, è stato avviato uno studio, che si è servito di un approccio bioinformatico, per l identificazione di nuovi geni preferenzialmente espressi nel muscolo striato e codificanti per proteine contenenti almeno un dominio idrofobico in grado di ancorarle alle membrane interne. L attenzione è stata rivolta ad uno di questi geni identificati: Yip1B. Questo gene codifica per una proteina omologa alla proteina Yip1p di lievito che sembra coinvolta nel early secretory pathway. Nei mammiferi sono presenti due isoforme, chiamate Yip1A e Yip1B, la cui localizzazione e funzione sono poco note. Lo scopo di questa tesi è stato quello di caratterizzare l isoforma muscolospecifica Yip1B, attraverso lo studio della sua espressione e localizzazione in cellule miogeniche e nel tessuto muscolare scheletrico, sia nella fase adulta che durante lo sviluppo, grazie all uso di un anticorpo policlonale specifico prodotto in laboratorio, utilizzato in esperimenti di immunofluorescenza e in Western blot.
42 SCOPO DELLA TESI Questi esperimenti hanno mostrato che l isoforma Yip1B è muscolo-specifica ed è localizzata in parziale sovrapposizione al marcatore del cis-golgi GM130. Sono state inoltre effettuate delle Real-Time PCR per lo studio dell espressione in diversi tessuti e durante lo sviluppo muscolare di entrambe le isoforme di Yip1. Questi esperimenti hanno mostrato che l isoforma Yip1B inizia ad essere espressa intorno al 16 giorno di vita embrionale del topo, ed aumenta la sua espressione fino all età adulta, mentre l isoforma Yip1A ha un andamento opposto. Allo scopo di comprendere il ruolo svolto dalla Yip1B nel tessuto muscolare scheletrico sono stati infine effettuati esperimenti di tipo funzionale. In particolare è stato indagato l effetto dell over-espressione di diverse porzioni della proteina Yip1 e sono stati effettuati esperimenti di RNA-interference allo scopo di studiare l effetto del silenziamento dell isoforma Yip1B. 38
43 3.Materiali e metodi 3.1 Colture cellulari Le cellule sono state coltivate utilizzando materiali e soluzioni sterili e lavorando sotto una cappa a flusso laminare. Le cellule sono state coltivate in piastre petri di diverse dimensioni, in un incubatore alla temperatura di 37 C con CO2 al 5%. Le cellule sono state allargate staccandole dalla piastra utilizzando una soluzione di Tripsina-EDTA (0.05% Tripsina, 0.53 mm EDTA, Invitrogen), e mantenute in coltura in terreni di coltura diversi a seconda della linea cellulare utilizzata. La linea cellulare NIH-3T3 (fibroblasti di topo) è stata coltivata in DMEM (Dulbecco s modified Eagle s medium) con aggiunta di glutammina 2 mm, streptomicina 100μg/ml, penicillina 100U/ml, sodio-piruvato 1mM, 10% siero fetale bovino (FBS). Le cellule sono state fatte crescere fino ad una confluenza di circa l 80%, poi staccate con tripsina-edta con un trattamento a 37 C per circa 5 minuti, risospese in terreno completo, contate in camera di Burker e infine piastrate. Per gli esperimenti d immunofluorescenza le cellule sono state piastrate direttamente su vetrini posizionati nella piastra di coltura. La linea cellulare C2C12 (mioblasti di topo) è stata coltivata nello stesso terreno di coltura utilizzato per la linea NIH-3T3 (DMEM completo con 10% FBS). Per il differenziamento in miotubi, al DMEM è stato aggiunto 2% di siero di cavallo. Per esperimenti d immunofluorescenza, le cellule sono state piastrate su vetrini ricoperti di gelatina animale al 2% disciolta in PBS 1x (Phosfate Buffer Solution 10x: NaCl 137 mm, KCl 2.7 mm, Na2HPO4/KH2PO4 10mM, ph 7.4) Miociti primari I miociti primari di ratto e di topo sono stati prelevati dagli arti posteriori di animali sacrificati a tre giorni di vita poiché garantiscono una resa maggiore di
44 MATERIALI E METODI cellule satelliti. Gli arti posteriori sono stati privati della pelle e lavati in PBS. Il tessuto è stato sminuzzato, trasferito in provette da 50 ml, lavato con PBS e lasciato sedimentare a 37 C. Il sedimento è stato lavato con nuovo PBS, e l operazione ripetuta più volte finchè il tampone non è apparso limpido. Al fine di isolare le singole cellule è stata effettuata un incubazione a 37 C con tripsina allo 0,25% per 5 minuti. Il sovranatante ottenuto dalla prima tripsinizzazione è stato scartato. Successivamente sono state effettuate tre incubazioni in tripsina di 15 minuti ciascuna durante le quali il campione è stato agitato mediante vortex ogni 3 minuti, per favorire la disgregazione meccanica del tessuto. I campioni sono stati poi centrifugati per 10 minuti a 1000 g a temperatura ambiente. Il sovranatante è stato trasferito in provette da 50 ml contenenti 5 ml di terreno DMEM completo con 10% di FBS e poi filtrato attraverso due strati di garza sterile. La sospensione cellulare è stata poi centrifugata per 10 minuti a 1000 g. I pellet cellulari sono stati trasferiti in un unica provetta utilizzando una pipetta pasteur di vetro e risospesi in 40 ml di terreno DMEM completo contenente 10% FBS. La sospensione così ottenuta è costituita da cellule satelliti e da una frazione di fibroblasti contaminanti. Per eliminare la frazione contaminante è stata effettuato un pre-piastramento, ponendo la sospensione cellulare a 37 C per 50 minuti in piastra Petri, per favorire l adesione dei fibroblasti alla piastra. La frazione di cellule rimasta in sospensione è stata raccolta in un unica provetta e centrifugata per 10 minuti a 1000 g. Il pellet ottenuto è stato risospeso in 20 ml di terreno DMEM completo con 10% FBS, contato in camera di Burker e piastrato ad una concentrazione di cellule per piastra da 35 mm, contenente vetrini ricoperti di gelatina al 2%. Le cellule sono state fatte moltiplicare per due giorni e poi fatte differenziare in terreno αmem completo con aggiunta di dexametasone 0,1 μm, idrocortisone 50 μm, 10% FBS e 5% HS. 40
45 MATERIALI E METODI 3.2 Esperimenti di immunofluorescenza Gli anticorpi primari utilizzati negli esperimenti di immunofluorescenza sono: α-yip1b prodotto nel presente lavoro (diluizione 1:1000); α-triadina ottenuto dalla Prof.ssa Isabelle Marty (Grenoble, France) (diluizione 1:10000); α-myc (Clontech, diluizione 1:500 per immunofluorescenza e 1:1000 per Western blot); α-gm130 (BD Biosciences, diluizione 1:200); α-actinina (Sigma, diluizione 1:2000); α- actinina (Sigma, diluizione 1:3000) premarcata mediante il sistema Alexa Fluor Monoclonal Antibody Labeling Kit (Invitrogen). Gli anticorpi secondari marcati con Cy-2/Cy-3 sono della Jackson ImmunoR, mentre quello marcato con Alexa Fluor647 è Invitrogen Esperimenti di immunofluorescenza su cellule Le cellule cresciute sui vetrini sono state lavate due volte con PBS per togliere il terreno di coltura. Le cellule sono state fissate con una soluzione di PBS contenente il 3% di paraformaldeide e il 2% di saccarosio per 7 minuti. Poi sono stati effettuati tre lavaggi veloci in PBS contenente BSA al 0.2% e successivamente le cellule sono state permeabilizzate con Hepes-Triton buffer (Hepes 20 mm ph 7.4, saccarosio 300 mm, NaCl 50 mm, MgCl2 3 mm, Triton- X %) per 3 minuti. Dopo tre lavaggi in PBS + 0.2% BSA, le cellule sono state saturate con siero di capra (goat serum 5% in PBS + 0.2% BSA) per circa un ora a temperatura ambiente, per impedire legami aspecifici dell anticorpo. Poi sono state incubate con l anticorpo primario diluito in PBS + 0.2% BSA per qualche ora o per 16 ore, dipendentemente dall anticorpo utilizzato, in camera umida a 4 C. Sono stati quindi effettuati tre lavaggi da 10 minuti ciascuno in PBS + 0.2% BSA e poi aggiunto l anticorpo secondario (coniugato con un fluorocromo) per 1h a temperatura ambiente, al riparo dalla luce. Sono stati di nuovo effettuati tre lavaggi da 10 minuti ciascuno prima di procedere al montaggio dei vetrini, utilizzando il montante Mowiol (PBS ph 7.4, Mowiol 20%, 41
46 MATERIALI E METODI 1.4-diazabiciclico-[2,2,2]-ottano DABCO come antifading agent). I vetrini sono stati conservati al buio a 4 C Esperimenti di immunofluorescenza su sezioni di tessuto Il tessuto muscolare di interesse è stato prelevato e fissato su un supporto di sughero in una goccia di OCT (Tissue Tek OCT) e allungato tramite spilli, poi immerso in 2-metilbutano raffreddato in azoto liquido (-196 C) e conservato a - 80 C. Il campione è stato poi tagliato in sezioni sottili (circa 7-8 μm) tramite un criostato (CM 1850, Leica) alla temperatura di circa -25 C. Le sezioni sono state poste su vetrini (Superfrost) e conservate a -80 C. La qualità delle sezioni è stata controllata tramite colorazione rapida con ematossilina di Herris (Sigma) al microscopio ottico. Il protocollo utilizzato per le reazioni di immunofluorescenza su sezioni è uguale a quello utilizzato per le cellule, con l unica differenza che lo step di permeabilizzazione è stato omesso e l incubazione con l anticorpo primario è stata effettuata per 16 ore Esperimenti di immunofluorescenza su diaframma Il diaframma è stato prelevato e fissato in paraformaldeide al 3% e Triton 0.5% per un ora a temperatura ambiente. Sono stati conservati in PBS 1X a +4 C. Il protocollo utilizzato per le reazioni di immunofluorescenza sul diaframma è uguale a quello utilizzato per le cellule, con l unica differenza che lo step di permeabilizzazione è stato effettuato contemporaneamente al fissaggio e l incubazione con l anticorpo primario è stata effettuata per 16 ore. 42
47 MATERIALI E METODI Microscopia confocale Per l osservazione dei preparati ottenuti mediante reazioni di immunofluorescenza e per l acquisizione delle immagini è stato utilizzato il microscopio confocale LSM 510 META (Zeiss) dotato di microscopio a epifluorescenza invertito Axiovert 200 M, e di tre laser: argon (verde) 40mW con un laser di eccitazione a 458, 488, 514 nm; HeNe (rosso) a 543 nm; HeNe (rosso lontano, Cy5 etc.) a 633nm. Le immagini sono state acquisite con un obiettivo 40x o 63.3x ad immersione, ad una risoluzione 1024x1024 pixels, con una profondità di immagine di 8 bits, ed elaborate con software Zeiss LSM 510 Image Examiner e Adobe Photoshop CS Preparazione di lisati cellulari e di tessuto Lisati cellulari Le cellule in coltura sono state lavate due volte in PBS, staccate meccanicamente (il tutto lavorando in ghiaccio), raccolte risospendendole in PBS e centrifugate a 9300 g per 10 minuti. Il pellet è stato risospeso in tampone di lisi RIPA (Tris HCl 50 mm, NaCl 150 mm, Sodio deoxicholato 1%, Triton-X100 1%, SDS 0.1%, NaN3 0.02%) a cui è stato aggiunto l inibitore delle serin-proteasi fenilmetilsulfonilfluoruro (PMSF) alla concentrazione finale di 0,1 mm. Le cellule sono state tenute in ghiaccio durante la lisi, per circa 1 ora, agitando di tanto in tanto; sono state poi centrifugate a 4 C per togliere i detriti cellulari, e il sovranatante è stato raccolto e conservato a -80 C Lisati di tessuto I campioni di tessuto muscolare sono stati omogenati con l omogenizzatore ultraturax 10 secondi per tre volte in ghiaccio e poi risospesi in buffer di lisi 43
48 MATERIALI E METODI RIPA+PMSF (come per i lisati cellulari). Il campione è stato poi trasferito in tubo o in Eppendorf e tenuto circa un ora in ghiaccio agitando di volta in volta, per poi essere centrifugato a 4 C per togliere i detriti cellulari. Il sovranatante è stato raccolto e conservato a -80 C. 3.4 Preparazione di microsomi da cellule e da tessuto I campioni cellulari sono stati raccolti come descritto per i lisati cellulari mentre i campioni di tessuto muscolare sono stati tagliati in piccole porzioni mediante bisturi (lavorando su una piastra petri posta in ghiaccio). A questo punto sia le cellule che i tessuti sono stati trasferiti in dounce da 7 ml con pestello di tipo tight contente il tampone di omogenizzazione (HEPES 5 mm ph 7.4, saccarosio 0.32 M e PMSF 0.1 mm) e omogenati con 40 colpi, in ghiaccio. L omogenato è stato trasferito in corex da 15 ml e centrifugato a 7000 g per 10 minuti a 4 C. Il sovranatante è stato trasferito in provette da ultracentrifuga Nalgene e centrifugato a g per un ora a 4 C in ultracentrifuga (Beckam). Il pellet di microsomi è stato risospeso in un piccolo volume di tampone di omogenizzazione, aliquotato e conservato a -80 C. 3.5 Quantizzazione proteica con il metodo Bradford La concentrazione proteica sia dei lisati che dei microsomi è stata valutata con il metodo Bradford (1976), che consiste in un saggio colorimetrico basato sul confronto della densità ottica del campione con quella di una quantità nota di una proteina standard, nel nostro caso la BSA (albumina serica bovina). Sia quattro concentrazioni scalari note (di solito 1, 3, 5, 9 μg) di proteina standard che un volume preciso del campione, sono stati sciolti in acqua e reattivo di Bradford (Coomassie G-250 blu, Biorad) mescolati in un rapporto di 4:1 Il reattivo di Bradford si lega alle proteine in una forma anionica blu che assorbe a 595 nm. Le 44
49 MATERIALI E METODI quattro concentrazioni note di BSA sono state utilizzate per costruire una curva di calibrazione, misurandone l assorbanza a 595 nm, mediante uno spettrofotometro (Ultrospec 2100 pro, UV/Visible Spectophotometer, Amersharm Pharmacia Biotech), sulla quale si basa la quantizzazione della concentrazione proteica del campione. 3.6 Elettroforesi in gel di poliacrilammide (SDS-PAGE) Per permettere la separazione di proteine in base al peso molecolare è stata utilizzata la tecnica SDS-PAGE (sodiumdodecylsulfate-polyacrylamid gel electrophoresis). Il gel è formato da una parte superiore (stacking gel), che compatta le proteine e gli pemette di raggiungere contemporaneamente la seconda parte del gel (running gel) dove le proteine vengono separate, e la cui concentrazione determina la dimensione dei pori e quindi la differente risoluzione del gel stesso. I gels sono stati preparati utilizzando Acrilammide:Bis 37,5:1 al 4% per lo stacking, e al 10 o 12,5% per il running in una soluzione di H2O, SDS 0,1%, APS 0,1%,Temed 0,1% e Tris HCl 0,5 M, ph 6,8 per lo stacking gel o Tris HCl 1,5 M, ph 8,8 per il running gel. I campioni sono stati preparati aggiungendo un opportuna quantità di acqua e di tampone Sample Buffer (0.065 M Tris HCl ph 6.8, SDS 2%, Glicerolo 10%, 2- mercaptoetanolo 5%, Bromophenol-Blue 0.001%) e poi denaturati a 95 C per 2 minuti. Un pozzetto è caricato con un marker di peso noto (All Blue Precision Plus Standards, Biorad). La corsa è stata eseguita in tampone di corsa TGS ( Tris 25 mm, Glicina 192 mm, SDS 0.1% ph 8.3) ad un amperaggio costante di 25 ma/gel. 45
50 MATERIALI E METODI 3.7 Western Blot Le proteine separate mediante elettroforesi sono state trasferite su una membrana PVDF (Polyvinylidene Difluoride) utilizzando un apposito apparato di trasferimento (Biorad) contenente il tampone di trasferimento (Tris 0.25%, glicina 1.92 M, SDS 0.01%, metanolo 10%). Il trasferimento è stato effettuato a 400 ma per un ora a 4 C oppure per 16 ore a 100 ma. Il gel è stato montato in un sandwich all interno della cella di trasferimento in cui sono stati posti in ordine: due spugne, due fogli di carta 3 MM, il gel, la membrana PVDF, due fogli di carta 3 MM e due spugne. Terminato il trasferimento, la membrana è stata saturata per un ora in agitazione a temperatura ambiente in TBS-T (Tris HCl 20 mm ph 7.4, NaCl 150 mm, Tween %) con aggiunta di latte in polvere al 5%. E stato poi aggiunto l anticorpo primario per un ora in agitazione a temperatura ambiente (se per 16 ore a 4 C). Gli anticorpi utilizzati sono: anti-yip1b, prodotto nel presente lavoro, anti-myc (Clontech) e anti PDI (Santa Cruz Biotechnology). Successivamente sono stati effettuati 3 lavaggi da 10 minuti ciascuno in TBS-T ed è stato aggiunto l anticorpo secondario coniugato con la perossidasi di rafano (HRP) (Amersham Pharmacia) per un ora in agitazione a temperatura ambiente. Al termine dell incubazione sono stati effettuati altre tre lavaggi in TBS-T. La rivelazione delle bande è stata ottenuta mediante ECL Western Blotting Detection (Amersham Bioscience) ed esposizione su lastre fotografiche HYPERFILM TM (Amersham Bioscience), sottoposte a sviluppo e fissaggio con liquidi fotografici (KODAK) in camera oscura. 3.8 Clonaggi I cloni utilizzati in questo studio sono riportati sinteticamente in tabella 3.2. Per il clone Yip1B-Myc la sequenza completa del cdna (Mus Musculus) 46
51 MATERIALI E METODI codificante la proteina Yip1B è stata inserita nel vettore di espressione pcdna.3.1/myc-his in frame con l epitopo Myc. La porzione N-terminale priva di domini transmembrana da base 1 a base 366 del cdna (Mus Musculus) di Yip1B è stata clonata nel vettore d espressione pgex4t-1 (Amersham Biosciences) per la produzione della proteina di fusione Yip1B-GST. I plasmidi ricombinanti Yip1B-N-ter, Yip1B-1-80, Yip1A intera, Yip1A N-ter, Yip1A 1-80, sono stati creati per inserimento degli inserti corrispondenti nel vettore pcdna.3.1/myc-his(-)c con l epitopo Myc non in frame con la proteina e quindi non espresso. Gli inserti sono stati ottenuti per PCR, con primers contenenti i siti di restrizione adatti, partendo dal cdna (Mus Musculus) delle proteine Yip1B e Yip1A. In tabella 3.1 è riportata la lunghezza degli inserti clonati. Plasmide cdna Inserto Yip1B-N-ter Yip1B..da base 1 a 366 Yip1B-1-80 Yip1B..da base 1 a 240 Yip1A intera Yip1A..da base 1 a 774 Yip1A N-ter Yip1A..da base 1 a 378 Yip1A 1-80 Yip1A..da base 1 a 246 Tab. 3.1 Lunghezza degli inserti ottenuti per PCR I plasmidi ricombinanti Yip1B-notag e Yip1B-GFP sono stati ottenuti per digestione enzimatica XhoI/BamHI prelevando l inserto dal clone Yip1B-Myc. Per la costruzione del plasmide Yip1B-notag il vettore utilizzato è il pcdna.3.1/myc-his(-)c con l epitopo Myc non in frame con la proteina e quindi non espresso. Per la costruzione del plasmide Yip1B-GFP è stato utilizzato un vettore di espressione eucariotica, pegfp-n3 (Clontech) per l espressione della proteina Yip1B con GFP all estremità C-terminale. Tutti i costrutti utilizzati sono stati confermati per sequenza. 47
52 MATERIALI E METODI Plasmide Primers Seq. primers Sito di restrizione Yip1B-GST 7a GST FW 7a GST REV cgggatcc atg tca aac cca gaa cag tat ccgctcgag cgt ttc att cat gat gct gcc BamHI /XhoI Yip1B-MYC P7PFW P7PR ccgctcgagcg atg tca aac cca gaa cag tat cgggatcc ttc gaa aac ggt cag aag ggc XhoI/BamHI Yip1B-GFP Ottenuto per digestione XhoI/BamHI Yip1B-notag Ottenuto per digestione XhoI/BamHI Yip1B-N-ter 7a GST FW myip1b 366Rev-Kpn cgggatcc atg tca aac cca gaa cag tat ggggatcc cgt ttc att cat gat gct gcc BamHI/KpnI Yip1B a GST FW myip1b 240Rev-Kpn cgggatcc atg tca aac cca gaa cag tat ggggtacc aac tga ggg aga ctg tga gta BamHI/KpnI Yip1A intera myip1a 1FwBamHI myip1a 772Rev KpnI cgggatcc atg tca ggc ttt gat aac tta ggggtacc gaa gac aga aat cag ggc aaa BamHI/KpnI Yip1A N-ter myip1a 1FwBamHI myip1a 378Rev KpnI cgggatcc atg tca ggc ttt gat aac tta ggggtacc gtc cgt ctc att cat gat gct BamHI/KpnI Yip1A 1-80 myip1a 1FwBamHI myip1a 246Rev KpnI cgggatcc atg tca ggc ttt gat aac tta ggggtacc ata gaa tgg ctg agg tgt tgt BamHI/KpnI Tab. 3.2 Elenco dei costrutti utilizzati 3.9 Trasfezioni Trasfezione transiente in cellule Le cellule sono trasfettate al raggiungimento di una confluenza di circa il 60 %, usando il Lipofectamine Plus Reagent (Invitrogen), seguendo le istruzioni riportate dalla ditta produttrice. Le cellule sono state incubate 3 ore a 37 C al 5% CO2 in presenza dei reagenti di trasfezione e poi il terreno è stato sostituito con DMEM completo con 10% FBS. Nel caso di C2C12 che devono essere 48
53 MATERIALI E METODI differenziate, il terreno di differenziamento è stato aggiunto il giorno successivo alla trasfezione Trasfezione transiente in vivo Le trasfezioni transienti in vivo sono state effettuate su muscolo tibiale di topo adulto (CD1 di circa tre mesi). Gli animali prima trattati con anestetico Avertin 1,25% (Aldrich 24), sono stati trasfettati con i costrutti di interesse isolando il tibiale e sottoponendolo ad elettroporazione con l utilizzo dell Electro Square Porator ECM 830, BTX. Condizioni per l elettroporazione: voltage 25 V, p.length 20 ms, impulse 5, interval 200 ms. I DNA dei cloni usati per trasfettare sono stati preparati con Kit Nucleobond Xtra Midi; Macherey-Nagel; e per ogni costrutto sono stati iniettati nel tessuto dai 15 ai 20 µg di DNA diluito in acqua in un volume massimo di 15 µl. I tessuti sono stati prelevati dopo 15 giorni dalla trasfezione mrna interference Per inibire l espressione genica della proteina di interesse è stato utilizzato il kit BLOCK-iT TM Pol II mir RNAi Expression Vector (Invitrogen), che fa uso di microrna (mirna), corte molecole di RNA della lunghezza di circa 22 nucleotidi. Il vettore di espressione contiene il promotore precoce del virus umano citomegalovirus (CMV), che permette un espressione elevata del mirna. Nel vettore è compresa la sequenza codificante per la proteina EmGFP (Emerald Green Fluorescent Protein, proteina bioluminescente della medusa Aequorea victoria), incorporata in modo che il sito di inserzione del pre-mirna si trovi nella regione al 3 non tradotta (3 UTR) dell mrna della EmGFP. L espressione della EmGFP permette di individuare le cellule esprimenti il mirna ed è quindi correlata al silenziamento del gene target. 49
54 MATERIALI E METODI Negli esperimenti di inibizione dell espressione della proteina Yip1B sono stati utilizzati tre mirna, le cui sequenze sono state ottenute con il programma BLOCK-iT TM RNAi Designer (Invitrogen), specifici per cdna di topo (Mus Musculus). I tre mirna riconoscono tre sequenze a partire rispettivamente dal nucleotide 93, 135, 553 (tab. 3.3). Il kit BLOCK-iT TM Pol II mir RNAi comprende anche un controllo negativo costituito da un plasmide esprimente un mirna che non riconosce la sequenza di alcun gene conosciuto di vertebrato. mirna Sequenza riconosciuta 93 ATGACATGGGCTTCTACCAAT 135 AGGAGCCGAGTTGCAATGATT 553 TCACGCCTTACTGAACTTGAT Tab. 3.3 Sequenze riconosciute dai tre mirna utilizzati negli esperimenti di RNA interference Estrazione RNA totale Tutte le operazioni per l estrazione dell RNA sono effettuate in ghiaccio o a 4 C. L estrazione dell RNA totale da tessuto di topo è effettuata tramite TRIzol (Invitrogen) seguendo il protocollo standard indicato dalla casa produttrice. Brevemente, mg di tessuto sono stati omogenizzati in presenza di 1ml di TRIzol. I campioni omogenizzati sono stati incubati per 5 minuti a temperatura ambiente e successivamente sono stati aggiunti 0,2 ml di cloroformio per ml di TRIzol usato. I campioni sono stati agitati e centrifugati a g per 15 minuti. L RNA rimasto nella fase acquosa è stato trasferito in un nuovo tubo e fatto precipitare con l aggiunta di isopropanolo, 0,5 ml per ml di TRIzol. Per l estrazione di RNA da cellule invece, è stato usato il Kit Nuclespin RNA II (Macherey-Nagel). L RNA dopo l estrazione è stato risospeso in acqua RNAsifree e conservato a -80 C. 50
55 MATERIALI E METODI La misura della concentrazione dell RNA è stata effettuata tramite lettura spettrofotometrica (Ultrospec 2100 pro, UV/Visible Spectophotometer, Amersharm Pharmacia Biotech), misurando l assorbanza a 260 nm, dove 1 OD260 = [40 μg/ml]. L integrità dell RNA è stata determinata tramite corsa elettroforetica su gel di agarosio all 1% Preparazione del cdna (RT-PCR) La sintesi di cdna tramite RT-PCR è stata effettuata con reagenti Promega; l enzima usato è l M-MLV RT (Moloney Murine Leukemia Virus reverse transcriptase) in presenza di esanucleotidi random, secondo le istruzioni della casa produttrice. La qualità del cdna ottenuto è stata saggiata tramite PCR utilizzando una coppia di primers (di senso: 5 TGCGTGACATCAAAGAGAAG; antisenso: 5 CGGATGTCAACGTCACACTT ) che amplificano per il gene ubiquitario della β-actina. Per la RT-PCR semi-quantitativa di Yip1B sono stati utilizzati i seguenti primers: di senso 5 AGAGATGTTCCTGCCATCAGA e antisenso 5 AAAGGATGGGTCCTGTGAGAT 3.13 Real Time PCR Per studiare l espressione genica sono stati effettuati degli esperimenti di Real- Time PCR, una tecnica di amplificazione del cdna di tipo quantitativo, che permette di seguire l andamento dell amplificazione in tempo reale grazie all'uso di coloranti fluorescenti, come il SYBR Green, che s intercalano con il DNA a doppio filamento. Per effettuare la Real-Time PCR è stata ustata la Real-Time Step One Plus (Applied Biosystems). I reagenti impiegati per la mix di reazione sono tutti 51
56 MATERIALI E METODI contenuti nella Power SYBR Green PCR Master Mix (Applied Biosystems) ad esclusione, ovviamente, dei primers e del templato: Volume (μl) Concentrazione finale Power SYBR Green PCR Master Mix (2X) 10 1X Primer Forward [1 μm] 1 50 nm Primer Reverse [1 μm] 1 50 nm Templato (1:5) 5 - Acqua 3 - Totale 20 - Come gene housekeeping è stato scelto quello della β-actina. In tabella 3.4 sono elencate le coppie di primers utilizzate. Primer Sequenza 5 3 Primer Sequenza 5 3 β-actina F β-actina R Yip1A F Yip1A R GATCTGGCACCACACCTTCT GGGGTGTTGAAGGTCTCAAA CTTAAACAGCGGTTTCTACCAGAC CTTGCTGTAGGGTCCTCCACT Yip1B F Yip1B R Yif1A F Yif1A R AGAGATGTTCCTGCCATCAGA AAAGGATGGGTCCTGTGAGAT TGCAATACAGCCATGATGTGCC CACCTCTGGGGAGAACCTTTG Yif1B F ATGCACGCGACAGGTTTGGC Yif1B R GGGCAGAACTCGTGTCATCAA Tab. 3.4 Primers utilizzati per la RealTime-PCR. I dati ottenuti sono stati elaborati mediante software Gene Expression Macro (Bio-Rad), che per la quantizzazione relativa impiega la formula del ΔΔCt 52
57 MATERIALI E METODI modificata da Pfaffl (Pfaffl M.W., 2001), che tiene conto dell efficienza di ciascuna coppia di primers. Per calcolare l espressione di Yip1A e Yip1B all interno dello stesso tessuto è stata utilizzata la seguente formula: E -(ΔCt) che richiede un efficienza dei primers simile, come nel nostro caso, e che non tiene conto del gene housekeeping, essendo la PCR di entrambi i geni effettuata sulla stessa preparazione di cdna. Per trasformare i valori ottenuti sottoforma di folds in valori percentuali, è stata utilizzata la seguente formula: Yip1A(%)=100/1+X dove X rappresenta l espressione di Yip1B rispetto a Yip1A in fold (E -(ΔCt) ). I valori ottenuti sono stati messi su grafico mediante software Excel Produzione e purificazione di anticorpi policlonali Per produrre la proteina ricombinante Yip1B-GST da utilizzare per l immunizzazione dei conigli, è stato utilizzato il plasmide Yip1B-GST, che codifica per i primi 122 aminoacidi della Yip1B murina in frame con la Glutatione-S-Transferasi (GST). La produzione e la purificazione della proteina sono state effettuate secondo tecniche standard indicate dalla casa produttrice. Gli anticorpi policlonali sono stati prodotti tramite immunizzazione di due conigli (Oryctolagus cuniculus) New Zealand White, mantenuti secondo le condizioni stabilite dai protocolli ministeriali. Ai conigli, dopo un periodo di adeguamento alle condizioni di stabulazione locali, vengono prelevati alcuni ml di sangue per ottenere il siero pre-immune, dopodichè sono immunizzati con iniezioni ripetute contenenti 250 μg di proteina Yip1B-GST diluita in PBS al volume finale di 500 μl. Per la prima iniezione, 500 μl di soluzione proteica vengono addizionati a 500 μl di adiuvante di Freund completo (SIGMA), l emulsione così ottenuta è iniettata sottocute mediante iniezioni multiple. Per la seconda immunizzazione è stato utilizzato l adiuvante incompleto di Freund (SIGMA) e l emulsione è iniettata a livello sottoscapolare tramite iniezioni ripetute. Dopo la seconda immunizzazione, è stato effettuato un prelievo di sangue dalla vena centrale dell orecchio 53
58 MATERIALI E METODI dell animale, sedato con Zoletil. Dopo le prime due immunizzazioni ed il primo prelievo è stata effettuata un iniezione endovena della soluzione proteica priva di adiuvante nella vena periferica dell orecchio del coniglio; in seguito il prelievo e l immunizzazione (tramite iniezione intramuscolare) sono stati effettuati a settimane alterne. I sieri sono stati preparati raccogliendo il sangue coagulato a 4 C over-night, poi centrifugato a 1100 g a 4 C per 30 minuti. I campioni di siero sono stati aliquotati e conservati alla temperatura di -20 C. La purificazione dell anticorpo policlonale è stata effettuata per affinità utilizzando una colonna di proteina A come matrice. Tutti i passaggi della purificazione sono stati fatti a 4 C o in ghiaccio per impedire la degradazione dell anticorpo. Le IgG totali sono state eluite dalla colonna con 100mM Glicina (ph3). Le IgG sono state alla fine dializzate con Centricon Plus-20 (AMICON Bioseparations) e la concentrazione di immunoglobuline è stata calcolata mediante una lettura allo spettrofotometro misurando l assorbanza a 280nm. La qualità del purificato è stata infine verificata caricando circa 10 µg di IgG su gel di acrilammide. Trattamento degli animali I campioni di tessuto utilizzati negli esperimenti sono stati prelevati dal personale autorizzato dello stabulario del Polo Scientifico di San Miniato dell Università degli Studi di Siena, dove gli animali vengono trattati nel rispetto delle normative vigenti riguardanti la protezione e l utilizzo degli animali vertebrati a fini sperimentali e scientifici: Decreto Legislativo del 27 gennaio 1992 n.116, la decisione del Consiglio 1999/575/CE del 23 marzo 1998 e Decisione 2003/584/CE del Consiglio del 22 luglio
59 4 Risultati 4.1 Identificazione di nuovi geni espressi nel muscolo striato Negli anni passati nel nostro laboratorio la Dott.ssa Jelena Kunic ha avviato uno studio mirato all identificazione di nuovi geni preferenzialmente espressi nel muscolo striato. Con l uso di differenti database di espressione genica, come SymAtlas, basati sui profili di espressione ottenuti mediante microarray, sono stati identificati 235 geni di Mus Musculus caratterizzati da elevati livelli di espressione nel muscolo striato rispetto agli altri tessuti (almeno 10 volte maggiori). Le proteine codificate da questi 235 geni sono state sottoposte all analisi mediante software di predizione di domini transmembrana, come SOSUI, per selezionare i geni codificanti per proteine contenenti almeno un dominio idrofobico, potenzialmente in grado di ancorarle alle membrane interne del muscolo scheletrico. Da questo screening sono state alla fine selezionate 4 proteine le cui funzioni sono in parte o completamente sconosciute. I loro profili d espressione sono a questo punto studiati anche mediante esperimenti di RT-PCR allo scopo di confermare la loro espressione preferenziale nel muscolo striato. Gli studi successivi si sono concentrati su una di queste quattro proteine, chiamata Yip1B (NCBI Ref Seq NM_023784). In figura 4.1 sono illustrati i livelli d espressione ottenuti mediante l analisi dei microarray, dove si può osservare un alto livello d espressione nel muscolo cardiaco (barra in verde chiaro) e nel muscolo scheletrico (barra in verde scuro). In figura 4.2 è rappresentata la struttura secondaria, elaborata dal software di predizione dei domini transmembrana SOSUI, di Yip1B: tale proteina sembra sia costituita da una porzione citosolica all N-terminale e da 4-5 domini idrofobici transmembrana all estremità C-terminale.
60 RISULTATI Fig. 4.1 Profili d espressione di Yip1B in diversi tessuti. In verde chiaro espressione nel cuore, in verde scuro nel muscolo scheletrico. Da Gene Atlas ( Fig. 4.2 Rappresentazione schematica degli ipotetici domini transmembrana di Yip1B. Da SOSUI ( Esperimenti di RT-PCR (fig. 4.3), hanno confermato l espressione esclusivamente muscolare della Yip1B che risulta espressa nel muscolo tibiale, nel soleo, nel diaframma e nel cuore, ma non in tutti gli altri tessuti analizzati. 56
61 RISULTATI Fig. 4.3 RT-PCR di Yip1B. E stato utilizzato come normalizzatore il gene housekeeping β-actina. 4.2 Espressione dei membri della famiglia Yip1 in diversi tessuti Allo scopo di verificare e quantificare l espressione di Yip1B e della sua isoforma ubiquitaria Yip1A, sono stati effettuati esperimenti di Real-Time PCR su diversi tessuti, compresi quattro tipi di tessuto muscolare scheletrico. Come illustrato nel grafico derivante dall analisi dell espressione di Yip1A, tale isoforma è espressa in tutti i tessuti analizzati anche se a livelli differenti, ma la sua espressione è assente nei diversi tipi di muscolo scheletrico presi in esame, ossia il muscolo tibiale, il soleo, l EDL e il diaframma; è invece espressa nel muscolo cardiaco (fig. 4.4). 57
62 RISULTATI Fig. 4.4 Espressione di Yip1A in diversi tessuti. L espressione relativa è calcolata rispetto a quella del muscolo tibiale (*). Al contrario, Yip1B è espressa nel muscolo striato, quindi scheletrico e cardiaco, a conferma di quanto emerso negli esperimenti di RT-PCR (vedi fig. 4.3), mentre la sua espressione è assente in tutti gli altri tessuti analizzati (fig. 4.5). Yip1B sembra quindi rappresentare l isoforma muscolo-specifica. Fig. 4.5 Espressione di Yip1B in diversi tessuti. L espressione relativa è calcolata rispetto a quella della milza (*). 58
63 RISULTATI Poichè è noto che Yip1A e Yip1B formano complessi molecolari con altri membri della stessa famiglia, ed in particolare con Yif1A e Yif1B, è stata analizzata anche l espressione di Yif1A e Yif1B. Entrambe le isoforme sono risultate presenti, sebbene con diversi livelli d espressione, in tutti i tessuti analizzati, compresi i diversi tipi di muscolo (fig. 4.6 e 4.7). Non sembra quindi emergere un isoforma muscolo specifica tra questi due interattori. Fig. 4.6 Espressione di Yif1A in diversi tessuti. L espressione relativa è calcolata rispetto a quella della milza (*). Fig. 4.7 Espressione di Yif1B in diversi tessuti. L espressione relativa è calcolata rispetto a quella della milza (*). 59
64 RISULTATI Espressione delle due isoforme di Yip1 in cellule C2C12 Confermata l espressione muscolo-specifica della Yip1B, sono stati effettuati esperimenti di Real-Time PCR anche sulla linea cellulare miogenica C2C12, per analizzare l espressione delle due isoforme di Yip1 durante il differenziamento di queste cellule. Dall analisi dei dati ottenuti è emerso che l espressione di Yip1B nelle C2C12 differenziate aumenta di circa 1700 volte rispetto alle cellule non differenziate, dove sembra essere assente (fig. 4.8). Fig. 4.8 Espressione di Yip1B in C2C12 non differenziate e differenziate. L espressione relativa è calcolata in base a quella delle C2C12 non differenziate (*). La Yip1A è invece presente anche nelle C2C12 non differenziate (dato rilevabile dal valore di ct, ma non dal grafico in fig. 4.9), ma la sua espressione aumenta di sole 10 volte con il differenziamento. Questo dato sembra essere in contrasto con quanto emerso nel grafico di fig. 4.4, poichè la Yip1A non è stata riscontrata nel muscolo scheletrico. La presenza della Yip1A nella linea cellulare C2C12 può essere spiegata dal fatto che solo circa il 40% delle cellule differenziano in miotubi, mentre le restanti rimangono mononucleate e continuano a proliferare, contribuendo probabilmente all aumento d espressione di Yip1A rilevato in questi esperimenti. Inoltre, trattandosi di un sistema in vitro, non si raggiunge un differenziamento completo paragonabile a quello delle fibre muscolari adulte. 60
65 RISULTATI Fig. 4.9 Espressione di Yip1A in C2C12 non differenziate e differenziate. L espressione relativa è calcolata rispetto a quella delle C2C12 non differenziate (*). Analizzando i livelli d espressione di un isoforma rispetto all altra, nelle cellule non differenziate e differenziate, emerge che nelle prime si ha esclusivamente la presenza dell isoforma Yip1A, mentre con il differenziamento la sua espressione diminuisce e comincia a comparire quella dell isoforma muscolare Yip1B (fig. 4.10). Fig Espressione di entrambe le isoforme Yip1 nelle C2C12 non differenziate e differenziate. 61
66 RISULTATI 4.3 Validazione dell anticorpo anti-yip1b mediante Western blot Per studiare la localizzazione sub-cellulare e per meglio comprendere la funzione di Yip1B è stato prodotto un anticorpo policlonale contro la porzione idrofilica di Yip1B di topo. In particolare, il cdna codificante per la porzione N- terminale della proteina è stata clonata nel vettore pgex-4t1. Tale costrutto è stato poi utilizzato per la produzione della proteina ricombinante in frame con la GST, necessaria per la produzione dell anticorpo specifico in grado di riconoscere la Yip1B. Per saggiare la specificità dell anticorpo ottenuto sono state inizialmente trasfettate cellule NIH3T3 con il cdna codificante la Yip1B in frame con l epitopo myc, e successivamente effettuati esperimenti di Western blot con l anticorpo prodotto e con l anticorpo monoclonale α-myc di controllo. Parte degli esperimenti di Western blot sono stati effetuati dalla Dott.ssa Antonietta Corrado durante lo svolgimento della sua tesi di laurea. E stato così verificato che l anticorpo è in grado di riconoscere in modo specifico la Yip1B ricombinante, caratterizzata da una banda di circa 37 KDa (fig. 4.11A); infatti la stessa banda è stata individuata anche dall anticorpo α-myc (fig.4.11b). A B Fig Analisi della specificità dell anticorpo mediante Western blot. In ogni pozzetto sono stati caricati 60 g di proteine totali. 62
67 RISULTATI 4.4 Analisi dell espressione di Yip1B nei tessuti e in C2C12 Una volta verificata la specificità dell anticorpo prodotto, è stata verificata anche la sua capacità di riconoscere la proteina endogena, e contemporaneamente è stata analizzata, sempre mediante esperimenti di Western blot, la sua espressione in diversi tessuti. L antisiero prodotto é in grado di riconoscere la proteina endogena in quanto si evidenzia una banda intorno ai 30 KDa, come atteso, ed inoltre la banda specifica è presente nei muscoli striati e non in altri tessuti (fig. 4.12A), ad ulteriore conferma che si tratta di una proteina muscolo-specifica. Inoltre è stato visto che la Yip1B è presente in tutte e tre le tipologie di muscolo scheletrico: nel soleo, che è composto in prevalenza da fibre muscolari di tipo lento; nell EDL, che è un muscolo a composizione prevalentemente veloce, e nel diaframma che è formato da fibre di entrambi i tipi ed è quindi considerato un muscolo misto (fig. 4.12B). L espressione di Yip1B è stata studiata anche nella linea cellulare miogenica C2C12: la proteina è presente solo in cellule differenziate, e quindi solo nei miotubi (fig. 4.12C), confermando i dati ottenuti dagli esperimenti di Real-Time PCR. A B C Fig Analisi dell espressione di Yip1B all interno di diversi tessuti e in cellule C2C12. In ogni pozzetto sono stati caricati 60 g di proteine totali. 63
68 RISULTATI Poiché l analisi informatica ha evidenziato che Yip1B presenta almeno quattro domini di membrana, esperimenti di Western blot sono stati effettuati anche sulla frazione microsomiale purificata da muscoli prelevati dagli arti inferiori di topo. I risultati ottenuti mostrano che Yip1B è presente in maggiori quantità nella frazione microsomiale dei muscoli scheletrici, confermando la sua associazione alle membrane (fig. 4.13A). A B Fig Analisi dell espressione di Yip1B nella frazione microsomiale di muscolo scheletrico. La banda intorno ai 100 KDa (B) rappresenta la triadina utilizzata per verificare la qualità della preparazione microsomiale. In ogni pozzetto sono stati caricati 60 g di proteine totali e 30 g della frazione microsomiale. 4.5 Localizzazione sub-cellulare di Yip1B Allo scopo di studiare la localizzazione sub-cellulare di Yip1B nelle cellule muscolari, sono stati effettuati esperimenti di immunofluorescenza su C2C12 differenziate, su miociti primari differenziati di ratto e su sezioni di muscolo scheletrico tibiale di topo Localizzazione di Yip1B in cellule C2C12 Al fine di analizzare la localizzazione di Yip1B sono stati effettuati degli esperimenti preliminari su cellule C2C12 trasfettate con diversi costrutti della proteina in esame, prima di passare ad esaminare la distribuzione della proteina 64
69 RISULTATI endogena. Dopo aver piastrato, trasfettato e differenziato per circa 7 giorni cellule C2C12, sono stati condotti esperimenti di immunofluorescenza con l utilizzo dell anticorpo appropriato e le cellule sono state analizzate al microscopio confocale. Cellule trasfettate con la proteina di fusione Yip1B-myc e colorate con l anticorpo α-myc mostrano una distribuzione perinucleare e in strutture puntiformi distribuite lungo il miotubo (fig. 4.14). Fig Immunofluorescenza su cellule C2C12 trasfettate con Yip1B-myc e differenziate. Il segnale specifico è stato evidenziato con l uso dell anticorpo primario α- myc (1:500) e dell anticorpo secondario rosso (barra: 5 μm). Una distribuzione simile è stata evidenziata anche trasfettando la proteina in frame con l epitopo GFP. Per escludere un eventuale localizzazione errata dovuta alla presenza dell epitopo, le cellule sono state trasfettate con la Yip1B priva di tag e colorate con l anti-siero α-yip1b. Come si osserva dalla figura 4.15 il segnale rimane perinucleare e in strutture puntiformi, indicando che gli epitopi non sembrano alterare la localizzazione della proteina ricombinante. 65
70 RISULTATI Fig Immunofluorescenza su cellule C2C12 trasfettate con Yip1B senza tag e differenziate. Il segnale specifico è stato evidenziato con l uso dell anticorpo α-yip1b e dell anticorpo secondario rosso (barra: 5 μm). Una volta dimostrata la specificità dell anticorpo prodotto, si è passati all esame della localizzazione della proteina endogena. Le cellule C2C12 sono state piastrate, fatte differenziare per circa 8 giorni e poi colorate con l uso dell anticorpo specifico. I risultati mostrano che la proteina endogena si distribuisce in modo simile a quella ricombinante, localizzandosi nella regione perinucleare e lungo i miotubi (fig. 4.16). Fig Immunofluorescenza su cellule C2C12 differenziate. Il segnale specifico è stato evidenziato con l uso dell anticorpo α-yip1b e dell anticorpo secondario rosso (barra: 5 μm). 66
71 RISULTATI Localizzazione di Yip1B in miociti primari Per verificare la localizzazione della proteina in cellule primarie, la stessa analisi è stata effettuata su miociti primari di ratto. I miociti sono stati piastrati su vetrini gelatinati, trasfettati con tre costrutti differenti, fatti differenziare per circa sei giorni, colorati con l anticorpo specifico e analizzati al microscopio confocale. Anche nei miotubi derivati dai miociti primari, come nelle C2C12, il segnale dato dalla Yip1B-myc e Yip1B-GFP (fig. 4.17) trasfettate è localizzato intorno al nucleo e in strutture puntiformi distribuite lungo il miotubo. A B Fig Immunofluorescenza su miociti primari di ratto trasfettati con Yip1Bmyc (A) e Yip1B-GFP (B) e differenziati. Per i miociti trasfettati con Yip1B-myc il segnale specifico è stato evidenziato con l uso dell anticorpo primario α-myc (1:500) e dell anticorpo secondario verde (barra: 5 μm). 67
72 Inoltre, come per le C2C12, i miociti sono stati trasfettati anche con la Yip1B priva di epitopi per escludere una localizzazione errata delle proteine con i diversi tag. Anche nei miociti la proteina priva di tag si dispone in modo simile a quella ricombinante (fig. 4.18). Fig Immunofluorescenza su miociti primari di ratto trasfettati. con Yip1B senza tag e.differenziati. Il segnale specifico è stato evidenziato con l uso dell anticorpo α-yip1b e dell anticorpo secondario rosso (barra: 5 μm). Per analizzare la distribuzione della proteina endogena nei miotubi derivanti da miociti primari, è stata effettuata una doppia colorazione con l antisiero α-yip1b e con l anticorpo diretto contro l α-actinina, una proteina dell apparato contrattile che è localizzata in corrispondenza del disco Z del sarcomero solo nei miociti differenziati. Come si può osservare dalla figura 4.19, la Yip1B si dispone intorno ai nuclei e in strutture puntiformi lungo la fibra, come avviene per la proteina ricombinante e come visto nella linea cellulare miogenica C2C12.
73 RISULTATI Yip1B α-actinina merge Fig Immunofluorescenza su miociti differenziati. Il segnale specifico è stato evidenziato con l uso dell anticorpo α-yip1b in rosso, e con l anticorpo contro l αactinina in verde (barra: 5 μm) Localizzazione di Yip1B in fibre muscolari adulte Si è passati poi ad analizzare la localizzazione di Yip1B nei muscoli adulti. A tale scopo sono stati prelevati muscoli tibiali di topo adulto, dai quali sono state preparate delle sezioni, colorate poi con l anti-siero α-yip1b purificato. Come si osserva dalla figura 4.20, la Yip1B si distribuisce in file di due o tre strutture puntiformi lungo la fibra e ai poli del nucleo, evidenziato con l uso del colorante nucleare DAPI. 69
74 RISULTATI Fig Immunofluorescenza su fibre di muscolo tibiale adulto. Il segnale specifico è stato evidenziato con l uso dell anticorpo α-yip1b in rosso, i nuclei con il DAPI in blu (non in confocale), (barra: 5 μm). Poiché tale localizzazione sembra essere molto simile a quella dell apparato di Golgi nelle fibre muscolari di tipo veloce, come appunto il muscolo tibiale, è stata effettuata una doppia colorazione con l anticorpo contro la Yip1B e con il marcatore del cis-golgi, il GM130. Quello che si osserva è una co-localizzazione della Yip1B con il cis-golgi, sia in sezione longitudinale (fig. 4.21A) che in sezione trasversale (fig. 4.21B), anche se ad un ingrandimento maggiore si può osservare che si tratta di una colocalizzazione solo parziale con il cis-golgi (fig. 4.21C). 70
75 RISULTATI A C Yip1B GM130 merge B Yip1B GM130 merge Yip1B GM130 merge Fig Immunofluorescenza su fibre di muscolo tibiale adulto. La sezione trasversale (A) e longitudinale (B) è stata colorata con l anticorpo α-yip1b in rosso e con il marcatore del cis-golgi GM130 in verde. Il riquadro C indica l ingrandimento della zona indicata dal riquadro in verde (barra: 5 μm). 4.6 Espressione di Yip1B durante il differenziamento cellulare delle C2C12 Essendo la Yip1B espressa, come visto dai dati di Real-Time PCR e da esperimenti di Western blot, nelle cellule C2C12 differenziate, ma non in quelle mononucleate, l espressione della proteina è stata analizzata durante il differenziamento di questa linea cellulare. Cellule C2C12 sono state fatte differenziare per un massimo di 10 giorni e raccolte anche a tempi intermedi, ossia al terzo, quinto e settimo giorno. Le cellule sono state quindi lisate e caricate su gel per poi effettuare un Western blot con l anti-siero α-yip1b. 71
76 RISULTATI I risultati mostrano che l espressione della proteina inizia intorno al 3 giorno di differenziamento ed aumenta con il progredire del differenziamento dei mioblasti in miotubi (fig.4.22). Fig Analisi dell espressione di Yip1B durante il differenziamento delle cellule C2C12. In ogni pozzetto sono stati caricati 60 μg di proteine totali, la normalizzazione della quantità di proteine caricate è stata effettuata con l anticorpo α- PDI. 4.7 Espressione di Yip1B e Yip1A durante lo sviluppo muscolare embrionale Essendo Yip1B una proteina muscolo-specifica che mostra un aumento d espressione con il progredire del differenziamento delle C2C12, abbiamo analizzato come varia la sua espressione durante lo sviluppo del muscolo scheletrico adulto Analisi mediante Real-time PCR L aumento dell espressione di Yip1B durante lo sviluppo è stato verificato con esperimenti di PCR quantitativa, effettuata su un mix di tessuti muscolari 72
MACROSTRUTTURA DEL MUSCOLO STRIATO SCHELETRICO
 FUNZIONE DEL MUSCOLO SCHELETRICO Ultrastruttura della cellula muscolare. Miofilamenti. Meccanismo della contrazione. Trasmissione neuromuscolare. Scossa semplice e tetano muscolare. Unità motoria. PROPRIETA
FUNZIONE DEL MUSCOLO SCHELETRICO Ultrastruttura della cellula muscolare. Miofilamenti. Meccanismo della contrazione. Trasmissione neuromuscolare. Scossa semplice e tetano muscolare. Unità motoria. PROPRIETA
Muscolo Scheletrico 1. Anatomia funzionale, eccitazione, contrazione
 Muscolo Scheletrico 1. Anatomia funzionale, eccitazione, contrazione Prof. Carlo Capelli Fisiologia Laurea in Scienze delle attività motorie e sportive Università di Verona Obiettivi Anatomia funzionale
Muscolo Scheletrico 1. Anatomia funzionale, eccitazione, contrazione Prof. Carlo Capelli Fisiologia Laurea in Scienze delle attività motorie e sportive Università di Verona Obiettivi Anatomia funzionale
LA REAZIONE ALL'AMBIENTE: L'ATTIVITÀ MUSCOLARE TUTTI I MOVIMENTI NEL CORPO E DEL CORPO SONO LA CONSEGUENZA DI CONTRAZIONI E RILASCIAMENTI MUSCOLARI
 LA REAZIONE ALL'AMBIENTE: L'ATTIVITÀ MUSCOLARE TUTTI I MOVIMENTI NEL CORPO E DEL CORPO SONO LA CONSEGUENZA DI CONTRAZIONI E RILASCIAMENTI MUSCOLARI CLASSIFICAZIONI DEI MUSCOLI: STRIATO SCHELETRICO STRATO
LA REAZIONE ALL'AMBIENTE: L'ATTIVITÀ MUSCOLARE TUTTI I MOVIMENTI NEL CORPO E DEL CORPO SONO LA CONSEGUENZA DI CONTRAZIONI E RILASCIAMENTI MUSCOLARI CLASSIFICAZIONI DEI MUSCOLI: STRIATO SCHELETRICO STRATO
Muscolo Scheletrico 2. Biomeccanica muscolare
 Muscolo Scheletrico 2. Biomeccanica muscolare Prof. Carlo Capelli Fisiologia Laurea in Scienze delle Attività Motorie e Sportive Università di Verona Obiettivi Definizione dei determinanti della potenza
Muscolo Scheletrico 2. Biomeccanica muscolare Prof. Carlo Capelli Fisiologia Laurea in Scienze delle Attività Motorie e Sportive Università di Verona Obiettivi Definizione dei determinanti della potenza
Fisiologia del muscolo
 Fisiologia del muscolo 3 tipi di muscolo Il muscolo scheletrico Fibre muscolari (Microscopia Ottica) Struttura dell apparato contrattile della fibra muscolare scheletrica Fibra muscolare Miofi brille (Microscopia
Fisiologia del muscolo 3 tipi di muscolo Il muscolo scheletrico Fibre muscolari (Microscopia Ottica) Struttura dell apparato contrattile della fibra muscolare scheletrica Fibra muscolare Miofi brille (Microscopia
-Subcellulare es cromosomi in mitosi; correnti citoplasma,trasporto vescicole
 Motilità e contrattilità cellulare Il movimento può avvenire a livello: -Subcellulare es cromosomi in mitosi; correnti citoplasma,trasporto vescicole -Cellulare protozoi ciliati, spermatozoi, migrazioni
Motilità e contrattilità cellulare Il movimento può avvenire a livello: -Subcellulare es cromosomi in mitosi; correnti citoplasma,trasporto vescicole -Cellulare protozoi ciliati, spermatozoi, migrazioni
Mediatore chimico. Recettore. Trasduzione del segnale. Risposta della cellula
 Mediatore chimico Recettore Trasduzione del segnale Risposta della cellula I mediatori chimici sono prodotti da cellule specializzate e sono diffusi nell organismo da apparati di distribuzione Sistemi
Mediatore chimico Recettore Trasduzione del segnale Risposta della cellula I mediatori chimici sono prodotti da cellule specializzate e sono diffusi nell organismo da apparati di distribuzione Sistemi
Energia chimica. muscolo. Energia meccanica
 Energia chimica muscolo Energia meccanica ! " # " Muscolo scheletrico Connettivo Fibre muscolari Vasi sanguigni Nervi Reticolo sarcoplasmatico Miofibrille Sarcolemma Tubuli T Nuclei Sarcoplasma Mitocondri
Energia chimica muscolo Energia meccanica ! " # " Muscolo scheletrico Connettivo Fibre muscolari Vasi sanguigni Nervi Reticolo sarcoplasmatico Miofibrille Sarcolemma Tubuli T Nuclei Sarcoplasma Mitocondri
La Velocità. Terzo incontro P.O.M.S. Relatore Averoldi Michele. Venerdi 24 Ottobre 2014
 La Velocità Terzo incontro P.O.M.S. Relatore Averoldi Michele La velocità Definizione e funzionamento Velocità (1) La velocità è la capacità di compiere movimenti di una certa ampiezza in un tempo limitato.
La Velocità Terzo incontro P.O.M.S. Relatore Averoldi Michele La velocità Definizione e funzionamento Velocità (1) La velocità è la capacità di compiere movimenti di una certa ampiezza in un tempo limitato.
in Terminazione Neurone Dendriti Soma Fessura sinaptica sinaptica Nucleo dendrite Segmento iniziale Sinapsi inibitoria Segmento mielinico Assone
 Le funzioni del sistema nervoso si basano sull attività dei neuroni che consiste nel generare, trasmettere ed elaborare informazioni nervose, che dipendono da modificazioni del potenziale di membrana,
Le funzioni del sistema nervoso si basano sull attività dei neuroni che consiste nel generare, trasmettere ed elaborare informazioni nervose, che dipendono da modificazioni del potenziale di membrana,
ASPETTI MECCANICI DELLA CONTRAZIONE MUSCOLARE. FGE aa.2015-16
 ASPETTI MECCANICI DELLA CONTRAZIONE MUSCOLARE FGE aa.2015-16 ARGOMENTI INNERVAZIONE DEL MUSCOLO SCHELETRICO PLACCA NEURO MUSCOLARE UNITÀ NEURO MOTORIE TIPI DI CONTRAZIONE SCOSSE SEMPLICI RELAZIONI TENSIONE-LUNGHEZZA
ASPETTI MECCANICI DELLA CONTRAZIONE MUSCOLARE FGE aa.2015-16 ARGOMENTI INNERVAZIONE DEL MUSCOLO SCHELETRICO PLACCA NEURO MUSCOLARE UNITÀ NEURO MOTORIE TIPI DI CONTRAZIONE SCOSSE SEMPLICI RELAZIONI TENSIONE-LUNGHEZZA
Il flusso dell informazione genetica. DNA -->RNA-->Proteine
 Il flusso dell informazione genetica DNA -->RNA-->Proteine Abbiamo visto i principali esperimenti che hanno dimostrato che il DNA è la molecola depositaria dell informazione genetica nella maggior parte
Il flusso dell informazione genetica DNA -->RNA-->Proteine Abbiamo visto i principali esperimenti che hanno dimostrato che il DNA è la molecola depositaria dell informazione genetica nella maggior parte
DIFFERENZIAMENTO DELLE CELLULE MUSCOLARI
 DIFFERENZIAMENTO DELLE CELLULE MUSCOLARI Testi di riferimento: Alberts B. et al. Biologia molecolare della cellula - Ed. Zanichelli Gilbert S.F. Biologia dello sviluppo - Ed. Zanichelli COS E UNA CELLULA
DIFFERENZIAMENTO DELLE CELLULE MUSCOLARI Testi di riferimento: Alberts B. et al. Biologia molecolare della cellula - Ed. Zanichelli Gilbert S.F. Biologia dello sviluppo - Ed. Zanichelli COS E UNA CELLULA
Lezione 4 *membrana cellulare *trasporti *specializzazioni del plasmalemma
 Lezione 4 *membrana cellulare *trasporti *specializzazioni del plasmalemma Lezione 3 membrana cellulare Le membrane, sia quelle che delimitano e costituiscono gli organuli cellulari che quelle che rivestono
Lezione 4 *membrana cellulare *trasporti *specializzazioni del plasmalemma Lezione 3 membrana cellulare Le membrane, sia quelle che delimitano e costituiscono gli organuli cellulari che quelle che rivestono
1) FIBRE ROSSE A CONTRAZIONE LENTA (Tipo I) 2) FIBRE BIANCHE INTERMEDIE (Tipo IIa) 3) FIBRE BIANCHE A CONTRAZIONE RAPIDA (Tipo IIb)
 LE FIBRE MUSCOLARI La fibra muscolare è considerata l' unità funzionale del muscolo scheletrico o, più semplicemente, una delle tante cellule che lo compongono. Ogni muscolo è infatti formato da un certo
LE FIBRE MUSCOLARI La fibra muscolare è considerata l' unità funzionale del muscolo scheletrico o, più semplicemente, una delle tante cellule che lo compongono. Ogni muscolo è infatti formato da un certo
RNA polimerasi operone. L operatore è il tratto
 La regolazione genica nei procarioti Alcune proteine vengono prodotte dalla cellula ad un ritmo relativamente costante e l attività dei geni che codificano queste proteine non è regolata in modo sofisticato.
La regolazione genica nei procarioti Alcune proteine vengono prodotte dalla cellula ad un ritmo relativamente costante e l attività dei geni che codificano queste proteine non è regolata in modo sofisticato.
Proteine integrali di membrana legate sul versante esterno a gruppi di carboidrati. Formati da diverse subunità che circoscrivono un poro acquoso che
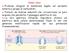 Canali ionici Proteine integrali di membrana legate sul versante esterno a gruppi di carboidrati. Formati da diverse subunità che circoscrivono un poro acquoso che permette il passaggio selettivo di ioni.
Canali ionici Proteine integrali di membrana legate sul versante esterno a gruppi di carboidrati. Formati da diverse subunità che circoscrivono un poro acquoso che permette il passaggio selettivo di ioni.
L endocitosi dell EGFR
 L endocitosi dell EGFR IFOM per la scuola Lo Studente Ricercatore 2011 Muzio Giulia Istituto d Istruzione Superiore Maserati Voghera Gruppo di lavoro: Determinanti della trasformazione neoplastica e della
L endocitosi dell EGFR IFOM per la scuola Lo Studente Ricercatore 2011 Muzio Giulia Istituto d Istruzione Superiore Maserati Voghera Gruppo di lavoro: Determinanti della trasformazione neoplastica e della
CELLULE EUCARIOTICHE
 CELLULE EUCARIOTICHE Le cellule eucariotiche sono di maggiori dimensioni, rispetto a quelle procariotiche (almeno 10 volte più grandi) Oltre a: membrana plasmatica, citoplasma, DNA e ribosomi (comuni a
CELLULE EUCARIOTICHE Le cellule eucariotiche sono di maggiori dimensioni, rispetto a quelle procariotiche (almeno 10 volte più grandi) Oltre a: membrana plasmatica, citoplasma, DNA e ribosomi (comuni a
La pompa Na + /Glucosio: simporto
 MFN0366-A1 (I. Perroteau) - trasportatori e canali La pompa Na + /Glucosio: simporto Il trasportatore oscilla fra due stati alternativi (A e B); nello stato A la proteina è aperta nello spazio extracellulare,
MFN0366-A1 (I. Perroteau) - trasportatori e canali La pompa Na + /Glucosio: simporto Il trasportatore oscilla fra due stati alternativi (A e B); nello stato A la proteina è aperta nello spazio extracellulare,
Macromolecole Biologiche. I domini (III)
 I domini (III) Domini α/β La cross over connection è l unità costitutiva su cui si basa la topologia di 3 tipi di domini α/β osservati nelle proteine: - α/β barrel - motivi ricchi di Leu (fold a ferro
I domini (III) Domini α/β La cross over connection è l unità costitutiva su cui si basa la topologia di 3 tipi di domini α/β osservati nelle proteine: - α/β barrel - motivi ricchi di Leu (fold a ferro
Elettroforesi. Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita.
 Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido
 Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido extracellulare e dalla loro regolazione. Membrana cellulare Ogni cellula presenta
Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido extracellulare e dalla loro regolazione. Membrana cellulare Ogni cellula presenta
Adattamenti del muscolo scheletrico all allenamento aerobico: ruolo dei radicali
 Adattamenti del muscolo scheletrico all allenamento aerobico: ruolo dei radicali Marina Marini Dipartimento di Medicina Specialistica, Diagnostica e Sperimentale Cosa sono i radicali? I radicali liberi
Adattamenti del muscolo scheletrico all allenamento aerobico: ruolo dei radicali Marina Marini Dipartimento di Medicina Specialistica, Diagnostica e Sperimentale Cosa sono i radicali? I radicali liberi
SINTESI PROTEICA. Replicazione. Trascrizione. Traduzione
 Replicazione SINTESI PROTEICA Trascrizione Traduzione 61 codoni codificanti 3 triplette non senso (STOP) AUG codone di inizio codone per Met Caratteristiche del codice genetico Specificità Il codice genetico
Replicazione SINTESI PROTEICA Trascrizione Traduzione 61 codoni codificanti 3 triplette non senso (STOP) AUG codone di inizio codone per Met Caratteristiche del codice genetico Specificità Il codice genetico
Struttura e funzioni della cellula. Corso di Biofisica, Università di Cagliari 1
 Struttura e funzioni della cellula 1 Riferimenti Books and others Biological Physics (updated 1 st ed.), Philip Nelson, Chap. 2 Physical Biology of the Cell, Phillips et al., Chap. 2 Movies Exercise 2
Struttura e funzioni della cellula 1 Riferimenti Books and others Biological Physics (updated 1 st ed.), Philip Nelson, Chap. 2 Physical Biology of the Cell, Phillips et al., Chap. 2 Movies Exercise 2
PRINCIPALI TIPI CELLULARI DEL SISTEMA NERVOSO NEURONI (CELLULE NERVOSE ) CELLULE GLIALI, O GLIA
 PRINCIPALI TIPI CELLULARI DEL SISTEMA NERVOSO NEURONI (CELLULE NERVOSE ) CELLULE GLIALI, O GLIA Corteccia cerebrale ed aree associate: da 12 a 15 miliardi di neuroni Cervelletto: 70 miliardi di neuroni
PRINCIPALI TIPI CELLULARI DEL SISTEMA NERVOSO NEURONI (CELLULE NERVOSE ) CELLULE GLIALI, O GLIA Corteccia cerebrale ed aree associate: da 12 a 15 miliardi di neuroni Cervelletto: 70 miliardi di neuroni
SINTESI DELL RNA. Replicazione. Trascrizione. Traduzione
 SINTESI DELL RNA Replicazione Trascrizione Traduzione L RNA ha origine da informazioni contenute nel DNA La TRASCRIZIONE permette la conversione di una porzione di DNA in una molecola di RNA con una sequenza
SINTESI DELL RNA Replicazione Trascrizione Traduzione L RNA ha origine da informazioni contenute nel DNA La TRASCRIZIONE permette la conversione di una porzione di DNA in una molecola di RNA con una sequenza
La cellula è l unità fondamentale di tutti gli organismi viventi ed è la più piccola struttura ad essere classificabile come vivente.
 CHE COS E LA CELLULA? La cellula è l unità fondamentale di tutti gli organismi viventi ed è la più piccola struttura ad essere classificabile come vivente. DA COSA SONO COSTITUITE LE CELLULE? Tutte le
CHE COS E LA CELLULA? La cellula è l unità fondamentale di tutti gli organismi viventi ed è la più piccola struttura ad essere classificabile come vivente. DA COSA SONO COSTITUITE LE CELLULE? Tutte le
ADESIONE CELLULARE SU MATERIALI BIOCOMPATIBILI
 Capitolo 11 - studi sperimentali e di ricerca ADESIONE CELLULARE SU MATERIALI BIOCOMPATIBILI a cura di Maristella Di Carmine Marco Marchisio Sebastiano Miscia 237 Implantologia Pratica Caratterizzazione
Capitolo 11 - studi sperimentali e di ricerca ADESIONE CELLULARE SU MATERIALI BIOCOMPATIBILI a cura di Maristella Di Carmine Marco Marchisio Sebastiano Miscia 237 Implantologia Pratica Caratterizzazione
Sostegno e locomozione
 Sostegno e locomozione Uno scheletro è un apparato che deve svolgere almeno le seguenti funzioni: sostenere il corpo permettere il movimento proteggere organi interni Uno scheletro può essere: Idroscheletro
Sostegno e locomozione Uno scheletro è un apparato che deve svolgere almeno le seguenti funzioni: sostenere il corpo permettere il movimento proteggere organi interni Uno scheletro può essere: Idroscheletro
SUPERAVVOLGIMENTO DEL DNA (ORGANIZZAZIONE TERZIARIA DEL DNA)
 SUPERAVVOLGIMENTO DEL DNA (ORGANIZZAZIONE TERZIARIA DEL DNA) ORGANIZZAZIONE TERZIARIA DEL DNA Il DNA cellulare contiene porzioni geniche e intergeniche, entrambe necessarie per le funzioni vitali della
SUPERAVVOLGIMENTO DEL DNA (ORGANIZZAZIONE TERZIARIA DEL DNA) ORGANIZZAZIONE TERZIARIA DEL DNA Il DNA cellulare contiene porzioni geniche e intergeniche, entrambe necessarie per le funzioni vitali della
Scuola Media Piancavallo 2
 LA CELLULA Una caratteristica di quasi tutti gli esseri viventi è quella di possedere una struttura più o meno complessa in cui parti diverse, gli organi, sono adatte a svolgere funzioni specifiche. Il
LA CELLULA Una caratteristica di quasi tutti gli esseri viventi è quella di possedere una struttura più o meno complessa in cui parti diverse, gli organi, sono adatte a svolgere funzioni specifiche. Il
Classificazione fibre muscolari
 Classificazione fibre muscolari Tipo fibra II B II A I Colore bianca rosa rossa Tipo di contrazione scossa rapida scossa rapida scossa lenta Affaticabilità rapida intermedia scarsa Metabolismo glicolitico
Classificazione fibre muscolari Tipo fibra II B II A I Colore bianca rosa rossa Tipo di contrazione scossa rapida scossa rapida scossa lenta Affaticabilità rapida intermedia scarsa Metabolismo glicolitico
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Utilizzo ECG
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Utilizzo ECG 27/4/2006 Cuore come dipolo elettrico Il cuore considerato come un generatore elettrico complesso, in cui sono presenti
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Utilizzo ECG 27/4/2006 Cuore come dipolo elettrico Il cuore considerato come un generatore elettrico complesso, in cui sono presenti
la struttura tridimensionale può essere ottenuta solo per Un intero dominio in genere da 50 a 300 residui
 Durante la traduzione l informazione di ripiegamento codificata nella sequenza aminoacidica diventa disponibile in maniera vettoriale la struttura tridimensionale può essere ottenuta solo per Un intero
Durante la traduzione l informazione di ripiegamento codificata nella sequenza aminoacidica diventa disponibile in maniera vettoriale la struttura tridimensionale può essere ottenuta solo per Un intero
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
I RECETTORI ACCOPPIATI A PROTEINE G
 I RECETTORI ACCOPPIATI A PROTEINE G I recettori accoppiati a proteine G sono costituiti da un unica subunità formata da un filamento di aminoacidi che attraversa 7 volte la membrana plasmatica Il sito
I RECETTORI ACCOPPIATI A PROTEINE G I recettori accoppiati a proteine G sono costituiti da un unica subunità formata da un filamento di aminoacidi che attraversa 7 volte la membrana plasmatica Il sito
Il metabolismo dell RNA. Prof. Savino; dispense di Biologia Molecolare, Corso di Laurea in Biotecnologie
 Il metabolismo dell RNA I vari tipi di RNA Il filamento di DNA che dirige la sintesi dello mrna è chiamato filamento stampo o filamento antisenso. L altro filamento che ha sequenza identica a quella dello
Il metabolismo dell RNA I vari tipi di RNA Il filamento di DNA che dirige la sintesi dello mrna è chiamato filamento stampo o filamento antisenso. L altro filamento che ha sequenza identica a quella dello
L APPARATO CIRCOLATORIO
 L APPARATO CIRCOLATORIO Tutte le cellule del nostro corpo hanno bisogno di sostanze nutritive e di ossigeno per svolgere le loro funzioni vitali. Così, esiste il sangue, un tessuto fluido che porta in
L APPARATO CIRCOLATORIO Tutte le cellule del nostro corpo hanno bisogno di sostanze nutritive e di ossigeno per svolgere le loro funzioni vitali. Così, esiste il sangue, un tessuto fluido che porta in
La contrazione deve essere coordinata e simultanea in tutte le cellule che costituiscono gli atri e i ventricoli.
 1 La contrazione deve essere coordinata e simultanea in tutte le cellule che costituiscono gli atri e i ventricoli. La contrazione è innescata dal potenziale d azione che nel cuore insorge spontaneamente
1 La contrazione deve essere coordinata e simultanea in tutte le cellule che costituiscono gli atri e i ventricoli. La contrazione è innescata dal potenziale d azione che nel cuore insorge spontaneamente
Le Biomolecole I parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Integrali (transmembrana), si estendono attraverso l intera membrana. Classificate in famiglie a seconda del numero di segmenti transmembrana.
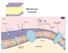 Membrana cellulare Proteine inserite nella membrana cellulare: Integrali (transmembrana), si estendono attraverso l intera membrana. Classificate in famiglie a seconda del numero di segmenti transmembrana.
Membrana cellulare Proteine inserite nella membrana cellulare: Integrali (transmembrana), si estendono attraverso l intera membrana. Classificate in famiglie a seconda del numero di segmenti transmembrana.
Il potenziale d azione si propaga a grandi distanze senza decremento permettendo la conduzione dell informazione nervosa.
 Il potenziale d azione si propaga a grandi distanze senza decremento permettendo la conduzione dell informazione nervosa. Soprasoglia La conduzione del potenziale d azione si basa sulla generazione di
Il potenziale d azione si propaga a grandi distanze senza decremento permettendo la conduzione dell informazione nervosa. Soprasoglia La conduzione del potenziale d azione si basa sulla generazione di
Automazione Industriale (scheduling+mms) scheduling+mms. adacher@dia.uniroma3.it
 Automazione Industriale (scheduling+mms) scheduling+mms adacher@dia.uniroma3.it Introduzione Sistemi e Modelli Lo studio e l analisi di sistemi tramite una rappresentazione astratta o una sua formalizzazione
Automazione Industriale (scheduling+mms) scheduling+mms adacher@dia.uniroma3.it Introduzione Sistemi e Modelli Lo studio e l analisi di sistemi tramite una rappresentazione astratta o una sua formalizzazione
Indice. pagina 2 di 10
 LEZIONE PROGETTAZIONE ORGANIZZATIVA DOTT.SSA ROSAMARIA D AMORE Indice PROGETTAZIONE ORGANIZZATIVA---------------------------------------------------------------------------------------- 3 LA STRUTTURA
LEZIONE PROGETTAZIONE ORGANIZZATIVA DOTT.SSA ROSAMARIA D AMORE Indice PROGETTAZIONE ORGANIZZATIVA---------------------------------------------------------------------------------------- 3 LA STRUTTURA
Corso di Componenti e Impianti Termotecnici LE RETI DI DISTRIBUZIONE PERDITE DI CARICO LOCALIZZATE
 LE RETI DI DISTRIBUZIONE PERDITE DI CARICO LOCALIZZATE 1 PERDITE DI CARICO LOCALIZZATE Sono le perdite di carico (o di pressione) che un fluido, in moto attraverso un condotto, subisce a causa delle resistenze
LE RETI DI DISTRIBUZIONE PERDITE DI CARICO LOCALIZZATE 1 PERDITE DI CARICO LOCALIZZATE Sono le perdite di carico (o di pressione) che un fluido, in moto attraverso un condotto, subisce a causa delle resistenze
2. Fisiologia Cellulare Diffusione, Trasporto, Osmosi
 2. Fisiologia Cellulare Diffusione, Trasporto, Osmosi Prof. Carlo Capelli Fisiologia Laurea in Scienze delle attività motorie e sportive Università di Verona Obiettivi Diffusione semplice e mediata da
2. Fisiologia Cellulare Diffusione, Trasporto, Osmosi Prof. Carlo Capelli Fisiologia Laurea in Scienze delle attività motorie e sportive Università di Verona Obiettivi Diffusione semplice e mediata da
Come funzionano gli oligo Antisenso? RNA WORLD. mrna. Regolare l espressione genica tramite molecole di RNA. Come funzionano gli oligo antisenso?
 RNA WORLD RNA Come funzionano gli oligo Antisenso? mrna Non coding RNA AAAAAAA rrna trna snrna snorna RNA Antisenso sirna Arresto della traduzione Proteina incompleta o nessuna sintesi MECCANISMO PASSIVO
RNA WORLD RNA Come funzionano gli oligo Antisenso? mrna Non coding RNA AAAAAAA rrna trna snrna snorna RNA Antisenso sirna Arresto della traduzione Proteina incompleta o nessuna sintesi MECCANISMO PASSIVO
LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI PROTEINE. sono ACIDI NUCLEICI. molecole complesse = POLIMERI. formate dall'unione di
 LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
La forza. In movimento Marietti Scuola 2010 De Agostini Scuola S.p.A. Novara
 La forza La definizione di forza Per forza s intende la capacità dell apparato neuro- muscolare di vincere o contrapporsi a un carico esterno con un impegno muscolare. La classificazione della forza Tipi
La forza La definizione di forza Per forza s intende la capacità dell apparato neuro- muscolare di vincere o contrapporsi a un carico esterno con un impegno muscolare. La classificazione della forza Tipi
www.fisiokinesiterapia.biz TRASCRIZIONE
 www.fisiokinesiterapia.biz TRASCRIZIONE TRASCRIZIONE Processo mediante il quale una sequenza di DNA (un gene) viene copiata in una sequenza di RNA Dalla trascrizione derivano gli mrna, che verranno tradotti
www.fisiokinesiterapia.biz TRASCRIZIONE TRASCRIZIONE Processo mediante il quale una sequenza di DNA (un gene) viene copiata in una sequenza di RNA Dalla trascrizione derivano gli mrna, che verranno tradotti
Regione cerniera monomero regione cerniera
 Regione cerniera Tutte le Ig, sia quelle secrete che quelle presenti sulla membrana plasmatica dei linfociti B, sono costituite da quattro catene proteiche, due pesanti (H, da heavy, in rosso nel disegno)
Regione cerniera Tutte le Ig, sia quelle secrete che quelle presenti sulla membrana plasmatica dei linfociti B, sono costituite da quattro catene proteiche, due pesanti (H, da heavy, in rosso nel disegno)
Descrivere la struttura e la funzione di un fuso neuromuscolare. Che cosa si intende per coattivazione alfa-gamma? Differenziare fra riflesso
 Descrivere la struttura e la funzione di un fuso neuromuscolare. Che cosa si intende per coattivazione alfa-gamma? Differenziare fra riflesso miotatico fasico e riflesso miotatico tonico. Inibizione dell
Descrivere la struttura e la funzione di un fuso neuromuscolare. Che cosa si intende per coattivazione alfa-gamma? Differenziare fra riflesso miotatico fasico e riflesso miotatico tonico. Inibizione dell
Dal DNA alle proteine: La trascrizione e la traduzione
 Dal DNA alle proteine: La trascrizione e la traduzione DNA RNA Trascrizione RNA PROTEINE Traduzione Dove avvengono? GLI EUCARIOTI I PROCARIOTI Cambell, Reece Biologia ZANICHELLI Trascrizione Sintesi di
Dal DNA alle proteine: La trascrizione e la traduzione DNA RNA Trascrizione RNA PROTEINE Traduzione Dove avvengono? GLI EUCARIOTI I PROCARIOTI Cambell, Reece Biologia ZANICHELLI Trascrizione Sintesi di
TEST BIOLOGIA 1 ANNO ABEI Da inviare a connesso@alice.it entro e non oltre il 6 novembre 2015
 1) I batteri sono organismi: a- bicellulari b- monocellulari c- pluricellulari 2) I virus: a- possono riprodursi solo nell acqua b- possono riprodursi solo sulla superficie di una cellula c- possono riprodursi
1) I batteri sono organismi: a- bicellulari b- monocellulari c- pluricellulari 2) I virus: a- possono riprodursi solo nell acqua b- possono riprodursi solo sulla superficie di una cellula c- possono riprodursi
Capitolo 3. L applicazione Java Diagrammi ER. 3.1 La finestra iniziale, il menu e la barra pulsanti
 Capitolo 3 L applicazione Java Diagrammi ER Dopo le fasi di analisi, progettazione ed implementazione il software è stato compilato ed ora è pronto all uso; in questo capitolo mostreremo passo passo tutta
Capitolo 3 L applicazione Java Diagrammi ER Dopo le fasi di analisi, progettazione ed implementazione il software è stato compilato ed ora è pronto all uso; in questo capitolo mostreremo passo passo tutta
La regolazione genica nei eucarioti
 La regolazione genica nei eucarioti Lic. Scientifico A. Meucci Aprilia Prof. Rolando Neri Differenziamento negli eucarioti pluricellulari Negli eucarioti le cellule specializzate dei vari tessuti contengono
La regolazione genica nei eucarioti Lic. Scientifico A. Meucci Aprilia Prof. Rolando Neri Differenziamento negli eucarioti pluricellulari Negli eucarioti le cellule specializzate dei vari tessuti contengono
Meccanica muscolare. Tensione muscolare: Forza esercitata dal muscolo / area di sezione (N/m 2 ) Carico: Forza esercitata da un peso sul muscolo
 Meccanica muscolare Tensione muscolare: Forza esercitata dal muscolo / area di sezione (N/m 2 ) Carico: Forza esercitata da un peso sul muscolo Quando i muscoli si contraggono sviluppano forza (spesso
Meccanica muscolare Tensione muscolare: Forza esercitata dal muscolo / area di sezione (N/m 2 ) Carico: Forza esercitata da un peso sul muscolo Quando i muscoli si contraggono sviluppano forza (spesso
Biosintesi non ribosomiale di metaboliti peptidici bioattivi
 Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
Potenziale di membrana: Differenza di potenziale elettrico a cavallo della membrana cellulare dovuta ad una diversa distribuzione ionica ai due lati
 Potenziale di membrana: Differenza di potenziale elettrico a cavallo della membrana cellulare dovuta ad una diversa distribuzione ionica ai due lati della membrana. Il potenziale di membrana (negativo
Potenziale di membrana: Differenza di potenziale elettrico a cavallo della membrana cellulare dovuta ad una diversa distribuzione ionica ai due lati della membrana. Il potenziale di membrana (negativo
TIPI DI CELLULE : PROCARIOTE ED EUCARIOTE
 TIPI DI CELLULE : PROCARIOTE ED EUCARIOTE Tutti i tipi cellulari presenti sul nostro pianeta appartengono ad uno di due gruppi fondamentali: procarioti ed eucarioti. I termini procariota (dal greco pro
TIPI DI CELLULE : PROCARIOTE ED EUCARIOTE Tutti i tipi cellulari presenti sul nostro pianeta appartengono ad uno di due gruppi fondamentali: procarioti ed eucarioti. I termini procariota (dal greco pro
Propagazione e trasmissione di segnali nervosi
 Propagazione e trasmissione di segnali nervosi La comunicazione tra le cellule Modalità di comunicazione cellulare: Mediante messaggi elettrici Mediante messaggi chimici In ambedue le modalità il messaggio,
Propagazione e trasmissione di segnali nervosi La comunicazione tra le cellule Modalità di comunicazione cellulare: Mediante messaggi elettrici Mediante messaggi chimici In ambedue le modalità il messaggio,
Realizzazione di un commutatore ultraveloce di flussi dati ottici basato su effetti non lineari in fibra. Claudia Cantini
 Realizzazione di un commutatore ultraveloce di flussi dati ottici basato su effetti non lineari in fibra Claudia Cantini 20 Luglio 2004 Ai miei genitori Prefazione La nostra vita di ogni giorno é sempre
Realizzazione di un commutatore ultraveloce di flussi dati ottici basato su effetti non lineari in fibra Claudia Cantini 20 Luglio 2004 Ai miei genitori Prefazione La nostra vita di ogni giorno é sempre
Macromolecole Biologiche. I domini (I)
 I domini (I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una
I domini (I) I domini I motivi generalmente si combinano a formare strutture globulari compatte, chiamate domini. Una proteina può essere costituita da uno o più domini. I domini sono definiti come una
Corso di elettrocardiografia essenziale
 Corso di elettrocardiografia essenziale Napoli Novembre 2004 ANMCO SIC GISE SIMEU SIS 118 ECG 12 derivazioni preospedaliero Il personale, chiamato ad intervenire nei casi di pazienti con sospetta SCA,
Corso di elettrocardiografia essenziale Napoli Novembre 2004 ANMCO SIC GISE SIMEU SIS 118 ECG 12 derivazioni preospedaliero Il personale, chiamato ad intervenire nei casi di pazienti con sospetta SCA,
L adattamento dei batteri. Strategie di adattamento
 L adattamento dei batteri Strategie di adattamento mutazione trasferimento genico orizzontale regolazione dell espressione genica regolazione della trascrizione regolazione della traduzione regolazione
L adattamento dei batteri Strategie di adattamento mutazione trasferimento genico orizzontale regolazione dell espressione genica regolazione della trascrizione regolazione della traduzione regolazione
ESISTONO DUE TIPI DI SECREZIONE
 ESOCITOSI ESISTONO DUE TIPI DI SECREZIONE SECREZIONE COSTITUTIVA (modalità continua): - proteine, glicoproteine e glicolipidi di membrana - proteine, glicoproteine e proteoglicani della matrice extracellulare
ESOCITOSI ESISTONO DUE TIPI DI SECREZIONE SECREZIONE COSTITUTIVA (modalità continua): - proteine, glicoproteine e glicolipidi di membrana - proteine, glicoproteine e proteoglicani della matrice extracellulare
Presentazione dell antigene tramite TCR
 Presentazione dell antigene tramite TCR Elena Adinolfi Il recettore della cellula T (TCR) Il TCR è il recettore per l antigene delle cellule T. In maniera analoga a quanto accade per le cellule B ad ogni
Presentazione dell antigene tramite TCR Elena Adinolfi Il recettore della cellula T (TCR) Il TCR è il recettore per l antigene delle cellule T. In maniera analoga a quanto accade per le cellule B ad ogni
Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas
 1 Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas Capitolo 7 Enzimi, le macchine della vita Piccole macchine regolano la funzione del corpo umano in un orchestrazione perfetta e a velocità
1 Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas Capitolo 7 Enzimi, le macchine della vita Piccole macchine regolano la funzione del corpo umano in un orchestrazione perfetta e a velocità
INTRODUZIONE: PERDITE IN FIBRA OTTICA
 INTRODUZIONE: PERDITE IN FIBRA OTTICA Il nucleo (o core ) di una fibra ottica è costituito da vetro ad elevatissima purezza, dal momento che la luce deve attraversare migliaia di metri di vetro del nucleo.
INTRODUZIONE: PERDITE IN FIBRA OTTICA Il nucleo (o core ) di una fibra ottica è costituito da vetro ad elevatissima purezza, dal momento che la luce deve attraversare migliaia di metri di vetro del nucleo.
L ORIGINE DEI TESSUTI
 L ORIGINE DEI TESSUTI Tutte le cellule dell organismo derivano dallo zigote Embrioni di topo a diversi stadi di sviluppo: A, stadio a 2 pronuclei; E, stadio a circa 16 cellule B, stadio a 2 blastomeri;
L ORIGINE DEI TESSUTI Tutte le cellule dell organismo derivano dallo zigote Embrioni di topo a diversi stadi di sviluppo: A, stadio a 2 pronuclei; E, stadio a circa 16 cellule B, stadio a 2 blastomeri;
DNA - RNA. Nucleotide = Gruppo Fosforico + Zucchero Pentoso + Base Azotata. Le unità fondamentali costituenti il DNA e l RNA sono i Nucleotidi.
 DNA - RNA Le unità fondamentali costituenti il DNA e l RNA sono i Nucleotidi. Nucleotide = Gruppo Fosforico + Zucchero Pentoso + Base Azotata. Esistono 4 basi azotate per il DNA e 4 per RNA Differenze
DNA - RNA Le unità fondamentali costituenti il DNA e l RNA sono i Nucleotidi. Nucleotide = Gruppo Fosforico + Zucchero Pentoso + Base Azotata. Esistono 4 basi azotate per il DNA e 4 per RNA Differenze
Citoscheletro Microfilamenti
 Citoscheletro Microfilamenti Biotecnologie 1 PROPRIETA DEI MICROTUBULI, FILAMENTI INTERMEDI E FILAMENTI DI ACTINA Uni Texas Da G. Karp, BIOLOGIA CELLULARE E MOLECOLARE, 3a ed, CORRETTA Microfilamenti I
Citoscheletro Microfilamenti Biotecnologie 1 PROPRIETA DEI MICROTUBULI, FILAMENTI INTERMEDI E FILAMENTI DI ACTINA Uni Texas Da G. Karp, BIOLOGIA CELLULARE E MOLECOLARE, 3a ed, CORRETTA Microfilamenti I
I documenti di www.mistermanager.it. Gli ingredienti per l allenamento per la corsa LE RIPETUTE
 I documenti di www.mistermanager.it Gli ingredienti per l allenamento per la corsa LE RIPETUTE Le Ripetute sono una delle forme di allenamento che caratterizzano i corridori più evoluti, in quanto partono
I documenti di www.mistermanager.it Gli ingredienti per l allenamento per la corsa LE RIPETUTE Le Ripetute sono una delle forme di allenamento che caratterizzano i corridori più evoluti, in quanto partono
tessuto muscolare: FUNZIONE movimento PROPRIETA contrattilità Scheletrico, striato, volontario Liscio, involontario Cardiaco, striato, automatico
 tessuto muscolare: Scheletrico, striato, volontario Liscio, involontario Cardiaco, striato, automatico cellule mioepiteliali, periciti, miofibroblasti FUNZIONE movimento PROPRIETA contrattilità Dove si
tessuto muscolare: Scheletrico, striato, volontario Liscio, involontario Cardiaco, striato, automatico cellule mioepiteliali, periciti, miofibroblasti FUNZIONE movimento PROPRIETA contrattilità Dove si
Macromolecole Biologiche. I domini (II)
 I domini (II) Domini β Nonostante l elevato numero di possibili disposizioni di filamenti β (a costituire foglietti β antiparalleli) connessi da tratti di loop, i domini β più frequentemente osservati
I domini (II) Domini β Nonostante l elevato numero di possibili disposizioni di filamenti β (a costituire foglietti β antiparalleli) connessi da tratti di loop, i domini β più frequentemente osservati
LA GRAFICA E LA GEOMETRIA OPERATIVA
 LA GRAFICA E LA GEOMETRIA OPERATIVA La geometria operativa, contrariamente a quella descrittiva basata sulle regole per la rappresentazione delle forme geometriche, prende in considerazione lo spazio racchiuso
LA GRAFICA E LA GEOMETRIA OPERATIVA La geometria operativa, contrariamente a quella descrittiva basata sulle regole per la rappresentazione delle forme geometriche, prende in considerazione lo spazio racchiuso
Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica.
 Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
Concanavalina A Emoglobina subunità Trioso fosfato isomerasi Una proteina qualsiasi assume costantemente un unica conformazione ben definita, cui è legata la sua azione biologica. 1 La conformazione è
PROTEINE. sono COMPOSTI ORGANICI QUATERNARI
 PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
Obiettivi della lezione scorsa
 Obiettivi della lezione scorsa 1) Imparare il significato dei termini contrazione, tensione, carico, scossa. 2) Esaminare la differenza fra una contrazione isotonica ed isometrica. 3) Capire la differenza
Obiettivi della lezione scorsa 1) Imparare il significato dei termini contrazione, tensione, carico, scossa. 2) Esaminare la differenza fra una contrazione isotonica ed isometrica. 3) Capire la differenza
Programmazione individuale per competenze CLASSE 3^A CMB. Materia: Biologia, microbiologia e biotecnologie
 Programmazione individuale per competenze CLASSE 3^A CMB Materia: Biologia, microbiologia e biotecnologie Situazione della classe Accordi con la classe Accordi con le altre discipline Correlazione con
Programmazione individuale per competenze CLASSE 3^A CMB Materia: Biologia, microbiologia e biotecnologie Situazione della classe Accordi con la classe Accordi con le altre discipline Correlazione con
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I I TRASPORTI ATTRAVERSO MEMBRANE BIOLOGICHE Movimenti di piccoli soluti attraverso le membrane 2 categorie generali Trasporto
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I I TRASPORTI ATTRAVERSO MEMBRANE BIOLOGICHE Movimenti di piccoli soluti attraverso le membrane 2 categorie generali Trasporto
Dal DNA all RNA. La trascrizione nei procarioti e negli eucarioti
 Dal DNA all RNA La trascrizione nei procarioti e negli eucarioti DOGMA CENTRALE DELLA BIOLOGIA MOLECOLARE Gene Regione di DNA che porta l informazione (= che CODIFICA) per una catena polipeptidica o per
Dal DNA all RNA La trascrizione nei procarioti e negli eucarioti DOGMA CENTRALE DELLA BIOLOGIA MOLECOLARE Gene Regione di DNA che porta l informazione (= che CODIFICA) per una catena polipeptidica o per
Muscoli. Caratteristiche del tessuto muscolare
 Muscoli Scheletrici (striati, volontari) Attaccati alle ossa: movimento, postura, respirazione Al microscopio mostra vistose bande regolari da cui il nome striati Lisci (involontari) Presente negli organi
Muscoli Scheletrici (striati, volontari) Attaccati alle ossa: movimento, postura, respirazione Al microscopio mostra vistose bande regolari da cui il nome striati Lisci (involontari) Presente negli organi
Differenziamento Cellule Staminali
 Differenziamento Cellule Staminali Differenziamento Tutte le cellule hanno funzioni di base Respirazione, crescita, divisione, sintesi La maggior parte ha inoltre delle capacità particolari 200 differenti
Differenziamento Cellule Staminali Differenziamento Tutte le cellule hanno funzioni di base Respirazione, crescita, divisione, sintesi La maggior parte ha inoltre delle capacità particolari 200 differenti
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it
 LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
PCR. PCR o reazione di polimerizzazione a catena. Amplificazione esponenziale di DNA. Puo amplificare un tratto di DNA per piu di 1 milione di volte
 PCR Prof.ssa Flavia Frabetti PCR o reazione di polimerizzazione a catena Fine anni 80 Amplificazione esponenziale di DNA. Puo amplificare un tratto di DNA per piu di 1 milione di volte Permette di estrarre
PCR Prof.ssa Flavia Frabetti PCR o reazione di polimerizzazione a catena Fine anni 80 Amplificazione esponenziale di DNA. Puo amplificare un tratto di DNA per piu di 1 milione di volte Permette di estrarre
Cellula nervosa tipo. Polarizzazione dinamica. Specificità delle connessioni. Fessura sinaptica Terminazione sinaptica. dendri te Segmento iniziale
 Le funzioni del sistema nervoso, anche le più complesse, si fondano sulle proprietà funzionali dei neuroni. L attività specifica dei neuroni consiste nel generare, trasmettere ed elaborare informazioni.
Le funzioni del sistema nervoso, anche le più complesse, si fondano sulle proprietà funzionali dei neuroni. L attività specifica dei neuroni consiste nel generare, trasmettere ed elaborare informazioni.
Embryology. Early development from a phenomenological point of view. Bolk s Companions for the study of medicine www.louisbolk.org
 Tratto da: Guus van der Bie, M.D. Embryology. Early development from a phenomenological point of view Bolk s Companions for the study of medicine www.louisbolk.org Traduzione a cura di: Stefano Cecchi
Tratto da: Guus van der Bie, M.D. Embryology. Early development from a phenomenological point of view Bolk s Companions for the study of medicine www.louisbolk.org Traduzione a cura di: Stefano Cecchi
POLITECNICO DI TORINO
 NEWSLETTER N2 - I dispositivi elettronici posti a protezione degli operatori E stato indicato nella precedente newsletter che la sicurezza degli operatori in un contesto industriale è affidata a una catena
NEWSLETTER N2 - I dispositivi elettronici posti a protezione degli operatori E stato indicato nella precedente newsletter che la sicurezza degli operatori in un contesto industriale è affidata a una catena
SISTEMI ENERGETICI. L ATP privato di uno dei suoi 3 radicali fosforici diventa ADP (adenosindifosfato).
 SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
DOMANDA FREQUENTE: QUALE E LA FUNZIONE DI UNA CERTA PROTEINA? SI AUMENTA O SI DIMINUISCE L ESPRESSIONE DELLA PROTEINA
 DOMANDA FREQUENTE: QUALE E LA FUNZIONE DI UNA CERTA PROTEINA? OVERESPRESSIONE DELLA PROTEINA ESPRESSIONE ECTOPICA CON UN VETTORE DI ESPRESSIONE ABOLIZIONE DELLA ESPRESSIONE DELLA PROTEINA INTERFERENZA
DOMANDA FREQUENTE: QUALE E LA FUNZIONE DI UNA CERTA PROTEINA? OVERESPRESSIONE DELLA PROTEINA ESPRESSIONE ECTOPICA CON UN VETTORE DI ESPRESSIONE ABOLIZIONE DELLA ESPRESSIONE DELLA PROTEINA INTERFERENZA
Le cellule eucariotiche svolgono durante la loro vita una serie ordinata di eventi che costituiscono il Ciclo Cellulare
 Le cellule eucariotiche svolgono durante la loro vita una serie ordinata di eventi che costituiscono il Ciclo Cellulare Interfase comprende le fasi G 1, S, and G 2 Sintesi di macromolecole durante la
Le cellule eucariotiche svolgono durante la loro vita una serie ordinata di eventi che costituiscono il Ciclo Cellulare Interfase comprende le fasi G 1, S, and G 2 Sintesi di macromolecole durante la
Il ciclo cellulare La divisione cellulare
 Il ciclo cellulare La divisione cellulare Il ciclo cellulare Meccanismo con cui si riproducono tutti gli organismi viventi La durata del ciclo varia moltissimo a seconda del tipo cellulare Cellule che
Il ciclo cellulare La divisione cellulare Il ciclo cellulare Meccanismo con cui si riproducono tutti gli organismi viventi La durata del ciclo varia moltissimo a seconda del tipo cellulare Cellule che
DIFFERENZIAMENTO E COMUNICAZIONE TRA CELLULE - LE CELLULE STAMINALI. www.fisiokinesiterapia.biz
 DIFFERENZIAMENTO E COMUNICAZIONE TRA CELLULE - LE CELLULE STAMINALI www.fisiokinesiterapia.biz sito dell NIH sulle cellule staminali in genere http://stemcells.nih.gov/info/basics/basics4.asp sito completo
DIFFERENZIAMENTO E COMUNICAZIONE TRA CELLULE - LE CELLULE STAMINALI www.fisiokinesiterapia.biz sito dell NIH sulle cellule staminali in genere http://stemcells.nih.gov/info/basics/basics4.asp sito completo
Il genoma dinamico: gli elementi trasponibili
 Il genoma dinamico: gli elementi trasponibili Anni trenta: studi sul mais ribaltano la visione classica secondo cui i geni si trovano solo in loci fissi sul cromosoma principale Esistono elementi genetici
Il genoma dinamico: gli elementi trasponibili Anni trenta: studi sul mais ribaltano la visione classica secondo cui i geni si trovano solo in loci fissi sul cromosoma principale Esistono elementi genetici
Università degli Studi di Messina
 Università degli Studi di Messina Guida alla Rendicontazione on-line delle Attività del Docente Versione della revisione: 2.02/2013-07 A cura di: Fabio Adelardi Università degli studi di Messina Centro
Università degli Studi di Messina Guida alla Rendicontazione on-line delle Attività del Docente Versione della revisione: 2.02/2013-07 A cura di: Fabio Adelardi Università degli studi di Messina Centro
INTERAZIONE DI PROTEINE CON SFINGOLIPIDI
 Seminario Rafts INTERAZIONE DI PROTEINE CON SFINGOLIPIDI Motivi strutturali coinvolti nell interazione di proteine con sfingolipidi e colesterolo (1) Uno dei primi passi per l identificazione di tale motive
Seminario Rafts INTERAZIONE DI PROTEINE CON SFINGOLIPIDI Motivi strutturali coinvolti nell interazione di proteine con sfingolipidi e colesterolo (1) Uno dei primi passi per l identificazione di tale motive
CABINE ELETTRICHE DI TRASFORMAZIONE
 Cabtrasf_parte_prima 1 di 8 CABINE ELETTRICHE DI TRASFORMAZIONE parte prima Una cabina elettrica è il complesso di conduttori, apparecchiature e macchine atto a eseguire almeno una delle seguenti funzioni:
Cabtrasf_parte_prima 1 di 8 CABINE ELETTRICHE DI TRASFORMAZIONE parte prima Una cabina elettrica è il complesso di conduttori, apparecchiature e macchine atto a eseguire almeno una delle seguenti funzioni:
