Lo stato liquido. Un liquido non ha una forma propria, ma ha la forma del recipiente che lo contiene; ha però volume proprio e non è comprimibile.
|
|
|
- Mariana Villa
- 7 anni fa
- Visualizzazioni
Transcript
1 I liquidi
2 Lo stato liquido Lo stato liquido rappresenta una condizione intermedia tra stato aeriforme e stato solido, tra lo stato di massimo disordine e quello di perfetto ordine Un liquido non ha una forma propria, ma ha la forma del recipiente che lo contiene; ha però volume proprio e non è comprimibile.
3 Il passaggio dallo stato aeriforme allo stato liquido si chiama liquefazione, nel caso dei gas, o condensazione, nel caso dei vapori. Il passaggio dallo stato solido allo stato liquido si chiama fusione. Il vapore può essere trasformato in un liquido in due modi: PER COMPRESSIONE. Se riduciamo il volume del vapore, aumentiamo le probabilità di urto tra le particelle, che riescono a legarsi tra loro per formare il liquido. PER RAFFREDDAMENTO. Se riduciamo l energia delle particelle, queste possono più facilmente stabilire i legami che portano allo stato liquido.
4 Liquidi molecolari, come acqua, ammoniaca e acetone, Liquidi ionici, come cloruro di sodio, nitrato di potassio o altri sali allo stato fuso. I liquidi tendono ad assumere la forma del recipiente che li contiene e non hanno una forma propria, ma hanno volume proprio. Diffondono e la loro diffusione aumenta all aumentare della temperatura. Scarsamente comprimibili Le particelle che costituiscono i liquidi sono soggette a forze attrattive intermolecolari.
5 Tensione Superficiale La tensione superficiale è dovuta alle forze di coesione tra le molecole del liquido. Le molecole dello strato superficiale sono attratte verso l interno della massa liquida. Questa spinta riunisce ancor più le molecole della superficie e forma una pellicola elastica che si oppone all attraversamento
6 Tensione superficiale La tensione superficiale è l energia richiesta per espandere la superficie di un liquido. Essa si origina perché le forze di attrazione presenti tra le particelle all interno della massa liquida agiscono in tutte le direzioni e si fanno equilibrio, mentre le forze con cui le particelle superficiali sono attirate hanno una risultante diretta verso il basso.
7 Evaporazione Il passaggio dallo stato liquido allo stato di vapore, al di sotto della temperatura di ebollizione, si chiama evaporazione. Le particelle di un liquido che hanno energia cinetica superiore alle forze intermolecolari riescono a sfuggire come vapore.
8 Capillarità e viscosità La capillarità è un fenomeno correlato alla tensione superficiale. Facciamo pescare nell acqua una estremità di un capillare, un tubo di vetro dal diametro molto piccolo, come un capello: vediamo che il liquido risale nel tubo Il fenomeno della capillarità si verifica quando le forze di adesione superano quelle di coesione La viscosità è la resistenza di un liquido a fluire. La viscosità dipende dalle dimensioni delle molecole e dalle forze di attrazione intermolecolari: quanto più sono elevate, tanto maggiore è la viscosità. La viscosità diminuisce all aumentare della temperatura, perché l energia cinetica più alta favorisce la mobilità delle particelle.
9 Capillarità e viscosità Viscosità = resistenza al fluire. Negli oli, più lunghe sono le catene, maggiori sono le forze intermolecolari, maggiore è la viscosità. Processo di capillarità: competizione tra forze di coesione e forze di adesione
10 L equilibrio del vapore saturo (A), nel recipiente viene fatto il vuoto e il manometro indica che la pressione è nulla. (B), dopo aver introdotto il bromo liquido, si nota un progressivo passaggio del bromo allo stato di vapore. Il manometro segnala un aumento della pressione. Le molecole che evaporano (freccia verso l alto) sono in numero maggiore di quelle che ridiventano liquide (freccia verso il basso). (C), quando si raggiunge il valore massimo di pressione, che rimane costante, le molecole di bromo che evaporano e quelle che condensano sono in numero uguale.
11 Tensione di vapore Equilibrio dinamico Liquido + calore vapore Dal momento in cui la concentrazione del vapore rimane sempre costante e quindi rimane costante anche la pressione. Si determina una condizione di equilibrio dinamico, cioè una situazione mantenuta da due processi opposti, che avvengono con la stessa velocità. Un vapore in equilibrio con il suo liquido è detto vapore saturo.
12 Tensione di vapore Il valore della pressione di vapore di un liquido dipende da tre fattori: il peso molecolare; la forza dei legami tra le molecole; la temperatura.
13 Tensione di vapore Più i legami intermolecolari sono forti, più è difficile che le molecole riescano ad avere l energia per romperli e per evaporare, e più la pressione di vapore è bassa. Il riscaldamento, fa aumentare il numero delle molecole con energia sufficiente a rompere i legami per evaporare: a temperatura più alta il passaggio allo stato di vapore è più probabile. La pressione di vapore di un liquido aumenta all aumentare della temperatura e diminuisce all aumentare del peso molecolare e della forza dei legami.
14 Ebollizione La temperatura di ebollizione di un liquido dipende dalla tendenza che ha a passare allo stato di vapore, cioè dipende dalla sua pressione di vapore. Per far bollire un liquido contenuto in un recipiente aperto occorre che la pressione del vapore abbia lo stesso valore della pressione atmosferica. All aumentare della temperatura aumenta la pressione di vapore. Quando la pressione di vapore è uguale alla pressione atmosferica, il liquido bolle. Alla pressione atmosferica l acqua bolle a 100 C, l etanolo a 78 C e l etere a 36 C. A pressioni minori i liquidi bollono a temperature inferiori; a pressioni maggiori i liquidi bollono a temperature superiori.
15 Ebollizione Un liquido bolle quando la sua tensione di vapore è uguale alla sua pressione atmosferica Formazione di bolle in tutta la massa liquida Punto di ebollizione normale: a pressione 1 atm
Le forze intermolecolari ed i liquidi Brooks/Cole - Cengage
 2018 Le forze intermolecolari ed i liquidi 1 2009 Brooks/Cole - Cengage Forze Intermolecolari 2 Forze intermolecolari sono forze che si esercitano fra molecole, fra ioni, o fra molecole e ioni. Forze intramolecolari
2018 Le forze intermolecolari ed i liquidi 1 2009 Brooks/Cole - Cengage Forze Intermolecolari 2 Forze intermolecolari sono forze che si esercitano fra molecole, fra ioni, o fra molecole e ioni. Forze intramolecolari
H - STATI DI AGGREGAZIONE DELLA MATERIA
 H - STATI DI AGGREGAZIONE DELLA MATERIA STATI DI AGGREGAZIONE DELLA MATERIA SOLIDO LIQUIDO AERIFORME STATO SOLIDO LA MATERIA E' COSTITUITA DA MOLECOLE MOLTO VICINE TRA LORO, DISPOSTE IN RETICOLI ORDINATI
H - STATI DI AGGREGAZIONE DELLA MATERIA STATI DI AGGREGAZIONE DELLA MATERIA SOLIDO LIQUIDO AERIFORME STATO SOLIDO LA MATERIA E' COSTITUITA DA MOLECOLE MOLTO VICINE TRA LORO, DISPOSTE IN RETICOLI ORDINATI
14. Transizioni di Fase_a.a. 2009/2010 TRANSIZIONI DI FASE
 TRANSIZIONI DI FASE Fase: qualsiasi parte di un sistema omogenea, di composizione chimica costante e in un determinato stato fisico. Una fase può avere le stesse variabili intensive (P, T etc) ma ha diverse
TRANSIZIONI DI FASE Fase: qualsiasi parte di un sistema omogenea, di composizione chimica costante e in un determinato stato fisico. Una fase può avere le stesse variabili intensive (P, T etc) ma ha diverse
Chimica generale. Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologia agroalimentare PARTE 3
 Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologia agroalimentare PARTE 3 1 GLI STATI DI AGGREGAZIONE DELLA MATERIA 2 I composti chimici
Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologia agroalimentare PARTE 3 1 GLI STATI DI AGGREGAZIONE DELLA MATERIA 2 I composti chimici
Lo stato liquido. Stato liquido: situazione intermedia non ben definita struttura semiordinata Volume proprio assenza di forma propria
 Lo stato liquido gas liquido solido erfetto disordine erfetto ordine Stato liquido: situazione intermedia non ben definita struttura semiordinata Volume proprio assenza di forma propria Modello per lo
Lo stato liquido gas liquido solido erfetto disordine erfetto ordine Stato liquido: situazione intermedia non ben definita struttura semiordinata Volume proprio assenza di forma propria Modello per lo
I cambiamenti di stato
 I cambiamenti di stato 1. I passaggi tra stati di aggregazione Le sostanze possono passare dall'uno all'altro dei tre stati di aggregazione mediante scambi di calore. La freccia rossa indica assorbimento
I cambiamenti di stato 1. I passaggi tra stati di aggregazione Le sostanze possono passare dall'uno all'altro dei tre stati di aggregazione mediante scambi di calore. La freccia rossa indica assorbimento
. Proprietà degli stati della materia Aeriforme Liquido Solido
 . Proprietà degli stati della materia Aeriforme Liquido Solido Volume variabile in funzione del recipiente Volume definito Volume definito Forma del recipiente Forma del recipiente Forma propria Miscibili
. Proprietà degli stati della materia Aeriforme Liquido Solido Volume variabile in funzione del recipiente Volume definito Volume definito Forma del recipiente Forma del recipiente Forma propria Miscibili
Le forze intermolecolari e i liquidi Brooks/Cole - Cengage
 Le forze intermolecolari e i liquidi 1 2017 2009 Brooks/Cole - Cengage 2 Forze Intermolecolari Forze attrattive che si esercitano fra molecole, fra ioni, o fra molecole e ioni. queste forze sono responsabili
Le forze intermolecolari e i liquidi 1 2017 2009 Brooks/Cole - Cengage 2 Forze Intermolecolari Forze attrattive che si esercitano fra molecole, fra ioni, o fra molecole e ioni. queste forze sono responsabili
LIQUIDI. Viscosità = resistenza al fluire di un liquido. dipende dalle forze intermolecolari (molto importante è il legame ad idrogeno)
 Proprietà salienti: LIQUIDI Viscosità = resistenza al fluire di un liquido. dipende dalle forze intermolecolari (molto importante è il legame ad idrogeno) Viscosità di alcuni liquidi a temperatura ambiente.
Proprietà salienti: LIQUIDI Viscosità = resistenza al fluire di un liquido. dipende dalle forze intermolecolari (molto importante è il legame ad idrogeno) Viscosità di alcuni liquidi a temperatura ambiente.
LE PROPRIETA DELLA MATERIA
 LE PROPRIETA DELLA MATERIA Gli aspetti macroscopico, microscopico e particellare della materia La materia è tutto ciò che possiede una massa e occupa un volume, cioè una porzione di spazio Un campione
LE PROPRIETA DELLA MATERIA Gli aspetti macroscopico, microscopico e particellare della materia La materia è tutto ciò che possiede una massa e occupa un volume, cioè una porzione di spazio Un campione
GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato liquido
 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato liquido Lo stato liquido Liquidi: energia dei moti termici confrontabile con quella delle forze coesive. Limitata libertà di movimento delle molecole, che
GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato liquido Lo stato liquido Liquidi: energia dei moti termici confrontabile con quella delle forze coesive. Limitata libertà di movimento delle molecole, che
Sommario delle lezione17. Diagrammi di stato
 Sommario delle lezione17 Diagrammi di stato Liquidi e solidi Non esiste una equazione di stato, come nel caso dei gas. Nei liquidi e nei solidi le molecole sono molto più vicine tra loro; le forze intermolecolari,
Sommario delle lezione17 Diagrammi di stato Liquidi e solidi Non esiste una equazione di stato, come nel caso dei gas. Nei liquidi e nei solidi le molecole sono molto più vicine tra loro; le forze intermolecolari,
PASSAGGI DI STATO. sublimazione fusione ebollizione. solidificazione. condensazione. brinamento. Calore processi fisici endotermici ( H>0).
 PASSAGGI DI STATO Calore processi fisici endotermici (H>0). sublimazione fusione ebollizione S solidificazione L condensazione V brinamento Scrittura in formule: - H 2 O (s) H 2 O (l) fusione - H 2 O (l)
PASSAGGI DI STATO Calore processi fisici endotermici (H>0). sublimazione fusione ebollizione S solidificazione L condensazione V brinamento Scrittura in formule: - H 2 O (s) H 2 O (l) fusione - H 2 O (l)
Corso di Chimica Generale CL Biotecnologie
 Corso di Chimica Generale CL Biotecnologie STATI DELLA MATERIA Prof. Manuel Sergi MATERIA ALLO STATO GASSOSO MOLECOLE AD ALTA ENERGIA CINETICA GRANDE DISTANZA TRA LE MOLECOLE LEGAMI INTERMOLECOLARI DEBOLI
Corso di Chimica Generale CL Biotecnologie STATI DELLA MATERIA Prof. Manuel Sergi MATERIA ALLO STATO GASSOSO MOLECOLE AD ALTA ENERGIA CINETICA GRANDE DISTANZA TRA LE MOLECOLE LEGAMI INTERMOLECOLARI DEBOLI
Lo stato liquido: il modello
 Lo stato liquido: il modello lemolecolesonoin moto perpetuo e casuale(moto Browniano) l'energia del moto: è dello stesso ordine di grandezza dell'energia di interazione tra le molecole dipende dalla temperatura(agitazione
Lo stato liquido: il modello lemolecolesonoin moto perpetuo e casuale(moto Browniano) l'energia del moto: è dello stesso ordine di grandezza dell'energia di interazione tra le molecole dipende dalla temperatura(agitazione
Tensione di vapore evaporazione
 Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Passaggi di stato. P = costante
 Passaggi di stato P costante Diagramma isobaro di riscaldamento, relativo ai passaggi di stato Solido Liquido vapore. Si noti che la diversa lunghezza dei tratti FG e EV vuol mettere in evidenza, qualitativamente,
Passaggi di stato P costante Diagramma isobaro di riscaldamento, relativo ai passaggi di stato Solido Liquido vapore. Si noti che la diversa lunghezza dei tratti FG e EV vuol mettere in evidenza, qualitativamente,
PASSAGGI DI STATO. sublimazione fusione ebollizione. solidificazione. condensazione. brinamento. Calore. Scrittura in formule:
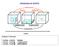 PASSAGGI DI STATO sublimazione fusione ebollizione S solidificazione L condensazione V brinamento Calore Scrittura in formule: - H O (s) H 2 2 O (l) fusione - H O (l) H 2 2 O (g) evaporazione - H O (s)
PASSAGGI DI STATO sublimazione fusione ebollizione S solidificazione L condensazione V brinamento Calore Scrittura in formule: - H O (s) H 2 2 O (l) fusione - H O (l) H 2 2 O (g) evaporazione - H O (s)
Termodinamica Chimica
 Universita degli Studi dell Insubria Corsi di Laurea in Scienze Chimiche e Chimica Industriale Termodinamica Chimica Equilibrio Liquido-Vapore dario.bressanini@uninsubria.it http://scienze-como.uninsubria.it/bressanini
Universita degli Studi dell Insubria Corsi di Laurea in Scienze Chimiche e Chimica Industriale Termodinamica Chimica Equilibrio Liquido-Vapore dario.bressanini@uninsubria.it http://scienze-como.uninsubria.it/bressanini
Le soluzioni. possono essere. solide (leghe) liquide aeriformi
 Le soluzioni Sono miscele omogenee di due o più sostanze (in forma di molecole, atomi, ioni) di cui quella presente in quantità maggiore è definita solvente, le altre soluti. possono essere solide (leghe)
Le soluzioni Sono miscele omogenee di due o più sostanze (in forma di molecole, atomi, ioni) di cui quella presente in quantità maggiore è definita solvente, le altre soluti. possono essere solide (leghe)
La materia e le sue proprietà
 La materia e le sue proprietà La materia La materia è tutto ciò che occupa spazio Una precisa porzione di materia viene indicata con corpo Il volume di un corpo è la quantità di spazio da esso occupata
La materia e le sue proprietà La materia La materia è tutto ciò che occupa spazio Una precisa porzione di materia viene indicata con corpo Il volume di un corpo è la quantità di spazio da esso occupata
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici
 La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
Distribuzione e Temperatura. Pressione di Vapore. Evaporazione
 Evaporazione Le molecole del Liquido hanno una distribuzione di energia cinetica. Una frazione di molecole della superficie del liquido ha energia cinetica sufficiente per sfuggire all attrazione attrazione
Evaporazione Le molecole del Liquido hanno una distribuzione di energia cinetica. Una frazione di molecole della superficie del liquido ha energia cinetica sufficiente per sfuggire all attrazione attrazione
Trasformazioni fisiche della materia: i passaggi di stato
 Trasformazioni fisiche della materia: i passaggi di stato Nelle condizioni terrestri la materia può presentarsi in tre differenti stati fisici o stati di aggregazione: solido, liquido e aeriforme. I solidi
Trasformazioni fisiche della materia: i passaggi di stato Nelle condizioni terrestri la materia può presentarsi in tre differenti stati fisici o stati di aggregazione: solido, liquido e aeriforme. I solidi
Le proprietà colligative delle soluzioni
 1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno 5. Legami a confronto
 Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Stati della materia. Esempio. Fusione e solidificazione. Esempio. Stati di aggregazione della materia
 Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia
 Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Acqua. E la molecola più abbondante nel corpo E vitale. Uova di rana in ambiente acquoso
 Acqua E la molecola più abbondante nel corpo E vitale Uova di rana in ambiente acquoso Proprietà chimica dell acqua I legami O-H sono covalenti polari. Infatti, l ossigeno attira fortemente gli elettroni
Acqua E la molecola più abbondante nel corpo E vitale Uova di rana in ambiente acquoso Proprietà chimica dell acqua I legami O-H sono covalenti polari. Infatti, l ossigeno attira fortemente gli elettroni
Stati della materia. Stati della materia
 Stati della materia La materia può esistere in 3 diversi STATI DI AGGREGAZIONE: SOLIDO LIQUIDO GASSOSO MACROSCOPICHE MICROSCOPICHE Stati della materia Lo stato di aggregazione di una sostanza dipende dal
Stati della materia La materia può esistere in 3 diversi STATI DI AGGREGAZIONE: SOLIDO LIQUIDO GASSOSO MACROSCOPICHE MICROSCOPICHE Stati della materia Lo stato di aggregazione di una sostanza dipende dal
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
I liquidi possiedono quindi un volume proprio e proprietà caratteristiche di questo stato fisico:
 STATO LIQUIDO E uno stato in cui le forze attrattive tra le molecole sono abbastanza consistenti anche se non sono sufficienti per garantire una struttura compatta presente invece nei solidi. Nello stato
STATO LIQUIDO E uno stato in cui le forze attrattive tra le molecole sono abbastanza consistenti anche se non sono sufficienti per garantire una struttura compatta presente invece nei solidi. Nello stato
Lo stato liquido forze coesive moto browniano Fanno eccezione l acqua e poche altre sostanze
 Lo stato liquido I liquidi presentano alcune caratteristiche dei solidi e altre dei gas. Le particelle che costituiscono il liquido sono vicine le une alle altre, trattenute da forze attrattive (forze
Lo stato liquido I liquidi presentano alcune caratteristiche dei solidi e altre dei gas. Le particelle che costituiscono il liquido sono vicine le une alle altre, trattenute da forze attrattive (forze
Lezione 12 Tensione superficiale. Deformabilità.
 Lezione 12 Tensione superficiale. Deformabilità. Fenomeni di interazione molecolare residua Abbiamo schematizzato i liquidi come insiemi di particelle poco interagenti tra loro. Tuttavia gli effetti di
Lezione 12 Tensione superficiale. Deformabilità. Fenomeni di interazione molecolare residua Abbiamo schematizzato i liquidi come insiemi di particelle poco interagenti tra loro. Tuttavia gli effetti di
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
La lezione di oggi. Le interazioni tra molecole alla superficie di un liquido generano fenomeni come: tensione superficiale capillarità
 1 La lezione di oggi Le interazioni tra molecole alla superficie di un liquido generano fenomeni come: tensione superficiale capillarità In medicina: Equilibrio alveolare 2 ! La tensione superficiale!
1 La lezione di oggi Le interazioni tra molecole alla superficie di un liquido generano fenomeni come: tensione superficiale capillarità In medicina: Equilibrio alveolare 2 ! La tensione superficiale!
STATI DI AGGREGAZIONE DELLA MATERIA E PROPRIETÀ DEI FLUIDI
 STATI DI AGGREGAZIONE DELLA MATERIA E PROPRIETÀ DEI FLUIDI 14/01/2014 2 Una porzione di materia costituita da una sostanza la cui composizione chimica non varia da un punto all altro si dice costituita
STATI DI AGGREGAZIONE DELLA MATERIA E PROPRIETÀ DEI FLUIDI 14/01/2014 2 Una porzione di materia costituita da una sostanza la cui composizione chimica non varia da un punto all altro si dice costituita
Sommario della lezione 18. Proprietà colligative
 Sommario della lezione 18 Proprietà colligative Interazioni soluto-solvente Interazioni soluto-solvente La solubilità di un soluto in un particolare solvente dipende da: la natura delle particelle di solvente
Sommario della lezione 18 Proprietà colligative Interazioni soluto-solvente Interazioni soluto-solvente La solubilità di un soluto in un particolare solvente dipende da: la natura delle particelle di solvente
Stati di aggregazione della materia. GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti
 9. I Gas Farmacia Stati di aggregazione della materia GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti Stato solido Nello stato solido l energia di
9. I Gas Farmacia Stati di aggregazione della materia GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti Stato solido Nello stato solido l energia di
Teoria Cinetica Molecolare dei Gas Ideali
 Teoria Cinetica Molecolare dei Gas Ideali Un gas è composto da molecole molto lontane tra di loro in confronto alle loro dimensioni e possono essere considerate puntiformi, quindi prive di volume. Le molecole
Teoria Cinetica Molecolare dei Gas Ideali Un gas è composto da molecole molto lontane tra di loro in confronto alle loro dimensioni e possono essere considerate puntiformi, quindi prive di volume. Le molecole
Tecniche di purificazione
 Tecniche di purificazione Definizione Passaggio di stato di una sostanza dalla fase solida alla fase vapore, senza la formazione intermedia della fase liquida. Una sostanza solida sublima solo se la pressione
Tecniche di purificazione Definizione Passaggio di stato di una sostanza dalla fase solida alla fase vapore, senza la formazione intermedia della fase liquida. Una sostanza solida sublima solo se la pressione
Stati della materia. Una sostanza pura è una sostanza la cui composizione chimica non varia. Ossigeno. Acqua. Aria
 1. Una sostanza pura non deve necessariamente essere composta da un unico elemento chimico. 2. Anche una miscela di più sostanze può essere considerata una sostanza pura purchè abbia una composizione chimica
1. Una sostanza pura non deve necessariamente essere composta da un unico elemento chimico. 2. Anche una miscela di più sostanze può essere considerata una sostanza pura purchè abbia una composizione chimica
GLI STATI DI AGGREGAZIONE DELLA MATERIA DIAGRAMMI DI STATO DI COMPONENTI PURI
 GLI STATI DI AGGREGAZIONE DELLA MATERIA DIAGRAMMI DI STATO DI COMPONENTI PURI Forti interazioni intermolecolari SOLIDI Assenza di libero movimento delle molecole Volume e forma propria Rigidi e incomprimibili
GLI STATI DI AGGREGAZIONE DELLA MATERIA DIAGRAMMI DI STATO DI COMPONENTI PURI Forti interazioni intermolecolari SOLIDI Assenza di libero movimento delle molecole Volume e forma propria Rigidi e incomprimibili
GAIALAB:INCONTRIAMO L AMBIENTE IN LABORATORIO
 LABORATORIO DI CHIMICA Dal ghiaccio al vapore: scoperta guidata delle proprietà dell acqua Ogni elemento chimico può esistere allo stato gassoso, allo stato liquido e in quello solido. Il passaggio da
LABORATORIO DI CHIMICA Dal ghiaccio al vapore: scoperta guidata delle proprietà dell acqua Ogni elemento chimico può esistere allo stato gassoso, allo stato liquido e in quello solido. Il passaggio da
PROPRIETÁ DEI LIQUIDI
 PROPRIETÁ DEI LIQUIDI Viscosità: resistenza di un fluido al flusso, ossia scorrimento relativo delle molecole Una semplice misura (indiretta) è il tempo di efflusso di un dato volume di liquido attraverso
PROPRIETÁ DEI LIQUIDI Viscosità: resistenza di un fluido al flusso, ossia scorrimento relativo delle molecole Una semplice misura (indiretta) è il tempo di efflusso di un dato volume di liquido attraverso
IL CALORE. Il calore. Esperimento di Joule. Il calore
 l calore l calore Q è energia che sta transitando da un sistema all altro, e compare ogni volta che c è un dislivello di temperatura. L CALORE l corpo più caldo cede parte della sua energia interna al
l calore l calore Q è energia che sta transitando da un sistema all altro, e compare ogni volta che c è un dislivello di temperatura. L CALORE l corpo più caldo cede parte della sua energia interna al
La misura della temperatura
 Calore e temperatura 1. La misura della temperatura 2. La dilatazione termica 3. La legge fondamentale della termologia 4. Il calore latente 5. La propagazione del calore La misura della temperatura La
Calore e temperatura 1. La misura della temperatura 2. La dilatazione termica 3. La legge fondamentale della termologia 4. Il calore latente 5. La propagazione del calore La misura della temperatura La
LA MATERIA E IL MODELLO PARTICELLARE
 LA MATERIA E IL MODELLO PARTICELLARE - Gli oggetti che ci circondano sono costituiti di materia. - Come possiamo definire la materia? La materia è tutto ciò che possiede una massa e occupa un volume. -
LA MATERIA E IL MODELLO PARTICELLARE - Gli oggetti che ci circondano sono costituiti di materia. - Come possiamo definire la materia? La materia è tutto ciò che possiede una massa e occupa un volume. -
Stati d aggregazione della materia
 Stati d aggregazione della materia SOLIDO: Forma e volume propri. GASSOSO: Forma e volume del recipiente in cui è contenuto. LIQUIDO: Forma del recipiente in cui è contenuto, ma volume proprio. Parametri
Stati d aggregazione della materia SOLIDO: Forma e volume propri. GASSOSO: Forma e volume del recipiente in cui è contenuto. LIQUIDO: Forma del recipiente in cui è contenuto, ma volume proprio. Parametri
Chimica. Gli stati di aggregazione della materia
 Chimica Gli stati di aggregazione della materia La materia si presenta in natura in tre modelli di aggregazione dei suoi costituenti (atomi, molecole o ioni): solido, liquido, aeriforme. Da un punto di
Chimica Gli stati di aggregazione della materia La materia si presenta in natura in tre modelli di aggregazione dei suoi costituenti (atomi, molecole o ioni): solido, liquido, aeriforme. Da un punto di
Appunti di termodinamica che completano il libro di testo
 Appunti di termodinamica che completano il libro di testo Forze intermolecolari Gas perfetto Dal punto di vista macroscopico un gas perfetto è un gas rarefatto a una temperatura molto maggiore di quella
Appunti di termodinamica che completano il libro di testo Forze intermolecolari Gas perfetto Dal punto di vista macroscopico un gas perfetto è un gas rarefatto a una temperatura molto maggiore di quella
L equilibrio dei gas. Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura
 Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Gli stati della materia
 Gli stati della materia Gli stati della materia Esperimento Gli stati della materia Proprietà fondamentali della materia 1. La materia è discontinua 2. La molecole che compongono la materia sono in continuo
Gli stati della materia Gli stati della materia Esperimento Gli stati della materia Proprietà fondamentali della materia 1. La materia è discontinua 2. La molecole che compongono la materia sono in continuo
Fluidi (FMLP: Cap. 11 Meccanica dei fluidi)
 In un fluido Fluidi (FMLP: Cap. 11 Meccanica dei fluidi) le molecole non sono vincolate a posizioni fisse a differenza di quello che avviene nei solidi ed in particolare nei cristalli Il numero di molecole
In un fluido Fluidi (FMLP: Cap. 11 Meccanica dei fluidi) le molecole non sono vincolate a posizioni fisse a differenza di quello che avviene nei solidi ed in particolare nei cristalli Il numero di molecole
Soluzioni degli esercizi del testo
 Klein, Il racconto della chimica Soluzioni degli esercizi del testo Lavorare con le mappe 1. 2. Risposta aperta. 4. Risposta aperta. 5. Risposta aperta. Conoscenze e abilità 1. B 2. A 3. A 4. A 5. A 6.
Klein, Il racconto della chimica Soluzioni degli esercizi del testo Lavorare con le mappe 1. 2. Risposta aperta. 4. Risposta aperta. 5. Risposta aperta. Conoscenze e abilità 1. B 2. A 3. A 4. A 5. A 6.
ESERCIZI ESERCIZI. 1) L equazione di stato valida per i gas perfetti è: a. PV = costante b. PV = nrt c. PV = znrt d. RT = npv Soluzione
 ESERCIZI 1) L equazione di stato valida per i gas perfetti è: a. PV = costante b. PV = nrt c. PV = znrt d. RT = npv 2) In genere, un gas si comporta idealmente: a. ad elevate pressioni e temperature b.
ESERCIZI 1) L equazione di stato valida per i gas perfetti è: a. PV = costante b. PV = nrt c. PV = znrt d. RT = npv 2) In genere, un gas si comporta idealmente: a. ad elevate pressioni e temperature b.
STATO LIQUIDO. Sono presenti forze intermolecolari ma in misura minore rispetto ai solidi. Le molecole possono scorrere tra loro
 Lo stato liquido STATO LIQUIDO Sono presenti forze intermolecolari ma in misura minore rispetto ai solidi Le molecole possono scorrere tra loro Ordine delle molecole solo a corto raggio Viscosità Resistenza
Lo stato liquido STATO LIQUIDO Sono presenti forze intermolecolari ma in misura minore rispetto ai solidi Le molecole possono scorrere tra loro Ordine delle molecole solo a corto raggio Viscosità Resistenza
Le soluzioni e il loro comportamento
 2017 Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli soluto / volume soluzione MOLALITA (m) moli soluto
2017 Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli soluto / volume soluzione MOLALITA (m) moli soluto
Un sistema è una porzione delimitata di materia.
 1. La materia e le sue caratteristiche Un sistema è una porzione delimitata di materia. 1. La materia e le sue caratteristiche Gli stati fisici in cui la materia si può trovare sono: solido; liquido; aeriforme.
1. La materia e le sue caratteristiche Un sistema è una porzione delimitata di materia. 1. La materia e le sue caratteristiche Gli stati fisici in cui la materia si può trovare sono: solido; liquido; aeriforme.
TERMODINAMICA E TERMOCHIMICA
 TERMODINAMICA E TERMOCHIMICA Termodinamica E la scienza delle relazioni tra calore ed altre forme di energia; determina quali processi chimici e fisici sono spontanei; non prende in considerazione la variabile
TERMODINAMICA E TERMOCHIMICA Termodinamica E la scienza delle relazioni tra calore ed altre forme di energia; determina quali processi chimici e fisici sono spontanei; non prende in considerazione la variabile
STATO LIQUIDO. Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso
 STATO LIQUIDO Caratteristiche: Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso intermolecolare I legami intermolecolari sono responsabili
STATO LIQUIDO Caratteristiche: Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso intermolecolare I legami intermolecolari sono responsabili
Legge di stato dei gas ideali
 Legge di stato dei gas ideali Le leggi di Boyle e Charles/Gay Lussac possono essere riunite, insieme al principio di Avogadro, in un'unica equazione che correla fra loro P, V, T e numero di moli di un
Legge di stato dei gas ideali Le leggi di Boyle e Charles/Gay Lussac possono essere riunite, insieme al principio di Avogadro, in un'unica equazione che correla fra loro P, V, T e numero di moli di un
STATO GASSOSO. parte I a. - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio
 STATO GASSOSO parte I a - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio GAS PERFETTI molecole puntiformi (volume proprio nullo) urti elastici (stesse particelle prima e dopo l'urto) parametri
STATO GASSOSO parte I a - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio GAS PERFETTI molecole puntiformi (volume proprio nullo) urti elastici (stesse particelle prima e dopo l'urto) parametri
Corso di Macromolecole LO STATO VETROSO
 LO STATO VETROSO er studiare lo stato fisico del sistema ed introdurre quindi la discussione sullo stato vetroso si può descrivere come esso varia al variare della temperatura. Ø partendo dal cristallo
LO STATO VETROSO er studiare lo stato fisico del sistema ed introdurre quindi la discussione sullo stato vetroso si può descrivere come esso varia al variare della temperatura. Ø partendo dal cristallo
CO 2 NO 2 SO 2 CH 4. He Ne Ar H 2 N 2 O 2 Cl 2
 Lo stato gassoso I gas sono materiali caratterizzati dalla mancanza di forma e volume propri. Assumono la forma ed il volume del recipiente che li contiene e sono facilmente comprimibili. Le sostanze gassose
Lo stato gassoso I gas sono materiali caratterizzati dalla mancanza di forma e volume propri. Assumono la forma ed il volume del recipiente che li contiene e sono facilmente comprimibili. Le sostanze gassose
Liquidi e Solidi. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Liquidi e Solidi Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. 1 Confronto fra Gas, Liquidi e Solidi I Gas sono fluidi comprimibili. Le loro molecole sono ben
Liquidi e Solidi Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. 1 Confronto fra Gas, Liquidi e Solidi I Gas sono fluidi comprimibili. Le loro molecole sono ben
Le soluzioni e il loro comportamento
 A. A. 2016 2017 1 CCS Scienze geologiche CCS Biologia Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli
A. A. 2016 2017 1 CCS Scienze geologiche CCS Biologia Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli
Termodinamica CAMBIAMENTI DI STATO
 FISICA Termodinamica CAMBIAMENTI DI STATO Autore: prof. Pappalardo Vincenzo docente di Matematica e Fisica STRUTTURA DELLA MATERIA Le idee di Democrito (460 a.c. 370 a.c) sulla costituzione atomica della
FISICA Termodinamica CAMBIAMENTI DI STATO Autore: prof. Pappalardo Vincenzo docente di Matematica e Fisica STRUTTURA DELLA MATERIA Le idee di Democrito (460 a.c. 370 a.c) sulla costituzione atomica della
La vita dipende dall acqua
 La vita dipende dall acqua La vita sulla Terra dipende dalle proprietà dell acqua. L acqua è il composto più abbondante negli esseri viventi. Le proprietà dell acqua derivano dalla sua particolare struttura
La vita dipende dall acqua La vita sulla Terra dipende dalle proprietà dell acqua. L acqua è il composto più abbondante negli esseri viventi. Le proprietà dell acqua derivano dalla sua particolare struttura
SOLUZIONI E CONCENTRAZIONE
 SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
Lezione n. 4. La superficie liquida
 Lezione n. 4 La superficie liquida Limiti di fase Diagramma di stato: rappresentazione delle regioni di pressione e temperatura in cui le fasi sono stabili da un punto di vista termodinamico. Confini di
Lezione n. 4 La superficie liquida Limiti di fase Diagramma di stato: rappresentazione delle regioni di pressione e temperatura in cui le fasi sono stabili da un punto di vista termodinamico. Confini di
Energia e trasformazioni spontanee
 Energia e trasformazioni spontanee Durante le trasformazioni (sia chimiche che fisiche) la materia acquista o cede energia. La termodinamica è quella scienza che studia le variazioni di energia in una
Energia e trasformazioni spontanee Durante le trasformazioni (sia chimiche che fisiche) la materia acquista o cede energia. La termodinamica è quella scienza che studia le variazioni di energia in una
LE PROPRIETA DEI GAS
 LE PROPRIETA DEI GAS Per definire lo stato di un gas, bisogna definire le tre grandezze fisiche, chiamate variabili di stato, che lo caratterizzano: volume, pressione e temperatura. E' possibile descrivere
LE PROPRIETA DEI GAS Per definire lo stato di un gas, bisogna definire le tre grandezze fisiche, chiamate variabili di stato, che lo caratterizzano: volume, pressione e temperatura. E' possibile descrivere
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 2. La carta d identità delle sostanze SEGUI LA MAPPA descrivere atomica 1 descrivere
Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 2. La carta d identità delle sostanze SEGUI LA MAPPA descrivere atomica 1 descrivere
Dinamica delle reazioni chimiche (attenzione: mancano i disegni)
 Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
Soluzioni unità 3, modulo D del libro
 Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
approfondimento Fasi e cambiamenti di fase
 approfondimento Fasi e cambiamenti di fase Gas ideali e gas reali Teoria cinetica dei gas e conseguenze Cambiamenti di fase e conservazione della energia Gas ideali e gas reali In un gas ideale: l interazione
approfondimento Fasi e cambiamenti di fase Gas ideali e gas reali Teoria cinetica dei gas e conseguenze Cambiamenti di fase e conservazione della energia Gas ideali e gas reali In un gas ideale: l interazione
Fisica Applicata, Area Infermieristica, M. Ruspa REGIMI DI MOTO DI UN FLUIDO REALE
 REGIMI DI MOTO DI UN FLUIDO REALE MOTO LAMINARE O TURBOLENTO? Dipende dalla velocita di scorrimento del fluido! VELOCITA CRITICA La velocita critica per un fluido di viscosita η e di densita d che scorre
REGIMI DI MOTO DI UN FLUIDO REALE MOTO LAMINARE O TURBOLENTO? Dipende dalla velocita di scorrimento del fluido! VELOCITA CRITICA La velocita critica per un fluido di viscosita η e di densita d che scorre
Laura Girola Liceo scientifico G.B.Grassi Saronno (VA) CLASSE PRIMA
 Laura Girola Liceo scientifico G.B.Grassi Saronno (VA) CLASSE PRIMA 1 CHIMICA 2 ESERCIZI SULLE UNITA DI MISURA 3 4 Le caratteristiche di un corpo Ogni corpo possiede proprietà fisiche definite da grandezze
Laura Girola Liceo scientifico G.B.Grassi Saronno (VA) CLASSE PRIMA 1 CHIMICA 2 ESERCIZI SULLE UNITA DI MISURA 3 4 Le caratteristiche di un corpo Ogni corpo possiede proprietà fisiche definite da grandezze
Densita. FLUIDI : liquidi o gas. macroscop.:
 6-SBAC Fisica 1/10 FLUIDI : liquidi o gas macroscop.: microscop.: sostanza che prende la forma del contenitore che la occupa insieme di molecole tenute insieme da deboli forze di coesione (primi vicini)
6-SBAC Fisica 1/10 FLUIDI : liquidi o gas macroscop.: microscop.: sostanza che prende la forma del contenitore che la occupa insieme di molecole tenute insieme da deboli forze di coesione (primi vicini)
Stati di aggregazione della materia, la pressione e i fluidi in quiete
 Stati di aggregazione della materia, la pressione e i fluidi in quiete Una porzione di materia costituita da una sostanza la cui composizione chimica non varia da un punto all altro si dice costituita
Stati di aggregazione della materia, la pressione e i fluidi in quiete Una porzione di materia costituita da una sostanza la cui composizione chimica non varia da un punto all altro si dice costituita
I legami fra molecole nei liquidi non sono forti ed esse possono fluire Riducendo l agitazione termica. legami tra molecole più stabili
 I legami fra molecole nei liquidi non sono forti ed esse possono fluire Riducendo l agitazione termica legami tra molecole più stabili formazione una massa rigida Una disposizione ordinata delle molecole
I legami fra molecole nei liquidi non sono forti ed esse possono fluire Riducendo l agitazione termica legami tra molecole più stabili formazione una massa rigida Una disposizione ordinata delle molecole
Esame del
 Chimica Generale ed Inorganica Esame del 08-02-2011 Chimica Generale Mazzi 1) La teoria VSEPR afferma che quando un atomo forma legami covalenti: A. tutti i suoi elettroni si respingono e si dispongono
Chimica Generale ed Inorganica Esame del 08-02-2011 Chimica Generale Mazzi 1) La teoria VSEPR afferma che quando un atomo forma legami covalenti: A. tutti i suoi elettroni si respingono e si dispongono
ATOMO. Viene considerato Elemento fondamentale della materia (solidi, liquidi e gas)
 http://riccardocavallaro.weebly.com ATOMO Viene considerato Elemento fondamentale della materia (solidi, liquidi e gas) Il tipo di atomi e la loro combinazione determina il tipo di materiale/materia. Struttura
http://riccardocavallaro.weebly.com ATOMO Viene considerato Elemento fondamentale della materia (solidi, liquidi e gas) Il tipo di atomi e la loro combinazione determina il tipo di materiale/materia. Struttura
Passaggi di stato. Prof.ssa Paravizzini Maria Rosa
 Passaggi di stato Prof.ssa Paravizzini Maria Rosa Proprietà e trasformazioni fisiche Le proprietà fisiche di una sostanza possono essere colte attraverso i sensi (colore, odore, consistenza al tatto) o
Passaggi di stato Prof.ssa Paravizzini Maria Rosa Proprietà e trasformazioni fisiche Le proprietà fisiche di una sostanza possono essere colte attraverso i sensi (colore, odore, consistenza al tatto) o
Richiami di Fisica, Meccanica e Termodinamica Introduzione al Corso Prof. Ing. Giulio Vannucci
 CORSO DI FISICA TECNICA Richiami di Fisica, Meccanica e Termodinamica Introduzione al Corso Prof. Ing. Giulio Vannucci RICHIAMI DI FISICA, MECCANICA E TERMODINAMICA Nozioni di unità di misura Elementi
CORSO DI FISICA TECNICA Richiami di Fisica, Meccanica e Termodinamica Introduzione al Corso Prof. Ing. Giulio Vannucci RICHIAMI DI FISICA, MECCANICA E TERMODINAMICA Nozioni di unità di misura Elementi
Centrali termiche: per la conduzione ci vuole la patente Obbligo del patentino di abilitazione di 2 grado per
 Centrali termiche: per la conduzione ci vuole la patente Obbligo del patentino di abilitazione di 2 grado per la conduzione degli impianti termici sopra i 232 kw Ing. Diego Danieli Libero Professionista
Centrali termiche: per la conduzione ci vuole la patente Obbligo del patentino di abilitazione di 2 grado per la conduzione degli impianti termici sopra i 232 kw Ing. Diego Danieli Libero Professionista
GLI STATI DI DI AGGREGAZIONE DELLA MATERIA. Dispense di Chimica Fisica per Biotecnologie I Anno- Dr.ssa R. Terracciano
 GLI STATI DI DI AGGREGAZIONE DELLA MATERIA GLI STATI DI AGGREGAZIONE DELLA MATERIA La materia esiste nei tre stati solido liquido e gassoso. Un solido ha volume e forma propri. Un liquido ha volume proprio,
GLI STATI DI DI AGGREGAZIONE DELLA MATERIA GLI STATI DI AGGREGAZIONE DELLA MATERIA La materia esiste nei tre stati solido liquido e gassoso. Un solido ha volume e forma propri. Un liquido ha volume proprio,
Viscosità Energia superficiale. Pressione di vapore. Liquido + Liquido. Liquido + Gas. Liquido + Solido
 Liquidi puri (proprietà) Viscosità Energia superficiale Pressione di vapore Liquidi Temperatura di fusione Temperatura di ebollizione soluzioni (proprietà) Liquido + Liquido Liquido + Gas Liquido + Solido
Liquidi puri (proprietà) Viscosità Energia superficiale Pressione di vapore Liquidi Temperatura di fusione Temperatura di ebollizione soluzioni (proprietà) Liquido + Liquido Liquido + Gas Liquido + Solido
LEGAMI INTERMOLECOLARI LEGAMI INTERMOLECOLARI
 I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
Il binomio di van t Hoff Le proprietà colligative dipendono dal numero di particelle effettivamente presenti nella soluzione. Nel caso in cui il solut
 Proprietà colligative di soluzioni ideali Si definiscono proprietà colligative alcune proprietà delle soluzioni indipendenti dalla natura del soluto ma che dipendono soltanto dal numero delle particelle
Proprietà colligative di soluzioni ideali Si definiscono proprietà colligative alcune proprietà delle soluzioni indipendenti dalla natura del soluto ma che dipendono soltanto dal numero delle particelle
Richiami di Calorimetria Introduzione al Corso Prof. Ing. Giulio Vannucci
 CORSO DI FISICA TECNICA Richiami di Calorimetria Introduzione al Corso Prof. Ing. Giulio Vannucci Calorimetria Calore Il calore è una forma di energia che si trasferisce tra due corpi, o tra due parti
CORSO DI FISICA TECNICA Richiami di Calorimetria Introduzione al Corso Prof. Ing. Giulio Vannucci Calorimetria Calore Il calore è una forma di energia che si trasferisce tra due corpi, o tra due parti
Studente. Matricola. Anno di corso. Esame Corso di Fisica AA /01/2017 Corso di Laurea in Scienze Geologiche
 Teoria: Esercizi: Quesiti: Studente Matricola Anno di corso Esame Corso di Fisica AA. 2015-2016 16/01/2017 Corso di Laurea in Scienze Geologiche Griglia quesiti risposta multipla A B C D 1 2 3 4 5 6 7
Teoria: Esercizi: Quesiti: Studente Matricola Anno di corso Esame Corso di Fisica AA. 2015-2016 16/01/2017 Corso di Laurea in Scienze Geologiche Griglia quesiti risposta multipla A B C D 1 2 3 4 5 6 7
STATO GASSOSO. parte I a. - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio
 STATO GASSOSO parte I a - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio GAS PERFETTI molecole puntiformi (volume proprio nullo) urti elastici (stesse particelle prima e dopo l'urto) parametri
STATO GASSOSO parte I a - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio GAS PERFETTI molecole puntiformi (volume proprio nullo) urti elastici (stesse particelle prima e dopo l'urto) parametri
I liquidi. Viscosità Energia superficiale Pressione di vapore Temperatura di fusione Temperatura di ebollizione. Liquidi puri (proprietà) Liquidi
 I liquidi Liquidi puri (proprietà) Viscosità Energia superficiale ressione di vapore emperatura di fusione emperatura di ebollizione Liquidi Soluzioni (proprietà) Liquido id + Liquidoid Liquido + Gas Liquido
I liquidi Liquidi puri (proprietà) Viscosità Energia superficiale ressione di vapore emperatura di fusione emperatura di ebollizione Liquidi Soluzioni (proprietà) Liquido id + Liquidoid Liquido + Gas Liquido
Ogni sostanza è composta da un grandissimo numero di molecole soggette a forze di attrazione reciproche più o meno intense (coesione molecolare o più
 I Fluidi Ogni sostanza è composta da un grandissimo numero di molecole soggette a forze di attrazione reciproche più o meno intense (coesione molecolare o più comunemente forze di coesione) che caratterizzano
I Fluidi Ogni sostanza è composta da un grandissimo numero di molecole soggette a forze di attrazione reciproche più o meno intense (coesione molecolare o più comunemente forze di coesione) che caratterizzano
