GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato solido
|
|
|
- Raffaello Cicci
- 5 anni fa
- Visualizzazioni
Transcript
1 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato solido
2 Lo stato solido Nello stato solido, le forze attrattive tra le particelle (ioni, atomi, molecole) prevalgono largamente sull effetto dell agitazione termica. Libertà di movimento quasi completamente soppressa: rimangono possibili solo oscillazioni intorno alla posizione di equilibrio (moti vibrazionali). Tutte le sostanze si possono trovare allo stato solido; l intervallo di temperature in cui ciò si verifica dipende dalla forze di interazione tra le particelle. Più deboli sono le forze attrattive e più bassa sarà la temperatura alla quale si ha il passaggio allo stato liquido. Caratteristiche incomprimibilità, rigidità, forma propria 2
3 SOLIDI CRISTALLINI struttura ordinata AMORFI struttura disordinata Solidi AMORFI Sono caratterizzati da una disposizione disordinata degli atomi (ioni, molecole) paragonabile a quella presente nei liquidi. Hanno proprietà ottiche, meccaniche, elettriche ISOTROPE. Non sono caratterizzati da una temperatura di fusione ben definita, ma le proprietà variano gradualmente all aumentare della temperatura. Tipico esempio di solidi amorfi sono i VETRI. 3
4 Solidi CRISTALLINI Sono caratterizzati da una disposizione ordinata degli atomi (ioni, molecole) secondo un ben definito RETICOLO CRISTALLINO. Nei solidi cristallini esiste un ordine a lungo raggio, vale a dire un ordine che si estende su una scala molto maggiore delle dimensioni atomiche (molecolari) degli elementi del reticolo. Caratteristica dei reticoli cristallini è la CELLA ELEMENTARE, vale a dire l unità strutturale minima la cui ripetizione nelle tre dimensioni dello spazio può generare l intero reticolo. 4
5 Solidi CRISTALLINI In genere le proprietà ottiche, meccaniche, elettriche sono diverse nelle varie direzioni: ANISOTROPIA. Presentano una ben definita temperatura di FUSIONE, accompagnata da una netta variazione delle proprietà fisiche. Hanno superfici piatte e ben definite, chiamate FACCE, che formano angoli ben definiti tra loro. Alcuni solidi si presentano come agglomerati, all apparenza amorfi, di numerosissimi cristalli microscopici chiamati cristalliti o grani. Tali solidi sono chiamati POLICRISTALLINI e hanno la caratteristica di essere isotropi, in quanto, anche se ogni cristallite è anisotropo, dato che ciscuno di essi è orientato in modo casuale, le proprietà dell insieme risultano uguali in tutte le direzioni. Sono policristallini tutti i solidi metallici. 5
6 Il reticolo cristallino c c a b α γ b β a La cella unitaria o elementare è l unità più piccola del reticolo che, ripetuta nelle tre dimensioni dello spazio genera l intero cristallo. Gli spigoli della cella elementare, che formano tra loro gli angoli α, β e γ definiscono le direzioni degli ASSI CRISTALLOGRAFICI. Le lunghezze a, b e c sono i PERIODI di IDENTITA. I vertici della cella elementare sono chiamati NODI e sono occupati da atomi, molecole o ioni. 6
7 I reticoli di Bravais Tutti i reticoli cristallini noti si possono ricondurre a 14 tipi fondamentali, (reticoli di Bravais), raggruppabili in base alle loro caratteristiche di simmetria in 7 gruppi o SISTEMI CRISTALLOGRAFICI: 1. Triclino 2. Monoclino 3. Ortorombico 4. Esagonale 5. Romboedrico 6. Tetragonale 7. Cubico 7
8 8
9 Celle unitarie dei 14 reticoli di Bravais P = cella primitiva ( o semplice) FC = a facce centrate CC = a corpo centrato BC = a basi centrate 9
10 10
11 Allotropia, polimorfismo e isomorfismo Si parla di POLIMORFISMO quando una sostanza, cristallizzando in condizioni diverse, dà origine a cristalli con struttura reticolare diversa. Se la sostanza che dà origine a cristalli diversi è una specie allo stato elementare, si parla più correttamente di ALLOTROPIA. Esistono anche casi di sostanze diverse che possono cristallizzare nella stessa forma, dando cristalli simili: tale fenomeno è definito ISOMORFISMO. Es. di sostanze polimorfe CaCO 3 : calcite (romboedrica) aragonite (ortorombica) SiO 2 : quarzo (α romboedrica, β esagonale) tridimite (α rombica, β esagonale) cristobalite (α tetragonale, β cubica) 11
12 Es. di sostanze allotropiche zolfo carbonio α (rombica) β (esagonale) diamante (cubica a facce centrate) grafite (struttura a strati) grafite diamante Le diverse forme polimorfe o allotropiche hanno diverse proprietà fisiche diverse. Pressione e temperatura determinano le condizioni di stabilità di una fase o dell altra. zolfo ( P= 1atm) α rombica stabile al di sotto di 95.5 C β esagonale al di sopra 12
13 Isomorfismo L analogia delle strutture reticolari è propria di sostanze formate da unità strutturali analoghe per forma e dimensioni. Es. carbonati Mg 2+ r = 0.65 Å Zn 2+ r = 0.74 Å Fe 2+ r = 0.75 Å Mn 2+ r = 0.80 Å Alcune sostanze isomorfe, solidificando insieme possono dare luogo a cristalli misti, cioè ad una sola fase cristallina in cui sono presente entrambe. 13
14 Solidi cristallini Formano solidi cristallini: elementi metallici (Na, Fe, Co,.), leghe metalliche (bronzo, ottone, ), elementi non metallici (iodio, zolfo, fosforo, argo), composti ionici (NaCl, CaCO 3, CaSO 4,. ). Si possono classificare in base al legame che tiene uniti i loro atomi (ioni, molecole). Classificazione solidi cristallini Solidi ionici: reciproca attrazione tra cationi e anioni (elettrostatica). Solidi covalenti: atomi legati ai loro vicini mediante legami covalenti. Solidi molecolari: insiemi di molecole vincolate nella loro posizione da forze intermolecolari. Solidi metallici: atomi legati insieme da legame metallico. 14
15 Strutture cristalline compatte Impacchettamento sfere identiche in modo da ottenere la massima densità Atomi nei metalli possono essere rappresentati con sferette rigide tutte uguali; Occupazione massima (più efficiente) dello spazio: strutture cristalline compatte; Coordinazione 6 per la massima occupazione dello spazio delle sferette nello stesso piano (reticolo piano a maglie triangolari); Sovrapposizione di piani di sferette per rappresentare il solido. 15
16 Strutture cristalline compatte Come si può ottenere il massimo impacchettamento? Sfere leggermente separate le une dalle altre per chiarezza 16
17 Strutture cristalline compatte Strato a + strato b (sferette nei vuoti dello strato a): struttura ESAGONALE COMPATTA 17
18 Strutture cristalline compatte Strato a + strato b (sferette nei vuoti dello strato a): struttura ESAGONALE COMPATTA N coordinazione 12, le sfere occupano 74% del volume a disposizione 18
19 Strutture cristalline compatte Strato a + strato b (sferette nei vuoti dello strato a) + strato c (sferette nei vuoti dello strato b): struttura CUBICA COMPATTA (cubica a facce centrate) 19
20 Strutture cristalline compatte Strato a + strato b (sferette nei vuoti dello strato a) + strato c (sferette nei vuoti dello strato b): struttura CUBICA COMPATTA (cubica a facce centrate) N coordinazione 12, le sfere occupano 74% del volume a disposizione 20
21 Strutture cristalline meno compatte Dall impacchettamento in tre dimensioni di piani in cui le sferette sono disposte secondo una matrice quadrata, si ottengono strutture cristalline meno compatte di quelle viste in precedenza, ma ancora caratterizzate da elevata densità. Si realizzano così le strutture: CUBICA A CORPO CENTRATO CUBICA SEMPLICE 21
22 Strutture cristalline meno compatte CUBICA A CORPO CENTRATO Assumono questa struttura: Li, Na, K, Rb, V, Cr, Fe, Mo N coordinazione 8, le sfere occupano 68% volume a disposizione 22
23 Strutture cristalline meno compatte CUBICA SEMPLICE (SC) solo per il Po (a T e P ambiente) N coordinazione 6 23
24 Strutture cristalline La struttura compatta che un metallo adotta è quella che permette di raggiungere lo stato di minore energia e dipende dalla sua struttura elettronica. Esagonale compatta n.c. 12 Be, Mg, Ca, Zn, Cd Cubica a facce centrate n.c. 12 Ni, Pt, Pd, Cu, Ag, Au, Al, Pb Cubica a corpo centrato n.c. 8 Li, Na, K, Rb, Cs, Cr, Mo 24
25 Numero di atomi per cella elementare La cella elementare è l unità strutturale minima attraverso cui è possibile costruire l intera struttura del cristallo. Un atomo può appartenere ad una sola cella, oppure essere condiviso da più celle elementari. Per calcolare il numero di atomi presenti nella cella elementare, 1 se appartiene a 1 sola cella; 1/2 se è condiviso tra 2 celle; 1/4 se è condiviso tra 4 celle; 1/8 se è condiviso tra 8 celle 25
26 Le strutture cristalline di molti composti ionici di tipo AB, AB 2 o A 2 B sono facilmente derivabili da quelle a massimo impacchettamento. Ogni ione deve essere circondato dal massimo numero di ioni di segno opposto e la distanza tra ione positivo e ione negativo deve essere la minima possibile Es: atomi A disposti secondo struttura compatta, atomi B occupano le cavità esistenti tra le sfere A Ad ogni sfera sono associati 2 siti tetraedrici Ad ogni sfera è associato 1 sito ottaedrico Molti solidi ionici sono rappresentabili con strutture compatte in cui gli anioni si dispongono in modo da occupare lo spazio nel modo più efficiente e i cationi si dispongono negli interstizi del reticolo formato dagli anioni, occupando siti di coordinazione diversa a seconda del rapporto tra i RAGGI IONICI: r+/r-. Numero di coordinazione: numero massimo di anioni che è possibile 26 porre a contatto con un catione
27 I solidi ionici Modello di impacchettamento di sfere rigide ancora utilizzabile, ma: dimensioni (raggio ionico) di anioni e cationi differenti; elettroneutralità del solido; nella cella unitaria, deve essere rispettato il rapporto stechiometrico, M z x Az- y. 27
28 Reticolo ionico del cloruro di sodio 28
29 Le proprietà dei composti ionici Nei composti ionici è presente un legame elettrostatico tra ioni di carica opposta molto forte (elevata energia di coesione). Il legame ionico, a differenza di quello covalente, è adirezionale il numero di ioni di carica opposta che circondano un dato ione dipende da fattori geometrici Danno origine a solidi cristallini Hanno alte temperature di fusione Sono poco volatili Sono ben solubili in acqua Sono insolubili in solventi apolari Sono isolanti allo stato solido Sono conduttori allo stato fuso Sono duri, ma fragili. 29
30 I solidi ionici sono duri ma fragili!! DURI forza necessaria per distorcere il reticolo rilevante a causa dell elevata energia di legame tra gli ioni FRAGILI una volta provocata la deformazione si spacca con facilità. 30
31 I solidi a reticolo covalente Se le particelle (in genere atomi) che costituiscono un cristallo sono legati tra di loro da legami covalenti, allora i corrispondenti solidi sono detti a reticolo covalente. L energia di coesione è molto elevata, per cui tali solidi sono poco volatili, hanno temperatura di fusione elevata, sono molto duri e poco comprimibili ed inoltre, essendo il legame covalente direzionale, mostrano un comportamento fragile. Hanno proprietà analoghe a quelle dei solidi ionici ma si differenziano da questi perché presentano una conducibilità elettrica piuttosto bassa. Struttura cristallina del diamante: Ogni atomo di C è legato ad altri 4 atomi attraverso un legame covalente Struttura cubica a facce centrate ALTRI ESEMPI: Si, Ge, SiO 2, SiC 31
32 I solidi molecolari Nei cristalli molecolari l unità che si ripete nel reticolo è costituito da una molecola o da un atomo chimicamente identificabile. I legami che si formano sono dovuti a forze di Van der Waals ai quali si possono sovrapporre legami a ponte di idrogeno. Se non sono presenti legami ad idrogeno tali solidi sono molto volatili e possono sublimare a pressione atmosferica (I 2 ). Sono facilmente deformabili e buoni isolanti elettrici. ALCUNI ESEMPI: H 2 O, CO 2, S 8, I 2 32
33 I solidi metallici Sono solidi policristallini (isotropi) caratterizzati da buona conducibilità elettrica e termica, lucentezza, alta temperatura di fusione, elevata densità, ecc. (vedi legame metallico). Il reticolo cristallino è molto compatto per permettere l interazione degli elettroni più esterni di un atomo con il maggiore numero di nuclei. Reticoli esagonale compatto: Be, Mg, Zn, Cd, Ti Reticoli cubico a facce centrate: Ca, Sr, Cu, Ag, Au, Al, Ni, Pt, Pb Reticolo cubico a corpo centrato: Na, K, Fe, Cr, Ba 33
34 Strutture a strati o a catena Alcune sostanze solide hanno strutture cristalline con legami di tipo covalente o ionico in un piano (o lungo una direzione) mentre i piani reticolari (o le catene) sono tenuti insieme da forze di Van der Waals. Struttura cristallina della grafite: Atomi di C disposti ai vertici di esagoni regolari legati tra di loro da legami covalenti di tipo σ e da legami di tipo π (responsabili dell elevata conducibilità della grafite). I piani reticolari sono invece tenuti assieme da forze di Van der Waals. Comportamento anisotropo ed elevata sfaldabilità 34
35 Esempi di solidi ionici, covalenti, metallici e molecolari Solidi metallici Solidi ionici Cl-- Na+ Cl-- Il cloruro di sodio Na+ Cl-- Na+ Cl-- Na+ Cl-- Solidi molecolari Il ghiaccio Solidi covalenti Il diamante 35
36 Proprietà di solidi cristallini diversi Tipo di reticolo Componenti ai punti del reticolo Tipo di legame/ forze IM Proprietà Solido ionico Solido molecolare Solido metallico Ioni Molecole Atomi metallici Legame ionico Duri, p.f. elevato, isolanti Esempi NaCl, CaF 2, CaO, LiF Forze di V.d. W. Teneri, p.f. basso, isolanti H 2 O, CO 2, S 8, I 2, Xe Legami metallici Ampio intervallo di durezza e p.f., conduttori Li, Ag, Fe, Cu, Na, Solido a reticolo covalente Atomi di non metalli Legame covalente Duri, p.f. elevati, semiconduttori o isolanti C, Si 36
37 I difetti nei cristalli Si tratta di imperfezioni nella struttura cristallina, quasi sempre presenti nei cristalli reali (i reticoli cristallini perfetti sono solo modelli idealizzati). I difetti reticolari influenzano in modo determinante le proprietà macroscopiche. Si classificano in: 1) Difetti puntiformi: riguardano soltanto qualche posizione isolata del reticolo 2) Difetti lineari o dislocazioni: sono dovuti a piani del reticolo disposti irregolarmente 3) Difetti superficiali: si riferiscono a imperfezioni sulla superficie esterna di un cristallo o nella zona di transizione tra due microcristalli adiacenti, orientati in modo diverso. 37
38 Leghe metalliche In genere i metalli non sono mai impiegati allo stato puro ma in miscela con altri elementi la cui presenza, anche minima, può comportare variazioni rilevanti nelle proprietà del solido. Si definisce lega una miscela solida mono o polifasica, composta da 2 o più elementi, di cui almeno uno, il principale, è metallico. Una lega monofasica è costituita da un unica soluzione solida, mentre una lega polifasica è costituita da un miscuglio di soluzioni solide. Una soluzione solida si forma quando gli atomi di 2 o più elementi sono in grado di costituire un unica fase e di occupare in diverse proporzioni i siti di un reticolo cristallino. Le soluzioni solide possono essere di due tipi: soluzioni solide sostituzionali e soluzioni solide interstiziali. 38
39 Le leghe metalliche Soluzioni solide sostituzionali: nel reticolo del metallo base un certo numero di atomi viene sostituito da atomi di un diverso elemento che ne prendono il posto senza causare distorsioni nel reticolo stesso. Dimensioni degli atomi di A e B confrontabili (fino a ± 15%); le proprietà elettroniche sono simili; struttura cristallina simile dei metalli puri. Situazione tipica nelle leghe degli elementi di transizione 39
40 Le leghe metalliche Soluzioni solide interstiziali: gli atomi dell elemento aggiuntivo si sistemano negli interstizi del reticolo del metallo di base. Atomi di B molto più piccoli di A (meno del 60% del raggio atomico del metallo ospite): H, B, N, C. Acciai al carbonio: soluzioni interstiziali di C in Fe (2.06 % di C in Fe γ). Fe α struttura cubica a corpo centrato (fino a 910 C) Fe γ struttura cubica a facce centrate (temperature maggiori di 910 C) 40
41 A Alcune leghe metalliche Lega Ottone Bronzo Rame-nickel Peltro Lega per saldare Acciaio inox Composizione (% in peso) Fino al 40% di Zn in Cu 10% Sn e 5% Pb in Cu Ni in Cu (nelle monete, 25% Ni) 6% Sb e 1.5% Cu in Sn Stagno e piombo > 12% cromo in ferro 41
42 Riassumendo.. Solidi ionici - Legame forte; energia di coesione molto elevata ( KJ/mol); poco volatili; elevate T di fusione; duri e fragili; scarsa conducibilità allo stato solido ma buoni conduttori elettrici allo stato fuso; elevata solubilità in acqua. Solidi covalenti - Legame forte; energia di coesione elevata; poco volatili; elevate T di fusione; duri e fragili; scarsa conducibilità elettrica; insolubili nei comuni solventi. Solidi molecolari - Deboli interazioni di Van der Waals tra le molecole o tra gli atomi che costituiscono il reticolo; energia di coesione bassa; volatili (molti sublimano a P atm ); facilmente deformabili; isolanti elettrici; solubili in solventi che hanno caratteristiche di polarità simili. Solidi metallici - Legame forte; energia di coesione elevata; poco volatili; elevate T di fusione; elevata densità; duttili e malleabili: sopportano notevoli deformazioni permanenti prima di giungere alla rottura (i piani reticolari possono slittare gli uni sugli altri); elevata 42 conducibilità elettrica e termica; reticoli cristallini molto compatti..
LO STATO SOLIDO. Lo stato solido rappresenta uno dei tre stati di aggregazione della materia
 LO STATO SOLIDO Lo stato solido rappresenta uno dei tre stati di aggregazione della materia Nello stato solido le forze attrattive tra le particelle (ioni, atomi, molecole) prevalgono largamente sull effetto
LO STATO SOLIDO Lo stato solido rappresenta uno dei tre stati di aggregazione della materia Nello stato solido le forze attrattive tra le particelle (ioni, atomi, molecole) prevalgono largamente sull effetto
STRUTTURA E GEOMETRIA CRISTALLINA
 STRUTTURA E GEOMETRIA CRISTALLINA La struttura fisica dei materiali solidi dipende dalla disposizione degli atomi, ioni o molecole che compongono il solido e dalle forze che li legano fra loro. Quando
STRUTTURA E GEOMETRIA CRISTALLINA La struttura fisica dei materiali solidi dipende dalla disposizione degli atomi, ioni o molecole che compongono il solido e dalle forze che li legano fra loro. Quando
PARTE PRIMA ASPETTI GENERALI Capitolo 1 STRUTTURA E PROPRIET DEI MATERIALI 1. STRUTTURA DEI MATERIALI 1.1. Macrostruttura 1.2. Microstruttura 1.3.
 PARTE PRIMA ASPETTI GENERALI Capitolo 1 STRUTTURA E PROPRIET DEI MATERIALI 1. STRUTTURA DEI MATERIALI 1.1. Macrostruttura 1.2. Microstruttura 1.3. Struttura atomica o molecolare 1.4. Complementarita degli
PARTE PRIMA ASPETTI GENERALI Capitolo 1 STRUTTURA E PROPRIET DEI MATERIALI 1. STRUTTURA DEI MATERIALI 1.1. Macrostruttura 1.2. Microstruttura 1.3. Struttura atomica o molecolare 1.4. Complementarita degli
1. Talco (più tenero) 2. Gesso 3. Calcite 4. Fluorite 5. Apatite 6. Ortoclasio 7. Quarzo 8. Topazio 9. Corindone 10. Diamante (più duro)
 1. Lo stato solido Lo stato solido è uno stato condensato della materia; le particelle (che possono essere presenti come atomi, ioni o molecole) occupano posizioni fisse e la loro libertà di movimento
1. Lo stato solido Lo stato solido è uno stato condensato della materia; le particelle (che possono essere presenti come atomi, ioni o molecole) occupano posizioni fisse e la loro libertà di movimento
Struttura e geometria cristallina
 Struttura e geometria cristallina Descrizione macroscopica e microscopica Nello studio delle proprietà fisiche della materia è utile distinguere tra descrizione microscopica e descrizione macroscopica
Struttura e geometria cristallina Descrizione macroscopica e microscopica Nello studio delle proprietà fisiche della materia è utile distinguere tra descrizione microscopica e descrizione macroscopica
Capitolo 1 COSTITUZIONE DELLA MATERIA
 ITST J.F. KENNEDY - PN Disciplina: TECNOLOGIA MECCANICA Capitolo 1 COSTITUZIONE DELLA MATERIA A cura di Prof. Antonio Screti LA COSTITUZIONE DELLA MATERIA CARATTERISTICHE DEI MATERIALI METALLICI Le caratteristiche
ITST J.F. KENNEDY - PN Disciplina: TECNOLOGIA MECCANICA Capitolo 1 COSTITUZIONE DELLA MATERIA A cura di Prof. Antonio Screti LA COSTITUZIONE DELLA MATERIA CARATTERISTICHE DEI MATERIALI METALLICI Le caratteristiche
STRUTTURA DEI MATERIALI
 STRUTTURADEIMATERIALI CRISTALLINA AMORFA ORDINATAmetalli,ceramici Sonocaratterizzatidaunadisposizioneordinata degliatomi(ioni,molecole)secondounben definitoreticolocristallino.leproprietà ottiche,meccanicheedelettrichesonodiversea
STRUTTURADEIMATERIALI CRISTALLINA AMORFA ORDINATAmetalli,ceramici Sonocaratterizzatidaunadisposizioneordinata degliatomi(ioni,molecole)secondounben definitoreticolocristallino.leproprietà ottiche,meccanicheedelettrichesonodiversea
I differenti materiali differiscono per le caratteristiche meccaniche e fisiche.
 MATERIALI COMPOSITI I differenti materiali differiscono per le caratteristiche meccaniche e fisiche. I METALLI hanno forma cristallina e forti legami molecolari (legame metallico), che danno loro resistenza
MATERIALI COMPOSITI I differenti materiali differiscono per le caratteristiche meccaniche e fisiche. I METALLI hanno forma cristallina e forti legami molecolari (legame metallico), che danno loro resistenza
Minerali e rocce. La Terra solida è formata da minerali.
 1.4 Minerali e rocce La Terra solida è formata da minerali. Un minerale è un corpo solido cristallino naturale omogeneo, costituito da un elemento o da un composto chimico inorganico e caratterizzato da
1.4 Minerali e rocce La Terra solida è formata da minerali. Un minerale è un corpo solido cristallino naturale omogeneo, costituito da un elemento o da un composto chimico inorganico e caratterizzato da
TECNOLOGIA DEI MATERIALI RIASSUNTO
 TECNOLOGIA DEI MATERIALI RIASSUNTO MATERIALI I solidi possono essere: di tipo cristallino, cioè caratterizzati da una struttura ordinata a livello atomico o molecolare (ad esempio il reticolo cristallino
TECNOLOGIA DEI MATERIALI RIASSUNTO MATERIALI I solidi possono essere: di tipo cristallino, cioè caratterizzati da una struttura ordinata a livello atomico o molecolare (ad esempio il reticolo cristallino
SOLUZIONE ESERCIZIO 1.1
 SOLUZIONE ESERCIZIO 1.1 La temperatura di fusione ed il coefficiente di espansione termica di alcuni metalli sono riportati nella tabella e nel diagramma sottostante: Metallo Temperatura di fusione [ C]
SOLUZIONE ESERCIZIO 1.1 La temperatura di fusione ed il coefficiente di espansione termica di alcuni metalli sono riportati nella tabella e nel diagramma sottostante: Metallo Temperatura di fusione [ C]
Solidi cristallini. I solidi cristallini sono caratterizzati da una distribuzione regolare delle particelle nello spazio.
 Solidi cristallini. I solidi cristallini sono caratterizzati da una distribuzione regolare delle particelle nello spazio. Il modo in cui le particelle costituenti il cristallo sono disposti nello spazio
Solidi cristallini. I solidi cristallini sono caratterizzati da una distribuzione regolare delle particelle nello spazio. Il modo in cui le particelle costituenti il cristallo sono disposti nello spazio
Produzione di titanio metallico puro.
 Leghe di Titanio Produzione di titanio metallico puro. Il titanio e le sue leghe sono classificati in tre grandi categorie in base alle fasi predominanti presenti nella microstruttura a temperatura ambiente.
Leghe di Titanio Produzione di titanio metallico puro. Il titanio e le sue leghe sono classificati in tre grandi categorie in base alle fasi predominanti presenti nella microstruttura a temperatura ambiente.
Transizioni di fase. O (g) evaporazione O (s) H 2. O (l) H 2. O (g) sublimazione...
 Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
LA MOLE LA MOLE 2.A PRE-REQUISITI 2.3 FORMULE E COMPOSIZIONE 2.B PRE-TEST
 LA MOLE 2.A PRE-REQUISITI 2.B PRE-TEST 2.C OBIETTIVI 2.1 QUANTO PESA UN ATOMO? 2.1.1 L IDEA DI MASSA RELATIVA 2.1.2 MASSA ATOMICA RELATIVA 2.2.4 ESERCIZI SVOLTI 2.3 FORMULE E COMPOSIZIONE 2.4 DETERMINAZIONE
LA MOLE 2.A PRE-REQUISITI 2.B PRE-TEST 2.C OBIETTIVI 2.1 QUANTO PESA UN ATOMO? 2.1.1 L IDEA DI MASSA RELATIVA 2.1.2 MASSA ATOMICA RELATIVA 2.2.4 ESERCIZI SVOLTI 2.3 FORMULE E COMPOSIZIONE 2.4 DETERMINAZIONE
MATERIALI CERAMICI. Prodotti ottenuti da materie prime inorganiche non metalliche formate a freddo e consolidate mediante cottura.
 MATERIALI CERAMICI Prodotti ottenuti da materie prime inorganiche non metalliche formate a freddo e consolidate mediante cottura. Sono caratterizzati da legami ionici e/o covalenti. Caratteristiche dei
MATERIALI CERAMICI Prodotti ottenuti da materie prime inorganiche non metalliche formate a freddo e consolidate mediante cottura. Sono caratterizzati da legami ionici e/o covalenti. Caratteristiche dei
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
CAPITOLO 11 Materiali ceramici ESERCIZI CON SOLUZIONE SVOLTA. Problemi di conoscenza e comprensione
 CAPITOLO 11 Materiali ceramici ESERCIZI CON SOLUZIONE SVOLTA Problemi di conoscenza e comprensione 11.10 (a) Le strutture a isola dei silicati si formano quando ioni positivi, come Mg 2+ e Fe 2+, si legano
CAPITOLO 11 Materiali ceramici ESERCIZI CON SOLUZIONE SVOLTA Problemi di conoscenza e comprensione 11.10 (a) Le strutture a isola dei silicati si formano quando ioni positivi, come Mg 2+ e Fe 2+, si legano
MATERIALI CERAMICI Classificazione e caratteristiche generali
 MATERIALI CERAMICI Classificazione e caratteristiche generali I materiali ceramici sono materiali inorganici non metallici, costituiti da elementi metallici e non metalici legati fra loro prevalentemente
MATERIALI CERAMICI Classificazione e caratteristiche generali I materiali ceramici sono materiali inorganici non metallici, costituiti da elementi metallici e non metalici legati fra loro prevalentemente
PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI
 PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI DEFINIZIONE DI VETRO LO STATO VETROSO È QUELLO DI UN SOLIDO BLOCCATO NELLA STRUTTURA DISORDINATA DI UN LIQUIDO (FASE AMORFA) SOLIDO:ORDINE A LUNGO RAGGIO
PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI DEFINIZIONE DI VETRO LO STATO VETROSO È QUELLO DI UN SOLIDO BLOCCATO NELLA STRUTTURA DISORDINATA DI UN LIQUIDO (FASE AMORFA) SOLIDO:ORDINE A LUNGO RAGGIO
La mobilità degli elementi chimici
 La mobilità degli elementi chimici Gli ioni contenuti nella parte sinistra del diagramma sono quelli che in soluzione si presentano sotto forma di cationi semplici. Gli ioni nella parte centrale del diagramma
La mobilità degli elementi chimici Gli ioni contenuti nella parte sinistra del diagramma sono quelli che in soluzione si presentano sotto forma di cationi semplici. Gli ioni nella parte centrale del diagramma
Energia elettrica. L atomo nel suo complesso è neutro perché ha l equilibrio tra protoni ed elettroni presenti nello stesso numero.
 Energia elettrica Si fonda sulla costituzione dell atomo che è costituito da particelle più piccole : neutroni (carica neutra) e protoni (carica +) che costituiscono il nucleo ed elettroni (carica negativa)
Energia elettrica Si fonda sulla costituzione dell atomo che è costituito da particelle più piccole : neutroni (carica neutra) e protoni (carica +) che costituiscono il nucleo ed elettroni (carica negativa)
STATI FISICI DELLA MATERIA: SOLIDI, LIQUIDI E GAS
 STATI FISICI DELLA MATERIA: SOLIDI, LIQUIDI E GAS 7.A PRE-REQUISITI 7.B PRE-TEST 7.C OBIETTIVI 7.1 INTRODUZIONE 7.2 LO STATO SOLIDO 7.2.1 IL RETICOLO CRISTALLINO 7.2.2 STRUTTURA E PROPRIETA DEI DIVERSI
STATI FISICI DELLA MATERIA: SOLIDI, LIQUIDI E GAS 7.A PRE-REQUISITI 7.B PRE-TEST 7.C OBIETTIVI 7.1 INTRODUZIONE 7.2 LO STATO SOLIDO 7.2.1 IL RETICOLO CRISTALLINO 7.2.2 STRUTTURA E PROPRIETA DEI DIVERSI
Gli stati fisici condensati: stato liquido e stato solido
 1 Espansione 1.3 Gli stati fisici condensati: stato liquido e stato solido Secondo la teoria particellare della materia ogni corpo è costituito da particelle (atomi, molecole o ioni) unite tra loro, in
1 Espansione 1.3 Gli stati fisici condensati: stato liquido e stato solido Secondo la teoria particellare della materia ogni corpo è costituito da particelle (atomi, molecole o ioni) unite tra loro, in
4b. STATI DI AGGREGAZIONE DELLA MATERIA (parte seconda)
 4b. STATI DI AGGREGAZIONE DELLA MATERIA (parte seconda) La maggior parte delle sostanze che sono liquide a STP sono costituite da molecole (liquidi molecolari). I composti ionici e metallici sono generalmente
4b. STATI DI AGGREGAZIONE DELLA MATERIA (parte seconda) La maggior parte delle sostanze che sono liquide a STP sono costituite da molecole (liquidi molecolari). I composti ionici e metallici sono generalmente
Liquidi, Solidi e Forze Intermolecolari
 Liquidi, Solidi e Forze Intermolecolari Distanze tra molecole Stati Fisici (Fase) Comportamento atipico La maggiore differenza tra liquidi e solidi consiste nella libertà di movimento delle loro molecole
Liquidi, Solidi e Forze Intermolecolari Distanze tra molecole Stati Fisici (Fase) Comportamento atipico La maggiore differenza tra liquidi e solidi consiste nella libertà di movimento delle loro molecole
Un nuovo spettrometro XRF portatile: prima applicazione a un bronzo dorato del Battistero di Firenze
 Un nuovo spettrometro XRF portatile: prima applicazione a un bronzo dorato del Battistero di Firenze A. Migliori a,b, P. Bonanni a, L. Carraresi a, N. Grassi a, P.A. Mandò a a Dipartimento di Fisica dell
Un nuovo spettrometro XRF portatile: prima applicazione a un bronzo dorato del Battistero di Firenze A. Migliori a,b, P. Bonanni a, L. Carraresi a, N. Grassi a, P.A. Mandò a a Dipartimento di Fisica dell
Problemi ad alta temperatura: Creep (scorrimento viscoso a caldo) Ossidazione
 Problemi ad alta temperatura: Creep (scorrimento viscoso a caldo) Ossidazione Acciai al carbonio Possono essere impiegati fino a 450 C C 0.20% Mn 1.6% Si tra 0.15 e 0.50% S e P 0.040% Per combattere invecchiamento
Problemi ad alta temperatura: Creep (scorrimento viscoso a caldo) Ossidazione Acciai al carbonio Possono essere impiegati fino a 450 C C 0.20% Mn 1.6% Si tra 0.15 e 0.50% S e P 0.040% Per combattere invecchiamento
I MINERALI I minerali
 I minerali 1.1 La Terra un pianeta a strati 1.2 I materiali del pianeta Terra 1.3 Composizione della crosta terrestre 1.4 Minerali e rocce 1.5 Minerali e cristalli 1.6 Struttura dei cristalli 1.7 Classificazione
I minerali 1.1 La Terra un pianeta a strati 1.2 I materiali del pianeta Terra 1.3 Composizione della crosta terrestre 1.4 Minerali e rocce 1.5 Minerali e cristalli 1.6 Struttura dei cristalli 1.7 Classificazione
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He. 2) L'acqua è:
 1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
Chimica. Ingegneria Meccanica, Elettrica e Civile Simulazione d'esame
 Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3.
 Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
GEOLOGIA (studio della litosfera) Essa si divide in MINERALOGIA (studio dei minerali) e PETROGRAFIA ( studio delle rocce)
 GEOLOGIA (studio della litosfera) Essa si divide in MINERALOGIA (studio dei minerali) e PETROGRAFIA ( studio delle rocce) I MINERALI I minerali sono sostanze solide omogenee, inorganiche, esprimibili mediante
GEOLOGIA (studio della litosfera) Essa si divide in MINERALOGIA (studio dei minerali) e PETROGRAFIA ( studio delle rocce) I MINERALI I minerali sono sostanze solide omogenee, inorganiche, esprimibili mediante
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 2
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
Gruppo 10 Nickel Ni (1751)
 Gruppo 10 ickel i (1751) Proprietà i Pd Pt Z 28 46 78 umero di isotopi 5 6 6 naturali Massa atomica 58.69 106.42 195.08 onfigurazione [Ar]3d 8 4s 2 [Kr]4d 10 [Xe]4f 14 5d 9 6s 1 elettronica Aspetto Metallo
Gruppo 10 ickel i (1751) Proprietà i Pd Pt Z 28 46 78 umero di isotopi 5 6 6 naturali Massa atomica 58.69 106.42 195.08 onfigurazione [Ar]3d 8 4s 2 [Kr]4d 10 [Xe]4f 14 5d 9 6s 1 elettronica Aspetto Metallo
Cap. 2 - Strutture cristalline.
 Cap. 2 - Strutture cristalline. Lo studio delle proprietà fisiche dei solidi è iniziato nei primi anni del '900 grazie alla scoperta della diffrazione X da parte dei cristalli. Lo studio delle proprietà
Cap. 2 - Strutture cristalline. Lo studio delle proprietà fisiche dei solidi è iniziato nei primi anni del '900 grazie alla scoperta della diffrazione X da parte dei cristalli. Lo studio delle proprietà
I MINERALI DELLA CROSTA TERRESTRE
 I MINERALI DELLA CROSTA TERRESTRE Sono solidi cristallini, di origine inorganica, caratterizzati da una precisa formula chimica. Una sostanza è un minerale se: si presenta come solido cristallino, cioè
I MINERALI DELLA CROSTA TERRESTRE Sono solidi cristallini, di origine inorganica, caratterizzati da una precisa formula chimica. Una sostanza è un minerale se: si presenta come solido cristallino, cioè
Degrado dei materiali non-metallici 1 materiali polimerici. Contenuto
 Contenuto o legame chimico C C - legame covalente, energia di legame - struttura tetragonale dei quattro legami del carbonio reazioni di polimerizzazione - poliaddizione, esempi - policondensazione, esempi
Contenuto o legame chimico C C - legame covalente, energia di legame - struttura tetragonale dei quattro legami del carbonio reazioni di polimerizzazione - poliaddizione, esempi - policondensazione, esempi
STATO LIQUIDO. Si definisce tensione superficiale (γ) il lavoro che bisogna fare per aumentare di 1 cm 2 la superficie del liquido.
 STTO LIQUIDO Una sostanza liquida è formata da particelle in continuo movimento casuale, come in un gas, tuttavia le particelle restano a contatto le une alle altre e risentono sempre delle notevoli forze
STTO LIQUIDO Una sostanza liquida è formata da particelle in continuo movimento casuale, come in un gas, tuttavia le particelle restano a contatto le une alle altre e risentono sempre delle notevoli forze
LE PROPRIETA DEI MATERIALI METALLICI
 LE PROPRIETA DEI MATERIALI METALLICI Si suddividono in : proprietà chimico-strutturali strutturali; proprietà fisiche; proprietà meccaniche; proprietà tecnologiche. Le proprietà chimico-strutturali riguardano
LE PROPRIETA DEI MATERIALI METALLICI Si suddividono in : proprietà chimico-strutturali strutturali; proprietà fisiche; proprietà meccaniche; proprietà tecnologiche. Le proprietà chimico-strutturali riguardano
ELETTROCHIMICA. Uso di reazioni chimiche per produrre corrente elettrica (Pile)
 ELETTROCHIMICA Uso di reazioni chimiche per produrre corrente elettrica (Pile) Uso di forza elettromotrice (fem) esterna per forzare reazioni chimiche non spontanee (Elettrolisi) Coppia redox: Ossidazione
ELETTROCHIMICA Uso di reazioni chimiche per produrre corrente elettrica (Pile) Uso di forza elettromotrice (fem) esterna per forzare reazioni chimiche non spontanee (Elettrolisi) Coppia redox: Ossidazione
I Materiali Polimerici
 I Materiali Polimerici I Materiali Polimerici Un polimero è costituito da molte unità molecolari ricorrenti, unite tra di loro per addizione sequenziale di molecole di monomero. Molte molecole del monomero
I Materiali Polimerici I Materiali Polimerici Un polimero è costituito da molte unità molecolari ricorrenti, unite tra di loro per addizione sequenziale di molecole di monomero. Molte molecole del monomero
8. Cosa sono il polimorfismo e l allotropia? Pagina 1 di 8
 Solidi cristallini 1. I solidi cristallini presentano strutture compatte e dotate di elevata simmetria. Tali strutture risultano costituite dall insieme di più celle elementari, le quali sono caratterizzate
Solidi cristallini 1. I solidi cristallini presentano strutture compatte e dotate di elevata simmetria. Tali strutture risultano costituite dall insieme di più celle elementari, le quali sono caratterizzate
METALLI FERROSI GHISA ACCIAIO
 METALLI FERROSI I metalli ferrosi sono i metalli e le leghe metalliche che contengono ferro. Le leghe ferrose più importanti sono l acciaio e la ghisa. ACCIAIO: lega metallica costituita da ferro e carbonio,
METALLI FERROSI I metalli ferrosi sono i metalli e le leghe metalliche che contengono ferro. Le leghe ferrose più importanti sono l acciaio e la ghisa. ACCIAIO: lega metallica costituita da ferro e carbonio,
NOTA TECNICA : Metallurgia di base degli acciai speciali da costruzione
 NOTA TECNICA : Metallurgia di base degli acciai speciali da costruzione Indice : 1. INTRODUZIONE p. 1 2. FASI e COSTITUENTI STRUTTURALI p. 3 3. PUNTI CRITICI p. 4 4. TRATTAMENTI TERMICI MASSIVI p. 5 0
NOTA TECNICA : Metallurgia di base degli acciai speciali da costruzione Indice : 1. INTRODUZIONE p. 1 2. FASI e COSTITUENTI STRUTTURALI p. 3 3. PUNTI CRITICI p. 4 4. TRATTAMENTI TERMICI MASSIVI p. 5 0
Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici.
 LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
LE REAZIONI DI OSSIDO-RIDUZIONE Le reazioni di ossido-riduzione o reazioni redox rivestono grande importanza, non solo in chimica, ma anche nei fenomeni biologici. La vita dipende dalle reazioni redox.
modulo: CHIMICA DEI POLIMERI
 CORSO PON Esperto nella progettazione, caratterizzazione e lavorazione di termoplastici modulo: CHIMICA DEI POLIMERI Vincenzo Venditto influenza delle caratteristiche strutturali, microstrutturali e morfologiche
CORSO PON Esperto nella progettazione, caratterizzazione e lavorazione di termoplastici modulo: CHIMICA DEI POLIMERI Vincenzo Venditto influenza delle caratteristiche strutturali, microstrutturali e morfologiche
Laboratorio di sistemi 3 A Meccanica Energia. Resistività ρ Resistori e resistenza elettrica Ω
 Laboratorio di sistemi 3 A Meccanica Energia Resistività ρ Resistori e resistenza elettrica Ω Resistività elettrica La resistività elettrica (ρ), anche detta resistenza elettrica specifica, è l'attitudine
Laboratorio di sistemi 3 A Meccanica Energia Resistività ρ Resistori e resistenza elettrica Ω Resistività elettrica La resistività elettrica (ρ), anche detta resistenza elettrica specifica, è l'attitudine
Biologia. Organismi: faa di materia, cosctuita di elemen%, che si combinano in compos%. La chimica della vita. I legami chimici. L acqua.
 Biologia Chimica Fisica Organismi: faa di materia, cosctuita di elemen%, che si combinano in compos%. ElemenC naturali nel corpo umano Simbolo Elemento % in peso Il 96% é fako di O Ossigeno 65.0 C Carbonio
Biologia Chimica Fisica Organismi: faa di materia, cosctuita di elemen%, che si combinano in compos%. ElemenC naturali nel corpo umano Simbolo Elemento % in peso Il 96% é fako di O Ossigeno 65.0 C Carbonio
PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI
 PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI Cos è un vetro? COS È UN VETRO? SOLIDO? LIQUIDO? ALTRO? GLI STATI DELLA MATERIA Volume specifico Liquido Vetro Tg CAMBIAMENTO DI VOLUME Tf Tf =TEMPERATURA
PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI Cos è un vetro? COS È UN VETRO? SOLIDO? LIQUIDO? ALTRO? GLI STATI DELLA MATERIA Volume specifico Liquido Vetro Tg CAMBIAMENTO DI VOLUME Tf Tf =TEMPERATURA
LA FRAZIONE SOLIDA INORGANICA
 LA FRAZIONE SOLIDA INORGANICA ROCCE MINERALI Classe Alogenuri Solfati Solfuri Ossidi ed idrossidi (Al, Fe, Mn, Ti) Carbonati Nitrati Fosfati Silicati (fillosilicati) Minerale Cloruro di sodio Gesso Pirite
LA FRAZIONE SOLIDA INORGANICA ROCCE MINERALI Classe Alogenuri Solfati Solfuri Ossidi ed idrossidi (Al, Fe, Mn, Ti) Carbonati Nitrati Fosfati Silicati (fillosilicati) Minerale Cloruro di sodio Gesso Pirite
MEMBRANE. struttura: fosfolipidi e proteine
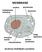 MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
MEMBRANE struttura: fosfolipidi e proteine I lipidi sono sostanze di origine biologica insolubili in acqua. Vi fanno parte: trigliceridi, fosfolipidi, colesterolo, sfingolipidi, alcoli alifatici, cere,
13 La chimica dei solidi
 STATI DELLA MATERIA 13 La chimica dei solidi La grafite è composta da strati di atomi di carbonio in anelli a sei membri. Per gent. conc. di Jannik Meyer Per gent. conc. di R. Bruce Weisman, Rice University
STATI DELLA MATERIA 13 La chimica dei solidi La grafite è composta da strati di atomi di carbonio in anelli a sei membri. Per gent. conc. di Jannik Meyer Per gent. conc. di R. Bruce Weisman, Rice University
STRUTTURA DEI METALLI
 STRUTTURA DEI METALLI Durante la solidificazione di un metallo liquido si formano progressivamente in tutta la massa i grani cristallini affiancati. GRANI CRISTALLINI I grani sono visibili con un microscopio
STRUTTURA DEI METALLI Durante la solidificazione di un metallo liquido si formano progressivamente in tutta la massa i grani cristallini affiancati. GRANI CRISTALLINI I grani sono visibili con un microscopio
La crosta è costituita da materiali solidi: le rocce. Le rocce sono aggregati di uno o più minerali
 Nella sua superficie oltre all acqua (liquida degli oceani, e solida della calotte polari), la Terra presenta una struttura solida: la crosta. La crosta è costituita da materiali solidi: le rocce. Le rocce
Nella sua superficie oltre all acqua (liquida degli oceani, e solida della calotte polari), la Terra presenta una struttura solida: la crosta. La crosta è costituita da materiali solidi: le rocce. Le rocce
LIPIDI. I lipidi sono suddivisi in due gruppi principali.
 LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
L equilibrio dei gas. Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura
 Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
La pressione è una grandezza fisica, definita come il rapporto tra la forza agente normalmente su una superficie e la superficie stessa.
 Pressione La pressione è una grandezza fisica, definita come il rapporto tra la forza agente normalmente su una superficie e la superficie stessa. E originata dallo scambio di forze fra le molecole del
Pressione La pressione è una grandezza fisica, definita come il rapporto tra la forza agente normalmente su una superficie e la superficie stessa. E originata dallo scambio di forze fra le molecole del
Gli elementi di transizione
 Gli elementi di transizione A partire dal quarto periodo del Sistema Periodico, nella costruzione della configurazione elettronica degli elementi, dopo il riempimento degli orbitali s del guscio di valenza
Gli elementi di transizione A partire dal quarto periodo del Sistema Periodico, nella costruzione della configurazione elettronica degli elementi, dopo il riempimento degli orbitali s del guscio di valenza
 LEGAME CHIMICO In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE
LEGAME CHIMICO In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE
grado di fornire i propri servizi Dal 1959 la ditta E.L.B.A., con grande tempestività su Emporio, Lingotto, Bronzo, tutto il territorio nazionale,
 Dal 1959 la ditta E.L.B.A., Emporio, Lingotto, Bronzo, Alluminio, inizia la commercializzazione di barre in bronzo a colata continua nella 1 sede del centro cittadino, fornendo i clienti della zona che
Dal 1959 la ditta E.L.B.A., Emporio, Lingotto, Bronzo, Alluminio, inizia la commercializzazione di barre in bronzo a colata continua nella 1 sede del centro cittadino, fornendo i clienti della zona che
UNIVERSITÀ DEGLI STUDI DI PADOVA Facoltà di Ingegneria A.A. 2009/10
 UNIVERSITÀ DEGLI STUDI DI PDOV Facoltà di Ingegneria Corso di Disegno Tecnico Industriale per i Corsi di Laurea triennale in Ingegneria Meccanica e in Ingegneria dell Energia Costruzioni geometriche in
UNIVERSITÀ DEGLI STUDI DI PDOV Facoltà di Ingegneria Corso di Disegno Tecnico Industriale per i Corsi di Laurea triennale in Ingegneria Meccanica e in Ingegneria dell Energia Costruzioni geometriche in
Corso di Laurea in FARMACIA
 Corso di Laurea in FARMACIA 2015 simulazione 1 FISICA Cognome nome matricola a.a. immatric. firma N Evidenziare le risposte esatte Una sferetta è appesa con una cordicella al soffitto di un ascensore fermo.
Corso di Laurea in FARMACIA 2015 simulazione 1 FISICA Cognome nome matricola a.a. immatric. firma N Evidenziare le risposte esatte Una sferetta è appesa con una cordicella al soffitto di un ascensore fermo.
GLI ELEMENTI CHIMICI
 In natura esistono 92 elementi chimici naturali. GLI ELEMENTI CHIMICI Nella tavola periodica sono riportati tutti gli elementi chimici: naturali e non naturali ( UNA DECINA) COMBINANDOSI TRA LORO IN VARIO
In natura esistono 92 elementi chimici naturali. GLI ELEMENTI CHIMICI Nella tavola periodica sono riportati tutti gli elementi chimici: naturali e non naturali ( UNA DECINA) COMBINANDOSI TRA LORO IN VARIO
Esercizi di Chimica (2 a prova in itinere)
 Esercizi di Chimica (2 a prova in itinere) 3) Calcolare la normalità (N) di una soluzione ottenuta sciogliendo 3,5 g di H 3 PO 4 in 900 ml di acqua [0,119 N] 4) Quanti grammi di soluto sono contenuti in
Esercizi di Chimica (2 a prova in itinere) 3) Calcolare la normalità (N) di una soluzione ottenuta sciogliendo 3,5 g di H 3 PO 4 in 900 ml di acqua [0,119 N] 4) Quanti grammi di soluto sono contenuti in
2.1 Difetti stechiometrici Variano la composizione del cristallo con la presenza di elementi diversi dalla natura dello stesso.
 2. I difetti nei cristalli In un cristallo perfetto (o ideale) tutti gli atomi occuperebbero le corrette posizioni reticolari nella struttura cristallina. Un tale cristallo perfetto potrebbe esistere,
2. I difetti nei cristalli In un cristallo perfetto (o ideale) tutti gli atomi occuperebbero le corrette posizioni reticolari nella struttura cristallina. Un tale cristallo perfetto potrebbe esistere,
Equilibri di precipitazione
 Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI
 DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI - si sfrutta una proprietà chimico-fisica o fisica che varia nel corso della titolazione - tale proprietà è in genere proporzionale
DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI - si sfrutta una proprietà chimico-fisica o fisica che varia nel corso della titolazione - tale proprietà è in genere proporzionale
Indice. 1 La materia e la sua struttura. 2 La radioattività ed i processi nucleari
 Indice PREFAZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi 5 1.3. L unità di
Indice PREFAZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi 5 1.3. L unità di
FENOMENI DI CORROSIONE ED OSSIDAZIONE La corrosione è un fenomeno di degrado dei metalli. E un fenomeno termodinamico (chiamato anche
 FENOMENI DI CORROSIONE ED OSSIDAZIONE La corrosione è un fenomeno di degrado dei metalli. E un fenomeno termodinamico (chiamato anche antimetallurgia) che si manifesta spontaneamente se: G
FENOMENI DI CORROSIONE ED OSSIDAZIONE La corrosione è un fenomeno di degrado dei metalli. E un fenomeno termodinamico (chiamato anche antimetallurgia) che si manifesta spontaneamente se: G
LE LEGHE DI ALLUMINIO E LO SMALTO PORCELLANATO
 LE LEGHE DI ALLUMINIO E LO SMALTO PORCELLANATO Angelo Ferraro, Technical Customer Service Manager Novelis Italia Angelo.Ferraro@novelis.com Premessa In questi ultimi anni c è stato un forte interesse per
LE LEGHE DI ALLUMINIO E LO SMALTO PORCELLANATO Angelo Ferraro, Technical Customer Service Manager Novelis Italia Angelo.Ferraro@novelis.com Premessa In questi ultimi anni c è stato un forte interesse per
I MINERALI. Appunti di geografia per gli studenti delle sezioni C e D a cura della prof.ssa A.Pulvirenti.
 I MINERALI Appunti di geografia per gli studenti delle sezioni C e D a cura della prof.ssa A.Pulvirenti. Le immagini presenti in questo file sono state reperite in rete o modificate da testi cartacei e
I MINERALI Appunti di geografia per gli studenti delle sezioni C e D a cura della prof.ssa A.Pulvirenti. Le immagini presenti in questo file sono state reperite in rete o modificate da testi cartacei e
Durezza è la resistenza che ha un minerale nell'opporsi alla scalfittura. utilizzata la scala di Mohs.
 PROPRIETA FISICHE DEI MINERALI Densità g/cm 3 Durezza è la resistenza che ha un minerale nell'opporsi alla scalfittura. utilizzata la scala di Mohs. Sfaldatura: proprietà di rompersi più facilmente lungo
PROPRIETA FISICHE DEI MINERALI Densità g/cm 3 Durezza è la resistenza che ha un minerale nell'opporsi alla scalfittura. utilizzata la scala di Mohs. Sfaldatura: proprietà di rompersi più facilmente lungo
MATERIALI. Introduzione
 MATERIALI 398 Introduzione Gli acciai sono leghe metalliche costituite da ferro e carbonio, con tenore di carbonio (in massa) non superiore al 2%. Attenzione: la normazione sugli acciai è in fase di armonizzazione
MATERIALI 398 Introduzione Gli acciai sono leghe metalliche costituite da ferro e carbonio, con tenore di carbonio (in massa) non superiore al 2%. Attenzione: la normazione sugli acciai è in fase di armonizzazione
LEZIONE 1. Materia: Proprietà e Misura
 LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
EFFETTO FOTOELETTRICO
 EFFETTO FOTOELETTRICO Come funziona una cella solare TECHNOTOU R SEMICONDUTTORI 1 Materiali con una conducibilità intermedia tra quella di un buon conduttore e quella di un buon isolante. Possono essere
EFFETTO FOTOELETTRICO Come funziona una cella solare TECHNOTOU R SEMICONDUTTORI 1 Materiali con una conducibilità intermedia tra quella di un buon conduttore e quella di un buon isolante. Possono essere
MASSE ATOMICHE. 1,000 g di idrogeno reagiscono con 7,9367 g di ossigeno massa atomica ossigeno=2 x 7,9367=15,873 g (relativa all'idrogeno)
 MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Composizione degli acciai Conoscere bene per comprare meglio
 Composizione degli acciai Conoscere bene per comprare meglio Manuele Dabalà Dip. Ingegneria Industriale Università di Padova Introduzione Cos è l acciaio? Norma UNI EN 10020/01 Materiale il cui tenore
Composizione degli acciai Conoscere bene per comprare meglio Manuele Dabalà Dip. Ingegneria Industriale Università di Padova Introduzione Cos è l acciaio? Norma UNI EN 10020/01 Materiale il cui tenore
Elettrochimica. 1. Celle elettrolitiche. 2. Celle galvaniche o pile
 Elettrochimica L elettrochimica studia l impiego di energia elettrica per promuovere reazioni non spontanee e l impiego di reazioni spontanee per produrre energia elettrica, entrambi i processi coinvolgono
Elettrochimica L elettrochimica studia l impiego di energia elettrica per promuovere reazioni non spontanee e l impiego di reazioni spontanee per produrre energia elettrica, entrambi i processi coinvolgono
Quesiti e problemi. 12 Individua l elemento del terzo periodo che appartiene. 13 Completa la parte evidenziata del sistema periodico,
 SUL LIBR DA PAG 184 A PAG 18 Quesiti e problemi 1 L energia di legame 1 Definisci l energia di legame. L energia di legame è la quantità di energia che è necessario fornire a una mole di sostanza per rompere
SUL LIBR DA PAG 184 A PAG 18 Quesiti e problemi 1 L energia di legame 1 Definisci l energia di legame. L energia di legame è la quantità di energia che è necessario fornire a una mole di sostanza per rompere
Radiazione solare. Energia elettrica
 Un modulo fotovoltaico è un dispositivo in grado di convertire energia solare direttamente in energia elettrica mediante effetto fotovoltaico ed è impiegato come generatore di corrente quasi puro in un
Un modulo fotovoltaico è un dispositivo in grado di convertire energia solare direttamente in energia elettrica mediante effetto fotovoltaico ed è impiegato come generatore di corrente quasi puro in un
AUTODIFFUSIONE Autodiffusione
 DIFFUSIONE ATOMICA La diffusione è un processo importante che influenza il comportamento di un materiale alle alte temperature (creep, trattamenti termici superficiali, tempra chimica del vetro, ricristallizzazione,
DIFFUSIONE ATOMICA La diffusione è un processo importante che influenza il comportamento di un materiale alle alte temperature (creep, trattamenti termici superficiali, tempra chimica del vetro, ricristallizzazione,
ELASTOMERI ELASTOMERI
 ELASTOMERI Gli elastomeri o gomme, sono materiali polimerici le cui dimensioni possono variare enormemente so
ELASTOMERI Gli elastomeri o gomme, sono materiali polimerici le cui dimensioni possono variare enormemente so
2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà. I liquidi e loro proprietà
 2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà 1 I liquidi e loro proprietà 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito. I gas occupano i loro contenitori uniformemente
2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà 1 I liquidi e loro proprietà 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito. I gas occupano i loro contenitori uniformemente
BIOLOGIA GENERALE. Alessandro Massolo Dip. Biologia Animale e Genetica c/o Prof. F. Dessì-Fulgheri (Via Romana 17) massolo@unifi.
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
Caratterizzazione chimico fisica delle biomasse legnose
 Caratterizzazione chimico fisica delle biomasse legnose Rossana Cerioni SIBE Srl Spin-Off dell Università Politecnica delle Marche BIOENERGY - Verona, 4 febbraio 2010 COMPONENTI DELLA BIOMASSA SOLIDA Aspetti
Caratterizzazione chimico fisica delle biomasse legnose Rossana Cerioni SIBE Srl Spin-Off dell Università Politecnica delle Marche BIOENERGY - Verona, 4 febbraio 2010 COMPONENTI DELLA BIOMASSA SOLIDA Aspetti
Indice. 1 La materia e la sua struttura. 2 La radioattività ed i processi nucleari
 Indice PREFAZIONE ALLA SECONDA EDIZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi
Indice PREFAZIONE ALLA SECONDA EDIZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi
Mtll Metallurgia Acciai e ghise
 Acciai e ghise Mtll Metallurgia Acciai e ghise Prof. Studio: piano terra Facoltà di Ingegneria, stanza 25 Orario di ricevimento: i Mercoledì 14.00-16.00 Tel. 07762993681 E-mail: iacoviello@unicas.itit
Acciai e ghise Mtll Metallurgia Acciai e ghise Prof. Studio: piano terra Facoltà di Ingegneria, stanza 25 Orario di ricevimento: i Mercoledì 14.00-16.00 Tel. 07762993681 E-mail: iacoviello@unicas.itit
* Densità. Per la vicinanza delle particelle la densità di una sostanza solida è generalmente maggiore di quella della sostanza allo stato liquido.
 16. STATO SOLIDO D. I solidi sono costituiti da atomi, molecole o ioni aventi energia cinetica insufficiente per vincere le forze di coesione; le particelle non possono allontanarsi le une dalle altre
16. STATO SOLIDO D. I solidi sono costituiti da atomi, molecole o ioni aventi energia cinetica insufficiente per vincere le forze di coesione; le particelle non possono allontanarsi le une dalle altre
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
GAS IDEALI E MACCHINE TERMICHE. G. Pugliese 1
 GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato gassoso
 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
Lezioni di Metallurgia meccanica
 A09 58 Umberto Bernabai Raffaele Torella Lezioni di Metallurgia meccanica Corso di laurea in Ingegneria Meccanica Copyright MMVI ARACNE editrice S.r.l. www.aracneeditrice.it info@aracneeditrice.it via
A09 58 Umberto Bernabai Raffaele Torella Lezioni di Metallurgia meccanica Corso di laurea in Ingegneria Meccanica Copyright MMVI ARACNE editrice S.r.l. www.aracneeditrice.it info@aracneeditrice.it via
Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA
 Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
Scienza e Tecnologia dei Materiali
 Scienza e Tecnologia dei Materiali Ingegneria Civile Docente: Prof. Laura Montanaro laura.montanaro@polito.it Prof. L. Montanaro STM Ing. Civile 1 Generalità Orario lezioni: Lunedì 11.30-13.00 Martedì
Scienza e Tecnologia dei Materiali Ingegneria Civile Docente: Prof. Laura Montanaro laura.montanaro@polito.it Prof. L. Montanaro STM Ing. Civile 1 Generalità Orario lezioni: Lunedì 11.30-13.00 Martedì
* Preparazione. Si realizza mescolando i componenti in svariate apparecchiature. In laboratorio si usano i mortai e i mulini a sfere.
 18. SISTEMI A PIU' COMPONENTI D. Occupiamoci ora dei sistemi a due o più componenti; alcuni hanno nomi particolari. Tab. 18/1. Classificazione dei sistemi a due o più componenti. sistemi eterogenei sistemi
18. SISTEMI A PIU' COMPONENTI D. Occupiamoci ora dei sistemi a due o più componenti; alcuni hanno nomi particolari. Tab. 18/1. Classificazione dei sistemi a due o più componenti. sistemi eterogenei sistemi
Trattamenti di modificazione microstrutturale
 Trattamenti di modificazione microstrutturale Hanno lo scopo di modificare la microstruttura superficiale dei componenti meccanici senza alterare la composizione chimica. AUMENTO DELLA DUREZZA SUPERFICIALE
Trattamenti di modificazione microstrutturale Hanno lo scopo di modificare la microstruttura superficiale dei componenti meccanici senza alterare la composizione chimica. AUMENTO DELLA DUREZZA SUPERFICIALE
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
