NAB PACLITAXEL - ABRAXANE
|
|
|
- Gianluigi Testa
- 10 anni fa
- Просмотров:
Транскрипт
1 giunta regionale Allegato A al Decreto n. 291 del 7 ottobre 2015 pag. 1/8 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED NAB PACLITAXEL - ABRAXANE Indicazione in esame: in associazione con gemcitabina è indicato per il trattamento di prima linea di pazienti adulti con adenocarcinoma metastatico del pancreas. A cura del Gruppo Farmaci Innovativi del Coordinamento della Rete Oncologica Veneta Raccomandazione n. 14 data di redazione: maggio 2015 Documento approvato nella seduta del 18 giugno 2015 della Commissione Tecnica Regionale Farmaci, ex DGR n. 952/2013
2 Allegato A al Decreto n. 291 del 7 ottobre 2015 pag. 2/8 Gruppo Farmaci Innovativi del Coordinamento della Rete Oncologica Veneta Membri (votanti) CONTE PierFranco, Direttore UOC Oncologia Medica 2 - IOV Padova (Coordinatore) BASSAN Franco, Direttore UOC Oncologia Medica - Azienda ULSS 4 Alto Vicentino DEL GIUDICE Augusta, Associazione Noi e il cancro Volontà di Vivere ONLUS - Padova FERRARESE Annalisa, Direttore SOC Farmacia ospedaliera - Azienda ULSS 18 Rovigo GASPARETTO Teresa, Responsabile Ricerca Innovazione e Health Technology Assessment (HTA) - Regione Veneto GORI Stefania, Direttore UOC Oncologia - Ospedale Sacro Cuore Don Calabria, Negrar (VR) LEONE Roberto, Professore Associato di Farmacologia - Università degli Studi di Verona MORANDI Paolo, UOC Oncologia Medica - Azienda ULSS 12 Veneziana Ospedale Dell Angelo, Mestre PERTILE Paolo, Ricercatore Dipartimento di Scienze Economiche - Università degli Studi di Verona SAUGO Mario, Servizio Epidemiologico Regionale - Regione Veneto SCANNAPIECO Gianluigi, Direttore Sanitario - Azienda Ospedaliera Padova SCROCCARO Giovanna, Dirigente Settore Farmaceutico-Protesica-Dispositivi Medici - Regione Veneto TORTORA Giampaolo, Direttore Oncologia Medica A du - Azienda Ospedaliera Universitaria Integrata Verona TOTTOLO Paolo, Medico di Medicina Generale - Azienda ULSS 9 Treviso ZAGONEL Vittorina, Direttore UOC Oncologia Medica 1 - IOV Padova Segreteria Scientifica ADAMI Silvia Coordinamento Regionale Unico sul Farmaco (CRUF) Regione Veneto BORTOLAMI Alberto Coordinamento Tecnico-Scientifico Rete Oncologica Veneta CONTE PierFranco Coordinatore Tecnico-Scientifico Rete Oncologica Veneta SCROCCARO Giovanna Dirigente Settore Farmaceutico Protesica Dispositivi Medici - Regione Veneto Coordinamento Organizzativo Rete Oncologica Veneta MARCHESE Fortunata Settore Farmaceutico Protesica Dispositivi Medici RONI Chiara Farmacista Il presente documento è stato realizzato dal Gruppo Farmaci Innovativi del Coordinamento della Rete Oncologica Veneta con il supporto metodologico del Coordinamento Regionale Unico sul Farmaco ed è stato approvato dalla Commissione Tecnica Regionale Farmaci. Riferimenti Coordinamento Rete Oncologica Veneta Coordinamento Regionale Unico sul Farmaco [email protected]
3 Allegato A al Decreto n. 291 del 7 ottobre 2015 pag. 3/8 SCHEDA DEL FARMACO Nome Commerciale ABRAXANE Principio Attivo Nab paclitaxel Ditta Produttrice Celgene Srl ATC L01CD01 Formulazione Polvere per sospensione per infusione Dosaggio 1 fl 100 mg Categoria Terapeutica Antineoplastici- alcaloidi da piante ed altri prodotti naturali Indicazioni oggetto di ABRAXANE in associazione con gemcitabina è indicato per il valutazione trattamento di prima linea di pazienti adulti con adenocarcinoma metastatico del pancreas. Classificazione ai fini della Classe H rimborsabilità Innovazione terapeutica importante. Ai fini delle prescrizioni a carico del SSN, i centri utilizzatori specificatamente individuati dalle Regioni, dovranno compilare la scheda raccolta dati informatizzata di arruolamento che indica i pazienti eleggibili e la scheda di follow-up e applicare le condizioni negoziali secondo le indicazioni pubblicate sul sito dell'agenzia, all'indirizzo: registri/. Classificazione ai fini della Medicinale soggetto a prescrizione medica limitativa, utilizzabile fornitura esclusivamente in ambiente ospedaliero o in struttura ad esso assimilabile (OSP). Prezzo SSR 1 fl 100 mg = * Ulteriori condizioni negoziali Payment by results per i pazienti che interrompono il trattamento entro il secondo ciclo di terapia (incluso). Registro AIFA SI Il paziente è eleggibile al trattamento con nab-paclitaxel se: età 18 anni; non ha ricevuto un precedente trattamento neoadiuvante o adiuvante per malattia non metastatica con paclitaxel, nabpaclitaxel o docetaxel; non ha ricevuto una precedente terapia sistemica per malattia metastatica o localmente avanzata inoperabile; ha ECOG perfomance status compreso tra 0 e 2; non ha una compromissione epatica severa o Child-Pugh C; il medicinale verrà somministrato in associazione a gemcitabina. *Prezzo massimo di cessione ospedaliera al netto dell IVA al 10%.
4 Allegato A al Decreto n. 291 del 7 ottobre 2015 pag. 4/8 SINTESI DELLE RACCOMANDAZIONI Quesito clinico N. 1 Nei pazienti affetti da adenocarcinoma del pancreas metastatico è raccomandato il regime di trattamento Gemcitabina + Nab-paclitaxel? Raccomandazione: MODERATAMENTE RACCOMANDATO Raccomandazione formulata sulla base di: rapporto benefici/rischi: favorevole evidenze considerate di qualità: moderata alternative terapeutiche: disponibili ma meno soddisfacenti costo rispetto alle alternative: superiore Utilizzo atteso: sulla base della raccomandazione formulata, si prevede un tasso di utilizzo compreso tra il 30% e il 60% dei pazienti candidabili alla terapia. Votazione del Gruppo di Lavoro (14 votanti presenti): 2 Raccomandato, 11 Moderatamente raccomandato, 1 Raccomandato in casi selezionati. Commento: Le evidenze a supporto dell impiego di nab-paclitaxel per l indicazione in esame provengono da un unico RCT condotto in aperto. L endpoint primario di efficacia era la sopravvivenza globale (OS) valutata sulla popolazione ITT (Intention to treat): questo endpoint è stato ritenuto dal Panel importante ed essenziale. Nell analisi aggiornata (follow up mediano a 13.9 mesi per il gruppo sperimentale) nab-paclitaxel ha mostrato un beneficio incrementale in termini di OS di 2.1 mesi rispetto al controllo (8.7 mesi vs 6.6 mesi; HR=0.72, IC 95%: ; p<0.001). La terapia combinata ha portato un beneficio significativo anche in relazione agli endpoint secondari (PFS e ORR valutate da una commissione di revisione indipendente). La riduzione del rischio di morte o progressione era maggiore nei pazienti con malattia più avanzata e con le seguenti caratteristiche: scarso performance status, presenza di metastasi epatiche e più di tre sedi metastatiche. L EMA sottolinea che non è stato dimostrato un beneficio statisticamente significativo nei pazienti di età superiore a 75 anni e con livelli normali di Ca La qualità delle evidenze è stata ritenuta dal Panel di grado moderato per la scelta non completamente adeguata del comparator. La terapia combinata nab-paclitaxel+ gemcitabina è stata studiata verso la gemcitabina in monoterapia, che rappresentava il gold standard al momento della progettazione dello studio ma che ora viene utilizzata solo nei pazienti di età >75 anni, comorbidità e scarso performance status. Nei pazienti con buon performance status (KPS 80) e di età <75 anni, la terapia ottimale da linee guida è rappresentata dal regime FOLFIRINOX, di efficacia sovrapponibile a nab-paclitaxel+gemcitabina. Nello studio principale, il regime FOLFIRINOX ha mostrato un beneficio incrementale di mesi mesi rispetto alla gemcitabina in monoterapia (11.1 mesi vs 6.8 mesi; HR 0.57; 95% IC, ; p<0.001) a fronte, tuttavia, di un profilo di tossicità decisamente peggiore. Il Panel segnala problemi di trasferibilità per pazienti con KPS performance status 70 in quanto rappresentavano una minoranza della popolazione reclutata nello studio clinico (circa 14% del totale). Il costo di nab-paclitaxel è risultato superiore a FOLFIRINOX e nettamente superiore rispetto a gemcitabina in monoterapia.
5 Allegato A al Decreto n. 291 del 7 ottobre 2015 pag. 5/8 SINTESI DELLE EVIDENZE DISPONIBILI, QUALITA METODOLOGICA DEGLI STUDI E COSTI Nab-paclitaxel contiene nanoparticelle di paclitaxel legate all albumina del siero umano: con la somministrazione endovenosa, le nanoparticelle si dissociano rapidamente in complessi solubili delle dimensioni di circa 10 nm. La presenza dell albumina favorisce il trasporto di paclitaxel attraverso le cellule endoteliali, determinandone un maggiore accumulo nella zona tumorale grazie a una proteina legante l albumina (Secreted protein acidic rich in cysteine, SPARC). Il paclitaxel favorisce l aggregazione dei microtubuli dai dimeri della tubulina e li stabilizza impedendone la depolimerizzazione, inibendo in questo modo la normale riorganizzazione del microtubulo, essenziale per l interfase vitale e per le funzioni mitotiche cellulari. Inoltre, il paclitaxel induce la formazione di anormali aggregazioni o fasci di microtubuli durante il ciclo della cellula e di astrosfere multiple di microtubuli durante la mitosi. La dose raccomandata di nab-paclitaxel è di 125 mg/m 2 seguita da una dose di gemcitabina pari a mg/m 2, entrambi somministrati in infusione endovenosa nei giorni 1, 8 e 15 di ciascun ciclo di 28 giorni. L efficacia per l indicazione oggetto di valutazione è supportata da un RCT in aperto (studio MPACT) condotto su 861 pazienti affetti da adenocarcinoma pancreatico metastatico mai trattati in precedenza per malattia metastatica. Nello studio sono stati inclusi pazienti adulti con Karnofsky Perfomance Status (KPS) 70, adeguata funzionalità d organo, diagnosi di malattia metastatica entro 6 settimane dalla randomizzazione e malattia misurabile secondo i criteri RECIST 1.0. Inoltre, erano eleggibili pazienti che avevano ricevuto fluorouracile o gemcitabina come trattamento adiuvante almeno 6 mesi prima della randomizzazione. Sono stati, invece, esclusi pazienti con malattia localmente avanzata, pazienti che avevano ricevuto precedente chemioterapia in adiuvante e pazienti con neoplasia delle cellule insulari. Il 58% circa della popolazione arruolata presentava un buon punteggio KPS performance status (90-100); l età mediana era di 63 anni; la sede prevalente del tumore era rappresentata dalla testa (43%) seguita da corpo (31%) e coda (25%). La maggior parte delle metastasi erano localizzate a livello epatico (84% del totale) e il 17% dei pazienti aveva uno stent biliare. I pazienti sono stati randomizzati in rapporto 1:1 a ricevere nab-paclitaxel (125 mg/m² ev) seguito da gemcitabina (1000 mg/m² ev) somministrati nei giorni 1, 8 e 15 di ciascun ciclo di 4 settimane oppure gemcitabina (1000 mg/m² ev) ogni settimana per 7 settimane durante il primo ciclo da 8 e dal secondo ciclo in poi nei giorni 1, 8 e 15 ogni 4 settimane, fino a progressione di malattia o tossicità inaccettabile. Il protocollo non consentiva ai pazienti del braccio di controllo lo switch al trattamento sperimentale dopo la randomizzazione. La randomizzazione è stata stratificata in base al performance status (70-80 vs ), presenza di metastasi epatiche (sì vs no) e provenienza geografica (Nord America vs altro). L end-point primario dello studio era la sopravvivenza globale (OS) valutata sulla popolazione ITT (intention to treat); gli end-point secondari comprendevano invece la sopravvivenza libera da progressione (PFS) e il tasso di risposte obiettive (ORR), valutate da una commissione di revisione indipendente. Nell analisi aggiornata dello studio MPACT (follow-up mediano 13.9 mesi) nab-paclitaxel ha mostrato un beneficio statisticamente significativo in termini di OS rispetto al controllo: 8.7 mesi vs 6.6 mesi (HR=0.72, IC 95%: ; p<0.001). La percentuale di sopravvivenza a 1 anno è risultata, rispettivamente, pari al 35% nei pazienti trattati con nab-paclitaxel vs 22% nei pazienti trattati con gemcitabina; 10% vs 5% a 2 anni; 4% vs 0% a 3 anni. Differenze significative sono state riscontrate anche in relazione alla PFS da revisione indipendente: 5.5 mesi nel gruppo sperimentale vs 3.7 mesi nel gruppo trattato con gemcitabina (p<0.001) e all ORR (23% vs 7%; p<0.001). La riduzione del rischio di morte o progressione era maggiore nei pazienti con malattia più avanzata e con le seguenti caratteristiche: scarso performance status, presenza di metastasi epatiche e più di tre sedi metastatiche. L EMA sottolinea che non è stato dimostrato un beneficio statisticamente significativo nei pazienti di età superiore a 75 anni e con livelli normali di Ca Nello studio MPACT non è stata valutata la qualità della vita. È stata, recentemente, pubblicata un analisi retrospettiva dei dati dei pazienti inclusi nello studio, effettuata utilizzando la metodica Quality-adjusted time
6 Allegato A al Decreto n. 291 del 7 ottobre 2015 pag. 6/8 without symtoms or toxicities (Q-TWiST) che consente di valutare un endpoint farmacoeconomico di "tempo" combinando il concetto di qualità della vita di un individuo con quello di sopravvivenza. Sono state considerate 3 categorie temporali: il tempo di vita senza sintomi da progressione o grave tossicità; la durata delle tossicità gravi; il tempo alla ricaduta. Il valore medio del Q-TWiST è stato poi calcolato moltiplicando il tempo speso dai pazienti in ognuna delle tre categorie temporali con una correzione per utilità. I pazienti che hanno ricevuto la terapia combinata hanno riportato una miglior qualità della vita misurata con Q- TWiST (+1.7 mesi 95% IC ) rispetto a quelli del braccio di controllo, mostrando un tempo di buona qualità della vita significativamente maggiore (8.2 mesi vs 6.5 mesi). Tollerabilità. Gli eventi avversi di grado di gravità 3 correlati al trattamento sono stati riscontrati più frequentemente nel gruppo trattato con nab-paclitaxel rispetto al gruppo di controllo (89% vs 75% rispettivamente). Gli eventi avversi di grado di gravità 3 più comuni con nab-paclitaxel rispetto a chemioterapia erano: neutropenia (38% nel gruppo sperimentale vs 27% nel gruppo di controllo), leucopenia (31% vs 16%), fatigue (17% vs 7%) e neuropatia periferica (17% vs 1%). Il tasso d interruzione del trattamento con nabpaclitaxel a causa di neuropatia periferica (di tutti i gradi di gravità) è stato pari a 8%. È opportuno sottolineare che il tempo mediano per il miglioramento della neuropatia periferica dal grado di gravità 3 al grado di gravità 1 o risoluzione dell evento avverso era di 29 giorni. La percentuale di decessi per eventi avversi seri era uguale nei due bracci di trattamento (4%). Infine, è stata osservata una maggiore incidenza di eventi avversi nei pazienti over 75 (75%) rispetto ai pazienti di età inferiore (48%). La scheda registrazione paziente AIFA riporta che nei pazienti molto anziani (>75 anni) trattati con nabpaclitaxel e gemcitabina, si è registrata una maggiore incidenza di reazioni avverse serie e di reazioni avverse che hanno comportato la sospensione del trattamento, tra cui tossicità ematologica, neuropatia periferica, diminuzione dell appetito e disidratazione. Nei pazienti con adenocarcinoma pancreatico di età uguale o superiore a 75 anni, è necessario valutare attentamente la capacità di tollerare nab-paclitaxel in associazione con gemcitabina, tenendo conto in particolare del performance status, delle co-morbilità e del maggiore rischio di infezioni. Il riassunto delle caratteristiche del prodotto riporta che i pazienti in trattamento con nab-paclitaxel dovranno essere sottoposti ad attento monitoraggio al fine di rilevare l insorgenza di eventi cardiaci. Infatti sono state riportate rare segnalazioni di insufficienza cardiaca congestizia e disfunzione ventricolare sinistra, sebbene la maggior parte dei soggetti era stata esposta in precedenza a medicinali cardiotossici, come le antracicline, o aveva cardiopatie pregresse. Per quanto riguarda la qualità delle evidenze, si segnala un problema di trasferibilità dei risultati ottenuti nello studio registrativo nella pratica clinica. La terapia combinata nab-paclitaxel+ gemcitabina è stata studiata verso la gemcitabina in monoterapia, che rappresentava il gold standard al momento della progettazione dello studio ma che ora viene utilizzata solo nei pazienti di età >75 anni, comorbidità e scarso performance status. Nei pazienti con buon performance status (KPS 80) la terapia ottimale da linee guida è rappresentata dal regime FOLFIRINOX, di efficacia sovrapponibile ma tossicità decisamente maggiore. Vi sono problemi di trasferibilità per pazienti con KPS performance status 70 in quanto rappresentavano una minoranza della popolazione reclutata nello studio clinico (circa 14% del totale). Il costo di una terapia con nab-paclitaxel+gemcitabina, considerando come durata del trattamento la mediana di trattamento da studio registrativo, è di circa La ditta ha contrattato con AIFA un meccanismo di condivisione del rischio, che prevede un payment by result del 100% per i pazienti non responder al secondo ciclo (incluso). Sulla base della percentuale di pazienti non responder a 3 mesi entro il secondo ciclo (10.6%), il costo della terapia con nab-paclitaxel e gemcitabina è pari a circa ed è, quindi, superiore rispetto alle alternative terapeutiche disponibili, FOLFIRINOX e gemcitabina (Tabella 1).
7 Allegato A al Decreto n. 291 del 7 ottobre 2015 pag. 7/8 Tabella 1. Costo di regimi alternativi in pazienti adulti affetti da adenocarcinoma del pancreas metastatico. Regime terapeutico Schedula Costo ciclo di terapia* Durata trattamento Costo totale* Costo totale al netto di sconti * Ω Nab paclitaxel + gemcitabina 125 mg/m² nei giorni 1, 8 e 15 ogni 28 giorni mg/m² nei giorni 1, 8 e 15 ogni 28 giorni Acido Folinico 400 mg/m² mesi (4 cicli) # FOLFIRINOX 5-fluoro uracile mg/m² Irinotecan 180 mg/m² Oxaliplatino 85mg/m² ogni due settimane mesi (10 cicli) Gemcitabina 1000 mg/m 2 per 7 settimane ogni 8 il 1 ciclo, poi per 3 settimane ogni 4 dal successivo mesi (1 ciclo da 8 settimane + 1 ciclo da 4 settimane) Si considera una superficie corporea di 1,8 m². Costo incluso di IVA 10%; Ω Ove presenti, sono stati considerati i costi di somministrazione, pari a 343 ogni somministrazione. #Payment by results per pazienti non responder entro il secondo ciclo incluso. BIBLIOGRAFIA Determina Gazzetta Ufficiale n. 57 del 26 gennaio 2015 Riassunto delle caratteristiche del prodotto ABRAXANE Assesment Report ABRAXANE, Procedure No. EMEA/H/C/000778/II/ Linee Guida AIOM. Carcinoma del pancreas esocrino. Edizione 2014 Von Hoff et al. Increased Survival in Pancreatic Cancer with nab-paclitaxel plus Gemcitabine. The New England Journal of Medicine 2013; 369: Goldstein et al. Nab-Paclitaxel Plus Gemcitabine for Metastatic Pancreatic Cancer: Long-Term Survival From a Phase III Trial. Journal of the National Cancer Institute 2015, Vol. 107, No. 2; 1 10 Tabernero et al. Prognostic Factors of Survival in a Randomized Phase III Trial (MPACT) of Weekly nab-paclitaxel Plus Gemcitabine Versus Gemcitabine Alone in Patients With Metastatic Pancreatic Cancer. The Oncologist 2015; 20:1 8 Reni et al. Quality-adjusted survival with combination nab-paclitaxel + gemcitabine vs gemcitabine alone in metastatic pancreatic cancer: a Q-TWiST analysis. Journal of Medical Economics 2014, Avis 15 ottobre SMC (968/14) (accesso maggio 2015) Conroy et al. FOLFIRINOX versus Gemcitabine for Metastatic Pancreatic Cancer. The New England Journal of Medicine 2011;364: I numeri del cancro in Italia 2014, a cura di AIRTUM e AIOM
8 Allegato A al Decreto n. 291 del 7 ottobre 2015 pag. 8/8 METODOLOGIA I quesiti clinici riferiti alla indicazione oggetto di analisi vengono predisposti dal Gruppo di Lavoro sulla base del contesto clinico di riferimento. Il Gruppo di Lavoro ha deciso di votare, per ciascun quesito clinico, quattro aspetti: 1. Giudizio sulle alternative terapeutiche (da linee guida / da esperienza clinica): sulla base dell analisi del contesto clinico le alternative terapeutiche sono considerate: DISPONIBILI DISPONIBILI MA MENO SODDISFACENTI ASSENTI O DISPONIBILI MA INSODDISFACENTI Le alternative considerate sono le migliori alternative disponibili e possono essere rappresentate sia dal comparator da studio clinico che dalla terapia normalmente utilizzata nella pratica clinica per la medesima indicazione. 2. Giudizio sulla qualità delle evidenze: la qualità delle evidenze è classificata (secondo il metodo GRADE) in quattro categorie: ALTA MODERATA BASSA MOLTO BASSA Partendo dalla qualità teoricamente alta di uno studio randomizzato, la qualità si può abbassare per la presenza di limiti legati a bias nella conduzione e analisi dello studio, scelta del gruppo di controllo, trasferibilità, incoerenza dei risultati/eterogeneità, stime imprecise o dati insufficienti, pubblicazione selettiva dei dati. 3. Giudizio sul bilancio benefici/rischi: dopo aver identificato e classificato gli outcome clinici come importanti ed essenziali, importanti ma non essenziali e non importanti, viene assegnato un giudizio sui risultati di efficacia clinica disponibili che vengono considerati, in funzione dell importanza degli outcome clinici e dell entità dei risultati: MOLTO RILEVANTI (Outcome clinici importanti ed essenziali ed entità del risultato clinicamente rilevante) RILEVANTI (Outcome clinici importanti ma non essenziali ed entità del risultato clinicamente rilevante oppure Outcome clinici importanti ed essenziali ed entità del risultato solo moderatamente rilevante) POCO RILEVANTI (Outcome clinici non importanti benché con entità del risultato clinicamente rilevante) MARGINALI (Qualsiasi Outcome clinico ed entità del risultato clinicamente non rilevante) Viene inoltre espresso un giudizio sulla tollerabilità, considerata: BUONA DISCRETA SCARSA Sulla base del giudizio espresso su efficacia e tollerabilità viene quindi espresso un giudizio complessivo sul bilancio benefici/rischi, considerato: MOLTO FAVOREVOLE FAVOREVOLE INCERTO SFAVOREVOLE 4. Giudizio sul costo rispetto alle alternative: il costo della terapia, calcolato al netto degli eventuali sconti derivanti dagli accordi negoziali e dei meccanismi di condivisione del rischio, viene considerato, rispetto alle alternative (se presenti): INFERIORE SOVRAPPONIBILE SUPERIORE Ogni componente del Gruppo di Lavoro effettua la propria valutazione in merito a ciascun punto sopra descritto e, utilizzando un algoritmo decisionale condiviso, definisce il livello di raccomandazione del quesito in oggetto. In particolare, sono previsti quattro possibili livelli di raccomandazione: RACCOMANDATO (R) utilizzabile nella maggioranza dei pazienti MODERATAMENTE RACCOMANDATO (MR) Si nutrono dei dubbi sul fatto che il farmaco debba essere utilizzato nella maggioranza dei pazienti, ma si ritiene che il suo impiego debba essere tenuto in considerazione RACCOMANDATO IN CASI SELEZIONATI (RS) utilizzabile solo in casi selezionati di pazienti NON RACCOMANDATO (NR) si sconsiglia l utilizzo del farmaco Il livello di raccomandazione viene definito a maggioranza; in caso di pareggio o incertezza, la decisione viene assunta collegialmente. Sulla base della raccomandazione formulata, il Gruppo di Lavoro prevede una percentuale di utilizzo atteso che viene esplicitata per singola raccomandazione. In caso di quesiti su popolazioni non considerate all interno degli studi clinici, il Gruppo di Lavoro sceglie tra le opzioni NR o RS, di volta in volta, valutata anche la presenza o meno di alternative.
CABAZITAXEL - JEVTANA
 giunta regionale Allegato F al Decreto n. 139 del 3 giugno 2015 pag. 1/7 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED CABAZITAXEL - JEVTANA Indicazione in esame: in combinazione
giunta regionale Allegato F al Decreto n. 139 del 3 giugno 2015 pag. 1/7 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED CABAZITAXEL - JEVTANA Indicazione in esame: in combinazione
La valutazione multidisciplinare in sanità dalla teoria alla applicazione pratica: modello di valutazione in oncologia
 Motore Sanità - Summer School Il futuro del SSN tra modelli organizzativi, sostenibilità ed innovazione La valutazione multidisciplinare in sanità dalla teoria alla applicazione pratica: modello di valutazione
Motore Sanità - Summer School Il futuro del SSN tra modelli organizzativi, sostenibilità ed innovazione La valutazione multidisciplinare in sanità dalla teoria alla applicazione pratica: modello di valutazione
Quali strategie per un utilizzo razionale dei farmaci oncologici innovativi? L esperienza della Regione Veneto
 FARMACI ONCOLOGICI INNOVATIVI: SCENARIO ATTUALE E LORO VALUTAZIONE Quali strategie per un utilizzo razionale dei farmaci oncologici innovativi? L esperienza della Regione Veneto Roberto Leone Dipartimento
FARMACI ONCOLOGICI INNOVATIVI: SCENARIO ATTUALE E LORO VALUTAZIONE Quali strategie per un utilizzo razionale dei farmaci oncologici innovativi? L esperienza della Regione Veneto Roberto Leone Dipartimento
CRIZOTINIB - XALKORI
 giunta regionale Allegato A al Decreto n. 253 del 28 agosto 2015 pag. 1/8 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED CRIZOTINIB - XALKORI Indicazione in esame: é indicato per
giunta regionale Allegato A al Decreto n. 253 del 28 agosto 2015 pag. 1/8 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED CRIZOTINIB - XALKORI Indicazione in esame: é indicato per
Le raccomandazioni regionali all utilizzo dei farmaci ad alto costo
 Le raccomandazioni regionali all utilizzo dei farmaci ad alto costo Verona, 18 settembre, 2015 Pierfranco Conte, Alberto Bortolami Coordinamento Rete Oncologica del Veneto - ROV Compiti della Rete Oncologica
Le raccomandazioni regionali all utilizzo dei farmaci ad alto costo Verona, 18 settembre, 2015 Pierfranco Conte, Alberto Bortolami Coordinamento Rete Oncologica del Veneto - ROV Compiti della Rete Oncologica
Tavola Rotonda Monitoraggio consumo farmaci, innovazione e PDTA
 Tavola Rotonda Monitoraggio consumo farmaci, innovazione e PDTA PierFranco Conte, Silvia Adami, Alberto Bortolami, Chiara Roni, Giovanna Scroccaro Coordinamento Rete Oncologica del Veneto - ROV Università
Tavola Rotonda Monitoraggio consumo farmaci, innovazione e PDTA PierFranco Conte, Silvia Adami, Alberto Bortolami, Chiara Roni, Giovanna Scroccaro Coordinamento Rete Oncologica del Veneto - ROV Università
PERTUZUMAB - PERJETA
 giunta regionale Allegato C al Decreto n. 119 del 12 maggio 2015 pag. 1/9 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED PERTUZUMAB - PERJETA Indicazione in esame: Pertuzumab (Perjeta
giunta regionale Allegato C al Decreto n. 119 del 12 maggio 2015 pag. 1/9 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED PERTUZUMAB - PERJETA Indicazione in esame: Pertuzumab (Perjeta
nel carcinoma del pancreas esocrino metastatico (I linea di terapia) A cura del Gruppo Regionale Farmaci Oncologici (GReFO)
 Raccomandazioni evidence-based Nab-paclitaxel nel carcinoma del pancreas esocrino metastatico (I linea di terapia) A cura del Gruppo Regionale Farmaci Oncologici (GReFO) Raccomandazione d uso n. 40 Febbraio
Raccomandazioni evidence-based Nab-paclitaxel nel carcinoma del pancreas esocrino metastatico (I linea di terapia) A cura del Gruppo Regionale Farmaci Oncologici (GReFO) Raccomandazione d uso n. 40 Febbraio
SCHEDA FARMACO. Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta
 Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Indicazione terapeutica Classificazione: Spesa per paziente trattato (euro, posologia/durata)
Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Indicazione terapeutica Classificazione: Spesa per paziente trattato (euro, posologia/durata)
Documento PTR n.212 relativo a:
 Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n.212 relativo a: PAZOPANIB Aprile 2014 Pazopanib Indicazioni registrate
Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n.212 relativo a: PAZOPANIB Aprile 2014 Pazopanib Indicazioni registrate
MINI SCHEDA HTA BEVACIZUMAB (AVASTIN ) INDICAZIONE CARCINOMA OVARICO
 1/7 MINI SCHEDA HTA BEVACIZUMAB (AVASTIN ) INDICAZIONE CARCINOMA OVARICO Nome Commerciale Avastin Principio Attivo Bevacizumab Ditta Produttrice Roche ATC L01XC07 Formulazione Concentrato per soluzione
1/7 MINI SCHEDA HTA BEVACIZUMAB (AVASTIN ) INDICAZIONE CARCINOMA OVARICO Nome Commerciale Avastin Principio Attivo Bevacizumab Ditta Produttrice Roche ATC L01XC07 Formulazione Concentrato per soluzione
Accesso ai farmaci innovativi e controllo della spesa a livello regionale
 FARMACI INNOVATIVI Qualità efficacia appropriatezza 9 ottobre 2009 Camera dei Deputati Palazzo Marini (Roma) Accesso ai farmaci innovativi e controllo della spesa a livello regionale Stefania Melena Direzione
FARMACI INNOVATIVI Qualità efficacia appropriatezza 9 ottobre 2009 Camera dei Deputati Palazzo Marini (Roma) Accesso ai farmaci innovativi e controllo della spesa a livello regionale Stefania Melena Direzione
ABRAXANE (nab-paclitaxel) - Carcinoma pancreas esocrino
 Campo obbligatorio ai fini dell'eleggibilità Campo obbligatorio ABRAXAN (nab-paclitaxel) - Carcinoma pancreas esocrino Abraxane in associazione con gemcitabina è indicato per il trattamento di prima linea
Campo obbligatorio ai fini dell'eleggibilità Campo obbligatorio ABRAXAN (nab-paclitaxel) - Carcinoma pancreas esocrino Abraxane in associazione con gemcitabina è indicato per il trattamento di prima linea
A cura del Gruppo Regionale Farmaci Oncologici (GReFO) (pubblicato a maggio 2014) Aggiornata alla pubblicazione della negoziazione AIFA (luglio 2014)
 Raccomandazioni evidence-based Pertuzumab Nel carcinoma mammario avanzato HER2/neu positivo (I linea di terapia) A cura del Gruppo Regionale Farmaci Oncologici (GReFO) Raccomandazione d uso n. 26 Settembre
Raccomandazioni evidence-based Pertuzumab Nel carcinoma mammario avanzato HER2/neu positivo (I linea di terapia) A cura del Gruppo Regionale Farmaci Oncologici (GReFO) Raccomandazione d uso n. 26 Settembre
Il Direttore della Direzione Regionale Programmazione Sanitaria -Risorse Umane e Sanitarie
 Oggetto: Aggiornamento della determinazione 1875 del Modalità di erogazione dei farmaci classificati in regime di rimborsabilità in fascia H e in regime di fornitura OSP2, così come modificata dalla determinazione
Oggetto: Aggiornamento della determinazione 1875 del Modalità di erogazione dei farmaci classificati in regime di rimborsabilità in fascia H e in regime di fornitura OSP2, così come modificata dalla determinazione
REGIONE DEL VENETO AZIENDA UNITA LOCALE SOCIO-SANITARIA N. 6 VICENZA DELIBERAZIONE. n. 749 del 26-10-2015 O G G E T T O
 REGIONE DEL VENETO AZIENDA UNITA LOCALE SOCIO-SANITARIA N. 6 VICENZA DELIBERAZIONE n. 749 del 26-10-2015 O G G E T T O Istituzione Commissione per la valutazione della richiesta di farmaci non erogabili
REGIONE DEL VENETO AZIENDA UNITA LOCALE SOCIO-SANITARIA N. 6 VICENZA DELIBERAZIONE n. 749 del 26-10-2015 O G G E T T O Istituzione Commissione per la valutazione della richiesta di farmaci non erogabili
16th World Conference on Lung Cancer (WCLC): highlights
 16th World Conference on Lung Cancer (WCLC): highlights RISULTATI PRELIMINARI STUDIO ITACA Lo studio Itaca è uno studio multicentrico italiano di Fase III che confronta un trattamento chemioterapico tailored
16th World Conference on Lung Cancer (WCLC): highlights RISULTATI PRELIMINARI STUDIO ITACA Lo studio Itaca è uno studio multicentrico italiano di Fase III che confronta un trattamento chemioterapico tailored
SCHEDA FARMACO (a cura di UOS Farmacoeconomia e HTA, Area Centro) Nintedanib (VARGATEF)
 Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta SCHEDA FARMACO (a cura di UOS Farmacoeconomia e HTA, Area Centro) Nintedanib (VARGATEF)
Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta SCHEDA FARMACO (a cura di UOS Farmacoeconomia e HTA, Area Centro) Nintedanib (VARGATEF)
MINI SCHEDA HTA CRIZOTINIB (XALKORI )
 1/7 MINI SCHEDA HTA CRIZOTINIB (XALKORI ) Nome Commerciale XALKORI Principio Attivo Crizotinib Ditta Produttrice Pfizer Italia Srl ATC L01XE16 Formulazione Capsule rigide Dosaggio 200 mg 250 mg Altri antineoplastici
1/7 MINI SCHEDA HTA CRIZOTINIB (XALKORI ) Nome Commerciale XALKORI Principio Attivo Crizotinib Ditta Produttrice Pfizer Italia Srl ATC L01XE16 Formulazione Capsule rigide Dosaggio 200 mg 250 mg Altri antineoplastici
LA RESEZIONE DELLE METASTASI EPATICHE NEL TUMORE METASTATICO DEL COLON RETTO
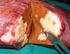 LA RESEZIONE DELLE METASTASI EPATICHE NEL TUMORE METASTATICO DEL COLON RETTO Cetuximab può ridurre la massa tumorale per permettere la resezione delle metastasi, anche, in pazienti inizialmente non resecabili,
LA RESEZIONE DELLE METASTASI EPATICHE NEL TUMORE METASTATICO DEL COLON RETTO Cetuximab può ridurre la massa tumorale per permettere la resezione delle metastasi, anche, in pazienti inizialmente non resecabili,
SEBASTIANO FILETTI. Dipartimento di Medicina Interna e Specialità Mediche. Università di Roma Sapienza, Roma
 SEBASTIANO FILETTI Dipartimento di Medicina Interna e Specialità Mediche Università di Roma Sapienza, Roma La malattia tiroidea è in aumento negli ultimi anni. Quali le ragioni? Dati epidemiologici provenienti
SEBASTIANO FILETTI Dipartimento di Medicina Interna e Specialità Mediche Università di Roma Sapienza, Roma La malattia tiroidea è in aumento negli ultimi anni. Quali le ragioni? Dati epidemiologici provenienti
Alberto Bortolami Coordinamento Rete Oncologica del Veneto Istituto Oncologico Veneto
 Alberto Bortolami Coordinamento Rete Oncologica del Veneto Istituto Oncologico Veneto Metodologia Farmaci Innovativi Metodologia Percorso Valutativo (dr. Alberto Bortolami-Coordinamento Rete Oncologica)
Alberto Bortolami Coordinamento Rete Oncologica del Veneto Istituto Oncologico Veneto Metodologia Farmaci Innovativi Metodologia Percorso Valutativo (dr. Alberto Bortolami-Coordinamento Rete Oncologica)
STUDIO OSSERVAZIONALE SULLA TERAPIA DELLA PATOLOGIA MAMMARIA INDOTTA DALLA MONOTERAPIA CON ANTIANDROGENO PURO PER ADENOCARCINOMA PROSTATICO
 STUDIO OSSERVAZIONALE SULLA TERAPIA DELLA PATOLOGIA MAMMARIA INDOTTA DALLA MONOTERAPIA CON ANTIANDROGENO PURO PER ADENOCARCINOMA PROSTATICO FAX: 0916552413 SITO WEB: www.gstu.it E-MAIL: [email protected] CRITERI
STUDIO OSSERVAZIONALE SULLA TERAPIA DELLA PATOLOGIA MAMMARIA INDOTTA DALLA MONOTERAPIA CON ANTIANDROGENO PURO PER ADENOCARCINOMA PROSTATICO FAX: 0916552413 SITO WEB: www.gstu.it E-MAIL: [email protected] CRITERI
EVEROLIMUS - AFINITOR
 giunta regionale Allegato D al Decreto n. 119 del 12 maggio 2015 pag. 1/10 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED EVEROLIMUS - AFINITOR Indicazione in esame: Everolimus
giunta regionale Allegato D al Decreto n. 119 del 12 maggio 2015 pag. 1/10 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED EVEROLIMUS - AFINITOR Indicazione in esame: Everolimus
La gestione del rischio clinico nei reparti ospedalieri e nelle RSA
 Coordinamento Regionale Unico sul Farmaco Risultati indagine regionale: La gestione del rischio clinico nei reparti ospedalieri e nelle RSA Dr.ssa Silvia Adami Venezia, 28-02-2014 2 Programma S. Adami:
Coordinamento Regionale Unico sul Farmaco Risultati indagine regionale: La gestione del rischio clinico nei reparti ospedalieri e nelle RSA Dr.ssa Silvia Adami Venezia, 28-02-2014 2 Programma S. Adami:
IL REGISTRO ONCOLOGICO COME STRUMENTO DI IMPLEMENTAZIONE DELLE DECISIONI: QUALE RUOLO NELL HTA
 IL REGISTRO ONCOLOGICO COME STRUMENTO DI IMPLEMENTAZIONE DELLE DECISIONI: QUALE RUOLO NELL HTA Francesca Caprari Direttore Affari Istituzionali e Relazioni Esterne Celgene srl L inizio Il Registro AIFA
IL REGISTRO ONCOLOGICO COME STRUMENTO DI IMPLEMENTAZIONE DELLE DECISIONI: QUALE RUOLO NELL HTA Francesca Caprari Direttore Affari Istituzionali e Relazioni Esterne Celgene srl L inizio Il Registro AIFA
CARTA INTESTATA DEL CENTRO CLINICO
 CARTA INTESTATA DEL CENTRO CLINICO CERLiguria_Mod.10_Uso_Compassionevole RICHIESTA DI PARERE AL COMITATO ETICO PER USO TERAPEUTICO DI MEDICINALE SOTTOPOSTO A SPERIMENTAZIONE CLINICA Si applica solo se
CARTA INTESTATA DEL CENTRO CLINICO CERLiguria_Mod.10_Uso_Compassionevole RICHIESTA DI PARERE AL COMITATO ETICO PER USO TERAPEUTICO DI MEDICINALE SOTTOPOSTO A SPERIMENTAZIONE CLINICA Si applica solo se
Diagnosi precoce delle neoplasie del collo dell utero
 Diagnosi precoce delle neoplasie del collo dell utero La neoplasia del collo dell utero a livello mondiale rappresenta ancora il secondo tumore maligno della donna, con circa 500.000 nuovi casi stimati
Diagnosi precoce delle neoplasie del collo dell utero La neoplasia del collo dell utero a livello mondiale rappresenta ancora il secondo tumore maligno della donna, con circa 500.000 nuovi casi stimati
MINI SCHEDA HTA AXITINIB (INLYTA )
 1/6 MINI SCHEDA HTA AXITINIB (INLYTA ) FARMACO IN ESAME Nome commerciale Inlyta Principio Attivo Axitinib Ditta Produttrice Pfizer Italia srl ATC L01XE17 Formulazione Compresse rivestite Dosaggio 1 mg
1/6 MINI SCHEDA HTA AXITINIB (INLYTA ) FARMACO IN ESAME Nome commerciale Inlyta Principio Attivo Axitinib Ditta Produttrice Pfizer Italia srl ATC L01XE17 Formulazione Compresse rivestite Dosaggio 1 mg
NSCLC - stadio iiib/iv
 I TUMORI POLMONARI linee guida per la pratica clinica NSCLC - stadio iiib/iv quale trattamento per i pazienti anziani con malattia avanzata? Il carcinoma polmonare è un tumore frequente nell età avanzata.
I TUMORI POLMONARI linee guida per la pratica clinica NSCLC - stadio iiib/iv quale trattamento per i pazienti anziani con malattia avanzata? Il carcinoma polmonare è un tumore frequente nell età avanzata.
Sinossi di studio clinico Codice: GECP06/01 Pag. 1 di 5
 Codice: GECP06/01 Pag. 1 di 5 Studio aperto randomizzato multicentrico di fase III di confronto tra il trattamento con Erlotinib (Tarceva ) e la chemioterapia nei pazienti affetti da carcinoma non a piccole
Codice: GECP06/01 Pag. 1 di 5 Studio aperto randomizzato multicentrico di fase III di confronto tra il trattamento con Erlotinib (Tarceva ) e la chemioterapia nei pazienti affetti da carcinoma non a piccole
Nella provincia di Latina sono diagnosticati in media ogni anno 98 casi ogni 100.000 uomini e 27 ogni 100.000 donne.
 TUMORE DEL POLMONE Nel periodo 27-211 sono stati registrati complessivamente in provincia di Latina 172 nuovi casi di tumore del polmone. E risultato al 1 posto in termini di frequenza fra le neoplasie
TUMORE DEL POLMONE Nel periodo 27-211 sono stati registrati complessivamente in provincia di Latina 172 nuovi casi di tumore del polmone. E risultato al 1 posto in termini di frequenza fra le neoplasie
BEVACIZUMAB - AVASTIN
 giunta regionale Allegato B al Decreto n. 139 del 3 giugno 2015 pag. 1/8 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED BEVACIZUMAB - AVASTIN Indicazione in esame: Bevacizumab
giunta regionale Allegato B al Decreto n. 139 del 3 giugno 2015 pag. 1/8 Regione del Veneto Area Sanità e Sociale RACCOMANDAZIONI EVIDENCE BASED BEVACIZUMAB - AVASTIN Indicazione in esame: Bevacizumab
GESTIONE DEL PAZIENTE NEFROPATICO
 II edizione del corso teorico pratico GESTIONE DEL PAZIENTE NEFROPATICO IL TRAPIANTO RENALE NEL PAZIENTE ANZIANO Angelica Parodi UOC Nefrologia e Dialisi L età dei pazienti con ESRD è in aumento esponenziale
II edizione del corso teorico pratico GESTIONE DEL PAZIENTE NEFROPATICO IL TRAPIANTO RENALE NEL PAZIENTE ANZIANO Angelica Parodi UOC Nefrologia e Dialisi L età dei pazienti con ESRD è in aumento esponenziale
Cetuximab e mutazione K-Ras nel tumore del colon-retto
 Università di Pisa Dipartimento di Farmacia Corso di laurea in CTF Corso: Basi biochimiche dell azione dei farmaci Cetuximab e mutazione K-Ras nel tumore del colon-retto Pisa, 27/03/2014 Samuela Fabiani
Università di Pisa Dipartimento di Farmacia Corso di laurea in CTF Corso: Basi biochimiche dell azione dei farmaci Cetuximab e mutazione K-Ras nel tumore del colon-retto Pisa, 27/03/2014 Samuela Fabiani
Informazioni per potenziali partecipanti. Possiamo sciogliere l'amiloidosi AL?
 Informazioni per potenziali partecipanti Possiamo sciogliere l'amiloidosi AL? È ora di affrontare diversamente l amiloidosi AL? L amiloidosi AL è una malattia rara e spesso fatale causata dall accumulo
Informazioni per potenziali partecipanti Possiamo sciogliere l'amiloidosi AL? È ora di affrontare diversamente l amiloidosi AL? L amiloidosi AL è una malattia rara e spesso fatale causata dall accumulo
Il contributo dei Centri di servizi per anziani a supporto della domiciliarità: alcune esperienze a livello locale
 Il contributo dei Centri di servizi per anziani a supporto della domiciliarità: alcune esperienze a livello locale dr. Stefano Vianello - Direttore Distretto Socio-Sanitario 1 Dr.ssa Beatrice Baggio -
Il contributo dei Centri di servizi per anziani a supporto della domiciliarità: alcune esperienze a livello locale dr. Stefano Vianello - Direttore Distretto Socio-Sanitario 1 Dr.ssa Beatrice Baggio -
Grazie dell attenzione
 Grazie dell attenzione http://www.registri-tumori.it/pdf/aiom2012/i_numeri_del_cancro_2012.pdf In Italia circa 2.250mila persone (4% del totale della popolazione) vivono avendo avuto una precedente
Grazie dell attenzione http://www.registri-tumori.it/pdf/aiom2012/i_numeri_del_cancro_2012.pdf In Italia circa 2.250mila persone (4% del totale della popolazione) vivono avendo avuto una precedente
PREVENZIONE POLMONITE
 fiammaz o l m o n a r e struzione br avità pleuri Streptococcus p n e u m o n i a Infezione Mal Respiratorio PREVENZIONE POLMONITE Vaccino Pneumococcico Polisaccaridico Coniugato, (13Valente Adsorbito)
fiammaz o l m o n a r e struzione br avità pleuri Streptococcus p n e u m o n i a Infezione Mal Respiratorio PREVENZIONE POLMONITE Vaccino Pneumococcico Polisaccaridico Coniugato, (13Valente Adsorbito)
Panitumumab. Raccomandazioni evidence-based. Carcinoma colon-rettale metastatico (I linea di terapia)
 Raccomandazioni evidence-based Panitumumab Carcinoma colon-rettale metastatico (I linea di terapia) A cura del Gruppo Regionale Farmaci Oncologici (GReFO) Raccomandazione d uso n. 36 Ottobre 2014 Direzione
Raccomandazioni evidence-based Panitumumab Carcinoma colon-rettale metastatico (I linea di terapia) A cura del Gruppo Regionale Farmaci Oncologici (GReFO) Raccomandazione d uso n. 36 Ottobre 2014 Direzione
MINI SCHEDA HTA EVEROLIMUS (AFINITOR ) INDICAZIONE CARCINOMA MAMMARIO
 1/7 MINI SCHEDA HTA EVEROLIMUS (AFINITOR ) INDICAZIONE CARCINOMA MAMMARIO Nome Commerciale AFINITOR Principio Attivo everolimus Ditta Produttrice Novartis Farma spa ATC L01XE10 Formulazione Compresse Dosaggio
1/7 MINI SCHEDA HTA EVEROLIMUS (AFINITOR ) INDICAZIONE CARCINOMA MAMMARIO Nome Commerciale AFINITOR Principio Attivo everolimus Ditta Produttrice Novartis Farma spa ATC L01XE10 Formulazione Compresse Dosaggio
Trials clinici. Disegni di studio
 Trials Clinici Dott.ssa Pamela Di Giovanni Studi descrittivi Disegni di studio Popolazioni Individui Studi analitici Osservazionali Sperimentali Studi di correlazione o ecologici Case report - Case series
Trials Clinici Dott.ssa Pamela Di Giovanni Studi descrittivi Disegni di studio Popolazioni Individui Studi analitici Osservazionali Sperimentali Studi di correlazione o ecologici Case report - Case series
Capitolo 6 La mortalità per malattie del fegato
 Capitolo 6 La mortalità per malattie del fegato Introduzione In questo capitolo viene presentata la mortalità per malattie epatiche. Si è scelto di aggregare patologie classificate in diverse parti della
Capitolo 6 La mortalità per malattie del fegato Introduzione In questo capitolo viene presentata la mortalità per malattie epatiche. Si è scelto di aggregare patologie classificate in diverse parti della
REGIONE DEL VENETO AZIENDA UNITA LOCALE SOCIO SANITARIA N. 6 VICENZA PROVVEDIMENTO DEL DIRIGENTE RESPONSABILE
 REGIONE DEL VENETO AZIENDA UNITA LOCALE SOCIO SANITARIA N. 6 VICENZA PROVVEDIMENTO DEL DIRIGENTE RESPONSABILE Servizio Risorse Umane e Relazioni Sindacali delegato dal Direttore Generale dell Azienda con
REGIONE DEL VENETO AZIENDA UNITA LOCALE SOCIO SANITARIA N. 6 VICENZA PROVVEDIMENTO DEL DIRIGENTE RESPONSABILE Servizio Risorse Umane e Relazioni Sindacali delegato dal Direttore Generale dell Azienda con
Aggiornamenti su RAS: mutazioni di KRAS ed NRAS nel carcinoma del colon retto. Carmelo Lupo
 Aggiornamenti su RAS: mutazioni di KRAS ed NRAS nel carcinoma del colon retto Carmelo Lupo RAS-RAF signaling Activation of the RAS-RAF signaling cascade occurs via the following sequential steps 1 : Activation
Aggiornamenti su RAS: mutazioni di KRAS ed NRAS nel carcinoma del colon retto Carmelo Lupo RAS-RAF signaling Activation of the RAS-RAF signaling cascade occurs via the following sequential steps 1 : Activation
16/05/2012. La Legge 648/96: una risorsa tutta italiana, da perfezionare e mutare. Carlo Tomino. Roma, 10 Maggio 2012
 La Legge 648/96: una risorsa tutta italiana, da perfezionare e mutare. Carlo Tomino Roma, 10 Maggio 2012 1 Dichiarazione di trasparenza/interessi: Carlo Tomino, dirigente Le opinioni espresse in questa
La Legge 648/96: una risorsa tutta italiana, da perfezionare e mutare. Carlo Tomino Roma, 10 Maggio 2012 1 Dichiarazione di trasparenza/interessi: Carlo Tomino, dirigente Le opinioni espresse in questa
Quando il dolore è ancora un problema. XVII CIPOMO Congresso Nazionale Roma, 20-22 giugno 2013
 Quando il dolore è ancora un problema XVII CIPOMO Congresso Nazionale Roma, 20-22 giugno 2013 Marta Gentili vivere senza dolore onlus In Italia, nel 2012, si stimano circa 364 mila nuove diagnosi per tumore
Quando il dolore è ancora un problema XVII CIPOMO Congresso Nazionale Roma, 20-22 giugno 2013 Marta Gentili vivere senza dolore onlus In Italia, nel 2012, si stimano circa 364 mila nuove diagnosi per tumore
Governo del Farmaco. Azienda Ospedaliera di Verona
 Governo del Farmaco Elementi organizzativi e tecnologie: Esperienze a confronto Venezia 23 Febbraio 2009 Giovanna Scroccaro Azienda Ospedaliera di Verona Governo del Farmaco Elementi organizzativi e tecnologie:
Governo del Farmaco Elementi organizzativi e tecnologie: Esperienze a confronto Venezia 23 Febbraio 2009 Giovanna Scroccaro Azienda Ospedaliera di Verona Governo del Farmaco Elementi organizzativi e tecnologie:
Il programma si compone di due ricerche internazionali sulle valutazioni legate all assistenza degli individui affetti da tali patologie.
 Keeping Care Complete Sintesi dei risultati internazionali Keeping Care Complete ha l obiettivo di esaminare e creare consapevolezza circa le questioni emotive e sociali associate al trattamento e all
Keeping Care Complete Sintesi dei risultati internazionali Keeping Care Complete ha l obiettivo di esaminare e creare consapevolezza circa le questioni emotive e sociali associate al trattamento e all
Contenuti e indicatori per le CPDO - Mario Saugo
 Restituzione report 2012/3 CD e CPDO Montecchio P.no, 07/11/2014 REGIONE DEL VENETO Contenuti e indicatori per le CPDO - Mario Saugo Valutazione dei ricoveri di fine vita I pazienti in CPDO, specialmente
Restituzione report 2012/3 CD e CPDO Montecchio P.no, 07/11/2014 REGIONE DEL VENETO Contenuti e indicatori per le CPDO - Mario Saugo Valutazione dei ricoveri di fine vita I pazienti in CPDO, specialmente
AZIENDA PROVINCIALE PER I SERVIZI SANITARI
 Provincia Autonoma di Trento AZIENDA PROVINCIALE PER I SERVIZI SANITARI Trento via Degasperi 79 VERBALE DI DELIBERAZIONE DEL DIRETTORE GENERALE Reg. delib. n. 271 2014 OGGETTO: Approvazione del documento
Provincia Autonoma di Trento AZIENDA PROVINCIALE PER I SERVIZI SANITARI Trento via Degasperi 79 VERBALE DI DELIBERAZIONE DEL DIRETTORE GENERALE Reg. delib. n. 271 2014 OGGETTO: Approvazione del documento
L età dei vincitori La presenza femminile. L età dei vincitori La presenza femminile. Confronto tra il concorso ordinario ed il concorso riservato
 Premessa Corso-concorso ordinario L età dei vincitori La presenza femminile Corso-concorso riservato L età dei vincitori La presenza femminile Confronto tra il concorso ordinario ed il concorso riservato
Premessa Corso-concorso ordinario L età dei vincitori La presenza femminile Corso-concorso riservato L età dei vincitori La presenza femminile Confronto tra il concorso ordinario ed il concorso riservato
E.Molfese, P.Matteucci, A.Iurato, M. Fiore, L.E. Trodella, L. Poggesi, R.M. D Angelillo, E. Iannacone, L.Trodella!
 Il trattamento stereotassico delle lesioni surrenaliche in pazienti oligometastatici affetti da NSCLC: una promettente arma per il controllo locale di malattia?! E.Molfese, P.Matteucci, A.Iurato, M. Fiore,
Il trattamento stereotassico delle lesioni surrenaliche in pazienti oligometastatici affetti da NSCLC: una promettente arma per il controllo locale di malattia?! E.Molfese, P.Matteucci, A.Iurato, M. Fiore,
SINOSSI DELLO STUDIO EUDRACT N. 2012-001028-36 COORDINAMENTO E RESPONSABILE DELLO STUDIO
 SINOSSI DELLO STUDIO TITOLO EUDRACT N. 2012-001028-36 COORDINAMENTO E RESPONSABILE DELLO STUDIO SPONSOR Sequenza ottimale di ormonoterapia in pazienti con carcinoma mammario metastatico ricadute dopo terapia
SINOSSI DELLO STUDIO TITOLO EUDRACT N. 2012-001028-36 COORDINAMENTO E RESPONSABILE DELLO STUDIO SPONSOR Sequenza ottimale di ormonoterapia in pazienti con carcinoma mammario metastatico ricadute dopo terapia
IL MEDICO DI MEDICINA GENERALE E LA NEFROPATIA DIABETICA: studio sui comportamenti prescrittivi diagnosticoterapeutici di un gruppo di medici genovesi
 Università degli Studi di Genova Facoltà di Medicina e Chirurgia IL MEDICO DI MEDICINA GENERALE E LA NEFROPATIA DIABETICA: studio sui comportamenti prescrittivi diagnosticoterapeutici di un gruppo di medici
Università degli Studi di Genova Facoltà di Medicina e Chirurgia IL MEDICO DI MEDICINA GENERALE E LA NEFROPATIA DIABETICA: studio sui comportamenti prescrittivi diagnosticoterapeutici di un gruppo di medici
LA PANDEMIA SILENTE DEL DIABETE: UN EMERGENZA SANITARIA, SOCIALE ED ECONOMICA
 LA PANDEMIA SILENTE DEL DIABETE: UN EMERGENZA SANITARIA, SOCIALE ED ECONOMICA Antonio Nicolucci Direttore Dipartimento di Farmacologia Clinica e Epidemiologia, Consorzio Mario Negri Sud Coordinatore Data
LA PANDEMIA SILENTE DEL DIABETE: UN EMERGENZA SANITARIA, SOCIALE ED ECONOMICA Antonio Nicolucci Direttore Dipartimento di Farmacologia Clinica e Epidemiologia, Consorzio Mario Negri Sud Coordinatore Data
Piano di investimento dei fondi per la Farmacovigilanza 2008-2009. Regione Lazio
 Piano di investimento dei fondi per la Farmacovigilanza 2008-2009 Regione Lazio Premessa L attuazione delle linee di indirizzo elaborate dalla Regione Lazio per l impegno dei fondi 2007 della farmacovigilanza
Piano di investimento dei fondi per la Farmacovigilanza 2008-2009 Regione Lazio Premessa L attuazione delle linee di indirizzo elaborate dalla Regione Lazio per l impegno dei fondi 2007 della farmacovigilanza
Chairmen: Sabino De Placido, Luca Gianni
 Chairmen: Sabino De Placido, Luca Gianni P R O G R A M M A S C I E N T I F I C O P R E L I M I N A R E COORDINATORI SCIENTIFICI SABINO DE PLACIDO Università Degli Studi di Napoli Federico II, Napoli LUCA
Chairmen: Sabino De Placido, Luca Gianni P R O G R A M M A S C I E N T I F I C O P R E L I M I N A R E COORDINATORI SCIENTIFICI SABINO DE PLACIDO Università Degli Studi di Napoli Federico II, Napoli LUCA
TEST SULLE CONOSCENZE ED ESERCIZI DEL MANUALE 3 SU EBM
 TEST SULLE CONOSCENZE ED ESERCIZI DEL MANUALE 3 SU EBM 3.1 Test di conoscenza sulla EBM 1) Quali sono i due modi principali in cui viene tradotto in italiano Evidence-Based medicine?: a) b) 2) Quali sono
TEST SULLE CONOSCENZE ED ESERCIZI DEL MANUALE 3 SU EBM 3.1 Test di conoscenza sulla EBM 1) Quali sono i due modi principali in cui viene tradotto in italiano Evidence-Based medicine?: a) b) 2) Quali sono
Modulo 4 LA GESTIONE CONDIVISA TRA SPECIALISTA E MMG DELLE SINDROMI RINO-BRONCHIALI
 Modulo 4 LA GESTIONE CONDIVISA TRA SPECIALISTA E MMG DELLE SINDROMI RINO-BRONCHIALI 1 Obiettivi del modulo 4 Definire i principali ostacoli che incontra il MMG nella sua attività quotidiana Spiegare le
Modulo 4 LA GESTIONE CONDIVISA TRA SPECIALISTA E MMG DELLE SINDROMI RINO-BRONCHIALI 1 Obiettivi del modulo 4 Definire i principali ostacoli che incontra il MMG nella sua attività quotidiana Spiegare le
Terapia in fase Avanzata
 IL CARCINOMA DEL COLON-RETTO 14 OTTOBRE 2011, ROMA Terapia in fase Avanzata Maria Sofia Rosati Oncologia A Policlinico Umberto I Roma Numeri.. e persone!! ***Solo il 56% *50% dei pz con CRC è over 70 degli
IL CARCINOMA DEL COLON-RETTO 14 OTTOBRE 2011, ROMA Terapia in fase Avanzata Maria Sofia Rosati Oncologia A Policlinico Umberto I Roma Numeri.. e persone!! ***Solo il 56% *50% dei pz con CRC è over 70 degli
HTA e farmaci: il ruolo dell AIFA
 HTA e farmaci: il ruolo dell AIFA Simona Montilla 12 luglio 2013 Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono personali e non impegnano in alcun modo l AIFA
HTA e farmaci: il ruolo dell AIFA Simona Montilla 12 luglio 2013 Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono personali e non impegnano in alcun modo l AIFA
REGOLAMENTO PER LA MISURAZIONE E LA VALUTAZIONE DEL PERSONALE DEI LIVELLI
 REGOLAMENTO PER LA MISURAZIONE E LA VALUTAZIONE DEL PERSONALE DEI LIVELLI Art. 1 campo di applicazione. 1. Il presente regolamento definisce i criteri per la valutazione e la premialità del personale dei
REGOLAMENTO PER LA MISURAZIONE E LA VALUTAZIONE DEL PERSONALE DEI LIVELLI Art. 1 campo di applicazione. 1. Il presente regolamento definisce i criteri per la valutazione e la premialità del personale dei
DISTURBI AFFETTIVI. Antonio Lora DISTURBI AFFETTIVI NEI DSM LOMBARDI (2009) 27/09/2012 8.223 PAZIENTI CON DISTURBO BIPOLARE
 DISTURBI AFFETTIVI Antonio Lora DISTURBI AFFETTIVI NEI DSM LOMBARDI (2009) DIST. BIPOLARE DIST. 6% DEPRESSIVO 17% 8.223 PAZIENTI CON DISTURBO BIPOLARE 22.234 CON DISTURBO DEPRESSIVO PREVALENZA TRATTATA
DISTURBI AFFETTIVI Antonio Lora DISTURBI AFFETTIVI NEI DSM LOMBARDI (2009) DIST. BIPOLARE DIST. 6% DEPRESSIVO 17% 8.223 PAZIENTI CON DISTURBO BIPOLARE 22.234 CON DISTURBO DEPRESSIVO PREVALENZA TRATTATA
VIGILANZA SU FARMACI E FITOTERAPICI
 VIGILANZA SU FARMACI E FITOTERAPICI VIGILANZA SUI FARMACI Gli operatori sanitari (medici, farmacisti, infermieri ecc.) devono: compilare l apposita scheda di segnalazione delle reazioni avverse (vedi allegato1);
VIGILANZA SU FARMACI E FITOTERAPICI VIGILANZA SUI FARMACI Gli operatori sanitari (medici, farmacisti, infermieri ecc.) devono: compilare l apposita scheda di segnalazione delle reazioni avverse (vedi allegato1);
Prevenzione della tossicità cutanea indotta da trattamento radioterapico nel tumore della mammella: confronto tra diversi trattamenti topici
 Prevenzione della tossicità cutanea indotta da trattamento radioterapico nel tumore della mammella: G.Virdis, G. Pavanato, G. Mandoliti SOC Radioterapia Oncologica Azienda ULSS 18 - Rovigo Obiettivi dello
Prevenzione della tossicità cutanea indotta da trattamento radioterapico nel tumore della mammella: G.Virdis, G. Pavanato, G. Mandoliti SOC Radioterapia Oncologica Azienda ULSS 18 - Rovigo Obiettivi dello
Salute percepita nella ASL 8 di Cagliari
 Salute percepita nella ASL 8 di Cagliari Servizio Igiene e Sanità Pubblica Direttore Dott. Giorgio Carlo Steri Database PASSI 2010 2013 % (IC95%) Percezione del proprio stato di salute: Buono Discreto
Salute percepita nella ASL 8 di Cagliari Servizio Igiene e Sanità Pubblica Direttore Dott. Giorgio Carlo Steri Database PASSI 2010 2013 % (IC95%) Percezione del proprio stato di salute: Buono Discreto
I nuovi anticoagulanti orali nella fibrillazione atriale non valvolare: le linee guida per la prescrizione
 I nuovi anticoagulanti orali nella fibrillazione atriale non valvolare: le linee guida per la prescrizione Anna Maria Marata Area Valutazione del Farmaco ASSR Regione Emilia Romagna 9 Dicembre 2013 October
I nuovi anticoagulanti orali nella fibrillazione atriale non valvolare: le linee guida per la prescrizione Anna Maria Marata Area Valutazione del Farmaco ASSR Regione Emilia Romagna 9 Dicembre 2013 October
Metodologia di calcolo del pay-back 5% - 2013
 Metodologia di calcolo del pay-back 5% - 2013 Vista la proroga al 31 dicembre 2013 emanata ai sensi del D.P.C.M. 26 giugno 2013, dei termini previsti all art.9, comma 1, del D.L. 31 dicembre 2007, n.248,
Metodologia di calcolo del pay-back 5% - 2013 Vista la proroga al 31 dicembre 2013 emanata ai sensi del D.P.C.M. 26 giugno 2013, dei termini previsti all art.9, comma 1, del D.L. 31 dicembre 2007, n.248,
L ESEMPIO DELLA VALVOLA CARDIACA TRANSCATETERE
 L ESEMPIO DELLA VALVOLA CARDIACA TRANSCATETERE VALVOLA CARDIACA TRANSCATETERE L ASSESSMENT Caratteristiche del dispositivo medico: le protesi valvolari aortiche trascatetere in commercio presentano alcune
L ESEMPIO DELLA VALVOLA CARDIACA TRANSCATETERE VALVOLA CARDIACA TRANSCATETERE L ASSESSMENT Caratteristiche del dispositivo medico: le protesi valvolari aortiche trascatetere in commercio presentano alcune
Ministero della Salute
 ALLEGATO 1 N. Ministero della Salute DIPARTIMENTO DELLA PREVENZIONE E DELLA COMUNICAZIONE DIREZIONE GENERALE DELLA PREVENZIONE SANITARIA Ufficio V - Malattie Infettive e Profilassi Internazionale DGPREV.V/19262/P/I.4.c.a.9
ALLEGATO 1 N. Ministero della Salute DIPARTIMENTO DELLA PREVENZIONE E DELLA COMUNICAZIONE DIREZIONE GENERALE DELLA PREVENZIONE SANITARIA Ufficio V - Malattie Infettive e Profilassi Internazionale DGPREV.V/19262/P/I.4.c.a.9
SCELTA DELL APPROCCIO. A corredo delle linee guida per l autovalutazione e il miglioramento
 SCELTA DELL APPROCCIO A corredo delle linee guida per l autovalutazione e il miglioramento 1 SCELTA DELL APPROCCIO l approccio all autovalutazione diffusa può essere normale o semplificato, a seconda delle
SCELTA DELL APPROCCIO A corredo delle linee guida per l autovalutazione e il miglioramento 1 SCELTA DELL APPROCCIO l approccio all autovalutazione diffusa può essere normale o semplificato, a seconda delle
Autorità Nazionale Anticorruzione e per la valutazione e la trasparenza delle amministrazioni pubbliche
 Autorità Nazionale Anticorruzione e per la valutazione e la trasparenza delle amministrazioni pubbliche Metodologia dell attività di vigilanza e controllo dell Autorità in relazione agli obblighi di pubblicazione
Autorità Nazionale Anticorruzione e per la valutazione e la trasparenza delle amministrazioni pubbliche Metodologia dell attività di vigilanza e controllo dell Autorità in relazione agli obblighi di pubblicazione
UNIVERSITA DEGLI STUDI DI PERUGIA STATUTO DEL CENTRO UNIVERSITARIO DI RICERCA INTERDIPARTIMENTALE SULL ATTIVITÀ MOTORIA (C.U.R.I.A.MO.
 UNIVERSITA DEGLI STUDI DI PERUGIA STATUTO DEL CENTRO UNIVERSITARIO DI RICERCA INTERDIPARTIMENTALE SULL ATTIVITÀ MOTORIA (C.U.R.I.A.MO.) Art. 1 E costituito il Centro Universitario di Ricerca Interdipartimentale
UNIVERSITA DEGLI STUDI DI PERUGIA STATUTO DEL CENTRO UNIVERSITARIO DI RICERCA INTERDIPARTIMENTALE SULL ATTIVITÀ MOTORIA (C.U.R.I.A.MO.) Art. 1 E costituito il Centro Universitario di Ricerca Interdipartimentale
L ESPERIENZA DELLE REGIONE LAZIO NELLA GESTIONE DELLE INFEZIONI CORRELATE ALL ASSISTENZA
 L ESPERIENZA DELLE REGIONE LAZIO NELLA GESTIONE DELLE INFEZIONI CORRELATE ALL ASSISTENZA Dott.ssa Cristina Matranga Coordinamento Regionale Rischio Clinico INCIDENZA DI PAZIENTI INFETTI 5,2% IN ITALIA
L ESPERIENZA DELLE REGIONE LAZIO NELLA GESTIONE DELLE INFEZIONI CORRELATE ALL ASSISTENZA Dott.ssa Cristina Matranga Coordinamento Regionale Rischio Clinico INCIDENZA DI PAZIENTI INFETTI 5,2% IN ITALIA
REGIONE DEL VENETO ISTITUTO ONCOLOGICO VENETO I.R.C.C.S. DELIBERAZIONE DEL DIRETTORE GENERALE N. 85 DEL 13/03/2013
 REGIONE DEL VENETO ISTITUTO ONCOLOGICO VENETO I.R.C.C.S. DELIBERAZIONE DEL DIRETTORE GENERALE N. 85 DEL 13/03/2013 OGGETTO: Approvazione convenzione con la Società Pierre Fabre Pharma srl di Milano per
REGIONE DEL VENETO ISTITUTO ONCOLOGICO VENETO I.R.C.C.S. DELIBERAZIONE DEL DIRETTORE GENERALE N. 85 DEL 13/03/2013 OGGETTO: Approvazione convenzione con la Società Pierre Fabre Pharma srl di Milano per
La tutela dei pazienti affetti da malattie rare
 La tutela dei pazienti affetti da malattie rare Isabella Quinti Responsabile Centro di Riferimento Immunodeficienze Primitive Sapienza Università di Roma La tutela Sociale: Non sentirsi solo Legislativa
La tutela dei pazienti affetti da malattie rare Isabella Quinti Responsabile Centro di Riferimento Immunodeficienze Primitive Sapienza Università di Roma La tutela Sociale: Non sentirsi solo Legislativa
La sopravvivenza dei malati di tumore in Veneto
 luglio 2014, SER Sistema Epidemiologico Regionale Azienda ULSS 4 Alto Vicentino Area Sanità e Sociale - Sezione Controlli Governo e Personale SSR Regione Veneto La sopravvivenza dei malati di tumore in
luglio 2014, SER Sistema Epidemiologico Regionale Azienda ULSS 4 Alto Vicentino Area Sanità e Sociale - Sezione Controlli Governo e Personale SSR Regione Veneto La sopravvivenza dei malati di tumore in
BOLLETTINO UFFICIALE DELLA REGIONE CAMPANIA - N. 28 DEL 26 GIUGNO 2006
 REGIONE CAMPANIA - Giunta Regionale - Seduta del 6 giugno 2006 - Deliberazione N. 737 - Area Generale di Coordinamento N. 20 - Assistenza Sanitaria - Regolamentazione farmaci di fascia H: modalita di prescrizione
REGIONE CAMPANIA - Giunta Regionale - Seduta del 6 giugno 2006 - Deliberazione N. 737 - Area Generale di Coordinamento N. 20 - Assistenza Sanitaria - Regolamentazione farmaci di fascia H: modalita di prescrizione
RAZIONALE ED OBIETTIVI DIDATTICI
 PRESIDENTI COMITATO ORGANIZZATORE Giovanni Battista D Errico COMITATO SCIENTIFICO Vincenzo Contursi Giovanni Battista D Errico SEGRETERIA SCIENTIFICA SIICP-Società Italiana Interdisciplinare per le Cure
PRESIDENTI COMITATO ORGANIZZATORE Giovanni Battista D Errico COMITATO SCIENTIFICO Vincenzo Contursi Giovanni Battista D Errico SEGRETERIA SCIENTIFICA SIICP-Società Italiana Interdisciplinare per le Cure
Allegato I. Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Vista la relazione di valutazione del comitato di valutazione
Allegato I Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Vista la relazione di valutazione del comitato di valutazione
EMATOLOGI ED INTERNISTI A C O N F R O N T O : NELLA GESTIONE MULTIDISCIPLINARE DELLA LEUCEMIA LINFATICA CRONICA
 EMATOLOGI ED INTERNISTI A C O N F R O N T O : EVIDENCE-BASED MEDICINE NELLA GESTIONE MULTIDISCIPLINARE DELLA LEUCEMIA LINFATICA CRONICA MULTIDISCIPLINARIETÀ E SINERGISMO NELLA LLC: EMATOLOGI ED INTERNISTI
EMATOLOGI ED INTERNISTI A C O N F R O N T O : EVIDENCE-BASED MEDICINE NELLA GESTIONE MULTIDISCIPLINARE DELLA LEUCEMIA LINFATICA CRONICA MULTIDISCIPLINARIETÀ E SINERGISMO NELLA LLC: EMATOLOGI ED INTERNISTI
REGOLAMENTO COMUNALE DELLE ASSOCIAZIONI INDICE
 C O M U N E D I B A Z Z A N O REGOLAMENTO COMUNALE DELLE ASSOCIAZIONI Allegato alla delibera di Consiglio Comunale n.104 del28/11/2011 INDICE Art. 1 - Finalità Art. 2- Registro comunale delle associazioni
C O M U N E D I B A Z Z A N O REGOLAMENTO COMUNALE DELLE ASSOCIAZIONI Allegato alla delibera di Consiglio Comunale n.104 del28/11/2011 INDICE Art. 1 - Finalità Art. 2- Registro comunale delle associazioni
REGOLAMENTO DI VALUTAZIONE DEL PERSONALE DIPENDENTE
 REGOLAMENTO DI VALUTAZIONE DEL PERSONALE DIPENDENTE Approvato con Determinazione del Direttore Generale n. 244 del 20/07/2010 L importanza di un sistema operativo di valutazione comune e riconoscibile
REGOLAMENTO DI VALUTAZIONE DEL PERSONALE DIPENDENTE Approvato con Determinazione del Direttore Generale n. 244 del 20/07/2010 L importanza di un sistema operativo di valutazione comune e riconoscibile
Prescrizione di un programma di esercizio fisico strutturato
 Prescrizione di un programma di esercizio fisico strutturato a P. Sarto, a F. Giorgiano; b D. Frezza; c D. Noventa, c F. Giada, d V. Lamberti, e F. Banovich, f M. Zaccaria, g F. Michieletto, g F. Russo.
Prescrizione di un programma di esercizio fisico strutturato a P. Sarto, a F. Giorgiano; b D. Frezza; c D. Noventa, c F. Giada, d V. Lamberti, e F. Banovich, f M. Zaccaria, g F. Michieletto, g F. Russo.
L Investigator s Brochure. Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari. Maglie 25 novembre 2004
 L Investigator s Brochure Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari Maglie 25 novembre 2004 Investigator s Brochure Good Clinical Practice DM 15/07/97 Cosa è? L IB è una raccolta
L Investigator s Brochure Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari Maglie 25 novembre 2004 Investigator s Brochure Good Clinical Practice DM 15/07/97 Cosa è? L IB è una raccolta
PROGRAMMA DI PREVENZIONE CARDIOVASCOLARE nella REGIONE VENETO
 PROGRAMMA DI PREVENZIONE CARDIOVASCOLARE nella REGIONE VENETO Il programma di prevenzione cardiovascolare è stato attivato nella Regione Veneto nel corso del 2008, dopo una fase di preparazione durata
PROGRAMMA DI PREVENZIONE CARDIOVASCOLARE nella REGIONE VENETO Il programma di prevenzione cardiovascolare è stato attivato nella Regione Veneto nel corso del 2008, dopo una fase di preparazione durata
Sperimentazione Clinica: ruolo e responsabilità dell Infermiere
 Sperimentazione Clinica: ruolo e responsabilità dell Infermiere Fasi dello studio Disegni di ricerca sperimentale Barbara Gorini, Investigator Site Development Lead, Development Operations- Pfizer ITALIA
Sperimentazione Clinica: ruolo e responsabilità dell Infermiere Fasi dello studio Disegni di ricerca sperimentale Barbara Gorini, Investigator Site Development Lead, Development Operations- Pfizer ITALIA
ALLEGATO I. Pagina 1 di 6
 ALLEGATO I ELENCO DEL NOME, DELLA FORMA FARMACEUTICA, DEL DOSAGGIO DEL MEDICINALE VETERINARIO, DELLA SPECIE ANIMALE, DELLE VIE DI SOMMINISTRAZIONE, DEL TITOLARE DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO
ALLEGATO I ELENCO DEL NOME, DELLA FORMA FARMACEUTICA, DEL DOSAGGIO DEL MEDICINALE VETERINARIO, DELLA SPECIE ANIMALE, DELLE VIE DI SOMMINISTRAZIONE, DEL TITOLARE DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO
