Distribuzione AA in banca dati
|
|
|
- Giacomo Venturi
- 9 anni fa
- Visualizzazioni
Transcript
1 Aminoacidi
2
3
4 Distribuzione AA in banca dati
5 Distribuzione AA in banca dati
6 Aminoacidi
7 Aminoacidi
8 Aminoacidi
9 Aminoacidi
10 Aminoacidi
11 (rappresenta l'assorbanza provocata da una soluzione a concentrazione molare unitaria della sostanza ad una data lunghezza d'onda, attraverso una cella di lunghezza ottica unitaria)
12 Aminoacidi
13 Aminoacidi
14 Aminoacidi
15 Aminoacidi
16 Aminoacidi
17 Aminoacidi
18
19
20
21
22
23
24 Sono solo 20 gli aminoacidi in natura codificati geneticamente?? 1. Il 21esimo aminoacido la selenocisteina 2. Il 22esimo aminoacido la pirrolisina 3. Forse altri..
25
26
27 Protein AminoAcids Name (Residue) 3 letter code Single code Relative abundance (%) E.C. MW pk VdW volume(å3) Charged, Polar, Hydrophobic Alanine ALA A H Arginine ARG R C+ Asparagine ASN N P Aspartate ASP D C Cysteine CYS C P Glutamate GLU E C Glutamine GLN Q P Glycine GLY G Histidine HIS H P,C+ Isoleucine ILE I H Leucine LEU L H Lysine LYS K C+ Methionine MET M H Phenylala. PHE F H Proline PRO P H Serine SER S P Threonine THR T P Tryptophan TRP W P Tyrosine TYR Y P Valine VAL V H
28 Hydroxylation of proline and lysine Phosphorylation of Serine & Tyrosine Naturally occuring chemical modifications of genetically encoded amino acids R group methylation of lysine, histidine and arginine. R group acetylation of lysine. N terminal methylation of alanine. N terminal acetylation of serine. N terminal formylation of methionine. Addition of carbohydrates (at Asparagine and Serine). Addition of Lipids (at Cysteine, N terminal glycine and C terminal via carbohydrate linker group) Covalent attachment of cofactors (eg. pyridoxal 5 phosphate attached at lysine; hemes attached at cysteines).
29 Reazioni degli aminoacidi La reattivita dei gruppi α aminici e α carbossilici non varia nei diversi aminoacidi: I gruppi carbossilici possono formare amidi ed esteri I gruppi aminici possono formare basi di Schiff e amidi Le catene laterali esibiscono specifiche reattivita chimiche: I residui di Cys possono formare disulfidi e venire facilmente alchilati Alcune reazioni sono specifiche per certe di catene laterali
30 A reazione con l ammoniaca dà amidi non sostituite B reazione con amina primaria dà amidi sostituite C reazione con alcoli in ambiente fortemente acido D può avvenire polimerizzazione per ripetizione ciclica di questa reazione. Il gruppo carbossilico deve essere opportunamente esterificato Gli aminogruppi liberi possono reagire con aldeidi per fare basi di Schiff Possono essere acilati con anidridi acide
31 Alcune reazioni delle catene laterali
32 Ninidrina= trichetoidrindene idrato e un agente ossidante che causa deaminazione ossidativa della funzione alfa aminica. I prodotti sono l aldeide risultante ammoniacoa CO2 e idrindantina un derivato ridotto della ninidrina. L ammoniaca puo reagire poi con l idrindantina e un altra molecola di ninidrina per dare un prodotto porpora che puo essere quantificato spettrofotometricamente a 570nm. Puo essere misurata anche l evoluzione di CO2, che indica la presenza di un alfa aminoacido. Gli alfa imminoacidi, come la prolina e la idrossiprolina danno prodotti gialli per reazione con la ninidrina (assorbimento max a 440nm) permettendo di distinguere questi dagli alfa aminoacidi. E usata in medicina forense per rilevare impronte digitali. Oggi si usano reagenti fluorescenti piu sensibili
33 Separazione di miscele di Aminoacidi Mikhail Tswett, un botanico russo, separò per primo pigmenti colorati da estratti di piante facendo una cromatografia Esistono molti metodi cromatografici per la separazione di misture di aminoacidi chromatografia a scambio ionico (tradizionale) High Performance Liquid Chromatography (HPLC)
34
35 Separazione di aminoacidi su di una colonna scambiatrice di cationi
36 Separazione di aminoacidi secondo Moore e coll., Gli aminoacidi sono applicati ad una colonna scambiatrice di cationi a ph 4.25, gli aminoacidi acidi (pk ) si legano debolmente e gli aminoacidi basici si legano fortemente. Per eluire si usa sodio citrato a due diverse concentrazioni e a 3 valori di ph
37 Cromatogramma HPLC di aminoacidi con derivatizzazione precolonna con o phthaldialdehyde (OPA) (Jones e coll., 1981) Risoluzione molto alta, alta sensibilita, molto veloce HPLC colonne di acciaio impaccate con particelle + piccole e piu uniformi. Le alte pressioni riducono i tempi. Riducono le diffusioni laterali e permettono migliori risoluzioni. La derivatizzazione precolonna con composti fluorescenti o Uv permette l analisi a livelli picomolari (derivanti da 1 2 migrogr di prot) Colonna: reverse phase ODS Fase mobile:a: tetraidrofurano/metanolo/acetato di sodio(0.5 M ph5.9) 1/19/80 B: metanolo/acetato di sodio (0.5M ph 5.9) 4/1 Flusso: 1.7ml/min
38 La conoscenza della sequenza amminoacidica di una proteina costituisce il prerequisito per la determinazione della sua struttura tridimensionale ed è essenziale per comprenderne il suo meccanismo d azione molecolare I confronti tra le sequenze di proteine analoghe ottenute da specie differenti consentono di approfondire le nostre conoscenze sulla funzione di queste proteine e svelano le relazioni evolutive tra le proteine e gli organismi che le sintetizzano Numerose malattie ereditarie sono causate da mutazioni che determinano una sostituzione amminoacidica in una proteina le analisi delle sequenze amminoacidiche possono essere di ausilio nello sviluppo di test diagnostici e di terapie efficaci La proteina da sequenziare deve essere scissa in frammenti sufficientemente brevi da poter essere sequenziati individualmente, poi, partendo dalla sequenza dei tratti sovrapposti, si ricostruisce la struttura primaria della proteina intatta
39 DEGRADAZIONE DI EDMAN 1. Il reagente di Edman, fenilisotiocianato (PITC), reagisce con il gruppo amminico N-terminale di un polipeptide in condizioni blandamente alcaline, per formare il feniltiocarbamile (PTC) 2. Tale addotto è trattato con acido trifluoroacetico (F 3 CCOOH) anidro, che libera il residuo N-terminale sotto forma di derivato tiazolinonico, senza idrolizzare gli altri legami peptidici 3. Il derivato tiazolinone-amminoacido è estratto selettivamente con un solvente organico ed è convertito nel più stabile derivato feniltioidantoina (PTH) mediante trattamento con un acido in soluzione acquosa Condizioni basiche Analisi tramite HPLC Derivato tiazolinonico TFA 100% anidro Condizioni blande acide in acqua Derivato feniltioidantoina (PTH) (più stabile)
40
41 Identificazione del PTH-aa N-terminale mediante cromatografia Il tipo di amminoacido è identificato con una cromatografia per mezzo di amminoacidi standard di riferimento Separazione dei 20 PTH-aa
42 Dopo circa 30 cicli diventa difficile determinare la sequenza amminoacidica. Ciò accade perché, dopo un numero elevato di cicli, gli effetti cumulativi di reazioni incomplete e di reazioni secondarie del processo di degradazione di Edman rendono impossibile una identificazione certa dell amminoacido rilasciato e quindi della sequenza amminoacidica. Per tale motivo la proteina da sequenziare è scissa in piccoli frammenti polipeptidici. Una volta determinata la sequenza di ognuno di essi, si procede con la determinazione della sequenza della proteina completa mediante il principio della sovrapposizione dei peptidi.
43 Proteina di 150 aa N ter K------K------R R K C ter N ter K cter N ter K cter N ter R cter N ter R cter N ter K cter Idrolisi con TRIPSINA, peptidasi dotata di elevata specificità: taglia i legami peptidici dal lato C (verso il terminale carbossilico) dei residui carichi positivamente Arg (R) e Lys (K), se il residuo successivo non è Pro 1 peptide 2 peptide 3 peptide 4 peptide 5 peptide N ter C ter 6 peptide
44 Separazione dei PEPTIDI mediante cromatografia Determinazione della sequenza N-terminale di ciascun peptide N ter K cter 1 peptide N ter K cter 2 peptide N ter R cter 3 peptide N ter R cter 4 peptide N ter K cter 5 peptide N ter C ter 6 peptide
45 E necessario adoperare un metodo diverso per generare una serie di frammenti peptidici differenti Anche in questo caso si procederà alla determinazione della sequenza N-terminale di ciascun peptide ottenuto Le due serie di sequenze peptidiche sovrapposte consentono di ricostruire la sequenza di ciascun polipeptide
46 I risultanti gruppi sulfidrilici liberi sono alchilati, di norma mediante trattamento con iodoacetato, per prevenire la riformazione dei ponti disolfurici attraverso ossidazione da parte di O 2
47 Ala-Gly-Asp-Phe-Arg-Gly i. Determinazione della composizione in ammionoacidi cromatografia a scambio ionico eluzione in funzione del ph
48 Scambiatore cationico forte ph 1 2 (tutti gli aa si legano) Eluizione tramite aumento di ph e forza ionica: 1. aa acidi (es. aspartato e glutammato) 2. aa neutri (es. glicina e valina) 3. aa basici (es. lisina e arginina) Rivelazione tramite ninidrina
49 ii. Identificazione del residuo amino terminale (a) marcatura con cloruro di dansile idrolisi Il composto fluorescente dansil cloruro reagisce con le ammine primarie formando polipeptidi dansilati. Il trattamento di un polipeptide dansilato con un acido in soluzione acquosa ad alta temperatura idrolizza i suoi legami peptidici ed il residuo N-terminale risulta così libero. Questo derivato può poi essere separato dagli altri amminoacidi per via cromatografica ed identificato grazie alla sua intensa fluorescenza gialla. (b) degradazione di Edman: rimozione di un amminoacido alla volta dall estremità NH 2 -terminale
50 a-c Ala c-e Gly
51 Degradazione di Edman Lunghezza massima 50 residui perdita di attendibilità Tagli specifici con metodi chimici o enzimatici Reagente Taglio chimico Bromuro di cianogeno O-iodobenzoato Idrossilammina 2-Nitro-5-tiocianobenzoato Taglio enzimatico Tripsina Clostripaina Proteasi dello Stafilococco Sito di taglio Lato carbossilico di residui Met Lato carbossilico di residui Trp Legami Asp-Gly Lato aminico di residui di Cys Lato carbossilico di residui Lys e Arg Lato carbossilico di residui Arg Lato carbossilico di residui Asn e Gln
52 Prima proteina sequenziata Sanger F., Tuppy H. (1951) The amino-acid sequence in the phenylalanyl chain of insulin 2. The investigation of peptides from enzymic hydrolysates. Biochem. J. 49: Si dimostró che la sequenza era costituita solo da L-aminoacidi uniti tra loro da legami peptidici fra i gruppi α-amminici e i gruppi α-carbossilici
53
54
55
56
57
58
59
Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, Padova. Tel.
 Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, 3-35121 Padova. Tel.:+39-049-8276104 Fax.:+39-049-8073310 E-mail: [email protected] Funzioni delle
Prof. Fulvio Ursini Dipartimento di Chimica Biologica (Vallisneri IV piano Nord) Viale G. Colombo, 3-35121 Padova. Tel.:+39-049-8276104 Fax.:+39-049-8073310 E-mail: [email protected] Funzioni delle
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
AMMINO ACIDI. L equilibrio è regolato dal ph
 AMMINO ACIDI AMMINO ACIDI Amminoacido: un composto difunzionale che contiene nell ambito della stessa molecola una funzione amminica -NH 2 e una funzione carbossilica -COOH α-ammino acido: I due gruppi
AMMINO ACIDI AMMINO ACIDI Amminoacido: un composto difunzionale che contiene nell ambito della stessa molecola una funzione amminica -NH 2 e una funzione carbossilica -COOH α-ammino acido: I due gruppi
La struttura covalente delle proteine (la sequenza amminoacidica)
 La struttura covalente delle proteine (la sequenza amminoacidica) Sequenza amminoacidica dell ormone insulina bovino (Frederick Sanger, 1953) Il primo passo per determinare la sequenza di un peptide è
La struttura covalente delle proteine (la sequenza amminoacidica) Sequenza amminoacidica dell ormone insulina bovino (Frederick Sanger, 1953) Il primo passo per determinare la sequenza di un peptide è
α-amminoacidi O α O α R CH C O - NH 3 forma ionizzata sale interno (zwitterione) OH NH 2 forma non ionizzata (non esistente in realtà)
 Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 14
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 14 Caratterizzazione strutturale delle proteine Concetti chiave: Per poter essere sequenziata, una proteina deve essere separata
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 14 Caratterizzazione strutturale delle proteine Concetti chiave: Per poter essere sequenziata, una proteina deve essere separata
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
PROTIDI: LE PROTEINE E GLI AMMINOACIDI
 PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Proteine strutturali Sostegno meccanico Cheratina: costituisce i capelli Collagene: costituisce le cartilagini Proteine di immagazzinamento
 Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH. ) ed un gruppo carbossilico ( COOH) nella stessa molecola
 Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Vittoria Patti MACROMOLECOLE BIOLOGICHE. 4. proteine
 Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
MACROMOLECOLE. Polimeri (lipidi a parte)
 MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMINOACIDI - 1 AMINOACIDI - 2
 AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
AMINOAIDI - 1 Proteine (gr. pròtos = primo) 50-80% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida o alcalina α-aminoacidi proteasi Struttura generale degli α-aminoacidi primari
moli OH - /mole amminoacido
 ) ) Di seguito è riportata la curva di titolazione di un amminoacido. Osservando il grafico: a) stabilire il valore dei pka dell aminoacido b) calcolare il valore del pi e individuarlo sul grafico. c)
) ) Di seguito è riportata la curva di titolazione di un amminoacido. Osservando il grafico: a) stabilire il valore dei pka dell aminoacido b) calcolare il valore del pi e individuarlo sul grafico. c)
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa.
 La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
Spettrofotometria e analisi di amminoacidi
 Spettrofotometria e analisi di amminoacidi Quantizzazione di proteine e di miscele di amminoacidi Antimo Di Maro Anno Accademico 2015-16 Assorbimento della luce ONDE ELETTROMAGNETICHE La radiazione elettromagnetica
Spettrofotometria e analisi di amminoacidi Quantizzazione di proteine e di miscele di amminoacidi Antimo Di Maro Anno Accademico 2015-16 Assorbimento della luce ONDE ELETTROMAGNETICHE La radiazione elettromagnetica
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
La fissazione dell azoto
 La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
Le proteine. Polimeri composto da 20 diversi aminoacidi
 Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
Le proteine Polimeri composto da 20 diversi aminoacidi (D. Voet, J.G. Voet, Biochemistry, 3 ed., John Wiley & Sons, 2004) PROTEINE come ATTUATORI nella cellula Trasporto elettronico Trasporto di ioni e
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. DiSTABiF. Antimo Di Maro. Lezione 3. Corso di Laurea in Scienze Biologiche
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Antimo Di Maro Anno Accademico 2016-2017 Lezione 3 GLI AMMINOACIDI PROTEICI Le
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Antimo Di Maro Anno Accademico 2016-2017 Lezione 3 GLI AMMINOACIDI PROTEICI Le
REPLICAZIONE DEL DNA
 REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. Metodologie 1. DiSTABiF. Corso di Laurea in SCIENZE BIOLOGICHE.
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in SCIENZE BIOLOGICHE Insegnamento di CHIMICA BIOLOGICA Anno Accademico 2016-17 Metodologie 1 Spettrofotometria e analisi di amminoacidi
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in SCIENZE BIOLOGICHE Insegnamento di CHIMICA BIOLOGICA Anno Accademico 2016-17 Metodologie 1 Spettrofotometria e analisi di amminoacidi
AMINOACIDI. GENE PROTEINA EFFETTO. calore. idrolisi acida (o alcalina) Struttura generale degli α-aminoacidi primari (standard, normali):
 AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
AMINOAIDI. Proteine (gr. pròtos = primo) > 50% peso secco cellulare GENE POTEINA EFFETTO proteine calore idrolisi acida (o alcalina) α-aminoacidi Struttura generale degli α-aminoacidi primari (standard,
Proteine: struttura e funzione
 Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
3.3.2. ALIMENTI DI ORIGINE VEGETALE. 3.3.2.1. Verdure
 3.3.2. ALIMENTI DI ORIGINE VEGETALE 3.3.2.1. Verdure Nella Tabella 9 sono riportati i valori degli aminoacidi liberi presenti in alcune fra le più diffuse verdure in commercio. In un passato recente era
3.3.2. ALIMENTI DI ORIGINE VEGETALE 3.3.2.1. Verdure Nella Tabella 9 sono riportati i valori degli aminoacidi liberi presenti in alcune fra le più diffuse verdure in commercio. In un passato recente era
Spettrofotometria e analisi di amminoacidi. Quantizzazione di proteine e di miscele di amminoacidi
 Spettrofotometria e analisi di amminoacidi Quantizzazione di proteine e di miscele di amminoacidi Assorbimento della luce ONDE ELETTROMAGNETICHE La radiazione elettromagnetica è, dal punto di vista dell'elettromagnetismo
Spettrofotometria e analisi di amminoacidi Quantizzazione di proteine e di miscele di amminoacidi Assorbimento della luce ONDE ELETTROMAGNETICHE La radiazione elettromagnetica è, dal punto di vista dell'elettromagnetismo
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
cromatografia Esplorando le proteine
 Cromatografia Flavia Frabetti Tecnici di laboratorio 2010/2011 Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per
Cromatografia Flavia Frabetti Tecnici di laboratorio 2010/2011 Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
Metodi per il sequenziamento di proteine
 Metodi per il sequenziamento di proteine Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto
Metodi per il sequenziamento di proteine Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
AMMINOACIDI E PROTEINE Vengono chiamate amminoacidi quelle molecole organiche in cui sono contemporaneamente presenti sia un gruppo acido carbossilico -COO che un gruppo amminico -N2. Una molecola appartenente
I gruppi R differenziano i 20 amminoacidi standard. Tratto da D. Voet, G. Voet e C.W. Pratt Fondamenti di biochimica
 Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
Gli aminoacidi NOMENCLATURA Aminoacido Abbr. tre lettere Abbr. una lettera Aminoacido Abbr. tre lettere Abbr. una lettera Alanina ALA A Lisina LYS K Arginina ARG R Metionina MET M Asparagina ASN N Fenilalanina
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
Spettrometria di Massa applicata alla PROTEOMICA
 Spettrometria di Massa applicata alla PROTEOMICA 1. MALDI-TOF: Determinazione di mappe peptidiche mediante digestione in gel di spot separati su E-2D E da estratti proteici totali Identificazione rapida
Spettrometria di Massa applicata alla PROTEOMICA 1. MALDI-TOF: Determinazione di mappe peptidiche mediante digestione in gel di spot separati su E-2D E da estratti proteici totali Identificazione rapida
Biocatalizzatori. Tecniche di immobilizzazione e applicazioni biotecnologiche di cellule ed enzimi
 Biocatalizzatori Tecniche di immobilizzazione e applicazioni biotecnologiche di cellule ed enzimi BIOCATALIZZATORI Cellule in coltura l organismo viene cresciuto nel terreno A le cellule vengono raccolte
Biocatalizzatori Tecniche di immobilizzazione e applicazioni biotecnologiche di cellule ed enzimi BIOCATALIZZATORI Cellule in coltura l organismo viene cresciuto nel terreno A le cellule vengono raccolte
Il metabolismo dell azoto
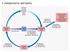 Il metabolismo dell azoto La fissazione dell azoto Radici di una leguminosa e il simbionte Rhizobium leguminosarum. Microrganismi azotofissatori : ad es. batteri appartenenti ai generi Clostridium e Azotobacter.
Il metabolismo dell azoto La fissazione dell azoto Radici di una leguminosa e il simbionte Rhizobium leguminosarum. Microrganismi azotofissatori : ad es. batteri appartenenti ai generi Clostridium e Azotobacter.
INTRODUZIONE ALLA PROTEINE BCP 1-2
 INTRODUZIONE ALLA BIOCHIMICA DELLE PROTEINE BCP 1-2 Pietre miliari Lehninger 1973 Biochemistry Proteine ricombinanti Protein engineering Cristallografia, NMR, EM, MS, spettroscopie... Computing Bioinformaticai
INTRODUZIONE ALLA BIOCHIMICA DELLE PROTEINE BCP 1-2 Pietre miliari Lehninger 1973 Biochemistry Proteine ricombinanti Protein engineering Cristallografia, NMR, EM, MS, spettroscopie... Computing Bioinformaticai
Gli amminoacidi ( 20) hanno proprietà strutturali comuni
 Quando nel XIX secolo gli scienziati rivolsero per la prima volta la loro attenzione alla nutrizione, in breve tempo scoprirono che i prodotti naturali contenenti azoto erano essenziali per la nutrizione
Quando nel XIX secolo gli scienziati rivolsero per la prima volta la loro attenzione alla nutrizione, in breve tempo scoprirono che i prodotti naturali contenenti azoto erano essenziali per la nutrizione
9) Scrivere un disaccaride formato dal β-d-galattosio e dall α-d-n-acetil-glucosammina legati da un legame glicosidico β(1-4).
 CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta)
 Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta) E il termine generico che indica una serie di tecniche di separazione di molecole simili in
Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta) E il termine generico che indica una serie di tecniche di separazione di molecole simili in
Continua. Peptidasi H 2 O
 Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Amminoacidi/peptidi/proteine. Chimica Organica II
 Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Cosa determina l assorbanza di un cromoforo?
 Cosa determina l assorbanza di un cromoforo? I cromofori sono di solito caratterizzati da doppi legami e sistemi di risonanza Lo spettro di assorbimento di un cromoforo è solo parzialmente determinato
Cosa determina l assorbanza di un cromoforo? I cromofori sono di solito caratterizzati da doppi legami e sistemi di risonanza Lo spettro di assorbimento di un cromoforo è solo parzialmente determinato
Esercitazione Esempi di domande del test intermedio
 Esercitazione Esempi di domande del test intermedio Materiale occorrente : Calcolatrice Penna Matita Righello Gomma Severamente vietato servirsi di libri, appunti, telefoni cellulari Quindi..!!!!! la legge
Esercitazione Esempi di domande del test intermedio Materiale occorrente : Calcolatrice Penna Matita Righello Gomma Severamente vietato servirsi di libri, appunti, telefoni cellulari Quindi..!!!!! la legge
Percorsi di chimica organica - Soluzioni degli esercizi del testo
 ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Determinazione della sequenza aminoacilica di una
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Determinazione della sequenza aminoacilica di una
Le proteine. Sintetizzate nei ribosomi come una sequenza lineare di amminoacidi assumono in seguito una struttura tridimensionale
 Le proteine Elementi funzionali e strutturali di fondamentale importanza per lo svolgimento di funzioni metaboliche, di trasporto, di trasmissione nervosa o contrattile, ormonale o immunitaria Sintetizzate
Le proteine Elementi funzionali e strutturali di fondamentale importanza per lo svolgimento di funzioni metaboliche, di trasporto, di trasmissione nervosa o contrattile, ormonale o immunitaria Sintetizzate
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
LE PROTEINE SINTESI PROTEICA. funzione delle proteine nel nostro organismo
 LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
20/12/ tipi di amino acidi: parecchie combinazioni
 20 tipi di amino acidi: parecchie combinazioni Le proteine sono polimeri di amino acidi 1 SEMPLICI : costituite solo da amino acidi PROTEINE CONIUGATE Apoproteina = parte proteica Gruppo prostetico = parte
20 tipi di amino acidi: parecchie combinazioni Le proteine sono polimeri di amino acidi 1 SEMPLICI : costituite solo da amino acidi PROTEINE CONIUGATE Apoproteina = parte proteica Gruppo prostetico = parte
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi. Possono assumere forme diverse a seconda della funzione
 Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
scaricato da I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE
 Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
LE PROTEINE. Le proteine sono i biopolimeri piu' abbondanti negli organismi viventi e svolgono funzioni biologiche di fondamentale importanza:
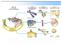 LE PRTEINE Le proteine sono i biopolimeri piu' abbondanti negli organismi viventi e svolgono funzioni biologiche di fondamentale importanza: PRTEINE CATALITICHE PRTEINE REGLATRICI PRTEINE DIFESA PRTEINE
LE PRTEINE Le proteine sono i biopolimeri piu' abbondanti negli organismi viventi e svolgono funzioni biologiche di fondamentale importanza: PRTEINE CATALITICHE PRTEINE REGLATRICI PRTEINE DIFESA PRTEINE
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: [email protected] Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
mediante proteasi industriali
 Valorizzazione delle farine disoleate mediante proteasi industriali Alessandra Stefan Unità operativa: CSGI (Consorzio per lo Sviluppo dei Sistemi a Grande Interfase, Firenze) Dipartimento di Farmacia
Valorizzazione delle farine disoleate mediante proteasi industriali Alessandra Stefan Unità operativa: CSGI (Consorzio per lo Sviluppo dei Sistemi a Grande Interfase, Firenze) Dipartimento di Farmacia
06_citologia_SER_golgi 1
 1 La sintesi proteica inizia sempre nello stesso modo: aggancio della piccola subunità ribosomale al estremità 5 dell mrna. si aggancio la grande subunità ribosomale In corrispondenza del codone di inizio
1 La sintesi proteica inizia sempre nello stesso modo: aggancio della piccola subunità ribosomale al estremità 5 dell mrna. si aggancio la grande subunità ribosomale In corrispondenza del codone di inizio
a) un movimento contro gradiente di concentrazione che utilizza fonti primarie di energia
 1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
26 Aprile 1915, 81 compleanno
 Reazioni di addizione-eliminazione eliminazione di composti carbonilici Ammine primarie reagiscono con composti carbonilici per dare immine, anche denominate basi di Schiff 1 Ugo Shiff (1834-1915) 1915)
Reazioni di addizione-eliminazione eliminazione di composti carbonilici Ammine primarie reagiscono con composti carbonilici per dare immine, anche denominate basi di Schiff 1 Ugo Shiff (1834-1915) 1915)
TECNICHE CROMATOGRAFICHE
 TECNICHE CROMATOGRAFICHE Le tecniche cromatografiche permettono di separare gli analiti presenti in una miscela complessa. Tutti i sistemi cromatografici sono costituiti da una fase stazionaria, che puo
TECNICHE CROMATOGRAFICHE Le tecniche cromatografiche permettono di separare gli analiti presenti in una miscela complessa. Tutti i sistemi cromatografici sono costituiti da una fase stazionaria, che puo
dieta vengono convertiti in composti dei corpi chetonici.
 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
La chimica della pelle
 La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
