Acqua e cibo alcalini perchè? (equilibrio acido-basico)
|
|
|
- Leonora Gori
- 7 anni fa
- Visualizzazioni
Transcript
1 Acqua e cibo alcalini perchè? (equilibrio acido-basico) Chiunque conosce un po di fisiologia umana sa che la biochimica del nostro corpo tende ad essere leggermente alcalina. Alcalino è anche e soprattutto il sangue arterioso, il cui range normale del ph è compreso tra 7,30 e 7,45. Valori al di sotto di 7 e superiori a 8 sarebbero incompatibili con la vita e molti disturbi vengono a manifestarsi man mano ci si allontana dal valore ottimale di 7,4. Noi umani siamo un progetto genetico biochimico alcalino e questo è un dato di fatto, che non necessita di essere dimostrato. Prima di procedere nell esposizione del presente argomento chiariremo il significato di ph, con cui si misura la concentrazione di idrogenioni (H+) presenti in una soluzione od ovunque ci sia dell acqua. Una delle caratteristiche dell acqua maggiormente importante per la vita è la ionizzazione, processo chimico che consiste nella perdita o acquisto di una o più cariche elettriche da parte di un atomo o di una molecola. L attività biochimica cellulare è basata essenzialmente in un continuo processo di scissione della molecola d acqua (H2O) in ione H+ (idrogenione) e ione OH- (ossidrile) e nella sua ricombinazione, catalizzando tutti gli altri processi biochimici, che ci permettono di vivere. Infatti dopo l aria, l acqua è l elemento più essenziale per qualsiasi forma di vita sulla terra. Ebbene, questa caratteristica dell idrolisi (o auto-protolisi) e della sua ricombinazione sia nella cellula che fuori nel liquido extracellulare è uno dei fattori più fondamentali per la vita. In una massa d acqua la quantità di ioni H+ e di ioni OH- può variare per diversi motivi. 1 / 10
2 L acqua che contiene più idrogenioni viene chiamata acqua acida, quella che contiene più ioni ossidrili viene detta acqua alcalina, mentre, se il numero di ioni positivi e negativi si equivale, l acqua viene considerata neutra. In una determinata quantità d acqua neutra a temperatura ambiente (22 C) il rapporto sia degli ioni H+ che degli ioni OH- con il totale delle molecole di quel volume d acqua è per entrambe di 1:107. Se aggiungiamo dell acido nella predetta soluzione neutra, il numero di ioni H+ aumenta. Quando il numero aumenta a 1x10-6 (dieci volte più dell acqua neutra) la legge della Natura costringe il numero degli ioni OH- a diminuire a 1x10-8 unità. Poiché la somma degli esponenti delle suddette moltiplicazioni è sempre 14, al ph 6 corrisponde il poh 8. Pertanto nel valutare il ph di una soluzione viene sottinteso il corrispettivo poh. La scala del ph si estende da 1 a 14, ove il valore 7 corrisponde al neutro; dal 7 in giù esprime valori sempre maggiori di acidità e dal 7 in su valori sempre maggiori di alcalinità. Poiché è una scala logaritmica negativa decadica, ogni punto, che si allontana dal 7 nei due sensi, corrisponde ad un valore 10 volte superiore al precedente. Per esempio un ph 6 esprime una concentrazione acida 10 volte maggiore di 7, mentre un ph 5 un valore 10 volte maggiore di 6, quindi 100 volte maggiore di 7. Tutta la biochimica non può prescindere, in ogni suo processo, dalla presenza dell acqua. Una caratteristica interessante dell acqua è che essa si ionizza facilmente. La ionizzazione è quel processo chimico che comprende contestualmente reazioni d ossidazione e di riduzione. L ossidazione presuppone la cessione di elettroni, la riduzione, invece, l assorbimento di elettroni. Non esiste ossidazione senza simultanea riduzione: questa combinazione di reazioni chimiche viene chiamata reazione REDOX. A questo punto possiamo riprendere il discorso sull importanza di una biochimica alcalina per la salute. Sappiamo che alla nascita un bambino sano ha una biochimica alcalina. Alcalino è il latte materno, alcalina o appena acida è la sua urina. Ciò che permette al corpo di mantenersi sano ed alcalino, nonostante le cellule continuino a produrre costantemente acidi, è la sua capacità drenante e la sua riserva alcalina. La riserva alcalina è costituita principalmente dai minerali alcalini presenti nel sangue, nei tessuti, nei denti e nelle ossa. Quando la riserva alcalina del sangue e dei tessuti si esaurisce, il prelievo dei minerali alcalini necessari alla neutralizzazione dell acidosi avviene dai denti e dalle ossa. Carie ed osteoporosi sono due condizioni specifiche dell acidosi cronica metabolica e digestiva. E interessante notare che la Natura provvede a dotare il nascituro di abbondante riserva alcalina, prelevandola dalle riserve della madre; frequenti sono, infatti, carie ed osteoporosi nelle donne in gravidanza, le cui riserve alcaline sono carenti. Poiché il mantenimento del ph fisiologico è un fattore fondamentale per ogni altro corretto processo biologico, la Natura ha dotato il nostro organismo di vari sistemi tampone per assicurare la migliore condizione biologica possibile. I sistemi tampone intervengono per compensare l eccesso di acidità o di alcalinità. Purtroppo per il nostro innaturale stile di vita, soprattutto alimentare, l organismo si trova costretto a tamponare molto più frequentemente l eccesso di acidi, per cui in questo articolo ci occuperemo principalmente dei meccanismi di correzione dell acidosi metabolica e digestiva. 2 / 10
3 Sistemi morfo-fisiologici di correzione del ph Il ph fisiologico ematico è frutto di un meccanismo di controllo automatico che si serve in primis del normale atto respiratorio, delle riserve ematiche acide (H2CO3) ed alcaline (HCO3-). Quando la normale respirazione non è sufficiente a compensare e smaltire l eccessiva acidità del sangue, in pochi minuti interviene una aumentata risposta respiratoria. La ventilazione polmonare svolge un ruolo fondamentale nella correzione del ph. Con la ventilazione polmonare, oltre all anidride carbonica (CO2), vengono eliminati altri acidi organici presenti nel sangue in forma gassosa. La CO2 prodotta dalle cellule si diffonde nel sangue, ove si trasforma in acido carbonico (H2CO3), in modo da essere trasportata più facilmente fino agli alveoli polmonari, ove si ritrasforma in C O2 per essere eliminata dai polmoni. Durante l idratazione della CO2 (CO2 + H2O = H2CO3 à H+ + HCO3-) per merito dell anidrasi carbonica si formano ioni H+ che devono essere tamponati per evitare una ricaduta di ph verso valori di acidità, incompatibili con la vita delle cellule. A fare ciò interviene in prima battuta l emoglobina, che è dotata di un efficientissima capacità tampone. In condizioni fisiologiche le variazioni metaboliche di produzione di CO2 sono prontamente controbilanciate dalle variazioni ventilatorie, in modo da mantenere costante la quantità di CO2 nel sangue. L aumento della pco2, la diminuzione del ph e della po2 del sangue stimolano l iperventilazione, mentre una modificazione in senso opposto porta ad ipoventilazione. Per l equilibrio acido-basico plasmatico sono fondamentali due fattori: la concentrazione degli idrogenioni ( H+) espressa dal ph e la riserva alcalina del bicarbonato (HCO3-), derivato dalla trasformazione della CO2. A questi fattori si aggiungono, inoltre, costantemente sostanze acide ed alcaline derivate dal metabolismo intermedio e finale del processo digestivo. Poiché questi due fattori possono variare indipendentemente, si può parlare di equilibrio acido-basico solo quando c è il giusto rapporto tra riserva alcalina ed acidi. A far deragliare maggiormente e precocemente l equilibrio acido-basico è l abnorme mole di acidi prodotti dal metabolismo digestivo a causa dell alimentazione innaturale ed antifisiologica utilizzata ormai universalmente. Infatti con l eccessiva ed innaturale alimentazione si producono: A) Acido carbonico, risultato finale della combustione del carbonio contenuto nei cibi. B) Acido solforico, derivato dalla digestione delle proteine. C) Acido fosforico, derivato dall ossidazione dei fosfolipidi e nucleo-protidi. 3 / 10
4 D) Acido acetacetico e beta-idrossibutirrico derivato dagli acidi grassi. E) Acido urico, derivato dal metabolismo dei nucleo-protidi. F) Acido lattico prodotto dal metabolismo del glicogeno e di altri acidi vari, generati dall ossidazione incompleta degli zuccheri (spesso per la carenza di ossigeno). G) Acido ossalico liberato da alcuni alimenti (cacao, spinaci, pomodori, ecc.). H) Anche gli acidi organici dei vegetali, inoltre, in carenza di ioni alcalini (sodio, potassio, magnesio, calcio), se non sono tamponati sufficientemente, aggiungono acidità a quella propria dell organismo. Tutti questi acidi, ma soprattutto gli acidi fissi, cioè quelli che non si trasformano in CO2 e non sono in forma gassosa, eliminabili quindi con la respirazione e la traspirazione, devono comunque essere tamponati ed eliminati necessariamente dal nostro corpo per via renale. La CO2 ha un ruolo bifasico nel processo dell equilibrio acido-basico: da un lato è il prodotto acido quantitativamente più importante da cui il corpo si deve difendere per non abbassare il proprio ph ed a ciò provvedono principalmente, come abbiamo visto, i polmoni; dall altro lato provvede per circa la metà dell attività tampone in difesa del ph contro gli acidi fissi. Il sistema tampone acido-basico della CO2 è detto sistema tampone primario, in quanto è di un importanza di gran lunga superiore agli altri. Quando nell acqua extracellulare sopraggiunge un acido forte, come per esempio l acido cloridrico (HCl), avviene la seguente reazione: HCl + NaHCO3 = NaCl + H2CO3. Dell acido carbonico prodotto in questa reazione una parte si trasforma in H2O + CO2, ove la CO2 verrà espulsa con la ventilazione, mentre un altra parte si trasforma in HCO3- + H+, ove HCO3sarà riassorbito a livello dei tubuli renali e rimesso in circolo, mentre H + sarà eliminato con le urine. La secrezione renale di H+ rappresenta uno dei sistemi fondamentali per mantenere costante il ph fisiologico del corpo. Gli idrogenioni (H+) secreti dal tubulo renale vengono eliminati con l urina. I reni partecipano al mantenimento dell equilibrio acido-basico tramite tre importanti sistemi tampone: riassorbimento degli ioni di bicarbonato, escrezione di acidi fissi (titolabili), escrezione di NH4 (ammonio), mentre l eliminazione di H+ liberi è di poca entità. 1) Riassorbimento degli ioni HCO3-. I bicarbonati filtrati dai glomeruli vengono riassorbiti per circa l 80% nel tubulo prossimale ed il rimanente nel tubulo distale del nefrone. Numerosi sistemi possono influenzare la capacità di riassorbimento tubulare dei bicarbonati. I più importanti sono: volume extracellulare, pco2, 4 / 10
5 potassiemia, paratormone, calcemia, fosforemia. Ai fini dell equilibrio acido-basico, all escrezione netta degli acidi deve corrispondere altrettantto riassorbimento di bicarbonati (HCO3) 2) Escrezione di acidi fissi (titolabili). Tra gli acidi titolabili urinari, i fosfati sono il sistema tampone più importante. Quando l urina si acidifica (per escrezione di H+), gran parte del fosfato bibasico (HPO4 - -) si trasforma in monobasico (H2PO4-) secondo la seguente formula: HPO H+ = H2PO4-, che viene eliminato con l urina e con esso lo ione H+ acquisito. In caso di alcalosi avverrebbe la reazione inversa con relativo rilascio di H+ da parte del fosfato monobasico. 3) Ecrezione di NH4+ (ammonio) Alcuni acidi fissi (acido solforico, cloridrico, ossalico, ecc.) prodotti dall organismo o introdotti con l alimentazione sono acidi forti, che il rene è incapace di protonare (capacità di legare lo ione H+) neanche ad un ph urinario di 4,5. Per compensare questa incapacità di protonazione degli acidi forti presenti nell urina, il rene produce un altro tampone, l ammoniaca (NH3) per idrolisi della glutammina. La produzione di ammoniaca è correlata allo stato acido-basico dell organismo. Tutto il nefrone partecipa alla produzione di ammoniaca, ma se ne troverà maggiore quantità in quei segmenti del nefrone ove l acidità dell urina è maggiore, cioè nel tubulo distale e specialmente nel collettore. Pertanto la produzione e l escrezione renale di NH3 rappresenta il sistema più valido per controllare l eliminazione degli acidi fissi. Infatti l escrezione di H+ legato a NH3 (come NH4+) rappresenta più del 50% dell escrezione totale della acidità urinaria e può aumentare fino all 80% in caso di forte acidosi. Per avere il ph ematico ottimale di 7,4 occorre un rapporto di 20:1 tra bicarbonato e acido carbonico. Pertanto l alterazione di questo rapporto influenzerà relativamente il ph ematico verso l acidità o verso l alcalinità. A mantenere costante questo rapporto contribuiscono, come abbiamo visto finora, sistemi tampone sistemici, polmoni, reni e come vedremo ora l apparato digerente, di cui soprattutto lo stomaco. L attività biochimica dello stomaco riveste un importanza primaria nell equilibrio acido basico. Sicuramente sono importanti i sistemi tampone e gli organi analizzati fino adesso, ma, se non ci fosse l apparato digerente, in cui entrano e vengono processate le sostanze basilari per la produzione degli acidi, delle basi, dei bicarbonati e dello stesso acido carbonico, non si potrebbe nemmeno immaginare una qualsivoglia altra attività vitale. Infatti, se non si mangia e soprattutto non si beve, sopraggiunge presto la morte. Di tutto l apparato digestivo (bocca, stomaco, fegato, pancreas, intestino con tutte le sue ghiandole secretive di enorme importanza vitale) un ruolo di primaria importanza per l equilibrio acido-basico viene svolto dallo stomaco e precisamente dalle cellule parietali della parete (mucosa) gastrica. Le cellule parietali sono specializzate nella produzione dell acido cloridrico 5 / 10
6 (HCl), che è essenziale non solo per l attività digestiva ma anche per l equilibrio acido-basico dell intero organismo. Infatti, le cellule parietali nel produrre HCl partecipano all equilibrio acido-basico generale con la produzione contestuale di altrettanto bicarbonato (HCO3-), che viene riversato nel flusso sanguigno per depositarsi nei tessuti tampone, come la mucosa e sottomucosa gastrica. Altre cellule della mucosa gastrica secernano muco, enzimi e molti altri fattori digestivi e non. A maggiore velocità di secrezione gastrica corrisponde maggiore acidità, ma fino al limite di concentrazione di HCl di 150 meq/l, sicuro limite d incolumità biologica. La secrezione parietale non contiene solo HCl, ma anche diversi cloruri (KCl, NaCl), che però diminuiscono man mano aumenta l acidità. Il meccanismo della produzione dell acido cloridrico più accreditato dai fisiologi è il seguente. Il citoplasma della cellula parietale funge da trasportatore di ioni Cl- (oltre che di acqua e di vari cationi K+, Na+, ecc.) provenienti dal sangue verso i canalicoli ed il tubulo della cellula, ove avviene la sintesi dell acido cloridrico per la presenza di ioni H+ secreti dalla stessa cellula parietale. Gli ioni H+ deriverebbero dal processo d idrolisi della molecola d acqua nella cellula parietale secondo la seguente formula: H2O= H+ + OH-. Lo ione H+ esce fuori dalla cellula scambiandosi con ioni K+ e Na+ diffusi nel canalicolo e qui si combina con Cldiventando HCl (acido forte), che viene secreto nel lume gastrico. La base OH- si combina con la CO2 presente nella cellula formando HCO3-, il quale viene immesso nel flusso sanguigno ove si combina con vari cationi (K+, Na+, Ca++, Mg++, ecc), determinando le migliori riserve alcaline ematiche. Sappiamo, quindi, dalla fisiologia che per la produzione dell acido cloridrico la cellula parietale ha bisogno di scambiare gli ioni H+ con dei cationi di minerali alcalini, che necessariamente devono essere introdotti con l alimentazione, che etimologicamente significa ciò che si porta al mento ossia cibo ed acqua. Pertanto, se con l alimentazione (acqua e cibo) non introduciamo sufficienti quantità di cationi di minerali alcalini, avremo una carente produzione di acido cloridrico (ipocloridria), che paradossalmente ci procurerà acidità gastrica, derivante dalla fermentazione prodotta dalla maggiore permanenza del cibo nello stomaco e non dall eccesiva secrezione di HCl (ipercloridria). Il bruciore è determinato dalla penetrazione degli acidi nel tessuto sottomucoso, a causa dell assottigliamento dello strato mucoso, primaria barriera contro gli acidi. Già negli anni 70 del secolo scorso il medico Dr. Jonathan V. Wrigth sosteneva quello che ho appena detto. E, infatti, possibile, con un sistema da lui inventato, controllare con precisione la produzione di acido cloridrico nello stomaco delle persone, e diagnosticare l ipocloridria in coloro che lamentano bruciore di stomaco ed indigestione. Come abbiamo visto precedentemente, la Natura ha predisposto un limite di sicurezza nella produzione di HCl. Lo studio della biochimica nutrizionale ci dimostra che l acqua, soprattutto se alcalina, ma anche i cibi alcalini, soprattutto se crudi e naturali, se masticati opportunamente, cedono più facilmente ed abbondantemente all organismo i cationi dei minerali alcalini, necessari, come abbiamo visto, per lo scambio con H+ ed apportano anche abbondante acido carbonico, fonte, come abbiamo visto, degli ioni H+ ed HCO3-. L attività digestiva è un processo biochimico complesso, che contempla non solo l acido cloridrico, ma anche bicarbonati, enzimi, ormoni e vari fattori biochimici ed emotivi. La produzione di acido cloridrico è sotto induzione e controllo ormonale secondo il fabbisogno 6 / 10
7 digestivo. Le cellule parietali producono acido cloridrico, solo se indotte dall introduzione di cibo (soprattutto proteine) da digerire, e non bevendo acqua. La produzione di HCl, come pure degli enzimi digestivi, è correlata al fabbisogno digestivo ed alla propria capacità secretiva. Infatti, la secrezione gastrica varia secondo la quantità e la qualità del cibo che ingeriamo. Pertanto, se mangiamo frutta e verdura non avverrà che una minima secrezione gastrica, mentre, se mangiamo carne, pesce, uova, formaggi, cereali e legumi si verificherà un abbondante secrezione gastrica, a patto che le cellule parietali abbiano conservato la loro capacità funzionale e che l organismo possieda tutte le sostanze necessarie per produrre e bilanciare l'acido cloridrico (HCl.) Infatti, se lo stomaco non provvedesse alla corrispettiva produzione di bicarbonato, necessario alle cellule mucose dello stomaco per difendersi dallo stesso acido cloridrico (e dagli altri acidi prodotti ed introdotti con l alimentazione), ed indispensabile all attività del pancreas, del fegato e delle ghiandole alcalofile del duodeno e del tenue, il processo digestivo sarebbe incompleto e l equilibrio acido-basico generale dell organismo sarebbe presto compromesso. Bevendo qualsiasi quantità d acqua, anche se alcalina, le cellule parietali non saranno stimolate a produrre HCl, perché l acqua non necessita di essere digerita. Bevendo acqua, la concentrazione degli acidi presenti nello stomaco viene diluita momentaneamente, finché l acqua non viene riassorbita o eliminata completamente dallo stomaco. Se lo stomaco è vuoto, il suo riassorbimento e svuotamento attraverso il piloro sarà veloce ed il ph ritornerà ben presto al suo stato fisiologico precedente, ma senza nessun altra produzione di HCl, mentre, se esso contiene cibo da digerire, le cellule parietali continueranno a produrre acido cloridrico proporzionalmente al tipo ed alla quantità di cibo ivi contenuto, e l acqua con i suoi minerali, assieme ai minerali del cibo, contribuirà durante tutta la fase digestiva a rimpiazzare nelle cellule parietali l acqua e minerali consumati nella produzione dell HCl. Poiché la capacità di assorbimento dell acqua da parte della parete gastrica nella fase secretiva è molto lenta e lo svuotamento attraverso il piloro anche, bere durante i pasti rallenta la digestione per effetto della diluizione dei succhi gastrici. Se l assunzione d acqua alcalina in sé stimolasse la produzione immediata di HCl, più acqua si berrebbe nei pasti, migliore sarebbe la digestione, ma sappiamo che ciò non è vero, come pure dovremmo avere bruciore di stomaco a fronte dell assunzione di abbondanti quantità d acqua alcalina a digiuno, ma vi assicuro che ciò non accade nelle normali condizioni fisiologiche ed organiche. Quanto appena detto contraddice la convinzione di coloro che pensano che lo stomaco produce HCl, sotto l induzione dell acqua alcalina. L assunzione di acqua non può stimolare la produzione immediata di acido cloridrico, perché questa funzione è correlata alla necessità di digerire il cibo: questa è la nostra fisiologia. Pertanto, bevendo acqua alcalina, giammai si produrrà un eccesso di HCl nello stomaco, come alcuni critici vorrebbero far credere, mentre l assorbimento ematico di cationi alcalini e di ossigeno (OH-), di cui l acqua alcalina ed i vegetali crudi abbondano, permetterà ai sistemi tampone sistemici e morfo-fisiologici di mantenere l equilibrio acido-basico e di permettere, al tempo opportuno, di produrre acido cloridrico. Il pregio dell acqua alcalina è quello di avere un abbondanza di molecole di idrossido di minerali alcalini (es. KOH= K+ + OH- ), che facilmente si scindono in ioni positivi e negativi, promuovendo un abbondante ed interessante attività REDOX, fondamentale per tutti i processi 7 / 10
8 biochimici. Se mai si riuscisse a bere tanta acqua alcalina da superare la capacità di riserva ematica dei minerali alcalini, questi sarebbero prontamente eliminati con l urina, come avviene naturalmente con l eliminazione dei minerali in eccesso presenti nell alimentazione quotidiana, della cui abbondanza minimamente ci preoccupiamo. L acqua alcalina abbonda in Natura. L acqua maggiormente disponibile in natura per la vita animale, quindi anche nostra, è alcalina. Infatti, l acqua di mare è alcalina, l acqua dei fiumi e dei ruscelli, della maggior parte delle sorgenti, dei laghi, dei pozzi è alcalina. La Natura dispensa acqua acida con le piogge alle piante, mentre offre acqua alcalina agli animali ed agli uomini. Provate a mettere dei pesci in acqua acida e li vedrete ben presto morire. Non avrebbe avuto senso che la Natura ci avesse fornito di una fisiologia alcalina, come abbiamo visto, se poi non ci avesse dato l acqua ed il cibo necessari per soddisfare le esigenze biochimiche alcaline. Non è lo scopo di quest articolo quello di approfondire il tema dei cibi alcalini. Con la pubblicazione del MIRACOLO DEL ph ALCALINO, di prossima pubblicazione del Dr. ROBERT YOUNG e Shelley Redford potrete approfondire questo argomento. Dobbiamo riconoscere che la vita che conduciamo oggigiorno è molto distante dagli standard previsti dalla Natura per gli esseri umani. Anche questo argomento non rientra nelle motivazioni di questo articolo, anche se ci sarebbe molto da dire. Poiché la società tecnologica ci ha allontanato, un po per forze maggiori, un po per nostre scelte, dalle opportunità che la Natura ci offre, abbiamo la necessità di operare delle correzioni al nostro forsennato ed autolesionista stile di vita. Primaria importanza riveste il ruolo dell acqua nella nostra vita. Le fonti di approvvigionamento di acqua potabile sono sempre più inquinate da prodotti chimici e farmaci, oltre al fatto che stanno diventando proprietà private delle multinazionali. E questo è un altro scottante argomento. L inquinamento delle acque ha spinto l industrie a costruire dei sistemi di purificazione, in modo da rendere più sicura l acqua potabile delle nostre case. Vari sistemi esistono in commercio, ma quello che maggiormente soddisfa le nostre esigenze fisiologiche è lo ionizzatore d acqua. L acqua alcalina prodotta con gli ionizzatori d acqua è un acqua viva, simile all acqua di sorgente ed anche migliore, perché la ionizzazione effettuata con l attuale tecnologia produce clusters d acqua molto più piccoli di ogni altra acqua potabile disponibile, permettendo una sua maggiore e più veloce penetrazione nella cellula. E importante comprendere la nozione di cluster (grappolo). In natura non esiste una molecola d acqua isolata, bensì un determinato gruppo di molecole, unite da un legame elettromagnetico. La minore dimensione dei clusters dell acqua ionizzata agevola anche il trasporto di tutte le sostanze idrosolubili di cui la cellula necessita ed agevola il drenaggio dei cataboliti cellulari. Infatti, questi clusters possono avere un peso molecolare di solo 18, molto più piccolo di altre molecole di grande importanza biologica come, per esempio, il betacarotene che ha un peso di 150, la vitamina E di 153, la 8 / 10
9 vitamina C di 176. Gli ionizzatori d acqua moderni possono produrre acqua alcalina a piacimento, dei cui vantaggi abbiamo trattato prima, ma anche acqua acida, i cui vantaggi saranno esposti nel prossimo approfondimento. Un altra interessante caratteristica dell acqua ionizzata alcalina è la sua struttura molecolare cristallina, simile alle migliori acque di sorgente, come ha dimostrato una ricerca di Masaru Emoto. Contrariamente a quanto si pensa, in Natura non è rara neppure l acqua super alcalina. Ci sono, infatti, molte sorgenti e molti laghi sparsi in tutto il mondo con valori di ph da 9 a 10. Famosi per la loro forza e longevità sono gli Hunza, un popolo che vive in alcune vallate dell Himalaya del Pakistan, che bevono un acqua le cui caratteristiche eccezionali hanno indotto, oltre mezzo secolo fa, alcuni scienziati russi e giapponesi a sperimentare l acqua alcalina per uso umano. Pochi di noi sanno che fin dalla preistoria i nostri antenati si sono dissetati con acqua naturale fortemente alcalina. Famosi sono i laghi della Rift Valley per la loro forte alcalinità: il Turkana ha ph 9,5-9,7; il Malawi ph 8,2-8,9; il Tanganika ph 8-9. Ebbene attorno a questi laghi si sono evoluti per milioni di anni 6 tipi di nostri antenati, tra cui l Homo Hergaster, diventato poi Homo Sapiens. L'acqua di questi laghi è tuttora potabile. In Tanzania la tribù degli Hadzab si disseta ancora oggi al lago Eyasi, che ha un ph di 9,4. Anche nel Ciad, Camerun, Niger e nella Nigeria si trovano laghi ricchi di bicarbonato di sodio con ph 9,5 10. In Bulgaria vengono vendute acque minerali con ph intorno a 9,5. Dallo studio delle popolazioni più longeve al mondo (Okinawa, Abkhazia, Vilcabamba, Avventisti di Loma Linda, Sardegna, ecc.) si evince che queste popolazioni hanno come denominatore comune i seguenti fattori: mangiano poco e con calma, mangiano per lo più cibi alcalini (frutta, verdura, cereali integrali), niente o pochi prodotti animali e bevono acqua con molti bicarbonati o minerali alcalini. Mentre la popolazione meno longeva, la cui vita media non supera i 30 anni, è quella dei minatori che estraggono lo zolfo attorno al lago Kawak (Indonesia), che con i suoi 36 milioni di m3 di acido solforico ed acido cloridrico è il lago più acido al mondo (ph 0,3). Dopo queste osservazioni biochimiche, fisiologiche e sociologiche, mi sembrano alquanto sostenibili tutte quelle ricerche a favore dell acqua e dei cibi alcalini e non ci sono ragioni, se non faziose, per scoraggiare l uso dell acqua alcalina da utilizzare, sicuramente, assieme a tutti gli altri fattori biologici che la Natura e la sana ricerca tecnologica ci mettono a disposizione. Il vantaggioso utilizzo dell acqua alcalina ionizzata da parte dei Giapponesi e Coreani per oltre mezzo secolo, da parte degli USA per oltre un trentennio vale molto di più delle aleatorie sperimentazioni scientifiche. A prescindere dai racconti miracolosi, comunque l acqua alcalina non potrà far male, perché l acqua alcalina è specifica per la nostra fisiologia. Per i curiosi ed i diffidenti consiglio di documentarsi sulle ricerche scientifiche fatte in tutto il mondo, ma soprattutto di sperimentare in proprio i meravigliosi effetti dell acqua alcalina, che non necessariamente deve essere quella di un apparecchio tecnologico, dal momento che ci sono innumerevoli sorgenti alcaline sparse in tutto il mondo. Cari lettori ricordiamoci sempre quello che diceva Galileo Galilei: Una esperienza vera vale più di mille ragioni, ma è vera per 9 / 10
10 ognuno di noi solo quella che sperimentiamo. Dr. Rocco Palmisano Laureato in Scienza della Salute (Laurea USA) Naturopata, Tecnico Sanitario di Radiologia Medica Il pioniere dell acqua alcalina in Italia 10 / 10
ACQUA E CIBO ALCALINI PERCHE?
 ACQUA E CIBO ALCALINI PERCHE? EQUILIBRIO ACIDO-BASICO Dr. Rocco Palmisano Laureato in Scienza della Salute, U.S.A. Naturopata Fondatore Associazione S.A.P.I.O. Chiunque conosca un po di fisiologia umana
ACQUA E CIBO ALCALINI PERCHE? EQUILIBRIO ACIDO-BASICO Dr. Rocco Palmisano Laureato in Scienza della Salute, U.S.A. Naturopata Fondatore Associazione S.A.P.I.O. Chiunque conosca un po di fisiologia umana
Plasma ph Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca
 Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
ph = log 1/[H + ] = log [H + ]
![ph = log 1/[H + ] = log [H + ] ph = log 1/[H + ] = log [H + ]](/thumbs/49/24977942.jpg) ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
Le reazioni metaboliche sono estremamente sensibili alla concentrazione degli ioni H + nel liquido in cui avvengono, perché gli ioni H + influenzano
 EQUILIBRIO ACIDOBASE Le reazioni metaboliche sono estremamente sensibili alla concentrazione degli ioni H + nel liquido in cui avvengono, perché gli ioni H + influenzano il funzionamento degli enzimi.
EQUILIBRIO ACIDOBASE Le reazioni metaboliche sono estremamente sensibili alla concentrazione degli ioni H + nel liquido in cui avvengono, perché gli ioni H + influenzano il funzionamento degli enzimi.
Rene ed equilibrio acido-base
 Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
a.a. 2017/18 Prof.ssa Pia Lucidi Laboratorio di Cognizione e Benessere Animale RICEVIMENTO: Lunedì 17:30-18:30
 a.a. 2017/18 Prof.ssa Pia Lucidi Laboratorio di Cognizione e Benessere Animale RICEVIMENTO: Lunedì 17:3018:30 Omeostasi acidobasica Gli enzimi operano ad un ph ottimale in un range molto ristretto (7.4
a.a. 2017/18 Prof.ssa Pia Lucidi Laboratorio di Cognizione e Benessere Animale RICEVIMENTO: Lunedì 17:3018:30 Omeostasi acidobasica Gli enzimi operano ad un ph ottimale in un range molto ristretto (7.4
Per le lezioni del prof. P.P. Battaglini Schemi di. v 3.2. ph = pka + log10 [!$]
![Per le lezioni del prof. P.P. Battaglini Schemi di. v 3.2. ph = pka + log10 [!$] Per le lezioni del prof. P.P. Battaglini Schemi di. v 3.2. ph = pka + log10 [!$]](/thumbs/92/108719223.jpg) Per le lezioni del prof. P.P. Battaglini Schemi di v 3.2 ph = pka + log10! " [!$] Dichiarazione Le immagini presenti in questo file sono state reperite in rete o modificate da testi cartacei. Queste immagini
Per le lezioni del prof. P.P. Battaglini Schemi di v 3.2 ph = pka + log10! " [!$] Dichiarazione Le immagini presenti in questo file sono state reperite in rete o modificate da testi cartacei. Queste immagini
Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio
 Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
I tre sistemi per la regolazione del ph
 I tre sistemi per la regolazione del ph Se vuoi finalmente capire quali sono e come funzionano i sistemi per la regolazione del ph questo breve articolo fa proprio al caso tuo. In questo articolo parleremo
I tre sistemi per la regolazione del ph Se vuoi finalmente capire quali sono e come funzionano i sistemi per la regolazione del ph questo breve articolo fa proprio al caso tuo. In questo articolo parleremo
Equilibrio acido base
 Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
7.5 Acqua e sali minerali
 7.5 Acqua e sali minerali L acqua negli alimenti Gli alimenti contengono acqua in quantità molto variabile. L acqua negli alimenti può essere legata: - è unita ad altre molecole - non è congelabile - non
7.5 Acqua e sali minerali L acqua negli alimenti Gli alimenti contengono acqua in quantità molto variabile. L acqua negli alimenti può essere legata: - è unita ad altre molecole - non è congelabile - non
Acqua e cibo alcalini perchè?
 Acqua e cibo alcalini perchè? Chiunque conosce un po di fisiologia umana sa che la biochimica del nostro corpo tende ad essere leggermente alcalina. Alcalino è anche e soprattutto il sangue arterioso,
Acqua e cibo alcalini perchè? Chiunque conosce un po di fisiologia umana sa che la biochimica del nostro corpo tende ad essere leggermente alcalina. Alcalino è anche e soprattutto il sangue arterioso,
A C Q U A c o n B A S S O R E S I D U O F I S S O
 A C Q U A c o n B A S S O R E S I D U O F I S S O Il fabbisogno idrico giornaliero è di circa 2 litri per un adulto. A questo quantitativo vanno aggiunti i liquidi forniti al corpo da frutta e verdura,
A C Q U A c o n B A S S O R E S I D U O F I S S O Il fabbisogno idrico giornaliero è di circa 2 litri per un adulto. A questo quantitativo vanno aggiunti i liquidi forniti al corpo da frutta e verdura,
Alterazione della capacità tampone nell'organismo. Alterazione capacità tampone rev. 0 - data: 5 luglio
 Alterazione della capacità tampone nell'organismo Alterazione capacità tampone rev. 0 - data: 5 luglio 2008 1 Il ph fisiologico dell'organismo è compreso tra 7.38 e 7.44 Nel liquido extracellulare sono
Alterazione della capacità tampone nell'organismo Alterazione capacità tampone rev. 0 - data: 5 luglio 2008 1 Il ph fisiologico dell'organismo è compreso tra 7.38 e 7.44 Nel liquido extracellulare sono
Jay Phelan, Maria Cristina Pignocchino. Scopriamo la biologia
 Jay Phelan, Maria Cristina Pignocchino Scopriamo la biologia Capitolo 10 La digestione e l escrezione 3 1. La struttura e le funzioni dell apparato digerente /1 L apparato digerente è formato dal tubo
Jay Phelan, Maria Cristina Pignocchino Scopriamo la biologia Capitolo 10 La digestione e l escrezione 3 1. La struttura e le funzioni dell apparato digerente /1 L apparato digerente è formato dal tubo
I principi nutritivi. Enrico Degiuli Classe Seconda
 I principi nutritivi Enrico Degiuli Classe Seconda A cosa servono gli alimenti? Tutti gli animali si nutrono di sostanze necessarie alla loro sopravvivenza. Il nostro corpo è una macchina estremamente
I principi nutritivi Enrico Degiuli Classe Seconda A cosa servono gli alimenti? Tutti gli animali si nutrono di sostanze necessarie alla loro sopravvivenza. Il nostro corpo è una macchina estremamente
EQUILIBRIO ACIDO-BASICO. Chiunque conosca un pò di fisiologia umana sa che la biochimica del nostro corpo tende ad essere leggermente alcalina.
 EQUILIBRIO ACIDO-BASICO A cura del Dr. Rocco Palmisano (Laureato in Scienza della Salute, U.S.A. - Naturopata) Chiunque conosca un pò di fisiologia umana sa che la biochimica del nostro corpo tende ad
EQUILIBRIO ACIDO-BASICO A cura del Dr. Rocco Palmisano (Laureato in Scienza della Salute, U.S.A. - Naturopata) Chiunque conosca un pò di fisiologia umana sa che la biochimica del nostro corpo tende ad
Equilibrio acido-base
 Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI
 EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI SOMMARIO ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO ACIDO-BASE EGA (EMOGAS-ANALISI) ANALISI) ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO
EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI SOMMARIO ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO ACIDO-BASE EGA (EMOGAS-ANALISI) ANALISI) ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO
Impariamo a mangiare bene
 Impariamo a mangiare bene I sei alimenti fondamentali I 6 alimenti fondamentali sono: Zuccheri Grassi Proteine Vitamine Acqua Sali minerali Soddisfazione dei fabbisogni biologici Nessun alimento da solo
Impariamo a mangiare bene I sei alimenti fondamentali I 6 alimenti fondamentali sono: Zuccheri Grassi Proteine Vitamine Acqua Sali minerali Soddisfazione dei fabbisogni biologici Nessun alimento da solo
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra ). La stabilità del ph è insidiata da
 Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Equilibrio acido-base: il ph è importante
 Equilibrio acido-base: il ph è importante il ph è strettamente controllato il ph influenza l attività enzimatica il ph è diverso nei vari compartimenti: Esempio: stomaco- acido duodeno alcalino Il ph varia
Equilibrio acido-base: il ph è importante il ph è strettamente controllato il ph influenza l attività enzimatica il ph è diverso nei vari compartimenti: Esempio: stomaco- acido duodeno alcalino Il ph varia
Tamponi biologici per il controllo del ph
 Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante di dissociazione
L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante di dissociazione
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi Lezione 24 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante
L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi Lezione 24 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE 1 I tamponi fisiologici del ph 1 - Il sistema acido carbonico-bicarbonato: H 2 CO 3 H + + HCO 3 pka = 6.1 ph = 6.1 + log [HCO 3 ] [H 2 CO 3 ] 2 - Il sistema fosfato:
L EQUILIBRIO ACIDO-BASE NEL SANGUE 1 I tamponi fisiologici del ph 1 - Il sistema acido carbonico-bicarbonato: H 2 CO 3 H + + HCO 3 pka = 6.1 ph = 6.1 + log [HCO 3 ] [H 2 CO 3 ] 2 - Il sistema fosfato:
Un mare di Risorse 3 edizione
 Liceo Scientifico «G. Marconi» - Foggia Un mare di Risorse 3 edizione Analisi delle acque Prof.ssa Flora Marino Nitrati Lo ione nitrato è un importante anione poliatomico. Ha formula NO 3. Lo ione NO 3
Liceo Scientifico «G. Marconi» - Foggia Un mare di Risorse 3 edizione Analisi delle acque Prof.ssa Flora Marino Nitrati Lo ione nitrato è un importante anione poliatomico. Ha formula NO 3. Lo ione NO 3
Siamo fatti così. Il nostro corpo è fatto di acqua, proteine, lipìdi, minerali, carboidrati e anche un po di vitamine.
 Alimentazione L alimentazione è importante per la salute e ci fornisce l energia per affrontare la giornata. Per mezzo di essa possiamo correre, divertirci, giocare ecc... La scienza dell alimentazione
Alimentazione L alimentazione è importante per la salute e ci fornisce l energia per affrontare la giornata. Per mezzo di essa possiamo correre, divertirci, giocare ecc... La scienza dell alimentazione
Tamponi Biologici. AO/Febbraio 2016
 Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
Sali minerali negli alimenti
 1 SALI MINERALI Sali minerali elementi inorganici. Sono necessari in piccole quantità (mg o mcg). Non forniscono calorie. Costituiscono circa il 4% in peso del corpo umano. Svolgono sia un azione plastica
1 SALI MINERALI Sali minerali elementi inorganici. Sono necessari in piccole quantità (mg o mcg). Non forniscono calorie. Costituiscono circa il 4% in peso del corpo umano. Svolgono sia un azione plastica
Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia
 Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia Obiettivi Produzione e bilancio degli idrogenioni Regolazione respiratoria e renale del ph Riassorbimento del bicarbonato e secrezione
Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia Obiettivi Produzione e bilancio degli idrogenioni Regolazione respiratoria e renale del ph Riassorbimento del bicarbonato e secrezione
PRINCIPALI SISTEMI TAMPONE
 SISTEMI TAMPONE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE -------------------------------------------------------------------------------------------------------------- 3 2 PRINCIPALI SISTEMI TAMPONE
SISTEMI TAMPONE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE -------------------------------------------------------------------------------------------------------------- 3 2 PRINCIPALI SISTEMI TAMPONE
Sistema urinario: la funzione renale
 Sistema urinario: la funzione renale FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici, i reni ne regolano la concentrazione plasmatica
Sistema urinario: la funzione renale FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici, i reni ne regolano la concentrazione plasmatica
U.D.A. Scienza in cucina. Sali Minerali
 U.D.A. Scienza in cucina Sali Minerali Pagine sul libro da pag. 129 a pag. 133 CHE COSA SONO I MINERALI NUTRIENTI ESSENZIALI NON CALORICI I MINERALI SONO MICRONUTRIENTI A differenza di quanto avviene
U.D.A. Scienza in cucina Sali Minerali Pagine sul libro da pag. 129 a pag. 133 CHE COSA SONO I MINERALI NUTRIENTI ESSENZIALI NON CALORICI I MINERALI SONO MICRONUTRIENTI A differenza di quanto avviene
acqua, CO 2, O 2, sali e ioni H +
 Legge dell Equilibrio di Massa Se la quantità di una sostanza nell organismo deve rimanere costante, ad ogni sua acquisizione deve corrispondere una perdita di eguale entità acqua, CO 2, O 2, sali e ioni
Legge dell Equilibrio di Massa Se la quantità di una sostanza nell organismo deve rimanere costante, ad ogni sua acquisizione deve corrispondere una perdita di eguale entità acqua, CO 2, O 2, sali e ioni
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da
 Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Equilibrio acido-base
 Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
45. Fisiologia dell'equilibrio acido-base
 Lezioni di Patologia generale Capitolo 45. Fisiologia dell'equilibrio acido-base 1465 45. Fisiologia dell'equilibrio acido-base III edizione ebook Luigi Barbieri (opzionale) 45. Fisiologia dell'equilibrio
Lezioni di Patologia generale Capitolo 45. Fisiologia dell'equilibrio acido-base 1465 45. Fisiologia dell'equilibrio acido-base III edizione ebook Luigi Barbieri (opzionale) 45. Fisiologia dell'equilibrio
45. Fisiologia dell'equilibrio acido-base
 Lezioni di Patologia generale Capitolo 45. Fisiologia dell'equilibrio acido-base 1465 45. Fisiologia dell'equilibrio acido-base III edizione print edition Luigi Barbieri (opzionale) 45. Fisiologia dell'equilibrio
Lezioni di Patologia generale Capitolo 45. Fisiologia dell'equilibrio acido-base 1465 45. Fisiologia dell'equilibrio acido-base III edizione print edition Luigi Barbieri (opzionale) 45. Fisiologia dell'equilibrio
I processi fondamentali che permettono all organismo di ricavare nutrimento dal cibo sono: Digestione: gli alimenti sono ridotti a sostanze semplici;
 I processi fondamentali che permettono all organismo di ricavare nutrimento dal cibo sono: Digestione: gli alimenti sono ridotti a sostanze semplici; Assorbimento: i nutrienti entrano nel sangue e sono
I processi fondamentali che permettono all organismo di ricavare nutrimento dal cibo sono: Digestione: gli alimenti sono ridotti a sostanze semplici; Assorbimento: i nutrienti entrano nel sangue e sono
I principi nutritivi
 I principi nutritivi Quali sono? Qual è la loro funzione? In quali cibi si trovano? Perché sono importanti? Quante Kilocalorie sviluppano? Kilocalorie Unità di misura dell energia accumulata negli alimenti
I principi nutritivi Quali sono? Qual è la loro funzione? In quali cibi si trovano? Perché sono importanti? Quante Kilocalorie sviluppano? Kilocalorie Unità di misura dell energia accumulata negli alimenti
Il Potassio è il principale catione intracellulare (K+) Si verifica per il Potassio la situazione inversa a quella del Sodio.
 POTASSIO Il Potassio è il principale catione intracellulare (K+) I suoi sali sono molto solubili in acqua. Si verifica per il Potassio la situazione inversa a quella del Sodio. Il mantenimento del gradiente
POTASSIO Il Potassio è il principale catione intracellulare (K+) I suoi sali sono molto solubili in acqua. Si verifica per il Potassio la situazione inversa a quella del Sodio. Il mantenimento del gradiente
Rene ed equilibrio acido base. La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica. Principali funzioni renali
 Rene ed equilibrio acido base La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica Savi Umberto Scuola di Specializzazione in Nefrologia S.C. di Nefrologia e Dialisi Cattinara
Rene ed equilibrio acido base La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica Savi Umberto Scuola di Specializzazione in Nefrologia S.C. di Nefrologia e Dialisi Cattinara
Acqua: nutriente essenziale
 Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
1. Controllo dell equilibrio acido-base. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 1. Controllo dell equilibrio acido-base Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Misura dell acidità di una soluzione Definizione di acido: qualsiasi sostanza chimica che
1. Controllo dell equilibrio acido-base Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Misura dell acidità di una soluzione Definizione di acido: qualsiasi sostanza chimica che
Trasporto epiteliale
 Trasporto epiteliale Rivestono le cavità e le superfici corporee: interfaccia tra gli spazi interni dell organismo e l ambiente Semplice rivestimento o funzione di regolazione (es:osmoregolazione) Trasporto
Trasporto epiteliale Rivestono le cavità e le superfici corporee: interfaccia tra gli spazi interni dell organismo e l ambiente Semplice rivestimento o funzione di regolazione (es:osmoregolazione) Trasporto
L apparato digerente è composto dal. Tubo digerente. Che comprende. Bocca. Faringe. Esofago. Stomaco. Intestino
 L apparato digerente è composto dal Tubo digerente Che comprende Bocca Faringe Esofago Stomaco Intestino Ghiandole Salivari Costituita da Lingua Cosparsa di Producono 32 Denti Papille Gustative Saliva
L apparato digerente è composto dal Tubo digerente Che comprende Bocca Faringe Esofago Stomaco Intestino Ghiandole Salivari Costituita da Lingua Cosparsa di Producono 32 Denti Papille Gustative Saliva
L ALIMENTAZIONE IL NOSTRO CORPO È UNA MACCHINA CHE HA BISOGNO CONTINUAMENTE DI ENERGIA ANCHE QUANDO È A RIPOSO.
 L ALIMENTAZIONE IL NOSTRO CORPO È UNA MACCHINA CHE HA BISOGNO CONTINUAMENTE DI ENERGIA ANCHE QUANDO È A RIPOSO. L ENERGIA VIENE RICAVATA DAI PRINCIPI NUTRITIVI O NUTRIENTI ALIMENTARSI VUOL DIRE SODDISFARE
L ALIMENTAZIONE IL NOSTRO CORPO È UNA MACCHINA CHE HA BISOGNO CONTINUAMENTE DI ENERGIA ANCHE QUANDO È A RIPOSO. L ENERGIA VIENE RICAVATA DAI PRINCIPI NUTRITIVI O NUTRIENTI ALIMENTARSI VUOL DIRE SODDISFARE
Funzioni. Regola composizione ionica plasmatica Volume plasmatico Osmolarità ph Rimuove I prodotti di scarto
 La Funzione Renale Funzioni Regola composizione ionica plasmatica Volume plasmatico Osmolarità ph Rimuove I prodotti di scarto Il Nefrone Distinguiamo un tubulo renale (trasporto) ed un corpuscolo renale
La Funzione Renale Funzioni Regola composizione ionica plasmatica Volume plasmatico Osmolarità ph Rimuove I prodotti di scarto Il Nefrone Distinguiamo un tubulo renale (trasporto) ed un corpuscolo renale
Impariamo a mangiare bene. Scienze Motorie Prof.ssa Marta Pippo
 Impariamo a mangiare bene 1 Scienze Motorie Prof.ssa Marta Pippo I 6 alimenti fondamentali sono: Zuccheri Grassi Proteine Vitamine Acqua Sali minerali Una buona alimentazione deve ricorrere alla combinazione
Impariamo a mangiare bene 1 Scienze Motorie Prof.ssa Marta Pippo I 6 alimenti fondamentali sono: Zuccheri Grassi Proteine Vitamine Acqua Sali minerali Una buona alimentazione deve ricorrere alla combinazione
SOLUZIONI derivate da: Acido debole/ sale (CH 3 COOH/CH 3 COONa) Base debole/ suo sale (NH 4 OH/NH 4 Cl)
 Soluzioni Tampone Si definiscono soluzioni tampone quelle soluzioni in grado di mantenere pressoché costante il proprio ph per aggiunta di una ragionevole quantità di acido o di base forte o per moderata
Soluzioni Tampone Si definiscono soluzioni tampone quelle soluzioni in grado di mantenere pressoché costante il proprio ph per aggiunta di una ragionevole quantità di acido o di base forte o per moderata
LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE
 LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE 1 ALDOSTERONE Ormone steroideo rilasciato dalla corticale surrenale l aldosterone stimola: riassorbimento di Na +
LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE 1 ALDOSTERONE Ormone steroideo rilasciato dalla corticale surrenale l aldosterone stimola: riassorbimento di Na +
Qualità dell'acqua Pagina 1 di 6
 Qualità dell'acqua Pagina 1 di 6 DISTRETTO CASTELLO Alcalinità equivalente a bicarbonati (HCO3) 29/08/2018 414 mg/l - Ammoniaca (NH4) 29/08/2018 0,05 mg/l 0-0,5 Calcio (Ca) 29/08/2018 122 mg/l - Cloro
Qualità dell'acqua Pagina 1 di 6 DISTRETTO CASTELLO Alcalinità equivalente a bicarbonati (HCO3) 29/08/2018 414 mg/l - Ammoniaca (NH4) 29/08/2018 0,05 mg/l 0-0,5 Calcio (Ca) 29/08/2018 122 mg/l - Cloro
Qualità dell'acqua Pagina 1 di 6
 Qualità dell'acqua Pagina 1 di 6 DISTRETTO CASTELLO Alcalinità equivalente a bicarbonati (HCO3) 28/11/2016 284 mg/l - Ammoniaca (NH4) 28/11/2016 0,058 mg/l 0-0,5 Calcio (Ca) 28/11/2016 87,6 mg/l - Cloro
Qualità dell'acqua Pagina 1 di 6 DISTRETTO CASTELLO Alcalinità equivalente a bicarbonati (HCO3) 28/11/2016 284 mg/l - Ammoniaca (NH4) 28/11/2016 0,058 mg/l 0-0,5 Calcio (Ca) 28/11/2016 87,6 mg/l - Cloro
ALTERAZIONI IDROELETTROLITICHE. ACIDO-BASE (2 parte) scaricato da EQUILIBRIO ACIDO-BASE (EAB) NECESSITA : EQUILIBRIO ACIDO-BASE
 (EAB) ALTERAZIONI IDROELETTROLITICHE ED ACIDOBASE (2 parte) NECESSITA : Mantenere costante il ph dei liquidi dell organismo su valori di 7,407,41 a fronte della produzione continua di acidi fissi ( 1mEq/kg
(EAB) ALTERAZIONI IDROELETTROLITICHE ED ACIDOBASE (2 parte) NECESSITA : Mantenere costante il ph dei liquidi dell organismo su valori di 7,407,41 a fronte della produzione continua di acidi fissi ( 1mEq/kg
Qualità dell'acqua Pagina 1 di 7
 Qualità dell'acqua Pagina 1 di 7 DISTRETTO CECINA Alcalinità equivalente a bicarbonati (HCO3) 27/03/2018 223,5 mg/l - Ammoniaca (NH4) 27/03/2018 0,0565 mg/l 0-0,5 Calcio (Ca) 27/03/2018 79,55 mg/l - Cloro
Qualità dell'acqua Pagina 1 di 7 DISTRETTO CECINA Alcalinità equivalente a bicarbonati (HCO3) 27/03/2018 223,5 mg/l - Ammoniaca (NH4) 27/03/2018 0,0565 mg/l 0-0,5 Calcio (Ca) 27/03/2018 79,55 mg/l - Cloro
Conoscere gli alimenti
 L educazione alimentare Conoscere gli alimenti Gli alimenti sono tutte le sostanze che l organismo può sfruttare per l accrescimento, il mantenimento e il funzionamento delle strutture corporee. Bisogna
L educazione alimentare Conoscere gli alimenti Gli alimenti sono tutte le sostanze che l organismo può sfruttare per l accrescimento, il mantenimento e il funzionamento delle strutture corporee. Bisogna
Qualità dell'acqua Pagina 1 di 7
 Qualità dell'acqua Pagina 1 di 7 DISTRETTO CECINA Alcalinità equivalente a bicarbonati (HCO3) 04/01/2017 152,5 mg/l - Ammoniaca (NH4) 04/01/2017 0,0935 mg/l 0-0,5 Calcio (Ca) 04/01/2017 56,35 mg/l - Cloro
Qualità dell'acqua Pagina 1 di 7 DISTRETTO CECINA Alcalinità equivalente a bicarbonati (HCO3) 04/01/2017 152,5 mg/l - Ammoniaca (NH4) 04/01/2017 0,0935 mg/l 0-0,5 Calcio (Ca) 04/01/2017 56,35 mg/l - Cloro
Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali:
 Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali: 1) Secerne Idrogenioni; 1a) Riassorbe il Bicarbonato Filtrato; 1b) Produce Nuovo Bicarbonato. 4320 meq/die
Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali: 1) Secerne Idrogenioni; 1a) Riassorbe il Bicarbonato Filtrato; 1b) Produce Nuovo Bicarbonato. 4320 meq/die
ACIDI E BASI LA TEORIA DI ARRHENIUS
 ACIDI E BASI LA TEORIA DI ARRHENIUS Il chimico svedese Arrhenius nel 1887 diede la prima definizione di acido e base, basata sulla capacità di queste sostanze di condurre la corrente elettrica. Secondo
ACIDI E BASI LA TEORIA DI ARRHENIUS Il chimico svedese Arrhenius nel 1887 diede la prima definizione di acido e base, basata sulla capacità di queste sostanze di condurre la corrente elettrica. Secondo
Pagine sul libro. da pag. 368 a pag. 375
 Sali minerali Pagine sul libro da pag. 368 a pag. 375 Minerali I minerali, così come le vitamine, devono essere assunti con la dieta e fanno parte dei princìpi nutritivi che non apportano energia Sono
Sali minerali Pagine sul libro da pag. 368 a pag. 375 Minerali I minerali, così come le vitamine, devono essere assunti con la dieta e fanno parte dei princìpi nutritivi che non apportano energia Sono
EQUILIBRIO ACIDO-BASE E ALIMENTAZIONE
 EQUILIBRIO ACIDO-BASE E ALIMENTAZIONE www.iurlarostudio.it Dott.ssa Maria Pia Iurlaro Equilibrio Acido-Base e Alimentazione Molti ricercatori hanno evidenziato l importanza dell equilibrio acido-basico
EQUILIBRIO ACIDO-BASE E ALIMENTAZIONE www.iurlarostudio.it Dott.ssa Maria Pia Iurlaro Equilibrio Acido-Base e Alimentazione Molti ricercatori hanno evidenziato l importanza dell equilibrio acido-basico
Qualità dell'acqua Pagina 1 di 5
 Qualità dell'acqua Pagina 1 di 5 DISTRETTO GARDONCINO Alcalinità equivalente a bicarbonati (HCO3) 08/02/2018 101 mg/l - Ammoniaca (NH4) 08/02/2018 0,05 mg/l 0-0,5 Arsenico (As) 08/02/2018 1,06 µg/l 0-10
Qualità dell'acqua Pagina 1 di 5 DISTRETTO GARDONCINO Alcalinità equivalente a bicarbonati (HCO3) 08/02/2018 101 mg/l - Ammoniaca (NH4) 08/02/2018 0,05 mg/l 0-0,5 Arsenico (As) 08/02/2018 1,06 µg/l 0-10
Qualità dell'acqua Pagina 1 di 6
 Qualità dell'acqua Pagina 1 di 6 DISTRETTO BOGLIACO/VILLA Alcalinità equivalente a bicarbonati (HCO3) 04/01/2017 184 mg/l - Ammoniaca (NH4) 04/01/2017 0,1933333 0-0,5 Arsenico (As) 04/01/2017 0 µg/l 0-10
Qualità dell'acqua Pagina 1 di 6 DISTRETTO BOGLIACO/VILLA Alcalinità equivalente a bicarbonati (HCO3) 04/01/2017 184 mg/l - Ammoniaca (NH4) 04/01/2017 0,1933333 0-0,5 Arsenico (As) 04/01/2017 0 µg/l 0-10
Qualità dell'acqua Pagina 1 di 5
 Qualità dell'acqua Pagina 1 di 5 DISTRETTO CASTELLETTO Alcalinità equivalente a bicarbonati (HCO3) 31/10/2016 384 mg/l - Ammoniaca (NH4) 31/10/2016 0,11 mg/l 0-0,5 Arsenico (As) 31/10/2016 0 µg/l 0-10
Qualità dell'acqua Pagina 1 di 5 DISTRETTO CASTELLETTO Alcalinità equivalente a bicarbonati (HCO3) 31/10/2016 384 mg/l - Ammoniaca (NH4) 31/10/2016 0,11 mg/l 0-0,5 Arsenico (As) 31/10/2016 0 µg/l 0-10
Biofisica e Fisiologia I semestre-ii anno 8 crediti. Elementi di Fisiologia e Biofisica Cellulare. Fisiologia dell apparato muscolare
 Biofisica e Fisiologia I semestre-ii anno 8 crediti Docenti: G. Irace I. Sirangelo http://dbb.unina2.it Obiettivi formativi Elementi di Fisiologia e Biofisica Cellulare Eccitabilità Fisiologia dell apparato
Biofisica e Fisiologia I semestre-ii anno 8 crediti Docenti: G. Irace I. Sirangelo http://dbb.unina2.it Obiettivi formativi Elementi di Fisiologia e Biofisica Cellulare Eccitabilità Fisiologia dell apparato
Qualità dell'acqua Pagina 1 di 5
 Qualità dell'acqua Pagina 1 di 5 DISTRETTO CISANO Alcalinità equivalente a bicarbonati (HCO3) 28/08/2018 115 mg/l - Ammoniaca (NH4) 28/08/2018 0,05 mg/l 0-0,5 Arsenico (As) 28/08/2018 1 µg/l 0-10 Calcio
Qualità dell'acqua Pagina 1 di 5 DISTRETTO CISANO Alcalinità equivalente a bicarbonati (HCO3) 28/08/2018 115 mg/l - Ammoniaca (NH4) 28/08/2018 0,05 mg/l 0-0,5 Arsenico (As) 28/08/2018 1 µg/l 0-10 Calcio
Qualità dell'acqua Pagina 1 di 5
 Qualità dell'acqua Pagina 1 di 5 DISTRETTO CISANO Alcalinità equivalente a bicarbonati (HCO3) 17/11/2016 120 mg/l - Ammoniaca (NH4) 17/11/2016 0,093 mg/l 0-0,5 Arsenico (As) 17/11/2016 0 µg/l 0-10 Calcio
Qualità dell'acqua Pagina 1 di 5 DISTRETTO CISANO Alcalinità equivalente a bicarbonati (HCO3) 17/11/2016 120 mg/l - Ammoniaca (NH4) 17/11/2016 0,093 mg/l 0-0,5 Arsenico (As) 17/11/2016 0 µg/l 0-10 Calcio
GLI ACIDI E LE BASI nel quotidiano L acido acetico: è presente nell aceto; L acido formico: a questo composto si deve il bruciore che si avverte dopo
 GLI ACIDI E LE BASI nel quotidiano L acido acetico: è presente nell aceto; L acido formico: a questo composto si deve il bruciore che si avverte dopo il morso di una formica; L acido citrico: è contenuto
GLI ACIDI E LE BASI nel quotidiano L acido acetico: è presente nell aceto; L acido formico: a questo composto si deve il bruciore che si avverte dopo il morso di una formica; L acido citrico: è contenuto
La classificazione delle proteine
 protidi 1 La classificazione delle proteine In base al valore biologico (ovvero al contenuto di AAE) si distinguono: - p. ad alto valore biologico contengono tutti gli AAE (es. carne, pesce, uova, latte
protidi 1 La classificazione delle proteine In base al valore biologico (ovvero al contenuto di AAE) si distinguono: - p. ad alto valore biologico contengono tutti gli AAE (es. carne, pesce, uova, latte
Qualità dell'acqua Pagina 1 di 9
 Qualità dell'acqua Pagina 1 di 9 DISTRETTO DESENZANO CENT Alcalinità equivalente a bicarbonati (HCO3) 23/12/2016 148,5 mg/l - Ammoniaca (NH4) 23/12/2016 0,1275 mg/l 0-0,5 Arsenico (As) 23/12/2016 0,8125
Qualità dell'acqua Pagina 1 di 9 DISTRETTO DESENZANO CENT Alcalinità equivalente a bicarbonati (HCO3) 23/12/2016 148,5 mg/l - Ammoniaca (NH4) 23/12/2016 0,1275 mg/l 0-0,5 Arsenico (As) 23/12/2016 0,8125
Qualità dell'acqua Pagina 1 di 6
 Qualità dell'acqua Pagina 1 di 6 DISTRETTO CASTELLETTO Alcalinità equivalente a bicarbonati (HCO3) 23/04/2018 194 mg/l - Ammoniaca (NH4) 23/04/2018 0,05 mg/l 0-0,5 Arsenico (As) 23/04/2018 1,16 µg/l 0-10
Qualità dell'acqua Pagina 1 di 6 DISTRETTO CASTELLETTO Alcalinità equivalente a bicarbonati (HCO3) 23/04/2018 194 mg/l - Ammoniaca (NH4) 23/04/2018 0,05 mg/l 0-0,5 Arsenico (As) 23/04/2018 1,16 µg/l 0-10
Qualità dell'acqua Pagina 1 di 6
 Qualità dell'acqua Pagina 1 di 6 DISTRETTO CASTELLETTO Alcalinità equivalente a bicarbonati (HCO3) 02/11/2016 200 mg/l - Ammoniaca (NH4) 02/11/2016 0,1 mg/l 0-0,5 Arsenico (As) 02/11/2016 1,26 µg/l 0-10
Qualità dell'acqua Pagina 1 di 6 DISTRETTO CASTELLETTO Alcalinità equivalente a bicarbonati (HCO3) 02/11/2016 200 mg/l - Ammoniaca (NH4) 02/11/2016 0,1 mg/l 0-0,5 Arsenico (As) 02/11/2016 1,26 µg/l 0-10
Qualità dell'acqua Pagina 1 di 9
 Qualità dell'acqua Pagina 1 di 9 DISTRETTO DESENZANO CENTRO Alcalinità equivalente a bicarbonati (HCO3) 22/06/2017 141,6 mg/l - Ammoniaca (NH4) 22/06/2017 0,147 mg/l 0-0,5 Arsenico (As) 22/06/2017 0,27
Qualità dell'acqua Pagina 1 di 9 DISTRETTO DESENZANO CENTRO Alcalinità equivalente a bicarbonati (HCO3) 22/06/2017 141,6 mg/l - Ammoniaca (NH4) 22/06/2017 0,147 mg/l 0-0,5 Arsenico (As) 22/06/2017 0,27
Apparato digerente. È formato dal un lungo tubo che inizia con la bocca e finisce con l'ano. Le parti principali in cui si suddivide sono:
 Apparato digerente È formato dal un lungo tubo che inizia con la bocca e finisce con l'ano. Le parti principali in cui si suddivide sono: bocca faringe esofago stomaco intestino tenue intestino crasso
Apparato digerente È formato dal un lungo tubo che inizia con la bocca e finisce con l'ano. Le parti principali in cui si suddivide sono: bocca faringe esofago stomaco intestino tenue intestino crasso
Capitolo 6 La respirazione cellulare
 Capitolo 6 La respirazione cellulare Introduzione alla respirazione cellulare 6.1 La respirazione polmonare rifornisce le nostre cellule di ossigeno ed elimina diossido di carbonio La respirazione polmonare
Capitolo 6 La respirazione cellulare Introduzione alla respirazione cellulare 6.1 La respirazione polmonare rifornisce le nostre cellule di ossigeno ed elimina diossido di carbonio La respirazione polmonare
Qualità dell'acqua Pagina 1 di 8
 Qualità dell'acqua Pagina 1 di 8 DISTRETTO DESENZANO CENTRO Alcalinità equivalente a bicarbonati (HCO3) 17/09/2018 155,25 mg/l - Arsenico (As) 17/09/2018 1,012 µg/l 0-10 Calcio (Ca) 17/09/2018 43,15 mg/l
Qualità dell'acqua Pagina 1 di 8 DISTRETTO DESENZANO CENTRO Alcalinità equivalente a bicarbonati (HCO3) 17/09/2018 155,25 mg/l - Arsenico (As) 17/09/2018 1,012 µg/l 0-10 Calcio (Ca) 17/09/2018 43,15 mg/l
diminuito aumentato I disordini acido-base primari metabolici si riconoscono attraverso la valutazione della concentrazione di HCO3-
 diminuito aumentato I disordini acido-base primari metabolici si riconoscono attraverso la valutazione della concentrazione di HCO3- Risposta compensatoria all acidosi metabolica Compensazione polmonare
diminuito aumentato I disordini acido-base primari metabolici si riconoscono attraverso la valutazione della concentrazione di HCO3- Risposta compensatoria all acidosi metabolica Compensazione polmonare
Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento.
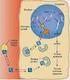 Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento. Lungo i tubuli renali viene riassorbita la maggior parte dei soluti e il
Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento. Lungo i tubuli renali viene riassorbita la maggior parte dei soluti e il
Qualità dell'acqua Pagina 1 di 5
 Qualità dell'acqua Pagina 1 di 5 DISTRETTO CISANO Alcalinità equivalente a bicarbonati (HCO3) 08/05/2018 131 mg/l - Ammoniaca (NH4) 08/05/2018 0,05 mg/l 0-0,5 Arsenico (As) 08/05/2018 1 µg/l 0-10 Calcio
Qualità dell'acqua Pagina 1 di 5 DISTRETTO CISANO Alcalinità equivalente a bicarbonati (HCO3) 08/05/2018 131 mg/l - Ammoniaca (NH4) 08/05/2018 0,05 mg/l 0-0,5 Arsenico (As) 08/05/2018 1 µg/l 0-10 Calcio
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
L'EQUILIBRIO ACIDO-BASE
 L'EQUILIBRIO ACIDO-BASE La concentrazione nell'organismo degli ioni H+ è finemente regolata perché quasi tutte le attività enzimatiche sono influenzate sostanzialmente dalle variazioni di ph. Quindi l'attività
L'EQUILIBRIO ACIDO-BASE La concentrazione nell'organismo degli ioni H+ è finemente regolata perché quasi tutte le attività enzimatiche sono influenzate sostanzialmente dalle variazioni di ph. Quindi l'attività
le reazioni chimiche
 le reazioni chimiche Una reazione (o equazione) chimica e una trasformazione di sostanze dette reagenti in altre sostanze dette prodotti. reagenti prodotti ESEMPI DI REAZIONI CHIMICHE: - ACETO + BICARBONATO
le reazioni chimiche Una reazione (o equazione) chimica e una trasformazione di sostanze dette reagenti in altre sostanze dette prodotti. reagenti prodotti ESEMPI DI REAZIONI CHIMICHE: - ACETO + BICARBONATO
Acqua, buona da mangiare
 Acqua, buona da mangiare 25 settembre 2010 Dott.ssa Alessandra Palomba S.I.A.N. AUSL Reggio Emilia Il 70-80% del nostro corpo è costituito da acqua % di acqua contenuta nel corpo umano ~ sangue 90% ~ cervello
Acqua, buona da mangiare 25 settembre 2010 Dott.ssa Alessandra Palomba S.I.A.N. AUSL Reggio Emilia Il 70-80% del nostro corpo è costituito da acqua % di acqua contenuta nel corpo umano ~ sangue 90% ~ cervello
i principi nutritivi seconda parte Prof.ssa Mila del Corno
 i principi nutritivi seconda parte Prof.ssa Mila del Corno L ACQUA E il componente più abbondante del corpo umano, di cui rappresenta circa il 60-65% del peso L acqua non fornisce energia (quindi non fa
i principi nutritivi seconda parte Prof.ssa Mila del Corno L ACQUA E il componente più abbondante del corpo umano, di cui rappresenta circa il 60-65% del peso L acqua non fornisce energia (quindi non fa
Qualità dell'acqua Pagina 1 di 5
 Qualità dell'acqua Pagina 1 di 5 DISTRETTO CALCINATELLO Alcalinità equivalente a bicarbonati (HCO3) 04/10/2016 225 mg/l - Calcio (Ca) 04/10/2016 69,9 mg/l - Cloro attivo libero (al prelievo) 04/10/2016
Qualità dell'acqua Pagina 1 di 5 DISTRETTO CALCINATELLO Alcalinità equivalente a bicarbonati (HCO3) 04/10/2016 225 mg/l - Calcio (Ca) 04/10/2016 69,9 mg/l - Cloro attivo libero (al prelievo) 04/10/2016
Qualità dell'acqua Pagina 1 di 5
 Qualità dell'acqua Pagina 1 di 5 DISTRETTO CALCINATELLO Alcalinità equivalente a bicarbonati (HCO3) 06/04/2018 227 mg/l - Calcio (Ca) 06/04/2018 95 mg/l - Cloro attivo libero (al prelievo) 06/04/2018 0,1
Qualità dell'acqua Pagina 1 di 5 DISTRETTO CALCINATELLO Alcalinità equivalente a bicarbonati (HCO3) 06/04/2018 227 mg/l - Calcio (Ca) 06/04/2018 95 mg/l - Cloro attivo libero (al prelievo) 06/04/2018 0,1
Qualità dell'acqua Pagina 1 di 7
 Qualità dell'acqua Pagina 1 di 7 DISTRETTO ARMO Alcalinità equivalente a bicarbonati (HCO3) 01/10/2018 192 mg/l - Calcio (Ca) 01/10/2018 35,2 mg/l - Cloro attivo libero (al prelievo) 01/10/2018 0,07 mg/l
Qualità dell'acqua Pagina 1 di 7 DISTRETTO ARMO Alcalinità equivalente a bicarbonati (HCO3) 01/10/2018 192 mg/l - Calcio (Ca) 01/10/2018 35,2 mg/l - Cloro attivo libero (al prelievo) 01/10/2018 0,07 mg/l
FORZA DI ACIDI E BASI HA + :B HB + + A
 FORZA DI ACIDI E BASI n La forza di un acido è la misura della tendenza di una sostanza a cedere un protone. n La forza di una base è una misura dell'affinità di un composto ad accettare un protone. n
FORZA DI ACIDI E BASI n La forza di un acido è la misura della tendenza di una sostanza a cedere un protone. n La forza di una base è una misura dell'affinità di un composto ad accettare un protone. n
Qualità dell'acqua Pagina 1 di 6
 Qualità dell'acqua Pagina 1 di 6 DISTRETTO CAMPOVERDE Alcalinità equivalente a bicarbonati (HCO3) 06/09/2018 238 mg/l - Calcio (Ca) 06/09/2018 69,1 mg/l - Cloro attivo libero (al prelievo) 06/09/2018 0,29
Qualità dell'acqua Pagina 1 di 6 DISTRETTO CAMPOVERDE Alcalinità equivalente a bicarbonati (HCO3) 06/09/2018 238 mg/l - Calcio (Ca) 06/09/2018 69,1 mg/l - Cloro attivo libero (al prelievo) 06/09/2018 0,29
LA RISPOSTA POLMONARE
 IL CONTROLLO INTEGRATO DELL EQUILIBRIO ACIDO-BASE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE --------------------------------------------------------------------------------------------------------------
IL CONTROLLO INTEGRATO DELL EQUILIBRIO ACIDO-BASE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE --------------------------------------------------------------------------------------------------------------
L APPARATO DIGERENTE E COSTITUITO DA UN LUNGO TUBO DI FORMA IRREGOLARE DETTO CANALE DIGERENTE CHE INIZIA CON L APERTURA DELLA BOCCA, PROSEGUE CON LA
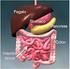 L APPARATO DIGERENTE E COSTITUITO DA UN LUNGO TUBO DI FORMA IRREGOLARE DETTO CANALE DIGERENTE CHE INIZIA CON L APERTURA DELLA BOCCA, PROSEGUE CON LA FARINGE, L ESOFAGO, LO STOMACO, L INTESTINO TENUE, L
L APPARATO DIGERENTE E COSTITUITO DA UN LUNGO TUBO DI FORMA IRREGOLARE DETTO CANALE DIGERENTE CHE INIZIA CON L APERTURA DELLA BOCCA, PROSEGUE CON LA FARINGE, L ESOFAGO, LO STOMACO, L INTESTINO TENUE, L
Equilibri acido-base, ph e sistemi tampone
 Equilibri acido-base, ph e sistemi tampone Tiziana Bellini Dipartimento di Scienze Biomediche Chirurgico Specialistiche Facoltà di Medicina Farmacia e Prevenzione Università di Ferrara Cos è un acido?
Equilibri acido-base, ph e sistemi tampone Tiziana Bellini Dipartimento di Scienze Biomediche Chirurgico Specialistiche Facoltà di Medicina Farmacia e Prevenzione Università di Ferrara Cos è un acido?
I PROTIDI ASPETTI GENERALI
 I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
DISORDINI DELL EQUILIBRIO ACIDO - BASE
 DISORDINI DELL EQUILIBRIO ACIDO - BASE Equilibrio acido-base e potassio Nel tubulo distale e dotto collettore il riassorbimento del bicarbonato è legato a quello del potassio Il riassorbimento del bicarbonato
DISORDINI DELL EQUILIBRIO ACIDO - BASE Equilibrio acido-base e potassio Nel tubulo distale e dotto collettore il riassorbimento del bicarbonato è legato a quello del potassio Il riassorbimento del bicarbonato
STRUTTURA e FUNZIONE
 STRUTTURA e FUNZIONE LA FUNZIONE DIPENDE DALLA STRUTTURA ossia LA FISIOLOGIA SI BASA SULL'ANATOMIA (e sull'istologia) Esempi sono: la miosina (testa e coda) lo pneumocita di I ordine: perché è così piatto?
STRUTTURA e FUNZIONE LA FUNZIONE DIPENDE DALLA STRUTTURA ossia LA FISIOLOGIA SI BASA SULL'ANATOMIA (e sull'istologia) Esempi sono: la miosina (testa e coda) lo pneumocita di I ordine: perché è così piatto?
Qualità dell'acqua Pagina 1 di 7
 Qualità dell'acqua Pagina 1 di 7 DISTRETTO CECINA Alcalinità equivalente a bicarbonati (HCO3) 28/09/2018 211 mg/l - Calcio (Ca) 28/09/2018 65,85 mg/l - Cloro attivo libero (al prelievo) 28/09/2018 0,14
Qualità dell'acqua Pagina 1 di 7 DISTRETTO CECINA Alcalinità equivalente a bicarbonati (HCO3) 28/09/2018 211 mg/l - Calcio (Ca) 28/09/2018 65,85 mg/l - Cloro attivo libero (al prelievo) 28/09/2018 0,14
La massa è la quantità di materia di cui è fatta una qualsiasi cosa
 Dall atomo all organizzazione cellulare Tutti gli organismi viventi sono costituiti da atomi Due o più atoni insieme formano le molecole La materia è tutto ciò che occupa uno spazio, ha un volume e una
Dall atomo all organizzazione cellulare Tutti gli organismi viventi sono costituiti da atomi Due o più atoni insieme formano le molecole La materia è tutto ciò che occupa uno spazio, ha un volume e una
I materiali della vita
 I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
NUTRIRSI AL TOP. Conferenza del dott. Luciano Rizzo
 NUTRIRSI AL TOP Conferenza del dott. Luciano Rizzo Luciano Rizzo vive a Trieste, esercita la professione di medico e scrittore. Si occupa di medicina naturale, ama i viaggi e le persone creative. Finora
NUTRIRSI AL TOP Conferenza del dott. Luciano Rizzo Luciano Rizzo vive a Trieste, esercita la professione di medico e scrittore. Si occupa di medicina naturale, ama i viaggi e le persone creative. Finora
