PROCESSI CHE INFLUENZANO L ASSORBIMENTO DEL PRINCIPIO ATTIVO 1 PARTE
|
|
|
- Basilio Lombardo
- 7 anni fa
- Visualizzazioni
Transcript
1 Tecnologia Socioeconomia Legislazione Farmaceutica 1 con laboratorio - CdLM CTF 12 cfu 1 semestre PROCESSI CHE INFLUENZANO L ASSORBIMENTO DEL PRINCIPIO ATTIVO 1 PARTE Docente: Prof.ssa Anna Maria Maccioni 1
2 La velocità di assorbimento di un principio attivo dipende dalla sua velocità di dissoluzione nei liquidi biologici e dalla sua velocità di diffusione attraverso le membrane FASE FARMACEUTICA 2
3 insieme dei processi che portano il farmaco ad essere nel sito di assorbimento in forma dissolta o in forma assorbibile 3
4 FASE FARMACEUTICA Farmaco nella forma Farmaceutica nei fluidi biologici disaggregazione liberazione KL Grado di liberazione del farmaco Farmaco libero dissoluzione Farmaco in soluzione nel fluido biologico assorbimento Kp Kd Grado di dissoluzione del farmaco Farmaco in circolo Grado di permeabilità del farmaco nella fase di assorbimento attraverso le membrane Se Kd è minore di KL e Kp l assorbimento è regolato dalla DISSOLUZIONE 4
5 F.F. orale solida la velocità di liberazione e poi di dissoluzione del farmaco nei liquidi biologici rappresenta l elemento limitante l assorbimento. Bagnabilità f.f. Rigonfiamento f.f. Rottura f.f. Disgregazione f.f. Liberazione del p.a. 5
6 + Particella solida Solvente + Da un composto solido in cristalli, immerso in un liquido, per effetto della sua solubilità e delle interazioni con il liquido, le molecole più superficiali si staccano dal reticolo cristallino e passano in soluzione fino a che viene raggiunto uno stato di equilibrio (saturazione). 6
7 1 Stadio Processo multistadio E un processo interfacciale che consiste nella liberazione di molecole di soluto dalla fase solida alla fase liquida rappresentato dal solvente, in questo caso il fluido biologico. Come conseguenza di ciò, all equilibrio, si forma intono alla particella solida un sottile strato di soluzione satura, chiamato strato di saturazione di concentrazione Cs e di spessore h h solido Cs Bulk Strato di saturazione di altezza h e concentrazione Cs Cristallo di superficie S 7
8 2 Stadio È un processo di Diffusione, rappresentato dal trasporto di altre molecole di soluto, che si staccano dalla superficie solida, verso la massa totale del solvente (bulk), attraverso lo strato di saturazione*. Ossia le molecole diffondono dall interfaccia solido/strato di saturazione fino all interfaccia strato di saturazione/massa del solvente (bulk). *Strato di saturazione = Strato di diffusione Interfaccia solido/ strato di saturazione h solido Cs Bulk (Concentrazione Ct) Processo di diffusione Interfaccia strato di saturazione / bulk del solvente (fluido GI) Esso rappresenta lo Stadio Lento del Processo di dissoluzione 8
9 Descrive il processo di dissoluzione regolato dalla Diffusione dc dt KS( Cs Ct) dc/dt = velocità di dissoluzione ossia la variazione di concentrazione nell'unità di tempo. S = superficie specifica delle particelle solide (area per unità di volume) Cs = concentrazione nello strato di diffusione ossia la solubilità della sostanza. Ct = concentrazione nel solvente circostante al tempo t (Bulk) (Cs-Ct) = gradiente di concentrazione K D h D = coefficiente di diffusione del soluto h = spessore dello strato di diffusione h solido Cs Bulk (Concentrazione Ct) 9
10 Coefficiente di Diffusione - D K D h 1 a Legge di Fick esprime la velocità di diffusione di un soluto: D il coefficiente di diffusione ha le dimensioni di area/unità di tempo (cm 2 /t). Il segno negativo sta' ad indicare che la diffusione avviene da un luogo ad alta concentrazione ad uno a minore concentrazione. dm dt DA dc dx dm è la quantità di soluto che diffonde nel tempo dt attraverso una superficie A, sotto l'influenza di un gradiente di concentrazione dc/dx. Massa molecolare del soluto Viscosità del mezzo Fattori che influenzano D Concentrazione del soluto Temperatura 10
11 Dalla concentrazione del soluto Dalla massa molecolare del soluto Fattori che influenzano D tanto maggiore è la dimensione della molecola tanto MINORE è il coefficiente di diffusione; Dalla viscosità dello strato diffusionale maggiore è la viscosità del solvente MINORE è il coefficiente di diffusione, in quanto viene rallentato lo scorrimento tra le molecole di solvente e di soluto (Cibo, eccipienti della formulazione,e altro). Dalla temperatura con l'aumento della temperatura AUMENTA il coefficiente di diffusione in quanto aumenta l'energia cinetica delle molecole di soluto e di solvente; in più diminuisce la viscosità e l'altezza dello strato di diffusione h, dovuta al fenomeno dell agitazione termica. 11
12 Superficie specifica - S aumenta con il diminuire delle dimensioni delle particelle solide (tale aumento è reso evidente se si esprime la superficie in cm 2 per ogni unità di volume della sostanza) dc dt KS( Cs Ct) A = Area della particella solida. V = Volume della particella solida S sp A V 6 l 2 l 3 6 l l =1 cm l =1 mm N dei cubi l A Ssp (cm2/cm3) 1 1 cm 6 cm mm 60 cm mm 600 cm mm 6000 cm l =0,1 mm 12
13 solubilità Solubilità - Cs Massima concentrazione di un soluto in una quantità nota di solvente ad una determinata temperatura. E una proprietà statica a differenza della dissoluzione che è dinamica C 0 Solubilità vera Cs dc KS( Cs Ct) dt Punto di saturazione Sostanza pura Soluzione C Soluzione satura a 37 C Peso di soluto per un determinato volume di solvente FDA definisce: Bassa solubilità: quando < 5 mg/ml Bassa dissoluzione quando < 50% in 30 Una solubilità < di 1 mg/ml può costituire un fattore limitante per l assorbimento, in quanto solubilità e velocità di dissoluzione sono correlati. 13
14 Gradiente di concentrazione (Cs Ct) nello strato di diffusione, la concentrazione delle molecole di soluto varia, in funzione della distanza, in modo costante da Cs a Ct Interfaccia soluzione satura/bulk del solvente All interfaccia stato solido/strato diffusionale X = 0, il farmaco allo stato solido è in equilibrio con il farmaco nello strato diffusionale. Oltre lo strato diffusionale (nel bulk del solvente) ad una distanza X > h, il farmaco si trova distribuito in concentrazione uniforme C = Ct attraverso tutta la massa. Il gradiente, ossia la variazione della concentrazione del farmaco in funzione della distanza attraverso lo strato diffusionale diminuisce in modo costante, come 14 rappresentato nel grafico, fino a raggiungere un valore costante pari a Ct
15 Condizioni di Sink (Ct «Cs) Le condizioni di Sink possono essere assimilate al gocciolamento di un rubinetto in un lavandino, dove la goccia, che si stacca dal rubinetto (particella solida), rappresenta la molecola che passa in soluzione, il tragitto della goccia fino allo scarico rappresenta la distanza h, lo scarico rappresenta il bulk del solvente. h s Cs Bulk (Concentrazione Ct) h Le condizioni di Sink si verificano in vivo quando il p.a. disciolto nel fluido gastrointestinale, viene assorbito più velocemente rispetto al processo di dissoluzione. Nella Legge di Noyse Whytney la concentrazione Ct può essere eliminata dall equazione, la quale si riduce dc dt KSC s La velocità di dissoluzione, (dc/dt) (1/S), è la quantità di farmaco che si dissolve per unità di superficie nell'unità di tempo (g/cm2/min). 15
16 Metodi per migliorare la dissoluzione Una dissoluzione intrinseca > 1 mg/cm 2 indica buona dissoluzione Una dissoluzione intrinseca < 0,1 mg/cm 2 indica problemi di dissoluzione Modifiche sul p.a. MODIFICHE DI TIPO FISICO MODIFICHE DI TIPO CHIMICO Stessa entità chimica Nuova entità chimica Modifiche formulative SCELTA DEGLI ECCIPIENTI Complessazione ed inclusione Modifiche del ph micro-ambientale Impiego di cosolventi Formazioni di soluzioni e dispersioni solide Impiego di tensioattivi Sistemi lipofili Adsorbimento 16
17 Modifiche sul p.a. MODIFICHE DI TIPO FISICO Stessa entità chimica Forma e dimensioni delle particelle - S La solubilità e la di dissoluzione può essere collegata a: n facce esposte rugosità di superficie n di gruppi funzionali idrofili esposti 17
18 Dimensioni Stessa entità chimica Le dimensioni delle particelle influenzano l area superficiale S 18
19 19
20 Con la micronizzazione potrà essere somministrata una dose inferiore del p.a., evitando i danni potenziali dovuti alle particelle normalmente non disciolte nell organismo che possono solubilizzarsi accidentalmente, ottenendo per di più un risparmio da un punto di vista economico. utilizzando 0.50g di griseofulvina micronizzata si aveva lo stesso livello ematico di 1g di griseofulvina di particelle con grandezza superiore. INCONVENIENTI Non micronizzata Tempo di emivita nel siero 10 ore micronizzata Tempo di emivita nel siero 4 ore La micronizzazione può dare luogo ad aggregati (> energia di superficie ) che,per Farmaci poco solubili, portano a decremento della Dissoluzione (<bagnabilità) 20
21 Stato solido Stessa entità chimica COMPOSTO CHIMICO I cristalli presentano una forma definita con elevata energia di struttura Struttura interna Entità singola Cristallina Polimorfi* Amorfa I prodotti amorfi non possiedono una struttura definita con bassa energia di struttura ( più solubili e biodisponibili) Anidra Solvatate (Idrate) Es. tolbutamide, novobiocina, prednisolone * 21
22 Polimorfi Stessa entità chimica Differenze nell energia libera (DG) dei cristalli di un polimorfo portano a differenti caratteristiche fisiche. Il polimorfo più stabile è quello con impaccamento di struttura maggiore, quindi più densa e con minor energia libera alla quale corrisponde una solubilità minore Polimorfi solidi metastabili che tendono a trasformarsi nella forma più stabile possiedono maggiore attività termodinamica e quindi meno densa e più solubile (Barbiturici e steroidi) La conversione a stato stabile, può essere sufficientemente lenta da poter utilizzare la forma metastabile con diverse proprietà chimiche e fisiche e si sceglierà quella più adatta a seconda delle esigenze farmaceutiche. (CAF palmitato, clorpropamide, clortalidone, cimetidina) 22
23 La Riboflavina possiede 3 polimorfi con solubilità che va da 0,06 a 1,2 mg/ml. 23
24 24
25 Anidre/ Solvatate (Idrate) Stessa entità chimica Durante la cristallizzazione, le molecole di solvente possono combinarsi alla materia prima, dando luogo a composti, più o meno stabili, detti solvatati, e se il solvente è l acqua, idrati. La presenza di molecole d acqua nella struttura, riduce la tendenza ad acquisire altra acqua cosi le forme idrate dissolvono generalmente (ampicillina, teofillina, caffeina) +lentamente (Eccezione:acetato di fluorocortisone forma solvatata + solubile di quella anidra) 25
26 MODIFICHE DI TIPO CHIMICO Nuova entità chimica Formazione di Pro-Drug Formazione di esteri: generalmente tale modifica determina un rallentamento della dissoluzione. evitare la degradazione a livello dello stomaco. ritardare o prolungare l azione di certi p.a mascherare odori o sapori sgradevole 26
27 Formazione di sali Nuova entità chimica il processo di salificazione riveste una notevole importanza per i p.a. capaci di trovarsi nella forma ionica e non ionica (acidi e basi deboli) Gli acidi e basi deboli vengono ionizzati lungo il tratto gastrointestinale e la loro solubilità si modifica lungo tale tragitto, in funzione dell aumento di ph, passando dallo stomaco all intestino. Stomaco ph 1-3 (più solubili le basi deboli) Intestino ph 5-7 (più solubili gli acidi deboli) 27
28 Sale di un acido debole più solubile nello stomaco Nuova entità chimica A - A - A - A - A - A - A - AH AH M e m b r a n a g a s t r i c a Data l elevata superficie specifica il farmaco passa di nuovo in soluzione nella forma più adatta per essere assorbito Il sale solublizzandosi forma una soluzione tampone a ph 5-6 che facilita ulteriormente la dissoluzione dell acido debole Superata la zona di micro-ph favorevole, la forma ionica incontra il ph acido del fluido dello stomaco e riprecipita in forma non ionica micronizzata (elevata superficie specifica) Modificazioni di ph possono essere idotte con la formulazione con l impiego di tamponi a base di sali di fosfati, citrati, carbonati di calcio e magnesio per aumentare la dissoluzione di formulazioni solide orali a base ad esempio di naproxene o acido acetil salicilico sia a ph 7 che a ph 2 28
29 Tipologia degli Eccipienti Modifiche formulative SOSPENDENTI LUBRIFICANTI Sfavoriscono la dissoluzione BAGNANTI SOSTANZE TAMPONANTI Favoriscono la dissoluzione 29
30 Modifiche formulative Complessazione e inclusione Gli eccipienti di una formulazione possono interagire direttamente col farmaco per dare un complesso solubile o insolubile nell acqua. La formazione avviene attraverso interazioni tipo legame idrogeno. 30
31 Modifiche del ph micro-ambientale Aggiunta di sistemi tampone alla formulazione: fosfati, citrati, carbonati di calcio e magnesio Impiego di cosolventi Possibile sciogliere il Farmaco in appropriati solventi (meglio se quelli utilizzati anche per via parenterale) e disperderli su adsorbenti e comprimerli Basse dosi Buona solubilità nel solvente Buon adsorbimento sul substrato Buona stabilità Buon comportamento tecnologico 31
DISSOLUZIONE. Velocità di dissoluzione di un farmaco è un importante parametro preformulativo
 DISSOLUZIONE Velocità di dissoluzione di un farmaco è un importante parametro preformulativo Se C< 0,15C s dm dt = ka(c s -C) condizioni sink dm dt o =kac s Figura 2.6 Profili di concentrazione relativi
DISSOLUZIONE Velocità di dissoluzione di un farmaco è un importante parametro preformulativo Se C< 0,15C s dm dt = ka(c s -C) condizioni sink dm dt o =kac s Figura 2.6 Profili di concentrazione relativi
Esercitazioni di Elementi di Chimica. Modulo 3 Trasformazioni della Materia
 Esercitazioni di Elementi di Chimica Modulo 3 Trasformazioni della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Quale/i dei seguenti
Esercitazioni di Elementi di Chimica Modulo 3 Trasformazioni della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Quale/i dei seguenti
FARMACOCINETICA 1. Farmacologia generale FARMACOCINETICA FARMACOLOGIA FARMACODINAMICA
 FARMACOCINETICA 1 Farmacologia generale FARMACOCINETICA FARMACOLOGIA FARMACODINAMICA 1 ASSORBIMENTO DEI FARMACI cioè il processo per mezzo del quale un farmaco passa dal sito di somministrazione al plasma
FARMACOCINETICA 1 Farmacologia generale FARMACOCINETICA FARMACOLOGIA FARMACODINAMICA 1 ASSORBIMENTO DEI FARMACI cioè il processo per mezzo del quale un farmaco passa dal sito di somministrazione al plasma
Farmacocinetica. Lo studio di questi quattro processi viene definito come FARMACOCINETICA del farmaco
 Farmacocinetica Affinché un farmaco possa raggiungere il sito d azione ad una concentrazione sufficiente per esercitare il proprio effetto terapeutico specifico deve generalmente essere: assorbito dal
Farmacocinetica Affinché un farmaco possa raggiungere il sito d azione ad una concentrazione sufficiente per esercitare il proprio effetto terapeutico specifico deve generalmente essere: assorbito dal
Fondamenti di Chimica Farmaceutica. Farmacocinetica
 Fondamenti di Chimica Farmaceutica Farmacocinetica Farmacocinetica Il farmaco somministrato arriva al sito di azione (farmacocinetica) quindi interagisce con il bersaglio e determina l azione farmacologica
Fondamenti di Chimica Farmaceutica Farmacocinetica Farmacocinetica Il farmaco somministrato arriva al sito di azione (farmacocinetica) quindi interagisce con il bersaglio e determina l azione farmacologica
Teorie per il calcolo dei coefficienti di trasporto di materia (interfaccia fluido-fluido) Fenomeni di Trasporto
 Teorie per il calcolo dei coefficienti di trasporto di materia (interfaccia fluido-fluido) Fenomeni di Trasporto 1 Teoria del film (Lewis, 1924) Si assume che il trasporto di materia avvenga in uno strato
Teorie per il calcolo dei coefficienti di trasporto di materia (interfaccia fluido-fluido) Fenomeni di Trasporto 1 Teoria del film (Lewis, 1924) Si assume che il trasporto di materia avvenga in uno strato
Studio del meccanismo di idratazione e disidratazione dell ibuprofene sodico
 Università degli Studi di Camerino Scuola in Scienze del farmaco e dei Prodotti della Salute Facoltà di Farmacia Corso di Laurea in Chimica e Tecnologia Farmaceutiche Studio del meccanismo di idratazione
Università degli Studi di Camerino Scuola in Scienze del farmaco e dei Prodotti della Salute Facoltà di Farmacia Corso di Laurea in Chimica e Tecnologia Farmaceutiche Studio del meccanismo di idratazione
La via di somministrazione Orale
 La via di somministrazione Orale Francesco Lai Tecnologia Farmaceutica Applicata Dipartimento di Scienze della Vita e dell Ambiente Università degli Studi di Cagliari Fasi Principali vie di somministrazione
La via di somministrazione Orale Francesco Lai Tecnologia Farmaceutica Applicata Dipartimento di Scienze della Vita e dell Ambiente Università degli Studi di Cagliari Fasi Principali vie di somministrazione
VIA ORALE MODULO DI TECNICHE E FORME FARMACEUTICHE CORSO DI LAUREA IN BIOTECNOLOGIE ANNO ACCADEMICO 2004-2005
 VIA ORALE MODULO DI TECNICHE E FORME FARMACEUTICHE CORSO DI LAUREA IN BIOTECNOLOGIE ANNO ACCADEMICO 2004-2005 2005 VANTAGGI DELLA VIA ORALE! Le forme farmaceutiche orali sono facili e convenienti da usare
VIA ORALE MODULO DI TECNICHE E FORME FARMACEUTICHE CORSO DI LAUREA IN BIOTECNOLOGIE ANNO ACCADEMICO 2004-2005 2005 VANTAGGI DELLA VIA ORALE! Le forme farmaceutiche orali sono facili e convenienti da usare
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
SOLUZIONI E CONCENTRAZIONE
 SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
PROCESSI CHE INFLUENZANO L ASSORBIMENTO DEL PRINCIPIO ATTIVO 2 PARTE
 Tecnologia Socioeconomia Legislazione Farmaceutica 1 con laboratorio - CdLM CTF 12 cfu 1 semestre PROCESSI CHE INFLUENZANO L ASSORBIMENTO DEL PRINCIPIO ATTIVO 2 PARTE Docente: Prof.ssa Anna Maria Maccioni
Tecnologia Socioeconomia Legislazione Farmaceutica 1 con laboratorio - CdLM CTF 12 cfu 1 semestre PROCESSI CHE INFLUENZANO L ASSORBIMENTO DEL PRINCIPIO ATTIVO 2 PARTE Docente: Prof.ssa Anna Maria Maccioni
Topiche (locali) Sistemiche
 Assorbimento 1. I farmaci sono in genere molecole piccole e diffondono attraverso le membrane in stato non carico; 2. Molti Farmaci sono acidi o basi deboli oppure anfoteri, quindi il ph del liquido o
Assorbimento 1. I farmaci sono in genere molecole piccole e diffondono attraverso le membrane in stato non carico; 2. Molti Farmaci sono acidi o basi deboli oppure anfoteri, quindi il ph del liquido o
PROGETTAZIONE E SVILUPPO DEI MEDICINALI
 Tecnologia Socioeconomia Legislazione Farmaceutica 1 con laboratorio - CdLM CTF 12 cfu 1 semestre PROGETTAZIONE E SVILUPPO DEI MEDICINALI Docente: Prof.ssa Anna Maria Maccioni 1 MEDICAMENTO FARMACO RISOLUZIONE
Tecnologia Socioeconomia Legislazione Farmaceutica 1 con laboratorio - CdLM CTF 12 cfu 1 semestre PROGETTAZIONE E SVILUPPO DEI MEDICINALI Docente: Prof.ssa Anna Maria Maccioni 1 MEDICAMENTO FARMACO RISOLUZIONE
1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno 5. Legami a confronto
 Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
I legami fra molecole nei liquidi non sono forti ed esse possono fluire Riducendo l agitazione termica. legami tra molecole più stabili
 I legami fra molecole nei liquidi non sono forti ed esse possono fluire Riducendo l agitazione termica legami tra molecole più stabili formazione una massa rigida Una disposizione ordinata delle molecole
I legami fra molecole nei liquidi non sono forti ed esse possono fluire Riducendo l agitazione termica legami tra molecole più stabili formazione una massa rigida Una disposizione ordinata delle molecole
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia
 Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Lezione 11 Soluzioni. Diffusione ed osmosi.
 Lezione 11 Soluzioni. Diffusione ed osmosi. Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici
Lezione 11 Soluzioni. Diffusione ed osmosi. Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici
L ACQUA. E il mezzo in cui avvengono le maggiori reazioni. Tutte le molecole biologiche assumono forma e
 L ACQUA E il mezzo in cui avvengono le maggiori reazioni biochimiche Tutte le molecole biologiche assumono forma e funzione in base alle proprietà chimiche e fisiche delle molecole di H 2 O che le circondano
L ACQUA E il mezzo in cui avvengono le maggiori reazioni biochimiche Tutte le molecole biologiche assumono forma e funzione in base alle proprietà chimiche e fisiche delle molecole di H 2 O che le circondano
Il potenziale di membrana a riposo
 Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti su entambe le facce della membrana; la membrana stessa;
Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti su entambe le facce della membrana; la membrana stessa;
EQUILIBRI DI SOLUBILITA
 EQUILIBRI DI SOLUBILITA Solubilità In generale solo una quantità finita di un solido si scioglie in un dato volume di solvente dando luogo ad una soluzione satura, cioè una soluzione in equilibrio con
EQUILIBRI DI SOLUBILITA Solubilità In generale solo una quantità finita di un solido si scioglie in un dato volume di solvente dando luogo ad una soluzione satura, cioè una soluzione in equilibrio con
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
Lo stato liquido. Un liquido non ha una forma propria, ma ha la forma del recipiente che lo contiene; ha però volume proprio e non è comprimibile.
 I liquidi Lo stato liquido Lo stato liquido rappresenta una condizione intermedia tra stato aeriforme e stato solido, tra lo stato di massimo disordine e quello di perfetto ordine Un liquido non ha una
I liquidi Lo stato liquido Lo stato liquido rappresenta una condizione intermedia tra stato aeriforme e stato solido, tra lo stato di massimo disordine e quello di perfetto ordine Un liquido non ha una
L equilibrio dell acqua
 L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di
 La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di un solido (polvere) che diverrà il ceramico, con un
La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di un solido (polvere) che diverrà il ceramico, con un
FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA
 FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti
FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti
Appunti: Cristallizzazione Padova, 14/02/09. Cristallizzazione. Appunti di lezione. Introduzione 2
 ristallizzazione Appunti di lezione Indice Introduzione 2 Modi di portare una soluzione in condizioni di cristallizzabilità 2 Scelta del metodo per portare a cristallizzabilità una soluzione 4 Solubilità:
ristallizzazione Appunti di lezione Indice Introduzione 2 Modi di portare una soluzione in condizioni di cristallizzabilità 2 Scelta del metodo per portare a cristallizzabilità una soluzione 4 Solubilità:
Entropia e secondo principio della termodinamica: prevedere la spontaneità di un processo
 1 Entropia e secondo principio della termodinamica: prevedere la spontaneità di un processo Limitazioni della prima legge della termodinamica 2 E = q + w E universo = E sistema + E ambiente E sistema =
1 Entropia e secondo principio della termodinamica: prevedere la spontaneità di un processo Limitazioni della prima legge della termodinamica 2 E = q + w E universo = E sistema + E ambiente E sistema =
Saggi preliminari. Esame organolettico Combustione Saggi di solubilità Comportamento chimico
 Saggi preliminari Esame organolettico Combustione Saggi di solubilità Comportamento chimico Esame organolettico Stato fisico: legato alle caratteristiche chimico fisiche del composto (solido, liquido o
Saggi preliminari Esame organolettico Combustione Saggi di solubilità Comportamento chimico Esame organolettico Stato fisico: legato alle caratteristiche chimico fisiche del composto (solido, liquido o
Diffusione e osmosi. Roberto Cirio. Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico Corso di Fisica
 Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
Chimica e laboratorio
 ITIS H.HERTZ Progetto Monoennio Chimica e laboratorio PARTE PRIMA I MODULO: Struttura atomica e molecolare della materia PESO : 70% UNITA ORARIE PREVISTE : 20 h Unità A: ATOMI Descrivere le caratteristiche
ITIS H.HERTZ Progetto Monoennio Chimica e laboratorio PARTE PRIMA I MODULO: Struttura atomica e molecolare della materia PESO : 70% UNITA ORARIE PREVISTE : 20 h Unità A: ATOMI Descrivere le caratteristiche
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro.
 Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
Assorbimento Cinetiche di assorbimento Biodisponibilità Volume di distribuzione Emivita L. 3
 Assorbimento Cinetiche di assorbimento Biodisponibilità Volume di distribuzione Emivita L. 3 Prof. Aldo Pinto ASSORBIMENTO Insieme di processi attivi e passivi che consente il passaggio di un farmaco dal
Assorbimento Cinetiche di assorbimento Biodisponibilità Volume di distribuzione Emivita L. 3 Prof. Aldo Pinto ASSORBIMENTO Insieme di processi attivi e passivi che consente il passaggio di un farmaco dal
PROGRAMMA DISCIPLINARE SVOLTO a. s / N.B. il programma è pubblico ad uso degli studenti e delle famiglie.
 Pagina 1 di 5 PROGRAMMA DISCIPLINARE SVOLTO a. s. 2015 / 2016 DOCENTE: Ghezzi Maria Grazia CLASSE: 2^ ID DISCIPLINA: S.I.CHIMICA MACROARGOMENTI che sono stati trattate nel corso del corrente anno scolastico
Pagina 1 di 5 PROGRAMMA DISCIPLINARE SVOLTO a. s. 2015 / 2016 DOCENTE: Ghezzi Maria Grazia CLASSE: 2^ ID DISCIPLINA: S.I.CHIMICA MACROARGOMENTI che sono stati trattate nel corso del corrente anno scolastico
Chimica 047SM. Informazioni sul corso. (6 CFU) Docente : Jan Kašpar Dip. Scienze Chimiche a Farmaceutiche tel.
 Chimica 047SM Informazioni sul corso Chimica (6 CFU) Docente : Jan Kašpar Dip. Scienze Chimiche a Farmaceutiche e-mail: kaspar@units.it tel. 040 5583960 Ed. C11 V piano - stanza 504 home page corso: http://www.dscf.units.it/kaspar
Chimica 047SM Informazioni sul corso Chimica (6 CFU) Docente : Jan Kašpar Dip. Scienze Chimiche a Farmaceutiche e-mail: kaspar@units.it tel. 040 5583960 Ed. C11 V piano - stanza 504 home page corso: http://www.dscf.units.it/kaspar
SCHEDA PROGRAMMAZIONE UNITÀ FORMATIVE DISCIPLINARI
 SCHEDA PROGRAMMAZIONE UNITÀ FORMATIVE DISCIPLINARI UNITÀ FORMATIVA N 1 - CLASSE 2 A Professionale TITOLO: Le formule dei composti e le reazioni chimiche Periodo/Durata: settembre-ottobre/ 12 ore Saper
SCHEDA PROGRAMMAZIONE UNITÀ FORMATIVE DISCIPLINARI UNITÀ FORMATIVA N 1 - CLASSE 2 A Professionale TITOLO: Le formule dei composti e le reazioni chimiche Periodo/Durata: settembre-ottobre/ 12 ore Saper
Elementi sistemati nella TAVOLA PERIODICA DEGLI ELEMENTI in base al numero atomico crescente O, H, N, C (+ del 96% della materia vivente)
 OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
ELIMINAZIONE DEI FARMACI. L eliminazione di un farmaco avviene per escrezione e/o per biotrasformazione.
 ELIMINAZIONE DEI FARMACI L eliminazione di un farmaco avviene per escrezione e/o per biotrasformazione. Possono essere escreti: il farmaco immodificato i suoi metaboliti Le principali vie di escrezione
ELIMINAZIONE DEI FARMACI L eliminazione di un farmaco avviene per escrezione e/o per biotrasformazione. Possono essere escreti: il farmaco immodificato i suoi metaboliti Le principali vie di escrezione
 Il processo di cura - tecniche di studio Calorimetria a scansione differenziale (DSC) La calorimetria differenziale a scansione è la principale tecnica di analisi termica utilizzabile per caratterizzare
Il processo di cura - tecniche di studio Calorimetria a scansione differenziale (DSC) La calorimetria differenziale a scansione è la principale tecnica di analisi termica utilizzabile per caratterizzare
Termodinamica e termochimica
 Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Gli equilibri di solubilità
 Gli equilibri di solubilità Abbiamo definito la solubilità come la concentrazione della soluzione satura, che è una soluzione il cui il composto in soluzione è in equilibrio con il composto indisciolto.
Gli equilibri di solubilità Abbiamo definito la solubilità come la concentrazione della soluzione satura, che è una soluzione il cui il composto in soluzione è in equilibrio con il composto indisciolto.
Trasferimento di ossigeno nei bioreattori. In particolare avremo:
 Trasferimento di ossigeno nei bioreattori In particolare avremo: 1. resistenza di trasferimento nella fase gassosa. Questo è generalmente trascurabile dato che la velocità del trasferimento del gas in
Trasferimento di ossigeno nei bioreattori In particolare avremo: 1. resistenza di trasferimento nella fase gassosa. Questo è generalmente trascurabile dato che la velocità del trasferimento del gas in
PRIMI ELEMENTI DI TERMODINAMICA. La termodinamica studia le leggi con cui i sistemi scambiano (cedono e ricevono) energia con l ambiente.
 PRIMI ELEMENTI DI TERMODINAMICA Un sistema è un insieme di corpi che possiamo immaginare avvolti da una superficie chiusa, ma permeabile alla materia e all energia. L ambiente è tutto ciò che si trova
PRIMI ELEMENTI DI TERMODINAMICA Un sistema è un insieme di corpi che possiamo immaginare avvolti da una superficie chiusa, ma permeabile alla materia e all energia. L ambiente è tutto ciò che si trova
FARMACODINAMICA. La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci.
 FARMACODINAMICA La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci. La farmacodinamica si propone di: * identificare i siti d azione dei farmaci * delineare le interazioni
FARMACODINAMICA La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci. La farmacodinamica si propone di: * identificare i siti d azione dei farmaci * delineare le interazioni
Studio e sviluppo di un integratore: formulazione, analisi e stabilità. ACADEMY NUTRACEUTICA ottobre 2016
 . Studio e sviluppo di un integratore: formulazione, analisi e stabilità ACADEMY NUTRACEUTICA 21-22 ottobre 2016 Qual è il percorso che porta alla produzione dell INTEGRATORE? Materie prime Titolo, tipologia
. Studio e sviluppo di un integratore: formulazione, analisi e stabilità ACADEMY NUTRACEUTICA 21-22 ottobre 2016 Qual è il percorso che porta alla produzione dell INTEGRATORE? Materie prime Titolo, tipologia
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 19 L energia si trasferisce 3 Sommario (I) 1. L «ABC» dei trasferimenti energetici 2. Durante le reazioni varia l energia chimica
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 19 L energia si trasferisce 3 Sommario (I) 1. L «ABC» dei trasferimenti energetici 2. Durante le reazioni varia l energia chimica
Transizioni liquido-solido: Aspetti cinetici
 Transizioni liquido-solido: Aspetti cinetici Prof.G.Marletta Chimica Fisica dei Materiali II e Laboratorio Laurea Magistrale in Chimica dei Materiali Università di Catania A.A. 2011/2012 1- Caratteri generali
Transizioni liquido-solido: Aspetti cinetici Prof.G.Marletta Chimica Fisica dei Materiali II e Laboratorio Laurea Magistrale in Chimica dei Materiali Università di Catania A.A. 2011/2012 1- Caratteri generali
Soluzioni unità 3, modulo D del libro
 Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Siena, 10 Giugno 2015 Sandra Defazio Serena Fedi
 CLASSE I A Costruzione Ambiente e Territorio omogenei ed eterogenei e curva di riscaldamento di un miscuglio. nobili. Distinzione fra molecole e atomi. Principio di conservazione della massa. Teoria atomica
CLASSE I A Costruzione Ambiente e Territorio omogenei ed eterogenei e curva di riscaldamento di un miscuglio. nobili. Distinzione fra molecole e atomi. Principio di conservazione della massa. Teoria atomica
Prodotto di solubilità (Kps)
 Prodotto di solubilità (Kps) SOLUBILITA Concentrazione massima che si può raggiungere per un soluto in un dato solvente ad una certa temperatura. (Es: g soluto/100g di solvente) Solubiltà di NaCl in acqua
Prodotto di solubilità (Kps) SOLUBILITA Concentrazione massima che si può raggiungere per un soluto in un dato solvente ad una certa temperatura. (Es: g soluto/100g di solvente) Solubiltà di NaCl in acqua
CdL Professioni Sanitarie A.A. 2012/2013. Unità 9: Gas e processi di diffusione
 L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
Chimica SM 032. Informazioni sul corso
 Chimica SM 032 Informazioni sul corso Chimica (6 CFU) Docente : Jan Kašpar e-mail: kaspar@units.it tel. 040 5583960 Ed. C11 V piano - stanza 504 home page corso: www.dsch.units.it e seguire link phone
Chimica SM 032 Informazioni sul corso Chimica (6 CFU) Docente : Jan Kašpar e-mail: kaspar@units.it tel. 040 5583960 Ed. C11 V piano - stanza 504 home page corso: www.dsch.units.it e seguire link phone
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa
 Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Movimenti dell acqua e dei soluti nella cellula vegetale
 Movimenti dell acqua e dei soluti nella cellula vegetale L acqua si sposta in funzione dell energia potenziale in essa contenuta o Potenziale idrico Si sposta da una regione dove il potenziale idrico è
Movimenti dell acqua e dei soluti nella cellula vegetale L acqua si sposta in funzione dell energia potenziale in essa contenuta o Potenziale idrico Si sposta da una regione dove il potenziale idrico è
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
Stati della materia. Esempio. Fusione e solidificazione. Esempio. Stati di aggregazione della materia
 Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
CRISTALLIZZAZIONE. Scelta del solvente: Affinché la cristallizzazione possa essere efficace, è necessario scegliere il solvente più
 CRISTALLIZZAZIONE La cristallizzazione è stata a lungo utilizzata nella purificazione delle sostanze. Si tratta essenzialmente di una tecnica di separazione solido-liquido molto importante per ricavare
CRISTALLIZZAZIONE La cristallizzazione è stata a lungo utilizzata nella purificazione delle sostanze. Si tratta essenzialmente di una tecnica di separazione solido-liquido molto importante per ricavare
GLI STATI DI AGGREGAZIONE DELLA MATERIA DIAGRAMMI DI STATO DI COMPONENTI PURI
 GLI STATI DI AGGREGAZIONE DELLA MATERIA DIAGRAMMI DI STATO DI COMPONENTI PURI Forti interazioni intermolecolari SOLIDI Assenza di libero movimento delle molecole Volume e forma propria Rigidi e incomprimibili
GLI STATI DI AGGREGAZIONE DELLA MATERIA DIAGRAMMI DI STATO DI COMPONENTI PURI Forti interazioni intermolecolari SOLIDI Assenza di libero movimento delle molecole Volume e forma propria Rigidi e incomprimibili
Le trasformazioni chimiche e fisiche della materia. Lezioni d'autore di Giorgio Benedetti
 Le trasformazioni chimiche e fisiche della materia Lezioni d'autore di Giorgio Benedetti INTRODUZIONE (I) VIDEO INTRODUZIONE (II) La comprensione delle proprietà delle sostanze e le trasformazioni che
Le trasformazioni chimiche e fisiche della materia Lezioni d'autore di Giorgio Benedetti INTRODUZIONE (I) VIDEO INTRODUZIONE (II) La comprensione delle proprietà delle sostanze e le trasformazioni che
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 22 Acidi e basi si scambiano protoni 3 Sommario 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. La forza
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 22 Acidi e basi si scambiano protoni 3 Sommario 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. La forza
SOLUZIONI. Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto).
 SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
Organizzazione della materia
 Organizzazione della materia Elementi: sostanze che non possono essere scisse in altre più semplici mediante reazioni chimiche ordinarie. Atomo: è la porzione più piccola di un elemento, formato da 3 particelle
Organizzazione della materia Elementi: sostanze che non possono essere scisse in altre più semplici mediante reazioni chimiche ordinarie. Atomo: è la porzione più piccola di un elemento, formato da 3 particelle
Mantenere un giusto grado di alcalinità (ph 7,30 7,60).
 Funzioni Umettare e lubrificare le superfici cartilaginee a contatto Fra loro si interpone una pellicola ad alta viscosità che elimina ogni fenomeno di attrito, specie all inizio del movimento e rende
Funzioni Umettare e lubrificare le superfici cartilaginee a contatto Fra loro si interpone una pellicola ad alta viscosità che elimina ogni fenomeno di attrito, specie all inizio del movimento e rende
Amministrazione, finanza e marketing - Turismo Ministero dell Istruzione, dell Università e della Ricerca PROGRAMMAZIONE DISCIPLINARE PER U. di A.
 MATERIA CHIMICA CLASSE 2 INDIRIZZO AFM / TUR DESCRIZIONE Unità di Apprendimento UdA n. 1 Titolo: LA MATERIA Aver acquisito la capacità di osservare, descrivere ed analizzare i fenomeni legati alle trasformazioni
MATERIA CHIMICA CLASSE 2 INDIRIZZO AFM / TUR DESCRIZIONE Unità di Apprendimento UdA n. 1 Titolo: LA MATERIA Aver acquisito la capacità di osservare, descrivere ed analizzare i fenomeni legati alle trasformazioni
Tecnologia Meccanica Proff. Luigi Carrino Antonio Formisano Solidificazione
 Solidificazione FONDERIA Nella tecnica di fonderia il metallo, fuso nei forni, viene colato in una forma cava della quale, solidificando, assume la configurazione e le dimensioni FONDERIA Stampo per fonderia
Solidificazione FONDERIA Nella tecnica di fonderia il metallo, fuso nei forni, viene colato in una forma cava della quale, solidificando, assume la configurazione e le dimensioni FONDERIA Stampo per fonderia
Stati della materia. Stati della materia
 Stati della materia La materia può esistere in 3 diversi STATI DI AGGREGAZIONE: SOLIDO LIQUIDO GASSOSO MACROSCOPICHE MICROSCOPICHE Stati della materia Lo stato di aggregazione di una sostanza dipende dal
Stati della materia La materia può esistere in 3 diversi STATI DI AGGREGAZIONE: SOLIDO LIQUIDO GASSOSO MACROSCOPICHE MICROSCOPICHE Stati della materia Lo stato di aggregazione di una sostanza dipende dal
1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di
 Unità 19 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di soluzioni acide e
Unità 19 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di soluzioni acide e
MINISTERO DELLA PUBBLICA ISTRUZIONE DIREZIONE GENERALE ISTRUZIONE TECNICA
 MINISTERO DELLA PUBBLICA ISTRUZIONE DIREZIONE GENERALE ISTRUZIONE TECNICA ISTITUTO TECNICO COMMERCIALE LORGNA-PINDEMONTE VERONA INDIRIZZO AMMINISTRAZIONE, FINANZA E MARKETING/TURISMO PROGRAMMA ANALITICO
MINISTERO DELLA PUBBLICA ISTRUZIONE DIREZIONE GENERALE ISTRUZIONE TECNICA ISTITUTO TECNICO COMMERCIALE LORGNA-PINDEMONTE VERONA INDIRIZZO AMMINISTRAZIONE, FINANZA E MARKETING/TURISMO PROGRAMMA ANALITICO
La mobilità degli elementi chimici
 La mobilità degli elementi chimici Gli ioni contenuti nella parte sinistra del diagramma sono quelli che in soluzione si presentano sotto forma di cationi semplici. Gli ioni nella parte centrale del diagramma
La mobilità degli elementi chimici Gli ioni contenuti nella parte sinistra del diagramma sono quelli che in soluzione si presentano sotto forma di cationi semplici. Gli ioni nella parte centrale del diagramma
TREELIUM SA VIA LAVEGGIO STABIO-SWITZERLAND TEL:
 T-Sonik OM è un armonizzatore d acqua che funziona secondo il principio dell attivazione idrodinamica in grado di ridurre drasticamente il deposito di calcare ed abbattere la presenza del cloro libero
T-Sonik OM è un armonizzatore d acqua che funziona secondo il principio dell attivazione idrodinamica in grado di ridurre drasticamente il deposito di calcare ed abbattere la presenza del cloro libero
Le proprietà colligative delle soluzioni
 1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
SOLUZIONI e DILUIZIONI
 SOLUZIONI e DILUIZIONI Introduzione In chimica viene definita soluzione un sistema in cui due o più sostanze formano un miscuglio omogeneo. Nella maggior parte dei casi una soluzione è costituita da due
SOLUZIONI e DILUIZIONI Introduzione In chimica viene definita soluzione un sistema in cui due o più sostanze formano un miscuglio omogeneo. Nella maggior parte dei casi una soluzione è costituita da due
5. Trasporto di membrana
 5. Trasporto di membrana contiene materiale protetto da copyright, ad esclusivo uso personale; 1 non è consentita diffusione ed utilizzo di tipo commerciale Le membrane biologiche hanno una permeabilità
5. Trasporto di membrana contiene materiale protetto da copyright, ad esclusivo uso personale; 1 non è consentita diffusione ed utilizzo di tipo commerciale Le membrane biologiche hanno una permeabilità
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
EQUILIBRIO CHIMICO REAZIONI A TERMINE REAZIONI DI EQUILIBRIO 04/11/2015. Reazione: A B
 REAZIONI A TERMINE Reazione: A B REAZIONI DI EQUILIBRIO EQUILIBRIO CHIMICO L'equilibrio chimico è la condizione dipendente dalla temperatura in cui le concentrazioni delle specie chimiche che partecipano
REAZIONI A TERMINE Reazione: A B REAZIONI DI EQUILIBRIO EQUILIBRIO CHIMICO L'equilibrio chimico è la condizione dipendente dalla temperatura in cui le concentrazioni delle specie chimiche che partecipano
CRISTALLIZZAZIONE. ITIS Marconi Forlì 4 CH Prof Roberto Riguzzi
 CRISTALLIZZAZIONE ITIS Marconi Forlì 4 CH Prof Roberto Riguzzi DEFINIZIONE La cristallizzazione è quel processo di separazione fisico di separazione dei componenti di un miscuglio, in cui si separa il
CRISTALLIZZAZIONE ITIS Marconi Forlì 4 CH Prof Roberto Riguzzi DEFINIZIONE La cristallizzazione è quel processo di separazione fisico di separazione dei componenti di un miscuglio, in cui si separa il
POTENZA METABOLICA. Fisica Applicata, Area Infermieristica, M. Ruspa
 POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici
 La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
CORSO DI CHIMICA PER L AMBIENTE. Lezione del 12 Aprile 2016
 CORSO DI CHIMICA PER L AMBIENTE Lezione del 12 Aprile 2016 Proprietà dei Metalli Malleabilità: i metalli possono esser facilmente ridotti in lamine sottili per battitura Duttilità: i metalli possono essere
CORSO DI CHIMICA PER L AMBIENTE Lezione del 12 Aprile 2016 Proprietà dei Metalli Malleabilità: i metalli possono esser facilmente ridotti in lamine sottili per battitura Duttilità: i metalli possono essere
Densita. FLUIDI : liquidi o gas. macroscop.:
 6-SBAC Fisica 1/10 FLUIDI : liquidi o gas macroscop.: microscop.: sostanza che prende la forma del contenitore che la occupa insieme di molecole tenute insieme da deboli forze di coesione (primi vicini)
6-SBAC Fisica 1/10 FLUIDI : liquidi o gas macroscop.: microscop.: sostanza che prende la forma del contenitore che la occupa insieme di molecole tenute insieme da deboli forze di coesione (primi vicini)
Scambi gassosi e regolazione del respiro
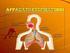 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ruolo del Sistema Respiratorio: - fornire O 2 - rimuovere CO 2 Scaricato da www.sunhope.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ruolo del Sistema Respiratorio: - fornire O 2 - rimuovere CO 2 Scaricato da www.sunhope.it
ATTIVITA FORMULATIVA
 FORME di DOSAGGIO SOLIDE ORALI ATTIVITA FORMULATIVA Performance biofarmaceutica Stabilità Caratteristiche tecnologiche QUALITA FORME di DOSAGGIO SOLIDE ORALI ATTIVITA FORMULATIVA Primi Obiettivi scorrevolezza
FORME di DOSAGGIO SOLIDE ORALI ATTIVITA FORMULATIVA Performance biofarmaceutica Stabilità Caratteristiche tecnologiche QUALITA FORME di DOSAGGIO SOLIDE ORALI ATTIVITA FORMULATIVA Primi Obiettivi scorrevolezza
Cenni di Farmacocinetica, Biofarmaceutica, Biodisponibilità
 Cenni di Farmacocinetica, Biofarmaceutica, Biodisponibilità Rappresentazione schematica di assorbimento, distribuzione ed eliminazione del principio attivo Aulton M. E., Taylor K. M.G., Tecnologie Farmaceutiche.
Cenni di Farmacocinetica, Biofarmaceutica, Biodisponibilità Rappresentazione schematica di assorbimento, distribuzione ed eliminazione del principio attivo Aulton M. E., Taylor K. M.G., Tecnologie Farmaceutiche.
Protocollo dei saperi imprescindibili
 Protocollo dei saperi imprescindibili Ordine di scuola: LICEO ARTISTICO DISCIPLINA: CHIMICA DEI MATERIALI RESPONSABILE: MERI TETI CLASSE III / INDIRIZZO: Competenze: correla le grandezze fondamentali e
Protocollo dei saperi imprescindibili Ordine di scuola: LICEO ARTISTICO DISCIPLINA: CHIMICA DEI MATERIALI RESPONSABILE: MERI TETI CLASSE III / INDIRIZZO: Competenze: correla le grandezze fondamentali e
U.D. CHIMICA classe 2 a TECN. (CAT) CHIMICA TECNOLOGICO (CAT) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO
 CHIMICA Classe 2 a TECNOLOGICO (CAT) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO U.D. Periodo Ore lezione 1. Nomenclatura molecole inorganiche (ripasso) settembre 6 2. Struttura atomica e tavola periodica
CHIMICA Classe 2 a TECNOLOGICO (CAT) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO U.D. Periodo Ore lezione 1. Nomenclatura molecole inorganiche (ripasso) settembre 6 2. Struttura atomica e tavola periodica
STATI DI AGGREGAZIONE DELLA MATERIA E PROPRIETÀ DEI FLUIDI
 STATI DI AGGREGAZIONE DELLA MATERIA E PROPRIETÀ DEI FLUIDI 14/01/2014 2 Una porzione di materia costituita da una sostanza la cui composizione chimica non varia da un punto all altro si dice costituita
STATI DI AGGREGAZIONE DELLA MATERIA E PROPRIETÀ DEI FLUIDI 14/01/2014 2 Una porzione di materia costituita da una sostanza la cui composizione chimica non varia da un punto all altro si dice costituita
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 17 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 17 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione
Programma di CHIMICA E LABORATORIO
 Istituto di Istruzione Secondaria Superiore Statale «IIS Via Silvestri 301» Plesso «ALESSANDRO VOLTA» Programma di CHIMICA E LABORATORIO Classe 1 a A Indirizzo ELETTRONICA ED ELETTROTECNICA Anno Scolastico
Istituto di Istruzione Secondaria Superiore Statale «IIS Via Silvestri 301» Plesso «ALESSANDRO VOLTA» Programma di CHIMICA E LABORATORIO Classe 1 a A Indirizzo ELETTRONICA ED ELETTROTECNICA Anno Scolastico
LEZIONE 4. Le soluzioni
 LEZIONE 4 Le soluzioni Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il componente delle
LEZIONE 4 Le soluzioni Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il componente delle
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
Corso di Laurea Magistrale in Chimica e Tecnologia Farmaceutiche
 Universita degli Studi di Milano Corso di Laurea Magistrale in Chimica e Tecnologia Farmaceutiche Tecnologia e Legislazione Farmaceutiche II - 9 CFU Biofarmaceutica - 3 Prof. Andrea Gazzaniga ASSORBIMENTO
Universita degli Studi di Milano Corso di Laurea Magistrale in Chimica e Tecnologia Farmaceutiche Tecnologia e Legislazione Farmaceutiche II - 9 CFU Biofarmaceutica - 3 Prof. Andrea Gazzaniga ASSORBIMENTO
CHIMICA (Corso Integrato) CHIMICA GENERALE ED INORGANICA Dott. Francesco Musiani (6 crediti -48 ore)
 CHIMICA (Corso Integrato) CHIMICA GENERALE ED INORGANICA Dott. Francesco Musiani (6 crediti -48 ore) Orario (prime tre settimane di Ottobre) Mercoledì 14-16 Giovedì 14-16 Venerdì 14-16 Chimica Generale
CHIMICA (Corso Integrato) CHIMICA GENERALE ED INORGANICA Dott. Francesco Musiani (6 crediti -48 ore) Orario (prime tre settimane di Ottobre) Mercoledì 14-16 Giovedì 14-16 Venerdì 14-16 Chimica Generale
struttura e composizione della membrana cellulare Prof. Davide Cervia - Fisiologia Fisiologia della cellula: trasporti di membrana
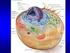 struttura e composizione della membrana cellulare 1 funzioni: separazione, regolazione, comunicazione, stabilizzazione modello a mosaico liquido 2 lipidi di membrana 3 4 Glicoproteine Glicolipidi Glicocalice
struttura e composizione della membrana cellulare 1 funzioni: separazione, regolazione, comunicazione, stabilizzazione modello a mosaico liquido 2 lipidi di membrana 3 4 Glicoproteine Glicolipidi Glicocalice
Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana
 Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana Le proteine diffondono nel piano della membrana per diffusione rotazionale e laterale Le membrane cellulari La componente
Le membrane cellulari La componente proteica: Diffusione delle proteine nella membrana Le proteine diffondono nel piano della membrana per diffusione rotazionale e laterale Le membrane cellulari La componente
Comportamento dei metalli alcalini in ammoniaca liquida (P.E. 33 C) i metalli alcalini sono molto solubili in ammoniaca liquida (130 g di Cs in 40
 Comportamento dei metalli alcalini in ammoniaca liquida (P.E. 33 C) i metalli alcalini sono molto solubili in ammoniaca liquida (130 g di Cs in 40 g di NH 3, ossia 2,34 molecole NH 3 / 1 atomo Cs), dando
Comportamento dei metalli alcalini in ammoniaca liquida (P.E. 33 C) i metalli alcalini sono molto solubili in ammoniaca liquida (130 g di Cs in 40 g di NH 3, ossia 2,34 molecole NH 3 / 1 atomo Cs), dando
Tecnologia Meccanica prof. Luigi Carrino. Solidificazione e
 Solidificazione e Difetti Cristallini nei Solidi FONDERIA Nella tecnica di fonderia il metallo, fuso nei forni, viene colato in una forma cava della quale, solidificando, assume la configurazione e le
Solidificazione e Difetti Cristallini nei Solidi FONDERIA Nella tecnica di fonderia il metallo, fuso nei forni, viene colato in una forma cava della quale, solidificando, assume la configurazione e le
LIPIDI. I lipidi (la parola deriva dal greco lìpos, grasso) sono un gruppo di sostanze grasse presente in tutti gli organismi viventi.
 LIPIDI I lipidi (la parola deriva dal greco lìpos, grasso) sono un gruppo di sostanze grasse presente in tutti gli organismi viventi. I lipidi sono composti idrofobi perché non sono solubili in acqua ma
LIPIDI I lipidi (la parola deriva dal greco lìpos, grasso) sono un gruppo di sostanze grasse presente in tutti gli organismi viventi. I lipidi sono composti idrofobi perché non sono solubili in acqua ma
