COVERSYL 2 mg Compresse Uso orale. COVERSYL 4 mg Compresse Uso orale
|
|
|
- Giovanni Pietro Innocenti
- 5 anni fa
- Visualizzazioni
Transcript
1 ALLEGATO I ELENCO DEI NOMI DEL MEDICINALE, DELLE FORME FARMACEUTICHE, DEI DOSAGGI, DELLA VIA DI SOMMINISTRAZIONE, DEI TITOLARI DELLE AUTORIZZAZIONI ALL IMMISSIONE IN COMMERCIO NEGLI STATI MEMBRI 1
2 Stato Membro Titolare dell autorizzazione all immissione in commercio Nome di fantasia Dosaggio Forma farmaceutica Via di somministrazione Austria Servier Austria GmbH COVERSUM 2 mg Compresse Uso orale Austria Servier Austria GmbH COVERSUM 4 mg Compresse Uso orale Belgio Servier Benelux S.A. COVERSYL 2 mg Compresse Uso orale Belgio Servier Benelux S.A. COVERSYL 4 mg Compresse Uso orale Danimarca Les Laboratoires Servier COVERSYL 2 mg Compresse Uso orale Danimarca Les Laboratoires Servier COVERSYL 4 mg Compresse Uso orale Finlandia Les Laboratoires Servier COVERSYL 2 mg Compresse Uso orale Finlandia Les Laboratoires Servier COVERSYL 4 mg Compresse Uso orale Francia Les Laboratoires Servier COVERSYL 2 mg Compresse Uso orale Francia Les Laboratoires Servier COVERSYL 4 mg Compresse Uso orale Germania Les Laboratoires Servier COVERSUM COR 2 mg Compresse Uso orale Germania Les Laboratoires Servier COVERSUM 4 mg Compresse Uso orale Grecia Grecia Servier Hellas Pharmaceuticals S.A. Servier Hellas Pharmaceuticals S.A. COVERSYL 2 mg Compresse Uso orale COVERSYL 4 mg Compresse Uso orale Islanda Les Laboratoires Servier COVERSYL 2 mg Compresse Uso orale 2
3 Stato Membro Titolare dell autorizzazione all immissione in commercio Nome di fantasia Dosaggio Forma farmaceutica Via di somministrazione Irlanda Les Laboratoires Servier COVERSYL 2 mg Compresse Uso orale Irlanda Les Laboratoires Servier COVERSYL 4 mg Compresse Uso orale Italia Les Laboratoires Servier COVERSYL 4 mg Compresse Uso orale Lussemburgo Servier Benelux S.A. COVERSYL 2 mg Compresse Uso orale Lussemburgo Servier Benelux S.A. COVERSYL 4 mg Compresse Uso orale Paesi Bassi Les Laboratoires Servier COVERSYL 2 mg Compresse Uso orale Paesi Bassi Les Laboratoires Servier COVERSYL 4 mg Compresse Uso orale Norvegia Les Laboratoires Servier COVERSYL 2 mg Compresse Uso orale Norvegia Les Laboratoires Servier COVERSYL 4 mg Compresse Uso orale Portogallo Servier Portugal - Especialidades Farmacêuticas Portogallo Servier Portugal - Especialidades Farmacêuticas COVERSYL 2 mg Compresse Uso orale COVERSYL 4 mg Compresse Uso orale Spagna Les Laboratoires Servier COVERSYL 4 mg Compresse Uso orale Svezia Les Laboratoires Servier COVERSYL 2 mg Compresse Uso orale Svezia Les Laboratoires Servier COVERSYL 4 mg Compresse Uso orale Regno Unito Les Laboratoires Servier COVERSYL 2 mg Compresse Uso orale Regno Unito Les Laboratoires Servier COVERSYL 4 mg Compresse Uso orale 3
4 ALLEGATO II CONCLUSIONI SCIENTIFICHE E MOTIVI DELLA MODIFICA DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO PRESENTATI DALL EMEA 4
5 CONCLUSIONI SCIENTIFICHE SINTESI GENERALE DELLA VALUTAZIONE SCIENTIFICA DI COVERSYL E DENOMINAZIONI ASSOCIATE (vedi allegato I) Coversyl e denominazioni associate contengono perindoprile, un noto e potente enzima convertitore dell angiotensina (ACE-I) commercializzato in Francia come Coversyl 2 e 4 mg dal 1988, nell intera Unione europea, e in più di 10 paesi terzi, compresi USA e Giappone. Il perindropile è attualmente indicato per il trattamento dell ipertensione e dell insufficienza cardiaca sintomatica. Informazioni generali sulla modifica di tipo II attraverso la procedura di mutuo riconoscimento Nel fascicolo originario sulla modifica di tipo II presentato con procedura di muto riconoscimento (FR/H/246/01-02/001) il richiedente propone la seguente indicazione: Coronaropatia stabile: riduzione del rischio di eventi cardiovascolari in pazienti con coronaropatia stabile. Questa dicitura si basa su una significativa riduzione del rischio relativo (RRR) del 20% (CI 95% [9,4; 28,6] p=0,0003) nell endpoint primario combinato di mortalità cardiovascolare, infarto miocardico non letale o arresto cardiaco con rianimazione riuscita osservato nello studio EUROPA. Un effetto benefico di perindoprile è stato rilevato per tutte le sottocomponenti individuali dell endpoint primario combinato, sebbene soltanto la riduzione del rischio nell infarto miocardico non letale abbia raggiunto un'importanza statistica. Nella relazione sulla valutazione finale (del 14 febbraio 2005) l indicazione proposta dallo Stato membro relatore era limitata a Riduzione del rischio di infarto miocardico ricorrente in pazienti con storia di infarto del miocardio, in base alla considerazione che la riduzione del rischio era soltanto dimostrata per la componente infarto miocardico non letale dell endpoint primario e che l effetto del perindoprile è stato chiaramente rilevato solo nei pazienti con pregresso infarto miocardico. Di conseguenza, il 23 febbraio 2005 il richiedente ha inviato un documento programmatico a tutti gli Stati membri, dichiarando che l indicazione proposta dallo Stato membro relatore non era accettabile, e che sarebbe stato necessario approvare un indicazione più ampia, che potesse riflettere la popolazione oggetto dello studio, vale a dire: Coronaropatia stabile: riduzione del rischio di eventi cardiaci nei pazienti con una storia di infarto miocardico e/o rivascolarizzazione. L indicazione è stata approvata da alcuni Stati membri interessati. Al termine della procedura di mutuo riconoscimento sono emerse discrepanze tra gli Stati membri interessati in merito alla dicitura dell indicazione, che dovrebbe adeguatamente rispecchiare i dati di EUROPA. Un deferimento ufficiale per arbitrato è stato notificato al CHMP dai Paesi Bassi il 17 marzo Nell aprile 2005 il CHMP ha adottato il seguente limite di quantificazione: 1.- Il richiedente deve giustificare l indicazione proposta sulla base dei risultati dello studio EUROPA e della letteratura pertinente pubblicata riguardante altri ACE-I in termini di pazienti da inserire nello studio e obiettivi della terapia. Il richiedente deve in particolare focalizzarsi sui pazienti con una storia di rivascolarizzazione ma senza episodi di infarto miocardico alle spalle, poiché questa popolazione è eterogenea in termini di gravità delle lesioni, tecnica di rivascolarizzazione e trattamenti concomitanti. I risultati raccolti in questa popolazione sono meno convincenti e potrebbe essere necessaria un ulteriore differenziazione del rischio prima di inserire questo gruppo di pazienti nella formulazione dell indicazione. 2.- La seconda questione riguarda la possibilità o meno di estendere l effetto benefico al di là della mera riduzione dell infarto miocardico, ossia alla riduzione degli eventi cardiaci. Tra le varie componenti dell endpoint primario è stata notata una certa coerenza, sebbene siano stati raggiunti risultati significativi soltanto per la prevenzione dell infarto miocardico. Significativo era anche l effetto rilevato sull incidenza dell insufficienza cardiaca. Questo punto richiede una discussione più approfondita. 5
6 Valutazione dell efficacia clinica L indicazione in fase di revisione si fonda sui risultati dello studio EUROPA, concepito per valutare la capacità del perindoprile di ridurre il rischio dell endpoint combinato di morte cardiovascolare, infarto miocardico acuto non letale e arresto cardiaco con rianimazione riuscita in pazienti con coronaropatia stabile senza segni di insufficienza cardiaca. I risultati dello studio dimostrano che il trattamento con perindoprile somministrato una volta al giorno ha determinato una significativa riduzione assoluta nell endpoint primario. Il beneficio era statisticamente significativo per l infarto del miocardio non letale, uno degli elementi dell endpoint combinato. Una tendenza favorevole, sia pur non statisticamente significativa, è stata invece osservata per le altre due componenti. Dal momento che si prevedeva che il sottogruppo di pazienti con una storia di rivascolarizzazione ma senza episodi pregressi di infarto miocardico fosse eterogeneo in termini di gravità delle lesioni, tecnica di rivascolarizzazione e trattamenti concomitanti, è stato suggerito al richiedente di studiare tale aspetto per giustificare l inclusione di questo specifico gruppo di pazienti nell indicazione proposta. In base ai dati forniti dalla società questa popolazione non sarebbe così eterogenea, bensì abbastanza simile alla popolazione inserita nello studio EUROPA, perlomeno in termini di tecniche di rivascolarizzazione e di trattamenti concomitanti. La più alta percentuale di pazienti con un restringimento di almeno il 70% di una o più grosse arterie (82,4% contro il 60,5%) rifletterebbe la presenza di lesioni coronariche gravi nel gruppo di pazienti con una storia di rivascolarizzazione ma senza episodi pregressi di infarto miocardico. Al richiedente è stato inoltre chiesto di giustificare l indicazione sulla base dei risultati della letteratura pertinente pubblicata per altri ACE-I in termini di numero di pazienti da includere e obiettivi della terapia. Si ammette la difficoltà di fare confronti tra i vari studi, che utilizzano una popolazione diversa e impiegano endpoint diversi. Ciò nonostante il richiedente ha provato ad esaminare i risultati di due studi (PEACE e HOPE), in cui sono stati coinvolti pazienti con coronaropatia stabile e frazione di eiezione normale. I risultati degli studi HOPE e PEACE sembrano confermare l effetto benefico del perindoprile osservato nello studio EUROPA per pazienti con rischio di eventi cardiaci da medio ad alto. I pazienti con una storia di rivascolarizzazione sarebbero inclusi in questi gruppi. È stato infine chiesto al richiedente di giustificare l effetto benefico del perindoprile al di là della mera riduzione dell infarto del miocardio. Sebbene per due dei tre elementi dell endpoint composito non sia stato dimostrato un beneficio statisticamente significativo, a causa del numero limitato di casi, è stata comunque osservata una tendenza in favore del perindoprile. Inoltre si è notata una coerenza con le variabili secondarie, nonché addirittura un effetto significativo sull incidenza dell'insufficienza cardiaca nella popolazione in generale. Il CHMP è del parere che l assenza di una differenza statisticamente significativa per due dei tre elementi dell endpoint composito nello studio EUROPA non sia un motivo sufficiente per limitare l indicazione a un unica componente, data anche la tendenza positiva e perfettamente coerente che è stata osservata per queste due componenti. Poiché è dimostrata un ulteriore coerenza per le variabili secondarie, è ragionevole estendere l indicazione da riduzione dell infarto miocardico a riduzione degli eventi cardiaci, espressione questa che comprende i pazienti con una storia di infarto miocardico e/o di rivascolarizzazione. Questa dicitura sarebbe in linea con la politica generale del CHMP sui prodotti che impiegano endpoint compositi per la valutazione dell efficacia. Alla luce di quanto esposto il CHMP conclude che l indicazione proposta per Coversyl Coronaropatia stabile: riduzione del rischio di eventi cardiaci nei pazienti con una storia di infarto miocardico e/o rivascolarizzazione sia adeguatamente confortata dalle informazioni fornite. Conclusioni generali sul rapporto rischi/benefici Durante la riunione del luglio 2005 il CHMP ha valutato i dati sull efficacia presentati dai titolari dell autorizzazione all immissione in commercio, concludendo che è stato dimostrato che Coversyl e denominazioni associate è efficace nella riduzione del rischio di eventi cardiaci in pazienti con coronaropatia stabile e con una storia di infarto miocardico e/o rivascolarizzazione. 6
7 Il CHMP ha raccomandato che fosse concessa la modifica di tipo II al fine di estendere l indicazione. 7
8 MOTIVI DELLA MODIFICA DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Considerato che, il CHP ha esaminato il deferimento presentato ai sensi dell articolo 6, paragrafo 12, del regolamento (CE) n. 1084/2003 della Commissione per Coversyl e denominazioni associate (vedi allegato I); il titolare dell autorizzazione all immissione in commercio ha inserito nell RCP il testo proposto dal CHMP, vale a dire: Si propone di aggiungere la seguente indicazione nella sezione 4.1: Coronaropatia stabile: riduzione del rischio di eventi cardiaci nei pazienti con una storia di infarto miocardico e/o rivascolarizzazione. La posologia nella sezione 4.2 deve essere così aggiornata: Coronaropatia stabile: La terapia con COVERSYL deve essere avviata con una dose di 4 mg una volta al dì per due settimane, successivamente portata a 8 mg una volta al dì, a seconda della funzionalità renale e purché la dose di 4 mg sia ben tollerata. Ai pazienti anziani va somministrata la dose di 2 mg una volta al dì per una settimana, portata a 4 mg una volta al dì nella seconda settimana, prima di aumentare la dose a un massimo di 8 mg una volta al dì, sempre a seconda della funzionalità renale (vedi la Tabella 1 Adeguamenti del dosaggio nei pazienti con compromessa funzione renale ). La dose andrebbe aumentata soltanto se la precedente dose somministrata è stata ben tollerata. Nella sezione 4.4 è stata inserita un avvertenza: Coronaropatia stabile: Se nel primo mese di trattamento con perindoprile si verifica un episodio di angina instabile (maggiore o no), prima di continuare la terapia deve essere valutato con attenzione il rapporto rischi/benefici. La seguente descrizione degli effetti collaterali osservati è stata aggiunta nella sezione 4.8: Studi clinici: Durante il periodo randomizzato dello studio EUROPA sono stati registrati soltanto eventi avversi gravi. Alcuni pazienti hanno subito eventi avversi gravi: 16 (0,3%) dei 6122 pazienti trattati con perindoprile e 12 (0,2%) dei 6107 pazienti trattati con placebo. Nei pazienti trattati con perindoprile si è osservato: ipotensione in 6 soggetti, angioedema in 3 soggetti e arresto cardiaco improvviso in 1 soggetto. È più alto il numero di pazienti che si è ritirato dallo studio per tosse, ipotensione o altri fenomeni di intolleranza al perindoprile rispetto al placebo, vale a dire del 6,0% (n=366) rispetto al 2,1% (n=129). La sezione 5.1 è stata così aggiornata allo scopo di includere i risultati dello studio EUROPA: Pazienti con coronaropatia stabile: Lo studio EUROPA era uno studio clinico multicentrico, internazionale, randomizzato, in doppio cieco, controllato con placebo, condotto nell arco di 4 anni. I pazienti randomizzati al perindoprile 8 mg (n=6110) o al placebo (n=6108) sono stati dodicimiladuecentodiciotto (12.218), tutti di maggiore età. La popolazione dello studio era affetta da coronaropatia senza tuttavia mostrare segni clinici di insufficienza cardiaca. Nel complesso, il 90% dei pazienti riferiva all anamnesi un infarto miocardico e/o pregressa rivascolarizzazione coronaria. La maggior parte dei pazienti ha ricevuto il farmaco oggetto dello studio in aggiunta alla terapia convenzionale, costituita, tra le altre cose, da inibitori piastrinici, agenti ipolipidici e betabloccanti. Il principale criterio per misurare l efficacia era l endpoint composito di mortalità cardiovascolare, infarto miocardico non letale e/o arresto cardiaco con rianimazione riuscita. Il trattamento con perindoprile 8 mg una volta al dì ha indotto una riduzione assoluta 8
9 significativa nell endpoint primario dell 1,9% (riduzione del rischio relative del 20%, CI 95% [9,4; 28,6] p<0,001). Nei pazienti con una storia di infarto del miocardio e/o rivascolarizzazione, è stata osservata rispetto al placebo una riduzione assoluta del 2,2% pari a una RRR del 22,4% (CI 95% [12,0; 31,6] p<0,001) nell endpoint primario; non sono stati individuati elementi pregiudizievoli per la sicurezza in riferimento all estensione dell indicazione, di conseguenza, il CHMP considera positivo il rapporto rischi/benefici per il summenzionato ampliamento dell indicazione. Il CHMP raccomanda di accordare la variazione delle autorizzazioni all immissione in commercio; il relativo Riassunto delle caratteristiche del prodotto per Coversyl e denominazioni associate (vedi allegato I) figura nell allegato III. 9
10 ALLEGATO III RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 10
11 1. DENOMINAZIONE DEL MEDICINALE <COVERSYL e marchi correlati (vedere allegato I)> <dosaggio>, compresse [vedere Allegato I completare con i dati nazionali] 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA <COVERSYL e marchi correlati> 2 mg : 2 mg di perindopril tert-butilamina, equivalenti a 1,669 mg di perindopril Ogni compressa contiene: perindopril tert-butilamina mg 2, equivalenti a mg 1,669 di perindopril Per gli eccipienti vedere paragrafo FORMA FARMACEUTICA Compresse. 4. INFORMAZIONI CLINICHE 4.1. Indicazioni terapeutiche Ipertensione: Trattamento dell ipertensione Insufficienza cardiaca: Trattamento dell insufficienza cardiaca congestizia. Coronaropatia stabile: Riduzione del rischio di eventi cardiaci in pazienti con una anamnesi di infarto miocardico e/o rivascolarizzazione Posologia e modo di somministrazione Si raccomanda di somministrare <COVERSYL e marchi correlati> in una dose singola giornaliera al mattino prima di un pasto. La posologia deve essere individualizzata in base al profilo del paziente (vedere paragrafo 4.4: Avvertenze speciali e opportune precauzioni d impiego ) e alla risposta pressoria. Ipertensione: <COVERSYL e marchi correlati> può essere usato in monoterapia o in associazione con altre classi di antiipertensivi. La posologia iniziale raccomandata è di 4 mg in un unica somministrazione al mattino. Nei pazienti con forte stimolazione del sistema renina-angiotensina-aldosterone (in particolare ipertensione renovascolare, deplezione idrosalina, scompenso cardiaco o ipertensione grave) si può verificare una diminuzione eccessiva della pressione arteriosa in seguito all assunzione della dose iniziale. In questi pazienti si raccomanda di iniziare il trattamento alla posologia di 2 mg e sotto controllo medico. 11
12 Dopo un mese di trattamento la posologia può essere aumentata fino a 8 mg in un unica assunzione quotidiana. Si può avere ipotensione sintomatica in seguito all inizio della terapia con <COVERSYL e marchi correlati>; ciò è più probabile che si verifichi in pazienti che sono al momento trattati con diuretici. Dunque, si raccomanda cautela, dato che questi pazienti possono presentare deplezione idrosalina. Ove possibile, il diuretico deve essere interrotto 2 o 3 giorni prima di iniziare il trattamento con <COVERSYL e marchi correlati> (vedi paragrafo 4.4: Avvertenze speciali e opportune precauzioni di impiego ). Nei pazienti ipertesi in cui il diuretico non può essere sospeso, il trattamento con <COVERSYL e marchi correlati> deve essere iniziato alla posologia di 2 mg. La funzionalità renale e la potassemia devono essere tenute sotto controllo. La posologia di <COVERSYL e marchi correlati > deve essere successivamente adattata in funzione della risposta pressoria. Ove richiesto, il trattamento diuretico può essere reintrodotto. Nei pazienti anziani il trattamento deve essere iniziato alla posologia di 2 mg che, se necessario, può essere progressivamente aumentata a 4 mg dopo un mese di trattamento e quindi a 8 mg in base alla funzione renale (vedere la tabella sottostante). Insufficienza cardiaca congestizia: Si raccomanda che il trattamento con <COVERSYL e marchi correlati>, generalmente in associazione con un diuretico non risparmiatore di potassio e/o con digossina e/o con un beta-bloccante, sia istituito sotto stretto controllo medico alla posologia iniziale consigliata di 2 mg assunti al mattino. Tale posologia può essere aumentata, se tollerata, fino a 4 mg in un unica assunzione giornaliera, con incrementi posologici di 2 mg ad intervalli non inferiori alle 2 settimane. Gli aggiustamenti posologici devono avvenire in base alla risposta clinica individuale del paziente. Nell insufficienza cardiaca grave e in altri pazienti considerati a rischio elevato (pazienti con funzionalità renale compromessa e che presentano una alterazione degli elettroliti, pazienti trattati contemporaneamente con diuretici e/o con vasodilatatori), il trattamento deve essere iniziato sotto attento controllo medico (vedere paragrafo 4.4: Avvertenze speciali e opportune precauzioni d impiego ). Nei pazienti a rischio elevato di ipotensione sintomatica p.e. pazienti con deplezione salina con o senza iponatriemia, pazienti ipovolemici o pazienti in trattamento con dosi massive di diuretici si deve procedere, ove possibile, a una correzione di tali fattori prima di iniziare la terapia con <COVERSYL e marchi correlati >. La pressione arteriosa, la funzione renale e le concentrazioni plasmatiche di potassio devono essere controllate attentamente sia prima che durante il trattamento con <COVERSYL e marchi correlati > (vedere paragrafo 4.4: Avvertenze speciali e opportune precauzioni d impiego ). Coronaropatia stabile: Il trattamento con <COVERSYL e marchi correlati> deve essere iniziato alla posologia di 4 mg in un unica assunzione giornaliera per 2 settimane, da aumentare fino a 8 mg, in un unica assunzione quotidiana, in base alla funzionalità renale e a condizione che la dose da 4 mg sia ben tollerata. I pazienti anziani devono iniziare il trattamento con 2 mg in un unica assunzione quotidiana per una settimana, da aumentare a 4 mg una volta al giorno nella settimana successiva, prima di passare a 8 mg, in un unica assunzione quotidiana, in base alla funzionalità renale (vedere Tabella Adattamento della posologia nell insufficienza renale ). Il dosaggio deve essere aumentato solo se la dose inferiore precedente è ben tollerata. Adattamento della posologia nell insufficienza renale: Nei pazienti affetti da insufficienza renale la posologia deve essere adattata in base alla clearance della creatinina come delineato nella sottostante tabella I: Tabella I: aggiustamento della posologia nell insufficienza renale 1. clearance della creatinina (ml/min) posologia raccomandata Cl CR 60 4 mg al giorno 30< Cl CR < 60 2 mg al giorno 15< Cl CR < 30 2 mg a giorni alterni pazienti emodializzati* 12
13 Cl CR < 15 2 mg il giorno della dialisi * La clearance di dialisi del perindoprilato è di 70 ml/min. Nei pazienti in emodialisi, la dose deve essere somministrata dopo la dialisi. Adattamento della posologia nell insufficienza epatica: Nei pazienti affetti da insufficienza epatica non è richiesto alcun adattamento della posologia (vedere paragrafi 4.4: Avvertenze speciali e opportune precauzioni d impiego e 5.2: Proprietà farmacocinetiche ). Uso pediatrico: L efficacia e la sicurezza di impiego non sono state studiate nei bambini. Pertanto l uso in pediatria è sconsigliato Controindicazioni Ipersensibilità al perindopril, a qualcuno degli eccipienti o a qualunque altro ACE inibitore; Antecedente di angioedema correlato a precedente terapia con ACE inibitori; Angioedema ereditario o idiopatico; Secondo e terzo trimestre di gravidanza (vedere paragrafo 4.6: Gravidanza e allattamento ) 4.4. Avvertenze speciali e opportune precauzioni d impiego Coronaropatia stabile: Se durante il primo mese di trattamento con perindopril si manifesta un episodio di angina pectoris instabile (maggiore o no), deve essere effettuata un attenta valutazione del beneficio/rischio prima di continuare il trattamento. Ipotensione: Gli ACE inibitori possono provocare una caduta della pressione arteriosa. Raramente è stata osservata ipotensione sintomatica in pazienti con ipertensione non complicata ed è più probabile che si manifesti in pazienti ipovolemici, p.e. in seguito a un trattamento diuretico, a un regime alimentare a ridotto contenuto di sale, a dialisi, a diarrea o vomito, o affetti da grave ipertensione renino-dipendente (vedere paragrafo 4.5: Interazioni con altri medicinali e altre forme di interazione e paragrafo 4.8: Effetti indesiderati ). Ipotensione sintomatica è stata osservata in pazienti con insufficienza cardiaca congestizia, associata o meno a insufficienza renale. Ciò è più probabile che avvenga in pazienti affetti da un insufficienza cardiaca di grado severo, come rispecchiato dalla somministrazione di dosi elevate di diuretici dell ansa, dall iponatriemia o dalla compromissione della funzionalita renale. L inizio del trattamento e gli adattamenti posologici devono essere accuratamente controllati nei pazienti a rischio elevato di ipotensione sintomatica (vedere paragrafo 4.2: Posologia e modo di somministrazione e 4.8: Effetti indesiderati ). Analoghe considerazioni valgono per i pazienti con cardiopatia ischemica o disturbi cerebrovascolari nei quali una eccessiva caduta della pressione arteriosa può portare a un infarto miocardico o a un evento cerebrovascolare. Se dovesse manifestarsi ipotensione, il paziente deve essere posto in posizione supina e, se necessario, deve essere somministrata una infusione endovenosa di soluzione fisiologica. La comparsa di un ipotensione transitoria non rappresenta una controindicazione alla somministrazione di ulteriori dosi, che generalmente può avvenire senza difficoltà dopo aumento della pressione arteriosa per espansione della volemia. In alcuni pazienti con insufficienza cardiaca congestizia e con pressione arteriosa normale o bassa, si può verificare un ulteriore riduzione della pressione arteriosa sistemica in seguito alla somministrazione di <COVERSYL e marchi correlati >. Tale effetto è previsto e generalmente non costituisce motivo di sospensione del trattamento. Se l ipotensione diviene sintomatica, può rendersi necessaria una riduzione della posologia o l interruzione del trattamento con <COVERSYL e marchi correlati >. 13
14 Stenosi delle valvole aortica e mitrale/cardiomiopatia ipertrofica: Al pari degli altri ACE inibitori, <COVERSYL e marchi correlati > deve essere somministrato con cautela in pazienti con stenosi della valvola mitrale e ostruzione del tratto d efflusso del ventricolo sinistro, quali la stenosi aortica o la cardiomiopatia ipertrofica. Insufficienza renale: Nei casi di insufficienza renale (clearance della creatinina < 60 ml/min.) la posologia iniziale del perindopril deve essere adattata in funzione della clearance della creatinina del paziente (vedere paragrafo 4.2: Posologia e modo di somministrazione ) e successivamente in funzione della risposta del paziente al trattamento. In questi pazienti un regolare controllo del potassio e della creatinina devono far parte della pratica medica corrente (vedere paragrafo 4.8: Effetti indesiderati ). Nei pazienti con insufficienza cardiaca congestizia, l ipotensione conseguente all inizio della terapia con ACE inibitori può determinare una ulteriore compromissione della funzione renale. In tale situazione è stata riferita insufficienza renale acuta generalmente reversibile. In alcuni pazienti con stenosi bilaterale dell arteria renale o stenosi dell arteria a un singolo rene, trattati con ACE inibitori, è stato osservato un aumento dell azotemia e della creatinina plasmatica, generalmente reversibile all arresto del trattamento. Ciò è probabile soprattutto in pazienti con insufficienza renale. La contemporanea presenza di ipertensione renovascolare aumenta il rischio di ipotensione grave e di insufficienza renale. In questi pazienti il trattamento deve essere iniziato sotto stretto controllo medico con posologie ridotte e accuratamente titolate. Poiché il trattamento con diuretici può contribuire all instaurarsi di quanto sopra descritto, la somministrazione di diuretici deve essere interrotta e la funzione renale deve essere monitorata durante le prime settimane di terapia con <COVERSYL e marchi correlati >. In alcuni pazienti ipertesi senza apparente malattia renovascolare pregressa, è stato riscontrato un aumento generalmente lieve e transitorio dell azotemia e della creatinina plasmatica, soprattutto quando <COVERSYL e marchi correlati > è stato somministrato in concomitanza a un diuretico. Ciò è più probabile che si verifichi in pazienti con preesistente compromissione renale. Una riduzione della posologia e/o una sospensione del diuretico e/o di <COVERSYL e marchi correlati> potrebbero rendersi necessarie. Pazienti in emodialisi: In pazienti in emodialisi con membrane high-flux e in terapia con ACE inibitori sono state segnalate reazioni anafilattoidi. Per questi pazienti dovrebbe essere preso in considerazione l impiego di un tipo diverso di membrane per dialisi o di una classe diversa di agenti antiipertensivi. Trapianto di rene: Non vi sono esperienze sulla somministrazione di <COVERSYL e marchi correlati> in pazienti sottoposti di recente a trapianto di rene. Ipersensibilità/angioedema: Un angioedema al volto, alle estremità, alle labbra, alle mucose, alla lingua, alla glottide e/o alla laringe è stato raramente riscontrato in pazienti trattati con ACE inibitori, incluso <COVERSYL e marchi correlati > (vedere paragrafo 4.8: Effetti indesiderati ). Ciò può verificarsi in qualunque momento durante la terapia. In questi casi <COVERSYL e marchi correlati > deve essere immediatamente sospeso e il paziente tenuto sotto osservazione fino a completa risoluzione dei sintomi. Nel caso di edema limitato al volto e alle labbra l evoluzione è stata generalmente regressiva in assenza di trattamento, sebbene gli antistaminici siano stati utili nell alleviare i sintomi. L angioedema associato a un edema laringeo può essere fatale. Qualora vi sia un interessamento della lingua, della glottide o della laringe che possa provocare l ostruzione delle vie aeree deve essere rapidamente adottata una terapia di emergenza. In tal caso si deve prevedere la somministrazione di adrenalina e/o il mantenimento della pervietà delle vie aeree. Il paziente deve essere posto sotto stretto controllo fino a completa e prolungata scomparsa dei sintomi. Gli inibitori dell enzima di conversione dell angiotensina provocano angioedema con maggiore frequenza nei pazienti di razza nera rispetto ai pazienti di altre razze. Pazienti con antecedente di angioedema non correlato al trattamento con ACE inibitori possono presentare un rischio maggiore di comparsa di angioedema quando trattati con un ACE inibitore (vedere paragrafo 4.3: Controindicazioni ). 14
15 Reazioni anafilattoidi durante aferesi delle lipoproteine a bassa densità (LDL): Raramente in pazienti in trattamento con ACE inibitori sottoposti ad aferesi delle lipoproteine a bassa densità (LDL) con destran solfato sono stati riportati casi di reazioni anafilattoidi a rischio di vita per il soggetto. Queste reazioni possono essere prevenute sospendendo temporaneamente il trattamento con l ACE inibitore prima di ogni aferesi. Reazioni anafilattiche durante trattamento di desensibilizzazione: In pazienti in terapia con ACE inibitori sottoposti a un trattamento desensibilizzante (p.e. veleno di imenotteri) sono stati riportati casi di reazioni anafilattoidi. Negli stessi pazienti tali reazioni sono state prevenute sospendendo temporaneamente il trattamento con ACE inibitori, ma sono ricomparse in seguito a riesposizione accidentale del paziente. Insufficienza epatica: Raramente, il trattamento con ACE inibitori è stato associato ad una sindrome che ha inizio con ittero colestatico e progredisce fino alla necrosi epatica fulminante e (talora) alla morte. Il meccanismo di questa sindrome è sconosciuto. I pazienti in trattamento con ACE inibitori nei quali compaia ittero o un aumento significativo degli enzimi epatici devono sospendere l ACE inibitore ed essere posti sotto stretto controllo medico (vedere 4.8: Effetti indesiderati ). Neutropenia/Agranulocitosi/Trombocitopenia/Anemia: In pazienti trattati con ACE inibitori sono stati riscontrati casi di neutropenia/agranulocitosi/ trombocitopenia e anemia. Nei pazienti con funzione renale normale e in assenza di altri fattori di complicazione, raramente compare neutropenia. Il perindopril deve essere somministrato con estrema cautela a pazienti con collagenopatie, trattati con agenti immunosoppressori, con allopurinolo o procainamide, o che presentino una combinazione di questi fattori di complicazione, specialmente in presenza di antecedente compromissione renale. Alcuni di questi pazienti hanno sviluppato infezioni gravi, che in pochi casi non hanno risposto a una terapia antibiotica intensiva. Se questi pazienti vengono trattati con perindopril, si raccomanda di eseguire un controllo periodico della conta dei globuli bianchi e di invitarli a segnalare qualunque episodio di infezione. Razza: Gli ACE inibitori possono provocare la comparsa di angioedema con maggiore frequenza nei pazienti di razza nera rispetto ai pazienti di altre razze. Al pari di altri ACE inibitori, il perindopril può essere meno efficace nel ridurre la pressione arteriosa in pazienti di razza nera rispetto ai pazienti di altre razze, probabilmente a causa di una maggiore prevalenza di ridotte concentrazioni di renina nella popolazione ipertesa di razza nera. Tosse: A seguito di somministrazione di ACE inibitori è stata riportata la comparsa di tosse. Questa tosse caratteristica è secca, persistente e si risolve alla sospensione del trattamento. La tosse indotta dagli ACE inibitori deve essere tenuta in considerazione nel porre diagnosi differenziale di tosse. Intervento chirurgico/anestesia: In pazienti sottoposti a interventi di chirurgia maggiore o in corso di anestesia con agenti che provocano ipotensione, <COVERSYL e marchi correlati> può bloccare la formazione di angiotensina II secondaria alla liberazione compensatoria di renina. Il trattamento deve essere interrotto un giorno prima dell intervento. Se si manifesta ipotensione e la si ritiene correlata al suddetto meccanismo, deve essere corretta mediante espansione della volemia. Iperkalemia: In alcuni pazienti in terapia con ACE inibitori, perindopril incluso, è stato segnalato un aumento delle concentrazioni plasmatiche di potassio. I pazienti a rischio di comparsa di iperkalemia sono quelli affetti da insufficienza renale, diabete mellito non controllato, trattati contemporaneamente con diuretici risparmiatori di potassio, integratori di potassio o sostituti del sale contenenti potassio; ovvero pazienti in trattamento con altri farmaci che provocano un aumento del potassio plasmatico (p.e. eparina). Se l uso concomitante dei farmaci sopra menzionati è ritenuta appropriata, si raccomanda un controllo regolare del potassio plasmatico. 15
16 Pazienti diabetici: In pazienti diabetici trattati con agenti antidiabetici orali o insulina, la glicemia deve essere attentamente controllata durante il primo mese di terapia con un ACE inibitore (vedere paragrafo 4.5: Interazioni con altri medicinali ed altre forme di interazione Antidiabetici ). Litio: L associazione di litio e perindopril è generalmente sconsigliata (vedere paragrafo: 4.5: Interazioni con altri medicinali ed altre forme di interazione ). Diuretici risparmiatori di potassio, integratori di potassio o sostituti del sale contenenti potassio: L associazione di perindopril con diuretici risparmiatori di potassio, integratori di potassio o sostituti del sale contenenti potassio è generalmente sconsigliata (vedere paragrafo: 4.5: Interazioni con altri medicinali ed altre forme di interazione ). Gravidanza e allattamento: (Vedere paragrafo 4.3: Controindicazioni e paragrafo 4.6: Gravidanza ed allattamento ). 4.5 Interazioni con altri medicinali ed altre forme di interazione Diuretici: I pazienti in trattamento con diuretici e specialmente quelli con deplezione idrosalina, possono manifestare una riduzione eccessiva della pressione arteriosa dopo l inizio di una terapia con ACE inibitori. La comparsa di effetti ipotensivi può essere diminuita sospendendo il diuretico, espandendo la volemia o aumentando l assunzione di sale prima di iniziare una terapia con perindopril, a posologie basse e progressive. Diuretici risparmiatori di potassio, integratori di potassio o sostituti del sale contenenti potassio: Sebbene le concentrazioni plasmatiche di potassio rimangano di solito entro limiti normali, in alcuni pazienti in trattamento con perindopril può insorgere iperkalemia. I diuretici risparmiatori di potassio (p.e. spironolattone, triamterene o amiloride), gli integratori di potassio o i sostituti del sale contenenti potassio possono provocare aumenti significativi delle concentrazioni plasmatiche di potassio. Pertanto si sconsiglia l associazione di perindopril con i farmaci sopra citati (vedere paragrafo 4.4). Se l uso concomitante dei farmaci sopra citati è ritenuto appropriato a causa di una ipokalemia accertata, essi devono essere impiegati con cautela e con frequenti controlli della potassemia. Litio: Aumenti reversibili delle concentrazioni plasmatiche e della tossicità del litio sono stati riscontrati in seguito a somministrazione concomitante di litio e ACE inibitori. L uso concomitante di diuretici tiazidici può aumentare ulteriormente il rischio di tossicità del litio, di per sé già elevato in corso di trattamento con ACE inibitori. La somministrazione di perindopril in corso di trattamento con litio è sconsigliata, tuttavia se ritenuta necessaria, deve essere eseguito un accurato monitoraggio dei livelli plasmatici di litio (vedere paragrafo 4.4). Farmaci antiinfiammatori non steroidei (FANS) inclusa l aspirina a posologie 3 g al giorno: La somministrazione contemporanea di farmaci antiinfiammatori non steroidei può ridurre l efficacia antiipertensiva degli ACE inibitori. Inoltre FANS e ACE inibitori esercitano un effetto sinergico sull aumento delle concentrazioni di potassio e possono provocare una compromissione della funzione renale. Tali effetti sono generalmente reversibili. Raramente, potrebbe manifestarsi un insufficienza renale acuta, specialmente nei pazienti con funzionalità renale compromessa, quali gli anziani o i pazienti disidratati. Agenti antiipertensivi e vasodilatatori: La somministrazione concomitante di questi farmaci può aumentare l effetto ipotensivo del perindopril. La somministrazione contemporanea di nitroglicerina e altri nitrati o altri vasodilatatori può ridurre ulteriormente la pressione arteriosa. 16
17 Agenti antidiabetici: Studi epidemiologici hanno suggerito che la somministrazione concomitante di ACE inibitori e farmaci antidiabetici (insulina, agenti ipoglicemizzanti orali) può provocare una eccessiva riduzione del glucosio nel sangue con rischio di ipoglicemia. La comparsa di tale fenomeno sembra essere più probabile durante le prime settimane di trattamento combinato e in pazienti con insufficienza renale. Acido acetil-salicilico, trombolitici, beta-bloccanti, nitrati: Il perindopril può essere somministrato contemporaneamente ad acido acetil-salicilico (se usato come trombolitico), trombolitici, beta-bloccanti e/o nitrati. Antidepressivi triciclici/antipsicotici/anestetici: La somministrazione concomitante di ACE inibitori e taluni anestetici, antidepressivi triciclici e antipsicotici può provocare una ulteriore diminuzione della pressione arteriosa (vedere paragrafo 4.4). Simpaticomimetici: Gli agenti simpaticomimetici possono ridurre l efficacia antiipertensiva degli ACE inibitori Gravidanza ed allattamento Gravidanza: <COVERSYL e marchi correlati> non deve essere somministrato durante il primo trimestre di gravidanza. Se si pianifica o viene accertata una gravidanza, il passaggio ad un trattamento alternativo deve essere iniziato appena possibile. Nella donna non sono stati effettuati studi controllati con ACE inibitori, tuttavia in un numero limitato di esposizioni durante il primo trimestre di gravidanza non sembra essersi verificata alcuna malformazione legata a fetotossicità umana, come più sotto riportato. Il perindopril è controindicato durante il 2 e il 3 trimestre di gravidanza. E noto che un esposizione prolungata agli ACE inibitori durante il 2 e il 3 trimestre di gravidanza provochi fetotossicità umana (ridotta funzionalità renale, oligoidramnios, ritardata ossificazione del cranio) e tossicità neonatale (insufficienza renale, ipotensione, iperkalemia) (vedere paragrafo 5.3: Dati preclinici di sicurezza ). Nel caso in cui si sia verificata una esposizione al perindopril a partire dal 2 trimestre di gravidanza è consigliabile un controllo ecografico della funzionalità renale e del cranio. Allattamento: Non è conosciuto se il perindopril sia escreto nel latte materno. Pertanto l uso di <COVERSYL e marchi correlati > è sconsigliato nelle donne che allattano al seno Effetti sulla capacità di guidare veicoli e sull uso di macchinari Durante la guida di veicoli o l uso di macchinari deve essere tenuto presente che occasionalmente possono manifestarsi senso di vertigine o faticabilità Effetti indesiderati In corso di trattamento con perindopril sono stati segnalati i seguenti effetti indesiderati che sono stati classificati secondo la seguente frequenza: molto comune (>1/10); comune (>1/100, <1/10); non comune (1/1000, < 1/100); raro (>1/10000, <1/1000); molto raro (<1/10000), comprese segnalazioni isolate. Disturbi psichiatrici: Non comune: disturbi dell umore o del sonno. Alterazioni del sistema nervoso: Comune: cefalea, capogiro, vertigine, parestesie. Molto raro: confusione. 17
18 Disturbi oculari: Comune: alterazioni della visione. Disturbi dell apparato auditivo e vestibolare: Comune: tinnito. Alterazioni cardiovascolari: Comune: ipotensione e effetti correlati all ipotensione. Molto raro: aritmia, angina pectoris, infarto miocardico e ictus, probabilmente secondari a marcata ipotensione in pazienti ad alto rischio (vedere 4.4: Avvertenze speciali e opportune precauzioni d impiego ). Alterazioni dell apparato respiratorio, del torace e del mediastino: Comune: tosse, dispnea. Non comune: broncospasmo. Molto raro: polmonite eosinofilica, rinite. Alterazioni dell apparato gastrointestinale: Comune: nausea, vomito, dolore addominale, disgeusia, dispepsia, diarrea, stipsi. Non comune: secchezza della bocca. Molto raro: pancreatite. Alterazioni del sistema epatobiliare: Molto raro: epatite, sia citolitica che colestatica (vedere paragrafo 4.4: Avvertenze speciali e opportune precauzioni d impiego ). Alterazioni della cute e del tessuto sottocutaneo: Comune: rash, prurito. Non comune: angioedema del volto, delle estremità, delle labbra, delle mucose, della lingua, della glottide e/o della laringe, orticaria (vedere paragrafo 4.4: Avvertenze speciali e opportune precauzioni d impiego ). Molto raro: eritema multiforme. Alterazioni dell apparato muscolo-scheletrico, del tessuto connettivo e delle ossa: Comune: crampi muscolari. Alterazioni renali e delle vie urinarie: Non comune: insufficienza renale. Molto raro: insufficienza renale acuta. Disordini del sistema riproduttivo e della mammella: Non comune: impotenza. Disordini generali: Comune: astenia. Non comune: sudorazione. Alterazioni del sangue e sistema linfatico: Riduzione dell emoglobina e dell ematocrito, trombocitopenia, leucopenia/neutropenia, episodi di agranulocitosi o pancitopenia sono stati segnalati molto raramente. In pazienti affetti da una deficienza congenita di G-6PDH, sono stati segnalati episodi molto rari di anemia emolitica (vedere paragrafo 4.4: Avvertenze speciali e opportune precauzioni d impiego ). Indagini diagnostiche: Aumenti dell azotemia e della creatinina plasmatica, iperkalemia reversibile alla sospensione del trattamento si possono manifestare soprattutto in presenza di insufficienza renale, insufficienza 18
19 cardiaca grave e ipertensione renovascolare. Raramente è stato segnalato un aumento degli enzimi epatici e della bilirubina. Studi clinici: Durante il periodo di randomizzazione dello studio EUROPA, sono stati raccolti solo gli eventi avversi gravi. Pochi pazienti hanno riportato eventi avversi gravi: 16 dei 6122 pazienti (0,3%) trattati con perindopril e 12 dei 6107 pazienti (0,2%) trattati con placebo. Nei pazienti trattati con perindopril, è stata osservata ipotensione in 6 pazienti, angioedema in 3 e arresto cardiaco improvviso in 1. Più pazienti hanno sospeso il trattamento per tosse, ipotensione o altra intolleranza con perindopril, rispetto al placebo, rispettivamente 6,0% (n=366) verso 2,1% (n=129) 4.9. Sovradosaggio Sono disponibili dati clinici limitati relativi al sovradosaggio. I sintomi associati al sovradosaggio con ACE inibitori possono includere ipotensione, shock circolatorio, alterazione degli elettroliti, insufficienza renale, iperventilazione, tachicardia, palpitazioni, bradicardia, senso di vertigine, ansia e tosse. In caso di sovradosaggio si consiglia il trattamento con una infusione endovenosa di soluzione fisiologica. Se si manifesta ipotensione il paziente deve essere posizionato come in caso di shock. Ove disponibile, può inoltre essere preso in considerazione il trattamento con un infusione endovenosa di angiotensina II e/o di catecolamine. Il perindopril può essere rimosso dal circolo generale con l emodialisi (vedere paragrafo 4.4: Avvertenze speciali e opportune precauzioni d impiego Pazienti in emodialisi ). L impiego di un pacemaker è indicato in caso di bradicardia resistente alla terapia. Si devono controllare continuamente i segni vitali, gli elettroliti del siero e le concentrazioni della creatinina. 5. PROPRIETÀ FARMACOLOGICHE 5.1. Proprietà farmacodinamiche Codice ATC: C09AA04 Il perindopril è un inibitore dell enzima di conversione (ACE) dell angiotensina I in angiotensina II. L enzima di conversione o chinasi, è un esopeptidasi che consente la conversione dell angiotensina I in angiotensina II, agente vasocostrittore, e la degradazione della bradichinina, agente vasodilatatore, in un eptapeptide inattivo. L inibizione dell ACE provoca una riduzione dell angiotensina II nel plasma che conduce ad un aumento di attività della renina plasmatica (per inibizione del meccanismo di feedback negativo del rilascio di renina) e ad una ridotta secrezione di aldosterone. Poiché l ACE inattiva la bradichinina l inibizione dell ACE determina altresì un aumento di attività del sistema callicreina-chinina a livello circolatorio e locale (e quindi anche una attivazione delle prostaglandine). E probabile che tale meccanismo contribuisca alla riduzione della pressione arteriosa da parte degli ACE inibitori e che sia parzialmente responsabile di certi effetti collaterali (p.e. tosse). Il perindopril agisce attraverso il suo metabolita attivo, il perindoprilato. Gli altri metaboliti non mostrano in vitro inibizione dell attività dell ACE. Ipertensione: Il perindopril è attivo a tutti gli stadi dell ipertensione: leggera, moderata, grave; è stata osservata una riduzione della pressione arteriosa sistolica e diastolica in clinostatismo e in ortostatismo. Il perindopril riduce le resistenze vascolari periferiche provocando una riduzione della pressione arteriosa. Di conseguenza si verifica un aumento del flusso sanguigno periferico, senza alcun effetto sulla frequenza cardiaca. Il flusso sanguigno renale di regola aumenta, mentre il tasso di filtrazione glomerulare (GFR) rimane generalmente immodificato. Il picco dell effetto antiipertensivo sopraggiunge 4-6 ore dopo somministrazione singola e l efficacia antiipertensiva si mantiene per almeno 24 ore: l efficacia intermedia è compresa tra l 87 e il 100% dell effetto di picco. 19
20 La riduzione della pressione arteriosa avviene rapidamente. Nei pazienti che rispondono, la normalizzazione pressoria è raggiunta dopo un mese di trattamento e si mantiene senza comparsa di tachifilassi. L arresto del trattamento non è accompagnato da fenomeni di rebound. Il perindopril riduce l ipertrofia ventricolare sinistra. E stato clinicamente dimostrato nell uomo che il perindopril possiede proprietà vasodilatatrici. Migliora l elasticità dei grossi tronchi arteriosi e riduce il rapporto media/lume delle piccole arterie. L aggiunta di un diuretico tiazidico determina una sinergia di tipo additivo. L associazione di un ACE inibitore e di un tiazidico riduce inoltre il rischio di ipokalemia indotta dal trattamento diuretico. Insufficienza cardiaca: <COVERSYL e marchi correlati> riduce il lavoro del cuore attraverso una riduzione del pre-carico e del post-carico. Gli studi condotti in pazienti affetti da insufficienza cardiaca hanno evidenziato: - una riduzione della pressione di riempimento ventricolare sinistro e destro, - una diminuzione delle resistenze vascolari periferiche totali, - un aumento della portata cardiaca e un miglioramento dell indice cardiaco. In studi di confronto la prima somministrazione di 2 mg di <COVERSYL e marchi correlati > in pazienti affetti da insufficienza cardiaca da lieve a moderata non ha comportato alcuna riduzione significativa della pressione arteriosa rispetto al placebo. Pazienti con coronaropatia stabile: EUROPA è uno studio clinico multicentrico, internazionale, randomizzato, in doppio cieco vs placebo, la cui durata è stata di 4 anni. Dodicimiladuecentodiciotto (12218) pazienti di età superiore ai 18 anni sono stati randomizzati a perindopril 8 mg (n=6110) o placebo (n=6108). I pazienti arruolati presentavano una coronaropatia documentata senza evidenza di segni clinici di insufficienza cardiaca. Complessivamente, il 90% dei pazienti aveva avuto un precedente infarto miocardico e/o una precedente rivascolarizzazione coronarica. La maggior parte dei pazienti assumeva il farmaco in studio in aggiunta alla terapia convenzionale, che comprendeva farmaci antiaggreganti piastrinici, ipolipemizzanti e beta-bloccanti. Il principale criterio di efficacia è stato la combinazione di mortalità cardiovascolare, infarto miocardico non fatale e/o arresto cardiaco con rianimazione riuscita. Il trattamento con perindopril 8 mg, una volta al giorno, ha dimostrato una riduzione assoluta dell end-point primario significativa, pari all 1,9% (riduzione del 20% del rischio relativo, 95% CI [9,4; 28,6] p<0,001). In pazienti con anamnesi di infarto miocardico e/o rivascolarizzazione, è stata osservata una riduzione assoluta dell end-point primario del 2,2% corrispondente a un RRR del 22,4% (95% CI [12,0; 31,6 p<0,001), nei confronti del placebo Proprietà farmacocinetiche Per via orale, l'assorbimento del perindopril è rapido e il picco di concentrazione è completo entro 1 ora. La biodisponibilità è del 65-70%. Circa il 20% della quantità totale di perindopril assorbito è convertito in perindoprilato, il metabolita attivo. In aggiunta al perindoprilato attivo, il perindopril produce 5 metaboliti tutti inattivi. L emivita plasmatica del perindopril è di 1 ora. Il picco di concentrazione plasmatica del perindoprilato viene raggiunto in 3-4 ore. Poiché l assunzione di cibo riduce la conversione a perindoprilato e dunque la biodisponibilità, <COVERSYL e marchi correlati > deve essere somministrato per via orale in un unica dose giornaliera al mattino prima di un pasto. Il volume di distribuzione del perindoprilato libero è di circa 0,2 l/kg. Il legame con le proteine è modesto (il legame del perindoprilato all enzima di conversione dell angiotensina è inferiore al 30%), ma è concentrazione-dipendente. Il perindoprilato è eliminato con le urine e l emivita della frazione libera è di circa 3-5 ore. La dissociazione del perindoprilato legato all enzima di conversione dell angiotensina conduce ad una emivita effettiva di eliminazione di 25 ore, con il raggiungimento dello steady-state entro 4 giorni. Non è stato osservato accumulo di perindopril in seguito a somministrazioni ripetute. 20
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO NB: QUESTO SPC È QUELLO PRECEDENTEMENTE ANNESSO ALLA DECISIONE DELLA COMMISSIONE RIGUARDO QUESTO DEFERIMENTO PER ARBITRATO. IL TESTO ERA QUELLO VALIDO ALL EPOCA.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO NB: QUESTO SPC È QUELLO PRECEDENTEMENTE ANNESSO ALLA DECISIONE DELLA COMMISSIONE RIGUARDO QUESTO DEFERIMENTO PER ARBITRATO. IL TESTO ERA QUELLO VALIDO ALL EPOCA.
Perindopril ratiopharm 4 mg compresse perindopril sale di tert-butilamina 4 mg, equivalenti a 3,338 mg di perindopril.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL PRODOTTO MEDICINALE Perindopril ratiopharm 4 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Perindopril ratiopharm 4 mg compresse
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL PRODOTTO MEDICINALE Perindopril ratiopharm 4 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Perindopril ratiopharm 4 mg compresse
Forma farmaceutica. Nome di fantasia. COVERSUM 2 mg COVERSUM 4 mg COVERSYL. 2 mg. 2 mg. COVERSYL 4 mg. 2 mg. COVERSYL 4 mg ACERTIL. 2 mg.
 ALLEGATO I ELENCO DEI NOMI DEL MEDICINALE, DELLE FORME FARMACEUTICHE, DEI DOSAGGI, DELLA VIA DI SOMMINISTRAZIONE, DEI TITOLARI DELLE AUTORIZZAZIONI ALL IMMISSIONE IN COMMERCIO, DEI CONTENITORI E DEI CONTENUTI
ALLEGATO I ELENCO DEI NOMI DEL MEDICINALE, DELLE FORME FARMACEUTICHE, DEI DOSAGGI, DELLA VIA DI SOMMINISTRAZIONE, DEI TITOLARI DELLE AUTORIZZAZIONI ALL IMMISSIONE IN COMMERCIO, DEI CONTENITORI E DEI CONTENUTI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 1. DENOMINAZIONE DEL MEDICINALE PERINDOPRIL DOC Generici 4 mg compresse RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Perindopril tert-butilamina. Ciascuna compressa
1. DENOMINAZIONE DEL MEDICINALE PERINDOPRIL DOC Generici 4 mg compresse RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Perindopril tert-butilamina. Ciascuna compressa
Allegato III. Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Queste modifiche ai paragrafi pertinenti del Riassunto delle Caratteristiche
Allegato III Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Queste modifiche ai paragrafi pertinenti del Riassunto delle Caratteristiche
Allegato III. Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo
 Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
Allegato II. Modifiche ai relativi paragrafi del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato II Modifiche ai relativi paragrafi del riassunto delle caratteristiche del prodotto e del foglio illustrativo 6 Per i medicinali contenenti gli inibitori dell enzima di conversione dell angiotensina
Allegato II Modifiche ai relativi paragrafi del riassunto delle caratteristiche del prodotto e del foglio illustrativo 6 Per i medicinali contenenti gli inibitori dell enzima di conversione dell angiotensina
Allegato IV. Conclusioni scientifiche
 Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Il 7 giugno 2017, la Commissione europea (CE) è stata informata di un caso mortale di insufficienza epatica fulminante in un paziente trattato
Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Il 7 giugno 2017, la Commissione europea (CE) è stata informata di un caso mortale di insufficienza epatica fulminante in un paziente trattato
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Perindopril Teva Italia 2,5 mg compresse rivestite con film Perindopril Teva Italia 5 mg compresse rivestite con film Perindopril
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Perindopril Teva Italia 2,5 mg compresse rivestite con film Perindopril Teva Italia 5 mg compresse rivestite con film Perindopril
Vasculopatie venose. Dr. Giovanni Papa Coordinatore FIMMG FORMAZIONE LAZIO
 Vasculopatie venose Dr. Giovanni Papa Coordinatore FIMMG FORMAZIONE LAZIO CASO CLINICO Manfredi, 63 anni Anamnesi patologica remota: Ipertensione arteriosa Dislipidemia Insufficienza venosa di grado lieve
Vasculopatie venose Dr. Giovanni Papa Coordinatore FIMMG FORMAZIONE LAZIO CASO CLINICO Manfredi, 63 anni Anamnesi patologica remota: Ipertensione arteriosa Dislipidemia Insufficienza venosa di grado lieve
Farmaci del sistema renina-angiotensina. Antagonisti dei recettori AT1. Inibitori della renina. Pressione dei vasi preglomerulari
 ANTIPERTENSIVI Farmaci del sistema renina-angiotensina Ace-inibitori Antagonisti dei recettori AT1 Inibitori della renina Attività simpatica renale via β 1 Pressione dei vasi preglomerulari Riassorb di
ANTIPERTENSIVI Farmaci del sistema renina-angiotensina Ace-inibitori Antagonisti dei recettori AT1 Inibitori della renina Attività simpatica renale via β 1 Pressione dei vasi preglomerulari Riassorb di
Allegato II. Conclusioni scientifiche
 Allegato II Conclusioni scientifiche 13 Conclusioni scientifiche Haldol, che contiene il principio attivo aloperidolo, è un antipsicotico appartenente al gruppo del butirrofenone. È un potente antagonista
Allegato II Conclusioni scientifiche 13 Conclusioni scientifiche Haldol, che contiene il principio attivo aloperidolo, è un antipsicotico appartenente al gruppo del butirrofenone. È un potente antagonista
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Maggio 2013 Nuove importanti restrizioni all uso di Protelos/Osseor (ranelato di
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Maggio 2013 Nuove importanti restrizioni all uso di Protelos/Osseor (ranelato di
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PERINDOPRIL e AMLODIPINA DOC Generici 4 mg/5 mg compresse PERINDOPRIL e AMLODIPINA DOC Generici 4 mg/10 mg compresse PERINDOPRIL
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PERINDOPRIL e AMLODIPINA DOC Generici 4 mg/5 mg compresse PERINDOPRIL e AMLODIPINA DOC Generici 4 mg/10 mg compresse PERINDOPRIL
LO SCOMPENSO (insufficienza) CARDIACO (IC)
 LO SCOMPENSO (insufficienza) CARDIACO (IC) Cause e origine Lo scompenso origina da una disfunzione sistolica e/o diastolica ed è tra le cause più comuni di invalidità e di morte nelle nazioni industrializzate
LO SCOMPENSO (insufficienza) CARDIACO (IC) Cause e origine Lo scompenso origina da una disfunzione sistolica e/o diastolica ed è tra le cause più comuni di invalidità e di morte nelle nazioni industrializzate
LO SCOMPENSO (insufficienza) CARDIACO (IC)
 LO SCOMPENSO (insufficienza) CARDIACO (IC) Cause e origine Lo scompenso origina da una disfunzione sistolica e/o diastolica ed è tra le cause più comuni di invalidità e di morte nelle nazioni industrializzate
LO SCOMPENSO (insufficienza) CARDIACO (IC) Cause e origine Lo scompenso origina da una disfunzione sistolica e/o diastolica ed è tra le cause più comuni di invalidità e di morte nelle nazioni industrializzate
Allegato III. Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
Allegato III. Modifiche ai paragrafi pertinenti delle Informazioni sul Prodotto
 Allegato III Modifiche ai paragrafi pertinenti delle Informazioni sul Prodotto Nota: Le presenti modifiche ai paragrafi pertinenti delle informazioni sul prodotto sono l esito della procedura di referral.
Allegato III Modifiche ai paragrafi pertinenti delle Informazioni sul Prodotto Nota: Le presenti modifiche ai paragrafi pertinenti delle informazioni sul prodotto sono l esito della procedura di referral.
Allegato III. Modifiche ai paragrafi rilevanti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Modifiche ai paragrafi rilevanti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Le sezioni relative delle Caratteristiche del Prodotto e Foglio Illustrativo
Allegato III Modifiche ai paragrafi rilevanti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Le sezioni relative delle Caratteristiche del Prodotto e Foglio Illustrativo
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
TERAPIA DELLO SCOPENSO CARDIACO CONGESTIZIO
 TERAPIA DELLO SCOPENSO CARDIACO CONGESTIZIO Scompenso cardiaco Dal punto di vista etiologico, diverse possono essere le cause di scompenso cardiaco: Cause responsabili (alterazioni strutturali congenite
TERAPIA DELLO SCOPENSO CARDIACO CONGESTIZIO Scompenso cardiaco Dal punto di vista etiologico, diverse possono essere le cause di scompenso cardiaco: Cause responsabili (alterazioni strutturali congenite
Flusso x resistenza = pressione IPERTENSIONE ARTERIOSA. Meccanismi di regolazione della pressione arteriosa
 IPERTENSIONE ARTERIOSA Flusso x resistenza = pressione Gettata cardiaca x resistenze vascolari = pressione arteriosa Meccanismi di regolazione della pressione arteriosa 1) Sistema nervoso simpatico ( controllo
IPERTENSIONE ARTERIOSA Flusso x resistenza = pressione Gettata cardiaca x resistenze vascolari = pressione arteriosa Meccanismi di regolazione della pressione arteriosa 1) Sistema nervoso simpatico ( controllo
ALLEGATO CONCLUSIONI SCIENTIFICHE PRESENTATE DALL'EMEA
 ALLEGATO CONCLUSIONI SCIENTIFICHE PRESENTATE DALL'EMEA 1 CONCLUSIONI SCIENTIFICHE PRESENTATE DALL EMEA RIASSUNTO COMPLESSIVO DELLA VALUTAZIONE SCIENTIFICA DI RESCUPASE Qualità Si ritiene che la qualità
ALLEGATO CONCLUSIONI SCIENTIFICHE PRESENTATE DALL'EMEA 1 CONCLUSIONI SCIENTIFICHE PRESENTATE DALL EMEA RIASSUNTO COMPLESSIVO DELLA VALUTAZIONE SCIENTIFICA DI RESCUPASE Qualità Si ritiene che la qualità
Conclusioni scientifiche
 ALLEGATO II CONCLUSIONI SCIENTIFICHE E MOTIVI PER LA RICHIESTA DI MODIFICA DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO, DELL'ETICHETTATURA E DEL FOGLIO ILLUSTRATIVO PRESENTATA DALL'AGENZIA EUROPEA
ALLEGATO II CONCLUSIONI SCIENTIFICHE E MOTIVI PER LA RICHIESTA DI MODIFICA DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO, DELL'ETICHETTATURA E DEL FOGLIO ILLUSTRATIVO PRESENTATA DALL'AGENZIA EUROPEA
GAZZETTA UFFICIALE DELLA REPUBBLICA ITALIANA Serie generale n. 115
 AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Maggio 2007 Modifica degli stampati dei medicinali contenenti farmaci antinfiammatori non steroidei (FANS) non selettivi per uso sistemico - ATC M01A. omissis
AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Maggio 2007 Modifica degli stampati dei medicinali contenenti farmaci antinfiammatori non steroidei (FANS) non selettivi per uso sistemico - ATC M01A. omissis
LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
FARMACOVIGILANZA LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
Medicinale non più autorizzato. Allegato I
 Allegato I Conclusioni scientifiche e motivi per la sospensione dell autorizzazione all immissione in commercio presentati dall Agenzia europea per i medicinali 1 Conclusioni scientifiche Riassunto generale
Allegato I Conclusioni scientifiche e motivi per la sospensione dell autorizzazione all immissione in commercio presentati dall Agenzia europea per i medicinali 1 Conclusioni scientifiche Riassunto generale
Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali
 Allegato II Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali Il Riassunto delle Caratteristiche del Prodotto e il foglio
Allegato II Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali Il Riassunto delle Caratteristiche del Prodotto e il foglio
Allegato II. Conclusioni scientifiche
 Allegato II Conclusioni scientifiche 7 Conclusioni scientifiche Solu-Medrol 40 mg polvere e solvente per soluzione per iniezione (di seguito «Solu-Medrol») contiene metilprednisolone e, come eccipiente,
Allegato II Conclusioni scientifiche 7 Conclusioni scientifiche Solu-Medrol 40 mg polvere e solvente per soluzione per iniezione (di seguito «Solu-Medrol») contiene metilprednisolone e, come eccipiente,
FARMACI IN GRADO DI INFLUENZARE LA FUNZIONALITA RENALE: I DIURETICI
 FARMACI IN GRADO DI INFLUENZARE LA FUNZIONALITA RENALE: I DIURETICI DIURETICI Aumentano il flusso urinario e l escrezione dello ione Na + (e generalmente Cl - ) e vengono utilizzati per ripristinare il
FARMACI IN GRADO DI INFLUENZARE LA FUNZIONALITA RENALE: I DIURETICI DIURETICI Aumentano il flusso urinario e l escrezione dello ione Na + (e generalmente Cl - ) e vengono utilizzati per ripristinare il
FRISIUM 10 MG CAPSULE RIGIDE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA FRISIUM 10 MG CAPSULE RIGIDE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione V&A/1598/2013 del 27 settembre
FARMACOVIGILANZA FRISIUM 10 MG CAPSULE RIGIDE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione V&A/1598/2013 del 27 settembre
Foglio illustrativo: informazioni per il paziente
 Foglio illustrativo: informazioni per il paziente butamirato citrato Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni
Foglio illustrativo: informazioni per il paziente butamirato citrato Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
Allegato III. Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PERINDOPRIL e AMLODIPINA DOC Generici 4 mg/5 mg compresse PERINDOPRIL e AMLODIPINA DOC Generici 4 mg/10 mg compresse PERINDOPRIL
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PERINDOPRIL e AMLODIPINA DOC Generici 4 mg/5 mg compresse PERINDOPRIL e AMLODIPINA DOC Generici 4 mg/10 mg compresse PERINDOPRIL
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 1. DENOMINAZIONE DEL MEDICINALE LISINOPRIL DOC Generici 5 mg compresse LISINOPRIL DOC Generici 20 mg compresse RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una
1. DENOMINAZIONE DEL MEDICINALE LISINOPRIL DOC Generici 5 mg compresse LISINOPRIL DOC Generici 20 mg compresse RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una
Allegato IV. Conclusioni scientifiche
 Allegato IV Conclusioni scientifiche 59 Conclusioni scientifiche Informazioni di base Ponatinib è un inibitore delle tirosin-chinasi (Tyrosine Kinase Inhibitor, TKI), concepito per inibire l attività tirosin-chinasica
Allegato IV Conclusioni scientifiche 59 Conclusioni scientifiche Informazioni di base Ponatinib è un inibitore delle tirosin-chinasi (Tyrosine Kinase Inhibitor, TKI), concepito per inibire l attività tirosin-chinasica
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LISINOPRIL DOC Generici 5 mg compresse LISINOPRIL DOC Generici 20 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LISINOPRIL DOC Generici 5 mg compresse LISINOPRIL DOC Generici 20 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una
ALLEGATO III RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DEL PAESE MEMBRO DI RIFERIMENTO, CORRETTO
 ALLEGATO III RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DEL PAESE MEMBRO DI RIFERIMENTO, CORRETTO NB: Questo SPC e` quello precedentemente annesso alla Decisione della Commissione riguardo questo 'Community
ALLEGATO III RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DEL PAESE MEMBRO DI RIFERIMENTO, CORRETTO NB: Questo SPC e` quello precedentemente annesso alla Decisione della Commissione riguardo questo 'Community
Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA ORUDIS 50 MG CAPSULE RIGIDE ORUDIS 200 MG CAPSULE RIGIDE A RILASCIO PROLUNGATO ORUDIS 100 MG/2 ML SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE ORUDIS 5% GEL ORUDIS SUPPOSTE Variazioni
FARMACOVIGILANZA ORUDIS 50 MG CAPSULE RIGIDE ORUDIS 200 MG CAPSULE RIGIDE A RILASCIO PROLUNGATO ORUDIS 100 MG/2 ML SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE ORUDIS 5% GEL ORUDIS SUPPOSTE Variazioni
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
Richiedente Nome di fantasia Dosaggio Forma farmaceutica. Metoprololtartrat/Felodipinratiopharm. Retardtabletten. Mefecomb 50 mg/5 mg depottabletti
 ALLEGATO I ELENCO DEI NOMI, DELLE FORME FARMACEUTICHE, DEL DOSAGGIO DEI MEDICINALI, DELLA VIA DI SOMMINISTRAZIONE, DEI RICHIEDENTI E DEI TITOLARI DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO NEGLI STATI
ALLEGATO I ELENCO DEI NOMI, DELLE FORME FARMACEUTICHE, DEL DOSAGGIO DEI MEDICINALI, DELLA VIA DI SOMMINISTRAZIONE, DEI RICHIEDENTI E DEI TITOLARI DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO NEGLI STATI
Allegato III. Modifiche alle sezioni rilevanti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Modifiche alle sezioni rilevanti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Il riassunto delle caratteristiche del prodotto e il foglio illustrativo potrebbero
Allegato III Modifiche alle sezioni rilevanti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Il riassunto delle caratteristiche del prodotto e il foglio illustrativo potrebbero
1. Quali dei seguenti fattori influenza l assorbimento di un farmaco?
 QUESTIONARIO 1. Quali dei seguenti fattori influenza l assorbimento di un farmaco? 1. la sua solubilità 2. la sua concentrazione 3. l estensione della superficie disponibile per il suo assorbimento 4.
QUESTIONARIO 1. Quali dei seguenti fattori influenza l assorbimento di un farmaco? 1. la sua solubilità 2. la sua concentrazione 3. l estensione della superficie disponibile per il suo assorbimento 4.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRENTAL 600 mg compresse a rilascio modificato. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa a rilascio modificato
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRENTAL 600 mg compresse a rilascio modificato. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa a rilascio modificato
Allegato III Modifiche al riassunto delle caratteristiche del prodotto e al foglio illustrativo
 Allegato III Modifiche al riassunto delle caratteristiche del prodotto e al foglio illustrativo Nota: le modifiche di questo riassunto delle caratteristiche del prodotto e del foglio illustrativo sono
Allegato III Modifiche al riassunto delle caratteristiche del prodotto e al foglio illustrativo Nota: le modifiche di questo riassunto delle caratteristiche del prodotto e del foglio illustrativo sono
Posso andare in montagna?
 Posso andare in montagna? Testo elaborato dal dott. Andrea Ponchia Cardiologo (07/2007) L ambiente montano presenta alcune caratteristiche fisiche (carenza di ossigeno, bassa temperatura) che richiedono
Posso andare in montagna? Testo elaborato dal dott. Andrea Ponchia Cardiologo (07/2007) L ambiente montano presenta alcune caratteristiche fisiche (carenza di ossigeno, bassa temperatura) che richiedono
LO SHOCK ANAFILATTICO
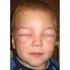 LO SHOCK ANAFILATTICO LO SHOCK - DEFINIZIONE Si definisce come una grave e diffusa alterazione della perfusione tessutale, che determina danno e morte cellulare GLI SHOCK - CLASSIFICAZIONE 1. IPOVOLEMICO
LO SHOCK ANAFILATTICO LO SHOCK - DEFINIZIONE Si definisce come una grave e diffusa alterazione della perfusione tessutale, che determina danno e morte cellulare GLI SHOCK - CLASSIFICAZIONE 1. IPOVOLEMICO
MEDICINALI CONTENENTI IODOCASEINA/TIAMINA CON AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO NELL'UNIONE EUROPEA. Nome di fantasia
 ALLEGATO I ELENCO DEL NOME DEL MEDICINALE, DELLA FORMA FARMACEUTICA, DEL DOSAGGIO, DELLA VIA DI SOMMINISTRAZIONE, DEL RICHIEDENTE, DEL TITOLARE DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO NEGLI STATI
ALLEGATO I ELENCO DEL NOME DEL MEDICINALE, DELLA FORMA FARMACEUTICA, DEL DOSAGGIO, DELLA VIA DI SOMMINISTRAZIONE, DEL RICHIEDENTE, DEL TITOLARE DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO NEGLI STATI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO NB: QUESTO SPC È QUELLO PRECEDENTEMENTE ANNESSO ALLA DECISIONE DELLA COMMISSIONE RIGUARDO QUESTO DEFERIMENTO PER ARBITRATO. IL TESTO ERA QUELLO VALIDO ALL EPOCA.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO NB: QUESTO SPC È QUELLO PRECEDENTEMENTE ANNESSO ALLA DECISIONE DELLA COMMISSIONE RIGUARDO QUESTO DEFERIMENTO PER ARBITRATO. IL TESTO ERA QUELLO VALIDO ALL EPOCA.
NAPRILENE 5 mg COMPRESSE NAPRILENE 20 mg COMPRESSE enalapril maleato
 NAPRILENE 5 mg COMPRESSE NAPRILENE 20 mg COMPRESSE enalapril maleato CATEGORIA FARMACOTERAPEUTICA Inibitore dell'enzima di conversione dell'angiotensina (ACE-inibitore). INDICAZIONI Trattamento dell ipertensione.
NAPRILENE 5 mg COMPRESSE NAPRILENE 20 mg COMPRESSE enalapril maleato CATEGORIA FARMACOTERAPEUTICA Inibitore dell'enzima di conversione dell'angiotensina (ACE-inibitore). INDICAZIONI Trattamento dell ipertensione.
ALLEGATO III MODIFICHE AL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E AL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE AL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E AL FOGLIO ILLUSTRATIVO 1 MODIFICHE DA INCLUDERE NEI RELATIVI PARAGRAFI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO PER I MEDICINALI
ALLEGATO III MODIFICHE AL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E AL FOGLIO ILLUSTRATIVO 1 MODIFICHE DA INCLUDERE NEI RELATIVI PARAGRAFI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO PER I MEDICINALI
Allegato III. Modifiche ai paragrafi pertinenti delle informazioni sul medicinale
 Allegato III Modifiche ai paragrafi pertinenti delle informazioni sul medicinale Nota: Queste informazioni sul medicinale sono il risultato della procedura di riferimento correlata alla Decisione della
Allegato III Modifiche ai paragrafi pertinenti delle informazioni sul medicinale Nota: Queste informazioni sul medicinale sono il risultato della procedura di riferimento correlata alla Decisione della
TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE
 FARMACOVIGILANZA TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono
FARMACOVIGILANZA TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono
Beta- bloccanti - dott. G. Begliuomini
 Beta- bloccanti - dott. G. Begliuomini Controllate sempre le informazioni sulle fonti originali LINEE GUIDA www.escardio.org In italiano su www.federcardio.it 1973 : prima crisi petrolifera Dopo la guerra
Beta- bloccanti - dott. G. Begliuomini Controllate sempre le informazioni sulle fonti originali LINEE GUIDA www.escardio.org In italiano su www.federcardio.it 1973 : prima crisi petrolifera Dopo la guerra
 Patofisiologia scompenso cardiaco Terapia farmacologica scompenso cardiaco Storicamente il trattamento dello scompenso cardiaco si e focalizzato sulle manifestazioni finali della patologia ossia Sovraccarico
Patofisiologia scompenso cardiaco Terapia farmacologica scompenso cardiaco Storicamente il trattamento dello scompenso cardiaco si e focalizzato sulle manifestazioni finali della patologia ossia Sovraccarico
La farmacovigilanza, per un buon uso dei farmaci
 Azienda Sanitaria Locale N 5 Spezzino S.C. Formazione e Promozione alla Salute La farmacovigilanza, per un buon uso dei farmaci - - - - - - - - - - - - - - - - - - - - - - - - Ideato da: Montanari & Cavallini
Azienda Sanitaria Locale N 5 Spezzino S.C. Formazione e Promozione alla Salute La farmacovigilanza, per un buon uso dei farmaci - - - - - - - - - - - - - - - - - - - - - - - - Ideato da: Montanari & Cavallini
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE BLOPRESS 2 mg compresse BLOPRESS 4 mg compresse BLOPRESS 8 mg compresse BLOPRESS 16 mg compresse BLOPRESS 32 mg compresse 2.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE BLOPRESS 2 mg compresse BLOPRESS 4 mg compresse BLOPRESS 8 mg compresse BLOPRESS 16 mg compresse BLOPRESS 32 mg compresse 2.
ALLEGATO I CONCLUSIONI SCIENTIFICHE E MOTIVI DELLA MODIFICA DEI RIASSUNTI DELLE CARATTERISTICHE DEL PRODOTTO PRESENTATI DALL EMEA
 ALLEGATO I CONCLUSIONI SCIENTIFICHE E MOTIVI DELLA MODIFICA DEI RIASSUNTI DELLE CARATTERISTICHE DEL PRODOTTO PRESENTATI DALL EMEA 1 CONCLUSIONI SCIENTIFICHE RIASSUNTO GENERALE DELLA VALUTAZIONE SCIENTIFICA
ALLEGATO I CONCLUSIONI SCIENTIFICHE E MOTIVI DELLA MODIFICA DEI RIASSUNTI DELLE CARATTERISTICHE DEL PRODOTTO PRESENTATI DALL EMEA 1 CONCLUSIONI SCIENTIFICHE RIASSUNTO GENERALE DELLA VALUTAZIONE SCIENTIFICA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DIKEPRIL 5 mg compresse DIKEPRIL 20 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene lisinopril
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DIKEPRIL 5 mg compresse DIKEPRIL 20 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene lisinopril
Pagina 1 di 5 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE. MOLAXOLE polvere per soluzione orale
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE MOLAXOLE polvere per soluzione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni bustina contiene i seguenti principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE MOLAXOLE polvere per soluzione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni bustina contiene i seguenti principi attivi:
Allegato I. Conclusioni scientifiche e motivazioni per la variazione dei termini dell'/delle autorizzazione/i all immissione in commercio
 Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini dell'/delle autorizzazione/i all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione del Comitato
Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini dell'/delle autorizzazione/i all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione del Comitato
Felodipina ratiopharm 5 mg compresse a rilascio prolungato Felodipina ratiopharm 10 mg compresse a rilascio prolungato.
 1. DENOMINAZIONE DEL MEDICINALE Felodipina ratiopharm 5 mg compresse a rilascio prolungato Felodipina ratiopharm 10 mg compresse a rilascio prolungato. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Felodipina
1. DENOMINAZIONE DEL MEDICINALE Felodipina ratiopharm 5 mg compresse a rilascio prolungato Felodipina ratiopharm 10 mg compresse a rilascio prolungato. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Felodipina
Sintesi generale della valutazione scientifica di Kytril e denominazioni associate (vedere Allegato I)
 ALLEGATO II CONCLUSIONI SCIENTIFICHE E MOTIVI DELLA MODIFICA DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO, DELL ETICHETTATURA E DEL FOGLIO ILLUSTRATIVO PRESENTATI DALL AGENZIA EUROPEA PER I MEDICINALI
ALLEGATO II CONCLUSIONI SCIENTIFICHE E MOTIVI DELLA MODIFICA DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO, DELL ETICHETTATURA E DEL FOGLIO ILLUSTRATIVO PRESENTATI DALL AGENZIA EUROPEA PER I MEDICINALI
GLUCOBAY 50 mg compresse GLUCOBAY 100 mg compresse acarbose
 GLUCOBAY 50 mg compresse GLUCOBAY 100 mg compresse acarbose Categoria farmacoterapeutica Farmaco usato nel diabete; ipoglicemizzanti orali. Indicazioni terapeutiche Diabete mellito non-insulino-dipendente
GLUCOBAY 50 mg compresse GLUCOBAY 100 mg compresse acarbose Categoria farmacoterapeutica Farmaco usato nel diabete; ipoglicemizzanti orali. Indicazioni terapeutiche Diabete mellito non-insulino-dipendente
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ESAPENT 1000 mg Capsule molli ESAPENT 500 mg Capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ESAPENT 1000 mg capsule
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ESAPENT 1000 mg Capsule molli ESAPENT 500 mg Capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ESAPENT 1000 mg capsule
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE AUREOMICINA 1 % Crema Oftalmica Tubo 3,5 g 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di crema oftalmica contiene:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE AUREOMICINA 1 % Crema Oftalmica Tubo 3,5 g 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di crema oftalmica contiene:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ebastina Teva 10 mg compresse orodispersibili Ebastina Teva 20 mg compresse orodispersibili 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ebastina Teva 10 mg compresse orodispersibili Ebastina Teva 20 mg compresse orodispersibili 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Come migliorare le performances
 Come migliorare le performances La registrazione dei dati e la gestione delle patologie croniche Sono i metodi per migliorare gli outcomes del Progetto Qualità Le più importanti delle patologie croniche
Come migliorare le performances La registrazione dei dati e la gestione delle patologie croniche Sono i metodi per migliorare gli outcomes del Progetto Qualità Le più importanti delle patologie croniche
Gruppo di lavoro per l appropriatezza prescrittiva ospedale/territorio Documento finale - giugno 2014
 Gruppo di lavoro per l appropriatezza prescrittiva ospedale/territorio Documento finale - giugno 2014 Prescrizione di farmaci Classe C10AA (inibitori della HMG CoA reduttasi) L indicazione regionale è
Gruppo di lavoro per l appropriatezza prescrittiva ospedale/territorio Documento finale - giugno 2014 Prescrizione di farmaci Classe C10AA (inibitori della HMG CoA reduttasi) L indicazione regionale è
Allegato II. Conclusioni scientifiche
 Allegato II Conclusioni scientifiche 7 Conclusioni scientifiche L amitriptilina è un noto antidepressivo triciclico con un consolidato meccanismo d azione e d uso (Brunton 2011). L amitriptilina è un ammina
Allegato II Conclusioni scientifiche 7 Conclusioni scientifiche L amitriptilina è un noto antidepressivo triciclico con un consolidato meccanismo d azione e d uso (Brunton 2011). L amitriptilina è un ammina
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OMEGA 3 DOC Generici 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula molle contiene 1000 mg di
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OMEGA 3 DOC Generici 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula molle contiene 1000 mg di
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Losartan ratiopharm 12,5 mg compresse rivestite con film Losartan ratiopharm 50 mg compresse rivestite con film 2. COMPOSIZIONE
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Losartan ratiopharm 12,5 mg compresse rivestite con film Losartan ratiopharm 50 mg compresse rivestite con film 2. COMPOSIZIONE
DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla
FARMACOVIGILANZA DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla
Allegato IV. Conclusioni scientifiche
 Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Da quando è stata concessa l autorizzazione all immissione in commercio di Esmya sono stati riportati quattro casi di gravi lesioni epatiche
Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Da quando è stata concessa l autorizzazione all immissione in commercio di Esmya sono stati riportati quattro casi di gravi lesioni epatiche
Gli antinfiammatori in Pediatria I FANS. Dott.ssa Alessia Nucci Università degli Studi di Firenze AOU Meyer
 Gli antinfiammatori in Pediatria I FANS Dott.ssa Alessia Nucci Università degli Studi di Firenze AOU Meyer Cosa sono i FANS? I FANS sono un gruppo di composti di classi chimiche diverse con proprietà analgesiche,
Gli antinfiammatori in Pediatria I FANS Dott.ssa Alessia Nucci Università degli Studi di Firenze AOU Meyer Cosa sono i FANS? I FANS sono un gruppo di composti di classi chimiche diverse con proprietà analgesiche,
1. Farmaci biotecnologici: esempi di farmaci usati in terapia con riferimento al meccanismo d azione, indicazioni terapeutiche e controindicazioni
 TRACCE DI TEMI DI AMBITO FARMACOLOGICO 1. Farmaci biotecnologici: esempi di farmaci usati in terapia con riferimento al meccanismo d azione, indicazioni terapeutiche e controindicazioni 2. Effetti indesiderati
TRACCE DI TEMI DI AMBITO FARMACOLOGICO 1. Farmaci biotecnologici: esempi di farmaci usati in terapia con riferimento al meccanismo d azione, indicazioni terapeutiche e controindicazioni 2. Effetti indesiderati
Trattamento di Emergenza della Anafilassi
 Trattamento di Emergenza della Anafilassi Dott. Alessandro Tubaro, DESA Servizio di Anestesia e Rianimazione Ospedale Sacro Cuore Don Calabria Negrar (VR) Caso Clinico: Paziente di 60 anni inizia infusione
Trattamento di Emergenza della Anafilassi Dott. Alessandro Tubaro, DESA Servizio di Anestesia e Rianimazione Ospedale Sacro Cuore Don Calabria Negrar (VR) Caso Clinico: Paziente di 60 anni inizia infusione
Allegato I. Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione del Comitato
Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione del Comitato
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LISOMUCIL TOSSE MUCOLITICO 100 mg/5 ml sciroppo con zucchero LISOMUCIL TOSSE MUCOLITICO 100 mg/5 ml sciroppo senza zucchero
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LISOMUCIL TOSSE MUCOLITICO 100 mg/5 ml sciroppo con zucchero LISOMUCIL TOSSE MUCOLITICO 100 mg/5 ml sciroppo senza zucchero
Sessione 3.1 Il controllo farmacologico
 Modulo 3 La prevenzione secondaria Sessione 3.1 Il controllo farmacologico durata: 30 min. 0 di 11 Obiettivi di apprendimento della sessione conoscere le tecniche di controllo farmacologico a LT descrivere
Modulo 3 La prevenzione secondaria Sessione 3.1 Il controllo farmacologico durata: 30 min. 0 di 11 Obiettivi di apprendimento della sessione conoscere le tecniche di controllo farmacologico a LT descrivere
Foglio illustrativo: informazioni per il paziente. ACIDO PIPEMIDICO EG 400 mg capsule rigide. Medicinale equivalente
 Foglio illustrativo: informazioni per il paziente ACIDO PIPEMIDICO EG 400 mg capsule rigide Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti
Foglio illustrativo: informazioni per il paziente ACIDO PIPEMIDICO EG 400 mg capsule rigide Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti
ALLEGATO III EMENDAMENTI AI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III EMENDAMENTI AI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO Nota: Gli emendamenti al Riassunto delle caratteristiche del prodotto e ai fogli
ALLEGATO III EMENDAMENTI AI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO Nota: Gli emendamenti al Riassunto delle caratteristiche del prodotto e ai fogli
ENALAPRIL DOC 5 mg compresse Le compresse sono rotonde, bianche o biancastre, con la dicitura ED 5 su un lato e una linea di frattura sull altro lato.
 1. DENOMINAZIONE DEL MEDICINALE ENALAPRIL DOC 5 mg compresse ENALAPRIL DOC 20 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ENALAPRIL DOC 5 mg compresse Una compressa di ENALAPRIL DOC contiene
1. DENOMINAZIONE DEL MEDICINALE ENALAPRIL DOC 5 mg compresse ENALAPRIL DOC 20 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ENALAPRIL DOC 5 mg compresse Una compressa di ENALAPRIL DOC contiene
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIDO-HYAL A 25 U.I. e LIDO-HYAL B 175 U.I. soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN PRINCIPI ATTIVI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIDO-HYAL A 25 U.I. e LIDO-HYAL B 175 U.I. soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN PRINCIPI ATTIVI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
Sintesi generale della valutazione scientifica dei medicinali contenenti nimesulide (formulazioni sistemiche) (cfr. allegato I)
 Allegato II Conclusioni scientifiche e motivi della modifica del riassunto delle caratteristiche del prodotto, dell etichettatura e del foglio illustrativo presentati dall EMA 41 Conclusioni scientifiche
Allegato II Conclusioni scientifiche e motivi della modifica del riassunto delle caratteristiche del prodotto, dell etichettatura e del foglio illustrativo presentati dall EMA 41 Conclusioni scientifiche
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE BIONICARD 20 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA BIONICARD 20mg compresse: Principio attivo: Nicardipina
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE BIONICARD 20 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA BIONICARD 20mg compresse: Principio attivo: Nicardipina
Raccomandazioni del PRAC in merito a segnali per l aggiornamento delle informazioni sul prodotto
 23 April 2015 EMA/PRAC/273910/2015 Pharmacovigilance Risk Assessment Committee Raccomandazioni del PRAC in merito a segnali per l aggiornamento delle informazioni sul prodotto Adottate nella riunione del
23 April 2015 EMA/PRAC/273910/2015 Pharmacovigilance Risk Assessment Committee Raccomandazioni del PRAC in merito a segnali per l aggiornamento delle informazioni sul prodotto Adottate nella riunione del
