EMA conferma le raccomandazioni per minimizzare il rischio di PML, un infezione del cervello, in seguito a utilizzo di Tysabri
|
|
|
- Raffaele Cenci
- 7 anni fa
- Visualizzazioni
Transcript
1 26 febbraio 2016 EMA/137488/2016 EMA conferma le raccomandazioni per minimizzare il rischio di PML, un infezione del cervello, in seguito a utilizzo di Tysabri Più frequenti scansioni di Risonanza Magnetica (RM), devono essere considerate per i pazienti a più alto rischio. EMA ha completato la sua revisione sul rischio conosciuto di leucoencefalopatia multifocale progressiva (PML) con l uso del medicinale per la sclerosi multipla Tysabri (natalizumab) e ha confermato le iniziali raccomandazioni 1 allo scopo di minimizzare il rischio. La PML è una rara infezione del cervello causata dal virus John Cunningham (JC). Questo virus è molto comune nella popolazione generale ed è normalmente innocuo; tuttavia, può portare a PML in persone il cui sistema immunitario è indebolito. I sintomi più comuni di PML sono debolezza progressiva, difficoltà del linguaggio e della comunicazione, disturbi visivi, e, talvolta, cambiamenti di umore o di comportamento. La PML è una condizione molto grave che può esitare in grave disabilità o morte. Studi recenti suggeriscono che la diagnosi precoce e il trattamento della PML quando la malattia è asintomatica (essa è ancora nelle fasi iniziali e non mostra sintomi) possono migliorare la prognosi dei pazienti. Casi asintomatici di PML possono essere rilevati con la Risonanza Magnetica (RM) e gli esperti del settore della risonanza magnetica e sclerosi multipla concordano sul fatto che i protocolli di RM semplificati (atti a consentire procedure più brevi, e anche limitare il carico per i pazienti sottoposti a scansioni) consentono l'identificazione delle lesioni PML. Tutti i pazienti che assumono Tysabri devono essere sottoposti a scansioni complete di RM, almeno una volta all'anno, ma sulla base dei nuovi dati, EMA ora raccomanda che per i pazienti a più alto rischio di PML, devono essere considerate scansioni più frequenti di RM (ad esempio ogni 3 o 6 mesi) eseguite utilizzando protocolli semplificati. Se si scoprono lesioni suggestive di PML, il protocollo RM deve essere esteso per includere 'sequenze T1 pesate mediante RM e potenziate con mezzo di contrasto', e deve essere considerato il test del liquido spinale per la presenza del virus JC. Nuovi dati provenienti da ampi studi clinici suggeriscono anche che, nei pazienti che non sono stati trattati con immunosoppressori (farmaci che riducono l attività del Sistema Immunitario) prima di iniziare Tysabri, il livello nel sangue di anticorpi contro il virus JC ('indice anticorpale') è correlato con il livello di rischio per la PML. Alla luce delle nuove evidenze, i pazienti sono considerati a più alto rischio di sviluppare PML se: sono risultati positivi per il virus JC, e 1 Raccomandazioni PRAC emesse in data 11 febbraio 2016
2 sono stati trattati con Tysabri per più di 2 anni, e o hanno utilizzato un immunosoppressore prima di iniziare Tysabri, o non hanno utilizzato immunosoppressori e hanno un alto indice anticorpale di JC virus. In questi pazienti, il trattamento con Tysabri deve essere continuato solo se i benefici superano i rischi. Se si sospetta una PML in qualsiasi momento, il trattamento con Tysabri deve essere sospeso fino a quando la PML sia stata esclusa. Le raccomandazioni di EMA si basano su un primo esame del Comitato di valutazione dei rischi per la farmacovigilanza (PRAC). Le raccomandazioni del PRAC sono state inviate al Comitato per i prodotti medicinali per uso umano (CHMP), che ora li ha confermati e ha emesso il suo parere definitivo. Il parere del CHMP sarà ora inviato alla Commissione Europea per una decisione giuridicamente vincolante valida in tutta l'ue. Informazioni per i pazienti La leucoencefalopatia multifocale progressiva (PML, una grave infezione del cervello) è conosciuta per essere un rischio non comune per i pazienti affetti da sclerosi multipla in trattamento con Tysabri. Le nuove raccomandazioni che sono state emesse, possono facilitare la diagnosi precoce di PML e migliorare i risultati dei pazienti. Il rischio di PML dipende da diversi fattori, ad esempio se avete anticorpi contro il virus JC nel sangue (un segno che siete stati esposti al virus che causa la PML) e quale sia il loro livello, per quanto tempo siete stati in trattamento con Tysabri, e se siete stati trattati o meno con farmaci che deprimono il sistema immunitario prima di iniziare Tysabri. Considerando questi fattori, il vostro medico sarà in grado di consigliarvi riguardo il rischio di sviluppare PML Prima di iniziare il trattamento con Tysabri, e poi regolarmente durante il trattamento, il vostro medico vi farà fare gli esami del sangue per misurare il livello di anticorpi per il virus JC e la risonanza magnetica per monitorare la vostra condizione. Il medico verificherà anche la presenza di segni e sintomi indicativi di PML. Questi test possono essere fatti più spesso se siete considerati ad alto rischio di PML. Se si sospetta una PML, il medico interromperà il trattamento con Tysabri fino a che la PML possa essere esclusa. I sintomi della PML possono essere simili a quelli di un attacco di sclerosi multipla, e includono debolezza progressiva, difficoltà del linguaggio e della comunicazione, problemi di visione, e, talvolta, cambiamenti di umore o di comportamento. Se ritenete che la vostra malattia stia peggiorando, o se notate qualsiasi sintomo nuovo o inusuale durante l'utilizzo di Tysabri e per 6 mesi dopo l'interruzione del Tysabri, rivolgetevi al vostro medico il più presto possibile. Maggiori informazioni sul rischio di PML con Tysabri sono incluse nella Scheda di Allerta per il paziente che vi è stato dato dal vostro medico. E 'importante leggere questa scheda con attenzione. Tenete questa scheda con voi e assicuratevi che il vostro partner o assistente sia a conoscenza del suo contenuto. Se avete domande o dubbi, rivolgetevi al vostro medico, infermiere o farmacista. EMA/137488/2016 Page 2/5
3 Informazioni per gli operatori sanitari I fattori di rischio noti per lo sviluppo di PML in pazienti trattati con Tysabri sono la presenza di anticorpi contro il virus JC, il trattamento con Tysabri per più di due anni, e l'uso precedente di immunosoppressori. I dati raccolti da ampi studi clinici suggeriscono che, nei pazienti senza precedente uso di immunosoppressori, il livello di risposta anticorpale anti-jc virus (indice) sia correlato con il livello di rischio per la PML. Sulla base di questi dati, sono disponibili le stime di rischio per PML 2 aggiornate per i pazienti positivi agli anticorpi anti-jc virus trattati con Tysabri, come indicato nella tabella 1 qui di seguito: Tabella 1: stime di rischio per la PML per pazienti, in pazienti positivi agli anticorpi anti-jc virus* Durata del trattamento con Tysabri Nessun precedente uso di immunosoppressori Indice tra 0.9 Nessun indice Indice 0.9 e 1.5 Indice 1.5 Precedente uso di immunosoppressori 1-12 mesi mesi mesi mesi mesi mesi * da Linea guida per la gestione del Tysabri e informazioni per i medici Le stime del rischio aggiornate sopra riportate dimostrano che il rischio di sviluppare la PML è piccolo, e inferiore a quello precedentemente stimato, a valori di indice di anticorpi uguale 0,9 o meno, e aumentano sostanzialmente nei pazienti con valori di indice uguale o superiore a 1,5 che sono stati trattati con Tysabri per più di 2 anni. Nei pazienti che sono risultati negativi per gli anticorpi anti-jc virus, la stima del rischio di PML rimane invariata a 0,1 per pazienti. Informazioni più dettagliate sulla stratificazione del rischio, la diagnosi e il trattamento della PML saranno incluse nella Linea guida per la gestione del Tysabri e informazioni per i medici. Gli operatori sanitari devono seguire queste raccomandazioni: Prima di iniziare il trattamento con Tysabri, i pazienti e i loro assistenti devono essere informati circa il rischio di PML. I pazienti devono essere istruiti a rivolgersi al medico se pensano che la loro malattia stia peggiorando, o se notano sintomi nuovi o inusuali. Prima di iniziare il trattamento, deve essere disponibile una RM basale (di solito entro 3 mesi) come riferimento, e un test basale degli anticorpi anti-jcv deve essere effettuato per sostenere la stratificazione del rischio di PML 2 Le stime di rischio per la PML sono state ottenute usando il metodo delle tavole di sopravvivenza sulla base dei dati ottenuti nella coorte riunita di pazienti che hanno partecipato agli studi clinici denominati rispettivamente: STRATIFY-2, TOP, TYGRIS, and STRATA. Un ulteriore stratificazione del richio di PML rispetto all indice degli anticorpi contro il virus JC per I pazienti che non avevano usato precedentemente immunosoppressori è stata ottenuta combimando il richio totale per anno con la distribuzione dell indice anticorpale. EMA/137488/2016 Page 3/5
4 Durante il trattamento con Tysabri, i pazienti devono essere monitorati ad intervalli regolari per segni e sintomi di una nuova disfunzione neurologica, e almeno una volta all'anno deve essere eseguita una risonanza magnetica cerebrale completa per tutta la durata del trattamento. Per i pazienti ad alto rischio di PML, devono essere considerate risonanze magnetiche più frequenti (ad esempio ogni 3-6 mesi) con un protocollo abbreviato (ad esempio FLAIR, T2-pesato e DW imaging). Una diagnosi precoce di PML in pazienti asintomatici è associata a prognosi migliori di PML. La PML deve essere considerata nella diagnosi differenziale di ogni paziente con sintomi neurologici e/o nuove lesioni cerebrali alla risonanza magnetica. Sono stati riportati casi asintomatici di PML la cui diagnosi si è basata sulla risonanza magnetica e la positività per DNA del virus JC nel liquido cerebrospinale. Se si sospetta una PML, il protocollo di RM deve essere esteso per includere sequenze T1 pesate mediante RM potenziate con mezzo di contrato e deve essere considerato il test del liquido cerebrospinale per la presenza di DNA del virus JC utilizzando PCR ultrasensibile. Se si sospetta una PML in qualsiasi momento, il trattamento con Tysabri deve essere sospeso fino a quando la PML non sia stata esclusa. Il test degli anticorpi Anti-JC virus deve essere effettuato ogni 6 mesi nei pazienti anticorponegativi. I pazienti che hanno bassi valori di indice e senza storia di precedente uso di immunosoppressori devono essere testati ogni 6 mesi una volta che raggiungono i 2 anni di trattamento. Dopo 2 anni di trattamento, i pazienti devono essere informati di nuovo sul rischio di PML con Tysabri I pazienti e i i loro assistenti devono essere avvisati di continuare ad essere vigili circa il rischio di PML fino a 6 mesi dopo l'interruzione del Tysabri Maggiori informazioni sul medicinale Tysabri è un medicinale utilizzato per trattare pazienti adulti con sclerosi multipla (SM) altamente attiva, una patologia del sistema nervoso centrale in cui l infiammazione distrugge la guaina protettiva delle cellule nervose. Tysabri è utilizzato nella forma di SM nota come remittente-recidivante in cui il paziente presenta ricadute (recidive) intervallate da periodi di assenza dei sintomi (remissioni). E impiegato quando la patologia non ha risposto al trattamento con interferon beta o con glatiramer acetato (altri tipi di medicinali utilizzati nella SM) o quando è grave e peggiora rapidamente. La sostanza attiva contenuta nel Tysabri, natalizumab, è un anticorpo monoclonale (un tipo di proteina) che è stato formulato per riconoscere e attaccare una parte specifica di una proteina denominata integrina α4β1". Questa proteina si trova sulla superficie di molti leucociti (i globuli bianchi del sangue che sono coinvolti nel processo infiammatorio). Attraverso il blocco dell integrina, natalizumab blocca il passaggio dei leucociti dal sangue al tessuto nervoso, riducendo l infiammazione e il danno nervoso alla base della SM. Tysabri è stato autorizzato nell Unione Europea a Giugno del EMA/137488/2016 Page 4/5
5 Maggiori informazioni sulla procedura. La revisione del Tysabri è iniziata il 7 maggio 2015 su richiesta della Commissione Europea sulla base dell Articolo 20 del Regolamento Comunitario N. 726/2004. La revisione è stata effettuata prima dal Comitato di valutazione dei Rischi per la Farmacovigilanza (Pharmacovigilance Risk Assessment Committee - PRAC), responsabile della valutazione delle questioni di sicurezza relative ai medicinali per uso umano, il quale ha emesso una serie di raccomandazioni. Le raccomandazioni del PRAC sono state poi inviate al Comitato per i Prodotti Medicinali per uso umano (Committee for Medicinal Products for Human Use - CHMP), responsabile delle problematiche relative ai medicinali per uso umano che ha adottato l opinione finale dell Agenzia. L opinione del CHMP sarà ora trasmessa alla Commissione Europea che emetterà una decisione finale giuridicamente vincolante da applicare a tempo debito a tutti gli Stati Membri dell EU. EMA/137488/2016 Page 5/5
L EMA conferma le raccomandazioni per ridurre al minimo il rischio di PML, un infezione cerebrale, associato all uso di Tysabri
 25/04/2016 EMA/266665/2016 L EMA conferma le raccomandazioni per ridurre al minimo il rischio di PML, un infezione cerebrale, associato all uso di Tysabri Per i pazienti a più alto rischio è necessario
25/04/2016 EMA/266665/2016 L EMA conferma le raccomandazioni per ridurre al minimo il rischio di PML, un infezione cerebrale, associato all uso di Tysabri Per i pazienti a più alto rischio è necessario
AIFA Agenzia Italiana del Farmaco Natalizumab (Tysabri)
 AIFA - Natalizumab (Tysabri) 18/02/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Natalizumab (Tysabri) Nota Informativa Importante Del 18 Febbraio 2010 file:///c /documenti/notys120.htm [18/02/2010
AIFA - Natalizumab (Tysabri) 18/02/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Natalizumab (Tysabri) Nota Informativa Importante Del 18 Febbraio 2010 file:///c /documenti/notys120.htm [18/02/2010
Allegato IV. Conclusioni scientifiche
 Allegato IV Conclusioni scientifiche 38 Conclusioni scientifiche Le evidenze scientifiche sulla comparsa della leucoencefalopatia multifocale progressiva (progressive multifocal leukoencephalopathy, PML)
Allegato IV Conclusioni scientifiche 38 Conclusioni scientifiche Le evidenze scientifiche sulla comparsa della leucoencefalopatia multifocale progressiva (progressive multifocal leukoencephalopathy, PML)
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Novembre 2015 TECFIDERA (DIMETILFUMARATO): NUOVE MISURE PER MINIMIZZARE IL RISCHIO DI
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Novembre 2015 TECFIDERA (DIMETILFUMARATO): NUOVE MISURE PER MINIMIZZARE IL RISCHIO DI
TERAPIA DELLA SCLEROSI MULTIPLA
 TERAPIA DELLA SCLEROSI MULTIPLA Alessio Bratina Cosimo Maggiore Il ruolo dell infermiere CENTRI DI SCLEROSI MULTIPLA DEL TRIVENETO Trieste, 10 giugno 2005 TERAPIA CONCETTI GENERALI Terapia della fase acuta
TERAPIA DELLA SCLEROSI MULTIPLA Alessio Bratina Cosimo Maggiore Il ruolo dell infermiere CENTRI DI SCLEROSI MULTIPLA DEL TRIVENETO Trieste, 10 giugno 2005 TERAPIA CONCETTI GENERALI Terapia della fase acuta
NUOVE OPPORTUNITÀ DI TRATTAMENTO: GLI ANTICORPI MONOCLONALI
 NUOVE OPPORTUNITÀ DI TRATTAMENTO: GLI ANTICORPI MONOCLONALI Cosa sono gli anticorpi? Nel nostro organismo, gli anticorpi sono come sentinelle che circolano nel flusso sanguigno, alla ricerca di agenti
NUOVE OPPORTUNITÀ DI TRATTAMENTO: GLI ANTICORPI MONOCLONALI Cosa sono gli anticorpi? Nel nostro organismo, gli anticorpi sono come sentinelle che circolano nel flusso sanguigno, alla ricerca di agenti
I benefici dei contraccettivi ormonali combinati (COC) continuano a
 22 Novembre 2013 EMA/709120/2013 I benefici dei contraccettivi ormonali combinati (COC) continuano a superarne i rischi Informazioni sui medicinali da aggiornare per aiutare le donne a prendere decisioni
22 Novembre 2013 EMA/709120/2013 I benefici dei contraccettivi ormonali combinati (COC) continuano a superarne i rischi Informazioni sui medicinali da aggiornare per aiutare le donne a prendere decisioni
(Note Informative AIFA - EMA)
 FARMACOVIGILANZA Febbraio 2016 SINTESI DEI PIU RECENTI SEGNALI SULLA SICUREZZA DEI FARMACI (Note Informative AIFA - EMA) In questo numero: Fiale di solvente (Lidocaina) distribuite nelle confezioni di
FARMACOVIGILANZA Febbraio 2016 SINTESI DEI PIU RECENTI SEGNALI SULLA SICUREZZA DEI FARMACI (Note Informative AIFA - EMA) In questo numero: Fiale di solvente (Lidocaina) distribuite nelle confezioni di
I medici non devono più prescrivere medicinali contenenti calcitonina in forma di spray nasale per il trattamento dell'osteoporosi.
 20 Luglio 2012 EMA/CHMP/483874/2012 L Agenzia Europea del Medicinali raccomanda la limitazione dell uso a lungo termine di medicinali a base di calcitonina Ritiro della formulazione intranasale per il
20 Luglio 2012 EMA/CHMP/483874/2012 L Agenzia Europea del Medicinali raccomanda la limitazione dell uso a lungo termine di medicinali a base di calcitonina Ritiro della formulazione intranasale per il
AIFA Agenzia Italiana Del Farmaco Natalizumab (Tysabri)
 AIFA - Natalizumab (Tysabri) 21/01/2010 (Livello 2) AIFA Agenzia Italiana Del Farmaco Natalizumab (Tysabri) Comunicato Stampa EMEA FAQ (Domande e Risposte) file:///c /documenti/tysa24.htm [21/01/2010 18.15.06]
AIFA - Natalizumab (Tysabri) 21/01/2010 (Livello 2) AIFA Agenzia Italiana Del Farmaco Natalizumab (Tysabri) Comunicato Stampa EMEA FAQ (Domande e Risposte) file:///c /documenti/tysa24.htm [21/01/2010 18.15.06]
MANIFESTAZIONI NEUROLOGICHE IN CORSO DI INFEZIONE DA HIV
 MANIFESTAZIONI NEUROLOGICHE IN CORSO DI INFEZIONE DA HIV L'HIV è stato isolato nel tessuto cerebrale e nel liquor, edèpresente nel SNC fin dai primi stadi dell'infezione virale generalizzata I disturbi
MANIFESTAZIONI NEUROLOGICHE IN CORSO DI INFEZIONE DA HIV L'HIV è stato isolato nel tessuto cerebrale e nel liquor, edèpresente nel SNC fin dai primi stadi dell'infezione virale generalizzata I disturbi
Il CHMP ha adottato un opinione finale a seguito delle raccomandazioni del PRAC sulla procedura di revisione di Esmya
 Il CHMP ha adottato un opinione finale a seguito delle raccomandazioni del PRAC sulla procedura di revisione di Esmya Budapest, Ungheria 1 giugno 2018 Gedeon Richter Plc. ha annunciato oggi che a seguito
Il CHMP ha adottato un opinione finale a seguito delle raccomandazioni del PRAC sulla procedura di revisione di Esmya Budapest, Ungheria 1 giugno 2018 Gedeon Richter Plc. ha annunciato oggi che a seguito
AIFA Agenzia Italiana del Farmaco Octagam (Immunoglobulina Normale Umana)
 Immunoglobulina Normale Umana (Octagam) 24/09/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Octagam (Immunoglobulina Normale Umana) Comunicato EMA Del 24 Settembre 2010 Domande e Risposte (FAQ) file:///c
Immunoglobulina Normale Umana (Octagam) 24/09/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Octagam (Immunoglobulina Normale Umana) Comunicato EMA Del 24 Settembre 2010 Domande e Risposte (FAQ) file:///c
INTESTAZIONE SINGOLA STRUTTURA
 Pag. 1 di 15 ----------INTESTAZIONE SINGOLA STRUTTURA -------- Foglio informativo e consenso all uso terapeutico di NATALIZUMAB (TYSABRI) nella Sclerosi Multipla Recidivante Remittente. Gentile Signore/a,
Pag. 1 di 15 ----------INTESTAZIONE SINGOLA STRUTTURA -------- Foglio informativo e consenso all uso terapeutico di NATALIZUMAB (TYSABRI) nella Sclerosi Multipla Recidivante Remittente. Gentile Signore/a,
PILLOLE DI FARMACOVIGILANZA
 PILLOLE DI FARMACOVIGILANZA NUMERO 6/MAGGIO 2015 Farmacovigilanza Insieme delle attività il cui obiettivo è quello di fornire, in modo continuativo, le migliori informazioni possibili sulla sicurezza dei
PILLOLE DI FARMACOVIGILANZA NUMERO 6/MAGGIO 2015 Farmacovigilanza Insieme delle attività il cui obiettivo è quello di fornire, in modo continuativo, le migliori informazioni possibili sulla sicurezza dei
AIFA Agenzia Italiana Del Farmaco Becaplermina (Regranex)
 AIFA - Becaplermina (Regranex) 19/02/2010 (Livello 2) AIFA Agenzia Italiana Del Farmaco Becaplermina (Regranex) Comunicato Stampa EMEA Domande e Risposte (FAQ) file:///c /documenti/reg1571.htm [19/02/2010
AIFA - Becaplermina (Regranex) 19/02/2010 (Livello 2) AIFA Agenzia Italiana Del Farmaco Becaplermina (Regranex) Comunicato Stampa EMEA Domande e Risposte (FAQ) file:///c /documenti/reg1571.htm [19/02/2010
VEDOLIZUMAB PIONIERE DI UNA NUOVA CLASSE
 Le Malattie infiammatorie croniche intestinali (MICI) Tra appropriatezza e sostenibilità VEDOLIZUMAB PIONIERE DI UNA NUOVA CLASSE Dr.ssa Mariangela Mercaldo UOC Controllo Interno di Gestione ASL Caserta
Le Malattie infiammatorie croniche intestinali (MICI) Tra appropriatezza e sostenibilità VEDOLIZUMAB PIONIERE DI UNA NUOVA CLASSE Dr.ssa Mariangela Mercaldo UOC Controllo Interno di Gestione ASL Caserta
L impegno del farmacista nell adozione e monitoraggio del PDTA: l esempio della sclerosi multipla. D. Miceli
 L impegno del farmacista nell adozione e monitoraggio del PDTA: l esempio della sclerosi multipla D. Miceli INTRODUZIONE La SCLEROSI MULTIPLA (SM) è una malattia infiammatoria cronica demielinizzante che
L impegno del farmacista nell adozione e monitoraggio del PDTA: l esempio della sclerosi multipla D. Miceli INTRODUZIONE La SCLEROSI MULTIPLA (SM) è una malattia infiammatoria cronica demielinizzante che
Allegato IV. Conclusioni scientifiche
 Allegato IV Conclusioni scientifiche 57 Conclusioni scientifiche Il 7 giugno 2017, la Commissione europea (CE) è stata informata di un caso con esito mortale di insufficienza epatica fulminante in un paziente
Allegato IV Conclusioni scientifiche 57 Conclusioni scientifiche Il 7 giugno 2017, la Commissione europea (CE) è stata informata di un caso con esito mortale di insufficienza epatica fulminante in un paziente
Allegato IV. Conclusioni scientifiche
 Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Da quando è stata concessa l autorizzazione all immissione in commercio di Esmya sono stati riportati quattro casi di gravi lesioni epatiche
Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Da quando è stata concessa l autorizzazione all immissione in commercio di Esmya sono stati riportati quattro casi di gravi lesioni epatiche
Nuovo testo delle informazioni sul prodotto estratti dalle raccomandazioni del PRAC in merito ai segnali
 12 October 2017 EMA/PRAC/662553/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Nuovo testo delle informazioni sul prodotto estratti dalle raccomandazioni del PRAC in merito ai Adottato nella riunione
12 October 2017 EMA/PRAC/662553/2017 Pharmacovigilance Risk Assessment Committee (PRAC) Nuovo testo delle informazioni sul prodotto estratti dalle raccomandazioni del PRAC in merito ai Adottato nella riunione
FRONTESPIZIO PROTOCOLLO GENERALE
 FRONTESPIZIO PROTOCOLLO GENERALE AOO: REGISTRO: NUMERO: DATA: OGGETTO: ausl_fe Protocollo generale 0001490 10/01/2019 Comunicato EMA su efficacia Omega 3 nella prevenzione delle malattie cardiache SOTTOSCRITTO
FRONTESPIZIO PROTOCOLLO GENERALE AOO: REGISTRO: NUMERO: DATA: OGGETTO: ausl_fe Protocollo generale 0001490 10/01/2019 Comunicato EMA su efficacia Omega 3 nella prevenzione delle malattie cardiache SOTTOSCRITTO
Nuova restrizione nell indicazione e raccomandazioni per il monitoraggio nell uso di Protelos/Osseor (ranelato di stronzio)
 NOTAINFORMATIVAIMPORTANTECONCORDATACONL AGENZIAEUROPEADEIMEDICINALI (EMA)EL AGENZIAITALIANADELFARMACO(AIFA) Marzo2014 Nuovarestrizionenell indicazioneeraccomandazioniperilmonitoraggio nell usodiprotelos/osseor(ranelatodistronzio)
NOTAINFORMATIVAIMPORTANTECONCORDATACONL AGENZIAEUROPEADEIMEDICINALI (EMA)EL AGENZIAITALIANADELFARMACO(AIFA) Marzo2014 Nuovarestrizionenell indicazioneeraccomandazioniperilmonitoraggio nell usodiprotelos/osseor(ranelatodistronzio)
MALATTIA O COREA DI HUNTINGTON George Huntington USA
 MALATTIA O COREA DI HUNTINGTON 1872 George Huntington USA 1850-1916 PATOLOGIA EREDITARIA (autosomica dominante) INCOORDINAZIONE MOTORIA DECLINO COGNITIVO IN ETA MEDIA SINTOMI movimenti intermittenti degli
MALATTIA O COREA DI HUNTINGTON 1872 George Huntington USA 1850-1916 PATOLOGIA EREDITARIA (autosomica dominante) INCOORDINAZIONE MOTORIA DECLINO COGNITIVO IN ETA MEDIA SINTOMI movimenti intermittenti degli
Febbre Periodica con Aftosi, Adenite e Faringite (PFAPA)
 www.printo.it/pediatric-rheumatology/ch_it/intro Febbre Periodica con Aftosi, Adenite e Faringite (PFAPA) Versione 2016 1. CHE COS È LA SINDROME PFAPA 1.1 Che cos è? PFAPA è l acronimo che sta per febbri
www.printo.it/pediatric-rheumatology/ch_it/intro Febbre Periodica con Aftosi, Adenite e Faringite (PFAPA) Versione 2016 1. CHE COS È LA SINDROME PFAPA 1.1 Che cos è? PFAPA è l acronimo che sta per febbri
PILLOLE DI FARMACOVIGILANZA
 PILLOLE DI FARMACOVIGILANZA NUMERO 7/Giugno 2015 Farmacovigilanza Insieme delle attività il cui obiettivo è quello di fornire, in modo continuativo, le migliori informazioni possibili sulla sicurezza dei
PILLOLE DI FARMACOVIGILANZA NUMERO 7/Giugno 2015 Farmacovigilanza Insieme delle attività il cui obiettivo è quello di fornire, in modo continuativo, le migliori informazioni possibili sulla sicurezza dei
1. La sclerosi multipla è una malattia che interessa: a) Il sistema nervoso centrale b) Tutti gli organi c) Non so
 MSKQ2014- Versione A 2014/A Edizione Originale Italiana MSKQ Versione A: Copyright 2009 - Alessandra Solari, Fondazione IRCCS Istituto Neurologico C. Besta, Via Celoria 11, 20133 Milano solari@istituto-besta.it
MSKQ2014- Versione A 2014/A Edizione Originale Italiana MSKQ Versione A: Copyright 2009 - Alessandra Solari, Fondazione IRCCS Istituto Neurologico C. Besta, Via Celoria 11, 20133 Milano solari@istituto-besta.it
Allegato IV. Conclusioni scientifiche
 Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Il 7 giugno 2017, la Commissione europea (CE) è stata informata di un caso mortale di insufficienza epatica fulminante in un paziente trattato
Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Il 7 giugno 2017, la Commissione europea (CE) è stata informata di un caso mortale di insufficienza epatica fulminante in un paziente trattato
Allegato III. Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
AIFA Agenzia Italiana del Farmaco Benfluorex
 AIFA - Benfluorex 18/12/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Benfluorex Comunicato EMEA Domande e Risposte (FAQ) file:///c /documenti/ben950.htm [18/12/2009 15.50.04] 18 December 2009 EMA/CHM/815033/2009
AIFA - Benfluorex 18/12/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Benfluorex Comunicato EMEA Domande e Risposte (FAQ) file:///c /documenti/ben950.htm [18/12/2009 15.50.04] 18 December 2009 EMA/CHM/815033/2009
SPECIALE TYSABRI. Dossier scientifico
 SPECIALE TYSABRI Dossier scientifico ITER DI APPROVAZIONE TERAPIE Per far sì che un nuovo farmaco o una terapia divengano di uso generale, è necessario un rigoroso iter di sperimentazione. Si tratta di
SPECIALE TYSABRI Dossier scientifico ITER DI APPROVAZIONE TERAPIE Per far sì che un nuovo farmaco o una terapia divengano di uso generale, è necessario un rigoroso iter di sperimentazione. Si tratta di
SCLEROSI MULTIPLA: ETIOPATOGENESI, DIAGNOSI, TRATTAMENTO FARMACOLOGICO, LE RICADUTE SULL AMMALATO, SULLA FAMIGLIA E SULLA SOCIETÀ
 CORSO FAD SCLEROSI MULTIPLA: ETIOPATOGENESI, DIAGNOSI, TRATTAMENTO FARMACOLOGICO, LE RICADUTE SULL AMMALATO, SULLA FAMIGLIA E SULLA SOCIETÀ ID ECM: 113620 CREDITI DESTINATARI 12 CREDITI ECM Farmacisti
CORSO FAD SCLEROSI MULTIPLA: ETIOPATOGENESI, DIAGNOSI, TRATTAMENTO FARMACOLOGICO, LE RICADUTE SULL AMMALATO, SULLA FAMIGLIA E SULLA SOCIETÀ ID ECM: 113620 CREDITI DESTINATARI 12 CREDITI ECM Farmacisti
Raccomandazioni del PRAC in merito a segnali per l aggiornamento delle informazioni sul prodotto
 23 April 2015 EMA/PRAC/273910/2015 Pharmacovigilance Risk Assessment Committee Raccomandazioni del PRAC in merito a segnali per l aggiornamento delle informazioni sul prodotto Adottate nella riunione del
23 April 2015 EMA/PRAC/273910/2015 Pharmacovigilance Risk Assessment Committee Raccomandazioni del PRAC in merito a segnali per l aggiornamento delle informazioni sul prodotto Adottate nella riunione del
AIFA - Agenzia Italiana del Farmaco
 Giugno 2013 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Limitazioni all uso di TROBALT (retigabina) il trattamento può comportare
Giugno 2013 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Limitazioni all uso di TROBALT (retigabina) il trattamento può comportare
Ictus Acuto: Fase di Ospedalizzazione (Diagnosi) Ictus Cerebrale: Linee Guida Italiane di Prevenzione e Trattamento
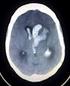 Ictus Acuto: Fase di Ospedalizzazione (Diagnosi) Ictus Cerebrale: Linee Guida Italiane di Prevenzione e Trattamento L'approccio clinico al paziente con sospetto ictus cerebrale che arriva in ospedale deve
Ictus Acuto: Fase di Ospedalizzazione (Diagnosi) Ictus Cerebrale: Linee Guida Italiane di Prevenzione e Trattamento L'approccio clinico al paziente con sospetto ictus cerebrale che arriva in ospedale deve
Meccanismi, diagnosi e trattamento dell epilessia farmaco-resistente
 Meccanismi, diagnosi e trattamento dell epilessia farmaco-resistente Paolo Nichelli 1.identificare quali caratteristiche cliniche di malattia si associano allo sviluppo di EFR e gli outcome cognitivi;
Meccanismi, diagnosi e trattamento dell epilessia farmaco-resistente Paolo Nichelli 1.identificare quali caratteristiche cliniche di malattia si associano allo sviluppo di EFR e gli outcome cognitivi;
RADAR-CNS. Remote Assessment of Disease and Relapse Central Nervous System.
 RADAR-CNS Remote Assessment of Disease and Relapse Central Nervous System www.radar-cns.org Fatti & Cifre RADAR-CNS 22 organizzazioni provenienti da tutta Europa e Stati Uniti Collaborazione Un partenariato
RADAR-CNS Remote Assessment of Disease and Relapse Central Nervous System www.radar-cns.org Fatti & Cifre RADAR-CNS 22 organizzazioni provenienti da tutta Europa e Stati Uniti Collaborazione Un partenariato
ALLEGATO CONCLUSIONI SCIENTIFICHE E MOTIVI DEL RIFIUTO PRESENTATI DALL EMEA
 ALLEGATO CONCLUSIONI SCIENTIFICHE E MOTIVI DEL RIFIUTO PRESENTATI DALL EMEA RIESAME DEL PARERE DEL CHMP DEL 19 LUGLIO 2007 IN MERITO A NATALIZUMAB ELAN PHARMA Nel corso della riunione del luglio 2007,
ALLEGATO CONCLUSIONI SCIENTIFICHE E MOTIVI DEL RIFIUTO PRESENTATI DALL EMEA RIESAME DEL PARERE DEL CHMP DEL 19 LUGLIO 2007 IN MERITO A NATALIZUMAB ELAN PHARMA Nel corso della riunione del luglio 2007,
Allegato I. Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione del Comitato
Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione del Comitato
Protelos/Osseor (ranelato di stronzio): nuove informazioni di sicurezza dall EMEA
 PROTELOS : ATTENZIONE! L'azienda farmaceutica francese Servier è nell occhio del ciclone mediatico nel suo paese e in tutta Europa per un dossier dell'emea, in cui viene accusata di aver "nascosto alle
PROTELOS : ATTENZIONE! L'azienda farmaceutica francese Servier è nell occhio del ciclone mediatico nel suo paese e in tutta Europa per un dossier dell'emea, in cui viene accusata di aver "nascosto alle
Focus on sclerosi multipla: il Farmacista del SSN tra clinica, terapia e
 Focus on sclerosi multipla: il Farmacista del SSN tra clinica, terapia e innovazione Palermo, 7 maggio 2015 Il processo di budget: uno strumento di programmazione nella diversa somministrazione dei farmaci
Focus on sclerosi multipla: il Farmacista del SSN tra clinica, terapia e innovazione Palermo, 7 maggio 2015 Il processo di budget: uno strumento di programmazione nella diversa somministrazione dei farmaci
Revisione della produzione di soluzioni di Baxter per dialisi peritoneale a seguito presenza potenziale di endotossine in alcuni lotti
 21 gennaio 2011 Comunicato Stampa Revisione della produzione di soluzioni di Baxter per dialisi peritoneale a seguito presenza potenziale di endotossine in alcuni lotti Raccomandazioni emanate al fine
21 gennaio 2011 Comunicato Stampa Revisione della produzione di soluzioni di Baxter per dialisi peritoneale a seguito presenza potenziale di endotossine in alcuni lotti Raccomandazioni emanate al fine
SPECIALE TYSABRI Dossier scientifico
 SPECIALE TYSABRI Dossier scientifico LA STORIA DEL NATALIZUMAB Il natalizumab (Tysabri ) è un anticorpo monoclonale oggi approvato sia negli Stati Uniti che in Europa per il trattamento della sclerosi
SPECIALE TYSABRI Dossier scientifico LA STORIA DEL NATALIZUMAB Il natalizumab (Tysabri ) è un anticorpo monoclonale oggi approvato sia negli Stati Uniti che in Europa per il trattamento della sclerosi
DOSSIER Speciale TYSABRI
 DOSSIER Speciale TYSABRI CONTENUTI 1. La storia del natalizumab I primi studi a breve termine Gli studi a lungo termine: AFFIRM e SENTINEL L approvazione dell FDA La notizia della sospensione La posizione
DOSSIER Speciale TYSABRI CONTENUTI 1. La storia del natalizumab I primi studi a breve termine Gli studi a lungo termine: AFFIRM e SENTINEL L approvazione dell FDA La notizia della sospensione La posizione
IMMAGINE 1 Il sale iodato è amico della tiroide! IMMAGINE 2
 IMMAGINE 1 Il sale iodato è amico della tiroide! Lo iodio rappresenta il principale costituente degli ormoni prodotti dalla tiroide e la principale fonte di iodio è l alimentazione che però, spesso, non
IMMAGINE 1 Il sale iodato è amico della tiroide! Lo iodio rappresenta il principale costituente degli ormoni prodotti dalla tiroide e la principale fonte di iodio è l alimentazione che però, spesso, non
La nuova legislazione sulla Farmacovigilanza. Trasparenza e comunicazione nella farmacovigilanza. Carmela Macchiarulo. Roma, 13 settembre 2012
 La nuova legislazione sulla Farmacovigilanza Trasparenza e comunicazione nella farmacovigilanza Carmela Macchiarulo Roma, 13 settembre 2012 Dichiarazione di trasparenza/interessi* Le opinioni espresse
La nuova legislazione sulla Farmacovigilanza Trasparenza e comunicazione nella farmacovigilanza Carmela Macchiarulo Roma, 13 settembre 2012 Dichiarazione di trasparenza/interessi* Le opinioni espresse
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
Allegato I. Conclusioni scientifiche e motivi della modifica dei termini della/e autorizzazione/i all immissione in commercio
 Allegato I Conclusioni scientifiche e motivi della modifica dei termini della/e autorizzazione/i all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della relazione del Comitato di valutazione
Allegato I Conclusioni scientifiche e motivi della modifica dei termini della/e autorizzazione/i all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della relazione del Comitato di valutazione
La Sclerosi Multipla. Patogenesi. La Sclerosi Multipla: La multidisciplinarietà al servizio di una malattia
 La Sclerosi Multipla: La Sclerosi Multipla La multidisciplinarietà al servizio di una malattia Corso di Laurea in Terapia Occupazionale Dott M Mancuso, Dott.ssa Isabella Righini U.O. Neurologia Università
La Sclerosi Multipla: La Sclerosi Multipla La multidisciplinarietà al servizio di una malattia Corso di Laurea in Terapia Occupazionale Dott M Mancuso, Dott.ssa Isabella Righini U.O. Neurologia Università
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 25 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 25 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
DOSSIER Speciale TYSABRI
 DOSSIER Speciale TYSABRI CONTENUTI 1. La storia del natalizumab I primi studi a breve termine Gli studi a lungo termine: AFFIRM e SENTINEL L approvazione dell FDA La notizia della sospensione La posizione
DOSSIER Speciale TYSABRI CONTENUTI 1. La storia del natalizumab I primi studi a breve termine Gli studi a lungo termine: AFFIRM e SENTINEL L approvazione dell FDA La notizia della sospensione La posizione
Antibiotici: AIFA, vieta utilizzo farmaco Acido Pipemidico Eg. Scritto da La Redazione Giovedì 28 Marzo :58
 In attuazione della decisione di esecuzione della Commissione Europea n. 2050 dell'11 marzo 2019 e a seguito della comunicazione della sospensione dell'autorizzazione all'immissione in commercio della
In attuazione della decisione di esecuzione della Commissione Europea n. 2050 dell'11 marzo 2019 e a seguito della comunicazione della sospensione dell'autorizzazione all'immissione in commercio della
Quotidiano.
 Quotidiano 097156 www.ecostampa.it Quotidiano 097156 www.ecostampa.it Quotidiano 097156 www.ecostampa.it Quotidiano 097156 www.ecostampa.it Quotidiano 097156 www.ecostampa.it Corriere della Sera http://www.corriere.it/salute/neuroscienze/13_dicembre_09/diagnosi-sempre-piu-prec...
Quotidiano 097156 www.ecostampa.it Quotidiano 097156 www.ecostampa.it Quotidiano 097156 www.ecostampa.it Quotidiano 097156 www.ecostampa.it Quotidiano 097156 www.ecostampa.it Corriere della Sera http://www.corriere.it/salute/neuroscienze/13_dicembre_09/diagnosi-sempre-piu-prec...
Motivazioni per la variazione dei termini dell autorizzazione/delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini all immissione in commercio Conclusioni scientifiche Tenendo conto della valutazione
Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini all immissione in commercio Conclusioni scientifiche Tenendo conto della valutazione
26 MAGGIO :57
 26 MAGGIO 2015-20:57 Per i pazienti affetti da sclerosi multipla sono importanti i trattamenti personalizzati. Lo ha ricordato la Società italiana di neurologia (Sin) in vista della Giornata Mondiale della
26 MAGGIO 2015-20:57 Per i pazienti affetti da sclerosi multipla sono importanti i trattamenti personalizzati. Lo ha ricordato la Società italiana di neurologia (Sin) in vista della Giornata Mondiale della
FORLÌ-CESENA. Aprile 2018
 RETE @ism FORLÌ-CESENA Aprile 2018 Sommario Raccolta Fondi Solidali tutto l anno con il 45512 Diritti Nuova Pubblicazione INPS - AISM Servizi 30 MAGGIO 2018 : Giornata Mondiale della SCLEROSI MULTIPLA
RETE @ism FORLÌ-CESENA Aprile 2018 Sommario Raccolta Fondi Solidali tutto l anno con il 45512 Diritti Nuova Pubblicazione INPS - AISM Servizi 30 MAGGIO 2018 : Giornata Mondiale della SCLEROSI MULTIPLA
Allegato I. Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Tenendo conto della valutazione del Comitato per
Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Tenendo conto della valutazione del Comitato per
Abseamed (epoetina alfa)
 EMA/552931/2018 EMEA/H/C/000727 Sintesi di Abseamed e perché è autorizzato nell Unione europea (UE) Cos è Abseamed e per cosa si usa? Abseamed è un medicinale usato nei seguenti casi: per trattare l anemia
EMA/552931/2018 EMEA/H/C/000727 Sintesi di Abseamed e perché è autorizzato nell Unione europea (UE) Cos è Abseamed e per cosa si usa? Abseamed è un medicinale usato nei seguenti casi: per trattare l anemia
Il Manuale della PCR
 Il Manuale della PCR Perchè utilizzare la PCR in situazioni cliniche critiche? La PCR rileva una infiammazione sistemica quando non vi sono altri chiari sintomi Determina l estensione della infiammazione
Il Manuale della PCR Perchè utilizzare la PCR in situazioni cliniche critiche? La PCR rileva una infiammazione sistemica quando non vi sono altri chiari sintomi Determina l estensione della infiammazione
Allegato I. Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione delle autorizzazioni all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione
Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione delle autorizzazioni all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione
Numero Luglio 2011
 Numero 119 15 Luglio 2011 Newsletter della Sezione Provinciale del Sindacato dei Medici di Medicina Generale LA SEGRETERIA PROVINCIALE INFORMA a cura di Ivana Garione, Marco Morgando e Aldo Mozzone L'ORDINE
Numero 119 15 Luglio 2011 Newsletter della Sezione Provinciale del Sindacato dei Medici di Medicina Generale LA SEGRETERIA PROVINCIALE INFORMA a cura di Ivana Garione, Marco Morgando e Aldo Mozzone L'ORDINE
Una nuova designazione di Farmaco Orfano per il sirolimus nell anemia falciforme
 Una nuova designazione di Farmaco Orfano per il sirolimus nell anemia falciforme Milano (Italia) 24 gennaio 2018 Rare Partners Srl Impresa Sociale annuncia che la Commissione Europea ha concesso la Designazione
Una nuova designazione di Farmaco Orfano per il sirolimus nell anemia falciforme Milano (Italia) 24 gennaio 2018 Rare Partners Srl Impresa Sociale annuncia che la Commissione Europea ha concesso la Designazione
Morbo di Alzheimer. Demenza senile non segue il normale deterioramento delle strutture cerebrali o dell invecchiamento.
 Morbo di Alzheimer Malattia neurologica a carattere progressivo ed irreversibile associata a specifiche alterazioni cerebrali istologiche e chimiche (placche neuritiche, masse neurofibrillari, distrofie
Morbo di Alzheimer Malattia neurologica a carattere progressivo ed irreversibile associata a specifiche alterazioni cerebrali istologiche e chimiche (placche neuritiche, masse neurofibrillari, distrofie
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
RoActemra. tocilizumab. Che cos è RoActemra? Per che cosa si usa RoActemra? Riassunto destinato al pubblico
 EMA/18167/2014 EMEA/H/C/000955 Riassunto destinato al pubblico tocilizumab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
EMA/18167/2014 EMEA/H/C/000955 Riassunto destinato al pubblico tocilizumab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
L assistenza al post partum Silvia Vaccari
 Presentazione della linea guida Prevenzione e trattamento della emorragia del post partum Sistema nazionale linee guida Roma, 25.09.09 L assistenza al post partum Silvia Vaccari Roma 24 ottobre 2016 Aula
Presentazione della linea guida Prevenzione e trattamento della emorragia del post partum Sistema nazionale linee guida Roma, 25.09.09 L assistenza al post partum Silvia Vaccari Roma 24 ottobre 2016 Aula
Febbre Mediterranea Familiare
 www.printo.it/pediatric-rheumatology/ch_it/intro Febbre Mediterranea Familiare Versione 2016 2. DIAGNOSI E TRATTAMENTO 2.1 Come viene diagnosticata? In genere si segue il seguente approccio: Sospetto clinico:
www.printo.it/pediatric-rheumatology/ch_it/intro Febbre Mediterranea Familiare Versione 2016 2. DIAGNOSI E TRATTAMENTO 2.1 Come viene diagnosticata? In genere si segue il seguente approccio: Sospetto clinico:
Allegato I. Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione/delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione/delle autorizzazioni all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione
Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione/delle autorizzazioni all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione
Allegato II. Conclusioni scientifiche
 Allegato II Conclusioni scientifiche 7 Conclusioni scientifiche Solu-Medrol 40 mg polvere e solvente per soluzione per iniezione (di seguito «Solu-Medrol») contiene metilprednisolone e, come eccipiente,
Allegato II Conclusioni scientifiche 7 Conclusioni scientifiche Solu-Medrol 40 mg polvere e solvente per soluzione per iniezione (di seguito «Solu-Medrol») contiene metilprednisolone e, come eccipiente,
Allegato I. Conclusioni scientifiche e motivazioni per la variazione dei termini della/delle autorizzazione/i all immissione in commercio
 Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini della/delle autorizzazione/i all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione da parte
Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini della/delle autorizzazione/i all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione da parte
Drop out e Patologie Infettive Aspetti clinici e assistenziali
 Evento Formativo Regionale SITD Lazio «Il drop out nel trattamento delle dipendenze patologiche» 6 giugno 2019 Drop out e Patologie Infettive Aspetti clinici e assistenziali Dott.ssa Anna Maria Lupi Dirigente
Evento Formativo Regionale SITD Lazio «Il drop out nel trattamento delle dipendenze patologiche» 6 giugno 2019 Drop out e Patologie Infettive Aspetti clinici e assistenziali Dott.ssa Anna Maria Lupi Dirigente
MALATTIA DI FABRY OPUSCOLO INFORMATIVO IN PAZIENTI CON PATOLOGIA RENALE
 MALATTIA DI FABRY IN PAZIENTI CON PATOLOGIA RENALE OPUSCOLO INFORMATIVO Hai ricevuto questo opuscolo perché il tuo medico sospetta che la tua patologia renale possa essere collegata alla malattia di Fabry,
MALATTIA DI FABRY IN PAZIENTI CON PATOLOGIA RENALE OPUSCOLO INFORMATIVO Hai ricevuto questo opuscolo perché il tuo medico sospetta che la tua patologia renale possa essere collegata alla malattia di Fabry,
LA SCLEROSI MULTIPLA: IL BURDEN COGNITIVO-EMOTIVO
 LA SCLEROSI MULTIPLA: IL BURDEN COGNITIVO-EMOTIVO Marco Rovaris UO Riabilitazione Neuromotoria - Centro Sclerosi Multipla IRCCS Santa Maria Nascente Fondazione Don Gnocchi - Milano la memoria è diminuita,
LA SCLEROSI MULTIPLA: IL BURDEN COGNITIVO-EMOTIVO Marco Rovaris UO Riabilitazione Neuromotoria - Centro Sclerosi Multipla IRCCS Santa Maria Nascente Fondazione Don Gnocchi - Milano la memoria è diminuita,
SPINRAZA. NUSINERSEN Terapia farmacologica: presupposti per il meccanismo d azione, vie di somministrazione
 SPINRAZA NUSINERSEN Terapia farmacologica: presupposti per il meccanismo d azione, vie di somministrazione SSD Farmacia e Farmacologia Clinica IRCCS Burlo Garofolo Dott.ssa Alessandra Maestro Dott. Davide
SPINRAZA NUSINERSEN Terapia farmacologica: presupposti per il meccanismo d azione, vie di somministrazione SSD Farmacia e Farmacologia Clinica IRCCS Burlo Garofolo Dott.ssa Alessandra Maestro Dott. Davide
SCHEDA DI VALUTAZIONE PER L INSERIMENTO DI FARMACI NON PRESENTI NEL PTR NATALIZUMAB
 Presentata da RICHIESTA DI INSERIMENTO IN PTR DI ATC L04AA23 (TYSABRI ) Componente Commissione Prontuario Terapeutico Regionale In data Marzo 2007 Per le seguenti motivazioni (sintesi): Indicato in monoterapia,
Presentata da RICHIESTA DI INSERIMENTO IN PTR DI ATC L04AA23 (TYSABRI ) Componente Commissione Prontuario Terapeutico Regionale In data Marzo 2007 Per le seguenti motivazioni (sintesi): Indicato in monoterapia,
Artrite Reumatoide in remissione : strategia di arresto o di riduzione dei farmaci biologici
 L evoluzione e la prognosi dell Artrite Reumatoide sono considerevolmente migliorate negli ultimi 20 anni. Questo è il risultato di una utilizzazione ampia e precoce del trattamento di fondo convenzionale
L evoluzione e la prognosi dell Artrite Reumatoide sono considerevolmente migliorate negli ultimi 20 anni. Questo è il risultato di una utilizzazione ampia e precoce del trattamento di fondo convenzionale
Nuove misure per minimizzare il rischio di embolia gassosa durante l'applicazione in spray.
 16 novembre 2012 EMA/734886/2012 Comunicato stampa L Agenzia Europea dei Medicinali fornisce nuove raccomandazioni ai chirurghi sull'uso sicuro dei sigillanti a base di fibrina Evicel e Quixil. Nuove misure
16 novembre 2012 EMA/734886/2012 Comunicato stampa L Agenzia Europea dei Medicinali fornisce nuove raccomandazioni ai chirurghi sull'uso sicuro dei sigillanti a base di fibrina Evicel e Quixil. Nuove misure
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
il rapporto sessuale è la via preminente di contagio sono guaribili (eccetto AIDS ed epatite C) se vengono riconosciute il più presto possibile
 LE MALATTIE SESSUALMENTE TRASMESSE il rapporto sessuale è la via preminente di contagio sono guaribili (eccetto AIDS ed epatite C) se vengono riconosciute il più presto possibile alcune possono essere
LE MALATTIE SESSUALMENTE TRASMESSE il rapporto sessuale è la via preminente di contagio sono guaribili (eccetto AIDS ed epatite C) se vengono riconosciute il più presto possibile alcune possono essere
ALLEGATO IV CONCLUSIONI SCIENTIFICHE
 ALLEGATO IV CONCLUSIONI SCIENTIFICHE Conclusioni scientifiche La coinfezione da virus dell epatite В (HBV) e virus dell epatite C (HCV) non è rara, data la sovrapposizione delle modalità di trasmissione.
ALLEGATO IV CONCLUSIONI SCIENTIFICHE Conclusioni scientifiche La coinfezione da virus dell epatite В (HBV) e virus dell epatite C (HCV) non è rara, data la sovrapposizione delle modalità di trasmissione.
13.30 Introduzione al corso Dr.ssa Agnese Fabbri Dr.ssa Ida Paris
 Carcinoma mammario her 2 positivo in fase metastatica: la sequenza terapeutica dall algoritmo alla pratica clinica Hotel Ripa Roma, Roma 15 giugno 2018 Ble & Associates srl id. 5357 numero ecm 227755,
Carcinoma mammario her 2 positivo in fase metastatica: la sequenza terapeutica dall algoritmo alla pratica clinica Hotel Ripa Roma, Roma 15 giugno 2018 Ble & Associates srl id. 5357 numero ecm 227755,
La Sclerosi Multipla si esprime più frequentemente nel sesso femminile?
 Le donne e la SCLEROSI MULTIPLA La Sclerosi Multipla si esprime più frequentemente nel sesso femminile? Il sesso femminile ha un rischio tre volte maggiore rispetto al sesso maschile di ammalarsi di SM.
Le donne e la SCLEROSI MULTIPLA La Sclerosi Multipla si esprime più frequentemente nel sesso femminile? Il sesso femminile ha un rischio tre volte maggiore rispetto al sesso maschile di ammalarsi di SM.
MSKQ2014 - Versione B
 MSKQ2014 - Versione B 2014/B Edizione Originale Italiana MSKQ Versione B: Copyright 2009 - Alessandra Solari, Fondazione IRCCS Istituto Neurologico C. Besta, Via Celoria 11, 20133 Milano solari@istituto-besta.it
MSKQ2014 - Versione B 2014/B Edizione Originale Italiana MSKQ Versione B: Copyright 2009 - Alessandra Solari, Fondazione IRCCS Istituto Neurologico C. Besta, Via Celoria 11, 20133 Milano solari@istituto-besta.it
Modello di Cura (MdC) per le persone affette da Artrite Reumatoide
 Translation into: Completed by: Email: MdC 1 MdC 2 MdC 3 MdC 4 MdC 5 Italian Modello di Cura (MdC) per le persone affette da Artrite Reumatoide Annamaria Iuliano annamariaiuliano@hotmail.it Le persone
Translation into: Completed by: Email: MdC 1 MdC 2 MdC 3 MdC 4 MdC 5 Italian Modello di Cura (MdC) per le persone affette da Artrite Reumatoide Annamaria Iuliano annamariaiuliano@hotmail.it Le persone
PROTOCOLLO DI STUDIO
 Studio Dolaren 2014 PROTOCOLLO DI STUDIO Studio clinico randomizzato e controllato, in aperto, per comparare l efficacia analgesica di percorsi terapeutici effettuati con Ozoile (ozono topico stabilizzato
Studio Dolaren 2014 PROTOCOLLO DI STUDIO Studio clinico randomizzato e controllato, in aperto, per comparare l efficacia analgesica di percorsi terapeutici effettuati con Ozoile (ozono topico stabilizzato
Il disturbo primario del morbo celiaco è l intolleranza al glutine, ad una componente proteica, gliadina, presente nel grano, orzo e segale.
 La malattia celiaca è una condizione infiammatoria della mucosa del piccolo intestino che regredisce in seguito all eliminazione dalla dieta di alimenti contenenti glutine. Il disturbo primario del morbo
La malattia celiaca è una condizione infiammatoria della mucosa del piccolo intestino che regredisce in seguito all eliminazione dalla dieta di alimenti contenenti glutine. Il disturbo primario del morbo
Direttore Dipartimento Farmaceutico Dr. Eduardo Nava
 Farmaci nota 65 Dalla distribuzione diretta alla dpc Dott.ssa Mariachiara Izzo Farmacista Dirigente Coordinamento e Controllo Farmaceutica Territoriale Direttore Dipartimento Farmaceutico Dr. Eduardo Nava
Farmaci nota 65 Dalla distribuzione diretta alla dpc Dott.ssa Mariachiara Izzo Farmacista Dirigente Coordinamento e Controllo Farmaceutica Territoriale Direttore Dipartimento Farmaceutico Dr. Eduardo Nava
Allegato I. Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione del Comitato
Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione del Comitato
REPORT EUROPEO SULLA FARMACOVIGILANZA OTTOBRE 2012
 REPORT EUROPEO SULLA FARMACOVIGILANZA OTTOBRE 2012 COMITATO DI VALUTAZIONE DEI RISCHI PER LA FARMACOVIGILANZA (PHARMACOVIGILANCE RISK ASSESSMENT COMMITTEE: PRAC) Ordine del giorno della riunione tenutasi
REPORT EUROPEO SULLA FARMACOVIGILANZA OTTOBRE 2012 COMITATO DI VALUTAZIONE DEI RISCHI PER LA FARMACOVIGILANZA (PHARMACOVIGILANCE RISK ASSESSMENT COMMITTEE: PRAC) Ordine del giorno della riunione tenutasi
Vivo Deceduto Perso al Follow Up. causa: INFORMAZIONI RELATIVE ALLA FARMACOVIGILANZA. Orticaria: Sì. Mal di testa: Sì. Capogiri: Sì.
 FOLLOW UP I campi contrassegnati con* sono obbligatori. Data valutazione:* / / (gg/mm/aaaa) Stato del paziente* Vivo Deceduto Perso al Follow Up In caso di decesso, indicare: causa: Cause infettive PML
FOLLOW UP I campi contrassegnati con* sono obbligatori. Data valutazione:* / / (gg/mm/aaaa) Stato del paziente* Vivo Deceduto Perso al Follow Up In caso di decesso, indicare: causa: Cause infettive PML
Micaela Robotti Centro Sclerosi Multipla IRCCS Policlinico SanDonato
 Micaela Robotti Centro Sclerosi Multipla IRCCS Policlinico SanDonato Non sempre scegliere la giusta terapia è facile. G.F., un uomo di 38 anni, Si presenta ad una visita neurologica a giugno 2012 con parestesie
Micaela Robotti Centro Sclerosi Multipla IRCCS Policlinico SanDonato Non sempre scegliere la giusta terapia è facile. G.F., un uomo di 38 anni, Si presenta ad una visita neurologica a giugno 2012 con parestesie
FARMACI: EMA, NEL 2012 RICEVUTE 96 RICHIESTE AIC, 59 PARERI POSITIVI CHMP = IL BILANCIO ANNUALE DELL' ATTIVITA' DELL' AGENZIA REGOLATORIA UE
 FARMACI: EMA, NEL 2012 RICEVUTE 96 RICHIESTE AIC, 59 PARERI POSITIVI CHMP = IL BILANCIO ANNUALE DELL' ATTIVITA' DELL' AGENZIA REGOLATORIA UE Roma, 17 apr. (Adnkronos Salute) - L' Agenzia europea dei medicinali
FARMACI: EMA, NEL 2012 RICEVUTE 96 RICHIESTE AIC, 59 PARERI POSITIVI CHMP = IL BILANCIO ANNUALE DELL' ATTIVITA' DELL' AGENZIA REGOLATORIA UE Roma, 17 apr. (Adnkronos Salute) - L' Agenzia europea dei medicinali
West Nile Disease. Situazione epidemiologica. N ottobre 2008 ore 17:00
 West Nile Disease N. 10 2 ottobre 2008 ore 17:00 Situazione epidemiologica 2 Ottobre 2008 La situazione epidemiologica odierna rimane stazionaria rispetto a ieri per quanto riguarda gli esiti di laboratorio
West Nile Disease N. 10 2 ottobre 2008 ore 17:00 Situazione epidemiologica 2 Ottobre 2008 La situazione epidemiologica odierna rimane stazionaria rispetto a ieri per quanto riguarda gli esiti di laboratorio
West Nile Disease. Situazione epidemiologica. N settembre 2008 ore 18:00
 West Nile Disease N. 6 24 settembre 2008 ore 18:00 Situazione epidemiologica 24 Settembre 2008 Ad oggi sono stati segnalati 16 cavalli che hanno avuto sintomatologia clinica riferibile a West Nile disease
West Nile Disease N. 6 24 settembre 2008 ore 18:00 Situazione epidemiologica 24 Settembre 2008 Ad oggi sono stati segnalati 16 cavalli che hanno avuto sintomatologia clinica riferibile a West Nile disease
Il farmacista nel percorso ictus. L attacco ischemico transitorio: «angina del cervello» XXXXXXXXX XXXXXX
 Il farmacista nel percorso ictus L attacco ischemico transitorio: «angina del cervello» XXXXXXXXX XXXXXX Che cos è un TIA? Definizione classica: improvvisa comparsa di segni e/o sintomi riferibili a deficit
Il farmacista nel percorso ictus L attacco ischemico transitorio: «angina del cervello» XXXXXXXXX XXXXXX Che cos è un TIA? Definizione classica: improvvisa comparsa di segni e/o sintomi riferibili a deficit
SCHEDA DI VALUTAZIONE PER L INSERIMENTO DI FARMACI NON PRESENTI NEL PTR
 Approvata nella seduta della del 23.05.07 Presentata da RICHIESTA DI INSERIMENTO IN PTR DI NATALIZUMAB (TYSABRI ) ATC L04AA23 Prof. Giulio Rosati, Direttore della Clinica Neurologica dell Università di
Approvata nella seduta della del 23.05.07 Presentata da RICHIESTA DI INSERIMENTO IN PTR DI NATALIZUMAB (TYSABRI ) ATC L04AA23 Prof. Giulio Rosati, Direttore della Clinica Neurologica dell Università di
Secondo i dati dei registri tumori, il cancro della mammella provoca un quarto di tutti i tumori maligni delle donne.
 RAPPORTO NAZIONALE PASSI 2009 LO SCREENING MAMMOGRAFICO NEL 2009 Secondo i dati dei registri tumori, il cancro della mammella provoca un quarto di tutti i tumori maligni delle donne. L Istituto superiore
RAPPORTO NAZIONALE PASSI 2009 LO SCREENING MAMMOGRAFICO NEL 2009 Secondo i dati dei registri tumori, il cancro della mammella provoca un quarto di tutti i tumori maligni delle donne. L Istituto superiore
ATTIVAZIONE MICROGLIALE NELLE MALATTIE EXTRAPIRAMIDALI: UNO STUDIO PET-[11C]PK11195
![ATTIVAZIONE MICROGLIALE NELLE MALATTIE EXTRAPIRAMIDALI: UNO STUDIO PET-[11C]PK11195 ATTIVAZIONE MICROGLIALE NELLE MALATTIE EXTRAPIRAMIDALI: UNO STUDIO PET-[11C]PK11195](/thumbs/52/28978256.jpg) UNIVERSITA DEGLI STUDI DI MILANO-BICOCCA Facoltà di Medicina e Chirurgia Corso di Laurea Magistrale in Biotecnologie Mediche ATTIVAZIONE MICROGLIALE NELLE MALATTIE EXTRAPIRAMIDALI: UNO STUDIO PET-[11C]PK11195
UNIVERSITA DEGLI STUDI DI MILANO-BICOCCA Facoltà di Medicina e Chirurgia Corso di Laurea Magistrale in Biotecnologie Mediche ATTIVAZIONE MICROGLIALE NELLE MALATTIE EXTRAPIRAMIDALI: UNO STUDIO PET-[11C]PK11195
