TEORIA QUANTISTICA E STRUTTURA ATOMICA
|
|
|
- Gianluca Fabiani
- 8 anni fa
- Visualizzazioni
Transcript
1 TEORIA QUANTISTICA E STRUTTURA ATOMICA Gli argomenti di queste lezioni sono trattati nel Capitolo 7 del testo e nei paragrafi 1, e 3 del Capitolo 8. Non ci sono parti da non considerare. La moderna definizione della struttura atomica è un perfetto esempio dell applicazione del metodo scientifico in cui successive approssimazioni e sviluppo di modelli via via più raffinati ha portato conoscenze attuali. 1. MODELLO PLANETARIO DI RUTHERFORD L atomo è costituito da un nucleo centrale in cui e' la quasi totalità della massa atomica con cariche elementari positive caratteristiche per ogni specie atomica (numero atomico) e da elettroni (carica elementare negativa) ruotanti attorno al nucleo. Struttura essenzialmente vuota: raggio nucleare m raggio atomico m = 1Å Modello in disaccordo con la teoria elettromagnetica classica secondo la quale la luce e' costituita da un campo elettromagnetico oscillante che si propaga nello spazio. L'energia della luce dipende solo dall'ampiezza massima dell'onda e non da frequenza (ν) o lunghezza d'onda (λ). I λ I = ampiezza o intensita' λ = 1/ν Il continuo di energia radiante costituisce lo spettro elettromagnetico (di cui la luce visibile costituisce la piccola parte con 400 < λ < 750 nm). 1
2 La radiazione elettromagnetica è caratterizzata da frequenza (ν), lunghezza d onda (λ), ampiezza (o intensità, o brillantezza). ν λ = c (velocità della luce) Lo spettro della radiazione elettromagnetica è costituito da: ν λ Raggi γ Raggi X Ultravioletto (UV) Visibile Infrarosso (IR) Microonde Radio onde Una carica in moto (l' e) dovrebbe emettere radiazione elettromagnetica (luce) diminuendo il proprio contenuto di energia e quindi il raggio dell'orbita. L' e dovrebbe cadere sul nucleo in un tempo t sec. D altra parte, se gli e fossero considerati stazionari dovrebbero essere attirati dal nucleo secondo la legge di Coulomb: F = q /r. La formulazione della meccanica quantistica (spiegazione della radiazione di corpo nero e dell effetto fotoelettrico) e la legge dell'equivalenza della massa/energia hanno portato alla moderna teoria atomica che supera queste incongruenze. In tale visione la luce si considera costituita da un fascio di particelle, i fotoni, di energia quantizzata (E può assumere solo valori discreti, non continui) pari a E = n h ν (h = costante di Planck = J s, n = numero intero positivo). In tal modo l intensità della radiazione risulta proporzionale al numero di fotoni e non alla loro energia.
3 EFFETTO FOTOELETTRICO Una radiazione incidente su una superficie metallica sotto vuoto provoca emissione di e dalla superficie stessa. Si potrebbe spiegare con la teoria classica:l E dell onda viene utilizzata per strappare l e al metallo. Ci sono però alcune evidenze in disaccordo con la teoria elettromagnetica classica: 1. nessun e viene emesso finché la frequenza della radiazione non supera un valore soglia ν 0. ν 0. l E cinetica degli elettroni aumenta con la frequenza della radiazione. ν 0 3. Aumentando l intensità della radiazione non aumenta l E degli e ma solo il loro numero per unità di tempo. Maggiore intensità di luce di stessa frequenza causa emissione di un maggior numero di elettroni ma con la stessa energia cinetica (maggior numero di fotoni di uguale energia). 3
4 Problema risolto da Einstein nel 1905 ammettendo che la luce sia formata da un fascio di particelle (FOTONI) di energia E = h ν Ogni fotone provoca l espulsione di un fotoelettrone trasferendogli la sua energia. In questo modo si ottengono per i dati sperimentali le opportune risposte: 1. non si ha emissione finché l E del fotone non è uguale all E che lega l e al metallo (E 0 = h ν 0 ). Per diversi metalli si hanno tutte linee parallele la cui pendenza è h.. Se ν > ν 0 la rimanente energia viene utilizzata come energia cinetica degli elettroni emessi. 3. il numero di fotoelettroni per unità di tempo è proporzionale al numero di fotoni: aumentando l intensità della radiazione varia infatti non l energia, ma il numero di fotoni associati. 4
5 . MODELLO QUANTISTICO DELL ATOMO (Atomo di Bohr, 1913) Basato sulla quantizzazione delle E degli e e su una serie di assunzioni (di cui solo la prima e la seconda si riveleranno assolutamente corrette): 1. Per il moto dell elettrone sono permessi solo alcuni stati (stati stazionari) in cui non varia il contenuto di E dell e.. Un elettrone in uno stato stazionario non emette radiazione, ma può solo passare da uno stato stazionario all altro, perdendo o acquistando un quanto di energia hν, pari alla differenza di energia tra gli stati (tale processo è detto transizione elettronica, lo stato ad energia minore è detto stato fondamentale, quelli ad energia superiore sono detti stati eccitati). 3. In ogni stato stazionario l e si muove su un orbita circolare attorno al nucleo. 4. Gli stati permessi sono quelli in cui il momento angolare è un multiplo intero di h/π: m v r = n h / π = n h n = numero quantico principale = 1,, 3. TRATTAZIONE QUANTISTICA DELL ATOMO DI H: sistema costituito da un e e un protone. La forza coulombiana che attrae l e verso il nucleo deve essere uguale alla forza centrifuga: e r = mv r Ma mvr = n h perciò r = nh mv Sostituendo il valore di r nel primo membro della prima equazione: 5
6 e m v n h Da cui: = mv r r = n h me Inserendo i dati: n = 1 r = 0.53Ǻ n = r =.1Ǻ Dalla quantizzazione dei raggi segue la quatizzazione dell E totale del sistema: E = E pot + E cin E pot = - e /r dovuta alla posizione dell e nel campo elettrico del nucleo e E cin = dovuta al moto dell e r E e e = + TOT r r Sostituendo l espressione di r: E TOT = 1 n me h 4 Il modello di Bohr ha permesso di spiegare gli spettri atomici (vedi paragrafo 7.). 6
7 La luce proveniente dal tubo di scarica viene collimata da una fenditura, quindi un prisma separa le varie frequenze che appaiono come righe sulla lastra. L e assorbe energia dall alta tensione e la riemette sotto forma di radiazione elettromagnetica. L e può assorbire solo quanti di energia (hν) che lo facciano passare da uno stato 1 = n E1 1 R Ad un alto con 1 = n E R In cui R è una costante detta costante di Ridberg. La presenza di multipletti (linee spettrali di E molto vicina) fu spiegata mediante ulteriori numeri quantici: 7
8 l = numero quantico angolare, valori permessi: 0, 1,,, n-1 giustificato assumendo ellittica l orbita dell elettrone: l regolerebbe la quantizzazione dell asse minore dell ellisse, n dell asse maggiore. m = numero quantico magnetico, valori permessi: - l 0 + l introdotto per spiegare ulteriori molteplicità nelle linee spettrali osservate in presenza di campo magnetico esterno (effetto Zeeman): si considerò che l e, girando attorno al nucleo genera un campo magnetico che può allinearsi od opporsi al campo esterno. s = numero quantico di spin, valori permessi: ± ½ che doveva tenere conto della possibile rotazione oraria o antioraria dell e su se stesso. Nel modello di Bohr, l e è dunque caratterizzato da 4 numeri quantici: n, l, m, s per i quali vale il Principio di esclusione (Pauli): in un singolo atomo non possono esistere due elettroni che abbiano i 4 numeri quantici uguali. Es: n = 1 l = 0 m = 0 s= ± ½ e n = l = 0 m = 0 s= ± ½ e n = l = 1 m = 1 s= ± 8 e ½ e n = l = 1 m = 0 s= ± ½ e n = l = 1 m =-1 s= ± ½ e Per ogni stato caratterizzato da un certo n ci saranno dunque n e. 8
9 Limiti del Modello di Bohr: 1. L e ha solo stati stazionari di E (VERO). Per ogni transizione E = hn (VERO) 3. mvr = nh/π definisce gli stati di moto permessi (APPROSSIMATO) 4. l e si muove su un orbita attorno al nucleo (FALSO) 5. non spiega esaurientemente gli spettri degli atomi polielettronici 6. non spiega la formazione dei legami chimici La teoria di Bohr è stata abbandonata dopo circa 10 anni ma viene ancora studiata perché costituisce una rappresentazione pittorica efficace. La meccanica ondulatoria, basata sul dualismo onda-particella ha permesso di superare i limiti del modello di Bohr. L osservazione che la diffrazione da parte di una lamina metallica di raggi X (onda elettromagnetica, ma costituita da fotoni) o di elettroni dà risultati analoghi, ha portato a considerare anche questi ultimi come onde. Si può arrivare a tale considerazione anche seguendo la logica del principio di equivalenza massa/energia: E = mc E è massa e la massa è E La materia sembra continua e anche l E sembra continua, Ma la materia è discreta (corpuscolare, fatta di atomi) e anche E è discreta (corpuscolare fatta di fotoni) L E ha anche natura ondulatoria Allora anche la materia è ondulatoria? La risposta è certamente positiva: a tutte le particelle è associata un onda di lunghezza d onda λ = h / p (Relazione di De Broglie) Tutte le particelle hanno proprietà simili alle onde ma la lunghezza d onda di oggetti macroscopici è talmente piccola che non dà luogo a fenomeni rilevanti. 9
10 Le caratteristiche ondulatorie o particellari vengono rivelate dal particolare esperimento effettuato. Una conseguenza del dualismo onda-particella è l abbandono di criteri deterministici per cui si potrebbe misurare contemporaneamente posizione e quantità di moto (ovvero definire l equazione del moto) di una particella subatomica così come si fa nella meccanica classica. Per misurare la posizione di un e è necessario vederlo e, secondo i principi dell ottica, non si può definire la posizione di un oggetto con accuratezza superiore a quella della lunghezza d onda della luce usata per l osservazione. Si introduce un incertezza di misura x. La luce necessaria per osservare un e dovrebbe avere λ piccolissima (l e è piccolissimo!) e poiché λ = h / p, p dovrebbe essere molto grande. Nella collisione una frazione di impulso si trasferirebbe all e generando una variazione (incertezza sul valore originario di impulso dell e), p. L incertezza complessiva può essere espressa dalla relazione sviluppata da W. Heisenberg: x p h / 4 π HEISENBERG PRINCIPIO DI INDETERMINAZIONE DI Parlare di traiettoria precisa dell e non ha più senso dato che non è determinabile. Nasce così la MECCANICA ONDULATORIA secondo la quale le particelle sono anche onde e le loro leggi del moto vengono espresse da equazioni d onda. 10
11 Un esempio macroscopico di onda è rappresentato dalla vibrazione di una corda. Ponendo come limite il fatto che le estremità della corda non si possano muovere, solo alcune vibrazioni sono permesse: Si definiscono nodi i punti in cui la posizione della corda non varia. Ogni volta che si passa per un nodo la vibrazione cambia fase ( fase +, fase -). La vibrazione in cui i limiti della corda si spostano non è permessa. La vibrazione è quantizzata e la condizione di quantizzazione è: L = n λ Questo genera uno spettro a righe delle vibrazioni analogo a quello degli atomi: L L /3 L 1/ L λ Per l e la condizione limite è che a distanza infinita dal nucleo non c è più interazione tra nucleo ed elettrone, che la velocità dell elettrone è finita e che la funzione che descrive le proprietà ondulatorie dell e (Ψ: FUNZIONE D ONDA) è nulla all infinito. L equazione d onda degli e ci dice quindi quali sono gli stato di moto permessi per gli e. Le funzioni d onda che soddisfano tali stati sono quelle degli stati stazionari. 11
12 Tale equazione d onda può essere scritta, in forma semplificata, come: H Ψ = E Ψ EQUAZIONE DI SCHROEDINGER in cui H (operatore Hamiltoniano) rappresenta un operatore matematico che, applicato ad una funzione Ψ dà un autovalore di E che corrisponde ad uno stato energetico permesso (stato stazionario). H è correlato all E cinetica e all E potenziale dell elettrone. H h δ δ δ = + + Ψ + VΨ m δx δy δz La teoria ondulatoria è una teoria probabilistica: la descrizione del moto dell onda associata all e ci dice quale sarà la probabilità di trovare l e in una data regione di spazio. L e è descritto da una funzione d onda Ψ il cui quadrato, Ψ, rappresenta la probabilità di trovare l e in una data regione. Le zone di massima probabilità saranno le zone di massima densità elettronica e si indicano con il nome di orbitali. Per il singolo orbitale dell atomo di H, la probabilità elettronica può essere rappresentata in diversi modi: come una curva di probabilità in funzione della distanza dal nucleo, come una mappa di cerchi concentrici di uguale probabilità o come una sfera attorno al nucleo. Lo stato fondamentale dell atomo di H è rappresentato da una Ψ che è funzione solo della distanza dal nucleo (r). Per ogni valore di r esiste una superficie, di raggio r, che è il luogo dei punti in cui c è uguale probabilità di trovare l elettrone. 1
13 La massima probabilità per l e dell atomo di H si ha per r = 0.53 Å, che coincide con il raggio dell orbita dell atomo di Bohr. E una coincidenza ma c è una profonda differenza concettuale: nel modello di Bohr l e si trova su un orbita circolare di raggio 0.53Å, nel modello ondulatorio 0.53 Å è solo la distanza dal nucleo a cui è più probabile trovare l e. Riassumendo, nella teoria quantistica: la risoluzione dell equazione di Schroedinger fornisce i valori delle E permessi per gli e e una funzione d onda, Ψ, il cui quadrato è legato alla probabilità di localizzare l e in una data regione di spazio la traiettoria dell e è completamente indeterminata la posizione dell e è nota solo in termini probabilistici come nel caso della quantizzazione delle vibrazioni di una corda (D) le Ψ possono avere delle superfici nodali (3D) attraversando le quali la Ψ cambia fase è l interazione costruttiva (in fase) di due Ψ di e di atomi diversi che genera il legame chimico I numeri quantici di Bohr diventano coefficienti matematici nell espressione di Ψ. Tra essi sussistono le stesse relazioni algebriche della teoria di Bohr. n = 1,, 3. principale (dimensione orbitale, distanza dal nucleo) l = 0, 1,.(n-1) angolare (forma dell orbitale) m = -l 0 +l magnetico (orientamento dell orbitale) s = ±½ spin Ancora una coincidenza, ma solo formale: nella teoria di Bohr ad ogni numero quantico è associata una precisa realtà fisica, nella teoria ondulatoria sono coefficienti numerici di equazioni d onda a cui non si può dare un significato fisico visualizzabile. Vale ancora il Principio di esclusione di Pauli. 13
14 I coefficienti determinano però le forme delle funzioni e le loro orientazioni relative. Se si esprime la Ψ in coordinate polari e la si scompone in parte radiale ed angolare, risulta infatti: Ψ n,l,m (r, θ, φ) = R n,l,m (r) Y l,m (θ, φ) Per convenzione gli orbitali vengono indicati con lettere diverse a seconda del valore di l: l Simbolo Numero di orbitali ( l + 1) dell orbitale 0 s 1 ( m = 0) 1 p 3 (m = -1, 0, 1) d 5 (m = -, -1, 0, 1, ) 3 f 7 (m = - 3, -, -1, 0, 1,, 3) Orbitali di uguale n ed l, ovvero di uguale energia si dicono degeneri. Gli orbitali vengono indicati con il loro simbolo a cui viene premesso il numero quantico principale (ad es. 1s, s, p etc.) In conclusione, la risoluzione dell equazione di Schroedinger dà: E: i valori di E permessi Ψ: una funzione delle coordinate dell e che permette di calcolare la probabilità di trovarlo in una determinata regione (Ψ ) n ed l determinano l energia degli orbitali, m l orientazione relativa. n,inoltre è pari al numero di nodi di Ψ (uno dei nodi è all infinito per la condizione limite imposta). 14
15 15
16 l determina la forma dell orbitale nello spazio: Per l = 1, m = -1, 0, +1 ovvero gli orbitali p x, p y e p z. Per l =, m = -, -1, 0, +1, + ovvero gli orbitali d. 16
17 Atomi polielettronici: il Sistema Periodico I fenomeni chimici sono basati sulle interazioni delle funzioni d onda elettroniche e vengono descritti come interazioni elettriche tra atomi che perdono, acquistano o mettono in comune elettroni. La struttura elettronica è dunque correlata alle proprietà chimiche. Determinanti per le proprietà chimiche sono gli e più esterni (ad energia maggiore) che sono quelli meno fortemente legati al nucleo, sia per l aumento della distanza dal nucleo, sia per l effetto di schermo della carica positiva del nucleo da parte degli e interni. Se si ordinano gli elementi in ordine di numero atomico crescente si manifesta un ordinata replica delle strutture elettroniche esterne che è la base razionale del Sistema Periodico di Mendeleev. E dunque necessario saper costruire la struttura elettronica (l ordinamento dei livelli energetici) degli atomi polielettronici. Negli atomi o ioni idrogenoidi (con 1 solo e), quali H, He +, Li +, Be 3+, la carica nucleare è più alta di quella dell atomo di H (da +1 a +4) e il nucleo attirerà più fortemente l e. Il valore dell E totale calcolato per l atomo di H: E TOT = 1 n me h 4 Conteneva il fattore e derivante dall attrazione di due cariche unitarie +e e e (+1, -1). Ora se la carica nucleare è + (He + ) o + 3 (Li + ) etc. invece del fattore e si avrà, rispettivamente (-1 ) = 4 e (-1 3) = 9. A parità di numeri quantici, l energia degli orbitali sarà dunque decrescente nell ordine Be 3+ < Li + < He + < H. I raggi atomici sono inferiori e inferiore sarà l estensione degli orbitali. Maggiore è la carica nucleare (Z), maggiore sarà la stabilità del sistema e minore l energia degli orbitali. I calcoli risultano perfettamente in accordo con gli spettri atomici. A parità di numero quantico principale per atomi o ioni monoelettronici: 17
18 H -1311kJ/mol He kj/mol Li + quando Z aumenta: E orbitale MINORE Dimensione orbitale MAGGIORE Stabilità MINORE Be 3+ Energia Orbitali Carica Nucleare (Z) dimensione orbitali stabilità sistema Negli atomi polielettronici, oltre all attrazione del nucleo verso gli e, si deve anche tener conto della repulsione interelettronica e della forma degli orbitali. L E pot non è più dovuta solo all attrazione nucleo/elettroni ma ogni e respinge gli altri. Si può immaginare il Principio di esclusione con dovuto alla repulsione interelettronica: due e in uno stesso orbitale tenderanno ad essere diversi (lontani). In prima approssimazione si considera indipendente l attrazione coulombiana verso il nucleo e si aggiunge un fattore di E pot (V) che tenga conto della repulsione interelettronica: E = T 1 + V 1 + T + V + V 1,1 Aumentando il numero di e, questi si disporranno via via in orbitali ad energia crescente (più lontani dal nucleo) ovvero con n crescente. Gli elettroni si disporranno quindi negli orbitali a più bassa E con la massima molteplicità e in base al principio di esclusione. La configurazione elettronica dell He sarà pertanto 1s (due elettroni con spin antiparallelo nell orbitale 1s), quella del Li 1s s, quella del Be 1s s, quella del B 1s s p etc. 18
19 Negli atomi o ioni monoelettronici l energia di orbitali con stesso n è uguale ( per H l energia dell orbitale s è uguale a quella dell orbitale p). Ciò non è più vero nel caso di atomi polielettronici in cui si deve tener conto anche di interazioni repulsive elettrone-elettrone. L orbitale s ha energia diversa (inferiore) da quella dell orbitale p perchè la sua forma è tale che esso penetra maggiormente verso il nucleo (su cui c è un nodo per l orbitale p) e dunque risente di più dell attrazione del nucleo stesso. Inoltre c è un effetto di schermo da parte degli e interni che diminuisce l attrazione nucleo-elettrone. I valori delle energie di orbitali di atomi diversi sono diversi anche a parità di numeri quantici perché è diversa la carica nucleare e quindi il campo elettrico dovuto ad essa. Si parla perciò di carica nucleare effettiva (Z eff ) che è minore di quella nominale proprio a causa dell effetto di schermo degli e interni. 19
20 Ad esempio: atomo Configurazione Z Z eff elettronica He 1s 1.34 Li 1s s Be 1s s Zeff F He Li Be B C N O H n atomico L andamento della carica nucleare effettiva coincide con il completamento di una riga (periodo) del sistema periodico, ovvero con il riempimento di un livello con stesso n. Infine si deve tener conto del Principio di massima molteplicità (regola di Hund): in assenza di campi magnetici esterni gli e si distribuiranno nel massimo numero possibile di orbitali degeneri con spin parallelo. Ad es. la configurazione elettronica esterna dell N (7 e) sarà:1s s p x p y p z Ovvero: p s 1s 0
21 Riassumendo per costruire la configurazione elettronica, ovvero la distribuzione di e negli orbitali si devono seguire i seguenti criteri: 1. E minore. Principio di esclusione 3. Principio di massima molteplicità In generale l ordine di riempimento degli orbitali è: 1s, s, p, 3s, 3p, 4s, 3d, 4p, 5s L E dell orbitale 4s è inferiore a quella degli orbitali 3d a causa della sua maggiore penetrazione verso il nucleo. Alcune eccezioni (ad es. Cr, 4 e, configurazione elettronica esterna 3d 5 4s 1 e non, come aspettato, 3d 4 4s ) a causa della particolare stabilità dei livelli semipieni in cui è minore la repulsione interelettronica. Altre irregolarità sono dovute a fenomeni e principi analoghi: ad es Mn 3d 5 4s. 1
Generalità delle onde elettromagnetiche
 Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
1 3 STRUTTURA ATOMICA
 1 3 STRUTTURA ATOMICA COME SI SPIEGA LA STRUTTURA DELL ATOMO? Secondo il modello atomico di Rutherford e sulla base della fisica classica, gli elettroni dovrebbero collassare sul nucleo per effetto delle
1 3 STRUTTURA ATOMICA COME SI SPIEGA LA STRUTTURA DELL ATOMO? Secondo il modello atomico di Rutherford e sulla base della fisica classica, gli elettroni dovrebbero collassare sul nucleo per effetto delle
Capitolo 8 La struttura dell atomo
 Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
Rappresentazione dell atomo. Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano.
 Rappresentazione dell atomo Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano. Informazioni importanti circa la dimensione dell atomo e la distribuzione della massa
Rappresentazione dell atomo Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano. Informazioni importanti circa la dimensione dell atomo e la distribuzione della massa
Teoria Atomica Moderna. Chimica generale ed Inorganica: Chimica Generale. sorgenti di emissione di luce. E = hν. νλ = c. E = mc 2
 sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
Le Caratteristiche della Luce
 7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA. (Plank Einstein)
 L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
Modelli atomici Modello atomico di Rutheford Per t s d u i diare la t s rutt ttura t a omica Ruth th f or (
 Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford (1871-1937) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio) Rutherford suppose che gli atomi
Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford (1871-1937) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio) Rutherford suppose che gli atomi
ATOMO. Avogadro (1811) Volumi uguali di gas diversi contengono un ugual numero di MOLECOLE (N A =6,022*10 23 )
 ATOMO Democrito IV secolo A.C. (atomos = indivisibile) Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811)
ATOMO Democrito IV secolo A.C. (atomos = indivisibile) Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811)
Comune ordine di riempimento degli orbitali di un atomo
 Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno:
 La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno: Vedi documento Atomo di Bohr.pdf sul materiale didattico per la derivazione di queste equazioni Livelli Energetici dell Atomo di Idrogeno
La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno: Vedi documento Atomo di Bohr.pdf sul materiale didattico per la derivazione di queste equazioni Livelli Energetici dell Atomo di Idrogeno
L atomo di Bohr e i raggi X
 L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica
 ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
L atomo. Il neutrone ha una massa 1839 volte superiore a quella dell elettrone. 3. Le particelle fondamentali dell atomo
 L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
Struttura Elettronica degli Atomi Meccanica quantistica
 Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Atomo. Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale)
 Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano
Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano
mvr = n h e 2 r = m v 2 e m r v = La configurazione elettronica r = e 2 m v 2 (1) Quantizzazione del momento angolare (2) 4 πε.
 La configurazione elettronica Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica F = m a. F Coulomb = 1 4 πε. q q ' F r centrifuga = m v r ε =8.85*10-1 Fm-1 (costante
La configurazione elettronica Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica F = m a. F Coulomb = 1 4 πε. q q ' F r centrifuga = m v r ε =8.85*10-1 Fm-1 (costante
STRUTTURA ATOMICA. Per lo studio della struttura dell atomo ci si avvale della Spettroscopia.
 STRUTTURA ATOMICA Il modello planetario dell atomo secondo Rutherford si appoggia sulla meccanica classica. Il modello non può essere corretto visto che per descrivere il comportamento delle particelle
STRUTTURA ATOMICA Il modello planetario dell atomo secondo Rutherford si appoggia sulla meccanica classica. Il modello non può essere corretto visto che per descrivere il comportamento delle particelle
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE
 LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
La Teoria dei Quanti e la Struttura Elettronica degli Atomi. Capitolo 7
 La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
- Dati sperimentali: interazione luce / materia spettri caratteristici
 - Thomson: evidenza sperimentale per elettrone misura e/m e - Millikan: misura la carica dell elettrone e ne ricava la massa e = 1,60 x 10-19 C - Rutherford: stima le dimensioni atomiche struttura vuota
- Thomson: evidenza sperimentale per elettrone misura e/m e - Millikan: misura la carica dell elettrone e ne ricava la massa e = 1,60 x 10-19 C - Rutherford: stima le dimensioni atomiche struttura vuota
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE
 LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton)
 Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
A Z. L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone. +1e e.
 L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone +1e 0-1e e = Carica elettrica elementare 1.60 10-19 u.m.a.= Unità di Massa Atomica 1.6605 10-4 Il Nuclide A Z Nu Coulomb
L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone +1e 0-1e e = Carica elettrica elementare 1.60 10-19 u.m.a.= Unità di Massa Atomica 1.6605 10-4 Il Nuclide A Z Nu Coulomb
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO
 La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
Corso di CHIMICA LEZIONE 2
 Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
Teoria Atomica di Dalton
 Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
La struttura dell atomo
 La Teoria Atomica La struttura dell atomo 10-10 m 10-14 m Proprietà delle tre particelle subatomiche fondamentali Carica Massa Nome (simbolo) relativa assoluta (C) relativa (uma)* Assoluta (g) Posizione
La Teoria Atomica La struttura dell atomo 10-10 m 10-14 m Proprietà delle tre particelle subatomiche fondamentali Carica Massa Nome (simbolo) relativa assoluta (C) relativa (uma)* Assoluta (g) Posizione
Modello atomico ad orbitali e numeri quantici
 Modello atomico ad orbitali e numeri quantici Il modello atomico di Bohr permette di scrivere correttamente la configurazione elettronica di un atomo ma ha dei limiti che sono stati superati con l introduzione
Modello atomico ad orbitali e numeri quantici Il modello atomico di Bohr permette di scrivere correttamente la configurazione elettronica di un atomo ma ha dei limiti che sono stati superati con l introduzione
STRUTTURA DELL'ATOMO
 STRUTTURA DELL'ATOMO IDROGENO 1 H ELIO He 1 2 4 Modello planetario di Rutherford -protoni e neutroni costituiscono il nucleo in cui è concentrata tutta la massa - gli elettroni ruotano attorno al nucleo
STRUTTURA DELL'ATOMO IDROGENO 1 H ELIO He 1 2 4 Modello planetario di Rutherford -protoni e neutroni costituiscono il nucleo in cui è concentrata tutta la massa - gli elettroni ruotano attorno al nucleo
Il modello di Bohr. Lezioni d'autore di Giorgio Benedetti
 Il modello di Bohr Lezioni d'autore di Giorgio Benedetti VIDEO Gli spettri di emissione Nel 1859 il fisico G.R. Kirchoff scoprì che ogni elemento chimico presenta uno spettro di emissione caratteristico,
Il modello di Bohr Lezioni d'autore di Giorgio Benedetti VIDEO Gli spettri di emissione Nel 1859 il fisico G.R. Kirchoff scoprì che ogni elemento chimico presenta uno spettro di emissione caratteristico,
L atomo di Bohr. Argomenti. Al tempo di Bohr. Spettri atomici 19/03/2010
 Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
the power of ten Prof.ssa Patrizia Gallucci
 https://www.youtube.com/watch?v=5ckd0apswe8 the power of ten Prof.ssa Patrizia Gallucci ESPERIMENTO DI RUTHEFORD Dopo l esperimento Rutheford ipotizzò un atomo con un nucleo centrale,formato da neutroni
https://www.youtube.com/watch?v=5ckd0apswe8 the power of ten Prof.ssa Patrizia Gallucci ESPERIMENTO DI RUTHEFORD Dopo l esperimento Rutheford ipotizzò un atomo con un nucleo centrale,formato da neutroni
Il metodo scientifico
 Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Unità 2. La teoria quantistica
 Unità 2 La teoria quantistica L'effetto fotoelettrico Nel 1902 il fisico P. Lenard studiò l'effetto fotoelettrico. Esso è l'emissione di elettroni da parte di un metallo su cui incide un'onda elettromagnetica.
Unità 2 La teoria quantistica L'effetto fotoelettrico Nel 1902 il fisico P. Lenard studiò l'effetto fotoelettrico. Esso è l'emissione di elettroni da parte di un metallo su cui incide un'onda elettromagnetica.
Il principio di indeterminazione di Heisenberg
 Il principio di indeterminazione di Heisenberg Il prodotto degli errori nella determinazione contemporanea della quantità di moto (q = mv) e della posizione di un corpo in movimento è almeno uguale a h
Il principio di indeterminazione di Heisenberg Il prodotto degli errori nella determinazione contemporanea della quantità di moto (q = mv) e della posizione di un corpo in movimento è almeno uguale a h
COMPORTAMENTO DUALISTICO della MATERIA
 COMPORTAMENTO DUALISTICO della MATERIA Come la luce anche la materia assume comportamento dualistico. Equazione di De Broglie: λ = h/mv Per oggetti macroscopici la lunghezza d onda è così piccola da non
COMPORTAMENTO DUALISTICO della MATERIA Come la luce anche la materia assume comportamento dualistico. Equazione di De Broglie: λ = h/mv Per oggetti macroscopici la lunghezza d onda è così piccola da non
ATOMI E PARTICELLE SUBATOMICHE
 ATOMI E PARTICELLE SUBATOMICHE ELETTRICITÀ DELL ATOMO ESISTONO DUE TIPI DI CARICHE ELETTRICHE, DENOMINATE CONVENZIONALMENTE NEGATIVA E POSITIVA CARICHE DI SEGNO UGUALE SI RESPINGONO, MENTRE CARICHE DI
ATOMI E PARTICELLE SUBATOMICHE ELETTRICITÀ DELL ATOMO ESISTONO DUE TIPI DI CARICHE ELETTRICHE, DENOMINATE CONVENZIONALMENTE NEGATIVA E POSITIVA CARICHE DI SEGNO UGUALE SI RESPINGONO, MENTRE CARICHE DI
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA
 LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
Introduzione al corso. Cenni storici ed evidenze sperimentali determinanti lo sviluppo della fisica atomica come la conosciamo ora...
 Introduzione al corso Cenni storici ed evidenze sperimentali determinanti lo sviluppo della fisica atomica come la conosciamo ora... Legge di Boyle (1662)-> La pressione di un gas cresce quando decresce
Introduzione al corso Cenni storici ed evidenze sperimentali determinanti lo sviluppo della fisica atomica come la conosciamo ora... Legge di Boyle (1662)-> La pressione di un gas cresce quando decresce
STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA
 pg 1 STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA Per capire il comportamento degli atomi dobbiamo studiare il comportamento dei suoi elettroni L'atomo e le sue particelle NON sono direttamente visibili
pg 1 STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA Per capire il comportamento degli atomi dobbiamo studiare il comportamento dei suoi elettroni L'atomo e le sue particelle NON sono direttamente visibili
ATOMO POLIELETTRONICO. Numero quantico di spin m s
 ATOMO POLIELETTRONICO La teoria fisico-matematica che ha risolto esattamente il problema dell atomo di idrogeno non è in grado di descrivere con uguale precisione l atomo polielettronico. Problema: interazioni
ATOMO POLIELETTRONICO La teoria fisico-matematica che ha risolto esattamente il problema dell atomo di idrogeno non è in grado di descrivere con uguale precisione l atomo polielettronico. Problema: interazioni
n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]
![n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm] n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]](/thumbs/92/108343390.jpg) Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
catastrofe ultravioletta
 Fisica moderna Radiazione termica La radiazione termica è l insieme di onde elettromagnetiche che ogni corpo emette per effetto della sua temperatura Un corpo nero è un corpo che assorbe completamente
Fisica moderna Radiazione termica La radiazione termica è l insieme di onde elettromagnetiche che ogni corpo emette per effetto della sua temperatura Un corpo nero è un corpo che assorbe completamente
Prerequisiti Lezione 1. Ripasso
 Prerequisiti Lezione 1 Ripasso Misura di angoli Nel sistema sessagesimale l'angolo completo o angolo giro è suddiviso in 360 spicchi, equivalenti all'unità di misura convenzionale denominata grado sessagesimale,
Prerequisiti Lezione 1 Ripasso Misura di angoli Nel sistema sessagesimale l'angolo completo o angolo giro è suddiviso in 360 spicchi, equivalenti all'unità di misura convenzionale denominata grado sessagesimale,
Lezione n. 19. L equazione. di Schrodinger L atomo. di idrogeno Orbitali atomici. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Nell'atomo l'energia dell'elettrone varia per quantità discrete (quanti).
 4. ORBITALI ATOMICI Energia degli orbitali atomici Nell'atomo l'energia dell'elettrone varia per quantità discrete (quanti). Il diagramma energetico dell'atomo di idrogeno: i livelli (individuati da n)
4. ORBITALI ATOMICI Energia degli orbitali atomici Nell'atomo l'energia dell'elettrone varia per quantità discrete (quanti). Il diagramma energetico dell'atomo di idrogeno: i livelli (individuati da n)
Comunicazioni Docente - Studenti
 Comunicazioni Docente - Studenti 1. Lista di distribuzione: francesco.musiani.chimgenbiotech 2. Scrivere (moderatamente) a: francesco.musiani@unibo.it 3. Avvisi sul sito del docente: https://www.unibo.it/sitoweb/francesco.musiani
Comunicazioni Docente - Studenti 1. Lista di distribuzione: francesco.musiani.chimgenbiotech 2. Scrivere (moderatamente) a: francesco.musiani@unibo.it 3. Avvisi sul sito del docente: https://www.unibo.it/sitoweb/francesco.musiani
Bohr e la struttura dell atomo. Lezioni 11-12
 Bohr e la struttura dell atomo Lezioni 11-12 Onde elettromagnetiche Radiazione Elettromagnetica raggi X e raggi > 10 3 Hz
Bohr e la struttura dell atomo Lezioni 11-12 Onde elettromagnetiche Radiazione Elettromagnetica raggi X e raggi > 10 3 Hz
FISICA delle APPARECCHIATURE per RADIOTERAPIA
 Anno Accademico 2012-2013 Corso di Laurea in Tecniche Sanitarie di Radiologia Medica per Immagini e Radioterapia FISICA delle APPARECCHIATURE per RADIOTERAPIA Marta Ruspa 20.01.13 M. Ruspa 1 ONDE ELETTROMAGNETICHE
Anno Accademico 2012-2013 Corso di Laurea in Tecniche Sanitarie di Radiologia Medica per Immagini e Radioterapia FISICA delle APPARECCHIATURE per RADIOTERAPIA Marta Ruspa 20.01.13 M. Ruspa 1 ONDE ELETTROMAGNETICHE
CORSO DI LAUREA IN OTTICA E OPTOMETRIA
 CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
Risultato: ELABORAZIONE della MECCANICA QUANTISTICA e sua applicazione sistematica ai nuovi fenomeni
 Tra la fine del XIX e inizio del XX secolo una serie di fenomeni non trovano interpretazione adeguata, basata su fisica classica (meccanica, elettromagnetismo, ottica e termodinamica) Essi risultarono
Tra la fine del XIX e inizio del XX secolo una serie di fenomeni non trovano interpretazione adeguata, basata su fisica classica (meccanica, elettromagnetismo, ottica e termodinamica) Essi risultarono
Pinzani, Panero, Bagni Sperimentare la chimica Soluzioni degli esercizi Capitolo 9
 Pinzani, Panero, Bagni Sperimentare la chimica Soluzioni degli esercizi Capitolo 9 Esercizio PAG 198 ES 1 PAG 198 ES 2 PAG 198 ES 3 PAG 198 ES 4 PAG 198 ES 5 PAG 198 ES 6 PAG 198 ES 7 PAG 198 ES 8 PAG
Pinzani, Panero, Bagni Sperimentare la chimica Soluzioni degli esercizi Capitolo 9 Esercizio PAG 198 ES 1 PAG 198 ES 2 PAG 198 ES 3 PAG 198 ES 4 PAG 198 ES 5 PAG 198 ES 6 PAG 198 ES 7 PAG 198 ES 8 PAG
Meccanica quantistica Mathesis 2016 Prof. S. Savarino
 Meccanica quantistica Mathesis 2016 Prof. S. Savarino Quanti Corpo nero: è un oggetto che assorbe tutta la radiazione senza rifletterla. Come una corda legata agli estremi può produrre onde stazionarie
Meccanica quantistica Mathesis 2016 Prof. S. Savarino Quanti Corpo nero: è un oggetto che assorbe tutta la radiazione senza rifletterla. Come una corda legata agli estremi può produrre onde stazionarie
Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole
 Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole Secondo questa teoria l elettrone può essere descritto come fosse un
Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole Secondo questa teoria l elettrone può essere descritto come fosse un
La struttura degli atomi
 1 La struttura degli atomi pg. 298 27-28 31-37 43 47 51-53 55-57 61-62 67(a/h) 68(a/i) La struttura degli atomi e gli andamenti periodici pg.332 1-7 11-15 17-18 27-30 37 40-42 51 Solvay conference, 1927
1 La struttura degli atomi pg. 298 27-28 31-37 43 47 51-53 55-57 61-62 67(a/h) 68(a/i) La struttura degli atomi e gli andamenti periodici pg.332 1-7 11-15 17-18 27-30 37 40-42 51 Solvay conference, 1927
E. SCHRODINGER ( )
 E. SCHRODINGER (1887-1961) Elettrone = onda le cui caratteristiche possono essere descritte con un equazione simile a quella delle onde stazionarie le cui soluzioni, dette funzioni d onda ψ, rappresentano
E. SCHRODINGER (1887-1961) Elettrone = onda le cui caratteristiche possono essere descritte con un equazione simile a quella delle onde stazionarie le cui soluzioni, dette funzioni d onda ψ, rappresentano
La Struttura degli Atomi
 La Struttura degli Atomi!!!!! Perché gli atomi si combinano per formare composti? Perché differenti elementi presentano differenti proprietà? Perché possono essere gassosi, liquidi, solidi, metalli o non-metalli?
La Struttura degli Atomi!!!!! Perché gli atomi si combinano per formare composti? Perché differenti elementi presentano differenti proprietà? Perché possono essere gassosi, liquidi, solidi, metalli o non-metalli?
Ma se dobbiamo trattare l elettrone come un onda occorre una funzione (che dobbiamo trovare) che ne descriva esaurientemente queste proprietà.
 Ma se dobbiamo trattare l elettrone come un onda occorre una funzione (che dobbiamo trovare) che ne descriva esaurientemente queste proprietà. Nell atomo l energia associata ad un elettrone (trascurando
Ma se dobbiamo trattare l elettrone come un onda occorre una funzione (che dobbiamo trovare) che ne descriva esaurientemente queste proprietà. Nell atomo l energia associata ad un elettrone (trascurando
Quarta unità didattica. Disposizione degli elettroni nell atomo
 Quarta unità didattica Disposizione degli elettroni nell atomo Modello atomico di Bohr 1913 L' atomo di Borh consiste in un nucleo di carica positiva al quale ruotano intorno gli elettroni di carica negativa
Quarta unità didattica Disposizione degli elettroni nell atomo Modello atomico di Bohr 1913 L' atomo di Borh consiste in un nucleo di carica positiva al quale ruotano intorno gli elettroni di carica negativa
Lezioni di Meccanica Quantistica
 Luigi E. Picasso Lezioni di Meccanica Quantistica seconda edizione Edizioni ETS www.edizioniets.com Copyright 2015 EDIZIONI ETS Piazza Carrara, 16-19, I-56126 Pisa info@edizioniets.com www.edizioniets.com
Luigi E. Picasso Lezioni di Meccanica Quantistica seconda edizione Edizioni ETS www.edizioniets.com Copyright 2015 EDIZIONI ETS Piazza Carrara, 16-19, I-56126 Pisa info@edizioniets.com www.edizioniets.com
1. La struttura atomica Le particelle subatomiche L atomo, per molti secoli ritenuto indivisibile, è formato da particelle più piccole.
 1. La struttura atomica Le particelle subatomiche L atomo, per molti secoli ritenuto indivisibile, è formato da particelle più piccole. Le particelle fondamentali che costituiscono l atomo sono: Il protone,
1. La struttura atomica Le particelle subatomiche L atomo, per molti secoli ritenuto indivisibile, è formato da particelle più piccole. Le particelle fondamentali che costituiscono l atomo sono: Il protone,
La radiazione elettromagnetica. aumento della frequenza n della radiazione aumento dell energia E della radiazione
 La radiazione elettromagnetica aumento della frequenza n della radiazione aumento dell energia E della radiazione La radiazione elettromagnetica Un onda elettromagnetica è caratterizzata dalla lunghezza
La radiazione elettromagnetica aumento della frequenza n della radiazione aumento dell energia E della radiazione La radiazione elettromagnetica Un onda elettromagnetica è caratterizzata dalla lunghezza
S P E T T R O S C O P I A. Dispense di Chimica Fisica per Biotecnologie Dr.ssa Rosa Terracciano
 S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
Introduzione alla meccanica quantistica. Vincenzo Barone
 Accademia delle Scienze di Torino 9 novembre 2017 Introduzione alla meccanica quantistica Vincenzo Barone barone@to.infn.it Parte I: Le basi della meccanica quantistica (questioni didattiche) Parte II:
Accademia delle Scienze di Torino 9 novembre 2017 Introduzione alla meccanica quantistica Vincenzo Barone barone@to.infn.it Parte I: Le basi della meccanica quantistica (questioni didattiche) Parte II:
La teoria atomistica
 La teoria atomistica Joseph John Thomson Fisico britannico È noto per aver scoperto nel 1897 la particella di carica negativa: l'elettrone Ebbe come studente Rutherford Vinse il Nobel per la fisica nel
La teoria atomistica Joseph John Thomson Fisico britannico È noto per aver scoperto nel 1897 la particella di carica negativa: l'elettrone Ebbe come studente Rutherford Vinse il Nobel per la fisica nel
ATOMI MONOELETTRONICI
 ATOMI MONOELETTRONICI L equazione di Schrödinger per gli atomi contenenti un solo elettrone (atomo di idrogeno, ioni He +, Li 2+ ) può essere risolta in maniera esatta e le soluzioni ottenute permettono
ATOMI MONOELETTRONICI L equazione di Schrödinger per gli atomi contenenti un solo elettrone (atomo di idrogeno, ioni He +, Li 2+ ) può essere risolta in maniera esatta e le soluzioni ottenute permettono
Laurea Magistrale di INGEGNERIA ELETTRONICA (LM-29) a.a , I semestre! Programma del corso di FISICA SUPERIORE! Docente: MAURO PAPINUTTO!
 Laurea Magistrale di INGEGNERIA ELETTRONICA (LM-29) a.a. 2013-14, I semestre Programma del corso di FISICA SUPERIORE Docente: MAURO PAPINUTTO Dipartimento di Fisica Phone: +39 06 4991 4376 Universita`
Laurea Magistrale di INGEGNERIA ELETTRONICA (LM-29) a.a. 2013-14, I semestre Programma del corso di FISICA SUPERIORE Docente: MAURO PAPINUTTO Dipartimento di Fisica Phone: +39 06 4991 4376 Universita`
raggio atomico: raggio del nucleo: cm cm
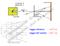 raggio atomico: raggio del nucleo: 10 10 8 1 cm cm Modello di Rutherford: contrasto con la fisica classica perché prima o poi l elettrone avrebbe dovuto cadere sul nucleo irradiando Energia. Le leggi valide
raggio atomico: raggio del nucleo: 10 10 8 1 cm cm Modello di Rutherford: contrasto con la fisica classica perché prima o poi l elettrone avrebbe dovuto cadere sul nucleo irradiando Energia. Le leggi valide
Tabella periodica degli elementi
 Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Seconda parte Teorie atomiche. Configurazione elettronica. Il legame chimico. Prof. Stefano Piotto Università di Salerno
 Seconda parte Teorie atomiche. Configurazione elettronica. Il legame chimico Prof. Stefano Piotto Università di Salerno Seconda parte 1. Teoria atomica 2. Esperimenti di Thompson e Millikan 3. Modello
Seconda parte Teorie atomiche. Configurazione elettronica. Il legame chimico Prof. Stefano Piotto Università di Salerno Seconda parte 1. Teoria atomica 2. Esperimenti di Thompson e Millikan 3. Modello
3. Struttura dell atomo
 Di cosa parleremo L organizzazione interna delle particelle che costituiscono gli atomi è stata oggetto di studio per lungo tempo e le ipotesi sulla struttura atomica si sono evolute nel tempo in base
Di cosa parleremo L organizzazione interna delle particelle che costituiscono gli atomi è stata oggetto di studio per lungo tempo e le ipotesi sulla struttura atomica si sono evolute nel tempo in base
Struttura atomica, configurazione elettronica e periodicità chimica
 Struttura atomica, configurazione elettronica e periodicità chimica Dualismo onda-particella (V. de Broglie) Principio di indeterminazione (W. Heisenberg) Equazione di Shrodinger(1925) Modello quantomeccanico
Struttura atomica, configurazione elettronica e periodicità chimica Dualismo onda-particella (V. de Broglie) Principio di indeterminazione (W. Heisenberg) Equazione di Shrodinger(1925) Modello quantomeccanico
Il modello atomico fino all Ottocento
 Il modello atomico fino all Ottocento Fino a quasi tutto l Ottocento gli atomi vennero considerati, secondo il modello atomico di Dalton, come porzioni di materia indivisibili Il modello, di diretta derivazione
Il modello atomico fino all Ottocento Fino a quasi tutto l Ottocento gli atomi vennero considerati, secondo il modello atomico di Dalton, come porzioni di materia indivisibili Il modello, di diretta derivazione
ESERCIZI W X Y Z. Numero di massa Neutroni nel nucleo Soluzione
 ESERCIZI 1) La massa di un elettrone, rispetto a quella di un protone, è: a. uguale b. 1850 volte più piccola c. 100 volte più piccola d. 18,5 volte più piccola 2) I raggi catodici sono: a. radiazioni
ESERCIZI 1) La massa di un elettrone, rispetto a quella di un protone, è: a. uguale b. 1850 volte più piccola c. 100 volte più piccola d. 18,5 volte più piccola 2) I raggi catodici sono: a. radiazioni
La struttura della materia
 La struttura della materia IL CORPO NERO In fisica, i corpi solidi o liquidi emettono radiazioni elettromagnetiche, a qualsiasi temperatura. Il corpo nero, invece, è un oggetto ideale che assorbe tutta
La struttura della materia IL CORPO NERO In fisica, i corpi solidi o liquidi emettono radiazioni elettromagnetiche, a qualsiasi temperatura. Il corpo nero, invece, è un oggetto ideale che assorbe tutta
Fenomeni quantistici
 Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
2.1 (p. 37) Bohr descrisse un orbitale atomico come una traiettoria circolare seguita dall elettrone. Un orbitale è una
 Capitolo 2 Risposte alle Domande ed esercizi inclusi nel Capitolo 2.1 (p. 37) Bohr descrisse un orbitale atomico come una traiettoria circolare seguita dall elettrone. Un orbitale è una regione di spazio
Capitolo 2 Risposte alle Domande ed esercizi inclusi nel Capitolo 2.1 (p. 37) Bohr descrisse un orbitale atomico come una traiettoria circolare seguita dall elettrone. Un orbitale è una regione di spazio
COMPETENZE ABILITÀ CONOSCENZE. descrivere la. Comprendere ed applicare analogie relative ai concetti presi in analisi. struttura.
 ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
Sulla nascita di questo libro. Introduzione 1
 Indice Sulla nascita di questo libro V Introduzione 1 1 Luce e materia 7 Che cos è veramente la luce? 7 Ma qui che cosa oscilla? 9 Che cosa sono la frequenza e la lunghezza d onda della luce? 11 Che cos
Indice Sulla nascita di questo libro V Introduzione 1 1 Luce e materia 7 Che cos è veramente la luce? 7 Ma qui che cosa oscilla? 9 Che cosa sono la frequenza e la lunghezza d onda della luce? 11 Che cos
CHIMICA: studio della struttura e delle trasformazioni della materia
 CHIMICA: studio della struttura e delle trasformazioni della materia!1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
CHIMICA: studio della struttura e delle trasformazioni della materia!1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
La struttura dell atomo
 La struttura dell atomo raggi catodici (elettroni) raggi canale (ioni positivi) Modello di Thomson Atomo come una piccola sfera omogenea carica di elettricità positiva, nella quale sono dispersi gli elettroni,
La struttura dell atomo raggi catodici (elettroni) raggi canale (ioni positivi) Modello di Thomson Atomo come una piccola sfera omogenea carica di elettricità positiva, nella quale sono dispersi gli elettroni,
Il metodo scientifico
 Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Come sono disposti gli elettroni intorno al nucleo in un atomo?
 Come sono disposti gli elettroni intorno al nucleo in un atomo? La natura ondulatoria della radiazione elettromagnetica e della luce La luce è una radiazione elettromagnetica che si muove nello spazio
Come sono disposti gli elettroni intorno al nucleo in un atomo? La natura ondulatoria della radiazione elettromagnetica e della luce La luce è una radiazione elettromagnetica che si muove nello spazio
LASER. Light Amplification by Stimulated Emission of Radiation. Introduzione. Assorbimento, emissione spontanea, emissione stimolata
 LASER Light Amplification by Stimulated Emission of Radiation Introduzione. Assorbimento, emissione spontanea, emissione stimolata Cenni storici 1900 Max Planck introduce la teoria dei quanti (la versione
LASER Light Amplification by Stimulated Emission of Radiation Introduzione. Assorbimento, emissione spontanea, emissione stimolata Cenni storici 1900 Max Planck introduce la teoria dei quanti (la versione
Lezione n. 13. Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo. di idrogeno. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 13 Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo di idrogeno Antonino Polimeno 1 Radiazione elettromagnetica (1) - Rappresentazione
Chimica Fisica Biotecnologie sanitarie Lezione n. 13 Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo di idrogeno Antonino Polimeno 1 Radiazione elettromagnetica (1) - Rappresentazione
Fisica Moderna e contemporanea
 Fisica Moderna e contemporanea SSIS Puglia Prof. Luigi Schiavulli luigi.schiavulli@ba.infn.it Dipartimento Interateneo di Fisica Michelangelo Merlin 02/02/2006 1 Sommario Quadro riassuntivo sulla Fisica
Fisica Moderna e contemporanea SSIS Puglia Prof. Luigi Schiavulli luigi.schiavulli@ba.infn.it Dipartimento Interateneo di Fisica Michelangelo Merlin 02/02/2006 1 Sommario Quadro riassuntivo sulla Fisica
LIBRETTO DELLE LEZIONI DEL CORSO DI. Fisica quantistica e dello stato solido IMPARTITE DAL PROF. Antonio Polimeni NELL'ANNO ACCADEMICO 2017/2018
 1 UNIVERSITA DEGLI STUDI DI ROMA LA SAPIENZA FACOLTA DI INGEGNERIA LIBRETTO DELLE LEZIONI DEL CORSO DI Fisica quantistica e dello stato solido IMPARTITE DAL PROF. Antonio Polimeni NELL'ANNO ACCADEMICO
1 UNIVERSITA DEGLI STUDI DI ROMA LA SAPIENZA FACOLTA DI INGEGNERIA LIBRETTO DELLE LEZIONI DEL CORSO DI Fisica quantistica e dello stato solido IMPARTITE DAL PROF. Antonio Polimeni NELL'ANNO ACCADEMICO
Fisica Quantistica. 1. Comportamento quantistico. 2. Effetto fotoelettrico. 3. Dualismo onda-corpuscolo. 4. Principio di indeterminazione
 Fisica Quantistica by Prof.ssa Paola Giacconi 1. Comportamento quantistico 2. Effetto fotoelettrico 3. Dualismo onda-corpuscolo 4. Principio di indeterminazione 1. COMPORTAMENTO QUANTISTICO La meccanica
Fisica Quantistica by Prof.ssa Paola Giacconi 1. Comportamento quantistico 2. Effetto fotoelettrico 3. Dualismo onda-corpuscolo 4. Principio di indeterminazione 1. COMPORTAMENTO QUANTISTICO La meccanica
Interferenza di elettroni e! Principio di Indeterminazione
 Interferenza di elettroni e! Principio di Indeterminazione Paolo Pendenza Corso PAS, 10 luglio 2014 Anche nelle scienze non si possono scoprire nuove terre se non si è pronti a lasciarsi indietro il porto
Interferenza di elettroni e! Principio di Indeterminazione Paolo Pendenza Corso PAS, 10 luglio 2014 Anche nelle scienze non si possono scoprire nuove terre se non si è pronti a lasciarsi indietro il porto
Atomi a più elettroni
 Atomi a più elettroni L atomo di elio è il più semplice sistema di atomo a più elettroni. Due sistemi di livelli tra i quali non si osservano transizioni Sistema di singoletto->paraelio Righe singole,
Atomi a più elettroni L atomo di elio è il più semplice sistema di atomo a più elettroni. Due sistemi di livelli tra i quali non si osservano transizioni Sistema di singoletto->paraelio Righe singole,
Problemi con l'atomo. Significato delle righe spettrali. Modello dell'atomo
 Problemi con l'atomo Significato delle righe spettrali Modello dell'atomo Righe spettrali della luce emissione e assorbimento Posizione delle righe spettrali Dipende dall'elemento considerato Per l'idrogeno
Problemi con l'atomo Significato delle righe spettrali Modello dell'atomo Righe spettrali della luce emissione e assorbimento Posizione delle righe spettrali Dipende dall'elemento considerato Per l'idrogeno
FISICA QUANTISTICA LIMITI AL MODELLO ATOMICO DI RUTHERFORD. e - Per spiegare la disposizione degli elettroni nell atomo (STRUTTURA ELETTRONICA)
 LIMITI AL MODELLO ATOMICO DI RUTHERFORD e - + nucleo In base alle leggi della FISICA CLASSICA, una particella carica dotata di un movimento circolare libera energia. Di conseguenza, gli elettroni che,
LIMITI AL MODELLO ATOMICO DI RUTHERFORD e - + nucleo In base alle leggi della FISICA CLASSICA, una particella carica dotata di un movimento circolare libera energia. Di conseguenza, gli elettroni che,
Radiazione e Materia. Insegnamento di Chimica Generale CCS CHI e MAT. Scuola di Ingegneria Industriale e dell Informazione
 Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Radiazione e Materia Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio
Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Radiazione e Materia Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio
