Il metodo scientifico
|
|
|
- Antonietta Rinaldi
- 8 anni fa
- Visualizzazioni
Transcript
1 Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1
2 Leggi ponderali Legge della conservazione della massa (Lavoisier) La massa totale di un sistema reagente non varia Legge delle proporzioni definite (Proust) In qualunque composto il rapporto fra le quantità in peso degli elementi costituenti è definito e costante Legge delle proporzioni multiple (Dalton) Quando due elementi possono combinarsi insieme in rapporti ponderali diversi per dare diversi composti, le quantità di uno di essi che nei vari casi si combina con la medesima quantità dell altro stanno fra loro in rapporti espressi da numeri interi, generalmente piccoli
3 Legge delle proporzioni multiple g di azoto g di ossigeno N O 8 16 N O 8 3 N O N O N O
4 Ipotetico esperimento per verificare l inesattezza concettuale della legge di Lavoisiere La massa di un corpo è una misura del suo contenuto di energia (Einstein). In questo ipotetico esperimento le due batterie sono identiche in ogni dettaglio se non per il fatto che la batteria di sinistra è carica mentre l altra l è scarica. 4
5 Modello atomico Crisi della Fisica Classica Problemi non risolti: Stabilità della dimensione degli atomi Emissione ed assorbimento da parte degli atomi di radiazioni elettromagnetiche caratterizzate da frequenze discrete Effetto fotoelettrico Spettro delle frequenze emesse da un corpo riscaldato 5
6 Modello atomico - Sviluppo storico Modelli Atomici Spettri Atomici Fisica Quantistica Dalton Atomi indivisibili Thomson Particelle subatomiche Rutherford Atomo nucleare Tubi di Crooke Leggi di Faraday Radioattività Bunsen Spettri atomici Rydberg λ spettro H Bohr Orbite permesse Postulato quantizzazione Plank Radiazione corpo nero Teoria dei quanti Einstein Fotoni Effetto fotoelettrico De Broglie Proprietà corpuscolari - ondulatorie dell elettrone Onde stazionarie Principio di Indeterminazione di Heisenberg Schrödinger Numeri quantici Stati energetici Orbitali Probabilità 6
7 Struttura atomica della materia Teoria atomica di Dalton La materia è costituita da atomi indivisibili e indistruttibili Tutti gli atomi di uno stesso elemento hanno la stessa massa e le stesse proprietà chimiche Atomi di elementi diversi hanno masse diverse e proprietà chimiche diverse Gli atomi di elementi diversi si combinano fra loro in rapporti di numeri interi John Dalton ( ) 7
8 Modello atomico di Thomson L atomo è concepito come una sferetta con la massa e la carica positiva uniformemente distribuita,con gli elettroni negativi in numero tale da rendere la struttura complessivamente neutra. Gli elettroni oscillano attorno a posizioni di equilibrio determinate dalle forze di attrazione verso il baricentro delle cariche positive e le forze di repulsione interelettroniche Punti negativi elettroni Nuvola positiva 8
9 Struttura atomica: modello atomico di Rutherford Per interpretare i dati ottenuti inviando particelle α su sottilissime lamine di oro, Rutherford propose un modello atomico che prevedeva un nucleo estremamente piccolo attorno al quale ruotavano uno o più elettroni su orbite molto ampie. 9
10 Modello atomico ( planetario ) di Rutherford Gli atomi sono costituiti da particelle subatomiche, elettroni, protoni, e un ulteriore particella neutra (ipotizzata ma non ancora individuata). Il protone e la particella incognita formano un corpo centrale compatto (nucleo) mentre gli elettroni ruotano attorno al nucleo su orbite circolari o ellittiche (nuvola elettronica). 10
11 Modello atomico di Rutherford Atomi di oro Nucleo dell atomo di oro Particelle α Il modello è incompatibile con le leggi della fisica classica in quanto una particella carica, che non si muove con moto rettilineo uniforme, deve emettere energia sotto forma di radiazioni elettromagnetiche. 11
12 Modello atomico di Rutherford elettroni nucleo Particella sconosciuta protone Rutherford ipotizzò che all interno del nucleo oltre ai protoni vi fosse un secondo tipo di particella neutra (questa particella venne successivamente chiamata neutrone e individuata sperimentalmente nel 193). 1
13 Spettro di emissione del corpo nero Emissione del corpo nero Risultati sperimentali Previsione classica La catastrofe ultravioletta 13
14 Lo spettro del corpo nero emissione secondo le leggi classiche curve sperimentali Secondo le leggi classiche dell elettromagnetismo l emissione è dovuta agli oscillatori elettronici elementari che oscillano con tutte le frequenze emettendo una radiazione corrispondente, di intensità: I κt c = κ = costante di Boltzmann Incongruenza con i dati sperimentali 14
15 Teoria dei Quanti Planck postulò che ogni oscillatore elementare (gli elettroni all interno dell atomo) potesse assorbire o emettere solo quantità di energia che fossero multipli interi di una quantità minima finita, ε, caratteristica di ogni oscillatore; in altre parole l energia poteva essere assorbita o emessa solo per salti successivi di grandezza ε (quantità discrete o quanti). ε = h ν h = costante di Planck ( erg s) ν = frequenza dell oscillatore 15
16 Effetto fotoelettrico Emissione di elettroni da parte di una superfice metallica (ad esempio potassio o sodio) colpita da una radiazione elettromagnetica di opportuna frequenza Osservazioni sperimentali Per ogni metallo esiste una frequenza minima (ν 0 : frequenza di soglia) tale che l effetto si osserva solo per radiazioni aventi ν maggiore di ν 0 L energia cinetica massima degli elettroni emessi è indipendente dall intensità della radiazione incidente, ma dipende da ν Fissata la frequenza, il numero di elettroni emessi è proporzionale all intensità della radiazione incidente 16
17 Interpretazione di Einstein Una radiazione elettromagnetica è costituita da pacchetti elementari (chiamati quanti di luce e successivamente fotoni) ognuno dei quali trasporta quantità di energia pari a E = h ν ; quando un fotone colpisce un atomo gli trasferisce la sua energia e se questa è maggiore dell energia E 0 necessaria per strappare l elettrone meno legato si verifica l espulsione. Quindi si osserva l effetto fotoelettrico quando: h ν E 0 ν E / 0 h La frequenza di soglia viene definita dalla relazione: ν 0 = E / 0 h 17
18 E max = h ν - h ν 0 energia E 0 energia fotone incidente da cui: E max = h ( ν ν 0 ) Legge di Einstein E max Andamento di E max in funzione di ν ν 0 ν 18
19 Massa e quantità di moto di un quanto di luce Sappiamo che: E = m c eguagliando otteniamo: e per la luce: E = h ν m ν c = h ν quindi: m ν = h ν / c massa di un quanto calcoliamo la quantità di moto: p = ν m c ν = (h ν / c ) c = h ν / c e dato che: λ = c/ ν p ν = h / λ λ = h / p ν quantità di moto di un quanto 19
20 Energia cinetica massima dei fotoelettroni emessi da alcuni metalli E cin = E fot -E emis = hν hν 0 E cin = h ( ν ν 0 ) Na Li pendenza = h = J sec
21 Compton (19) 1
22
23 L immagine della coppa è formata da profili facciali di fronte 3
24 Spettri atomici:interazioni delle radiazioni elettromagnetiche con i sistemi atomici e molecolari Verso la metà del 1800 Bunsen iniziò degli studi riguardanti le interazioni delle onde elettromagnetiche con la materia; tali studi vennero successivamente ampliati e razionalizzati ad opera di Balmer, Paschen, Rydberg, etc. I dati sperimentali ottenuti vennero elaborati ottenendo relazioni empiriche che permettevano di descrivere le osservazioni fatte. Tuttavia, non avendo a disposizione un modello atomico accettabile risultava impossibile fornire una interpretazione teorica di questi dati. 4
25 Generalità sulle onde elettromagnetiche λ E max Ampiezza massima: E max (B max ) Lunghezza d onda: λ (nm, Å) Periodo: τ (s) 1 = Frequenza: (s -1 ) Numero d onda: ~ = 1 (cm -1 ) λ ν = c = c = ~ 1 = = c c 5
26 Spettri di emissione e di assorbimento degli atomi Quando un corpo viene riscaldato, ad esempio il filamento di una lampadina, emette radiazioni elettromagnetiche. Se queste radiazioni vengono inviate su di un prisma, questo le separa in funzione delle loro lunghezze d onda (avendo angoli di diffrazione diversi). Se le radiazioni così separate vengono inviate su una lastra fotografica, si ottiene uno spettro continuo, cioè tutte le zone della lastra, corrispondenti ognuna ad una specifica lunghezza d onda, vengono interessate. Al contrario se eccitiamo dei singoli atomi, ad esempio con un arco elettrico, ed andiamo ad analizzare le radiazioni emesse, otteniamo degli spettri a righe (chiamati anche spettri atomici). 6
27 Spettro di emissione dell atomo di idrogeno Spettro a righe Prisma Lastra fotografica Campione Fenditura 7
28 Spettro di emissione dell atomo di idrogeno Serie di Balmer Serie di Lyman Lunghezza d onda (nm) Infrarossi Visibile Ultravioletto n = Serie di Balmer = R H 1 1 n ν R H = cm -1 8
29 Spettro di emissione dell atomo di idrogeno Serie di Balmer Serie di Lyman Lunghezza d onda (nm) Infrarossi Visibile Ultravioletto Equazione di Ridberg ν = R H 1 m m = 1,, 3,, 1 n Serie m n Lyman 1, 3, 4,... Balmer 3, 4, 5,... Paschen 3 4, 5, 6,... Brackett 4 5, 6, 7,... Pfund 5 6, 7, 8,... n = m + 1,, Valida anche per ioni idrogenoidi (He +, Li ++, Be +++, ) 9
30 Modello atomico di Bohr Modifica il modello di Rutherford introducendo due postulati r Leggi della fisica classica applicate all atomo di idrogeno; tra elettrone e nucleo vi è attrazione coulombiana, definita dalla relazione: F = e r e = carica dell elettrone r = raggio dell orbita tale forza di interazione deve rispettare anche la relazione: F = m a m = massa dell elettrone a = accel. centripeta 30
31 dato che: v a cen = r si ha: F = m v r quindi: e r = m v r esplicitando r e ν otteniamo le espressioni: r = e m v ν = e m r In base a queste relazioni il raggio dell orbita è funzione soltanto della velocità e quindi non essendovi limitazioni per questa, anche il raggio può assumere qualsiasi valore 31
32 Analogamente anche per l energia totale dell elettrone non vi sono limitazioni, infatti: E = E cin + E p = 1 mv e r dalla relazione esprimente r otteniamo: mv = e r quindi: E = 1 e r e r = 1 e r 3
33 Primo postulato di Bohr Il valore del momento della quantità di moto dell elettrone ruotante attorno al nucleo deve essere un multiplo intero della quantità h/π + r - v mvr = n h π con n = 1,, 3,.... Questa limitazione, come conseguenza, porta alla quantizzazione del raggio delle orbite e dell energia totale dell elettrone; dall equazione sopra scritta otteniamo: v = n h πrm mentre dalla relazione che ci definisce r otteniamo per la ν la seguente espressione: v = e mr 33
34 Eguagliando le due espressioni si ottiene: n h πrm = e mr elevando al quadrato: n h 4π r m = e mr da cui: r n = n h 4π me Quindi il raggio dell orbita risulta definito da n (numero quantico) 34
35 introducendo i valori numerici delle costanti (h, e, m, π) nella espressione di r n si ottiene: r n = n 0, ( cm) per n = 1 r 1 = 0,59 (A) per n = r = 0,59 =,116 (A) r 1 = 0,59 A viene chiamato primo raggio di Bohr e viene usato come unità di misura della lunghezza per dimensioni atomiche 35
36 Quantizzazione dell energia Sappiamo che: E= 1 Introducendo nella relazione che ci permette di calcolare E l espressione di r n otteniamo: E n e = r e r = 1 e r 1 13,6 ( ev n ) r n = n h 4π me E n = 1 n π me 4 Quindi anche i valori che l energia dell elettrone può assumere dipendono unicamente da n. Sostituendo nella espressione di E i valori delle costanti si ottiene: per n = 1 E 1 = -13,6 ev per n = E = -3,4 ev h 36
37 Secondo postulato di Bohr L atomo emette o assorbe energia sotto forma di radiazioni elettromagnetiche solo quando si hanno delle transizioni, cioè dei passaggi tra stati quantici diversi e quando ciò si verifica l energia corrispondenti alla differenza tra i livelli energetici propri degli stati quantici tra i quali avviene la transizione è emessa o assorbita sotto forma di un singolo fotone E = E n - E n energia del livello di numero quantico n energia del livello di numero quantico n questa energia viene scambiata sotto forma di un singolo fotone E = h ν E n - E n = h ν ν = E n E n' h Legge di Bohr 37
38 Il modello atomico di Bohr: secondo postulato Emissione Spettro E A > E B Energia ν A > ν B λ A < λ B Energia Transizione Frequenza 38
39 Teoria di Bohr dell atomo di idrogeno Grandezze relative delle prime cinque orbite di Bohr per l atomo di idrogeno 39
40 Energia di ionizzazione dell atomo di idrogeno Calcolo dell energia di ionizzazione dell atomo di idrogeno: Energia del livello avente n = EI = E E 1 Energia del livello avente n = 1 Sappiamo che: E n = 1 n π me n 4 Usando i valori delle varie costanti si ottiene: E n = 1 n 13,6 (ev) per per n n = E = 0 = 1 E = 13,6 ev 1 EI = 0 ( 13,6 ) = 13,6 ev 40
41 Modelli molecolari di Bohr per H, O, H O (191). Riprodotti da disegni di Bohr (Memorandum( Memorandum,, estate 191). 41
42 Proprietà ondulatorie della materia: dualismo onda-particella Nel 194 De Broglie postulò che ogni particella in movimento avesse anche proprietà ondulatorie e propose di considerare l elettrone, ruotante attorno al nucleo, come un onda stazionaria Per il fotone abbiamo che: p = mc = ν h λ quindi: λ = h mc Queste relazione erano ritenute valide solo per i fotoni, De Broglie propose di estenderle a qualsiasi particella di massa m in movimento con velocità v: λ = h mv Equazione di De Broglie 4
43 Ipotesi di De Broglie postulato di Bohr Circonferenza π r = n λ 43
44 Applichiamo la relazione di De Broglie al moto dell elettrone attorno al nucleo; affinchè l elettrone possa rimanere in uno stato stazionario deve descrivere un onda stazionaria e quindi la circonferenza dell orbita deve essere un numero intero di lunghezze d onda: n λ = π r quindi dato che: λ = h mv possiamo scrivere: h mv = πr n rielaborando questa uguaglianza otteniamo: mvr = n h π h 1 Postulato di Bohr 44
45 45
46 Dualismo onda particella Radiazione elettromagnetica (luce) Fascio di fotoni Foglio metallico policristallino o cristallo Fascio di elettroni Elettroni 197, Davisson, Germer e Thomson 46
Il metodo scientifico
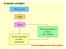 Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Da Newton a Planck. La struttura dell atomo. Da Newton a Planck. Da Newton a Planck. Meccanica classica (Newton): insieme
 Da Newton a Planck Meccanica classica (Newton): insieme La struttura dell atomo di leggi che spiegano il mondo fisico fino alla fine del XIX secolo Prof.ssa Silvia Recchia Quantomeccanica (Planck): insieme
Da Newton a Planck Meccanica classica (Newton): insieme La struttura dell atomo di leggi che spiegano il mondo fisico fino alla fine del XIX secolo Prof.ssa Silvia Recchia Quantomeccanica (Planck): insieme
Struttura Elettronica degli Atomi
 Prof. A. Martinelli Struttura Elettronica degli Atomi Dipartimento di Farmacia 1 La Natura ondulatoria della luce - La luce visibile è una piccola parte dello spettro delle onde elettromagnetiche. 1 La
Prof. A. Martinelli Struttura Elettronica degli Atomi Dipartimento di Farmacia 1 La Natura ondulatoria della luce - La luce visibile è una piccola parte dello spettro delle onde elettromagnetiche. 1 La
IL MODELLO ATOMICO DI BOHR
 IL MODELLO ATOMICO DI BOHR LA LUCE Un valido contributo alla comprensione della struttura dell atomo venne dato dallo studio delle radiazioni luminose emesse dagli atomi opportunamente sollecitati. Lo
IL MODELLO ATOMICO DI BOHR LA LUCE Un valido contributo alla comprensione della struttura dell atomo venne dato dallo studio delle radiazioni luminose emesse dagli atomi opportunamente sollecitati. Lo
May 5, 2013. Fisica Quantistica. Monica Sambo. Sommario
 May 5, 2013 Bohr, Born,, Dirac e Pauli accettano in modo incondizionato la nuova fisica Einstein, De, e pur fornendo importanti contributi alla nuova teoria cercano di ottenere una descrizione CAUSALE
May 5, 2013 Bohr, Born,, Dirac e Pauli accettano in modo incondizionato la nuova fisica Einstein, De, e pur fornendo importanti contributi alla nuova teoria cercano di ottenere una descrizione CAUSALE
Tabella periodica degli elementi
 Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA
 EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
MODELLI ATOMICI. Modello Atomico di Dalton
 MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
LA NATURA DELLA LUCE E IL MODELLO ATOMICO DI BOHR
 LA NATURA DELLA LUCE E IL MODELLO ATOMICO DI BOHR LIMITI DEL MODELLO ATOMICO DI RUTHERFORD Il modello atomico planetario di Ernest Rutherford, seppure rappresentava un grande passo avanti rispetto al modello
LA NATURA DELLA LUCE E IL MODELLO ATOMICO DI BOHR LIMITI DEL MODELLO ATOMICO DI RUTHERFORD Il modello atomico planetario di Ernest Rutherford, seppure rappresentava un grande passo avanti rispetto al modello
PARTICELLE SUBATOMICHE
 MODELLI ATOMICI Il cammino per arrivare alla moderna teoria atomica è stato lungo e complesso: ogni nuova scoperta faceva venire alla luce anche nuovi problemi, che dovevano essere affrontati e risolti;
MODELLI ATOMICI Il cammino per arrivare alla moderna teoria atomica è stato lungo e complesso: ogni nuova scoperta faceva venire alla luce anche nuovi problemi, che dovevano essere affrontati e risolti;
FISICA E LABORATORIO
 Programma di FISICA E LABORATORIO Anno Scolastico 2014-2015 Classe V P indirizzo OTTICO Docente Giuseppe CORSINO Programma di FISICA E LABORATORIO Anno Scolastico 2013-2014 Classe V P indirizzo OTTICO
Programma di FISICA E LABORATORIO Anno Scolastico 2014-2015 Classe V P indirizzo OTTICO Docente Giuseppe CORSINO Programma di FISICA E LABORATORIO Anno Scolastico 2013-2014 Classe V P indirizzo OTTICO
1 3 STRUTTURA ATOMICA
 1 3 STRUTTURA ATOMICA COME SI SPIEGA LA STRUTTURA DELL ATOMO? Secondo il modello atomico di Rutherford e sulla base della fisica classica, gli elettroni dovrebbero collassare sul nucleo per effetto delle
1 3 STRUTTURA ATOMICA COME SI SPIEGA LA STRUTTURA DELL ATOMO? Secondo il modello atomico di Rutherford e sulla base della fisica classica, gli elettroni dovrebbero collassare sul nucleo per effetto delle
Natura della luce. Qualsiasi tipo di onda è caratterizzato da:
 Natura della luce James C. Maxwell (1831-79) dimostrò che tutte le proprietà note della luce erano spiegabili attraverso un insieme di equazioni basate sull ipotesi che la luce fosse un onda elettromagnetica
Natura della luce James C. Maxwell (1831-79) dimostrò che tutte le proprietà note della luce erano spiegabili attraverso un insieme di equazioni basate sull ipotesi che la luce fosse un onda elettromagnetica
Spettrofotometria. Le onde luminose consistono in campi magnetici e campi elettrici oscillanti, fra loro perpendicolari.
 Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
I modelli atomici da Dalton a Bohr
 1 Espansione 2.1 I modelli atomici da Dalton a Bohr Modello atomico di Dalton: l atomo è una particella indivisibile. Modello atomico di Dalton Nel 1808 John Dalton (Eaglesfield, 1766 Manchester, 1844)
1 Espansione 2.1 I modelli atomici da Dalton a Bohr Modello atomico di Dalton: l atomo è una particella indivisibile. Modello atomico di Dalton Nel 1808 John Dalton (Eaglesfield, 1766 Manchester, 1844)
Un altro importante parametro di questo processo è la risoluzione che rappresenta la distanza minima che la litografia può apprezzare.
 TECNICHE LITOGRAFICHE La litografia è un processo basilare nella realizzazione di circuiti integrati,esso consiste nel depositare un materiale detto resist sul wafer da processare che una volta esposto
TECNICHE LITOGRAFICHE La litografia è un processo basilare nella realizzazione di circuiti integrati,esso consiste nel depositare un materiale detto resist sul wafer da processare che una volta esposto
LA MATERIA MATERIA. COMPOSIZIONE (struttura) Atomi che la compongono
 LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
La propagazione delle onde luminose può essere studiata per mezzo delle equazioni di Maxwell. Tuttavia, nella maggior parte dei casi è possibile
 Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
Elementi di ottica L ottica si occupa dello studio dei percorsi dei raggi luminosi e dei fenomeni legati alla propagazione della luce in generale. Lo studio dell ottica nella fisica moderna si basa sul
Generalità delle onde elettromagnetiche
 Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
MODELLI ATOMICI. Dai primi modelli alla teoria moderna
 MODELLI ATOMICI Dai primi modelli alla teoria moderna Se numerose evidenze sperimentali avevano permesso di trovare l'esistenza delle particelle subatomiche, le loro dimensioni, così infinitamente piccole,
MODELLI ATOMICI Dai primi modelli alla teoria moderna Se numerose evidenze sperimentali avevano permesso di trovare l'esistenza delle particelle subatomiche, le loro dimensioni, così infinitamente piccole,
Il fotone. Emanuele Pugliese, Lorenzo Santi URDF Udine
 Il fotone Emanuele Pugliese, Lorenzo Santi URDF Udine Interpretazione di Einstein dell effetto fotoelettrico Esistono «particelle»* di luce: i fotoni! La luce è composta da quantità indivisibili di energia
Il fotone Emanuele Pugliese, Lorenzo Santi URDF Udine Interpretazione di Einstein dell effetto fotoelettrico Esistono «particelle»* di luce: i fotoni! La luce è composta da quantità indivisibili di energia
LE PARTICELLE ELEMENTARI: loro scoperta
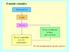 LE PARTICELLE ELEMENTARI: loro scoperta Atomo: composto da particelle elementari più piccole (protoni, neutroni, elettroni) Atomi di elementi diversi contengono le STESSE particelle, ma in numero diverso
LE PARTICELLE ELEMENTARI: loro scoperta Atomo: composto da particelle elementari più piccole (protoni, neutroni, elettroni) Atomi di elementi diversi contengono le STESSE particelle, ma in numero diverso
Spettrometria. Introduzione.
 Spettrometria. Introduzione. Lo studio degli spettri di emissione e di assorbimento è stato sicuramente uno degli aspetti che hanno maggiormente contribuito alla crisi della meccanica classica a cavallo
Spettrometria. Introduzione. Lo studio degli spettri di emissione e di assorbimento è stato sicuramente uno degli aspetti che hanno maggiormente contribuito alla crisi della meccanica classica a cavallo
IL FOTOVOLTAICO E L ARCHITETTURA
 IL FOTOVOLTAICO E L ARCHITETTURA Prof. Paolo ZAZZINI Ing. Nicola SIMIONATO COME FUNZIONA UNA CELLA FOTOVOLTAICA EFFETTO FOTOVOLTAICO: Un flusso luminoso che incide su un materiale semiconduttore opportunamente
IL FOTOVOLTAICO E L ARCHITETTURA Prof. Paolo ZAZZINI Ing. Nicola SIMIONATO COME FUNZIONA UNA CELLA FOTOVOLTAICA EFFETTO FOTOVOLTAICO: Un flusso luminoso che incide su un materiale semiconduttore opportunamente
Dai primi modelli atomici alla teoria moderna
 Dai primi modelli atomici alla teoria moderna 1 Se numerose evidenze sperimentali avevano permesso di trovare l'esistenza delle particelle subatomiche, le loro dimensioni, così infinitamente piccole, non
Dai primi modelli atomici alla teoria moderna 1 Se numerose evidenze sperimentali avevano permesso di trovare l'esistenza delle particelle subatomiche, le loro dimensioni, così infinitamente piccole, non
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
L atomo di Bohr e i raggi X
 L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
APPUNTI DI RISONANZA MAGNETICA NUCLEARE Dr. Claudio Santi. CAPITOLO 1 NMR Risonanza Magnetica Nucleare
 APPUNTI DI RISONANZA MAGNETICA NUCLEARE Dr. Claudio Santi CAPITOLO 1 NMR Risonanza Magnetica Nucleare INTRODUZIONE Nel 1946 due ricercatori, F. Block ed E.M.Purcell, hanno indipendentemente osservato per
APPUNTI DI RISONANZA MAGNETICA NUCLEARE Dr. Claudio Santi CAPITOLO 1 NMR Risonanza Magnetica Nucleare INTRODUZIONE Nel 1946 due ricercatori, F. Block ed E.M.Purcell, hanno indipendentemente osservato per
RADIAZIONI RADIAZIONI IONIZZANTI RADIAZIONI IONIZZANTI
 RADIAZIONI Le radiazioni ionizzanti sono quelle onde elettromagnetiche in grado di produrre coppie di ioni al loro passaggio nella materia (raggi X, raggi gamma, raggi corpuscolari). Le radiazioni non
RADIAZIONI Le radiazioni ionizzanti sono quelle onde elettromagnetiche in grado di produrre coppie di ioni al loro passaggio nella materia (raggi X, raggi gamma, raggi corpuscolari). Le radiazioni non
Q 1 = +3 10-5 C carica numero 1 Q 2 = +4 10-5 C carica numero 2 forza esercitata tra le cariche distanza tra le cariche, incognita
 Problema n 1 A quale distanza, una dall'altra bisogna porre nel vuoto due cariche (Q 1 =3 10-5 C e Q 2 =4 10-5 C) perché esse esercitino una sull'altra la forza di 200 N? Q 1 = +3 10-5 C carica numero
Problema n 1 A quale distanza, una dall'altra bisogna porre nel vuoto due cariche (Q 1 =3 10-5 C e Q 2 =4 10-5 C) perché esse esercitino una sull'altra la forza di 200 N? Q 1 = +3 10-5 C carica numero
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
Esercizi su elettrostatica, magnetismo, circuiti elettrici, interferenza e diffrazione
 Esercizi su elettrostatica, magnetismo, circuiti elettrici, interferenza e diffrazione 1. L elettrone ha una massa di 9.1 10-31 kg ed una carica elettrica di -1.6 10-19 C. Ricordando che la forza gravitazionale
Esercizi su elettrostatica, magnetismo, circuiti elettrici, interferenza e diffrazione 1. L elettrone ha una massa di 9.1 10-31 kg ed una carica elettrica di -1.6 10-19 C. Ricordando che la forza gravitazionale
Fisica II - CdL Chimica. La natura della luce Ottica geometrica Velocità della luce Dispersione Fibre ottiche
 La natura della luce Ottica geometrica Velocità della luce Dispersione Fibre ottiche La natura della luce Teoria corpuscolare (Newton) Teoria ondulatoria: proposta già al tempo di Newton, ma scartata perchè
La natura della luce Ottica geometrica Velocità della luce Dispersione Fibre ottiche La natura della luce Teoria corpuscolare (Newton) Teoria ondulatoria: proposta già al tempo di Newton, ma scartata perchè
IL CAMPO MAGNETICO. V Scientifico Prof.ssa Delfino M. G.
 IL CAMPO MAGNETICO V Scientifico Prof.ssa Delfino M. G. UNITÀ - IL CAMPO MAGNETICO 1. Fenomeni magnetici 2. Calcolo del campo magnetico 3. Forze su conduttori percorsi da corrente 4. La forza di Lorentz
IL CAMPO MAGNETICO V Scientifico Prof.ssa Delfino M. G. UNITÀ - IL CAMPO MAGNETICO 1. Fenomeni magnetici 2. Calcolo del campo magnetico 3. Forze su conduttori percorsi da corrente 4. La forza di Lorentz
La corrente elettrica
 PROGRAMMA OPERATIVO NAZIONALE Fondo Sociale Europeo "Competenze per lo Sviluppo" Obiettivo C-Azione C1: Dall esperienza alla legge: la Fisica in Laboratorio La corrente elettrica Sommario 1) Corrente elettrica
PROGRAMMA OPERATIVO NAZIONALE Fondo Sociale Europeo "Competenze per lo Sviluppo" Obiettivo C-Azione C1: Dall esperienza alla legge: la Fisica in Laboratorio La corrente elettrica Sommario 1) Corrente elettrica
Elettricità e magnetismo
 E1 Cos'è l'elettricità La carica elettrica è una proprietà delle particelle elementari (protoni e elettroni) che formano l'atomo. I protoni hanno carica elettrica positiva. Gli elettroni hanno carica elettrica
E1 Cos'è l'elettricità La carica elettrica è una proprietà delle particelle elementari (protoni e elettroni) che formano l'atomo. I protoni hanno carica elettrica positiva. Gli elettroni hanno carica elettrica
LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.6 ENERGIE DI IONIZZAZIONE E DISTRIBUZIONE DEGLI ELETTRONI 4.C OBIETTIVI
 LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.C OBIETTIVI 4.1 UNO SGUARDO ALLA STORIA 4.2 L ATOMO DI BOHR (1913) 4.5.2 PRINCIPIO DELLA MASSIMA MOLTEPLICITA (REGOLA DI HUND) 4.5.3 ESERCIZI SVOLTI
LA STRUTTURA DELL ATOMO 4.A PRE-REQUISITI 4.B PRE-TEST 4.C OBIETTIVI 4.1 UNO SGUARDO ALLA STORIA 4.2 L ATOMO DI BOHR (1913) 4.5.2 PRINCIPIO DELLA MASSIMA MOLTEPLICITA (REGOLA DI HUND) 4.5.3 ESERCIZI SVOLTI
STRUTTURA DELL'ATOMO
 STRUTTURA DELL'ATOMO Vari esperimenti condotti fra la fine del 1800 e l inizio del 1900 dimostrarono che gli atomi non sono indivisibili, ma costituiti da particelle più piccole (elementari). PARTICELLE
STRUTTURA DELL'ATOMO Vari esperimenti condotti fra la fine del 1800 e l inizio del 1900 dimostrarono che gli atomi non sono indivisibili, ma costituiti da particelle più piccole (elementari). PARTICELLE
Riepilogo programma di Chimica Ginnasio Anno scolastico 2011/2012
 Riepilogo programma di Chimica Ginnasio Anno scolastico 2011/2012 Misure e grandezze Grandezze fondamentali Grandezza fisica Simbolo della grandezza Unità di misura Simbolo dell unità di misura lunghezza
Riepilogo programma di Chimica Ginnasio Anno scolastico 2011/2012 Misure e grandezze Grandezze fondamentali Grandezza fisica Simbolo della grandezza Unità di misura Simbolo dell unità di misura lunghezza
CLASSE 5 A L.S.A. ISTITUTO D ISTRUZIONE SUPERIORE STATALE G. CIGNA ANNO SCOL: 2015/2016 PROGRAMMAZIONE ANNUALE DI FISICA. Docente: Prof.
 ISTITUTO D ISTRUZIONE SUPERIORE STATALE G. CIGNA ANNO SCOL: 2015/2016 PROGRAMMAZIONE ANNUALE DI FISICA CLASSE 5 A L.S.A. Docente: Prof. LINGUA ALDO Libro di testo: CORSO di FISICA: voll. 3 James S. Walker
ISTITUTO D ISTRUZIONE SUPERIORE STATALE G. CIGNA ANNO SCOL: 2015/2016 PROGRAMMAZIONE ANNUALE DI FISICA CLASSE 5 A L.S.A. Docente: Prof. LINGUA ALDO Libro di testo: CORSO di FISICA: voll. 3 James S. Walker
Corso di Laboratorio di Fisica prof. Mauro Casalboni dott. Giovanni Casini
 SSIS indirizzo Fisico - Informatico - Matematico 2 anno - a.a.. 2006/2007 Corso di Laboratorio di Fisica prof. Mauro Casalboni dott. Giovanni Casini LA LUCE La luce è un onda elettromagnetica Il principio
SSIS indirizzo Fisico - Informatico - Matematico 2 anno - a.a.. 2006/2007 Corso di Laboratorio di Fisica prof. Mauro Casalboni dott. Giovanni Casini LA LUCE La luce è un onda elettromagnetica Il principio
Modelli atomici Modello atomico di Rutheford Per t s d u i diare la t s rutt ttura t a omica Ruth th f or (
 Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford (1871-1937) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio) Rutherford suppose che gli atomi
Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford (1871-1937) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio) Rutherford suppose che gli atomi
Effetto fotoelettrico
 Effetto fotoelettrico Introduzione. Verso la seconda metà del XIX secolo c era la convinzione che la meccanica "classica" (Newton e sviluppi successivi), l elettromagnetismo (sostanzialmente riassunto
Effetto fotoelettrico Introduzione. Verso la seconda metà del XIX secolo c era la convinzione che la meccanica "classica" (Newton e sviluppi successivi), l elettromagnetismo (sostanzialmente riassunto
Liceo Scientifico Statale A. Volta, Torino Anno scolastico 2015 / 2016
 Liceo Scientifico Statale A. Volta, Torino Anno scolastico 2015 / 2016 FISICA ELETTROMAGNETISMO FISICA MODERNA classe 5 B MAG. 2016 Esercitazione di Fisica in preparazione all Esame di Stato A.S. 2015-2016
Liceo Scientifico Statale A. Volta, Torino Anno scolastico 2015 / 2016 FISICA ELETTROMAGNETISMO FISICA MODERNA classe 5 B MAG. 2016 Esercitazione di Fisica in preparazione all Esame di Stato A.S. 2015-2016
Com è fatto l atomo ATOMO. UNA VOLTA si pensava che l atomo fosse indivisibile. OGGI si pensa che l atomo è costituito da tre particelle
 STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
Misureremo e analizzeremo la distribuzione di intensità luminosa di diverse figure di diffrazione in funzione della posizione acquisite on- line.
 4 IV Giornata Oggi termineremo questo percorso sulla luce misurando l intensità luminosa della distribuzione di massimi e minimi delle figure di diffrazione e di interferenza. In particolare confronteremo
4 IV Giornata Oggi termineremo questo percorso sulla luce misurando l intensità luminosa della distribuzione di massimi e minimi delle figure di diffrazione e di interferenza. In particolare confronteremo
LICEO SCIENTIFICO VITO VOLTERRA
 LICEO SCIENTIFICO VITO VOLTERRA DIPARTIMENTO DI FISICA ORIETTA DI BIAGIO Penso si possa tranquillamente affermare che nessuno capisce la meccanica quantistica Richard P. Feynman Premio Nobel nel 1963 Quelli
LICEO SCIENTIFICO VITO VOLTERRA DIPARTIMENTO DI FISICA ORIETTA DI BIAGIO Penso si possa tranquillamente affermare che nessuno capisce la meccanica quantistica Richard P. Feynman Premio Nobel nel 1963 Quelli
LE RADIAZIONI. E = h. in cui è la frequenza ed h una costante, detta costante di Plank.
 LE RADIAZIONI Nel campo specifico di nostro interesse la radiazione è un flusso di energia elettromagnetica o di particelle, generato da processi fisici che si producono nell atomo o nel nucleo atomico.
LE RADIAZIONI Nel campo specifico di nostro interesse la radiazione è un flusso di energia elettromagnetica o di particelle, generato da processi fisici che si producono nell atomo o nel nucleo atomico.
Le proprietà periodiche degli elementi LA LEZIONE
 Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Campione sciolto in un solvente (deuterato) e. posto in un tubo. di vetro a pareti sottili di diametro di 5 mm e lungo circa 20 cm
 posto in un tubo Campione sciolto in un solvente (deuterato) e di vetro a pareti sottili di diametro di 5 mm e lungo circa 20 cm o spettrometro NMR è formato da alcuni mponenti fondamentali: un magnete,
posto in un tubo Campione sciolto in un solvente (deuterato) e di vetro a pareti sottili di diametro di 5 mm e lungo circa 20 cm o spettrometro NMR è formato da alcuni mponenti fondamentali: un magnete,
LA CORRENTE ELETTRICA CONTINUA
 LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
GIROSCOPIO. Scopo dell esperienza: Teoria fisica. Verificare la relazione: ω p = bmg/iω
 GIROSCOPIO Scopo dell esperienza: Verificare la relazione: ω p = bmg/iω dove ω p è la velocità angolare di precessione, ω è la velocità angolare di rotazione, I il momento principale d inerzia assiale,
GIROSCOPIO Scopo dell esperienza: Verificare la relazione: ω p = bmg/iω dove ω p è la velocità angolare di precessione, ω è la velocità angolare di rotazione, I il momento principale d inerzia assiale,
STRUTTURA ATOMICA. Per lo studio della struttura dell atomo ci si avvale della Spettroscopia.
 STRUTTURA ATOMICA Il modello planetario dell atomo secondo Rutherford si appoggia sulla meccanica classica. Il modello non può essere corretto visto che per descrivere il comportamento delle particelle
STRUTTURA ATOMICA Il modello planetario dell atomo secondo Rutherford si appoggia sulla meccanica classica. Il modello non può essere corretto visto che per descrivere il comportamento delle particelle
13 La temperatura - 8. Il gas perfetto
 La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
19 Il campo elettrico - 3. Le linee del campo elettrico
 Moto di una carica in un campo elettrico uniforme Il moto di una particella carica in un campo elettrico è in generale molto complesso; il problema risulta più semplice se il campo elettrico è uniforme,
Moto di una carica in un campo elettrico uniforme Il moto di una particella carica in un campo elettrico è in generale molto complesso; il problema risulta più semplice se il campo elettrico è uniforme,
ELEMENTI DI DI OTTICA E FISICA NUCLEARE INSEGNAMENTO COMPLEMENTARE (9 CFU) PER:
 ELEMENTI DI DI OTTICA E FISICA NUCLEARE INSEGNAMENTO COMPLEMENTARE (9 CFU) PER: CORSO DI LAUREA TRIENNALE IN SCIENZE E TECNOLOGIE PER LO STUDIO E LA CONSERVAZIONE DEI BENI CULTURALI E DEI SUPPORTI DELLA
ELEMENTI DI DI OTTICA E FISICA NUCLEARE INSEGNAMENTO COMPLEMENTARE (9 CFU) PER: CORSO DI LAUREA TRIENNALE IN SCIENZE E TECNOLOGIE PER LO STUDIO E LA CONSERVAZIONE DEI BENI CULTURALI E DEI SUPPORTI DELLA
LE ONDE. Le onde Fisica Medica Lauree triennali nelle Professioni Sanitarie. P.Montagna gen-08. pag.1
 LE ONDE Fenomeni ondulatori Periodo e frequenza Lunghezza d onda e velocità Legge di propagazione Energia trasportata Onde meccaniche: il suono Onde elettromagnetiche Velocità della luce Spettro elettromagnetico
LE ONDE Fenomeni ondulatori Periodo e frequenza Lunghezza d onda e velocità Legge di propagazione Energia trasportata Onde meccaniche: il suono Onde elettromagnetiche Velocità della luce Spettro elettromagnetico
Capitolo 7 Le particelle dell atomo
 Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le particelle fondamentali dell atomo 4. La scoperta dell elettrone 5. L esperimento
Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le particelle fondamentali dell atomo 4. La scoperta dell elettrone 5. L esperimento
Esempio Esame di Fisica Generale I C.d.L. ed.u. Informatica
 Esempio Esame di Fisica Generale I C.d.L. ed.u. Informatica Nome: N.M.: 1. 1d (giorno) contiene all incirca (a) 8640 s; (b) 9 10 4 s; (c) 86 10 2 s; (d) 1.44 10 3 s; (e) nessuno di questi valori. 2. Sono
Esempio Esame di Fisica Generale I C.d.L. ed.u. Informatica Nome: N.M.: 1. 1d (giorno) contiene all incirca (a) 8640 s; (b) 9 10 4 s; (c) 86 10 2 s; (d) 1.44 10 3 s; (e) nessuno di questi valori. 2. Sono
April 11, 2011. Fisica Nucleare. Monica Sambo. Sommario. Introduzione. Radioattivitá. Fisica del nucleo. Bibliografia. Esempio. Raggi emessi Esempio
 April 11, 2011 1 2 3 4 Indicando con Z il numero dei protoni (numero atomico dell atomo) e con N il numero dei neutroni si definisce A il numero di massa del : A = Z + N (1) Nei nuclei leggeri si ha la
April 11, 2011 1 2 3 4 Indicando con Z il numero dei protoni (numero atomico dell atomo) e con N il numero dei neutroni si definisce A il numero di massa del : A = Z + N (1) Nei nuclei leggeri si ha la
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Capitolo 4 Le spettroscopie. 1. Lo spettro elettromagnetico
 Capitolo 4 Le spettroscopie 1. Lo spettro elettromagnetico 2) Tipi di spettroscopia Emissione: transizione da livello superiore a livello inferiore Assorbimento: contrario 2.1 Spettroscopie rotazionali,
Capitolo 4 Le spettroscopie 1. Lo spettro elettromagnetico 2) Tipi di spettroscopia Emissione: transizione da livello superiore a livello inferiore Assorbimento: contrario 2.1 Spettroscopie rotazionali,
Introduzione alla Meccanica Quantistica. Fausto Borgonovi
 Introduzione alla Meccanica Quantistica Fausto Borgonovi Dipartimento di Matematica e Fisica e i.l.a.m.p. Universitá Cattolica, via Musei 41, BRESCIA Istituto Nazionale di Fisica Nucleare, PAVIA fausto.borgonovi@unicatt.it
Introduzione alla Meccanica Quantistica Fausto Borgonovi Dipartimento di Matematica e Fisica e i.l.a.m.p. Universitá Cattolica, via Musei 41, BRESCIA Istituto Nazionale di Fisica Nucleare, PAVIA fausto.borgonovi@unicatt.it
SPETTROSCOPIA MOLECOLARE
 SPETTROSCOPIA MOLECOLARE La spettroscopia molecolare studia l assorbimento o l emissione delle radiazioni elettromagnetiche da parte delle molecole. Il dato sperimentale che si ottiene, chiamato rispettivamente
SPETTROSCOPIA MOLECOLARE La spettroscopia molecolare studia l assorbimento o l emissione delle radiazioni elettromagnetiche da parte delle molecole. Il dato sperimentale che si ottiene, chiamato rispettivamente
Ottica fisica e ottica ondulatoria Lezione 12
 Ottica fisica e ottica ondulatoria Lezione La luce è un onda elettromagnetica; ne studiamo le proprietà principali, tra cui quelle non dipendenti direttamente dalla natura ondulatoria (ottica geometrica
Ottica fisica e ottica ondulatoria Lezione La luce è un onda elettromagnetica; ne studiamo le proprietà principali, tra cui quelle non dipendenti direttamente dalla natura ondulatoria (ottica geometrica
Università degli studi di Messina facoltà di Scienze mm ff nn. Progetto Lauree Scientifiche (FISICA) Prisma ottico
 Università degli studi di Messina facoltà di Scienze mm ff nn Progetto Lauree Scientifiche (FISICA) Prisma ottico Parte teorica Fenomenologia di base La luce che attraversa una finestra, un foro, una fenditura,
Università degli studi di Messina facoltà di Scienze mm ff nn Progetto Lauree Scientifiche (FISICA) Prisma ottico Parte teorica Fenomenologia di base La luce che attraversa una finestra, un foro, una fenditura,
ELETTROSTATICA + Carica Elettrica + Campi Elettrici + Legge di Gauss + Potenziale Elettrico + Capacita Elettrica
 ELETTROSTATICA + Carica Elettrica + Campi Elettrici + Legge di Gauss + Potenziale Elettrico + Capacita Elettrica ELETTRODINAMICA + Correnti + Campi Magnetici + Induzione e Induttanza + Equazioni di Maxwell
ELETTROSTATICA + Carica Elettrica + Campi Elettrici + Legge di Gauss + Potenziale Elettrico + Capacita Elettrica ELETTRODINAMICA + Correnti + Campi Magnetici + Induzione e Induttanza + Equazioni di Maxwell
Einstein ci dice che la luce è costituita da unità elementari chiamate fotoni. Cosa sono questi fotoni?
 La natura della luce Einstein ci dice che la luce è costituita da unità elementari chiamate fotoni. Cosa sono questi fotoni? Se si potesse fotografare un fotone in un certo istante vedremmo una deformazione
La natura della luce Einstein ci dice che la luce è costituita da unità elementari chiamate fotoni. Cosa sono questi fotoni? Se si potesse fotografare un fotone in un certo istante vedremmo una deformazione
Si classifica come una grandezza intensiva
 CAP 13: MISURE DI TEMPERATURA La temperatura È osservata attraverso gli effetti che provoca nelle sostanze e negli oggetti Si classifica come una grandezza intensiva Può essere considerata una stima del
CAP 13: MISURE DI TEMPERATURA La temperatura È osservata attraverso gli effetti che provoca nelle sostanze e negli oggetti Si classifica come una grandezza intensiva Può essere considerata una stima del
Istituzioni di fisica della materia I Lezione 3. S. Solimeno lezione 3 1
 Istituzioni di fisica della materia I Lezione 3 S. Solimeno lezione 3 1 S. Solimeno lezione 3 2 S. Solimeno lezione 3 3 S. Solimeno lezione 3 4 S. Solimeno lezione 3 5 spettroscopia gamma di colori che
Istituzioni di fisica della materia I Lezione 3 S. Solimeno lezione 3 1 S. Solimeno lezione 3 2 S. Solimeno lezione 3 3 S. Solimeno lezione 3 4 S. Solimeno lezione 3 5 spettroscopia gamma di colori che
LA CORRENTE ELETTRICA
 L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
INDICE CARICA ELETTRICA E LEGGE DI COULOMB 591 ENERGIA POTENZIALE E POTENZIALI ELETTRICI 663 CAMPO ELETTRICO 613 PROPRIETÀ ELETTRICHE DELLA MATERIA 93
 INDICE CAPITOLO 25 CARICA ELETTRICA E LEGGE DI COULOMB 591 25.1 Elettromagnetismo: presentazione 591 25.2 Carica elettrica 592 25.3 Conduttori e isolanti 595 25.4 Legge di Coulomb 597 25.5 Distribuzioni
INDICE CAPITOLO 25 CARICA ELETTRICA E LEGGE DI COULOMB 591 25.1 Elettromagnetismo: presentazione 591 25.2 Carica elettrica 592 25.3 Conduttori e isolanti 595 25.4 Legge di Coulomb 597 25.5 Distribuzioni
SCIENZE INTEGRATE FISICA
 CLASSE DISCIPLINA ORE SETTIMANALI TIPO DI PROVA PER GIUDIZIO SOSPESO MODULO 1: Il moto e l energia I concetti di sistema di riferimento e le grandezze cinematiche. I diversi tipi di rappresentazione del
CLASSE DISCIPLINA ORE SETTIMANALI TIPO DI PROVA PER GIUDIZIO SOSPESO MODULO 1: Il moto e l energia I concetti di sistema di riferimento e le grandezze cinematiche. I diversi tipi di rappresentazione del
L ATOMO. Risponde (o almeno ci prova)
 L ATOMO Di cosa sono fatte le cose? Come si è arrivati a capire gli atomi? Com è fatto un atomo? Quanto è grande un atomo? Che atomi esistono in natura? Perché esistono gli atomi? Risponde (o almeno ci
L ATOMO Di cosa sono fatte le cose? Come si è arrivati a capire gli atomi? Com è fatto un atomo? Quanto è grande un atomo? Che atomi esistono in natura? Perché esistono gli atomi? Risponde (o almeno ci
u 1 u k che rappresenta formalmente la somma degli infiniti numeri (14.1), ordinati al crescere del loro indice. I numeri u k
 Capitolo 4 Serie numeriche 4. Serie convergenti, divergenti, indeterminate Data una successione di numeri reali si chiama serie ad essa relativa il simbolo u +... + u +... u, u 2,..., u,..., (4.) oppure
Capitolo 4 Serie numeriche 4. Serie convergenti, divergenti, indeterminate Data una successione di numeri reali si chiama serie ad essa relativa il simbolo u +... + u +... u, u 2,..., u,..., (4.) oppure
Slide Cerbara parte1 5. Le distribuzioni teoriche
 Slide Cerbara parte1 5 Le distribuzioni teoriche I fenomeni biologici, demografici, sociali ed economici, che sono il principale oggetto della statistica, non sono retti da leggi matematiche. Però dalle
Slide Cerbara parte1 5 Le distribuzioni teoriche I fenomeni biologici, demografici, sociali ed economici, che sono il principale oggetto della statistica, non sono retti da leggi matematiche. Però dalle
1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3.
 Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Teoria Atomica Moderna. Chimica generale ed Inorganica: Chimica Generale. sorgenti di emissione di luce. E = hν. νλ = c. E = mc 2
 sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
Dispositivi optoelettronici (1)
 Dispositivi optoelettronici (1) Sono dispositivi dove giocano un ruolo fondamentale sia le correnti elettriche che i fotoni, le particelle base della radiazione elettromagnetica. Le onde elettromagnetiche
Dispositivi optoelettronici (1) Sono dispositivi dove giocano un ruolo fondamentale sia le correnti elettriche che i fotoni, le particelle base della radiazione elettromagnetica. Le onde elettromagnetiche
FAM. 1. Sistema composto da quattro PM come nella tabella seguente
 Serie 11: Meccanica IV FAM C. Ferrari Esercizio 1 Centro di massa: sistemi discreti Determina il centro di massa dei seguenti sistemi discreti. 1. Sistema composto da quattro PM come nella tabella seguente
Serie 11: Meccanica IV FAM C. Ferrari Esercizio 1 Centro di massa: sistemi discreti Determina il centro di massa dei seguenti sistemi discreti. 1. Sistema composto da quattro PM come nella tabella seguente
La Meccanica Quantistica
 Alunno: Giovannangelo Dante Liceo Scientifico Tecnologico L. Da Vinci, Lanciano La Meccanica Quantistica La realtà così come non la vediamo Il percorso 1. Storia 2. Fisica 3. Matematica La Meccanica Quantistica
Alunno: Giovannangelo Dante Liceo Scientifico Tecnologico L. Da Vinci, Lanciano La Meccanica Quantistica La realtà così come non la vediamo Il percorso 1. Storia 2. Fisica 3. Matematica La Meccanica Quantistica
Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose.
 Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose. 2.1 Spettro di emissione Lo spettro di emissione di
Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose. 2.1 Spettro di emissione Lo spettro di emissione di
9. Urti e conservazione della quantità di moto.
 9. Urti e conservazione della quantità di moto. 1 Conservazione dell impulso m1 v1 v2 m2 Prima Consideriamo due punti materiali di massa m 1 e m 2 che si muovono in una dimensione. Supponiamo che i due
9. Urti e conservazione della quantità di moto. 1 Conservazione dell impulso m1 v1 v2 m2 Prima Consideriamo due punti materiali di massa m 1 e m 2 che si muovono in una dimensione. Supponiamo che i due
MOTO DI UNA CARICA IN UN CAMPO ELETTRICO UNIFORME
 6. IL CONDNSATOR FNOMNI DI LTTROSTATICA MOTO DI UNA CARICA IN UN CAMPO LTTRICO UNIFORM Il moto di una particella carica in un campo elettrico è in generale molto complesso; il problema risulta più semplice
6. IL CONDNSATOR FNOMNI DI LTTROSTATICA MOTO DI UNA CARICA IN UN CAMPO LTTRICO UNIFORM Il moto di una particella carica in un campo elettrico è in generale molto complesso; il problema risulta più semplice
Prova scritta intercorso 2 31/5/2002
 Prova scritta intercorso 3/5/ Diploma in Scienza e Ingegneria dei Materiali anno accademico - Istituzioni di Fisica della Materia - Prof. Lorenzo Marrucci Tempo a disposizione ora e 45 minuti ) Un elettrone
Prova scritta intercorso 3/5/ Diploma in Scienza e Ingegneria dei Materiali anno accademico - Istituzioni di Fisica della Materia - Prof. Lorenzo Marrucci Tempo a disposizione ora e 45 minuti ) Un elettrone
AC6 Misure della massa delle stelle
 AC6 Misure della massa delle stelle Stelle doppie e relative misure di parallasse. Ancora il satellite Hypparcos Doppie fotometriche Doppie eclissanti e misure fotometriche di massa Relazione empirica
AC6 Misure della massa delle stelle Stelle doppie e relative misure di parallasse. Ancora il satellite Hypparcos Doppie fotometriche Doppie eclissanti e misure fotometriche di massa Relazione empirica
È importante quindi conoscere le proprietà chimiche dell acqua. Le reazioni acido base sono particolari esempi di equilibrio chimico in fase acquosa
 Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Le immagini digitali. Le immagini digitali. Caterina Balletti. Caterina Balletti. Immagini grafiche. Trattamento di immagini digitali.
 1 Le immagini digitali Le immagini digitali Università IUAV di venezia Trattamento di immagini digitali immagini grafiche immagini raster immagini vettoriali acquisizione trattamento geometrico trattamento
1 Le immagini digitali Le immagini digitali Università IUAV di venezia Trattamento di immagini digitali immagini grafiche immagini raster immagini vettoriali acquisizione trattamento geometrico trattamento
La diffrazione. Lezioni d'autore
 La diffrazione Lezioni d'autore Figure di diffrazione VIDEO Il potere risolutivo di un sistema ottico (I) Un esperienza classica sulle capacità di una persona di distinguere due oggetti vicini si realizza
La diffrazione Lezioni d'autore Figure di diffrazione VIDEO Il potere risolutivo di un sistema ottico (I) Un esperienza classica sulle capacità di una persona di distinguere due oggetti vicini si realizza
Generatore radiologico
 Generatore radiologico Radiazioni artificiali alimentazione: corrente elettrica www.med.unipg.it/ac/rad/ www.etsrm.it oscar fiorucci. laurea.tecn.radiol@ospedale.perugia.it Impianto radiologico trasformatore
Generatore radiologico Radiazioni artificiali alimentazione: corrente elettrica www.med.unipg.it/ac/rad/ www.etsrm.it oscar fiorucci. laurea.tecn.radiol@ospedale.perugia.it Impianto radiologico trasformatore
Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia.
 G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
Teoria Atomica di Dalton
 Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
isolanti e conduttori
 1. ELETTROMAGNETISMO 1.1. Carica elettrica 1.1.1. Storia: Franklin Thomson Rutherford Millikan 1.1.2. L atomo: struttura elettroni di valenza (legame metallico) isolanti e conduttori ATOMO legge di conservazione
1. ELETTROMAGNETISMO 1.1. Carica elettrica 1.1.1. Storia: Franklin Thomson Rutherford Millikan 1.1.2. L atomo: struttura elettroni di valenza (legame metallico) isolanti e conduttori ATOMO legge di conservazione
PIANO DI STUDIO DELLA DISCIPLINA
 Modulo Gestione Qualità UNI EN ISO 9001 : 2008 Tel. 0331635718 fax 0331679586 info@isisfacchinetti.it www.isisfacchinetti.it PIANO STUDIO DELLA DISCIPLINA PIANO DI STUDIO DELLA DISCIPLINA Chimica Analitica
Modulo Gestione Qualità UNI EN ISO 9001 : 2008 Tel. 0331635718 fax 0331679586 info@isisfacchinetti.it www.isisfacchinetti.it PIANO STUDIO DELLA DISCIPLINA PIANO DI STUDIO DELLA DISCIPLINA Chimica Analitica
RIDUZIONE DELLE CLOROAMMINE IN PISCINA TRAMITE RAGGI ULTRAVIOLETTI
 RIDUZIONE DELLE CLOROAMMINE IN PISCINA TRAMITE RAGGI ULTRAVIOLETTI Autore: Andrea Peluso INTRODUZIONE: La riduzione delle cloroammine in piscina tramite l utilizzo di raggi ultravioletti è una pratica
RIDUZIONE DELLE CLOROAMMINE IN PISCINA TRAMITE RAGGI ULTRAVIOLETTI Autore: Andrea Peluso INTRODUZIONE: La riduzione delle cloroammine in piscina tramite l utilizzo di raggi ultravioletti è una pratica
SENSORI E TRASDUTTORI
 SENSORI E TRASDUTTORI Il controllo di processo moderno utilizza tecnologie sempre più sofisticate, per minimizzare i costi e contenere le dimensioni dei dispositivi utilizzati. Qualsiasi controllo di processo
SENSORI E TRASDUTTORI Il controllo di processo moderno utilizza tecnologie sempre più sofisticate, per minimizzare i costi e contenere le dimensioni dei dispositivi utilizzati. Qualsiasi controllo di processo
Le Caratteristiche della Luce
 7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
FONDAMENTI DI ILLUMINOTECNICA
 Prof. Ceccarelli Antonio ITIS G. Marconi Forlì Articolazione: Elettrotecnica Disciplina: Tecnologie e progettazione di sistemi elettrici ed elettronici A.S. 2012/13 FONDAMENTI DI ILLUMINOTECNICA CHE COSA
Prof. Ceccarelli Antonio ITIS G. Marconi Forlì Articolazione: Elettrotecnica Disciplina: Tecnologie e progettazione di sistemi elettrici ed elettronici A.S. 2012/13 FONDAMENTI DI ILLUMINOTECNICA CHE COSA
Relazione di Fisica. IV E a.s. 2011/2012. Badioli Federico, Ciprianetti Sofia, Pasqualini Roberto.
 Relazione di Fisica IV E a.s. 2011/2012 Badioli Federico, Ciprianetti Sofia, Pasqualini Roberto. Scopo: Misurare la lunghezza d onda (λ) di un laser HeNe attraverso un reticolo di diffrazione. Materiale
Relazione di Fisica IV E a.s. 2011/2012 Badioli Federico, Ciprianetti Sofia, Pasqualini Roberto. Scopo: Misurare la lunghezza d onda (λ) di un laser HeNe attraverso un reticolo di diffrazione. Materiale
