Gli scambi gassosi, i gradienti di pressione parziale e la finestra di Ossigeno.
|
|
|
- Dante Brunelli
- 7 anni fa
- Visualizzazioni
Transcript
1 Gli scambi gassosi, i gradienti di pressione parziale e la finestra di Ossigeno. di Johnny E. Brian Jr. M.D. Professore Associato Dipartimento di Anestesia University of Iowa College of Medicine Traduzione dall originale americano di Paolo Genta info@wreckdiveliguria.com 2005 by Paolo Genta 1
2 Finestra di Ossigeno. Sottosaturazione inerente. Deficit di pressione parziale. La maggior parte dei subacquei interessati ad immersioni con decompressione hanno probabilmente fatto conoscenza con questi termini, prima o poi. Tutte e tre queste espressioni vengono utilizzate per descrivere lo stesso fenomeno fisico. Per gli scopi di questo articolo verrà usato il termine finestra di Ossigeno poiché esso sembra essere quello più applicato. I termini sottosaturazione inerente e deficit di pressione parziale descrivono comunque il fenomeno fisico in modo più corretto. Le attuali tecniche di immersione con decompressione assistita da Ossigeno si basano sull impiego della finestra di Ossigeno. Nonostante l uso comune della finestra di Ossigeno da parte dei subacquei questo sembra essere uno dei concetti meno considerati nelle immersioni con decompressione. Comprendere la finestra di Ossigeno richiede una certa conoscenza della fisiologia della circolazione e dei flussi di gas: il modo migliore per partire è considerare la fisiologia normobarica. LA VITA AD UNA ATMOSFERA La Fisiologia non è qualcosa di omogeneo. In persone sane ed in condizioni normali il flusso sanguigno polmonare e la ventilazione, così come il flusso sanguigno dei tessuti ed il metabolismo, cambiano su di un ampia scala. Il flusso sanguigno, la ventilazione ed il metabolismo possono variare entrambi in aree determinate ed in modo generale con il tempo. Queste variabili influiscono sull esatto scambio gassoso che si verifica in determinate zone dei polmoni e dei tessuti corporei. Per rendere questi complessi processi in qualche modo più comprensibili, molto della Fisiologia è stato ridotto nei termini più semplici. Tuttavia le descrizioni riflettono correttamente i processi generali dell assimilazione ed eliminazione di gas ed i dati presentati corrispondono a valori medi. I valori di pressione parziale sono espressi in millimetri di mercurio (mmhg), ove 1 ATA equivale a 760 mmhg. Per i puristi del Sistema Internazionale dividendo per 7.5 si convertono i mmhg in Kilopascal, la corretta unità di misura per la pressione nel SI (Sistema Internazionale, NdT). Il trasporto di gas dai polmoni ai tessuti, e ritorno, dipende dal gradiente di pressione parziale. Il concetto di pressione parziale di un gas in soluzione è qualche volta impreciso, poiché i gas nei liquidi si dissolvono in soluzione. Un gas disciolto in un liquido non esercita una pressione idrostatica come un gas in fase libera perché i sui atomi o molecole non sono più liberi di circolare come allo stato di fase libera. Questo punto è molto importante da comprendere o accettare. Le forze che tengono un gas in soluzione sono le stesse che tengono ogni altro soluto non ionizzato (gas, liquidi o solidi) in soluzione. I tessuti sono principalmente dei liquidi e la pressione parziale di un gas disciolto in un liquido si definisce come la pressione parziale che il gas eserciterebbe se la sua fase libera fosse in equilibrio con il liquido. 2
3 Le pressioni parziali di un gas in un tessuto vengono in genere espresse in mmhg o atmosfere assolute (ATA). La pressione parziale di un gas in un tessuto è l indice della quantità di quel gas nel tessuto. La quantità totale di un gas presente in un tessuto viene anche influenzata dalla solubilità del gas, che può variare per i vari gas e tessuti. Un certo tessuto assorbirà un volume più grande di un gas più solubile rispetto ad un gas con minore solubilità, prima di raggiungere qualunque pressione parziale data. In altre parole, se un dato volume di gas si discioglie in un tessuto la pressione parziale esercitata nel tessuto da un gas molto solubile risulterà essere minore della pressione parziale esercitata nello stesso tessuto da un gas di minore solubilità. Il gas in soluzione si trasferisce per diffusione da un area a pressione parziale più alta verso un area a pressione parziale più bassa. Sebbene la forza della diffusione stia nel gradiente di pressione parziale, non è la pressione in quanto tale a causare il trasferimento di gas. Quando un circuito di gas viene pressurizzato per caricare una bombola, il differenziale di pressione causa massicci trasferimenti di atomi o molecole. Però la diffusione non è tanto da intendersi come un trasferimento massiccio, quanto piuttosto come una migrazione di singoli atomi o molecole dovuta a movimenti atomici o molecolari casuali. La diffusione di un singolo gas all interno o verso l esterno di un certo tessuto dipende solamente dal gradiente di pressione parziale di quel gas e non da altri gas presenti nel tessuto. Ciò può sembrare paradossale, poiché i subacquei molto spesso pensano ai gas contenuti in un tessuto come a qualcosa che esercita una pressione che tiene gli altri gas al di fuori di quel tessuto. Ma tale analogia è errata. La diffusione dei gas non dipende dal trasferimento massiccio causato da un differenziale di pressione, ma piuttosto dal movimento di singoli atomi o molecole lungo il gradiente di pressione parziale. L interazione di singoli gas disciolti in soluzione non influisce sulla diffusione dei gas. A titolo di esempio, la Fig. 1) mostra la diffusione di un gas dal sangue al tessuto circostante. Nella Fig. 1A al tempo 0 il sangue contenente Elio (He) ad una pressione parziale (PHe) di 500 mmhg defluisce attraverso il capillare nel tessuto con una PHe uguale a 0. A causa del movimento casuale gli atomi di Elio cominciano a sbattere contro le pareti interne del capillare. Alcuni atomi di Elio attraversano le pareti del capillare dirigendosi verso il tessuto, dove gli atomi di Elio possono continuare a diffondersi o a ritornare all interno del capillare. La direzione del movimento è un evento casuale, ma a questo punto vi sono molti più atomi di Elio che si dirigono verso la parete interna del capillare invece che dall esterno verso l interno di esso e la diffusione totale di He avviene all esterno del capillare. Ad un certo punto di tempo intermedio tra le Fig. 1A e 1B, la PHe del tessuto raggiungerebbe i 250 mmhg. A questo punto gli atomi di He presenti nel tessuto incontrerebbero la parete esterna del capillare con una frequenza che sarebbe la metà 3
4 di quella con la quale gli atomi di He presenti nel sangue incontrerebbero la parete interna dello stesso capillare. La diffusione totale dell Elio avviene ancora al di fuori del capillare, ma alla metà della frequenza della Fig. 1A. Alla fine, al tempo 0 + X, viene raggiunto lo stato di equilibrio e la PHe raggiunge i 500 mmhg sia nel sangue che nel tessuto (Fig. 1B). Allo stato di equilibrio gli atomi di Elio continuano ad attraversare la parete del capillare e a diffondersi nel tessuto alla stessa velocità di quando la PHe era uguale a 0. In ogni caso la diffusione effettiva degli atomi di Elio ammonta ora a zero, perché gli atomi di Elio presenti nel tessuto incontrano ora la parete esterna del capillare e ritornano a diffondersi al suo interno alla stessa velocità con la quale gli atomi di Elio incontrano la parete interna e si diffondono dentro il tessuto (diffusione qui raffigurata dalle frecce della stessa lunghezza). Fig. 1 Nella Fig. 1C sussiste una condizione simile a quella della Fig. 1A, ad eccezione del fatto che il sangue ed il tessuto sono prima stati messi in equilibrio con una pressione parziale di 500 mmhg di azoto (PN 2 ). L azoto N 2 è in equilibrio e le molecole di N 2 si diffondono al di fuori e di nuovo all interno del sangue alla stessa velocità. Ipotizzando che la pressione ambiente sia maggiore o uguale a 1000 mmhg quando il sangue con una PN 2 di 500 mmhg ed una PHe di 500 mmhg fluisce all interno del capillare, l Elio diffonde nel tessuto come in Fig. 1A. Le molecole di N2 non bloccano la diffusione di Elio dal sangue verso il tessuto. Il gradiente di diffusione dell Elio ammonta a 500 mmhg sia in Fig. 1A che in Fig. 1C. 4
5 Nella Fig. 1D l Elio raggiungerebbe lo stato di equilibrio con il tessuto nello stesso tempo che impiegherebbe l Elio da solo per raggiungere l equilibrio in Fig. 1B. Quando un gas si diffonde attraverso un liquido le interazioni delle molecole di gas con le molecole del liquido hanno il sopravvento su qualsiasi interazione gas-gas. Ad esempio, saturando acqua con N 2 ad 1 ATA e 37 C le molecole di N 2 ammontano a solo lo 0.01% del numero totale (acqua e azoto). Se si raddoppiasse la quantità di N 2 (2 ATA) le molecole di N 2 crescerebbero solamente fino allo 0.02% del totale delle molecole presenti. Di fatto la probabilità di interazione tra N 2 e molecole di acqua è maggiore di quanto le percentuali qui riportate indicherebbero, poiché il diametro molecolare dell acqua è maggiore di quello di molte altre molecole di gas (l acqua ha dimensioni maggiori). Inoltre, a causa delle interazioni solvente-soluto (acqua-gas), le molecole di gas disciolto tendono a rimanere circondate da quelle dell acqua. L idea che gli atomi o le molecole di gas disciolte in un tessuto possano spingere altre molecole al di fuori del tessuto a causa delle interazioni gas-gas, è errata. IL TRASPORTO DI GAS NEL SANGUE In condizioni usuali il sangue che percorre i polmoni cede CO2 ed assorbe O 2. In condizioni normali, ad 1 ATA, siamo saturi di N 2 e di altri gas rari, e di conseguenza non vi è gradiente di pressione parziale per questi gas tra polmoni e tessuto. Per la fisiologia normobarica usuale l azoto e gli altri gas rari vengono ignorati, poiché non vi sono scambi attivi per questi gas. Per i nostri scopi è invece utile includere l azoto e i gas rari, dal momento che ciò ci aiuta a mostrare come la finestra ad Ossigeno possa venire allargata. Negli esempi seguenti tutti i gas rari (principalmente Argon) sono stati inclusi con l N 2, al fine di semplificare la trattazione e gli esempi grafici. Anche il CO 2 atmosferico è stato ignorato, poiché la CO 2 rappresenta solo una frazione di una percentuale della atmosfera. Fig. 2 Quando respiriamo aria ad 1 ATA l aria inspirata scende lungo la nostra trachea ed arriva agli alveoli polmonari, che sono le unità delegate allo scambio gassoso all interno dei polmoni. 5
6 Quando il gas entra nei polmoni si satura di vapor acqueo, che diluisce i gas inspirati. Alla temperatura di 37 C la pressione parziale del vapore acqueo è di 47 mmhg. La membrana degli alveoli non costituisce un ostacolo alla diffusione dei gas ed i gas alveolari vanno rapidamente in equilibrio con il sangue che attraversa i capillari. Poiché gli alveoli sono spazi aerei in comunicazione con la pressione ambiente la somma delle pressioni parziali dei gas contenuti negli alveoli dovrà essere uguale alla pressione ambiente totale. L Ossigeno procede a diffondersi mentre il CO 2 si stabilizza negli alveoli: entrambi questi processi abbassano la pressione parziale dell Ossigeno (PO 2 ) negli alveoli. La Fig. 2 mostra la pressione parziale del miscuglio di aria sia alveolare che inspirato. Ad 1 ATA l aria secca ha una PO 2 di 159 mmhg. Comunque, quando l aria raggiunge un alveolo e si mette in equilibrio col sangue la PO 2 alveolare (PaO 2 ) cade intorno ai 103 mmhg. Ciò significa che la PO 2 che ha perfusione nei capillari alveolari non potrà essere più alta di 103 mmhg. La ventilazione e la perfusione nei polmoni non sono perfette e, in condizioni normali in individui sani, una certa quantità di sangue attraversa i polmoni senza sottoporsi allo scambio gassoso. Tutto il sangue che scorre attraverso i polmoni alla fine si mescola nella parte sinistra del cuore. Durante il mescolamento il sangue non ventilato rimuove una quantità di ossigeno dal sangue che è stato invece sottoposto allo scambio gassoso, il che farà cadere ulteriormente la PO 2 arteriosa (PaO 2 ) a 95 mmhg. Una PaO 2 di 95 mmhg risulta un valore ottimale, dove i valori correnti di PaO 2 in individui sani possono aggirarsi tra gli 85 e i 95 mmhg. Fig. 3 Per motivi pratici i liquidi sono incomprimibili e non reagiscono a cambiamenti di pressione ambiente. A causa di ciò la somma delle pressioni parziali dei gas in un liquido potrà essere minore della pressione ambiente totale. 6
7 Liquidi come il sangue ed altri tessuti corporei si equilibreranno solamente con con le pressioni parziali dei gas a cui essi vengono esposti. Sulla parte alveolare della membrana alveolare la pressioni parziali complessive devono equilibrarsi con la pressione ambiente. In ogni modo, sulla parte liquida della membrana le pressioni parziali complessive possono essere minori ed in alcune zone possono essere anche di alquanto più piccole della pressione ambiente. La pressione parziale esercitata da un gas in un liquido dipende dalla temperatura, dalla solubilità del gas nel liquido e dalla quantità di gas presente. Quindi, se la quantità di gas presente e la temperatura rimangono costanti, la pressione parziale del gas in un tessuto rimane costante. Se un gas viene eliminato da un tessuto, i gas rimanenti non si espandono per occupare la pressione parziale lasciata libera dal gas rimosso. La Fig. 3 mostra le pressioni parziali complessive per aria respirata ad 1 ATA da un gas inspirato al sangue venoso. A causa della diminuzione di PO 2 dagli alveoli al sangue arterioso la pressione parziale complessiva del gas nel sangue arterioso in aria respirata ad 1 ATA è di 752 mmhg, cioè meno della pressione ambiente (760 mmhg). Se la PaO 2 è minore di 95 mmhg (come assunto da questo esempio), la pressione parziale complessiva nel sangue arterioso sarà minore. Gas inattivi dal punto di vista metabolico, come He ed N 2, vengono trasportati solo in fase disciolta nel sangue e la quantità di gas presente nel sangue è direttamente proporzionale alla pressione parziale del gas. All opposto, i gas coinvolti nel metabolismo come O 2 e CO 2, dispongono di sistemi di veicolazione altamente specializzati. A 1 ATA di pressione la maggior parte dell O 2 viene trasportato nel sangue attraverso il legame con l emoglobina. L emoglobina è una proteina specializzata delle cellule del sangue (Red Blood Cells) che si lega in modo reversibile all O 2. Fig.4 Quando l O 2 è legato all emoglobina non è più dissolto in soluzione e non contribuisce più alla PO 2. Per via del legame dell O 2 con l emoglobina la relazione 7
8 tra il contenuto in O 2 nel sangue (CO 2 ) e la PO 2 è prettamente non-lineare a causa della curva di dissociazione non-lineare O 2 emoglobina (Fig. 4). L asse Y rappresenta la saturazione in percentuale dell emoglobina, che corrisponde alla frazione di molecole di emoglobina che hanno legami con l O 2. L asse X rappresenta la PO 2. La parte sinistra della curva è relativamente ripida e, con la crescita della PO 2 la saturazione percentuale aumenta rapidamente con i legami dell O 2 all emoglobina. Quando la saturazione dell emoglobina si approssima al 90% la curva inizia ad appiattirsi e l aumento di saturazione cede ad ogni aumento di PO 2. In condizioni normali l emoglobina lega 1,39 ml di O 2 per grammo di emoglobina. Negli esempi che seguono ci si è basati su di una concentrazione di 15 grammi di emoglobina per decilitro di sangue. La quantità di O 2 legato all emoglobina può essere calcolata moltiplicando dapprima la concentrazione dell emoglobina per 1,39 e poi per il suo valore di saturazione. Per esempio: se il valore dell emoglobina è di 15 g/dl per una saturazione del 97,25%, l O 2 risultante in legame con l emoglobina sarà di (1,39)(15)(0,9725) = 20,28 ml di O 2 per decilitro di sangue. L ossigeno certamente si discioglierà nel sangue, ma la quantità di O 2 disciolto è limitata a confronto della quantità che ne rimane legata all emoglobina. Solamente 0,003 ml di O 2 per decilitro di sangue per mmhg di PO 2 si dissolveranno nel sangue. Con il 97,25 % di saturazione dell emoglobina la PO 2 è di 95 mmhg, così l ossigeno disciolto è dato da (0,003)(95) = 0,29 ml di O 2 per decilitro di sangue. La CO 2 del sangue è la somma della frazione di emoglobina in legame e della frazione disciolta. Quindi la CO 2 è in relazione con la PO 2 ma questa non è una semplice relazione lineare come avviene con i gas che vanno in dissoluzione completa. Il diossido di carbonio viene anche veicolato in stati diversi da quello gassoso quando viene convertito in ioni di bicarbonato all interno delle cellule del sangue e legandosi all emoglobina. In ogni caso questi meccanismi sono molto meno efficienti del legame dell O 2 con l emoglobina, e la relazione tra la PCO 2 e il contenuto di CO 2 è praticamente lineare. Quando il sangue va in perfusione nel tessuto l O 2 si libera al suo interno mentre il CO 2 si trasmette nel sangue. Se la PO 2 assorbita dal sangue venisse rimpiazzata da una eguale PCO 2 dal tessuto non vi sarebbe alcun cambiamento nella pressione parziale complessiva dal sangue arterioso al venoso. In ogni caso, allorchè il sangue attraversa il tessuto l aumento in PCO 2 è molto meno marcato della diminuizione in PO 2. Questa è la creazione della finestra di Ossigeno. Respirando aria in condizioni normali ad 1 ATA la differenza media arterioso-venosa (a-v) in PO 2 è di circa 50 mmhg, il che significa che la PO 2 venosa (PvO 2 ) risulta di circa 50 mmhg minore della PaO 2. Come la PO 2 si riduce a 50 mmhg, la PCO 2 si accresce di soli 5 mmhg nel passaggio dal sangue arterioso al venoso. La PCO 2 aumenta molto meno della diminuzione di PO 2 per due motivi. Primo, non tutto l O 2 metabolizzato viene convertito in CO 2. In condizioni normali solo l 80% dell ossigeno viene convertito in anidride carbonica. La seconda e più importante ragione è che nel sangue il CO 2 è 20 volte più solubile che l O 2. 8
9 I gas a maggiore solubilità producono una pressione parziale minore quando un dato volume di gas viene assorbito da un liquido. La Fig. 3 mostra le pressioni parziali complessive dei gas in una respirazione ad 1 ATA. La somma delle pressioni parziali si riduce leggermente nel passaggio dagli alveoli al sangue, dove la pressione parziale complessiva è di 752 mmhg. La pressione parziale complessiva esistente nella parte venosa della circolazione risulta di 706 mmhg, per via del consumo di O 2 da parte del tessuto. Nel nostro esempio l O 2 diminuisce da 95 a 44 mmhg, mentre il CO 2 aumenta da 40 a 45 mmhg. Le pressioni parziali dell azoto e del vapore acqueo rimangono costanti nel passaggio dagli alveoli, al sangue arterioso e poi venoso. Tale valore è stato calcolato sottraendo dalla pressione ambiente la somma delle pressioni parziali nel sangue venoso. La finestra di ossigeno si apre quando l O 2 viene rimosso dal sangue arterioso ma solo parzialmente rimpiazzato dal CO 2 presente nel sangue venoso. Il fattore principale nella formazione della finestra di ossigeno è la differenza di PO 2 tra sangue arterioso e venoso. La pressione parziale totale del gas nel tessuto è minore di quella del sangue venoso, a causa dei gradienti di diffusione esistenti tra tessuto e sangue. La PO 2 diminuisce all aumentare della distanza dal capillare, ma la PCO 2 aumenta solo di poco, a causa della solubilità del CO 2. Fig. 5 La sottosaturazione di sangue e tessuti è stata documentata in diversi studi. Nel 1910 Krogh dimostrò che la pressione parziale complessiva dei gas nel sangue arterioso era minore della pressione ambiente, sebbene Krogh non fosse in grado di misurare le pressioni parziali di tali gas (5). Dai tempi di Krogh la sottosaturazione inerente del sangue venoso e dei tessuti è stata confermata da misurazioni dirette delle pressioni parziali dei gas sia nel sangue venoso che nei tessuti (1,6). I risultati degli studi sperimentali confermano i valori calcolati presentati nelle immagini di questo articolo. La riduzione di pressione parziale complessiva dei gas nel passaggio dal 9
10 sangue arterioso al venoso fu in seguito denominata deficit di pressione parziale da Momsen, sottosaturazione inerente da Hills, e finestra di Ossigeno da Behnke (7). L esatta grandezza della finestra di ossigeno dipende dal consumo di CaO 2 e di ossigeno nel tessuto. La Fig. 5 mostra la curva di dissociazione dell ossiemoglobina con una riga verde, ma l asse Y rappresenta valori del CO 2 invece della percentuale di saturazione dell emoglobina, come si vedeva dalla Fig. 4. Le linee rosse rappresentano la PaO 2 e la CaO 2, mentre le linee blu rappresentano la PvO 2 e la CvO 2 in respirazione di aria ad 1 ATA. Per questo grafico sono state ipotizzate una differenza media di CO 2 arterioso-venoso di 4,5 ml di O 2 per decilitro di sangue ed una concentrazione di emoglobina di 15 g/dl di sangue. Per ogni data PaO 2 è possibile calcolare la CaO 2 che viene ottenuta sottraendo dal valore di CaO 2 4,5 ml di O 2 per decilitro. La PvO 2 può venire ottenuta dalla curva trovando il valore di PvO 2 che corrisponde alla CvO 2 calcolata. Le pressioni parziali venose complessive possono essere sommate e sottratte dalla pressione ambiente per determinare la finestra di ossigeno. Per determinare la pressione parziale corrispondente ed i valori di contenuto registrati dalla curva di dissociazione della Ossiemoglobina di questi esempi è stato utilizzato un nomogramma della Ossiemoglobina più dettagliato. La curva di dissociazione dell Ossiemoglobina si appiattisce per valori più alti della PO 2 perché l emoglobina si avvicina al 100% della saturazione e quindi ogni ulteriore molecola di Ossigeno (O 2 ) viene trasportato principalmente nella fase disciolta. Fig. 6 10
11 Poiché la quantità di O 2 che si dissolverà è molto minore di quella che si legherà all emoglobina, quando l emoglobina è completamente satura l aumento di CO 2 è molto minore per ogni aumento di PO 2. Quando l O 2 viene trasferito dal sangue al tessuto, l O 2 dissolto si diffonde dal sangue al tessuto e poi viene sostituito dall O 2 rilasciato dall emoglobina. Quando il sangue passa attraverso il tessuto, un volume (contenuto) determinato di O 2 viene rimosso. Il cambio in PO 2 necessario per ristabilire il volume di O 2 dipende da dove i valori di CO 2 sono posizionati sulla curva di dissociazione dell ossiemoglobina. Poiché la pendenza della curva di dissociazione dell ossiemoglobina si appiattisce sul lato destro della curva, quando la PaO 2 si sposta verso destra la riduzione in PO 2 aumenta in corrispondenza della rimozione di un determinato volume di O 2. Ciò accade perché una quantità maggiore di O 2 disciolto viene rimossa, mano a mano che ci si muove lungo il lato destro della curva. Ciò significa che il cambio medio sull asse delle ordinate resta sempre 4.5 mlo 2 /dl, ma il cambio sull asse delle ascisse varia in dipendenza da dove i valori di CO 2 sono posizionati lungo la curva. Questo costituisce il processo di apertura della finestra di ossigeno con l aumentare della PO 2. Ipotizzando che il volume di O 2 rimosso sia costante (4.5 mlo 2 /dl) la quantità di CO 2 prodotta rimane costante, e tale rimane anche l aumento di Pvco 2. Questo significa che l aumento di arterioso-venoso nella Pco 2 rimane sempre a circa 5 mmhg, mentre la riduzione di arterioso-venoso della PO 2 può variare dai 50 a più di 1000 mmhg. LA RESPIRAZIONE VITALE DI OSSIGENO AD UNA ATMOSFERA Prima di dedicarci alla fisiologia iperbarica la comprensione di come la finestra a ossigeno possa venire ampliata a 1 ATA è utile per capire il passaggio dalla superficie alla profondità. La Fig. 6 mostra le pressioni parziali inspirate verso il Fig. 7 11
12 sangue venoso durante la respirazione di O 2 a 1 ATA. In questo esempio si assume che tutto l azoto, l argon ed altri gas rari siano stati eliminati dal sistema. Durante la respirazione di O 2 le disuguaglianze nella ventilazione/perfusione del polmone hanno un impatto molto maggiore sulla Pao 2 che durante la respirazione in aria. In condizioni ottimali durante la respirazione di ossigeno ad 1 ATA la PaO 2 ammonterebbe a circa 500 mmhg. A causa della maggiore differenza tra la PO 2 alveolare ed arteriosa, il sangue arterioso è sottosaturato a 166 mmhg. Quando il sangue si sposta attraverso il tessuto gli stessi 4.5 mlo 2 /dl di sangue vengono rimossi e la PO 2 cade a 57 mmhg nel sangue venoso. Perciò il sangue venoso è insaturo a 518 mmhg, durante la respirazione di ossigeno a 1 ATA. La figura 7 mostra le difference di CO 2 e PO 2 nel sangue arterioso e venoso durante la respirazione in O 2 a 1 ATA. Si tratta della stessa curva di dissociazione dell ossiemoglobina mostrata in fig. 5, ma la parte destra del grafico è stata estesa a valori maggiori della PO 2. Si noti che la quantità di O 2 rimossa ammonta a 4.5 mlo 2 /dl di sangue (sull asse delle ordinate), come nella figura 5. Ma, poiché la PaO 2 viene a muoversi verso la destra quando la pendenza della curva si appiattisce, il cambiamento nella PO 2 è molto maggiore dell aria respirata ad 1 ATA. In questo esempio i 518 mmhg di in saturazione nel sangue venoso costituiscono la Finestra d Ossigeno. Se un gas non-respiratorio fosse rilasciato dai tessuti esso potrebbe occupare una parte o tutta la Finestra d Ossigeno. LA VITA SUBACQUEA E finalmente arriviamo agli effetti delle condizioni iperbariche sulla Finestra d Ossigeno. Respirare O 2 a 20 piedi (6 m, NdT) da come risultato una PO 2 di 1,6 ATA (1216 mmhg). Come nel precedente esempio di respirazione in Ossigeno ad 1 ATA, si presupponeva la presenza di soli gas respiratori. La Fig 8 mostra pressioni parziali per gas ispirato e venoso per una respirazione di Ossigeno ad 1,6 ATA. Come nelle precedenti figure 3 e 6, sussiste una diminuzione a gradino nelle pressioni parziali dagli alveoli al sangue venoso. La fig. 9 illustra la relazione tra i valori di CO 2 e PO 2 per Ossigeno respirato ad 1,6 ATA. La differenza tra CO 2 arterioso e venoso (asse delle ordinate) rimane costante a 4,5 ml O 2 /dl di sangue. Pertanto, poiché il contenuto di ossigeno disciolto è cresciuto notevolmente, i valori di CO 2 vengono a spostarsi verso l alto sull asse delle ordinate, ed i valori della PO 2 si spostano verso destra dell asse delle ascisse. Una osservazione della curva nella fig. 9 indica che con lo spostamento verso destra della CaO 2 (arteriosa) e della CvO 2 (venosa) la finestra ad ossigeno continuerà ad espandersi fino a che la CvO 2 si sposta sopra la piega della curva. Ciò accade quando l emoglobina venosa viene saturata completamente di ossigeno e solamente l ossigeno disciolto viene rimosso per rispondere alla domanda di ossigeno del tessuto. Per raggiungere la piena saturazione dell emoglobina venosa è necessaria una pressione parziale PO 2 di approssimativamente 3 ATA. La fig. 10 mostra uno schema della finestra di ossigeno nei confronti della PaO 2. Quando la PaO 2 supera i
13 mmhg la finestra di ossigeno avrà raggiunto un valore massimo di 1400 mmhg. La tossicità dell ossigeno chiaramente limita la finestra di ossigeno a valori molto più bassi durante l immersione. Fig. 8 Sarà utile considerare cosa accada alla finestra di ossigeno quando l ossigeno venga respirato a 3 ed a 6 m. Quando l ossigeno viene respirato a 6 m. (1,6 ATA) la finestra di ossigeno risulta di 1066 mmhg. Se l ossigeno viene respirato a 3 metri (1,3 ATA) la finestra di ossigeno si riduce a 844 mmhg, un decremento di 222 mmhg. Ciò significa che vi è meno spazio di pressione parziale da occupare nel sangue venoso per il gas non-metabolico durante la respirazione di ossigeno a 3 m. se confrontato con i 6 m. Inoltre l eliminazione del gas inerte è indipendente dalla profondità durante la respirazione in ossigeno. Il gradiente di pressione parziale del gas per il passaggio dal tessuto nel sangue non viene influenzato dalla pressione ambiente; esso viene controllato dalla pressione parziale del gas nel tessuto e nel sangue arterioso. Fin tanto che la pressione parziale arteriosa sarà zero il gradiente per la rimozione del gas dal tessuto risulta massimo. Respirare ossigeno ad una profondità maggiore ha il vantaggio che una pressione idrostatica maggiore tenga il gas disciolto in soluzione. Se un miscuglio di gas con meno del 100% di ossigeno fosse respirato una parte della finestra di ossigeno sarebbe occupata dal gas inerte. Per esempio, se si respirasse un miscuglio di Nitrox al 50% oppure 80% a 6 m. l N 2 occuperebbe una parte della pressione parziale della finestra di ossigeno. Quanto della finestra sarebbe occupato dipenderà dalla pressione parziale di N 2 nel tessuto, la quale determinerà quanto N 2 si diffonderebbe dal sangue nel tessuto e la PvN 2 risultante. La finestra ad ossigeno si ridurrebbe di una quantità uguale alla PvN 2. 13
14 Fig. 9 E IMPORTANTE LA FINESTRA DI OSSIGENO? Dovrebbe essere di per sé ovvio che l eliminazione di un gas dal tessuto può venire accelerata dalla eliminazione del gas dal miscuglio inspirato. Se la pressione parziale arteriosa di un gas è nulla non vi sarà alcun gas in diffusione nel tessuto mentre il gas si sta diffondendo al di fuori del tessuto. Come discusso sopra la diffusione di un solo gas in soluzione non è interessata dalla presenza di altri gas. Nonostante tutta la discussione precedente sulla diffusione dei gas la maggior parte dei modelli decompressivi di uso comune, inclusi i modelli di Bühlmann, sono modelli limitati alla per fusione. In un modello a per fusione si assume che la diffusione sia illimitata e che diu conseguenza essa non possa limitare l assorbimento di gas nel tessuto o il suo rilascio. I semiperiodi del tessuto dell He ed N 2 sono indipendenti l uno dall altro e di conseguenza la presenza o assenza dell N 2 non cambia il ritmo di passaggio in entrata od in uscita in fase libera dell He e viceversa. In teoria il rilascio in fase libera dell He non dovrebbe cambiare respirando aria, Nitrox 50% o Ossigeno 100% durante una decompressione successiva ad una immersione con He. L eliminazione dell He durante una decompressione in aria o ossigeno successiva ad una immersione a base di Elio è stata misurata ed il gas decompressivo non ha influenzato il ritmo o il volume dell Elio in espirazione (4). In un altro studio ad 1 ATA la liberazione di N 2 non cambia durante la respirazione di O 2 o Heliox (3). Entrambi gli studi sono fondati sulla fisica della diffusione dei gas in soluzione, dove la presenza di un secondo gas non-metabolico non rallenta la diffusione del primo gas non-metabolico. In realtà ad ogni data pressione ambiente, indipendentemente dalla dimensione della finestra di ossigeno, finchè non vi sia Elio inspirato, il tasso di eliminazione in fase libera di He resterà invariato. 14
15 La decompressione da una immersione eseguita a base di N 2 è di durata maggiore con miscele decompressive contenenti N 2 perché una certa quantità di N 2 si continua a diffondere nel tessuto durante la decompressione. La decompressione da una immersione eseguita a base di He può durare di più con miscele decompressive contenenti N 2 in quanto l N 2 si diffonde nel tessuto mentre l He si diffonde al di fuori. La necessità di decomprimersi di un compartimento tissutale dipende dalla somma delle pressioni parziali di gas in quel compartimento. Ciò significa che se un tessuto è carico di N 2 appena l He viene liberato, quel tessuto detiene una maggiore necessità a decomprimersi che nel caso in cui nessuna quantità di N 2 si aggiunga al tessuto durante la liberazione di He. Un allargamento della finestra di ossigeno può verificarsi solamente quando la PaO 2 aumenta fino ad un valore massimo tollerato o per aumento della profondità o per aumento della FiO 2 della miscela gassosa oppure per entrambe le cause. Sebbene l allargamento della finestra di ossigeno non possa direttamente influire sull eliminazione del gas nel tessuto, esso influenza invece direttamente l assorbimento di gas nel tessuto durante la decompressione, la quale influenza la quantità di tempo necessaria per decomprimere il tessuto. L ampliamento della finestra ad ossigeno può avere un secondo effetto, più sottile del passaggio in soluzione e del rilascio di gas nel tessuto. La considerazione che segue è una ipotesi basata su dati disponibili dalla letteratura e non è stata fatta direttamente oggetto di studi. Durante la decompressione a seguito di immersione in aria, effettuata su animali il sangue venoso si sovrasatura di N 2 durante le fasi iniziali della decompressione e la sovrasaturazione del sangue venoso sembrava connessa alla formazione di bolle venose (2). Fig
16 Fig. 11 La sovrasaturazione di N 2 nel sangue venoso si verificò in seguito ad uno stress decompressivo relativamente medio in una risalita da 15 m alla superficie. Dopo la formazione di bolle la liberazione del gas fu rallentata, forse da bolle presenti nella circolazione venosa (2). Limitando la velocità con la quale la pressione ambiente viene cambiata i deep stops possono venire utilizzati per ridurre la sovrasaturazione nel sangue venoso e la formazione di bolle collegata alla sovrasaturazione. Aumentare la finestra di ossigeno durante la decompressione farà diminuire la sovrasaturazione del sangue venoso con la diminuizione della quantità di gas nonmetabolico nel sangue. Di fatto la presenza o assenza di un secondo gas nonmetabolico non altererà la quantità di gas in fuoriuscita dal tessuto. Però la presenza di un gas inspirato non-metabolico potrebbe aumentare la consistenza della sovrasaturazione nel sangue venoso. La Fig. 12 dimostra le pressioni parziali venose ipotetiche durante la decompressione da una immersione in He con Ossigeno o aria a 6 m. In questo esempio la pressione parziale dell Elio nel sangue venososi assume essere di 1000 mmhg in entrambe le condizioni. Durante la respirazione in Aria a 6 m, la PaN 2 ammonterebbe approssimativamente a 1140 mmhg, di conseguenza una Pressione venosa presunta dell N 2 del valore di 800 mmhg permette un certo assorbimento di N 2 nei tessuti. La pressione ambiente a 6 m è di 1216 mmhg. A causa della finestra di Ossigeno la pressione parziale totale nel sangue venoso durante la respirazione di Ossigeno ammonterebbe a 1150 mmhg, quindi di meno che la pressione ambiente. Il valore totale della pressione parziale del sangue venoso durante la respirazione in Aria a 6 m ammonterebbe a 1937 mmhg, quindi al di sopra della pressione ambiente. Sebbene non esistano dati sperimentali su questo argomento, la respirazione in Ossigeno può limitare la sovrasaturazione del sangue venoso, può prevenire la formazione di bolle nel sangue venoso, e di conseguenza accelerare la liberazione del gas dal tessuto. 16
17 Fig. 12 CONCLUSIONI Dovrebbe risultare ovvio dalla discussione di cui sopra, come la più parte della fisiologia decompressiva venga scarsamente compresa e come i modelli utilizzati approssimino nella migliore delle ipotesi la reale fisiologia. Certamente non tutte le patologie da decompressione possono essere previste o evitate. Ma comunque una applicazione ragionevole dei modelli a disposizione associata ad una tecnica di immersione conservativa può minimizzare i rischi di malattia da decompressione. Riducendo i gas non-metabolici al minimo e diminuendo l assorbimento tissutale dei gas la finestra di Ossigeno può venire utilizzata per aumentare la quantità di gas uscente in fase libera dai tessuti durante la decompressione. L esperienza dalla vita reale indica che l utilizzo di miscele decompressive arricchite di Ossigeno può funzionare al fine di limitare il tempo decompressivo e la possibilità di una incidenza di malattia da decompressione. L uso di miscele ad alto contenuto di Ossigeno richiede precisa attenzione alla pianificazione della immersione ed alla sua esecuzione. E, come sempre, il subacqueo concentrato ed attento sarà un subacqueo protetto. 17
18 RIFERIMENTI 1. Asknes, E., e H. Rahn. Measurement of total gas pressure in blood. J. Appl. Physiol. 10: , D Aoust, B.G., H.T. Swanson, R. White, R. Dunford, e J. Mahoney. Central venous bubbles and mixed venous nitrogen in goats following decompression. J. Appl. Physiol. 51: , Groom, A.C., S.H. Song, Y. Ohta, e L.E. Farhi. Effect of Anesthesia on rate of N 2 washout from body stores. J. Appl. Physiol. 37: , Kindwall, E.P. Measurement of Helium elimination from man during decompression breathing air or oxygen. Undersea Biomed. Res. 2: , Krogh, A. e M. Krogh. On the tension of gases in the arterial blood. Skandinavisches Archiv für Physiol. 23: , Lategola, M.T. Measurement of total pressure of dissolved gas in mammalian tissue in vivo. J. Appl. Physiol.19: , Vann, R.D., e E.D.Thalmann: Decompression Physiology and Practice in P. Bennet and D. Elliott (eds): The Physiology and Medicine of Diving. London, W.B. Saunders Company, Ltd, 1993, pp
Scambi gassosi e regolazione del respiro
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ruolo del Sistema Respiratorio: - fornire O 2 - rimuovere CO 2 Scaricato da www.sunhope.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ruolo del Sistema Respiratorio: - fornire O 2 - rimuovere CO 2 Scaricato da www.sunhope.it
Trasporto di O 2 nel sangue
 Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Fisiologia della Respirazione 9.Scambi gassosi-ventilazione vent/perf. FGE aa
 Fisiologia della Respirazione 9.Scambi gassosi-ventilazione vent/perf FGE aa.2015-16 Obiettivi Studio delle relazioni quantitative tra ventilazione, flusso di sangue nei polmoni, composizione dell aria
Fisiologia della Respirazione 9.Scambi gassosi-ventilazione vent/perf FGE aa.2015-16 Obiettivi Studio delle relazioni quantitative tra ventilazione, flusso di sangue nei polmoni, composizione dell aria
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO
 L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
po % O % N % CO 2 = 159 mmhg pn 2 = 597 mmhg pco 2 = 0.3 mmhg
 Scambi alveolari L aria che respiriamo è una miscela di gas, principalmente costituita da O 2, N 2 e CO 2. La velocità di diffusione di ciascuno di questi gas (quantità di gas che diffonde nell unità di
Scambi alveolari L aria che respiriamo è una miscela di gas, principalmente costituita da O 2, N 2 e CO 2. La velocità di diffusione di ciascuno di questi gas (quantità di gas che diffonde nell unità di
I gas e loro proprietà Cap , 9-12, 15-24, 27-28, 31-33, 37-40, 52, 93-96
 2016 2017 CCS - Biologia CCS Scienze Geologiche 1 I gas e loro proprietà Cap 11. 1-7, 9-12, 15-24, 27-28, 31-33, 37-40, 52, 93-96 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito.
2016 2017 CCS - Biologia CCS Scienze Geologiche 1 I gas e loro proprietà Cap 11. 1-7, 9-12, 15-24, 27-28, 31-33, 37-40, 52, 93-96 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito.
Anatomia del sistema respiratorio
 Funzioni del sistema respiratorio 1. Convogliare l aria muovendola verso le vie respiratorie e viceversa. 2. Proteggere le superfici di scambio da danni ambientali e disidratazione. 3. Riscaldare e umidificare
Funzioni del sistema respiratorio 1. Convogliare l aria muovendola verso le vie respiratorie e viceversa. 2. Proteggere le superfici di scambio da danni ambientali e disidratazione. 3. Riscaldare e umidificare
LEGGI DI FISICA PER LA SUBACQUEA PRINCIPIO DI ARCHIMEDE
 LEGGI DI FISICA PER LA SUBACQUEA PRINCIPIO DI ARCHIMEDE Un corpo immerso in un fluido riceve una spinta dal basso verso l'alto pari al peso del volume del fluido che sposta. Il GAV è una applicazione pratica
LEGGI DI FISICA PER LA SUBACQUEA PRINCIPIO DI ARCHIMEDE Un corpo immerso in un fluido riceve una spinta dal basso verso l'alto pari al peso del volume del fluido che sposta. Il GAV è una applicazione pratica
Anatomia del sistema respiratorio
 Funzioni del sistema respiratorio 1. Fornire una vasta area per lo scambio gassoso tra sangue e ambiente esterno (aria) per consentire ingresso di ossigeno ed eliminazione di anidride carbonica. 2. Convogliare
Funzioni del sistema respiratorio 1. Fornire una vasta area per lo scambio gassoso tra sangue e ambiente esterno (aria) per consentire ingresso di ossigeno ed eliminazione di anidride carbonica. 2. Convogliare
Apparato Respiratorio
 Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica A.A. 2016-2017 Apparato Respiratorio Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica A.A. 2016-2017 Apparato Respiratorio Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Azoto. La molecola di azoto e formata da due atomi di azoto, legati insieme con un triplo legame:
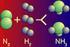 Aria ed atmosfera L aria Questo sottile strato, inodore ed incolore è una miscela di gas: 78 % di azoto; 21 % di ossigeno; 0,03 % di anidride carbonica; 0,97 % altri gas. Azoto La molecola di azoto e formata
Aria ed atmosfera L aria Questo sottile strato, inodore ed incolore è una miscela di gas: 78 % di azoto; 21 % di ossigeno; 0,03 % di anidride carbonica; 0,97 % altri gas. Azoto La molecola di azoto e formata
QUADERNI DIDATTICI L OSSIGENO NEGLI INCIDENTI DECOMPRESSIVI IN COLLABORAZIONE CON
 QUADERNI DIDATTICI L OSSIGENO NEGLI INCIDENTI DECOMPRESSIVI IN COLLABORAZIONE CON DIPARTIMENTO NAZIONALE EMERGENZA MARE 1 NEGLI INCIDENTI DECOMPRESSIVI SOMMINISTRARE OSSIGENO FINO ALL ARRIVO IN CAMERA
QUADERNI DIDATTICI L OSSIGENO NEGLI INCIDENTI DECOMPRESSIVI IN COLLABORAZIONE CON DIPARTIMENTO NAZIONALE EMERGENZA MARE 1 NEGLI INCIDENTI DECOMPRESSIVI SOMMINISTRARE OSSIGENO FINO ALL ARRIVO IN CAMERA
CdL Professioni Sanitarie A.A. 2012/2013. Unità 9: Gas e processi di diffusione
 L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
POTENZA METABOLICA. Fisica Applicata, Area Infermieristica, M. Ruspa
 POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
L apparato respiratorio. In movimento Marietti Scuola 2010 De Agostini Scuola S.p.A. Novara
 L apparato respiratorio Fasi della respirazione La ventilazione polmonare (o esterna) La diffusione Il trasporto dei gas La respirazione cellulare (o interna) Le vie aeree Le vie aeree I polmoni Il destro
L apparato respiratorio Fasi della respirazione La ventilazione polmonare (o esterna) La diffusione Il trasporto dei gas La respirazione cellulare (o interna) Le vie aeree Le vie aeree I polmoni Il destro
LA DECOMPRESSIONE DA ALTOFONDALE Prof. Luigi Magno UNIVERSITÀ DEGLI STUDI DI GENOVA
 LA DECOMPRESSIONE DA ALTOFONDALE Prof. Luigi Magno UNIVERSITÀ DEGLI STUDI DI GENOVA È noto che l assorbimento dei gas da parte dei liquidi è proporzionale alla pressione alla quale essi sono sottoposti
LA DECOMPRESSIONE DA ALTOFONDALE Prof. Luigi Magno UNIVERSITÀ DEGLI STUDI DI GENOVA È noto che l assorbimento dei gas da parte dei liquidi è proporzionale alla pressione alla quale essi sono sottoposti
Trasporto dei gas. Pressioni Volumi
 Trasporto dei gas Pressioni Volumi Il 97% dell O 2 trasportato nel plasma si trova chimicamente legato all Hb nei globuli rossi, solo lo 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O
Trasporto dei gas Pressioni Volumi Il 97% dell O 2 trasportato nel plasma si trova chimicamente legato all Hb nei globuli rossi, solo lo 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O
COMPOSIZIONE DELL ARIA ATMOSFERICA SECCA E PRESSIONI PARZIALI DEI GAS - (760 TORR, 15 C)
 COMPOSIZIONE DELL ARIA ATMOSFERICA SECCA E PRESSIONI PARZIALI DEI GAS - (760 TORR, 15 C) COMPOSIZIONE ARIA NELL ATMOSFERA = COSTANTE A PARTE LE VARIAZIONI DELLA QUANTITA DI VAPORE ACQUEO A 0 C 1 torr =
COMPOSIZIONE DELL ARIA ATMOSFERICA SECCA E PRESSIONI PARZIALI DEI GAS - (760 TORR, 15 C) COMPOSIZIONE ARIA NELL ATMOSFERA = COSTANTE A PARTE LE VARIAZIONI DELLA QUANTITA DI VAPORE ACQUEO A 0 C 1 torr =
Fisiologia della Respirazione 6.Meccanica respiratoria: Statica e fenomeni di superficie 2. FGE aa
 Fisiologia della Respirazione 6.Meccanica respiratoria: Statica e fenomeni di superficie 2 FGE aa.2015-16 Obiettivi I fenomeni di superficie principali determinanti dell isteresi polmonare e della pressione
Fisiologia della Respirazione 6.Meccanica respiratoria: Statica e fenomeni di superficie 2 FGE aa.2015-16 Obiettivi I fenomeni di superficie principali determinanti dell isteresi polmonare e della pressione
FISIOLOGIA VEGETALE. I movimenti dell acqua e dei soluti
 FISIOLOGIA VEGETALE I movimenti dell acqua e dei soluti MOVIMENTI DELL ACQUA E DEI SOLUTI L acqua si muove seguente delle differenze di potenziali di energia Il potenziale di energia è l energia che viene
FISIOLOGIA VEGETALE I movimenti dell acqua e dei soluti MOVIMENTI DELL ACQUA E DEI SOLUTI L acqua si muove seguente delle differenze di potenziali di energia Il potenziale di energia è l energia che viene
il sistema respiratorio
 il sistema respiratorio respirazione cellulare (o interna) e respirazione esterna scambio dei gas regolato dalle leggi della diffusione in alcuni organismi la respirazione avviene attraverso la superficie
il sistema respiratorio respirazione cellulare (o interna) e respirazione esterna scambio dei gas regolato dalle leggi della diffusione in alcuni organismi la respirazione avviene attraverso la superficie
Apparato respiratorio
 Apparato respiratorio Anatomia Le vie aeree: di conduzione e di scambio 3 L Trachea, bronchi principali, bronchioli (diametro 1 mm) sono dotati di struttura cartilaginea ad anello incompleto e fibre muscolari
Apparato respiratorio Anatomia Le vie aeree: di conduzione e di scambio 3 L Trachea, bronchi principali, bronchioli (diametro 1 mm) sono dotati di struttura cartilaginea ad anello incompleto e fibre muscolari
Apparato respiratorio. Anatomia
 Apparato respiratorio Anatomia 1 Le vie aeree: di conduzione e di scambio 3 L Trachea, bronchi principali, bronchioli (diametro 1 mm) sono dotati di struttura cartilaginea ad anello incompleto e fibre
Apparato respiratorio Anatomia 1 Le vie aeree: di conduzione e di scambio 3 L Trachea, bronchi principali, bronchioli (diametro 1 mm) sono dotati di struttura cartilaginea ad anello incompleto e fibre
Entropia e secondo principio della termodinamica: prevedere la spontaneità di un processo
 1 Entropia e secondo principio della termodinamica: prevedere la spontaneità di un processo Limitazioni della prima legge della termodinamica 2 E = q + w E universo = E sistema + E ambiente E sistema =
1 Entropia e secondo principio della termodinamica: prevedere la spontaneità di un processo Limitazioni della prima legge della termodinamica 2 E = q + w E universo = E sistema + E ambiente E sistema =
Stati della materia. Esempio. Fusione e solidificazione. Esempio. Stati di aggregazione della materia
 Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Il prodotto della pressione per il volume di una determinata massa gassosa è direttamente proporzionale alla temperatura assoluta: PV = KT
 ESERCITAZIONE 5 LEGGI DEI GAS Le leggi che governano i rapporti che si stabiliscono tra massa, volume, temperatura e pressione di un gas, sono leggi limite, riferite cioè ad un comportamento ideale, cui
ESERCITAZIONE 5 LEGGI DEI GAS Le leggi che governano i rapporti che si stabiliscono tra massa, volume, temperatura e pressione di un gas, sono leggi limite, riferite cioè ad un comportamento ideale, cui
COMPITO: assicurare un continuo ed adeguato apporto di O 2 alle cellule ed eliminare l eccesso di CO 2
 RESPIRAZIONE è l insieme dei meccanismi che permettono lo scambio di gas metabolicamente attivi (O 2 e CO 2 ) tra ambiente esterno e cellule dell organismo vivente COMPITO: assicurare un continuo ed adeguato
RESPIRAZIONE è l insieme dei meccanismi che permettono lo scambio di gas metabolicamente attivi (O 2 e CO 2 ) tra ambiente esterno e cellule dell organismo vivente COMPITO: assicurare un continuo ed adeguato
Diagramma di fase f(p,v,t)=0
 Diagramma di fase f(p,v,t)=0 Taglio P(V) (per diversi valori di T) Prospetto P(T) Prospetto P(T): variazione di volume alla fusione Congelando si contrae Es: anidride carbonica Congelando si espande
Diagramma di fase f(p,v,t)=0 Taglio P(V) (per diversi valori di T) Prospetto P(T) Prospetto P(T): variazione di volume alla fusione Congelando si contrae Es: anidride carbonica Congelando si espande
Regolazione della pressione arteriosa
 Regolazione della pressione arteriosa Riflesso barocettivo Controllo riflesso Centro di integrazione: bulbo del troncoencefalico Mantenimento flusso sanguigno a cuore e cervello Risposta veloce Regolazione
Regolazione della pressione arteriosa Riflesso barocettivo Controllo riflesso Centro di integrazione: bulbo del troncoencefalico Mantenimento flusso sanguigno a cuore e cervello Risposta veloce Regolazione
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici
 La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
FISIOLOGIA GENERALE - ESERCITAZIONE n. 5 del 30 Novembre Superficie
 FISIOLOGIA GENERALE - ESERCITAZIONE n. 5 del 30 Novembre 2016 Esercizio n. 1 Respirazione Si prendano in considerazione i diversi fattori che, in combinazione, danno origine alle differenze di velocità
FISIOLOGIA GENERALE - ESERCITAZIONE n. 5 del 30 Novembre 2016 Esercizio n. 1 Respirazione Si prendano in considerazione i diversi fattori che, in combinazione, danno origine alle differenze di velocità
Lezione 20: Atomi e molecole
 Lezione 20 - pag.1 Lezione 20: Atomi e molecole 20.1. Il punto della situazione Abbiamo visto, nella lezione precedente, come il modello atomico sia in grado di spiegare la grande varietà di sostanze che
Lezione 20 - pag.1 Lezione 20: Atomi e molecole 20.1. Il punto della situazione Abbiamo visto, nella lezione precedente, come il modello atomico sia in grado di spiegare la grande varietà di sostanze che
Un modello per il gas ideale
 Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
P aria (livello del mare) = 760 mmhg. Composizione: O 2 : 20.84% N 2 : 78.62% CO 2 : 0.04% po 2 = 159 mmhg. pn 2 = 597mmHg. pco 2 = 0.
 Scambi alveolari Aria atmosferica = miscela di gas (principalmente O 2, N 2, CO 2 ) La velocità di diffusione di un gas (quantità di gas che diffonde nell unità di tempo) è direttamente proporzionale alla
Scambi alveolari Aria atmosferica = miscela di gas (principalmente O 2, N 2, CO 2 ) La velocità di diffusione di un gas (quantità di gas che diffonde nell unità di tempo) è direttamente proporzionale alla
Lezione 11 Soluzioni. Diffusione ed osmosi.
 Lezione 11 Soluzioni. Diffusione ed osmosi. Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici
Lezione 11 Soluzioni. Diffusione ed osmosi. Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici
FUNZIONI delle PROTEINE
 FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
Diffusione e osmosi. Roberto Cirio. Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico Corso di Fisica
 Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
1.Pressione di un Gas
 1.Pressione di un Gas Un gas è formato da molecole che si muovono in modo disordinato, urtandosi fra loro e urtando contro le pareti del recipiente che le contiene. Durante gli urti, le molecole esercitano
1.Pressione di un Gas Un gas è formato da molecole che si muovono in modo disordinato, urtandosi fra loro e urtando contro le pareti del recipiente che le contiene. Durante gli urti, le molecole esercitano
GAS. H 2 N 2 O 2 F 2 Cl 2 CO CO 2 NO 2 SO 2 CH 4
 GAS Non hanno né forma né volume propri. Sono facilmente comprimibili. Sono in genere gassose le sostanze costituite da molecole piccole e di basso peso molecolare. H 2 N 2 O 2 F 2 Cl 2 He Ne Ar CO CO
GAS Non hanno né forma né volume propri. Sono facilmente comprimibili. Sono in genere gassose le sostanze costituite da molecole piccole e di basso peso molecolare. H 2 N 2 O 2 F 2 Cl 2 He Ne Ar CO CO
MODULO 3. La pressione
 MODULO 3 La pressione La pressione L obiettivo del modulo è comprendere gli effetti delle forze che dipendono dalla superficie su cui esse vengono applicate. Il grado di concentrazione di una forza sulla
MODULO 3 La pressione La pressione L obiettivo del modulo è comprendere gli effetti delle forze che dipendono dalla superficie su cui esse vengono applicate. Il grado di concentrazione di una forza sulla
Lezione 2. Leggi ponderali
 Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE
 VOLUMI POLMONARI DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE DEFINIRE LE RESISTENZE POLMONARI DEFINIRE IL LAVORO POLMONARE Equazione
VOLUMI POLMONARI DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE DEFINIRE LE RESISTENZE POLMONARI DEFINIRE IL LAVORO POLMONARE Equazione
10. LA MISURA DELLA TEMPERATURA
 1. LA MISURA DELLA TEMPERATURA 1.1 L organizzazione della materia Tutte le sostanze sono composte da atomi. Quando due o più atomi si legano assieme formano molecole. Atomi o molecole sono le unità (particelle)
1. LA MISURA DELLA TEMPERATURA 1.1 L organizzazione della materia Tutte le sostanze sono composte da atomi. Quando due o più atomi si legano assieme formano molecole. Atomi o molecole sono le unità (particelle)
Misure di gas disciolti
 Misure di gas disciolti Misura dell ossigeno Elettrodo di ossigeno L elettrodo Clark Misura di anidride carbonica Misurazione transcutanea dei gas nel sangue Monitoraggio transcutaneo di anidride carbonica
Misure di gas disciolti Misura dell ossigeno Elettrodo di ossigeno L elettrodo Clark Misura di anidride carbonica Misurazione transcutanea dei gas nel sangue Monitoraggio transcutaneo di anidride carbonica
IL SISTEMA CIRCOLATORIO UMANO
 Funzione Vasi sanguigni Aorta Vene cave IL SISTEMA CIRCOLATORIO Arterie polmonari UMANO Vene polmonari Struttura Circolazione Sistematica e polmonare FUNZIONI Distribuzione delle sostanze nutritive dall
Funzione Vasi sanguigni Aorta Vene cave IL SISTEMA CIRCOLATORIO Arterie polmonari UMANO Vene polmonari Struttura Circolazione Sistematica e polmonare FUNZIONI Distribuzione delle sostanze nutritive dall
delle curve isoterme dell anidride carbonica
 COMPORTAMENTO DEI GAS REALI l andamento delle curve isoterme dell anidride carbonica mostra che: a temperature elevate le isoterme assomigliano a quelle di un gas perfetto Diagramma di Andrews a temperature
COMPORTAMENTO DEI GAS REALI l andamento delle curve isoterme dell anidride carbonica mostra che: a temperature elevate le isoterme assomigliano a quelle di un gas perfetto Diagramma di Andrews a temperature
Il potenziale di membrana a riposo
 Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti su entambe le facce della membrana; la membrana stessa;
Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti su entambe le facce della membrana; la membrana stessa;
Massa degli atomi e delle molecole
 Dallo studio dei volumi di gas nelle reazioni chimiche alle masse degli atomi e delle molecole Lo stato fisico di di un gas è descritto da tre grandezze fisiche: PRESSIONE (p) VOLUME (V) TEMPERATURA (T)
Dallo studio dei volumi di gas nelle reazioni chimiche alle masse degli atomi e delle molecole Lo stato fisico di di un gas è descritto da tre grandezze fisiche: PRESSIONE (p) VOLUME (V) TEMPERATURA (T)
APPARATO RESPIRATORIO
 APPARATO RESPIRATORIO Cosa impareremo: 1. Le funzioni generali della respirazione 2. Gli organi dell apparato respiratorio superiore 3. Gli organi dell apparato respiratorio inferiore 4. La ventilazione
APPARATO RESPIRATORIO Cosa impareremo: 1. Le funzioni generali della respirazione 2. Gli organi dell apparato respiratorio superiore 3. Gli organi dell apparato respiratorio inferiore 4. La ventilazione
Esercitazioni per il corso di Storia economica (00-49) Parte II 12 maggio 2015
 Esercitazioni per il corso di Storia economica (00-49) Parte II 12 maggio 2015 Prof. Michelangelo Vasta 1 Oggi vedremo: (1) Economie di Scala (2) Disoccupazione e Legge di Okun (3) Inflazione e Curva di
Esercitazioni per il corso di Storia economica (00-49) Parte II 12 maggio 2015 Prof. Michelangelo Vasta 1 Oggi vedremo: (1) Economie di Scala (2) Disoccupazione e Legge di Okun (3) Inflazione e Curva di
EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI
 EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI SOMMARIO ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO ACIDO-BASE EGA (EMOGAS-ANALISI) ANALISI) ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO
EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI SOMMARIO ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO ACIDO-BASE EGA (EMOGAS-ANALISI) ANALISI) ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO
Protezione Civile - Regione Friuli Venezia Giulia. Protezione Civile - Regione Friuli Venezia Giulia
 1 Principi di idraulica Definizioni MECCANICA DEI FLUIDI È il ramo della fisica che studia le proprietà dei fluidi, cioè liquidi, vapori e gas. Idrostatica Studia i fluidi in quiete Idrodinamica Studia
1 Principi di idraulica Definizioni MECCANICA DEI FLUIDI È il ramo della fisica che studia le proprietà dei fluidi, cioè liquidi, vapori e gas. Idrostatica Studia i fluidi in quiete Idrodinamica Studia
Dinamica delle reazioni chimiche (attenzione: mancano i disegni)
 Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
Distribuzione e Temperatura. Pressione di Vapore. Evaporazione
 Evaporazione Le molecole del Liquido hanno una distribuzione di energia cinetica. Una frazione di molecole della superficie del liquido ha energia cinetica sufficiente per sfuggire all attrazione attrazione
Evaporazione Le molecole del Liquido hanno una distribuzione di energia cinetica. Una frazione di molecole della superficie del liquido ha energia cinetica sufficiente per sfuggire all attrazione attrazione
ESERCIZIO n. 2. Soluzione
 Economia Internazionale e Politiche Commerciali a.a. 2013/14 ESERCIZIO n. 2 Krugman, Obstfeld e Melitz, Capitolo 4: Problemi n. 2, 3, 4, 5 e 6 (pp. 101 103) Problema 3 domanda d): Calcolate Discutete gli
Economia Internazionale e Politiche Commerciali a.a. 2013/14 ESERCIZIO n. 2 Krugman, Obstfeld e Melitz, Capitolo 4: Problemi n. 2, 3, 4, 5 e 6 (pp. 101 103) Problema 3 domanda d): Calcolate Discutete gli
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
Introduzione. Emanuele Osti
 Introduzione Emanuele Osti Il sistema respiratorio organizza e attiva la respirazione, un processo tramite il quale il corpo umano prende l aria dall atmosfera, estrae l ossigeno che la circolazione porterà
Introduzione Emanuele Osti Il sistema respiratorio organizza e attiva la respirazione, un processo tramite il quale il corpo umano prende l aria dall atmosfera, estrae l ossigeno che la circolazione porterà
FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA
 FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti
FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti
Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O 2 dagli alveoli al sangue e della
 Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O 2 dagli alveoli al sangue e della CO 2 in direzione opposta. L aria che respiriamo è una
Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O 2 dagli alveoli al sangue e della CO 2 in direzione opposta. L aria che respiriamo è una
SCHEDA PER LO STUDENTE DETERMINAZIONE DELLA DENSITÀ DI UN CORPO SOLIDO
 SCHEDA PER LO STUDENTE DETERMINAZIONE DELLA DENSITÀ DI UN CORPO SOLIDO I Titolo dell esperienza N 2 DETERMINAZIONE DEL VOLUME E DELLA DENSITÀ DI UN CORPO SOLIDO IRREGOLARE Autori Prof.sse Fabbri Fiamma,
SCHEDA PER LO STUDENTE DETERMINAZIONE DELLA DENSITÀ DI UN CORPO SOLIDO I Titolo dell esperienza N 2 DETERMINAZIONE DEL VOLUME E DELLA DENSITÀ DI UN CORPO SOLIDO IRREGOLARE Autori Prof.sse Fabbri Fiamma,
PASSAGGI DI STATO. sublimazione fusione ebollizione. solidificazione. condensazione. brinamento. Calore processi fisici endotermici ( H>0).
 PASSAGGI DI STATO Calore processi fisici endotermici (H>0). sublimazione fusione ebollizione S solidificazione L condensazione V brinamento Scrittura in formule: - H 2 O (s) H 2 O (l) fusione - H 2 O (l)
PASSAGGI DI STATO Calore processi fisici endotermici (H>0). sublimazione fusione ebollizione S solidificazione L condensazione V brinamento Scrittura in formule: - H 2 O (s) H 2 O (l) fusione - H 2 O (l)
Il binomio di van t Hoff Le proprietà colligative dipendono dal numero di particelle effettivamente presenti nella soluzione. Nel caso in cui il solut
 Proprietà colligative di soluzioni ideali Si definiscono proprietà colligative alcune proprietà delle soluzioni indipendenti dalla natura del soluto ma che dipendono soltanto dal numero delle particelle
Proprietà colligative di soluzioni ideali Si definiscono proprietà colligative alcune proprietà delle soluzioni indipendenti dalla natura del soluto ma che dipendono soltanto dal numero delle particelle
Trasformazioni fisiche della materia: i passaggi di stato
 Trasformazioni fisiche della materia: i passaggi di stato Nelle condizioni terrestri la materia può presentarsi in tre differenti stati fisici o stati di aggregazione: solido, liquido e aeriforme. I solidi
Trasformazioni fisiche della materia: i passaggi di stato Nelle condizioni terrestri la materia può presentarsi in tre differenti stati fisici o stati di aggregazione: solido, liquido e aeriforme. I solidi
Fluidi (FMLP: Cap. 11 Meccanica dei fluidi)
 In un fluido Fluidi (FMLP: Cap. 11 Meccanica dei fluidi) le molecole non sono vincolate a posizioni fisse a differenza di quello che avviene nei solidi ed in particolare nei cristalli Il numero di molecole
In un fluido Fluidi (FMLP: Cap. 11 Meccanica dei fluidi) le molecole non sono vincolate a posizioni fisse a differenza di quello che avviene nei solidi ed in particolare nei cristalli Il numero di molecole
SCOPI DELL EMOGASANALISI
 EMOGASANALISI SCOPI DELL EMOGASANALISI La funzione principale della respirazione è quella di assicurare ossigeno all organismo e di eliminare l eccesso di anidride carbonica. L emogasanalisi arteriosa
EMOGASANALISI SCOPI DELL EMOGASANALISI La funzione principale della respirazione è quella di assicurare ossigeno all organismo e di eliminare l eccesso di anidride carbonica. L emogasanalisi arteriosa
Lo stato liquido. Un liquido non ha una forma propria, ma ha la forma del recipiente che lo contiene; ha però volume proprio e non è comprimibile.
 I liquidi Lo stato liquido Lo stato liquido rappresenta una condizione intermedia tra stato aeriforme e stato solido, tra lo stato di massimo disordine e quello di perfetto ordine Un liquido non ha una
I liquidi Lo stato liquido Lo stato liquido rappresenta una condizione intermedia tra stato aeriforme e stato solido, tra lo stato di massimo disordine e quello di perfetto ordine Un liquido non ha una
Le proprietà colligative delle soluzioni
 1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Fisica per scienze ed ingegneria
 Serway, Jewett Fisica per scienze ed ingegneria Capitolo 20 Fino a circa il 1850 su riteneva che la meccanica e la termodinamica fossero due scienze completamente distinte. La legge di conservazione dell
Serway, Jewett Fisica per scienze ed ingegneria Capitolo 20 Fino a circa il 1850 su riteneva che la meccanica e la termodinamica fossero due scienze completamente distinte. La legge di conservazione dell
SOLUZIONI E CONCENTRAZIONE
 SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
apparato respiratorio generalità
 apparato respiratorio generalità 1 funzioni scambio di sostanze gassose tra atmosfera e sangue regolazione del ph corporeo eliminazione della CO2 protezione da patogeni inalati vocalizzazione determina
apparato respiratorio generalità 1 funzioni scambio di sostanze gassose tra atmosfera e sangue regolazione del ph corporeo eliminazione della CO2 protezione da patogeni inalati vocalizzazione determina
Apparato respiratorio
 Apparato respiratorio La respirazione Respirare è l attività che assolve l esigenza continua di fornire ossigeno alle nostre cellule affinché esse, attraverso la combustione delle sostanze nutritive, producano
Apparato respiratorio La respirazione Respirare è l attività che assolve l esigenza continua di fornire ossigeno alle nostre cellule affinché esse, attraverso la combustione delle sostanze nutritive, producano
Meccanica dei Fluidi. stati di aggregazione della materia: solidi liquidi gas. fluidi assumono la forma del contenitore
 Meccanica dei luidi stati di aggregazione della materia: solidi liquidi gas fluidi assumono la forma del contenitore Caratteristiche di un fluido LUIDO sostanza senza forma propria (assume la forma del
Meccanica dei luidi stati di aggregazione della materia: solidi liquidi gas fluidi assumono la forma del contenitore Caratteristiche di un fluido LUIDO sostanza senza forma propria (assume la forma del
Controllo nervoso del respiro
 Controllo nervoso del respiro La respirazione è una funzione involontaria controllata da 3 gruppi di neuroni (centri) localizzati nel tronco encefalico: Controllo nervoso del respiro Centro respiratorio
Controllo nervoso del respiro La respirazione è una funzione involontaria controllata da 3 gruppi di neuroni (centri) localizzati nel tronco encefalico: Controllo nervoso del respiro Centro respiratorio
Bioenergetica e fisiologia dell esercizio 5. Risposte Cardiovascolari all Esercizio Muscolare
 Bioenergetica e fisiologia dell esercizio 5. Risposte Cardiovascolari all Esercizio Muscolare Prof. Carlo Capelli, Fisiologia Generale e dell Esercizio, Facoltà di Scienze Motorie, Università degli Studi
Bioenergetica e fisiologia dell esercizio 5. Risposte Cardiovascolari all Esercizio Muscolare Prof. Carlo Capelli, Fisiologia Generale e dell Esercizio, Facoltà di Scienze Motorie, Università degli Studi
CALORIMETRO DELLE mescolanze
 CALORIMETRO DELLE mescolanze Scopo dell esperienza è la misurazione del calore specifico di un corpo solido. Il funzionamento del calorimetro si basa sugli scambi di energia, sotto forma di calore, che
CALORIMETRO DELLE mescolanze Scopo dell esperienza è la misurazione del calore specifico di un corpo solido. Il funzionamento del calorimetro si basa sugli scambi di energia, sotto forma di calore, che
INTRODUZIONE ALLA TERMODINAMICA. Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta
 INTRODUZIONE ALLA TERMODINAMICA Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta in un recipiente, ad esempio 5g di ossigeno. Dato l elevato numero di molecole
INTRODUZIONE ALLA TERMODINAMICA Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta in un recipiente, ad esempio 5g di ossigeno. Dato l elevato numero di molecole
Effetti dell altitudine su cuore, polmone e circolazione
 Effetti dell altitudine su cuore, polmone e circolazione 2.035 metri Marina Tricoli, ASP 6 Palermo Sestriere 28 A livello del mare.. La pressione barometrica è 760 mmhg La pressione parziale di O2 dell
Effetti dell altitudine su cuore, polmone e circolazione 2.035 metri Marina Tricoli, ASP 6 Palermo Sestriere 28 A livello del mare.. La pressione barometrica è 760 mmhg La pressione parziale di O2 dell
1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5.
 Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
La misura della temperatura
 Calore e temperatura 1. La misura della temperatura 2. La dilatazione termica 3. La legge fondamentale della termologia 4. Il calore latente 5. La propagazione del calore La misura della temperatura La
Calore e temperatura 1. La misura della temperatura 2. La dilatazione termica 3. La legge fondamentale della termologia 4. Il calore latente 5. La propagazione del calore La misura della temperatura La
Il Gas Ideale. Il gas ideale é un'astrazione
 Il Gas Ideale a) le particelle sono animate da moto perenne, ed occupano omogeneamente tutto lo spazio a loro disposizione b) il movimento delle particelle è casuale c) le particelle hanno volume proprio
Il Gas Ideale a) le particelle sono animate da moto perenne, ed occupano omogeneamente tutto lo spazio a loro disposizione b) il movimento delle particelle è casuale c) le particelle hanno volume proprio
approfondimento Fasi e cambiamenti di fase
 approfondimento Fasi e cambiamenti di fase Gas ideali e gas reali Teoria cinetica dei gas e conseguenze Cambiamenti di fase e conservazione della energia Gas ideali e gas reali In un gas ideale: l interazione
approfondimento Fasi e cambiamenti di fase Gas ideali e gas reali Teoria cinetica dei gas e conseguenze Cambiamenti di fase e conservazione della energia Gas ideali e gas reali In un gas ideale: l interazione
Tamponi biologici per il controllo del ph
 Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
PERCORSI ABILITANTI SPECIALI CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA
 PERCORSI ABILITANTI SPECIALI 2014 - CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA Cognome Nome Numero progressivo sul registro 1. Viene disciolto zucchero in un certo volume di acqua pura fino a che si
PERCORSI ABILITANTI SPECIALI 2014 - CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA Cognome Nome Numero progressivo sul registro 1. Viene disciolto zucchero in un certo volume di acqua pura fino a che si
Integrazioni al corso di Economia Politica (anno accademico ) Marianna Belloc
 Integrazioni al corso di Economia Politica (anno accademico 2013-2014) Marianna Belloc 1 L elasticità Come è già noto, la funzione di domanda di mercato indica la quantità che il mercato è disposto ad
Integrazioni al corso di Economia Politica (anno accademico 2013-2014) Marianna Belloc 1 L elasticità Come è già noto, la funzione di domanda di mercato indica la quantità che il mercato è disposto ad
Momento. Si può definire il momento rispetto ad un punto. in è possibile riassumere questa definizione nella formula
 Momento di una forza rispetto a un punto Si può definire il momento rispetto ad un punto 1 Il suo modulo è il prodotto della forza per la distanza del punto dall asse di applicazione di questa 2 La direzione
Momento di una forza rispetto a un punto Si può definire il momento rispetto ad un punto 1 Il suo modulo è il prodotto della forza per la distanza del punto dall asse di applicazione di questa 2 La direzione
L aria e l atmosfera A cura di Giovanna Puppo
 www.matematicamente.it Aria e atmosfera 1 L aria e l atmosfera A cura di Giovanna Puppo 1. Quali sono i gas che costituiscono per la maggior parte l atmosfera? A. Azoto e Ossigeno B. Ossigeno e anidride
www.matematicamente.it Aria e atmosfera 1 L aria e l atmosfera A cura di Giovanna Puppo 1. Quali sono i gas che costituiscono per la maggior parte l atmosfera? A. Azoto e Ossigeno B. Ossigeno e anidride
NOZIONI DI ANATOMIA E FISIOLOGIA
 NOZIONI DI ANATOMIA E FISIOLOGIA SISTEMA RESPIRATORIO FUNZIONI: Rifornire l organismo di ossigeno Eliminare l anidride carbonica Mantenere il normale equilibrio acido-base del sangue Ventilare i polmoni
NOZIONI DI ANATOMIA E FISIOLOGIA SISTEMA RESPIRATORIO FUNZIONI: Rifornire l organismo di ossigeno Eliminare l anidride carbonica Mantenere il normale equilibrio acido-base del sangue Ventilare i polmoni
Bilancio di energia: il Primo Principio della Termodinamica. Termodinamica dell Ingegneria Chimica
 Bilancio di energia: il Primo Principio della Termodinamica Termodinamica dell Ingegneria Chimica 1 I Sistemi termodinamici Un sistema è definito da una superficie di controllo, reale o immaginaria, che
Bilancio di energia: il Primo Principio della Termodinamica Termodinamica dell Ingegneria Chimica 1 I Sistemi termodinamici Un sistema è definito da una superficie di controllo, reale o immaginaria, che
-GAS IDEALI- Le particelle che costituiscono un gas ideale:
 -GAS IDEALI- Le particelle che costituiscono un gas ideale: sono in movimento continuo e casuale hanno un volume trascurabile rispetto al volume totale a disposizione del gas non interagiscono fra loro
-GAS IDEALI- Le particelle che costituiscono un gas ideale: sono in movimento continuo e casuale hanno un volume trascurabile rispetto al volume totale a disposizione del gas non interagiscono fra loro
Le proteine III. Corso di Biochimica 1. Prof. Giuseppina Pitari
 Le proteine III Corso di Biochimica 1 Prof. Giuseppina Pitari Ossi-mioglobina legame idrogeno lato distale La mioglobina L eme quindi consiste di una struttura organica alla quale è legato un atomo di
Le proteine III Corso di Biochimica 1 Prof. Giuseppina Pitari Ossi-mioglobina legame idrogeno lato distale La mioglobina L eme quindi consiste di una struttura organica alla quale è legato un atomo di
Lavoro. Esempio. Definizione di lavoro. Lavoro motore e lavoro resistente. Lavoro compiuto da più forze ENERGIA, LAVORO E PRINCIPI DI CONSERVAZIONE
 Lavoro ENERGIA, LAVORO E PRINCIPI DI CONSERVAZIONE Cos è il lavoro? Il lavoro è la grandezza fisica che mette in relazione spostamento e forza. Il lavoro dipende sia dalla direzione della forza sia dalla
Lavoro ENERGIA, LAVORO E PRINCIPI DI CONSERVAZIONE Cos è il lavoro? Il lavoro è la grandezza fisica che mette in relazione spostamento e forza. Il lavoro dipende sia dalla direzione della forza sia dalla
MISCELE DI GAS PERFETTI
 Lezione IX 2/04/2014 ora 09.30 12.30 Miscele di gas perfetti Originale di Chiari Giulio, Mannelli Andrea MISCELE DI GAS PERFETTI In questo corso prenderemo in considerazione due miscele di gas perfetti.
Lezione IX 2/04/2014 ora 09.30 12.30 Miscele di gas perfetti Originale di Chiari Giulio, Mannelli Andrea MISCELE DI GAS PERFETTI In questo corso prenderemo in considerazione due miscele di gas perfetti.
Plasma ph Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca
 Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
L APPARATO RESPIRATORIO
 Tutte le illustrazioni sono state prese dal seguente testo con l unico proposito di illustrare questi appunti ad uso e consumo degli studenti di Scienze Motorie che a causa del terremoto non hanno potuto
Tutte le illustrazioni sono state prese dal seguente testo con l unico proposito di illustrare questi appunti ad uso e consumo degli studenti di Scienze Motorie che a causa del terremoto non hanno potuto
Aria e gas perfetti. kelvin, n numero di moli, R costante dei gas perfetti.
 Aria e gas perfetti Aria secca a terra è composta da miscela di gas per lo più N 2 (78%) e O 2 (21%) e componenti minori di CO 2, e altri gas L aria è per alcuni scopi trattata come se fosse un gas perfetto
Aria e gas perfetti Aria secca a terra è composta da miscela di gas per lo più N 2 (78%) e O 2 (21%) e componenti minori di CO 2, e altri gas L aria è per alcuni scopi trattata come se fosse un gas perfetto
Introduzione alla Chimica. Paolo Mazza
 Introduzione alla Chimica Paolo Mazza 2 aprile 2013 Indice 1 Introduzione 2 2 Le teorie della materia 4 2.1 Teoria atomica.................................... 4 2.2 Teoria cinetica.....................................
Introduzione alla Chimica Paolo Mazza 2 aprile 2013 Indice 1 Introduzione 2 2 Le teorie della materia 4 2.1 Teoria atomica.................................... 4 2.2 Teoria cinetica.....................................
L ossigeno e l immersione subacquea. Capitano di Vascello Medico Fabio FARALLI COMSUBIN
 L ossigeno e l immersione subacquea Capitano di Vascello Medico Fabio FARALLI COMSUBIN La scoperta dell ossigeno come gas è attribuita a Joseph Priestley nel 1775 che lo denominò dephlogisticated air.
L ossigeno e l immersione subacquea Capitano di Vascello Medico Fabio FARALLI COMSUBIN La scoperta dell ossigeno come gas è attribuita a Joseph Priestley nel 1775 che lo denominò dephlogisticated air.
Modulo B Unità 3 Equilibrio dei fluidi Pagina 1. Solidi, liquidi, aeriformi
 Modulo B Unità 3 Equilibrio dei fluidi Pagina Solidi, liquidi, aeriformi I solidi hanno forma e volume propri, i liquidi hanno volume proprio e forma del recipiente che li contiene, gli aeriformi hanno
Modulo B Unità 3 Equilibrio dei fluidi Pagina Solidi, liquidi, aeriformi I solidi hanno forma e volume propri, i liquidi hanno volume proprio e forma del recipiente che li contiene, gli aeriformi hanno
