Tutta la materia è fatta da particelle piccolissime, invisibili ed indivisibili dette ATOMI;
|
|
|
- Giovanni Lentini
- 7 anni fa
- Visualizzazioni
Transcript
1 Tutta la materia è fatta da particelle piccolissime, invisibili ed indivisibili dette ATOMI; ELEMENTO: sostanza formata da un solo tipo di atomi, tutti uguali e con le stesse proprietà chimiche; COMPOSTO: sostanza formata da almeno 2 tipi di atomi diversi, chimicamente legati tra loro e sempre con gli stessi rapporti numerici; Gli atomi di elementi diversi differiscono per la massa e per le proprietà chimiche. Nelle reazioni chimiche gli atomi rimangono inalterati e si ritrovano nei prodotti, combinati tra loro in modo diverso. 1
2 E conosciuta dall antichità: Elektron = AMBRA Nella materia ci sono due tipi di cariche: positive e negative Normalmente la materia è neutra cioè cariche + e sono in ugual numero Se strofiniamo una penna con un panno di lana o di pelle, creiamo uno sbilanciamento delle cariche e la penna attrae oggetti molto leggeri (es. carta) Carica elettrica = quantità di elettricità posseduta da un corpo CARICHE ELETTRICHE DELLO STESSO SEGNO SI RESPINGONO E CARICHE DI SEGNO OPPOSTO SI ATTRAGGONO 2
3 PRIMI ESPERIMENTI (Crookes ): ai due elettrodi è applicato un voltaggio elevato, ( volt) e dentro il tubo è posto del gas rarefatto (P=1E-3 atm). Si ha una scarica elettrica e sulla parete dietro l anodo (+) si ha una fluorescenza. DAL CATODO PARTONO QUINDI DEI RAGGI, CHE VENGONO DETTI: RAGGI CATODICI 3
4 Hanno carica negativa Si propagano in linea retta: infatti se mettiamo un ostacolo dentro il tubo, sulla parete opposta viene proiettata un ombra che ha la forma dell ostacolo (es. una croce) Hanno natura corpuscolare: fanno girare un piccolo mulinello Cambiando il metallo del catodo o il gas contenuto nel tubo le particelle sono sempre identiche. SONO UN FLUSSO DI ELETTRONI 4
5 DETERMINAZIONE RAPPORTO q/m (Thomson): q e /m e = -1.76x10 8 C/g DETERMINAZIONE DELLA CARICA DELL ELETTRONE (Millikan -1909) q e = -1.6x10-19 C m e = 9.109x10-28 g 5
6 Un fascio di raggi luminosi detti raggi canale si muove in senso opposto ai raggi catodici e determina una fluorescenza sullo schermo di P sul fondo del tubo (Goldstein 1886); Tali raggi hanno carica positiva; Variando il gas nel tubo varia la massa di queste particelle (con l idrogeno è la più bassa di tutte m=1.673x10-24 g). La massa delle altre particelle è sempre multipla della massa dell idrogeno. 6
7 Gli elettroni emessi dal catodo collidono con le molecole del gas. In questo urto le molecole perdono un elettrone e si trasformano in frammenti con carica positiva. La particella elementare positiva, proveniente dall idrogeno è detta PROTONE (dal greco Proteios cioè di prima importanza). La carica di queste particelle è + 1.6x10-19 C (Wien 1911) Nel 1933 Chadwich scoprì un altra particelle subatomica senza carica elettrica, avente m = 1.675x10-24 g che fu chiamata NEUTRONE 7
8 Nome Particella Carica elettrica (C) Carica relativa rispetto al protone Massa (g) Massa/Massa protone Elettrone (e) -1.6 x x /1836 Protone (p) +1.6 x x Neutrone (n) x10-24 Circa 1 MA IN QUALE MODO QUESTE PARTICELLE SONO POSTE DENTRO L ATOMO??... 8
9 Deriva dalle esperienze di Thomson e Goldstein; L atomo nel suo insieme è neutro; L atomo è fatto da una massa positiva di forma sferica nella quale sono immersi gli elettroni (modello a panettone ); La ddp applicata nei tubi di Crookes separa le cariche positive e negative. 9
10 E stata scoperta da H. Becquerel nel I coniugi Curie nel 1898 hanno isolato due elementi (polonio e radio) più radioattivi dell uranio. I nuclei radioattivi sono instabili e si trasformano spontaneamente in altri più stabili, dando luogo ai decadimenti radioattivi. In questo processo emettono differenti tipi di radiazioni: raggi α (alfa): He ++ (nucleo di elio formato da 2p + e 2n) raggi β (Beta): elettroni raggi γ (gamma): radiazioni ad altissima energia 10
11 Rutherford nel 1910 pensò di verificare sperimentalmente il modello proposto da Thomson ed utilizzò i raggi α per bombardare una lamina d oro molto sottile (circa 0.04 mm). Conclusioni: Non erano spiegabili con il modello di Thomson le deviazioni consistenti di alcuni raggi α né i pochi raggi α (1/20.000) che rimbalzavano indietro; 11
12 Rutherford ipotizzò quindi il seguente modello: a) un atomo praticamente vuoto nel quale la maggior parte dei raggi α potevano passare indisturbati; b) una zona piccolissima dentro l atomo (nucleo), nel quale era concentrata tutta la carica positiva e la massa e quindi in grado di deviare/far rimbalzare le particelle α; c)gli elettroni ruotano attorno al nucleo a una distanza notevole come pianeti attorno al sole e bilanciano esattamente la carica positiva del nucleo; 12
13 Nel modello di Rutherford non sono presenti i neutroni perché non erano ancora stati scoperti. Vari esperimenti avevano però evidenziato che l atomo di elio aveva una massa 4 volte più grande di quello di idrogeno, ma aveva solo il doppio degli elettroni. Era stato anche ipotizzato che nel nucleo di elio ci fossero 4 protoni e 2 elettroni. Finché nel 1932 Chadwick scoprì una nuova particella con massa circa uguale al protone e senza carica. Tali particelle (NEUTRONI) stanno nel nucleo e tengono separati i protoni in modo da diminuire la repulsione elettrostica, (fanno da cuscinetti ). 13
14 Nelle trasformazioni chimiche i nuclei rimangono inalterati, quindi proprio il nucleo rappresenta la carta d identità degli atomi. NUMERO ATOMICO (Z) = Numero di protoni presenti nel nucleo NUMERO DI MASSA (A) = è il numero totale dei nucleoni, cioè delle particelle presenti nel nucleo. A = n+p = n + Z A Z X 14
15 Atomi di un elemento che hanno lo stesso numero atomico ma diverso numero di massa (cioè differiscono per il numero di neutroni). Quasi tutti gli elementi in natura sono costituiti da isotopi (eccezioni F, Au). Sono stati trovati circa 300 differenti isotopi variamente distribuiti tra tutti gli elementi. Gli isotopi hanno lo stesso comportamento chimico dato che esso dipende dal numero degli elettroni. Per descrivere un atomo devo quindi conoscere il numero dei protoni e dei neutroni. Gli isotopi sono anche detti NUCLIDI. 15
16 FAMIGLIA ISOTOPICA = insieme degli isotopi di uno stesso elemento, sia naturali che artificiali. Sono ad esempio nuclidi il carbonio-12, il carbonio-13 e l uranio C Carbonio
17 Nel modello di Rutherford gli elettroni ruotavano attorno al nucleo con moto circolare; La forza di attrazione tra nucleo ed elettroni era bilanciata dalla forza centrifuga e quindi l elettrone si manteneva in un orbita costante, ma: A) Questo modello era in contrasto con le leggi dell elettromagnetismo, secondo le quali una particella carica che si muove di moto non rettilineo emette energia sotto forma di luce, di tutte le lunghezze d onda; B) A causa di questa perdita di energia, l elettrone sarebbe inoltre dovuto ricadere sul nucleo, con un movimento a spirale, in un tempo brevissimo (10-8 s). Invece: L atomo è un sistema stabile!! Tutti gli atomi (sia delle sostanze gassose che dei metalli), quando vengono scaldati emettono degli spettri a righe, non spettri continui. 17
18 La luce è costituita da onde elettromagnetiche, formate dalla propagazione di un campo magnetico (M) e di un campo elettrico (E) che sono tra loro perpendicolari. Consideriamo solo la componente elettrica, un onda viene rappresentata quindi come: c = λ ν dove c = velocità della luce (nel vuoto) = Km/s =3x10 8 m/s λ (lambda)= lunghezza d onda (m) ν (ni) = frequenza (s -1 ) =Hz 18
19 Il nostro occhio vede solo una piccola parte delle radiazioni (luce visibile) e percepisce le radiazioni con lunghezza d onda diversa come luce di vari colori. Luce monocromatica = fatta da un solo colore, o meglio da una sola lunghezza d onda. La luce del sole (o anche quella artificiale delle lampade), è fatta da un miscuglio di colori, ed è detta luce policromatica. La luce policromatica può essere divisa nei suoi colori utilizzando ad esempio un prisma (dispersione della luce). Si ottiene uno spettro continuo, cioè un insieme di radiazioni di colore diverso che si susseguono in modo continuo. Fenomeno naturale di dispersione della luce: arcobaleno Se scaldiamo invece degli elementi in fase gassosa otteniamo uno spettro fatto solo da alcune righe, (spettro a righe). Ad esempio lo spettro dell idrogeno è fatto da 4 righe. 19
20 È l insieme delle radiazioni elettromagnetiche; Si divide in regioni spettrali: visibile, UV, IR, microonde, onde radio 20
21 Tra la fine del 1800 e l inizio del 1900 molti fisici studiarono gli spettri dei corpi. Il colore dei corpi cambia con la temperatura: a) se scaldiamo del ferro esso diventa prima rosso, poi giallo, poi bianco; b) anche il colore delle stelle dipende dalla loro temperatura. Infatti le stelle più fredde (T <3000 K) ci appaiono rosse e quelle più calde (T> K) di colore azzurro (il sole ha una T di circa 6000 C!!). M. Planck arrivò a concludere che: l energia luminosa viene emessa dai corpi sotto forma di pacchetti di energia detti quanti ; La relazione tra energia e frequenza della luce è data da: E= hν (dove h= costante di Planck= J s) 21
22 L idea che l energia si liberi solo a pacchetti era decisamente rivoluzionaria. Einstein chiamò questi pacchetti di luce FOTONI. La luce ha cioè una doppia natura ONDULATORIA e PARTICELLARE. Alcuni fenomeni della luce (diffrazione della luce su un CD) possono essere spiegati considerandola come onda ed altri fenomeni (es. effetto fotoelettrico), considerandola come formata da quanti di luce. 22
23 Basandosi sugli studi degli spettri di assorbimento e di emissione degli atomi, Bohr nel 1913 propose il seguente modello: 1) l elettrone ruota attorno al nucleo soltanto in determinate orbite circolari (orbite stazionarie), che soddisfano la seguente relazione: r = n h 2π m cos t dove: n = numero quantico principale = 1,2,3 (intero) n h = costante di Planck= 6.63*10-34 j/s, m e v = massa e velocità dell elettrone v = 23
24 Sia le orbite che le energie possono assumere solo alcuni valori (sono quantizzate) e dipendono dal valore di n. Lo stato dell elettrone, avente n=1, si chiama stato fondamentale, gli altri si chiamano stati eccitati. 2) Muovendosi su queste orbite (permesse), l elettrone non irradia energia. 24
25 3) Fornendo energia ad un elettrone, esso passa dallo stato fondamentale ad uno eccitato, dove però è instabile e rimane per un tempo brevissimo (10-8 s) per poi passare ad uno stato meno energetico (non necessariamente a quello fondamentale). L energia assorbita viene riemessa sotto forma di radiazione di una ben definita lunghezza d onda, calcolabile dalla equazione di Planck. Ogni riga dello spettro corrisponde quindi ad una transizione da uno stato eccitato ad uno con energia più bassa. 25
26 Questo modello spiegava molto bene lo spettro dell atomo di idrogeno e con piccole correzioni poteva essere applicato anche ad altri atomi semplici (es. Li + ). LIMITI: Non riusciva invece a calcolare le frequenze delle righe di atomi con più elettroni. Non spiegava perché l elettrone muovendosi su un orbita permessa non dovesse perdere energia. Inoltre, con l utilizzo degli spettroscopi, si vide che in realtà le righe degli spettri erano fatte da gruppi di righe più sottili, tali sdoppiamenti non erano spiegabili con il modello di Bohr. 26
27 Sommerfeld propose allora un nuovo modello atomico (che perfezionava quello di Bohr ed è stato usato fino al 1925), nel quale le orbite erano ellittiche e erano utilizzati 4 numeri quantici per descrivere l orbita dell elettrone. Anche tale modello però non riusciva a descrivere in modo completo atomi con molti elettroni. La meccanica classica era però inadeguata nello spiegare i sistemi microscopici (atomi e molecole). 27
28 De Broglie nel 1924 ipotizzò che ogni particella in movimento (carica o neutra) presenti una doppia natura particellare e ondulatoria. L aspetto ondulatorio è però evidente solo quando la massa delle particelle è molto piccola: λ = h m v Esempio: ad una palla da tennis (massa circa 50 g e v=20m/s) è associata un onda con λ = ~ m, troppo piccola quindi per essere rivelata. Ipotizzò quindi che anche l elettrone potesse avere, (come la luce) una doppia natura, particellare e ondulatoria. Le onde associate a qualunque corpo sono dette onde di materia (da non confondere con le onde elettromagnetiche). 28
29 Nel 1927 Heisenberg osservò che nel mondo macroscopico era possibile misurare tutte le grandezze necessarie per descrivere il moto di un corpo (posizione, velocità..). Nel mondo microscopico invece la misura che facciamo altera (disturba) le caratteristiche del moto e quindi introduciamo un errore nella misura. Ad esempio nel momento in cui vogliamo determinare la posizione di un elettrone noi utilizziamo dei fotoni (luce) che però perturbano il moto dell elettrone perché gli trasmettono energia. PRINCIPIO DI INDETERMINAZIONE: non è possibile misurare contemporaneamente e con precisione assoluta la posizione di un elettrone e la sua velocità 29
30 Non ha senso quindi secondo Heinsemberg parlare di orbita dell elettrone e di traiettoria definita intorno al nucleo, perché non siamo in grado di misurarla. ERA NECESSARIO QUINDI UN APPROCCIO DIVERSO ALLE TEORIE ATOMICHE. 30
31 Il modello atomico attualmente utilizzato ha avuto origine da due distinte teorie: - Teoria della meccanica ondulatoria: Schrödinger nel 1926 aveva elaborato una equazione matematica (equazione d onda) in grado di rappresentare la natura ondulatoria dell elettrone. - Teoria della meccanica quantistica: nata da un idea di Heisenberg con il contributo di Born e Jordan, descrive la relazione tra le frequenze e le intensità delle righe spettrali emesse dai sistemi eccitati. Le due teorie hanno portato a risultati analoghi. 31
32 TEORIA MECCANICA ONDULATORIA (SCHRÖDINGER) TEORIA MECCANICA QUANTISTICA (HEISEMBERG) MODELLO QUANTO MECCANICO (MODELLO A ORBITALI) Tale modello, detto QUANTO MECCANICO su base ondulatoria è figlio di entrambe le teorie. 32
33 Gli orbitali sono rappresentati da equazioni (molto complesse) ed astratte (equazioni di Schrödinger). Le soluzioni di tali equazioni sono chiamate funzioni d onda e sono indicate con ψ (psi). Ci permettono di calcolare i valori delle energie (quantizzate) degli stati elettronici. Ψ 2 è proporzionale alla probabilità che l elettrone sia presente in una determinata regione di spazio. Con l aiuto del computer si possono quindi disegnare le superfici tridimensionali che hanno la stessa probabilità. Se prendiamo una superficie che delimita uno spazio dove la probabilità è molto alta possiamo dire, con buona approssimazione, che rappresenta lo spazio dove si trova l elettrone. 33
34 Nelle teorie moderne viene abbandonato quindi il concetto di orbita e si passa a quello di orbitale. ORBITA = Traiettoria ben definita dell elettrone intorno al nucleo. ORBITALE = Regione di spazio nella quale la probabilità di trovare l elettrone è del 95 %. Tale modello è in accordo con le evidenze sperimentali e conferma ad esempio il raggio calcolato da Bohr per l elettrone dell atomo di idrogeno (0.053 nm). Nelle soluzioni dell equazione di Scrödinger sono presenti 4 numeri, detti numeri quantici. Tali numeri descrivono gli orbitali ed hanno lo stesso significato fisico di quelli presenti nel modello di Bohr Sommerfield. 34
35 Simbolo Nome Valori permessi Significato fisico n Numero quantico principale Interi da 1 a (per gli atomi non eccitati da 1 a 7) Livello energetico (energia dell elettrone) l Numero quantico secondario Interi da 0 a n-1 Forma (tipo) di orbitale (orbitali s, p,d, f) m l (o m) Numero quantico magnetico Interi da -l..0..+l Possibili orientamenti spaziali dell orbitale (numero di orbitali di quel tipo) m s Numero quantico di spin +1/2; -1/2 Senso di rotazione dell elettrone su se stesso* Nelle teorie moderne indica in realtà la polarizzazione dell onda, ma per semplicità manteniamo il significato proveniente dalle teorie basate sulla meccanica classica. 35
Teoria Atomica di Dalton
 Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Capitolo 8 La struttura dell atomo
 Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
La struttura dell atomo
 La Teoria Atomica La struttura dell atomo 10-10 m 10-14 m Proprietà delle tre particelle subatomiche fondamentali Carica Massa Nome (simbolo) relativa assoluta (C) relativa (uma)* Assoluta (g) Posizione
La Teoria Atomica La struttura dell atomo 10-10 m 10-14 m Proprietà delle tre particelle subatomiche fondamentali Carica Massa Nome (simbolo) relativa assoluta (C) relativa (uma)* Assoluta (g) Posizione
Modelli atomici Modello atomico di Rutheford Per t s d u i diare la t s rutt ttura t a omica Ruth th f or (
 Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford (1871-1937) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio) Rutherford suppose che gli atomi
Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford (1871-1937) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio) Rutherford suppose che gli atomi
STRUTTURA ATOMICA. Per lo studio della struttura dell atomo ci si avvale della Spettroscopia.
 STRUTTURA ATOMICA Il modello planetario dell atomo secondo Rutherford si appoggia sulla meccanica classica. Il modello non può essere corretto visto che per descrivere il comportamento delle particelle
STRUTTURA ATOMICA Il modello planetario dell atomo secondo Rutherford si appoggia sulla meccanica classica. Il modello non può essere corretto visto che per descrivere il comportamento delle particelle
ATOMI E PARTICELLE SUBATOMICHE
 ATOMI E PARTICELLE SUBATOMICHE ELETTRICITÀ DELL ATOMO ESISTONO DUE TIPI DI CARICHE ELETTRICHE, DENOMINATE CONVENZIONALMENTE NEGATIVA E POSITIVA CARICHE DI SEGNO UGUALE SI RESPINGONO, MENTRE CARICHE DI
ATOMI E PARTICELLE SUBATOMICHE ELETTRICITÀ DELL ATOMO ESISTONO DUE TIPI DI CARICHE ELETTRICHE, DENOMINATE CONVENZIONALMENTE NEGATIVA E POSITIVA CARICHE DI SEGNO UGUALE SI RESPINGONO, MENTRE CARICHE DI
Teoria Atomica Moderna. Chimica generale ed Inorganica: Chimica Generale. sorgenti di emissione di luce. E = hν. νλ = c. E = mc 2
 sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
Pinzani, Panero, Bagni Sperimentare la chimica Soluzioni degli esercizi Capitolo 9
 Pinzani, Panero, Bagni Sperimentare la chimica Soluzioni degli esercizi Capitolo 9 Esercizio PAG 198 ES 1 PAG 198 ES 2 PAG 198 ES 3 PAG 198 ES 4 PAG 198 ES 5 PAG 198 ES 6 PAG 198 ES 7 PAG 198 ES 8 PAG
Pinzani, Panero, Bagni Sperimentare la chimica Soluzioni degli esercizi Capitolo 9 Esercizio PAG 198 ES 1 PAG 198 ES 2 PAG 198 ES 3 PAG 198 ES 4 PAG 198 ES 5 PAG 198 ES 6 PAG 198 ES 7 PAG 198 ES 8 PAG
Atomo: modello microscopico
 Atomo: modello microscopico 1 Modello atomico di Dalton (1808) Materia è composta di atomi indivisibili e indistruttibili Atomi uguali hanno identica massa e identiche proprietà chimiche Gli atomi non
Atomo: modello microscopico 1 Modello atomico di Dalton (1808) Materia è composta di atomi indivisibili e indistruttibili Atomi uguali hanno identica massa e identiche proprietà chimiche Gli atomi non
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA
 LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
1. La struttura atomica Le particelle subatomiche L atomo, per molti secoli ritenuto indivisibile, è formato da particelle più piccole.
 1. La struttura atomica Le particelle subatomiche L atomo, per molti secoli ritenuto indivisibile, è formato da particelle più piccole. Le particelle fondamentali che costituiscono l atomo sono: Il protone,
1. La struttura atomica Le particelle subatomiche L atomo, per molti secoli ritenuto indivisibile, è formato da particelle più piccole. Le particelle fondamentali che costituiscono l atomo sono: Il protone,
La Struttura degli Atomi
 La Struttura degli Atomi!!!!! Perché gli atomi si combinano per formare composti? Perché differenti elementi presentano differenti proprietà? Perché possono essere gassosi, liquidi, solidi, metalli o non-metalli?
La Struttura degli Atomi!!!!! Perché gli atomi si combinano per formare composti? Perché differenti elementi presentano differenti proprietà? Perché possono essere gassosi, liquidi, solidi, metalli o non-metalli?
Atomo. Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale)
 Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano
Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano
1 3 STRUTTURA ATOMICA
 1 3 STRUTTURA ATOMICA COME SI SPIEGA LA STRUTTURA DELL ATOMO? Secondo il modello atomico di Rutherford e sulla base della fisica classica, gli elettroni dovrebbero collassare sul nucleo per effetto delle
1 3 STRUTTURA ATOMICA COME SI SPIEGA LA STRUTTURA DELL ATOMO? Secondo il modello atomico di Rutherford e sulla base della fisica classica, gli elettroni dovrebbero collassare sul nucleo per effetto delle
LUCE E ONDE ELETTROMAGNETICHE
 LUCE E ONDE ELETTROMAGNETICHE QUASI TUTTO QUELLO CHE SAPPIAMO SULLA STRUTTURA DELL ATOMO DERIVA DALL ANALISI DELLA LUCE EMESSA O ASSORBITA DALLE SOSTANZE CHI FU IL PRIMO AD ACCORGERSI CHE I SINGOLI ELEMENTI
LUCE E ONDE ELETTROMAGNETICHE QUASI TUTTO QUELLO CHE SAPPIAMO SULLA STRUTTURA DELL ATOMO DERIVA DALL ANALISI DELLA LUCE EMESSA O ASSORBITA DALLE SOSTANZE CHI FU IL PRIMO AD ACCORGERSI CHE I SINGOLI ELEMENTI
L atomo. Il neutrone ha una massa 1839 volte superiore a quella dell elettrone. 3. Le particelle fondamentali dell atomo
 L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
STRUTTURA DELL'ATOMO
 STRUTTURA DELL'ATOMO IDROGENO 1 H ELIO He 1 2 4 Modello planetario di Rutherford -protoni e neutroni costituiscono il nucleo in cui è concentrata tutta la massa - gli elettroni ruotano attorno al nucleo
STRUTTURA DELL'ATOMO IDROGENO 1 H ELIO He 1 2 4 Modello planetario di Rutherford -protoni e neutroni costituiscono il nucleo in cui è concentrata tutta la massa - gli elettroni ruotano attorno al nucleo
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. Le particelle fondamentali
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. Le particelle fondamentali
Generalità delle onde elettromagnetiche
 Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Sommario della lezione 2. Materia e definizioni. Struttura dell atomo
 Sommario della lezione 2 Materia e definizioni Struttura dell atomo La materia è qualsiasi cosa abbia una massa e occupi uno spazio. Esiste in tre stati: Solido Forma e volume determinati Liquido Volume
Sommario della lezione 2 Materia e definizioni Struttura dell atomo La materia è qualsiasi cosa abbia una massa e occupi uno spazio. Esiste in tre stati: Solido Forma e volume determinati Liquido Volume
A Z. L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone. +1e e.
 L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone +1e 0-1e e = Carica elettrica elementare 1.60 10-19 u.m.a.= Unità di Massa Atomica 1.6605 10-4 Il Nuclide A Z Nu Coulomb
L'atomo Entità subatomiche Carica elettrica Massa (u.m.a) Protone Neutrone elettrone +1e 0-1e e = Carica elettrica elementare 1.60 10-19 u.m.a.= Unità di Massa Atomica 1.6605 10-4 Il Nuclide A Z Nu Coulomb
Lo strofinio di qualsiasi oggetto provoca la comparsa su di esso di una carica elettrica che può attrarre piccoli oggetti.
 1. La natura elettrica della materia Lo strofinio di qualsiasi oggetto provoca la comparsa su di esso di una carica elettrica che può attrarre piccoli oggetti. La carica elettrica può essere positiva o
1. La natura elettrica della materia Lo strofinio di qualsiasi oggetto provoca la comparsa su di esso di una carica elettrica che può attrarre piccoli oggetti. La carica elettrica può essere positiva o
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
mvr = n h e 2 r = m v 2 e m r v = La configurazione elettronica r = e 2 m v 2 (1) Quantizzazione del momento angolare (2) 4 πε.
 La configurazione elettronica Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica F = m a. F Coulomb = 1 4 πε. q q ' F r centrifuga = m v r ε =8.85*10-1 Fm-1 (costante
La configurazione elettronica Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica F = m a. F Coulomb = 1 4 πε. q q ' F r centrifuga = m v r ε =8.85*10-1 Fm-1 (costante
L atomo di Bohr e i raggi X
 L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
the power of ten Prof.ssa Patrizia Gallucci
 https://www.youtube.com/watch?v=5ckd0apswe8 the power of ten Prof.ssa Patrizia Gallucci ESPERIMENTO DI RUTHEFORD Dopo l esperimento Rutheford ipotizzò un atomo con un nucleo centrale,formato da neutroni
https://www.youtube.com/watch?v=5ckd0apswe8 the power of ten Prof.ssa Patrizia Gallucci ESPERIMENTO DI RUTHEFORD Dopo l esperimento Rutheford ipotizzò un atomo con un nucleo centrale,formato da neutroni
Rappresentazione dell atomo. Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano.
 Rappresentazione dell atomo Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano. Informazioni importanti circa la dimensione dell atomo e la distribuzione della massa
Rappresentazione dell atomo Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano. Informazioni importanti circa la dimensione dell atomo e la distribuzione della massa
Le particelle dell atomo
 La carica elettrica I fenomeni elettrici sono noti fin dall antichità: gli antichi Greci usavano la parola elektron per spiegare il fenomeno dell elettrizzazione dell ambra. I Greci sapevano che strofinando
La carica elettrica I fenomeni elettrici sono noti fin dall antichità: gli antichi Greci usavano la parola elektron per spiegare il fenomeno dell elettrizzazione dell ambra. I Greci sapevano che strofinando
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO
 La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
Il modello di Bohr. Lezioni d'autore di Giorgio Benedetti
 Il modello di Bohr Lezioni d'autore di Giorgio Benedetti VIDEO Gli spettri di emissione Nel 1859 il fisico G.R. Kirchoff scoprì che ogni elemento chimico presenta uno spettro di emissione caratteristico,
Il modello di Bohr Lezioni d'autore di Giorgio Benedetti VIDEO Gli spettri di emissione Nel 1859 il fisico G.R. Kirchoff scoprì che ogni elemento chimico presenta uno spettro di emissione caratteristico,
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 4. Modelli e configurazione SEGUI LA MAPPA e distinguere di massa (A) Spettri 1 e
Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 4. Modelli e configurazione SEGUI LA MAPPA e distinguere di massa (A) Spettri 1 e
Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton)
 Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica
 ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
La teoria atomistica
 La teoria atomistica Joseph John Thomson Fisico britannico È noto per aver scoperto nel 1897 la particella di carica negativa: l'elettrone Ebbe come studente Rutherford Vinse il Nobel per la fisica nel
La teoria atomistica Joseph John Thomson Fisico britannico È noto per aver scoperto nel 1897 la particella di carica negativa: l'elettrone Ebbe come studente Rutherford Vinse il Nobel per la fisica nel
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 7 Le particelle dell atomo 3 Sommario (I) 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 7 Le particelle dell atomo 3 Sommario (I) 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le
L atomo di Bohr. Argomenti. Al tempo di Bohr. Spettri atomici 19/03/2010
 Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
Le Caratteristiche della Luce
 7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
COMPORTAMENTO DUALISTICO della MATERIA
 COMPORTAMENTO DUALISTICO della MATERIA Come la luce anche la materia assume comportamento dualistico. Equazione di De Broglie: λ = h/mv Per oggetti macroscopici la lunghezza d onda è così piccola da non
COMPORTAMENTO DUALISTICO della MATERIA Come la luce anche la materia assume comportamento dualistico. Equazione di De Broglie: λ = h/mv Per oggetti macroscopici la lunghezza d onda è così piccola da non
ATOMO. Avogadro (1811) Volumi uguali di gas diversi contengono un ugual numero di MOLECOLE (N A =6,022*10 23 )
 ATOMO Democrito IV secolo A.C. (atomos = indivisibile) Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811)
ATOMO Democrito IV secolo A.C. (atomos = indivisibile) Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811)
FISICA QUANTISTICA LIMITI AL MODELLO ATOMICO DI RUTHERFORD. e - Per spiegare la disposizione degli elettroni nell atomo (STRUTTURA ELETTRONICA)
 LIMITI AL MODELLO ATOMICO DI RUTHERFORD e - + nucleo In base alle leggi della FISICA CLASSICA, una particella carica dotata di un movimento circolare libera energia. Di conseguenza, gli elettroni che,
LIMITI AL MODELLO ATOMICO DI RUTHERFORD e - + nucleo In base alle leggi della FISICA CLASSICA, una particella carica dotata di un movimento circolare libera energia. Di conseguenza, gli elettroni che,
Crisi della Fisica Classica & Fisica Quantistica
 Crisi della Fisica Classica & Fisica Quantistica Guido Montagna Dipartimento di Fisica, Università di Pavia & INFN, Sezione di Pavia February 11, 2018 G. Montagna, Università di Pavia & INFN (Dipartimento
Crisi della Fisica Classica & Fisica Quantistica Guido Montagna Dipartimento di Fisica, Università di Pavia & INFN, Sezione di Pavia February 11, 2018 G. Montagna, Università di Pavia & INFN (Dipartimento
Fisica Moderna e contemporanea
 Fisica Moderna e contemporanea SSIS Puglia Prof. Luigi Schiavulli luigi.schiavulli@ba.infn.it Dipartimento Interateneo di Fisica Michelangelo Merlin 02/02/2006 1 Sommario Quadro riassuntivo sulla Fisica
Fisica Moderna e contemporanea SSIS Puglia Prof. Luigi Schiavulli luigi.schiavulli@ba.infn.it Dipartimento Interateneo di Fisica Michelangelo Merlin 02/02/2006 1 Sommario Quadro riassuntivo sulla Fisica
FISICA delle APPARECCHIATURE per RADIOTERAPIA
 Anno Accademico 2012-2013 Corso di Laurea in Tecniche Sanitarie di Radiologia Medica per Immagini e Radioterapia FISICA delle APPARECCHIATURE per RADIOTERAPIA Marta Ruspa 20.01.13 M. Ruspa 1 ONDE ELETTROMAGNETICHE
Anno Accademico 2012-2013 Corso di Laurea in Tecniche Sanitarie di Radiologia Medica per Immagini e Radioterapia FISICA delle APPARECCHIATURE per RADIOTERAPIA Marta Ruspa 20.01.13 M. Ruspa 1 ONDE ELETTROMAGNETICHE
P. Sapia Università della Calabria. a.a. 2009/10
 FISICA PER I BENI CULTURALI Ii MATERIA E INTERAZIONE CON LA RADIAZIONE P. Sapia Università della Calabria a.a. 2009/10 Interazioni fondamentali Gravitazionale Debolmente attrattiva, tra tutte le particelle
FISICA PER I BENI CULTURALI Ii MATERIA E INTERAZIONE CON LA RADIAZIONE P. Sapia Università della Calabria a.a. 2009/10 Interazioni fondamentali Gravitazionale Debolmente attrattiva, tra tutte le particelle
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA. (Plank Einstein)
 L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
Il metodo scientifico
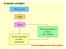 Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]
![n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm] n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]](/thumbs/92/108343390.jpg) Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
Lo Spettro Elettromagnetico
 Spettroscopia 1 Lo Spettro Elettromagnetico Lo spettro elettromagnetico è costituito da un insieme continuo di radiazioni (campi elettrici e magnetici che variano nel tempo, autogenerandosi) che va dai
Spettroscopia 1 Lo Spettro Elettromagnetico Lo spettro elettromagnetico è costituito da un insieme continuo di radiazioni (campi elettrici e magnetici che variano nel tempo, autogenerandosi) che va dai
Corso di CHIMICA LEZIONE 2
 Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
Università degli studi di MILANO Facoltà di AGRARIA. El. di Chimica e Chimica Fisica. Mod. 1 CHIMICA. Mod. 2 CHIMICA FISICA. Lezione 1 RECAPITI
 Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 1 Anno Accademico 2010-2011 Docente: Dimitrios Fessas RECAPITI Prof. Dimitrios
Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 1 Anno Accademico 2010-2011 Docente: Dimitrios Fessas RECAPITI Prof. Dimitrios
Quarta unità didattica. Disposizione degli elettroni nell atomo
 Quarta unità didattica Disposizione degli elettroni nell atomo Modello atomico di Bohr 1913 L' atomo di Borh consiste in un nucleo di carica positiva al quale ruotano intorno gli elettroni di carica negativa
Quarta unità didattica Disposizione degli elettroni nell atomo Modello atomico di Bohr 1913 L' atomo di Borh consiste in un nucleo di carica positiva al quale ruotano intorno gli elettroni di carica negativa
CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI
 CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI Elettrici I anno - III Quadr. a.acc. 2006/07 Laboratorio: Laboratorio Materiali piano S-1 26/04/2007 Chimica e Scienza e Tecnologia dei Materiali
CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI Elettrici I anno - III Quadr. a.acc. 2006/07 Laboratorio: Laboratorio Materiali piano S-1 26/04/2007 Chimica e Scienza e Tecnologia dei Materiali
La radiazione elettromagnetica. aumento della frequenza n della radiazione aumento dell energia E della radiazione
 La radiazione elettromagnetica aumento della frequenza n della radiazione aumento dell energia E della radiazione La radiazione elettromagnetica Un onda elettromagnetica è caratterizzata dalla lunghezza
La radiazione elettromagnetica aumento della frequenza n della radiazione aumento dell energia E della radiazione La radiazione elettromagnetica Un onda elettromagnetica è caratterizzata dalla lunghezza
Modello atomico ad orbitali e numeri quantici
 Modello atomico ad orbitali e numeri quantici Il modello atomico di Bohr permette di scrivere correttamente la configurazione elettronica di un atomo ma ha dei limiti che sono stati superati con l introduzione
Modello atomico ad orbitali e numeri quantici Il modello atomico di Bohr permette di scrivere correttamente la configurazione elettronica di un atomo ma ha dei limiti che sono stati superati con l introduzione
Radiazioni ionizzanti
 Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Radiazioni ionizzanti 11/3/2005 Struttura atomica Atomo Nucleo Protone 10 10 m 10 14 m 10 15 m ev MeV GeV 3 3,0 0,3 0 0 0 Atomo Dimensioni lineari
Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Radiazioni ionizzanti 11/3/2005 Struttura atomica Atomo Nucleo Protone 10 10 m 10 14 m 10 15 m ev MeV GeV 3 3,0 0,3 0 0 0 Atomo Dimensioni lineari
Scienziati in Erba Chimica
 Scienziati in Erba Chimica Acqua Oro Zucchero L atomo Acqua Oro Zucchero La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti
Scienziati in Erba Chimica Acqua Oro Zucchero L atomo Acqua Oro Zucchero La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti
La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno:
 La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno: Vedi documento Atomo di Bohr.pdf sul materiale didattico per la derivazione di queste equazioni Livelli Energetici dell Atomo di Idrogeno
La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno: Vedi documento Atomo di Bohr.pdf sul materiale didattico per la derivazione di queste equazioni Livelli Energetici dell Atomo di Idrogeno
Onde elettromagnetiche ed altre storie
 Onde elettromagnetiche ed altre storie Onde elettromagnetiche Un onda elettromagnetica è una oscillazione del campo elettromagnetico che si propaga nello spazio. Le onde elettromagnetiche si propagano
Onde elettromagnetiche ed altre storie Onde elettromagnetiche Un onda elettromagnetica è una oscillazione del campo elettromagnetico che si propaga nello spazio. Le onde elettromagnetiche si propagano
Atomo e particelle atomiche
 Atomo e particelle atomiche La natura elettrica della materia lo strofinio di qualsiasi materiale provoca la comparsa su di esso di una carica elettrica capace di attrarre piccoli oggetti; la carica elettrica
Atomo e particelle atomiche La natura elettrica della materia lo strofinio di qualsiasi materiale provoca la comparsa su di esso di una carica elettrica capace di attrarre piccoli oggetti; la carica elettrica
L energia assorbita dall atomo durante l urto iniziale è la stessa del fotone che sarebbe emesso nel passaggio inverso, e quindi vale: m
 QUESITI 1 Quesito Nell esperimento di Rutherford, una sottile lamina d oro fu bombardata con particelle alfa (positive) emesse da una sorgente radioattiva. Secondo il modello atomico di Thompson le particelle
QUESITI 1 Quesito Nell esperimento di Rutherford, una sottile lamina d oro fu bombardata con particelle alfa (positive) emesse da una sorgente radioattiva. Secondo il modello atomico di Thompson le particelle
LEZIONE N 28. Corso di Fisica II Prof. Giuseppe Ciancio
 LEZIONE N 28 1 Cenni storici atomo dal greco "atomòs" "indivisibile" Democrito In verità esistono solo atomi e il vuoto«. L uomo pensava che ogni cosa nel mondo fosse un composto dei quattro elementi:
LEZIONE N 28 1 Cenni storici atomo dal greco "atomòs" "indivisibile" Democrito In verità esistono solo atomi e il vuoto«. L uomo pensava che ogni cosa nel mondo fosse un composto dei quattro elementi:
Risultato: ELABORAZIONE della MECCANICA QUANTISTICA e sua applicazione sistematica ai nuovi fenomeni
 Tra la fine del XIX e inizio del XX secolo una serie di fenomeni non trovano interpretazione adeguata, basata su fisica classica (meccanica, elettromagnetismo, ottica e termodinamica) Essi risultarono
Tra la fine del XIX e inizio del XX secolo una serie di fenomeni non trovano interpretazione adeguata, basata su fisica classica (meccanica, elettromagnetismo, ottica e termodinamica) Essi risultarono
Introduzione alla Meccanica Quantistica (MQ):
 Introduzione alla Meccanica Quantistica (MQ): 1 MECCANICA QUANTISTICA ELETTRONI MATERIA MOLECOLE ATOMI NUCLEI La nostra attuale comprensione della struttura atomica e molecolare si basa sui principi della
Introduzione alla Meccanica Quantistica (MQ): 1 MECCANICA QUANTISTICA ELETTRONI MATERIA MOLECOLE ATOMI NUCLEI La nostra attuale comprensione della struttura atomica e molecolare si basa sui principi della
La struttura degli atomi
 1 La struttura degli atomi pg. 298 27-28 31-37 43 47 51-53 55-57 61-62 67(a/h) 68(a/i) La struttura degli atomi e gli andamenti periodici pg.332 1-7 11-15 17-18 27-30 37 40-42 51 Solvay conference, 1927
1 La struttura degli atomi pg. 298 27-28 31-37 43 47 51-53 55-57 61-62 67(a/h) 68(a/i) La struttura degli atomi e gli andamenti periodici pg.332 1-7 11-15 17-18 27-30 37 40-42 51 Solvay conference, 1927
Spettroscopia. Spettroscopia
 Spettroscopia Spettroscopia IR Spettroscopia NMR Spettrometria di massa 1 Spettroscopia E un insieme di tecniche che permettono di ottenere informazioni sulla struttura di una molecola attraverso l interazione
Spettroscopia Spettroscopia IR Spettroscopia NMR Spettrometria di massa 1 Spettroscopia E un insieme di tecniche che permettono di ottenere informazioni sulla struttura di una molecola attraverso l interazione
Lezione n. 19. L equazione. di Schrodinger L atomo. di idrogeno Orbitali atomici. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni
 CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni composto materia sostanza pura miscela omogenea elemento eterogenea Elementi, Composti e Miscele Miscela eterogenea
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni composto materia sostanza pura miscela omogenea elemento eterogenea Elementi, Composti e Miscele Miscela eterogenea
Il modello atomico fino all Ottocento
 Il modello atomico fino all Ottocento Fino a quasi tutto l Ottocento gli atomi vennero considerati, secondo il modello atomico di Dalton, come porzioni di materia indivisibili Il modello, di diretta derivazione
Il modello atomico fino all Ottocento Fino a quasi tutto l Ottocento gli atomi vennero considerati, secondo il modello atomico di Dalton, come porzioni di materia indivisibili Il modello, di diretta derivazione
Fenomeni quantistici
 Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi stato fondamentale stati eccitati
 4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi Accanto allo spettro continuo che i corpi emettono in ragione del loro stato termico, si osservano spettri discreti che sono caratteristici
4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi Accanto allo spettro continuo che i corpi emettono in ragione del loro stato termico, si osservano spettri discreti che sono caratteristici
MODELLO ATOMICO DI BOHR - ULTERIORI APPROFONDIMENTI
 MODELLO ATOMICO DI BOHR - ULTERIORI APPROFONDIMENTI Se riscaldiamo un qualsiasi elemento chimico ponendolo ad esempio su una fiamma, notiamo che esso emette un colore caratteristico. Ad esempio riscaldando
MODELLO ATOMICO DI BOHR - ULTERIORI APPROFONDIMENTI Se riscaldiamo un qualsiasi elemento chimico ponendolo ad esempio su una fiamma, notiamo che esso emette un colore caratteristico. Ad esempio riscaldando
- + MODELLI ATOMICI + + Particelle subatomiche
 MODELLI ATOMICI Particelle subatomiche L atomo è costituito da due zone: il NUCLEO, formato al suo interno da due tipi di particelle subatomiche, ovvero particelle ancora più piccole dell atomo (i protoni
MODELLI ATOMICI Particelle subatomiche L atomo è costituito da due zone: il NUCLEO, formato al suo interno da due tipi di particelle subatomiche, ovvero particelle ancora più piccole dell atomo (i protoni
Prof. Luisa Ferronato 1
 Prof. Luisa Ferronato 1 L atomo e l antichitl antichità Forse venticinque secoli fa, sulle rive del mare divino, dove il canto degli aedi si era appena spento, qualche filosofo insegnava già che la mutevole
Prof. Luisa Ferronato 1 L atomo e l antichitl antichità Forse venticinque secoli fa, sulle rive del mare divino, dove il canto degli aedi si era appena spento, qualche filosofo insegnava già che la mutevole
Struttura Elettronica degli Atomi Meccanica quantistica
 Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
Loriano Storchi.
 Loriano Storchi loriano@storchi.org http://www.storchi.org/ Metodo scientifico Nessuna quantità di esperimenti potrà dimostrare che ho ragione; un unico esperimento potrà dimostrare che ho sbagliato Il
Loriano Storchi loriano@storchi.org http://www.storchi.org/ Metodo scientifico Nessuna quantità di esperimenti potrà dimostrare che ho ragione; un unico esperimento potrà dimostrare che ho sbagliato Il
Teoria atomica. Dr. Lucia Tonucci Ingegneria delle Costruzioni
 Teoria atomica Dr. Lucia Tonucci l.tonucci@unich.it Ingegneria delle Costruzioni Cenni storici V Sec. a.c. Democrito: la materia è costituita da corpuscoli indivisibili, gli atomi (atomo = indivisibile)
Teoria atomica Dr. Lucia Tonucci l.tonucci@unich.it Ingegneria delle Costruzioni Cenni storici V Sec. a.c. Democrito: la materia è costituita da corpuscoli indivisibili, gli atomi (atomo = indivisibile)
COMPETENZE ABILITÀ CONOSCENZE. descrivere la. Comprendere ed applicare analogie relative ai concetti presi in analisi. struttura.
 ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
Unità 2. La teoria quantistica
 Unità 2 La teoria quantistica L'effetto fotoelettrico Nel 1902 il fisico P. Lenard studiò l'effetto fotoelettrico. Esso è l'emissione di elettroni da parte di un metallo su cui incide un'onda elettromagnetica.
Unità 2 La teoria quantistica L'effetto fotoelettrico Nel 1902 il fisico P. Lenard studiò l'effetto fotoelettrico. Esso è l'emissione di elettroni da parte di un metallo su cui incide un'onda elettromagnetica.
STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA
 pg 1 STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA Per capire il comportamento degli atomi dobbiamo studiare il comportamento dei suoi elettroni L'atomo e le sue particelle NON sono direttamente visibili
pg 1 STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA Per capire il comportamento degli atomi dobbiamo studiare il comportamento dei suoi elettroni L'atomo e le sue particelle NON sono direttamente visibili
Equazioni di Maxwell. (legge di Gauss per il campo elettrico) (legge di Gauss per il campo magnetico) C (legge di Faraday)
 Equazioni di Maxwell Φ S ( r E ) = Q ε 0 (legge di Gauss per il campo elettrico) Φ S ( r B ) = 0 (legge di Gauss per il campo magnetico) C l ( r Φ B ) = µ 0 ε S ( E r ) 0 + µ (legge di Ampère - Maxwell)
Equazioni di Maxwell Φ S ( r E ) = Q ε 0 (legge di Gauss per il campo elettrico) Φ S ( r B ) = 0 (legge di Gauss per il campo magnetico) C l ( r Φ B ) = µ 0 ε S ( E r ) 0 + µ (legge di Ampère - Maxwell)
Gli argomenti trattati
 LEZIONE 1 Struttura della materia e Gli argomenti trattati Composizione della materia materia, sostanze e miscele, elementi e composti Fondamenti di struttura atomica Molecole: formula empirica, formula
LEZIONE 1 Struttura della materia e Gli argomenti trattati Composizione della materia materia, sostanze e miscele, elementi e composti Fondamenti di struttura atomica Molecole: formula empirica, formula
Meccanica quantistica Mathesis 2016 Prof. S. Savarino
 Meccanica quantistica Mathesis 2016 Prof. S. Savarino Quanti Corpo nero: è un oggetto che assorbe tutta la radiazione senza rifletterla. Come una corda legata agli estremi può produrre onde stazionarie
Meccanica quantistica Mathesis 2016 Prof. S. Savarino Quanti Corpo nero: è un oggetto che assorbe tutta la radiazione senza rifletterla. Come una corda legata agli estremi può produrre onde stazionarie
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni
 CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni Lavoisier e la legge di conservazione della massa Lavoisier riconobbe l importanza delle misurazioni accurate
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni Lavoisier e la legge di conservazione della massa Lavoisier riconobbe l importanza delle misurazioni accurate
Radioattività. 1. Massa dei nuclei. 2. Decadimenti nucleari. 3. Legge del decadimento XVI - 0. A. Contin - Fisica Generale Avanzata
 Radioattività 1. Massa dei nuclei 2. Decadimenti nucleari 3. Legge del decadimento XVI - 0 Nucleoni Protoni e neutroni sono chiamati, indifferentemente, nucleoni. Il numero di protoni (e quindi di elettroni
Radioattività 1. Massa dei nuclei 2. Decadimenti nucleari 3. Legge del decadimento XVI - 0 Nucleoni Protoni e neutroni sono chiamati, indifferentemente, nucleoni. Il numero di protoni (e quindi di elettroni
1. LA STRUTTURA DELL ATOMO
 1. LA STRUTTURA DELL ATOMO 1 LA STRUTTURA DELL ATOMO Alla fine del XIX secolo le conoscenze acquisite nel campo della fisica e della chimica erano tali da poter permettere una conoscenza più approfondita
1. LA STRUTTURA DELL ATOMO 1 LA STRUTTURA DELL ATOMO Alla fine del XIX secolo le conoscenze acquisite nel campo della fisica e della chimica erano tali da poter permettere una conoscenza più approfondita
La Teoria dei Quanti e la Struttura Elettronica degli Atomi. Capitolo 7
 La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
Struttura dell Atomo
 LM85-bis Scienze della formazione primaria Struttura dell Atomo Prof. Federico Teloni Elementi di Chimica A. A. 2018-2019 e-mail: federico.teloni@istruzione.it Materia e Particelle Definiamo materia tutto
LM85-bis Scienze della formazione primaria Struttura dell Atomo Prof. Federico Teloni Elementi di Chimica A. A. 2018-2019 e-mail: federico.teloni@istruzione.it Materia e Particelle Definiamo materia tutto
Radiazione elettromagnetica
 Spettroscopia Radiazione elettromagnetica: energia che si propaga in un mezzo fenomeno ondulatorio dovuto alla propagazione simultanea nello spazio di un campo elettrico (E) e di uno magnetico (M) perpendicolari
Spettroscopia Radiazione elettromagnetica: energia che si propaga in un mezzo fenomeno ondulatorio dovuto alla propagazione simultanea nello spazio di un campo elettrico (E) e di uno magnetico (M) perpendicolari
Prerequisiti Lezione 1. Ripasso
 Prerequisiti Lezione 1 Ripasso Misura di angoli Nel sistema sessagesimale l'angolo completo o angolo giro è suddiviso in 360 spicchi, equivalenti all'unità di misura convenzionale denominata grado sessagesimale,
Prerequisiti Lezione 1 Ripasso Misura di angoli Nel sistema sessagesimale l'angolo completo o angolo giro è suddiviso in 360 spicchi, equivalenti all'unità di misura convenzionale denominata grado sessagesimale,
Modelli atomici. Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle.
 Modelli atomici Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle. Presupposti 1. Legge di Lavoisier della conservazione della massa: in una reazione chimica nulla si
Modelli atomici Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle. Presupposti 1. Legge di Lavoisier della conservazione della massa: in una reazione chimica nulla si
Comune ordine di riempimento degli orbitali di un atomo
 Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
La nascita della fisica moderna. (un racconto di inizio 900)
 La nascita della fisica moderna (un racconto di inizio 900) Sviluppo storico della fisica tra fine 800 e il 1927 Fisica sperimentale fine 800 Fisica teorica fine 800 1900 1905 1911 1913 1916 1924 1925-1927
La nascita della fisica moderna (un racconto di inizio 900) Sviluppo storico della fisica tra fine 800 e il 1927 Fisica sperimentale fine 800 Fisica teorica fine 800 1900 1905 1911 1913 1916 1924 1925-1927
catastrofe ultravioletta
 Fisica moderna Radiazione termica La radiazione termica è l insieme di onde elettromagnetiche che ogni corpo emette per effetto della sua temperatura Un corpo nero è un corpo che assorbe completamente
Fisica moderna Radiazione termica La radiazione termica è l insieme di onde elettromagnetiche che ogni corpo emette per effetto della sua temperatura Un corpo nero è un corpo che assorbe completamente
L atomo di Bohr. Per spiegare il mistero delle righe spettrali, Bohr propose un Modello Atomico dell Atomo di Idrogeno (1913)
 L atomo di Bohr Per spiegare il mistero delle righe spettrali, Bohr propose un Modello Atomico dell Atomo di Idrogeno (1913) L atomo di Bohr L atomo di idrogeno presenta un solo elettrone 1. L elettrone
L atomo di Bohr Per spiegare il mistero delle righe spettrali, Bohr propose un Modello Atomico dell Atomo di Idrogeno (1913) L atomo di Bohr L atomo di idrogeno presenta un solo elettrone 1. L elettrone
