Equilibrio dei liquidi, degli elettroliti e acido-base
|
|
|
- Berta Baldini
- 6 anni fa
- Visualizzazioni
Transcript
1
2
3
4 25 Equilibrio dei liquidi, degli elettroliti e acido-base OBIETTIVI DI APPRENDIMENTO Questi obiettivi di apprendimento corrispondono ai numeri dei moduli di questo capitolo e indicano ciò che si dovrebbe conoscere dopo aver completato il capitolo. SEZIONE 1 Equilibrio dei liquidi e degli elettroliti 25.1 Indicare i compartimenti dei liquidi corporei, identificare le componenti solide e riassumerne i contenuti Spiegare cosa si intende per equilibrio dei liquidi e discutere la sua importanza per l omeostasi Spiegare cosa si intende per equilibrio dei minerali e discuterne l importanza per l omeostasi Riassumere la relazione tra sodio e acqua nel mantenimento dell equilibrio dei liquidi e degli elettroliti MODULO CLINICO Spiegare quali sono i fattori che controllano l equilibrio del potassio e discutere ipokaliemia e iperkaliemia. SEZIONE 2 Equilibrio acido-base 25.6 Descrivere le tre classi di acidi presenti nel corpo Spiegare il ruolo dei sistemi tampone nel mantenimento dell equilibrio acido-base e del ph Spiegare il ruolo dei sistemi tampone nel regolare il ph dei liquidi intracellulare ed extracellulare Descrivere i meccanismi compensatori implicati nel mantenimento dell equilibrio acido-base MODULO CLINICO Descrivere l acidosi respiratoria e l alcalosi respiratoria. OA Gli Obiettivi di Apprendimento sono ripetuti alla fine di ciascun modulo. 962
5 Modulo 25.1 SEZIONE 1 Equilibrio dei liquidi e degli elettroliti La composizione corporea può essere considerata in termini di componenti solide e di due compartimenti di liquidi Il Capitolo 23 ha preso in considerazione il metabolismo delle componenti organiche del corpo. Questo capitolo illustra la composizione del corpo in toto. Verranno analizzate le componenti inorganiche: l acqua e i minerali. I minerali sono le sostanze inorganiche che si dissociano nei fluidi corporei per formare ioni chiamati elettroliti. 1 Questi grafici a torta paragonano la composizione corporea di maschi e femmine adulti. Le maggiori variazioni si riscontrano nel liquido intracellulare (LIC), o citosol, come risultato delle differenze del contenuto intracellulare di acqua nel grasso (10%) rispetto al muscolo scheletrico (75%). Differenze meno marcate si riscontrano nel liquido extracellulare (LEC), dovute alle variazioni nel volume del liquido interstiziale e al maggiore volume di sangue nei maschi rispetto alle femmine (per semplificare, plasma si riferisce al plasma sanguigno). LEC e LIC sono indicati come due diversi compartimenti dei liquidi, perché solitamente si comportano come entità distinte. Poiché le cellule hanno una membrana plasmatica e alla superficie della membrana si verifica un trasporto attivo, le cellule sono capaci di mantenere un ambiente interno distinto da quello del LEC. ACQUA 60% ACQUA 50% LIC LEC Liquido Liquido intracellulare 33% interstiziale 21,5% Plasma 4,5% Solidi 40% (materiali organici e inorganici) Altri liquidi corporei ( 1%) LIC LEC Liquido Liquido intracellulare 27% interstiziale 18% Plasma 4,5% Solidi 50% (materiali organici e inorganici) Altri liquidi corporei ( 1%) Maschi adulti COMPONENTI SOLIDE 40% Femmine adulte COMPONENTI SOLIDE 50% kg COMPONENTI SOLIDE (31,5 kg) 2 Le componenti solide costituiscono solo il 40-50% della massa corporea. Questo grafico a barre mostra la distribuzione delle componenti solide in un soggetto adulto di 70 kg con un minimo contenuto di grasso. Il grafico presenta i valori medi ottenuti da maschi e femmine di età compresa tra 18 e 40 anni. 0 Proteine Lipidi Minerali Carboidrati Miscellanea Verifica del modulo 25.1 In questa sezione verranno presi in esame gli scambi di acqua ed elettroliti tra LEC e LIC e tra il corpo e l ambiente esterno. a. Cosa sono i minerali? b. Indicare i due compartimenti dei liquidi. c. Come fanno le cellule a mantenere costante il loro ambiente interno? OA 25.1 Indicare i compartimenti dei liquidi corporei, identificare le componenti solide e riassumerne i contenuti. 963
6 Modulo 25.2 L equilibrio dei liquidi sussiste quando la quantità di acqua che si perde Equilibrio dei liquidi è uguale a quella Fonte che si introduce 1 Il nostro corpo si trova in uno stato di equilibrio dei liquidi quando il contenuto totale di acqua rimane costante nel tempo. L acqua si assume essenzialmente a livello dell apparato digerente, mentre può essere persa per vie diverse; circa la metà delle perdite giornaliere avviene attraverso l urina. Introito giornaliero (ml) Acqua contenuta nei cibi 1000 Acqua assunta con i liquidi 1200 Acqua prodotta con il catabolismo 300 Totale 2500 Metodo di eliminazione Perdita giornaliera (ml) Minzione 1200 Evaporazione attraverso la cute 750 Evaporazione attraverso i polmoni 400 Perdita con le feci 150 Totale Questa figura schematica indica dove l acqua entra nel canale alimentare Introito dietetico Secrezioni digestive mediante ingestione o secrezione e dove Cibi e bevande 2200 ml viene riassorbita. Solo una piccola quantità Saliva 1500 ml lascia il canale alimentare con le feci. La situazione è complicata dal fatto che le ghiandole esocrine annesse al canale alimentare producono secrezioni acquose che si mescolano con il contenuto del lume del canale alimentare. La maggior parte dell acqua rilasciata nei secreti deve essere Secrezioni gastriche 1500 ml recuperata insieme all acqua assunta con cibi e bevande. Questi movimenti dell acqua 5200 ml seguono passivamente gradienti osmotici. Le cellule epiteliali intestinali assorbono di continuo nutrienti e ioni e queste attività diminuiscono gradualmente la concentrazione dei soluti nel lume del canale alimen ml Riassorbimento dell acqua Fegato (bile) 1000 ml Pancreas (succo pancreatico) 1000 ml Secrezioni intestinali 2000 ml tare e aumentano la concentrazione dei soluti nel liquido interstiziale della lamina L intestino tenue riassorbe 8000 ml propria. Man mano che la concentrazione dei soluti diminuisce nel lume, l acqua si muove attraverso l epitelio verso il liquido 1200 ml interstiziale, mantenendo l equilibrio osmotico. Una volta giunta nel liquido interstiziale, l acqua assorbita si distribuisce rapida ml Secrezioni mucose del colon mente nel LEC. ml Il colon riassorbe 1250 ml 150 ml persi con le feci 964 Capitolo 25: Equilibrio dei liquidi, degli elettroliti e acido-base
7 3 Questa figura schematica illustra i fattori che incidono sul volume del LEC. Sebbene la composizione di LEC e LIC sia molto diversa, essi sono in equilibrio osmotico. Il volume del LIC è maggiore di quello del LEC. Il volume dell acqua all interno delle cellule rappresenta una riserva significativa che può evitare improvvisi cambiamenti nelle concentrazioni di soluti e acqua nel LEC. Un movimento veloce di acqua tra LEC e LIC in risposta ad un gradiente osmotico è chiamato spostamento dei liquidi. Spostamenti di liquidi si verificano rapidamente in risposta ai cambiamenti nella concentrazione osmotica del LEC e l equilibrio viene raggiunto in pochi minuti o ore. Questo può essere un fattore importante quando l assunzione di acqua è limitata e le perdite di acqua sono gravi. LIC Acqua metabolica (300 ml) Membrana plasmatica delle cellule nei tessuti Acqua assorbita attraverso l epitelio del canale alimentare (2200 ml) LEC Acqua persa con l urina (1200 ml) Acqua persa per evaporazione attraverso cute e polmoni (1150 ml) Acqua persa con le feci (150 ml) Acqua secreta dalle ghiandole sudoripare (variabile) Liquido intracellulare (LIC) Liquido extracellulare (LEC) Perdita d acqua dal LEC LEC e LIC sono in equilibrio; le due soluzioni sono isotoniche. La perdita d acqua dal LEC diminuisce il volume e rende la soluzione ipertonica rispetto al LIC. 4 La disidratazione si sviluppa quando le perdite di acqua superano le entrate. Quando si perde acqua ma si conservano gli elettroliti, la concentrazione osmotica del LEC aumenta. La pressione osmotica fa quindi muovere l acqua dal LIC al LEC finché le due soluzioni diventano isotoniche. A quel punto, sia il LIC che il LEC sono alquanto più concentrati rispetto al normale ed entrambi i volumi sono inferiori a prima della perdita di liquidi. Poiché il LIC è notevolmente superiore rispetto al LEC, esso rappresenta una riserva idrica efficace. Tuttavia, se lo squilibrio idrico continua in modo incontrollato, la perdita di acqua dal LIC produce grave sete, secchezza della pelle e formazione di rughe. Alla fine, la volemia e la pressione sanguigna possono diminuire fino a provocare uno shock circolatorio. Diminuito volume del LIC Aumentato volume del LEC Un passaggio di acqua per osmosi dal LIC al LEC ripristina l equilibrio osmotico, ma diminuisce il volume del LIC. Verifica del modulo 25.2 a. Identificare le modalità di perdita dei liquidi dall organismo. b. Descrivere lo spostamento dei liquidi. c. Spiegare la disidratazione e i suoi effetti sulla concentrazione osmotica del sangue. OA 25.2 Spiegare cosa si intende per equilibrio dei liquidi e discutere la sua importanza per l omeostasi. Sezione 1: Equilibrio dei liquidi e degli elettroliti 965
8 Modulo 25.3 L equilibrio dei minerali dipende dall equilibrio tra introiti e perdite di elettroliti 1 L equilibrio dei minerali dipende dal rapporto tra l assorbimento degli ioni, che si verifica attraverso l epitelio dell intestino tenue e del colon, e l escrezione degli ioni, che avviene principalmente nel rene. Le ghiandole sudoripare sono una potenziale fonte di perdita di acqua e minerali, ma la velocità di secrezione è estremamente variabile. Assorbimento degli ioni L assorbimento degli ioni avviene attraverso l epitelio che riveste il lume dell intestino tenue e del colon. Riserva di ioni (principalmente nello scheletro) Escrezione degli ioni Secrezione delle ghiandole sudoripare (sito secondario di perdita degli ioni) Pool di ioni nei liquidi corporei Reni (sito principale di perdita degli ioni) LIC LEC 2 Questa tabella elenca i meccanismi coinvolti nell assorbimento dei principali elettroliti lungo il canale alimentare. Assorbimento dei minerali Elettroliti Na + Ca 2+ K + Mg 2+ Fe 2+ CI I HCO 3 NO 3 3 PO 4 2 SO 4 Meccanismi Diffusione mediata da canali, cotrasporto o trasporto attivo Trasporto attivo Diffusione mediata da canali Trasporto attivo Trasporto attivo Diffusione mediata da canali o trasporto mediato da carrier Diffusione mediata da canali o trasporto mediato da carrier Diffusione mediata da canali o trasporto mediato da carrier Diffusione mediata da canali o trasporto mediato da carrier Trasporto attivo Trasporto attivo 966 Capitolo 25: Equilibrio dei liquidi, degli elettroliti e acido-base
9 3 Il corpo contiene notevoli riserve di minerali fondamentali. Questa tabella riassume le funzioni dei vari minerali e indica le vie principali di escrezione degli ioni. La quantità persa ogni giorno deve essere uguale alla quantità introdotta giornalmente per mantenere l equilibrio dei minerali corporei. Minerali e riserve di minerali Minerale Funzioni Contenuto totale nel corpo Principale via di escrezione Dose giornaliera raccomandata (RDA) (in mg) Minerali fondamentali Sodio Principale catione nei liquidi corporei; essenziale per la normale funzione delle membrane cellulari 110 g, principalmente nei liquidi corporei Urina, sudore, feci 1500 Potassio Principale catione nel citosol; essenziale per la normale funzione delle membrane cellulari 140 g, principalmente nel citosol Urina 4700 Cloruro Principale anione nei liquidi corporei; funziona formando HCl 89 g, principalmente nei liquidi corporei Urina, sudore 2300 Calcio Essenziale per la normale funzione di muscoli e neuroni e per la normale struttura ossea 1,36 kg, soprattutto nello scheletro Urina, feci Fosforo Nei composti ad alta energia, negli acidi nucleici e nella matrice ossea (sotto forma di fosfato) 744 g, principalmente nello scheletro Urina, feci 700 Magnesio Cofattore di enzimi, richiesto per la normale funzione delle membrane 29 g (scheletro, 17 g; citosol e liquidi corporei, 12 g) Urina Minerali in tracce Ferro Componente di emoglobina, mioglobina e citocromi 3,9 g (1,6 g immagazzinati come ferritina o emosiderina) Urina (tracce) 818 Zinco Rame Cofattore di sistemi enzimatici, in particolare anidrasi carbonica Richiesto come cofattore per la sintesi di emoglobina 2 g Urina, capelli (tracce) mg Urina, feci (tracce) 0,9 Manganese Cofattore per alcuni enzimi 11 mg Feci, urina (tracce) 1,82,3 Cobalto Cofattore per le transaminazioni; presente nella vitamina B 12 (cobalamina) 1,1 g Feci, urina 0,0001 Verifica del modulo 25.3 a. Definire l equilibrio dei minerali. b. Indicare gli ioni assorbiti mediante trasporto attivo. c. Spiegare il ruolo di due importanti minerali corporei: sodio e calcio. OA 25.3 Spiegare cosa si intende per equilibrio dei minerali e discuterne l importanza per l omeostasi. Sezione 1: Equilibrio dei liquidi e degli elettroliti 967
10 Modulo 25.4 L equilibrio idrico dipende dall equilibrio del sodio e i due sono regolati simultaneamente Risposta ai cambiamenti nei livelli di sodio 1 L equilibrio del sodio esiste quando le quantità di sodio in entrata sono uguali a quelle in uscita. Il meccanismo di regolazione cambia il volume del LEC, ma mantiene la concentrazione di Na + relativamente stabile. Quando le quantità di sodio in entrata superano le perdite, il volume del LEC aumenta; quando le perdite superano le entrate, il volume del LEC diminuisce. Le variazioni di volume del LEC avvengono senza un significativo cambiamento nella sua concentrazione osmotica. Queste regolazioni provocano piccoli cambiamenti nel volume del LEC, tali da non causare effetti fisiologici avversi. Aumento dei livelli di sodio nel sangue Osmocettori ipotalamici stimolati La secrezione di ADH aumenta La secrezione di ADH limita le perdite d acqua e stimola la sete, inducendo un ulteriore consumo d acqua Richiamo di liquidi Poiché l osmolarità del LEC aumenta, l acqua si sposta dal LIC, aumentando il volume del LEC e diminuendo la concentrazione del Na + nel LEC Se si consumano grandi quantità di sale senza un adeguata introduzione di liquidi, come quando si mangiano delle patatine salate senza bere, la concentrazione del Na + aumenta temporaneamente ALTERATA Aumentati livelli di Na + nel LEC Normale concentrazione di Na + nel LEC Inizio RIPRISTINATA Diminuiti livelli di Na + nel LEC ALTERATA RIPRISTINATA Diminuiti livelli di Na + nel LEC Aumentati livelli di Na + nel LEC Osmocettori ipotalamici inibiti La secrezione di ADH diminuisce La perdita di acqua riduce il volume del LEC e concentra gli ioni Diminuzione dei livelli di sodio nel sangue Quando la concentrazione osmotica del LEC diminuisce del 2 percento o più, la sete viene soppressa e la perdita di acqua attraverso i reni aumenta 968 Capitolo 25: Equilibrio dei liquidi, degli elettroliti e acido-base
11 Risposta ai cambiamenti di volume del LEC 2 Se i cambiamenti del volume del LEC causati da alterazioni nell equilibrio del sodio sono cospicui, vengono attivati i meccanismi omeostatici responsabili della regolazione di pressione sanguigna e volemia. Quando il volume del LEC cambia, cambia anche il volume del plasma e quindi del sangue. Se il volume del LEC aumenta, anche la volemia aumenta; se il volume del LEC diminuisce, anche la volemia diminuisce. Aumento di pressione sanguigna e volemia Rilascio di peptidi natriuretici dalle cellule muscolari cardiache Risposte ai peptidi natriuretici Aumentata perdita di Na + con l urina Aumentata perdita di acqua con l urina Diminuzione della sete Inibizione del rilascio di ADH, aldosterone, epinefrina e norepinefrina Effetti combinati Diminuzione della volemia Diminuzione della pressione sanguigna Aumento della volemia e distensione atriale ALTERATA RIPRISTINATA Aumento del volume del LEC in seguito ad aumento dei liquidi o dei liquidi e del Na + ALTERATA Diminuzione del volume del LEC in seguito a perdita di liquidi o di liquidi e Na + Normale volume del LEC Inizio Diminuzione del volume del LEC RIPRISTINATA Aumento del volume del LEC Diminuzione di pressione sanguigna e volemia Diminuzione di volemia e pressione sanguigna Risposte endocrine Aumento della secrezione di renina e attivazione dell angiotensina II Aumento del rilascio di aldosterone Aumento del rilascio di ADH Effetti combinati Aumentata ritenzione urinaria di Na + Diminuita perdita urinaria di acqua Aumento della sete Aumento dell assunzione di acqua La concentrazione di Na + nel LEC subisce forti variazioni solo quando si verificano gravi problemi nell equilibrio dei liquidi. Se la concentrazione di Na + nel LEC scende al di sotto di 136 meq/l, si instaura uno stato di iponatriemia (natrium, sodio); questo può essere causato da un eccessiva assunzione di acqua (iperidratazione) o da un assunzione insufficiente di sale. Quando il contenuto di acqua del corpo diminuisce, aumenta la concentrazione Na + ; quando la concentrazione di sodio supera i 145 meq/l, si ha ipernatriemia, la cui causa più comune è la disidratazione. Entrambe le condizioni sono gravi e potenzialmente pericolose per la vita. OA 25.4 Riassumere la relazione tra sodio e acqua nel mantenimento dell equilibrio dei liquidi e degli elettroliti. Verifica del modulo 25.4 a. Quale effetto esercita l inibizione degli osmocettori sulla secrezione di ADH e la sensazione di sete? b. Quale effetto produce l aldosterone sulla concentrazione di ioni sodio nel LEC? c. Riassumere brevemente la relazione tra concentrazione di ioni sodio e LEC. Sezione 1: Equilibrio dei liquidi e degli elettroliti 969
12 Modulo 25.5 MODULO CLINICO Alterazioni dell equilibrio del potassio sono rare ma estremamente pericolose 1 Questa figura schematica indica i principali fattori coinvolti nell equilibrio del potassio. I fattori chiave nel mantenere l equilibrio del potassio sono (1) il tasso di ingresso del K + attraverso l epitelio del canale alimentare e (2) il tasso di perdita del K + con l urina. Fattori che controllano l equilibrio del potassio Circa 100 meq (1,9-5,8 g) di ioni potassio sono assorbiti dal canale alimentare ogni giorno. K + K + Circa il 98 percento del contenuto di potassio del corpo si trova nel LIC piuttosto che nel LEC. La concentrazione degli ioni potassio nel LEC è circa 5 meq/l. La concentrazione del K + nel LEC è relativamente bassa. Il K + che esce dal LIC mediante canali ionici è bilanciato dal K + che entra mediante la pompa di scambio Na + /K +. K + Quando il potassio è all equilibrio, l escrezione urinaria di K + uguaglia l assorbimento di K + nel canale alimentare. K + Na + LEGENDA = Assorbimento = Secrezione = Diffusione attraverso canali ionici La concentrazione degli ioni potassio nel LIC è circa 135 meq/l. Le perdite di K + a livello renale sono di circa 100 meq al giorno. 2 Poiché l apporto dietetico è relativamente costante, il rene gioca un ruolo chiave nel determinare la concentrazione di K + nel LEC. La perdita di potassio dal rene è regolata mediante un controllo sulle attività delle pompe ioniche lungo le porzioni distali del nefrone e il sistema dei tubuli collettori. L attività di queste pompe è regolata dai livelli di aldosterone circolante. L aldosterone stimola il riassorbimento del Na + e contemporaneamente accelera l escrezione di K + (Modulo 24.10, p. 941). Il principale meccanismo per la secrezione del potassio è costituito da una pompa di scambio che estrude gli ioni potassio e riassorbe gli ioni sodio. K + K A + Na + Na + Liquido tubulare LEC LEGENDA A = Pompa a scambio ionico sensibile all aldosterone = Pompa di scambio sodio-potassio Gli ioni sodio sono poi pompati fuori dalla cellula e scambiati con gli ioni potassio presenti nel LEC. Si tratta della stessa pompa che estrude gli ioni sodio che entrano nel citosol attraverso canali ionici. 970 Capitolo 25: Equilibrio dei liquidi, degli elettroliti e acido-base
13 3 La regolazione dell equilibrio del potassio non è un processo a se stante. Per esempio, la secrezione di aldosterone aumenta in risposta a elevate concentrazioni ematiche di K + o a diminuiti livelli di Na + nel LEC. Comunque, alterazioni nell equilibrio acido-base possono compromettere l equilibrio del potassio agendo sulle pompe sensibili all aldosterone (Modulo 24.13, p. 947). Tubulo contorto distale K + A Dotto collettore Na + A Na + In condizioni normali, le pompe sensibili all aldosterone scambiano K + nel LEC con Na + nel liquido tubulare. Il risultato netto che si ottiene è un aumento dei livelli ematici di sodio e un aumentata perdita di K + nell urina. Quando il ph diminuisce nel LEC e la concentrazione di è relativamente alta, la pompa di scambio lega ioni invece di ioni K +. Questo aiuta a stabilizzare il ph del LEC, ma a costo di aumentare i livelli di K + nel LEC. 4 La figura schematica che segue indica i principali fattori coinvolti nella disregolazione dell equilibrio del potassio. Il range di concentrazione del K + nel LEC è di 3,5-5,0 meq/l. Variazioni al di fuori di tale intervallo sono insolite e potenzialmente pericolose. Quando la concentrazione del potassio nel sangue scende sotto 2 meq/l, si sviluppa una estesa debolezza muscolare, seguita da eventuale paralisi. Questa condizione, chiamata ipokaliemia grave (kalium, potassio), è potenzialmente letale a causa dei suoi effetti sul cuore. Livelli normali di potassio nel sangue (3,55,0 meq/l) Alte concentrazioni di K + nel sangue producono una condizione ugualmente pericolosa nota come iperkaliemia. Iperkaliemia grave si verifica quando la concentrazione di K + supera i 7 meq/l, portando ad aritmie cardiache. Fattori che promuovono l ipokaliemia Fattori che promuovono l iperkaliemia Diversi diuretici sono in grado di produrre ipokaliemia aumentando il volume di urina prodotta. La malattia endocrina chiamata iperaldosteronismo, caratterizzata da eccessiva secrezione di aldosterone, produce ipokaliemia per una iperstimolazione della ritenzione di sodio e della perdita di potassio. Un ph del sangue cronicamente basso promuove iperkaliemia interferendo con l escrezione di K + dal rene. L insufficienza renale dovuta a danni o malattie impedisce la normale secrezione di K + e quindi produce iperkaliemia. Diversi farmaci promuovono la minzione bloccando il riassorbimento del Na + dal rene. Quando il riassorbimento del sodio rallenta, rallenta anche la secrezione di potassio e ne può risultare iperkaliemia. Il trattamento dell ipokaliemia include generalmente un aumento dell assunzione di potassio con la dieta, salando i cibi con sali di potassio (KCl), o mediante assunzione di compresse di potassio, come lo Slow-K (K a lento rilascio). Il trattamento dell iperkaliemia in genere include una diluizione del LEC con una soluzione a basso contenuto di K +, stimolando la perdita di K + con le urine mediante diuretici come il Lasix, regolando il ph del LEC e operando una restrizione nell assunzione del K +. Nei casi derivanti da insufficienza renale, potrebbe essere necessaria la dialisi renale. OA 25.5 Spiegare quali sono i fattori che controllano l equilibrio del potassio e discutere ipokaliemia e iperkaliemia. Verifica del modulo 25.5 a. Quali organi sono principalmente responsabili della regolazione della concentrazione degli ioni K + nel LEC? b. Identificare i fattori che causano l escrezione del K +. c. Definire l ipokaliemia e l iperkaliemia. Sezione 1: Equilibrio dei liquidi e degli elettroliti 971
14 SEZIONE 1 Verifica 1 Collegare. Matching Collegare ciascun termine alla descrizione più appropriata. a. Reni b. Potassio c. Compartimenti dei liquidi d. Equilibrio dei liquidi e. Plasma ipertonico f. Disidratazione g. Aldosterone h. Plasma, liquido interstiziale i. Osmocettori j. Spostamento dei liquidi k. Ipokaliemia l. ADH m. Iponatriemia n. Sodio 1 Monitorano la concentrazione osmotica del sangue 2 Introito d acqua = perdita d acqua 3 Componenti principali del LEC 4 Catione predominante nel LEC 5 Ormone che limita la perdita d acqua e stimola la sete 6 Causata da iperidratazione 7 Catione predominante nel LIC 8 LIC e LEC 9 Siti più importanti per la regolazione dello ione sodio 10 Movimento di acqua tra LEC e LIC 11 L acqua passa dalle cellule al LEC 12 A seguito di iperaldosteronismo 13 Perdite di acqua maggiori delle entrate 14 Regola l assorbimento degli ioni sodio lungo il tubulo contorto distale e il sistema collettore Scelta multipla Selezionare la risposta corretta tra quelle elencate. 15 Circa 2/3 del contenuto totale di acqua è a livello di: a) liquido extracellulare (LEC) b) liquido intracellulare (LIC) c) liquido tissutale d) liquido interstiziale 16 L equilibrio elettrolitico implica un bilanciamento tra la velocità di assorbimento attraverso l apparato digerente e le perdite a livello di: a) cuore e polmoni b) stomaco e fegato c) reni e ghiandole sudoripare d) pancreas e cistifellea 17 Se il LEC è ipertonico rispetto al LIC, l acqua si sposta: a) dal LEC nelle cellule finché l equilibrio osmotico sarà ripristinato b) dalle cellule nel LEC finché l equilibrio osmotico sarà ripristinato c) in entrambe le direzioni finché l equilibrio osmotico sarà ripristinato d) in risposta alla pompa sodio-potassio 18 Quando viene consumata acqua pura, il LEC: a) diventa ipotonico rispetto al LIC b) diventa ipertonico rispetto al LIC c) diventa isotonico rispetto al LIC d) presenta una maggiore concentrazione di elettroliti 19 Aggiustamenti fisiologici che influenzano l equilibrio idroelettrolitico sono mediati principalmente da: a) ormone antidiuretico b) aldosterone c) peptidi natriuretici d) tutte le risposte 20 Quando l acqua viene persa ma gli elettroliti vengono conservati, l osmolarità del LEC aumenta e l osmosi quindi sposta l acqua: a) dal LEC nel LIC b) avanti e indietro tra LIC e LEC c) dal LIC nel LEC d) nessuna delle risposte Integrazione alla sezione Malia, una studentessa di infermieristica, si occupa dei pazienti ustionati. Si accorge che hanno costantemente elevati livelli di potassio nelle urine e si chiede perché. Cosa bisognerebbe risponderle?
15 Modulo 25.6 SEZIONE 2 Equilibrio acido-base Ci sono tre classi di acidi nel corpo Il corpo si trova in equilibrio acido-base quando la produzione di ioni idrogeno è esattamente compensata dalla loro perdita e quando il ph dei liquidi corporei rimane entro limiti normali. 1 Questa figura schematica mostra i principali fattori coinvolti nel mantenimento dell equilibrio acido-base. Il principale problema per l omeostasi è che il corpo genera diversi acidi durante il normale metabolismo ed è necessario impedire una diminuzione significativa del ph dei liquidi. Gli apparati respiratorio e urinario e i sistemi tampone nel LIC e nel LEC giocano importanti ruoli omeostatici per l equilibrio acido-base. I tessuti attivi generano continuamente anidride carbonica (CO 2 ), che in soluzione forma acido carbonico (H 2 CO 3 ), che si dissocia immediatamente in uno ione idrogeno e uno ione bicarbonato ( + HCO 3 ). Ulteriori acidi, come l acido lattico, vengono prodotti nel corso dei normali processi metabolici. 2 Cellule dei tessuti Ci sono tre classi di acidi che possono alterare l equilibrio del ph. CO 2 CO 2 ph ematico normale (7,357,45) Sistemi tampone I sistemi tampone possono immagazzinare temporaneamente gli ioni idrogeno e quindi possono stabilizzare il ph a breve termine. L apparato respiratorio è fondamentale per eliminare l anidride carbonica. I reni svolgono un ruolo importante secernendo ioni idrogeno nell urina e generando tamponi che entrano nel torrente circolatorio. Il tasso di escrezione aumenta o diminuisce a seconda delle necessità per mantenere il normale ph del sangue. Di conseguenza, il ph normale dell urina varia ampiamente, ma in media è 6,0 debolmente acido. Classi di acidi Acidi fissi Gli acidi fissi sono acidi che rimangono in soluzione; una volta prodotti, rimangono nei liquidi corporei fino a che vengono eliminati dai reni. Acido solforico e acido fosforico sono i più importanti acidi fissi del corpo. Essi sono generati in piccola quantità durante il catabolismo degli amminoacidi e dei composti che contengono gruppi fosfato, tra cui fosfolipidi e acidi nucleici. Acidi organici Gli acidi organici sono acidi che partecipano o sono prodotti dal metabolismo cellulare. Importanti acidi organici sono l acido lattico (prodotto dal metabolismo anaerobico del piruvato) e i corpi chetonici (sintetizzati dall acetil-coa). In condizioni normali, la maggior parte degli acidi organici è metabolizzata rapidamente, così non si verificano accumuli significativi. Acidi volatili Gli acidi volatili possono lasciare il corpo a livello dei polmoni, mediante gli atti respiratori. L acido carbonico (H 2 CO 3 ) è un acido volatile che si forma dall interazione tra acqua e anidride carbonica. Verifica del modulo 25.6 a. Quand è che il corpo si trova in equilibrio acidobase? b. Qual è il principale problema per l omeostasi acido-base? c. Elencare le tre classi di acidi che possono alterare il ph. OA 25.6 Descrivere le tre classi di acidi presenti nel corpo. 973
16 Modulo 25.7 Alterazioni potenzialmente pericolose dell equilibrio acido-base sono contrastate da sistemi tampone 1 Gli argomenti relativi a ph, caratteristiche chimiche di acidi e basi e sistemi tampone sono stati trattati nel Modulo 2.12 (p. 64). Questa tabella riassume i termini chiave che saranno impiegati nella discussione seguente. Termini utilizzati per descrivere l equilibrio acido-base ph Esponente negativo (logaritmo negativo) della concentrazione di ioni idrogeno [ ] in soluzione Neutra Acida Basica (alcalina) Acido Base Sale Tampone Una soluzione con ph uguale a 7; la soluzione contiene un numero uguale di ioni idrogeno (H+) e ioni idrossido (OH ) Una soluzione con ph inferiore a 7; in questa soluzione prevalgono gli ioni idrogeno Una soluzione con ph superiore a 7; in questa soluzione prevalgono gli ioni idrossido Una sostanza che dissociandosi rilascia ioni idrogeno, facendo diminuire il ph Una sostanza che dissociandosi rilascia ioni idrossido o cattura ioni idrogeno, facendo aumentare il ph Un composto ionico formato da un catione diverso dall idrogeno e da un anione diverso dall idrossido Una sostanza che tende ad opporsi ai cambiamenti di ph rimuovendo o rimpiazzando gli ioni idrogeno; nei liquidi corporei i sistemi tampone mantengono il ph del sangue entro i limiti della norma (7,357,45) 2 Il ph del LEC normalmente rimane entro limti relativamente ristretti, di solito tra 7,35 e 7,45. Qualunque deviazione dalla norma è estremamente pericolosa, in quanto variazioni nella concentrazione di ioni distruggono la stabilità delle membrane plasmatiche, alterano la struttura delle proteine e cambiano l attività di enzimi importanti. Non è possibile sopravvivere a lungo con un ph del LEC inferiore a 6,8 o superiore a 7,7. In pratica, si osservano più comunemente diminuzioni del ph rispetto ad aumenti, in quanto diversi acidi, tra cui l acido carbonico, sono generati durante il normale metabolismo cellulare. Qualunque variazione del ph si ripercuote su tutti i sistemi corporei, ma il sistema nervoso e l apparato cardiovascolare sono particolarmente sensibili alle fluttuazioni del ph. Quando il ph del sangue scende al di sotto di 7,35 si instaura acidemia. Lo stato fisiologico che ne risulta è chiamato acidosi. Il ph del LEC normalmente varia tra 7,35 e 7,45. Quando il ph del sangue aumenta al di sopra di 7,45 si instaura alcalemia. Lo stato fisiologico che ne risulta è chiamato alcalosi. Estremamente acido Estremamente basico ph Un acidosi severa (ph inferiore a 7,0) può essere letale perché (1) le funzioni del sistema nervoso centrale si deteriorano e il paziente può entrare in coma; (2) le contrazioni cardiache diventano deboli e irregolari e si possono sviluppare i segni e i sintomi dell insufficienza miocardica; (3) la vasodilatazione periferica produce un importante calo pressorio, con la possibilità di innescare un collasso cardiocircolatorio. Anche un alcalosi severa è pericolosa, ma i casi gravi sono relativamente rari. 974 Capitolo 25: Equilibrio dei liquidi, degli elettroliti e acido-base
17 3 La pressione parziale di anidride carbonica (P CO2 ) nel sangue è il fattore più importante capace di alterare il ph dei tessuti corporei, in quanto l anidride carbonica si combina con l acqua per formare acido carbonico (H 2 CO 3 ). Poiché la maggior parte dell anidride carbonica in soluzione viene convertita in acido carbonico dall anidrasi carbonica e la maggior parte dell acido carbonico si dissocia in ioni idrogeno e ioni bicarbonato, vi è una relazione inversa tra la P CO2 e il ph. P CO mm Hg ph 7,357,45 Se la P CO2 aumenta Se la P CO 2 diminuisce H 2 O + CO 2 H 2 CO 3 + HCO 3 + HCO 3 H 2 CO 3 H 2 O + CO 2 Quando i livelli di anidride carbonica aumentano, si forma più acido carbonico e vengono rilasciati ulteriori ioni idrogeno e bicarbonato e il ph diminuisce. Quando la P CO2 diminuisce, la reazione avviene al contrario e l acido carbonico si dissocia in anidride carbonica e acqua. Di conseguenza, ioni idrogeno vengono rimossi dalla soluzione e il ph aumenta. P CO2 ph P CO2 ph 4 Un sistema tampone nei liquidi corporei generalmente consiste in una combinazione di un acido debole (HY) e di un anione (Y ) rilasciato dalla sua dissociazione. L anione funziona come una base debole. In soluzione, le molecole dell acido debole sono in equilibrio con i suoi prodotti di dissociazione. Da un punto di vista chimico, questa relazione è rappresentata come: L aggiunta di ioni alla soluzione altera l equilibrio e provoca la formazione di ulteriori molecole di acido debole. Anche la rimozione di ioni dalla soluzione altera l equilibrio e provoca la dissociazione di altre molecole di HY, con rilascio di ioni. + HY + Y HY + Y + Y + HY Verifica del modulo 25.7 a. Definire acidemia e alcalemia. b. Quale composto intermedio formato da acqua e anidride carbonica influenza direttamente il ph del LEC? c. Definire la relazione tra P CO2 e ph. OA 25.7 Spiegare il ruolo dei sistemi tampone nel mantenimento dell equilibrio acido-base e del ph. Sezione 2: Equilibrio acido-base 975
18 Modulo 25.8 I sistemi tampone possono ritardare ma non evitare variazioni di ph nel LIC e nel LEC 1 Il corpo ha tre principali sistemi tampone, ciascuno con caratteristiche e distribuzione leggermente diverse. Anche se i sistemi tampone possono legare gli ioni in eccesso, forniscono solo una soluzione temporanea per lo squilibrio acido-base. Gli ioni idrogeno non sono eliminati, ma semplicemente resi innocui (neutralizzati). Nel processo viene legata una molecola di tampone e la quantità di molecole tampone è limitata. Sistemi tampone esistono in Liquido intracellulare (LIC) Liquido extracellulare (LEC) Sistema tampone fosfato Il sistema tampone fosfato ha un ruolo importante nel tamponare il ph del LIC e dell urina. Sistemi tampone proteici I sistemi tampone proteici contribuiscono alla regolazione del ph nel LEC e nel LIC. Questi tamponi interagiscono estesamente con gli altri due sistemi tampone. Sistema tampone acido carbonico-bicarbonato Il sistema tampone acido carbonicobicarbonato è il più importante nel LEC. Sistema tampone dell emoglobina (solo emazie) Sistemi tampone amminoacidici (tutte le proteine) Sistemi tampone delle proteine plasmatiche 2 Il sistema tampone dell emoglobina è l unico sistema tampone intracellulare che può avere un effetto immediato sul ph dei liquidi corporei. Nei tessuti, i globuli rossi assorbono l anidride carbonica dal plasma e la convertono in acido carbonico. Quando l acido carbonico si dissocia, gli ioni idrogeno vengono tamponati dall emoglobina. Nei polmoni, l intera sequenza di reazioni procede in senso contrario e la CO 2 diffonde negli alveoli per l espirazione (Modulo 21.14, p. 812). Cellule dei tessuti Plasma H 2 O Globuli rossi Plasma Globuli rossi H 2 O Polmoni Rilasciata con l espirazione CO 2 H 2 CO 3 Hb HCO 3 + Hb + HCO 3 H 2 CO 3 CO Capitolo 25: Equilibrio dei liquidi, degli elettroliti e acido-base
19 3 I sistemi tampone proteici impediscono cambiamenti significativi del ph, di solito legando gli ioni idrogeno ( ) in eccesso. Questi tamponi dipendono dalla capacità degli amminoacidi di rispondere alle variazioni di ph, accettando o rilasciando. Ogni amminoacido ha un ph specifico (normalmente inferiore a 7) in cui il gruppo carbossilico ha rilasciato uno ione idrogeno e il gruppo amminico ne ha legato uno. Questa forma, che non ha carica ionica netta, è chiamato zwitterione. Nelle soluzioni con ph superiore a 7, il gruppo amminico (NH 2 ), il gruppo carbossilato (COO ) e il gruppo laterale (R) della maggior parte degli amminoacidi liberi possono agire come tampone. Il meccanismo implicato è indicato qui. Tuttavia, in una proteina, la maggior parte dei gruppi carbossilato e amminici della catena principale è impegnata in legami peptidici. Solo il gruppo amminico e il gruppo carbossilato situati alle due estremità della catena proteica sono disponibili per esplicare un attività tampone. Così, la maggior parte delle capacità tampone delle proteine è fornita dai gruppi R degli amminoacidi. + H H H N H C R C O O H Aumento di acidità (diminuzione di ph) H H N H C R C O O Amminoacido (zwitterione) Se il ph diminuisce, il gruppo carbossilato (COO ) e il gruppo amminico (NH 2 ) di un amminoacido possono fungere da basi deboli e accettare ioni idrogeno aggiuntivi, formando rispettivamente un gruppo carbossilico (COOH) e uno ione ammino (NH 3 + ). Anche molti dei gruppi R possono accettare ioni idrogeno, formando R. H H ph normale (7,357,45) N Inizio H C R Al ph normale dei liquidi corporei (7,357,45), né i gruppi carbossilato (COO ) né i gruppi amminici (NH 2 ) della maggior parte degli amminoacidi sono legati a ioni idrogeno. C O O 4 Il sistema tampone acido carbonico-bicarbonato coinvolge reazioni liberamente reversibili. Un cambiamento nella concentrazione di qualsiasi componente influenza le concentrazioni di tutti gli altri componenti e modifica la direzione delle reazioni in corso. SISTEMA TAMPONE ACIDO CARBONICO-BICARBONATO CO H 2 CO 3 CO H 2 O + HCO 3 (acido carbonico) (ione bicarbonato) Polmoni I liquidi corporei contengono una grande riserva di HCO 3, principalmente sotto forma di molecole della base debole bicarbonato di sodio (NaHCO 3 ) in soluzione. Questa riserva prontamente disponibile di HCO 3 è definita riserva dei bicarbonati. HCO + Na + 3 RISERVA DEI BICARBONATI NaHCO 3 (bicarbonato di sodio) Inizio Aggiunta di prodotti dall attività metabolica La funzione principale del sistema tampone acido carbonico-bicarbonato è quella di protezione dagli effetti degli acidi organici e fissi prodotti dal metabolismo. Infatti, esso lega l rilasciato da questi acidi e produce acido carbonico che si dissocia in acqua e anidride carbonica, che viene facilmente eliminata attraverso i polmoni. Squilibri acido-base metabolici derivano dalla produzione o dalla perdita di quantità eccessive di acidi fissi o organici. Il ruolo primario del sistema tampone acido carbonico-bicarbonato è quello di proteggere da tali alterazioni. Squilibri acido-base respiratori derivano da uno squilibrio tra la velocità di generazione di CO 2 e la velocità di eliminazione della CO 2 dai polmoni. Il sistema tampone acido carbonico-bicarbonato non può proteggere dalle patologie respiratorie; gli squilibri devono essere corretti da cambiamenti nella profondità e nella frequenza del respiro. Verifica del modulo 25.8 a. Identificare i tre principali sistemi tampone del corpo. b. Quali liquidi sono tamponati dal sistema del tampone fosfato? c. Descrivere il sistema tampone acido carbonico-bicarbonato. OA 25.8 Spiegare il ruolo dei sistemi tampone nel regolare il ph dei liquidi intracellulare ed extracellulare. Sezione 2: Equilibrio acido-base 977
20 Modulo 25.9 Le risposte omeostatiche ad acidosi e alcalosi metaboliche coinvolgono meccanismi respiratori e renali e sistemi tampone Risposte all acidosi metabolica 1 L acidosi metabolica si sviluppa quando un gran numero di ioni idrogeno viene rilasciato da acidi organici o fissi e il ph diminuisce. Per mantenere l omeostasi, l eccesso di deve essere legato permanentemente attraverso la formazione di acqua (legata alla formazione di CO 2, che può essere eliminata dai polmoni) o rimosso dai liquidi corporei attraverso la secrezione renale. Inizio Aggiunta di SISTEMA TAMPONE ACIDO CARBONICO-BICARBONATO RISERVA DEI BICARBONATI H 2 CO 3 CO 2 CO 2 + H 2 O + HCO 3 HCO 3 + Na + NaHCO 3 (acido carbonico) (ione bicarbonato) (bicarbonato di sodio) Polmoni Produzione di HCO 3 Risposta respiratoria all acidosi Un aumentata frequenza respiratoria fa diminuire la P CO2, convertendo efficacemente molecole di acido carbonico in acqua. Altri sistemi tampone legano RENI Secrezione di Risposta renale all acidosi I tubuli renali rispondono (1) secernendo ioni, (2) rimuovendo CO 2 e (3) riassorbendo HCO 3 per aiutare a ricostituire la riserva dei bicarbonati. 2 Le cellule dei tubuli renali secernono nel liquido tubulare lungo il tubulo contorto prossimale (TCP), il tubulo contorto distale (TCD) e il sistema collettore. Rinforzano anche la capacità del sistema tampone acido carbonico-bicarbonato aumentando la concentrazione di ioni bicarbonato nel LEC, sostituendo quelli assorbiti dalla riserva dei bicarbonati. Liquido tubulare CO 2 CO 2 CO 2 + H 2 O Na + Anidrasi carbonica H 2 CO 3 Cl Cellule del tubulo renale HCO 3 Cl LEC HCO 3 HCO 3 Na + Passaggi nella rimozione di e nella produzione di HCO 3 La CO 2 prodotta dalle cellule del tubulo si aggiunge alla CO 2 che diffonde nelle cellule dall urina e dal LEC. L anidrasi carbonica converte la CO 2 e l acqua in acido carbonico, che poi si dissocia. Gli ioni cloruro scambiati con gli ioni bicarbonato sono escreti nel liquido tubulare. Gli ioni bicarbonato e sodio sono trasportati nel LEC e vengono accumulati nella riserva dei bicarbonati. 978 Capitolo 25: Equilibrio dei liquidi, degli elettroliti e acido-base
21 Risposte all alcalosi metabolica 3 L alcalosi metabolica si sviluppa quando un gran numero di ioni idrogeno viene rimosso dai liquidi corporei, con conseguente aumento del ph. Quando si verifica ciò, (1) il tasso di secrezione di da parte dei reni diminuisce, (2) le cellule dei tubuli non recuperano i bicarbonati nel liquido tubulare e (3) il sistema collettore trasporta HCO 3 nel liquido tubulare rilasciando un acido forte (HCl) nel LEC. Rimozione Inizio di SISTEMA TAMPONE ACIDO CARBONICO-BICARBONATO RISERVA DEI BICARBONATI Polmoni H 2 CO 3 CO 2 + H 2 O + HCO 3 HCO 3 + Na + NaHCO 3 (acido carbonico) (ione bicarbonato) (bicarbonato di sodio) Risposta respiratoria all alcalosi La diminuita frequenza respiratoria aumenta la P CO2, convertendo efficacemente molecole di CO 2 in acido carbonico. Altri sistemi tampone legano Produzione di RENI Secrezione di HCO 3 Risposta renale all alcalosi I tubuli renali rispondono conservando ioni e secernendo HCO 3. 4 Le cellule dei tubuli secernono ioni bicarbonato nel liquido tubulare lungo il tubulo contorto prossimale (TCP), il tubulo contorto distale (TCD) e il sistema collettore. Spostano anche ioni nel LEC. Liquido tubulare Cellule del tubulo renale CO 2 CO 2 CO 2 + H 2 O Anidrasi carbonica H 2 CO 3 HCO 3 HCO 3 Cl Cl LEC Passaggi nella rimozione di HCO 3 e nella produzione di La CO 2 prodotta dalle cellule del tubulo si aggiunge alla CO 2 che diffonde nelle cellule dal liquido tubulare e dal LEC. L anidrasi carbonica converte la CO 2 e l acqua in acido carbonico, che poi si dissocia. Gli ioni idrogeno sono traportati attivamente nel LEC, accompagnati dalla diffusione di ioni cloruro. L HCO 3 viene pompato nel liquido tubulare e scambiato con ioni cloruro, che diffonderanno nel LEC. Verifica del modulo 25.9 a. Descrivere l acidosi metabolica. b. Descrivere l alcalosi metabolica. c. Se i reni trattengono HCO 3 ed eliminano nell urina acida, si produce alcalosi metabolica o acidosi metabolica? OA 25.9 Descrivere i meccanismi compensatori implicati nel mantenimento dell equilibrio acido-base. Sezione 2: Equilibrio acido-base 979
22 Modulo MODULO CLINICO I disordini acido-base respiratori sono la causa più comune di alterazioni dell equilibrio acido-base I disordini acido-base respiratori derivano da uno squilibrio tra la velocità di produzione di CO 2 nei tessuti del corpo e la velocità di eliminazione della CO 2 nei polmoni. Acidosi respiratoria 1 I disturbi acido-base respiratori non possono essere corretti, neanche temporaneamente, dal sistema tampone acido carbonico-bicarbonato. Se la velocità di generazione della CO 2 supera la velocità della sua rimozione, si sviluppa la condizione di acidosi respiratoria. L acidosi respiratoria è relativamente comune e può essere pericolosa per la vita. SISTEMA TAMPONE ACIDO CARBONICO-BICARBONATO RISERVA DEI BICARBONATI H HCO 3 + Na + 2 CO 3 CO 2 CO 2 + H 2 O + HCO 3 NaHCO 3 (acido carbonico) (ione bicarbonato) (bicarbonato di sodio) Polmoni 1 2 Quando l attività respiratoria non tiene il passo con la velocità di produzione della CO 2, la P CO2 alveolare ed ematica aumenta. Questo sconvolge l equilibrio e sposta la reazione verso destra, generando ulteriore H 2 CO 3, che rilascia e diminuisce il ph del sangue. L acido carbonico si dissocia in ioni bicarbonato e ioni idrogeno e l eccesso di ioni bicarbonato entra a far parte della riserva dei bicarbonati. Per limitare gli effetti sul ph dell acidosi respiratoria, l eccesso di deve essere sequestrato da altri sistemi tampone o eliminato dai reni. Il problema di fondo, tuttavia, non può essere eliminato senza un aumento della frequenza respiratoria. 2 Questo diagramma di flusso riassume le risposte omeostatiche integrate all acidosi respiratoria. Aumentata P CO2 Acidosi respiratoria L aumento della P CO2 produce una diminuzione del ph del sangue Risposte all acidosi Compensazione respiratoria La stimolazione dei chemocettori delle arterie e del LCS induce un aumento della frequenza respiratoria Compensazione renale Secrezione di e produzione di HCO 3 Altri sistemi tampone, oltre al sistema acido carbonico-bicarbonato, accettano Effetti combinati Diminuzione della P CO2 Diminuzione di e aumento di HCO 3 ALTERATA Ipoventilazione che determina aumento della P CO2 Equilibrio acido-base normale Inizio RIPRISTINATA Il ph ritorna ai valori normali 980 Capitolo 25: Equilibrio dei liquidi, degli elettroliti e acido-base
23 Alcalosi respiratoria 3 Se la velocità di eliminazione della CO 2 supera la velocità di generazione della CO 2, si sviluppa la condizione di alcalosi respiratoria. L alcalosi respiratoria è relativamente rara e raramente grave. SISTEMA TAMPONE ACIDO CARBONICO-BICARBONATO H HCO 3 + Na + 2 CO 3 CO 2 CO 2 + H 2 O + HCO 3 NaHCO 3 (acido carbonico) (ione bicarbonato) (bicarbonato di sodio) Polmoni 1 2 Se l attività respiratoria supera la velocità di produzione della CO 2, la P CO2 alveolare ed ematica diminuisce; questo altera l equilibrio e sposta la reazione verso sinistra, rimuovendo e aumentando il ph del sangue. Man mano che gli ioni bicarbonato e idrogeno sono rimossi per formare acido carbonico, gli ioni bicarbonato ma non gli ioni idrogeno sono rimpiazzati dalla riserva dei bicarbonati. RISERVA DEI BICARBONATI 4 Le risposte omeostatiche all alcalosi respiratoria sono riassunte in questo diagramma di flusso. La maggior parte dei casi è correlata all ansia e la conseguente iperventilazione è autolimitante, la persona spesso sviene e la velocità respiratoria diminuisce quindi fino a raggiungere livelli normali. Un trattamento comune consiste nel far respirare la persona dentro e fuori un sacchetto di carta; gli aumentati livelli di CO 2 nell aria riciclata aumentano la P CO2 nel sangue ed eliminano l alcalosi. ALTERATA L iperventilazione provoca la diminuzione della P CO2 Equiibrio acido-base normale Inizio RIPRISTINATA Il ph del sangue ritorna nella norma Alcalosi respiratoria La diminuzione della P CO2 provoca un aumento del ph del sangue Risposte all alcalosi Compensazione respiratoria L inibizione dei chemocettori nelle arterie e nel LCS provoca una diminuzione della frequenza respiratoria Effetti combinati Aumento della P CO2 Aumento degli ioni e diminuzione degli ioni HCO 3 Diminuita P CO2 Compensazione renale Produzione di ioni e secrezione di ioni HCO 3 Sistemi tampone diversi dal sistema acido carbonico-bicarbonato rilasciano Verifica del modulo a. Definire acidosi respiratoria e alcalosi respiratoria. b. Come varia la P CO2 nel sangue di un paziente con ostruzione delle vie respiratorie? c. In che modo una diminuzione del ph dei liquidi corporei influenza la frequenza respiratoria? OA Descrivere l acidosi respiratoria e l alcalosi respiratoria. Sezione 2: Equilibrio acido-base 981
24 SEZIONE 2 Verifica Identificare Utilizzare i seguenti termini per riempire le caselle nei due diagrammi di flusso. I termini possono essere utilizzati più di una volta. Diminuzione del ph del sangue Aumento del ph del sangue Aumento della P CO2 Diminuzione della P CO2 Aumentato Diminuito Alcalosi Acidosi Prodotto Secreto 2 produce 3 respiratoria Risposte Compensazione respiratoria La stimolazione dei chemocettori nelle arterie e nel LCS produce un 4 della frequenza respiratoria. Compensazione renale Gli ioni idorgeno ( ) sono 5 Gli ioni bicarbonato (HCO 3 )sono Effetti combinati P CO2 HCO 3 ALTERATA Sistemi tampone diversi dal sistema acido carbonico-bicarbonato accettano. RIPRISTINATA Ipoventilazione che causa 1 Inizio Il ph del sangue ritorna nella norma ALTERATA Equilibrio acido-base normale Inizio RIPRISTINATA Iperventilazione che causa 10 Risposte Compensazione respiratoria L inibizione dei chemocettori nelle arterie e nel LCS produce Il ph del sangue ritorna nella norma Effetti combinati 11 produce 12 respiratoria 13 della frequenza respiratoria. Compensazione renale Gli ioni idrogeno ( ) sono P CO2 HCO 3 14 Gli ioni bicarbonato (HCO 3 ) sono 15 Sistemi tampone diversi dal sistema acido carbonico-bicarbonato rilasciano. Integrazione alla sezione Un ragazzo che stava annegando dopo essere caduto in un lago profondo è stato salvato. I soccorritori valutano le sue condizioni e scoprono che i suoi liquidi corporei hanno elevati valori di P CO2 e di lattato e bassi livelli di P O2. Identificare il problema di fondo e consigliare il trattamento necessario per ripristinare le condizioni omeostatiche
25 CAPITOLO 25 VERIFICA Equilibrio dei liquidi, degli elettroliti e acido-base Sommario del capitolo SEZIONE 1 Equilibrio dei liquidi e degli elettroliti 25.1 La composizione corporea può essere considerata in termini di componenti solide e di due compartimenti di liquidi p I minerali sono sostanze inorganiche che si dissociano nei liquidi corporei per formare ioni chiamati elettroliti. 2. Il liquido intracellulare (LIC) e il liquido extracellulare (LEC) costituiscono i compartimenti dei liquidi. 3. Le cellule sono in grado di mantenere l ambiente interno completamente separato da quello del LEC perché hanno una membrana plasmatica e un sistema di trasporto attivo sulla superficie della membrana. 4. I componenti solidi costituiscono solo il percento della massa corporea L equilibrio dei liquidi sussiste quando la quantità di acqua che si perde è uguale a quella che si introduce p L equilibrio dei liquidi nel corpo si verifica quando il contenuto di acqua rimane stabile nel tempo. 6. L ingresso di acqua nel corpo si verifica soprattutto nel canale alimentare. Quasi la metà delle perdite di acqua si verifica attraverso la minzione. 7. L introito quotidiano d acqua dipende dal contenuto di acqua presente nei cibi, dai liquidi consumati, dall acqua prodotta durante il metabolismo e si aggira intorno ai 2500 ml. Un totale di 2500 ml di acqua viene eliminato attraverso la minzione, l evaporazione dalla cute e dai polmoni, la perdita attraverso le feci e la secrezione delle ghiandole sudoripare. LIC Liquido intracellulare 27% ACQUA 50% LEC Liquido interstiziale 18% Solidi 50% (sostanze organiche e inorganiche) Plasma 4,5% COMPONENTI SOLIDE 50% Composizione corporea di una donna adulta 25.4 L equilibrio idrico dipende dall equilibrio del sodio e i due sono regolati simultaneamente p L equilibrio del sodio sussiste quando l assunzione di sodio uguaglia le perdite di sodio. 13. Quando gli introiti di sodio superano le perdite, il volume del LEC aumenta; quando le perdite di sodio superano i guadagni, il volume del LEC diminuisce. 14. Se il volume del LEC aumenta, la volemia aumenta. Se il volume del LEC diminuisce, la volemia diminuisce. 15. Quando la concentrazione di Na + nel LEC scende sotto i 136 meq/l, si instaura uno stato di iponatriemia. Ciò può essere causato da eccessiva assunzione di acqua (iperidratazione) o inadeguata assunzione di sale. 16. Quando il contenuto di acqua corporea diminuisce, la concentrazione di Na + aumenta; quando la concentrazione supera i 145 meq/l, si produce ipernatriemia; la disidratazione ne è la causa più comune. 8. Un passaggio rapido di acqua tra LEC e LIC in risposta ad un gradiente osmotico è chiamato spostamento dei liquidi. 9. La disidratazione si sviluppa quando le perdite di acqua superano l acqua assunta e prodotta nell organismo L equilibrio dei minerali dipende dall equilibrio tra introiti e perdite di elettroliti p L equilibrio dei minerali è l equilibrio tra l assorbimento ionico, che si verifica attraverso l epitelio della mucosa dell intestino tenue e del colon, e l escrezione di ioni, che si verifica soprattutto attraverso i reni. 11. Il corpo contiene notevoli riserve di minerali fondamentali. La quantità persa ogni giorno deve essere uguagliata dall assunzione giornaliera, per mantenere l equilibrio dei minerali Alterazioni dell equilibrio del potassio sono rare ma estremamente pericolose p I fattori chiave per mantenere l equilibrio del potassio sono la quantità di K + che entra nell organismo attraverso l epitelio del canale alimentare e la quantità di K + che viene persa nell urina. 18. I reni sono i principali determinanti della concentrazione di K + nel LEC. 19. La perdita di potassio dai reni è regolata dall aldosterone, che stimola il riassorbimento del Na + e contemporaneamente accelera l escrezione del K Il disordine endocrino iperaldosteronismo (eccessiva secrezione di aldosterone) si traduce in ipokaliemia (basso potassio) per eccesso di ritenzione di sodio e di perdita di potassio. Diuretici, come il Lasix, possono causare ipokalemia aumentando il volume di urina prodotta. Capitolo 25 Verifica 983
26 CAPITOLO 25 VERIFICA Equilibrio dei liquidi, degli elettroliti e acido-base (continua) 21. L iperkaliemia (eccesso di potassio) può essere causata da basso ph del sangue, insufficienza renale e diuretici che bloccano il riassorbimento del Na + (che causano anche rallentata secrezione di potassio). SEZIONE 2 Equilibrio acido-base 25.6 Ci sono tre classi di acidi nel corpo p L equilibrio acido-base si verifica nel corpo quando la produzione di è esattamente compensata dalla loro perdita e quando il ph dei liquidi corporei rimane entro limiti normali. 23. Il problema principale per l equilibrio acido-base è dato dalla varietà di acidi prodotti dal corpo durante il normale metabolismo, poiché una diminuzione significativa del ph nei liquidi corporei deve essere evitata. 24. Tre classi di acidi possono minacciare l equilibrio del ph: acidi fissi (acidi che rimangono in soluzione), acidi organici (prodotti del metabolismo cellulare) e acidi volatili (acidi che lasciano il corpo attraverso i polmoni) Alterazioni potenzialmente pericolose dell equilibrio acido-base sono contrastate da sistemi tampone p Il ph del LEC rimane normalmente tra 7,35 e 7, Le variazioni della concentrazione di ioni che si discostano dalla norma perturbano la stabilità delle membrane plasmatiche, alterano la struttura delle proteine e modificano le attività di importanti enzimi. 27. Quando il ph del sangue scende sotto 7,35, si instaura acidemia, con conseguente acidosi. Quando il ph del sangue aumenta sopra 7,45, si instaura alcalemia, con conseguente alcalosi. 28. Il fattore più importante che influenza il ph dei tessuti corporei è la P CO 2, perché l anidride carbonica si combina con l acqua per formare acido carbonico, che si dissocia in uno ione e uno ione bicarbonato (HCO 3 ) nella reazione H 2 O + CO 2 H 2 CO 3 + HCO 3. Esiste una relazione inversa tra P CO2 e ph. 29. Un sistema tampone nei liquidi corporei consiste generalmente in una combinazione di un acido debole (HY) e dell anione (Y ) liberato dalla sua dissociazione I sistemi tampone possono ritardare ma non evitare variazioni di ph nel LIC e nel LEC p Ci sono tre sistemi tampone principali: il sistema tampone fosfato, i sistemi tampone proteici e il sistema tampone acido carbonico-bicarbonato. 31. Il sistema tampone fosfato svolge un ruolo importante nel tamponare il ph del LIC e delle urine. 32. I sistemi tampone proteici regolano il ph di LEC e LIC e interagiscono con gli altri due sistemi tampone. I sistemi tampone proteici impediscono significativi cambiamenti del ph legando gli ioni in eccesso. Sono coinvolti i gruppi amminici, carbossilato e R (laterali) di amminoacidi liberi o gruppi laterali R di proteine. 33. Il sistema tampone acido carbonico-bicarbonato è il più importante nel LEC. Assume gli ioni rilasciati dall attività metabolica e genera acido carbonico, che si dissocia in acqua e anidride carbonica, che può essere facilmente eliminata dai polmoni Le risposte omeostatiche ad acidosi e alcalosi metaboliche coinvolgono meccanismi respiratori e renali e sistemi tampone p L acidosi metabolica si sviluppa quando gli acidi organici o fissi rilasciano un gran numero di ioni e il ph diminuisce. 35. L eccesso di ioni deve essere legato in modo permanente attraverso la formazione di acqua o rimosso dai liquidi del corpo attraverso la secrezione renale. 36. La risposta respiratoria all acidosi consiste in un aumentata frequenza respiratoria per diminuire la P CO2. A livello renale le cellule dei tubuli secernono nel liquido tubulare lungo il tubulo contorto prossimale (TCP), il tubulo contorto distale (TCD) e il sistema collettore. 37. L alcalosi metabolica si sviluppa quando un gran numero di ioni è rimosso dai liquidi corporei, con conseguente aumento del ph. 38. La risposta respiratoria all alcalosi metabolica consiste in una diminuzione della frequenza respiratoria. Questo comporta un aumento della P CO2, con conseguente conversione delle molecole di CO 2 in acido carbonico e aggiunta di. La risposta renale avviene a livello dei tubuli renali con risparmio di e secrezione di HCO I disordini acido-base respiratori sono la causa più comune di alterazioni dell equilibrio acido-base p I disturbi acido-base respiratori derivano da uno squilibrio tra la velocità di generazione di CO 2 nei tessuti corporei e la velocità di eliminazione della CO 2 dai polmoni. Questo non può essere corretto dal sistema tampone acido carbonico-bicarbonato. 40. Se la velocità di generazione della CO 2 è superiore alla velocità di rimozione della CO 2 per ipoventilazione, allora si sviluppa la condizione di acidosi respiratoria. Questa non può essere eliminata senza un aumento della frequenza respiratoria. 41. Se la velocità di eliminazione della CO 2 supera la velocità di generazione della CO 2 per iperventilazione, si sviluppa la condizione di alcalosi respiratoria. Questa è piuttosto inconsueta e raramente grave. 42. L alcalosi respiratoria è spesso legata a iperventilazione indotta da ansia; la persona sviene e di conseguenza si ripristina la normale velocità di ventilazione. Un trattamento comune consiste nel far respirare il soggetto in un sacchetto di carta. Gli aumentati livelli di CO 2 nell aria riciclata fanno aumentare la P CO2 nel sangue ed eliminano l alcalosi. Estremamente acido Estremamente basico ph Capitolo 25: Equilibrio dei liquidi, degli elettroliti e acido-base Alcalosi e acidosi severe sono entrambe estremamente pericolose.
27 Quesiti di verifica del capitolo Vero/falso Indicare se ciascuna affermazione è vera o falsa. 1 L acidosi metabolica si sviluppa quando un gran numero di ioni idrogeno è rimosso dai liquidi corporei, con conseguente aumento del ph. 2 Le proteine sono le componenti solide più abbondanti della massa corporea. 3 Circa la metà della perdita giornaliera di acqua avviene per evaporazione dai polmoni. 4 L alcalosi respiratoria si può trattare semplicemente facendo respirare il paziente dentro e fuori un sacchetto di carta. 5 L ipokaliemia è provocata da un inadeguata secrezione di aldosterone. 6 Il ferro è classificato come minerale fondamentale. 7 L acido carbonico è un acido volatile che si forma attraverso l interazione tra acqua e anidride carbonica. 8 Il ph del LEC normalmente varia da 7,0 a 7,30. 9 La composizione corporea totale dei maschi adulti è formata per il 60 percento da acqua e per il 40 percento da massa solida, mentre nelle femmine la composizione corporea totale è del 50 percento di acqua e per il 50 percento di massa solida. 10 Circa il 98 percento del contenuto di potassio del corpo umano si trova nel LIC, invece che nel LEC Collegare Collegare ciascun termine alla descrizione più appropriata. a. Tampone b. Acida c. Basica o alcalina d. ph e. Acido f. Base g. Neutra h. Sale 11 Esponente negativo della concentrazione di ioni idrogeno in soluzione 12 Una sostanza che si dissocia per rilasciare ioni idrossido per rimuovere ioni idrogeno, aumentando il ph 13 Una soluzione con ph uguale a 7, contenente lo stesso numero di ioni idrogeno e ioni idrossido 14 Una sostanza che tende ad opporsi a cambiamenti del ph di una soluzione, rimuovendo o sostituendo ioni idrogeno 15 Una soluzione con ph superiore a 7, in cui prevalgono gli ioni idrossido 16 Una sostanza che si dissocia liberando ioni idrogeno, diminuendo il ph 17 Un composto ionico costituito da un catione diverso dallo ione idrogeno e un anione diverso dallo ione idrossido 18 Una soluzione con un ph inferiore a 7, con prevalenza di ioni idrogeno Capitolo 25 Verifica 985
28 CAPITOLO 25 VERIFICA Equilibrio dei liquidi, degli elettroliti e acido-base (continua) Scelta multipla Selezionare la risposta corretta tra quelle elencate. 19 Il fattore più importante che influenza il ph dei tessuti corporei è: a) l acido cloridrico b) i corpi chetonici c) l acido lattico d) la pressione parziale dell anidride carbonica 20 L acidosi respiratoria si sviluppa quando il ph del sangue è: a) aumentato a causa di una diminuzione della P CO2 b) diminuito a causa di un aumento della P CO2 c) aumentato a causa di un aumento della P CO2 d) diminuito a causa di una diminuzione della P CO2 21 Quale delle seguenti è l equazione chimica corretta della reazione tra acqua e anidride carbonica? a) H 2 CO 3 + HCO 3 + H 2 O CO 2 b) H 2 O + CO 2 H 2 CO 3 + HCO 3 c) H 2O + CO 2 HCO 3 H 2CO 3 d) H 2 O + CO 2 + H 2 CO 3 HCO 3 22 La maggior parte della capacità tampone delle proteine è data da: a) gruppi R degli amminoacidi componenti b) legami peptidici tra amminoacidi adiacenti c) gruppi amminici e carbossilici degli amminoacidi componenti d) gruppo carbonioso centrale della maggior parte degli amminoacidi 23 Quale delle seguenti non è una risposta endocrina alla diminuzione della volemia e della pressione sanguigna? a) Aumentata secrezione di renina e attivazione di angiotensina II b) aumento del rilascio di aldosterone c) aumento del rilascio di ADH d) aumento di Na + nell urina 24 La condizione caratterizzata da una concentrazione ematica di Na + inferiore alla norma è detta: a) iponatriemia b) ipernatriemia c) ipokaliemia d) iperkaliemia 25 Quale dei seguenti minerali entra nella composizione di mioglobina, emoglobina e citocromi? a) Zinco b) Rame c) Ferro d) Cobalto 26 Il sito primario di perdita di ioni è costituito da: a) ghiandole sudoripare b) reni c) intestino d) polmoni Risposte brevi 27 Illustrare le differenze tra equilibrio dei liquidi, equilibrio dei minerali ed equilibrio acido-base. 28 Che cosa accadrebbe se un paziente disidratato ricevesse accidentalmente per endovena una soluzione salina ipertonica? 986 Capitolo 25: Equilibrio dei liquidi, degli elettroliti e acido-base
29 Integrazione al capitolo Applicazioni pratiche Problemi intestinali in paradiso Durante un viaggio in un Paese straniero con acqua potabile di bassa qualità, Beth e Tom hanno bevuto una bibita con ghiaccio durante la cena. Molti viaggiatori evitano di bere l acqua in Paesi stranieri, ma dimenticano che il ghiaccio spesso è fatto con acqua di rubinetto locale! Di conseguenza, sia Beth che Tom hanno contratto una malattia intestinale con una forma grave di diarrea. (La diarrea, caratterizzata da ampi passaggi di acqua nel lume intestinale con produzione di feci acquose, se non trattata, può causare complicazioni anche gravi). Si stima che ogni anno tale diarrea del viaggiatore interessi si almeno 10 milioni di americani. Destinazioni ad alto rischio comprendono i Paesi meno sviluppati dell America Latina, l Africa, il Medio Oriente e regioni dell Asia. I CDC hanno messo a disposi-izione un sito web per informare i viaggiatori. Dopo 2 giorni di attacchi incontrollati di diarrea, la coppia si è rivolta a un vicino centro medico per le cure. I test hanno rivelato che la causa è il batterio Escherichia coli. Ulteriori test hanno no stabilito che sia Beth che Tom sono disidratati, così sono stati prescritti loro liquidi per via endovenosa. Purtroppo, l infermiera si è distratta e ha somministrato erroneamente a Tom una soluzione di glucosio ipertonica invece della soluzione fisiologica che è stata somministrata a Beth. 1 In che modo lo stato di disidratazione di Tom e Beth ha influenzato il loro o ph ematico e urinario e la loro respirazione? 2 Che effetto avrà la soluzione ipertonica glucosata somministrata per via endovenosa a Tom sui livelli ematici di ADH e sulla quantità di urina emessa? Capitolo 25 Verifica 987
30
Plasma ph Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca
 Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
Escrezione renale di Na + e sua regolazione
 Escrezione renale di e sua regolazione L escrezione di dipende dal carico filtrato (e quindi dalla VFG) e dal carico riassorbito Il riassorbimento di avviene in tutti i segmenti del nefrone e nel nefrone
Escrezione renale di e sua regolazione L escrezione di dipende dal carico filtrato (e quindi dalla VFG) e dal carico riassorbito Il riassorbimento di avviene in tutti i segmenti del nefrone e nel nefrone
Sistema urinario: la funzione renale
 Sistema urinario: la funzione renale FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici, i reni ne regolano la concentrazione plasmatica
Sistema urinario: la funzione renale FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici, i reni ne regolano la concentrazione plasmatica
Equilibrio acido base
 Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio
 Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Rene ed equilibrio acido-base
 Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
ph = log 1/[H + ] = log [H + ]
![ph = log 1/[H + ] = log [H + ] ph = log 1/[H + ] = log [H + ]](/thumbs/49/24977942.jpg) ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
17/05/2010. Equilibrio idrico. Variazioni del volume ematico indicono risposte omeostatiche
 Equilibrio idrico Variazioni del volume ematico indicono risposte omeostatiche 1 Ruolo del rene nel bilancio idrico Variazioni dell osmolarità attraverso la midollare 2 Scambio per controcorrente nella
Equilibrio idrico Variazioni del volume ematico indicono risposte omeostatiche 1 Ruolo del rene nel bilancio idrico Variazioni dell osmolarità attraverso la midollare 2 Scambio per controcorrente nella
Sodio. L introduzione giornaliera con la dieta di sodio (200 meq/l) è maggiore del nostro fabbisogno (20 meq/l): è necessaria l escrezione urinaria
 Sodio L introduzione giornaliera con la dieta di sodio (200 meq/l) è maggiore del nostro fabbisogno (20 meq/l): è necessaria l escrezione urinaria E elemento principale per il controllo dell osmolalità
Sodio L introduzione giornaliera con la dieta di sodio (200 meq/l) è maggiore del nostro fabbisogno (20 meq/l): è necessaria l escrezione urinaria E elemento principale per il controllo dell osmolalità
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei Mantenere costanti volume ed osmolarità dei liquidi corporei è essenziale per l omeostasi. Questo è possibile solo se assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei Mantenere costanti volume ed osmolarità dei liquidi corporei è essenziale per l omeostasi. Questo è possibile solo se assunzione ed eliminazione di H 2
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra ). La stabilità del ph è insidiata da
 Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Acqua: nutriente essenziale
 Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Fisiologia Renale 8. Bilancio idro-elettrolitico III. Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona
 Fisiologia Renale 8. Bilancio idro-elettrolitico III Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona Obiettivi Bilancio del sodio e regolazione del volume extracellulare
Fisiologia Renale 8. Bilancio idro-elettrolitico III Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona Obiettivi Bilancio del sodio e regolazione del volume extracellulare
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE 1 I tamponi fisiologici del ph 1 - Il sistema acido carbonico-bicarbonato: H 2 CO 3 H + + HCO 3 pka = 6.1 ph = 6.1 + log [HCO 3 ] [H 2 CO 3 ] 2 - Il sistema fosfato:
L EQUILIBRIO ACIDO-BASE NEL SANGUE 1 I tamponi fisiologici del ph 1 - Il sistema acido carbonico-bicarbonato: H 2 CO 3 H + + HCO 3 pka = 6.1 ph = 6.1 + log [HCO 3 ] [H 2 CO 3 ] 2 - Il sistema fosfato:
Tamponi Biologici. AO/Febbraio 2016
 Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
SECREZIONI DEL SISTEMA GASTROINTESTINALE
 SECREZIONI DEL SISTEMA GASTROINTESTINALE SECREZIONE SALIVARE Funzioni della saliva Lubrificazione, legata al contenuto in acqua e muco Protezione, poiché tampona sostanze nocive esogene ed endogene e presenta
SECREZIONI DEL SISTEMA GASTROINTESTINALE SECREZIONE SALIVARE Funzioni della saliva Lubrificazione, legata al contenuto in acqua e muco Protezione, poiché tampona sostanze nocive esogene ed endogene e presenta
CONTROLLO DELL OSMOLALITA DEI LIQUIDI CORPOREI
 CONTROLLO DELL OSMOLALITA DEI LIQUIDI CORPOREI Il rene è responsabile del controllo dell escrezione di acqua. Altre vie che consentono l eliminazione di acqua dall organismo includono sudorazione, feci
CONTROLLO DELL OSMOLALITA DEI LIQUIDI CORPOREI Il rene è responsabile del controllo dell escrezione di acqua. Altre vie che consentono l eliminazione di acqua dall organismo includono sudorazione, feci
Omeostasi idro-elettrolitica
 Omeostasi idro-elettrolitica Riassorbimento idrico isoosmotico o obbligatorio Riassorbimento idrico non-isoosmotico o facoltativo Il bilancio idrico richiede l azione integrata di molteplici sistemi 1
Omeostasi idro-elettrolitica Riassorbimento idrico isoosmotico o obbligatorio Riassorbimento idrico non-isoosmotico o facoltativo Il bilancio idrico richiede l azione integrata di molteplici sistemi 1
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi Lezione 24 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante
L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi Lezione 24 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante
FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua
 FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie Università degli Studi Verona Obiettivi Funzioni
FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie Università degli Studi Verona Obiettivi Funzioni
Tamponi biologici per il controllo del ph
 Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg
 LEZIONE RENE 6 I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg BL 4.2mM 150mM BILANCIO DEL POTASSIO 4 moli di K nei compartimenti liquidi Liquido intracellulare
LEZIONE RENE 6 I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg BL 4.2mM 150mM BILANCIO DEL POTASSIO 4 moli di K nei compartimenti liquidi Liquido intracellulare
L anatomia dell apparato urinario
 L anatomia dell apparato urinario Le funzioni del rene Secrezione (escrezione) Equilibrio idrico (controllo della pressione arteriosa) Equilibrio salino (controllo della composizione elettrolitica) Endocrina
L anatomia dell apparato urinario Le funzioni del rene Secrezione (escrezione) Equilibrio idrico (controllo della pressione arteriosa) Equilibrio salino (controllo della composizione elettrolitica) Endocrina
Trasporto dei gas respiratori nel sangue
 Trasporto dei gas respiratori nel sangue La soluzione dei gas nei liquidi C Legge di Henry acq P gas S gas C acq = quantità di gas disciolta nella fase acquosa P gas = pressione parziale del gas nella
Trasporto dei gas respiratori nel sangue La soluzione dei gas nei liquidi C Legge di Henry acq P gas S gas C acq = quantità di gas disciolta nella fase acquosa P gas = pressione parziale del gas nella
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da
 Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Trasporto epiteliale
 Trasporto epiteliale Rivestono le cavità e le superfici corporee: interfaccia tra gli spazi interni dell organismo e l ambiente Semplice rivestimento o funzione di regolazione (es:osmoregolazione) Trasporto
Trasporto epiteliale Rivestono le cavità e le superfici corporee: interfaccia tra gli spazi interni dell organismo e l ambiente Semplice rivestimento o funzione di regolazione (es:osmoregolazione) Trasporto
EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI
 EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI SOMMARIO ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO ACIDO-BASE EGA (EMOGAS-ANALISI) ANALISI) ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO
EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI SOMMARIO ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO ACIDO-BASE EGA (EMOGAS-ANALISI) ANALISI) ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO
OSMOREGOLAZIONE DEI LIQUIDI CORPOREI
 OSMOREGOLAZIONE DEI LIQUIDI CORPOREI Lezione 25 1 Distribuzione dei liquidi corporei L H 2 O contenuta nel corpo è circa il 60% del peso totale ed è così ripartita: 67% 33% EXTRACELLULARE 33% INTRACELLULARE
OSMOREGOLAZIONE DEI LIQUIDI CORPOREI Lezione 25 1 Distribuzione dei liquidi corporei L H 2 O contenuta nel corpo è circa il 60% del peso totale ed è così ripartita: 67% 33% EXTRACELLULARE 33% INTRACELLULARE
Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento.
 Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento. Lungo i tubuli renali viene riassorbita la maggior parte dei soluti e il
Il rene regola l escrezione dei diversi soluti indipendentemente l uno dall altro, controllandone la velocità di riassorbimento. Lungo i tubuli renali viene riassorbita la maggior parte dei soluti e il
L EMOGASANALISI. P. Scavalli, M. Vitto, S. Mosillo
 L EMOGASANALISI P. Scavalli, M. Vitto, S. Mosillo EMOGASANALISI Consente la misurazione immediata dei due gas più importanti del sangue e di un terzo parametro fondamentale per la valutazione dell omeostasi
L EMOGASANALISI P. Scavalli, M. Vitto, S. Mosillo EMOGASANALISI Consente la misurazione immediata dei due gas più importanti del sangue e di un terzo parametro fondamentale per la valutazione dell omeostasi
Proprietà delle Soluzioni
 Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
600 mosm/dì 1200 mosm/l. = 0.5 l/dì
 Il rene elimina acqua in eccesso attraverso l escrezione di urina diluita Il rene trattiene acqua mediante l escrezione di urina concentrata Il rene controlla l osmolarità e la concentrazione del sodio
Il rene elimina acqua in eccesso attraverso l escrezione di urina diluita Il rene trattiene acqua mediante l escrezione di urina concentrata Il rene controlla l osmolarità e la concentrazione del sodio
Equilibrio acido-base
 Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Alterazione della capacità tampone nell'organismo. Alterazione capacità tampone rev. 0 - data: 5 luglio
 Alterazione della capacità tampone nell'organismo Alterazione capacità tampone rev. 0 - data: 5 luglio 2008 1 Il ph fisiologico dell'organismo è compreso tra 7.38 e 7.44 Nel liquido extracellulare sono
Alterazione della capacità tampone nell'organismo Alterazione capacità tampone rev. 0 - data: 5 luglio 2008 1 Il ph fisiologico dell'organismo è compreso tra 7.38 e 7.44 Nel liquido extracellulare sono
Rene ed equilibrio acido base. La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica. Principali funzioni renali
 Rene ed equilibrio acido base La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica Savi Umberto Scuola di Specializzazione in Nefrologia S.C. di Nefrologia e Dialisi Cattinara
Rene ed equilibrio acido base La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica Savi Umberto Scuola di Specializzazione in Nefrologia S.C. di Nefrologia e Dialisi Cattinara
Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia
 Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia Obiettivi Produzione e bilancio degli idrogenioni Regolazione respiratoria e renale del ph Riassorbimento del bicarbonato e secrezione
Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia Obiettivi Produzione e bilancio degli idrogenioni Regolazione respiratoria e renale del ph Riassorbimento del bicarbonato e secrezione
BILANCIO IDROLETTROLITICO (Alfonso Siani. ISA CNR) ACQUA
 BILANCIO IDROLETTROLITICO (Alfonso Siani. ISA CNR) ACQUA L acqua rappresenta il maggiore costituente dell organismo umano, e rappresenta all incirca il 60% del peso corporeo di un adulto. Il contenuto
BILANCIO IDROLETTROLITICO (Alfonso Siani. ISA CNR) ACQUA L acqua rappresenta il maggiore costituente dell organismo umano, e rappresenta all incirca il 60% del peso corporeo di un adulto. Il contenuto
Il Potassio è il principale catione intracellulare (K+) Si verifica per il Potassio la situazione inversa a quella del Sodio.
 POTASSIO Il Potassio è il principale catione intracellulare (K+) I suoi sali sono molto solubili in acqua. Si verifica per il Potassio la situazione inversa a quella del Sodio. Il mantenimento del gradiente
POTASSIO Il Potassio è il principale catione intracellulare (K+) I suoi sali sono molto solubili in acqua. Si verifica per il Potassio la situazione inversa a quella del Sodio. Il mantenimento del gradiente
L'EQUILIBRIO ACIDO-BASE
 L'EQUILIBRIO ACIDO-BASE La concentrazione nell'organismo degli ioni H+ è finemente regolata perché quasi tutte le attività enzimatiche sono influenzate sostanzialmente dalle variazioni di ph. Quindi l'attività
L'EQUILIBRIO ACIDO-BASE La concentrazione nell'organismo degli ioni H+ è finemente regolata perché quasi tutte le attività enzimatiche sono influenzate sostanzialmente dalle variazioni di ph. Quindi l'attività
FISIOLOGIA dell ALLENAMENTO. dai processi fisiologici alle metodiche di allenamento
 FISIOLOGIA dell ALLENAMENTO dai processi fisiologici alle metodiche di allenamento Introduzione alla fisiologia Metabolismo cellulare Il sistema cardiovascolare: funzione cardiaca vasi, flusso, pressione
FISIOLOGIA dell ALLENAMENTO dai processi fisiologici alle metodiche di allenamento Introduzione alla fisiologia Metabolismo cellulare Il sistema cardiovascolare: funzione cardiaca vasi, flusso, pressione
Eliminare dall organismo prodotti di rifiuto e sostanze tossiche idrosolubili(soprattutto prodotti azotati e creatinina);
 Funzioni del rene Eliminare dall organismo prodotti di rifiuto e sostanze tossiche idrosolubili(soprattutto prodotti azotati e creatinina); Regolare il volume e la composizione del liquido extracellulare;
Funzioni del rene Eliminare dall organismo prodotti di rifiuto e sostanze tossiche idrosolubili(soprattutto prodotti azotati e creatinina); Regolare il volume e la composizione del liquido extracellulare;
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Osmosi Scaricaricato da www.sunhope.it A B 30 mm 5 mm [Soluto] A [Soluto] B [H 2 O] A < [H 2 O] B Scaricaricato da www.sunhope.it
Farmacocinetica. Lo studio di questi quattro processi viene definito come FARMACOCINETICA del farmaco
 Farmacocinetica Affinché un farmaco possa raggiungere il sito d azione ad una concentrazione sufficiente per esercitare il proprio effetto terapeutico specifico deve generalmente essere: assorbito dal
Farmacocinetica Affinché un farmaco possa raggiungere il sito d azione ad una concentrazione sufficiente per esercitare il proprio effetto terapeutico specifico deve generalmente essere: assorbito dal
Raffaele Alvisi 14 gennaio 1916
 Raffaele Alvisi 14 gennaio 1916 Alterazioni del ph = Alterazioni dell equilibrio Acido-Base X 1 2 3 4 5 6 7 8 9 Conoscenze o Capacità Acquisite SI/NO Il clinico sospetta e dimostra l alterazione dell equilibrio
Raffaele Alvisi 14 gennaio 1916 Alterazioni del ph = Alterazioni dell equilibrio Acido-Base X 1 2 3 4 5 6 7 8 9 Conoscenze o Capacità Acquisite SI/NO Il clinico sospetta e dimostra l alterazione dell equilibrio
1. Controllo dell equilibrio acido-base. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 1. Controllo dell equilibrio acido-base Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Misura dell acidità di una soluzione Definizione di acido: qualsiasi sostanza chimica che
1. Controllo dell equilibrio acido-base Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Misura dell acidità di una soluzione Definizione di acido: qualsiasi sostanza chimica che
Il processo di ultrafiltrazione è interamente passivo e dipende sostanzialmente da tre fattori:
 Il processo di ultrafiltrazione è interamente passivo e dipende sostanzialmente da tre fattori: 1) Dalla differenza netta di pressione tra il lume del capillare ed il lume della capsula di Bowman; 2) dalla
Il processo di ultrafiltrazione è interamente passivo e dipende sostanzialmente da tre fattori: 1) Dalla differenza netta di pressione tra il lume del capillare ed il lume della capsula di Bowman; 2) dalla
Attivi (non equilibranti) Passivi (equilibranti) Migrazione attraverso canali membran. Diffusione semplice. Tasporto attivo secondario
 TRASPORTI Trasporti in forma libera Trasporti mediati Diffusione semplice Migrazione attraverso canali membran. Diffusione facilitata Trasporto attivo primario Tasporto attivo secondario Passivi (equilibranti)
TRASPORTI Trasporti in forma libera Trasporti mediati Diffusione semplice Migrazione attraverso canali membran. Diffusione facilitata Trasporto attivo primario Tasporto attivo secondario Passivi (equilibranti)
Riassorbimento dell acqua lungo il nefrone
 Riassorbimento dell acqua lungo il nefrone La quota escreta di acqua varia fra 0.25% (0.5 L/giorno, massima antidiuresi) ed il 13% (24 L/giorno, massima diuresi), attestandosi in condizioni normali intorno
Riassorbimento dell acqua lungo il nefrone La quota escreta di acqua varia fra 0.25% (0.5 L/giorno, massima antidiuresi) ed il 13% (24 L/giorno, massima diuresi), attestandosi in condizioni normali intorno
Le funzioni dell acqua
 Le funzioni dell acqua Principio nutritivo non energetico L acqua: costituisce il solvente di numerosi composti presenti nell organismo e permette il trasporto dei nutrienti. serve a mantenere costante
Le funzioni dell acqua Principio nutritivo non energetico L acqua: costituisce il solvente di numerosi composti presenti nell organismo e permette il trasporto dei nutrienti. serve a mantenere costante
5. Trasporto di membrana
 5. Trasporto di membrana contiene materiale protetto da copyright, ad esclusivo uso personale; 1 non è consentita diffusione ed utilizzo di tipo commerciale Le membrane biologiche hanno una permeabilità
5. Trasporto di membrana contiene materiale protetto da copyright, ad esclusivo uso personale; 1 non è consentita diffusione ed utilizzo di tipo commerciale Le membrane biologiche hanno una permeabilità
Anatomia funzionale del rene
 Anatomia funzionale del rene Funzione dei reni: Regolazione del volume del liquido extracellulare Regolazione dell osmolarità Mantenimento del bilancio idrico Regolazione omeostatica del ph Escrezione
Anatomia funzionale del rene Funzione dei reni: Regolazione del volume del liquido extracellulare Regolazione dell osmolarità Mantenimento del bilancio idrico Regolazione omeostatica del ph Escrezione
Le Quattro Funzioni principali di eliminazione nel rene: I -Ultrafiltrazione (capsula di Bowman) II -Diffusione (riassorbimento) III -Secrezione per:
 Escrezione I Farmaci previa o meno biotrasformazione (metabolismo) possono essere escreti dal rene (urine), dal fegato e intestino (bile e feci), dal polmone (aria espirata), ma anche col latte materno,
Escrezione I Farmaci previa o meno biotrasformazione (metabolismo) possono essere escreti dal rene (urine), dal fegato e intestino (bile e feci), dal polmone (aria espirata), ma anche col latte materno,
Biofisica e Fisiologia I semestre-ii anno 8 crediti. Elementi di Fisiologia e Biofisica Cellulare. Fisiologia dell apparato muscolare
 Biofisica e Fisiologia I semestre-ii anno 8 crediti Docenti: G. Irace I. Sirangelo http://dbb.unina2.it Obiettivi formativi Elementi di Fisiologia e Biofisica Cellulare Eccitabilità Fisiologia dell apparato
Biofisica e Fisiologia I semestre-ii anno 8 crediti Docenti: G. Irace I. Sirangelo http://dbb.unina2.it Obiettivi formativi Elementi di Fisiologia e Biofisica Cellulare Eccitabilità Fisiologia dell apparato
DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE
 VOLUMI POLMONARI DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE DEFINIRE LE RESISTENZE POLMONARI DEFINIRE IL LAVORO POLMONARE Equazione
VOLUMI POLMONARI DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE DEFINIRE LE RESISTENZE POLMONARI DEFINIRE IL LAVORO POLMONARE Equazione
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE
 FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
4ª UNITA DIDATTICA Modello Nutrizionale metabolico
 4ª UNITA DIDATTICA Modello Nutrizionale metabolico Contenuti Modello Nutrizionale metabolico Sezione del modello: Equilibrio idro-elettrolitico e acido-base Assistenza alla persona con problemi relativi
4ª UNITA DIDATTICA Modello Nutrizionale metabolico Contenuti Modello Nutrizionale metabolico Sezione del modello: Equilibrio idro-elettrolitico e acido-base Assistenza alla persona con problemi relativi
L NH 3 è prodotta da tutti i tessuti durante il metabolismo di diversi composti, ma solo il fegato èin grado di eliminarla sotto forma di urea
 L NH 3 è prodotta da tutti i tessuti durante il metabolismo di diversi composti, ma solo il fegato èin grado di eliminarla sotto forma di urea L NH 3 è estremamente tossica per il cervello: un aumento
L NH 3 è prodotta da tutti i tessuti durante il metabolismo di diversi composti, ma solo il fegato èin grado di eliminarla sotto forma di urea L NH 3 è estremamente tossica per il cervello: un aumento
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO
 L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
Gerard Tortora, Brian Derrickson. Conosciamo
 1 Gerard Tortora, Brian Derrickson Conosciamo il corpo umano Capitolo 1 L organizzazione del corpo umano 1. Che cosa sono l anatomia e la fisiologia 2. I livelli di organizzazione e gli apparati del corpo
1 Gerard Tortora, Brian Derrickson Conosciamo il corpo umano Capitolo 1 L organizzazione del corpo umano 1. Che cosa sono l anatomia e la fisiologia 2. I livelli di organizzazione e gli apparati del corpo
LEZIONE 30: SISTEMA DIGERENTE
 LEZIONE 30: SISTEMA DIGERENTE 1 ORGANO SECREZIONI FUNZIONI Bocca, faringe Masticazione, inizio riflesso deglutizione Ghiandole salivari Sali e acqua Muco Amilasi Lubrificare il cibo Lubrificare Digerire
LEZIONE 30: SISTEMA DIGERENTE 1 ORGANO SECREZIONI FUNZIONI Bocca, faringe Masticazione, inizio riflesso deglutizione Ghiandole salivari Sali e acqua Muco Amilasi Lubrificare il cibo Lubrificare Digerire
STOMACO.
 STOMACO FONTE : RUGARLI Medicina Interna Lo stomaco è la parte più espansa di tutto il canale alimentare; la sua notevole capacità contenitiva (1000-1500 ml) e le peculiari modalità di svuotamento attribuiscono
STOMACO FONTE : RUGARLI Medicina Interna Lo stomaco è la parte più espansa di tutto il canale alimentare; la sua notevole capacità contenitiva (1000-1500 ml) e le peculiari modalità di svuotamento attribuiscono
Mantenimento dell omeostasi
 Sistema Endocrino Ruolo nell omeostasi Ruolo nell esercizio fisico 1. Regolazione del metabolismo 2. Induzione di risposte adattative allo stress 3. Promozione della crescita e dello sviluppo sequenziale
Sistema Endocrino Ruolo nell omeostasi Ruolo nell esercizio fisico 1. Regolazione del metabolismo 2. Induzione di risposte adattative allo stress 3. Promozione della crescita e dello sviluppo sequenziale
Mantenimento dell omeostasi
 Sistema Endocrino Ruolo nell omeostasi Ruolo nell esercizio fisico 1. Regolazione del metabolismo 2. Induzione di risposte adattative allo stress 3. Promozione della crescita e dello sviluppo sequenziale
Sistema Endocrino Ruolo nell omeostasi Ruolo nell esercizio fisico 1. Regolazione del metabolismo 2. Induzione di risposte adattative allo stress 3. Promozione della crescita e dello sviluppo sequenziale
www.slidetube.it Il nefrone è costituito dal corpuscolo renale e dal tubulo
 Il nefrone è costituito dal corpuscolo renale e dal tubulo Il corpuscolo renale è formato da : a) il glomerulo arterioso b) la capsula di Bowman www.slidetube.it Zona corticale Zona midollare Dall arteria
Il nefrone è costituito dal corpuscolo renale e dal tubulo Il corpuscolo renale è formato da : a) il glomerulo arterioso b) la capsula di Bowman www.slidetube.it Zona corticale Zona midollare Dall arteria
DEBOLE MEDIA FORTE FARMACI DIURETICI AD INTENSITÀ D AZIONE
 FARMACI DIURETICI AD INTENSITÀ D AZIONE a) osmotici mannitolo (Isotol), glicerina b) inibitori dell anidrasi carbonica acetazolamide (Diamox) c) risparmiatori di spironolattone (Aldactone, Spirolang),
FARMACI DIURETICI AD INTENSITÀ D AZIONE a) osmotici mannitolo (Isotol), glicerina b) inibitori dell anidrasi carbonica acetazolamide (Diamox) c) risparmiatori di spironolattone (Aldactone, Spirolang),
Equilibrio idroelettrolitico
 Equilibrio idroelettrolitico Sodio Potassio Sodio e volume extracellulare Bilancio e distribuzione dell acqua corporea Regolazione del bilancio dell acqua Aumento dell osmolarità o Riduzione del volume
Equilibrio idroelettrolitico Sodio Potassio Sodio e volume extracellulare Bilancio e distribuzione dell acqua corporea Regolazione del bilancio dell acqua Aumento dell osmolarità o Riduzione del volume
Fisiologia Umana - 6 CFU Docente: Loriana Castellani PROGRAMMA
 Fisiologia Umana - 6 CFU Docente: Loriana Castellani PROGRAMMA Fisiologia cellulare: Membrana cellulare. Trasporto di ioni e molecole attraverso la membrana cellulare. Canali ionici, pompe e proteine vettrici.
Fisiologia Umana - 6 CFU Docente: Loriana Castellani PROGRAMMA Fisiologia cellulare: Membrana cellulare. Trasporto di ioni e molecole attraverso la membrana cellulare. Canali ionici, pompe e proteine vettrici.
Ioni fosfato e proteine (anioni) sono prevalenti nella cellula
 Equilibrio osmotico tra liquido intracellulare e liquido extracellulare (e plasma) mm Na + K + Cl - HCO 3 - grandi anioni proteine Liquido intracellulare Liquido extracellulare 10 140 140 5 5 35 10 35
Equilibrio osmotico tra liquido intracellulare e liquido extracellulare (e plasma) mm Na + K + Cl - HCO 3 - grandi anioni proteine Liquido intracellulare Liquido extracellulare 10 140 140 5 5 35 10 35
Trasporto di O 2 nel sangue
 Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Sali minerali negli alimenti
 1 SALI MINERALI Sali minerali elementi inorganici. Sono necessari in piccole quantità (mg o mcg). Non forniscono calorie. Costituiscono circa il 4% in peso del corpo umano. Svolgono sia un azione plastica
1 SALI MINERALI Sali minerali elementi inorganici. Sono necessari in piccole quantità (mg o mcg). Non forniscono calorie. Costituiscono circa il 4% in peso del corpo umano. Svolgono sia un azione plastica
1) La bile ha una funzione fondamentale nella digestione dei grassi, grazie
 Il fegato ha molteplici funzioni che interessano vari aspetti del metabolismo corporeo. Fra queste funzioni, direttamente correlata alla funzione digestiva è la capacità di secernere bile, normalmente
Il fegato ha molteplici funzioni che interessano vari aspetti del metabolismo corporeo. Fra queste funzioni, direttamente correlata alla funzione digestiva è la capacità di secernere bile, normalmente
Appunti dalle lezioni
 La Fisiologia è la disciplina che studia il funzionamento dell organismo nel suo insieme e lo svolgimento delle funzioni corporee in condizioni di omeostasi, ovvero di benessere. Coglie l aspetto dinamico
La Fisiologia è la disciplina che studia il funzionamento dell organismo nel suo insieme e lo svolgimento delle funzioni corporee in condizioni di omeostasi, ovvero di benessere. Coglie l aspetto dinamico
Bilancio Sodio e Potassio
 Bilancio Sodio e Potassio Sodio E l elemento fondamentale per: Controllo osmolalità Mantenimento volume del LEC Mantenimento Pressione arteriosa L introduzione giornaliera di sodio con la dieta (200 meq/l)
Bilancio Sodio e Potassio Sodio E l elemento fondamentale per: Controllo osmolalità Mantenimento volume del LEC Mantenimento Pressione arteriosa L introduzione giornaliera di sodio con la dieta (200 meq/l)
Il livello cellulare di organizzazione: la struttura cellulare. Cattedra di Fisiologia Umana
 Il livello cellulare di organizzazione: la struttura cellulare Cattedra di Fisiologia Umana 1. La diversità delle cellule nel corpo umano Le cellule del corpo hanno molte differenti forme ed una varietà
Il livello cellulare di organizzazione: la struttura cellulare Cattedra di Fisiologia Umana 1. La diversità delle cellule nel corpo umano Le cellule del corpo hanno molte differenti forme ed una varietà
Equilibri acido-base, ph e sistemi tampone
 Equilibri acido-base, ph e sistemi tampone Tiziana Bellini Dipartimento di Scienze Biomediche Chirurgico Specialistiche Facoltà di Medicina Farmacia e Prevenzione Università di Ferrara Cos è un acido?
Equilibri acido-base, ph e sistemi tampone Tiziana Bellini Dipartimento di Scienze Biomediche Chirurgico Specialistiche Facoltà di Medicina Farmacia e Prevenzione Università di Ferrara Cos è un acido?
Meccanismo di moltiplicazione controcorrente
 Equilibrio idroelettrolitico Dr. Alessandro Capitanini Meccanismo di moltiplicazione controcorrente Body Fluids 28 litri Acqua corporea totale in uomo di 70 kg = 42 litri Ambiente interno in equilibrio
Equilibrio idroelettrolitico Dr. Alessandro Capitanini Meccanismo di moltiplicazione controcorrente Body Fluids 28 litri Acqua corporea totale in uomo di 70 kg = 42 litri Ambiente interno in equilibrio
I materiali della vita
 I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Riassorbimento tubulare
 Riassorbimento tubulare Riassorbimento Secrezione Qtr = Qf- Qe Qts = Qe Qf Qtr = VFG*P UV Qts = UV VFG*P Le urine si formano mediante tre processi: Filtrazione glomerulare Riassorbimento di acqua e soluti
Riassorbimento tubulare Riassorbimento Secrezione Qtr = Qf- Qe Qts = Qe Qf Qtr = VFG*P UV Qts = UV VFG*P Le urine si formano mediante tre processi: Filtrazione glomerulare Riassorbimento di acqua e soluti
Emogasanalisi in t.i.
 Emogasanalisi in t.i. 9 volte su 10 6 volte su 10 100 e più alterati rispetto ai v.n. interpretazioni inesatte diagrammi, nomogrammi, equazioni e sistemi di valutazione 100 anni dall equazione di Handerson
Emogasanalisi in t.i. 9 volte su 10 6 volte su 10 100 e più alterati rispetto ai v.n. interpretazioni inesatte diagrammi, nomogrammi, equazioni e sistemi di valutazione 100 anni dall equazione di Handerson
45. Fisiologia dell'equilibrio acido-base
 Lezioni di Patologia generale Capitolo 45. Fisiologia dell'equilibrio acido-base 1465 45. Fisiologia dell'equilibrio acido-base III edizione ebook Luigi Barbieri (opzionale) 45. Fisiologia dell'equilibrio
Lezioni di Patologia generale Capitolo 45. Fisiologia dell'equilibrio acido-base 1465 45. Fisiologia dell'equilibrio acido-base III edizione ebook Luigi Barbieri (opzionale) 45. Fisiologia dell'equilibrio
Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali:
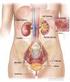 Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali: 1) Secerne Idrogenioni; 1a) Riassorbe il Bicarbonato Filtrato; 1b) Produce Nuovo Bicarbonato. 4320 meq/die
Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali: 1) Secerne Idrogenioni; 1a) Riassorbe il Bicarbonato Filtrato; 1b) Produce Nuovo Bicarbonato. 4320 meq/die
In base all equazione di Henderson-Hasselbalch
 Alterazioni dell equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Si ha acidosi quando il rapporto HCO 3 /CO 2 diminuisce, causando una diminuzione del ph.
Alterazioni dell equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Si ha acidosi quando il rapporto HCO 3 /CO 2 diminuisce, causando una diminuzione del ph.
Controllo nervoso del respiro
 Controllo nervoso del respiro La respirazione è una funzione involontaria controllata da 3 gruppi di neuroni (centri) localizzati nel tronco encefalico: Controllo nervoso del respiro Centro respiratorio
Controllo nervoso del respiro La respirazione è una funzione involontaria controllata da 3 gruppi di neuroni (centri) localizzati nel tronco encefalico: Controllo nervoso del respiro Centro respiratorio
Caratteristiche delle membrane biologiche
 Membrane Biologiche Caratteristiche delle membrane biologiche 1. Le membrane sono strutture a foglio che formano setti di separazione tra compartimenti con composizione diversa tra loro. 2. Sono costituite
Membrane Biologiche Caratteristiche delle membrane biologiche 1. Le membrane sono strutture a foglio che formano setti di separazione tra compartimenti con composizione diversa tra loro. 2. Sono costituite
IL GRUPPO EME. PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici.
 IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
CORSO DI CHIMICA PER L AMBIENTE. Lezione del 5 Maggio 2016
 CORSO DI CHIMICA PER L AMBIENTE Lezione del 5 Maggio 2016 Sali Acidi o Basici La neutralità acido-base dell acqua può essere alterata anche dal discioglimento di alcuni sali. Prendiamo ad esempio NH 4
CORSO DI CHIMICA PER L AMBIENTE Lezione del 5 Maggio 2016 Sali Acidi o Basici La neutralità acido-base dell acqua può essere alterata anche dal discioglimento di alcuni sali. Prendiamo ad esempio NH 4
equilibrio acido base
 Alterazioni dell equilibrio equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [ ] [CO 2 ] Si ha acidosi quando, per diminuzione del rapporto /CO 2 il ph diminuisce. L acidosi
Alterazioni dell equilibrio equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [ ] [CO 2 ] Si ha acidosi quando, per diminuzione del rapporto /CO 2 il ph diminuisce. L acidosi
Diffusione facilitata Trasporti mediati da proteine di membrana: i trasportatori
 Diffusione facilitata Trasporti mediati da proteine di membrana: i trasportatori I trasportatori somigliano agli enzimi: catalizzano la traslocazione dei substrati da una parte all altra della membrana
Diffusione facilitata Trasporti mediati da proteine di membrana: i trasportatori I trasportatori somigliano agli enzimi: catalizzano la traslocazione dei substrati da una parte all altra della membrana
Scaricato da
 -Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
-Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
Permeabilità Di Membrana Cellulare
 Permeabilità Di Membrana Cellulare Le membrane biologiche rappresentano una barriera per le molecole polari La membrana cellulare controlla il volume, la componente ionica e molecolare della cellula Una
Permeabilità Di Membrana Cellulare Le membrane biologiche rappresentano una barriera per le molecole polari La membrana cellulare controlla il volume, la componente ionica e molecolare della cellula Una
COSA DOBBIAMO RICORDARE: 19. FUNZIONE OMEOSTATICA DEL RENE
 COSA DOBBIAMO RICORDARE: 19. FUNZIONE OMEOSTATICA DEL RENE 1. La Concentrazione delle urine 2. La creazione del gradiente osmotico nella midollare del rene da parte del meccanismo controcorrente: acquaporine
COSA DOBBIAMO RICORDARE: 19. FUNZIONE OMEOSTATICA DEL RENE 1. La Concentrazione delle urine 2. La creazione del gradiente osmotico nella midollare del rene da parte del meccanismo controcorrente: acquaporine
2.Controllo dell equilibrio acido-base - II. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 2.Controllo dell equilibrio acidobase II Carlo Capelli Fisiologia Facoltà di Scienze Motorie Università di Verona 1. Tampone bicarbonatoco 2 E il sistema tampone fisiologico più importante [ CO 2] = PCO
2.Controllo dell equilibrio acidobase II Carlo Capelli Fisiologia Facoltà di Scienze Motorie Università di Verona 1. Tampone bicarbonatoco 2 E il sistema tampone fisiologico più importante [ CO 2] = PCO
La eliminazione dei protoni nelle urine permette il ripristino di bicarbonato nel circolo sistemico.
 ESCREZIONE URINARIA DI ACIDI : 1-1,5 meq/l Es. produzione endogena di ac. solforico o cloridrico, formazione di sodio solfato o cloruro, eliminazione urinaria di ammonio legato ai sali. La eliminazione
ESCREZIONE URINARIA DI ACIDI : 1-1,5 meq/l Es. produzione endogena di ac. solforico o cloridrico, formazione di sodio solfato o cloruro, eliminazione urinaria di ammonio legato ai sali. La eliminazione
I compartimenti liquidi corporei
 I compartimenti liquidi corporei Il mantenimento di un volume relativamente costante e di una composizione stabile dei liquidi corporei è essenziale per l omeostasi. In condizioni di equilibrio, l assunzione
I compartimenti liquidi corporei Il mantenimento di un volume relativamente costante e di una composizione stabile dei liquidi corporei è essenziale per l omeostasi. In condizioni di equilibrio, l assunzione
scaricato da sunhope.it Edema
 Edema rigonfiamento cutaneo evidente all esame obiettivo, quindi visibile e/o palpabile, da aumento liquido interstiziale sede consistenza evidenza localizzato, se alterazione non sistemica generalizzato,
Edema rigonfiamento cutaneo evidente all esame obiettivo, quindi visibile e/o palpabile, da aumento liquido interstiziale sede consistenza evidenza localizzato, se alterazione non sistemica generalizzato,
Fisiologia dell apparato urinario
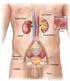 Fisiologia dell apparato urinario Funzioni del Rene Nefroni Corticale Midollare Pelvi renale Uretere Capsula Escrezione prodotti di scarto del metabolismo (urea, creatinina, acido urico, prodotti finali
Fisiologia dell apparato urinario Funzioni del Rene Nefroni Corticale Midollare Pelvi renale Uretere Capsula Escrezione prodotti di scarto del metabolismo (urea, creatinina, acido urico, prodotti finali
Interpretazione dell emogasanalisi
 Interpretazione dell emogasanalisi Guglielmo IMBRIACO Gaetano TAMMARO Rianimazione Terapia Intensiva Ospedale MAGGIORE - Bologna A cosa serve l emogasanalisi? Esame rapido Valutare la ventilazione Valutare
Interpretazione dell emogasanalisi Guglielmo IMBRIACO Gaetano TAMMARO Rianimazione Terapia Intensiva Ospedale MAGGIORE - Bologna A cosa serve l emogasanalisi? Esame rapido Valutare la ventilazione Valutare
