Emission: Una transizione da un livello più alto ad uno più basso con trasferimento di energia dall'emettitore. Se nessuna radiazione viene emessa la
|
|
|
- Riccardo Palumbo
- 6 anni fa
- Visualizzazioni
Transcript
1 Le tecniche spettroscopiche Sono dette tali le tecniche che usano l'interazione delle radiazioni elettromagnetiche con un campione per ottenere una sua analisi. I dati vengono ottenuti come spettri. Lo spettro viene rappresentato come un grafico che riporta l'energia emessa o assorbita in funzione della lunghezza d'onda o di un altro parametro elettromagnetico (la massa, il momento, la frequenza, etc..). La luce, il calore e altre radiazioni elettromagnetiche sono onde elettromagnetiche che viaggiano alla velocità di 3 x 108 m s-1. Un'onda elettromagnetica è costituita da un campo elettrico e uno magnetico che viaggiano insieme l'uno perpendicolarmente all'altro. Oltre alla luce, anche le radioonde, le microonde e i raggi X sono onde elettromagnetiche. Un'onda elettromagnetica può essere definita in termini di frequenza della sua oscillazione, indicata con la lettera greca nu (n ). L'onda si muove lungo una linea retta con una velocità costante, indicata con c se si muove nel vuoto. La distanza tra due successivi picchi dell'onda è detta lunghezza d'onda, l. La lunghezza d'onda è determinata dall'energia contenuta in un quanto. La luce infatti può essere anche descritta come un fascio di quanti o fotoni. La relazione che lega l'energia dell'onda elettromagnetica e i suoi parametri: E= hc/λ =hn dove h = costante di Planck c = velocità della luce nel vuoto λ = lunghezza d'onda n = frequenza La spettroscopia si basa sul fatto che le molecole interagiscono con le radiazioni di diversa lunghezza d'onda e queste interazioni originano spettri in regioni diverse. Lo spettro come già enunciato viene rappresentato come un grafico che riporta l'energia emessa o assorbita in funzione della lunghezza d'onda o di un altro parametro elettromagnetico (la massa, il momento, la frequenza, etc..). La strumentazione richiesta per gli studi spettroscopici è diversa per ogni regione dello spettro elettromagnetico. La spettroscopia è l'uso dell'assorbimento, dell'emissione o dello scattering della radiazione elettromagnetica da parte della materia per studi quantitativi o qualitativi della materia o per studiare processi fisici. La materia possono essere atomi, molecole, ioni atomici o molecolari, solidi. L'interazione della radiazione con la materia può causare deviazione della radiazione e/o transizioni tra livelli energetici degli atomi e delle molecole. Assorbimento: Una transizione da un livello inferiore ad uno superiore
2 Emission: Una transizione da un livello più alto ad uno più basso con trasferimento di energia dall'emettitore. Se nessuna radiazione viene emessa la transizione è detta decadimento radioattivo. Scattering (dispersione): Reindirizzamento della luce dovuto a interazione con la materia. Può avvenire con o senza un trasferimento energetico, es. la radiazione dispersa potrebbe (oppure no) avere una leggera differente lunghezza d'onda comparata a quella della luce che colpisce il campione. Che informazioni si ottengono? Uno spettro può essere usato per ottenere informazioni sui livelli energetici atomici e molecolari, sulle geometrie molecolari (accessibilità di residui ionizzabili ad esempio), sui legami chimici, le interazioni tra molecole. Gli spettri elettronici sono dovuti a transizioni di livello energetico da parte degli elettroni più esterni di un atomo. Essi sono prodotti nelle regioni dell'ultravioletto e nel visibile e sono anche accompagnati, di solito, da variazioni di livello energetico rotazionale e vibrazionale. Gli spettri di fluorescenza sono dovuti al medesimo tipo di transizioni energetiche. Gli spettri vibrazionali e rotazionali si originano grazie alle transizioni tra livelli energetici vibrazionali Gli spettri di risonanza magnetica e paramagnetica elettronica originano dalle variazioni dell'orientamento di spin in un campo magnetico rispettivamente di un nucleo e di un elettrone. Nei termini più semplici, quindi, la spettroscopia richiede una fonte energetica (comunemente un laser) e un qualcosa che misuri il cambiamento dell'energia irradiata dopo che questa ha interagito col campione (spesso uno spettrofotometro o interferometro). La spettroscopia d'assorbimento molecolare nel visibile e nell'ultravioletto Dal momento che la luce colpisce il campione e si vuole misurare il cambiamento di essa in seguito all'evento, bisogna conoscere le leggi dell'assorbimento della luce. Le leggi dell'assorbimento della luce La trasmittanza: è la frazione di radiazione che attraversa un mezzo che assorbe in modo uniforme. T= I/I0 = radiazione trasmessa/radiazione incidente L'assorbanza: è l'entità della radiazione assorbita, detta anche estinzione, è uguale al logaritmo del reciproco della trasmittanza. A = E = log 1/T = log I0/I Il coefficiente di estinzione molare: corrisponde all'assorbanza di una soluzione 1M di un composto puro in condizioni standard di solvente, temperatura e lunghezza d'onda. La legge di Lambert-Beer: esprime la relazione tra assorbanza, concentrazione della sostanza, spessore del campione.
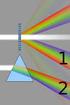
3 A = ελ c d dove ελ = il coefficiente di estinzione molare della sostanza che assorbe la luce ad una data lunghezza d'onda λ c = concentrazione della sostanza d = cammino ottico della radiazione nella soluzione NOTA: è l'equazione di una retta Sono comunque possibili deviazioni da questa legge. Deviazioni positive, dovute a : 1) aumento della concentrazione 2) aggregazione e scattering (dispersione) Deviazioni negative, dovute a: 1) aumento della concentrazione 2) denaturazione a basse concentr. di proteine. Lo spostamento del massimo a λ maggiori (verso il rosso) è detto effetto batocromico. Lo spostamento del massimo a λ minori (verso il blu) è detto effetto ipsocromico. Incremento del massimo di assorbimento: effetto ipercromico. Decremento del massimo di assorbimento: effetto ipocromico Lo spettrofotometro - la spettrofotometria nell'ultravioletto e nel visibile Schema di uno spettrofotometro monoraggio L1 ed L2 sono le due sorgenti luminose, una lampada ad idrogeno o deuterio per l'ultravioletto ed una al tungsteno per il visibile. Nella figura i raggi vengono convogliati da delle lenti, ma negli strumenti più moderni si preferiscono gli specchi perchè meno costosi e perchè si ha minor perdita di radiazione. M è il monocromatore che consente, partendo da una sorgente di radiazione policromatica, di ottenere un fascio di radiazione monocromatica e parallela: in teoria una radiazione composta da una sola lunghezza d'onda. Il monocromatore può essere un prisma come in figura o un reticolo di diffrazione. F1 ed F2 sono due fenditure che contribuiscono ad ottenere una luce monocromatica. S è la slitta che porta gli alloggiamenti per le cuvette nelle quali viene posto il campione da analizzare. V è la cella fotoelettrica. La spettrofotometria si basa infatti sul fatto che il potenziale in una cella fotoelettrica è proporzionale all'intensità della radiazione che arriva alla fotocella stessa. Le fotocelle convertono i quanti della radiazione luminosa in energia elettrica che può poi essere amplificata, rilevata e registrata. le cuvette quando si lavora nell'ultravioletto si devono utilizzare cuvette di quarzo o di silice perchè sono trasparenti a lunghezze d'onda superiori ai 180 nm
4 quando invece si lavora nel visibile si possono utilizzare quelle di vetro o plastica poichè assorbono le radiazioni al di sotto dei 340 nm. affinchè la misura sia accurata si deve sempre verificare che le due cuvette appartengano alla stessa serie ottica. per tarare lo strumento a zero di estinzione bisogna predisporre una cuvetta di riferimento otticamente identica a quella di misura e con il medesimo solvente. spettrofotometri speciali: spettrofotometri a doppio raggio Possono eseguire sia uno spettro sia misurare variazioni di assorbanza. La principale differenza rispetto a quelli monoraggio è la presenza di un componente che sdoppia il raggio, per cui è possibile avere il confronto simultaneo tra assorbimento della cuvetta contenente il campione e cuvetta di riferimento. La colorimetria è in biochimica tra le applicazioni più importanti dello spettrofotometro. Numerose sostanze non hanno un coefficiente d'estinzione significativo nel visibile, ma possono reagire quantitativamente con un'altra sostanza a formare un prodotto colorato. Questa proprietà viene sfruttata per la determinazione quantitativa di tali sostanze. La formazione del prodotto colorato (cromoforo) deve avvenire in condizioni standardizzate secondo un rapporto stechiometrico con la sostanza e si misura quindi l'estinzione dei campioni rispetto a quella di un bianco, contenuto nella cuvetta di riferimento e costituito da tutti i reagenti tranne la sostanza da determinare. E' necessario prima della misurazione dei vari campioni azzerare contro il bianco. Si pongono poi i valori delle varie letture in funzione della quantità o della concentrazione della sostanza in esame che forma il prodotto colorato. Questo grafico è la curva di taratura. A questo punto è possibile dosare quantità ignote della sostanza facendo avvenire la reazione colorimetrica nelle stesse condizioni, misurando l'estinzione ed estrapolando l'altro valore dalla curva di taratura Normalmente si usa l'albumina di siero bovino (BSA) per la costruzione della curva di taratura ed il Comassie Brilliant Blue come colorante specifico per le proteine. Lo spettro di questo cromoforo presenta un massimo a 465 nm a ph acido. Il suo complesso con le proteine presenta invece un massimo a 595 nm a ph acido. Il metodo Bradford Questo metodo è molto popolare perchè semplice, rapido, economico e sensibile. Esso si basa sull'azione del Coomassie brilliant blue G-250 (CBBG) che si lega specificatamente a residui di arginina, triptofano, tirosina, istidina e fenilalanina. Da notare che agisce primariamente con i residui di arginina ( 8 volte più che con gli altri residui elencati) quindi se si ha una proteina ricca in arginina è preferibile utilizzare uno standard che sia anch'esso ricco in arginina. Il CBBG si lega a questi residui in una forma anionica, con assorbanza massima a 595 nm. Il colorante nella soluzione madre si trova infatti in forma cationica che ha un massimo di assorbanza a 470 nm.
5 E' da sottolineare che gli spettri di assorbimento delle due forme del colorante si sovrappongono. Questo fa si che il saggio non risponda in modo lineare nella curva standard. Quando viene tracciata la curva si nota infatti che una curva di secondo ordine si adatta meglio di una curva lineare. Il saggio risulta lineare a concentrazioni basse della proteina. Bradford stesso sottolinea che il saggio non sia lineare nell'intero range dell'articolo originale. Typical Bradford Assay Standard Curve Una parte cruciale di questo saggio è il bianco. Dal momento che il saggio non risponde linearmente è molto importante "bloccare" il punto zero. Dal momento che questo punto è molto importante per la curva è fortemente raccomandato che vengano eseguiti almeno due bianchi. La scelta dello standard per questo tipo di saggio è cruciale per il suo successo. Molti ricercatori hanno notato anormalità utilizzando diversi standard con questo metodo. la BSA è stato lo standard originale ed è quello che usualmente si trova con l'acquisto dei vari kit. Tuttavia, è stato notato che la BSA piuttosto che una risposta "normale" dà un'altra risposta e potrebbe non sempre essere affidabile. Svariati ricercatori tendono perciò ad usare l'immunoglobulina G (IgG) come standard. Il CBBG si lega alle cuvette di quarzo abbastanza fortemente. Di conseguenza, dovrebbero essere utilizzate le cuvette di vetro o plastica. Esistono due principali "formati" del saggio ognuno con un differente range di funzionalità. Il microsaggio ottimizzato per concentrazioni proteiche che vanno da 1-20 microgrammi/microlitro ed il macrosaggio ottimizzato per concentrazioni proteiche che vanno da 20 a 100 microgrammi/microlitro. Generalmente è più conveniente usare il microformato e diluire la proteina fino al range di concentrazione. Il microsaggio consente di sprecare meno materiale e consente al concentrato di durare più a lungo. Una considerazione: usare un pò di NaOH nel saggio per aiutare a solubilizzare la proteina (vale soprattutto per quelle idrofobiche, di membrana). Quali sono i gruppi cromofori presenti nelle proteine? A) Nei legami peptidici si osservano le seguenti transizioni: 1) n p* a nm dai livelli di non legame n a quelli di antilegame p* 2) p p* a nm, da un livello di legame p ad uno di antilegame p* 3) n s* a 175 nm, dai livelli di non legame n a quelli di antilegame s* B) Nelle catene laterali: a parte le transizioni comuni al legame peptidico e quindi poco osservabili, sono da ricordare i gruppi aromatici ( nm), Trp, Tyr, Phe C) I gruppi prostetici Quali sono i fattori che influenzano le proprietà di assorbimento di un cromoforo?
6 1) ph - il ph del solvente determina lo stato di ionizzazione di cromofori ionizzabili 2) la polarità - per cromofori polari, il valore di λmax per le transizioni n p* è minore in solventi polari (H2O, alcool) e maggiore in solventi non polari. 3) caratteristiche geometriche - la diversa organizzazione strutturale dei gruppi cromofori influenza fortemente sia ε che λmax. Informazioni sull'accessibilità dei residui ionizzabili in proteine native. Dal momento che modificando il ph cambia lo stato di ionizzazione dei cromofori ionizzabili, cambiano anche i rispettivi λmax e ε. Perciò se cambiamo il PH: a) se non si osservano cambi spettrali per questi cromofori a ph tali per cui devono essere in forma ionizzata, questo significa che sono nascosti in una regione non polare della proteina. b) se il cambio spettrale è osservato significa che i cromofori in questione sono accessibili e, dall'esame delle curve di titolazione spettrofotometriche è possibile capire se si trovano in un intorno polare facilmente accessibile o in un intorno formato da residui apolari e poco accessibili al solvente. Ad esempio questo è lo spettro di assorbimento della tirosina a ph 6 e 13. Nota che sia il λmax che il ε aumentano quando l'oh fenolico è dissociato. Vediamo ora un ipotetica proteina contenente 5 tirosine La curva A corrisponde all'ipotetica proteina che abbia tutte e 5 le tirosine esposte: lo spettro cambia in funzione del ph come lo spettro della tirosina libera La curva C corrisponde all'ipotetica proteina che abbia 3 tirosine interne in un intorno polare facilmente accessibile al solvente La curva B corrisponde all'ipotetica proteina che abbia 3 tirosine interne in un intorno non polare (non accessibile). Il valore del primo plateau è 2/5 del valore del plateau finale. Il profilo della curva si impenna a valori di ph elevati ad indicare che le 3 tirosine interne diventano esposte al solvente in seguito a denaturazione della proteina Determinazione dell'accessibilità di gruppi cromofori in proteine native: perturbazione del solvente e spettroscopia differenziale Solventi perturbanti: 80% H2O + 20% solvente apolare (dimetilsolfossido, diossano, etilenglicole, glicerolo) Spettroscopia differenziale: cuvetta 1: campione + H2O «cuvetta 2: campione + solvente perturbante Uno spettro di differenza "non zero" si ottiene solo se il campione è perturbato dal solvente ESEMPIO: determinazione della posizione dei Trp in una proteina
7 campione in H2O concentrazione=1m lunghezza del cammino ottico =1 cm ε280=5.6 x 10-3 M-1cm-1 A280=0.028=28 x 10-3 quindi la proteina ha 28 x 10-3/5.6 x 10-3= 5 Trp totali campione in 80% H2O + 20% solvente apolare concentrazione=1m lunghezza del cammino ottico =1 cm ε292=0.2 x 10-2 M-1cm-1 A292=0.006=0.6 x 10-2 quindi la proteina ha 0.6 x 10-2/0.2 x 10-2= 3 Trp perturbati dal solvente gli altri 2 sono interni La scelta del perturbante si basa sulle dimensioni molecolari delle sue molecole. ESEMPIO: Nella prima figura entrambi i residui vengono modificati da una molecola piccola presente nel solvente Nel secondo caso molecole di dimensioni maggiori possono interagire solamente coi residui di tirosina in posizioni esposte. => la tirosina presente nella fessura è modificata dalle molecole piccole ma non da quelle più grandi La spettrofluorimetria La fluorescenza è un fenomeno di emissione in cui si misura la trasmissione energetica all'interno della molecola da un livello energetico più alto ad uno inferiore, rilevando la radiazione emessa piuttosto che quella assorbita. Il principale vantaggio dell'utilizzo della fluorescenza rispetto alle misure di assorbimento è la maggiore sensibilità dal momento che il segnale di fluorescenza parte da un background pari a 0. Le applicazioni analitiche includono misurazioni quantitative di molecole in soluzione e l'impiego in cromatografie liquide. Affinché vi sia fluorescenza la molecola deve essere "eccitata" mediante l'assorbimento di luce di lunghezza d'onda minore (cioè a maggiore energia) rispetto a quella emessa ( a minore energia). La differenza tra questi due lambda è nota come shift di Stokes ed i generale i migliori risultati sono ottenuti con quei composti che presentano degli spostamenti molto ampi. È possibile anche che un composto assorba nell'ultravioletto ed emetta nel visibile. Transizioni tra livelli energetici elettronici molecolari:
8 Molte molecole organiche assorbono nel visibile e nell'u.v. ma solo poche di esse sono fluorescenti. Tuttavia molte di queste sono di interesse biologico. Gruppi fluorescenti nelle proteine sono:trp, Tyr, Phe. La fosforescenza è un fenomeno associato alla fluorescenza ma ha tempi di decadimento maggiori ed in genere permane anche quando l'energia di eccitazione non è più applicata. Si definisce efficienza quantica: Q= quanti emessi/quanti assorbiti e a basse concentrazioni (<10-5M) è valida la legge: If= k 2.3 I0 ελ c d Q dove If=intensità di fluorescenza, I0= intensità radiazione incidente, ελ=coefficiente di estinzione molare alla lunghezza di assorbimento, c=concentrazione, d=cammino ottico, k= fattore geometrico strumentale La relazione mostra che l'intensità della fluorescenza è linearmente proporzionale alla concentrazione dell'analita. Determinare la concentrazione dalla fluorescenza emessa da un campione richiede la calibrazione del fluorimetro con uno standard (per determinare k e Q) o l'impiego di una curva di lavoro. Il fluorimetro Un tipico fluorimetro contiene una sorgente d'eccitazione, una cella per il campione, un rilevatore. Le molecole in soluzione sono normalmente eccitate da raggi UV e la sorgente d'eccitazione è una lampada di deuterio o xenon. La luce proveniente dalla lampada passa attraverso un monocromatore. La fluorescenza viene dispersa da un'altro monocromatore e rivelata da un tubo fotomoltiplicatore.
Schema a blocchi di uno spettrofluorimetro
 MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
Dosaggio delle proteine
 Laboratorio Integrato 4 Lezione n.2 Dosaggio delle proteine Dott.ssa Francesca Zazzeroni METODI PER EFFETTUARE UN DOSAGGIO PROTEICO 1-Metodo del Biureto - il reattivo del biureto consiste in una soluzione
Laboratorio Integrato 4 Lezione n.2 Dosaggio delle proteine Dott.ssa Francesca Zazzeroni METODI PER EFFETTUARE UN DOSAGGIO PROTEICO 1-Metodo del Biureto - il reattivo del biureto consiste in una soluzione
SPETTROFOTOMETRIA UV/VIS
 SPETTROFOTOMETRIA UV/VIS TECNICHE SPETTROSCOPICHE Le tecniche spettroscopiche sono tutte quelle tecniche basate sull interazione tra la materia e le radiazioni elettromagnetiche. La luce, il calore ed
SPETTROFOTOMETRIA UV/VIS TECNICHE SPETTROSCOPICHE Le tecniche spettroscopiche sono tutte quelle tecniche basate sull interazione tra la materia e le radiazioni elettromagnetiche. La luce, il calore ed
S P E T T R O S C O P I A. Dispense di Chimica Fisica per Biotecnologie Dr.ssa Rosa Terracciano
 S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
Tra nm Nucleotidi mono-fosfato
 Un estratto proteico può contenere acidi nucleici, nucleotidi Posso verificare la loro presenza mediante la misura di uno spettro di assorbimento. Gli acidi nucleici e i nucleotidi assorbono nell UV, grazie
Un estratto proteico può contenere acidi nucleici, nucleotidi Posso verificare la loro presenza mediante la misura di uno spettro di assorbimento. Gli acidi nucleici e i nucleotidi assorbono nell UV, grazie
Applicazioni della Spettroscopia UV-vis all analisi delle proteine
 Applicazioni della Spettroscopia UV-vis all analisi delle proteine La radiazione elettromagnetica Con il termine radiazione s intende normalmente ogni forma di energia che si propaga mediante onde o particelle
Applicazioni della Spettroscopia UV-vis all analisi delle proteine La radiazione elettromagnetica Con il termine radiazione s intende normalmente ogni forma di energia che si propaga mediante onde o particelle
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
INTRODUZIONE ALLA SPETTROMETRIA
 INTRODUZIONE ALLA SPETTROMETRIA La misurazione dell assorbimento e dell emissione di radiazione da parte della materia è chiamata spettrometria. Gli strumenti specifici usati nella spettrometria sono chiamati
INTRODUZIONE ALLA SPETTROMETRIA La misurazione dell assorbimento e dell emissione di radiazione da parte della materia è chiamata spettrometria. Gli strumenti specifici usati nella spettrometria sono chiamati
ISTITUTO D ISTRUZIONE SUPERIORE AMEDEO AVOGADRO PROGRAMMA SVOLTO
 ISTITUTO D ISTRUZIONE SUPERIORE AMEDEO AVOGADRO PROGRAMMA SVOLTO DISCIPLINA Analisi chimica elaborazione dati e laboratorio CLASSE IV SEZ. A indirizzo CHIMICA ANNO SCOLASTICO 2014-2015 INSEGNANTI Prof.ssa
ISTITUTO D ISTRUZIONE SUPERIORE AMEDEO AVOGADRO PROGRAMMA SVOLTO DISCIPLINA Analisi chimica elaborazione dati e laboratorio CLASSE IV SEZ. A indirizzo CHIMICA ANNO SCOLASTICO 2014-2015 INSEGNANTI Prof.ssa
SPETTROSCOPIA DI ASSORBIMENTO ATOMICO
 SPETTROSCOPIA DI ASSORBIMENTO ATOMICO L applicazione della spettroscopia UV-Vis ai singoli atomi piuttosto che alle molecole complesse è detta Spettroscopia di Assorbimento Atomico. L assorbimento di un
SPETTROSCOPIA DI ASSORBIMENTO ATOMICO L applicazione della spettroscopia UV-Vis ai singoli atomi piuttosto che alle molecole complesse è detta Spettroscopia di Assorbimento Atomico. L assorbimento di un
Fondamenti di spettrofotometria. Spettroscopia UV/Vis
 Fondamenti di spettrofotometria Spettroscopia UV/Vis Spettroscopia Definizione: Lo studio della struttura e della dinamica della materia (in biologia delle molecole) attraverso l analisi dell interazione
Fondamenti di spettrofotometria Spettroscopia UV/Vis Spettroscopia Definizione: Lo studio della struttura e della dinamica della materia (in biologia delle molecole) attraverso l analisi dell interazione
MISURA DELLA [Ca 2+ ] INTRACELLULARE IN VIVO
![MISURA DELLA [Ca 2+ ] INTRACELLULARE IN VIVO MISURA DELLA [Ca 2+ ] INTRACELLULARE IN VIVO](/thumbs/48/23964432.jpg) MISURA DELLA [Ca 2+ ] INTRACELLULARE IN VIVO Per misurare la [Ca 2+ ] intracellulare ([Ca 2+ ] i ) si usano molecole fluorescenti:queste, colpite da un raggio di luce di una certa λ, emettono luce con
MISURA DELLA [Ca 2+ ] INTRACELLULARE IN VIVO Per misurare la [Ca 2+ ] intracellulare ([Ca 2+ ] i ) si usano molecole fluorescenti:queste, colpite da un raggio di luce di una certa λ, emettono luce con
INTERAZIONI DELLE RADIAZIONI CON LA MATERIA
 M. Marengo INTERAZIONI DELLE RADIAZIONI CON LA MATERIA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna mario.marengo@unibo.it Si definiscono radiazioni ionizzanti tutte le
M. Marengo INTERAZIONI DELLE RADIAZIONI CON LA MATERIA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna mario.marengo@unibo.it Si definiscono radiazioni ionizzanti tutte le
Corso di Laboratorio di Biofotonica
 SAIENZA Università di Roma Laurea magistrale in Ingegneria delle Nanotecnologie A.A. 2015-2016 Corso di Laboratorio di Biofotonica rof. Francesco Michelotti SAIENZA Università di Roma Facoltà di Ingegneria
SAIENZA Università di Roma Laurea magistrale in Ingegneria delle Nanotecnologie A.A. 2015-2016 Corso di Laboratorio di Biofotonica rof. Francesco Michelotti SAIENZA Università di Roma Facoltà di Ingegneria
Fenomeni quantistici
 Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Spettroscopia molecolare: interazioni luce-materia
 Spettroscopia molecolare: interazioni luce-materia Nella spettroscopia molecolare il campione è irradiato con luce avente λ nell UV, nel visibile o nell infrarosso. Le molecole di cui è costituito il campione
Spettroscopia molecolare: interazioni luce-materia Nella spettroscopia molecolare il campione è irradiato con luce avente λ nell UV, nel visibile o nell infrarosso. Le molecole di cui è costituito il campione
La struttura della materia
 La struttura della materia IL CORPO NERO In fisica, i corpi solidi o liquidi emettono radiazioni elettromagnetiche, a qualsiasi temperatura. Il corpo nero, invece, è un oggetto ideale che assorbe tutta
La struttura della materia IL CORPO NERO In fisica, i corpi solidi o liquidi emettono radiazioni elettromagnetiche, a qualsiasi temperatura. Il corpo nero, invece, è un oggetto ideale che assorbe tutta
vi dipende dalla composizione del mezzo che attraversa
 LA SPETTROSCOPIA Le tecniche spettroscopiche si basano sull assorbimento o sulla emissione di una radiazione elettromagnetica da parte di un atomo o di una molecola La radiazione elettromagnetica è una
LA SPETTROSCOPIA Le tecniche spettroscopiche si basano sull assorbimento o sulla emissione di una radiazione elettromagnetica da parte di un atomo o di una molecola La radiazione elettromagnetica è una
CLASSIFICAZIONE DELLE BANDE DI ASSORBIMENTO. Fig. 4
 CLASSIFICAZIONE DELLE BANDE DI ASSORBIMENTO Fig. 4 1 E PERCE BANDE E NON RIGE? E 3 Nell pratica : E 2 E 1 E 0 4000 600 cm -1 4000 600 cm -1 Tra 2 livelli vibrazionali puliti Sottolivelli rotazionali 2
CLASSIFICAZIONE DELLE BANDE DI ASSORBIMENTO Fig. 4 1 E PERCE BANDE E NON RIGE? E 3 Nell pratica : E 2 E 1 E 0 4000 600 cm -1 4000 600 cm -1 Tra 2 livelli vibrazionali puliti Sottolivelli rotazionali 2
Spettroscopia Raman. Trasmissione-assorbimento
 Spettroscopia Raman Quando una radiazione monocromatica di frequenza n o e incidente ad un sistema molecolare la luce viene: assorbita se ha energia pari ad una possibile transizione ad un livello energetico
Spettroscopia Raman Quando una radiazione monocromatica di frequenza n o e incidente ad un sistema molecolare la luce viene: assorbita se ha energia pari ad una possibile transizione ad un livello energetico
ESERCITAZIONI FISICA PER FARMACIA A.A. 2012/2013 ELETTROMAGNETISMO - OTTICA
 ESERCITAZIONI FISICA PER FARMACIA A.A. 2012/2013 ELETTROMAGNETISMO - OTTICA Esercizio 1 Due cariche q 1 e q 2 sono sull asse x, una nell origine e l altra nel punto x = 1 m. Si trovi il campo elettrico
ESERCITAZIONI FISICA PER FARMACIA A.A. 2012/2013 ELETTROMAGNETISMO - OTTICA Esercizio 1 Due cariche q 1 e q 2 sono sull asse x, una nell origine e l altra nel punto x = 1 m. Si trovi il campo elettrico
Corso di insegnamento Biochimica e Biotecnologie degli Alimenti. Spettrofotometria. Lezione n. XXII-30.05.14
 Corso di insegnamento Biochimica e Biotecnologie degli Alimenti Spettrofotometria Lezione n. XXII-30.05.14 RADIAZIONI ELETTROMAGNETICHE Le radiazioni elettromagnetiche possono essere rappresentate sia
Corso di insegnamento Biochimica e Biotecnologie degli Alimenti Spettrofotometria Lezione n. XXII-30.05.14 RADIAZIONI ELETTROMAGNETICHE Le radiazioni elettromagnetiche possono essere rappresentate sia
DNA, RNA E PROTEINE DA CAMPIONI BIOLOGICI
 DNA, RNA E PROTEINE DA CAMPIONI BIOLOGICI UNA VOLTA ESTRATTI VANNO QUANTIFICATI QUANTIFICAZIONE DEI CAMPIONI Vi sono numerosi metodi. Alcuni forniscono valori assoluti, altri relativi; in tal caso lo standard
DNA, RNA E PROTEINE DA CAMPIONI BIOLOGICI UNA VOLTA ESTRATTI VANNO QUANTIFICATI QUANTIFICAZIONE DEI CAMPIONI Vi sono numerosi metodi. Alcuni forniscono valori assoluti, altri relativi; in tal caso lo standard
L equilibrio dell acqua
 L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
CORSO DI LAUREA IN OTTICA E OPTOMETRIA
 CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
SPETTROSCOPIA MOLECOLARE
 SPETTROSCOPIA MOLECOLARE La spettroscopia molecolare studia l assorbimento o l emissione delle radiazioni elettromagnetiche da parte delle molecole. Il dato sperimentale che si ottiene, chiamato rispettivamente
SPETTROSCOPIA MOLECOLARE La spettroscopia molecolare studia l assorbimento o l emissione delle radiazioni elettromagnetiche da parte delle molecole. Il dato sperimentale che si ottiene, chiamato rispettivamente
REGOLE DELLA RISONANZA
 REGOLE DELLA RISONANZA 1. Tutte le strutture canoniche di risonanza devono essere strutturedi Lewis corrette per esempio, nessuna può avere atomi di C con cinque valenze 2. La posizione dei nuclei DEVE
REGOLE DELLA RISONANZA 1. Tutte le strutture canoniche di risonanza devono essere strutturedi Lewis corrette per esempio, nessuna può avere atomi di C con cinque valenze 2. La posizione dei nuclei DEVE
Le unità fondamentali SI. Corrente elettrica
 ESERITAZIONE 1 1 Le unità fondamentali SI Grandezza fisica Massa Lunghezza Tempo Temperatura orrente elettrica Quantità di sostanza Intensità luminosa Nome dell unità chilogrammo metro secondo Kelvin ampere
ESERITAZIONE 1 1 Le unità fondamentali SI Grandezza fisica Massa Lunghezza Tempo Temperatura orrente elettrica Quantità di sostanza Intensità luminosa Nome dell unità chilogrammo metro secondo Kelvin ampere
La Teoria dei Quanti e la Struttura Elettronica degli Atomi. Capitolo 7
 La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
Laboratorio di Ottica e Spettroscopia
 Laboratorio di Ottica e Spettroscopia Quarta lezione Applicazione di tecniche di diffrazione (Laboratorio II) Antonio Maggio e Luigi Scelsi Istituto Nazionale di Astrofisica Osservatorio Astronomico di
Laboratorio di Ottica e Spettroscopia Quarta lezione Applicazione di tecniche di diffrazione (Laboratorio II) Antonio Maggio e Luigi Scelsi Istituto Nazionale di Astrofisica Osservatorio Astronomico di
Ottica geometrica. Propagazione per raggi luminosi (pennello di luce molto sottile)
 Ottica geometrica Propagazione per raggi luminosi (pennello di luce molto sottile) All interno di un mezzo omogeneo la propagazione e rettilinea: i raggi luminosi sono pertanto rappresentati da tratti
Ottica geometrica Propagazione per raggi luminosi (pennello di luce molto sottile) All interno di un mezzo omogeneo la propagazione e rettilinea: i raggi luminosi sono pertanto rappresentati da tratti
Spettrofotometria. Le onde luminose consistono in campi magnetici e campi elettrici oscillanti, fra loro perpendicolari.
 Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
LASER. Light Amplification by Stimulated Emission of Radiation. Introduzione. Assorbimento, emissione spontanea, emissione stimolata
 LASER Light Amplification by Stimulated Emission of Radiation Introduzione. Assorbimento, emissione spontanea, emissione stimolata Cenni storici 1900 Max Planck introduce la teoria dei quanti (la versione
LASER Light Amplification by Stimulated Emission of Radiation Introduzione. Assorbimento, emissione spontanea, emissione stimolata Cenni storici 1900 Max Planck introduce la teoria dei quanti (la versione
Laurea Magistrale in Biologia
 Laurea Magistrale in Biologia Laboratorio del corso di Chimica Fisica Biologica Anno accademico 2009/10 SCOPO Determinazione dei parametri termodinamici associati alla denaturazione termica di una piccola
Laurea Magistrale in Biologia Laboratorio del corso di Chimica Fisica Biologica Anno accademico 2009/10 SCOPO Determinazione dei parametri termodinamici associati alla denaturazione termica di una piccola
UNITA DIDATTICA P A1.01
 Titolo: Grandezze fisiche fondamentali e derivate, unità di misura. Conversioni di unità di misura e notazione scientifica. Codice: A1-P-Tec-Gra Campo di indagine della chimica. Il Sistema Internazionale
Titolo: Grandezze fisiche fondamentali e derivate, unità di misura. Conversioni di unità di misura e notazione scientifica. Codice: A1-P-Tec-Gra Campo di indagine della chimica. Il Sistema Internazionale
LA LUCE. Perché vediamo gli oggetti Che cos è la luce La propagazione della luce La riflessione La rifrazione
 LA LUCE Perché vediamo gli oggetti Che cos è la luce La propagazione della luce La riflessione La rifrazione Perché vediamo gli oggetti? Perché vediamo gli oggetti? Noi vediamo gli oggetti perché da essi
LA LUCE Perché vediamo gli oggetti Che cos è la luce La propagazione della luce La riflessione La rifrazione Perché vediamo gli oggetti? Perché vediamo gli oggetti? Noi vediamo gli oggetti perché da essi
Cenni di Spettroscopia
 Cenni di Spettroscopia Gli elettroni di una molecola possono avere energie diverse, possono, cioè, essere più o meno legati ai nuclei degli atomi che costituiscono la molecola. l numero di energie possibili
Cenni di Spettroscopia Gli elettroni di una molecola possono avere energie diverse, possono, cioè, essere più o meno legati ai nuclei degli atomi che costituiscono la molecola. l numero di energie possibili
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
5.4 Larghezza naturale di una riga
 5.4 Larghezza naturale di una riga Un modello classico più soddisfacente del processo di emissione è il seguente. Si considera una carica elettrica puntiforme in moto armonico di pulsazione ω 0 ; la carica,
5.4 Larghezza naturale di una riga Un modello classico più soddisfacente del processo di emissione è il seguente. Si considera una carica elettrica puntiforme in moto armonico di pulsazione ω 0 ; la carica,
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
DOSAGGIO ACIDI NUCLEICI
 DOSAGGIO ACIDI NUCLEICI l Cuvetta contenente il campione di proteina a concentrazione C Sorgente I 0 I 1 I 0 Rivelatore Quando si fa passare una luce di una particolare lunghezza d onda d
DOSAGGIO ACIDI NUCLEICI l Cuvetta contenente il campione di proteina a concentrazione C Sorgente I 0 I 1 I 0 Rivelatore Quando si fa passare una luce di una particolare lunghezza d onda d
Spettroscopia UV-visibile (parte 1)
 (parte 1) Orbitali atomici Orbitali molecolari Transizioni elettroniche Regole di selezione Cromoforo Spettrofotometro Legge Lambert-Beer La Spettroscopia Uv-visibile studia gli spettri di assorbimento
(parte 1) Orbitali atomici Orbitali molecolari Transizioni elettroniche Regole di selezione Cromoforo Spettrofotometro Legge Lambert-Beer La Spettroscopia Uv-visibile studia gli spettri di assorbimento
CON L EUROPA INVESTIAMO NEL VOSTRO FUTURO Fondi Strutturali Europei Programmazione FSE PON "Competenze per lo sviluppo" Bando 2373
 CON L EUROPA INVESTIAMO NEL VOSTRO FUTURO Fondi Strutturali Europei Programmazione 2007-2013 FSE PON "Competenze per lo sviluppo" Bando 2373 26/02/2013 Piano integrato 2013 Codice progetto: C-2-FSE-2013-313
CON L EUROPA INVESTIAMO NEL VOSTRO FUTURO Fondi Strutturali Europei Programmazione 2007-2013 FSE PON "Competenze per lo sviluppo" Bando 2373 26/02/2013 Piano integrato 2013 Codice progetto: C-2-FSE-2013-313
IIS Moro Dipartimento di matematica e fisica
 IIS Moro Dipartimento di matematica e fisica Obiettivi minimi per le classi prime - Fisica Poiché la disciplina Fisica è parte dell Asse Scientifico Tecnologico, essa concorre, attraverso lo studio dei
IIS Moro Dipartimento di matematica e fisica Obiettivi minimi per le classi prime - Fisica Poiché la disciplina Fisica è parte dell Asse Scientifico Tecnologico, essa concorre, attraverso lo studio dei
Richiami. Esercizio 1.1. La radiazione elettromagnetica del corpo nero ha la seguente densità di energia per unità di frequenza
 Parte I Problemi Richiami Esercizio 1.1. La radiazione elettromagnetica del corpo nero ha la seguente densità di energia per unità di frequenza u ν = 8π hν c 3 ν e βhν 1, dove c è la velocità della luce
Parte I Problemi Richiami Esercizio 1.1. La radiazione elettromagnetica del corpo nero ha la seguente densità di energia per unità di frequenza u ν = 8π hν c 3 ν e βhν 1, dove c è la velocità della luce
Esperimento sull ottica
 Esperimento sull ottica Gruppo: Valentina Sotgiu, Irene Sini, Giorgia Canetto, Federica Pitzalis, Federica Schirru, Jessica Atzeni, Martina Putzu, Veronica, Orgiu e Deborah Pilleri. Teoria di riferimento:
Esperimento sull ottica Gruppo: Valentina Sotgiu, Irene Sini, Giorgia Canetto, Federica Pitzalis, Federica Schirru, Jessica Atzeni, Martina Putzu, Veronica, Orgiu e Deborah Pilleri. Teoria di riferimento:
Istituzioni di fisica della materia I Lezione 3. S. Solimeno lezione 3 1
 Istituzioni di fisica della materia I Lezione 3 S. Solimeno lezione 3 1 S. Solimeno lezione 3 2 S. Solimeno lezione 3 3 S. Solimeno lezione 3 4 S. Solimeno lezione 3 5 spettroscopia gamma di colori che
Istituzioni di fisica della materia I Lezione 3 S. Solimeno lezione 3 1 S. Solimeno lezione 3 2 S. Solimeno lezione 3 3 S. Solimeno lezione 3 4 S. Solimeno lezione 3 5 spettroscopia gamma di colori che
1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di
 Unità 19 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di soluzioni acide e
Unità 19 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di soluzioni acide e
Laboratorio 2B A.A. 2012/2013. 7 Ottica Fisica II. Assorbimento Sorgenti luminose LED Diodi laser. Lab 2B CdL Fisica
 Laboratorio 2B A.A. 2012/2013 7 Ottica Fisica Assorbimento Sorgenti luminose LED Diodi laser Spettrofotometria: assorbimento ottico La spettroscopia può fornire informazioni sulla natura degli atomi. Esempio:
Laboratorio 2B A.A. 2012/2013 7 Ottica Fisica Assorbimento Sorgenti luminose LED Diodi laser Spettrofotometria: assorbimento ottico La spettroscopia può fornire informazioni sulla natura degli atomi. Esempio:
Chimica Analitica e Laboratorio 2. Modulo di Spettroscopia Analitica
 Chimica Analitica e Laboratorio 2 Modulo di Spettroscopia Analitica Introduzione ai metodi spettroscopici Doppia rappresentazione delle radiazioni elettromagnetiche (dualismo onda/corpuscolo): Ø onda elettromagnetica
Chimica Analitica e Laboratorio 2 Modulo di Spettroscopia Analitica Introduzione ai metodi spettroscopici Doppia rappresentazione delle radiazioni elettromagnetiche (dualismo onda/corpuscolo): Ø onda elettromagnetica
La legge di Lambert-Beer
 La legge di Lambert-Beer In questa esperienza determinerete la concentrazione di una soluzione incognita di permanganato di potassio per via spettrofotometrica. Generalita La spettroscopia si occupa dell
La legge di Lambert-Beer In questa esperienza determinerete la concentrazione di una soluzione incognita di permanganato di potassio per via spettrofotometrica. Generalita La spettroscopia si occupa dell
Ultima verifica pentamestre. 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!
 Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
ATOMI E MOLECOLE. Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti).
 1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
1 ATOMI E MOLECOLE Tutte le varie forme di materia esistenti sono costituite da sostanze semplici (elementi) e da sostanze composte (composti). Un elemento (es. il mercurio) è una sostanza che non può
Spettrofotometria UV/Visibile
 Spettrofotometria UV/Visibile Assorbimento atomico Ogni sostanza ha un caratteristico spettro di assorbimento, che dipende in certa misura anche dallo stato di aggregazione (solido, liquido o gas), ma
Spettrofotometria UV/Visibile Assorbimento atomico Ogni sostanza ha un caratteristico spettro di assorbimento, che dipende in certa misura anche dallo stato di aggregazione (solido, liquido o gas), ma
Grandezze fisiche e loro misura
 Grandezze fisiche e loro misura Cos è la fisica? e di che cosa si occupa? - Scienza sperimentale che studia i fenomeni naturali suscettibili di sperimentazione e caratterizzati da grandezze misurabili.
Grandezze fisiche e loro misura Cos è la fisica? e di che cosa si occupa? - Scienza sperimentale che studia i fenomeni naturali suscettibili di sperimentazione e caratterizzati da grandezze misurabili.
Quantizzazione del DNA con spettrofotometro
 Quantizzazione del DNA ed elettroforesi 1 Quantizzazione del DNA con spettrofotometro Al termine della metodica di estrazione, occorre quantificare il DNA isolato. Un metodo per quantificare in modo preciso
Quantizzazione del DNA ed elettroforesi 1 Quantizzazione del DNA con spettrofotometro Al termine della metodica di estrazione, occorre quantificare il DNA isolato. Un metodo per quantificare in modo preciso
Misure di ph e titolazione acidobase con metodo potenziometrico
 - Laboratorio di Chimica 1 Misure di ph e titolazione acidobase con metodo potenziometrico PAS A.A. 2013-14 Obiettivi 2 Uso di un ph-metro per la misura del ph Titolazione acido-base: costruzione della
- Laboratorio di Chimica 1 Misure di ph e titolazione acidobase con metodo potenziometrico PAS A.A. 2013-14 Obiettivi 2 Uso di un ph-metro per la misura del ph Titolazione acido-base: costruzione della
Luce e Vita (Luce è Vita) LUCE: FONTE ENERGETICA E PORTATRICE DI INFORMAZIONI
 Luce e Vita (Luce è Vita) LUCE: FONTE ENERGETICA E PORTATRICE DI INFORMAZIONI Luce : Fonte di Energia Fotosintesi Sviluppo e mantenimento della vita sulla Terra 6CO 2 + 6H 2 O + 60 fotoni ----> C 6 H 12
Luce e Vita (Luce è Vita) LUCE: FONTE ENERGETICA E PORTATRICE DI INFORMAZIONI Luce : Fonte di Energia Fotosintesi Sviluppo e mantenimento della vita sulla Terra 6CO 2 + 6H 2 O + 60 fotoni ----> C 6 H 12
Capitolo 2 Le misure delle grandezze fisiche
 Capitolo 2 Le misure delle grandezze fisiche Gli strumenti di misura Gli errori di misura Il risultato di una misura Errore relativo ed errore percentuale Propagazione degli errori Rappresentazione di
Capitolo 2 Le misure delle grandezze fisiche Gli strumenti di misura Gli errori di misura Il risultato di una misura Errore relativo ed errore percentuale Propagazione degli errori Rappresentazione di
L ONDA ELETTROMAGNETICA UNITA DI MISURA E DEFINIZIONI. ν ν. λ =
 IR: Teoria Campo elettrico L ONDA ELETTROMAGNETICA Lunghezza d onda Direzione di propagazione Campo magnetico Lunghezza d onda (cm) Numero d onda (cm -1 ) UNITA DI MISURA E DEFINIZIONI c λ = ν ν ν = =
IR: Teoria Campo elettrico L ONDA ELETTROMAGNETICA Lunghezza d onda Direzione di propagazione Campo magnetico Lunghezza d onda (cm) Numero d onda (cm -1 ) UNITA DI MISURA E DEFINIZIONI c λ = ν ν ν = =
Metodologie informatiche per la chimica
 Metodologie informatiche per la chimica Dr. Sergio Brutti Metodologie di analisi dei dati Strumenti di misura Uno strumento di misura e un dispositivo destinato a essere utilizzato per eseguire una misura,
Metodologie informatiche per la chimica Dr. Sergio Brutti Metodologie di analisi dei dati Strumenti di misura Uno strumento di misura e un dispositivo destinato a essere utilizzato per eseguire una misura,
DIODO. La freccia del simbolo indica il verso della corrente.
 DIODO Si dice diodo un componente a due morsetti al cui interno vi è una giunzione P-N. Il terminale del diodo collegato alla zona P si dice anodo; il terminale collegato alla zona N si dice catodo. Il
DIODO Si dice diodo un componente a due morsetti al cui interno vi è una giunzione P-N. Il terminale del diodo collegato alla zona P si dice anodo; il terminale collegato alla zona N si dice catodo. Il
Utilizzeremo un kit analitico per valutare la qualità dell acqua potabile delle nostre case, scuole e fontanelle cittadine.
 Acqua in brocca Ciao! Io sono LABBY e vi farò da guida per l analisi dell acqua del vostro rubinetto! Utilizzeremo un kit analitico per valutare la qualità dell acqua potabile delle nostre case, scuole
Acqua in brocca Ciao! Io sono LABBY e vi farò da guida per l analisi dell acqua del vostro rubinetto! Utilizzeremo un kit analitico per valutare la qualità dell acqua potabile delle nostre case, scuole
PROVA 1. Dati i composti con formula KBr e HClO 2 :
 PROVA 1 Dati i composti con formula KBr e HClO 2 : 1) Individuare a quale categoria di composti appartengono (ossidi,anidridi,idrossidi,acidi,sali) 2) Determinare le valenze o i numeri di ossidazione di
PROVA 1 Dati i composti con formula KBr e HClO 2 : 1) Individuare a quale categoria di composti appartengono (ossidi,anidridi,idrossidi,acidi,sali) 2) Determinare le valenze o i numeri di ossidazione di
Capitolo 4 Le spettroscopie. 1. Lo spettro elettromagnetico
 Capitolo 4 Le spettroscopie 1. Lo spettro elettromagnetico 2) Tipi di spettroscopia Emissione: transizione da livello superiore a livello inferiore Assorbimento: contrario 2.1 Spettroscopie rotazionali,
Capitolo 4 Le spettroscopie 1. Lo spettro elettromagnetico 2) Tipi di spettroscopia Emissione: transizione da livello superiore a livello inferiore Assorbimento: contrario 2.1 Spettroscopie rotazionali,
Il modello strutturale dell atomo
 Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
valore di a: verso l alto (ordinate crescenti) se a>0, verso il basso (ordinate decrescenti) se a<0;
 La parabola è una particolare conica definita come è una curva aperta, nel senso che non può essere contenuta in alcuna superficie finita del piano; è simmetrica rispetto ad una retta, detta ASSE della
La parabola è una particolare conica definita come è una curva aperta, nel senso che non può essere contenuta in alcuna superficie finita del piano; è simmetrica rispetto ad una retta, detta ASSE della
Spettroscopia. Reticolo di diffrazione Spettrometro a reticolo Spettroscopia Raman
 Spettroscopia Reticolo di diffrazione Spettrometro a reticolo Spettroscopia Raman Di nuovo l'esperimento di Young delle due fenditure Onda piana incidente Se la larghezza d delle fenditure tende a zero:
Spettroscopia Reticolo di diffrazione Spettrometro a reticolo Spettroscopia Raman Di nuovo l'esperimento di Young delle due fenditure Onda piana incidente Se la larghezza d delle fenditure tende a zero:
Sorgenti di radiazione luminosa
 Sorgenti di radiazione luminosa Quello che differenzia le fonti di luce (e quindi la qualità della radiazione emessa) è il meccanismo con cui viene generata l onda elettromagnetica. Poiché l onda trasporta
Sorgenti di radiazione luminosa Quello che differenzia le fonti di luce (e quindi la qualità della radiazione emessa) è il meccanismo con cui viene generata l onda elettromagnetica. Poiché l onda trasporta
La Polarizzazione della luce
 La Polarizzazione della luce Applet Java sulle OEM Le Onde Elettromagnetiche Sono onde trasversali costituite dalle vibrazioni del vuoto quantistico. Hanno velocità c=3.0 10 8 m/s. In ogni istante E è
La Polarizzazione della luce Applet Java sulle OEM Le Onde Elettromagnetiche Sono onde trasversali costituite dalle vibrazioni del vuoto quantistico. Hanno velocità c=3.0 10 8 m/s. In ogni istante E è
MICHELSON. Interferometro. A.Guarrera, Liceo Galilei CT
 L INTERFEROMETRO DI MICHELSON 1 A.Guarrera, Liceo Galilei CT L interferometria è un metodo di misura molto preciso e molto sensibile che permette di determinare, ad esempio, variazioni di lunghezza, densità
L INTERFEROMETRO DI MICHELSON 1 A.Guarrera, Liceo Galilei CT L interferometria è un metodo di misura molto preciso e molto sensibile che permette di determinare, ad esempio, variazioni di lunghezza, densità
Chimica. Lezione 1 La materia
 Chimica Lezione 1 La materia Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido, gassoso) o della COMPOSIZIONE
Chimica Lezione 1 La materia Materia Tutte le sostanze che costituiscono l universo Infinita varietà di forme Classificazione a seconda dello stato FISICO (solido, liquido, gassoso) o della COMPOSIZIONE
Modelli atomici. Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle.
 Modelli atomici Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle. Presupposti 1. Legge di Lavoisier della conservazione della massa: in una reazione chimica nulla si
Modelli atomici Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle. Presupposti 1. Legge di Lavoisier della conservazione della massa: in una reazione chimica nulla si
LA FOTOSINTESI: conversione di energia luminosa in energia chimica
 LA FOTOSINTESI: conversione di energia luminosa in energia chimica Fonte principale di carboidrati Via principale di fissazione del carbonio Fonte di ossigeno dell atmosfera La FOTOSINTESI consiste di
LA FOTOSINTESI: conversione di energia luminosa in energia chimica Fonte principale di carboidrati Via principale di fissazione del carbonio Fonte di ossigeno dell atmosfera La FOTOSINTESI consiste di
Tecnologie di Recupero e Riciclo dei Materiali Alberto Simboli I MATERIALI NELLA PRODUZIONE
 Tecnologie di Recupero e Riciclo dei Materiali Alberto Simboli 3. I MATERIALI NELLA PRODUZIONE 3.1. INTRODUZIONE Origine dei materiali I materiali, dal punto di vista della loro origine si possono suddividere
Tecnologie di Recupero e Riciclo dei Materiali Alberto Simboli 3. I MATERIALI NELLA PRODUZIONE 3.1. INTRODUZIONE Origine dei materiali I materiali, dal punto di vista della loro origine si possono suddividere
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni
 CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni composto materia sostanza pura miscela omogenea elemento eterogenea Elementi, Composti e Miscele Miscela eterogenea
CHIMICA: studio della composizione e della struttura della materia e delle sue trasformazioni composto materia sostanza pura miscela omogenea elemento eterogenea Elementi, Composti e Miscele Miscela eterogenea
Elettroforesi di Tamara Benincasa
 Elettroforesi di Tamara Benincasa L elettroforesi è una metodologia utilizzata in laboratorio attraverso la quale molecole biologiche (ammino acidi, peptidi, proteine, nucleotidi ed acidi nucleici), dotate
Elettroforesi di Tamara Benincasa L elettroforesi è una metodologia utilizzata in laboratorio attraverso la quale molecole biologiche (ammino acidi, peptidi, proteine, nucleotidi ed acidi nucleici), dotate
ANALISI SPETTROFOTOMETRICHE
 LICEO SCIENTIFICO. G.MARCONI FOGGIA PROGETTO DIOR Progetto pilota di didattica orientativa in ambito scientifico ANALISI SPETTROFOTOMETRICHE Determinazione qualitativa e quantitativa delle sostanze 18
LICEO SCIENTIFICO. G.MARCONI FOGGIA PROGETTO DIOR Progetto pilota di didattica orientativa in ambito scientifico ANALISI SPETTROFOTOMETRICHE Determinazione qualitativa e quantitativa delle sostanze 18
Misure di fenomeni di aberrazione di una lente
 Padova, gennaio 00 Misure di fenomeni di aberrazione di una lente Indicare il numero identificativo e le caratteristiche geometriche della lente utilizzata: Lente num. =... Spessore =... Spigolo =... Indice
Padova, gennaio 00 Misure di fenomeni di aberrazione di una lente Indicare il numero identificativo e le caratteristiche geometriche della lente utilizzata: Lente num. =... Spessore =... Spigolo =... Indice
ANALISI DI SEGNALI TEMPO VARIANTI
 ANALISI DI SEGNALI TEMPO VARIANTI Nel corso di questa esercitazione verrà illustrato come utilizzare Excel per eseguire la FFT di un segnale. Algebra complessa Excel consente di eseguire calcoli anche
ANALISI DI SEGNALI TEMPO VARIANTI Nel corso di questa esercitazione verrà illustrato come utilizzare Excel per eseguire la FFT di un segnale. Algebra complessa Excel consente di eseguire calcoli anche
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I seguenti grafici rappresentano istantanee dell onda di equazione:
 Descrizione matematica di un onda armonica La descrizione matematica di un onda è data dalla seguente formula : Y ; t) A cos( k ω t + ϕ ) () ( ove ω e k, dette rispettivamente pulsazione e numero d onda,
Descrizione matematica di un onda armonica La descrizione matematica di un onda è data dalla seguente formula : Y ; t) A cos( k ω t + ϕ ) () ( ove ω e k, dette rispettivamente pulsazione e numero d onda,
APPUNTI DI MATEMATICA ALGEBRA \ CALCOLO LETTERALE \ MONOMI (1)
 LGEBR \ CLCOLO LETTERLE \ MONOMI (1) Un monomio è un prodotto di numeri e lettere; gli (eventuali) esponenti delle lettere sono numeri naturali (0 incluso). Ogni numero (reale) può essere considerato come
LGEBR \ CLCOLO LETTERLE \ MONOMI (1) Un monomio è un prodotto di numeri e lettere; gli (eventuali) esponenti delle lettere sono numeri naturali (0 incluso). Ogni numero (reale) può essere considerato come
FORMULARIO DI CHIMICA
 ARGOMENTO Grandezze chimiche fondamentali: 1. Numero di Avogadro 2. Mole 3. Massa Molare 4. Densità 5. Volume molare di un gas Modi di esprimere la concentrazione: 1. Molare M 2. Parti per milione ppm
ARGOMENTO Grandezze chimiche fondamentali: 1. Numero di Avogadro 2. Mole 3. Massa Molare 4. Densità 5. Volume molare di un gas Modi di esprimere la concentrazione: 1. Molare M 2. Parti per milione ppm
Insegnare relatività. nel XXI secolo
 Insegnare relatività nel XXI secolo E s p a n s i o n e d e l l ' U n i v e r s o e l e g g e d i H u b b l e La legge di Hubble Studiando distanze e moto delle galassie si trova che quelle più vicine
Insegnare relatività nel XXI secolo E s p a n s i o n e d e l l ' U n i v e r s o e l e g g e d i H u b b l e La legge di Hubble Studiando distanze e moto delle galassie si trova che quelle più vicine
Dalla radiazione elettromagnetica alle celle fotovoltaiche TECHNOTOU R
 Dalla radiazione elettromagnetica alle celle fotovoltaiche TECHNOTOU R Elettromagnetismo: storia http://it.wikipedia.org http://it.wikipedia.org http://it.wikipedia.org http://www.destudiishumanitatis.it
Dalla radiazione elettromagnetica alle celle fotovoltaiche TECHNOTOU R Elettromagnetismo: storia http://it.wikipedia.org http://it.wikipedia.org http://it.wikipedia.org http://www.destudiishumanitatis.it
TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI
 TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI MATERIA: CHIMICA CLASSI: SECONDE I II QUADRIMESTRE Competenze Abilità/Capacità Conoscenze* Attività didattica Strumenti Tipologia verifiche Individuare e spiegare
TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI MATERIA: CHIMICA CLASSI: SECONDE I II QUADRIMESTRE Competenze Abilità/Capacità Conoscenze* Attività didattica Strumenti Tipologia verifiche Individuare e spiegare
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO
 I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
Rivelatori a gas. In situazione di equilibrio il gas si comporta come isolante e non c è passaggio di corrente elettrica
 STRUMENTI Rivelatori a gas I rivelatori a gas sono costituiti da due elettrodi immersi in un gas tra i quali è applicata un campo elettrico uniforme (differenza di potenziale) In situazione di equilibrio
STRUMENTI Rivelatori a gas I rivelatori a gas sono costituiti da due elettrodi immersi in un gas tra i quali è applicata un campo elettrico uniforme (differenza di potenziale) In situazione di equilibrio
REALIZZATO NUOVO DISPOSITIVO FOTOVOLTAICO TRASPARENTE INTEGRABILE NEGLI EDIFICI
 COMUNICATO STAMPA REALIZZATO NUOVO DISPOSITIVO FOTOVOLTAICO TRASPARENTE INTEGRABILE NEGLI EDIFICI La collaborazione virtuosa tra Industria (Centro Ricerche Eni per le Energie Rinnovabili e l'ambiente -
COMUNICATO STAMPA REALIZZATO NUOVO DISPOSITIVO FOTOVOLTAICO TRASPARENTE INTEGRABILE NEGLI EDIFICI La collaborazione virtuosa tra Industria (Centro Ricerche Eni per le Energie Rinnovabili e l'ambiente -
Magnete in caduta in un tubo metallico
 Magnete in caduta in un tubo metallico Progetto Lauree Scientifiche 2009 Laboratorio di Fisica Dipartimento di Fisica Università di Genova in collaborazione con il Liceo Leonardo da Vinci Genova - 25 novembre
Magnete in caduta in un tubo metallico Progetto Lauree Scientifiche 2009 Laboratorio di Fisica Dipartimento di Fisica Università di Genova in collaborazione con il Liceo Leonardo da Vinci Genova - 25 novembre
Lampade fluorescenti Generalità sulle lampade fluorescenti:
 Lampade fluorescenti Generalità sulle lampade fluorescenti: Le lampade fluorescenti sono lampade a scarica, cioè è il meccanismo della scarica elettrica in un gas a determinare l emissione luminosa, direttamente
Lampade fluorescenti Generalità sulle lampade fluorescenti: Le lampade fluorescenti sono lampade a scarica, cioè è il meccanismo della scarica elettrica in un gas a determinare l emissione luminosa, direttamente
Spettroscopia e spettrometria ottica. Francesco Nobili
 Spettroscopia e spettrometria ottica Francesco Nobili SPETTROSCOPIA OTTICA Nelle tecniche spettroscopiche si analizza l intensità dell interazione radiazione-materia a varie lunghezze d onda Tale interazione
Spettroscopia e spettrometria ottica Francesco Nobili SPETTROSCOPIA OTTICA Nelle tecniche spettroscopiche si analizza l intensità dell interazione radiazione-materia a varie lunghezze d onda Tale interazione
Quadro riassuntivo di geometria analitica
 Quadro riassuntivo di geometria analitica IL PIANO CARTESIANO (detta ascissa o coordinata x) e y quella dall'asse x (detta ordinata o coordinata y). Le coordinate di un punto P sono: entrambe positive
Quadro riassuntivo di geometria analitica IL PIANO CARTESIANO (detta ascissa o coordinata x) e y quella dall'asse x (detta ordinata o coordinata y). Le coordinate di un punto P sono: entrambe positive
Spettroscopia atomica
 Spettroscopia atomica La spettroscopia atomica è una tecnica di indagine qualitativa e quantitativa, in cui una sostanza viene decomposta negli atomi che la costituiscono tramite una fiamma, un fornetto
Spettroscopia atomica La spettroscopia atomica è una tecnica di indagine qualitativa e quantitativa, in cui una sostanza viene decomposta negli atomi che la costituiscono tramite una fiamma, un fornetto
AMPICILLINA SODICA PREPARAZIONE INIETTABILE. Ampicillina sodica polvere sterile per preparazioni iniettabili
 1 0 1 0 1 0 1 0 1 001/FU Aprile 00 Commenti entro il Settembre 00 NOTA: Armonizzata con la versione revisionata della B.P. La monografia è stata completamente revisionata per armonizzarla con le corrispondenti
1 0 1 0 1 0 1 0 1 001/FU Aprile 00 Commenti entro il Settembre 00 NOTA: Armonizzata con la versione revisionata della B.P. La monografia è stata completamente revisionata per armonizzarla con le corrispondenti
gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico
 gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico Il legame peptidico si ha quando il gruppo carbossilico (-
gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico Il legame peptidico si ha quando il gruppo carbossilico (-
Campo di Variazione Costituisce la misura di
 Statistica2 22/09/2015 I Parametri di dispersione Campo di Variazione Costituisce la misura di PESO ALLA NASCITA DEI BOVINI matricola PESO SESSO 7 38,00 F 8 38,00 F 1 40,00 F 2 40,00 F 5 40,00 F 10 42,00
Statistica2 22/09/2015 I Parametri di dispersione Campo di Variazione Costituisce la misura di PESO ALLA NASCITA DEI BOVINI matricola PESO SESSO 7 38,00 F 8 38,00 F 1 40,00 F 2 40,00 F 5 40,00 F 10 42,00
Struttura elettronica e tavola periodica
 Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
Inquinamento da Campi Elettromagnetici
 Inquinamento da Campi Elettromagnetici Aspetti Tecnici, Sanitari, Normativi A cura di ECORICERCHE s.r.l. Lo Spettro Elettromagnetico ECORICERCHE s.r.l. 2 Elettrosmog: che cos è? E un termine entrato nell
Inquinamento da Campi Elettromagnetici Aspetti Tecnici, Sanitari, Normativi A cura di ECORICERCHE s.r.l. Lo Spettro Elettromagnetico ECORICERCHE s.r.l. 2 Elettrosmog: che cos è? E un termine entrato nell
