ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
|
|
|
- Gilberto Bellini
- 6 anni fa
- Visualizzazioni
Transcript
1 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1
2 1. DENOMINAZIONE DEL MEDICINALE Amyvid 800 MBq/ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml di soluzione iniettabile contiene 800 MBq di florbetapir ( 18 F) alla data e ora di calibrazione (ToC, Time of Calibration). L attività per flaconcino varia da 800 MBq a MBq alla data e ora di calibrazione. Il fluoro ( 18 F) decade in ossigeno stabile ( 18 O) con un emivita di circa 110 minuti emettendo una radiazione di positroni di 634 kev, seguita da radiazione da annichilazione fotonica di 511 kev. Eccipienti con effetti noti: Questo medicinale contiene 79 mg/ml di etanolo e fino a 37 mg di sodio. Per l elenco completo degli eccipienti, vedere paragrafo FORMA FARMACEUTICA Soluzione iniettabile. Soluzione limpida incolore. 4. INFORMAZIONI CLINICHE 4.1 Indicazioni terapeutiche Medicinale solo per uso diagnostico. Amyvid è un radiofarmaco indicato per rilevare con la tomografia ad emissione di positroni (PET) le immagini della densità delle placche neuritiche di β-amiloide nel cervello di pazienti adulti con decadimento cognitivo che vengono valutati per la malattia di Alzheimer (AD) e altre cause di decadimento cognitivo. Amyvid deve essere usato congiuntamente alla valutazione clinica. Una scansione negativa indica la presenza di poche placche o l assenza di placche, il che non è coerente con una diagnosi di AD. Per i limiti nell interpretazione di una scansione positiva vedere i paragrafi 4.4 e Posologia e modo di somministrazione Una scansione PET con florbetapir deve essere richiesta da medici con esperienza nella gestione clinica delle patologie neurodegenerative. Le immagini ottenute con Amyvid devono essere interpretate solo da valutatori che hanno effettuato un training su come interpretare le immagini della PET con florbetapir ( 18 F). Nei casi in cui con la scansione PET è difficile localizzare la sostanza grigia e il margine della sostanza bianca/grigia, si raccomanda un esame recente con tomografia computerizzata (TC) o con risonanza magnetica (RM), co-registrato con l esame PET, per ottenere un immagine combinata PET-TC o PET-RM (vedere il paragrafo 4.4 Interpretazione delle immagini). Posologia L attività raccomandata per un adulto che pesa 70 kg è 370 MBq di florbetapir ( 18 F). Il volume dell iniezione non deve essere inferiore a 1 ml e non superare 10 ml. 2
3 Popolazioni speciali Pazienti anziani Non è raccomandato un aggiustamento della dose in base all età. Insufficienza renale ed epatica E necessaria una valutazione attenta dell attività da somministrare perché in questi pazienti è possibile che l esposizione alle radiazioni risulti maggiore. Vedere il paragrafo 4.4. Non sono stati eseguiti studi estesi per determinare il range o l aggiustamento della dose con questo medicinale nelle popolazioni normali e speciali. Le farmacocinetiche di florbetapir ( 18 F) in pazienti con insufficienza renale o epatica non sono state caratterizzate. Popolazione pediatrica Non c è un uso rilevante di Amyvid nella popolazione pediatrica. Modo di somministrazione Per uso endovenoso. Per uso multidose. L attività di florbetapir ( 18 F) deve essere misurata con un calibratore di dose immediatamente prima dell iniezione. La dose è somministrata per iniezione endovenosa in bolo, seguita da un lavaggio con una soluzione iniettabile di cloruro di sodio 9 mg/ml (0,9%) per assicurare la somministrazione completa della dose. L iniezione di Amyvid attraverso un catetere endovenoso corto (approssimativamente di 4 cm o meno) minimizza il potenziale assorbimento del principio attivo da parte del catetere. L'iniezione di florbetapir ( 18 F) deve essere endovenosa per evitare l irradiazione dovuta a travaso locale, così come la rilevazione di immagini artefatte. Acquisizione delle immagini Un immagine PET di 10 minuti deve essere acquisita circa minuti dopo l iniezione endovenosa di Amyvid. I pazienti devono stare supini con la testa posizionata in modo tale da centrare il cervello, incluso il cervelletto, nel campo visivo dello scanner della PET. Per ridurre il movimento della testa possono essere impiegati un nastro o altri poggiatesta flessibili. La ricostruzione deve includere la correzione per l attenuazione per avere pixel transassiali delle dimensioni comprese tra 2,0 e 3,0 mm. 4.3 Controindicazioni Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo Avvertenze speciali e precauzioni di impiego Giustificazione di un rapporto beneficio/rischio individuale Per ogni paziente l esposizione a radiazioni deve essere giustificata sulla base dei possibili benefici. L attività somministrata deve, in ogni caso, essere la più bassa possibile per ottenere le informazioni diagnostiche richieste. Insufficienza renale e insufficienza epatica Per questi pazienti è necessaria un attenta valutazione del rapporto beneficio/rischio poiché è possibile che l esposizione alle radiazioni risulti aumentata. Florbetapir ( 18 F) è escreto principalmente attraverso il sistema epatobiliare e per i pazienti con insufficienza epatica esiste la possibilità di un aumentata esposizione alle radiazioni. Vedere anche il paragrafo
4 Popolazione pediatrica Per informazioni sull uso nella popolazione pediatrica, vedere i paragrafi 4.2 o 5.1. Interpretazione delle immagini con Amyvid Le immagini con Amyvid devono essere interpretate solo da valutatori che hanno effettuato il training su come interpretare le immagini della PET con florbetapir ( 18 F). Una scansione negativa indica una densità scarsa o assente di placche neuritiche corticali di ß-amiloide. Una scansione positiva indica una densità da moderata a frequente. Sono stati osservati errori di interpretazione dell immagine nella valutazione della densità delle placche neuritiche cerebrali di β-amiloide, inclusi dei falsi negativi. La valutazione delle immagini deve essere eseguita principalmente nell orientamento transassiale e, quando necessario, anche sui piani sagittale e coronale. Si raccomanda che la valutazione delle immagini includa tutte le sezioni transassiali del cervello usando una scala in bianco e nero con l intensità massima della scala impostata alla massima intensità di pixel su tutto il cervello. L interpretazione dell immagine come negativa o positiva viene effettuata confrontando visivamente l attività della sostanza grigia corticale con l attività della sostanza bianca corticale adiacente (vedere la Figura 1). Scansioni negative hanno più attività nella sostanza bianca che nella sostanza grigia, creando un evidente contrasto grigio-bianco. Scansioni positive avranno: a) Due o più aree del cervello (ciascuna più larga di una singola circonvoluzione corticale) in cui il contrasto grigio-bianco è ridotto o assente. Questo è il modo in cui appare più comunemente una scansione positiva. b) Una o più aree in cui l attività della sostanza grigia è intensa e supera in modo evidente l attività della sostanza bianca adiacente. 4
5 Figura 1: Immagini PET con Amyvid che mostrano esempi di scansioni negative (le due righe in alto) e di scansioni positive (le due righe in basso). Le figure da sinistra a destra mostrano le immagini PET relative alla sezione sagittale, coronale e trasversale. L ultima figura a destra mostra l immagine ingrandita dell area del cervello evidenziata nel rettangolo. Le due frecce in alto indicano il normale contrasto grigio-bianco preservato con un attività corticale inferiore a quella della sostanza bianca adiacente. Le due frecce in basso indicano aree con un ridotto contrasto grigio-bianco e un aumentata attività corticale che è paragonabile all attività della sostanza bianca adiacente. Limitazioni di utilizzo Una scansione positiva non è sufficiente da sola a stabilire una diagnosi di AD o di un altro disturbo cognitivo poiché nei pazienti anziani asintomatici e in alcune demenze neurodegenerative (AD, demenza da corpi di Lewy, demenza da malattia di Parkinson) possono essere presenti depositi di placche neuritiche nella sostanza grigia. Per le limitazioni di utilizzo nei pazienti con deterioramento cognitivo lieve (MCI), vedere il paragrafo 5.1. L efficacia di Amyvid nel prevedere lo sviluppo di AD o monitorare la risposta alla terapia non è stata stabilita (vedere il paragrafo 5.1). Alcune scansioni possono essere di difficile interpretazione a causa del rumore di fondo dell immagine, della marcata atrofia con assottigliamento corticale o dell immagine sfocata che possono portare ad errori di interpretazione. Nei casi in cui è difficile individuare con le scansioni PET la sede della sostanza grigia e il margine della sostanza bianca/grigia, ed è disponibile un immagine recente di TC o di RM registrata 5
6 contemporaneamente all esame PET, chi effettua l interpretazione deve esaminare l immagine combinata della PET-TC o della PET-RM per chiarire la correlazione tra il reperto della PET e l anatomia della sostanza grigia. In alcuni casi è stata identificata un aumentata captazione in strutture extracerebrali quali le ghiandole salivali, la cute, i muscoli e le ossa (vedere il paragrafo 5.2). L esame delle immagini sagittali e le immagini della TC o della RM registrate contemporaneamente possono aiutare a distinguere l osso occipitale dalla sostanza grigia occipitale. Dopo l esame Nelle prime 24 ore successive all iniezione, il contatto ravvicinato con bambini e donne in gravidanza deve essere limitato. Avvertenze specifiche Il contenuto di sodio è superiore a 1 mmol (fino a 37 mg per dose). Questo deve essere tenuto in considerazione nei pazienti con una dieta a basso contenuto di sodio. Questo medicinale contiene 10 vol % di etanolo (alcol), cioè fino a 790 mg per dose, equivalenti a 20 ml di birra o 8 ml di vino per dose. Questa quantità può essere dannosa per chi soffre di alcolismo e ciò deve essere tenuto in considerazione nelle donne in gravidanza e che stanno allattando e nei gruppi ad alto rischio come i pazienti con malattia epatica o epilessia. 4.5 Interazioni con altri medicinali ed altre forme di interazione Non sono stati effettuati studi di interazione in vivo. Studi di legame in vitro non hanno mostrato interferenze del legame di florbetapir ( 18 F) alle placche di ß- amiloide in presenza degli altri medicinali comunemente assunti dai pazienti con AD. 4.6 Fertilità, gravidanza e allattamento Donne potenzialmente fertili Quando è prevista la somministrazione di radiofarmaci ad una donna potenzialmente fertile, è importante determinare se è o non è in stato di gravidanza. Ove non sia provato il contrario, qualsiasi donna che abbia saltato un ciclo mestruale deve essere considerata in stato di gravidanza. In caso di dubbi riguardo ad una possibile gravidanza (se la donna ha saltato un ciclo mestruale, se il ciclo mestruale è molto irregolare, etc.), devono essere proposte alla paziente tecniche alternative che non utilizzino radiazioni ionizzanti (qualora ve ne siano). Gravidanza Le metodiche che utilizzano radionuclidi impiegate su donne in stato di gravidanza generano radiazioni che coinvolgono il feto. Pertanto, durante la gravidanza devono essere eseguiti soltanto gli esami ritenuti essenziali, quando il probabile beneficio supera di gran lunga il rischio per la madre e per il feto. Non sono stati condotti studi nelle donne in stato di gravidanza. Non sono stati eseguiti studi negli animali per valutare gli effetti di florbetapir ( 18 F) sulla riproduzione (vedere il paragrafo 5.3). Allattamento Non è noto se florbetapir ( 18 F) sia escreto nel latte umano durante l allattamento. Prima della somministrazione di radiofarmaci a una madre che sta allattando al seno si deve valutare la possibilità di ritardare la somministrazione del radionuclide fino a quando la madre abbia terminato l allattamento al seno e considerare se sia stato scelto il radiofarmaco più appropriato tenendo presente l eliminazione di attività nel latte materno. Se la somministrazione è ritenuta necessaria, l allattamento deve essere interrotto per 24 ore e il latte prodotto deve essere eliminato. Nelle prime 24 ore successive all iniezione, il contatto ravvicinato con bambini deve essere limitato. 6
7 Fertilità Non sono stati effettuati studi sulla fertilità. 4.7 Effetti sulla capacità di guidare veicoli e sull uso di macchinari Non pertinente. 4.8 Effetti indesiderati Riassunto del profilo di sicurezza Le reazioni avverse sono state raccolte negli studi clinici che hanno coinvolto 555 soggetti con 665 somministrazioni di Amyvid soluzione iniettabile. Non sono state riportate reazioni avverse gravi correlate alla somministrazione di Amyvid. Elenco delle reazioni avverse La frequenza è definita come molto comune ( 1/10), comune ( 1/100, <1/10), non comune ( 1/1.000, <1/100), raro ( 1/10.000, <1/1.000), molto raro (<1/10.000), non nota (la frequenza non può essere definita sulla base dei dati disponibili). Nella realtà le reazioni avverse potrebbero verificarsi con una frequenza anche inferiore a quella riportata di seguito, ma la dimensione del database da cui sono stati ottenuti i dati non ha permesso di assegnare le categorie di frequenza inferiore alla categoria non comune ( 1/1.000, <1/100). Patologie del sistema nervoso Comuni: cefalea Non comuni: disgeusia Patologie vascolari Non comuni: vampate di calore Patologie gastrointestinali Non comuni: nausea Patologie della cute e del tessuto sottocutaneo Non comuni: prurito, orticaria Patologie sistemiche e condizioni relative alla sede di somministrazione Non comuni: rash a livello del sito di infusione L'esposizione alle radiazioni ionizzanti è correlata all'induzione di cancro e al potenziale sviluppo di difetti ereditari. Poiché, quando viene somministrata l'attività raccomandata di 370 MBq di florbetapir ( 18 F), la dose efficace è 7 msv, queste reazioni avverse sono attese con una bassa probabilità. 4.9 Sovradosaggio Data la piccola quantità di florbetapir ( 18 F) in ogni dose, il sovradosaggio non dovrebbe provocare effetti farmacologici. Nel caso di somministrazione di un sovradosaggio di radiazioni, la dose assorbita dal paziente deve essere ridotta se possibile aumentando l eliminazione del radionuclide dal corpo con una frequente minzione e defecazione. Potrebbe essere utile calcolare la dose efficace che è stata impiegata. 7
8 5. PROPRIETÀ FARMACOLOGICHE 5.1 Proprietà farmacodinamiche Categoria farmacoterapeutica: radiofarmaceutici diagnostici, sistema nervoso centrale, Codice ATC: V09AX05. Meccanismo d azione Florbetapir ( 18 F) si lega alle placche neuritiche di ß-amiloide. Gli studi di legame che usano i tradizionali metodi di colorazione neuropatologica su cervelli con AD post-mortem hanno dimostrato una correlazione statisticamente significativa (p < ) tra il legame di florbetapir ( 18 F) in vitro e il deposito di aggregati ß- amiloidi. In vivo, la correlazione tra la captazione di florbetapir ( 18 F) nella sostanza grigia corticale e la quantità totale di ß-amiloide è stata valutata in pazienti in fin di vita usando l anticorpo anti-amiloide 4G8 che evidenzia la ß-amiloide trovata sia nelle placche neuritiche che diffuse. Il legame in vivo di florbetapir ( 18 F) ad altre strutture ß-amiloidi o ad altre strutture o recettori cerebrali rimane sconosciuto. Effetti farmacodinamici Alle basse concentrazioni chimiche presenti in Amyvid, florbetapir ( 18 F) non ha una attività farmacologica rilevabile. Negli studi clinici completati, la captazione di florbetapir ( 18 F) in 6 aree corticali predefinite del cervello (precuneo, frontale, cingolato anteriore, cingolato posteriore, parietale e temporale) è stata misurata quantitativamente usando come indice il valore di captazione standardizzato (SUV, Standardised Uptake Value). I rapporti medi dei SUV corticali (SUVR, relativi al cervelletto) sono più alti nei pazienti con AD rispetto a quelli dei soggetti volontari sani. I valori medi dei SUVR corticali rispetto a quelli cerebellari nei pazienti con AD mostrano sostanziali aumenti continui dal tempo zero nei 30 minuti dopo la somministrazione e successivamente, con solo delle piccole variazioni, fino a 90 minuti dopo la somministrazione. Non sono state notate differenze nei risultati in termini di SUVR nei soggetti che assumevano i comuni trattamenti per l AD rispetto a quelli che non li assumevano. Efficacia clinica E stato eseguito uno studio pivotal su 59 pazienti in fin di vita con l obiettivo di stabilire la performance diagnostica di Amyvid nel rilevare la densità delle placche neuritiche corticali (densità assente o scarsa vs densità moderata o frequente). I risultati della PET sono stati confrontati con la più alta densità di placche neuritiche misurata sulle sezioni della corteccia frontale, temporale o parietale di pazienti sottoposti ad autopsia nei 24 mesi successivi alla scansione PET. Non è stato possibile misurare in modo affidabile lo stato cognitivo dei soggetti. In tutti i 59 soggetti, la valutazione della PET in cieco da parte di 5 medici nucleari ha dato come risultato nella maggior parte dei casi una sensibilità di lettura del 92% (95% IC: 78-98%) e una specificità del 100% (95% IC: %). In uno studio su 47 volontari sani giovani (di età inferiore a 40 anni), che si presumeva essere privi di depositi ß-amiloidi, tutte le scansioni PET con Amyvid sono state negative. La sensibilità e la specificità di Amyvid nel rilevare la densità delle placche neuritiche corticali sono state ulteriormente valutate in due altri studi in cui differenti gruppi di valutatori hanno interpretato le immagini di alcuni soggetti poi sottoposti ad esame autoptico nello studio pivotal. I risultati di questi studi sono stati analoghi ai risultati ottenuti nello studio pivotal. La consistenza tra i valutatori, usando valori della kappa di Fleiss, variava da 0.75 a In uno studio longitudinale, 142 soggetti (con diagnosi clinica di MCI, AD o cognitivamente normali) sono stati sottoposti alle scansioni PET con florbetapir ( 18 F) all inizio dello studio e poi sono stati seguiti per 3 anni per valutare la relazione tra le immagini ottenute con Amyvid e le variazioni dello stato diagnostico. 8
9 I valori di performance diagnostica della PET con florbetapir ( 18 F) sono riportati nella tabella di seguito: Accordo con la diagnosi di MCI all inizio dello studio Accordo con la diagnosi di di AD clinicamente manifesta all inizio dello studio N=51 N=31 Sensibilità 19/51 = 37,3% (95% IC: 24,1-51,9%) 21/31 = 67,7% (95% IC: 51,3-84,2%) Specificità Utilizzando casi non-mci (cognitivamente normali & con AD clinicamente manifesta) 69/100 = 69,0% (95% IC: 59,9-78,1%) Utilizzando casi non-ad (cognitivamente normali & con MCI) 91/120 = 75,8% (95% IC: 68,2-83,5%) Quoziente di probabilità positivo 1.20 (95% IC: ) 2.80 (95% CI: ) Dei pazienti che all inizio dello studio avevano avuto una diagnosi clinica di MCI, 9 (19%) sono passati ad AD clinicamente manifesta dopo 36 mesi. Dei 17 pazienti con MCI che hanno avuto una scansione PET positiva, 6 (35%) hanno avuto una diagnosi di probabile AD clinicamente manifesta dopo 36 mesi rispetto a 3 (10%) dei 30 pazienti che hanno avuto una scansione negativa. La sensibilità della scansione con Amyvid nel rilevare la percentuale di passaggio da MCI ad AD nei 9 pazienti è stata del 66,7% (95% IC: 35-88%), la specificità nei 38 pazienti che non hanno avuto questa evoluzione è stata del 71,0% (95% IC: 55-83%) e il quoziente di probabilità positivo è stato di 2.31 (95% IC: %). Il disegno di questo studio non permette di stimare il rischio di evoluzione da MCI ad AD clinicamente manifesta. Popolazione pediatrica L Agenzia europea dei medicinali ha previsto l esonero dall obbligo di presentare i risultati degli studi con Amyvid in tutti i sottogruppi della popolazione pediatrica poiché non è indicato per l uso nella popolazione pediatrica. 5.2 Proprietà farmacocinetiche Distribuzione Florbetapir ( 18 F) si distribuisce nell organismo entro alcuni minuti dall iniezione e poi è rapidamente metabolizzato. Captazione a livello degli organi La massima captazione di florbetapir ( 18 F) a livello encefalico si verifica entro alcuni minuti dall iniezione, seguita da una rapida clearance a livello encefalico nei primi 30 minuti successivi all iniezione. Gli organi di maggiore esposizione sono gli organi di eliminazione, principalmente la colecisti, il fegato e l intestino. I soggetti di controllo sani mostrano livelli di accumulo relativamente bassi di florbetapir ( 18 F) a livello della corteccia e del cervelletto. Analisi regionali mostrano livelli leggermente più alti di accumulo nel caudato, nel putamen e nell ippocampo. Il livello più alto di captazione si verifica nelle regioni composte principalmente da sostanza bianca (ponte e centro semiovale). Nei soggetti con AD, le regioni corticali e il putamen mostrano una captazione significativamente maggiore rispetto ai soggetti di controllo. Nei soggetti con AD, come nei soggetti di controllo, c è un ridotto accumulo nel cervelletto e nell ippocampo e un elevato accumulo nel ponte e nel centro semiovale. Le basi biofisiche dell accumulo di florbetapir ( 18 F) nella sostanza bianca del cervello umano vivente non possono essere ancora del tutto spiegate. Si ipotizza che una clearance inferiore del radiofarmaco possa contribuire all accumulo nella sostanza bianca poiché il flusso ematico cerebrale regionale nella sostanza bianca è meno della metà di quello nella corteccia. In alcuni casi è stata identificata un aumentata captazione in strutture extracerebrali quali il cuoio capelluto, le ghiandole salivali, i muscoli e le ossa del cranio. La 9
10 ragione di questa captazione non è nota, ma potrebbe essere dovuta all accumulo di florbetapir ( 18 F) o di qualche suo metabolita radioattivo o alla radioattività presente nel sangue. Eliminazione L eliminazione avviene principalmente per clearance epatica ed escrezione nella colecisti e nell intestino. Un certo accumulo/escrezione è osservato anche nella vescica. Nelle urine la radioattività è presente sottoforma di metaboliti polari di florbetapir ( 18 F). Emivita Florbetapir ( 18 F) scompare molto rapidamente dal circolo sanguigno dopo l iniezione endovenosa. Meno del 5% della radioattività 18 F iniettata rimane nel sangue 20 minuti dopo la somministrazione e meno del 2% è presente 45 minuti dopo la somministrazione. Il fluoro 18 F residuo in circolo durante la finestra di minuti di rilevamento delle immagini è principalmente nelle forme polari del 18 F. L emivita radioattiva del 18 F è 110 minuti. Insufficienza renale/epatica Le farmacocinetiche in pazienti con insufficienza renale o epatica non sono state caratterizzate. 5.3 Dati preclinici di sicurezza Tossicologia animale e sicurezza farmacologica I dati non clinici rivelano che non c è un rischio specifico per l uomo sulla base degli studi convenzionali di sicurezza farmacologica e di tossicità a dose singola e ripetuta, nei quali è stato usato florbetapir [la forma non radioattiva di florbetapir ( 18 F)]. Uno studio con una dose acuta è stato eseguito nei ratti ed è stato determinato che il NOAEL (No Observed Adverse Effect Level - la dose senza effetto avverso osservabile) è almeno 100 volte la massima dose per l uomo. La tossicità potenziale di iniezioni endovenose di florbetapir ripetute per 28 giorni è stata valutata nei ratti e nei cani beagle ed il NOAEL è stato almeno 25 volte la massima dose per l uomo. In un test di reversione della mutazione (test di Ames) su batteri in vitro, sono stati osservati aumenti del numero delle colonie revertite in 2 dei 5 ceppi esposti a florbetapir. In uno studio in vitro di aberrazione cromosomica con culture di cellule linfocitarie periferiche umane, florbetapir non ha causato un aumento della percentuale di cellule con aberrazione cromosomica dopo 3 ore di esposizione, con o senza attivazione; tuttavia, un esposizione per 22 ore ha prodotto un aumento delle aberrazioni cromosomiche in tutte le concentrazioni testate. La tossicità genomica potenziale in vivo di florbetapir è stata valutata in uno studio sui micronuclei dei ratti. Con questo metodo, florbetapir non ha determinato un aumento del numero degli eritrociti policromatici micronucleati al più alto livello di dose ottenibile, 372 µg/kg/die somministrato due volte al giorno per 3 giorni consecutivi. Questa dose è circa 500 volte la dose umana massima e non ha mostrato evidenze di mutazioni geniche. Non sono stati effettuati studi su animali per valutare la cancerogenicità potenziale a lungo termine, la fertilità o gli effetti di florbetapir ( 18 F) sulla riproduzione. Non sono stati effettuati studi di tossicologia animale e sicurezza farmacologica con florbetapir ( 18 F). 6. INFORMAZIONI FARMACEUTICHE 6.1 Elenco degli eccipienti Etanolo assoluto Sodio ascorbato Sodio cloruro Acqua per preparazioni iniettabili 10
11 6.2 Incompatibilità In assenza di studi di compatibilità, questo medicinale non deve essere miscelato con altri medicinali. 6.3 Periodo di validità 7.5 ore dall ora di calibrazione 6.4 Precauzioni particolari per la conservazione Questo medicinale non richiede alcuna temperatura particolare di conservazione. Per le precauzioni di conservazione dopo la prima apertura, vedere il paragrafo 6.3. La conservazione dei radiofarmaci deve avvenire in conformità con le normative nazionali in materia di prodotti radioattivi. 6.5 Natura e contenuto del contenitore Amyvid è fornito in flaconcini trasparenti di vetro di Tipo I borosilicato da 10 ml o 15 ml con tappi di elastomero clorobutilico rivestito con FluroTec e ghiere di alluminio. Un flaconcino multidose della capacità di 10 ml contiene da 1 a 10 ml di soluzione, corrispondenti a MBq alla data e ora di calibrazione. Un flaconcino multidose della capacità di 15 ml contiene da 1 a 15 ml di soluzione, corrispondenti a MBq alla data e ora di calibrazione. A seguito delle differenze del processo di produzione, è possibile che i flaconcini di alcuni lotti di prodotto siano distribuiti con tappi di gomma forati. Ogni flaconcino è racchiuso in un contenitore schermato di spessore adeguato per minimizzare l esposizione alle radiazioni esterne. Confezione: 1 flaconcino. 6.6 Precauzioni particolari per lo smaltimento e la manipolazione Avvertenza generale: I radiofarmaci devono essere ricevuti, usati e somministrati solo da personale autorizzato all interno di apposite strutture cliniche. Il loro ricevimento, conservazione, uso, trasferimento e smaltimento sono soggetti alle norme e/o alle opportune autorizzazioni rilasciate dalle autorità competenti. I prodotti radiofarmaceutici devono essere preparati secondo modalità che soddisfino i requisiti sia in materia di sicurezza radiologica sia di qualità farmaceutica. Devono essere adottate precauzioni di asepsi appropriate. Se l integrità del flaconcino è compromessa, questo non deve essere usato. Le procedure di somministrazione devono essere eseguite in modo da rendere minimo il rischio di contaminazione del prodotto medicinale e di irradiazione degli operatori. E obbligatoria un adeguata protezione. La somministrazione di radiofarmaci comporta rischi per altre persone (incluso il personale sanitario in stato di gravidanza) dovuti alla radiazione esterna o alla contaminazione per versamento di urine, vomito, etc. Pertanto devono essere adottate le dovute precauzioni di protezione dalle radiazioni in conformità con la normativa locale vigente. 11
12 Il medicinale non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità alla normativa locale vigente. 7. TITOLARE DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO Eli Lilly Nederland B.V., Grootslag 1-5, NL-3991 RA Houten, Paesi Bassi 8. NUMERO(I) DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO 9. DATA DELLA PRIMA AUTORIZZAZIONE/RINNOVO DELL AUTORIZZAZIONE 10. DATA DI REVISIONE DEL TESTO 11. DOSIMETRIA Le dosi calcolate di radiazioni assorbite, da organi e tessuti, da un paziente adulto di corporatura media (70 kg) dopo la somministrazione di 370 MBq di florbetapir ( 18 F) usando i metodi standard per il calcolo della dosimetria (ICRP Volume 30) sono elencate nella tabella di seguito. Non sono state fatte assunzioni sullo svuotamento della vescica. Dose assorbita per attività somministrata (µgy/mbq) Organo/tessuto Media Ghiandole surrenali 13,6 Cervello 10,0 Mammelle 6,2 Parete della colecisti 143,0 Parete dell intestino crasso inferiore 27,8 Intestino tenue 65,5 Parete dello stomaco 11,7 Parete dell intestino crasso superiore 74,4 Parete del cuore 12,7 Reni 13,0 Fegato 64,4 Polmoni 8,5 Muscoli 8,6 Ovaie 17,6 Pancreas 14,4 Midollo osseo 14,3 Cellule osteogeniche 27,6 Cute 5,9 Milza 8,9 Testicoli 6,8 Timo 7,3 Tiroide 6,8 Parete della vescica 27,1 Utero 15,6 Corpo in toto 11,6 Dose Efficace [µsv/mbq] a 18,6 a Coefficiente di qualità (Q) assunto pari a 1 per la conversione dalla dose assorbita alla dose efficace di 18 F. 12
13 La dose efficace che risulta dalla somministrazione di una dose di 370 MBq per un adulto che pesa 70 kg è circa 7 msv. Se contemporaneamente viene eseguita una scansione TC come parte della procedura della PET, l esposizione alla radiazione ionizzante aumenterà in misura dipendente dalle impostazioni utilizzate per l acquisizione della TC. Per un attività somministrata di 370 MBq, la dose di radiazioni standard erogata all organo target (cervello) è 3,7 mgy. Per un attività somministrata di 370 MBq, le dosi di radiazioni standard erogate agli organi critici, colecisti, parete dell intestino crasso superiore, parete dell intestino crasso inferiore, intestino tenue e fegato sono state rispettivamente 53 mgy, 27,5 mgy, 10,3 mgy, 24,2 mgy e 23,8 mgy. 12. ISTRUZIONI PER LA PREPARAZIONE DI RADIOFARMACI Metodo di preparazione La confezione deve essere controllata prima dell uso e l attività misurata usando un calibratore di dose. I prelievi devono essere eseguiti in condizioni asettiche. I flaconcini non devono essere aperti prima di aver disinfettato il tappo, la soluzione deve essere prelevata attraverso il tappo utilizzando una siringa monodose dotata di un adeguata schermatura di protezione e un ago sterile monouso oppure utilizzando un sistema automatico di somministrazione autorizzato. Devono essere usate solamente siringhe di propilene/hdpe. Se l integrità del flaconcino è compromessa, il prodotto non deve essere usato. Amyvid può essere diluito in condizioni asettiche con una soluzione iniettabile di cloruro di sodio 9 mg/ml (0,9%) fino a una diluizione massima di 1:5. Il prodotto diluito deve essere usato entro 4 ore dalla diluizione. Controllo qualità La soluzione deve essere controllata visivamente prima della somministrazione. Devono essere usate solo soluzioni limpide, senza particelle visibili. Informazioni più dettagliate su questo medicinale sono disponibili sul sito web della Agenzia europea dei medicinali: 13
14 1. DENOMINAZIONE DEL MEDICINALE Amyvid 1900 MBq/ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml di soluzione iniettabile contiene 1900 MBq di florbetapir ( 18 F) alla data e ora di calibrazione (ToC, Time of Calibration). L attività per flaconcino varia da 1900 MBq a MBq alla data e ora di calibrazione. Il fluoro ( 18 F) decade in ossigeno stabile ( 18 O) con un emivita di circa 110 minuti emettendo una radiazione di positroni di 634 kev, seguita da radiazione da annichilazione fotonica di 511 kev. Eccipienti con effetti noti: Questo medicinale contiene 79 mg/ml di etanolo e fino a 37 mg di sodio. Per l elenco completo degli eccipienti, vedere paragrafo FORMA FARMACEUTICA Soluzione iniettabile. Soluzione limpida incolore. 4. INFORMAZIONI CLINICHE 4.1 Indicazioni terapeutiche Medicinale solo per uso diagnostico. Amyvid è un radiofarmaco indicato per rilevare con la tomografia ad emissione di positroni (PET) le immagini della densità delle placche neuritiche di β-amiloide nel cervello di pazienti adulti con decadimento cognitivo che vengono valutati per la malattia di Alzheimer (AD) e altre cause di decadimento cognitivo. Amyvid deve essere usato congiuntamente alla valutazione clinica. Una scansione negativa indica la presenza di poche placche o l assenza di placche, il che non è coerente con una diagnosi di AD. Per i limiti nell interpretazione di una scansione positiva vedere i paragrafi 4.4 e Posologia e modo di somministrazione Una scansione PET con florbetapir deve essere richiesta da medici con esperienza nella gestione clinica delle patologie neurodegenerative. Le immagini ottenute con Amyvid devono essere interpretate solo da valutatori che hanno effettuato un training su come interpretare le immagini della PET con florbetapir ( 18 F). Nei casi in cui con la scansione PET è difficile localizzare la sostanza grigia e il margine della sostanza bianca/grigia, si raccomanda un esame recente con tomografia computerizzata (TC) o con risonanza magnetica (RM), co-registrato con l esame PET, per ottenere un immagine combinata PET-TC o PET-RM (vedere il paragrafo 4.4 Interpretazione delle immagini). Posologia L attività raccomandata per un adulto che pesa 70 kg è 370 MBq di florbetapir ( 18 F). Il volume dell iniezione non deve essere inferiore a 1 ml e non superare 10 ml. 14
15 Popolazioni speciali Pazienti anziani Non è raccomandato un aggiustamento della dose in base all età. Insufficienza renale ed epatica E necessaria una valutazione attenta dell attività da somministrare perché in questi pazienti è possibile che l esposizione alle radiazioni risulti maggiore. Vedere il paragrafo 4.4. Non sono stati eseguiti studi estesi per determinare il range o l aggiustamento della dose con questo medicinale nelle popolazioni normali e speciali. Le farmacocinetiche di florbetapir ( 18 F) in pazienti con insufficienza renale o epatica non sono state caratterizzate. Popolazione pediatrica Non c è un uso rilevante di Amyvid nella popolazione pediatrica. Modo di somministrazione Per uso endovenoso. Per uso multidose. L attività di florbetapir ( 18 F) deve essere misurata con un calibratore di dose immediatamente prima dell iniezione. La dose è somministrata per iniezione endovenosa in bolo, seguita da un lavaggio con una soluzione iniettabile di cloruro di sodio 9 mg/ml (0,9%) per assicurare la somministrazione completa della dose. L iniezione di Amyvid attraverso un catetere endovenoso corto (approssimativamente di 4 cm o meno) minimizza il potenziale assorbimento del principio attivo da parte del catetere. L'iniezione di florbetapir ( 18 F) deve essere endovenosa per evitare l irradiazione dovuta a travaso locale, così come la rilevazione di immagini artefatte. Acquisizione delle immagini Un immagine PET di 10 minuti deve essere acquisita circa minuti dopo l iniezione endovenosa di Amyvid. I pazienti devono stare supini con la testa posizionata in modo tale da centrare il cervello, incluso il cervelletto, nel campo visivo dello scanner della PET. Per ridurre il movimento della testa possono essere impiegati un nastro o altri poggiatesta flessibili. La ricostruzione deve includere la correzione per l attenuazione per avere pixel transassiali delle dimensioni comprese tra 2,0 e 3,0 mm. 4.3 Controindicazioni Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo Avvertenze speciali e precauzioni di impiego Giustificazione di un rapporto beneficio/rischio individuale Per ogni paziente l esposizione a radiazioni deve essere giustificata sulla base dei possibili benefici. L attività somministrata deve, in ogni caso, essere la più bassa possibile per ottenere le informazioni diagnostiche richieste. Insufficienza renale e insufficienza epatica Per questi pazienti è necessaria un attenta valutazione del rapporto beneficio/rischio poiché è possibile che l esposizione alle radiazioni risulti aumentata. Florbetapir ( 18 F) è escreto principalmente attraverso il sistema epatobiliare e per i pazienti con insufficienza epatica esiste la possibilità di un aumentata esposizione alle radiazioni. Vedere anche il paragrafo
16 Popolazione pediatrica Per informazioni sull uso nella popolazione pediatrica, vedere i paragrafi 4.2 o 5.1. Interpretazione delle immagini con Amyvid Le immagini con Amyvid devono essere interpretate solo da valutatori che hanno effettuato il training su come interpretare le immagini della PET con florbetapir ( 18 F). Una scansione negativa indica una densità scarsa o assente di placche neuritiche corticali di ß-amiloide. Una scansione positiva indica una densità da moderata a frequente. Sono stati osservati errori di interpretazione dell immagine nella valutazione della densità delle placche neuritiche cerebrali di β-amiloide, inclusi dei falsi negativi. La valutazione delle immagini deve essere eseguita principalmente nell orientamento transassiale e, quando necessario, anche sui piani sagittale e coronale. Si raccomanda che la valutazione delle immagini includa tutte le sezioni transassiali del cervello usando una scala in bianco e nero con l intensità massima della scala impostata alla massima intensità di pixel su tutto il cervello. L interpretazione dell immagine come negativa o positiva viene effettuata confrontando visivamente l attività della sostanza grigia corticale con l attività della sostanza bianca corticale adiacente (vedere la Figura 1). Scansioni negative hanno più attività nella sostanza bianca che nella sostanza grigia, creando un evidente contrasto grigio-bianco. Scansioni positive avranno: a) Due o più aree del cervello (ciascuna più larga di una singola circonvoluzione corticale) in cui il contrasto grigio-bianco è ridotto o assente. Questo è il modo in cui appare più comunemente una scansione positiva. b) Una o più aree in cui l attività della sostanza grigia è intensa e supera in modo evidente l attività della sostanza bianca adiacente. 16
17 Figura 1: Immagini PET con Amyvid che mostrano esempi di scansioni negative (le due righe in alto) e di scansioni positive (le due righe in basso). Le figure da sinistra a destra mostrano le immagini PET relative alla sezione sagittale, coronale e trasversale. L ultima figura a destra mostra l immagine ingrandita dell area del cervello evidenziata nel rettangolo. Le due frecce in alto indicano il normale contrasto grigio-bianco preservato con un attività corticale inferiore a quella della sostanza bianca adiacente. Le due frecce in basso indicano aree con un ridotto contrasto grigio-bianco e un aumentata attività corticale che è paragonabile all attività della sostanza bianca adiacente. Limitazioni di utilizzo Una scansione positiva non è sufficiente da sola a stabilire una diagnosi di AD o di un altro disturbo cognitivo poiché nei pazienti anziani asintomatici e in alcune demenze neurodegenerative (AD, demenza da corpi di Lewy, demenza da malattia di Parkinson) possono essere presenti depositi di placche neuritiche nella sostanza grigia. Per le limitazioni di utilizzo nei pazienti con deterioramento cognitivo lieve (MCI), vedere il paragrafo 5.1. L efficacia di Amyvid nel prevedere lo sviluppo di AD o monitorare la risposta alla terapia non è stata stabilita (vedere il paragrafo 5.1). Alcune scansioni possono essere di difficile interpretazione a causa del rumore di fondo dell immagine, della marcata atrofia con assottigliamento corticale o dell immagine sfocata che possono portare ad errori di interpretazione. Nei casi in cui è difficile individuare con le scansioni PET la sede della sostanza grigia e il margine della sostanza bianca/grigia, ed è disponibile un immagine recente di TC o di RM registrata 17
18 contemporaneamente all esame PET, chi effettua l interpretazione deve esaminare l immagine combinata della PET-TC o della PET-RM per chiarire la correlazione tra il reperto della PET e l anatomia della sostanza grigia. In alcuni casi è stata identificata un aumentata captazione in strutture extracerebrali quali le ghiandole salivali, la cute, i muscoli e le ossa (vedere il paragrafo 5.2). L esame delle immagini sagittali e le immagini della TC o della RM registrate contemporaneamente possono aiutare a distinguere l osso occipitale dalla sostanza grigia occipitale. Dopo l esame Nelle prime 24 ore successive all iniezione, il contatto ravvicinato con bambini e donne in gravidanza deve essere limitato. Avvertenze specifiche Il contenuto di sodio è superiore a 1 mmol (fino a 37 mg per dose). Questo deve essere tenuto in considerazione nei pazienti con una dieta a basso contenuto di sodio. Questo medicinale contiene 10 vol % di etanolo (alcol), cioè fino a 790 mg per dose, equivalenti a 20 ml di birra o 8 ml di vino per dose. Questa quantità può essere dannosa per chi soffre di alcolismo e ciò deve essere tenuto in considerazione nelle donne in gravidanza e che stanno allattando e nei gruppi ad alto rischio come i pazienti con malattia epatica o epilessia. 4.5 Interazioni con altri medicinali ed altre forme di interazione Non sono stati effettuati studi di interazione in vivo. Studi di legame in vitro non hanno mostrato interferenze del legame di florbetapir ( 18 F) alle placche di ß- amiloide in presenza degli altri medicinali comunemente assunti dai pazienti con AD. 4.6 Fertilità, gravidanza e allattamento Donne potenzialmente fertili Quando è prevista la somministrazione di radiofarmaci ad una donna potenzialmente fertile, è importante determinare se è o non è in stato di gravidanza. Ove non sia provato il contrario, qualsiasi donna che abbia saltato un ciclo mestruale deve essere considerata in stato di gravidanza. In caso di dubbi riguardo ad una possibile gravidanza (se la donna ha saltato un ciclo mestruale, se il ciclo mestruale è molto irregolare, etc.), devono essere proposte alla paziente tecniche alternative che non utilizzino radiazioni ionizzanti (qualora ve ne siano). Gravidanza Le metodiche che utilizzano radionuclidi impiegate su donne in stato di gravidanza generano radiazioni che coinvolgono il feto. Pertanto, durante la gravidanza devono essere eseguiti soltanto gli esami ritenuti essenziali, quando il probabile beneficio supera di gran lunga il rischio per la madre e per il feto. Non sono stati condotti studi nelle donne in stato di gravidanza. Non sono stati eseguiti studi negli animali per valutare gli effetti di florbetapir ( 18 F) sulla riproduzione (vedere il paragrafo 5.3). Allattamento Non è noto se florbetapir ( 18 F) sia escreto nel latte umano durante l allattamento. Prima della somministrazione di radiofarmaci a una madre che sta allattando al seno si deve valutare la possibilità di ritardare la somministrazione del radionuclide fino a quando la madre abbia terminato l allattamento al seno e considerare se sia stato scelto il radiofarmaco più appropriato tenendo presente l eliminazione di attività nel latte materno. Se la somministrazione è ritenuta necessaria, l allattamento deve essere interrotto per 24 ore e il latte prodotto deve essere eliminato. 18
19 Nelle prime 24 ore successive all iniezione, il contatto ravvicinato con bambini deve essere limitato. Fertilità Non sono stati effettuati studi sulla fertilità. 4.7 Effetti sulla capacità di guidare veicoli e sull uso di macchinari Non pertinente. 4.8 Effetti indesiderati Riassunto del profilo di sicurezza Le reazioni avverse sono state raccolte negli studi clinici che hanno coinvolto 555 soggetti con 665 somministrazioni di Amyvid soluzione iniettabile. Non sono state riportate reazioni avverse gravi correlate alla somministrazione di Amyvid. Elenco delle reazioni avverse La frequenza è definita come molto comune ( 1/10), comune ( 1/100, <1/10), non comune ( 1/1.000, <1/100), raro ( 1/10.000, <1/1.000), molto raro (<1/10.000), non nota (la frequenza non può essere definita sulla base dei dati disponibili). Nella realtà le reazioni avverse potrebbero verificarsi con una frequenza anche inferiore a quella riportata di seguito, ma la dimensione del database da cui sono stati ottenuti i dati non ha permesso di assegnare le categorie di frequenza inferiore alla categoria non comune ( 1/1.000, <1/100). Patologie del sistema nervoso Comuni: cefalea Non comuni: disgeusia Patologie vascolari Non comuni: vampate di calore Patologie gastrointestinali Non comuni: nausea Patologie della cute e del tessuto sottocutaneo Non comuni: prurito, orticaria Patologie sistemiche e condizioni relative alla sede di somministrazione Non comuni: rash a livello del sito di infusione L'esposizione alle radiazioni ionizzanti è correlata all'induzione di cancro e al potenziale sviluppo di difetti ereditari. Poiché, quando viene somministrata l'attività raccomandata di 370 MBq di florbetapir ( 18 F), la dose efficace è 7 msv, queste reazioni avverse sono attese con una bassa probabilità. 4.9 Sovradosaggio Data la piccola quantità di florbetapir ( 18 F) in ogni dose, il sovradosaggio non dovrebbe provocare effetti farmacologici. Nel caso di somministrazione di un sovradosaggio di radiazioni, la dose assorbita dal paziente deve essere ridotta se possibile aumentando l eliminazione del radionuclide dal corpo con una frequente minzione e defecazione. Potrebbe essere utile calcolare la dose efficace che è stata impiegata. 19
20 5. PROPRIETÀ FARMACOLOGICHE 5.1 Proprietà farmacodinamiche Categoria farmacoterapeutica: radiofarmaceutici diagnostici, sistema nervoso centrale, Codice ATC: V09AX05. Meccanismo d azione Florbetapir ( 18 F) si lega alle placche neuritiche di ß-amiloide. Gli studi di legame che usano i tradizionali metodi di colorazione neuropatologica su cervelli con AD post-mortem hanno dimostrato una correlazione statisticamente significativa (p < ) tra il legame di florbetapir ( 18 F) in vitro e il deposito di aggregati ß- amiloidi. In vivo, la correlazione tra la captazione di florbetapir ( 18 F) nella sostanza grigia corticale e la quantità totale di ß-amiloide è stata valutata in pazienti in fin di vita usando l anticorpo anti-amiloide 4G8 che evidenzia la ß-amiloide trovata sia nelle placche neuritiche che diffuse. Il legame in vivo di florbetapir ( 18 F) ad altre strutture ß-amiloidi o ad altre strutture o recettori cerebrali rimane sconosciuto. Effetti farmacodinamici Alle basse concentrazioni chimiche presenti in Amyvid, florbetapir ( 18 F) non ha una attività farmacologica rilevabile. Negli studi clinici completati, la captazione di florbetapir ( 18 F) in 6 aree corticali predefinite del cervello (precuneo, frontale, cingolato anteriore, cingolato posteriore, parietale e temporale) è stata misurata quantitativamente usando come indice il valore di captazione standardizzato (SUV, Standardised Uptake Value). I rapporti medi dei SUV corticali (SUVR, relativi al cervelletto) sono più alti nei pazienti con AD rispetto a quelli dei soggetti volontari sani. I valori medi dei SUVR corticali rispetto a quelli cerebellari nei pazienti con AD mostrano sostanziali aumenti continui dal tempo zero nei 30 minuti dopo la somministrazione e successivamente, con solo delle piccole variazioni, fino a 90 minuti dopo la somministrazione. Non sono state notate differenze nei risultati in termini di SUVR nei soggetti che assumevano i comuni trattamenti per l AD rispetto a quelli che non li assumevano. Efficacia clinica E stato eseguito uno studio pivotal su 59 pazienti in fin di vita con l obiettivo di stabilire la performance diagnostica di Amyvid nel rilevare la densità delle placche neuritiche corticali (densità assente o scarsa vs densità moderata o frequente). I risultati della PET sono stati confrontati con la più alta densità di placche neuritiche misurata sulle sezioni della corteccia frontale, temporale o parietale di pazienti sottoposti ad autopsia nei 24 mesi successivi alla scansione PET. Non è stato possibile misurare in modo affidabile lo stato cognitivo dei soggetti. In tutti i 59 soggetti, la valutazione della PET in cieco da parte di 5 medici nucleari ha dato come risultato nella maggior parte dei casi una sensibilità di lettura del 92% (95% IC: 78-98%) e una specificità del 100% (95% IC: %). In uno studio su 47 volontari sani giovani (di età inferiore a 40 anni), che si presumeva essere privi di depositi ß-amiloidi, tutte le scansioni PET con Amyvid sono state negative. La sensibilità e la specificità di Amyvid nel rilevare la densità delle placche neuritiche corticali sono state ulteriormente valutate in due altri studi in cui differenti gruppi di valutatori hanno interpretato le immagini di alcuni soggetti poi sottoposti ad esame autoptico nello studio pivotal. I risultati di questi studi sono stati analoghi ai risultati ottenuti nello studio pivotal. La consistenza tra i valutatori, usando valori della kappa di Fleiss, variava da 0.75 a In uno studio longitudinale, 142 soggetti (con diagnosi clinica di MCI, AD o cognitivamente normali) sono stati sottoposti alle scansioni PET con florbetapir ( 18 F) all inizio dello studio e poi sono stati seguiti per 3 anni per valutare la relazione tra le immagini ottenute con Amyvid e le variazioni dello stato diagnostico. 20
21 I valori di performance diagnostica della PET con florbetapir ( 18 F) sono riportati nella tabella di seguito: Accordo con la diagnosi di MCI all inizio dello studio Accordo con la diagnosi di di AD clinicamente manifesta all inizio dello studio N=51 N=31 Sensibilità 19/51 = 37,3% (95% IC: 24,1-51,9%) 21/31 = 67,7% (95% IC: 51,3-84,2%) Specificità Utilizzando casi non-mci (cognitivamente normali & con AD clinicamente manifesta) 69/100 = 69,0% (95% IC: 59,9-78,1%) Utilizzando casi non-ad (cognitivamente normali & con MCI) 91/120 = 75,8% (95% IC: 68,2-83,5%) Quoziente di probabilità positivo 1.20 (95% IC: ) 2.80 (95% CI: ) Dei pazienti che all inizio dello studio avevano avuto una diagnosi clinica di MCI, 9 (19%) sono passati ad AD clinicamente manifesta dopo 36 mesi. Dei 17 pazienti con MCI che hanno avuto una scansione PET positiva, 6 (35%) hanno avuto una diagnosi di probabile AD clinicamente manifesta dopo 36 mesi rispetto a 3 (10%) dei 30 pazienti che hanno avuto una scansione negativa. La sensibilità della scansione con Amyvid nel rilevare la percentuale di passaggio da MCI ad AD nei 9 pazienti è stata del 66,7% (95% IC: 35-88%), la specificità nei 38 pazienti che non hanno avuto questa evoluzione è stata del 71,0% (95% IC: 55-83%) e il quoziente di probabilità positivo è stato di 2.31 (95% IC: %). Il disegno di questo studio non permette di stimare il rischio di evoluzione da MCI ad AD clinicamente manifesta. Popolazione pediatrica L Agenzia europea dei medicinali ha previsto l esonero dall obbligo di presentare i risultati degli studi con Amyvid in tutti i sottogruppi della popolazione pediatrica poiché non è indicato per l uso nella popolazione pediatrica. 5.2 Proprietà farmacocinetiche Distribuzione Florbetapir ( 18 F) si distribuisce nell organismo entro alcuni minuti dall iniezione e poi è rapidamente metabolizzato. Captazione a livello degli organi La massima captazione di florbetapir ( 18 F) a livello encefalico si verifica entro alcuni minuti dall iniezione, seguita da una rapida clearance a livello encefalico nei primi 30 minuti successivi all iniezione. Gli organi di maggiore esposizione sono gli organi di eliminazione, principalmente la colecisti, il fegato e l intestino. I soggetti di controllo sani mostrano livelli di accumulo relativamente bassi di florbetapir ( 18 F) a livello della corteccia e del cervelletto. Analisi regionali mostrano livelli leggermente più alti di accumulo nel caudato, nel putamen e nell ippocampo. Il livello più alto di captazione si verifica nelle regioni composte principalmente da sostanza bianca (ponte e centro semiovale). Nei soggetti con AD, le regioni corticali e il putamen mostrano una captazione significativamente maggiore rispetto ai soggetti di controllo. Nei soggetti con AD, come nei soggetti di controllo, c è un ridotto accumulo nel cervelletto e nell ippocampo e un elevato accumulo nel ponte e nel centro semiovale. Le basi biofisiche dell accumulo di florbetapir ( 18 F) nella sostanza bianca del cervello umano vivente non possono essere ancora del tutto spiegate. Si ipotizza che una clearance inferiore del radiofarmaco possa contribuire all accumulo nella sostanza bianca poiché il flusso ematico cerebrale regionale nella sostanza bianca è meno della metà di quello nella corteccia. In alcuni casi è stata identificata un aumentata captazione in strutture extracerebrali quali il cuoio capelluto, le ghiandole salivali, i muscoli e le ossa del cranio. La 21
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE REKORD B12 polvere e solvente per sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il tappo contiene: Principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE REKORD B12 polvere e solvente per sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il tappo contiene: Principi attivi:
Contiene il virus vivo attenuato ceppo Oka/Merck Contiene il virus vivo attenuato ceppo Oka Tra +2 e +8 Tra +2 e +8
 Varivax Varilrix Ditta Sanofi Pasteur MSD GlaxoSmithKline Ceppo virus varicella Temperatura di conservazione Immunogenicità Inizio della risposta immunitaria Durata della risposta immunitaria Efficacia
Varivax Varilrix Ditta Sanofi Pasteur MSD GlaxoSmithKline Ceppo virus varicella Temperatura di conservazione Immunogenicità Inizio della risposta immunitaria Durata della risposta immunitaria Efficacia
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
Foglio illustrativo: informazioni per l utilizzatore. NEOMERCUROCROMO soluzione cutanea. Eosina/ Cloroxilenolo/ Propilenglicole
 Foglio illustrativo: informazioni per l utilizzatore NEOMERCUROCROMO soluzione cutanea Eosina/ Cloroxilenolo/ Propilenglicole Legga attentamente questo foglio prima di usare questo medicinale perchè contiene
Foglio illustrativo: informazioni per l utilizzatore NEOMERCUROCROMO soluzione cutanea Eosina/ Cloroxilenolo/ Propilenglicole Legga attentamente questo foglio prima di usare questo medicinale perchè contiene
Presentazione dei dati
 Presentazione dei dati Per ogni principio attivo, per il quale è stato possibile reperire informazioni riguardanti il passaggio nel latte materno, è stata creata una scheda monografica con informazioni
Presentazione dei dati Per ogni principio attivo, per il quale è stato possibile reperire informazioni riguardanti il passaggio nel latte materno, è stata creata una scheda monografica con informazioni
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 25 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 25 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
20/04/2015. Retrospettivi Caso-controllo. Prospettici Per Coorte
 OSSERVAZIONALI DATI AGGREGATI DATI INDIVIDUALI ECOLOGICI TRASVERSALI ANALITICI CASO-CONTROLLO PER COORTE malattia Retrospettivi Caso-controllo studio malattia Prospettici Per Coorte Un gruppo di persone
OSSERVAZIONALI DATI AGGREGATI DATI INDIVIDUALI ECOLOGICI TRASVERSALI ANALITICI CASO-CONTROLLO PER COORTE malattia Retrospettivi Caso-controllo studio malattia Prospettici Per Coorte Un gruppo di persone
TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE
 FARMACOVIGILANZA TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono
FARMACOVIGILANZA TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
Informazioni da apporre sull etichetta {Tubo in polipropilene} 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN TERMINI DI PRINCIPIO ATTIVO
 Etichettatura: Informazioni da apporre sull etichetta {Tubo in polipropilene} 1. DENOMINAZIONE DEL MEDICINALE 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN TERMINI DI PRINCIPIO ATTIVO Ciascuna compressa
Etichettatura: Informazioni da apporre sull etichetta {Tubo in polipropilene} 1. DENOMINAZIONE DEL MEDICINALE 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN TERMINI DI PRINCIPIO ATTIVO Ciascuna compressa
MEDICINALI BIOEQUIVALENTI E BIOSIMILARI. Dipartimento Farmaceutico Interaziendale Azienda Ospedaliero Universitaria di Ferrara
 MEDICINALI BIOEQUIVALENTI E BIOSIMILARI Dipartimento Farmaceutico Interaziendale Azienda Ospedaliero Universitaria di Ferrara FARMACO GENERICO e EQUIVALENTE Con la Legge 28/12/1995 art. 130 comma 3, il
MEDICINALI BIOEQUIVALENTI E BIOSIMILARI Dipartimento Farmaceutico Interaziendale Azienda Ospedaliero Universitaria di Ferrara FARMACO GENERICO e EQUIVALENTE Con la Legge 28/12/1995 art. 130 comma 3, il
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Documento reso disponibile da AIFA il 10/06/2016 1. DENOMINAZIONE DEL MEDICINALE OMKASA 1mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Documento reso disponibile da AIFA il 10/06/2016 1. DENOMINAZIONE DEL MEDICINALE OMKASA 1mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Figura 1 Distrofia simpatico riflessa:
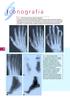 I conografia Figura 1 istrofia simpatico riflessa: alterazioni radiografiche.,. Quest uomo di 65 anni ha presentato dolore e tumefazione alla mano dopo un lieve trauma. Nella prima radiografia () si rileva
I conografia Figura 1 istrofia simpatico riflessa: alterazioni radiografiche.,. Quest uomo di 65 anni ha presentato dolore e tumefazione alla mano dopo un lieve trauma. Nella prima radiografia () si rileva
Disegni di studio nella ricerca epidemiologica
 Disegni di studio nella ricerca epidemiologica Dott. Pamela Di Giovanni Disegni epidemiologici La ricerca epidemiologica utilizza, per i suoi scopi, diverse strategie di studio che vengono distinte in
Disegni di studio nella ricerca epidemiologica Dott. Pamela Di Giovanni Disegni epidemiologici La ricerca epidemiologica utilizza, per i suoi scopi, diverse strategie di studio che vengono distinte in
Uso dei farmaci e allattamento al seno
 Uso dei farmaci e allattamento al seno Serve un attitudine positiva da parte degli operatori sanitari R&P 2015; 31: 171-187 La Società Italiana di Medicina Perinatale ha elaborato un consensus statement
Uso dei farmaci e allattamento al seno Serve un attitudine positiva da parte degli operatori sanitari R&P 2015; 31: 171-187 La Società Italiana di Medicina Perinatale ha elaborato un consensus statement
Fonti di alcol nella dieta
 ETANOLO - ALCOL Definita «sostanza non nutriente di interesse nutrizionale» perché nella tradizione alimentare del nostro paese è presente il consumo di una bevanda alcoolica (vino) Occorre ricordare che
ETANOLO - ALCOL Definita «sostanza non nutriente di interesse nutrizionale» perché nella tradizione alimentare del nostro paese è presente il consumo di una bevanda alcoolica (vino) Occorre ricordare che
Il significato degli esami di coagulazione. Walter Ageno
 Il significato degli esami di coagulazione Walter Ageno Principali caratteristiche dei nuovi anticoagulanti Via orale di somministrazione Ampia finestra terapeutica Farmacocinetica e farmacodinamica prevedibili
Il significato degli esami di coagulazione Walter Ageno Principali caratteristiche dei nuovi anticoagulanti Via orale di somministrazione Ampia finestra terapeutica Farmacocinetica e farmacodinamica prevedibili
Gravidanza o no? Patient Diagnostics Test Rapidi della Progettazione Familiare
 Gravidanza o no? Patient Diagnostics Test Rapidi della Progettazione Familiare Gli unici test a domicilio per la pianificazione familiare Test di ovulazione Test precoce di gravidanza Test di gravidanza
Gravidanza o no? Patient Diagnostics Test Rapidi della Progettazione Familiare Gli unici test a domicilio per la pianificazione familiare Test di ovulazione Test precoce di gravidanza Test di gravidanza
Nota Informativa Importante. Guida alla Terapia per i Paziente. Guida alla Contraccezione. Modulo d'informazione e Consenso Informato
 AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
Livello di benessere organizzativo, grado di condivisione del sistema di valutazione e valutazione del superiore gerarchico
 Livello di benessere organizzativo, grado di condivisione del sistema di valutazione e valutazione del superiore gerarchico Sintesi dei risultati dell indagine 2013 svolta sul personale della Camera di
Livello di benessere organizzativo, grado di condivisione del sistema di valutazione e valutazione del superiore gerarchico Sintesi dei risultati dell indagine 2013 svolta sul personale della Camera di
4. Informazioni cliniche 4.1 Indicazioni terapeutiche VECTAVIR LABIALE è indicato per il trattamento dell'herpes labialis.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. Denominazione del medicinale VECTAVIR LABIALE 1% crema 2. Composizione qualitativa e quantitativa Ogni grammo di crema contiene 10 mg di penciclovir Eccipienti
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. Denominazione del medicinale VECTAVIR LABIALE 1% crema 2. Composizione qualitativa e quantitativa Ogni grammo di crema contiene 10 mg di penciclovir Eccipienti
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. Octreoscan viene fornito in due flaconcini che non possono essere utilizzati separatamente.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Octreoscan Kit per preparazione radiofarmaceutica di In-pentetreotide, MBq/mL 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Octreoscan
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Octreoscan Kit per preparazione radiofarmaceutica di In-pentetreotide, MBq/mL 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Octreoscan
Dottor LOMUSCIO Giuseppe Responsabile di Struttura Semplice Dipartimentale UO Medicina Nucleare - Azienda Ospedaliera BUSTO ARSIZIO - Varese
 Dottor LOMUSCIO Giuseppe Responsabile di Struttura Semplice Dipartimentale UO Medicina Nucleare - Azienda Ospedaliera BUSTO ARSIZIO - Varese L adesione alle Linee Guida NON sarà assicurare al Paziente
Dottor LOMUSCIO Giuseppe Responsabile di Struttura Semplice Dipartimentale UO Medicina Nucleare - Azienda Ospedaliera BUSTO ARSIZIO - Varese L adesione alle Linee Guida NON sarà assicurare al Paziente
Foglio illustrativo: informazioni per il paziente. Lyseen 4 mg compresse Lyseen 2 mg/ml soluzione iniettabile pridinolo mesilato
 Foglio illustrativo: informazioni per il paziente pridinolo mesilato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei. - Conservi questo
Foglio illustrativo: informazioni per il paziente pridinolo mesilato Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per lei. - Conservi questo
andate, insegnate, guarite.
 andate, insegnate, guarite. Fondazione Istituto San Raffaele G.Giglio di Cefalù Servizio di Medicina Nucleare Servizio accoglienza: 0921 920553 Centro prenotazioni: 0921 920564 Servizio di Medicina Nucleare:
andate, insegnate, guarite. Fondazione Istituto San Raffaele G.Giglio di Cefalù Servizio di Medicina Nucleare Servizio accoglienza: 0921 920553 Centro prenotazioni: 0921 920564 Servizio di Medicina Nucleare:
APIVAR. Riassunto delle caratteristiche del prodotto
 APIVAR Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO APIVAR 500 mg strisce per alveare per api. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una striscia per alveare
APIVAR Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO APIVAR 500 mg strisce per alveare per api. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una striscia per alveare
Epidemiologia della tubercolosi in Italia (anni )
 Epidemiologia della tubercolosi in Italia (anni 1995 2005) Prefazione Il sistema di notifica della tubercolosi, elemento indispensabile al programma di controllo della malattia stessa, ha tra gli obiettivi
Epidemiologia della tubercolosi in Italia (anni 1995 2005) Prefazione Il sistema di notifica della tubercolosi, elemento indispensabile al programma di controllo della malattia stessa, ha tra gli obiettivi
AGGIORNAMENTI SULLA Vitamina D
 AGGIORNAMENTI SULLA Vitamina D Approviggionamento di Vitamin D Livelli di vitamina D nel sangue Metabolismo Vitamina D e mortalità VitaminaD e fratture Vitamina D e cancro Vitamina D ed altre patologie
AGGIORNAMENTI SULLA Vitamina D Approviggionamento di Vitamin D Livelli di vitamina D nel sangue Metabolismo Vitamina D e mortalità VitaminaD e fratture Vitamina D e cancro Vitamina D ed altre patologie
AMPICILLINA SODICA PREPARAZIONE INIETTABILE. Ampicillina sodica polvere sterile per preparazioni iniettabili
 1 0 1 0 1 0 1 0 1 001/FU Aprile 00 Commenti entro il Settembre 00 NOTA: Armonizzata con la versione revisionata della B.P. La monografia è stata completamente revisionata per armonizzarla con le corrispondenti
1 0 1 0 1 0 1 0 1 001/FU Aprile 00 Commenti entro il Settembre 00 NOTA: Armonizzata con la versione revisionata della B.P. La monografia è stata completamente revisionata per armonizzarla con le corrispondenti
Foglio illustrativo: informazioni per l utilizzatore
 Foglio illustrativo: informazioni per l utilizzatore POTASSIO CLORURO MONICO 2 meq/ml concentrato per soluzione per infusione 3 meq/ml concentrato per soluzione per infusione Potassio cloruro Medicinale
Foglio illustrativo: informazioni per l utilizzatore POTASSIO CLORURO MONICO 2 meq/ml concentrato per soluzione per infusione 3 meq/ml concentrato per soluzione per infusione Potassio cloruro Medicinale
Test tecnico per culture starter di batteri lattici 2012
 Test tecnico per culture starter di batteri lattici 2012 Il presente rapporto contiene l esame tecnico per culture STARTER di batteri lattici per la fermentazione malolattica. Lo scopo non è quello di
Test tecnico per culture starter di batteri lattici 2012 Il presente rapporto contiene l esame tecnico per culture STARTER di batteri lattici per la fermentazione malolattica. Lo scopo non è quello di
Importanza delle incertezze nelle misure fisiche
 Importanza delle incertezze nelle misure fisiche La parola errore non significa equivoco o sbaglio Essa assume il significato di incertezza da associare alla misura Nessuna grandezza fisica può essere
Importanza delle incertezze nelle misure fisiche La parola errore non significa equivoco o sbaglio Essa assume il significato di incertezza da associare alla misura Nessuna grandezza fisica può essere
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OLEVIA 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una capsula molle contiene 1000 mg di Acidi omega-3
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OLEVIA 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una capsula molle contiene 1000 mg di Acidi omega-3
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. L'attività specifica del Samario è di circa MBq/µg di Samario
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE QUADRAMET, soluzione iniettabile. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascun ml di soluzione contiene 1,3 GBq di Samario
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE QUADRAMET, soluzione iniettabile. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascun ml di soluzione contiene 1,3 GBq di Samario
Gli errori di terapia: approccio alla problematica e studi internazionali
 Gli errori di terapia: approccio alla problematica e studi internazionali SICUREZZA DEL PAZIENTE E GESTIONE DEL RISCHIO CLINICO Ancona 15.03.2010 I.N.R.C.A. Ancona RACCOMANDAZIONI USO POTASSIO CONCENTRATO
Gli errori di terapia: approccio alla problematica e studi internazionali SICUREZZA DEL PAZIENTE E GESTIONE DEL RISCHIO CLINICO Ancona 15.03.2010 I.N.R.C.A. Ancona RACCOMANDAZIONI USO POTASSIO CONCENTRATO
Informazioni per il PAZIENTE Scintigrafia Totale Corporea e/o polmonare con traccianti positivi cod
 Informazioni per il PAZIENTE Scintigrafia Totale Corporea e/o polmonare con traccianti positivi cod. 92.15.4 Che cosa è la scintigrafia polmonare con traccianti positivi? E un esame che si propone di studiare
Informazioni per il PAZIENTE Scintigrafia Totale Corporea e/o polmonare con traccianti positivi cod. 92.15.4 Che cosa è la scintigrafia polmonare con traccianti positivi? E un esame che si propone di studiare
Test di depistaggio prenatale del 1 trimestre Informativa per lo studio medico
 Test di depistaggio prenatale del 1 trimestre Informativa per lo studio medico Determinazione del rischio di trisomie fetali attraverso l età materna, la translucenza nucale e i valori di PAPP-A e free
Test di depistaggio prenatale del 1 trimestre Informativa per lo studio medico Determinazione del rischio di trisomie fetali attraverso l età materna, la translucenza nucale e i valori di PAPP-A e free
ALLEGATO III. Modifiche ai paragrafi rilevanti del riassunto delle caratteristiche del prodotto, etichettatura e foglio illustrativo
 ALLEGATO III Modifiche ai paragrafi rilevanti del riassunto delle caratteristiche del prodotto, etichettatura e foglio illustrativo 8 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Medicinale sottoposto
ALLEGATO III Modifiche ai paragrafi rilevanti del riassunto delle caratteristiche del prodotto, etichettatura e foglio illustrativo 8 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Medicinale sottoposto
CIED e Radioterapia. Mara Severgnini, Fisica Medica A.O.U. Ospedali Riuniti di Trieste
 CIED e Radioterapia Mara Severgnini, Fisica Medica A.O.U. Ospedali Riuniti di Trieste Dispositivi Cardiaci Impiantabili e radioterapia Pacemaker Defibrillatori Le radiazioni provocano danni: distruzione
CIED e Radioterapia Mara Severgnini, Fisica Medica A.O.U. Ospedali Riuniti di Trieste Dispositivi Cardiaci Impiantabili e radioterapia Pacemaker Defibrillatori Le radiazioni provocano danni: distruzione
Domande relative alla specializzazione in: Medicina nucleare
 Domande relative alla specializzazione in: Medicina nucleare Domanda #1 (codice domanda: n.961) : Quale tra queste condizioni è controindicazione assoluta al trattamento radiometabolico del dolore da metastasi
Domande relative alla specializzazione in: Medicina nucleare Domanda #1 (codice domanda: n.961) : Quale tra queste condizioni è controindicazione assoluta al trattamento radiometabolico del dolore da metastasi
7 Disegni sperimentali ad un solo fattore. Giulio Vidotto Raffaele Cioffi
 7 Disegni sperimentali ad un solo fattore Giulio Vidotto Raffaele Cioffi Indice: 7.1 Veri esperimenti 7.2 Fattori livelli condizioni e trattamenti 7.3 Alcuni disegni sperimentali da evitare 7.4 Elementi
7 Disegni sperimentali ad un solo fattore Giulio Vidotto Raffaele Cioffi Indice: 7.1 Veri esperimenti 7.2 Fattori livelli condizioni e trattamenti 7.3 Alcuni disegni sperimentali da evitare 7.4 Elementi
INDICAZIONI TERAPEUTICHE
 FOGLIO ILLUSTRATIVO Potassio cloruro S.A.L.F. 2 meq/ml concentrato per soluzione per infusione CATEGORIA FARMACOTERAPEUTICA Soluzioni elettrolitiche. INDICAZIONI TERAPEUTICHE Trattamento di deficienze
FOGLIO ILLUSTRATIVO Potassio cloruro S.A.L.F. 2 meq/ml concentrato per soluzione per infusione CATEGORIA FARMACOTERAPEUTICA Soluzioni elettrolitiche. INDICAZIONI TERAPEUTICHE Trattamento di deficienze
Valutazione efficacia della terapia con campi magneto-elettrici ultradeboli ODONTOIATRIA. Risultati definitivi Marzo 2014
 Valutazione efficacia della terapia con campi magneto-elettrici ultradeboli ODONTOIATRIA Risultati definitivi Marzo 2014 1. Analisi descrittive sul campione Il campione è composto da 20 partecipanti, con
Valutazione efficacia della terapia con campi magneto-elettrici ultradeboli ODONTOIATRIA Risultati definitivi Marzo 2014 1. Analisi descrittive sul campione Il campione è composto da 20 partecipanti, con
Cosa è l HPV. E un VIRUS Costituito da un nucleo centrale (core) di DNA rivestito da un involucro di natura proteica
 L INFEZIONE DA HPV Cosa è l HPV E un VIRUS Costituito da un nucleo centrale (core) di DNA rivestito da un involucro di natura proteica Identificati 100 tipi di HPV che possono interessare l uomo. Di questi
L INFEZIONE DA HPV Cosa è l HPV E un VIRUS Costituito da un nucleo centrale (core) di DNA rivestito da un involucro di natura proteica Identificati 100 tipi di HPV che possono interessare l uomo. Di questi
Ematoma Sottodurale Cronico
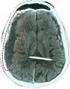 Ematoma Sottodurale Cronico CHE COSA È UN EMATOMA SOTTODURALE CRONICO L Ematoma Sottodurale Cronico è una patologia benigna, tipica dell anziano, caratterizzata da una raccolta di fluido, generalmente
Ematoma Sottodurale Cronico CHE COSA È UN EMATOMA SOTTODURALE CRONICO L Ematoma Sottodurale Cronico è una patologia benigna, tipica dell anziano, caratterizzata da una raccolta di fluido, generalmente
Valutazione dei costi
 Valutazione dei costi L impianto di lampioni smart considerato è costituito da: - Lampioni led da 61W; - un Kit smart, costituito da: un sistema di controllo e gestione dei lampioni (algoritmo di controllo
Valutazione dei costi L impianto di lampioni smart considerato è costituito da: - Lampioni led da 61W; - un Kit smart, costituito da: un sistema di controllo e gestione dei lampioni (algoritmo di controllo
CONNESSO ALLE DERIVAZIONI IDRICHE IN RELAZIONE AGLI OBIETTIVI DI QUALITA AMBIENTALE DEFINITI DAL PIANO DI GESTIONE DISTRETTO IDROGRAFICO PO»
 NUOVE DISPOSIZIONI DEL COMITATO ISTITUZIONALE AUTORITA DI BACINO PO: DELIBERAZIONI DI DICEMBRE 2015 DIRETTIVA «VALUTAZIONE DEL RISCHIO AMBIENTALE CONNESSO ALLE DERIVAZIONI IDRICHE IN RELAZIONE AGLI OBIETTIVI
NUOVE DISPOSIZIONI DEL COMITATO ISTITUZIONALE AUTORITA DI BACINO PO: DELIBERAZIONI DI DICEMBRE 2015 DIRETTIVA «VALUTAZIONE DEL RISCHIO AMBIENTALE CONNESSO ALLE DERIVAZIONI IDRICHE IN RELAZIONE AGLI OBIETTIVI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DITANRIX Adulti Sospensione iniettabile per uso intramuscolare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA una dose da 0,5 ml
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DITANRIX Adulti Sospensione iniettabile per uso intramuscolare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA una dose da 0,5 ml
Università degli studi di Genova Facoltà di Medicina e Chirurgia Corso di Laurea in Medicina e Chirurgia
 Università degli studi di Genova Facoltà di Medicina e Chirurgia Corso di Laurea in Medicina e Chirurgia Relatori: Chiar.ma Prof.ssa Antonietta Piana Chiar.mo Dott. Andrea Stimamiglio Candidata: Oliveri
Università degli studi di Genova Facoltà di Medicina e Chirurgia Corso di Laurea in Medicina e Chirurgia Relatori: Chiar.ma Prof.ssa Antonietta Piana Chiar.mo Dott. Andrea Stimamiglio Candidata: Oliveri
ESTRATTI, SUNTI E COMUNICATI
 ESTRATTI, SUNTI E COMUNICATI AGENZIA ITALIANA DEL FARMACO ModiÞ cazione dell autorizzazione all immisione in commercio, secondo procedura di mutuo riconoscimento, del medicinale «Multihance» Estratto determinazione
ESTRATTI, SUNTI E COMUNICATI AGENZIA ITALIANA DEL FARMACO ModiÞ cazione dell autorizzazione all immisione in commercio, secondo procedura di mutuo riconoscimento, del medicinale «Multihance» Estratto determinazione
Fiscal News La circolare di aggiornamento professionale
 Fiscal News La circolare di aggiornamento professionale N. 343 24.11.2014 Il nuovo ISEE corrente Quando si presenta e composizione del modello Categoria: Contribuenti Sottocategoria: Varie Con la pubblicazione
Fiscal News La circolare di aggiornamento professionale N. 343 24.11.2014 Il nuovo ISEE corrente Quando si presenta e composizione del modello Categoria: Contribuenti Sottocategoria: Varie Con la pubblicazione
Foglio illustrativo: informazioni per il paziente. ISORAM 4%, soluzione per infusione. Soluzione di aminoacidi
 Foglio illustrativo: informazioni per il paziente ISORAM 4%, soluzione per infusione Soluzione di aminoacidi Legga attentamente questo foglio prima che le venga somministrato questo medicinale perché contiene
Foglio illustrativo: informazioni per il paziente ISORAM 4%, soluzione per infusione Soluzione di aminoacidi Legga attentamente questo foglio prima che le venga somministrato questo medicinale perché contiene
I VALORI NUTRIZIONALI DI QUESTO PRODOTTO SONO STATI CONFRONTATI CON QUELLI MEDI DI UNA FOCACCIA-BASE PER PIZZA
 I VALORI NUTRIZIONALI DI QUESTO PRODOTTO SONO STATI CONFRONTATI CON QUELLI MEDI DI UNA FOCACCIA-BASE PER PIZZA Fonti: Tabelle di composizione degli alimenti, pizza bianca, INRAN http://nut.entecra.it/646/tabelle_di_composizione_degli_alimenti.html?idalimento=000700&quant=100
I VALORI NUTRIZIONALI DI QUESTO PRODOTTO SONO STATI CONFRONTATI CON QUELLI MEDI DI UNA FOCACCIA-BASE PER PIZZA Fonti: Tabelle di composizione degli alimenti, pizza bianca, INRAN http://nut.entecra.it/646/tabelle_di_composizione_degli_alimenti.html?idalimento=000700&quant=100
DOSE DI RADIAZIONE IONIZZANTE PERICOLO DA RADIAZIONI IONIZZANTI DOSE ASSORBITA D =!E AREA CONTROLLATA. energia assorbita nell'unità di massa
 DOSE DI RADIAZIONE IONIZZANTE PERICOLO DA RADIAZIONI IONIZZANTI DOSE ASSORBITA AREA CONTROLLATA D =!E!m energia assorbita nell'unità di massa 2 UNITA' DI MISURA dose assorbita D =!E!m dimensioni [D] =
DOSE DI RADIAZIONE IONIZZANTE PERICOLO DA RADIAZIONI IONIZZANTI DOSE ASSORBITA AREA CONTROLLATA D =!E!m energia assorbita nell'unità di massa 2 UNITA' DI MISURA dose assorbita D =!E!m dimensioni [D] =
il rapporto sessuale è la via preminente di contagio sono guaribili (eccetto AIDS ed epatite C) se vengono riconosciute il più presto possibile
 LE MALATTIE SESSUALMENTE TRASMESSE il rapporto sessuale è la via preminente di contagio sono guaribili (eccetto AIDS ed epatite C) se vengono riconosciute il più presto possibile alcune possono essere
LE MALATTIE SESSUALMENTE TRASMESSE il rapporto sessuale è la via preminente di contagio sono guaribili (eccetto AIDS ed epatite C) se vengono riconosciute il più presto possibile alcune possono essere
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori sanitari è
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori sanitari è
Esecuzione Pap test/hpv nella ASL 8 di Cagliari
 Esecuzione Pap test/hpv nella ASL 8 di Cagliari Servizio Igiene e Sanità Pubblica Direttore Dott. Giorgio Carlo Steri Database PASSI 2010 2013 % (IC95%) Donne che hanno eseguito il pap test/hpv in accordo
Esecuzione Pap test/hpv nella ASL 8 di Cagliari Servizio Igiene e Sanità Pubblica Direttore Dott. Giorgio Carlo Steri Database PASSI 2010 2013 % (IC95%) Donne che hanno eseguito il pap test/hpv in accordo
Errori cognitivi, probabilità e decisioni mediche nella diagnostica di laboratorio. M. Besozzi - IRCCS Istituto Auxologico Italiano
 Errori cognitivi, probabilità e decisioni mediche nella diagnostica di laboratorio M. Besozzi - IRCCS Istituto Auxologico Italiano L argomento... Errori cognitivi Il problema gnoseologico Dati, informazione
Errori cognitivi, probabilità e decisioni mediche nella diagnostica di laboratorio M. Besozzi - IRCCS Istituto Auxologico Italiano L argomento... Errori cognitivi Il problema gnoseologico Dati, informazione
Avviso di sicurezza Lotti del test di mutazione KRAS Idylla 2660, 2663 e 2707
 0047814-08/09/2016-DGDMF-MDS-A - Allegato Utente 1 (A01) All attenzione del Direttore di laboratorio Indirizzo linea 1 Indirizzo linea 2 Indirizzo linea 3 Indirizzo linea 4 Indirizzo linea 5 Avviso di
0047814-08/09/2016-DGDMF-MDS-A - Allegato Utente 1 (A01) All attenzione del Direttore di laboratorio Indirizzo linea 1 Indirizzo linea 2 Indirizzo linea 3 Indirizzo linea 4 Indirizzo linea 5 Avviso di
Il TU 81/2008 con le modifiche del D.lgs 39/2016
 Il TU 81/2008 con le modifiche del D.lgs 39/2016 Titolo IX Il D.lgs 39/2016 entrato in vigore il 29 marzo 2016, modifica così il Testo Unico Sicurezza Riferimento TU Testo ante modifiche Testo modificato
Il TU 81/2008 con le modifiche del D.lgs 39/2016 Titolo IX Il D.lgs 39/2016 entrato in vigore il 29 marzo 2016, modifica così il Testo Unico Sicurezza Riferimento TU Testo ante modifiche Testo modificato
Compressa. La compressa è di forma rotonda, di colore giallo chiaro.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1-DENOMINAZIONE DEL MEDICINALE BALFOLIC 400 microgrammi compresse 2-COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene: Principio attivo : Acido
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1-DENOMINAZIONE DEL MEDICINALE BALFOLIC 400 microgrammi compresse 2-COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene: Principio attivo : Acido
Bellavite sperimentazione Gelsemium. Scuola Omeopatia Classica Dulcamara - Faculty of Homeopathy of the United Kingdom
 Bellavite sperimentazione Gelsemium E stato pubblicato su Psychopharmacology 2010; [DOI 10.1007/s00213-010-1855-2], ad opera di Magnani P et al (Dipartimento di Patologia e Dipartimento di Medicina e Sanità
Bellavite sperimentazione Gelsemium E stato pubblicato su Psychopharmacology 2010; [DOI 10.1007/s00213-010-1855-2], ad opera di Magnani P et al (Dipartimento di Patologia e Dipartimento di Medicina e Sanità
Metodologie informatiche per la chimica
 Metodologie informatiche per la chimica Dr. Sergio Brutti Metodologie di analisi dei dati Strumenti di misura Uno strumento di misura e un dispositivo destinato a essere utilizzato per eseguire una misura,
Metodologie informatiche per la chimica Dr. Sergio Brutti Metodologie di analisi dei dati Strumenti di misura Uno strumento di misura e un dispositivo destinato a essere utilizzato per eseguire una misura,
Il contenuto di proteina umana è di 50 g/l, di cui almeno il 97% è costituito da IgG.
 1. DENOMINAZIONE DEL MEDICINALE Niuliva 250 U.I./ml soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Immunoglobulina umana antiepatite B. La distribuzione percentuale delle sottoclassi
1. DENOMINAZIONE DEL MEDICINALE Niuliva 250 U.I./ml soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Immunoglobulina umana antiepatite B. La distribuzione percentuale delle sottoclassi
Cifre significative delle misure di grandezze fisiche
 Cifre significative delle misure di grandezze fisiche Si definiscono grandezze fisiche tutte quelle entità con cui vengono descritti i fenomeni fisici e che sono suscettibili di una definizione quantitativa,
Cifre significative delle misure di grandezze fisiche Si definiscono grandezze fisiche tutte quelle entità con cui vengono descritti i fenomeni fisici e che sono suscettibili di una definizione quantitativa,
ANALISI CHIMICO FARMACEUTICA I
 Prof. Gianluca Sbardella : 089 969770 : gsbardella@unisa.it L INCERTEZZA E LE CIFRE SIGNIFICATIVE Tutte le misure sono affette da un certo grado di incertezza la cui entità può dipendere sia dall operatore
Prof. Gianluca Sbardella : 089 969770 : gsbardella@unisa.it L INCERTEZZA E LE CIFRE SIGNIFICATIVE Tutte le misure sono affette da un certo grado di incertezza la cui entità può dipendere sia dall operatore
Accuratezza, precisione, tipi di errori e cifre significative dei dati analitici.
 Accuratezza, precisione, tipi di errori e cifre significative dei dati analitici. Indice: 1. Lettura della buretta pag.2 2. Precisione ed Accuratezza pag.3 3. Tipi di errori pag.4 4. Affidabilità di una
Accuratezza, precisione, tipi di errori e cifre significative dei dati analitici. Indice: 1. Lettura della buretta pag.2 2. Precisione ed Accuratezza pag.3 3. Tipi di errori pag.4 4. Affidabilità di una
Mutuo riconoscimento di rodenticidi contenenti sostanze anticoagulanti: la linea guida delle Autorità Competenti
 Mutuo riconoscimento di rodenticidi contenenti sostanze anticoagulanti: la linea guida delle Autorità Competenti Renato Cabella Istituto Superiore di Sanità Centro Nazionale Sostanze Chimiche I prodotti
Mutuo riconoscimento di rodenticidi contenenti sostanze anticoagulanti: la linea guida delle Autorità Competenti Renato Cabella Istituto Superiore di Sanità Centro Nazionale Sostanze Chimiche I prodotti
ASPETTI STATISTICI. Master Universitario di II Livello Ricerca e Sviluppo Pre-Clinico e Clinico del Farmaco Modulo 4 Sviluppo Clinico dei Farmaci
 Master Universitario di II Livello Ricerca e Sviluppo Pre-Clinico e Clinico del Farmaco Modulo 4 Sviluppo Clinico dei Farmaci ASPETTI STATISTICI Docente: Prof. Antonio MARZO e-mail: antoniop.marzo@libero.it
Master Universitario di II Livello Ricerca e Sviluppo Pre-Clinico e Clinico del Farmaco Modulo 4 Sviluppo Clinico dei Farmaci ASPETTI STATISTICI Docente: Prof. Antonio MARZO e-mail: antoniop.marzo@libero.it
Elettroencefalogramma
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Elettroencefalogramma 2/5/2006 Casa è? L elettroencefalogramma (EEG) corrisponde a variazioni dell attività elettrica cerebrale registrate
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Elettroencefalogramma 2/5/2006 Casa è? L elettroencefalogramma (EEG) corrisponde a variazioni dell attività elettrica cerebrale registrate
Ca endometrio - incidenza
 Ca endometrio Il cancro dell'endometrio o del corpo dell'utero trae origine dalle ghiandole della mucosa (endometrio) che riveste la cavità del corpo dell'utero Ca endometrio - incidenza Ca endometrio
Ca endometrio Il cancro dell'endometrio o del corpo dell'utero trae origine dalle ghiandole della mucosa (endometrio) che riveste la cavità del corpo dell'utero Ca endometrio - incidenza Ca endometrio
Inquinamento da elettromagnetismo. Cos'è Perché è importante Come agire
 Inquinamento da elettromagnetismo Cos'è Perché è importante Come agire Inquinamento da elettromagnetismo cos'è DEFINIZIONE: È una forma particolare di inquinamento ambientale, non si ha una vera immissione
Inquinamento da elettromagnetismo Cos'è Perché è importante Come agire Inquinamento da elettromagnetismo cos'è DEFINIZIONE: È una forma particolare di inquinamento ambientale, non si ha una vera immissione
STATISTICHE DESCRITTIVE Parte II
 STATISTICHE DESCRITTIVE Parte II INDICI DI DISPERSIONE Introduzione agli Indici di Dispersione Gamma Differenza Interquartilica Varianza Deviazione Standard Coefficiente di Variazione introduzione Una
STATISTICHE DESCRITTIVE Parte II INDICI DI DISPERSIONE Introduzione agli Indici di Dispersione Gamma Differenza Interquartilica Varianza Deviazione Standard Coefficiente di Variazione introduzione Una
LA GIUNTA DELLA REGIONE EMILIA-ROMAGNA
 Prot. N. (OSP/08/220825) LA GIUNTA DELLA REGIONE EMILIA-ROMAGNA Visto il Decreto Ministeriale n. 279 del 18 maggio 2001 Regolamento di istituzione della rete nazionale delle malattie rare e di esenzione
Prot. N. (OSP/08/220825) LA GIUNTA DELLA REGIONE EMILIA-ROMAGNA Visto il Decreto Ministeriale n. 279 del 18 maggio 2001 Regolamento di istituzione della rete nazionale delle malattie rare e di esenzione
ANTIBIOTICO PROFILASSI IN CHIRURGIA GENERALE
 ANTIBIOTICO PROFILAS IN CHIRURGIA GENERALE 0. Indice 0. Indice... 1 1. Scopo e campo di applicazione... 1 2. Riferimenti...1 2.2 Documentali... 1 3. Modalità operative... 2 3.2 Classificazione degli interventi
ANTIBIOTICO PROFILAS IN CHIRURGIA GENERALE 0. Indice 0. Indice... 1 1. Scopo e campo di applicazione... 1 2. Riferimenti...1 2.2 Documentali... 1 3. Modalità operative... 2 3.2 Classificazione degli interventi
ANALISI DEI RISULTATI INVALSI 2014 ISTITUTO COMPRENSIVO D. SPADA, SOVERE (BG)
 ANALISI DEI RISULTATI INVALSI 2014 ISTITUTO COMPRENSIVO D. SPADA, SOVERE (BG) Classi Terze Scuola Secondaria di Primo Grado UNA RIFLESSIONE SUI RISULTATI INVALSI 2014 Nell ottica di un autovalutazione
ANALISI DEI RISULTATI INVALSI 2014 ISTITUTO COMPRENSIVO D. SPADA, SOVERE (BG) Classi Terze Scuola Secondaria di Primo Grado UNA RIFLESSIONE SUI RISULTATI INVALSI 2014 Nell ottica di un autovalutazione
Esercitazioni di statistica
 Esercitazioni di statistica Misure di associazione: Indipendenza assoluta e in media Stefania Spina Universitá di Napoli Federico II stefania.spina@unina.it 22 ottobre 2014 Stefania Spina Esercitazioni
Esercitazioni di statistica Misure di associazione: Indipendenza assoluta e in media Stefania Spina Universitá di Napoli Federico II stefania.spina@unina.it 22 ottobre 2014 Stefania Spina Esercitazioni
Foglio illustrativo: informazioni per il paziente. Delecit 600 mg soluzione orale. Colina alfoscerato
 Foglio illustrativo: informazioni per il paziente Delecit 600 mg soluzione orale Colina alfoscerato Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni
Foglio illustrativo: informazioni per il paziente Delecit 600 mg soluzione orale Colina alfoscerato Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni
Esempi di attribuzione dei seggi
 Esempi di attribuzione dei seggi Al fine di chiarire il funzionamento dei meccanismi previsti per l attribuzione dei seggi e l ordine delle relative operazioni, vengono presentati due esempi di attribuzione
Esempi di attribuzione dei seggi Al fine di chiarire il funzionamento dei meccanismi previsti per l attribuzione dei seggi e l ordine delle relative operazioni, vengono presentati due esempi di attribuzione
Manuale di Aggiornamento BOLLETTINO. Rel B. DATALOG Soluzioni Integrate a 32 Bit
 KING Manuale di Aggiornamento BOLLETTINO Rel. 4.70.2B DATALOG Soluzioni Integrate a 32 Bit - 2 - Manuale di Aggiornamento Sommario 1 PER APPLICARE L AGGIORNAMENTO... 3 2 NOVITA 4.70.2B... 5 2.1 Annullo
KING Manuale di Aggiornamento BOLLETTINO Rel. 4.70.2B DATALOG Soluzioni Integrate a 32 Bit - 2 - Manuale di Aggiornamento Sommario 1 PER APPLICARE L AGGIORNAMENTO... 3 2 NOVITA 4.70.2B... 5 2.1 Annullo
Cellule tessuti e corpo in generale
 Cellule tessuti e corpo in generale Il corpo umano è una macchina straordinaria e meravigliosa. È fatta di oltre 200 ossa, 450 muscoli, 100.000 capelli in testa, 130.000.000 di recettori sul fondo della
Cellule tessuti e corpo in generale Il corpo umano è una macchina straordinaria e meravigliosa. È fatta di oltre 200 ossa, 450 muscoli, 100.000 capelli in testa, 130.000.000 di recettori sul fondo della
Monitoraggio della terapia eparinica in corso di Angioplastica Coronarica Transluminale Percutanea: dati preliminari
 Monitoraggio della terapia eparinica in corso di Angioplastica Coronarica Transluminale Percutanea: dati preliminari Petronelli Mariella U.O. Patologia Clinica I Azienda Ospedaliero Universitaria Policlinico
Monitoraggio della terapia eparinica in corso di Angioplastica Coronarica Transluminale Percutanea: dati preliminari Petronelli Mariella U.O. Patologia Clinica I Azienda Ospedaliero Universitaria Policlinico
Prestazioni di accuratezza e precisione del sistema Accu-Chek Active. Introduzione. Metodo
 Prestazioni di accuratezza e precisione del sistema Accu-Chek Active I. ACCURATEZZA L'accuratezza del sistema è stata valutata in conformità con ISO 15197. Introduzione Lo scopo dello studio era di determinare
Prestazioni di accuratezza e precisione del sistema Accu-Chek Active I. ACCURATEZZA L'accuratezza del sistema è stata valutata in conformità con ISO 15197. Introduzione Lo scopo dello studio era di determinare
CLOSTRIDIUM DIFFICILE TOSSINE A e B
 MODALITA' DI RICHIESTA: Pazienti interni: tramite modulo interno prestampato. Pazienti esterni: tramite richiesta del medico curante. PREPARAZIONE DEL PAZIENTE ALL'ESAME: Nessuna. MODALITA' DI RACCOLTA
MODALITA' DI RICHIESTA: Pazienti interni: tramite modulo interno prestampato. Pazienti esterni: tramite richiesta del medico curante. PREPARAZIONE DEL PAZIENTE ALL'ESAME: Nessuna. MODALITA' DI RACCOLTA
FENILCHETONURIA. Adattarsi ad una nuova realtà
 FENILCHETONURIA Adattarsi ad una nuova realtà 9 Che cosa è la fenilchetonuria? Per capire la fenilchetonuria bisogna partire dal concetto che tutti gli alimenti, in quantità variabile, contengono una sostanza
FENILCHETONURIA Adattarsi ad una nuova realtà 9 Che cosa è la fenilchetonuria? Per capire la fenilchetonuria bisogna partire dal concetto che tutti gli alimenti, in quantità variabile, contengono una sostanza
ALTERAZIONI IATROGENE DEL PARENCHIMA TIROIDEO: STUDIO RETROSPETTIVO E PROSPETTICO DI 468 PAZIENTI
 ALTERAZIONI IATROGENE DEL PARENCHIMA TIROIDEO: STUDIO RETROSPETTIVO E PROSPETTICO DI 468 PAZIENTI Massimino M, Gandola L, Mattavelli F, Seregni E, Spreafico F, Marchianò A e Collini P Esposizione incidentale
ALTERAZIONI IATROGENE DEL PARENCHIMA TIROIDEO: STUDIO RETROSPETTIVO E PROSPETTICO DI 468 PAZIENTI Massimino M, Gandola L, Mattavelli F, Seregni E, Spreafico F, Marchianò A e Collini P Esposizione incidentale
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE neohepatect 50 UI/ml; soluzione per infusione 2.COMPOSIZIONE QUALITATIVA E QUANTITATIVA Immunoglobulina umana anti epatite B
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE neohepatect 50 UI/ml; soluzione per infusione 2.COMPOSIZIONE QUALITATIVA E QUANTITATIVA Immunoglobulina umana anti epatite B
Foglio illustrativo: informazioni per il paziente. Omega 3 Mylan Generics 1000 mg Capsule molli Medicinale Equivalente
 Principio attivo: esteri etilici 90 dell acido omega-3 Foglio illustrativo: informazioni per il paziente Omega 3 Mylan Generics 1000 mg Capsule molli Medicinale Equivalente Legga attentamente questo foglio
Principio attivo: esteri etilici 90 dell acido omega-3 Foglio illustrativo: informazioni per il paziente Omega 3 Mylan Generics 1000 mg Capsule molli Medicinale Equivalente Legga attentamente questo foglio
CAMPIONAMENTO fondamentale analisi campionamento omogenei stessa composizione variazione l abilità persona variabilità metodo analitico realtà
 CAMPIONAMENTO Un momento fondamentale di una analisi è rappresentato dal campionamento, generalmente si pensa che i campioni da analizzare siano omogenei e che abbiano in ogni punto la stessa composizione,
CAMPIONAMENTO Un momento fondamentale di una analisi è rappresentato dal campionamento, generalmente si pensa che i campioni da analizzare siano omogenei e che abbiano in ogni punto la stessa composizione,
Regime di rimborsabilità e prezzo di vendita del medicinale PROLIA (denosumab). (Determinazione/C n. 2535/2011).
 DETERMINAZIONE 8 agosto 2011. Regime di rimborsabilità e prezzo di vendita del medicinale PROLIA (denosumab). (Determinazione/C n. 2535/2011). Regime di rimborsabilità e prezzo di vendita della specialità
DETERMINAZIONE 8 agosto 2011. Regime di rimborsabilità e prezzo di vendita del medicinale PROLIA (denosumab). (Determinazione/C n. 2535/2011). Regime di rimborsabilità e prezzo di vendita della specialità
Foglio illustrativo: informazioni per l utilizzatore. MASTER-AID Disinfettante 1g/100ml soluzione cutanea Clorexidina digluconato
 Foglio illustrativo: informazioni per l utilizzatore MASTER-AID Disinfettante 1g/100ml soluzione cutanea Clorexidina digluconato Legga attentamente questo foglio prima di usare questo medicinale perché
Foglio illustrativo: informazioni per l utilizzatore MASTER-AID Disinfettante 1g/100ml soluzione cutanea Clorexidina digluconato Legga attentamente questo foglio prima di usare questo medicinale perché
COS'È TICALMA E A COSA SERVE
 TESTO UNICO RIPORTATO SUL CONFEZIONAMENTO PRIMARIO TICALMA 400 mg Tisana 20 bustine VALERIANA Radice Prima dell uso leggere con attenzione tutte le informazioni riportate sulla confezione Questo medicinale
TESTO UNICO RIPORTATO SUL CONFEZIONAMENTO PRIMARIO TICALMA 400 mg Tisana 20 bustine VALERIANA Radice Prima dell uso leggere con attenzione tutte le informazioni riportate sulla confezione Questo medicinale
I pazienti con diabete di tipo 1 sono in gran parte giovani, ma sono una piccola minoranza rispetto al totale. La maggior parte dei diabetici,
 DIABETE Per quali pazienti diabetici è indicato il trapianto di rene? I pazienti diabetici più comunemente inseriti in lista di trapianto renale sono quelli in cui il diabete è dovuto a un'insufficiente
DIABETE Per quali pazienti diabetici è indicato il trapianto di rene? I pazienti diabetici più comunemente inseriti in lista di trapianto renale sono quelli in cui il diabete è dovuto a un'insufficiente
AGENDA DELLA PRESSIONE
 Società Italiana dell Ipertensione Arteriosa Lega Italiana contro l Ipertensione Arteriosa AGENDA DELLA PRESSIONE TIENI SOTTO CONTROLLO LA PRESSIONE E LA FIBRILLAZIONE ATRIALE PER PREVENIRE LE MALATTIE
Società Italiana dell Ipertensione Arteriosa Lega Italiana contro l Ipertensione Arteriosa AGENDA DELLA PRESSIONE TIENI SOTTO CONTROLLO LA PRESSIONE E LA FIBRILLAZIONE ATRIALE PER PREVENIRE LE MALATTIE
IL DIABETE COME FATTORE DI RISCHIO DI DETERIORAMENTO COGNITIVO
 IL DIABETE COME FATTORE DI RISCHIO DI DETERIORAMENTO COGNITIVO Limongi F, Noale M, Marzari C, Gallina P, Maggi S, Crepaldi G. Istituto Di Neuroscienze CNR Sezione Clinica Invecchiamento Padova SOCIETA
IL DIABETE COME FATTORE DI RISCHIO DI DETERIORAMENTO COGNITIVO Limongi F, Noale M, Marzari C, Gallina P, Maggi S, Crepaldi G. Istituto Di Neuroscienze CNR Sezione Clinica Invecchiamento Padova SOCIETA
DOCUMENTO DI CONFRONTO DEI COSTI TRA PRINCIPI ATTIVI APPARTENENTI A CATEGORIE TERAPEUTICHE AD ELEVATO IMPATTO DI SPESA TERRITORIALE
 1/12 DOCUMENTO DI CONFRONTO DEI COSTI TRA PRINCIPI ATTIVI APPARTENENTI A CATEGORIE TERAPEUTICHE AD ELEVATO IMPATTO DI SPESA TERRITORIALE PREMESSA Nel 2014 la spesa farmaceutica territoriale della Regione
1/12 DOCUMENTO DI CONFRONTO DEI COSTI TRA PRINCIPI ATTIVI APPARTENENTI A CATEGORIE TERAPEUTICHE AD ELEVATO IMPATTO DI SPESA TERRITORIALE PREMESSA Nel 2014 la spesa farmaceutica territoriale della Regione
La buona pratica della raccolta di una anamnesi completa mediante colloquio con il medico di base in relazione alla selezione dei donatori di tessuti
 La buona pratica della raccolta di una anamnesi completa mediante colloquio con il medico di base in relazione alla selezione dei donatori di tessuti oculari Napoli, 23 aprile 2016 I. Zorzi, M. De Rossi,
La buona pratica della raccolta di una anamnesi completa mediante colloquio con il medico di base in relazione alla selezione dei donatori di tessuti oculari Napoli, 23 aprile 2016 I. Zorzi, M. De Rossi,
BOLLETTINO dei controlli della produttività del latte 2015
 ASSOCIAZIONE ITALIANA ALLEVATORI ENTE MORALE D.P.R. N. 1051 DEL 27-10-1950 UFFICIO CENTRALE DEI CONTROLLI DELLA PRODUTTIVITÁ ANIMALE SOTTOPOSTO ALLA VIGILANZA DEL MINISTERO DELLE POLITICHE AGRICOLE E FORESTALI
ASSOCIAZIONE ITALIANA ALLEVATORI ENTE MORALE D.P.R. N. 1051 DEL 27-10-1950 UFFICIO CENTRALE DEI CONTROLLI DELLA PRODUTTIVITÁ ANIMALE SOTTOPOSTO ALLA VIGILANZA DEL MINISTERO DELLE POLITICHE AGRICOLE E FORESTALI
Applicazione Periodo Fertile
 Applicazione Periodo Fertile Periodo è un applicazione mobile che non ha valenza medica ma fornisce uno strumento utile ed intuitivo per individuare i giorni fertili e per seguire passo dopo passo i cambiamenti
Applicazione Periodo Fertile Periodo è un applicazione mobile che non ha valenza medica ma fornisce uno strumento utile ed intuitivo per individuare i giorni fertili e per seguire passo dopo passo i cambiamenti
Schema a blocchi di uno spettrofluorimetro
 MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
