Modelli compartimentali e farmacocinetica.
|
|
|
- Michele Palma
- 6 anni fa
- Visualizzazioni
Transcript
1 Modelli compartimentali e farmacocinetica carmelo.demaria@centropiaggio.unipi.it
2 Obie4vi Apprendere le tecniche matema8che per l analisi della cine8ca dei traccian8 u8lizza8 per lo studio di sistemi endocrino- metabolici e del metabolismo d organo
3 Una disciplina ha tanto più la dignità della scienza quanto più fa uso dello strumento matema8co Galileo Galilei Per parlare di matema8ca applicata alla biologia non basta introdurre dei metodi quan8ta8vi nella descrizione dei fenomeni, occorre anche trovare delle connessioni e dei legami di 8po matema8co, ovvero formulare dei modelli che abbiano caraeere predi4vo e servano a risolvere problemi specifici.
4 Esempio Modelli che descrivono il metabolismo del glucosio, il metabolismo dei lipidi e l azione dell insulina che influenza sia il metabolismo del glucosio che quello dei lipidi. Farmacocine8ca
5 Farmacocine8ca La farmacocine8ca studia quan8ta8vamente l'assorbimento, la distribuzione, il metabolismo e l'eliminazione dei farmaci. I farmaci vengono assorbi8, distribui8, metabolizza8 ed elimina8 dall'organismo al quale vengono somministra8 Le velocità di assorbimento, distribuzione, metabolismo ed eliminazione sono determinan8 per gli effe4 di un farmaco. Un insieme di equazioni differenziali può descrivere i tempi e i modi in cui un farmaco viene assorbito, metabolizzato ed eliminato dall'organismo.
6 Costruzione di un modello matema8co Gli elemen8 da tener presente per costruire un modello valido possono essere in prima istanza suddivisi in: Obie4vi Ruolo delle conoscenze teoriche ed empiriche StruEura topologica ed anali8ca del modello Formulazione Iden8ficazione Validazione
7 PERCEZIONE DEL PROBLEMA OBIETTIVI LEGGI TEORIE DATI FORMULAZIONE DEL MODELLO CONCETTUALIZZAZIONE REALIZZAZIONE MATEMATICA VALIDAZIONE DEL MODELLO RISOLUZIONE IDENTIFICAZIONE DEL MODELLO MODELLO UTILIZZABILE
8 Iden8ficazione del modello 1/2 Con il termine iden8ficazione ci si riferisce ai procedimen8 con i quali si determina sia la strueura del modello matema8co, sia il valore dei parametri che in esso figurano, in modo da oeenere la corrispondenza tra il comportamento del modello ed un adeguato complesso di da8 sperimentali.
9 Iden8ficazione del modello 2/2 Le principali fasi del processo di iden8ficazione sono: determinazione della stru0ura del modello, in base alle conoscenze a priori sulle leggi fisico- chimiche che regolano i fenomeni studia8 o in base all esigenza di far corrispondere le soluzioni delle equazioni ai da8 sperimentali, anche senza aeribuire un par8colare significato fisico; proge0o ed esecuzione dell esperimento, quindi applicazione di ingressi e la misura delle uscite, cercando un compromesso opportuno tra significa8vità dell esperimento ai fini dell iden8ficazione e i vincoli di natura e8ca e pra8ca (in par8colare, un iden8ficazione a priori che l esperimento sia o no in grado di fornire i valori incogni8 dai da8 sperimentali, e se eventualmente la s8ma sia unica); s6ma dei parametri, u8lizzando algoritmi idonei e valutando la bontà della s8ma eseguita (accuratezza dei risulta8) nel quadro del problema deeo di iden8ficazione a posteriori; messa a punto e o7mizzazione dell esperimento proge0ato.
10 Validazione del modello È la serie di prove con cui si testa la validità del modello. Il conceeo di validità è molto ampio e richiede un criterio di valutazione. Ma tale criterio, molte volte rischia di essere sogge4vo, sopraeueo nei metri di misura. In linea generale: Criteri interni, basa8 sulle caraeeris8che interne del modello: Coerenza, in base alla quale non si devono presentare contraddizioni logiche, matema8che o fisiche. Validità algoritmica, rela8va all esigenza che le equazioni siano risolvibili in modo efficace e diano risulta8 con la precisione voluta. Criteri esterni, lega8 agli scopi, alle teorie e ai da8 sperimentali: Validità empirica, rela8va alla corrispondenza del comportamento tra sistema e modello Validità teorica, rela8va alla coerenza tra le ipotesi implicite e quelle acceeate. Validità pragma8ca, riferita all efficacia del modello di raggiungere gli obie4vi. Resta comunque complesso definire una misura ogge4va di tale efficacia. Validità euris8ca, rela8va alla capacità del modello di fornire suggerimen8 per l interpretazione dei fenomeni, per la verifica delle ipotesi e l individuazione di nuovi temi di ricerca.
11 StruEura anali8ca del modello Modelli determinis8ci, in cui le variabili di stato ed i parametri sono variabili determinis8che. Modelli stocas8ci, in cui le variabili di stato ed i parametri sono variabili aleatorie o processi stocas8ci. Modelli stocas8ci/determinis8ci, in cui le variabili di stato appartengono alla prima classe e i parametri all altra, o viceversa. Modelli lineari e non, in cui le relazioni tra le variabili sono lineari o meno. Modelli a parametri concentra8, in cui si concentrano le cause e gli effe4 in compar8men8 e si costruiscono le relazioni tra le variabili di tali compar8men8. Modelli a parametri distribui8, in cui cause ed effe4 non possono essere compar8mentalizza8.
12 Modello del metabolismo del glucosio a digiuno
13 Modello del metabolismo del glucosio a digiuno Poiché spesso il sito d interesse non è accessibile, si effeeua un prelievo di sangue (arterioso o venoso) e, tramite modelli matema8ci, si s8mano i parametri d interesse. Produzione di glucosio (input) U8lizzo di glucosio
14 Modello del metabolismo del glucosio a digiuno Dal prelievo di sangue a digiuno misuriamo la concentrazione del glucosio [G]. [G] è funzione sia della produzione (input) che dell u8lizzazione (output). Se sia l input che l output aumentano [G] rimane costante. Quindi la sola conoscenza di [G] non ci permeee di conoscere indipendentemente input e output e abbiamo bisogno di una sostanza che tracci il glucosio senza perturbarne lo stato stazionario.
15 TRACCIANTI
16 Tracciante È una sostanza marcata con un isotopo con le stesse caraeeris8che chimico- fisiche ma diversa massa: 1. si comporta come la sostanza che vogliamo studiare (sost. tracciata) 2. possiamo misurare separatamente il tracciante dalla sost. tracciata
17 Isotopi Gli isotopi (lee. nello stesso luogo) sono atomi dello stesso elemento chimico, e quindi con lo stesso numero atomico (cioè numero di protoni), ma con differente numero di massa, e quindi massa atomica. 1 H Idrogeno p 2 H Deuterio n p 3 H Trizio n n p e e e
18 Isotopi La differenza delle masse è dovuta a un diverso numero di neutroni presen8 nel nucleo dell'atomo. Se 2 nuclei contengono lo stesso numero di protoni, ma un numero differente di neutroni, i due nuclei avranno lo stesso comportamento chimico (con delle minime differenze nei tempi di reazione e nell'energia di legame), ma avranno comportamen8 fisici differen8, essendo uno più pesante dell'altro.
19 Isotopi Possono essere sia stabili che radioa4vi. 1 H Possono essere sia stabili che radioattivi. Idrogeno Massa=1 p 2 H Deuterio Massa=2 n p 3 H Trizio Massa=3 n n p e e e
20 Breve richiamo Atomic number (Z) = number of protons in nucleus Mass number (A) = number of protons + number of neutrons = atomic number (Z) + number of neutrons Mass Number Atomic Number A Z X Element Symbol
21 Isotopi radioa4vi La radioa4vità è causata dal rilascio spontaneo di par8celle e/o energia eleeromagne8ca dal nucleo di un atomo. La radioa4vità risiede nei NUCLEI INSTABILI. Nucleo decade con EMISSIONE DI RADIAZIONI. I traccian8 radioa4vi si caraeerizzano per sviluppare un processo di decadimento con disintegrazione e produzione di nuovi elemen8. Nel corso della disintegrazione vengono emesse radiazioni, la cui misura permeee di seguire lo svolgersi dei processi in aeo. La radioa4vità è misurata in: disintegrazioni/tempo. L unità standard sono i bequerel (Bq), corrispondente ad 1 decadimento per secondo Un altra unità di misura è il curie (Ci), equivalente a 3.7 x disint./sec.
22 Proprietà dei radioisotopi Tipo di emissione Emivita Energia di emissione
23 Tipi di emissione Par8celle α: nuclei di elio (isotopi pesan8; Z>82) Par8celle β: negatroni (eleeroni) o positroni Raggi γ: radiazioni eleeromagne8che derivate da riarrangiamen8 nucleari
24 Velocità del decadimento radioa4vo Il decadimento segue una cine8ca di I ordine: - dn(t)/dt = λn λ = costante di decadimento Integrando: ln N(t)/No = - λt In pra8ca la velocità di decadimento è espressa come emi- vita o tempo di dimezzamento t 1 2, cioè il tempo necessario perché l a4vità decada del 50 %: ln0.5=- λt log 10 2 = λt 1 2 t 1 2 = 0.693/λ
25 Emivita
26 Capacità di penetrazione
27 Radioisotopi in medicina 24 Na, t 1 2 = 14.8 hr, β emieer, blood- flow tracer 131 I, t 1 2 = 14.8 hr, β emieer, thyroid gland ac8vity 123 I, t 1 2 = 13.3 hr, γ ray emieer, brain imaging 18 F, t 1 2 = 1.8 hr, β + emieer, positron emission tomography 99m Tc, t 1 2 = 6 hr, γ ray emieer, imaging agent
28 Reazioni Chimiche vs Nucleari Reazioni Chimiche Gli atomi sono riarrangia8 aeraverso la roeura e la formazione di legami chimici Solamente gli eleeroni negli orbitali atomici o molecolari sono coinvol8 nella formazione o nella roeura dei legami Le reazioni sono accompagnate dall assorbimento o dal rilascio di una piccola quan8tà di energia La velocità di reazione sono influenzate da temperatura, pressione, concentrazione e catalisi Reazioni Nucleari Gli elemen8 (o gli isotopi di uno stesso elemento) vengono conver88 uno nell altro Protoni, neutroni, eleeroni ed altre par8celle elementari possono essere coinvol8 Le reazioni sono accompagna8 dall assorbimento o dal rilascio di una grande quan8tà di energia La velocità di reazione è normalmente non influenzata da temperatura, pressione e catalisi
29 Isotopi maggiormente u8lizza8 nella ricerca biologica Common Stable 1 H Rare stable 2 H (0.02%) Radioactive 3 H 12 C 13 C (1.1%) 14 C 14 N 16 O 15 N (0.37%) 18 O (0.04%) * *
30 Isotopi stabili vs radioa4vi Isotopi stabili Sicuri, non tossici Possono essere u8lizza8 in neona8, bambini e donne in gravidanza Diversi traccian8 possono essere u8lizza8 contemporaneamente in studi ripetu8 Il costo di alcuni traccian8 è davvero elevato È necessaria una grande quan8tà di tracciante (elevato rumore di fondo) AErezzature costose, personale tecnico qualificato Isotopi radioa7vi Radiazioni ionizzan8 Non posso essere u8lizza8 in tuea la popolazione Limitazioni nel numero di traccian8 e in studi ripetu8 Non esistono isotopi a lunga vita per O e N Non ci sono problemi di rumore di fondo, è necessaria una piccola quan8tà di tracciante AErezzature semplici e poco costose
31 Tracciante È una molecola in cui uno o più atomi sono sta8 sos8tui8 ( marca8 ) con isotopi e che si comporta come la sostanza che vogliamo studiare (sost. tracciata). Nel caso che il tracciante si compor8 sensibilmente diversamente dalle molecole che sos8tuisce (una massa diversa può influire su velocità di diffusione e di reazione chimica) si parla di effeeo di frazionamento dell isotopo.
32 Tracciante Da notare che le sostanze comunemente elaborate dai sistemi biologici sono in mol8 casi ognuna già una mistura di isotopi, anche se uno di essi è presente in quan8tà percentuale molto maggiore. Nell uso dei traccian8 non si fa quindi altro che aumentare la percentuale di uno degli altri isotopi, così da permeeere una più facile analisi dei processi in gioco. Oppure si introduce del tueo un nuovo isotopo.
33 Isotopi stabili nel corpo umano 11.4 kg C 137 g 4.6 g kg g 1.3 kg 5.1 g 14 N N kg H D 1.5 g
34 Esempi tracciante H H H H H CH 2 NH 2 C H COOH L- Phenylalanine 3 H = Tritium 3 H 3 H 3 H 3 H 3 H CH 2 NH 2 C H COOH L- [ring- 3 H 5 ]Phenylalanine 2 H = D (deuterium) D D D D D CH 2 NH 2 C H COOH L- [ring- 2 H 5 ]Phenylalanine C-4 C-6 C-8 CH 2 C-3 15 NH 2 C-2 C-1 C H COOH L- [2-15 N]Phenylalanine C-4 C-6 C-8 CH 2 C-3 C-2 NH 2 C H 13 COOH C-1 L- [1-13 C]Phenylalanine
35 Come misurare i traccian8 (1/4) Contatori di radioa4vità: Per ionizzazione (contatore Geiger- Muller), Per eccitazione (scin8llatori - gamma counter, beta counter) SpeErometro di massa: massa delle molecole o degli atomi all interno delle molecole dopo combus8one o conversione in gas (CO 2, N 2, H 2 )
36 Come misurare i traccian8 (2/4) Traccian8 radioa4vi I traccian8 radioa4vi si caraeerizzano per sviluppare un processo di decadimento con disintegrazione e produzione di nuovi elemen8. Nel corso della disintegrazione vengono emesse radiazioni, la cui misura permeee di seguire lo svolgersi dei processi in aeo. Unità di misura nella pra8ca: unità di conto/tempo (fornisce la quan8tà di radiazione effe4vamente rilevata). A pari condizioni di emissione, il valore in unita di conto è minore (al massimo uguale) rispeeo quello teorico. Per effeeo della geometria del sistema ricevitore ed altre sostanze presen8, la radiazione rilevabile è minore di quella teorica.
37 Come misurare i traccian8 (3/4) A7vità specifica: radioa4vità/(massa) = unità di conto /(massa tempo) Quan8tà tracciante: quan8tà minima di tracciante da immeeere, che permeee: di studiare 1 o più compar8men8. di essere piccola abbastanza da creare il minimo disturbo al sistema (in par8colare per le radiazioni emesse). Nella pra8ca si opera con quan8tà inferiori al 1%.
38 Come misurare i traccian8 (4/4) Traccian6 stabili Non emeeono radiazioni, per cui sono rileva8 in base a misure legate alla differenza di massa con analoghi isotopi più comuni. Unità di misura: molecole marcate/ totale molecole d interesse presen8 (altre unità di misura sono comunque usate). A4vità specifica: molecole marcate/ totale molecole d interesse presen8/massa (altre unità di misura coincidono direeamente con a.s.) Essendo il metodo di misura meno sensibile di quello usato per i traccian8 radioa4vi, è necessario impiegare una maggiore quan8tà di tracciante, per altro permessa dalla minore pericolosità.
39 U8lizzo di isotopi in studi del metabolismo umano Principio di diluizione del tracciante Modelli sta8ci Modelli dinamici Add known amount of tracer.. Mix and take small sample Infuse tracer with enrichment E i at a constant rate of i µmol/kg.min Tracer enrichment Plateau enrichment..and measure tracer/tracee ratio time E p..to unknown amount tracee Measure tracer enrichment
40 MODELLI NON- COMPARTIMENTALI
41 Approccio non compar8mentale Nessuna assunzione circa la distribuzione della sostanza all interno del corpo Conoscenza descri4va tra riguardo il tracciante (farmaco) Scarsa correlazione rispeeo alle specifiche funzioni di un organo La mancanza di assunzioni a priori consente di minimizzare gli eventuali bias dovute alla modellazione Descrizione dei da8 sperimentali tramite delle curve esponenziali
42 Esperimento Bolo di sostanza
43 Approccio non compar8mentale Da8 no8: Dose Osservare: C max (concentrazione massima) e T max (istante a cui si verifica la concentrazione massima) Calcolare: AUC (Area under curve - area soeo la curva; aeraverso la regola dei trapezi oppure integrando una curva teorica (es. esponenziali) che descrive i da8 sperimentali) k (elimina8on rate) Volume di distribu8one Clearance T 1/2
44 Area soeo la curva Metodo dei trapezi
45 Area soeo la curva 0 ) ( 0 > = k e C t C t k k C AUC e k C e k C dt e C dt t C t t k t t k t k ) ( = = = = Generalizzazione per curve a più esponenziali
46 Clearance Volume dal quale il farmaco viene rimosso in una data unità di tempo (volume / tempo) E una costante rispeeo alla dose e al tempo Può essere calcolato da: Excre8on rate (Rd) / Concentra8on (mg/min) / (mg/ml) = ml/min Dose / AUC (mg) / (mg/ml*min) = ml/min
47 Clearence La Clearance NON è un conceeo di eliminazione Collega la concentrazione con la velocità di eliminazione Elimination rate (Rd)= Concentrat x Clearance mg\min mg/ml ml/min L unità di misura dell elimina8on rate è massa per unità di tempo (mg/min) L unità di misura della Clearance è volume per unità di tempo (ml/min)
48 Volume di distribuzione V d lega la concentrazione della sostanza alla quan8ta di sostanza (A) (tracciante/ farmaco) presente nel corpo A=CxV d V d una costante rispeeo alla dose e al tempo V d =[Dose/(AUC 0- *k)]=cl/k Se diamo un bolo, la concentrazione estrapolata al tempo 0: C 0 =Dose/V d
49 Tempo medio di residenza Mean Residence Time (MRT) Tempo che mediamente una molecola di farmaco trascorre all interno del corpo MeEe in relazione la clearence con il volume di distribuzione MRT=V d /CL
50 MODELLI COMPARTIMENTALI
51 Modelli compar8mentali I modelli compar8mentali traggono il loro nome dalla scomposizione del sistema in varie par8 (compar8men8). Per compar8mento si intende un insieme di materia che per l organismo si comporta in maniera omogenea (sia dal punto di vista della distribuzione che del comportamento cine8co all interno del compar8mento). L approccio prevede l impiego di n variabili funzioni del tempo e legate da equazioni differenziali ordinarie. Tali equazioni vengono scriee a par8re da un unico conceeo base: il rispeeo della conservazione della massa.
52 I compar8men8 I compar8men8 sono volumi ideali, non necessariamente volumi reali, nei quali la sostanza (e il tracciante o il farmaco) entra, si distribuisce, esce. Un compar8mento può essere un insieme di tessu8 differen8 che possiedono un affinità per il farmaco e una perfusione sanguigna molto simile. Il numero di compar8men8 si stabilisce in base alla differenza piu o meno elevata che c è tra una costante di velocità e l altra. Il modello cine8co che ricorre piu spesso e il piu semplice e il modello mono- compar8mentale aperto.
53 Modello mono compar8mentale
54 Modello mono compar8mentale Assunzioni: Il corpo cos8tuisce un unico processo Miscelamento istantaneo Il tracciante (farmaco) si miscela istantaneamente nel sangue o nel plasma Un compar8mento Il tracciante (farmaco) che si trova nel sangue (plasma) è in equilibrio rapido con il tracciante (farmaco) che si trova nei tessu8 extravascolari. Modello lineare L eliminazione del farmaco segue una cine8ca del primo ordine
55 Modello monocompar8mentale Calcolare la cine8ca di un substrato significa determinare la velocità di comparsa (rate of appearance, Ra) di un substrato e, perlomeno nello stato stazionario, la velocità di scomparsa dello stesso (rate of disappearance, Rd). Possono inoltre essere deriva8 altri parametri come l emivita, il tempo medio di residenza e la clearance.
56 Modello monocompar8mentale Andamento del tracciante durante un esperimento di infusione con8nua tempo
57 Modello monocompar8mentale Andamento del tracciante durante un esperimento di infusione con8nua Vedi dispense per gli esperimen8 di infusione con8nua, bolo, e primed constant infusion
Modelli compartimentali e farmacocinetica.
 Modelli compartimentali e farmacocinetica carmelo.demaria@centropiaggio.unipi.it Domanda http://goo.gl/forms/i87yy6kdds Obiettivi Apprendere le tecniche matematiche per l analisi della cinetica dei traccianti
Modelli compartimentali e farmacocinetica carmelo.demaria@centropiaggio.unipi.it Domanda http://goo.gl/forms/i87yy6kdds Obiettivi Apprendere le tecniche matematiche per l analisi della cinetica dei traccianti
Calcolo delle cinetiche dei substrati: modello monocompartimentale.
 Calcolo delle cinetiche dei substrati: modello monocompartimentale. Calcolare la cinetica di un substrato significa determinare la velocità di comparsa (rate of appearance, Ra) di un substrato e, perlomeno
Calcolo delle cinetiche dei substrati: modello monocompartimentale. Calcolare la cinetica di un substrato significa determinare la velocità di comparsa (rate of appearance, Ra) di un substrato e, perlomeno
La radioattività. La radioattività è il fenomeno per cui alcuni nuclei si trasformano in altri emettendo particelle e/ radiazioneni elettromagnetiche.
 La radioattività La radioattività è il fenomeno per cui alcuni nuclei si trasformano in altri emettendo particelle e/ radiazioneni elettromagnetiche. La radioattività: isotopi. Il numero totale di protoni
La radioattività La radioattività è il fenomeno per cui alcuni nuclei si trasformano in altri emettendo particelle e/ radiazioneni elettromagnetiche. La radioattività: isotopi. Il numero totale di protoni
TECNICHE RADIOCHIMICHE
 TECNICHE RADIOCHIMICHE L ATOMO - Un atomo e costituito da un nucleo carico positivamente, circondato da una nuvola di elettroni carichi negativamente. - I nuclei atomici sono costituiti da due particelle:
TECNICHE RADIOCHIMICHE L ATOMO - Un atomo e costituito da un nucleo carico positivamente, circondato da una nuvola di elettroni carichi negativamente. - I nuclei atomici sono costituiti da due particelle:
Lezione 24 Radiazioni Ionizzanti
 Generalità Lezione 24 Radiazioni Ionizzanti Con il termine radiazione si descrivono fenomeni molto diversi fra loro: Emissione di luce da una lampada Emissione di calore da una fiamma Particelle elementari
Generalità Lezione 24 Radiazioni Ionizzanti Con il termine radiazione si descrivono fenomeni molto diversi fra loro: Emissione di luce da una lampada Emissione di calore da una fiamma Particelle elementari
Modelli compartimentali e farmacocinetica.
 Modelli compartimentali e farmacocinetica carmelo.demaria@centropiaggio.unipi.it Domanda http://goo.gl/forms/yvwxiwdfcq Distribuzione dell acqua Modelli compartimentali I modelli compartimentali traggono
Modelli compartimentali e farmacocinetica carmelo.demaria@centropiaggio.unipi.it Domanda http://goo.gl/forms/yvwxiwdfcq Distribuzione dell acqua Modelli compartimentali I modelli compartimentali traggono
CAPITOLO 20 LA CHIMICA NUCLEARE
 CAPITOLO 20 LA CHIMICA NUCLEARE 20.5 (a) La soma dei numeri atomici e la somma dei numeri di massa, da entrambi i lati dell equazione nucleare, deve coincidere. Dalla parte sinistra di questa equazione
CAPITOLO 20 LA CHIMICA NUCLEARE 20.5 (a) La soma dei numeri atomici e la somma dei numeri di massa, da entrambi i lati dell equazione nucleare, deve coincidere. Dalla parte sinistra di questa equazione
Esercizi su Chimica Nucleare e Nucleogenesi
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi su Chimica Nucleare e Nucleogenesi Prof. Dipartimento CMIC Giulio Natta http://chimicaverde.vosi.org/citterio/it//
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi su Chimica Nucleare e Nucleogenesi Prof. Dipartimento CMIC Giulio Natta http://chimicaverde.vosi.org/citterio/it//
Le radiazioni ionizzanti e la radioprotezione
 Le radiazioni ionizzanti e la radioprotezione Radiazioni Radiazioniionizzanti ionizzanti Il termine radiazione viene abitualmente usato per descrivere fenomeni apparentemente assai diversi tra loro,
Le radiazioni ionizzanti e la radioprotezione Radiazioni Radiazioniionizzanti ionizzanti Il termine radiazione viene abitualmente usato per descrivere fenomeni apparentemente assai diversi tra loro,
Chimica Nucleare. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Chimica Nucleare Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. 1 Riassunto Numero Atomico (Z) = numero di protoni nel nucleo Numero di Massa (A) = numero di
Chimica Nucleare Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. 1 Riassunto Numero Atomico (Z) = numero di protoni nel nucleo Numero di Massa (A) = numero di
Cenni di fisica moderna
 Cenni di fisica moderna 1 fisica e salute la fisica delle radiazioni è molto utilizzata in campo medico esistono applicazioni delle radiazioni non ionizzanti nella terapia e nella diagnosi (laser per applicazioni
Cenni di fisica moderna 1 fisica e salute la fisica delle radiazioni è molto utilizzata in campo medico esistono applicazioni delle radiazioni non ionizzanti nella terapia e nella diagnosi (laser per applicazioni
Emissione α. La sua carica elettrica è pari a +2e La sua massa a riposo è circa 7x10-27 kg.
 Reazioni nucleari Un nucleo instabile può raggiungere una nuova condizione di stabilità attraverso una serie di decadimenti con emissione di particelle α, β, γ o di frammenti nucleari (fissione). Emissione
Reazioni nucleari Un nucleo instabile può raggiungere una nuova condizione di stabilità attraverso una serie di decadimenti con emissione di particelle α, β, γ o di frammenti nucleari (fissione). Emissione
La Radioattività. da:ispra istituto superiore per la ricerca e protezione ambientale
 La Radioattività da:ispra istituto superiore per la ricerca e protezione ambientale Isotopi: Nuclei diversi del medesimo elemento chimico Vi sono elementi con atomi che, a parità di numero di protoni,
La Radioattività da:ispra istituto superiore per la ricerca e protezione ambientale Isotopi: Nuclei diversi del medesimo elemento chimico Vi sono elementi con atomi che, a parità di numero di protoni,
Il Nucleo. Dimensioni del nucleo dell'ordine di 10. m Il raggio nucleare R = R 0 -15
 Il Nucleo Nucleo e' costituito da nucleoni (protoni e neutroni). Mentre i neutroni liberi sono abbastanza instabili tendono a decadere in un protone ed un elettrone (t 1/2 circa 900 s), i protoni sono
Il Nucleo Nucleo e' costituito da nucleoni (protoni e neutroni). Mentre i neutroni liberi sono abbastanza instabili tendono a decadere in un protone ed un elettrone (t 1/2 circa 900 s), i protoni sono
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. Le particelle fondamentali
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. Le particelle fondamentali
Il numero di protoni presenti in un atomo si chiama numero atomico = Z elemento differisce per il numero Z. H deuterio (6000 volte abbondante)
 Il numero di protoni presenti in un atomo si chiama numero atomico = Z elemento differisce per il numero Z ogni ISOTOPI atomi di uno stesso elemento ma con un N di neutroni x es. 14 C e 12 C l H ha 3 isotopi:
Il numero di protoni presenti in un atomo si chiama numero atomico = Z elemento differisce per il numero Z ogni ISOTOPI atomi di uno stesso elemento ma con un N di neutroni x es. 14 C e 12 C l H ha 3 isotopi:
Radioattività. 1. Massa dei nuclei. 2. Decadimenti nucleari. 3. Legge del decadimento XVI - 0. A. Contin - Fisica Generale Avanzata
 Radioattività 1. Massa dei nuclei 2. Decadimenti nucleari 3. Legge del decadimento XVI - 0 Nucleoni Protoni e neutroni sono chiamati, indifferentemente, nucleoni. Il numero di protoni (e quindi di elettroni
Radioattività 1. Massa dei nuclei 2. Decadimenti nucleari 3. Legge del decadimento XVI - 0 Nucleoni Protoni e neutroni sono chiamati, indifferentemente, nucleoni. Il numero di protoni (e quindi di elettroni
Come calcolare i parametri farmacocinetici
 Come calcolare i parametri farmacocinetici La conoscenza dei parametri farmacocinetici fondamentali di un farmaco è essenziale per comprendere in che modo esso venga trattato dall organismo e come sia
Come calcolare i parametri farmacocinetici La conoscenza dei parametri farmacocinetici fondamentali di un farmaco è essenziale per comprendere in che modo esso venga trattato dall organismo e come sia
LA STRUTTURA DELL ATOMO
 Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Lezione 2 Anno Accademico 2010-2011 Docente: Dimitrios Fessas LA STRUTTURA DELL ATOMO IL NUCLEO In fisica
Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Lezione 2 Anno Accademico 2010-2011 Docente: Dimitrios Fessas LA STRUTTURA DELL ATOMO IL NUCLEO In fisica
REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA
 REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA Reazione chimica in condizione di equilibrio: concentrazioni costanti che obbediscono al vincolo determinato dalla costante
REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA Reazione chimica in condizione di equilibrio: concentrazioni costanti che obbediscono al vincolo determinato dalla costante
1.1 Struttura dell atomo
 CAPITOLO I Richiami di fisica generale e descrizione delle radiazioni ionizzanti. Struttura dell atomo L atomo è la più piccola porzione di un elemento chimico, che conserva le proprietà dell elemento
CAPITOLO I Richiami di fisica generale e descrizione delle radiazioni ionizzanti. Struttura dell atomo L atomo è la più piccola porzione di un elemento chimico, che conserva le proprietà dell elemento
ARGOMENTO: Cenni di Fisica del Nucleo
 UNIVERSITA DEGLI STUDI DI GENOVA C.L. TECNICHE DIAGNOSTICHE RADIOLOGICHE CORSO INTEGRATO: MISURE ELETTRICHE ED ELETTRONICHE MATERIA: FISICA APPLICATA 2 (2 anno 1 sem) ARGOMENTO: Cenni di Fisica del Nucleo
UNIVERSITA DEGLI STUDI DI GENOVA C.L. TECNICHE DIAGNOSTICHE RADIOLOGICHE CORSO INTEGRATO: MISURE ELETTRICHE ED ELETTRONICHE MATERIA: FISICA APPLICATA 2 (2 anno 1 sem) ARGOMENTO: Cenni di Fisica del Nucleo
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
Il modello strutturale dell atomo
 Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia. Massa atomica MOLE. a.a.
 Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia Massa atomica MOLE a.a. 2016-17 MATERIA costituita da ATOMI Miscele OMOGENEE o soluzioni Hanno la
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia Massa atomica MOLE a.a. 2016-17 MATERIA costituita da ATOMI Miscele OMOGENEE o soluzioni Hanno la
DECADIMENTO RADIOATTIVO
 DECADIMENTO RADIOATTIVO Emissione di una o più particelle da parte di un nucleo. Tutti i decadimenti (tranne il decad. γ) cambiano Z e/o N del nucleo. Radionuclidi = Nuclidi radioattivi presenti in natura:
DECADIMENTO RADIOATTIVO Emissione di una o più particelle da parte di un nucleo. Tutti i decadimenti (tranne il decad. γ) cambiano Z e/o N del nucleo. Radionuclidi = Nuclidi radioattivi presenti in natura:
ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI
 ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI Nelle reazioni chimiche gli atomi reagenti non cambiano mai la loro natura ( nucleo ) ma la loro configurazione elettronica. Nello specifico ad interagire
ORBITALI E CARATTERISTICHE CHIMICHE DEGLI ELEMENTI Nelle reazioni chimiche gli atomi reagenti non cambiano mai la loro natura ( nucleo ) ma la loro configurazione elettronica. Nello specifico ad interagire
Decadimento a. E tipico dei radioisotopi con Z > 82 (Pb), nei quali il rapporto tra il numero dei neutroni e quello dei protoni è troppo basso.
 Decadimento a Nel decadimento vengono emesse particelle formate da 2 protoni e 2 neutroni ( = nuclei di 4He) aventi velocità molto elevate (5-7% della velocità della luce) E tipico dei radioisotopi con
Decadimento a Nel decadimento vengono emesse particelle formate da 2 protoni e 2 neutroni ( = nuclei di 4He) aventi velocità molto elevate (5-7% della velocità della luce) E tipico dei radioisotopi con
COMPETENZE ABILITÀ CONOSCENZE. descrivere la. Comprendere ed applicare analogie relative ai concetti presi in analisi. struttura.
 ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
Radioattività artificiale Origine e impieghi
 ORIGIE DELL RDIOTTIVIT Radioattività naturale Raggi cosmici (primari e secondari) Radionuclidi primordiali (isolati) Famiglie radioattive naturali Radioattività artificiale Origine e impieghi L L RDIOTTIVIT
ORIGIE DELL RDIOTTIVIT Radioattività naturale Raggi cosmici (primari e secondari) Radionuclidi primordiali (isolati) Famiglie radioattive naturali Radioattività artificiale Origine e impieghi L L RDIOTTIVIT
Un po' di fisica nucleare: La radioattività
 Un po' di fisica nucleare: La radioattività at e ve de n d o.. = La radioattività La radioattività è il fenomeno per cui alcuni nuclei si trasformano in altri emettendo particelle. La radioattività non
Un po' di fisica nucleare: La radioattività at e ve de n d o.. = La radioattività La radioattività è il fenomeno per cui alcuni nuclei si trasformano in altri emettendo particelle. La radioattività non
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Esercitazioni di Elementi di Chimica. Modulo 2 Struttura della Materia
 Esercitazioni di Elementi di Chimica Modulo 2 Struttura della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Qual è lo stato fisico
Esercitazioni di Elementi di Chimica Modulo 2 Struttura della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Qual è lo stato fisico
Unità didattica 10. Decima unità didattica (Fisica) 1. Corso integrato di Matematica e Fisica per il Corso di Farmacia
 Unità didattica 10 Radioattività... 2 L atomo... 3 Emissione di raggi x... 4 Decadimenti nucleari. 6 Il decadimento alfa.... 7 Il decadimento beta... 8 Il decadimento gamma...... 9 Interazione dei fotoni
Unità didattica 10 Radioattività... 2 L atomo... 3 Emissione di raggi x... 4 Decadimenti nucleari. 6 Il decadimento alfa.... 7 Il decadimento beta... 8 Il decadimento gamma...... 9 Interazione dei fotoni
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Modelli differenziali per le scienze della vita
 Modelli differenziali per le scienze della vita Andrea Susa Agenda Modelli Matematici Crescita delle popolazioni isolate crescita di una cellula Decadimento radioattivo Modello Malthus Modello a crescita
Modelli differenziali per le scienze della vita Andrea Susa Agenda Modelli Matematici Crescita delle popolazioni isolate crescita di una cellula Decadimento radioattivo Modello Malthus Modello a crescita
ELEMENTI di CHIMICA NUCLEARE. La FISSIONE NUCLEARE
 ELEMENTI di CHIMICA NUCLEARE La FISSIONE NUCLEARE Lo scienziato Otto Hahn nel 938 scoprì che l'uranio 35 9U è fissile. La fissione è una rottura dei nuclei pesanti e può avvenire quando un neutrone lento
ELEMENTI di CHIMICA NUCLEARE La FISSIONE NUCLEARE Lo scienziato Otto Hahn nel 938 scoprì che l'uranio 35 9U è fissile. La fissione è una rottura dei nuclei pesanti e può avvenire quando un neutrone lento
Legge dell azione di massa. Misura sperimentale della costante di equilibrio. Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Legge dell azione di massa Il caso dei gas: utilizziamo le pressioni parziali Lezione 7-8 1 Per definizione le concentrazioni
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Legge dell azione di massa Il caso dei gas: utilizziamo le pressioni parziali Lezione 7-8 1 Per definizione le concentrazioni
Lezione 2. Leggi ponderali
 Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
La datazione mediante radioisotopi
 : Le trasformazioni nucleari: La datazione mediante radioisotopi Lezioni d'autore VIDEO Premessa (I) I processi radioattivi sono reazioni che dipendono dalla struttura nucleare degli atomi. Il rapporto
: Le trasformazioni nucleari: La datazione mediante radioisotopi Lezioni d'autore VIDEO Premessa (I) I processi radioattivi sono reazioni che dipendono dalla struttura nucleare degli atomi. Il rapporto
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 7 Le particelle dell atomo 3 Sommario (I) 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 7 Le particelle dell atomo 3 Sommario (I) 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le
MASSE ATOMICHE. Oggi è possibile misurare accuratamente le masse atomiche tramite uno strumento chiamato spettrometro di massa
 Stechiometria MASSE ATOMICHE Dal 1969 si usa una scala basata sull'isotopo 12 C : a tale isotopo è stata arbitrariamente assegnata una massa di 12 unità di massa atomica. Una unità di massa atomica (a.m.u.)=
Stechiometria MASSE ATOMICHE Dal 1969 si usa una scala basata sull'isotopo 12 C : a tale isotopo è stata arbitrariamente assegnata una massa di 12 unità di massa atomica. Una unità di massa atomica (a.m.u.)=
LA STRUTTURA DELL ATOMO
 Capitolo 4 LA STRUTTURA DELL ATOMO N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo Leo - Chimica
Capitolo 4 LA STRUTTURA DELL ATOMO N.B I concetti proposti sulle slide, in linea di massima seguono l ordine e i contenuti del libro, ma!!!! Ci possono essere delle variazioni Prof. Vincenzo Leo - Chimica
Intro & Stechiometria
 CHIMICA Studio della materia (composizione, stru7ura e proprietà) e dei suoi cambiamen; (trasformazioni) Azione: su due livelli macroscopico (proprietà e trasformazioni della materia visibile) microscopico
CHIMICA Studio della materia (composizione, stru7ura e proprietà) e dei suoi cambiamen; (trasformazioni) Azione: su due livelli macroscopico (proprietà e trasformazioni della materia visibile) microscopico
Laboratorio di Chimica Generale ed Inorganica. Lezione 3. Atomi ed elementi Unità di massa atomica Mole
 Laboratorio di Chimica Generale ed Inorganica Lezione 3 Atomi ed elementi Unità di massa atomica Mole Dott.ssa Lorenza Marvelli Dipartimento di Scienze Chimiche e Farmaceutiche Laboratorio di Chimica Generale
Laboratorio di Chimica Generale ed Inorganica Lezione 3 Atomi ed elementi Unità di massa atomica Mole Dott.ssa Lorenza Marvelli Dipartimento di Scienze Chimiche e Farmaceutiche Laboratorio di Chimica Generale
DECADIMENTI. Fissione spontanea di atomi instabili con emissione di neutroni
 DECADIMENTI Fissione spontanea di atomi instabili con emissione di neutroni DECADIMENTO ALPHA Tipico di elementi pesanti che diventano più stabili dopo il decadimento. DECADIMENTO BETA Prodotto da interazione
DECADIMENTI Fissione spontanea di atomi instabili con emissione di neutroni DECADIMENTO ALPHA Tipico di elementi pesanti che diventano più stabili dopo il decadimento. DECADIMENTO BETA Prodotto da interazione
Principio dell Aufbau (riempimento)
 LA TABELLA PERIODICA DEGLI ELEMENTI Principio dell Aufbau (riempimento) Schema semplificato dei livelli energetici atomici Distribuzione energetica reale dei livelli energetici atomici 7p Schema empirico
LA TABELLA PERIODICA DEGLI ELEMENTI Principio dell Aufbau (riempimento) Schema semplificato dei livelli energetici atomici Distribuzione energetica reale dei livelli energetici atomici 7p Schema empirico
Camera a Ioni. Misure di Radon. Sistema Theremino Rev.1. Sistema Theremino IonChamber_ITA - 22/06/2015 Pag. 1
 Camera a Ioni Misure di Radon Sistema Theremino Rev.1 Sistema Theremino IonChamber_ITA - 22/06/2015 Pag. 1 Sommario Misure con Camera a Ioni... 3 Teoria... 3 Apparecchiature... 3 Radon in abitazione -
Camera a Ioni Misure di Radon Sistema Theremino Rev.1 Sistema Theremino IonChamber_ITA - 22/06/2015 Pag. 1 Sommario Misure con Camera a Ioni... 3 Teoria... 3 Apparecchiature... 3 Radon in abitazione -
Valenza didattica (aggiunta e principale) Individuazione della grandezza da misurare. Misure ccomplementari/alternative
 Misura del coefficiente di emanazione del radon da un materiale poroso Valenza didattica (aggiunta e principale) Contesto Tematica Individuazione della grandezza da misurare Metodologia di misura Misure
Misura del coefficiente di emanazione del radon da un materiale poroso Valenza didattica (aggiunta e principale) Contesto Tematica Individuazione della grandezza da misurare Metodologia di misura Misure
Elio GIROLETTI - Università degli Studi di Pavia - Dip. Fisica nucleare e teorica marzo 2005
 UNIVERSITÀ DEGLI STUDI DI PVI dip. Fisica nucleare e teorica via assi 6, 271 Pavia, Italy tel. 38298.795 - girolett@unipv.it - www.unipv.it/webgiro webgiro elio giroletti radioattività (cenni) ELEMENTI
UNIVERSITÀ DEGLI STUDI DI PVI dip. Fisica nucleare e teorica via assi 6, 271 Pavia, Italy tel. 38298.795 - girolett@unipv.it - www.unipv.it/webgiro webgiro elio giroletti radioattività (cenni) ELEMENTI
L unità di misura della dose nel S.I. è il Gray
 LA LA DOSE DOSE DA DA RADIAZIONE Le radiazioni (particelle, raggi gamma ) quando interagiscono con un mezzo cedono (tutta o parte) della loro energia al mezzo stesso. Si definisce allora la dose assorbita
LA LA DOSE DOSE DA DA RADIAZIONE Le radiazioni (particelle, raggi gamma ) quando interagiscono con un mezzo cedono (tutta o parte) della loro energia al mezzo stesso. Si definisce allora la dose assorbita
Lo strofinio di qualsiasi oggetto provoca la comparsa su di esso di una carica elettrica che può attrarre piccoli oggetti.
 1. La natura elettrica della materia Lo strofinio di qualsiasi oggetto provoca la comparsa su di esso di una carica elettrica che può attrarre piccoli oggetti. La carica elettrica può essere positiva o
1. La natura elettrica della materia Lo strofinio di qualsiasi oggetto provoca la comparsa su di esso di una carica elettrica che può attrarre piccoli oggetti. La carica elettrica può essere positiva o
CHIMICA: studio della struttura e delle trasformazioni della materia
 CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
La radioattività può avere un origine sia artificiale che naturale.
 http://www.isprambiente.gov.it/it/temi/radioattivita-e-radiazioni/ radioattivita/radioattivita-naturale-e-artificiale La radioattività può avere un origine sia artificiale che naturale. La radioattività
http://www.isprambiente.gov.it/it/temi/radioattivita-e-radiazioni/ radioattivita/radioattivita-naturale-e-artificiale La radioattività può avere un origine sia artificiale che naturale. La radioattività
Sommario della lezione 4. Proprietà periodiche. Massa atomica e massa molecolare. Concetto di mole. Prime esercitazioni
 Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
Linear No-Threshold Hypothesis (LNT)
 Il concetto di dose La Dosimetria Una delle discipline scientifiche che supporta la legge è la dosimetria, cioè la misura delle grandezze che consentono di calcolare il danno biologico dovuto all esposizione
Il concetto di dose La Dosimetria Una delle discipline scientifiche che supporta la legge è la dosimetria, cioè la misura delle grandezze che consentono di calcolare il danno biologico dovuto all esposizione
Le particelle dell atomo
 La carica elettrica I fenomeni elettrici sono noti fin dall antichità: gli antichi Greci usavano la parola elektron per spiegare il fenomeno dell elettrizzazione dell ambra. I Greci sapevano che strofinando
La carica elettrica I fenomeni elettrici sono noti fin dall antichità: gli antichi Greci usavano la parola elektron per spiegare il fenomeno dell elettrizzazione dell ambra. I Greci sapevano che strofinando
MEDICINA NUCLEARE impiego a scopo diagnostico e terapeutico dei radionuclidi (isotopi radioattivi) prodotti artificialmente
 MEDICINA NUCLEARE impiego a scopo diagnostico e terapeutico dei radionuclidi (isotopi radioattivi) prodotti artificialmente Composizione dell atomo (piccola sfera 10 9 cm): a) costituita dal nucleo protoni
MEDICINA NUCLEARE impiego a scopo diagnostico e terapeutico dei radionuclidi (isotopi radioattivi) prodotti artificialmente Composizione dell atomo (piccola sfera 10 9 cm): a) costituita dal nucleo protoni
P. Sapia Università della Calabria. a.a. 2009/10
 FISICA PER I BENI CULTURALI Ii MATERIA E INTERAZIONE CON LA RADIAZIONE P. Sapia Università della Calabria a.a. 2009/10 Interazioni fondamentali Gravitazionale Debolmente attrattiva, tra tutte le particelle
FISICA PER I BENI CULTURALI Ii MATERIA E INTERAZIONE CON LA RADIAZIONE P. Sapia Università della Calabria a.a. 2009/10 Interazioni fondamentali Gravitazionale Debolmente attrattiva, tra tutte le particelle
Corso di chimica generale
 Corso di chimica generale Dr. Riccardo Montioli Email: riccardo.montioli@univr.it Programma - La materia e l energia - Le particelle subatomiche e la misura della massa - L atomo, teorie e struttura -
Corso di chimica generale Dr. Riccardo Montioli Email: riccardo.montioli@univr.it Programma - La materia e l energia - Le particelle subatomiche e la misura della massa - L atomo, teorie e struttura -
FNPA1 Prova parziale del 16/04/2012
 FNPA1 Prova parziale del 16/04/01 Problema 1 L energia di legame dei nuclei 4 He e 7 3 Li è rispettivamente 8.3 e 39.3 MeV. a) Verificare se la reazione p + 7 3 Li 4 3 He + 4 3 He è esotermica o endotermica.
FNPA1 Prova parziale del 16/04/01 Problema 1 L energia di legame dei nuclei 4 He e 7 3 Li è rispettivamente 8.3 e 39.3 MeV. a) Verificare se la reazione p + 7 3 Li 4 3 He + 4 3 He è esotermica o endotermica.
Le neuroimmagini: come la scienza e la tecnologia ci aiutano a studiare le funzioni del cervello. Event funded by FP7-Eu project DECIDE
 Le neuroimmagini: come la scienza e la tecnologia ci aiutano a studiare le funzioni del cervello Event funded by FP7-Eu project DECIDE Le neuroimmagini: visualizzazione in vivo del cervello Il termine
Le neuroimmagini: come la scienza e la tecnologia ci aiutano a studiare le funzioni del cervello Event funded by FP7-Eu project DECIDE Le neuroimmagini: visualizzazione in vivo del cervello Il termine
Classificazione della materia 3 STATI DI AGGREGAZIONE
 Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
La chimica nucleare. A cura della prof. ssa. Barone Antonina
 La chimica nucleare A cura della prof. ssa Barone Antonina La radioattività Nella seconda metà dell 800, Henry Becquerel, Pierre e Marie Curie, scoprirono che alcuni elementi( uranio, torio, radio) emettevano
La chimica nucleare A cura della prof. ssa Barone Antonina La radioattività Nella seconda metà dell 800, Henry Becquerel, Pierre e Marie Curie, scoprirono che alcuni elementi( uranio, torio, radio) emettevano
Elementi sistemati nella TAVOLA PERIODICA DEGLI ELEMENTI in base al numero atomico crescente O, H, N, C (+ del 96% della materia vivente)
 OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
Il Metodo Scientifico
 Unita Naturali Il Metodo Scientifico La Fisica si occupa di descrivere ed interpretare i fenomeni naturali usando il metodo scientifico. Passi del metodo scientifico: Schematizzazione: modello semplificato
Unita Naturali Il Metodo Scientifico La Fisica si occupa di descrivere ed interpretare i fenomeni naturali usando il metodo scientifico. Passi del metodo scientifico: Schematizzazione: modello semplificato
Distaccamento Volontari Caselle Torinese 5) RADIOATTIVITA. Testi, immagini ed argomenti trattati a cura del Comando Provinciale di Torino
 5) RADIOATTIVITA 5.1 Radioattività Parlando di radioattività bisogna partire dai concetti introduttivi di fisica nucleare. 5.1.1 L atomo L atomo può essere definito la più piccola parte di un elemento
5) RADIOATTIVITA 5.1 Radioattività Parlando di radioattività bisogna partire dai concetti introduttivi di fisica nucleare. 5.1.1 L atomo L atomo può essere definito la più piccola parte di un elemento
TECNICHE SPETTROSCOPICHE
 TECNICHE SPETTROSCOPICHE L interazione delle radiazioni elettromagnetiche con la materia e essenzialmente un fenomeno quantico, che dipende sia dalle proprieta della radiazione sia dalla natura della materia
TECNICHE SPETTROSCOPICHE L interazione delle radiazioni elettromagnetiche con la materia e essenzialmente un fenomeno quantico, che dipende sia dalle proprieta della radiazione sia dalla natura della materia
PRODUZIONE DI RADIOFARMACI EMETTITORI DI POSITRONI CON CICLOTRONE AD USO MEDICALE
 PRODUZIONE DI RADIOFARMACI EMETTITORI DI POSITRONI CON CICLOTRONE AD USO MEDICALE Dr. Asti Mattia Servizio di Medicina Nucleare Arcispedale Santa Maria Nuova RE LA MEDICINA NUCLEARE CHE COS E : branca
PRODUZIONE DI RADIOFARMACI EMETTITORI DI POSITRONI CON CICLOTRONE AD USO MEDICALE Dr. Asti Mattia Servizio di Medicina Nucleare Arcispedale Santa Maria Nuova RE LA MEDICINA NUCLEARE CHE COS E : branca
Il farmaco generico, ormai ridefinito farmaco equivalente, è considerato essenzialmente simile al medicinale già in commercio (farmaco originatore)
 1 Il farmaco generico, ormai ridefinito farmaco equivalente, è considerato essenzialmente simile al medicinale già in commercio (farmaco originatore) dal punto di vista qualitativo e quantitativo ma con
1 Il farmaco generico, ormai ridefinito farmaco equivalente, è considerato essenzialmente simile al medicinale già in commercio (farmaco originatore) dal punto di vista qualitativo e quantitativo ma con
Esercizi di. Stechiometria dei composti. mercoledì 9 dicembre 2015
 Esercizi di Stechiometria dei composti mercoledì 9 dicembre 2015 Il cloro ha due isotopi stabili contenenti rispettivamente 18 e 20 neutroni. Utilizzando la tavola periodica degli elementi, scrivere i
Esercizi di Stechiometria dei composti mercoledì 9 dicembre 2015 Il cloro ha due isotopi stabili contenenti rispettivamente 18 e 20 neutroni. Utilizzando la tavola periodica degli elementi, scrivere i
Fisica per Medicina. Lezione 25 - Ottica e Fisica Moderna. Dr. Cristiano Fontana
 Fisica per Medicina Lezione 25 - Ottica e Fisica Moderna Dr. Cristiano Fontana Dipartimento di Fisica ed Astronomia Galileo Galilei Università degli Studi di Padova 12 dicembre 2017 Indice Onde Ottica
Fisica per Medicina Lezione 25 - Ottica e Fisica Moderna Dr. Cristiano Fontana Dipartimento di Fisica ed Astronomia Galileo Galilei Università degli Studi di Padova 12 dicembre 2017 Indice Onde Ottica
Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza?
 Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza? Fisicamente è impossibile contare gli atomi contenuti in una data quantita di sostanza. E impossibile
Come possiamo conoscere il numero di atomi o molecole presenti in una definita quantità di sostanza? Fisicamente è impossibile contare gli atomi contenuti in una data quantita di sostanza. E impossibile
UNITA DI MISURA. Le unità di misura sono molto importanti
 Le unità di misura sono molto importanti UNITA DI MISURA 1000 è solo un numero 1000 LIRE unità di misura monetaria 1000 EURO unità di misura monetaria ma il valore di acquisto è molto diverso! 1000 Euro/mese
Le unità di misura sono molto importanti UNITA DI MISURA 1000 è solo un numero 1000 LIRE unità di misura monetaria 1000 EURO unità di misura monetaria ma il valore di acquisto è molto diverso! 1000 Euro/mese
SPECT (Gamma Camera)
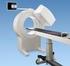 SPECT-PET Nella tomografia a raggi-x si usa la misura del coefficiente di attenuazione del tessuti per dedurre informazioni diagnostiche sul paziente. La tomografia ad emissione d altra parte utilizza
SPECT-PET Nella tomografia a raggi-x si usa la misura del coefficiente di attenuazione del tessuti per dedurre informazioni diagnostiche sul paziente. La tomografia ad emissione d altra parte utilizza
Atomo La più piccola particella di un elemento che resta inalterata nelle trasformazioni chimiche.
 Atomo La più piccola particella di un elemento che resta inalterata nelle trasformazioni chimiche. Molecola La più piccola particella di un individuo chimico (elemento o composto) capace di una propria
Atomo La più piccola particella di un elemento che resta inalterata nelle trasformazioni chimiche. Molecola La più piccola particella di un individuo chimico (elemento o composto) capace di una propria
Capitolo 5 La quantità chimica: la mole
 Capitolo 5 La quantità chimica: la mole 1. La massa di atomi e molecole: un po di storia 2. Le reazioni tra i gas e il principio di Avogadro 3. Quanto pesano un atomo o una molecola? 4. La massa atomica
Capitolo 5 La quantità chimica: la mole 1. La massa di atomi e molecole: un po di storia 2. Le reazioni tra i gas e il principio di Avogadro 3. Quanto pesano un atomo o una molecola? 4. La massa atomica
Esistono reazioni energeticamente favorite (ΔH<0) che non avvengono.es. C(diamante) à C(grafite)
 CINETICA CHIMICA Esistono reazioni energeticamente favorite (ΔH
CINETICA CHIMICA Esistono reazioni energeticamente favorite (ΔH
SOLUZIONI derivate da: Acido debole/ sale (CH 3 COOH/CH 3 COONa) Base debole/ suo sale (NH 4 OH/NH 4 Cl)
 Soluzioni Tampone Si definiscono soluzioni tampone quelle soluzioni in grado di mantenere pressoché costante il proprio ph per aggiunta di una ragionevole quantità di acido o di base forte o per moderata
Soluzioni Tampone Si definiscono soluzioni tampone quelle soluzioni in grado di mantenere pressoché costante il proprio ph per aggiunta di una ragionevole quantità di acido o di base forte o per moderata
Analisi Numerica. Debora Botturi ALTAIR. Debora Botturi. Laboratorio di Sistemi e Segnali
 Analisi Numerica ALTAIR http://metropolis.sci.univr.it Argomenti Argomenti Argomenti Rappresentazione di sistemi con variabili di stato; Tecniche di integrazione numerica Obiettivo: risolvere sistemi di
Analisi Numerica ALTAIR http://metropolis.sci.univr.it Argomenti Argomenti Argomenti Rappresentazione di sistemi con variabili di stato; Tecniche di integrazione numerica Obiettivo: risolvere sistemi di
Parte I - LE RADIAZIONI IONIZZANTI E LE GRANDEZZE FISICHE DI INTERESSE IN DOSIMETRIA
 INDICE Parte I - LE RADIAZIONI IONIZZANTI E LE GRANDEZZE FISICHE DI INTERESSE IN DOSIMETRIA Capitolo 1 Le radiazioni ionizzanti 19 1.1 Introduzione 19 1.2 Il fondo naturale di radiazione 21 1.2.1 La radiazione
INDICE Parte I - LE RADIAZIONI IONIZZANTI E LE GRANDEZZE FISICHE DI INTERESSE IN DOSIMETRIA Capitolo 1 Le radiazioni ionizzanti 19 1.1 Introduzione 19 1.2 Il fondo naturale di radiazione 21 1.2.1 La radiazione
MASSE ATOMICHE. 1,000 g di idrogeno reagiscono con 7,9367 g di ossigeno massa atomica ossigeno=2 x 7,9367=15,873 g (relativa all'idrogeno)
 MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare
 Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
U.M.A. e le masse ATOMICHE
 U.M.A. e le masse ATOMICHE L unità di massa atomica (u.m.a.) viene definita come 1/12 della massa del 12 C Il peso atomico (massa atomica relativa) di un atomo viene definito come: massa atomo considerato
U.M.A. e le masse ATOMICHE L unità di massa atomica (u.m.a.) viene definita come 1/12 della massa del 12 C Il peso atomico (massa atomica relativa) di un atomo viene definito come: massa atomo considerato
Testi Consigliati. I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli. Qualsiasi altro testo che tratti gli argomenti elencati nel programma
 Chimica Generale ed Inorganica Testi Consigliati I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli Chimica Organica Hart-Craine Introduzione alla Chimica Organica Zanichelli. Qualsiasi altro testo che
Chimica Generale ed Inorganica Testi Consigliati I. Bertini, C. Luchinat, F. Mani CHIMICA, Zanichelli Chimica Organica Hart-Craine Introduzione alla Chimica Organica Zanichelli. Qualsiasi altro testo che
Lezione 20: Atomi e molecole
 Lezione 20 - pag.1 Lezione 20: Atomi e molecole 20.1. Il punto della situazione Abbiamo visto, nella lezione precedente, come il modello atomico sia in grado di spiegare la grande varietà di sostanze che
Lezione 20 - pag.1 Lezione 20: Atomi e molecole 20.1. Il punto della situazione Abbiamo visto, nella lezione precedente, come il modello atomico sia in grado di spiegare la grande varietà di sostanze che
Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton)
 Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Corso di Studi in Scienze Naturali Corso di Chimica Generale e Inorganica Dott.ssa Maria Cristina Paganini Prof. Elio Giamello
 Corso di Studi in Scienze Naturali Corso di Chimica Generale e Inorganica Dott.ssa Maria Cristina Paganini Prof. Elio Giamello Avvertenza: Le immagini seguenti, proiettate durante le lezioni sono tratte
Corso di Studi in Scienze Naturali Corso di Chimica Generale e Inorganica Dott.ssa Maria Cristina Paganini Prof. Elio Giamello Avvertenza: Le immagini seguenti, proiettate durante le lezioni sono tratte
Diametro del nucleo: m. Diametro dell atomo: m
 Diametro del nucleo: 10 15 m Diametro dell atomo: 10 9-10 10 m The nuclear atom Thomson (Premio Nobel per la Fisica nel 1907) scopre l elettrone nel 1897 Rutherford (Premio Nobel per la Chimica nel 1908)
Diametro del nucleo: 10 15 m Diametro dell atomo: 10 9-10 10 m The nuclear atom Thomson (Premio Nobel per la Fisica nel 1907) scopre l elettrone nel 1897 Rutherford (Premio Nobel per la Chimica nel 1908)
Massa degli atomi e delle molecole
 Dallo studio dei volumi di gas nelle reazioni chimiche alle masse degli atomi e delle molecole Lo stato fisico di di un gas è descritto da tre grandezze fisiche: PRESSIONE (p) VOLUME (V) TEMPERATURA (T)
Dallo studio dei volumi di gas nelle reazioni chimiche alle masse degli atomi e delle molecole Lo stato fisico di di un gas è descritto da tre grandezze fisiche: PRESSIONE (p) VOLUME (V) TEMPERATURA (T)
ESERCITAZIONI CHIMICA-FISICA I a.a. 2012/2013. Metodo differenziale. Problema
 ESERCITAZIONI CHIMICA-FISICA I a.a. 0/03 Metodo differenziale Problema Per la reazione: A + B P sono stati condotti tre esperimenti cinetici a diverse concentrazioni iniziali dei reagenti. I valori iniziali
ESERCITAZIONI CHIMICA-FISICA I a.a. 0/03 Metodo differenziale Problema Per la reazione: A + B P sono stati condotti tre esperimenti cinetici a diverse concentrazioni iniziali dei reagenti. I valori iniziali
A 2 Z A 2 Z. PROTONI: carica +e, massa 1840 m e NEUTRONI: carica nulla, massa 1842 m e
 PROTONI: carica +e, massa 1840 m e NEUTRONI: carica nulla, massa 184 m e Z = numero atomico = numero dei protoni (elettroni) proprietà chimiche A = numero di massa = numero dei protoni + neutroni massa
PROTONI: carica +e, massa 1840 m e NEUTRONI: carica nulla, massa 184 m e Z = numero atomico = numero dei protoni (elettroni) proprietà chimiche A = numero di massa = numero dei protoni + neutroni massa
Radiazione: propagazione di energia senza che vi sia né. Radiazioni ionizzanti radiazioni che hanno energia sufficiente per produrre la ionizzazione.
 Radiazioni Radiazione: propagazione di energia senza che vi sia né trasporto di quantità macroscopiche di materia, né necessità di un substrato materiale per la propagazione. L energia viene ceduta quando
Radiazioni Radiazione: propagazione di energia senza che vi sia né trasporto di quantità macroscopiche di materia, né necessità di un substrato materiale per la propagazione. L energia viene ceduta quando
Atomi, molecole e ioni
 Atomi, molecole e ioni anione + - catione Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento
Atomi, molecole e ioni anione + - catione Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento
LA STRUTTURA DELL ATOMO
 Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 3 Anno Accademico 2010-2011 Docente: Dimitrios Fessas LA STRUTTURA DELL
Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 3 Anno Accademico 2010-2011 Docente: Dimitrios Fessas LA STRUTTURA DELL
Lezione n. 19. L equazione. di Schrodinger L atomo. di idrogeno Orbitali atomici. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Misura del coefficiente di assorbimento di vari materiali in funzione dell'energia del fascio dei fotoni incidenti
 materiali in funzione dell'energia del fascio dei fotoni Esperto Qualificato LNF - INFN Interazioni delle particelle indirettamente ionizzanti con la materia Le particelle indirettamente ionizzanti, principalmente
materiali in funzione dell'energia del fascio dei fotoni Esperto Qualificato LNF - INFN Interazioni delle particelle indirettamente ionizzanti con la materia Le particelle indirettamente ionizzanti, principalmente
Loriano Storchi.
 Loriano Storchi loriano@storchi.org http://www.storchi.org/ Metodo scientifico Nessuna quantità di esperimenti potrà dimostrare che ho ragione; un unico esperimento potrà dimostrare che ho sbagliato Il
Loriano Storchi loriano@storchi.org http://www.storchi.org/ Metodo scientifico Nessuna quantità di esperimenti potrà dimostrare che ho ragione; un unico esperimento potrà dimostrare che ho sbagliato Il
Corso di Modelli Matematici in Biologia Esame del 6 Luglio 2016
 Corso di Modelli Matematici in Biologia Esame del 6 Luglio 206 Scrivere chiaramente in testa all elaborato: Nome, Cognome, numero di matricola. Risolvere tutti gli esercizi. Tempo a disposizione: DUE ORE.
Corso di Modelli Matematici in Biologia Esame del 6 Luglio 206 Scrivere chiaramente in testa all elaborato: Nome, Cognome, numero di matricola. Risolvere tutti gli esercizi. Tempo a disposizione: DUE ORE.
