ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
|
|
|
- Francesco Marchese
- 8 anni fa
- Visualizzazioni
Transcript
1 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1
2 1. DENOMINAZIONE DEL MEDICINALE Lucentis 10 mg/ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml contiene 10 mg di ranibizumab*. Ogni flaconcino contiene 2,3 mg di ranibizumab in 0,23 ml di soluzione. *Ranibizumab è un frammento di un anticorpo monoclonale umanizzato prodotto nelle cellule di Escherichia coli mediante tecnologia da DNA ricombinante. Per l elenco completo degli eccipienti, vedere paragrafo FORMA FARMACEUTICA Soluzione iniettabile Soluzione acquosa limpida, da incolore a giallo pallido. 4. INFORMAZIONI CLINICHE 4.1 Indicazioni terapeutiche Lucentis è indicato negli adulti per: il trattamento della degenerazione maculare neovascolare (essudativa) correlata all età (AMD) (vedere paragrafo 5.1). il trattamento della diminuzione visiva causata dall edema maculare diabetico (DME) (vedere paragrafo 5.1). il trattamento della diminuzione visiva causata dall edema maculare secondario ad occlusione venosa retinica (RVO di branca o RVO centrale) (vedere paragrafo 5.1). 4.2 Posologia e modo di somministrazione Lucentis deve essere somministrato da un oculista qualificato, esperto in iniezioni intravitreali. Posologia Trattamento dell AMD essudativa La dose raccomandata di Lucentis è 0,5 mg somministrata mensilmente come una singola iniezione intravitreale. Questa corrisponde ad un volume iniettato di 0,05 ml. Il trattamento è somministrato mensilmente e continuato fino a che è ottenuta l acuità visiva massima per esempio l acuità visiva del paziente è stabile per tre controlli mensili consecutivi effettuati durante il trattamento con ranibizumab. Pertanto l acuità visiva dei pazienti deve essere monitorata mensilmente. Il trattamento deve essere ripreso quando il monitoraggio indica una diminuzione dell acuità visiva dovuta ad AMD essudativa. Le iniezioni mensili devono allora essere somministrate fino a quando non è raggiunta di nuovo un acuità visiva stabile per tre controlli mensili consecutivi (questo comporta un minimo di due iniezioni). L intervallo tra due dosi non deve essere inferiore a 1 mese. 2
3 Trattamento della diminuzione visiva causata da DME o edema maculare secondario ad RVO (vedere anche paragrafo 5.1) La dose raccomandata di Lucentis è di 0,5 mg somministrata mensilmentecome una singola iniezione intravitreale. Questa corrisponde ad un volume iniettato di 0,05 ml. Il trattamento è somministrato mensilmente e continuato fino a che è ottenuta l acuità visiva massima per esempio l acuità visiva del paziente è stabile per tre controlli mensili consecutivi effettuati durante il trattamento con ranibizumab. Se non c è miglioramento nell acuità visiva nel periodo delle prime tre iniezioni, la continuazione del trattamento non è raccomandata. Pertanto, l acuità visiva dei pazienti deve essere monitorata mensilmente. Il trattamento deve essere ripreso quando il monitoraggio indica una diminuzione dell acuità visiva dovuta al DME o ad edema maculare secondario ad RVO. Le iniezioni mensili devono allora essere somministrate fino a quando non è raggiunta di nuovo un acuità visiva stabile per tre controlli mensili consecutivi (questo comporta un minimo di due iniezioni). L intervallo tra le due dosi non deve essere inferiore ad 1 mese. Lucentis e fotocoagulazione laser nel DME e nell edema maculare secondario a BRVO Vi è una certa esperienza di somministrazione di Lucentis in concomitanza con fotocoagulazione laser (vedere paragrafo 5.1). Quando somministrato nello stesso giorno, Lucentis deve essere somministrato almeno 30 minuti dopo la fotocoagulazione laser. Lucentis può essere somministrato in pazienti che hanno ricevuto precedentemente la fotocoagulazione laser. Popolazioni Speciali Insufficienza epatica Lucentis non è stato studiato in pazienti con insufficienza epatica. Comunque, non sono necessarie speciali considerazioni per questa polazione. Insufficienza renale Non è necessario un aggiustamento della dose nei pazienti con insufficienza renale (vedere paragrafo 5.2). Anziani Non è richiesto un aggiustamento della dose negli anziani. C è un esperienza limitata in pazienti con DME di età superiore a 75 anni. Etnicità L esperienza con il trattamento è limitata nei gruppi diversi dai Caucasici. Popolazione pediatrica La sicurezza e l efficacia di Lucentis nei bambini e negli adolescenti sotto i 18 anni di età non sono state ancora stabilite. Non ci sono dati disponibili. Modo di somministrazione Flaconcini monouso solo per uso intravitreo. Prima della somministrazione Lucentis deve essere controllato visivamente per evidenziare la presenza di particelle e alterazioni cromatiche. Prima del trattamento, il paziente deve essere istruito ad instillarsi gocce antibiotiche (quattro volte al giorno nei 3 giorni precedenti e successivi ad ogni iniezione). 3
4 La procedura per l iniezione deve essere effettuata in condizioni asettiche, che includono la disinfezione delle mani come per ogni procedura chirurgica, guanti sterili, un telino sterile e un blefarostato sterile (o equivalente) e la possibilità di effettuare una paracentesi sterile (se necessaria). Prima di effettuare la procedura intravitreale si deve valutare attentamente l anamnesi del paziente per quanto riguarda le reazioni di ipersensibilità (vedere paragrafo 4.4). Prima dell iniezione si devono disinfettare le superfici perioculare, oculare e palpebrale e devono essere somministrati un anestesia adeguata ed un antimicrobico topico ad ampio spettro. Per informazioni sulla preparazione di Lucentis, vedere paragrafo 6.6. Inserire l ago per iniezione 3,5-4,0 mm posteriormente al limbus, in camera vitreale, evitando il meridiano orizzontale e dirigendo l ago verso il centro del globo oculare. Iniettare il volume d iniezione di 0,05 ml; cambiare la sede sclerale per le iniezioni successive. 4.3 Controindicazioni Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1. Pazienti con infezioni oculari o perioculari in atto o sospette. Pazienti con gravi infiammazioni intraoculari in atto. 4.4 Avvertenze speciali e precauzioni di impiego Reazioni correlate all iniezione intravitreale Le iniezioni intravitreali, comprese quelle con Lucentis, sono state associate ad endoftalmite, infiammazione intraoculare, distacco retinico regmatogeno, rottura retinica e cataratta traumatica iatrogena (vedere paragrafo 4.8). Per la somministrazione di Lucentis devono sempre essere usate idonee tecniche di iniezione in asepsi. Inoltre, i pazienti devono essere controllati nella settimana successiva all iniezione per consentire un rapido trattamento nel caso si verifichi un infezione. I pazienti devono essere istruiti sul modo in cui riportare senza indugio ogni sintomo indicativo di endoftalmite o uno qualsiasi degli eventi sopra riportati. Aumenti della pressione intraoculare Entro 60 minuti dall iniezione di Lucentis sono stati osservati transitori aumenti della pressione intraoculare (IOP). Sono stati osservati anche aumenti prolungati della IOP (vedere paragrafo 4.8). La pressione intraoculare e la perfusione della testa del nervo ottico devono essere controllate e trattate in modo appropriato. Trattamento bilaterale Non sono state studiate la sicurezza e l efficacia della terapia con Lucentis somministrato in entrambi gli occhi contemporaneamente. Se viene effettuato il trattamento bilaterale contemporaneo potrebbe aumentare l esposizione sistemica con un possibile aumento del rischio di eventi avversi sistemici. Immunogenicità Con Lucentis esiste un potenziale di immunogenicità. Poichè esiste una possibilità di un aumento dell esposizione sistemica nei soggetti con DME, non può essere escluso un aumento del rischio di sviluppo di ipersensibilità in questa popolazione di pazienti. I pazienti devono inoltre essere istruiti sul modo in cui riportare se un infiammazione intraoculare si aggrava perché potrebbe essere un sintomo clinico attribuibile alla formazione di anticorpi intraoculari. Uso concomitante con altri anti-vegf (fattore di crescita vascolare endoteliale) Lucentis non deve essere somministrato contemporaneamente ad altri medicinali (sistemici o oculari) anti-vegf. 4
5 Interruzione di Lucentis La dose non deve essere somministrata e il trattamento non deve essere ripreso prima del successivo trattamento programmato nel caso di: una diminuzione della migliore acuità visiva corretta (BCVA) 30 lettere rispetto all ultima valutazione; una pressione intraoculare 30 mmhg; una rottura retinica; un emorragia sottoretinica estesa al centro della fovea, o se l estensione dell emorragia è 50% dell area totale della lesione; intervento chirurgico intraoculare effettuato o pianificato entro i precedenti o i successivi 28 giorni. Rottura dell epitelio pigmentato retinico I fattori di rischio associati con l insorgenza di una rottura dell epitelio pigmentato retinico dopo terapia con anti-vegf per l AMD essudativa, includono un ampio e/o elevato distacco dell epitelio pigmentato retinico. Quando si inizia la terapia con Lucentis, deve essere usata cautela nei pazienti con questi fattori di rischio per la rottura dell epitelio pigmentato retinico. Distacco retinico regmatogeno o fori maculari Il trattamento deve essere interrotto nei soggetti con distacco retinico regmatogeno o fori maculari allo stadio 3 o 4. Popolazioni con dati limitati C è solo una limitata esperienza nel trattamento di soggetti con DME secondario a diabete di tipo I. Lucentis non è stato studiato in pazienti che avevano precedentemente ricevuto iniezioni intravitreali, in pazienti con infezioni sistemiche attive, retinopatia diabetica proliferante o in pazienti con concomitanti patologie oculari quali distacco di retina o foro maculare. Non c è inoltre esperienza sul trattamento con Lucentis in pazienti diabetici con HbAlc superiore al 12% ed ipertensione non controllata. La mancanza di informazione deve essere considerata dal medico quando tratta questi pazienti. Precedenti episodi di ictus o attacchi ischemici transitori Ci sono dati limitati sulla sicurezza del trattamento del DME e dell edema maculare causato da RVO in pazienti con anamnesi positiva per ictus o attacchi ischemici transitori. Dal momento che c è un potenziale rischio di eventi tromboembolici arteriosi secondari all uso intravitreale di inibitori del VEGF (fattore di crescita dell endotelio vascolare) bisogna usare particolare cautela quando si trattano tali pazienti (vedere paragrafo 4.8). Precedenti episodi di RVO, RVO ischemica di branca e centrale Esiste un esperienza limitata nel trattamento di pazienti con precedenti episodi di RVO e di pazienti con RVO ischemica di branca (BRVO) ed RVO centrale (CRVO). In pazienti con RVO che presentano perdita della funzione visiva con i segni clinici di ischemia irreversibile, il trattamento non è raccomandato. 4.5 Interazioni con altri medicinali ed altre forme di interazione Non sono stati effettuati studi convenzionali di interazione. Per l uso combinato della terapia fotodinamica (PDT) con verteporfina e Lucentis nell AMD essudativa, vedere paragrafo 5.1. Per l uso combinato della fotocoagulazione laser e Lucentis nel trattamento del DME e della BRVO, vedere paragrafi 4.2. e
6 4.6 Fertilità, gravidanza e allattamento Donne potenzialmente fertili/contraccezione nelle donne Le donne in età fertile devono usare misure contraccettive efficaci durante il trattamento. Gravidanza Per ranibizumab non sono disponibili dati clinici su gravidanze esposte. Studi su scimmie cynomolgus non hanno mostrato effetti dannosi diretti o indiretti riguardo la gravidanza o lo sviluppo embrionale/fetale (vedere paragrafo 5.3). Dopo somministrazione oculare l esposizione sistemica al ranibizumab è bassa, ma, a causa del meccanismo d azione, ranibizumab deve essere considerato come potenzialmente teratogeno e embrio-/fetotossico. Pertanto, ranibizumab non deve essere usato durante la gravidanza a meno che i benefici attesi non superino i potenziali rischi per il feto. Alle donne che pianificano una gravidanza e sono state trattate con ranibizumab si raccomanda di aspettare almeno 3 mesi dopo l ultima dose di ranibizumab prima di concepire un bambino. Allattamento Non è noto se Lucentis venga escreto nel latte umano. Durante l uso di Lucentis si raccomanda di non allattare. Fertilità Non ci sono dati disponibili sulla fertilità. 4.7 Effetti sulla capacità di guidare veicoli e sull uso di macchinari La procedura di trattamento con Lucentis può indurre transitori disturbi visivi che possono influenzare la capacità di guidare o usare macchinari (vedere paragrafo 4.8). I pazienti che manifestano questi sintomi non devono guidare o usare macchinari fino a quando non cessano questi transitori disturbi visivi. 4.8 Effetti indesiderati Riassunto del profilo di sicurezza La maggior parte delle reazioni avverse riportate in seguito alla somministrazione di Lucentis sono correlate alla procedura di iniezione intravitreale. Le reazioni avverse oculari più frequentemente riportate in seguito all iniezione di Lucentis sono: dolore oculare, iperemia oculare, aumento della pressione intraoculare, vitreite, distacco vitreale, emorragia retinica, disturbo visivo, mosche volanti (corpi mobili vitreali), emorragia congiuntivale, irritazione oculare, sensazione di corpo estraneo nell occhio, aumento della lacrimazione, blefarite, occhio secco e prurito oculare. Le reazioni avverse non oculari più frequentemente riportate sono mal di testa, nasofaringiti e artralgia. Reazioni avverse meno frequentemente riportate, ma più gravi, includono endoftalmiti, cecità, distacco retinico, rottura retinica e cataratta traumatica iatrogena (vedere paragrafo 4.4). I pazienti devono essere informati sui sintomi di queste potenziali reazioni avverse ed istruiti ad informare il medico se manifestano segni come dolore oculare o aumento del fastidio, peggioramento dell arrossamento oculare, offuscamento o diminuzione della visione, un aumentato numero di corpi mobili vitreali, o un aumentata sensibilità alla luce. Le reazioni avverse segnalate dopo la somministrazione di Lucentis negli studi clinici sono riassunte nella tabella seguente. 6
7 Elenco in tabella delle reazioni avverse # Le reazioni avverse sono elencate secondo classificazione sistemica organica e per frequenza usando la seguente convenzione: molto comune ( 1/10), comune ( 1/100, <1/10), non comune ( 1/1.000, <1/100), raro ( 1/10.000, <1/1.000), molto raro (<1/10.000), non nota (la frequenza non può essere definita sulla base dei dati disponibili). All interno di ciascuna classe di frequenza, le reazioni avverse sono riportate in ordine decrescente di gravità. Infezioni ed infestazioni Molto comune Comune Nasofaringiti Infezione del tratto urinario* Patologie del sistema emolinfopoietico Comune Anemia Disturbi del sistema immunitario Comune Disturbi psichiatrici Comune Patologie del sistema nervoso Molto comune Patologie dell occhio Molto comune Comune Non comune Ipersensibilità Ansia Mal di testa Vitreite, distacco del vitreo, emorragia retinica, disturbi visivi, dolore oculare, corpi mobili vitreali, emorragia congiuntivale, irritazione oculare, sensazione di corpo estraneo negli occhi, aumento della lacrimazione, blefarite, secchezza oculare, iperemia oculare, prurito all occhio. Degenerazione retinica, disturbi retinici, distacco retinico, lacerazione retinica, distacco dell epitelio pigmentato retinico, lacerazione dell epitelio pigmentato retinico, ridotta acuità visiva, emorragia vitreale, disturbi del vitreo, uveite, irite, iridociclite, cataratta, cataratta sottocapsulare, opacizzazione della capsula posteriore, cheratite puntata, abrasione corneale, reazione in camera anteriore, visione offuscata, emorragia nella sede di iniezione, emorragia oculare, congiuntivite, congiuntivite allergica, secrezione oculare, flash luminosi, fotofobia, discomfort oculare, edema palpebrale, dolore palpebrale, iperemia congiuntivale. Cecità, endoftalmite, ipopion, ifema, cheratopatia, sinechie iridee, depositi corneali, edema corneale, strie corneali, dolore nel sito d iniezione, irritazione nel sito d iniezione, sensazione anormale nell occhio, irritazione palpebrale. Patologie respiratorie, toraciche e mediastiniche Comune Tosse Patologie gastrointestinali Comune Nausea 7
8 Patologie della cute e del tessuto sottocutaneo Comune Reazioni allergiche (rash, orticaria, prurito, eritema) Patologie del sistema muscoloscheletrico e del tessuto connettivo Molto comune Artralgia Esami diagnostici Molto comune Aumento della pressione intraoculare # Le reazioni avverse erano definite come eventi avversi (in almeno lo 0,5 punti percentuali dei pazienti) che si sono verificati con un tasso più alto (almeno 2 punti percentuali) in pazienti che ricevevano il trattamento con Lucentis 0,5 mg rispetto a quelli che ricevevano il trattamento di controllo (sham o PDT verteporfina). * osservata solo nella popolazione con DME Reazioni avverse correlate alla categoria di farmaci Negli studi di fase III sull AMD essudativa, la frequenza totale di emorragie non oculari, un evento avverso potenzialmente correlato agli inibitori VEGF (fattore di crescita dei vasi endoteliali), era lievemente aumentato nei pazienti trattati con ranibizumab. Comunque, non c è stato uno schema conforme tra le differenti emorragie. C è un rischio teorico di eventi tromboembolici arteriosi conseguenti all uso intravitreale di inibitori VEGF. Negli studi clinici con Lucentis in pazienti con AMD, DME ed RVO è stata osservata una bassa incidenza di eventi tromboembolici arteriosi e non si sono osservate differenze tra i gruppi trattati con ranibizumab confrontati con il controllo. 4.9 Sovradosaggio Dagli studi clinici sull AMD essudativa e dai dati post-marketing sono stati riportati casi di sovradosaggio accidentale. Le reazioni avverse più frequentemente associate a questi casi sono state incremento della pressione intraoculare, cecità transiente, riduzione dell acuità visiva, edema corneale e dolore all occhio. Se si verifica un sovradosaggio, si deve controllare e trattare la pressione intraoculare, se ritenuto necessario dal medico. 5. PROPRIETÀ FARMACOLOGICHE 5.1 Proprietà farmacodinamiche Categoria farmacoterapeutica: Oftalmologici, agenti anti-neovascolarizzazione, codice ATC: S01LA04 Ranibizumab è un frammento di un anticorpo monoclonale ricombinante umanizzato diretto contro il fattore di crescita endoteliale vascolare umano A (VEGF-A). Esso si lega con un elevata affinità alle isoforme del VEGF-A (per es. VEGF 110, VEGF 121 e VEGF 165 ), prevenendo così il legame del VEGF-A ai suoi recettori VEGFR-1 e VEGFR-2. Il legame del VEGF-A ai suoi recettori porta ad una proliferazione delle cellule endoteliali ad una neovascolarizzazione, e ad un aumento della permeabilità vasale, che si ritiene contribuiscano alla progressione della forma neovascolare della degenerazione maculare senile, o diminuzione della visione causata o dall edema maculare diabetico o dall edema maculare secondario ad RVO. Trattamento dell AMD essudativa Per l AMD essudativa la sicurezza e l efficacia clinica di Lucentis sono state valutate in tre studi randomizzati, in doppio cieco, verso sham- o controllo attivo della durata di 24 mesi in pazienti con AMD neovascolare. In questi studi è stato arruolato un totale di pazienti (879 trattati e 444 controlli). 8
9 Nello studio FVF2598g (MARINA), 716 pazienti con lesioni da neovascolarizzazione coroideale (CNV) minimamente classica o occulta senza componente classica hanno ricevuto mensilmente iniezioni intravitreali di Lucentis 0,3 mg (n=238) o 0,5 mg (n=240) o iniezioni sham (n=238). Nello studio FVF2587g (ANCHOR), 423 pazienti con CNV prevalentemente classica hanno ricevuto uno dei seguenti trattamenti: 1) iniezioni intravitreali mensili di Lucentis 0,3 mg e PDT sham (n=140); 2) iniezioni intravitreali mensili di Lucentis 0,5 mg e PDT sham (n=140); o 3) iniezioni intravitreali sham e PDT con verteporfina (n=143). La PDT con verteporfina o sham veniva somministrata insieme all iniezione iniziale di Lucentis e successivamente ogni 3 mesi se la fluorangiografia evidenziava una persistenza o ripresa del leakage vascolare. I risultati chiave sono riassunti nelle Tabelle 1, 2 e nella Figura 1. Tabella 1 Risultati al mese 12 e mese 24 nello studio FVF2598g (MARINA) Misura del risultato Mese Sham (n=238) Perdita di <15 lettere nell acuità visiva (%) a (mantenimento della visione, endpoint primario) Lucentis 0,5 mg (n=240) Mese 12 62% 95% Mese 24 53% 90% Aumento di 15 lettere Mese 12 5% 34% nell acuità visiva (%) a Mese 24 4% 33% Variazione media nell acuità Mese 12-10,5 (16,6) +7,2 (14,4) visiva (lettere) (SD) a Mese 24-14,9 (18,7) +6,6 (16,5) a p 0,01 Tabella 2 Risultati al mese 12 e al mese 24 nello studio FVF2587g (ANCHOR) Misura del risultato Mese PDT con verteporfina (n=143) Perdita di <15 lettere nell acuità visiva (%) a (mantenimento della visione, endpoint primario) Lucentis 0,5 mg (n=140) Mese 12 64% 96% Mese 24 66% 90% Aumento di 15 lettere Mese 12 6% 40% nell acuità visiva (%) a Mese 24 6% 41% Variazione media nell acuità Mese 12-9,5 (16,4) +11,3 (14,6) visiva (lettere) (SD) a Mese 24-9,8 (17,6) +10,7 (16,5) a p<0,01 9
10 Variazione media nell acuità visiva ±SE (lettere) Variazione media nell acuità visiva ±SE (lettere) Figura 1 Variazione media nell acuità visiva rispetto ai valori iniziali al mese 24 nello studio FVF2598g (MARINA) e nello studio FVF2587g (ANCHOR) 15 Studio FVF2598g (MARINA) , , , Mese Studio FVF2587g (ANCHOR) +10, , , Mese MARINA LUCENTIS 0,5 mg (n=240) Sham (n=238) ANCHOR LUCENTIS 0,5 mg (n=140) Verteporfina PDT (n=143) I risultati di entrambi gli studi hanno mostrato che il trattamento continuato con ranibizumab potrebbe essere di beneficio anche nei pazienti che avevano perso 15 lettere della migliore acuità visiva corretta (BCVA) nel primo anno di trattamento. Non è stato studiato l uso di Lucentis oltre i 36 mesi. 10
11 Lo studio FVF3192g (PIER) era uno studio randomizzato, doppio-cieco, controllato verso sham progettato per valutare la sicurezza e l efficacia di Lucentis in 184 pazienti con tutte le forme di AMD neovascolare. I pazienti hanno ricevuto iniezioni intravitreali di Lucentis 0,3 mg (n=60) o 0,5 mg (n=61) o iniezioni sham (n=63) una volta al mese per 3 dosi consecutive, seguite da una dose somministrata una volta ogni 3 mesi. Dal mese 14 dello studio, i pazienti trattati con un iniezione sham sono stati ammessi al trattamento con ranibizumab e dal mese 19, si potevano effettuare trattamenti più frequenti. I pazienti trattati con Lucentis nello studio PIER hanno ricevuto una media di 10 trattamenti in totale. L endpoint primario di efficacia era la variazione media nell acuità visiva a 12 mesi, in confronto ai valori iniziali. Dopo un iniziale aumento nell acuità visiva (conseguente alla dose mensile), in media, l acuità visiva dei pazienti è diminuita con la somministrazione trimestrale, ritornando ai valori iniziali al mese 12 e questo effetto è stato mantenuto nella maggior parte dei pazienti trattati con ranibizumab (82%) al mese 24. I dati da un numero limitato di soggetti che erano stati trasferiti al trattamento con ranibizumab dopo più di un anno di trattamenti sham hanno suggerito che un inizio precoce del trattamento potrebbe essere associato ad una migliore conservazione dell acuità visiva. Sia nello studio MARINA che in ANCHOR, il miglioramento nell acuità visiva osservato con Lucentis 0,5 mg a 12 mesi è stato accompagnato da benefici riportati dai pazienti misurati con il punteggio del National Eye Institute Visual Function Questionnaire (VFQ-25). Le differenze tra Lucentis 0,5 mg e i due gruppi di controllo erano valutate con valori di p compresi tra 0,009 e <0,0001. L efficacia di Lucentis nel trattamento dell AMD essudativa è stata confermata in studi sull AMD finalizzati dopo l autorizzazione all immissione in commercio. I dati da due studi (MONT BLANC, BPD952A2308 e DENALI, BPD952A2309) non hanno dimostrato effetti addizionali della somministrazione combinata di verteporfina (Visudyne PDT) e Lucentis rispetto al Lucentis in monoterapia. Trattamento della diminuzione visiva dovuta a DME La sicurezza e l efficacia di Lucentis sono state valutate in due studi randomizzati, in doppio cieco, controllati con sham o in attivo della durata di 12 mesi in pazienti con diminuzione della visione dovuta ad edema maculare diabetico. Sono stati arruolati in questi studi un totale di 496 pazienti (336 in attivo e 160 controlli), la maggior parte avevano diabete di tipo II, 28 pazienti trattati avevano diabete di tipo I. Nella fase II dello studio D2201 (RESOLVE), 151 pazienti sono stati trattati con ranibizumab (6 mg/ml, n=51, 10 mg/ml, n=51) o sham (n=49) con un iniezione intravitreale al mese fino al raggiungimento dei criteri predefiniti. La dose iniziale di ranibizumab (0,3 mg o 0,5 mg) poteva essere raddoppiata in qualsiasi momento durante lo studio dopo la prima iniezione. La fotocoagulazione laser era consentita come trattamento di soccorso dal mese 3 in entrambi i bracci di trattamento. Lo studio ha avuto due parti: una parte esplorativa (i primi 42 pazienti visitati al mese 6) ed una parte confermativa (i rimanenti 109 pazienti visitati al mese 12). Risultati chiave dalla parte confermativa dello studio (2/3 dei pazienti), sono riassunti nella Tabella 3. 11
12 Tabella 3 Risultati al mese 12 nello studio D2201 (RESOLVE) (popolazione totale dello studio) Risultati Media delle variazioni medie nella BCVA dal mese 1 al mese 12 rispetto al baseline a (lettere) (SD) (endpoint primario) Ranibizumab in totale Sham (n=102) (n=49) +7,8 (7,72) -0,1 (9,77) Variazione media nella BCVA al +10,3 (9,14) -1,4 (14,16) mese 12 a (lettere) (SD) Incremento di 10 lettere nella 60,8 18,4 BCVA (%) al mese 12 a Incremento di 15 lettere nella 32,4 10,2 BCVA (%) al mese 12 Valore di p 0,0043 a p<0,0001 Nello studio di fase III D2301 (RESTORE), 345 pazienti con diminuzione visiva dovuta ad edema maculare sono stati randomizzati per ricevere o un iniezione intravitreale di 0,5 mg di ranibizumab come monoterapia e fotocoagulazione laser sham (n=116), o una combinazione di 0,5 mg di ranibizumab e fotocoagulazione laser (n=118) o un iniezione sham e fotocoagulazione laser (n=111). Il trattamento con ranibizumab era iniziato con iniezioni intravitreali mensili e continuato fino a che l acuità visiva rimaneva stabile per almeno tre controlli mensili consecutivi. Il trattamento veniva ripreso quando veniva osservata una riduzione nella BCVA dovuta alla progressione del DME. La fotocoagulazione laser è stata somministrata al baseline nello stesso giorno, almeno 30 minuti prima dell iniezione di ranibizumab, e successivamente al bisogno sulla base dei criteri ETDRS. I risultati chiave sono riassunti nella Tabella 4 e Figura 2. Tabella 4 Risultati al mese 12 nello studio D2301 (RESTORE) Risultati ottenuti confrontati al baseline Ranibizumab 0,5 mg n=115 Ranibizumab 0,5 mg + Laser n=118 Laser n=110 6,1 (6,4) 5,9 (7,9) 0,8 (8,6) Media delle variazioni medie nella BCVA dal mese 1 al mese 12 a ( SD) Incremento 10 lettere o BCVA 84 a (%) 37,4 43,2 15,5 Incremento 15 lettere o BCVA 84 (%) 22,6 22,9 8,2 Valore di p 0,0032 0,0021 a p<0,
13 Variazione media nell acuità visiva dal BL +/- SE (lettere) Figura 2 Variazione media nell acuità visiva rispetto al baseline nel corso dello studio D2301 (RESTORE) ,8/+ 6, ,2/ , Gruppo di trattamento Mese Ranibizumab 0,5 mg (n=115) Ranibizumab 0,5 mg + Laser (n=118) Laser (n=110) BL=baseline; SE=errore standard * Differenze nelle medie elevate al quadrato, p<0,0001/0,0004 basate sul test Cochran-Mantel-Haenszel a due stratificazioni L effetto è stato consistente nella maggior parte dei sottogruppi. Tuttavia, i soggetti con una BCVA abbastanza elevata al baseline (>73 lettere) con edema maculare e spessore retinico centrale <300 μm non hanno beneficiato del trattamento con ranibizumab se confrontato con il trattamento fotocoagulativo. Il miglioramento nell acuità visiva al mese 12 osservato con Lucentis 0,5 mg si è accompagnato a benefici riportati dai pazienti riguardo le maggiori funzioni correlate alla visione misurati con il punteggio del National Eye Institute Visual Function Questionnaire (VFQ-25). Per altre sottoclassi di questo questionario non possono essere stabilite differenze dovute al trattamento. La differenza tra Lucentis 0,5 mg ed il gruppo di controllo è stata valutata con un valore di p di 0,0137 (ranibizumab mono) e 0,0041 (ranibizumab + laser) per il punteggio composito del VFQ-25. In entrambi gli studi, il miglioramento visivo era accompagnato da una continua riduzione dell edema maculare misurato come spessore retinico centrale (CRT). Trattamento della diminuzione visiva causata da edema maculare secondario ad RVO La sicurezza clinica e l efficacia di Lucentis in pazienti con diminuzione visiva causata da edema maculare secondario ad RVO sono state valutate in studi randomizzati in doppio cieco, controllati: BRAVO e CRUISE che hanno reclutato pazienti rispettivamente con BRVO (n=397) e CRVO (n=392). In entrambi gli studi, i pazienti hanno ricevuto o 0,3 mg o 0,5 mg di ranibizumab intravitreale o iniezioni sham. Dopo 6 mesi, i pazienti del braccio di controllo sham erano stati spostati nel gruppo trattato con ranibizumab 0,5 mg. Nello studio BRAVO, la fotocoagulazione laser come trattamento di soccorso è stata permessa in tutti i bracci dal mese 3. I risultati chiave degli studi BRAVO e CRUISE sono riportati nelle Tabelle 5 e 6 e nella Figura 3 e 4. 13
14 Variazione media AV dal BL +- SE (lettere) Tabella 5 Risultati al mese 6 e 12 (BRAVO) Variazione media dell acuità visiva al mese 6 (lettere) (SD) (endpoint primario) Variazione media nella BCVA al mese 12 (lettere) (SD) Guadagno di 15 lettere nell acuità visiva al mese 6 a (%) Guadagno di 15 lettere nell acuità visiva al mese 12 (%) Percentuale (%) di pazienti che hanno ricevuto il trattamento laser di soccorso nei 12 mesi a p<0,0001 Sham/Lucentis 0,5 mg (n=132) Lucentis 0,5 mg (n=131) 7,3 (13,0) 18,3 (13,2) 12,1 (14,4) 18,3 (14,6) 28,8 61,1 43,9 60,3 61,4 34,4 Figura 3 Variazione media dal baseline nella BCVA nel corso del tempo al mese 6 e mese 12 (BRAVO) ,3 + 18, , Gruppo di trattamento Controllo sham + 7,3 Braccio di controllo sham Passaggio a ranibizumab Mese 2 Sham/Ranibizumab 0,5 mg (n=132) Ranibizumab 0,5 mg (n=131) BL=baseline; SE=errore standard 14
15 Variazione media AV dal BL +- SE (lettere) Tabella 6 Risultati al mese 6 e 12 (CRUISE) Variazione media nell acuità visiva al mese 6 a (lettere) (SD) (endpoint primario) Variazione media nella BCVA al mese 12 (lettere) (SD) Guadagno di 15 lettere nell acuità visiva al mese 6 a (%) Guadagno di 15 lettere nel acuità visiva al mese 12 (%) a p<0,0001 Sham/Lucentis 0,5 mg (n=130) Lucentis 0,5 mg (n=130) 0,8 (16,2) 14,9 (13,2) 7,3 (15,9) 13,9 (14,2) 16,9 47,7 33,1 50,8 Figura 4 Variazione media dal baseline BCVA nel periodo oltre il mese 6 e il mese 12 (CRUISE) Controllo sham + 14,9 Braccio di controllo sham Passaggio a ranibizumab , , , Gruppo di trattamento Mese Sham/Ranibizumab 0,5 mg (n=130) Ranibizumab 0,5 mg (n=130) BL=baseline; SE=errore standard In entrambi gli studi, il miglioramento visivo è stato accompagnato da una continua e significativa riduzione nell edema maculare misurato in termini di spessore retinico centrale. Nei pazienti con BRVO (studio BRAVO ed estensione dello studio HORIZON): dopo 2 anni, i pazienti che erano stati trattati con iniezioni sham nei primi 6 mesi e successivamente trasferiti al trattamento con ranibizumab hanno avuto un guadagno nella AV (~15 lettere) confrontabile a quello dei pazienti che erano stati trattati con ranibizumab dall inizio dello studio (~16 lettere). Tuttavia il numero di pazienti che avevano completato i 2 anni era limitato e nello studio HORIZON erano state programmate solo visite trimestrali. Quindi non ci sono evidenze sufficienti per concludere con delle raccomandazioni su quando deve essere iniziato il trattamento con ranibizumab nei pazienti con BRVO. 15
16 Nei pazienti con CRVO (studio CRUISE ed estensione dello studio HORIZON): dopo 2 anni, i pazienti che erano stati trattati nei primi 6 mesi con iniezioni sham e successivamenti trasferiti al trattamento con ranibizumab non hanno mostrato guadagni nella AV (~6 lettere) rispetto a quelli dei pazienti che erano stati trattati con ranibizumab dall inizio dello studio (~12 lettere). Il miglioramento nell acuità visiva osservato con il trattamento con ranibizumab ai mesi 6 e 12 è stato accompagnato da benefici riportati dai pazienti misurati con il National Eye Institute Visual Function Questionnaire (VFQ-25) sottogruppo relativo alle attività svolte da vicino e da lontano. La differenza tra Lucentis 0,5 mg ed il gruppo di controllo è risultata tra valori di p compresi tra 0,02 e 0,0002. Popolazione pediatrica La sicurezza e l efficacia del ranibizumab nei bambini non sono state ancora stabilite. L Agenzia Europea dei Medicinali ha previsto l esonero dall obbligo di presentare i risultati degli studi con Lucentis in tutti i sottogruppi della popolazione pediatrica per l AMD neovascolare, la diminuzione visiva dovuta ad edema maculare diabetico e la diminuzione visiva dovuta ad edema maculare secondario ad occlusione venosa retinica (vedere paragrafo 4.2 per informazioni sull uso pediatrico). 5.2 Proprietà farmacocinetiche In seguito a somministrazione intravitreale mensile di Lucentis a pazienti con AMD neovascolare, le concentrazioni sieriche di ranibizumab erano generalmente basse, con livelli massimi (C max ) generalmente inferiori alla concentrazione di ranibizumab necessaria a inibire del 50% l attività biologica del VEGF (11-27 ng/ml, valutata in un test in vitro di proliferazione cellulare). La C max era proporzionale alla dose per tutto l intervallo di dosi da 0,05 a 1,0 mg/occhio. In un numero limitato di pazienti con DME le concentrazioni sieriche rilevate indicano che un esposizione sistemica lievemente superiore non può essere esclusa rispetto a quelle osservate nei pazienti con AMD neovascolare. Le concentrazioni sieriche di ranibizumab in pazienti con RVO erano simili o leggermente superiori rispetto a quelle osservate in pazienti affetti da AMD neovascolare. In base all analisi della farmacocinetica nella popolazione studiata ed alla scomparsa di ranibizumab dal siero per pazienti con AMD neovascolare trattati con la dose 0,5 mg, l emivita media di eliminazione dal vitreo di ranibizumab è di circa 9 giorni. Si prevede che, al momento della somministrazione intravitreale mensile di Lucentis 0,5 mg/occhio, la C max sierica di ranibizumab, raggiunta 1 giorno circa dopo la dose, oscilli generalmente tra 0,79 e 2,90 ng/ml, mentre si prevede che la C min oscilli generalmente tra 0,07 e 0,49 ng/ml. Si stima che le concentrazioni sieriche di ranibizumab siano circa volte inferiori rispetto a quelle vitreali. Pazienti con insufficienza renale: Non sono stati effettuati studi convenzionali per esaminare la farmacocinetica di Lucentis nei pazienti con insufficienza renale. In un analisi della farmacocinetica in una popolazione di pazienti con AMD neovascolare, il 68% (136 su 200) dei pazienti avevano un insufficienza renale (46,5% lieve [50-80 ml/min], 20% moderata [30-50 ml/min] e 15% grave [<30 ml/min]). Nei pazienti con RVO, il 48,2% (253 di 525) aveva un insufficienza renale (36,4% lieve, 9,5% moderata e 2,3% grave). La clearance sistemica era leggermente inferiore, ma ciò non era clinicamente significativo. Pazienti con insufficienza epatica: Non sono stati effettuati studi convenzionali per esaminare la farmacocinetica di Lucentis nei pazienti con insufficienza epatica. 16
17 5.3 Dati preclinici di sicurezza La somministrazione intravitreale bilaterale di ranibizumab a scimmie cynomolgus a dosi tra 0,25 mg/occhio e 2,0 mg/occhio una volta ogni 2 settimane per periodi fino a 26 settimane ha prodotto effetti oculari dose-dipendenti. A livello intraoculare, si sono verificati aumenti dose-dipendenti di flare e cellule nella camera anteriore, con un picco 2 giorni dopo l iniezione. La gravità della risposta infiammatoria diminuisce generalmente con le iniezioni seguenti o durante il periodo di recupero. Nel segmento posteriore si sono verificati infiltrazioni cellulari e corpi mobili vitreali, che pure tendevano ad essere dosedipendenti e generalmente persistevano fino alla fine del periodo di trattamento. Nello studio di 26 settimane, la gravità dell infiammazione del vitreo aumentava con il numero delle iniezioni. Comunque, è stata osservata una reversibilità dopo il periodo di recupero. La natura e la durata dell infiammazione del segmento posteriore è indicativa di una risposta anticorpale immuno-mediata, che può essere clinicamente irrilevante. In alcuni animali si è osservata la formazione di cataratta dopo un periodo relativamente lungo di intensa infiammazione, suggerendo che le modificazioni del cristallino erano secondarie ad una grave infiammazione. In seguito ad iniezioni intravitreali è stato osservato un aumento transitorio della pressione intraoculare dopo la somministrazione, indipendentemente dalla dose. Modificazioni oculari microscopiche sono state correlate all infiammazione e non hanno indicato processi degenerativi. Modificazioni infiammatorie granulomatose sono state notate nel disco ottico di alcuni occhi. Queste modificazioni del segmento posteriore diminuivano, ed in alcuni casi si risolvevano, durante il periodo di recupero. Non si sono rilevati segni di tossicità sistemica in seguito a somministrazione intravitreale. In un sottoinsieme di animali trattati sono stati trovati anticorpi al ranibizumab sierici e vitrei. Non sono disponibili dati di carcinogenicità o mutagenicità. Nelle scimmie gravide, l iniezione intravitreale di ranibizumab che ha portato ad un esposizione sistemica massima 0,9-7 volte la peggiore esposizione clinica non ha provocato tossicità per lo sviluppo o teratogenicità, e non ha avuto effetti sul peso o sulla struttura della placenta, anche se, in base al suo effetto farmacologico il ranibizumab deve essere considerato potenzialmente teratogeno ed embrio/fetotossico. L assenza di effetti mediati di ranibizumab sullo sviluppo embrio/fetale, è plausibilmente legata principalmente all incapacità del frammento Fab di attraversare la placenta. Tuttavia è stato descritto un caso con alti livelli sierici materni di ranibizumab e di presenza di ranibizumab nel siero fetale, suggerendo che l anticorpo anti-ranibizumab ha agito come proteina (contenente la regione FC) che trasporta il ranibizumab, facendone così diminuire l eliminazione dal siero materno e consentendone il trasferimento alla placenta. Poiché gli accertamenti sullo sviluppo embrio/fetale sono stati condotti su animali sani in gravidanza ed alcune malattie (come il diabete) possono modificare la permeabilità placentare verso un frammento Fab, lo studio deve essere interpretato con cautela. 6. INFORMAZIONI FARMACEUTICHE 6.1 Elenco degli eccipienti α,α-trealosio diidrato Istidina cloridrato, monoidrato Istidina Polisorbato 20 Acqua per preparazioni iniettabili 17
18 6.2 Incompatibilità In assenza di studi di compatibilità, questo medicinale non deve essere miscelato con altri medicinali. 6.3 Periodo di validità 3 anni 6.4 Precauzioni particolari per la conservazione Conservare in frigorifero (2 C 8 C). Non congelare. Tenere il flaconcino nell imballaggio esterno per proteggere il medicinale dalla luce. 6.5 Natura e contenuto del contenitore 0,23 ml di soluzione sterile in un flaconcino (vetro di tipo I) con tappo (gomma clorobutilica), 1 ago filtro smussato (18G x 1½, 1,2 mm x 40 mm, 5 µm), 1 ago per iniezione (30G x ½, 0,3 mm x 13 mm) ed 1 siringa (polypropylene) (1 ml). La confezione contiene 1 flaconcino. 6.6 Precauzioni particolari per lo smaltimento e la manipolazione Il flaconcino, l ago per iniezione l ago filtro e la siringa sono da usare una sola volta. Il riutilizzo può causare infezione o altra malattia/lesione. Tutti i componenti sono sterili. Ogni componente con confezione che mostra segni di danneggiamento o manomissione non deve essere utilizzato. La sterilità non può essere garantita se il sigillo della confezione del componente non è intatto. Per preparare Lucentis per l iniezione intravitreale, si prega di seguire le seguenti istruzioni: 1. Disinfettare la parte esterna del tappo di gomma del flaconcino prima del prelievo. 2. Montare su una siringa da 1 ml (fornita) l ago filtro da 5 µm (18G x 1½, 1,2 mm x 40 mm, fornito) in asepsi. Inserire l ago filtro spuntato al centro del tappo fino a che non tocchi il fondo del flaconcino. 3. Prelevare tutto il liquido dal flaconcino tenendolo in posizione verticale, leggermente inclinato per facilitare il completo prelievo. 4. Assicurarsi che lo stantuffo della siringa sia tirato sufficientemente indietro quando si svuota il flaconcino in modo da svuotare completamente l ago filtro. 5. Lasciare l ago filtro spuntato nel flaconcino e staccare la siringa da questo.eliminare l ago filtro dopo aver prelevato il contenuto del flaconcino e non utilizzarlo per l iniezione intravitreale. 6. Montare saldamente ed in asepsi l ago per iniezione (30G x ½, 0,3 mm x 13 mm, fornito) sulla siringa. 7. Rimuovere attentamente il cappuccio dall ago per iniezione senza disconnettere l ago per iniezione dalla siringa. Nota: Tenere la base gialla dell ago per iniezione mentre si rimuove il cappuccio. 8. Espellere attentamente l aria dalla siringa e aggiustare la dose a 0,05 ml contrassegnati sulla siringa. La siringa è pronta per l iniezione. Nota: Non pulire l ago per iniezione. Non tirare indietro lo stantuffo. 18
19 Il medicinale non utilizzato ed i rifiuti derivati da tale medicinale devono essere smaltiti in conformità alla normativa locale vigente. Gettare gli aghi utilizzati in un apposito contenitore. 7. TITOLARE DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO Novartis Europharm Limited Wimblehurst Road Horsham West Sussex, RH12 5AB Regno Unito 8. NUMERO(I) DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO EU/1/06/374/ DATA DELLA PRIMA AUTORIZZAZIONE/RINNOVO DELL AUTORIZZAZIONE Data della prima autorizzazione: 22 Gennaio 2007 Data del rinnovo più recente: 22 Gennaio DATA DI REVISIONE DEL TESTO Informazioni più dettagliate su questo medicinale sono disponibili sul sito web dell Agenzia europea dei medicinali: 19
20 ALLEGATO II A. PRODUTTORI DEL PRINCIPIO ATTIVO BIOLOGICO E PRODUTTORE RESPONSABILE DEL RILASCIO DEI LOTTI B. CONDIZIONI O LIMITAZIONI DI FORNITURA E DI UTILIZZO C. ALTRE CONDIZIONI E REQUISITI DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO 20
21 A. PRODUTTORI DEL PRINCIPIO ATTIVO BIOLOGICO E PRODUTTORE RESPONSABILE DEL RILASCIO DEI LOTTI Nome e indirizzo dei produttori del principio attivo biologico Genentech, Inc. 1 DNA Way South San Francisco, CA USA Roche Singapore Technical Operations Pte. Ltd. 10 Tuas Bay Link Singapore Singapore Nome e indirizzo del produttore responsabile del rilascio dei lotti Novartis Pharma GmbH Roonstrasse 25 D Norimberga Germania B. CONDIZIONI O LIMITAZIONI DI FORNITURA E DI UTILIZZO Medicinale soggetto a prescrizione medica limitativa (vedere allegato I: riassunto delle caratteristiche del prodotto, paragrafo 4.2) C. ALTRE CONDIZIONI E REQUISITI DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO Sistema di farmacovigilanza Il titolare della autorizzazione all'immissione in commercio deve assicurare che il sistema di farmacovigilanza presentato nel Modulo dell autorizzazione all'immissione in commercio, esista e sia operativo prima e durante la commercializzazione del medicinale. Piano di Gestione del Rischio (Risk Management Plan, RMP) Il titolare dell autorizzazione all immissione in commercio deve effettuare le attività descritte nel piano di farmacovigilanza, come concordato nel RMP presentato nel modulo dell autorizzazione all immissione in commercio e in qualsiasi successivo aggiornamento del RMP approvato dal comitato per i medicinali per uso umano (Committee for Medicinal Products for Human Use, CHMP). In accordo con la linea guida del CHMP sui Sistemi di gestione del rischio per i medicinali per uso umano, il RMP aggiornato deve essere presentato insieme al successivo rapporto periodico di aggiornamento sulla sicurezza (Periodic Safety Update Report, PSUR). Inoltre, il RMP aggiornato deve essere presentato: quando si ricevono nuove informazioni che possano avere impatto sulle specifiche di sicurezza, sul piano di farmacovigilanza o sulle attività di minimizzazione del rischio in vigore entro 60 giorni dal raggiungimento di un importante obiettivo (di farmacovigilanza o di minimizzazione del rischio) su richiesta dell'agenzia europea dei medicinali. PSUR Lo schema di presentazione dello PSUR deve seguire un ciclo di 1 anno. 21
22 CONDIZIONI O LIMITAZIONI PER QUANTO RIGUARDA L'USO SICURO ED EFFICACE DEL MEDICINALE Il Titolare dell Autorizzazione all Immissione in Commercio deve assicurare che il materiale informativo aggiornato per i medici sia inviato a tutti gli oftalmologi quando si accingono ad usare Lucentis. Il materiale informativo per il medico deve contenere quanto segue: Informazioni per il medico Video sulla procedura di iniezione intravitreale Illustrazione della procedura di iniezione intravitreale Materiale informativo per il paziente Le informazioni per il medico devono comprendere i seguenti elementi chiave: Il Riassunto delle Caratteristiche del Prodotto Uso di tecniche sterili, incluse la disinfezione oculare e perioculare, per minimizzare il rischio di infezioni Uso di antibiotici Uso di povidone iodato o di equivalenti Tecniche per l iniezione intravitreale Segni e sintomi chiave degli eventi avversi correlati all iniezione intravitreale Modalità di trattamento degli eventi avversi correlati all iniezione intravitreale Il materiale informativo per il paziente deve essere fornito sia come opuscolo informativo che in CD audio e deve contenere i seguenti elementi chiave: Foglio illustrativo con le informazioni per il paziente Come prepararsi per il trattamento con Lucentis Quali sono gli step successivi al trattamento con Lucentis Segni e sintomi chiave di eventi avversi gravi Quando richiedere con urgenza l attenzione dell operatore sanitario Il Titolare dell Autorizzazione all Immissione in Commercio deve implementare razionalmente questo piano educazionale, prima della commercializzazione, e in accordo con le autorità competenti dello Stato Membro. 22
23 ALLEGATO III ETICHETTATURA E FOGLIO ILLUSTRATIVO 23
24 A. ETICHETTATURA 24
25 INFORMAZIONI DA APPORRE SUL CONFEZIONAMENTO SECONDARIO SCATOLA 1. DENOMINAZIONE DEL MEDICINALE Lucentis 10 mg/ml soluzione iniettabile Ranibizumab 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN TERMINI DI PRINCIPIO ATTIVO Ogni ml contiene 10 mg di ranibizumab. Il flaconcino contiene 2,3 mg di ranibizumab. 3. ELENCO DEGLI ECCIPIENTI Contiene anche: α,α-trealosio diidrato; istidina cloridrato, monoidrato; istidina; polisorbato 20; acqua per preparazioni iniettabili. 4. FORMA FARMACEUTICA E CONTENUTO 1 flaconcino da 0,23 ml di soluzione iniettabile, 1 ago per iniezione (30G x ½, 0,3 mm x 13 mm), 1 ago filtro (18G x 1½, 1,2 mm x 40 mm, 5 µm), 1 siringa (1 ml). 5. MODO E VIA(E) DI SOMMINISTRAZIONE Uso intravitreo. Flaconcino, aghi e siringa da usare una sola volta. Leggere il foglio illustrativo prima dell uso. L ago filtro non deve essere usato per l iniezione. 6 AVVERTENZA PARTICOLARE CHE PRESCRIVA DI TENERE IL MEDICINALE FUORI DALLA VISTA E DALLA PORTATA DEI BAMBINI Tenere fuori dalla vista e dalla portata dei bambini. 7. ALTRA(E) AVVERTENZA(E) PARTICOLARE(I), SE NECESSARIO 8. DATA DI SCADENZA Scad. 25
26 9. PRECAUZIONI PARTICOLARI PER LA CONSERVAZIONE Conservare in frigorifero. Non congelare. Tenere il flaconcino nell imballaggio esterno per proteggere il medicinale dalla luce. 10. PRECAUZIONI PARTICOLARI PER LO SMALTIMENTO DEL MEDICINALE NON UTILIZZATO O DEI RIFIUTI DERIVATI DA TALE MEDICINALE, SE NECESSARIO Gettare gli aghi utilizzati in un apposito contenitore. 11. NOME E INDIRIZZO DEL TITOLARE DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO Novartis Europharm Limited Wimblehurst Road Horsham West Sussex, RH12 5AB Regno Unito 12. NUMERO(I) DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO EU/1/06/374/ NUMERO DI LOTTO Lotto 14. CONDIZIONE GENERALE DI FORNITURA Medicinale soggetto a prescrizione medica. 15. ISTRUZIONI PER L USO 16. INFORMAZIONI IN BRAILLE Giustificazione per non apporre il Braille accettata. 26
27 INFORMAZIONI MINIME DA APPORRE SUI CONFEZIONAMENTI PRIMARI DI PICCOLE DIMENSIONI ETICHETTA DEL FLACONCINO 1. DENOMINAZIONE DEL MEDICINALE E VIA(E) DI SOMMINISTRAZIONE Lucentis 10 mg/ml soluzione iniettabile Ranibizumab Uso intravitreo 2. MODO DI SOMMINISTRAZIONE 3. DATA DI SCADENZA EXP 4. NUMERO DI LOTTO Lot 5. CONTENUTO IN PESO, VOLUME O UNITÀ 1 flaconcino = 2,3 mg di ranibizumab. 6. ALTRO 27
28 B. FOGLIO ILLUSTRATIVO 28
29 Foglio illustrativo: Informazioni per il paziente Lucentis 10 mg/ml soluzione iniettabile Ranibizumab Legga attentamente questo foglio prima che le venga somministrato questo medicinale perché contiene importanti informazioni per lei. - Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo. - Se ha qualsiasi dubbio, si rivolga al medico. - Se si manifesta un qualsiasi effetto indesiderato, compresi quelli non elencati in questo foglio, si rivolga al medico. Contenuto di questo foglio: 1. Che cos'è Lucentis e a che cosa serve 2. Cosa deve sapere prima che le venga somministrato Lucentis 3. Come le verrà somministrato Lucentis 4. Possibili effetti indesiderati 5. Come conservare Lucentis 6. Contenuto della confezione e altre informazioni 1. Che cos è Lucentis e a che cosa serve Lucentis fa parte di un gruppo di medicinali chiamati agenti antineovascolarizzazione. Contiene ranibizumab come principio attivo, che è una parte di un anticorpo. Gli anticorpi sono proteine che riconoscono e legano altre proteine specifiche nel corpo. Il ranibizumab si lega selettivamente a una proteina chiamata fattore di crescita endoteliale vascolare umano A (VEGF-A). Il VEGF-A causa una crescita anormale dei vasi sanguigni ed un rigonfiamento nella macula che danneggia la macula stessa e può compromettere la visione. La macula è la porzione centrale della parte posteriore dell occhio sensibile alla luce chiamata retina che è responsabile della visione nitida, centrale ed è importante per le attività come leggere o riconoscere i volti. Legandosi al VEGF-A, Lucentis può bloccare la sua azione e prevenire la crescita anormale ed il rigonfiamento. Lucentis è usato negli adulti per trattare un danno alla macula chiamato degenerazione maculare essudativa correlata all età (AMD essudativa), causato dalla crescita di vasi sanguigni anormali che lasciano fuoriuscire liquidi. È anche usato per trattare malattie come l edema maculare (rigonfiamento) causato dal diabete (chiamato edema maculare diabetico, DME) o l edema maculare causato dall occlusione delle vene dietro la retina (occlusione venosa retinica, RVO) dove i liquidi si accumulano nella parte posteriore dell occhio. Lucentis riduce la fuoriuscita di liquidi dai vasi sanguigni, il rigonfiamento della macula e il danno alla retina determinando, in media, un miglioramento della visione, come misurato con le tabelle per la valutazione della capacità visiva. Queste malattie colpiscono la parte centrale della retina (chiamata macula) nella parte posteriore dell occhio. La macula è responsabile della visione centrale e il danno alla macula causa una perdita della visione dritta-davanti. 2. Cosa deve sapere prima che le venga somministrato Lucentis Non deve ricevere Lucentis - se è allergico al ranibizumab o ad uno qualsiasi degli altri componenti di questo medicinale (elencati al paragrafo 6). - se ha un infezione in un occhio o nella zona circostante. - se ha dolore o rossore (grave infiammazione intraoculare) in un occhio. 29
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Lucentis 10 mg/ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml contiene 10 mg di ranibizumab*.
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Lucentis 10 mg/ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml contiene 10 mg di ranibizumab*.
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Lucentis 10 mg/ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml contiene 10 mg di ranibizumab*.
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Lucentis 10 mg/ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml contiene 10 mg di ranibizumab*.
Lucentis deve essere somministrato da un oculista qualificato, esperto in iniezioni intravitreali.
 1. DENOMINAZIONE DEL MEDICINALE Lucentis 10 mg/ml soluzione iniettabile in siringa preriempita 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml contiene 10 mg di ranibizumab*. Una siringa preriempita contiene
1. DENOMINAZIONE DEL MEDICINALE Lucentis 10 mg/ml soluzione iniettabile in siringa preriempita 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml contiene 10 mg di ranibizumab*. Una siringa preriempita contiene
FOGLIETTO ILLUSTRATIVO FUSIDIUM 1%
 FOGLIETTO ILLUSTRATIVO FUSIDIUM 1% FUSIDIUM 1 % Gocce oftalmiche Acido Fusidico CATEGORIA FARMACOTERAPEUTICA Antinfettivo oculare. INDICAZIONI Fusidium è indicato in infezioni batteriche oculari causate
FOGLIETTO ILLUSTRATIVO FUSIDIUM 1% FUSIDIUM 1 % Gocce oftalmiche Acido Fusidico CATEGORIA FARMACOTERAPEUTICA Antinfettivo oculare. INDICAZIONI Fusidium è indicato in infezioni batteriche oculari causate
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Lucentis 10 mg/ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml contiene 10 mg di ranibizumab.
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Lucentis 10 mg/ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml contiene 10 mg di ranibizumab.
Allegato I. Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Vista la relazione di valutazione del comitato di valutazione
Allegato I Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Vista la relazione di valutazione del comitato di valutazione
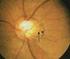
retina macula La macula è la parte centrale della retina. Essa consente la visione dei colori ed il riconoscimento di dettagli come ad es. la lettura.
 retina macula La macula è la parte centrale della retina. Essa consente la visione dei colori ed il riconoscimento di dettagli come ad es. la lettura. 2 Questa è l immagine schematica della macula sana.
retina macula La macula è la parte centrale della retina. Essa consente la visione dei colori ed il riconoscimento di dettagli come ad es. la lettura. 2 Questa è l immagine schematica della macula sana.
Foglio illustrativo: informazioni per il paziente Soluzione Schoum soluzione orale
 Foglio illustrativo: informazioni per il paziente Soluzione Schoum soluzione orale Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni per lei.
Foglio illustrativo: informazioni per il paziente Soluzione Schoum soluzione orale Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni per lei.
Foglio illustrativo: Informazioni per l utilizzatore. Atosiban Ibisqus 6,75 mg/0,9 ml soluzione iniettabile Medicinale equivalente
 Foglio illustrativo: Informazioni per l utilizzatore Atosiban Ibisqus 6,75 mg/0,9 ml soluzione iniettabile Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale perché
Foglio illustrativo: Informazioni per l utilizzatore Atosiban Ibisqus 6,75 mg/0,9 ml soluzione iniettabile Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale perché
Allegato III. Modifiche agli specifici paragrafi del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Modifiche agli specifici paragrafi del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Queste modifiche agli specifici paragrafi del Riassunto delle Caratteristiche
Allegato III Modifiche agli specifici paragrafi del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Queste modifiche agli specifici paragrafi del Riassunto delle Caratteristiche
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Eylea 40 mg/ml soluzione iniettabile in siringa preriempita 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Eylea 40 mg/ml soluzione iniettabile in siringa preriempita 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di
Foglio illustrativo: informazioni per il paziente. Gemadol 10% crema Etofenamato
 Foglio illustrativo: informazioni per il paziente Gemadol 10% crema Etofenamato 000020_024180_20150829_Rev 01 Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
Foglio illustrativo: informazioni per il paziente Gemadol 10% crema Etofenamato 000020_024180_20150829_Rev 01 Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti
Allegato 1 Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione all immissione in commercio
 Allegato 1 Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione all immissione in commercio Conclusioni scientifiche Tenendo conto della valutazione del Comitato per
Allegato 1 Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione all immissione in commercio Conclusioni scientifiche Tenendo conto della valutazione del Comitato per
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
Denominazione del medicinale STILLA DECONGESTIONANTE 0,05% collirio, soluzione Tetrizolina Cloridrato
 PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo e un medicinale di AUTOMEDICAZIONE che potete usare per curare disturbi lievi e transitori facilmente
PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo e un medicinale di AUTOMEDICAZIONE che potete usare per curare disturbi lievi e transitori facilmente
Intervento di Capsulotomia Laser INFORMAZIONI
 Intervento di Capsulotomia Laser INFORMAZIONI Gentile Signore/ Signora, Lei soffre di una opacizzazione dell involucro (capsula) che avvolge parzialmente il suo cristallino artificiale.esso è responsabile
Intervento di Capsulotomia Laser INFORMAZIONI Gentile Signore/ Signora, Lei soffre di una opacizzazione dell involucro (capsula) che avvolge parzialmente il suo cristallino artificiale.esso è responsabile
ALLEGATO I. Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio
 ALLEGATO I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche - Sindrome da astinenza: Con Effentora/Actiq si
ALLEGATO I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche - Sindrome da astinenza: Con Effentora/Actiq si
FOGLIO INFORMATIVO PER IL/LA PAZIENTE
 Allegato 4 DGR 1141 del 14_7_2014 Direzione Generale Sanità e Politiche sociali FOGLIO INFORMATIVO PER IL/LA PAZIENTE Gentile Signora/e la malattia che Lei ha agli occhi si chiama Degenerazione Maculare
Allegato 4 DGR 1141 del 14_7_2014 Direzione Generale Sanità e Politiche sociali FOGLIO INFORMATIVO PER IL/LA PAZIENTE Gentile Signora/e la malattia che Lei ha agli occhi si chiama Degenerazione Maculare
VECTAVIR LABIALE 1% crema penciclovir
 FOGLIO ILLUSTRATIVO PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIETTO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che potete usare per curare disturbi lievi
FOGLIO ILLUSTRATIVO PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIETTO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che potete usare per curare disturbi lievi
FINASTERIDE ZENTIVA 5 MG COMPRESSE RIVESTITE CON FILM. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA FINASTERIDE ZENTIVA 5 MG COMPRESSE RIVESTITE CON FILM Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
FARMACOVIGILANZA FINASTERIDE ZENTIVA 5 MG COMPRESSE RIVESTITE CON FILM Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
DIPARTIMENTO CHIRURGICO SPECIALISTICO Unità Operativa di Oculistica Direttore: prof. Paolo Perri IL GLAUCOMA OPUSCOLO INFORMATIVO PER I PAZIENTI
 DIPARTIMENTO CHIRURGICO SPECIALISTICO Unità Operativa di Oculistica Direttore: prof. Paolo Perri IL GLAUCOMA OPUSCOLO INFORMATIVO PER I PAZIENTI Gentile Signora/e, questo opuscolo ha lo scopo di informarla
DIPARTIMENTO CHIRURGICO SPECIALISTICO Unità Operativa di Oculistica Direttore: prof. Paolo Perri IL GLAUCOMA OPUSCOLO INFORMATIVO PER I PAZIENTI Gentile Signora/e, questo opuscolo ha lo scopo di informarla
Automedicarsi vuol dire curare da sé lievi disturbi o sintomi passeggeri,
 1. RESPONSABILE 1. CHE COSA È L AUTOMEDICAZIONE RESPONSABILE Automedicarsi vuol dire curare da sé lievi disturbi o sintomi passeggeri, come tosse, raffreddore, stitichezza: disturbi che conosciamo bene,
1. RESPONSABILE 1. CHE COSA È L AUTOMEDICAZIONE RESPONSABILE Automedicarsi vuol dire curare da sé lievi disturbi o sintomi passeggeri, come tosse, raffreddore, stitichezza: disturbi che conosciamo bene,
Pradaxa è un medicinale contenente il principio attivo dabigatran etexilato. È disponibile in capsule (75, 110 e 150 mg).
 EMA/47517/2015 EMEA/H/C/000829 Riassunto destinato al pubblico dabigatran etexilato Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato
EMA/47517/2015 EMEA/H/C/000829 Riassunto destinato al pubblico dabigatran etexilato Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato
Lei è affetto in OD/OS/OO da. Questa scheda contiene le informazioni sul trattamento che Le viene proposto, sui risultati e sui rischi.
 SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE MEDIANTE SOMMINISTRAZIONE DI RANIBIZUMAB (LUCENTIS, Novartis) PER VIA INTRAVITREALE Approvato dalla Società Oftalmologica Italiana - Marzo 2007 Primo
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE MEDIANTE SOMMINISTRAZIONE DI RANIBIZUMAB (LUCENTIS, Novartis) PER VIA INTRAVITREALE Approvato dalla Società Oftalmologica Italiana - Marzo 2007 Primo
SCHEDA DI SEGNALAZIONE SITUAZIONE DI RISCHIO
 SOCIETA ITALIANA DI FARMACIA OSPEDALIERA E DEI SERVIZI FARMACEUTICI DELLE AZIENDE SANITARIE Area Scientifico-Culturale SIFO Rischio Clinico SCHEDA DI SEGNALAZIONE SITUAZIONE DI RISCHIO MODALITÀ DI COMPILAZIONE
SOCIETA ITALIANA DI FARMACIA OSPEDALIERA E DEI SERVIZI FARMACEUTICI DELLE AZIENDE SANITARIE Area Scientifico-Culturale SIFO Rischio Clinico SCHEDA DI SEGNALAZIONE SITUAZIONE DI RISCHIO MODALITÀ DI COMPILAZIONE
STRUMENTO EDUCATIVO PER PAZIENTI CHE ASSUMONO FARMACI CHEMIOTERAPICI ORALI
 STRUMENTO EDUCATIVO PER PAZIENTI CHE ASSUMONO FARMACI CHEMIOTERAPICI ORALI Questo strumento è stato creato per facilitare gli operatori sanitari nella valutazione e nell educazione dei pazienti trattati
STRUMENTO EDUCATIVO PER PAZIENTI CHE ASSUMONO FARMACI CHEMIOTERAPICI ORALI Questo strumento è stato creato per facilitare gli operatori sanitari nella valutazione e nell educazione dei pazienti trattati
Riassunto delle caratteristiche del prodotto
 Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE INFLEXAL V Sospensione iniettabile Vaccino influenzale (antigene di superficie, inattivato, virosomale) Stagione 2011/2012 2.
Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE INFLEXAL V Sospensione iniettabile Vaccino influenzale (antigene di superficie, inattivato, virosomale) Stagione 2011/2012 2.
Questa scheda contiene le informazioni sul trattamento che Le viene proposto, sui risultati e sui rischi.
 Approvato dalla Società Oftalmologica Italiana - Marzo 2007 Primo Aggiornamento Ottobre 2007 Secondo Aggiornamento Giugno 2008 Gentile Sig./Sig.ra Lei è affetto in OD/OS/OO da Questa scheda contiene le
Approvato dalla Società Oftalmologica Italiana - Marzo 2007 Primo Aggiornamento Ottobre 2007 Secondo Aggiornamento Giugno 2008 Gentile Sig./Sig.ra Lei è affetto in OD/OS/OO da Questa scheda contiene le
SCHEDA INFORMATIVA ESAME ANGIOGRAFIA RETINICA
 Gentile Signora, Signore, Lei ha un problema alla retina. Questa scheda contiene le informazioni sul trattamento che Le è proposto, sui risultati e sui rischi. Tutte le espressioni tecniche è bene che
Gentile Signora, Signore, Lei ha un problema alla retina. Questa scheda contiene le informazioni sul trattamento che Le è proposto, sui risultati e sui rischi. Tutte le espressioni tecniche è bene che
CONSENSO INFORMATO PER LA LASERVITREOLISI DEI CORPI MOBILI VITREALI
 SIG... CONSEGNATO IL... FIRMA... Gentile Signora, Signore, Lei soffre di una affezione del vitreo responsabile dei suoi disturbi visivi. Questa scheda contiene le informazioni sul trattamento che Le è
SIG... CONSEGNATO IL... FIRMA... Gentile Signora, Signore, Lei soffre di una affezione del vitreo responsabile dei suoi disturbi visivi. Questa scheda contiene le informazioni sul trattamento che Le è
Riassunto delle caratteristiche del prodotto
 Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE INFLEXAL V Sospensione iniettabile Vaccino influenzale (antigene di superficie, inattivato, virosomale) Stagione 2007/2008 2.
Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE INFLEXAL V Sospensione iniettabile Vaccino influenzale (antigene di superficie, inattivato, virosomale) Stagione 2007/2008 2.
GAZYVARO. Farmaco di nuova registrazione
 AllegatoallaDeterminaAIFANumero1012/2014del24/09/2014/ Inserimento,inaccordoall articolo12,comma5dellalegge189/2012,inappositasezione(denominataclasse C(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilitànellemoredellapresentazioneda
AllegatoallaDeterminaAIFANumero1012/2014del24/09/2014/ Inserimento,inaccordoall articolo12,comma5dellalegge189/2012,inappositasezione(denominataclasse C(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilitànellemoredellapresentazioneda
Desensibilizzazione. o Immunoterapia Allergene specifica
 La Desensibilizzazione o Immunoterapia Allergene specifica Le allergie interessano il 25% della popolazione italiana e raggiungeranno 1 persona su 2 entro il 2010 La ragione di questo aumento è in parte
La Desensibilizzazione o Immunoterapia Allergene specifica Le allergie interessano il 25% della popolazione italiana e raggiungeranno 1 persona su 2 entro il 2010 La ragione di questo aumento è in parte
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1/19
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1/19 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Eurican Herpes 205 polvere e solvente per emulsione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1/19 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Eurican Herpes 205 polvere e solvente per emulsione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Marzo 2009 Nuove modalità di prescrizione per i medicinali contenenti isotretinoina ad
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Marzo 2009 Nuove modalità di prescrizione per i medicinali contenenti isotretinoina ad
Leggere attentamente l etichetta e la Scheda di 2Sicurezza (SDS)
 Leggere attentamente l etichetta e la Scheda di 2Sicurezza (SDS) Come si legge un etichetta L etichetta di un agrofarmaco deriva dalla valutazione di numerosi studi effettuati sul prodotto inerenti aspetti
Leggere attentamente l etichetta e la Scheda di 2Sicurezza (SDS) Come si legge un etichetta L etichetta di un agrofarmaco deriva dalla valutazione di numerosi studi effettuati sul prodotto inerenti aspetti
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO NAXCEL 200 mg/ml sospensione iniettabile per bovini 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO NAXCEL 200 mg/ml sospensione iniettabile per bovini 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un ml
PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO
 FOGLIO ILLUSTRATIVO PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che potete usare per curare disturbi lievi e
FOGLIO ILLUSTRATIVO PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che potete usare per curare disturbi lievi e
ADVANCED VITREORETINAL TECHNOLOGY CATANIA, 8 MAGGIO 2009 Dr. Lupo : PUCKER MACULARE Perché, quando, come operare
 CATANIA, 8 MAGGIO 2009 Dr. Lupo : PUCKER MACULARE Perché, quando, come operare Il PUCKER MACULARE E una membrana epiretinica maculare,che provoca come dice il termine stesso un raggrinzimento della retina.
CATANIA, 8 MAGGIO 2009 Dr. Lupo : PUCKER MACULARE Perché, quando, come operare Il PUCKER MACULARE E una membrana epiretinica maculare,che provoca come dice il termine stesso un raggrinzimento della retina.
FIACCHEZZA, STANCHEZZA, MALESSERE MORALE. Carenza di ferro molto diffusa e spesso sottovalutata
 FIACCHEZZA, STANCHEZZA, MALESSERE MORALE Carenza di ferro molto diffusa e spesso sottovalutata Cari pazienti! Vi sentite spesso fiacchi, stanchi, esauriti o giù di morale? Soffrite facilmente il freddo?
FIACCHEZZA, STANCHEZZA, MALESSERE MORALE Carenza di ferro molto diffusa e spesso sottovalutata Cari pazienti! Vi sentite spesso fiacchi, stanchi, esauriti o giù di morale? Soffrite facilmente il freddo?
IL GLAUCOMA I A P B I T A L I A O N L U S P E R A M O R E D E L L A V I S T A
 IL GLAUCOMA I A P B I T A L I A O N L U S P E R A M O R E D E L L A V I S T A IL GLAUCOMA Che cos è? Campagna informativa per la prevenzione delle malattie oculari che possono compromettere la visione
IL GLAUCOMA I A P B I T A L I A O N L U S P E R A M O R E D E L L A V I S T A IL GLAUCOMA Che cos è? Campagna informativa per la prevenzione delle malattie oculari che possono compromettere la visione
La valutazione del rischio chimico
 La valutazione del rischio chimico Introduzione Per sua stessa definizione, l agente chimico è una sostanza o un preparato di natura chimica. L agente chimico può presentarsi sotto forma di gas, vapore,
La valutazione del rischio chimico Introduzione Per sua stessa definizione, l agente chimico è una sostanza o un preparato di natura chimica. L agente chimico può presentarsi sotto forma di gas, vapore,
Stefano Miglior. Il glaucoma ad angolo aperto - G. Cronico SMI
 Stefano Miglior Il glaucoma ad angolo aperto - G. Cronico Concetti fondamentali E una malattia estremamente particolare caratterizzata da una progressione lenta ma continua verso la perdita della funzione
Stefano Miglior Il glaucoma ad angolo aperto - G. Cronico Concetti fondamentali E una malattia estremamente particolare caratterizzata da una progressione lenta ma continua verso la perdita della funzione
Dott. Vito Basile www.vitobasileoculista.it
 Dott. Vito Basile www.vitobasileoculista.it Funzioni visive principali Acutezza visiva Campo visivo Senso cromatico Ottotipo per lontano Ottotipo per vicino Campo visivo Seminario di Aggiornamento Professionale
Dott. Vito Basile www.vitobasileoculista.it Funzioni visive principali Acutezza visiva Campo visivo Senso cromatico Ottotipo per lontano Ottotipo per vicino Campo visivo Seminario di Aggiornamento Professionale
INFORMAZIONE AI LAVORATORI/ UTENTI DEL COLLEGIO. PROCEDURE DI SICUREZZA: RISCHIO CHIMICO dovuto all uso di stampanti e toner
 PROCEDURE DI SICUREZZA: RISCHIO CHIMICO dovuto all uso di stampanti e toner Procedure di sicurezza: RISCHIO CHIMICO DOVUTO ALL USO DI STAMPANTI E TONER Autore: IEC S.r.l. Revisione: settembre 2014 INDICE
PROCEDURE DI SICUREZZA: RISCHIO CHIMICO dovuto all uso di stampanti e toner Procedure di sicurezza: RISCHIO CHIMICO DOVUTO ALL USO DI STAMPANTI E TONER Autore: IEC S.r.l. Revisione: settembre 2014 INDICE
Studio di ricerca clinica sul dolore da endometriosi. Il dolore che Lei sente è reale... anche se gli altri non possono vederlo.
 Studio di ricerca clinica sul dolore da endometriosi Il dolore che Lei sente è reale... anche se gli altri non possono vederlo. A822523 Lo studio SOLSTICE verrà condotto in circa 200 centri di ricerca
Studio di ricerca clinica sul dolore da endometriosi Il dolore che Lei sente è reale... anche se gli altri non possono vederlo. A822523 Lo studio SOLSTICE verrà condotto in circa 200 centri di ricerca
Vaccino influenzale pandemico (antigeni di superficie, inattivati, adiuvati)
 A. ETICHETTATURA 29 INFORMAZIONI DA APPORRE SULL IMBALLAGGIO ESTERNO ASTUCCIO PER SIRINGA 1. DENOMINAZIONE DEL MEDICINALE Focetria sospensione iniettabile in siringa preriempita. Vaccino influenzale pandemico
A. ETICHETTATURA 29 INFORMAZIONI DA APPORRE SULL IMBALLAGGIO ESTERNO ASTUCCIO PER SIRINGA 1. DENOMINAZIONE DEL MEDICINALE Focetria sospensione iniettabile in siringa preriempita. Vaccino influenzale pandemico
(Sociale, Preventiva ed Ergonomica)
 SOCIETA ITALIANA DI OFTALMOLOGIA LEGALE (Sociale, Preventiva ed Ergonomica) Affiliata a Federazione Italiana Società Medico-Scientifiche (F.I.S.M.) SCHEDA INFORMATIVA E DICHIARAZIONE DI CONSENSO PER IL
SOCIETA ITALIANA DI OFTALMOLOGIA LEGALE (Sociale, Preventiva ed Ergonomica) Affiliata a Federazione Italiana Società Medico-Scientifiche (F.I.S.M.) SCHEDA INFORMATIVA E DICHIARAZIONE DI CONSENSO PER IL
ESSERE OPERATI DI CATARATTA
 DIPARTIMENTO CHIRURGICO SPECIALISTICO Unità Operativa di Oculistica Direttore: Prof. Paolo Perri ESSERE OPERATI DI CATARATTA OPUSCOLO INFORMATIVO PER I PAZIENTI Gentile Signora/e, questo opuscolo ha lo
DIPARTIMENTO CHIRURGICO SPECIALISTICO Unità Operativa di Oculistica Direttore: Prof. Paolo Perri ESSERE OPERATI DI CATARATTA OPUSCOLO INFORMATIVO PER I PAZIENTI Gentile Signora/e, questo opuscolo ha lo
Riassunto delle Caratteristiche del Prodotto INDICE. 01.0 DENOMINAZIONE DEL MEDICINALE Inizio Pagina.
 1 di 5 07/11/2012 14:56 A B C D E F G H I J K L M N O P Q R S T U V W X Y Riassunto delle Caratteristiche del Prodotto INDICE 01.0 DENOMINAZIONE DEL MEDICINALE 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA
1 di 5 07/11/2012 14:56 A B C D E F G H I J K L M N O P Q R S T U V W X Y Riassunto delle Caratteristiche del Prodotto INDICE 01.0 DENOMINAZIONE DEL MEDICINALE 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA
L Investigator s Brochure. Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari. Maglie 25 novembre 2004
 L Investigator s Brochure Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari Maglie 25 novembre 2004 Investigator s Brochure Good Clinical Practice DM 15/07/97 Cosa è? L IB è una raccolta
L Investigator s Brochure Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari Maglie 25 novembre 2004 Investigator s Brochure Good Clinical Practice DM 15/07/97 Cosa è? L IB è una raccolta
RUCONEST (Conestat alfa) RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RUCONEST (Conestat alfa) RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ruconest 2100 U polvere per soluzione iniettabile. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un flaconcino
RUCONEST (Conestat alfa) RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ruconest 2100 U polvere per soluzione iniettabile. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un flaconcino
Esposizione ad agenti biologici
 Esposizione ad agenti biologici Il Titolo X corrisponde al Titolo VIII del D.Lgs. 626/94 di attuazione della direttiva 90/679/CEE, relativa alla protezione di lavoratori contro i rischi derivanti dall
Esposizione ad agenti biologici Il Titolo X corrisponde al Titolo VIII del D.Lgs. 626/94 di attuazione della direttiva 90/679/CEE, relativa alla protezione di lavoratori contro i rischi derivanti dall
La TC. e il mezzo di. contrasto
 Istituto Scientifico di Pavia Sede di Via Salvatore Maugeri 10 La TC e il mezzo di contrasto INFORMATIVA PER PAZIENTI IS PV AL6-0 03/10/2011 INDICE Che cosa è la TAC o meglio la TC? 4 Tutti possono essere
Istituto Scientifico di Pavia Sede di Via Salvatore Maugeri 10 La TC e il mezzo di contrasto INFORMATIVA PER PAZIENTI IS PV AL6-0 03/10/2011 INDICE Che cosa è la TAC o meglio la TC? 4 Tutti possono essere
BS OHSAS 18001: 2007. Occupational. Health. Safety. Assesments. Series
 BS OHSAS 18001: 2007 Occupational Health Safety Assesments Series Prefazione La Norma è stata sviluppata per essere compatibile con le Norme: ISO 9001:2000 (Qualità) ISO 14001:2004 (Ambiente) Dr.ssa Carlotta
BS OHSAS 18001: 2007 Occupational Health Safety Assesments Series Prefazione La Norma è stata sviluppata per essere compatibile con le Norme: ISO 9001:2000 (Qualità) ISO 14001:2004 (Ambiente) Dr.ssa Carlotta
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Nobivac Myxo-RHD liofilizzato e solvente per sospensione iniettabile per conigli. 2. COMPOSIZIONE QUALITATIVA
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Nobivac Myxo-RHD liofilizzato e solvente per sospensione iniettabile per conigli. 2. COMPOSIZIONE QUALITATIVA
CETUXIMAB (Erbitux) POTENZIALI EFFETTI COLLATERALI
 CETUXIMAB (Erbitux) POTENZIALI EFFETTI COLLATERALI Le informazioni contenute in questo modello sono fornite in collaborazione con la Associazione Italiana Malati di Cancro, parenti ed amici ; per maggiori
CETUXIMAB (Erbitux) POTENZIALI EFFETTI COLLATERALI Le informazioni contenute in questo modello sono fornite in collaborazione con la Associazione Italiana Malati di Cancro, parenti ed amici ; per maggiori
AIFA Agenzia Italiana del Farmaco Sirolimus (Rapamune)
 AIFA - Sirolimus (Rapamune) 08/02/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Sirolimus (Rapamune) Nota Informativa Importante (08 Febbraio 2010) file:///c /documenti/sir653.htm [08/02/2010 10.47.36]
AIFA - Sirolimus (Rapamune) 08/02/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Sirolimus (Rapamune) Nota Informativa Importante (08 Febbraio 2010) file:///c /documenti/sir653.htm [08/02/2010 10.47.36]
Il rischio cancerogeno e mutageno
 Il rischio cancerogeno e mutageno Le sostanze cancerogene Un cancerogeno è un agente capace di provocare l insorgenza del cancro o di aumentarne la frequenza in una popolazione esposta. Il cancro è caratterizzato
Il rischio cancerogeno e mutageno Le sostanze cancerogene Un cancerogeno è un agente capace di provocare l insorgenza del cancro o di aumentarne la frequenza in una popolazione esposta. Il cancro è caratterizzato
INJEX - Iniezione senza ago
 il sistema per le iniezioni senz ago INJEX - Iniezione senza ago Riempire le ampolle di INJEX dalla penna o dalla cartuccia dalle fiale con la penna Passo dopo Passo Per un iniezione senza ago il sistema
il sistema per le iniezioni senz ago INJEX - Iniezione senza ago Riempire le ampolle di INJEX dalla penna o dalla cartuccia dalle fiale con la penna Passo dopo Passo Per un iniezione senza ago il sistema
PO 01 Rev. 0. Azienda S.p.A.
 INDICE 1 GENERALITA... 2 2 RESPONSABILITA... 2 3 MODALITA DI GESTIONE DELLA... 2 3.1 DEI NEOASSUNTI... 3 3.2 MANSIONI SPECIFICHE... 4 3.3 PREPOSTI... 4 3.4 ALTRI INTERVENTI FORMATIVI... 4 3.5 DOCUMENTAZIONE
INDICE 1 GENERALITA... 2 2 RESPONSABILITA... 2 3 MODALITA DI GESTIONE DELLA... 2 3.1 DEI NEOASSUNTI... 3 3.2 MANSIONI SPECIFICHE... 4 3.3 PREPOSTI... 4 3.4 ALTRI INTERVENTI FORMATIVI... 4 3.5 DOCUMENTAZIONE
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO ProteqFlu sospensione iniettabile per cavalli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una dose da
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO ProteqFlu sospensione iniettabile per cavalli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una dose da
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
La retinopatia diabetica complica in modo simile i due gruppi
 E UNA DELLE COMPLICANZE VASCOLARI DEL DIABETE Il Diabete è un anomalia del metabolismo del glucosio dovuta ad alterata produzione dell insulina che si manifesta con una elevata glicemia. 10-15% diabete
E UNA DELLE COMPLICANZE VASCOLARI DEL DIABETE Il Diabete è un anomalia del metabolismo del glucosio dovuta ad alterata produzione dell insulina che si manifesta con una elevata glicemia. 10-15% diabete
I Papillomavirus sono tutti uguali?
 Cos è il Papillomavirus? Il Papillomavirus è un microscopico nemico della tua salute. Attento, però, a non sottovalutare la pericolosità di questo microrganismo lungo solo 55 milionesimi di millimetro.
Cos è il Papillomavirus? Il Papillomavirus è un microscopico nemico della tua salute. Attento, però, a non sottovalutare la pericolosità di questo microrganismo lungo solo 55 milionesimi di millimetro.
della Valvola Mitrale
 Informazioni sul Rigurgito Mitralico e sulla Terapia con Clip della Valvola Mitrale Supporto al medico per le informazioni al paziente. Informazioni sul Rigurgito Mitralico Il rigurgito mitralico - o RM
Informazioni sul Rigurgito Mitralico e sulla Terapia con Clip della Valvola Mitrale Supporto al medico per le informazioni al paziente. Informazioni sul Rigurgito Mitralico Il rigurgito mitralico - o RM
Foglio illustrativo: informazioni per l utilizzatore. Tobramicina e Desametasone EG 0,3% + 0,1% collirio, soluzione Medicinale equivalente
 Foglio illustrativo: informazioni per l utilizzatore Tobramicina e Desametasone EG 0,3% + 0,1% collirio, soluzione Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale
Foglio illustrativo: informazioni per l utilizzatore Tobramicina e Desametasone EG 0,3% + 0,1% collirio, soluzione Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale
POLITERAPIE NEL PAZIENTE ANZIANO. Dipartimento Farmaceutico Azienda USL di Reggio Emilia
 POLITERAPIE NEL PAZIENTE ANZIANO Dipartimento Farmaceutico Azienda USL di Reggio Emilia PAZIENTI ANZIANI Maggiori utilizzatori di farmaci per la presenza di polipatologie spesso croniche Ridotte funzionalità
POLITERAPIE NEL PAZIENTE ANZIANO Dipartimento Farmaceutico Azienda USL di Reggio Emilia PAZIENTI ANZIANI Maggiori utilizzatori di farmaci per la presenza di polipatologie spesso croniche Ridotte funzionalità
Impara a riconoscere i segni e i fattori di rischio del diabete
 Diabete anche loro possono ammalarsi Impara a riconoscere i segni e i fattori di rischio del diabete Il diabete Il diabete mellito è una malattia caratterizzata da un aumento dei livelli di zucchero (glucosio)
Diabete anche loro possono ammalarsi Impara a riconoscere i segni e i fattori di rischio del diabete Il diabete Il diabete mellito è una malattia caratterizzata da un aumento dei livelli di zucchero (glucosio)
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Beta-interferoni: rischio di microangiopatia trombotica e sindrome nefrosica 20 Agosto
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Beta-interferoni: rischio di microangiopatia trombotica e sindrome nefrosica 20 Agosto
UNIVERSITA' CATTOLICA DEL SACRO CUORE FACOLTA' DI MEDICINA E CHIRURGIA "A. GEMELLI" - ROMA CORSO DI LAUREA IN INFERMIERISTICA. Protocollo n...
 UNIVERSITA' CATTOLICA DEL SACRO CUORE FACOLTA' DI MEDICINA E CHIRURGIA "A. GEMELLI" - ROMA CORSO DI LAUREA IN INFERMIERISTICA Protocollo n... Preparazione della Terapia Endovenosa OBIETTIVI Garantire un
UNIVERSITA' CATTOLICA DEL SACRO CUORE FACOLTA' DI MEDICINA E CHIRURGIA "A. GEMELLI" - ROMA CORSO DI LAUREA IN INFERMIERISTICA Protocollo n... Preparazione della Terapia Endovenosa OBIETTIVI Garantire un
100 ml contengono: ketotifene fumarato 0,069 g, pari a 0,05 g di ketotifene.
 1. DENOMINAZIONE DEL MEDICINALE EUSTAMYL 0,05% collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA EUSTAMYL 0,05% collirio, soluzione 100 ml contengono: ketotifene fumarato 0,069 g, pari a 0,05
1. DENOMINAZIONE DEL MEDICINALE EUSTAMYL 0,05% collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA EUSTAMYL 0,05% collirio, soluzione 100 ml contengono: ketotifene fumarato 0,069 g, pari a 0,05
Informazioni per potenziali partecipanti. Possiamo sciogliere l'amiloidosi AL?
 Informazioni per potenziali partecipanti Possiamo sciogliere l'amiloidosi AL? È ora di affrontare diversamente l amiloidosi AL? L amiloidosi AL è una malattia rara e spesso fatale causata dall accumulo
Informazioni per potenziali partecipanti Possiamo sciogliere l'amiloidosi AL? È ora di affrontare diversamente l amiloidosi AL? L amiloidosi AL è una malattia rara e spesso fatale causata dall accumulo
RACCOLTA DEL SANGUE E DEL TESSUTO CORDONALE ISTRUZIONI PER OPERATORI SANITARI
 RACCOLTA DEL SANGUE E DEL TESSUTO CORDONALE ISTRUZIONI PER OPERATORI SANITARI Informazioni importanti per Medici ed Ostetriche per la raccolta del sangue cordonale Questa è una procedura molto semplice,
RACCOLTA DEL SANGUE E DEL TESSUTO CORDONALE ISTRUZIONI PER OPERATORI SANITARI Informazioni importanti per Medici ed Ostetriche per la raccolta del sangue cordonale Questa è una procedura molto semplice,
LA SOLUZIONE AI NODULI BENIGNI DELLA TIROIDE
 LA SOLUZIONE AI NODULI BENIGNI DELLA TIROIDE www.modilite.info MODILITE In Italia la patologia nodulare tiroidea è piuttosto frequente ed è spesso asintomatica. Circa l 80% dei noduli tiroidei sono benigni
LA SOLUZIONE AI NODULI BENIGNI DELLA TIROIDE www.modilite.info MODILITE In Italia la patologia nodulare tiroidea è piuttosto frequente ed è spesso asintomatica. Circa l 80% dei noduli tiroidei sono benigni
SOSTANZE PERICOLOSE. rispettate le dosi consigliate dal produttore. È utile quindi utilizzare dei sistemi di dosaggio.
 SOSTANZE PERICOLOSE Le sostanze pericolose sono materiali e sostanze che possono essere pericolose per l uomo e l ambiente e che devono essere specificatamente contrassegnate (simbolo di pericolo). Per
SOSTANZE PERICOLOSE Le sostanze pericolose sono materiali e sostanze che possono essere pericolose per l uomo e l ambiente e che devono essere specificatamente contrassegnate (simbolo di pericolo). Per
Dronedarone e insufficienza renale acuta: analisi delle segnalazioni della Rete Nazionale di Farmacovigilanza
 Dronedarone e insufficienza renale acuta: analisi delle segnalazioni della Rete Nazionale di Farmacovigilanza Domenico Motola Dipartimento di Scienze Mediche e Chirurgiche Unità di farmacologia Università
Dronedarone e insufficienza renale acuta: analisi delle segnalazioni della Rete Nazionale di Farmacovigilanza Domenico Motola Dipartimento di Scienze Mediche e Chirurgiche Unità di farmacologia Università
Misericordia di Empoli Centro Formazione. Primo Soccorso. Eventi e Lesioni di Origine Traumatica
 Misericordia di Empoli Centro Formazione Primo Soccorso Eventi e Lesioni di Origine Traumatica Il Trauma E detto trauma un evento violento che reca un danno psico-fisico ad un individuo. Incidente SI Infarto
Misericordia di Empoli Centro Formazione Primo Soccorso Eventi e Lesioni di Origine Traumatica Il Trauma E detto trauma un evento violento che reca un danno psico-fisico ad un individuo. Incidente SI Infarto
CARTA INTESTATA DEL CENTRO CLINICO
 CARTA INTESTATA DEL CENTRO CLINICO CERLiguria_Mod.10_Uso_Compassionevole RICHIESTA DI PARERE AL COMITATO ETICO PER USO TERAPEUTICO DI MEDICINALE SOTTOPOSTO A SPERIMENTAZIONE CLINICA Si applica solo se
CARTA INTESTATA DEL CENTRO CLINICO CERLiguria_Mod.10_Uso_Compassionevole RICHIESTA DI PARERE AL COMITATO ETICO PER USO TERAPEUTICO DI MEDICINALE SOTTOPOSTO A SPERIMENTAZIONE CLINICA Si applica solo se
RISCHIO CHIMICO NELLE ATTIVITA DI PULIZIA
 RISCHIO CHIMICO NELLE ATTIVITA DI PULIZIA Unità didattica 3 CORSO DI FORMAZIONE SPECIFICA DEI LAVORATORI RISCHIO CHIMICO IL RISCHIO ESISTE LADDOVE CI SIA UNA ESPOSIZIONE AD UN QUALUNQUE AGENTE CHIMICO.
RISCHIO CHIMICO NELLE ATTIVITA DI PULIZIA Unità didattica 3 CORSO DI FORMAZIONE SPECIFICA DEI LAVORATORI RISCHIO CHIMICO IL RISCHIO ESISTE LADDOVE CI SIA UNA ESPOSIZIONE AD UN QUALUNQUE AGENTE CHIMICO.
Conclusioni scientifiche
 Allegato II Conclusioni scientifiche e motivi della revoca o variazione dei termini delle autorizzazioni all immissione in commercio e spiegazione dettagliata delle differenze rispetto alla raccomandazione
Allegato II Conclusioni scientifiche e motivi della revoca o variazione dei termini delle autorizzazioni all immissione in commercio e spiegazione dettagliata delle differenze rispetto alla raccomandazione
Domande e risposte 30 novembre 2010. Informazioni sulla tosse nei bambini sotto i 2 anni d età: perché i mucolitici non devono più essere utilizzati?
 Domande e risposte 30 novembre 2010 Informazioni sulla tosse nei bambini sotto i 2 anni d età: perché i mucolitici non devono più essere utilizzati? In sintesi: La tosse è un sintomo comune nei bambini
Domande e risposte 30 novembre 2010 Informazioni sulla tosse nei bambini sotto i 2 anni d età: perché i mucolitici non devono più essere utilizzati? In sintesi: La tosse è un sintomo comune nei bambini
CHECK LIST - CHIRURGIA REFRATTIVA CON LASER AD ECCIMERI
 ENTE DI CERTIFICAZIONE DI QUALITA S.O.I. S.r.l. con socio unico V.I. del c/o 1-REQUISITI STRUTTURALI 1.1-Generali 1.1.1 E' garantita una facile accessibilità dall'esterno sia per quanto concerne l'ingresso
ENTE DI CERTIFICAZIONE DI QUALITA S.O.I. S.r.l. con socio unico V.I. del c/o 1-REQUISITI STRUTTURALI 1.1-Generali 1.1.1 E' garantita una facile accessibilità dall'esterno sia per quanto concerne l'ingresso
Foglio illustrativo: informazioni per il paziente. Voltaren Emulgel 2% gel diclofenac dietilammonio
 Foglio illustrativo: informazioni per il paziente Voltaren Emulgel 2% gel diclofenac dietilammonio Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni
Foglio illustrativo: informazioni per il paziente Voltaren Emulgel 2% gel diclofenac dietilammonio Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni
Monitoraggio sulla conversione dei prezzi al consumo dalla Lira all Euro
 ISTAT 17 gennaio 2002 Monitoraggio sulla conversione dei prezzi al consumo dalla Lira all Euro Nell ambito dell iniziativa di monitoraggio, avviata dall Istat per analizzare le modalità di conversione
ISTAT 17 gennaio 2002 Monitoraggio sulla conversione dei prezzi al consumo dalla Lira all Euro Nell ambito dell iniziativa di monitoraggio, avviata dall Istat per analizzare le modalità di conversione
EW1051 Lettore di schede USB
 EW1051 Lettore di schede USB 2 ITALIANO EW1051 Lettore di schede USB Contenuti 1.0 Introduzione... 2 1.1 Funzioni e caratteristiche... 2 1.2 Contenuto della confezione... 2 2.0 Installazione del EW1051
EW1051 Lettore di schede USB 2 ITALIANO EW1051 Lettore di schede USB Contenuti 1.0 Introduzione... 2 1.1 Funzioni e caratteristiche... 2 1.2 Contenuto della confezione... 2 2.0 Installazione del EW1051
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L Agenzia Italiana del Farmaco (AIFA) IMPORTANTI INFORMAZIONI DI SICUREZZA BUFLOMEDIL
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L Agenzia Italiana del Farmaco (AIFA) Febbraio 2010 IMPORTANTI INFORMAZIONI DI SICUREZZA BUFLOMEDIL Nuove informazioni di sicurezza relative ai medicinali contenenti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L Agenzia Italiana del Farmaco (AIFA) Febbraio 2010 IMPORTANTI INFORMAZIONI DI SICUREZZA BUFLOMEDIL Nuove informazioni di sicurezza relative ai medicinali contenenti
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Purevax RC liofilizzato e solvente per sospensione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Purevax RC liofilizzato e solvente per sospensione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Conferenza di consenso Quale informazione per la donna in menopausa sulla terapia ormonale sostitutiva? Torino 17 maggio 2008
 Conferenza di consenso Quale informazione per la donna in menopausa sulla terapia ormonale sostitutiva? Torino 17 maggio 2008 1 Quali aspetti della menopausa possono essere divulgati come problemi di salute?
Conferenza di consenso Quale informazione per la donna in menopausa sulla terapia ormonale sostitutiva? Torino 17 maggio 2008 1 Quali aspetti della menopausa possono essere divulgati come problemi di salute?
Alto livello igienico
 La separazione fra aree che necessitano livelli igienici diversi viene definita zoning. Lo studio del zoning diventa molto importante nella prevenzione contro l entrata di potenziali contaminanti in specifiche
La separazione fra aree che necessitano livelli igienici diversi viene definita zoning. Lo studio del zoning diventa molto importante nella prevenzione contro l entrata di potenziali contaminanti in specifiche
INFORMATIVA PAZIENTI
 SOD Oculistica (Dir. Prof. U. Menchini) SOD Diagnostica Genetica (Dir. Dr.ssa F. Torricelli) Azienda Ospedaliero- Universitaria Careggi Via delle Oblate, 1-50141 FIRENZE Padiglione 4 Clinica Oculistica
SOD Oculistica (Dir. Prof. U. Menchini) SOD Diagnostica Genetica (Dir. Dr.ssa F. Torricelli) Azienda Ospedaliero- Universitaria Careggi Via delle Oblate, 1-50141 FIRENZE Padiglione 4 Clinica Oculistica
UTILIZZATORI A VALLE: COME RENDERE NOTI GLI USI AI FORNITORI
 UTILIZZATORI A VALLE: COME RENDERE NOTI GLI USI AI FORNITORI Un utilizzatore a valle di sostanze chimiche dovrebbe informare i propri fornitori riguardo al suo utilizzo delle sostanze (come tali o all
UTILIZZATORI A VALLE: COME RENDERE NOTI GLI USI AI FORNITORI Un utilizzatore a valle di sostanze chimiche dovrebbe informare i propri fornitori riguardo al suo utilizzo delle sostanze (come tali o all
LE CARTE DI CONTROLLO (4)
 LE CARTE DI CONTROLLO (4) Tipo di carta di controllo Frazione difettosa Carta p Numero di difettosi Carta np Dimensione campione Variabile, solitamente >= 50 costante, solitamente >= 50 Linea centrale
LE CARTE DI CONTROLLO (4) Tipo di carta di controllo Frazione difettosa Carta p Numero di difettosi Carta np Dimensione campione Variabile, solitamente >= 50 costante, solitamente >= 50 Linea centrale
CAPITOLO 20 AGGIORNAMENTO DEL CODICE DI STOCCAGGIO
 CAPITOLO 20 AGGIORNAMENTO DEL CODICE DI STOCCAGGIO 20.1 PREMESSA... 255 20.2 COMITATO DI CONSULTAZIONE... 255 20.3 SOGGETTI TITOLATI A PRESENTARE RICHIESTE DI MODIFICA... 255 20.4 REQUISITI DI RICEVIBILITA
CAPITOLO 20 AGGIORNAMENTO DEL CODICE DI STOCCAGGIO 20.1 PREMESSA... 255 20.2 COMITATO DI CONSULTAZIONE... 255 20.3 SOGGETTI TITOLATI A PRESENTARE RICHIESTE DI MODIFICA... 255 20.4 REQUISITI DI RICEVIBILITA
Spiegazioni per l utilizzazione dei formulari Assicurazione Qualità Latte
 Spiegazioni per l utilizzazione dei formulari Assicurazione Qualità Latte La salute delle mammelle, l utilizzazione e l approvigionamento di medicamenti veterinari e la pulizia degli impianti di mungitura
Spiegazioni per l utilizzazione dei formulari Assicurazione Qualità Latte La salute delle mammelle, l utilizzazione e l approvigionamento di medicamenti veterinari e la pulizia degli impianti di mungitura
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1/18
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1/18 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Oncept IL-2 liofilizzato e solvente per sospensione iniettabile per gatti 2. COMPOSIZIONE QUALITATIVA
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1/18 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Oncept IL-2 liofilizzato e solvente per sospensione iniettabile per gatti 2. COMPOSIZIONE QUALITATIVA
Breve guida per il paziente con insufficienza renale cronica
 Quando l insufficienza renale ti fa perdere l equilibrio, Fosforo Calcio cosa puoi fare per controllare il fosforo Breve guida per il paziente con insufficienza renale cronica ASSOCIAZIONE NAZIONALE EMODIALIZZATI
Quando l insufficienza renale ti fa perdere l equilibrio, Fosforo Calcio cosa puoi fare per controllare il fosforo Breve guida per il paziente con insufficienza renale cronica ASSOCIAZIONE NAZIONALE EMODIALIZZATI
Parte I (punti 3-9): Misure sanitarie obbligatorie per il controllo della Paratubercolosi bovina
 LINEE GUIDA PER L ADOZIONE DI PIANI DI CONTROLLO E PER L ASSEGNAZIONE DELLA QUALIFICA SANITARIA DEGLI ALLEVAMENTI NEI CONFRONTI DELLA PARATUBERCOLOSI BOVINA 1. Definizioni Ai sensi delle presenti linee
LINEE GUIDA PER L ADOZIONE DI PIANI DI CONTROLLO E PER L ASSEGNAZIONE DELLA QUALIFICA SANITARIA DEGLI ALLEVAMENTI NEI CONFRONTI DELLA PARATUBERCOLOSI BOVINA 1. Definizioni Ai sensi delle presenti linee
STUDI CLINICI 1. Che cosa è uno studio clinico e a cosa serve? 2. Come nasce la sperimentazione clinica e che tipi di studi esistono?
 STUDI CLINICI 1. Che cosa è uno studio clinico e a cosa serve? Si definisce sperimentazione clinica, o studio clinico controllato, (in inglese: clinical trial), un esperimento scientifico che genera dati
STUDI CLINICI 1. Che cosa è uno studio clinico e a cosa serve? Si definisce sperimentazione clinica, o studio clinico controllato, (in inglese: clinical trial), un esperimento scientifico che genera dati
DIABETE E AUTOCONTROLLO
 DIABETE E AUTOCONTROLLO Sì, gestire il diabete è possibile. Il monitoraggio della glicemia fa parte della terapia generale del diabete. Grazie all autocontrollo, potete misurare il livello di glicemia
DIABETE E AUTOCONTROLLO Sì, gestire il diabete è possibile. Il monitoraggio della glicemia fa parte della terapia generale del diabete. Grazie all autocontrollo, potete misurare il livello di glicemia
