ossigeno e ne facilita la diffusione dai capillari all ambiente intracellulare.
|
|
|
- Leonzia Scala
- 8 anni fa
- Visualizzazioni
Transcript
1 Ricostituzione e attività pseudoenzimatica della mioglobina modificata Giulia Bertelegni e Carolina Ferrari I.I.S. A.Maserati Facoltà di Scienze MM.FF.NN. Dipartimento di Chimica generale Università degli studi di Pavia
2 Cos è la mioglobina?? La mioglobina è un emeproteina che coordina reversibilmente l ossigeno molecolare e può essere trovata nei muscoli striati dei vertebrati in cui agisce come riserva di ossigeno e ne facilita la diffusione dai capillari all ambiente intracellulare.
3 Scopo del lavoro Estrazione dell apomioglobina Preparazione dell eme sintetico Costituzione della nuova proteina Controllo della ricostituzione della proteina Studio delle cinetiche
4 Estrazione dell apomioglobina Dopo aver sciolto in acqua distillata la mioglobina liofilizzata estratta dal cuore di cavallo, si acidifica la soluzione con HCl per rompere il legame tra il ferro del gruppo eme e l azoto imidazolico dell istidina prossimale. In seguito si effettuano varie estrazioni con butanone (CH 3 C(O)CH 2 CH 3 ) per ottenere l apomioglobina. Si preleva la fase contenente l apoproteina e la si pone in dialisi.
5 Preparazione dell eme sintetico Si solubilizza l eminatriptofano costituita da un gruppo eme legato al triptofano in cui è presente Fe lll (forma ossidata), il quale ha il compito di formare il legame con l apomioglobina.
6 Si calcola la concentrazione dell eminatriptofano e dell apomioglobina tramite una determinazione spettrofotometrica.
7 Sintesi del gruppo eme modificato dall aggiunta del triptofano
8 Ricostituzione della mioglobina Si aggiunge una quantità stechiometrica di emina all apoproteina in modo che le due soluzioni reagiscano in rapporto 1:1.
9 In seguito la nuova soluzione viene posta in un rotavapor e successivamente dializzata dopo aver aggiunto DMF, una sostanza molto polare, poiché l emina- triptofano precipitava in soluzione acquosa e non permetteva una corretta ricostituzione.
10 La proteina si è ricostituita?? Per controllare se nella soluzione vi è la presenza di proteina libera si effettua una determinazione spettrofotometrica. Se a 282 nm non vi sono picchi si può dedurre che la proteina si sia ricostituita del tutto in quanto l apomioglobina presenta una banda proprio a questa lunghezza d onda. Nel graficosièanchenotatoilpiccodelladmf.
11 Saggio dell emocromogeno Per poter calcolare la ε della mioglobina ricostituita è stata preparata una nuova soluzione di mioglobina in quanto quella da noi ottenuta era poco concentrata. Alla nuova proteina si aggiunge piridina, NaOH e sodio ditionito, un composto riducente.
12 Si è quindi formato l addotto eme bispiridina di cui noi conosciamo la ε a 556 nm. Grazie a questo dato e alla legge di Lambert Beer si può calcolare il valore approssimativo della mioglobina ricostituita (ε=123000) e la sua concentrazione.
13 Studi cinetici La cinetica di Michaelis - Menten La cinetica di Michaelis - Menten mostra la velocità di una reazione catalizzata da un enzima (che rimane immutato) al variare della concentrazione del substrato. Al raggiungimento della massima velocità della reazione corrisponde la saturazione dell enzima da parte del substrato.
14 Schema della reazione tra l enzima e il substrato L equazione di Michaelis- Menten L equazione mette in relazione la velocità di formazione del prodotto e concentrazione del substrato.
15 Nella nostra esperienza abbiamo effettuato studi di attività perossidasica. Ciclo catalitico della perossidasi
16 Mioglobina e perossidasi
17 Per effettuare le cinetiche sulla mioglobina e su quella ricostituita si effettua l ottimizzazione del perossido di idrogeno per trovare la quantità adatta. Quest ultimo hailcompitodiavviarelareazione.quindisi effettuano più misurazioni variando la concentrazione della tiramina(il substrato). I dati ottenuti vengono inseriti in un programma che utilizzando la formula Vm x/(km+x) ne mostra il grafico.
18 Mioglobina Mioglobina ricostituita
19 Conclusioni Dal grafico si capisce che la mioglobina non ricostituita è più attiva, tuttavia le curve sono molto simili. Questo comportamento è spiegabile tramite tre ipotesi: la proteina è la stessa e di conseguenza non ci sono molte modificazioni, la proteina non si è ricostituita del tutto oppure l eme nuovo è troppo grande e quindi non entra perfettamente nella tasca della apomioglobina.
20 Quali strumenti abbiamo utilizzato?? Spettrofotometro: strumento che, grazie a un fascio luminoso fatto passare attraverso una soluzione da analizzare, indica le lunghezze d onda assorbite da essa. La legge che ci permette di risalire alla concentrazione della proteina avendo l assorbanza ricavata dallo spettrofotometro è la seguente:
21 Assorbanza Lunghezza di cammino ottico A=εbc Coefficiente di estinzione molare Concentrazione Legge di Lambert-Beer
22 Rotavapor: Strumento che creando un vuoto all interno del pallone permette l eliminazione dei solventi per evaporazione. ph-metro: Strumento per rilevare la concentrazione di ioni H + in una sostanza utilizzando come riferimento standard a ph noto.
23
24
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA
 PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
Attivitá e cinetica enzimatica
 Attivitá e cinetica enzimatica PAS : Classe di insegnamento A60 Biologia e scienze A.A. 2013/2014 09/05/2014 Cinetica Enzimatica La cinetica enzimatica è misurata come velocità di conversione del substrato
Attivitá e cinetica enzimatica PAS : Classe di insegnamento A60 Biologia e scienze A.A. 2013/2014 09/05/2014 Cinetica Enzimatica La cinetica enzimatica è misurata come velocità di conversione del substrato
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola.
 Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
La percentuale massa/volume (%m/v) indica la quantità di soluto espressa in grammi presente in 100 ml di soluzione.
 La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
= 9,3 10-5 M = 1,05 10-5 M
 - Calcolare la solubilità molare di CaCO 3 ( = 8,7 10-9 ). La reazione di solubilizzazione di CaCO 3 (carbonato di calcio) è: CaCO 3 (s) Ca 2+ + CO 3 L espressione della sarà quindi: = [Ca 2+ ] [CO 3 ]
- Calcolare la solubilità molare di CaCO 3 ( = 8,7 10-9 ). La reazione di solubilizzazione di CaCO 3 (carbonato di calcio) è: CaCO 3 (s) Ca 2+ + CO 3 L espressione della sarà quindi: = [Ca 2+ ] [CO 3 ]
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Esperimenti per gioco. Progetto realizzato dagli alunni del liceo O.M. Corbino.
 Esperimenti per gioco Progetto realizzato dagli alunni del liceo O.M. Corbino. Il progetto ha lo scopo di avvicinare i ragazzi al mondo della scienza tramite lo svolgimento di semplici esperienze di laboratorio
Esperimenti per gioco Progetto realizzato dagli alunni del liceo O.M. Corbino. Il progetto ha lo scopo di avvicinare i ragazzi al mondo della scienza tramite lo svolgimento di semplici esperienze di laboratorio
INTEGRATORE E DERIVATORE REALI
 INTEGRATORE E DERIVATORE REALI -Schemi elettrici: Integratore reale : C1 R2 vi (t) R1 vu (t) Derivatore reale : R2 vi (t) R1 C1 vu (t) Elenco componenti utilizzati : - 1 resistenza da 3,3kΩ - 1 resistenza
INTEGRATORE E DERIVATORE REALI -Schemi elettrici: Integratore reale : C1 R2 vi (t) R1 vu (t) Derivatore reale : R2 vi (t) R1 C1 vu (t) Elenco componenti utilizzati : - 1 resistenza da 3,3kΩ - 1 resistenza
SCALA DEI PESI ATOMICI RELATIVI E MEDI
 SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
Equilibri di precipitazione
 Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Progetto lauree scientifiche 2015. da una tazzina di caffè. Pavia 1-11 settembre 2015. di Riccardo Scarabello e Damiano Duminuco
 Progetto lauree scientifiche 2015 da una tazzina di caffè di Riccardo Scarabello e Damiano Duminuco Pavia 1-11 settembre 2015 le nostre esperienze Estrazione della caffeina Estrazione dell olio dal caffè:
Progetto lauree scientifiche 2015 da una tazzina di caffè di Riccardo Scarabello e Damiano Duminuco Pavia 1-11 settembre 2015 le nostre esperienze Estrazione della caffeina Estrazione dell olio dal caffè:
SISTEMA BINARIO DI DUE LIQUIDI VOLATILI TOTALMENTE MISCIBILI che seguono Raoult
 SISTEM INRIO DI DUE IQUIDI OTII MENTE MISCIII che seguono Raoult Consideriamo due liquidi e totalmente miscibili di composizione χ e χ presenti in un contenitore ad una certa temperatura T=T 1. o strato
SISTEM INRIO DI DUE IQUIDI OTII MENTE MISCIII che seguono Raoult Consideriamo due liquidi e totalmente miscibili di composizione χ e χ presenti in un contenitore ad una certa temperatura T=T 1. o strato
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B
 Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
Spettrofotometria. Le onde luminose consistono in campi magnetici e campi elettrici oscillanti, fra loro perpendicolari.
 Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Analisi delle acque dell isola di Favignana
 Analisi delle acque dell isola di Favignana Durante le attività svolte al campo scuola nell ambito del progetto Un mare di.. risorse, il nostro gruppo si è occupato di analizzare le acque del mare in diversi
Analisi delle acque dell isola di Favignana Durante le attività svolte al campo scuola nell ambito del progetto Un mare di.. risorse, il nostro gruppo si è occupato di analizzare le acque del mare in diversi
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
Dissociazione elettrolitica
 Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
LA MATERIA Suggerimenti didattici e schede
 LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
Estrazione del DNA. 1. Introduzione
 Estrazione del DNA 1. Introduzione L obiettivo di questa esperienza è quello di osservare la molecola degli acidi nucleici, una volta separata dall involucro cellulare in cui è contenuta all interno della
Estrazione del DNA 1. Introduzione L obiettivo di questa esperienza è quello di osservare la molecola degli acidi nucleici, una volta separata dall involucro cellulare in cui è contenuta all interno della
PRODUZIONE DI MANGIMI DA PROCESSI FERMENTATIVI DI OLI ESAUSTI
 PRODUZIONE DI MANGIMI DA PROCESSI FERMENTATIVI DI OLI ESAUSTI Per questa sperimentazione si è utilizzato l olio esausto come substrato per processi fermentativi, ovvero trasformazione di materiale organico
PRODUZIONE DI MANGIMI DA PROCESSI FERMENTATIVI DI OLI ESAUSTI Per questa sperimentazione si è utilizzato l olio esausto come substrato per processi fermentativi, ovvero trasformazione di materiale organico
DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto:
 Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Analisi di Controllo di un Acqua Minerale Naturale
 Analisi di Controllo di un Acqua Minerale aturale ITODUZIOE Le acque potabili possono essere in diverse tipologie: si definiscono acque destinate al consumo umano, quelle acque rese potabili dopo aver
Analisi di Controllo di un Acqua Minerale aturale ITODUZIOE Le acque potabili possono essere in diverse tipologie: si definiscono acque destinate al consumo umano, quelle acque rese potabili dopo aver
Questionario di gradimento del Museo di Palazzo Grimani Estratto dalla relazione sui dati raccolti giugno 2011 luglio 2012
 Questionario di gradimento del Museo di Palazzo Grimani Estratto dalla relazione sui dati raccolti giugno 2011 luglio 2012 Premessa La seguente analisi dei questionari distribuiti dal Museo di Palazzo
Questionario di gradimento del Museo di Palazzo Grimani Estratto dalla relazione sui dati raccolti giugno 2011 luglio 2012 Premessa La seguente analisi dei questionari distribuiti dal Museo di Palazzo
PROTEINE. sono COMPOSTI ORGANICI QUATERNARI
 PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
MISURE DI POTERE CALORIFICO E COMPOSIZIONE
 MISURE DI POTERE CALORIFICO E COMPOSIZIONE Potere calorifico dei combustibili: bomba calorimetrica e calorimetro di Junkers Composizione: gascromatografia Composizione dei gas combusti: o Sonda λ o Strumenti
MISURE DI POTERE CALORIFICO E COMPOSIZIONE Potere calorifico dei combustibili: bomba calorimetrica e calorimetro di Junkers Composizione: gascromatografia Composizione dei gas combusti: o Sonda λ o Strumenti
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY
 DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI
 TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI MATERIA: CHIMICA CLASSI: PRIME I II QUADRIMESTRE Competenze Abilità/Capacità Conoscenze* Attività didattica Strumenti Tipologia verifiche Osservare, descrivere
TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI MATERIA: CHIMICA CLASSI: PRIME I II QUADRIMESTRE Competenze Abilità/Capacità Conoscenze* Attività didattica Strumenti Tipologia verifiche Osservare, descrivere
Capitolo 3. L applicazione Java Diagrammi ER. 3.1 La finestra iniziale, il menu e la barra pulsanti
 Capitolo 3 L applicazione Java Diagrammi ER Dopo le fasi di analisi, progettazione ed implementazione il software è stato compilato ed ora è pronto all uso; in questo capitolo mostreremo passo passo tutta
Capitolo 3 L applicazione Java Diagrammi ER Dopo le fasi di analisi, progettazione ed implementazione il software è stato compilato ed ora è pronto all uso; in questo capitolo mostreremo passo passo tutta
Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica
 Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Definizione
Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Definizione
RICHIAMI DI TERMOCHIMICA
 CAPITOLO 5 RICHIAMI DI TERMOCHIMICA ARIA TEORICA DI COMBUSTIONE Una reazione di combustione risulta completa se il combustibile ha ossigeno sufficiente per ossidarsi completamente. Si ha combustione completa
CAPITOLO 5 RICHIAMI DI TERMOCHIMICA ARIA TEORICA DI COMBUSTIONE Una reazione di combustione risulta completa se il combustibile ha ossigeno sufficiente per ossidarsi completamente. Si ha combustione completa
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
2) Calcolare la molarità di una soluzione di acido solforico al 17%,d = 1.12 g/ml
 Bari,11 gennaio 1999 Compito di analisi dei farmaci I 1) 1 ml di H 2 O 2 viene titolato con KMnO 4. Sono necessari 18.1 ml. La soluzione di KMnO 4 è 0.1023 N e la densità dell acqua ossigenata è 1.01 g/ml.
Bari,11 gennaio 1999 Compito di analisi dei farmaci I 1) 1 ml di H 2 O 2 viene titolato con KMnO 4. Sono necessari 18.1 ml. La soluzione di KMnO 4 è 0.1023 N e la densità dell acqua ossigenata è 1.01 g/ml.
Microeconomia, Esercitazione 3 Effetto reddito, sostituzione, variazione compensativa, domanda di mercato, surplus del consumatore.
 Microeconomia, Esercitazione 3 Effetto reddito, sostituzione, variazione compensativa, domanda di mercato, surplus del consumatore. Dott. Giuseppe Francesco Gori Domande a risposta multipla ) Se nel mercato
Microeconomia, Esercitazione 3 Effetto reddito, sostituzione, variazione compensativa, domanda di mercato, surplus del consumatore. Dott. Giuseppe Francesco Gori Domande a risposta multipla ) Se nel mercato
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni
 Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni Una delle più importanti proprietà di una soluzione acquosa è la sua concentrazione di ioni idrogeno. Lo ione H + o
Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni Una delle più importanti proprietà di una soluzione acquosa è la sua concentrazione di ioni idrogeno. Lo ione H + o
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti.
 Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Proprietà ottiche di nanocristalli
 Gerelli Yuri Corso di Spettroscopia Proprietà ottiche di nanocristalli Introduzione L esperienza affrontata in laboratorio prevede la caratterizzazione delle basilari proprietà ottiche di cristalli nanostrutturati,
Gerelli Yuri Corso di Spettroscopia Proprietà ottiche di nanocristalli Introduzione L esperienza affrontata in laboratorio prevede la caratterizzazione delle basilari proprietà ottiche di cristalli nanostrutturati,
SPC e distribuzione normale con Access
 SPC e distribuzione normale con Access In questo articolo esamineremo una applicazione Access per il calcolo e la rappresentazione grafica della distribuzione normale, collegata con tabelle di Clienti,
SPC e distribuzione normale con Access In questo articolo esamineremo una applicazione Access per il calcolo e la rappresentazione grafica della distribuzione normale, collegata con tabelle di Clienti,
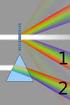
Università degli studi di Messina facoltà di Scienze mm ff nn. Progetto Lauree Scientifiche (FISICA) Prisma ottico
 Università degli studi di Messina facoltà di Scienze mm ff nn Progetto Lauree Scientifiche (FISICA) Prisma ottico Parte teorica Fenomenologia di base La luce che attraversa una finestra, un foro, una fenditura,
Università degli studi di Messina facoltà di Scienze mm ff nn Progetto Lauree Scientifiche (FISICA) Prisma ottico Parte teorica Fenomenologia di base La luce che attraversa una finestra, un foro, una fenditura,
DETERMINAZIONE DEL pk a DI UN INDICATORE DA MISURE SPETTROFOTOMETRICHE
 DETERMINAZIONE DEL pk a DI UN INDICATORE DA MISURE SPETTROFOTOMETRICHE Con il nome di indicatori di ph vengono denominate delle sostanze in grado di assumere diverse colorazioni a seconda della concentrazione
DETERMINAZIONE DEL pk a DI UN INDICATORE DA MISURE SPETTROFOTOMETRICHE Con il nome di indicatori di ph vengono denominate delle sostanze in grado di assumere diverse colorazioni a seconda della concentrazione
CO 2 aq l anidride carbonica disciolta, reagendo con l'acqua, forma acido carbonico secondo la reazione:
 DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
Metalli in medicina. L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il
 Metalli in medicina L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il rame, per esempio, erano utilizzati nella Grecia antica. Già da secoli il Hg 2+ era utilizzato nel trattamento
Metalli in medicina L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il rame, per esempio, erano utilizzati nella Grecia antica. Già da secoli il Hg 2+ era utilizzato nel trattamento
Piano Lauree Scientifiche 2010 2012 Area Chimica Università di Bologna Facoltà di Chimica Industriale. Laboratori didattici dei Corsi di Laurea
 Chimica Industriale Bologna Faenza Rimini BOLOGNA La Chimica nella vita di tutti i giorni è scienza per il futuro Dr. ELENA STROCCHI elena.strocchi@unibo.it Tel. 051 2093645 FAENZA La Chimica e i Materiali:
Chimica Industriale Bologna Faenza Rimini BOLOGNA La Chimica nella vita di tutti i giorni è scienza per il futuro Dr. ELENA STROCCHI elena.strocchi@unibo.it Tel. 051 2093645 FAENZA La Chimica e i Materiali:
Metodo per la determinazione di Ibuprofene in acque superficiali, sotterranee e di scarico.
 COPIA AD USO ESCLUSIVO DI. Progetto EMAS di Distretto finalizzato all Attestato APO (Ambiti Produttivi Omogenei) e al supporto delle singole organizzazioni dei comparti chimico farmaceutico operanti nel
COPIA AD USO ESCLUSIVO DI. Progetto EMAS di Distretto finalizzato all Attestato APO (Ambiti Produttivi Omogenei) e al supporto delle singole organizzazioni dei comparti chimico farmaceutico operanti nel
DALLA MOLE AI CALCOLI STECHIOMETRICI
 Conversione Massa Moli DALLA MOLE AI CALCOLI STECHIOMETRICI - ESERCIZI GUIDATI - LEGENDA DEI SIMBOLI: M = Peso molecolare m(g) = quantità in g di elemento o di composto n = numero di moli Ricorda che l'unità
Conversione Massa Moli DALLA MOLE AI CALCOLI STECHIOMETRICI - ESERCIZI GUIDATI - LEGENDA DEI SIMBOLI: M = Peso molecolare m(g) = quantità in g di elemento o di composto n = numero di moli Ricorda che l'unità
ITIS Castelli - Dipartimento di Chimica - a.s. 2010/11
 1 Nei laboratori di Chimica dell I.T.I.S. Castelli di Brescia sono stati eseguiti dei test miranti a determinare il residuo di calcinazione (cenere) sui campioni di lolla di riso puri o addizionati con
1 Nei laboratori di Chimica dell I.T.I.S. Castelli di Brescia sono stati eseguiti dei test miranti a determinare il residuo di calcinazione (cenere) sui campioni di lolla di riso puri o addizionati con
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Capitolo 7. Le soluzioni
 Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
IL MODELLO DI MICHAELIS E MENTEN PER LA CINETICA ENZIMATICA.
 CORSO DI CHIMICA E PROPEDEUTICA BIOCHIMICA FACOLTA DI MEDICINA E CHIRURGIA. IL MODELLO DI MICHAELIS E MENTEN PER LA CINETICA ENZIMATICA. Un enzima è una proteina capace di catalizzare una specifica reazione
CORSO DI CHIMICA E PROPEDEUTICA BIOCHIMICA FACOLTA DI MEDICINA E CHIRURGIA. IL MODELLO DI MICHAELIS E MENTEN PER LA CINETICA ENZIMATICA. Un enzima è una proteina capace di catalizzare una specifica reazione
ENERGIA NELLE REAZIONI CHIMICHE
 ENERGIA NELLE REAZIONI CHIMICHE Nelle trasformazioni chimiche e fisiche della materia avvengono modifiche nelle interazioni tra le particelle che comportano sempre variazioni di energia "C è un fatto,
ENERGIA NELLE REAZIONI CHIMICHE Nelle trasformazioni chimiche e fisiche della materia avvengono modifiche nelle interazioni tra le particelle che comportano sempre variazioni di energia "C è un fatto,
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
DISTILLAZIONE e ANALISI MERCEOLOGICHE
 DISTILLAZIONE e ANALISI MERCEOLOGICHE ANNA M. DI MARIA Determinazione del grado alcolico del vino (distillazione semplice) pallone di ebollizione da 250 ml tubo adduttore con bolla di sicurezza refrigerante
DISTILLAZIONE e ANALISI MERCEOLOGICHE ANNA M. DI MARIA Determinazione del grado alcolico del vino (distillazione semplice) pallone di ebollizione da 250 ml tubo adduttore con bolla di sicurezza refrigerante
Acqua azzurra, acqua chiara. Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao
 Acqua azzurra, acqua chiara Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao Proprietà fisiche Ecosistemi acquatici Origine della vita Ciclo dell acqua Acqua Scoperte Sensazioni Leggi La
Acqua azzurra, acqua chiara Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao Proprietà fisiche Ecosistemi acquatici Origine della vita Ciclo dell acqua Acqua Scoperte Sensazioni Leggi La
IDROGENO IN PRATICA. del gruppo degli allievi del Volta. Laboratorio di chimica I.T. I. Volta
 IDROGENO IN PRATICA Pratiche di laboratorio su iniziative del gruppo degli allievi del Volta Laboratorio di chimica I.T. I. Volta da: L Isola Misteriosa Giulio Verne 1874 Senza il carbone non ci sarebbero
IDROGENO IN PRATICA Pratiche di laboratorio su iniziative del gruppo degli allievi del Volta Laboratorio di chimica I.T. I. Volta da: L Isola Misteriosa Giulio Verne 1874 Senza il carbone non ci sarebbero
Guida all uso di Java Diagrammi ER
 Guida all uso di Java Diagrammi ER Ver. 1.1 Alessandro Ballini 16/5/2004 Questa guida ha lo scopo di mostrare gli aspetti fondamentali dell utilizzo dell applicazione Java Diagrammi ER. Inizieremo con
Guida all uso di Java Diagrammi ER Ver. 1.1 Alessandro Ballini 16/5/2004 Questa guida ha lo scopo di mostrare gli aspetti fondamentali dell utilizzo dell applicazione Java Diagrammi ER. Inizieremo con
V= R*I. LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro.
 LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
Esercitazione 8. Gli equilibri acido-base: Ka, Kb. L autoprotolisi dell acqua. Misura del ph Soluzioni tampone 1,0 10-14
 Esercitazione 8 Misura del ph Soluzioni tampone Gli equilibri acido-base: Ka, Kb HA + H 2 O! H 3 O + + A - Ka = [H 3 O+ ][A - ] [HA] A - + H 2 O! OH - + HA Kb = [OH- ][HA] [A - ] Ka Kb = [ H 3 O + ] [
Esercitazione 8 Misura del ph Soluzioni tampone Gli equilibri acido-base: Ka, Kb HA + H 2 O! H 3 O + + A - Ka = [H 3 O+ ][A - ] [HA] A - + H 2 O! OH - + HA Kb = [OH- ][HA] [A - ] Ka Kb = [ H 3 O + ] [
Teoria delle code. Sistemi stazionari: M/M/1 M/M/1/K M/M/S
 Teoria delle code Sistemi stazionari: M/M/1 M/M/1/K M/M/S Fabio Giammarinaro 04/03/2008 Sommario INTRODUZIONE... 3 Formule generali di e... 3 Leggi di Little... 3 Cosa cerchiamo... 3 Legame tra N e le
Teoria delle code Sistemi stazionari: M/M/1 M/M/1/K M/M/S Fabio Giammarinaro 04/03/2008 Sommario INTRODUZIONE... 3 Formule generali di e... 3 Leggi di Little... 3 Cosa cerchiamo... 3 Legame tra N e le
Concetti fondamentali su acidità e basicità delle soluzioni acquose
 Concetti fondamentali su acidità e basicità delle soluzioni acquose Le molecole H 2 O dell acqua liquida pura possono andare incontro a dissociazione. Il processo può essere descritto come una reazione
Concetti fondamentali su acidità e basicità delle soluzioni acquose Le molecole H 2 O dell acqua liquida pura possono andare incontro a dissociazione. Il processo può essere descritto come una reazione
LE SOLUZIONI 1.molarità
 LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
CERCASI ENZIMA. I.T.S.E. Cecilia DEGANUTTI ALUNNI: Bogojevic Lidija De Stefano Davide Gabara Mihai Andrei Stoian Ioana Versolatto Sara
 I.T.S.E. Cecilia DEGANUTTI CERCASI ENZIMA ALUNNI: Bogojevic Lidija De Stefano Davide Gabara Mihai Andrei Stoian Ioana Versolatto Sara INSEGNANTE: Prof.ssa Cinello Eugenia TECNICO LABORATORIO: Finiello
I.T.S.E. Cecilia DEGANUTTI CERCASI ENZIMA ALUNNI: Bogojevic Lidija De Stefano Davide Gabara Mihai Andrei Stoian Ioana Versolatto Sara INSEGNANTE: Prof.ssa Cinello Eugenia TECNICO LABORATORIO: Finiello
LABORATORIO PLS CHIMICA DEI MATERIALI SINTESI DI NANOGOLD
 PIANO NAZIONALE LAUREE SCIENTIFICHE (PNLS1) la scienza per una migliore qualità della vita LABORATORIO PLS CHIMICA DEI MATERIALI SINTESI DI NANOGOLD Relazione LAB PLS Chimica dei Materiali 01-07-2011 pag.
PIANO NAZIONALE LAUREE SCIENTIFICHE (PNLS1) la scienza per una migliore qualità della vita LABORATORIO PLS CHIMICA DEI MATERIALI SINTESI DI NANOGOLD Relazione LAB PLS Chimica dei Materiali 01-07-2011 pag.
Scritto Chimica generale 13.02.2012 Gruppo A
 Scritto Chimica generale 13.02.2012 Gruppo A 1. Calcolare il ph di una soluzione ottenuta mescolando 12.0 ml di una soluzione 1.00 M di nitrato di calcio, 150 ml di una soluzione 1.00 M di acido cloridrico,
Scritto Chimica generale 13.02.2012 Gruppo A 1. Calcolare il ph di una soluzione ottenuta mescolando 12.0 ml di una soluzione 1.00 M di nitrato di calcio, 150 ml di una soluzione 1.00 M di acido cloridrico,
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He. 2) L'acqua è:
 1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
GIOCHI DELLA CHIMICA
 GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
Strategie di purificazione di proteine
 Laurea Magistrale in Scienze e Biotecnologie degli Alimenti Strategie di purificazione di proteine Lezione n.xx-2-23 PRINCIPIO - ALIMENTI DA MATRICI SOLIDE E LIQUIDE MATRICI SOLIDE - ROMPERE LA STRUTTURA
Laurea Magistrale in Scienze e Biotecnologie degli Alimenti Strategie di purificazione di proteine Lezione n.xx-2-23 PRINCIPIO - ALIMENTI DA MATRICI SOLIDE E LIQUIDE MATRICI SOLIDE - ROMPERE LA STRUTTURA
LA NATURA DEL SILOSSANICO
 LA NATURA DEL SILOSSANICO Una sempre maggior attenzione al restauro degli edifici, in particolare nei centri storici, ha stimolato nuovi studi e ricerche di prodotti, e trattamenti preventivi di facciate,
LA NATURA DEL SILOSSANICO Una sempre maggior attenzione al restauro degli edifici, in particolare nei centri storici, ha stimolato nuovi studi e ricerche di prodotti, e trattamenti preventivi di facciate,
) e 200 ml di NaOH 0.1 M. I volumi si considerano additivi.[ph = 4.085]
![) e 200 ml di NaOH 0.1 M. I volumi si considerano additivi.[ph = 4.085] ) e 200 ml di NaOH 0.1 M. I volumi si considerano additivi.[ph = 4.085]](/thumbs/26/9134725.jpg) Chimica Analitica Prova scritta del 19 Gennaio 2004 1) 375 ml di soluzione acquosa contengono 21.2 µg di un principio attivo. Esprimere la concentrazione della soluzione in parti per milione (ppm) [0.056
Chimica Analitica Prova scritta del 19 Gennaio 2004 1) 375 ml di soluzione acquosa contengono 21.2 µg di un principio attivo. Esprimere la concentrazione della soluzione in parti per milione (ppm) [0.056
EMOGLOBINA ... www.pianetachimica.it
 EMGLBIA www.pianetachimica.it L'emoglobina è una proteina specializzata nel trasporto di ossigeno, si trova all interno dei globuli rossi del sangue ai quali conferisce il caratteristico colore rosso intenso.
EMGLBIA www.pianetachimica.it L'emoglobina è una proteina specializzata nel trasporto di ossigeno, si trova all interno dei globuli rossi del sangue ai quali conferisce il caratteristico colore rosso intenso.
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
REGOLE PER L'ATTRIBUZIONE DEI COEFFICIENTI STECHIOMETRICI DI UNA REAZIONE
 REGOLE PER L'ATTRIBUZIONE DEI COEFFICIENTI STECHIOMETRICI DI UNA REAZIONE OSSIDORIDUTTIVA SECONDO IL METODO DELLO IONE-ELETTRIONE. 1) Si individuano le coppie di atomi il cui numero di ossidazione cambia
REGOLE PER L'ATTRIBUZIONE DEI COEFFICIENTI STECHIOMETRICI DI UNA REAZIONE OSSIDORIDUTTIVA SECONDO IL METODO DELLO IONE-ELETTRIONE. 1) Si individuano le coppie di atomi il cui numero di ossidazione cambia
Pb Pb 2+ + 2e 2Ag + + 2e 2Ag
 ELETTROCHIMICA OBIETTIVO DELL ESPERIENZA: conoscere i fenomeni elettrici che si basano su trasformazioni chimiche che avvengono tramite l energia elettrica. Principio teorico: l elettrochimica studia quelle
ELETTROCHIMICA OBIETTIVO DELL ESPERIENZA: conoscere i fenomeni elettrici che si basano su trasformazioni chimiche che avvengono tramite l energia elettrica. Principio teorico: l elettrochimica studia quelle
Piano Lauree Scientifiche Laboratorio di Ottica: Diffrazione ed Interferenza parte I Incontro 3 27/4/2011
 Piano Lauree Scientifiche Laboratorio di Ottica: Diffrazione ed Interferenza parte I Incontro 3 27/4/2011 Parzialmente tratto dalle presentazioni della prof.ssa Ianniello Fabio Sciarrino Dipartimento di
Piano Lauree Scientifiche Laboratorio di Ottica: Diffrazione ed Interferenza parte I Incontro 3 27/4/2011 Parzialmente tratto dalle presentazioni della prof.ssa Ianniello Fabio Sciarrino Dipartimento di
Il bilanciamento delle reazioni chimiche
 1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
Corso di Laurea in Chimica e Tecnologia Farmaceutiche Esame di Chimica Analitica e Complementi di Chimica Modulo di Chimica Analitica 8 Novembre 2012
 Modulo di Chimica Analitica 8 Novembre 2012 1. Una soluzione viene preparata sciogliendo1210 mg di K 3 Fe(CN) 6 in 775 ml di acqua. Calcolare: a) la concentrazione analitica di K 3 Fe(CN) 6 b) la concentrazione
Modulo di Chimica Analitica 8 Novembre 2012 1. Una soluzione viene preparata sciogliendo1210 mg di K 3 Fe(CN) 6 in 775 ml di acqua. Calcolare: a) la concentrazione analitica di K 3 Fe(CN) 6 b) la concentrazione
Perché il logaritmo è così importante?
 Esempio 1. Perché il logaritmo è così importante? (concentrazione di ioni di idrogeno in una soluzione, il ph) Un sistema solido o liquido, costituito da due o più componenti, (sale disciolto nell'acqua),
Esempio 1. Perché il logaritmo è così importante? (concentrazione di ioni di idrogeno in una soluzione, il ph) Un sistema solido o liquido, costituito da due o più componenti, (sale disciolto nell'acqua),
Laboratorio di Fisica 3 Ottica 2. Studenti: Buoni - Giambastiani - Leidi Gruppo: G09
 Laboratorio di Fisica 3 Ottica 2 Studenti: Buoni - Giambastiani - Leidi Gruppo: G09 24 febbraio 2015 1 Lunghezza d onda di un laser He-Ne 1.1 Scopo dell esperienza Lo scopo dell esperienza è quello di
Laboratorio di Fisica 3 Ottica 2 Studenti: Buoni - Giambastiani - Leidi Gruppo: G09 24 febbraio 2015 1 Lunghezza d onda di un laser He-Ne 1.1 Scopo dell esperienza Lo scopo dell esperienza è quello di
Rapporto Struttura/Funzione delle Proteine
 Macromolecole Biologiche Chimica Biologica A.A. 2010-2011 Rapporto Struttura/Funzione delle Proteine Struttura/Funzione delle Proteine Interazioni proteina-ligando come base della funzione di molte proteine
Macromolecole Biologiche Chimica Biologica A.A. 2010-2011 Rapporto Struttura/Funzione delle Proteine Struttura/Funzione delle Proteine Interazioni proteina-ligando come base della funzione di molte proteine
LEZIONE 1. Materia: Proprietà e Misura
 LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
IL NUCLEO ATOMICO E LA MOLE
 IL NUCLEO ATOMICO E LA MOLE Gli atomi sono costituiti da un nucleo, formato da protoni (carica elettrica positiva, massa 1,6724 x 10-24 g) e neutroni (nessuna carica elettrica, massa 1,6745 x 10-24 g),
IL NUCLEO ATOMICO E LA MOLE Gli atomi sono costituiti da un nucleo, formato da protoni (carica elettrica positiva, massa 1,6724 x 10-24 g) e neutroni (nessuna carica elettrica, massa 1,6745 x 10-24 g),
Spettrometria di massa
 Tecniche di monitoraggio ambientale di tipo fisico Spettrometria di massa (J. B. Fenn, K. Tanaka, K. Wüthrich, premio nobel per la chimica nel 2002) Analisi chimica dell aerosol Riconoscimento di inquinanti
Tecniche di monitoraggio ambientale di tipo fisico Spettrometria di massa (J. B. Fenn, K. Tanaka, K. Wüthrich, premio nobel per la chimica nel 2002) Analisi chimica dell aerosol Riconoscimento di inquinanti
1. Distribuzioni campionarie
 Università degli Studi di Basilicata Facoltà di Economia Corso di Laurea in Economia Aziendale - a.a. 2012/2013 lezioni di statistica del 3 e 6 giugno 2013 - di Massimo Cristallo - 1. Distribuzioni campionarie
Università degli Studi di Basilicata Facoltà di Economia Corso di Laurea in Economia Aziendale - a.a. 2012/2013 lezioni di statistica del 3 e 6 giugno 2013 - di Massimo Cristallo - 1. Distribuzioni campionarie
Campione sciolto in un solvente (deuterato) e. posto in un tubo. di vetro a pareti sottili di diametro di 5 mm e lungo circa 20 cm
 posto in un tubo Campione sciolto in un solvente (deuterato) e di vetro a pareti sottili di diametro di 5 mm e lungo circa 20 cm o spettrometro NMR è formato da alcuni mponenti fondamentali: un magnete,
posto in un tubo Campione sciolto in un solvente (deuterato) e di vetro a pareti sottili di diametro di 5 mm e lungo circa 20 cm o spettrometro NMR è formato da alcuni mponenti fondamentali: un magnete,
Il Sistema Respiratorio. Fisica Medica
 Il Sistema Respiratorio La respirazione Trachea Bronchi Muscoli del diaframma I muscoli che controllano la respirazione fanno variare volume e pressione interna ai polmoni Fase Inspirazione Espirazione
Il Sistema Respiratorio La respirazione Trachea Bronchi Muscoli del diaframma I muscoli che controllano la respirazione fanno variare volume e pressione interna ai polmoni Fase Inspirazione Espirazione
Sia data la rete di fig. 1 costituita da tre resistori,,, e da due generatori indipendenti ideali di corrente ed. Fig. 1
 Analisi delle reti 1. Analisi nodale (metodo dei potenziali dei nodi) 1.1 Analisi nodale in assenza di generatori di tensione L'analisi nodale, detta altresì metodo dei potenziali ai nodi, è un procedimento
Analisi delle reti 1. Analisi nodale (metodo dei potenziali dei nodi) 1.1 Analisi nodale in assenza di generatori di tensione L'analisi nodale, detta altresì metodo dei potenziali ai nodi, è un procedimento
MISURE DI VOLUME. Per versare. Per contenere
 MISURE DI VOLUME Unità di volume: LITRO (L) (IUPAC: dm 3 ) ml : 10-3 L = cm 3 = cc ml : 10-6 L Il volume dipende dalla TEMPERATURA. I contenitori in vetro hanno coefficienti di espansione molto piccoli;
MISURE DI VOLUME Unità di volume: LITRO (L) (IUPAC: dm 3 ) ml : 10-3 L = cm 3 = cc ml : 10-6 L Il volume dipende dalla TEMPERATURA. I contenitori in vetro hanno coefficienti di espansione molto piccoli;
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Prova in itinere di Chimica Generale 1 Giugno 2011
 Prova in itinere di Chimica Generale 1 Giugno 2011 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Prova in itinere di Chimica Generale 1 Giugno 2011 A COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
Ottica fisiologica (2): sistemi ottici
 Ottica fisiologica (2): sistemi ottici Corso di Principi e Modelli della Percezione Prof. Giuseppe Boccignone Dipartimento di Informatica Università di Milano boccignone@di.unimi.it http://boccignone.di.unimi.it/pmp_2014.html
Ottica fisiologica (2): sistemi ottici Corso di Principi e Modelli della Percezione Prof. Giuseppe Boccignone Dipartimento di Informatica Università di Milano boccignone@di.unimi.it http://boccignone.di.unimi.it/pmp_2014.html
Istituto L. Einaudi Montebelluna Elaborato di Fisica dicembre 2010. Grafico della retta e rappresentazione di fenomeni
 Grafico della retta e rappresentazione di fenomeni Soluzioni degli esercizi di dicembre 00 Nota. In ogni esercizio: rappresentare graficamente i fenomeni individuati; eseguire tutti i passaggi matematici
Grafico della retta e rappresentazione di fenomeni Soluzioni degli esercizi di dicembre 00 Nota. In ogni esercizio: rappresentare graficamente i fenomeni individuati; eseguire tutti i passaggi matematici
È importante quindi conoscere le proprietà chimiche dell acqua. Le reazioni acido base sono particolari esempi di equilibrio chimico in fase acquosa
 Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Utilizzo delle formule in Excel
 Utilizzo delle formule in Excel Excel è dotato di un potente motore di calcolo che può essere utilizzato per elaborare i dati immessi dagli utenti. I calcoli sono definiti mediante formule. Ogni formula
Utilizzo delle formule in Excel Excel è dotato di un potente motore di calcolo che può essere utilizzato per elaborare i dati immessi dagli utenti. I calcoli sono definiti mediante formule. Ogni formula
DIPARTIMENTO DI SCIENZE INTEGRATE CHIMICA FISICA SCIENZE DELLA TERRA - BIOLOGIA
 IISS A. De Pace Lecce A.S. 2012-2013 DIPARTIMENTO DI SCIENZE INTEGRATE FISICA SCIENZE DELLA TERRA - BIOLOGIA PIANI DI STUDIO DELLE DISCIPLINE SECONDO ANNO Piano di studi della disciplina DESCRIZIONE Lo
IISS A. De Pace Lecce A.S. 2012-2013 DIPARTIMENTO DI SCIENZE INTEGRATE FISICA SCIENZE DELLA TERRA - BIOLOGIA PIANI DI STUDIO DELLE DISCIPLINE SECONDO ANNO Piano di studi della disciplina DESCRIZIONE Lo
Sommario Ottica geometrica... 2 Principio di Huygens-Fresnel... 4 Oggetto e immagine... 6 Immagine reale... 7 Immagine virtuale...
 IMMAGINI Sommario Ottica geometrica... 2 Principio di Huygens-Fresnel... 4 Oggetto e immagine... 6 Immagine reale... 7 Immagine virtuale... 9 Immagini - 1/11 Ottica geometrica È la branca dell ottica che
IMMAGINI Sommario Ottica geometrica... 2 Principio di Huygens-Fresnel... 4 Oggetto e immagine... 6 Immagine reale... 7 Immagine virtuale... 9 Immagini - 1/11 Ottica geometrica È la branca dell ottica che
1. la probabilità che siano tutte state uccise con pistole; 2. la probabilità che nessuna sia stata uccisa con pistole;
 Esercizi di Statistica della 5 a settimana (Corso di Laurea in Biotecnologie, Università degli Studi di Padova). Esercizio 1. L FBI ha dichiarato in un rapporto che il 44% delle vittime di un omicidio
Esercizi di Statistica della 5 a settimana (Corso di Laurea in Biotecnologie, Università degli Studi di Padova). Esercizio 1. L FBI ha dichiarato in un rapporto che il 44% delle vittime di un omicidio
SISTEMI ENERGETICI. L ATP privato di uno dei suoi 3 radicali fosforici diventa ADP (adenosindifosfato).
 SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
CHIMICApisce? Una lezione di Chimica con. 7 Gennaio 2016 San Valentino in A.C. Classe IIC
 CHIMICApisce? Una lezione di Chimica con Marco Catalano 7 Gennaio 2016 San Valentino in A.C. Classe IIC CHIMICApisce in una parola Se dovessimo descrivere la lezione di Marco con una sola parola, la più
CHIMICApisce? Una lezione di Chimica con Marco Catalano 7 Gennaio 2016 San Valentino in A.C. Classe IIC CHIMICApisce in una parola Se dovessimo descrivere la lezione di Marco con una sola parola, la più
