Elettroforesi proteine ed acidi nucleici
|
|
|
- Lorenza Agostini
- 9 anni fa
- Visualizzazioni
Transcript
1 Elettroforesi proteine ed acidi nucleici Flavia Frabetti Tecnici di laboratorio 2010/2011 ELETTORFORESI metodo fisico di separazione che sfrutta la mobilità elettroforetica di molecole cariche, sottoposte ad un campo elettrico si realizza attraverso l utilizzo di un sistema elettroforetico matrice di gel cella elettroforetica alimentatore (in cui applicare voltaggio o intensità di corrente costante) tamponi salini si possono studiare sia gli acidi nucleici (DNA e RNA) sia le proteine 1
2 Matrice di gel serve da setaccio molecolare e consente la separazione Come si forma il gel? può essere fatto di polimeri agarosio o poliacrilamide Gel di agarosio: pesare l agarosio misurare il buffer (TBE/TAE) bollire l agarosio in buffer versare il gel nella vaschetta allestita Gel di acrilamide: miscelando acrilamide e bis-acrilamide che formano un polimero complesso a maglia* Gel di acrilamide utili soprattutto per la separazione e caratterizzazione di proteine di solito in sistemi verticali, poiché se ne fanno lastre di 0,2-0,4 mm i cui pozzetti non sarebbero caricabili in un sistema orizzontale la velocità di migrazione elettroforetica attraverso i gel dipende principalmente da 4 parametri taglia molecolare del peptide concentrazione di acrilamide conformazione della molecola (denaturata o meno) voltaggio 2
3 Spesso si procede in condizioni denaturanti - SDS PAGE PAGE = Poli-Acrilamide Gel Elettroforesi delle proteine è di norma realizzata facendo polimerizzare la poliacrilamide tra due vetri piatti e la corsa viene eseguita in un sistema verticale SDS = detergente (sodio-dodecil-solfato) carico - well= pozzetto lane= corsia catodo anodo supporto di plastica campione pozzetti con i campioni tampone tampone DENATURAZIONE DELLE PROTEINE: preparazione del campione (sample) con proteine denaturate bollitura proteina tetramerica proteina monomerica bollitura peptidi connessi da ponti disolfuro peptidi separati SDS = Sodio Dodecil-Solfato (detergente anionico) BME = β- mercaptoetanolo (riducente) 3
4 Scelta della % di acrilamide in rapporto alla taglia molecolare delle proteine Acrilamide(%) Intervallo di separazione dei peptidi (in kilodalton) I fase: separazione per carica ph basico II fase: separazione dimensionale ph acido ELETTROFORESI BIDIMENSIONALE SU GEL o ISOELECTROFOCUSING punto isoelettrico (pi): il ph al quale la carica netta di una proteina è nulla per un bilancio tra + e -, qui La proteina non sarà più soggetta a migrazione elettroforetica Dal Chieffi riquadro 2.2 pag:
5 Rivelazione della separazione elettroforetica: tramite colorazione aspecifica di tutte le proteine della miscela (es. con comassie blue o silver-stain) trasferimento, anche qui elettroforetico, su opportune matrici di nitrocellulosa attraverso la tecnica del Western Blotting per analisi più fini, specifiche 1- riconoscimento mediante autoradiografia di proteine marcate con radioisotopi 2- riconoscimento immuno-enzimatico utilizzando anticorpi specifici 1- riconoscimento mediante autoradiografia di proteine marcate con radioisotopi consente di evidenziare proteine neo-sintetizzate ed analizzare il turn-over proteico (esperimenti di pulse-chaise) l isotopo radioattivo più usato è lo zolfo 35 S (emivita di 87gg) metionina cisteina 5
6 2- riconoscimento immuno-enzimatico utilizzando anticorpi specifici consente di riconoscere una specifica proteina di interesse consta di diverse fasi schematizzabili in: a) elettro-trasferimento dal gel ad una membrana di nitrocellulosa b) rivelazione con l anticorpo (colorazione immuno-enzimatica) a) elettro-trasferimento dal gel ad una membrana di nitrocellulosa trasferimento delle proteine carta imbevuta di tampone carta imbevuta di tampone proteina di interesse 6
7 b) rivelazione con l anticorpo (colorazione immuno-enzimatica) - fasi procedurali la membrana viene saturata da proteine inerti anticorpi I legano l antigene anticorpi II legano gli anticorpi I sviluppo della colorazione enzimatica Verifica qualitativa e quantitativa acidi nucleici Spettrofotometro Analisi a λ= 260 nm Si misura la ssorbanza o densità ottica O.D. 1 O.D. 50 µg DNA 1 O.D. 40 µg RNA 1 O.D. 30 µg oligonucleotidi λ= 280 nm proteine 260/280 > 1,8 ( 2) è abbastanza puro Nanodrop 7
8 Gel di agarosio utili per la separazione e caratterizzazione di acidi nucleici di solito in sistemi orizzontali la velocità di migrazione elettroforetica attraverso i gel di agarosio dipende principalmente da 4 parametri taglia molecolare del DNA o RNA concentrazione di agarosio conformazione della molecola voltaggio Allestimento della tecnica elettroforetica su gel orizzontali di agarosio (schema) preparazione gel Campione (sample)viene diluito in un tampone di caricamento (loading buffer) che contiene 2 coloranti per tracciare la corsa: Blu di bromofenolo (Bb) 300 bp Xilene cianolo (Xc) bp ed anche glicerolo per appesantire il campione caricamento campioni (Ø 5mm/well) rilevazione connessione ed accensione 8
9 Corsa e rilevazione su gel orizzontali di agarosio - procedure Riempire la vaschetta con il buffer Caricare i campioni sul gel Accendere l alimentatore (parte la corsa del gel) Analisi del gel al transilluminatore Fine della corsa Risultato std molecolari o markers a dimensione nota Le molecole più grandi hanno V minore, per > attrito e perché vengono intrappolate di più nelle maglie del gel Bande luminose per via del bromuro di etidio (intercalante del DNA) che fluoresce ai raggi UV e si vede banda giallo-arancio Limite di sensibilità 1-5 ng di DNA 9
10 Taglia molecolare del DNA o RNA e migrazione Agarosio (%) Intervallo di separazione di DNA lineare (in Kb) Di norma si applica un voltaggio di 5 Volt /cm di lunghezza della vaschetta Il voltaggio (V) tende a variare durante la corsa in rapporto alla variazione nella distribuzione delle cariche e del ph Durante la corsa la resistenza (R) aumenta V= i x R per avere una migrazione costante deve aumentare anche V Uniformità di calore e ph: le corsie periferiche sono più fredde (effetto smile) di norma evitato con tubicini che collegano parte negativa e positiva 10
11 I gel di poliacrilamide per separare acidi nucleici sono usati se: si devono separare piccoli oligonucleotidi < 100 basi, si possono risolvere anche oligo diversi anche per 1 nucleotide sono di solito a basse concentrazioni di acrilamide (<=6%) e contengono Urea (6M) Stima della dimensione di una molecola in rapporto alla mobilità elettroforetica di std di dimensione nota (questo vale anche per le proteine) Il DNA è una molecola che ha un rapporto carica/massa costante e dunque uniformità nella separazione 11
12 Gel controllo DNA markers a dimensione nota pozzetti frammenti di DNA genomico (50-100Kb) La quantità di DNA attesa è di 7 pg per cellula umana diploide Es. globuli bianchi 6.000/µl ovvero /ml x 7 pg= pg = ng= 42 µg GEL DNA APOPTOSI ladder (scala) apoptotico 12
13 Gel controllo RNA 28S (5000 basi) 18S (2000 basi) 5S+tRNA(100 basi) L 80-85% di RNA cellulare e costituito da rrna, circa il 10% da trna E tra 1-5 % da decine di migliaia di mrna diversi Gel degradazione RNA, contaminazione DNA effetto SMEAR striscia 13
cromatografia Elettroforesi
 Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
5- Estrazione ed analisi di DNA
 5- Estrazione ed analisi di DNA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU) 16 ore) Marco Scocchi ( BIO/10-11) La struttura del DNA La traduzione dell informazione
5- Estrazione ed analisi di DNA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU) 16 ore) Marco Scocchi ( BIO/10-11) La struttura del DNA La traduzione dell informazione
ELETTROFORESI DI PROTEINE
 ELETTROFORESI DI PROTEINE ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni
ELETTROFORESI DI PROTEINE ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni
Elettroforesi di Tamara Benincasa
 Elettroforesi di Tamara Benincasa L elettroforesi è una metodologia utilizzata in laboratorio attraverso la quale molecole biologiche (ammino acidi, peptidi, proteine, nucleotidi ed acidi nucleici), dotate
Elettroforesi di Tamara Benincasa L elettroforesi è una metodologia utilizzata in laboratorio attraverso la quale molecole biologiche (ammino acidi, peptidi, proteine, nucleotidi ed acidi nucleici), dotate
TECNICHE ELETTROFORETICHE
 TECNICHE ELETTROFORETICHE L elettroforesi e un metodo di separazione che si basa sulla diversa mobilita degli ioni (o di sostanze elettricamente cariche), quando posti all interno di un campo elettrico
TECNICHE ELETTROFORETICHE L elettroforesi e un metodo di separazione che si basa sulla diversa mobilita degli ioni (o di sostanze elettricamente cariche), quando posti all interno di un campo elettrico
Genomica e Proteomica
 Genomica e Proteomica Genomica: sequenziamento del DNA presente in un organismo e analisi dei geni (bioinformatica) Proteomica: analisi delle proteine di un organismo: Quali proteine in un dato momento
Genomica e Proteomica Genomica: sequenziamento del DNA presente in un organismo e analisi dei geni (bioinformatica) Proteomica: analisi delle proteine di un organismo: Quali proteine in un dato momento
ELETTROFORESI. Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico.
 ELETTROFORESI ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. Anioni ANODO (+) Cationi CATODO (-) v = velocità di migrazione μ =
ELETTROFORESI ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. Anioni ANODO (+) Cationi CATODO (-) v = velocità di migrazione μ =
Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa
 WESTERN BLOTTING Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa Tecnica di trasferimento delle proteine da un gel ad una membrana associata ad utilizzo di anticorpi
WESTERN BLOTTING Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa Tecnica di trasferimento delle proteine da un gel ad una membrana associata ad utilizzo di anticorpi
Quantizzazione del DNA con spettrofotometro
 Quantizzazione del DNA ed elettroforesi 1 Quantizzazione del DNA con spettrofotometro Al termine della metodica di estrazione, occorre quantificare il DNA isolato. Un metodo per quantificare in modo preciso
Quantizzazione del DNA ed elettroforesi 1 Quantizzazione del DNA con spettrofotometro Al termine della metodica di estrazione, occorre quantificare il DNA isolato. Un metodo per quantificare in modo preciso
Metodi di studio delle proteine :
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D determinazione del peso molecolare Spettrofotometro
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D determinazione del peso molecolare Spettrofotometro
3. ELETTROFORESI DI PROTEINE
 3. ELETTROFORESI DI PROTEINE Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) ELETTROFORESI PRINCIPI GENERALI Migrazione di particelle
3. ELETTROFORESI DI PROTEINE Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) ELETTROFORESI PRINCIPI GENERALI Migrazione di particelle
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI
 METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
WESTERN BLOT o IMMUNOFISSAZIONE
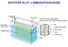 WESTERN BLOT o IMMUNOFISSAZIONE BLOTTING Trasferimento di macromolecole su una membrana immobilizzante. Southern DNA - da Edward Southern 1970 Northern Western RNA Proteine SCOPO DEL WESTERN BLOTTING Consente
WESTERN BLOT o IMMUNOFISSAZIONE BLOTTING Trasferimento di macromolecole su una membrana immobilizzante. Southern DNA - da Edward Southern 1970 Northern Western RNA Proteine SCOPO DEL WESTERN BLOTTING Consente
ELETTROFORESI SU GEL
 ELETTROFORESI SU GEL Permette la separazione di frammenti di DNA/RNA da una miscela complessa E una tecnica fondamentale per: l analisi (elettroforesi analitica) la purificazione degli acidi nucleici (elettroforesi
ELETTROFORESI SU GEL Permette la separazione di frammenti di DNA/RNA da una miscela complessa E una tecnica fondamentale per: l analisi (elettroforesi analitica) la purificazione degli acidi nucleici (elettroforesi
CORSO DI LAUREA IN BIOLOGIA GENERALE ED APPLICATA ESERCITAZIONE DEL CORSO DI ANALISI DI MACROMOLECOLE
 CORSO DI LAUREA IN BIOLOGIA GENERALE ED APPLICATA ESERCITAZIONE DEL CORSO DI ANALISI DI MACROMOLECOLE Anno accademico 2016-2017 L esperimento consiste nella analisi di due estratti proteici frazionati
CORSO DI LAUREA IN BIOLOGIA GENERALE ED APPLICATA ESERCITAZIONE DEL CORSO DI ANALISI DI MACROMOLECOLE Anno accademico 2016-2017 L esperimento consiste nella analisi di due estratti proteici frazionati
ELETTROFORESI DI PROTEINE
 ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni di PROTEINE è più piccola
ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni di PROTEINE è più piccola
2. Tecniche immunochimiche: Western blotting; ELISA; sandwich ELISA 3. Tecniche spettroscopiche: spettrofotometria UV/vis; spettrofluorimetria
 1. Tecniche elettroforetiche: SDS-PAGE 2. Tecniche immunochimiche: Western blotting; ELISA; sandwich ELISA 3. Tecniche spettroscopiche: spettrofotometria UV/vis; spettrofluorimetria Testo consigliato Keith
1. Tecniche elettroforetiche: SDS-PAGE 2. Tecniche immunochimiche: Western blotting; ELISA; sandwich ELISA 3. Tecniche spettroscopiche: spettrofotometria UV/vis; spettrofluorimetria Testo consigliato Keith
ELETTROFORESI. Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico.
 ELETTROFORESI ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. Anioni ANODO (+) Cationi CATODO (-) v = velocità di migrazione μ =
ELETTROFORESI ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. Anioni ANODO (+) Cationi CATODO (-) v = velocità di migrazione μ =
Southern blot. !Per. determinare la presenza o assenza di specifici frammenti genici. !Studio. della struttura e dell organizzazione di un gene
 Southern blot!per determinare la presenza o assenza di di specifici frammenti genici!studio della struttura e dell organizzazione di di un gene Southern blot Procedura Isolare DNA genomico Digerirlo con
Southern blot!per determinare la presenza o assenza di di specifici frammenti genici!studio della struttura e dell organizzazione di di un gene Southern blot Procedura Isolare DNA genomico Digerirlo con
Polymerase chain reaction - PCR. Biotecnologie applicate all ispezione degli alimenti di origine animale
 Prof.ssa Tiziana Pepe Polymerase chain reaction - PCR Biotecnologie applicate all ispezione degli alimenti di origine animale Dip. di Medicina Veterinaria e Produzioni animali [email protected] Metodologia
Prof.ssa Tiziana Pepe Polymerase chain reaction - PCR Biotecnologie applicate all ispezione degli alimenti di origine animale Dip. di Medicina Veterinaria e Produzioni animali [email protected] Metodologia
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento
 TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
Amplificazione mediante PCR (Polymerase Chain Reaction) del DNA estratto dalla saliva.
 OBIETTIVO DEL LAVORO SPERIMENTALE: TIPIZZAZIONE DEI CROMOSOMI SESSUALI X e Y Amplificazione mediante PCR (Polymerase Chain Reaction) del DNA estratto dalla saliva. Cromosoma X Cromosoma y La tipizzazione
OBIETTIVO DEL LAVORO SPERIMENTALE: TIPIZZAZIONE DEI CROMOSOMI SESSUALI X e Y Amplificazione mediante PCR (Polymerase Chain Reaction) del DNA estratto dalla saliva. Cromosoma X Cromosoma y La tipizzazione
L elettroforesi è una tecnica che consiste nella migrazione differenziata in un campo elettrico, di molecole elettricamente cariche.
 L elettroforesi è una tecnica che consiste nella migrazione differenziata in un campo elettrico, di molecole elettricamente cariche. L elettroforesi è una tecnica che viene usata per separare molecole
L elettroforesi è una tecnica che consiste nella migrazione differenziata in un campo elettrico, di molecole elettricamente cariche. L elettroforesi è una tecnica che viene usata per separare molecole
Elettroforesi su gel. L elettroforesi è definita come la migrazione di particelle sotto l influenza di un campo elettrico.
 Elettroforesi su gel L elettroforesi è definita come la migrazione di particelle sotto l influenza di un campo elettrico. La mobilità della particella dipende dalla forza elettrostatica netta che agisce
Elettroforesi su gel L elettroforesi è definita come la migrazione di particelle sotto l influenza di un campo elettrico. La mobilità della particella dipende dalla forza elettrostatica netta che agisce
SCOPO DEL WESTERN BLOTTING
 WESTERN BLOTTING SCOPO DEL WESTERN BLOTTING SCOPO DEL WESTERN BLOTTING SCOPO DEL WESTERN BLOTTING Tecnica che consente di visualizzare/individuare UNA proteina tra milioni, grazie all utilizzo di anticorpi
WESTERN BLOTTING SCOPO DEL WESTERN BLOTTING SCOPO DEL WESTERN BLOTTING SCOPO DEL WESTERN BLOTTING Tecnica che consente di visualizzare/individuare UNA proteina tra milioni, grazie all utilizzo di anticorpi
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Tecnologia del DNA e la genomica
 Tecnologia del DNA e la genomica DNA ricombinante La tecnologia del DNA ricombinante permette di unire in laboratorio il DNA di organismi diversi Permette di manipolare il DNA di un organismo allo scopo
Tecnologia del DNA e la genomica DNA ricombinante La tecnologia del DNA ricombinante permette di unire in laboratorio il DNA di organismi diversi Permette di manipolare il DNA di un organismo allo scopo
METODICHE DI IMMUNOCHIMICA
 METODICHE DI IMMUNOCHIMICA IMMUNOCHIMICA permette la determinazione quantitativa di proteine in tessuti e omogenati INTERAZIONI ANTIGENE-ANTICORPO L immunochimica si basa sulle interazioni antigene-anticorpo
METODICHE DI IMMUNOCHIMICA IMMUNOCHIMICA permette la determinazione quantitativa di proteine in tessuti e omogenati INTERAZIONI ANTIGENE-ANTICORPO L immunochimica si basa sulle interazioni antigene-anticorpo
Identificazione dei microrganismi mediante tecniche di biologia molecolare Esercitazione n 3. Criteri di identificazione
 Identificazione dei microrganismi mediante tecniche di biologia molecolare Esercitazione n 3 Criteri di identificazione Tradizionale (fenotipo) Tecniche di biologia molecolare Il livello di risoluzione
Identificazione dei microrganismi mediante tecniche di biologia molecolare Esercitazione n 3 Criteri di identificazione Tradizionale (fenotipo) Tecniche di biologia molecolare Il livello di risoluzione
Buone regole. -nel dubbio, chiedere! LEGGERE BENE IL PROTOCOLLO PRIMA DI INIZIARE
 Precauzioni da adottare in laboratorio: -non mangiare nè bere -indossare il camice -indossare sempre i guanti quando si maneggiano i tubini, i gel, le micropipette -nel dubbio, chiedere! Buone regole LEGGERE
Precauzioni da adottare in laboratorio: -non mangiare nè bere -indossare il camice -indossare sempre i guanti quando si maneggiano i tubini, i gel, le micropipette -nel dubbio, chiedere! Buone regole LEGGERE
Analisi di proteine:
 Analisi di proteine: Elettroforesi e Western Blot Seminario Metodologico per il Corso di Didattica Libera Marilena Dinardo [email protected] Le proteine sono il prodotto dei geni: sono le
Analisi di proteine: Elettroforesi e Western Blot Seminario Metodologico per il Corso di Didattica Libera Marilena Dinardo [email protected] Le proteine sono il prodotto dei geni: sono le
Cosa determina l assorbanza di un cromoforo?
 Cosa determina l assorbanza di un cromoforo? I cromofori sono di solito caratterizzati da doppi legami e sistemi di risonanza Lo spettro di assorbimento di un cromoforo è solo parzialmente determinato
Cosa determina l assorbanza di un cromoforo? I cromofori sono di solito caratterizzati da doppi legami e sistemi di risonanza Lo spettro di assorbimento di un cromoforo è solo parzialmente determinato
determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Spettrofotometro cuvetta monocromatore rivelatore
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Spettrofotometro cuvetta monocromatore rivelatore
Metodologie citogenetiche. Metodologie molecolari. Formulare la domanda Utilizzare la metodica appropriata
 In base al potere di risoluzione della tecnica Metodologie citogenetiche Metodologie molecolari Formulare la domanda Utilizzare la metodica appropriata 1 DNA RNA PROTEINE DNA Cromosomi (cariotipo, FISH,
In base al potere di risoluzione della tecnica Metodologie citogenetiche Metodologie molecolari Formulare la domanda Utilizzare la metodica appropriata 1 DNA RNA PROTEINE DNA Cromosomi (cariotipo, FISH,
VALUTAZIONE DELLA INTERAZIONE TRA ANTIGENE E ANTICORPO MEDIANTE TECNICA IMMUNOCHIMICA WESTERN BLOTTING
 VALUTAZIONE DELLA INTERAZIONE TRA ANTIGENE E ANTICORPO MEDIANTE TECNICA IMMUNOCHIMICA WESTERN BLOTTING Laboratorio di Biochimica Cellulare (Responsabile attività: Prof. Angela Ostuni; Tutor: Dr.ssa Agata
VALUTAZIONE DELLA INTERAZIONE TRA ANTIGENE E ANTICORPO MEDIANTE TECNICA IMMUNOCHIMICA WESTERN BLOTTING Laboratorio di Biochimica Cellulare (Responsabile attività: Prof. Angela Ostuni; Tutor: Dr.ssa Agata
Apparato elettroforesi
 Elettroforesi Tecniche che permettono di separare diverse macromolecole cariche tramite l applicazione di un campo elettrico. Apparato elettroforesi Fonte: Internet Utilizzata in biochimica e biologia
Elettroforesi Tecniche che permettono di separare diverse macromolecole cariche tramite l applicazione di un campo elettrico. Apparato elettroforesi Fonte: Internet Utilizzata in biochimica e biologia
Laurea Magistrale in Biologia
 Laurea Magistrale in Biologia Laboratorio del corso di Chimica Fisica Biologica Anno accademico 2009/10 SCOPO Determinazione dei parametri termodinamici associati alla denaturazione termica di una piccola
Laurea Magistrale in Biologia Laboratorio del corso di Chimica Fisica Biologica Anno accademico 2009/10 SCOPO Determinazione dei parametri termodinamici associati alla denaturazione termica di una piccola
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2006/2007. Corso di: Laboratorio di Biologia II Chimica Biologica
 CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2006/2007 Corso di: Laboratorio di Biologia II Chimica Biologica Dott. Marcello MEROLA Parziale purificazione dell enzima Alcool Deidrogenasi
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2006/2007 Corso di: Laboratorio di Biologia II Chimica Biologica Dott. Marcello MEROLA Parziale purificazione dell enzima Alcool Deidrogenasi
TECNICHE IMMUNOCHIMICHE
 TECNICHE IMMUNOCHIMICHE Tutte le tecniche immunochimiche si basano sull impiego di anticorpi Struttura tipica di un immunoglobulina (Ig) Le immunoglobuline si dividono in diverse classi, ciascuna dotata
TECNICHE IMMUNOCHIMICHE Tutte le tecniche immunochimiche si basano sull impiego di anticorpi Struttura tipica di un immunoglobulina (Ig) Le immunoglobuline si dividono in diverse classi, ciascuna dotata
Corso STEM Il papilloma virus (Prof.ssa Gabriella Di Cola)
 Corso STEM Il papilloma virus (Prof.ssa Gabriella Di Cola) Il papilloma virus (HPV) interessa maggiormente le donne intorno ai 25 anni di età; esso intacca la zona genitale, in particolare le cellule dell
Corso STEM Il papilloma virus (Prof.ssa Gabriella Di Cola) Il papilloma virus (HPV) interessa maggiormente le donne intorno ai 25 anni di età; esso intacca la zona genitale, in particolare le cellule dell
Elettroforesi degli acidi nucleici
 Elettroforesi degli acidi nucleici Una volta che i frammenti del DNA o del RNA da analizzare sono stati amplificati con la reazione PCR è necessario separarli ed identificarli. A tale scopo si utilizza
Elettroforesi degli acidi nucleici Una volta che i frammenti del DNA o del RNA da analizzare sono stati amplificati con la reazione PCR è necessario separarli ed identificarli. A tale scopo si utilizza
Lo studio delle varie conformazioni del DNA
 Lo studio delle varie conformazioni del DNA Separazione dei topoisomeri Molecole di DNA ccc di una uguale lunghezza e composizione in basi, ma diverso Lk, sono dette topoisomeri. I topoisomeri possono
Lo studio delle varie conformazioni del DNA Separazione dei topoisomeri Molecole di DNA ccc di una uguale lunghezza e composizione in basi, ma diverso Lk, sono dette topoisomeri. I topoisomeri possono
SDS-PAGE/Western blot
 SDS-PAGE/Western blot preparare 2 gels: 7.5% di acrilamide, SPACERS 1.5 mm. Uno verrà utilizzato per il trasferimento su nitrocellulosa, l altro colorato con il blu di coomassie. caricare i campioni dell
SDS-PAGE/Western blot preparare 2 gels: 7.5% di acrilamide, SPACERS 1.5 mm. Uno verrà utilizzato per il trasferimento su nitrocellulosa, l altro colorato con il blu di coomassie. caricare i campioni dell
Estrazione rapida di DNA plasmidico da Escherichia coli. (QIAscreen) ESERCITAZIONE DI LAB. N.1. Corso di INGEGNERIA GENETICA, Prof.
 Estrazione rapida di DNA plasmidico da Escherichia coli (QIAscreen) Corso di INGEGNERIA GENETICA, Prof. Renato Fani, ESERCITAZIONE DI LAB. N.1 PLASMIDI IN NUMEROSE SPECIE BATTERICHE SONO PRESENTI I PLASMIDI,
Estrazione rapida di DNA plasmidico da Escherichia coli (QIAscreen) Corso di INGEGNERIA GENETICA, Prof. Renato Fani, ESERCITAZIONE DI LAB. N.1 PLASMIDI IN NUMEROSE SPECIE BATTERICHE SONO PRESENTI I PLASMIDI,
Laboratorio di Genetica Molecolare: Prof. Davide Bizzaro, Prof. Anna La Teana
 Laboratorio di Genetica Molecolare: Prof. Davide Bizzaro, Prof. Anna La Teana Determinazione del polimorfismo del gene TAS2R38 coinvolto nella percezione dell amaro. I mammiferi riconoscono soltanto 5
Laboratorio di Genetica Molecolare: Prof. Davide Bizzaro, Prof. Anna La Teana Determinazione del polimorfismo del gene TAS2R38 coinvolto nella percezione dell amaro. I mammiferi riconoscono soltanto 5
Proteine: struttura e funzione
 Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Modulo 3. Lavorare con le proteine
 Modulo 3 Lavorare con le proteine La purificazione delle proteine Il primo passaggio nello studio delle proprietà di una proteina è la sua purificazione: la sua estrazione dalla matrice biologica in cui
Modulo 3 Lavorare con le proteine La purificazione delle proteine Il primo passaggio nello studio delle proprietà di una proteina è la sua purificazione: la sua estrazione dalla matrice biologica in cui
PCR allele-specifica Ibridazione con sonde allele-specifiche (ASO) PCR Real-time con sonde TaqMan Saggio OLA (Oligo Ligation Assay)
 Tecniche per l analisi di singole variazioni: PCR allele-specifica Ibridazione con sonde allele-specifiche (ASO) PCR Real-time con sonde TaqMan Saggio OLA (Oligo Ligation Assay) alcuni SNP (ca. 10%) sono
Tecniche per l analisi di singole variazioni: PCR allele-specifica Ibridazione con sonde allele-specifiche (ASO) PCR Real-time con sonde TaqMan Saggio OLA (Oligo Ligation Assay) alcuni SNP (ca. 10%) sono
Elettroforesi. Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita.
 Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
Perche usare Gel di Poliacrilammide per separare le proteine?
 Perche usare Gel di Poliacrilammide per separare le proteine? I gel di poliacrilammide hanno una trama piu compatta I pori hanno dimensioni minori che nei gel di agarosio Le proteine sono molto piu piccole
Perche usare Gel di Poliacrilammide per separare le proteine? I gel di poliacrilammide hanno una trama piu compatta I pori hanno dimensioni minori che nei gel di agarosio Le proteine sono molto piu piccole
IL SEQUENZIAMENTO DEL DNA. Obiettivo: ottenere la sequenza nucleotidica di un frammento di DNA.
 IL SEQUENZIAMENTO DEL DNA Obiettivo: ottenere la sequenza nucleotidica di un frammento di DNA. Il DNA può essere sequenziato generando frammenti di DNA la cui lunghezza dipende dall ultima base della sequenza.
IL SEQUENZIAMENTO DEL DNA Obiettivo: ottenere la sequenza nucleotidica di un frammento di DNA. Il DNA può essere sequenziato generando frammenti di DNA la cui lunghezza dipende dall ultima base della sequenza.
SPETTROFOTOMETRIA UV/VIS
 SPETTROFOTOMETRIA UV/VIS TECNICHE SPETTROSCOPICHE Le tecniche spettroscopiche sono tutte quelle tecniche basate sull interazione tra la materia e le radiazioni elettromagnetiche. La luce, il calore ed
SPETTROFOTOMETRIA UV/VIS TECNICHE SPETTROSCOPICHE Le tecniche spettroscopiche sono tutte quelle tecniche basate sull interazione tra la materia e le radiazioni elettromagnetiche. La luce, il calore ed
Laboratorio di Microbiologia Referente: Prof. Carla Vignaroli. I nostri inquilini invisibili
 Laboratorio di Microbiologia Referente: Prof. Carla Vignaroli I nostri inquilini invisibili Viviamo quotidianamente in compagnia di una moltitudine invisibile di microrganismi, che si trova nell ambiente
Laboratorio di Microbiologia Referente: Prof. Carla Vignaroli I nostri inquilini invisibili Viviamo quotidianamente in compagnia di una moltitudine invisibile di microrganismi, che si trova nell ambiente
04_biochimica. MFN0366-A1 (I. Perroteau) - Tecniche biochimiche-molecolari: Western blot
 1 2 1 - Gel di elettroforesi Trasferimento (blotting) + Membrana per western blot 3 4 2 Anticorpo primario ---> anticorpo secondario coniugato all enzima ---> reazione di biolimunescenza ---> luce che
1 2 1 - Gel di elettroforesi Trasferimento (blotting) + Membrana per western blot 3 4 2 Anticorpo primario ---> anticorpo secondario coniugato all enzima ---> reazione di biolimunescenza ---> luce che
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
FOCALIZZAZIONE ISOELETTRICA (IEF)
 FOCALIZZAZIONE ISOELETTRICA (IEF) ELETTROFORESI DI PROTEINE CRITERI DI SEPARAZIONE PAGE nativa densità di carica (pi), dimensioni, forma PAGE-SDS solo dimensioni IEF solo in base al punto isoelettrico
FOCALIZZAZIONE ISOELETTRICA (IEF) ELETTROFORESI DI PROTEINE CRITERI DI SEPARAZIONE PAGE nativa densità di carica (pi), dimensioni, forma PAGE-SDS solo dimensioni IEF solo in base al punto isoelettrico
Biologia Molecolare. CDLM in CTF La trascrizione negli eucarioti
 Biologia Molecolare CDLM in CTF 2010-2011 La trascrizione negli eucarioti I meccanismi della trascrizione Organizzazione generale delle sequenze regolative Il macchinario generale della trascrizione Si
Biologia Molecolare CDLM in CTF 2010-2011 La trascrizione negli eucarioti I meccanismi della trascrizione Organizzazione generale delle sequenze regolative Il macchinario generale della trascrizione Si
Schema a blocchi di uno spettrofluorimetro
 MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
Maria Antonietta Lepore. Principali tecniche di biologia molecolare clinica
 Maria Antonietta Lepore Principali tecniche di biologia molecolare clinica Copyright MMIX ARACNE editrice S.r.l. www.aracneeditrice.it [email protected] via Raffaele Garofalo, 133 a/b 00173 Roma (06)
Maria Antonietta Lepore Principali tecniche di biologia molecolare clinica Copyright MMIX ARACNE editrice S.r.l. www.aracneeditrice.it [email protected] via Raffaele Garofalo, 133 a/b 00173 Roma (06)
ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M
![ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M](/thumbs/59/43508258.jpg) ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
100bp DNA Ladder H3 RTU
 100bp DNA Ladder H3 RTU Elettroforesi Una combinazione unica di prodotti di PCR e una serie di plasmidi proprietarie digerito con enzimi di restrizione appropriati per produrre frammenti 12, adatto per
100bp DNA Ladder H3 RTU Elettroforesi Una combinazione unica di prodotti di PCR e una serie di plasmidi proprietarie digerito con enzimi di restrizione appropriati per produrre frammenti 12, adatto per
