FOCALIZZAZIONE ISOELETTRICA (IEF)
|
|
|
- Cosima Carlucci
- 6 anni fa
- Visualizzazioni
Transcript
1 FOCALIZZAZIONE ISOELETTRICA (IEF)
2 ELETTROFORESI DI PROTEINE CRITERI DI SEPARAZIONE PAGE nativa densità di carica (pi), dimensioni, forma PAGE-SDS solo dimensioni IEF solo in base al punto isoelettrico (pi)
3 FOCALIZZAZIONE ISOELETTRICA (IEF) pi: valore di ph al quale la carica netta di una proteina è nulla; sotto l azione di un campo elettrico non si sposta. Fra le migliori tecniche separative per proteine / peptidi. CAMPI DI UTILIZZO lab. di ricerca, lab. clinici, lab. di medicina legale e genetica umana, industrie alimentari ed agricole. Ricerche di enzimologia, immunologia, citologia e tassonomia, biochimica delle membrane, microbiologia, identificazione di proteine plasmatiche
4 CARATTERISTICHE DELLA IEF VANTAGGI Risoluzione altissima. Sensibilità elevata. Permette di misurare il pi. SVANTAGGI Costi elevati (apparecchiatura e materiali). Richiede ore di lavoro. Applicabilità solo a molecole anfotere.
5 FOCALIZZAZIONE ISOELETTRICA (IEF) Tipico supporto Tipica strip di un gel di PAA.
6 MIGRAZIONE DELLE MOLECOLE IN IEF Separazione elettroforetica, nel cui campo elettrico, oltre al gradiente di potenziale, vi sia un gradiente costante di ph ddp pi = pi = Anodo = + acido Catodo = + alcalino ph3 ph10 ph = 7.4 ph =
7 Catodo (-) Basico pi = ph 7.4 > è la distanza di una proteina dal proprio pi (in termini di ph), > sarà la sua carica, dunque anche la sua V. Anodo (+) Acido + + Proteina
8 MIGRAZIONE DELLE MOLECOLE IN IEF ddp V = E. q f pi = pi = Anodo = + acido Catodo = + alcalino ph3 ph4 ph5 ph6 ph10 ph = 7.4 ph = > è la distanza di una proteina dal proprio pi (in termini di ph),> sarà la sua carica, dunque anche la sua V.
9 MIGRAZIONE DELLE MOLECOLE IN IEF Anodo (+) Acido ARRIVO Punto Isoelettrico ph Catodo (-) Basico
10 Gradiente di ph FOCALIZZAZIONE ISOELETTRICA (IEF) _ pi A pi B L intervallo di ph è scelto in modo da contenere i pi di TUTTI i componenti della miscela da separare. + A B
11 ANFOLITI GRADIENTI DI ph IMMOBILIZZATI - Composti con n variabile di gruppi amminici e carbossilici. - Ciascuno ha un proprio pi - Basso assorbimento a 280 nm - Buona solubilità in acqua (per evitare la precipitazione) Vantaggio: alta capacita tamponante al loro pi. Svantaggi: gradiente non stabile e influenzabile dalle molecole che vengono analizzate. Derivati dell acrilammide, noti come Immobiline. R = gruppi carbossilici od amminici (pka da 0.8 a 4.6 / pka da 6.2 a 12).
12 ANFOLITI GRADIENTI DI ph - Composti con n variabile di gruppi amminici e carbossilici. - Ciascuno ha un proprio pi. - Basso assorbimento a 280 nm - Buona solubilità in acqua (per evitare la precipitazione). Vantaggio: alta capacita tamponante al loro pi. Svantaggi: gradiente non stabile e influenzabile dalle molecole che vengono analizzate.
13 IEF VERTICALE SU COLONNA Colonne termostatate di vetro Recipiente con acido Anfoliti disciolti in un addensante (es. saccarosio) Anodo (+) Prima si crea il gradiente di ph, poi si applica una ddp, che fa spostare gli anfoliti, infine si inietta il campione. Separazioni in 1-2 giorni Catodo (-) Recipiente con base
14 IEF ORIZZONTALE SU GEL Tecnica di elezione per la IEF: sottili lastre di gel vengono montate su vetro o plastica. Il gel (bassa [ ]) deve presentare un gradiente di ph. Dopo la corsa le proteine vengono rivelate per colorazione. Prima occorre lavare e contemporaneamente precipitare le proteine con un fissante (10% acido tricloroacetico TCA). Colorazione.
15 TAMPONE DI REIDRATAZIONE per denaturare e solubilizzare GRADIENTI DI ph IMMOBILIZZATI I gel recanti i gradienti di ph immobilizzati sono di solito disidratati e devono essere reidratati in opportune condizioni. I gel vengano messi a contatto con una soluzione di reidratazione (con o senza campione all interno): 8 M Urea 0,5-4% CHAPS TEMPERATURA: mantenuta attorno a 20 C. 0,2 0,8% DTT (o altri agenti riducenti) Glicerolo 10%
16 FLUSSO ELETTROENDOSMOTICO In presenza di cariche fisse sulla matrice del gel (in particolare, negative) e dei loro controioni (cationi con la loro sfera d idratazione od H 3 O + ) che attirano acqua per osmosi e migrano verso il catodo creando un vero e proprio flusso. Notevoli problemi con gradienti di ph non immobilizzati => => => => distorsione/spostamento del gradiente di ph. Il glicerolo, aumentando la densità del mezzo, minimizza questo effetto, importante anche durante il trasferimento delle proteine dalla prima alla seconda dimensione. Anodo + ph3 Flusso di acqua Catodo ph10 -
17 MODIFICAZIONI DEL FLUSSO ELETTROENDOSMOTICO Tensioattivi ph Temperatura EOF Forza Ionica Campo elettrico
18 DDP APPLICATE La ddp viene aumentata progressivamente Generatori molto potenti Necessario perchè nelle prime fasi della IEF vengano trasportati al di fuori del gel gli ioni presenti nel campione (e nei tamponi) o controioni dei gruppi acidi o basici del gel.
19 TERMINE DELLA IEF A) Possono essere trattate subito per la seconda dimensione. B) Congelamento: lavaggio delle strip H 2 O (immerse una decina di volte in un becker contenente H 2 O), scolate su un pezzo di carta e messe a congelare (-80 C) in un contenitore ove siano appoggiate sul loro supporto di plastica. (la seconda dimensione può essere corsa in un altro momento) Anche nel caso si possano correre subito, è consigliabile congelare sempre le strip. Aumenta la riproducibilità del metodo (IMPORTANTE: STESSE OPERAZIONI PER OGNI STRIP CHE SI VUOLE CONFRONTARE!)
20 CALCOLO DEL pi 1 Nterm 11 R 1 D 14 E 16 K 1 Cterm Algoritmi per il calcolo del pi pi misurabile o calcolabile, semplicemente sulla base della sequenza primaria, salvo che la proteina non sia glicosilata. Number of amino acids: 106 Molecular weight: Theoretical pi: Amino acid composition: Ala (A) 4 3.8% Arg (R) % Asn (N) 1 0.9% Asp (D) 1 0.9% Cys (C) 0 0.0% Gln (Q) 6 5.7% Glu (E) % Gly (G) % His (H) 0 0.0% Ile (I) 1 0.9% Leu (L) 3 2.8% Lys (K) % Met (M) 0 0.0% Phe (F) 0 0.0% Pro (P) % Ser (S) % Thr (T) 8 7.5% Trp (W) 0 0.0% Tyr (Y) 0 0.0% Val (V) 3 2.8%
21 PROTEOMICA
22 LA COMPLESSITA DEL GENOMA NON E SUFFICIENTE A SPIEGARE LA COMPLESSITA DELL ORGANISMO Circa 3000 geni di differenza!
23 DNA Trascritto FLUSSO DELL INFORMAZIONE Esone 1 Esone 2 Esone 3 Esone 1 Esone 2 Esone 3 mrna maturo Esone 1 Esone 2 Esone 3 TRADUZIONE Modificazioni post-traduzionali Tagli proteolitici ~20000 geni codificanti Vs > proteine
24 HUMAN PROTEOME NATURE 2014
25 OGGI Complessità crescente
26 Il proteoma è l insieme di tutte le proteine di un sistema biologico
27 Stesso genoma diverso proteoma!
28 ANALISI DI MAPPE BIDIMENSIONALI
29 ELETTROFORESI BIDIMENSIONALE o 2D SDS-PAGE ph 3 + IEF ph PM kda + 5
30 ELETTROFORESI BIDIMENSIONALE o 2D Accoppiamento di 2 metodi monodimensionali elettroforetici. Si effettua prima una isoelettrofocalizzazione (IEF), poi una SDS-PAGE. 1) Permette una risoluzione ancora > sulle proteine di una miscela complessa. 2) Permette di avere 2 informazioni su migliaia di campioni proteici (pi e PM). 3) Valutare meglio la purezza di una proteina purificata e identificare eventuali contaminanti. 4) Utilizzare la 2D per purificare proteine
31 Fields S. Proteomics. Proteomics in genomeland. Science 2001 Feb 16;291(5507):
32 TRATTAMENTO DEI CAMPIONI Estrazione Quantificazione? PREPARAZIONE CAMPIONE PROTEICO 1) Aggiunta di inibitori delle proteasi (PMSF, EDTA, Benzamidina)
33 Per evitare la degradazione proteolitica del campione si addizionano al sample buffer cocktails di inibitori. INIBIZIONE DELLE PROTEASI
34 TRATTAMENTO DEI CAMPIONI Estrazione Quantificazione? PREPARAZIONE CAMPIONE PROTEICO 1) Aggiunta di inibitori delle proteasi (PMSF, EDTA, Benzamidina) 2) Eliminazione delle sostanze non proteiche cariche; interferirebbero con l IEF
35 CONTAMINANTI SALI: Evitare concentrazioni saline >40mM Rimozione tramite dialisi, gel filtration, precipitazione (TCA/Acetone) DETERGENTI IONICI: Diluire il campione in una soluzione contenente un detergente neutro o zwitterionico (SDS<0.25%, Rapporto Det.neutro/SDS 8:1) Precipitazione ACIDI NUCLEICI: Potenziali artefatti dovuti al legame proteine-dna Elevata viscosità ostruisce i pori della poliacrilamide Digestione enzimatica (1mg/ml DNasi,0.25 mg/ml RNasi) POLISSACARIDI: Ostruzione dei pori della poliacrilamide (Destrani e Mucine) Legami con le proteine - Artefatti Precipitazione TCA/Acetone LIPIDI: Delipidazione con solventi organici (Cloroformio/Metanolo). Precipitazione TCA/Acetone. COMPOSTI FENOLICI Presenti in tessuti vegetali. Precipitazione TCA/Acetone Trattamento con Polivinilpirrolidone (PVP) o Polivinilpolipirrolidone (PVPP) e agenti riducenti
36 ESEMPIO DI PULIZIA DEL CAMPIONE ReadyPrep 2-D Cleanup Kit Precipitazione mediante TCA Rimuove Sali, detergenti, composti fenolici, lipidi, ioni Non trattato Migliora la risoluzione del gel eliminando le strisce. Elevato recupero delle proteine (>99.5% vs 70%). Trattato E. coli cell lysates spiked with 1% SDS Concentra campioni diluiti.
37 PREPARAZIONE CAMPIONE PROTEICO - denaturanti (Urea o Tiourea al posto dell SDS) 3) Aggiunta di: - detergenti non ionici o zwitterionici (CHAPS) - agenti riducenti (DTT, DTE e TBP) 4) Alchilazione (IAA) H 2 C CH 3 C H 2 CH 3 SH I S + H + + I - H 2 N H 2 C C O Iodoacetamide H 2 N CH 2 C O 5) Aggiunta di anfoliti.
38 1 DIMENSIONE: IEF Reidratazione passiva od attiva del gel per IEF. Posizionamento del gel nella camera di focalizzazione e separazione elettroforetica (IEF).
39 2 DIMENSIONE: IEF Equilibrazione e trasferimento del gel per IEF sulla sommità del gel per l SDS-PAGE (2 dimensione) Assemblaggio del gel di PAA nella camera per la 2 dimensione
40 ELETTROFORESI BIDIMENSIONALE o 2D Miscela di proteine 1 dimensione (in base al pi) Striscia da IEF incubata con SDS 2 dimensione (in base al PM)
41 SCELTA DEL RANGE DI ph ph range
42 INTERPRETAZIONE DEGLI SPOT ph 3.0 ph 10.0 _ A B C PM kda 200 E D + 10
43 INTERPRETAZIONE DEGLI SPOT ph 3.0 ph 10.0 _ A PM kda 200 ph 3.0 ph 10.0 _ 200 B Farmaco A B A Uno specifico software quantifica le variazioni.
44 2D: ESEMPIO PRATICO SU UNA PROTEINA PURIFICATA Colorazione argentica 64 kda BSA 51 kda Enzima E evidente la microeterogeneità delle proteine in studio (diverse fosforilazioni, carbossilazioni )
ELETTROFORESI DI PROTEINE
 ELETTROFORESI DI PROTEINE ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni
ELETTROFORESI DI PROTEINE ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni
Genomica e Proteomica
 Genomica e Proteomica Genomica: sequenziamento del DNA presente in un organismo e analisi dei geni (bioinformatica) Proteomica: analisi delle proteine di un organismo: Quali proteine in un dato momento
Genomica e Proteomica Genomica: sequenziamento del DNA presente in un organismo e analisi dei geni (bioinformatica) Proteomica: analisi delle proteine di un organismo: Quali proteine in un dato momento
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
ELETTROFORESI DI PROTEINE
 ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni di PROTEINE è più piccola
ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni di PROTEINE è più piccola
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento
 TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
METODI DI SEPARAZIONE IN PROTEOMICA
 METODI DI SEPARAZIONE IN PROTEOMICA ELETTROFORESI DI PROTEINE INTATTE MONODIMENSIONALE BIDIMENSIONALE CROMATOGRAFIA MONODIMENSIONALE DI PROTEINE INTATTE GEL FILTRAZIONE AFFINITA CROMATOGRAFIA MONO o BIDIMENSIONALE
METODI DI SEPARAZIONE IN PROTEOMICA ELETTROFORESI DI PROTEINE INTATTE MONODIMENSIONALE BIDIMENSIONALE CROMATOGRAFIA MONODIMENSIONALE DI PROTEINE INTATTE GEL FILTRAZIONE AFFINITA CROMATOGRAFIA MONO o BIDIMENSIONALE
5- Estrazione ed analisi di DNA
 5- Estrazione ed analisi di DNA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU) 16 ore) Marco Scocchi ( BIO/10-11) La struttura del DNA La traduzione dell informazione
5- Estrazione ed analisi di DNA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU) 16 ore) Marco Scocchi ( BIO/10-11) La struttura del DNA La traduzione dell informazione
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria contesto fisiologico livelli superiori funzione Elettrofores i
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria contesto fisiologico livelli superiori funzione Elettrofores i
Metodi di studio delle proteine :
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D determinazione del peso molecolare Spettrofotometro
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D determinazione del peso molecolare Spettrofotometro
3. ELETTROFORESI DI PROTEINE
 3. ELETTROFORESI DI PROTEINE Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) ELETTROFORESI PRINCIPI GENERALI Migrazione di particelle
3. ELETTROFORESI DI PROTEINE Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) ELETTROFORESI PRINCIPI GENERALI Migrazione di particelle
LUMINESCENZA. semiconduttore
 LUMINESCENZA LUMINESCENZA Elettroluminescenza Radioluminescenza Chemiluminescenza Bioluminescenza Termoluminescenza Triboluminescenza Sonoluminescenza Fotoluminescenza corrente elettrica in gas ionizzato
LUMINESCENZA LUMINESCENZA Elettroluminescenza Radioluminescenza Chemiluminescenza Bioluminescenza Termoluminescenza Triboluminescenza Sonoluminescenza Fotoluminescenza corrente elettrica in gas ionizzato
TECNICHE CROMATOGRAFICHE
 TECNICHE CROMATOGRAFICHE ISOLAMENTO DI MOLECOLE BIOLOGICHE Distruzione delle cellule e dei tessuti che contengono le molecole biologiche di nostro interesse (proteine o acidi nucleici) -Tampone (ph) -Sali
TECNICHE CROMATOGRAFICHE ISOLAMENTO DI MOLECOLE BIOLOGICHE Distruzione delle cellule e dei tessuti che contengono le molecole biologiche di nostro interesse (proteine o acidi nucleici) -Tampone (ph) -Sali
cromatografia Elettroforesi
 Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
α-amminoacidi O α O α R CH C O - NH 3 forma ionizzata sale interno (zwitterione) OH NH 2 forma non ionizzata (non esistente in realtà)
 Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
WESTERN BLOT o IMMUNOFISSAZIONE
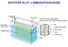 WESTERN BLOT o IMMUNOFISSAZIONE BLOTTING Trasferimento di macromolecole su una membrana immobilizzante. Southern DNA - da Edward Southern 1970 Northern Western RNA Proteine SCOPO DEL WESTERN BLOTTING Consente
WESTERN BLOT o IMMUNOFISSAZIONE BLOTTING Trasferimento di macromolecole su una membrana immobilizzante. Southern DNA - da Edward Southern 1970 Northern Western RNA Proteine SCOPO DEL WESTERN BLOTTING Consente
Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa
 WESTERN BLOTTING Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa Tecnica di trasferimento delle proteine da un gel ad una membrana associata ad utilizzo di anticorpi
WESTERN BLOTTING Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa Tecnica di trasferimento delle proteine da un gel ad una membrana associata ad utilizzo di anticorpi
Southern Blot: Per l analisi del DNA. (sonda = DNA o RNA). Northern Blot: Per l analisi dell RNA. (sonda = DNA o RNA).
 Southern Blot: Per l analisi del DNA. (sonda = DNA o RNA). Northern Blot: Per l analisi dell RNA. (sonda = DNA o RNA). Western Blot: Per l analisi delle proteine. (sonda = anticorpo). Una tecnica in cui
Southern Blot: Per l analisi del DNA. (sonda = DNA o RNA). Northern Blot: Per l analisi dell RNA. (sonda = DNA o RNA). Western Blot: Per l analisi delle proteine. (sonda = anticorpo). Una tecnica in cui
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
Elettroforesi proteine ed acidi nucleici
 Elettroforesi proteine ed acidi nucleici Flavia Frabetti Tecnici di laboratorio 2010/2011 ELETTORFORESI metodo fisico di separazione che sfrutta la mobilità elettroforetica di molecole cariche, sottoposte
Elettroforesi proteine ed acidi nucleici Flavia Frabetti Tecnici di laboratorio 2010/2011 ELETTORFORESI metodo fisico di separazione che sfrutta la mobilità elettroforetica di molecole cariche, sottoposte
mediante proteasi industriali
 Valorizzazione delle farine disoleate mediante proteasi industriali Alessandra Stefan Unità operativa: CSGI (Consorzio per lo Sviluppo dei Sistemi a Grande Interfase, Firenze) Dipartimento di Farmacia
Valorizzazione delle farine disoleate mediante proteasi industriali Alessandra Stefan Unità operativa: CSGI (Consorzio per lo Sviluppo dei Sistemi a Grande Interfase, Firenze) Dipartimento di Farmacia
MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine. Solo per uso didattico, vietata la riproduzione, la diffusione o la vendita
 MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine MFN0366-A1 (I. Perroteau) -traduzione delle proteine trna Traduzione: mrna -------> proteine mrna MFN0366-A1 (I. Perroteau) -traduzione
MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine MFN0366-A1 (I. Perroteau) -traduzione delle proteine trna Traduzione: mrna -------> proteine mrna MFN0366-A1 (I. Perroteau) -traduzione
Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008. Eloise Mastrangelo
 Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008 Eloise Mastrangelo Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle
Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008 Eloise Mastrangelo Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI
 METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
06_citologia_SER_golgi 1
 1 La sintesi proteica inizia sempre nello stesso modo: aggancio della piccola subunità ribosomale al estremità 5 dell mrna. si aggancio la grande subunità ribosomale In corrispondenza del codone di inizio
1 La sintesi proteica inizia sempre nello stesso modo: aggancio della piccola subunità ribosomale al estremità 5 dell mrna. si aggancio la grande subunità ribosomale In corrispondenza del codone di inizio
Schema a blocchi di uno spettrofluorimetro
 MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
Modulo 3. Lavorare con le proteine
 Modulo 3 Lavorare con le proteine La purificazione delle proteine Il primo passaggio nello studio delle proprietà di una proteina è la sua purificazione: la sua estrazione dalla matrice biologica in cui
Modulo 3 Lavorare con le proteine La purificazione delle proteine Il primo passaggio nello studio delle proprietà di una proteina è la sua purificazione: la sua estrazione dalla matrice biologica in cui
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
Strategie per la purificazione delle proteine
 Strategie per la purificazione delle proteine Attenzione! C è differenza tra separazione per alcuni scopi analitici (Gel-electrophoresis, IEF, 2D-gels) e purificazione In una cellula ci possono essere
Strategie per la purificazione delle proteine Attenzione! C è differenza tra separazione per alcuni scopi analitici (Gel-electrophoresis, IEF, 2D-gels) e purificazione In una cellula ci possono essere
ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M
![ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M](/thumbs/59/43508258.jpg) ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
MACROMOLECOLE. Polimeri (lipidi a parte)
 MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
Proteomica: Gel bidimensionale e Sistemi di Spettrometria di Massa
 Proteomica: Gel bidimensionale e Sistemi di Spettrometria di Massa DNA RNA Mantenimento e trasmissione informazione L informazione di base di un organismo è uguale per tutte le sue cellule GENOMICA Trasferimento
Proteomica: Gel bidimensionale e Sistemi di Spettrometria di Massa DNA RNA Mantenimento e trasmissione informazione L informazione di base di un organismo è uguale per tutte le sue cellule GENOMICA Trasferimento
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Cap. 1 Interazioni delle molecole con l acqua
 Cap. 1 nterazioni delle molecole con l acqua Ci sono legami idrogeno nel metano liquido (CH 4 mantenuto a -165 C)? Perché? No, perché il legame C-H non è sufficientemente polare da avere una distribuzione
Cap. 1 nterazioni delle molecole con l acqua Ci sono legami idrogeno nel metano liquido (CH 4 mantenuto a -165 C)? Perché? No, perché il legame C-H non è sufficientemente polare da avere una distribuzione
GENERALITA SULLA CROMATOGRAFIA
 GENERALITA SULLA CROMATOGRAFIA COSA SONO LE TECNICHE CROMATOGRAFICHE? La cromatografia consiste nello sfruttare la diversa attitudine di ogni molecola o ione nel distribuirsi fra 2 fasi differenti. Una
GENERALITA SULLA CROMATOGRAFIA COSA SONO LE TECNICHE CROMATOGRAFICHE? La cromatografia consiste nello sfruttare la diversa attitudine di ogni molecola o ione nel distribuirsi fra 2 fasi differenti. Una
v = velocità di migrazione della proteina in un campo elettrico E = forza del campo elettrico z = carica netta della proteina 3500 V catod o
 La prima e : Isoelectric focusing (IEF) v=e z f 1 step1 v = velocità di migrazione della proteina in un campo elettrico E = forza del campo elettrico z = carica netta della proteina Tot 76 kvh f = coefficiente
La prima e : Isoelectric focusing (IEF) v=e z f 1 step1 v = velocità di migrazione della proteina in un campo elettrico E = forza del campo elettrico z = carica netta della proteina Tot 76 kvh f = coefficiente
Relatrice: dott.ssa Ilaria Pegoretti
 Relatrice: dott.ssa Ilaria Pegoretti IL LABORATORIO DI BIOLOGIA MOLECOLARE: introduzione alle tecniche e alle loro applicazioni 26 Novembre 2011 Auditorium Presidio Ospedaliero S.Chiara, Trento Scoperta
Relatrice: dott.ssa Ilaria Pegoretti IL LABORATORIO DI BIOLOGIA MOLECOLARE: introduzione alle tecniche e alle loro applicazioni 26 Novembre 2011 Auditorium Presidio Ospedaliero S.Chiara, Trento Scoperta
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
REPLICAZIONE DEL DNA
 REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
2011 - G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
Ammino acidi Composto che contiene una funziome acida e amminica. Usualmente però con amminoacidi si intendono gli alfa- amminoacidi. Tra questi composti ve ne sono 20 che vengono definiti geneticamente
TECNICHE ELETTROFORETICHE
 TECNICHE ELETTROFORETICHE L elettroforesi e un metodo di separazione che si basa sulla diversa mobilita degli ioni (o di sostanze elettricamente cariche), quando posti all interno di un campo elettrico
TECNICHE ELETTROFORETICHE L elettroforesi e un metodo di separazione che si basa sulla diversa mobilita degli ioni (o di sostanze elettricamente cariche), quando posti all interno di un campo elettrico
PROTIDI: LE PROTEINE E GLI AMMINOACIDI
 PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Metodi per il sequenziamento di proteine
 Metodi per il sequenziamento di proteine Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto
Metodi per il sequenziamento di proteine Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Ø Gel Elettroforesi (GE) Ø Spettrometria di Massa (MS)
 Tecniche di indagine nello studio delle PTMs Ø Gel Elettroforesi (GE) Ø Tecniche cromatografiche (LC, HPLC) Ø Spettrometria di Massa (MS) Possono essere utilizzate da sole o in combinazione, direttamente
Tecniche di indagine nello studio delle PTMs Ø Gel Elettroforesi (GE) Ø Tecniche cromatografiche (LC, HPLC) Ø Spettrometria di Massa (MS) Possono essere utilizzate da sole o in combinazione, direttamente
Supplementi e reagenti per Biologia molecolare e cellulare
 Supplementi e reagenti per Biologia molecolare e cellulare Ammonium Acetate Solution (JN-4 BU101) Concentrazione: 5M - Forma liquida (100ml) Molecular Formula: CH3CO2NH4 Molecular Weight: 77.08 g/mol CAS#:
Supplementi e reagenti per Biologia molecolare e cellulare Ammonium Acetate Solution (JN-4 BU101) Concentrazione: 5M - Forma liquida (100ml) Molecular Formula: CH3CO2NH4 Molecular Weight: 77.08 g/mol CAS#:
PURIFICAZIONE DELLE PROTEINE
 PURIFICAZIONE DELLE PROTEINE 1 proteina da 10.000-20.000 proteine diverse (in una cellula, tessuto) Il grado finale di purezza che si vuole raggiungere dipende dagli scopi. Cosa si intende per proteina
PURIFICAZIONE DELLE PROTEINE 1 proteina da 10.000-20.000 proteine diverse (in una cellula, tessuto) Il grado finale di purezza che si vuole raggiungere dipende dagli scopi. Cosa si intende per proteina
Proteine strutturali Sostegno meccanico Cheratina: costituisce i capelli Collagene: costituisce le cartilagini Proteine di immagazzinamento
 Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
04_biochimica. MFN0366-A1 (I. Perroteau) - Tecniche biochimiche-molecolari: Western blot
 1 2 1 - Gel di elettroforesi Trasferimento (blotting) + Membrana per western blot 3 4 2 Anticorpo primario ---> anticorpo secondario coniugato all enzima ---> reazione di biolimunescenza ---> luce che
1 2 1 - Gel di elettroforesi Trasferimento (blotting) + Membrana per western blot 3 4 2 Anticorpo primario ---> anticorpo secondario coniugato all enzima ---> reazione di biolimunescenza ---> luce che
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 13 Cromatografia ed elettroforesi Concetti chiave: Il comportamento cromatografico di una proteina è influenzato da alcune
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 13 Cromatografia ed elettroforesi Concetti chiave: Il comportamento cromatografico di una proteina è influenzato da alcune
Elettroforesi di Tamara Benincasa
 Elettroforesi di Tamara Benincasa L elettroforesi è una metodologia utilizzata in laboratorio attraverso la quale molecole biologiche (ammino acidi, peptidi, proteine, nucleotidi ed acidi nucleici), dotate
Elettroforesi di Tamara Benincasa L elettroforesi è una metodologia utilizzata in laboratorio attraverso la quale molecole biologiche (ammino acidi, peptidi, proteine, nucleotidi ed acidi nucleici), dotate
Biologia Molecolare. CDLM in CTF La trascrizione negli eucarioti
 Biologia Molecolare CDLM in CTF 2010-2011 La trascrizione negli eucarioti I meccanismi della trascrizione Organizzazione generale delle sequenze regolative Il macchinario generale della trascrizione Si
Biologia Molecolare CDLM in CTF 2010-2011 La trascrizione negli eucarioti I meccanismi della trascrizione Organizzazione generale delle sequenze regolative Il macchinario generale della trascrizione Si
la purificazione può essere di tipo analitico o preparativo Purificare una proteina significa ottenerla in forma omogenea
 la purificazione può essere di tipo analitico o preparativo Purificare una proteina significa ottenerla in forma omogenea Analisi delle sue proprietà fisiche e biologiche Come viene modulata la sua espressione
la purificazione può essere di tipo analitico o preparativo Purificare una proteina significa ottenerla in forma omogenea Analisi delle sue proprietà fisiche e biologiche Come viene modulata la sua espressione
ELETTROFORESI. Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico.
 ELETTROFORESI ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. Anioni ANODO (+) Cationi CATODO (-) v = velocità di migrazione μ =
ELETTROFORESI ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. Anioni ANODO (+) Cationi CATODO (-) v = velocità di migrazione μ =
E. Giordano 16/09/2010
 GRUPPO NAZIONALE DI BIOINGEGNERIA XXIX Scuola Annuale BIOLOGIA SINTETICA Bressanone 13-17 settembre 2010 1/41 COSTITUENTI MOLECOLARI DELLO CHASSIS CELLULARE Emanuele GIORDANO II Facoltà di Ingegneria Dipartimento
GRUPPO NAZIONALE DI BIOINGEGNERIA XXIX Scuola Annuale BIOLOGIA SINTETICA Bressanone 13-17 settembre 2010 1/41 COSTITUENTI MOLECOLARI DELLO CHASSIS CELLULARE Emanuele GIORDANO II Facoltà di Ingegneria Dipartimento
Tecniche elettroforetiche. Applicazione: Proteolisi limitata
 Tecniche elettroforetiche Applicazione: Proteolisi limitata PRINCIPI GENERALI Elettroforesi: Migrazione di particelle cariche sotto l azione di un campo elettrico Il campo elettrico è generato applicando
Tecniche elettroforetiche Applicazione: Proteolisi limitata PRINCIPI GENERALI Elettroforesi: Migrazione di particelle cariche sotto l azione di un campo elettrico Il campo elettrico è generato applicando
le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. STRUTTURA TERZIARIA
 STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
STRUTTURA TERZIARIA le porzioni con strutture secondarie sono avvicinate e impaccate mediante anse e curve della catena. Le proteine globulari dopo aver organizzato il proprio scheletro polipeptidico con
COS E LA PROTEOMICA? The total PROTEIN complement of a GENOME Proteoma proteine codificate modificazioni post-traduzionali
 COS E LA PROTEOMICA? The total PROTEIN complement of a GENOME (M. Wilkins et al. Electrophoresis 1995,16 1090-95) La Proteomica è lo studio del PROTEOMA Ud'A [Biochimica Applicata 1] dia n. 1 Proteoma
COS E LA PROTEOMICA? The total PROTEIN complement of a GENOME (M. Wilkins et al. Electrophoresis 1995,16 1090-95) La Proteomica è lo studio del PROTEOMA Ud'A [Biochimica Applicata 1] dia n. 1 Proteoma
determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Spettrofotometro cuvetta monocromatore rivelatore
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Spettrofotometro cuvetta monocromatore rivelatore
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
Southern blot. !Per. determinare la presenza o assenza di specifici frammenti genici. !Studio. della struttura e dell organizzazione di un gene
 Southern blot!per determinare la presenza o assenza di di specifici frammenti genici!studio della struttura e dell organizzazione di di un gene Southern blot Procedura Isolare DNA genomico Digerirlo con
Southern blot!per determinare la presenza o assenza di di specifici frammenti genici!studio della struttura e dell organizzazione di di un gene Southern blot Procedura Isolare DNA genomico Digerirlo con
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. DiSTABiF. Antimo Di Maro. Lezione 3. Corso di Laurea in Scienze Biologiche
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Antimo Di Maro Anno Accademico 2016-2017 Lezione 3 GLI AMMINOACIDI PROTEICI Le
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Antimo Di Maro Anno Accademico 2016-2017 Lezione 3 GLI AMMINOACIDI PROTEICI Le
Acidi nucleici come materiale di studio. DNA endogeno DNA esogeno (transgeni) RNA strutturale mrna
 Acidi nucleici come materiale di studio DNA endogeno DNA esogeno (transgeni) RNA strutturale mrna Isolamento DNA da cellule eucariotiche Isolamento acidi nucleici 1. lisi cellulare 2. purificazione 2a.
Acidi nucleici come materiale di studio DNA endogeno DNA esogeno (transgeni) RNA strutturale mrna Isolamento DNA da cellule eucariotiche Isolamento acidi nucleici 1. lisi cellulare 2. purificazione 2a.
3.3.2. ALIMENTI DI ORIGINE VEGETALE. 3.3.2.1. Verdure
 3.3.2. ALIMENTI DI ORIGINE VEGETALE 3.3.2.1. Verdure Nella Tabella 9 sono riportati i valori degli aminoacidi liberi presenti in alcune fra le più diffuse verdure in commercio. In un passato recente era
3.3.2. ALIMENTI DI ORIGINE VEGETALE 3.3.2.1. Verdure Nella Tabella 9 sono riportati i valori degli aminoacidi liberi presenti in alcune fra le più diffuse verdure in commercio. In un passato recente era
Biochimica delle proteine Prof. M. Bolognesi a.a. 2006/2007. Eloise Mastrangelo
 Biochimica delle proteine Prof. M. Bolognesi a.a. 2006/2007 Eloise Mastrangelo Elettroforesi monodimensionale SDS-PAGE: Sodio DodecilSolfato-PoliAcrilammide Gel Elettroforesi L`elettroforesi su gel di
Biochimica delle proteine Prof. M. Bolognesi a.a. 2006/2007 Eloise Mastrangelo Elettroforesi monodimensionale SDS-PAGE: Sodio DodecilSolfato-PoliAcrilammide Gel Elettroforesi L`elettroforesi su gel di
BIOCHIMICA BIOCHIMICA APPLICATA
 BIOCHIMICA BIOCHIMICA APPLICATA Corso di Laurea in Farmacia Prof. Ivano F. Santarelli Introduzione Testi consigliati -I principi di Biochimica di Lehninger. D.L.Nelson, M.M. Cox. Zanichelli -Biochimica
BIOCHIMICA BIOCHIMICA APPLICATA Corso di Laurea in Farmacia Prof. Ivano F. Santarelli Introduzione Testi consigliati -I principi di Biochimica di Lehninger. D.L.Nelson, M.M. Cox. Zanichelli -Biochimica
ELETTROFORESI. Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico.
 ELETTROFORESI ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. Anioni ANODO (+) Cationi CATODO (-) v = velocità di migrazione μ =
ELETTROFORESI ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. Anioni ANODO (+) Cationi CATODO (-) v = velocità di migrazione μ =
REGOLAZIONE DELL ATTIVITA ENZIMATICA 1) MODULAZIONE ALLOSTERICA NON-COVALENTE (REVERSIBILE)
 REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
Struttura secondaria
 Struttura secondaria Struttura localmente ordinata Polimeri lineari ad unità monomeriche asimmetriche elica j = 0,1,2,..., N N = numero di residui z j = h z j + z 0 x j = r cos (j2p h z /P + d 0 ) y j
Struttura secondaria Struttura localmente ordinata Polimeri lineari ad unità monomeriche asimmetriche elica j = 0,1,2,..., N N = numero di residui z j = h z j + z 0 x j = r cos (j2p h z /P + d 0 ) y j
9) Scrivere un disaccaride formato dal β-d-galattosio e dall α-d-n-acetil-glucosammina legati da un legame glicosidico β(1-4).
 CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
CARBOIDRATI - AMMINOACIDI - PROTEINE 1) Scrivere la proiezione di Fisher del D-ribosio e del D-glucosio. La lettera D a cosa si riferisce? Disegnare inoltre il disaccaride ottenuto dalla condensazione
Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo
 Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo spettrometria di massa elettroforesi Spettrometria di massa Tecnica per indagine che si basa sulla ionizzazione di una molecola
Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo spettrometria di massa elettroforesi Spettrometria di massa Tecnica per indagine che si basa sulla ionizzazione di una molecola
Metodologie citogenetiche. Metodologie molecolari. Formulare la domanda Utilizzare la metodica appropriata
 In base al potere di risoluzione della tecnica Metodologie citogenetiche Metodologie molecolari Formulare la domanda Utilizzare la metodica appropriata 1 DNA RNA PROTEINE DNA Cromosomi (cariotipo, FISH,
In base al potere di risoluzione della tecnica Metodologie citogenetiche Metodologie molecolari Formulare la domanda Utilizzare la metodica appropriata 1 DNA RNA PROTEINE DNA Cromosomi (cariotipo, FISH,
l'analisi dello spettro permette di individuare la natura della sostanza in esame
 L'analisi spettrofotometrica consiste nella misurazione di radiazioni elettromagnetiche per ottenere informazioni sia qualitative che quantitative: ogni sostanza assorbe o emette radiazioni di lunghezza
L'analisi spettrofotometrica consiste nella misurazione di radiazioni elettromagnetiche per ottenere informazioni sia qualitative che quantitative: ogni sostanza assorbe o emette radiazioni di lunghezza
Strategie per la purificazione delle proteine
 Strategie per la purificazione delle proteine Attenzione! C è differenza tra separazione per alcuni scopi analitici (Gel-electrophoresis, IEF, 2D-gels) e purificazione In una cellula ci possono essere
Strategie per la purificazione delle proteine Attenzione! C è differenza tra separazione per alcuni scopi analitici (Gel-electrophoresis, IEF, 2D-gels) e purificazione In una cellula ci possono essere
Perche usare Gel di Poliacrilammide per separare le proteine?
 Perche usare Gel di Poliacrilammide per separare le proteine? I gel di poliacrilammide hanno una trama piu compatta I pori hanno dimensioni minori che nei gel di agarosio Le proteine sono molto piu piccole
Perche usare Gel di Poliacrilammide per separare le proteine? I gel di poliacrilammide hanno una trama piu compatta I pori hanno dimensioni minori che nei gel di agarosio Le proteine sono molto piu piccole
DOSAGGIO ACIDI NUCLEICI
 DOSAGGIO ACIDI NUCLEICI l Cuvetta contenente il campione di proteina a concentrazione C Sorgente I 0 I 1 I 0 Rivelatore Quando si fa passare una luce di una particolare lunghezza d onda d
DOSAGGIO ACIDI NUCLEICI l Cuvetta contenente il campione di proteina a concentrazione C Sorgente I 0 I 1 I 0 Rivelatore Quando si fa passare una luce di una particolare lunghezza d onda d
INDICE PARTE I CHIMICA. Autori Introduzione
 INDICE Autori Introduzione XI XIII PARTE I CHIMICA Capitolo 1 STRUTTURA DELL ATOMO 3 1.1 Teorie atomiche 3 1.2 Costituenti dell atomo 4 1.3 Numeri quantici 4 1.4 Tipi di orbitali 5 1.5 Aufbau 6 1.6 Sistema
INDICE Autori Introduzione XI XIII PARTE I CHIMICA Capitolo 1 STRUTTURA DELL ATOMO 3 1.1 Teorie atomiche 3 1.2 Costituenti dell atomo 4 1.3 Numeri quantici 4 1.4 Tipi di orbitali 5 1.5 Aufbau 6 1.6 Sistema
MODIFICHE INDOTTE DA TRATTAMENTI CON OZONO SULLE CARATTERISTICHE CHIMICO- FISICHE E SULLE PROPRIETÁ FUNZIONALI DELLE PROTEINE DEL SIERO DI LATTE
 MODIFICHE INDOTTE DA TRATTAMENTI CON OZONO SULLE CARATTERISTICHE CHIMICO- FISICHE E SULLE PROPRIETÁ FUNZIONALI DELLE PROTEINE DEL SIERO DI LATTE Nadia Innocente, Federica Buchini, Annalisa Segat Dipartimento
MODIFICHE INDOTTE DA TRATTAMENTI CON OZONO SULLE CARATTERISTICHE CHIMICO- FISICHE E SULLE PROPRIETÁ FUNZIONALI DELLE PROTEINE DEL SIERO DI LATTE Nadia Innocente, Federica Buchini, Annalisa Segat Dipartimento
Applicazioni biotecnologiche degli enzimi: le lipasi
 Applicazioni biotecnologiche degli enzimi: le lipasi Le lipasi Catalizzano l idrolisi e la sintesi di acilgliceroli Sono stabili in solventi organici Non richiedono cofattori Hanno bassa specificità di
Applicazioni biotecnologiche degli enzimi: le lipasi Le lipasi Catalizzano l idrolisi e la sintesi di acilgliceroli Sono stabili in solventi organici Non richiedono cofattori Hanno bassa specificità di
Tra nm Nucleotidi mono-fosfato
 Un estratto proteico può contenere acidi nucleici, nucleotidi Posso verificare la loro presenza mediante la misura di uno spettro di assorbimento. Gli acidi nucleici e i nucleotidi assorbono nell UV, grazie
Un estratto proteico può contenere acidi nucleici, nucleotidi Posso verificare la loro presenza mediante la misura di uno spettro di assorbimento. Gli acidi nucleici e i nucleotidi assorbono nell UV, grazie
CROMATOGRAFIA IONICA (IC)
 CROMATOGRAFIA IONICA (IC) CROMATOGRAFIA CROMATOGRAFIA IONICA RESINE A SCAMBIO IONICO Struttura Meccanismo di scambio STRUMENTAZIONE IC SOPPRESSORE A MEMBRANA PROTOCOLLO DI ANALISI CROMATOGRAFIA Analisi
CROMATOGRAFIA IONICA (IC) CROMATOGRAFIA CROMATOGRAFIA IONICA RESINE A SCAMBIO IONICO Struttura Meccanismo di scambio STRUMENTAZIONE IC SOPPRESSORE A MEMBRANA PROTOCOLLO DI ANALISI CROMATOGRAFIA Analisi
Continua. Peptidasi H 2 O
 Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Insegnamento: Tecnologie Biochimiche e Ricombinanti Modulo: Tecnologie Molecolari e Ricombinanti
 Insegnamento: Tecnologie Biochimiche e Ricombinanti Modulo: Tecnologie Molecolari e Ricombinanti Libri di testo consigliati: Dale J.W., von Schantz M., Plant N., Dai geni ai Genomi, EdiSES, 2013 Primrose
Insegnamento: Tecnologie Biochimiche e Ricombinanti Modulo: Tecnologie Molecolari e Ricombinanti Libri di testo consigliati: Dale J.W., von Schantz M., Plant N., Dai geni ai Genomi, EdiSES, 2013 Primrose
12-05-2010 ESTRAZIONE E PURIFICAZIONE DI ACIDI NUCLEICI ESTRAZIONE E PURIFICAZIONE DI ACIDI NUCLEICI ESTRAZIONE E PURIFICAZIONE DI ACIDI NUCLEICI
 Il primo passaggio per la maggior parte delle procedure che verranno trattate in questo corso consiste nell estrazione del DNA (e dell RNA) da materiale biologico, e nella sua purificazione mediante separazione
Il primo passaggio per la maggior parte delle procedure che verranno trattate in questo corso consiste nell estrazione del DNA (e dell RNA) da materiale biologico, e nella sua purificazione mediante separazione
TRATTAMENTO DELL ACQUA DI LABORATORIO. sostanza più frequentemente adoperata in laboratorio.
 TRATTAMENTO DELL ACQUA DI LABORATORIO 15.10.17 sostanza più frequentemente adoperata in laboratorio. serve a molte cose solvente per preparare soluzioni, diluire, cristallizzare, lavare, raffreddare,..
TRATTAMENTO DELL ACQUA DI LABORATORIO 15.10.17 sostanza più frequentemente adoperata in laboratorio. serve a molte cose solvente per preparare soluzioni, diluire, cristallizzare, lavare, raffreddare,..
LEZIONI Temi e competenze acquisite Argomenti Contenuti specifici Ore 1. INTRODUZIONE AL CORSO Informazioni per gli studenti. Strutture cicliche dei
 Insegnamento: CHIMICA DELLE SOSTANZE NATURALI (cod. 069; 6 CFU; 60 ore) A.A. 04-05 Corso di laurea: Tecnologie Alimentari (TA) Scuola di Agraria e Medicina Veterinaria - Campus di Cesena Dott.ssa ELENA
Insegnamento: CHIMICA DELLE SOSTANZE NATURALI (cod. 069; 6 CFU; 60 ore) A.A. 04-05 Corso di laurea: Tecnologie Alimentari (TA) Scuola di Agraria e Medicina Veterinaria - Campus di Cesena Dott.ssa ELENA
DNA, RNA E PROTEINE DA CAMPIONI BIOLOGICI
 DNA, RNA E PROTEINE DA CAMPIONI BIOLOGICI UNA VOLTA ESTRATTI VANNO QUANTIFICATI QUANTIFICAZIONE DEI CAMPIONI Vi sono numerosi metodi. Alcuni forniscono valori assoluti, altri relativi; in tal caso lo standard
DNA, RNA E PROTEINE DA CAMPIONI BIOLOGICI UNA VOLTA ESTRATTI VANNO QUANTIFICATI QUANTIFICAZIONE DEI CAMPIONI Vi sono numerosi metodi. Alcuni forniscono valori assoluti, altri relativi; in tal caso lo standard
Estrazione del DNA. A)Resine (Chelex 100) B) Solven: organici. C) Sali (sal:ng out)
 Estrazione del DNA A)Resine (Chelex 100) B) Solven: organici C) Sali (sal:ng out) La Chelex 100 è una resina cara4erizzata da biglie a carica nega:va (ioni imminoaceta: contenu: nei copolimeri di s:rene
Estrazione del DNA A)Resine (Chelex 100) B) Solven: organici C) Sali (sal:ng out) La Chelex 100 è una resina cara4erizzata da biglie a carica nega:va (ioni imminoaceta: contenu: nei copolimeri di s:rene
ESTRAZIONE ACIDI NUCLEICI CON PARTICOLARE RIFERIMENTO A DNA ESTRATTO DA TESSUTI FISSATI IN FORMALINA E INCLUSI IN PARAFFINA (FFPE)
 ESTRAZIONE ACIDI NUCLEICI CON PARTICOLARE RIFERIMENTO A DNA ESTRATTO DA TESSUTI FISSATI IN FORMALINA E INCLUSI IN PARAFFINA (FFPE) SALVATORE GIRLANDO LABORATORIO PATOLOGIA MOLECOLARE ANATOMIA PATOLOGICA
ESTRAZIONE ACIDI NUCLEICI CON PARTICOLARE RIFERIMENTO A DNA ESTRATTO DA TESSUTI FISSATI IN FORMALINA E INCLUSI IN PARAFFINA (FFPE) SALVATORE GIRLANDO LABORATORIO PATOLOGIA MOLECOLARE ANATOMIA PATOLOGICA
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2006/2007. Corso di: Laboratorio di Biologia II Chimica Biologica
 CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2006/2007 Corso di: Laboratorio di Biologia II Chimica Biologica Dott. Marcello MEROLA Parziale purificazione dell enzima Alcool Deidrogenasi
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2006/2007 Corso di: Laboratorio di Biologia II Chimica Biologica Dott. Marcello MEROLA Parziale purificazione dell enzima Alcool Deidrogenasi
Vittoria Patti MACROMOLECOLE BIOLOGICHE. 4. proteine
 Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Analisi di proteine:
 Analisi di proteine: Elettroforesi e Western Blot Seminario Metodologico per il Corso di Didattica Libera Marilena Dinardo mariamaddalena.dinardo@uniba.it Le proteine sono il prodotto dei geni: sono le
Analisi di proteine: Elettroforesi e Western Blot Seminario Metodologico per il Corso di Didattica Libera Marilena Dinardo mariamaddalena.dinardo@uniba.it Le proteine sono il prodotto dei geni: sono le
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
METODI BIOCHIMICI ESERCIZI D ESAME (by NewSgrunt)
 METODI BIOCHIMICI ESERCIZI D ESAME 2002 2006 (by NewSgrunt) A) SPETTROSCOPIA UV/vis, LAMBERT-BEER, STUDIO DELLE PROTEINE 1A) Il Citocromo c è caratterizzato dai seguenti coefficienti di estinzione molare:
METODI BIOCHIMICI ESERCIZI D ESAME 2002 2006 (by NewSgrunt) A) SPETTROSCOPIA UV/vis, LAMBERT-BEER, STUDIO DELLE PROTEINE 1A) Il Citocromo c è caratterizzato dai seguenti coefficienti di estinzione molare:
Identificazione dei microrganismi mediante tecniche di biologia molecolare Esercitazione n 3. Criteri di identificazione
 Identificazione dei microrganismi mediante tecniche di biologia molecolare Esercitazione n 3 Criteri di identificazione Tradizionale (fenotipo) Tecniche di biologia molecolare Il livello di risoluzione
Identificazione dei microrganismi mediante tecniche di biologia molecolare Esercitazione n 3 Criteri di identificazione Tradizionale (fenotipo) Tecniche di biologia molecolare Il livello di risoluzione
Dosaggio delle proteine
 Laboratorio Integrato 4 Lezione n.2 Dosaggio delle proteine Dott.ssa Francesca Zazzeroni METODI PER EFFETTUARE UN DOSAGGIO PROTEICO 1-Metodo del Biureto - il reattivo del biureto consiste in una soluzione
Laboratorio Integrato 4 Lezione n.2 Dosaggio delle proteine Dott.ssa Francesca Zazzeroni METODI PER EFFETTUARE UN DOSAGGIO PROTEICO 1-Metodo del Biureto - il reattivo del biureto consiste in una soluzione
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
