Erboristeria medicinale e salutare
|
|
|
- Luigi Orazio Santoro
- 9 anni fa
- Visualizzazioni
Transcript
1 Erboristeria medicinale e salutare Erboristeria medicinale e salutare Coesistono nello stesso settore prodotti con finalità terapeutiche prodotti con finalità salutari Problemi tecnici e normativi ai quali non è stata data ancora risposta a causa di: problematiche relative al controllo delle materie prime e dei prodotti finali mediante metodi analitici standardizzazione di materiali la cui composizione può variare anche sensibilmente in relazione ai luoghi di provenienza, al tempo di raccolta, alle modalità di conservazione tecnologie di produzione, che specialmente nei prodotti semplici (cioè non derivati da procedimenti per lo più mutuati da altri settori industriali, quali il farmaceutico o l alimentare) si prestano ben poco ai moderni concetti di convalida e di controllo stabilità e quindi la conservazione dei prodotti finali, nonché i criteri per determinarne il periodo di validità, per i quali non esistono che metodi di valutazione del tutto generali e per lo più soggettivi, non riconducibili pertanto ad accertamenti sperimentali codificabili e uguali 1
2 I prodotti di erboristeria medicinale costituiti da piante, loro parti e miscele, o dai derivati semplici o complessi - aventi proprietà curative o profilattiche delle malattie umane - che possano essere utilizzati sull uomo o somministrati all uomo allo scopo di ripristinare, correggere o modificare funzioni fisiologiche, esercitando azione farmacologica, immunologica o metabolica, ovvero di stabilire una diagnosi medica Sono commercializzati esclusivamente come medicamenti con tutti gli obblighi e le limitazioni e i vincoli che ne derivano e possono essere venduti solo in farmacia I prodotti di erboristeria salutare costituiti da piante loro parti e miscele, o dai derivati semplici o complessi delle stesse in grado di favorire le funzioni organiche dell uomo, esercitando un azione semplicemente benefica e quindi salutare. Sono fabbricati e commercializzati al di fuori della regolamentazione vigente dei medicamenti Possono essere venduti in esercizi diversi dalle farmacie 2
3 Attribuire un prodotto erboristico a una delle due categorie, medicinale o salutare può essere ricondotta a valutazione degli elementi sostanziali composizione qualitativa composizione quantitativa attività terapeutica dimostrabile valutazione degli elementi formali modalità di presentazione come si configurano dal contenuto e dalle diciture che compaiono nelle etichette, o in generale sulle confezioni, nei foglietti illustrativi e nella pubblicità. Normativa - Legge 6 gennaio 1931, n. 99 Disciplina della coltivazione, raccolta e commercio delle piante officinali. - Regio Decreto 19 novembre 1931, n Regolamento per l applicazione della Legge 6 gennaio 1931, n Regio Decreto 26 maggio 1932, n. 772, Elenco delle piante dichiarate officinali. - Regio Decreto 30 marzo 1933, n. 675, Modifica dell art. 1 del regolamento per l applicazione della legge 6 gennaio 1931, n Regio Decreto 27 luglio 1934, n Leggi sanitarie - R.D.L 12 novembre 1936, n Norme per la tutela della denominazione di «zafferano». - R.D.L 8 marzo 1937, n. 529 Tutela della denominazione di «Mannite» o «Mannite di frassino». - Legge 30 ottobre 1940, n Disciplina della raccolta e della vendita della camomilla. - Circolare 2 dicembre 1940, n Ministero dell Agricoltura e delle Foreste - Circolare 23 giugno 1942 Ministero dell Interno Direzione Sanità Pubblica - Legge 9 ottobre 1942, n Disciplina della raccolta e del commercio della digitale. - Parere del 3 febbraio 1970, n. 67 Consiglio di Stato Circolare 25 novembre 1977 Ministero della Sanità 3
4 Circolare n. 1 dell 8 gennaio 1981 (n AG.8I254) Ministero della Sanità: Prodotti a base di piante medicinali. Allegato A Elenco esemplificativo di piante medicinali vendibili soltanto dal farmacista, in farmacia Allegato B Elenco esemplificativo di piante medicinali aromatiche e da profumo vendibili anche fuori di farmacia 4
5 Nella X Edizione (come per la Ph. Eu.) le monografie delle piante erano inserite in ordine alfabetico insieme a quelle relative ai prodotti chimici. Alla fine del testo erano riportate le Avvertenze relative alle droghe vegetali con le informazioni che il produttore doveva trasmettere al farmacista: titolo del o dei princìpi attivi o costituenti caratteristici o ad altri caratteri specifici, comunque utili ai fini di un idoneo impiego in terapia o in farmacia perdita all essiccamento trattamenti fisici o chimico-fisici utilizzati per la conservazione, anche durante il trasporto e la distribuzione indicazioni da riportare in etichetta: nome e indirizzo del produttore o del responsabile della commercializzazione denominazione della droga e nome botanico della pianta secondo il nome scientifico della specie ufficialmente riconosciuto e accettato dalle Farmacopee o da documenti scientifici particolarmente qualificati luogo di origine della droga, se da pianta spontanea o coltivata data di raccolta, data di confezionamento e data limite di utilizzazione, numero del lotto di lavorazione forma di presentazione della droga (se polvere...) Affermando che il farmacista può ripartire, riconfezionare e miscelare le droghe vegetali, le Avvertenze indicavano le informazioni che il farmacista doveva riportare in etichetta oltre a quanto previsto dall articolo 37 del RD 1706/38: denominazione della farmacia dispensatrice data di ripartizione o di confezionamento o di miscelazione denominazione di ciascun componente e indicazione delle quantità quantità netta presente nella confezione istruzioni per l uso comprese modalità di conservazione e periodo limite di utilizzazione Nella XI e XII edizione della FU - i concetti fondamentali contenuti nelle Avvertenze relative alle droghe vegetali sono stati inseriti nelle NBP - sono state inserite nuove monografie, corrispondenti a quelle della Farmacopea Europea, quali "Droghe vegetali, "Preparazioni a base di droghe vegetali", "Piante per tisane" e "Estratti da droghe vegetali 5
6 Preparati galenici Preparato Magistrale pagina 1426, glossario, NBP, FU XII ed. Medicinale preparato in Farmacia in base ad una prescrizione medica destinata a un determinato paziente Preparato Officinale pagina 1426, glossario, NBP, FU XII ed. Medicinale preparato in farmacia in base alle indicazioni di una Farmacopea della UE e destinato ad essere fornito direttamente ai pazienti che si servono in tale farmacia Preparato salutare contenente esclusivamente piante e/o loro parti 6
7 Integratori alimentari D.L. del 21/05/2004 n.169 ha dato attuazione alla direttiva 2002/46/CE definisce gli integratori alimentari come prodotti alimentari destinati ad integrare la comune dieta e che costituiscono una fonte concentrata di sostanze nutritive, quali le vitamine e i minerali, o di altre sostanze aventi un effetto nutritivo o fisiologico, in particolare, ma non in via esclusiva, aminoacidi acidi grassi essenziali, fibre ed estratti di origine vegetale, sia monocomposti che pluricomposti, in forme predosate Integratori La produzione è consentita solo a livello industriale, quindi la farmacia non può eseguirli in scala ridotta, ma solo dietro presentazione di ricetta medica, nel qual caso si ricade in quanto specificato per la ricetta magistrale. La farmacia può vendere integratori prodotti da ditte autorizzate personalizzandoli con il proprio marchio ma è vietato sconfezionare un integratore acquistato in bulk. 7
8 Integratori alimentari erboristici/ salutistici * In base alla Direttiva 2002/46/CE le piante e gli estratti vegetali sono stati inclusi tra le altre sostanze aventi un effetto nutritivo o fisiologico utilizzabili per la produzione di integratori alimentari. * Con la Circolare n.3 del 18/07/2002 vengono estese le norme previste per gli integratori a base di vitamine e sali minerali anche a quelli costituiti esclusivamente da piante ed estratti vegetali aventi esclusivo carattere fisiologico/ salutistico Circolare Ministero della Salute n.3 del 18/07/2002 Applicazione della procedura di notifica dell etichetta di cui all art. 7 del decreto legislativo n. 111/1992, ai prodotti a base di piante e derivati aventi finalità salutistiche Nota n /ag45.1/706 del 05/12/2002 gli adempimenti introdotti dalla Circolare non si applicano a prodotti a base di ingredienti vegetali preparati nelle Farmacie, fornite di un laboratorio galenico autorizzato dalla ASL competente e periodicamente ispezionato 8
9 Integratori alimentari erboristici/salutistici In deroga alla Cir. Min. n. 3 del , il Farmacista può allestire, estemporaneamente e non, preparati non medicinali a base di ingredienti vegetali a condizione che: Siano a base di piante e loro parti riportate in un apposito elenco stilato dal Ministero della Salute Siano per uso orale Siano ottenuti seguendo le NBP della FU XII Siano venduti direttamente ed unicamente ai clienti della farmacia L etichetta non deve riportare indicazioni terapeutiche e ingenerare l equivoco che si possa trattare di medicinale Le piante ammesse all uso deliberato in tali preparazioni erboristiche sono riportate nella Lista erbe presente sul portale del Ministero della Salute Tali piante sono impiegabili nelle varie forme di presentazione: Polvere, Estratto Fluido, Tintura, Tintura Madre, Estratto Secco fatte salve le eventuali limitazioni di dosaggio riportate in tale tabella o in apposite Circolari 9
10 Preparato officinale * La disciplina di vendita (SOP, RR, RNR, RMR) si ricava dalle tabelle 4 e 5 della FU; in mancanza, si fa riferimento ai prodotti in commercio * Il preparato officinale in scala ridotta non può superare i g di formulato * Il Farmacista può procedere ad una successiva preparazione della formula officinale purché la scorta non superi comunque i 3 kg. * Il prezzo da applicare è libero e va apposto in etichetta in cifra unica; ci si può ispirare alla tariffa diminuendo l onorario del % * Può essere allestito anticipatamente, richiede la compilazione del foglio di lavorazione (numerato) * Tutti i preparati eseguiti (lotto) devono riportare il numero assegnato al foglio di lavorazione Etichetta prodotto erboristico Non deve in alcun modo: * Riportare indicazioni terapeutiche * Generare nel consumatore l equivoco che si tratti di medicinale 10
11 Etichetta * Farmacia Dr. Bianchi * Via, n - tel * Prep. n. del utilizzare entro * Composizione * Quantità dispensata o numero di dosi forma * Indicazioni d uso * Posologia * Informazioni * Eventuali reazioni avverse * Prezzo Foglio di lavorazione Prep. n. del utilizzare entro il * Il numero di preparazione è il numero attribuito al foglio di lavorazione che va sempre eseguito anche se si tratta di una preparazione singola * La data di preparazione è quella del foglio di lavorazione * La data limite di utilizzazione si calcola seguendo il criterio delle NBP 11
12 Data limite di utilizzazione Formule solide, liquide non acquose o con contenuto alcolico non inferiore al 25% Non oltre il 25% del più breve periodo di validità dei componenti utilizzati e comunque non oltre i sei mesi Tutte le altre formulazioni 30 giorni dalla data di preparazione. Limite riducibile o superabile sulla base di conoscenze specifiche e accorgimenti connessi con la protezione microbica Composizione * Quali quantitativa completa * La quantità dei principi attivi non deve discostarsi più o meno dal 10% del dichiarato (nel caso di capsule dal peso medio) 12
13 Quantità dispensata o numero di dosi forma Questo dato va sempre riportato: * Nel caso delle dosi forma (ad esempio capsule) si riporta il numero * Nel caso di gocce, sciroppi, tisane, ecc. si riporta la quantità contenuta espressa in grammi Indicazioni d uso * Lassativo per coadiuvare le funzioni fisiologiche del transito intestinale * Diuretico per coadiuvare le funzioni fisiologiche dell eliminazione dell acqua * Sedativo per contrastare gli stati di stress * Ipnotico per favorire la funzione fisiologica del sonno * Coleretico per coadiuvare le funzioni fisiologiche digestive favorendo l eliminazione della bile * Dimagrante per coadiuvare un idoneo regime dietetico per la perdita di peso * Antidispeptico - per coadiuvare le funzioni fisiologiche della digestione 13
14 Posologia * 1 3 capsule al giorno, preferibilmente dopo i pasti * 1 cucchiaio tre volte al giorno lontano dai pasti * 40 gocce 10 min prima dei pasti principali * 1 cucchiaio di tisana nel contenuto di una tazza da tè di acqua bollente in recipiente chiuso lasciando in infusione per almeno 5 min; filtrare ed eventualmente dolcificare Informazioni * Conservare lontano da fonti di calore * Conservare al riparo dalla luce * Tenere lontano dalla portata dei bambini * Contiene alcool * Contiene zucchero * Non assumere contemporaneamente a. 14
15 Eventuali reazioni avverse * L uso continuativo può provocare assuefazione. Non usare se sono presenti dolori addominali, nausea o vomito * Non somministrare ai bambini ed in gravidanza * Non superare la dose di.. - sinefrina (arancio amaro) max 30mg/die - ipericina (iperico) max 21mcg/die * Gingko biloba: prima dell uso consultare il medico se si stanno assumendo farmaci anticoagulanti o antiaggreganti piastrinici Prezzo Va obbligatoriamente riportato sul confezionamento e indicato in cifra unica Non si applica la Tariffa Nazionale poiché non si tratta di medicinale Può essere liberamente fissato dalla farmacia in base a: Regole di mercato Raddoppio del prezzo delle materie prime con aggiunta del costo dell eccipiente Tariffare come nel caso di un medicinale riducendo poi l onorario del 30-40% 15
16 Foglio di lavorazione Preparato erboristico gocce Data Quantità totale allestita: ml Sostanze Quantità 1. Fucus TM ml 2. Tarassaco TM ml 3. Betulla TM ml n. Il preparato è stato ripartito in 30 flaconi contagocce da 100 ml Da utilizzare entro sei mesi dalla data di preparazione Firma del preparatore In base alla Nota del Ministero della Salute /AG45.1/4 dell 8 (7) gennaio 2003 in risposta al quesito del SISTE (Società Italiana delle Scienze e delle Tecniche Erboristiche), anche l erborista (o il farmacista) in erboristeria può preparare prodotti venduti sfusi, non preconfezionati o aventi comunque carattere di preparazione estemporanea, secondo quanto già consentito dalle normative vigenti 16
17 cioè autorizzazione a laboratorio alimentare [annesso] ai locali di vendita, (rilasciata dal sindaco, previa ispezione dell ufficio d Igiene pubblica e del territorio), senza la necessità di richiedere al Ministero della Salute l autorizzazione alla produzione di Integratori alimentari (ai sensi del D.Lgs. 21 maggio 2004, n. 169, art. 9) né la necessità di notificare le etichette di tali prodotti al Min. Salute (D.Lgs. 111/92 art. 7 e Circolare Ministero Salute 18 luglio 2002, n. 3). Nota Min. Salute P 19 maggio 2010 ha chiarito che, analogamente alle erboristerie, anche nelle parafarmacie ove siano dotate di laboratorio provvisto dell autorizzazione della ASL per la manipolazione di alimenti (annesso ai locali di vendita n.d.r.) si ritiene applicabile quanto rappresentato per le erboristerie sulla possibilità di effettuare preparazioni estemporanee a base di piante e derivati. 17
18 Sito Ministero della Salute 18
19 Sito Ministero della Salute particolari e integratori&menu=integratori Pagina originale del ministero 19
20 Pagina originale del ministero Estratto dall elenco integrato 20
21 21
22 22
23 23
Corso di Laurea Magistrale in Farmacia
 Universita degli Studi di Milano Corso di Laurea Magistrale in Farmacia Mercato Farmaceutico e Normativa dei Prodotti Salutari - UD: Mercato Farmaceutico Prof. Andrea Gazzaniga PRODOTTI BORDERLINE Dott.ssa
Universita degli Studi di Milano Corso di Laurea Magistrale in Farmacia Mercato Farmaceutico e Normativa dei Prodotti Salutari - UD: Mercato Farmaceutico Prof. Andrea Gazzaniga PRODOTTI BORDERLINE Dott.ssa
Presentazione alla I edizione Prefazione alla II Edizione. Parte prima PARTE GENERALE
 Indice generale Presentazione alla I edizione Prefazione alla I Edizione Prefazione alla II Edizione XI XII XIII Parte prima PARTE GENERALE Capitolo 1: Inquadramento normativo dei prodotti a base di piante
Indice generale Presentazione alla I edizione Prefazione alla I Edizione Prefazione alla II Edizione XI XII XIII Parte prima PARTE GENERALE Capitolo 1: Inquadramento normativo dei prodotti a base di piante
La qualità delle materie prime: implicazioni per il farmacista preparatore
 La qualità delle materie prime: implicazioni per il farmacista preparatore Prof. Paola Minghetti Presidente SIFAP Roma, 17.12.2004, Istituto Superiore di Sanità Cos è la SIFAP? La SIFAP è una associazione
La qualità delle materie prime: implicazioni per il farmacista preparatore Prof. Paola Minghetti Presidente SIFAP Roma, 17.12.2004, Istituto Superiore di Sanità Cos è la SIFAP? La SIFAP è una associazione
Spedizione di una ricetta magistrale Prof. Carmelo Puglia
 Esami di abilitazione alla professione di Farmacista II sessione 2016 Spedizione di una ricetta magistrale Prof. Carmelo Puglia Classificazione amministrativa dei medicinali Art.1. 219/2006 E da considerare
Esami di abilitazione alla professione di Farmacista II sessione 2016 Spedizione di una ricetta magistrale Prof. Carmelo Puglia Classificazione amministrativa dei medicinali Art.1. 219/2006 E da considerare
Prefazione alla I Edizione. Prefazione alla II Edizione. Parte generale
 Indice generale Prefazione alla IV Edizione Prefazione alla III Edizione Prefazione alla II Edizione Prefazione alla I Edizione XIII XV XVII XIX Parte generale Capitolo 1: Inquadramento normativo 3 Norme
Indice generale Prefazione alla IV Edizione Prefazione alla III Edizione Prefazione alla II Edizione Prefazione alla I Edizione XIII XV XVII XIX Parte generale Capitolo 1: Inquadramento normativo 3 Norme
Decreto Ministeriale 18 novembre Procedure di allestimento dei preparati magistrali e officinali.
 Decreto Ministeriale 18 novembre 2003 Procedure di allestimento dei preparati magistrali e officinali. Pubblicato nella Gazzetta Ufficiale 15 gennaio 2004, n. 11 IL MINISTRO DELLA SALUTE Visto l'art. 124
Decreto Ministeriale 18 novembre 2003 Procedure di allestimento dei preparati magistrali e officinali. Pubblicato nella Gazzetta Ufficiale 15 gennaio 2004, n. 11 IL MINISTRO DELLA SALUTE Visto l'art. 124
Integratori alimentari: applicazioni delle normative vigenti dalla progettazione al prodotto finito.
 Integratori alimentari: applicazioni delle normative vigenti dalla progettazione al prodotto finito. Leader nella vendita di materie prime, API e attrezzature per il settore galenico è costituita da 4
Integratori alimentari: applicazioni delle normative vigenti dalla progettazione al prodotto finito. Leader nella vendita di materie prime, API e attrezzature per il settore galenico è costituita da 4
Preparazione officinali e magistrali eseguite in farmacia
 Preparazione officinali e magistrali eseguite in farmacia gli standard qualitativi di riferimento NBP Farmacopea Ufficiale XI ed. DM 18 novembre 2003 (semplificazione) DM 25 settembre 2005 La qualità,
Preparazione officinali e magistrali eseguite in farmacia gli standard qualitativi di riferimento NBP Farmacopea Ufficiale XI ed. DM 18 novembre 2003 (semplificazione) DM 25 settembre 2005 La qualità,
ASPETTI LEGISLATIVI CORRELATI ALLA PERSONALIZZAZIONE DELLE TERAPIE. Prof. Paola Minghetti Facoltà di Farmacia Università degli Studi di Milano
 ASPETTI LEGISLATIVI CORRELATI ALLA PERSONALIZZAZIONE DELLE TERAPIE Prof. Paola Minghetti Facoltà di Farmacia Università degli Studi di Milano PREPARAZIONI IN FARMACIA QUALI POSSIBILITA SI!Medicinali magistrali
ASPETTI LEGISLATIVI CORRELATI ALLA PERSONALIZZAZIONE DELLE TERAPIE Prof. Paola Minghetti Facoltà di Farmacia Università degli Studi di Milano PREPARAZIONI IN FARMACIA QUALI POSSIBILITA SI!Medicinali magistrali
LA RICERCA AL SERVIZIO DELL INNOVAZIONE
 LA RICERCA AL SERVIZIO DELL INNOVAZIONE STATO DI SALUTE MANTENIMENTO ALIMENTAZIONE ATTIVITA FISICA INTEGRAZIONE ALIMENTARE INTEGRATORI ALIMENTARI: DEFINIZIONE: prodotti alimentari destinati ad integrare
LA RICERCA AL SERVIZIO DELL INNOVAZIONE STATO DI SALUTE MANTENIMENTO ALIMENTAZIONE ATTIVITA FISICA INTEGRAZIONE ALIMENTARE INTEGRATORI ALIMENTARI: DEFINIZIONE: prodotti alimentari destinati ad integrare
La canapa come prodotto e come ingrediente secondo il Reg. UE 1169/2011
 Torino, 16 ottobre 2018 La canapa come prodotto e come ingrediente secondo il Reg. UE 1169/2011 Paola Rebufatti Laboratorio Chimico Camera di Commercio Torino SEMI DI CANAPA DECORTICATI Quantità Denominazione
Torino, 16 ottobre 2018 La canapa come prodotto e come ingrediente secondo il Reg. UE 1169/2011 Paola Rebufatti Laboratorio Chimico Camera di Commercio Torino SEMI DI CANAPA DECORTICATI Quantità Denominazione
PREPARAZIONI GALENICHE: PRESCRIZIONE E DISPENSAZIONE
 PREPARAZIONI GALENICHE: PRESCRIZIONE E DISPENSAZIONE Prof.ssa Maria Angela Vandelli - Università di Modena e Reggio Emilia Modena 12 dicembre 2018 TERMINOLOGIA Il termine preparato galenico deriva dal
PREPARAZIONI GALENICHE: PRESCRIZIONE E DISPENSAZIONE Prof.ssa Maria Angela Vandelli - Università di Modena e Reggio Emilia Modena 12 dicembre 2018 TERMINOLOGIA Il termine preparato galenico deriva dal
Radiofarmaci nella pratica clinica e in sperimentazione: indicazioni d uso e aspetti autorizzativi. Dr.ssa Caterina Donati
 1 Radiofarmaci nella pratica clinica e in sperimentazione: indicazioni d uso e aspetti autorizzativi Dr.ssa Caterina Donati 2 L Istituto Scientifico Romagnolo per lo Studio e la Cura dei Tumori (IRST)
1 Radiofarmaci nella pratica clinica e in sperimentazione: indicazioni d uso e aspetti autorizzativi Dr.ssa Caterina Donati 2 L Istituto Scientifico Romagnolo per lo Studio e la Cura dei Tumori (IRST)
La Nutraceutica, gli Alimenti Funzionali e gli Integratori: storia e significato. dott. Antonio Verginelli
 La Nutraceutica, gli Alimenti Funzionali e gli Integratori: storia e significato dott. Antonio Verginelli Quale è il significato di Nutraceutica? Il termine Nutraceutica è stato coniato dal dott. Stephen
La Nutraceutica, gli Alimenti Funzionali e gli Integratori: storia e significato dott. Antonio Verginelli Quale è il significato di Nutraceutica? Il termine Nutraceutica è stato coniato dal dott. Stephen
Il Laboratorio dalla A alla Z
 Il futuro della Farmacia nel nuovo millennio. Dalla ricetta al marketing Il Laboratorio dalla A alla Z Pesaro, 13 maggio 2010, Lucia Carletti La preparazione dei medicinali in Farmacia è l unica l attività
Il futuro della Farmacia nel nuovo millennio. Dalla ricetta al marketing Il Laboratorio dalla A alla Z Pesaro, 13 maggio 2010, Lucia Carletti La preparazione dei medicinali in Farmacia è l unica l attività
Biologia vegetale-farmacognosia. Modulo di Biologia vegetale
 CORSO DI LAUREA MAGISTRALE IN CHIMICA E TECNOLOGIA FARMACEUTICHE Esame integrato di Biologia vegetale-farmacognosia Modulo di Biologia vegetale ORE 21; CREDITI 3 Orario delle lezioni: Lun 9-13 Mer 11-13
CORSO DI LAUREA MAGISTRALE IN CHIMICA E TECNOLOGIA FARMACEUTICHE Esame integrato di Biologia vegetale-farmacognosia Modulo di Biologia vegetale ORE 21; CREDITI 3 Orario delle lezioni: Lun 9-13 Mer 11-13
Corso di Laurea Magistrale in Farmacia
 Universita degli Studi di Milano Corso di Laurea Magistrale in Farmacia INTRODUZIONE al CORSO Tecnologia e Legislazione Farmaceutiche I 9 CFU Prof. Andrea Gazzaniga Raramente si somministrano principi
Universita degli Studi di Milano Corso di Laurea Magistrale in Farmacia INTRODUZIONE al CORSO Tecnologia e Legislazione Farmaceutiche I 9 CFU Prof. Andrea Gazzaniga Raramente si somministrano principi
Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z)
 Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z) Corso di Laurea in Chimica e Tecnologia Farmaceutiche Facoltà di Farmacia e Medicina Anno Accademico 2013/2014 Dott. Giuseppe La Regina Tu,
Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z) Corso di Laurea in Chimica e Tecnologia Farmaceutiche Facoltà di Farmacia e Medicina Anno Accademico 2013/2014 Dott. Giuseppe La Regina Tu,
ETICHETTE ALIMENTARI etichetta carta d identità dei prodotti alimentari confezione
 1 ETICHETTE ALIMENTARI L etichetta costituisce la carta d identità dei prodotti alimentari e rappresenta lo strumento di comunicazione tra produttore e consumatore, permettendo allo stesso tempo un confronto
1 ETICHETTE ALIMENTARI L etichetta costituisce la carta d identità dei prodotti alimentari e rappresenta lo strumento di comunicazione tra produttore e consumatore, permettendo allo stesso tempo un confronto
INTEGRATORI : LEGGERE UN ETICHETTA E COMPRENDERNE IL SIGNIFICATO COME INTEGRARE UN INTEGRATORE ATTRAVERSO UNA PREPARAZIONE GALENICA ORALE E TOPICA
 GIORNATA DI APPROFONDIMENTOIN MEDICINA ANTI-AGING NUTRIGENOMICA FARMACOGENOMICA PER FARMACISTI, BIOLOGI E MEDICI NUTRACEUTICI E FORMULAZIONI GALENICHE ORALI E TOPICHE DALLA LETTURA ALL INTERPRETAZIONEDI
GIORNATA DI APPROFONDIMENTOIN MEDICINA ANTI-AGING NUTRIGENOMICA FARMACOGENOMICA PER FARMACISTI, BIOLOGI E MEDICI NUTRACEUTICI E FORMULAZIONI GALENICHE ORALI E TOPICHE DALLA LETTURA ALL INTERPRETAZIONEDI
Laboratorio Galenico Santa Maria Nuova. Procedura Aziendale Operazione di preparazione. Indice
 PA.DF.07 0 2 di 5 Indice 1. Premessa... 2 2. Scopo/ Obiettivi... 2 3. Campo di applicazione... 2 4. Glossario e Definizioni... 2 5. Responsabilità e descrizione delle attività... 3 6. Diffusione/conservazione/consultazione/archiviazione...
PA.DF.07 0 2 di 5 Indice 1. Premessa... 2 2. Scopo/ Obiettivi... 2 3. Campo di applicazione... 2 4. Glossario e Definizioni... 2 5. Responsabilità e descrizione delle attività... 3 6. Diffusione/conservazione/consultazione/archiviazione...
Indice 1 CENNI SULLA NORMATIVA SOPRANAZIONALE
 Indice 1 CENNI SULLA NORMATIVA SOPRANAZIONALE 1-1 Istituzioni sopranazionali che orientano la politica farmaceutica dei singoli Stati 1 1-2 Disciplina degli stupefacenti promossa dall Organizzazione delle
Indice 1 CENNI SULLA NORMATIVA SOPRANAZIONALE 1-1 Istituzioni sopranazionali che orientano la politica farmaceutica dei singoli Stati 1 1-2 Disciplina degli stupefacenti promossa dall Organizzazione delle
TIPOLOGIE DI MODELLI DI RICETTA
 La ricetta veterinaria Ricetta Veterinaria La prima normativa che regola la materia è del 1992 e prevede la suddivisione degli animali in due categorie: Animali da reddito (DPA) Animali da compagnia (non
La ricetta veterinaria Ricetta Veterinaria La prima normativa che regola la materia è del 1992 e prevede la suddivisione degli animali in due categorie: Animali da reddito (DPA) Animali da compagnia (non
Normativa vigente per integratori alimentari e novel food
 Normativa vigente per integratori alimentari e novel food Roma 23 ottobre 2007 Stefania Dalfrà Bruno Scarpa Ministero della Salute INTEGRATORI ALIMENTARI Ieri Prodotti aggiunti all alimentazione per fornire
Normativa vigente per integratori alimentari e novel food Roma 23 ottobre 2007 Stefania Dalfrà Bruno Scarpa Ministero della Salute INTEGRATORI ALIMENTARI Ieri Prodotti aggiunti all alimentazione per fornire
Indice 1 CENNI SULLA NORMATIVA SOPRANAZIONALE
 Indice 1 CENNI SULLA NORMATIVA SOPRANAZIONALE 1-1 Istituzioni sopranazionali che orientano la politica farmaceutica dei singoli Stati 1 1-2 Disciplina degli stupefacenti promossa dall Organizzazione delle
Indice 1 CENNI SULLA NORMATIVA SOPRANAZIONALE 1-1 Istituzioni sopranazionali che orientano la politica farmaceutica dei singoli Stati 1 1-2 Disciplina degli stupefacenti promossa dall Organizzazione delle
XVII. Indice. Parte 1 Prescrivibilità, concedibilità ed erogazione dei medicinali 1_. Presentazione Prefazione Introduzione
 VII Indice Presentazione Prefazione Introduzione XVII XIX XXI Parte 1 Prescrivibilità, concedibilità ed erogazione dei medicinali 1_ La classificazione normativa dei medicinali ad uso umano 3 1. Definizione
VII Indice Presentazione Prefazione Introduzione XVII XIX XXI Parte 1 Prescrivibilità, concedibilità ed erogazione dei medicinali 1_ La classificazione normativa dei medicinali ad uso umano 3 1. Definizione
Sostanze di derivazione vegetale: ammissibilità come ingredienti alimentari o novel food?
 LE PIANTE: UNA RISERVA INESAURIBILE DI PRINCIPI ATTIVI PER L INDUSTRIA DEI PRODOTTI NATURALI Savigliano, 16 maggio 2016 Sostanze di derivazione vegetale: ammissibilità come ingredienti alimentari o novel
LE PIANTE: UNA RISERVA INESAURIBILE DI PRINCIPI ATTIVI PER L INDUSTRIA DEI PRODOTTI NATURALI Savigliano, 16 maggio 2016 Sostanze di derivazione vegetale: ammissibilità come ingredienti alimentari o novel
Indice generale. Prefazione
 Indice generale Prefazione Autori XI XIII Capitolo 1: Contesto istituzionale e normativo dell Unione Europea 1 1 Trattati e Stati membri 1 2 Le istituzioni dell Unione Europea 3 2.1 Parlamento Europeo
Indice generale Prefazione Autori XI XIII Capitolo 1: Contesto istituzionale e normativo dell Unione Europea 1 1 Trattati e Stati membri 1 2 Le istituzioni dell Unione Europea 3 2.1 Parlamento Europeo
Corso base erboristeria Foce d Amelia PROGRAMMA
 Corso base erboristeria Foce d Amelia PROGRAMMA 2017-2018 BOTANICA ( Docente: Walter Culicelli) Storia della sistematica botanica; L Importanza del riconoscimento delle piante; La coltivazione tecniche,
Corso base erboristeria Foce d Amelia PROGRAMMA 2017-2018 BOTANICA ( Docente: Walter Culicelli) Storia della sistematica botanica; L Importanza del riconoscimento delle piante; La coltivazione tecniche,
TESTN.3. I) Quali sono i medicinali orneopatici che possono essere pubblicizzati. I-i
 3 TESTN.3 o I) Quali sono i medicinali orneopatici che possono essere pubblicizzati a) quelli di produzione nazionale b) quelli di importazione e) nessuno d) quelli in forma di capsule e) quelli per i
3 TESTN.3 o I) Quali sono i medicinali orneopatici che possono essere pubblicizzati a) quelli di produzione nazionale b) quelli di importazione e) nessuno d) quelli in forma di capsule e) quelli per i
LE NORMATIVE NAZIONALI ED EUROPEE INERENTI I GAS MEDICINALI
 LE NORMATIVE NAZIONALI ED EUROPEE INERENTI I GAS MEDICINALI ASPETTI LEGISLATIVI IN FUNZIONE DELLE MODIFICHE APPORTATE DAL DLvo 24 aprile 2006 n 219 Prof.ssa Paola Minghetti GAS DA SOMMINISTRARE ALL UOMO
LE NORMATIVE NAZIONALI ED EUROPEE INERENTI I GAS MEDICINALI ASPETTI LEGISLATIVI IN FUNZIONE DELLE MODIFICHE APPORTATE DAL DLvo 24 aprile 2006 n 219 Prof.ssa Paola Minghetti GAS DA SOMMINISTRARE ALL UOMO
Indice Agenzia Europea per i Medicinali (EMA) Consiglio d Europa Organizzazione Mondiale della Sanità (OMS) 11
 Indice 1 CENNI SULLA NORMATIVA SOPRANAZIONALE 1 1-1 Istituzioni sopranazionali che orientano la politica farmaceutica dei singoli Stati 1 1-2 Disciplina degli stupefacenti promossa dall Organizzazione
Indice 1 CENNI SULLA NORMATIVA SOPRANAZIONALE 1 1-1 Istituzioni sopranazionali che orientano la politica farmaceutica dei singoli Stati 1 1-2 Disciplina degli stupefacenti promossa dall Organizzazione
CONVENZIONE PER LA FORNITURA DI PREPARAZIONI MAGISTRALI A DOSAGGIO PERSONALIZZATO. Tra
 CONVENZIONE PER LA FORNITURA DI PREPARAZIONI MAGISTRALI A DOSAGGIO PERSONALIZZATO Tra L Azienda Sanitaria Locale della provincia di Como, di seguito denominata ASL di Como, con sede in Como, Via Pessina
CONVENZIONE PER LA FORNITURA DI PREPARAZIONI MAGISTRALI A DOSAGGIO PERSONALIZZATO Tra L Azienda Sanitaria Locale della provincia di Como, di seguito denominata ASL di Como, con sede in Como, Via Pessina
Etichettatura del miele. Dr Stefano Nonis - Servizio Veterinario - ASL 20 VR
 Etichettatura del miele Dr Stefano Nonis - Servizio Veterinario - ASL 20 VR Indicazioni obbligatorie in etichetta per il miele 1. La denominazione di vendita miele (o una delle definizioni di cui all art.
Etichettatura del miele Dr Stefano Nonis - Servizio Veterinario - ASL 20 VR Indicazioni obbligatorie in etichetta per il miele 1. La denominazione di vendita miele (o una delle definizioni di cui all art.
L uso del farmaco veterinario in acquacoltura
 L uso del farmaco veterinario in acquacoltura XVI CONVEGNO NAZIONALE S.I.P.I. ORVIETO 27-29 MAGGIO 2010 Dr. Salvatore Macrì Dirigente veterinario Uff. IV Farmaco veterinario Direzione Generale della Sanità
L uso del farmaco veterinario in acquacoltura XVI CONVEGNO NAZIONALE S.I.P.I. ORVIETO 27-29 MAGGIO 2010 Dr. Salvatore Macrì Dirigente veterinario Uff. IV Farmaco veterinario Direzione Generale della Sanità
IL PRESIDENTE DELLA REPUBBLICA
 D.P.R. 10 maggio 1982, n. 514. Attuazione della direttiva (CEE) n. 76/118 relativa a taluni tipi di latte conservato parzialmente o totalmente disidratato destinato all alimentazione umana. (I) (pubbl.
D.P.R. 10 maggio 1982, n. 514. Attuazione della direttiva (CEE) n. 76/118 relativa a taluni tipi di latte conservato parzialmente o totalmente disidratato destinato all alimentazione umana. (I) (pubbl.
Sig. NOME E COGNOME DEL DESTINATARIO DEL TRATTAMENTO (si può inserire al momento della consegna)
 Allegato C: INTESTAZIONE SC FARMACIA E AZIENDA OSPEDALIERA/ASL Protocollo di trattamento: NOME COMMERCIALE DEL MEDICINALE Sig. NOME E COGNOME DEL DESTINATARIO DEL TRATTAMENTO (si può inserire al momento
Allegato C: INTESTAZIONE SC FARMACIA E AZIENDA OSPEDALIERA/ASL Protocollo di trattamento: NOME COMMERCIALE DEL MEDICINALE Sig. NOME E COGNOME DEL DESTINATARIO DEL TRATTAMENTO (si può inserire al momento
D.M. 7 ottobre 1998, n. 519.
 D.M. 7 ottobre 1998, n. 519. Regolamento recante norme concernenti l attuazione della direttiva 96/8/CE della Commissione del 26 febbraio 1996 sugli alimenti destinati a diete ipocaloriche volte alla riduzione
D.M. 7 ottobre 1998, n. 519. Regolamento recante norme concernenti l attuazione della direttiva 96/8/CE della Commissione del 26 febbraio 1996 sugli alimenti destinati a diete ipocaloriche volte alla riduzione
Sicurezza e utilità dei fitoterapici in età pediatrica. Introduce Donatella Del Gaizo
 Sicurezza e utilità dei fitoterapici in età pediatrica Introduce Donatella Del Gaizo Premessa La Fitoterapia è una disciplina scientifica che definisce, con criteri scientifici rigorosi, l utilizzo delle
Sicurezza e utilità dei fitoterapici in età pediatrica Introduce Donatella Del Gaizo Premessa La Fitoterapia è una disciplina scientifica che definisce, con criteri scientifici rigorosi, l utilizzo delle
Normativa. DL 193/2006 Codice europeo dei medicinali veterinari. DL 143\2007 disposizioni correttive ed integrative
 Normativa DL 193/2006 Codice europeo dei medicinali veterinari DL 143\2007 disposizioni correttive ed integrative .DL 119/92 e s. m..dm 306 del 16.05.01.DL 47/97.DL 66/93 e s. m..dl 110/95 Abrogati: DEFINIZIONI
Normativa DL 193/2006 Codice europeo dei medicinali veterinari DL 143\2007 disposizioni correttive ed integrative .DL 119/92 e s. m..dm 306 del 16.05.01.DL 47/97.DL 66/93 e s. m..dl 110/95 Abrogati: DEFINIZIONI
CONTROLLI ETICHETTATURA DEGLI ALIMENTI CHECKLIST
 Pagina 1 di 7 CONTROLLI ETICHETTATURA DEGLI ALIMENTI CHECKLIST Ufficio territoriale di Data incarico Data accertamento Riferimento ai verbali (constatazione, contestazione, sequestro e prelievo) Tipo Numero
Pagina 1 di 7 CONTROLLI ETICHETTATURA DEGLI ALIMENTI CHECKLIST Ufficio territoriale di Data incarico Data accertamento Riferimento ai verbali (constatazione, contestazione, sequestro e prelievo) Tipo Numero
Rete Nazionale di Fitoterapia
 Parma 19-02-2011 Rete Nazionale di Fitoterapia Dr. Carla Ferrari Responsabile FIMP Fitoterapia Regione Emilia-Romagna Premessa La Fitoterapia è una disciplina Medica che definisce, con criteri scientifici
Parma 19-02-2011 Rete Nazionale di Fitoterapia Dr. Carla Ferrari Responsabile FIMP Fitoterapia Regione Emilia-Romagna Premessa La Fitoterapia è una disciplina Medica che definisce, con criteri scientifici
Il benessere attraverso le piante
 Il benessere attraverso le piante Di Elisa Negro Dott.ssa in Tecniche Erboristiche e Naturopata 6 novembre 2017 DISTINZIONE TRA FARMACO E PIANTA OFFICINALE FARMACO è una sostanza o un associazione di sostanze,
Il benessere attraverso le piante Di Elisa Negro Dott.ssa in Tecniche Erboristiche e Naturopata 6 novembre 2017 DISTINZIONE TRA FARMACO E PIANTA OFFICINALE FARMACO è una sostanza o un associazione di sostanze,
Formulazione e legislazione di prodotti salutari
 Corso di laurea in SCIENZE E TECNOLOGIE ERBORISTICHE Formulazione e legislazione di prodotti salutari (5 CFU frontali + 1 CFU esercitazioni di laboratorio a posto singolo obbligatorie) Propedeuticità:
Corso di laurea in SCIENZE E TECNOLOGIE ERBORISTICHE Formulazione e legislazione di prodotti salutari (5 CFU frontali + 1 CFU esercitazioni di laboratorio a posto singolo obbligatorie) Propedeuticità:
ALIMENTI A FINI MEDICI SPECIALI VS INTEGRATORI ALIMENTARI Prodotti borderline
 ALIMENTI A FINI MEDICI SPECIALI VS INTEGRATORI ALIMENTARI Prodotti borderline Bologna, 9 settembre 2016 Avv. Neva Monari Avvocati per l Impresa DEFINIZIONI alimento a fini medici speciali (AFMS): un prodotto
ALIMENTI A FINI MEDICI SPECIALI VS INTEGRATORI ALIMENTARI Prodotti borderline Bologna, 9 settembre 2016 Avv. Neva Monari Avvocati per l Impresa DEFINIZIONI alimento a fini medici speciali (AFMS): un prodotto
La gestione normativa dei medicinali
 Franco F. Vincieri Carlo Cirinei Daniela Cervini La gestione normativa dei medicinali Compendio di legislazione e socioeconomia farmaceutiche Quarta edizione aggiornata 2006 II Pensiero Scientifico Editore
Franco F. Vincieri Carlo Cirinei Daniela Cervini La gestione normativa dei medicinali Compendio di legislazione e socioeconomia farmaceutiche Quarta edizione aggiornata 2006 II Pensiero Scientifico Editore
Buon giorno a tutti. Ben trovati
 Buon giorno a tutti Ben trovati Gilda Zammillo Resp. Mod. Organizzativo Vigilanza Farmacie ADEMPIMENTI PRESCRITTIVI DEL MEDICO VETERINARIO ATTIVITA DI CONTROLLO DA PARTE DEL SERVIZIO FARMACEUTICO Gilda
Buon giorno a tutti Ben trovati Gilda Zammillo Resp. Mod. Organizzativo Vigilanza Farmacie ADEMPIMENTI PRESCRITTIVI DEL MEDICO VETERINARIO ATTIVITA DI CONTROLLO DA PARTE DEL SERVIZIO FARMACEUTICO Gilda
Gazzetta Ufficiale N. 223 del 24 Settembre 2005
 Gazzetta Ufficiale N. 223 del 24 Settembre 2005 MINISTERO DELLA SALUTE DECRETO 9 agosto 2005, n.199 Regolamento recante recepimento della direttiva 2003/115/CE che modifica la direttiva 94/35/CE sugli
Gazzetta Ufficiale N. 223 del 24 Settembre 2005 MINISTERO DELLA SALUTE DECRETO 9 agosto 2005, n.199 Regolamento recante recepimento della direttiva 2003/115/CE che modifica la direttiva 94/35/CE sugli
TITOLO III Immissione in commercio
 TITOLO III Immissione in commercio Art.6 (Estensione ed effetti dell autorizzazione) 1. Nessun medicinale può essere immesso in commercio sul territorio nazionale senza aver ottenuto un'autorizzazione
TITOLO III Immissione in commercio Art.6 (Estensione ed effetti dell autorizzazione) 1. Nessun medicinale può essere immesso in commercio sul territorio nazionale senza aver ottenuto un'autorizzazione
PRODOTTI DIETETICI: INQUADRAMENTO NORMATIVO E INTERFACCIA CON I NOVEL FOOD
 Roma, 13 settembre 2011 PRODOTTI DIETETICI: INQUADRAMENTO NORMATIVO E INTERFACCIA CON I NOVEL FOOD Bruno Scarpa Ministero della salute DSPVNSA Direzione generale sicurezza alimenti e nutrizione Ufficio
Roma, 13 settembre 2011 PRODOTTI DIETETICI: INQUADRAMENTO NORMATIVO E INTERFACCIA CON I NOVEL FOOD Bruno Scarpa Ministero della salute DSPVNSA Direzione generale sicurezza alimenti e nutrizione Ufficio
Foglio illustrativo: informazioni per il paziente. Indusil 30 mg polvere e solvente per soluzione orale. Cobamamide
 Foglio illustrativo: informazioni per il paziente Indusil 30 mg polvere e solvente per soluzione orale Cobamamide Legga attentamente questo foglio prima di prendere questo medicinale perchè contiene importanti
Foglio illustrativo: informazioni per il paziente Indusil 30 mg polvere e solvente per soluzione orale Cobamamide Legga attentamente questo foglio prima di prendere questo medicinale perchè contiene importanti
LE PROCEDURE INFORMATICHE PER LA GESTIONE DEL PROCESSO TERAPEUTICO IN ONCOLOGIA
 La Rete delle Farmacie Oncologiche della Regione Emilia Romagna I Corso regionale per Farmacisti e Tecnici di Laboratorio dell'area Oncologica Bologna, 20-21 ottobre 2009 LE PROCEDURE INFORMATICHE PER
La Rete delle Farmacie Oncologiche della Regione Emilia Romagna I Corso regionale per Farmacisti e Tecnici di Laboratorio dell'area Oncologica Bologna, 20-21 ottobre 2009 LE PROCEDURE INFORMATICHE PER
MEDICINALI INCLUSI NELLE TABELLE I,II E III DEL D.P.R. 309/90
 MODALITÀ DI ACQUISTO, CUSTODIA, PRESCRIZIONE E SPEDIZIONE DI MEDICINALI E DI SOSTANZE VELENOSE MEDICINALI INCLUSI NELLE TABELLE I,II E III DEL D.P.R. 309/90 Mediante buoni acquisto di modello ministeriale.
MODALITÀ DI ACQUISTO, CUSTODIA, PRESCRIZIONE E SPEDIZIONE DI MEDICINALI E DI SOSTANZE VELENOSE MEDICINALI INCLUSI NELLE TABELLE I,II E III DEL D.P.R. 309/90 Mediante buoni acquisto di modello ministeriale.
Prescrivibilità e Rimborsabilità dei Farmaci
 Prescrivibilità e Rimborsabilità dei Farmaci PRESCRIZIONE Per quanto riguarda la prescrizione, i medicinali si suddividono in cinque categorie: Medicinali senza obbligo di ricetta medica Medicinali soggetti
Prescrivibilità e Rimborsabilità dei Farmaci PRESCRIZIONE Per quanto riguarda la prescrizione, i medicinali si suddividono in cinque categorie: Medicinali senza obbligo di ricetta medica Medicinali soggetti
FARMACOGNOSIA E FITOTERAPIA
 FARMACOGNOSIA E FITOTERAPIA REGOLAMENTAZIONE Gabriela Mazzanti PREPARATI TOTALI Prodotti erboristici Fitoterapici Integratori alimentari Dispositivi medici Alimenti funzionali Nutraceutici Novelfood 1
FARMACOGNOSIA E FITOTERAPIA REGOLAMENTAZIONE Gabriela Mazzanti PREPARATI TOTALI Prodotti erboristici Fitoterapici Integratori alimentari Dispositivi medici Alimenti funzionali Nutraceutici Novelfood 1
MINISTERO DELLA SALUTE IL MINISTRO DELLA SALUTE
 Allegato n. 1 MINISTERO DELLA SALUTE IL MINISTRO DELLA SALUTE Visto l art. 124 del Testo Unico delle Leggi Sanitarie approvato con regio decreto 27 luglio 1934, n. 1265, modificato dalla legge 7 novembre
Allegato n. 1 MINISTERO DELLA SALUTE IL MINISTRO DELLA SALUTE Visto l art. 124 del Testo Unico delle Leggi Sanitarie approvato con regio decreto 27 luglio 1934, n. 1265, modificato dalla legge 7 novembre
Norme di Buona Preparazione. DM 18/11/2003.
 Norme di Buona Preparazione. DM 18/11/2003. Il Decreto del Ministro della Salute 18 novembre 2003 stabilisce procedure ed adempimenti semplificati per le farmacie che eseguono preparati officinali non
Norme di Buona Preparazione. DM 18/11/2003. Il Decreto del Ministro della Salute 18 novembre 2003 stabilisce procedure ed adempimenti semplificati per le farmacie che eseguono preparati officinali non
ETICHETTATURA PRODOTTI ALIMENTARI per i prodotti da agricoltura biologica
 INDICE Argomento Reg. (CE) n. 834/2007 Reg. (CE) n. 889/2008 Reg. (CE) n. 967/2008 Uso di termini riferiti alla produzione biologica Art. 23 Art. 27 Indicazioni obbligatorie Art. 24 Art. 31; Art. 58; Art.
INDICE Argomento Reg. (CE) n. 834/2007 Reg. (CE) n. 889/2008 Reg. (CE) n. 967/2008 Uso di termini riferiti alla produzione biologica Art. 23 Art. 27 Indicazioni obbligatorie Art. 24 Art. 31; Art. 58; Art.
Decreto Legislativo 219/2006 modificato dal D.Lgs.29 dicembre 2007, n.274
 Decreto Legislativo 219/2006 modificato dal D.Lgs.29 dicembre 2007, n.274 Attuazione della direttiva 2001/83/CE (e successive direttive di modifica) relativa ad un codice comunitario concernente i medicinali
Decreto Legislativo 219/2006 modificato dal D.Lgs.29 dicembre 2007, n.274 Attuazione della direttiva 2001/83/CE (e successive direttive di modifica) relativa ad un codice comunitario concernente i medicinali
Alimenti. Prodotti cosmetici
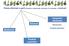 Piante officinali o parti (fresche o essiccate, da sole o in miscela) e derivati Alimenti Integratori alimentari Nutraceutici Medicinali Prodotti erboristici Prodotti cosmetici Integratori alimentari:
Piante officinali o parti (fresche o essiccate, da sole o in miscela) e derivati Alimenti Integratori alimentari Nutraceutici Medicinali Prodotti erboristici Prodotti cosmetici Integratori alimentari:
Titolo V. Etichettatura e foglio illustrativo
 Titolo V Etichettatura e foglio illustrativo aa) dosaggio del medicinale: il contenuto in sostanza attiva espresso, a seconda della forma farmaceutica, in quantità per unità posologica, per unità di volume
Titolo V Etichettatura e foglio illustrativo aa) dosaggio del medicinale: il contenuto in sostanza attiva espresso, a seconda della forma farmaceutica, in quantità per unità posologica, per unità di volume
Etichettatura dell Olio Extra Vergine di Oliva
 Etichettatura dell Olio Extra Vergine di Oliva PRESCRIZIONI GENERALI INDICAZIONI OBBLIGATORIE OLIO EXTRA VERGINE DI OLIVA (1) mediante procedimenti meccanici (2) ITALIANO oppure TOSCANO IGP oppure SEGGIANO
Etichettatura dell Olio Extra Vergine di Oliva PRESCRIZIONI GENERALI INDICAZIONI OBBLIGATORIE OLIO EXTRA VERGINE DI OLIVA (1) mediante procedimenti meccanici (2) ITALIANO oppure TOSCANO IGP oppure SEGGIANO
Il medicinale omeopatico
 Il medicinale omeopatico L OMEOPATIA IN ITALIA NORMATIVA I PRODOTTI OMEOPATICI in Italia sono regolamentati dal DL. 185/95 che li definisce MEDICINALI E quindi vendibili unicamente in farmacia L UTILIZZO
Il medicinale omeopatico L OMEOPATIA IN ITALIA NORMATIVA I PRODOTTI OMEOPATICI in Italia sono regolamentati dal DL. 185/95 che li definisce MEDICINALI E quindi vendibili unicamente in farmacia L UTILIZZO
PREPARAZIONI A BASE DI PIANTE
 PREPARAZIONI A BASE DI PIANTE Preparati erboristici (Prodotti a base di ingredienti vegetali preparati nelle farmacie e nelle erboristerie) Qualora preparati, confezionati e destinati alla cessione ai
PREPARAZIONI A BASE DI PIANTE Preparati erboristici (Prodotti a base di ingredienti vegetali preparati nelle farmacie e nelle erboristerie) Qualora preparati, confezionati e destinati alla cessione ai
AIFA Agenzia Italiana Del Farmaco Nota Informnativa Importante su Tachipirina e Medicinali Contenenti Paracetamolo da Solo e/o in Associazione
 AIFA - Tachipirina e Paracetamolo 20/01/2010 (Livello 2) AIFA Agenzia Italiana Del Farmaco Nota Informnativa Importante su Tachipirina e Medicinali Contenenti Paracetamolo da Solo e/o in Associazione Nota
AIFA - Tachipirina e Paracetamolo 20/01/2010 (Livello 2) AIFA Agenzia Italiana Del Farmaco Nota Informnativa Importante su Tachipirina e Medicinali Contenenti Paracetamolo da Solo e/o in Associazione Nota
