Composti Carbonilici
|
|
|
- Antonio Mori
- 9 anni fa
- Visualizzazioni
Transcript
1 omposti arbonilici 1
2 Introduzione Due grandi classi di composti contengono il gruppo carbonilico: 1. omposti che hanno solo atomi di carbonio e di idrogeno legati al carbonile: aldeidi e chetoni. aldeidi ' chetoni 2. omposti che contengono un atomo elettronegativo legato al carbonile: acidi e derivati. acidi l cloruri acidi anidridi ' ' esteri N ammidi 2
3 Il gruppo carbonilico Il gruppo carbonilico consiste di: un legame σ formato da sovrapposizione di orbitali ibridi sp 2 un legame π formato da sovrapposizione di orbitali 2p. Il legame = è polarizzato verso l atomo più elettronegativo, rendendo il carbonio elettron deficiente. Usando la descrizione della risonanza il carbonile ha due forme di risonanza. contributo maggiore contributo minore δ+ δ- ibrido carbonile polarizzato 3
4 Aldeidi e hetoni 4
5 Molecole che contengono il gruppo carbonilico 3 geraniale (E)-3,7-dimetil-2,6-ottadienale aldeide cinnamica trans-3-fenil-2-propenale vanillina 4-idrossi-3-metossibenzaldeide testosterone progesterone canfora 5
6 Nomenclatura aldeidi A. IUPA 1. generale: alcanale (carbonio aldeidico #1) 2. aldeidi cicliche: cicloalcancarbossaldeide 3. priorità: aldeide > chetone > alcool B. Nomi comuni Usare il prefisso del nome comune dell acido che si forma per ossidazione, facendolo seguire da aldeide. 1 : acido formico, formaldeide 2 : acido acetico, acetaldeide 3 : acido propionico, propionaldeide 4 : acido butirrico, butirraldeide. In una molecola contenente un gruppo funzionale a priorità maggiore, = è osso- e è formile. Aldeide priorità maggiore del chetone. 6
7 A. IUPA 1. generale: alcanone (carbonio carbonilico # più basso) 2. priorità: aldeide > chetone > alcool B. Nomi comuni Nomenclatura chetoni alchil alchil chetone (dagli alchili legati a =) chetoni aromatici: fenoni fenone acetofenone propiofenone benzofenone 7
8 Proprietà Fisiche Proprietà p. eb. e p.f. omposti con PM paragonabile: i p. eb. e p.f. seguono il solito trend. Maggiori le forze intermolecolari, maggiore il p.eb o il p.f PM 72 p.eb. 36 PM 72 p.eb. 70 PM 74 p.eb. 118 VDW VDW, DD VDW, DD, B PM 72 p.eb. 80 forze intermolecolari crescenti p. eb. crescente Solubilità e solubili in solventi organici e con <5 sono solubili in acqua e con >5 sono insolubili in acqua VDW = van der Waals, DD = dipolo-dipolo, B = legame idrogeno 8
9 Formaldeide Gas a t.a. Formalina è una soluzione acquosa al 40%. triossano p.f. 62 calore formaldeide p.eb formalina Esiste anche un polimero lineare della formaldeide che si chiama paraformaldeide. 9
10 Preparazione di aldeidi e chetoni Aldeidi ssidazione di alcoli 1 con P iduzione di esteri e nitrili con DIBAL- e cloruri di acidi con LiAl[( 3 ) 3 ] 3 Idratazione di alchini terminali per idroborazioneossidazione hetoni ssidazione di alcoli 2 con reagenti di r 6+ eazione di cloruri di acidi con organocuprati Acilazione di F.. Idratazione di alchini interni per idroborazione-ossidazione 10
11 Preparazione di aldeidi e chetoni iduzione di esteri e nitrili con DIBAL- e cloruri di acidi con LiAl[( 3 ) 3 ] 3. Li + Bu t Al Bu t Bu t Al Litio tri-tert-butilossialluminio idruro Diisobutilalluminio idruro Essi sono meno reattivi di LA, in parte perché stericamente ingombrati. l ' - N 1) LiAl(Bu t ) 3, etere, -78 2) 2 1) DIBAL-, esano, -78 2) 2 1) DIBAL-, esano 2) 2 11
12 iduzione di esteri e nitrili e cloruri di acidi Meccanismo: l Al((Me 3 ) 3 l Al[Bu t ] 3 Al[Bu t ] 3 l l Al[Bu t ] 3 2 ' AlBu i 2 AlBu i 2 ' AlBu i 2 ' AlBu i N AlBu i 2 N AlBu i 2 N AlBu i
13 eattività di aldeidi e chetoni basico 1. Formazione di legami 2. Protonazione δ+ δ- elettrofilo ADDIZINE NULEFILA Nucleofili dell Nucleofili dell N Nucleofili del Nucleofili dell 3. Addizione di 2 (idratazione) 4. Addizione di alcoli 5. Addizione-eliminazione di N 3 e derivati G-N 2 6. Addizione ioni N 7. Addizione di organometallici 8. Addizione di idruro 9. iduzione catalitica ad alcoli 10. iduzione = a ssidazione di a 13
14 eattività di aldeidi e chetoni Le aldeidi sono più reattive dei chetoni verso i nucleofili per ragioni steriche e elettroniche. aldeidi chetoni : : ingombro sterico minore δ- : : δ+ un solo stabilizza la carica + : : ingombro sterico maggiore δ- : : δ+ due stabilizzano la carica + meno elettrofilo 14
15 Addizione Nucleofila I carbonili reagiscono con i nucleofili carichi (:Nu ) o neutri (:Nu). Se neutri, hanno un legato (:Nu ). La presenza o assenza di un gruppo uscente sul carbonile determina il tipo di reazione. 1. Aldeidi e chetoni subiscono addizione nucleofila. (') :Nu 2. I composti carbonilici che contengono un gruppo uscente subiscono sostituzione nucleofila. Z (') Nu intermedio tetraedrico 2 (') Nu Nu e + si addizionano Nu sostituisce Z :Nu Questa reazione è Z chiamata sostituzione Z Nu Nu nucleofila acilica: intermedio tetraedrico - era legato a Z ora è legato a Nu. Z = l,,,, N 2, N, N 2 15
16 Addizione Nucleofila ad Aldeidi e hetoni Quali Nu si addizionano al carbonile? l, Br e I sono buoni nucleofili nelle sostituzioni al saturo ma sono inefficaci nelle reazioni al insaturo. Quando essi si addizionano a un carbonile, si forma un alcossido. Dato che X è una base molto più debole dell alcossido, l equilibrio è spostato verso i reagenti. base forte l base debole l alcossido 16
17 Addizione Nucleofila ad Aldeidi e hetoni Meccanismo: + Nu Nu intermedio tetraedrico Nu on alcuni nucleofili neutri l addizione ha luogo solo con catalisi acida. + + Nu Nu intermedio tetraedrico Nu 17
18 3. Addizione di 2 Idratazione Per trattamento di un aldeide o chetone con 2 in presenza di un acido o una base si ha addizione di e sul legame π =, generando un 1,1-diolo, gem-diolo o idrato. (') + o (') La resa in gem-dioli è buona solo con aldeidi non ingombrate o con aldeidi con gruppi elettron attrattori. Gruppi elettron attrattori destabilizzano il carbonile favorendo la forma idrata. 2 l 3 2 l 3 18
19 3. Addizione di 2 Idratazione Sia l acido che la base catalizzano l addizione di 2 al carbonile. 1. In base, il nucleofilo è, più forte di 2. intermedio tetraedrico 2. In ambiente acido la protonazione dell ossigeno del carbonile rende più elettrofilo il carbonio intermedio tetraedrico
20 3. Addizione di 2 Idratazione Aumentando il numero di alchili (elettron donatori) sul carbonio carbonilico, diminuisce la quantità di forma idrata. numero di crescente stabilità crescente del carbonile formaldeide 2 3 acetaldeide acetone % 58% 0.2% quantità di forma idrata crescente 20
21 4. Addizione di Alcoli: Formazione di Acetali Aldeidi e chetoni reagiscono con 2 equivalenti di alcool per dare acetali. La formazione di acetali è catalizzata da acidi come Ts (acido p- toluensolfonico). ' Quando si usa un diolo si forma un acetale ciclico etilenglicol '' '' 2 ' acetale Ts gli acetali non sono eteri + 2 La sintesi di acetali è reversibile. Per favorirne la formazione si rimuove l acqua. 21
22 4. Addizione di Alcoli: Formazione di Acetali Meccanismo: 1) Attacco nucleofilo al carbonile catalizzato da acido (1 eq di alcool) 2) S N 1 A (1 eq di alcool): " emiacetale ' - ' ' " " 2 ' ' " " ' " " emiacetale gen. instabile " ' - " ' " " acetale ' 22
23 4. Addizione di Alcoli: Formazione di Acetali Esempi 3 3 3, cicloesanone dimetil acetale Et Et, Et benzaldeide dietil acetale + 2-pentanone etilene acetale + 23
24 Acetali come gruppi proteggenti Br? Br protezione del carbonile + 1) Na 2) 2 Br l addizione al carbonile è più veloce della S N 2 Br Na + 3 non reattivo con nucleofili deprotezione 24
25 Acetali come gruppi proteggenti? Br Mg incompatibili Br MgBr + Mg 1) Br MgBr 2)
26 4a. Emiacetali ciclici Emiacetali ciclici a 5 e 6 termini sono composti stabili isolabili. legato a: un un emiacetale 5-idrossipentanale 4-idrossibutanale = = Sono reazioni intramolecolari, molto più veloci di quelle intermolecolari: i gruppi reattivi e = sono spazialmente vicini. 6% 94% 11% 89% legati a: un un con parte dell anello 26
27 5. Addizione Nucleofila di Il trattamento di un aldeide o chetone con un organometallico (Li, Na, MgX, ZnX), seguito da acqua produce un alcool 1, 2, 3. Il nucleofilo è. (') MgX o Li 2 (') '' Il meccanismo è a due stadi. Li Li + + Li attacco nucleofilo intermedio tetraedrico protonazione (ac. debole) 27
28 6. Addizione Nucleofila di N Il trattamento di un aldeide o un chetone con NaN e un acido forte come l addiziona N sul carbonile generando una cianidrina. Il meccanismo è il solito. NaN + 2 S 4 N (') attacco nucleofilo La reazione è reversibile in ambiente basico. N intermedio tetraedrico (') N protonazione (') N cianidrina + N Keq > 100 aldeidi e chetoni ciclici Keq < 0.02 chetoni lineari (') N (') N (') + N 28
29 ianidrine come Intermedi di Sintesi Il ciano gruppo di una cianidrina può venir idrolizzato a gruppo carbossilico per riscaldamento con un acido o una base acquosi o può essere ridotto ad ammino gruppo (con un atomo di in più). ' N 2 + o ' α-idrossiacido riduzione ' 1) LiAl 4 2) N 2 β-amminoalcool 29
30 La eazione di Wittig La reazione di Wittig usa un carbonio nucleofilo (il reagente di Wittig) per formare alcheni. Il gruppo = viene trasformato in =. (') Ph 3 P (') + Ph 3 P= Formazione dell ilide: Nel primo stadio si forma il sale di fosfonio. Nel secondo stadio una base forte rimuove un protone dando l ilide. Ph 3 P: + 3 Br ilide del fosforo S N 2 Bu Li Ph 3 P 2 Bu metiltrifenilfosfonio bromuro alchene Ph 3 P 2 Ph 3 P ilide carbonio nucleofilo Ilide: una molecola che, scritta nella struttura di Lewis, ha una carica positiva e una negativa su atomi adiacenti. 2 30
31 La eazione di Wittig La reazione di Wittig è una addizione-eliminazione. ' 2 PPh 3 + PPh 3 2 ' betaina PPh 3 2 ' ossafosfetano 2 ' + =PPh 3 trifenilfosfina ossido La formazione del doppio legame P=, molto forte, è la driving force per la reazione di Wittig Quando il carbonio dell ilide è sostituito si ottiene una miscela di alcheni. 31
32 7. Addizione Nucleofila di Idruro iduzione di = a Fonti di idruro sono sodio boridruro NaB 4 (in acqua o alcool) o litio alluminio idruro LiAl 4 (in etere anidro). Na non va bene perché è un Nu debole. Segue la protonazione che produce un alcool 1 o 2. Il nucleofilo è : Meccanismo: Li + Na + 3 Al 3 B (') attacco nucleofilo NaB 4 LiAl 4 intermedio tetraedrico B 3 Na + Al 3 Li + 2 (') B Na + Al Li + 4 protonazione 32 + Li
33 iduzione di = a 2 1. iduzione di lemmensen: condizioni acide: Zn(g), l conc., riscaldamento. ' Zn(g), l Et, iduzione di Wolff-Kishner: condizioni basiche. (') N 2 N 2 1) Na, 2, N 2 (') N 2) (') idrazone 3. Desolforazione di tiochetali (idrogenolisi): condizioni neutre S S BF 3, etere S S Ni aney Et 33
34 Meccanismo della Wolff-Kishner (') N N (') N N (') N N 2 si protona il -, più basico di N - (') 2 (') N 2 lento (') N N (') N N carbanione 34
35 8. Addizione Nucleofila di Ammine e Derivati 2 G-N 2 2 N G N 2 N immine enammine G =,,, N 2, N 6 3 (N 2 ) 2, NN 2 35
36 Meccanismo Formazione di Immine È simile all addizione di alcoli: 2 La formazione dell immina è più veloce quando il mezzo è debolmente acido (p 4-5). + + N + 2 G NG carbinolammina G N 2 instabile G N 2 stereoisomeria geometrica! G + N NG 2 addizione nucleofila disidratazione G =,, Ar,, N 2, N 6 3 (N 2 ) 2, NN 2 36
37 Meccanismo Formazione di Enammine La prima parte, addizione nucleofila, è uguale: 2 La formazione dell enammina è più veloce quando il mezzo è debolmente acido (p 4-5). + + N N2 addizione nucleofila carbinolammina 2 N + + N N 2 + N 2 disidratazione 2 2 enammina ione immonio 37
38 Formazione di Immine G =,, Ar omposto carbonilico G N 2 Immina N + N 2 + cicloesilimmina N 3 N-metilimmina + 3 N + del 2-pentanone 2 + N 2 + N N-fenilimmina della benzaldeide 38
39 omposto carbonilico Formazione di Immine G = N 2, N 6 3 (N 2 ) 2, NN 2 G N 2 Immina N acetone ossima + N + 2 acetone idrossilammina + 2 N N 2 + idrazina NN 2 acetone idrazone NN N N 2 2,4-dinitrofenilidrazina + 2 N NN N 2 acetone 2,4- dinitrofenilidrazone 2,4-DNP + 2 N NN 2 semicarbazide + 2 N NN acetone semicarbazone 39
40 ssidazione delle aldeidi [] [] = r VI Mn VII r 3 KMn 4 Ag 2 /N 3 2 K 2 r 2 7 r Alcune aldeidi sono ossidate facilmente: Ag 2 N 4, 2, Et 2 aria 40
41 ssidazione dei chetoni I chetoni sono inerti alla maggior parte degli agenti ossidanti. Subiscono lenta rottura in soluzione bollente alcalina di KMn KMn 4, 2, Na eazione di Bayer-Villiger: ' protonazione chetone " + ' ' + migra con ritenzione di configurazione attitudine migratoria: 3 > 2 > 1 > 3 41
42 ssidazione dei chetoni di J. Baeyer-Villiger Esempi 3 3 non
Addizioni nucleofile. Addizioni a C=O
 Addizioni nucleofile Addizioni a C= Substrato Un composto che possiede un atomo di carbonio elettron-deficiente legato con un legame π (che si possa rompere facilmente) ad un atomo più elettronegativo
Addizioni nucleofile Addizioni a C= Substrato Un composto che possiede un atomo di carbonio elettron-deficiente legato con un legame π (che si possa rompere facilmente) ad un atomo più elettronegativo
Lezione: aldeidi e chetoni
 Lezione: aldeidi e chetoni Il gruppo funzionale carbonilico Nomenclatura Proprietà fisiche Principali reazioni eazioni con N eazioni con alcoli eazioni con tioli eazioni con ammine Tautomeria cheto-enolica
Lezione: aldeidi e chetoni Il gruppo funzionale carbonilico Nomenclatura Proprietà fisiche Principali reazioni eazioni con N eazioni con alcoli eazioni con tioli eazioni con ammine Tautomeria cheto-enolica
Reazioni degli epossidi
 12-04-2016 Reazioni degli epossidi Apertura dell anello acido-catalizzata, esempi Struttura intermedio: 3 forme limiti di risonanza H H a a O O b b H O CH 3 CH 3 CH 3 H H H H Struttura ibrido intermedio
12-04-2016 Reazioni degli epossidi Apertura dell anello acido-catalizzata, esempi Struttura intermedio: 3 forme limiti di risonanza H H a a O O b b H O CH 3 CH 3 CH 3 H H H H Struttura ibrido intermedio
Aldeidi e Chetoni. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Aldeidi e Chetoni Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Aldeidi e Chetoni Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Composti Carbossilici. Reattività
 omposti arbossilici eattività omposti carbossilici N ' ' Ammide N' 2 Estere ' ' Anidride () 2 X Alogenuro acilico X I composti carbossilici hanno la caratteristica comune di possedere un gruppo carbonilico
omposti arbossilici eattività omposti carbossilici N ' ' Ammide N' 2 Estere ' ' Anidride () 2 X Alogenuro acilico X I composti carbossilici hanno la caratteristica comune di possedere un gruppo carbonilico
Unità Didattica 10. I composti carbonilici. Struttura, nomenclatura e reattività
 I composti caratterizzati dal gruppo carbonilico sono le aldeidi ed i chetoni Il gruppo funzionale è il doppio legame C=O Il carbonile ha geometria planare (il carbonio è sp 2 ) Unità Didattica 10 I composti
I composti caratterizzati dal gruppo carbonilico sono le aldeidi ed i chetoni Il gruppo funzionale è il doppio legame C=O Il carbonile ha geometria planare (il carbonio è sp 2 ) Unità Didattica 10 I composti
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI
 REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
Aldeidi e chetoni. Struttura e proprietà Nomenclatura e nomi comuni Fonti Reazioni Principali aldeidi e chetoni
 Aldeidi e chetoni Struttura e proprietà Nomenclatura e nomi comuni Fonti Reazioni Principali aldeidi e chetoni Aldeidi e chetoni Aldeidi e chetoni Aldeidi e chetoni Il legame = è costituito da un legame
Aldeidi e chetoni Struttura e proprietà Nomenclatura e nomi comuni Fonti Reazioni Principali aldeidi e chetoni Aldeidi e chetoni Aldeidi e chetoni Aldeidi e chetoni Il legame = è costituito da un legame
Sostituzione nucleofila Addizione a gruppi carbonilici Addizione a doppi legami attivati
 himica rganica II Sintesi di legami - Nella costruzione di molecole organiche complesse, gli stadi critici sono spesso quelli che comportano la formazione di legami carboni- carbonio. I legami - possono
himica rganica II Sintesi di legami - Nella costruzione di molecole organiche complesse, gli stadi critici sono spesso quelli che comportano la formazione di legami carboni- carbonio. I legami - possono
CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1
 CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1 ACIDITÀ Ragionare sulla base coniugata: quanto più la base coniugata è stabilizzata (è debole) tanto più l'acido sarà forte. ASPETTI CHE DETERMINANO LA STABILITA
CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1 ACIDITÀ Ragionare sulla base coniugata: quanto più la base coniugata è stabilizzata (è debole) tanto più l'acido sarà forte. ASPETTI CHE DETERMINANO LA STABILITA
Esteri degli acidi carbossilici
 Esteri degli acidi carbossilici Sono sostanze neutre facilmente idrolizzabili in ambiente acido e basico. Stato fisico Il punto di fusione degli esteri è inferiore a quello degli acidi aventi uguale P.M.
Esteri degli acidi carbossilici Sono sostanze neutre facilmente idrolizzabili in ambiente acido e basico. Stato fisico Il punto di fusione degli esteri è inferiore a quello degli acidi aventi uguale P.M.
G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 L addizione coniugata In un sistema carbonilico α,β-insaturo dove avverà l attacco di un nucleofilo? Al carbonio carbonilico o al doppio legame? Il sistema ha due centri elettrofili: il carbonio carbonilico
L addizione coniugata In un sistema carbonilico α,β-insaturo dove avverà l attacco di un nucleofilo? Al carbonio carbonilico o al doppio legame? Il sistema ha due centri elettrofili: il carbonio carbonilico
Reattività degli acidi carbossilici e loro derivati. La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica
 Reattività degli acidi carbossilici e loro derivati La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica δ - δ + Nu - Y Il carbonio carbonilico è elettrofilo, in grado di
Reattività degli acidi carbossilici e loro derivati La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica δ - δ + Nu - Y Il carbonio carbonilico è elettrofilo, in grado di
Acidi carbossilici e derivati
 Acidi carbossilici e derivati Acidi carbossilici Il gruppo funzionale di questa classe di sostanze è il carbossile: Il gruppo carbossilico è composto formalmente da un gruppo carbonilico legato ad un gruppo
Acidi carbossilici e derivati Acidi carbossilici Il gruppo funzionale di questa classe di sostanze è il carbossile: Il gruppo carbossilico è composto formalmente da un gruppo carbonilico legato ad un gruppo
Composti carbonilici: reazioni al carbonio in posizione a
 Composti carbonilici: reazioni al carbonio in posizione a Addizione nucleofila a composti carbonilici a,b-insaturi Nelle molecole contenenti carbonili coniugati con doppi legami sono presenti due siti
Composti carbonilici: reazioni al carbonio in posizione a Addizione nucleofila a composti carbonilici a,b-insaturi Nelle molecole contenenti carbonili coniugati con doppi legami sono presenti due siti
Reazioni degli alcoli
 Reazioni degli alcoli Indice: 1) Sintesi degli alcossidi. 2 2) Sintesi di Williamson degli eteri. 2 ) Trasformazione degli alcoli in alogenuri alchilici 4) Sintesi degli esteri. 6 5) Trasformazione degli
Reazioni degli alcoli Indice: 1) Sintesi degli alcossidi. 2 2) Sintesi di Williamson degli eteri. 2 ) Trasformazione degli alcoli in alogenuri alchilici 4) Sintesi degli esteri. 6 5) Trasformazione degli
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI
 REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
IDENTIFICAZIONE DEI COMPOSTI CARBONILICI C O
 IDENTIFIAZINE DEI MPSTI ABNILII Generalità Il gruppo carbonilico, caratteristico delle aldeidi e dei chetoni è polare, in quanto la nube elettronica del legame è attirata dall'atomo di ossigeno più elettronegativo.
IDENTIFIAZINE DEI MPSTI ABNILII Generalità Il gruppo carbonilico, caratteristico delle aldeidi e dei chetoni è polare, in quanto la nube elettronica del legame è attirata dall'atomo di ossigeno più elettronegativo.
Composti Carbonilici. Aldeidi e Chetoni RCHO; RCRO
 omposti arbonilici Aldeidi e hetoni ; ALDEIDI e ETNI Sono caratterizzati dalla presenza del gruppo carbonilico che consiste in un atomo di carbonio legato con un doppio legame ad un atomo di ossigeno aldeide
omposti arbonilici Aldeidi e hetoni ; ALDEIDI e ETNI Sono caratterizzati dalla presenza del gruppo carbonilico che consiste in un atomo di carbonio legato con un doppio legame ad un atomo di ossigeno aldeide
Ammine. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Ammine Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Ammine Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Gruppi funzionali. aldeidi
 Gruppi funzionali alcoli aldeidi chetoni Acidi carbossilici ' eteri ' esteri fenoli In grassetto il gruppo funzionale che definisce il carattere del composto 1 2 Gruppi funzionali: arrangiamento di pochi
Gruppi funzionali alcoli aldeidi chetoni Acidi carbossilici ' eteri ' esteri fenoli In grassetto il gruppo funzionale che definisce il carattere del composto 1 2 Gruppi funzionali: arrangiamento di pochi
ALDEIDI E CHETONI. Struttura e proprietà. Il gruppo carbonilico. Reattività dei composti carbonilici IL GRUPPO CARBONILICO C O R C
 Struttura e proprietà ALDEIDI E ETNI ALDEIDI E ETNI NTENGN IL GUPP ABNILI Molti altri composti presentano questo gruppo: Acili, acidi, esteri, ammidi, carboidrati, proteine Il gruppo carbonilico E il più
Struttura e proprietà ALDEIDI E ETNI ALDEIDI E ETNI NTENGN IL GUPP ABNILI Molti altri composti presentano questo gruppo: Acili, acidi, esteri, ammidi, carboidrati, proteine Il gruppo carbonilico E il più
Capitolo 8 Alcoli e Fenoli
 Chimica Organica Informazione Scientifica sul Farmaco Capitolo 8 Alcoli e Fenoli Organic Chemistry, 5 th Edition L. G. Wade, Jr. Struttura degli Alcoli Alcoli: Il gruppo funzionale è l ossidrile (), legato
Chimica Organica Informazione Scientifica sul Farmaco Capitolo 8 Alcoli e Fenoli Organic Chemistry, 5 th Edition L. G. Wade, Jr. Struttura degli Alcoli Alcoli: Il gruppo funzionale è l ossidrile (), legato
ALCOLI. Tabella dei valori di pka compresi tra 10 e estere acetacetico. pka CH HC. acetilene COOEt 24.0.
 ALLI Indice: intesi degli alcossidi 2 intesi di Williamson degli eteri 2 intesi degli alogenuri alchilici 3 intesi degli esteri 6 Disidratazione degli alcoli ad eteri 7 Disidratazione degli alcoli ad alcheni
ALLI Indice: intesi degli alcossidi 2 intesi di Williamson degli eteri 2 intesi degli alogenuri alchilici 3 intesi degli esteri 6 Disidratazione degli alcoli ad eteri 7 Disidratazione degli alcoli ad alcheni
Esercitazione n Reazioni e meccanismi di aldeidi e chetoni.
 19. a) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene tra etanale e metanolo, in presenza di acidi. b) Spiegare come varia la reattività se con metanolo si fa reagire l'aldeide
19. a) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene tra etanale e metanolo, in presenza di acidi. b) Spiegare come varia la reattività se con metanolo si fa reagire l'aldeide
Reazioni di aldeidi e chetoni
 Reazioni di aldeidi e chetoni www.pianetachimica.it Introduzione Il gruppo funzionale di aldeidi e chetoni è il carbonile ( terminale, nei chetoni si trova all interno della catena. pentanale aldeide ).
Reazioni di aldeidi e chetoni www.pianetachimica.it Introduzione Il gruppo funzionale di aldeidi e chetoni è il carbonile ( terminale, nei chetoni si trova all interno della catena. pentanale aldeide ).
Composti carbonilici Acidi carbossilici
 Composti carbonilici Acidi carbossilici Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli
Composti carbonilici Acidi carbossilici Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli
Alcoli, fenoli ed eteri
 Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Ammine : caratteristiche strutturali
 Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
Composti carbonilici. Chimica Organica II
 Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
Alcoli, eteri, tioli, solfuri
 Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Composti organici del silicio
 Composti organici del silicio e B C N O F Ne P S Ar Br Kr : 1s 2 2s 2 2p 6 3s 2 3p 2 3d 0 Il silicio è un elemento della seconda riga della tavole periodica, è più grande, meno elettronegativo e più polarizzabile
Composti organici del silicio e B C N O F Ne P S Ar Br Kr : 1s 2 2s 2 2p 6 3s 2 3p 2 3d 0 Il silicio è un elemento della seconda riga della tavole periodica, è più grande, meno elettronegativo e più polarizzabile
ALCOLI, ETERI, TIOLI. Alcol: molecola contenente un gruppo -OH legato ad un carbonio sp 3
 ALCOLI, ETERI, TIOLI Alcol: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Tiolo: molecola contenente un gruppo -SH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno
ALCOLI, ETERI, TIOLI Alcol: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Tiolo: molecola contenente un gruppo -SH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno
S N. Reazioni di Sostituzione Nucleofila. Nucleofilo: Nu: + C X C + Nu + X - Sostituzione Nucleofila:
 Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
Introduzione alla chimica organica. Daniele Dondi
 Introduzione alla chimica organica Daniele Dondi [email protected] Il carbonio nelle sue ibridazioni sp 3 sp 2 sp Il carbonio è un elemento fondamentale per la chimica organica. La stabilità del legame -
Introduzione alla chimica organica Daniele Dondi [email protected] Il carbonio nelle sue ibridazioni sp 3 sp 2 sp Il carbonio è un elemento fondamentale per la chimica organica. La stabilità del legame -
Introduzione alla chimica organica. Daniele Dondi
 Introduzione alla chimica organica Daniele Dondi [email protected] 1 enni sulla nascita della chimica organica Analisi elementari tramite combustione WÖLER (metà 1800) sintetizza l urea KLBE sintetizza l
Introduzione alla chimica organica Daniele Dondi [email protected] 1 enni sulla nascita della chimica organica Analisi elementari tramite combustione WÖLER (metà 1800) sintetizza l urea KLBE sintetizza l
Acidi carbossilici e derivati Composti organici che contengono legami doppi C=O e legami singoli C-eteroatomo (oppure il gruppo CN)
 himica rganica Acidi carbossilici e derivati omposti organici che contengono legami doppi = e legami singoli -eteroatomo (oppure il gruppo N) H Acido carbossilico X Alogenuro acilico Anidride ' N Estere
himica rganica Acidi carbossilici e derivati omposti organici che contengono legami doppi = e legami singoli -eteroatomo (oppure il gruppo N) H Acido carbossilico X Alogenuro acilico Anidride ' N Estere
ALCOLI, ETERI, TIOLI. Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3
 ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
Acidi carbossilici: nomenclatura. alcano -> acido alcanoico
 Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Si trovano generalmente come dimeri ciclici a causa dei legami a idrogeno
 Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Capitolo 24 Dai gruppi funzionali ai polimeri
 Capitolo 24 Dai gruppi funzionali ai polimeri 1. I gruppi funzionali 2. Alcoli, fenoli ed eteri 3. Le reazioni di alcoli e fenoli 4. Alcoli e fenoli di particolare interesse 5. Aldeidi e chetoni 6. Gli
Capitolo 24 Dai gruppi funzionali ai polimeri 1. I gruppi funzionali 2. Alcoli, fenoli ed eteri 3. Le reazioni di alcoli e fenoli 4. Alcoli e fenoli di particolare interesse 5. Aldeidi e chetoni 6. Gli
Esercitazione n. 15 - Reazioni e meccanismi di aldeidi e chetoni.
 Esercitazione n. 15 Reazioni e meccanismi di aldeidi e chetoni.. ompletare le equazioni chimiche per le reazioni del propanale con ciascuno dei seguenti reagenti: a) ab 4 (e poi ) a. ab 4 b. b) bromuro
Esercitazione n. 15 Reazioni e meccanismi di aldeidi e chetoni.. ompletare le equazioni chimiche per le reazioni del propanale con ciascuno dei seguenti reagenti: a) ab 4 (e poi ) a. ab 4 b. b) bromuro
Gli Acidi Carbossilici ed i loro Derivati
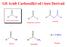 Gli Acidi arbossilici ed i loro Derivati Acido carbossilico X Alogenuro acilico Anidride ' ' N 2 N Estere Ammide Nitrile Nomenclatura degli Acidi arbossilici 3 3 2 3 2 1 Acido propanoico 3 2 2 5 4 3 2
Gli Acidi arbossilici ed i loro Derivati Acido carbossilico X Alogenuro acilico Anidride ' ' N 2 N Estere Ammide Nitrile Nomenclatura degli Acidi arbossilici 3 3 2 3 2 1 Acido propanoico 3 2 2 5 4 3 2
Forze intermolecolari
 Forze intermolecolari Sono le forze che si instaurano tra le molecole di un composto e ne determinano lo stato di aggregazione (gas, liquido, solido) interazioni dipolo-dipolo attrazioni di van der Waals
Forze intermolecolari Sono le forze che si instaurano tra le molecole di un composto e ne determinano lo stato di aggregazione (gas, liquido, solido) interazioni dipolo-dipolo attrazioni di van der Waals
L addizione coniugata
 L addizione coniugata In un sistema carbonilico α,β-insaturo dove avverà l attacco di un nucleofilo?? Al carbonio carbonilico o al doppio legame? Il sistema ha due centri elettrofili: : il carbonio carbonilico
L addizione coniugata In un sistema carbonilico α,β-insaturo dove avverà l attacco di un nucleofilo?? Al carbonio carbonilico o al doppio legame? Il sistema ha due centri elettrofili: : il carbonio carbonilico
Alcoli, eteri, tioli, solfuri
 Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
R-X ALOGENURI ALCHILICI. F Cl Br I. Nomenclatura. In genere si indicano con. + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo
 ALOGENURI ALCHILICI In genere si indicano con Nomenclatura R-X + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo X F Cl Br I 3-Bromo-2-metilpentano 4-Bromo-cicloesene trans-2-clorocicloesanolo
ALOGENURI ALCHILICI In genere si indicano con Nomenclatura R-X + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo X F Cl Br I 3-Bromo-2-metilpentano 4-Bromo-cicloesene trans-2-clorocicloesanolo
Chimica organica Chimica dei composti del carbonio. Nelle molecole organiche oltre al carbonio sono presenti pochi altri elementi: H, O, N, P,
 himica organica himica dei composti del carbonio. Nelle molecole organiche oltre al carbonio sono presenti pochi altri elementi:,, N, P, S, alogeni. Le molecole organiche presentano particolari raggruppamenti
himica organica himica dei composti del carbonio. Nelle molecole organiche oltre al carbonio sono presenti pochi altri elementi:,, N, P, S, alogeni. Le molecole organiche presentano particolari raggruppamenti
CHIMICA ORGANICA II. Corso di laurea in CHIMICA (L.T.) 1. Dare il livello di ossidazione degli atomi di carbonio indicati nei seguenti composti:
 IMIA RGAIA II orso di laurea in IMIA (L.T.) Esercitazione n.1. Livelli di ossidazione 1. Dare il livello di ossidazione degli atomi di carbonio indicati nei seguenti composti: a) l c) d) l e) f) g) h)
IMIA RGAIA II orso di laurea in IMIA (L.T.) Esercitazione n.1. Livelli di ossidazione 1. Dare il livello di ossidazione degli atomi di carbonio indicati nei seguenti composti: a) l c) d) l e) f) g) h)
Alcoli, fenoli ed eteri
 Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Mg-C. Δel = 1.3 C.I. = 34%
 Mg-C Δel = 1.3 C.I. = 34% COMPOSTI ORGANOMETALLICI Sono composti che contengono un legame C-Metallo (R-M) dove R è un residuo organico e M un metallo monovalente (Na, Li) o bivalente (Mg). In genere il
Mg-C Δel = 1.3 C.I. = 34% COMPOSTI ORGANOMETALLICI Sono composti che contengono un legame C-Metallo (R-M) dove R è un residuo organico e M un metallo monovalente (Na, Li) o bivalente (Mg). In genere il
Capitolo 4 Reazioni degli alcheni
 himica Organica Informazione Scientifica sul Farmaco apitolo 4 Reazioni degli alcheni Organic hemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: richiami generali sulle reazioni chimice reattività
himica Organica Informazione Scientifica sul Farmaco apitolo 4 Reazioni degli alcheni Organic hemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: richiami generali sulle reazioni chimice reattività
IDROCARBURI INSATURI: GLI ALCHENI HANNO ALMENO UN DOPPIO LEGAME NELLA STRUTTURA NOMENCLATURA: RADICE COME NEGLI IDROCARBURI, DESINENZA -ENE
 IDRCARBURI INSATURI: GLI ALCENI ANN ALMEN UN DPPI LEGAME NELLA STRUTTURA NMENCLATURA: RADICE CME NEGLI IDRCARBURI, DESINENZA -ENE butano 2-butene o but-2-ene Esempi di nomenclatura degli alcheni Esempi
IDRCARBURI INSATURI: GLI ALCENI ANN ALMEN UN DPPI LEGAME NELLA STRUTTURA NMENCLATURA: RADICE CME NEGLI IDRCARBURI, DESINENZA -ENE butano 2-butene o but-2-ene Esempi di nomenclatura degli alcheni Esempi
1. COS È LA CHIMICA ORGANICA?
 Università degli Studi di Bari Dipartimento di Farmacia Scienze del Farmaco Corso di Laurea in Tecniche Erboristiche A.A. 2013-2014 Chimica Organica Prof. Giuseppe Gerardo Carbonara Finalità. Scopo del
Università degli Studi di Bari Dipartimento di Farmacia Scienze del Farmaco Corso di Laurea in Tecniche Erboristiche A.A. 2013-2014 Chimica Organica Prof. Giuseppe Gerardo Carbonara Finalità. Scopo del
26 Aprile 1915, 81 compleanno
 Reazioni di addizione-eliminazione eliminazione di composti carbonilici Ammine primarie reagiscono con composti carbonilici per dare immine, anche denominate basi di Schiff 1 Ugo Shiff (1834-1915) 1915)
Reazioni di addizione-eliminazione eliminazione di composti carbonilici Ammine primarie reagiscono con composti carbonilici per dare immine, anche denominate basi di Schiff 1 Ugo Shiff (1834-1915) 1915)
REAZIONI DEGLI ALCHENI
 REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
COMPOSTI AROMATICI POLICICLICI
 CHIMICA DEI COMPOSTI AROMATICI POLICICLICI CHIMICA DI PIRROLO, FURANO E TIOFENE CHIMICA DI IMIDAZOLI, OSSAZOLI E TIAZOLI CHIMICA DI ISOSSAZOLI, PIRAZOLI, ISOTIAZOLI LEZIONE 5 COMPOSTI AROMATICI POLICICLICI
CHIMICA DEI COMPOSTI AROMATICI POLICICLICI CHIMICA DI PIRROLO, FURANO E TIOFENE CHIMICA DI IMIDAZOLI, OSSAZOLI E TIAZOLI CHIMICA DI ISOSSAZOLI, PIRAZOLI, ISOTIAZOLI LEZIONE 5 COMPOSTI AROMATICI POLICICLICI
Chimica del carbonio. 1. Composti contenenti azoto (C,H,N) ammine. Aromatici (derivati del benzene di formula C 6 H 6 )
 himica del carbonio Il carbonio forma con 4 atomi diversi 4 legami covalenti equivalenti posti a 109,5, oppure con 3 atomi diversi 3 legami posti a 120, di cui uno doppio, oppure 2 legami covalenti con
himica del carbonio Il carbonio forma con 4 atomi diversi 4 legami covalenti equivalenti posti a 109,5, oppure con 3 atomi diversi 3 legami posti a 120, di cui uno doppio, oppure 2 legami covalenti con
Alchini. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alchini Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alchini Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Appunti di Chimica Organica Elementi per CdL Ostetricia CHIMICA ORGANICA. Appunti di Lezione. Elementi per il corso di Laurea In Ostetricia
 Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
La condensazione di Claisen
 La condensazione di Claisen Oltre alle aldeidi e chetoni anche gli esteri possono generare enolati e funzionare da elettrofili.. Quando un estere viene trattato con una base avviene una trasformazione
La condensazione di Claisen Oltre alle aldeidi e chetoni anche gli esteri possono generare enolati e funzionare da elettrofili.. Quando un estere viene trattato con una base avviene una trasformazione
ALCOLI E FENOLI ALCOL FENOLO. Scaricato da Sunhope.it
 Indice Alcoli e fenoli: gruppo funzionale Alcoli: nomenclatura e classificazione Fenoli: nomenclatura Alcoli: principali reazioni Fenoli Eteri Epossidi Tioli Tioeteri ALLI E FENLI Alcoli e fenoli sono
Indice Alcoli e fenoli: gruppo funzionale Alcoli: nomenclatura e classificazione Fenoli: nomenclatura Alcoli: principali reazioni Fenoli Eteri Epossidi Tioli Tioeteri ALLI E FENLI Alcoli e fenoli sono
Enoli e Enolati. Reazioni di sostituzione nucleofila al carbonio a
 Enoli e Enolati Reazioni di sostituzione nucleofila al carbonio a Idrogeni in α ad un carbonile Perché vi è una reattività al carbonio in posizione a ad un carbonile? Perché solo gli idrogeni α sono acidi
Enoli e Enolati Reazioni di sostituzione nucleofila al carbonio a Idrogeni in α ad un carbonile Perché vi è una reattività al carbonio in posizione a ad un carbonile? Perché solo gli idrogeni α sono acidi
