POLIEDRI IN NATURA. Albert Einstein
|
|
|
- Olivia Gioia
- 7 anni fa
- Visualizzazioni
Transcript
1 POLIEDRI IN NATURA Come è possibile che la matematica, un prodotto del pensiero umano indipendente dall esperienza, corrisponda in modo così perfetto agli oggetti della realtà fisica? Albert Einstein I poliedri sono spesso presenti nel mondo che ci circonda: negli esseri viventi come i virus, le cui capsidi presentano simmetrie icosaedriche; nel campo della chimica, dove troviamo molecole, come il celebre C 60, che presentano simmetrie icosaedriche o come i reticoli di alcune molecole che hanno strutture tetraedriche o cubiche; nei cristalli, la cui classificazione è legata proprio alle simmetrie dei poliedri che ne rappresentano la struttura. Vediamo alcune di queste particolarità. POLIEDRI NELLE GEOMETRIE MOLECOLARI
2 Ricordiamo che si definisce molecola un insieme di almeno due atomi uniti da un legame chimico, che costituiscono la più piccola parte di un composto. In chimica e in fisica, saper riconoscere e distinguere le varie geometrie assume una rilevante importanza, perché con tali informazioni si possono spiegare alcune proprietà delle molecole, come la polarità o i punti di fusione ed ebollizione, e prevedere il loro comportamento. Le figure, qui sopra riportate, che abbiamo costruito e fotografato, mostrano alcune geometrie molecolari, con le loro simmetrie. Possiamo osservare come molecole con formula simile, come ad esempio il diossido di carbonio CO 2 e l acqua H 2 O, abbiano geometrie e quindi proprietà diverse; la prima ha una geometria lineare, con l angolo, per cui risulta essere una molecola apolare, in quanto i due dipoli sono opposti e perciò si annullano a vicenda; la seconda presenta una geometria piegata con l angolo, per cui risulta essere una molecola polare, in quanto la forma piegata non consente ai due dipoli opposti di annullarsi. Le formule di Lewis non danno alcuna informazione sulla geometria molecolare ma solo su come gli atomi sono connessi fra di loro da legami. La teoria di VSEPR (acronimo di VALENCE SHELL ELECTRON PAIR REPULSION, repulsione tra doppietti elettronici del guscio di valenza) permette invece di prevedere la geometria delle molecole a partire dalle formule di Lewis. Secondo questa teoria la migliore disposizione spaziale di un determinato numero di coppie elettroniche è quella che minimizza le repulsioni tra le coppie stesse. Infatti se immaginiamo due elettroni posti in un orbitale, poichè gli elettroni sono particelle con carica negativa, per minimizzare la forza di repulsione che si manifesta tra loro devono disporsi il più distante possibile l uno dall altro. Questa disposizione contribuisce anche alla stabilità della molecola. La VSEPR oltre a descrivere la struttura delle molecole, precisa l ampiezza degli angoli di legame e il numero sterico, che coincide con il numero di atomi che si legano con l atomo centrale. Sulla base di alcune considerazioni geometriche e al fatto che le coppie di valenza di un atomo devono disporsi alla massima distanza possibile, si possono definire diverse geometrie molecolari, che si differenziano l una dall altra proprio per il numero sterico e per l angolo di legame tra gli atomi. Vediamo le principali. LA GEOMETRIA LINEARE: AX 2. E la più semplice delle geometrie: la molecola è costituita generalmente da due atomi che si legano a un atomo centrale con angoli di legame di 180 e con una ibridazione sp. Abbiamo già visto che un esempio di questa geometria si trova nella molecola di anidride carbonica CO 2, che è formata da un atomo di carbonio al centro unito a due atomi di ossigeno, con due angoli di legame pari a 180 ( )
3 LA GEOMETRIA PLANARE: AX 3. La molecola è costituita da tre atomi uniti a quello centrale, con angoli di legame di 120 e generalmente con ibridazione sp 2. Questa struttura è presente, ad esempio nella molecola di trifluoruro di boro (BF 3 ), dove l atomo di boro, posto al centro, si lega con tre atomi di fluoro con ciascuna angolo di legame pari120 ( ) LA GEOMETRIA TETRAEDRICA: AX 4. La molecola di questo modello è costituita da quattro atomi legati a quello centrale con angoli di con ibridazione sp 3. Questa struttura è di particolare interesse perché ha la forma di un tetraedro, ovvero un poliedro regolare. In natura è possibile osservare questa struttura, ad esempio, nella molecole del metano CH 4, dove quattro atomi di idrogeno si legano con uno di carbonio posto al centro con un angolo di legame di ( )
4 LA GEOMETRIA TRIGONARE BIPIRAMIDALE: AX 5. Esempi di molecole caratterizzate da questo tipo di geometria è il pentacloruro di Fosforo PCl 5. Anche l ammoniaca NH 3, presenta una geometria trigonale piramidale. Vista la formula, ci si potrebbe aspettare che l atomo di azoto sia al centro di un triangolo equilatero circondato da tre atomi di idrogeno; invece analizzando la molecola si scopre che l azoto si trova circa al centro di un tetraedro distorto, che presenta infatti tre coppie di legame con un angolo e avente nel quarto vertice, apparentemente libero, una coppia elettronica non condivisa. LA GEOMETRIA OTTAEDRICA: AX 6. In questa struttura la molecola è formata da 6 atomi uniti all atomo centrale con una ibridazione dei legami pari a sp 3 d 2. Un esempio che rappresenti questa tipologia è la molecola dell esafluoruro di zolfo SF 6. Anche in questo caso la forma è quella di un poliedro regolare, l ottaedro.
5 RETICOLI : LA COORDINAZIONE DEGLI IONI Nel formare un legame ionico ciascun ione tende a raccogliere, coordinare, attorno a sé il maggior numero possibile di ioni di segno opposto; i centri degli ioni coordinati si trovano nei vertici di un poliedro, costruito attorno allo ione coordinante, le cui caratteristiche dipendono dai raggi atomici del catione e dell anione. Per esempio nel NaCl ciascun Na + ha sei Cl - come ioni primi vicini e perciò viene definito in coordinazione 6 con il Cl (N.C.6); ma anche gli anioni si possono considerare come centri coordinanti. Quindi, siccome sia rispetto al sodio che al cloro si ha N.C.6, si avrà allora lo stesso numero di ioni per le due specie, in accordo con la formula NaCl. I numeri di coordinazione possibili sono: Poichè in ogni caso il numero totale di ioni di tutte le specie in una struttura ionica stabile deve essere tale che il cristallo sia, considerato nel suo complesso, elettricamente neutro, nel NaCl i cationi e gli anioni formano ottaedri che condividono gli spigoli con ognuno dei dodici spigoli di un ottaedro condiviso con un ottaedro adiacente. Per spiegarlo ricordiamo la definizione di forza di un legame elettrostatico (v.e.): è la carica di valenza ionica (indicata con z) divisa per il suo numero di coordinazione (indicato con n): v.e. = z/n espressa in valore assoluto. Poiché in una struttura cristallina stabile, la forza totale dei legami di valenza che raggiungono un anione da tutti i cationi circostanti è uguale alla carica dell'anione, allora nell'nacl lo ione Cl - deve essere circondato da sei primi vicini Na + in coordinazione ottaedrica, in modo che ciascuno dei legami che raggiungono Na + abbia una forza (v.e.) di 1/6. In questo modo i sei Cl - coordinati ottaedricamente neutralizzano con i loro legami la carica dello ione Na +, posto al centro del poliedro di coordinazione. Ma anche Cl - ha sei ioni Na + primi vicini cosicché anche la v.e. per ciascuno dei legami che raggiungono Cl - è di 1/6;di conseguenza anche la carica sullo ione Cl - viene neutralizzata da sei legami di 1/6 dei sei ioni Na +, che risultano essere coordinati ottaedricamente con il Cl -. La figura mostra la neutralizzazione di uno ione centrale da parte dei legami con gli ioni primi vicini In modo analogo è spiegabile la struttura del CsCl; essa è costituita da cubi centrati che condividono le facce con sei altri cubi adiacenti. Gli ioni sono disposti secondo un reticolo cubico primitivo. Ciascun catione è circondato da otto primi vicini, e così ogni anione.
6 FORME ALLOTROPICHE DEL CARBONIO Il carbonio in natura si presenta con tre forme allotropiche: la grafite, i cui atomi generano degli strati a struttura esagonale, simile a quella delle celle delle api; il diamante, che si presenta con un reticolo cubico, che gli conferisce la sua caratteristica durezza; in esso ogni atomo di carbonio è legato a quattro altri atomi di carbonio disposti nei vertici di un tetraedro (un tetraedero si ottiene daun cubo congiungendo due suoi vertici non consecutivi); i fullereni, che sono una particolare tipologia di poliedri trivalenti, in quanto sono costituiti da un numero di facce 12. Tra i fullereni quello più stabile è il C 60 : è una molecola formata da 60 atomi di carbonio disposti in modo da formare 32 facce, 20 a forma di esagono e 12 a forma di pentagono, adiacenti tra loro; la forma è quella sferoidale cava, dove gli atomi di carbonio sono posizionati presso i vertici del poliedro, e i legami tra essi formano gli spigoli di uno dei 13 solidi semiregolari di Archimede, l icosaedro troncato. Sebbene l atomo di carbonio sia quadrivalente, il poliedro è trivalente, proprio perché ogni atomo è legato ad altri due da un legame singolo e ad un terzo da un doppio legame. Gli spigoli del poliedro risultano però uguali perché la differenza di lunghezza tra i legami singoli e quelli doppi si può considerare trascurabile. Il C 60 è anche il più noto tra i fullereni perché la sua forma assomiglia a quella di un pallone da calcio. Viene anche chiamato buckminsterfullerene, dal nome dell architetto americano Buckminster Fuller, che ha realizzato delle cupole geodetiche che ricordano proprio la forma di queste grandi molecole (come all Expo di Montreal, in figura) Esistono sostanzialmente due tipologie di fullereni: -i BUCKYBALL (o BUCKMINISTER-FULLERENE): le molecole hanno una forma sostanzialmente sferica e grandi dimensioni; all interno di questo gruppo troviamo il C 60, il C 36, con simmetria icosaedrale, e il C 70 ; - i BUCKYTUBE: le molecole hanno una forma tubolare allungata, formata da anelli esagonali di atomi di carbonio, chiusa all estremità da anelli pentagonali. I fullereni sono stati osservati anche nello spazio presso la nebulosa planetaria Tc1. Questa nebulosa è stata formata da stelle di media grandezza che nella loro fase finale di vita si trasformano in nane bianche; durante i processi di fusione nucleare che avvengono nel nucleo della stella vengono prodotti atomi fullerenici di carbonio, espulsi insieme a nubi di gas e polveri.
7 POLIEDRI NEGLI ESSERI VIVENTI Molti organismi microscopici si presentano con una forma poliedrale o presentano simmetrie poliedrali. Ad esempio i radiolari, protozoi ameboidi, che costituiscono parte del placton marino in tutti gli oceani, presentano uno scheletro siliceo caratterizzato da numerose simmetrie. Essi si presentano con la forma icosaedrica o geode. I virus sono parassiti delle cellule sia animali che vegetali. Le singole particelle dei virus, chiamate vironi, presentano al loro interno delle strutture poliedriche. All interno di questi agenti patogeni vi è il genoma composto da DNA e RNA; esso è contenuto all interno di un involucro proteico, detto capside, che ha proprio lo scopo di proteggere i geni al suo interno, costituito da subunità proteiche, chiamate capsometri. Vi sono due tipologie di capsidi aventi forme differenti: - capside con simmetria elicoidale: è una struttura formata da unità proteiche che formano una spirale avvolgendosi attorno all acido nucleico; - capside con simmetria icosaedrica: è una struttura formata da più capsometri che formano un icosaedro regolare; i capsometri che formano le venti facce dei poliedro sono chiamati esoni, mentre quelli che costituiscono i dodici vertici sono definiti pentoni. Nella figura in basso si vede un esempio di virus a geometria icosaedrica senza membrana. Sono indicati con (1) la capside, con (2) l acido nucleico e con (3) il capsometro di cui si riconosce la struttura icosaedrica. In natura troviamo dei virus definiti nudi, che sono costituiti solo da un nucleo capside e che possono avere simmetria elicoidale se di natura vegetale o simmetria icosaedrica se di origine animale. IInoltre ci sono dei virus detti rivestiti, perché hanno un rivestimento pericapsidrico, che hanno la capside con entrambe le simmetrie: per esempio il virus influenzali ha simmetria elicoidale, mentre quello dell HIV-1 ha simmetria icosaedrica.
8 NUOVE FRONTIERE DELLA RICERCA SCIENTIFICA: LE GABBIE DI ARCHIMEDE Anche nei settori più all avanguardia della ricerca in campo scientifico e farmaceutico, possiamo individuare strutture poliedriche. Il 22 luglio 2011, i ricercatori dell università italiana Milano-Bicocca in collaborazione con i colleghi della New York Univetsity (rispettivamente sotto la guida di Angolina Comotti e Michael Ward) hanno realizzato delle gabbie, formate da molecole, la cui struttura è tenuta insieme da atomi d idrogeno, che sono molto stabili e soprattutto possono assumere la forma geometrica di alcuni dei 13 poliedri archimedei (come si vede nella foto al microscopio elettronico); proprio per questo sono state chiamate con l appellativo di GABBIE DI ARCHIMEDE. Ad esempio, la struttura della gabbia avente la forma dell ottaedro troncato è tenuta insieme da legami idrogeno di esalfonatofenilbenzene e ione guanidinio e ha un volume di dimensioni nanometriche, pari a 2200 angstrom cubici. La peculiarità di questa scoperta, è la capacità delle gabbie di contenere altre molecole, cambiandone forma e proprietà, obbligandole a riprodurre esattamente i comandi decisi dai ricercatori: sono quindi controllabili. In natura esistono gabbie simili a quelle di Archimede, come per esempio le capsule dei virus, ma quest ultime, al contrario di quelle artificiali, sono incontrollabili e soprattutto non si può introdurre al loro interno altre molecole obbligandole a cambiare le loro funzioni. Le gabbie durano nel tempo, per cui le molecole ospiti sono protette dall ambiente esterno, così da non potersi degradare o ossidare; quando le gabbie vengono rimosse, le molecole cresciute al loro interno sono pronte per svolgere le loro nuove attività. Questa scoperta ha una rilevante importanza nel campo farmaceutico, perché queste molecole riprogrammate possono svolgere importanti funzioni, come il rilascio controllato dei farmaci, il miglior controllo della solubilità dei principi attivi o la maggior stabilità di nanoparticelle metalliche disperse. In medicina nucleare vengono inoltre utilizzate gabbie costituite da fullereni, le quali, unite ad atomi radioattivi, riescono ad eliminare le cellule tumorali, senza danneggiare quelle sane.
GEOMETRIA MOLECOLARE. La struttura di Lewis non fornisce alcuna indicazione sulla forma delle molecole in
 GEOMETRIA MOLECOLARE La struttura di Lewis non fornisce alcuna indicazione sulla forma delle molecole in quanto dipende dagli ANGOLI DI LEGAME cioè gli angoli tra le linee che congiungono i nuclei degli
GEOMETRIA MOLECOLARE La struttura di Lewis non fornisce alcuna indicazione sulla forma delle molecole in quanto dipende dagli ANGOLI DI LEGAME cioè gli angoli tra le linee che congiungono i nuclei degli
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici. Capitolo 10
 Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
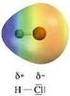
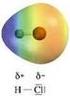
I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo
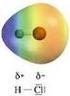 La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1. L energia di legame
 legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
1. L energia di legame. 2. I gas nobili e a regola dell ottetto. 3. Il legame covalente. 4. Il legame covalente dativo. 5. Il legame covalente polare
 Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Il legame chimico ATOMI MOLECOLE
 Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Il Legame Chimico e la Struttura Molecolare
 A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Formule di Lewis e regola dell ottetto
 Formule di Lewis e regola dell ottetto 1916-1919 Lewis si accorse che: Qualcosa di unico nelle configurazioni elettroniche dei gas nobili è responsabile della loro inerzia; gli atomi degli altri elementi
Formule di Lewis e regola dell ottetto 1916-1919 Lewis si accorse che: Qualcosa di unico nelle configurazioni elettroniche dei gas nobili è responsabile della loro inerzia; gli atomi degli altri elementi
IBRIDAZIONE e GEOMETRIA MOLECOLARE
 IBRIDAZIONE e GEOMETRIA MOLECOLARE Esempio: struttura della molecola del metano CH 4 1s 2s 2p Configurazione elettronica del C Per esempio il carbonio può utilizzare la configurazione in cui un elettrone
IBRIDAZIONE e GEOMETRIA MOLECOLARE Esempio: struttura della molecola del metano CH 4 1s 2s 2p Configurazione elettronica del C Per esempio il carbonio può utilizzare la configurazione in cui un elettrone
Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 13-14 2010 Configurazioni elettroniche Descrizioni diverse Sistema periodico Configurazioni elettroniche Il modello
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 13-14 2010 Configurazioni elettroniche Descrizioni diverse Sistema periodico Configurazioni elettroniche Il modello
Per esempio, possiamo osservare il legame ionico nella molecola di cloruro di sodio. Il cloro e il sodio hanno le seguenti strutture di Lewis:
 IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
Formule di Lewis e geometria molecolare
 Formule di Lewis e geometria molecolare Formalismo simbolico di Lewis Rappresentazione degli elettroni di valenza; permette di seguire gli elettroni di valenza durante la formazione di un legame Consiste
Formule di Lewis e geometria molecolare Formalismo simbolico di Lewis Rappresentazione degli elettroni di valenza; permette di seguire gli elettroni di valenza durante la formazione di un legame Consiste
CRISTALLOCHIMICA. La cristallochimica è la disciplina che studia le correlazioni tra la struttura cristallina e la composizione chimica dei minerali
 CRISTALLOCHIMICA La cristallochimica è la disciplina che studia le correlazioni tra la struttura cristallina e la composizione chimica dei minerali L atomo H orbitali Livelli energetici Lo ione Lo ione
CRISTALLOCHIMICA La cristallochimica è la disciplina che studia le correlazioni tra la struttura cristallina e la composizione chimica dei minerali L atomo H orbitali Livelli energetici Lo ione Lo ione
Legame covalente. H 1s un protone e un elettrone
 Legame covalente H 1s un protone e un elettrone Il legame covalente è formato da una coppia di elettroni condivisa fra due atomi. L energia richiesta per separare gli atomi legati è detta energia di legame.
Legame covalente H 1s un protone e un elettrone Il legame covalente è formato da una coppia di elettroni condivisa fra due atomi. L energia richiesta per separare gli atomi legati è detta energia di legame.
un legame covalente due legami covalenti? tre legami covalenti due legami covalenti un legame covalente
 e C N un legame covalente due legami covalenti? tre legami covalenti O F Ne 1s 2s 2p due legami covalenti un legame covalente C 1s 2s 2p ibridazione quattro legami covalenti Cariche Formali Usando le strutture
e C N un legame covalente due legami covalenti? tre legami covalenti O F Ne 1s 2s 2p due legami covalenti un legame covalente C 1s 2s 2p ibridazione quattro legami covalenti Cariche Formali Usando le strutture
Descrivere come dedurre la polarità delle molecole dalla geometria molecolare STRUTTURA ELETTRONICA DEGLI ATOMI
 Descrivere come dedurre la polarità delle molecole dalla geometria molecolare STRUTTURA ELETTRONICA DEGLI ATOMI Ogni atomo contiene un piccolo denso nucleo,formato da neutroni e protoni carichi positivamente.
Descrivere come dedurre la polarità delle molecole dalla geometria molecolare STRUTTURA ELETTRONICA DEGLI ATOMI Ogni atomo contiene un piccolo denso nucleo,formato da neutroni e protoni carichi positivamente.
METALLI: bassa energia di ionizzazione bassa affinità elettronica. NON METALLI: elevata energia di ionizzazione elevata affinità elettronica
 METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
La struttura di ioni e molecole
 La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
Atomi e molecole. Gli atomi degli elementi si trovano in natura generalmente combinati tra loro in molecole o composti ionici
 IL LEGAME CHIMICO Atomi e molecole È estremamente difficile trovare in natura una sostanza formata da singoli atomi isolati Solo i gas nobili sono presenti in natura come gas monoatomici Gli atomi degli
IL LEGAME CHIMICO Atomi e molecole È estremamente difficile trovare in natura una sostanza formata da singoli atomi isolati Solo i gas nobili sono presenti in natura come gas monoatomici Gli atomi degli
Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi
 LE MOLECOLE Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi ChimicaGenerale_lezione8 1 Risonanza * La teoria della risonanza
LE MOLECOLE Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi ChimicaGenerale_lezione8 1 Risonanza * La teoria della risonanza
CAPITOLO 4 STRUTTURE MOLECOLARI
 APITL 4 STRUTTURE MLELARI 4.1 (a) Di seguito è mostrata la struttura di Lewis di P 3. Nella teoria VSEPR il numero di coppie di elettroni attorno all atomo centrale è fondamentale per determinare la struttura.
APITL 4 STRUTTURE MLELARI 4.1 (a) Di seguito è mostrata la struttura di Lewis di P 3. Nella teoria VSEPR il numero di coppie di elettroni attorno all atomo centrale è fondamentale per determinare la struttura.
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
GEOMETRIA MOLECOLARE
 GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI. A cura della prof. C. Viscardi
 I LEGAMI CIMICI A cura della prof. C. Viscardi 1 ATOMI E MOLECOLE È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti
I LEGAMI CIMICI A cura della prof. C. Viscardi 1 ATOMI E MOLECOLE È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti
Chimica. Lezione 2 Parte II Composti ionici e molecolari
 Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
LEGAME CHIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici.
 LEGAME CIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
LEGAME CIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
LA CHIMICA DEL CARBONIO
 LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) colesterolo
LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) colesterolo
Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
 LEGAME CHIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
LEGAME CHIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
 ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
POLIEDRI IN CRISTALLOGRAFIA
 POLIEDRI IN CRISTALLOGRAFIA L'universo è composto di materia, ovviamente. E la materia è composta di particelle: elettroni, neutroni e protoni. Dunque l'intero universo è composto di particelle. Ora, di
POLIEDRI IN CRISTALLOGRAFIA L'universo è composto di materia, ovviamente. E la materia è composta di particelle: elettroni, neutroni e protoni. Dunque l'intero universo è composto di particelle. Ora, di
H 2 O 2 (aq) 2e - + O 2 (g) H + (aq) MnO 2 (s) +2e H + (aq Mn 2+ (aq) +2 H 2 O (l).
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico-elettronico: H 2 2 (aq) + Mn 2 (s) + H + (aq) Mn 2+ (aq) + 2 (g) + H 2 (l). Calcolare la massa di Mn 2 (s) necessaria per
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico-elettronico: H 2 2 (aq) + Mn 2 (s) + H + (aq) Mn 2+ (aq) + 2 (g) + H 2 (l). Calcolare la massa di Mn 2 (s) necessaria per
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta della struttura elettronica delle molecole, come quella
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta della struttura elettronica delle molecole, come quella
CHIMICA II (CHIMICA ORGANICA)
 CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
Introduzione alla chimica organica. 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole
 Introduzione alla chimica organica 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole La chimica organica tratta di pochissimi atomi che si possono combinare in moltissimi modi Grande importanza
Introduzione alla chimica organica 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole La chimica organica tratta di pochissimi atomi che si possono combinare in moltissimi modi Grande importanza
Il legame chimico. Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici
 Il legame chimico Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici Fra due atomi o fra due gruppi di atomi è presente un legame chimico quando l entità che
Il legame chimico Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici Fra due atomi o fra due gruppi di atomi è presente un legame chimico quando l entità che
Legame chimico unità 1, modulo D del libro
 Legame chimico unità 1, modulo D del libro PERCHÉ IL LEGAME CHIMICO? Gli atomi si trovano raramente isolati, spesso due o più atomi si uniscono tramite un legame chimico. Perché ciò avviene? Perché l insieme
Legame chimico unità 1, modulo D del libro PERCHÉ IL LEGAME CHIMICO? Gli atomi si trovano raramente isolati, spesso due o più atomi si uniscono tramite un legame chimico. Perché ciò avviene? Perché l insieme
Molecole e legami. Chimica generale
 Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Il tipo di legame chimico influenza in maniera fondamentale le caratteristiche macroscopiche del materiale.
 Il tipo di legame chimico influenza in maniera fondamentale le caratteristiche macroscopiche del materiale. 1 Nei materiali si distinguono cinque tipi di legame. Nei ceramici solo tre sono importanti:
Il tipo di legame chimico influenza in maniera fondamentale le caratteristiche macroscopiche del materiale. 1 Nei materiali si distinguono cinque tipi di legame. Nei ceramici solo tre sono importanti:
1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno 5. Legami a confronto
 Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia
 Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Lezione n. 22. Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 22 Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π 02/03/2008 Antonino Polimeno 1 Molecole poliatomiche (1) - Siamo ora
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 22 Molecole poliatomiche Metodo VSEPR Orbitali ibridi Coniugazione π 02/03/2008 Antonino Polimeno 1 Molecole poliatomiche (1) - Siamo ora
Lezione 3 - Legame chimico
 Lezione 3 - Legame chimico Generalità sul legame chimico Strutture di Lewis Elettronegatività e legame chimico Il legame covalente Gli orbitali molecolari e Il legame ionico Il legame metallico Orbitali
Lezione 3 - Legame chimico Generalità sul legame chimico Strutture di Lewis Elettronegatività e legame chimico Il legame covalente Gli orbitali molecolari e Il legame ionico Il legame metallico Orbitali
LA STRUTTURA DELLE MOLECOLE. Le Molecole Poliatomiche
 LA STRUTTURA DELLE MOLECOLE Le Molecole Poliatomiche LE MOLECOLE POLIATOMICE Le molecole poliatomiche sono quelle molecole che sono composte da più di due atomi e contengono nella maggior parte dei casi
LA STRUTTURA DELLE MOLECOLE Le Molecole Poliatomiche LE MOLECOLE POLIATOMICE Le molecole poliatomiche sono quelle molecole che sono composte da più di due atomi e contengono nella maggior parte dei casi
Esercizi sulle Forze Intermolecolari
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO
 I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
Energia potenziale. d l. E p
 IL LEGAME COVALENTE Legame covalente Si riscontra in composti molecolari i cui atomi costituenti sono uguali o per i quali non si può avere trasferimento elettronico. H 2 N 2 Cl 2 HCl CO in un legame covalente
IL LEGAME COVALENTE Legame covalente Si riscontra in composti molecolari i cui atomi costituenti sono uguali o per i quali non si può avere trasferimento elettronico. H 2 N 2 Cl 2 HCl CO in un legame covalente
Anche tra le molecole si instaurano forze di attrazione, meno intense dei legami chimici, che vengono chiamate legami secondari o legami deboli.
 I legami chimici Gli atomi isolati sono in generale instabili e tendono naturalmente a combinarsi attraverso legami chimici per formare molecole e aggregati cristallini caratterizzati da maggiore stabilità.
I legami chimici Gli atomi isolati sono in generale instabili e tendono naturalmente a combinarsi attraverso legami chimici per formare molecole e aggregati cristallini caratterizzati da maggiore stabilità.
Teorie del legame chimico. Teorie del legame chimico
 Teorie del legame chimico Le teorie proposte per la trattazione del legame chimico si prefiggono i seguenti scopi: 1. Prevedere la formazione di un legame tra due elementi 2. Predire la lunghezza del legame
Teorie del legame chimico Le teorie proposte per la trattazione del legame chimico si prefiggono i seguenti scopi: 1. Prevedere la formazione di un legame tra due elementi 2. Predire la lunghezza del legame
Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame
 IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
LEGAMI CHIMICI e GEOMETRIA MOLECOLARE
 DAI LEGAMI CH HIMICI ALLA GEOMETRIA DELLE MOLECOLE. LEGAMI CHIMICI e GEOMETRIA MOLECOLARE Cos è un legame chimico? Il legame chimico non esiste Quanti tipi di legame? Legame ionico Legame covalente LEGAME
DAI LEGAMI CH HIMICI ALLA GEOMETRIA DELLE MOLECOLE. LEGAMI CHIMICI e GEOMETRIA MOLECOLARE Cos è un legame chimico? Il legame chimico non esiste Quanti tipi di legame? Legame ionico Legame covalente LEGAME
Chimica e chimica della vita. Chimica della vita. Atomi. Materia ed elementi. Tavola periodica degli elementi. Elementi ed atomi
 Chimica e chimica della vita Tocca, Oliver diceva, lanciandomi una barretta non c è niente al mondo come il tungsteno sinterizzato Batteva sulle barrette e queste emettevano un tintinnio profondo Il suono
Chimica e chimica della vita Tocca, Oliver diceva, lanciandomi una barretta non c è niente al mondo come il tungsteno sinterizzato Batteva sulle barrette e queste emettevano un tintinnio profondo Il suono
Forze intermolecolari
 Forze intermolecolari Le forze intermolecolari sono forze attrattive tra molecole, tra ioni o tra ioni e molecole. In assenza di tali forze tutte le molecole sarebbero gas le molecole possono stabilire
Forze intermolecolari Le forze intermolecolari sono forze attrattive tra molecole, tra ioni o tra ioni e molecole. In assenza di tali forze tutte le molecole sarebbero gas le molecole possono stabilire
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2
 ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
STRUTTURA DELL'ATOMO
 STRUTTURA DELL'ATOMO L'atomo è costituito da un nucleo centrale costituito da protoni (carica positiva 1,62*10-19 coulomb) e neutroni (privi di carica), intorno al quale ruotano uno o più elettroni (carica
STRUTTURA DELL'ATOMO L'atomo è costituito da un nucleo centrale costituito da protoni (carica positiva 1,62*10-19 coulomb) e neutroni (privi di carica), intorno al quale ruotano uno o più elettroni (carica
Esercizi sulle Geometrie Molecolari
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Geometrie Molecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Geometrie Molecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
.. O. I LEGAMI CHIMICI
 I LEGAMI CHIMICI Gli atomi isolati, tranne i gas nobili, avendo livelli energetici esterni incompleti, sono instabili e di conseguenza hanno un elevata energia Per aumentare la stabilità modificano la
I LEGAMI CHIMICI Gli atomi isolati, tranne i gas nobili, avendo livelli energetici esterni incompleti, sono instabili e di conseguenza hanno un elevata energia Per aumentare la stabilità modificano la
1) Bilanciare la seguente reazione redox con il metodo ionico-elettronico Ag (s) + H + (aq) + NO 3
 A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
Poniamo il carbonio al centro, tre idrogeni sono legati al carbonio direttamente e uno attraverso l ossigeno
 Strutture di Lewis E un metodo semplice per ottenere le formule di struttura di composti covalenti nota la formula molecolare, la configurazione elettronica del livello di valenza degli atomi e la connettività
Strutture di Lewis E un metodo semplice per ottenere le formule di struttura di composti covalenti nota la formula molecolare, la configurazione elettronica del livello di valenza degli atomi e la connettività
Composti di coordinazione
 Composti di coordinazione Nelle molecole di un COMPOSTO DI COORDINAZIONE l atomo centrale e legato ad un numero di atomi superiore al suo numero di ossidazione. Lo studio dei composti di coordinazione
Composti di coordinazione Nelle molecole di un COMPOSTO DI COORDINAZIONE l atomo centrale e legato ad un numero di atomi superiore al suo numero di ossidazione. Lo studio dei composti di coordinazione
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU)
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
Trasformazioni chimiche:
 Il legame chimico 1 Trasformazioni chimiche Trasformazioni chimiche: Le sostanze si trasformano in altre sostanze aventi proprietà differenti (livello macroscopico). Le trasformazioni chimiche avvengono
Il legame chimico 1 Trasformazioni chimiche Trasformazioni chimiche: Le sostanze si trasformano in altre sostanze aventi proprietà differenti (livello macroscopico). Le trasformazioni chimiche avvengono
Chimica (A.A. 2010/2011)
 Chimica (A.A. 2010/2011) Il legame chimico. Tipi di legame e proprietà generali. Il legame ionico (cenni). Il legame covalente. Teoria del legame di valenza (Ibridazione. Formule di struttura e rappresentazioni
Chimica (A.A. 2010/2011) Il legame chimico. Tipi di legame e proprietà generali. Il legame ionico (cenni). Il legame covalente. Teoria del legame di valenza (Ibridazione. Formule di struttura e rappresentazioni
Proprietà Chimico-fisiche dei composti organici
 Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
CHIMICA: studio della struttura e delle trasformazioni della materia
 CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
Legame e struttura molecolare
 2016 2017 CCS Biologia CCS-Scienze Geologiche 1 Legame e struttura molecolare Orbitali atomici Molecole Cap 9. 1-3, 15-16, 18, 21-23, 40 CONSIDERAZIONI PRELIMINARI 2 Le strutture di Lewis e la teoria VSEPR
2016 2017 CCS Biologia CCS-Scienze Geologiche 1 Legame e struttura molecolare Orbitali atomici Molecole Cap 9. 1-3, 15-16, 18, 21-23, 40 CONSIDERAZIONI PRELIMINARI 2 Le strutture di Lewis e la teoria VSEPR
Corso di CHIMICA LEZIONE 1
 Corso di CHIMICA LEZIONE 1 MATERIA tutto ciò occupa spazio e ha massa si presenta in natura sottoforma di Miscugli: sostanze mescolate insieme in vario modo (rocce, acqua marina, aria, cellule) Sostanze
Corso di CHIMICA LEZIONE 1 MATERIA tutto ciò occupa spazio e ha massa si presenta in natura sottoforma di Miscugli: sostanze mescolate insieme in vario modo (rocce, acqua marina, aria, cellule) Sostanze
Esercizi sui Solidi. Insegnamento di Chimica Generale CCS CHI e MAT. A.A. 2015/2016 (I Semestre)
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Solidi Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio 1 Che composto
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Solidi Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio 1 Che composto
PERCORSI ABILITANTI SPECIALI CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA
 PERCORSI ABILITANTI SPECIALI 2014 - CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA Cognome Nome Numero progressivo sul registro 1. Viene disciolto zucchero in un certo volume di acqua pura fino a che si
PERCORSI ABILITANTI SPECIALI 2014 - CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA Cognome Nome Numero progressivo sul registro 1. Viene disciolto zucchero in un certo volume di acqua pura fino a che si
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
Le reazioni di ossido-riduzione
 Le reazioni di ossido-riduzione Si dicono reazioni di ossidazione e di riduzione (o ossido-riduzione) quelle reazioni che avvengono con cambiamento del numero di elettroni che una specie chimica coinvolge
Le reazioni di ossido-riduzione Si dicono reazioni di ossidazione e di riduzione (o ossido-riduzione) quelle reazioni che avvengono con cambiamento del numero di elettroni che una specie chimica coinvolge
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare
 Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
GEOMETRIA MOLECOLARE
 GEOMETRIA MOLECOLARE Le molecole hanno geometrie spaziali ben definite caratterizzate da distanze di legame ed angoli di legame. Questi possono essere determinati sperimentalmente (es. raggi X). Si vede
GEOMETRIA MOLECOLARE Le molecole hanno geometrie spaziali ben definite caratterizzate da distanze di legame ed angoli di legame. Questi possono essere determinati sperimentalmente (es. raggi X). Si vede
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
Metodi basati sulla meccanica quantistica
 Metodi basati sulla meccanica quantistica La descrizione più corretta della struttura elettronica delle molecole, come quella degli atomi, è basata sulla meccanica quantistica. Esistono due principali
Metodi basati sulla meccanica quantistica La descrizione più corretta della struttura elettronica delle molecole, come quella degli atomi, è basata sulla meccanica quantistica. Esistono due principali
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I - (aq) + NO 3
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
CHIMICA ORGANICA PER BIOTECNOLOGIE con esercitazioni di LABORATORIO D. Savoia
 CHIMICA RGANICA PER BITECNLGIE con esercitazioni di LABRATRI D. Savoia Brown, Poon - Introduzione alla Chimica rganica Brown, Foote - Chimica rganica Bruyce - Chimica rganica Solomons McMurray Etc Cos
CHIMICA RGANICA PER BITECNLGIE con esercitazioni di LABRATRI D. Savoia Brown, Poon - Introduzione alla Chimica rganica Brown, Foote - Chimica rganica Bruyce - Chimica rganica Solomons McMurray Etc Cos
LE MOLECOLE. 5.1 I legami molecolari 5.2 Le forze di Van der Walls 5.3 Il legame idrogeno 5.4 La teoria VSEPR
 LE MOLECOLE 5.1 I legami molecolari 5.2 Le forze di Van der Walls 5.3 Il legame idrogeno 5.4 La teoria VSEPR 5.1 I legami molecolari Si ha un legame chimico quando una forza di natura elettrostatica tiene
LE MOLECOLE 5.1 I legami molecolari 5.2 Le forze di Van der Walls 5.3 Il legame idrogeno 5.4 La teoria VSEPR 5.1 I legami molecolari Si ha un legame chimico quando una forza di natura elettrostatica tiene
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
La forma delle molecole
 La forma delle molecole Geometria molecolare: disposizione relativa nello spazio degli atomi costituenti una molecola o un composto covalente a struttura infinita La geometria delle molecole si esprime
La forma delle molecole Geometria molecolare: disposizione relativa nello spazio degli atomi costituenti una molecola o un composto covalente a struttura infinita La geometria delle molecole si esprime
Teoria degli orbitali ibridi
 Legami σ e π Teoria degli orbitali ibridi FORMAZIONE DEI LEGAMI CHIMICI COVALENTI L orbitale della molecola H 2 ha simmetria cilindrica intorno all asse internucleare H-H LEGAME SIGMA Gli orbitali molecolari
Legami σ e π Teoria degli orbitali ibridi FORMAZIONE DEI LEGAMI CHIMICI COVALENTI L orbitale della molecola H 2 ha simmetria cilindrica intorno all asse internucleare H-H LEGAME SIGMA Gli orbitali molecolari
Roberta Pierattelli. Metalli in Biologia. Qualche richiamo di chimica generale e inorganica
 Roberta Pierattelli Metalli in Biologia Qualche richiamo di chimica generale e inorganica Le proprietà periodiche n =1 n =2 n =3 n =4 n =5 n =6 n =7 Il numero del gruppo corrisponde alla somma degli elettroni
Roberta Pierattelli Metalli in Biologia Qualche richiamo di chimica generale e inorganica Le proprietà periodiche n =1 n =2 n =3 n =4 n =5 n =6 n =7 Il numero del gruppo corrisponde alla somma degli elettroni
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica -
 Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
Simulazioni del Test di Accesso Macroarea Scientifico-Tecnologica - Domande di Chimica - C1) ll numero atomico di un elemento rappresenta: a) il numero di elettroni b) il numero di protoni c) la somma
I LEGAMI CHIMICI. I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune
 I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
Idrogeno (H) Azoto (N) La materia è costituita da elementi chimici. In natura sono presenti 92 elementi
 Gli organismi sono fatti da MATERIA*. (*qualsiasi cosa che occupa uno spazio e ha una massa) Gli antichi filosofi greci dicevano che la materia deriva da 4 ingredienti di base o ELEMENTI (ARIA, ACQUA,
Gli organismi sono fatti da MATERIA*. (*qualsiasi cosa che occupa uno spazio e ha una massa) Gli antichi filosofi greci dicevano che la materia deriva da 4 ingredienti di base o ELEMENTI (ARIA, ACQUA,
Cos è un trasformazione chimica?
 Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Tavola Periodica degli Elementi
 Tavola Periodica degli Elementi È possibile classificare gli elementi? Hp: In base alla massa atomica. Ogni 8 elementi le proprietà si ripetono. Incongruenze A Ar >A K Il Problema Le proprietà Chimiche
Tavola Periodica degli Elementi È possibile classificare gli elementi? Hp: In base alla massa atomica. Ogni 8 elementi le proprietà si ripetono. Incongruenze A Ar >A K Il Problema Le proprietà Chimiche
Il legame covalente , P 4 , O 3 , N 2
 Il legame covalente Nel legame covalente gli elettroni responsabili del legame sono condivisi tra i due atomi legati: essi percorrono nel tempo lo spazio intorno a entrambi gli atomi, nonché la regione
Il legame covalente Nel legame covalente gli elettroni responsabili del legame sono condivisi tra i due atomi legati: essi percorrono nel tempo lo spazio intorno a entrambi gli atomi, nonché la regione
CORSO DI CHIMICA ORGANICA. Testo consigliato: Chimica Organica H.Hart,D.J.Hart, L.E.Craine Zanichelli
 CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
Elementi di Chimica Organica
 CORSO DI LAUREA IN BIOINFORMATICA Elementi di Chimica Organica Mariapina D Onofrio (mariapina.donofrio@univr.it) Orario ricevimento: mar e giov 11:30-13:30 Corso: 6 CFU = 48 ORE Lezioni: Mar 8:30-10:30,
CORSO DI LAUREA IN BIOINFORMATICA Elementi di Chimica Organica Mariapina D Onofrio (mariapina.donofrio@univr.it) Orario ricevimento: mar e giov 11:30-13:30 Corso: 6 CFU = 48 ORE Lezioni: Mar 8:30-10:30,
I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di energia.
 LEGAME COVALENTE H. +.H d H:H Lewis (oppure H-H Kekulè) 1s 1s 1s 2 1s 2 I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di
LEGAME COVALENTE H. +.H d H:H Lewis (oppure H-H Kekulè) 1s 1s 1s 2 1s 2 I due atomi di idrogeno condividono un elettrone ciascuno, raggiungendo ambedue la configurazione stabile 1s 2 guadagno globale di
