EMOGASANALISI ARTERIOSA
|
|
|
- Pietro Brunetti
- 7 anni fa
- Visualizzazioni
Transcript
1 EMOGASANALISI ARTERIOSA U.O.S PNEUMOLOGIA Ospedale «PISPICO» POGGIARDO Dott.ssa L.FERRAMOSCA
2 EMOGASANALISI ARTERIOSA E FACILE DA ESEGUIRE E RAPIDA E SOLO LIMITATAMENTE INVASIVA COMPLICANZE INFREQUENTI E DI SCARSA ENTITA
3 - ph - pco 2 - po 2 - B. E. -HCO - 3
4
5 EMOGASANALISI ARTERIOSA PH PCO mmhg HCO meq/l
6 ALTERAZIONI DELL EQUILIBRIO ACIDO-BASE VALORI DI RIFERIMENTO PH 7.4 PaCO2 40 mmhg HCO3-24 mmeq
7 L EGA rappresenta l esame principe dell urgenza, poiché è un ottima finestra su: VENTILAZIONE ALVEOLARE SCAMBIO GASSOSO PH ed EQUILIBRIO ACIDO-BASE In particolare l equilibrio acido-base è una spia di importanti funzioni come lo STATO DI IDRATAZIONE (pz disidratati presentano alcalosi metabolica), LA CIRCOLAZIONE (pz in stato di shock presentano acidosi metabolica)
8 Eq. Idroelettrolitico Eq. Acido-base Equilibrio osmolare F. Sgambato, S Prozzo, Eur.Resp.News
9 Equilibrio Acido-Base E UNO DEI PIU COMPLESSI E SOFISTICATI SISTEMI DI REGOLAZIONE ATTIVI NELL UOMO REGOLA LA CONCENTRAZIONE IDROGENIONICA [ H+] NEI LIQUIDI CORPOREI ATTRAVERSO MECCANISMI DI CONTROLLO. Ph = -log [H+]= LOG 1/[H+]
10 Equilibrio fra gli acidi e le basi ACIDO BASE H+ H+
11 IL NOSTRO ORGANISMO PRODUCE QUOTIDIANAMENTE ACIDI ( H+) E NON BASI (OH E NON BASI (OH-).
12 METABOLISMO COMPLETO ENERGIA ATP + CO2 + H20 H2CO CO3 H+ HCO3- Metabolismo intermedio Ac. Lattico Ac. Piruvico Ac. Citrico AC. Urico Metionina, Cisteina H+
13 Forme di acidi fissi e volatili Acidi Fissi Inorganici H 3 PO 4 (Fosfati organici, proteine) H 2 SO 4 (AA solforati) Acidi Volatili H 2 CO 3 CO 2 + H 2 O Organici Acido lattico Chetoacidi Tossici Farmaci
14 IL nostro organismo tende a produrre acidi per effetto del metabolismo: quotidianamente vengono prodotti nmoli di acidi volatili (CO2) che vengono eliminati con la respiarazione e 80 nmoli di acidi fissi che vengono eliminati dal rene. L organismo si difende contro le variazioni della concentrazione H+ con i sistemi tamponi, che se anche molto efficienti e veloci sono una fonte limitata ed esauribile: i polmoni intervengono nel giro di pochi minuti, i reni nel giro di qualche ora, ma completano il loro intervento solo dopo 2-3 giorni.
15 Impatto della dieta sull equilibrio acido-base (Dieta media con circa g. di proteine prevalentemente animali) - Produzione di acidi 240 meq - Produzione di basi (rimozione di acidi) 170 meq Il bilancio netto è di circa 70 meq di H + che si accumulano nell organismo (1 meq/kg/die)
16 SANGUE H+ H+ = 0,00004 millieq./l Log = 1 H PH
17 LA PIU IMPORTANTE PROPRIETA DEL SANGUE E LA SUA STRAORDINARIA ABILITA NEL NEUTRALIZZARE LARGHE QUANTITA DI ACIDI O BASI SENZA PERDERE LA SUA REAZIONE NEUTRA HENDERSON
18 PERCHE E IMPORTANTE CHE IL PH RIMANGA PRESSOCHE COSTANTE?
19 A FRONTE DI UNA CONCENTRAZIONE ESTREMAMENTE BASSA, GLI H+ SONO DOTATI DI UN ATTIVITA BIOLOGICA ESTREMAMENTE ELEVATA INTERAGISCONO CON I SITI DI VARIE MOLECOLE DI CUI MODIFICANO LA CONFORMAZIONE: - PROTEINE ENZIMATICHE (PFK) SONO RESPONSABILI DELL EFFICIENZA DI SISTEMI CONTRATTILI: ACTINA- MIOSINA AGISCONO SUI CANALI IONICI
20 ph - Il ph nel sangue deve essere sempre mantenuto in limiti molto stretti (VN di ph = ) 7.45) che corrispondono a una concentrazione di H+ di nmol/l (35 sta per un ph di 7.45 e 45 per un valore di ph di 7.35)..Valore maggiori di 120 nmol/l (ph=6.95) o minori di 20 nmol/l (ph=7.70) non sono compatibili con la vita. -valori di normalita (RANGE STRETTO) PH= 740 ( 7,35-7,45 7,45 ) VALORI COMPATIBILI CON LA VITA TRA 6,9 -- 7,70
21
22 Tamponi chimici BICARBONATO/ AC. CARBON pochi secondi H+ + HCO3- H2CO CO3 CO2+ H2O Tamponi biologici pochi secondi CELLULE Proteine Hb Fosfati POLMONI Tamponi fisiologici RENI
23 Meccanismi che limitano e/o correggono modificazioni della concentrazione idrogenionica nell organismo Sistemi tampone Sistema di prima difesa verso le alterazioni acido-basiche + trasporto acidi e basi verso gli apparati escretori (rene e polmone) Rene eliminazione acidi fissi (e basi) Polmone eliminazione acidi volatili (CO2) derivanti dal metabolismo dei nutrienti o dal tamponamento di acidi da parte del bicarbonato
24
25 TESSUTI CO2 CO2 CO2 CO2 CO2 CO2 CO2 CO2+H2O AC.CARBONICO VENTILAZIONE POLMONI CO2+H2O CO2 CO2 CO2 CO2 CO2 CO2 + H2O H2CO3 H+ HCO3- CL- HCO3- CO2+ H2O H2CO3 HCO3- -> HCO3- +H meq meq di CO2 [H+ volatili o respiratori)))
26 50-75 meq ( H+ fissi o metabolici) Ac. Lattico Ac. Piruvico Ac. Citrico H+ NH3 H+ Fosfati NH4+ AT H+ HCO3-
27 ESCEZIONE DI IDROGENIONI
28 KEY MESSAGE! ESCREZIONE DI H + NEL RENE Tutti gli H + prodotti devono comunque essere escreti dal rene rigenerando il bicarbonato La reazione di rigenerazione del bicarbonato avviene nel tubulo renale Gli H + escreti nelle urine devono comunque essere tamponati. I tamponi urinari sono il fosfato e l ammoniaca
29 I TAMPONI DEL SANGUE FORMULA DA SAPERE A MEMORIA H+ = PaCO2 / HCO3-
30
31 EQUILIBRIO ACIDO-BASE ACIDEMIA ALCALEMIA PH < 7.36 H + > 44 nmol/l PH > 7.44 H + < 36 nmol/l ACIDOSI Condizione patologica in cui c è tendenza alla diminuzione del PH se non subentra un meccanismo di compenso al processo primario ALCALOSI Condizione patologica in cui c è tendenza all aumento del PH se non subentra un meccanismo di compenso al processo primario
32 ACIDOSI RESPIRATORIA 1 ALCALOSI RESPIRATORIA 2 ACIDOSI METABOLICA 3 ALCALOSI METABOLICA 4
33 Com. METABOLICa HCO3- PH = pk+ log [HCO3- ] [CO2 ] CO2 PH Com. RESPIRATORIA ACIDOSI RESPIRATORIA
34 PCO2>44 PH<7.38 AUMENTATA PRODUZIONE DI CO2 FEBBRE SFORZO DIETA ABNORMEMENTE RICCA DI GLUCIDI IPOVENTILAZIONE ALVEOLARE MAL. VIE AEREE E PARENCHIMA POLM. RIDOTTA ELIMINAZIONE DI CO2 MAL. NEUROMUSCOLARI MAL. DELLA GABBIA TORACICA PCO2= VCO2 VA DEPRESSIONE DEI CENTRI RESPIRATORI FARMACI: OPPIACEI O2 TERAPIA NEI BPCO
35 Mai superiore a 30 meq/l! N Fino a meq/l Per ogni aumento di PCO2 di 10 mmhg i HCO3- aumentano di 1 m Eq/L (ACUTA ) e di 4 meq/ L ( CRONICA) Perdita di CL-
36 EFFETTI FUNZIONALI VASODILATAZIONE CEREBRALE P LIQUOR RIDOTTA CONTRATTILITA MIOCARDICA ALTERAZIONI RITMO MANIFESTAZIONI CLINICHE Cefalea, psicosi Sonnolenza Irritabilità neuromuscolare Coma Scompenso cardiaco Aritmie RIDUZIONE CONTRATTILITA DIAFRAMMA FATICA MUSCOLARE PERFORMANCE M. RESPIRATORI
37 VASODILATAZIONE SISTEMICA IPOTENSIONE VASOCOSTRIZIONE POLMONARE IPERTENSIONE POLMONARE BRONCOCOSTRIZIONE
38 ACIDOSI RESPIRATORIA ESEMPI Ph PaCO2 PaO2 HCO H+ = PCO2 / HCO3- Ph VALORI DI RIFERIMENTO PH 7.4 PaCO2 40 mmhg HCO3-24 mmeq
39 Com. METABOLICA Hco3- PH = pk+ log [HCO3- ] [CO2 ] CO2 PH Com. RESPIRATORIA ALCALOSI RESPIRATORIA RIDUZ. VENTILAZ
40 PIU FREQUENTE RISCONTRO SPESSO MISCONOSCIUTA PCO2 36 mmhg PH >7.44 IPERVENTILAZIONE ALVEOLARE DOVUTA INCREMENTO DRIVE NERVOSO AI M. RESPIRATORI
41 CON AZIONE DIRETTA SUL S.N.C. CON AZIONE MEDIATA DAL S.N.P. SUL S.N. C. ORIGINE PSICOGENA ( Ansia, isterismo ) PATOLOGIE SNC: -Infezioni ( meningiti, encefaliti) -Traumi -Ictus ORMONI ENDOGENI Progesterone (gravidanza) SOSTANZE ENDOGENE IN ALCUNE PATOLOGIE Falsi neurotrasm. Ins. Epat. IPOTENSIONE GRANDI ALTEZZE PATOLOGIE APP. RESP. Embolia Polmonare Fibrosi Polmonare Edema Polmonare Acuto Polmoniti STIMOLO DOLOROSO VENTILATORI!!
42 N Per ogni diminuzione di PCO2 di 10 mmhg i HCO3- si riducono di 2 meq/l( ACUTA) E di 5-7 Meq / L ( CRONICA) Perdita di NA+ IPOSODIEMIA Perdita di K+ IPOKALIEMIA Ritenzione di Fosfati
43 EFFETTI FUNZIONALI MANIFESTAZIONI CLINICHE RIDUZIONE FLUSSO EMATICO CEREBRALE ANSIA TREMORI- SENSAZIONI DI TESTA VUOTA AUMENTO ECCITABILITA NEUROMUSCOLARE PARESTESIE ARTI SPASMO CARPO- PEDALE CARDIOPALMO ALTERAZIONI E..C.. G
44 ALCALOSI RESPIRATORIA ESEMPI Ph PaCO2 PaO2 HCO H+ = PCO2 / HCO3- Ph Per ogni diminuzione di PCO2 di 10 mmhg i HCO3- si riducono di 2 meq/l( ACUTA) E di 5-7 Meq / L ( CRONICA
45 KEY MESSAGE! DISTURBI RESPIRATORI Si ha un disordine respiratorio primario quando la PaCO 2 ha valori anormali e la sua variazione è di senso opposto rispetto a quella del PH.
46 Com. METABOLICA ACIDOSI METABOLICA (CON ACIDEMIA ) PH = pk+ log [HCO3- ] [CO2 ] HCO3- PH Com. RESPIRATORIA RIDUZIONE PaCO2(20-30 MMHG X IPERVENTILAZ. ) 10 mm HG Pa CO2 PER 10 mm/l [HCO3] è
47 SE TROVO UNA ACIDOSI CON PaCO2 BASSO??? SE NON E UNA ACIDOSI RESPIRATORIA E UNA ACIDOSI METABOLICA!! LA CAUSA E UNA PERDITA DI BICARBONATI SI DEVE IPERVENTILARE PER COMPENSO H+ = PCO2 / HCO3- Ph
48 ACIDOSI METABOLICA ETIOPATOGENESI 1 ) Aumentata produzione di acidi Endogena Acidosi lattica (diabete ) Chetoacidosi Apporto esogeno di acidi o precursori di acidi Tossici 2) Perdita di bicarbonati a) Perdita diretta Via gastroenterica (diarrea, fistole biliari, pancreatiche, intestinali, ingest. salicilati Via renale (acidosi tubulari prossimali) b) Perdita indiretta di bicarbonati (ridotta capacità di rigenerazione renale dei bicarbonati per deficit di eliminazione urinaria di NH 4+ ) insufficienza renale acuta o cronica, acidosi tubulari distali
49 Acidosi Metabolica. Legata ad un eccesso di acidi fissi nel sangue con aumento di ioni H+ e conseguente diminuzione delle basi tampone. Si verifica nella chetoacidosi diabetica e alcolica, in alcune intossicazioni, nelle situazioni che determinano acidosi lattica come lo shock, l etilismo, alterazioni del metabolismo glicidico. Opportuno il ricorso alla somministrazione di basi tampone come il bicarbonato di sodio.
50 MECCANISMI DI COMPENSO ACIDOSI METABOLICA 1) Sistemi tampone extra- ed Intracellulari 2) Polmone (se il sistema ventilatorio è adeguato) 3) Rene (se non è causa primitiva dell acidosi metabolica)
51 ACIDOSI METABOLICA: ESEMPI Ph PaCO2 PaO2 HCO MA SE ACIDOSI RESPIRATORIA!!
52 ALCALOSI METABOLICA Com. METABOLICA HCO3- PH PH = pk+ log [HCO3- ] [CO2 ] Com. RESPIRATORIA Aumento di CO2 variabile e di modesta entita Limite di compenso : mm HG
53 ALCALOSI METABOLICA. Dovuta ad eccessiva perdita di idrogenioni e di altri elettroliti come avviene nel vomito o nelle occlusioni intestinali o per cause renali come nell iperaldosteronismo primario e secondario o per l utilizzo di alcuni diuretici. Altre volte è legata all aumento delle basi tampone come può accadere per abuso di assunzione di bicarbonato o in antibioticoterapie ad alte dosi con penicillina (perdita di K), o nel corso di alcuni stati caratterizzati da ipovolemie gravi.
54 ALCALOSI METABOLICA ESEMPI Ph PaCO2 PaO2 HCO MA SE ALCALOSI RESPIRATORIA!!
55 SE TROVO UNA ALCALOSI E PaCO2 ALTO? SE NON E UNA ALCALOSI RESPIRATORIA E UNA ALCALOSI METABOLICA LA CAUSA E UN ECCESSO DI BICARBONATI NEI DISIDRATATI DEVO IPOVENTILARE PER COMPENSO H+ = PCO2 / HCO3- Ph
56 KEY MESSAGE! DISORDINI METABOLICI Si ha un disordine metabolico primario quando il PH ha valori anormali e la sua variazione va nello stesso senso di quella della PaCO 2
57 KEY MESSAGE! RIASSUMENDO SE HO UNA ACIDOSI CON PaCO2 ALTA E RESPIRATORIA ALTRIMENTI E METABOLICA SE HO UNA ALCALOSI CON PaCO BASSA E RESPIRATORIA ALTRIMENTI E METABOLICA
58 DISORDINI DELL EQUILIBRIO ACIDO-BASE DISORDINE VARIAZIONE PRIMARIA PH COMPENSO Acidosi respiratoria PCO 2 HCO 3 - Alcalosi respiratoria PCO 2 HCO 3 - Acidosi metabolica HCO 3 - PCO 2 Alcalosi metabolica HCO 3 - PCO 2 Obiettivo finale è mantanere un rapporto PCO 2 HCO 3 - COSTANTE
59 COMPENSO ATTESO Dall esame di un enorme numero di EGA sono stati derivati i compensi che normalmente sono attesi. Tali compensi attesi permettono di capire se il disturbo è SEMPLICE (quando il compenso atteso viene soddisfatto) o se è MISTO (quando il compenso non è soddisfatto. Slatentizzare un disturbo misto significa comprendere un quadro clinico ed eseguire un adeguata terapia.
60
61
62
63
64
65 La PaO 2 e tutti ivalori da essa derivati permettono di capire: La PaO 2 e tutti ivalori da essa derivati permettono di capire: Pump/lung failure POSIZ. DELLACURVA DI DISSOCIAZ. HB RAPORTO PaO2 / FIO2
66
67
68
69
70
71
72
73
74
75
76
77
78
79
80
81
82
83
84
85
86
87
88
89
90
91
92
93
94
95
96 La PaO 2 e tutti ivalori da essa derivati permettono di capire: 1. Pump/lung failure 2. Posizione della curva di dissociazione dell Hb 3. Rapporto PaO 2 /FiO 2 Condition Timing PaO 2 /FiO 2 Rx-torace P.incuneamento ALI Acute < 300 Infiltrati bilaterali ARDS Acute < 200 Infiltrati bilaterali < 18 mmhg No aum. p. atriale < 18 mmhg No aum. P. atriale
97
98 Diagnosi differenziale dell acidosi metabolica GAP ANIONICO AUMENTATO Acidosi metaboliche da aumentata produzione di acidi (endogena o da precursori esogeni): di che acidi si tratta?
99 Gap osmolare plasmatico: background L osmolarità è determinata dal numero di particelle osmoticamente attive presenti in una soluzione A determinare l osmolarità plasmatica concorrono sia sostanze ioniche che nonioniche In condizioni normali l osmolarità plasmatica è determinata da cationi, anioni, glucosio e urea e può essere misurata con un osmometro oppure calcolata dalla formula 2Na + glicemia/18 + azotemia/60)(vn mosm/l) L osmolarità potrà aumentare per aumento della concentrazione di ioni (praticamente solo il Na) o di sostanze nonioniche già presenti nel plasma(ad es. iperglicemia), oppure in seguito all aggiunta di sostanze esogene a basso peso molecolare (ad es. tossici non misurati di routine, come ad esempio alcooli o glicoli, oppure farmaci) La differenza tra osmolarità misurata e calcolata è di solito inferiore a 10 mosm/l Se la differenza aumenta possibile accumulo di sostanze esogene
100 Acidosi metaboliche: semeiotica di laboratorio SANGUE Gap anionico Gap osmolare Acido lattico e screening tossicologico (tossici e farmaci) URINE Indici diretti: Acidità titolabile e ammoniuria Indici indiretti Gap anionico urinario Gap osmolare urinario
101 Diagnosi differenziale dell acidosi metabolica GAP ANIONICO NORMALE Acidosi da perdita di bicarbonati (diretta o indiretta) è il rene responsabile della perdita di bicarbonati?
102 Presupposto fisiopatologico: il principale meccanismo di compenso all acidosi metabolica è rappresentato dall aumento dell ammoniuria (aumenta la rigenerazione di HCO3) nell acidosi metabolica, se la causa non è il rene, dovrà esserci una ammoniuria elevata Escrezione urinaria di ioni ammonio (NH 4+ ) Elevata (appropriata alla presenza di acidosi) il rene risponde appropriatamente all acidosi l acidosi è di origine extrarenale Bassa (inappropriata alla presenza di acidosi) il rene non risponde in maniera adeguata alla presenza di acidosi l acidosi è di origine renale
103 Diagnosi differenziale dell acidosi metabolica gap anionico normale (acidosi ipercloremiche) La via più breve è rappresentata dalla misura dell acidità titolabile (titolazione delle urine con una soluzione basica fino ad un ph sovrapponibile a quello ematico) e soprattutto dell ammoniuria Se il ph è < 5 in presenza di acidosi, la capacità di acidificazione è conservata, ma il problema è negli accettori di H+ (essenzialmente è un problema di produzione e/o secrezione di NH3 cioè di eliminazione di NH 4+ ); se il ph è maggiore di 6, il problema invece è nella secrezione di H + la somma dell acidità titolabile e dell ammoniuria esprime l escrezione acida netta; in condizioni fisiologiche l escrezione acida netta è pari a circa meq/kg nelle 24 ore, 2/3 dei quali sotto forma di ioni ammonio NH + 4 In condizioni di acidosi da cause non renali, l acidità titolabile resta praticamente invariata, mentre è soprattutto l escrezione di NH4 + che aumenta notevolmente (compenso renale), con valori a 200 meq nelle 24 ore e oltre Non sempre l ammoniuria è facilmente disponibile, e quindi si utilizzano indici derivati che forniscono indicazioni approssimative sull escrezione di ioni ammonio: il gap anionico urinario ed il gap osmolare urinario
104 Gap anionico urinario (carica urinaria netta): background fisiopatologico Il gap anionico urinario si calcola come (Na + + K + ) Cl - I principali cationi urinari sono Na +, K+, NH 4+, il principale anione è Cl - (se ph < 6.5 l HCO 3 non è infatti presente) In presenza di acidosi metabolica, se Cl - è maggiore della somma di Na + e K+ (carica urinaria netta negativa), per il principio dell elettroneutralità deve essere presente nelle urine un catione non misurato in quantità equivalente alla differenza di solito si tratta di NH 4+ risposta adattativa adeguata In presenza di acidosi, se Cl- è inferiore alla somma di Na + e K+, significa che NH 4+ è presente in scarsa quantità ( risposta adattativa inadeguata), oppure che NH 4+ è escreto con un altro anione come ad esempio l anione di un acido organico in questo caso per valutare indirettamente l escrezione di NH 4+ si deve utilizzare il gap osmolare urinario)
105 Gap anionico urinario (carica urinaria netta) Come si calcola (in meq/l o mmol/l) (Na + + K + ) Cl - Valore normale positivo In condizioni fisiologiche Cosa occorre per calcolarlo Na +, K +, Cl - urinari, in meq/l Volume di diuresi nelle 24 ore Misurazione ph urinario (deve essere inferiore a 6.5) Cosa significa E un marker dell escrezione urinaria di H + sotto forma di ioni ammonio (fornisce indicazioni sulla presenza di ioni ammonio, ma non è in grado di quantificarli con esattezza per questo è necessaria l ammoniuria) Limiti metodologici Non devono essere presenti altri cationi urinari in quantità elevate (è quasi sempre vero) Non devono essere presenti altri anioni urinari oltre al Cl - in quantità elevate (attenzione in caso di eliminazione di anioni di acidi organici, utilizzare il gap osmolare urinario) Non utilizzabile in urine alcaline
106 Esempio 1: Paziente con acidosi metabolica a gap anionico plasmatico normale Dati urinari (urine 24 ore): Na 100 meq, K 70 meq, Cl 370 meq Carica netta urinaria (Gap anionico urinario) ( ) 370 = L ammoniuria nelle 24 ore è elevata (appropriatamente) L acidosi è presumibilmente da cause extrarenali (per es diarrea, fistola intestinale etc.)
107 Esempio 2: Paziente con acidosi metabolica a gap anionico plasmatico normale Dati urinari (urine 24 ore): Na 100 meq, K 70 meq, Cl 70 meq Carica urinaria netta (Gap anionico urinario) ( ) 150 = 20 L ammoniuria nelle 24 ore è bassa (assente): il compenso è inappropriato L acidosi è presumibilmente da cause renali (per es insufficienza renale, acidosi tubulare renale etc.)
108
109 Acidosi metabolica da perdita di bicarbonati per via gastroenterica Diarrea Drenaggi chirurgici Fistole enteriche Ureterosigmoidostomie
110 pco2 La pco2 è un indicedellapressioneparzialedi caricoacido. La pco2 variain manieralinearecon la concentrazioneplasmaticadell acidocarbonico; ad un aumento dell acido carbonico corrisponde quindi un aumento della pco2 e viceversa.. Si misuracon un elettrodoa vetromodificato
111 po2 La po2 è un indice della concentrazione inspiratoria di 02 misurata a livello del mare in un adulto normale. Il contenuto arterioso in ossigeno deve essere il più alto possibile per apportare la quantità di ossigeno massimale al cuore e al cervello. Solitamente a ogni atto inspiratorio si introduce nel polmone una concentrazione di 20,9% di O2, e la po2 misurata su questo valore deve risultare > 80 mmhg; se risulta inferiore il paziente è ipossiemico. Si misura con un elettrodo amperometrico
112 Ione Bicarbonato I bicarbonati rappresentano il carico basico: ad 1,2 meq/l di acido devono corrispondere 24 meq/l di bicarbonati perchè la bilancia acido-base risulti in equilibrio. Non si misura ma si calcola dall equazione di Henderson Hasselbalch
113 BASE EXCESS (BE) BE o l Eccesso di Basi costituisce una misurazione del livellodi acidometabolicochenormalmenteè zero. Le basidel sangue(basitotali) sonocirca 48 mmol/l in rapportoallaconcentrazionedi emoglobina. Le modificazioni delle basi ematiche sono dette eccesso o deficit di basi. Quando diciamocheun pazienteha un eccessodi basidi menodieci significa chequestopazienteha un eccessodi acidometabolico(acidosi) di 10 meq/l. L eccessodi basiè utilizzatoper calcolarela quantità di trattamento richiesta per contrastare l acidosi. NON SI MISURA
114 CALCOLO BE Nel diagramma derivato da Nomogramma in Vivo di Siggaard-Andersen sono evidenziate le componenti respiratoria (PCO2) e metabolica (Base Excess) e come l interazione tra le due determini il ph.
115
116
117
118
119
120
121 Compensi acidosi metabolica alcalosi metabolica acidosi respiratoria alcalosi respiratoria riduzione PaCO2 (polmone) aumento PaCO2 (polmone) aumento bicarbonati (rene) riduzione bicarbonati (rene)
122
123
124 INTERPRETAZIONE A STEP DELL EGA V STEP IV STEP III STEP II STEP I STEP
125 Ruolo del rene nel mantenimento del bilancio acido-basico Riassorbimento del bicarbonato già presente nel sangue e che venendo filtrato dal glomerulo verrebbe perso nelle urine (tubulo prossimale) Eliminazione netta di H + (tubulo distale) La base fisiologica di entrambi gli effetti è rappresentata dalla secrezione di H+, a livello dei tubuli prossimale e distale
126 Come si esegue l EGA? - siringa eparinata - prelievo in anaerobiosi - - misurazione immediata
127 EFFETTUARE L ANALISI IN VICINANZA DEL LETTO DEL PZ TEMPESTIVE DECISIONI TERAPEUTICHE INTERVALLO DI TEMPO FRA PRELIEVO E ANALISI 10 MIN SE POSTO IN CONTENITORE DI GHIACCIO SI EVITA LA RIDUZIONE DELL O2 DOVUTA AL METABOLISMO OSSIDATIVO DEI G.BIANCHI I VALORI DI PH E DI PCO2 NON PRESENTANO SIGNIFICATIVE VARIAZIONI ANCHE DOPO DUE ORE DI CONSERVAZIONE A T. AMBIENTE EVITARE LA PRESENZA DI BOLLE D ARIA Una bolla d aria pari al 10% del volume di sangue provoca una riduzione della PO2 pari al 15%, specie se la siringa viene agitata
128
129 ALTERAZIONI DELL EQUILIBRIO ACIDO-BASE VALORI DI RIFERIMENTO PH 7.4 PaCO2 40 mmhg HCO3-24 mmeq
130 I TAMPONI DEL SANGUE I tamponi sono sali di acidi deboli che in soluzione sono capaci di legare gli idrogenioni H + I tamponi del sangue non rimuovono gli H + ma annullano il loro effetto in maniera temporanea L eliminazione vera avviene nel rene I principali tamponi del sangue sono le proteine, in particolare l emoglobina, (presente negli RBC) e lo ione bicarbonato (presente nell ECF).
131 I TAMPONI DEL SANGUE. 2 Mentre I tamponi semplici diventano rapidamente inefficaci (dopo che hanno legato l H + ), il bicarbonato continua a svolgere la funzione tampone perche l acido carbonico, viene rimosso dal processo della respirazione. Solo quando lo ione bicarbonato e stato saturato, perde la sua funzione tamponante. Quindi lo stato acido-base di un paziente e valutato facendo riferimento alla concentrazione di bicarbonato.
132
133 Equilibrio Acido- Base
134 Bicarbonatemia < 22 meq/l, ph < 7.36 Acidosi metabolica Calcolo gap anionico Aumentato Acidosi a gap anionico elevato Normale Acidosi a gap anionico normale o ipercloremiche Ricerca acidi organici endogeni o esogeni (intossicazioni) Carica urinaria netta elevata (Na+K < Cl) Cause extrarenali (ad es diarrea, fistole intestinali etc.) Carica urinaria netta assente (Na+K > Cl) Cause renali (ad es insufficienza renale, acidosi tubulari distali)
135 I TAMPONI DEL SANGUE L associazione di H + al bicarbonato e molto efficiente La dissociazione dell acido carbonico in CO 2 e H 2 O e invece piuttosto lenta Questa reazione e accelerata nell organismo dall enzima anidrasi carbonica (si trova principalmente negli eritrociti e nei reni)
136 KEY MESSAGE! GAP ANIONICO L AG è un parametro dello stato acido-base utilizzato nella valutazione dei pz che presentano un acidosi metabolica, allo scopo di determinare se il problema sottostante sia un accumulo di idrogenioni o una perdita di bicarbonato. AG è un parametro affidabile soltanto in caso valore proteico normale La concentrazione degli anioni (carichi negativamente) deve bilanciare quella dei cationi (carichi positivamente): Na + + NM = (Cl - + HCO - 3) + ANM ANM (anioni non misurati) = PROTEINE, ACIDI ORGANICI, FOSFATI, SOLFATI CNM (cationi non misurati) = CALCIO, POTASSIO, MAGNESIO v.n. AG = 3-11 meq/l
137 Gap anionico su sangue Come si calcola (in meq/l o mmol/l) : Na + (Cl - + HCO3 + ) Valore normale : Cosa occorre per calcolarlo? : Cosa significa? Emogasanalisi arteriosa Sodiemia Cloremia Quantifica gli anioni non misurati (in condizioni fisiologiche costituiti in gran parte dai siti anionici dell albumina) Viene utilizzato per individuare le acidosi da aumentata produzione endogena o a partire da precursori esogeni (acidosi a gap anionico aumentato)
138 GAP ANIONICO GA Accumulo di H + ACIDOSI LATTICA CHETOACIDOSI INSUFFICIENZA RENALE per diminuzione dell escrezione di H + Gli H + che si accumulano si legano ai bicabornati formando acido carbonico, facendo diminuire la quantità di bicarbonati GA = Perdita di HCO - 3 DIARREA FASE INIZIALE INSUFFICIENZA RENALE per perdita di bicarbonati nelle urine La perdita di ioni bicarbonato viene controbilanciata dagli ioni cloro in modo proporzionale
139 Bicarbonatemia < 22 meq/l ph < 7.36 Acidosi metabolica Calcolo gap anionico Aumentato Acidosi metaboliche da accumulo e/o aumentata produzione di acidi organici (lattico, chetoacidi, tossici esogeni etc.) Acidosi a gap anionico elevato Normale Acidosi metaboliche da perdita di bicarbonati, che può essere diretta (gastroenterica o renale) o indiretta (ridotta rigenerazione renale) Acidosi a gap anionico normale o ipercloremiche
EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI
 EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI SOMMARIO ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO ACIDO-BASE EGA (EMOGAS-ANALISI) ANALISI) ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO
EQUILIBRIO ACIDO-BASE ED APPLICAZIONE ALL EMOGAS EMOGAS-ANALISIANALISI SOMMARIO ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO ACIDO-BASE EGA (EMOGAS-ANALISI) ANALISI) ASPETTI GENERALI DELL EQUILIBRIO EQUILIBRIO
Plasma ph Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca
 Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
EMOGASANALISI ARTERIOSA
 EMOGASANALISI ARTERIOSA L EGA rappresenta l esame principe dell urgenza, poiché è un ottima finestra su: VENTILAZIONE ALVEOLARE SCAMBIO GASSOSO PH ed EQUILIBRIO ACIDO-BASE In particolare l equilibrio acido-base
EMOGASANALISI ARTERIOSA L EGA rappresenta l esame principe dell urgenza, poiché è un ottima finestra su: VENTILAZIONE ALVEOLARE SCAMBIO GASSOSO PH ed EQUILIBRIO ACIDO-BASE In particolare l equilibrio acido-base
Le reazioni metaboliche sono estremamente sensibili alla concentrazione degli ioni H + nel liquido in cui avvengono, perché gli ioni H + influenzano
 EQUILIBRIO ACIDOBASE Le reazioni metaboliche sono estremamente sensibili alla concentrazione degli ioni H + nel liquido in cui avvengono, perché gli ioni H + influenzano il funzionamento degli enzimi.
EQUILIBRIO ACIDOBASE Le reazioni metaboliche sono estremamente sensibili alla concentrazione degli ioni H + nel liquido in cui avvengono, perché gli ioni H + influenzano il funzionamento degli enzimi.
[H + ] X [A - ] [ HA ]
![[H + ] X [A - ] [ HA ] [H + ] X [A - ] [ HA ]](/thumbs/81/84332766.jpg) Equazione di Handerson-HasselbalchHasselbalch [H + ] X [A - ] [ HA ] = K [H + ]X[HCO3 - ] [H2C03] = K 1 Composizione aria O 2 = 20.93% CO 2 = 0.03% N 2 + gas nobili = 79.04% Pressione esercitata dai gas
Equazione di Handerson-HasselbalchHasselbalch [H + ] X [A - ] [ HA ] = K [H + ]X[HCO3 - ] [H2C03] = K 1 Composizione aria O 2 = 20.93% CO 2 = 0.03% N 2 + gas nobili = 79.04% Pressione esercitata dai gas
diminuito aumentato I disordini acido-base primari metabolici si riconoscono attraverso la valutazione della concentrazione di HCO3-
 diminuito aumentato I disordini acido-base primari metabolici si riconoscono attraverso la valutazione della concentrazione di HCO3- Risposta compensatoria all acidosi metabolica Compensazione polmonare
diminuito aumentato I disordini acido-base primari metabolici si riconoscono attraverso la valutazione della concentrazione di HCO3- Risposta compensatoria all acidosi metabolica Compensazione polmonare
CHIRURGIA III ED EMERGENZE MEDICO - CHIRURGICHE. Sezione di Anestesia e Rianimazione Dir. Prof. Carlo Alberto Volta
 CHIRURGIA III ED EMERGENZE MEDICO - CHIRURGICHE Sezione di Anestesia e Rianimazione Dir. Prof. Carlo Alberto Volta Equilibrio acido-base Ph normale: 7.35-7.45 Acidemia per ph < 7.35 Alcalemia per ph >
CHIRURGIA III ED EMERGENZE MEDICO - CHIRURGICHE Sezione di Anestesia e Rianimazione Dir. Prof. Carlo Alberto Volta Equilibrio acido-base Ph normale: 7.35-7.45 Acidemia per ph < 7.35 Alcalemia per ph >
Equilibrio acido base
 Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
a.a. 2017/18 Prof.ssa Pia Lucidi Laboratorio di Cognizione e Benessere Animale RICEVIMENTO: Lunedì 17:30-18:30
 a.a. 2017/18 Prof.ssa Pia Lucidi Laboratorio di Cognizione e Benessere Animale RICEVIMENTO: Lunedì 17:3018:30 Omeostasi acidobasica Gli enzimi operano ad un ph ottimale in un range molto ristretto (7.4
a.a. 2017/18 Prof.ssa Pia Lucidi Laboratorio di Cognizione e Benessere Animale RICEVIMENTO: Lunedì 17:3018:30 Omeostasi acidobasica Gli enzimi operano ad un ph ottimale in un range molto ristretto (7.4
Gli scambi gassosi LA MISURA DELLA FUNZIONE RESPIRATORIA. OLTRE LA SPIROMETRIA Torino, 5 ottobre 2013
 LA MISURA DELLA FUNZIONE RESPIRATORIA OLTRE LA SPIROMETRIA Torino, 5 ottobre 2013 Gli scambi gassosi Claudio Norbiato AO Ordine Mauriziano SC Medicina Interna Emogasanalisi L emogasanalisi e l analisi
LA MISURA DELLA FUNZIONE RESPIRATORIA OLTRE LA SPIROMETRIA Torino, 5 ottobre 2013 Gli scambi gassosi Claudio Norbiato AO Ordine Mauriziano SC Medicina Interna Emogasanalisi L emogasanalisi e l analisi
Rene ed equilibrio acido base. La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica. Principali funzioni renali
 Rene ed equilibrio acido base La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica Savi Umberto Scuola di Specializzazione in Nefrologia S.C. di Nefrologia e Dialisi Cattinara
Rene ed equilibrio acido base La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica Savi Umberto Scuola di Specializzazione in Nefrologia S.C. di Nefrologia e Dialisi Cattinara
ph = log 1/[H + ] = log [H + ]
![ph = log 1/[H + ] = log [H + ] ph = log 1/[H + ] = log [H + ]](/thumbs/49/24977942.jpg) ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE 1 I tamponi fisiologici del ph 1 - Il sistema acido carbonico-bicarbonato: H 2 CO 3 H + + HCO 3 pka = 6.1 ph = 6.1 + log [HCO 3 ] [H 2 CO 3 ] 2 - Il sistema fosfato:
L EQUILIBRIO ACIDO-BASE NEL SANGUE 1 I tamponi fisiologici del ph 1 - Il sistema acido carbonico-bicarbonato: H 2 CO 3 H + + HCO 3 pka = 6.1 ph = 6.1 + log [HCO 3 ] [H 2 CO 3 ] 2 - Il sistema fosfato:
EMOGASANALISI ARTERIOSA INTERPRETAZIONE
 EMOGASANALISI ARTERIOSA INTERPRETAZIONE A cosa serve? Esame rapido Valutare la ventilazione Valutare il metabolismo Valutare parametri quali: Emoglobina Glicemia Elettroliti Interpretazione emogasanalisi
EMOGASANALISI ARTERIOSA INTERPRETAZIONE A cosa serve? Esame rapido Valutare la ventilazione Valutare il metabolismo Valutare parametri quali: Emoglobina Glicemia Elettroliti Interpretazione emogasanalisi
Rene ed equilibrio acido-base
 Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Per le lezioni del prof. P.P. Battaglini Schemi di. v 3.2. ph = pka + log10 [!$]
![Per le lezioni del prof. P.P. Battaglini Schemi di. v 3.2. ph = pka + log10 [!$] Per le lezioni del prof. P.P. Battaglini Schemi di. v 3.2. ph = pka + log10 [!$]](/thumbs/92/108719223.jpg) Per le lezioni del prof. P.P. Battaglini Schemi di v 3.2 ph = pka + log10! " [!$] Dichiarazione Le immagini presenti in questo file sono state reperite in rete o modificate da testi cartacei. Queste immagini
Per le lezioni del prof. P.P. Battaglini Schemi di v 3.2 ph = pka + log10! " [!$] Dichiarazione Le immagini presenti in questo file sono state reperite in rete o modificate da testi cartacei. Queste immagini
Interpretazione dell emogasanalisi
 Interpretazione dell emogasanalisi Guglielmo IMBRIACO Gaetano TAMMARO Rianimazione Terapia Intensiva Ospedale MAGGIORE - Bologna A cosa serve l emogasanalisi? Esame rapido Valutare la ventilazione Valutare
Interpretazione dell emogasanalisi Guglielmo IMBRIACO Gaetano TAMMARO Rianimazione Terapia Intensiva Ospedale MAGGIORE - Bologna A cosa serve l emogasanalisi? Esame rapido Valutare la ventilazione Valutare
In base all equazione di Henderson-Hasselbalch
 Alterazioni dell equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Si ha acidosi quando il rapporto HCO 3 /CO 2 diminuisce, causando una diminuzione del ph.
Alterazioni dell equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Si ha acidosi quando il rapporto HCO 3 /CO 2 diminuisce, causando una diminuzione del ph.
ALTERAZIONI IDROELETTROLITICHE. ACIDO-BASE (2 parte) scaricato da EQUILIBRIO ACIDO-BASE (EAB) NECESSITA : EQUILIBRIO ACIDO-BASE
 (EAB) ALTERAZIONI IDROELETTROLITICHE ED ACIDOBASE (2 parte) NECESSITA : Mantenere costante il ph dei liquidi dell organismo su valori di 7,407,41 a fronte della produzione continua di acidi fissi ( 1mEq/kg
(EAB) ALTERAZIONI IDROELETTROLITICHE ED ACIDOBASE (2 parte) NECESSITA : Mantenere costante il ph dei liquidi dell organismo su valori di 7,407,41 a fronte della produzione continua di acidi fissi ( 1mEq/kg
Equilibrio acido-base: il ph è importante
 Equilibrio acido-base: il ph è importante il ph è strettamente controllato il ph influenza l attività enzimatica il ph è diverso nei vari compartimenti: Esempio: stomaco- acido duodeno alcalino Il ph varia
Equilibrio acido-base: il ph è importante il ph è strettamente controllato il ph influenza l attività enzimatica il ph è diverso nei vari compartimenti: Esempio: stomaco- acido duodeno alcalino Il ph varia
equilibrio acido base
 Alterazioni dell equilibrio equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [ ] [CO 2 ] Si ha acidosi quando, per diminuzione del rapporto /CO 2 il ph diminuisce. L acidosi
Alterazioni dell equilibrio equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [ ] [CO 2 ] Si ha acidosi quando, per diminuzione del rapporto /CO 2 il ph diminuisce. L acidosi
Raffaele Alvisi 14 gennaio 1916
 Raffaele Alvisi 14 gennaio 1916 Alterazioni del ph = Alterazioni dell equilibrio Acido-Base X 1 2 3 4 5 6 7 8 9 Conoscenze o Capacità Acquisite SI/NO Il clinico sospetta e dimostra l alterazione dell equilibrio
Raffaele Alvisi 14 gennaio 1916 Alterazioni del ph = Alterazioni dell equilibrio Acido-Base X 1 2 3 4 5 6 7 8 9 Conoscenze o Capacità Acquisite SI/NO Il clinico sospetta e dimostra l alterazione dell equilibrio
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante di dissociazione
L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante di dissociazione
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi Lezione 24 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante
L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi Lezione 24 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante
Emogasanalisi Arteriosa
 Emogasanalisi Arteriosa Dr. Francesco Ponzetta UO Anestesia Rianimazione NOCSAE Modena L'EGA è un analisi dei gas ematici su sangue arterioso, può essre effettuata in laboratorio ma anche, in maniera decentralizzata,
Emogasanalisi Arteriosa Dr. Francesco Ponzetta UO Anestesia Rianimazione NOCSAE Modena L'EGA è un analisi dei gas ematici su sangue arterioso, può essre effettuata in laboratorio ma anche, in maniera decentralizzata,
INTERPRETAZIONE DELL EMOGASANALISI ACQUA ELETTROLITI ED EQUILIBRIO ACIDI-BASE
 INTERPRETAZIONE DELL EMOGASANALISI ACQUA ELETTROLITI ED EQUILIBRIO ACIDI-BASE Il prelievo arterioso può essere eseguito a livello di arteria femorale e arteria radiale (più doloroso) Il prelievo venoso
INTERPRETAZIONE DELL EMOGASANALISI ACQUA ELETTROLITI ED EQUILIBRIO ACIDI-BASE Il prelievo arterioso può essere eseguito a livello di arteria femorale e arteria radiale (più doloroso) Il prelievo venoso
Equilibrio acido-base
 Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
DISORDINI DELL EQUILIBRIO ACIDO - BASE
 DISORDINI DELL EQUILIBRIO ACIDO - BASE Equilibrio acido-base e potassio Nel tubulo distale e dotto collettore il riassorbimento del bicarbonato è legato a quello del potassio Il riassorbimento del bicarbonato
DISORDINI DELL EQUILIBRIO ACIDO - BASE Equilibrio acido-base e potassio Nel tubulo distale e dotto collettore il riassorbimento del bicarbonato è legato a quello del potassio Il riassorbimento del bicarbonato
La eliminazione dei protoni nelle urine permette il ripristino di bicarbonato nel circolo sistemico.
 ESCREZIONE URINARIA DI ACIDI : 1-1,5 meq/l Es. produzione endogena di ac. solforico o cloridrico, formazione di sodio solfato o cloruro, eliminazione urinaria di ammonio legato ai sali. La eliminazione
ESCREZIONE URINARIA DI ACIDI : 1-1,5 meq/l Es. produzione endogena di ac. solforico o cloridrico, formazione di sodio solfato o cloruro, eliminazione urinaria di ammonio legato ai sali. La eliminazione
Equilibrio acido-base
 Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Emogasanalisi in t.i.
 Emogasanalisi in t.i. 9 volte su 10 6 volte su 10 100 e più alterati rispetto ai v.n. interpretazioni inesatte diagrammi, nomogrammi, equazioni e sistemi di valutazione 100 anni dall equazione di Handerson
Emogasanalisi in t.i. 9 volte su 10 6 volte su 10 100 e più alterati rispetto ai v.n. interpretazioni inesatte diagrammi, nomogrammi, equazioni e sistemi di valutazione 100 anni dall equazione di Handerson
I tre sistemi per la regolazione del ph
 I tre sistemi per la regolazione del ph Se vuoi finalmente capire quali sono e come funzionano i sistemi per la regolazione del ph questo breve articolo fa proprio al caso tuo. In questo articolo parleremo
I tre sistemi per la regolazione del ph Se vuoi finalmente capire quali sono e come funzionano i sistemi per la regolazione del ph questo breve articolo fa proprio al caso tuo. In questo articolo parleremo
Emogasanalisi arteriosa: Valutaz. dell ossiemia Trasporto della PaCO2 Disturbi dell EAB. ph potere tampone compenso renale
 Emogasanalisi arteriosa: Valutaz. dell ossiemia Trasporto della PaCO2 Disturbi dell EAB ph potere tampone compenso renale EMOGASANALISI ARTERIOSA Misura l efficienza della funzione respiratoria e della
Emogasanalisi arteriosa: Valutaz. dell ossiemia Trasporto della PaCO2 Disturbi dell EAB ph potere tampone compenso renale EMOGASANALISI ARTERIOSA Misura l efficienza della funzione respiratoria e della
Equilibri acido-base, ph e sistemi tampone
 Equilibri acido-base, ph e sistemi tampone Tiziana Bellini Dipartimento di Scienze Biomediche Chirurgico Specialistiche Facoltà di Medicina Farmacia e Prevenzione Università di Ferrara Cos è un acido?
Equilibri acido-base, ph e sistemi tampone Tiziana Bellini Dipartimento di Scienze Biomediche Chirurgico Specialistiche Facoltà di Medicina Farmacia e Prevenzione Università di Ferrara Cos è un acido?
Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio
 Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
2.Controllo dell equilibrio acido-base - II. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 2.Controllo dell equilibrio acidobase II Carlo Capelli Fisiologia Facoltà di Scienze Motorie Università di Verona 1. Tampone bicarbonatoco 2 E il sistema tampone fisiologico più importante [ CO 2] = PCO
2.Controllo dell equilibrio acidobase II Carlo Capelli Fisiologia Facoltà di Scienze Motorie Università di Verona 1. Tampone bicarbonatoco 2 E il sistema tampone fisiologico più importante [ CO 2] = PCO
Tamponi biologici per il controllo del ph
 Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
PSEUDOIPERKALEMIA o IPERPOTASSIEMIA SPURIA. Il paziente non ha problemi cardiaci ma iperpotassiemia
 PSEUDOIPERKALEMIA o IPERPOTASSIEMIA SPURIA Il paziente non ha problemi cardiaci ma iperpotassiemia Cause: Prolungato utilizzo del laccio emostatico Rottura delle cellule, durante il prelievo di sangue
PSEUDOIPERKALEMIA o IPERPOTASSIEMIA SPURIA Il paziente non ha problemi cardiaci ma iperpotassiemia Cause: Prolungato utilizzo del laccio emostatico Rottura delle cellule, durante il prelievo di sangue
L INSUFFICIENZA RESPIRATORIA ACUTA DAL TERRITORIO ALLA MEDICINA D URGENZA
 L INSUFFICIENZA RESPIRATORIA ACUTA DAL TERRITORIO ALLA MEDICINA D URGENZA 28 SETTEMBRE 2010 NOLA MONITORAGGIO DEGLI SCAMBI GASSOSI ED ALTERAZIONI EMOGASANALITICHE DOTT.SSA GIOVANNA ESPOSITO PS e MU DEA
L INSUFFICIENZA RESPIRATORIA ACUTA DAL TERRITORIO ALLA MEDICINA D URGENZA 28 SETTEMBRE 2010 NOLA MONITORAGGIO DEGLI SCAMBI GASSOSI ED ALTERAZIONI EMOGASANALITICHE DOTT.SSA GIOVANNA ESPOSITO PS e MU DEA
Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia
 Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia Obiettivi Produzione e bilancio degli idrogenioni Regolazione respiratoria e renale del ph Riassorbimento del bicarbonato e secrezione
Fisiologia Renale Equilibrio acido-base: Fisiologia e fisiopatologia Obiettivi Produzione e bilancio degli idrogenioni Regolazione respiratoria e renale del ph Riassorbimento del bicarbonato e secrezione
Trasporto dei gas respiratori nel sangue
 Trasporto dei gas respiratori nel sangue La soluzione dei gas nei liquidi C Legge di Henry acq P gas S gas C acq = quantità di gas disciolta nella fase acquosa P gas = pressione parziale del gas nella
Trasporto dei gas respiratori nel sangue La soluzione dei gas nei liquidi C Legge di Henry acq P gas S gas C acq = quantità di gas disciolta nella fase acquosa P gas = pressione parziale del gas nella
Milano, 9 giugno acido-base? Ernesto Cristiano Lauritano
 ACQUA E SALE Milano, 9 giugno 2012 Quale approccio ai disordini acido-base? Ernesto Cristiano Lauritano Dipartimento di Emergenza e Accettazione Azienda Ospedaliera Nazionale SS. Antonio e Biagio e Cesare
ACQUA E SALE Milano, 9 giugno 2012 Quale approccio ai disordini acido-base? Ernesto Cristiano Lauritano Dipartimento di Emergenza e Accettazione Azienda Ospedaliera Nazionale SS. Antonio e Biagio e Cesare
Biochimica clinica. Corso di Laurea Triennale in Biotecnologie per la salute
 Corso di Laurea Triennale in Biotecnologie per la salute Biochimica clinica Argomenti della lezione:» Aspetti generali dell'equilibrio acidobase» Regolazione renale e polmonare» Emogasanalisi Gli elettroliti
Corso di Laurea Triennale in Biotecnologie per la salute Biochimica clinica Argomenti della lezione:» Aspetti generali dell'equilibrio acidobase» Regolazione renale e polmonare» Emogasanalisi Gli elettroliti
4ª UNITA DIDATTICA Modello Nutrizionale metabolico
 4ª UNITA DIDATTICA Modello Nutrizionale metabolico Contenuti Modello Nutrizionale metabolico Sezione del modello: Equilibrio idro-elettrolitico e acido-base Assistenza alla persona con problemi relativi
4ª UNITA DIDATTICA Modello Nutrizionale metabolico Contenuti Modello Nutrizionale metabolico Sezione del modello: Equilibrio idro-elettrolitico e acido-base Assistenza alla persona con problemi relativi
L acidosi metabolica Giuseppe Regolisti
 L acidosi metabolica Giuseppe Regolisti Terapia Intensiva Dipartimento di Emergenza-Urgenza e Area Medica Generale e Specialistica Azienda Ospedaliero-Universitaria e Università degli Studi di Parma Prevalenza
L acidosi metabolica Giuseppe Regolisti Terapia Intensiva Dipartimento di Emergenza-Urgenza e Area Medica Generale e Specialistica Azienda Ospedaliero-Universitaria e Università degli Studi di Parma Prevalenza
Quadri emogasanalitici complessi in terapia intensiva. Dott.ssa Valentina Alvisi U.O. Anestesia e Rianimazione Universitaria
 Quadri emogasanalitici complessi in terapia intensiva. Dott.ssa Valentina Alvisi U.O. Anestesia e Rianimazione Universitaria Normali valori dell EGA ph 7.35 7.45 PCO 2 PO 2 HCO 3 35 45 mmhg 80 100 mmhg
Quadri emogasanalitici complessi in terapia intensiva. Dott.ssa Valentina Alvisi U.O. Anestesia e Rianimazione Universitaria Normali valori dell EGA ph 7.35 7.45 PCO 2 PO 2 HCO 3 35 45 mmhg 80 100 mmhg
IL RUOLO DELL EMOGASANALISI NELL INSUFFIENZA RESPIRATORIA
 I CONGRESSO REGIONALE SIMEU BASILICATA 13 E 14 GIUGNO 2014 IL RUOLO DELL EMOGASANALISI NELL INSUFFIENZA RESPIRATORIA DOTT.SSA GIOVANNA ESPOSITO PS e MU DEA NOCERAPAGANI SEGRETARIO NAZIONALE FIMEUC PRESISDENTE
I CONGRESSO REGIONALE SIMEU BASILICATA 13 E 14 GIUGNO 2014 IL RUOLO DELL EMOGASANALISI NELL INSUFFIENZA RESPIRATORIA DOTT.SSA GIOVANNA ESPOSITO PS e MU DEA NOCERAPAGANI SEGRETARIO NAZIONALE FIMEUC PRESISDENTE
L'EQUILIBRIO ACIDO-BASE
 L'EQUILIBRIO ACIDO-BASE La concentrazione nell'organismo degli ioni H+ è finemente regolata perché quasi tutte le attività enzimatiche sono influenzate sostanzialmente dalle variazioni di ph. Quindi l'attività
L'EQUILIBRIO ACIDO-BASE La concentrazione nell'organismo degli ioni H+ è finemente regolata perché quasi tutte le attività enzimatiche sono influenzate sostanzialmente dalle variazioni di ph. Quindi l'attività
LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE
 LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE 1 ALDOSTERONE Ormone steroideo rilasciato dalla corticale surrenale l aldosterone stimola: riassorbimento di Na +
LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE 1 ALDOSTERONE Ormone steroideo rilasciato dalla corticale surrenale l aldosterone stimola: riassorbimento di Na +
Tamponi Biologici. AO/Febbraio 2016
 Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra ). La stabilità del ph è insidiata da
 Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
DEFINIZIONE ANALISI DELLE PRESSIONI PARZIALI DEI GAS E DEL EQUILIBRIO ACIDO- BASE NEL SANGUE ARTERIOSO
 DEFINIZIONE ANALISI DELLE PRESSIONI PARZIALI DEI GAS E DEL EQUILIBRIO ACIDO- BASE NEL SANGUE ARTERIOSO INDICAZIONI ALL EGA Dispnea (cardiaca, respiratoria, metabolica) Dolore toracico (embolie polmonari
DEFINIZIONE ANALISI DELLE PRESSIONI PARZIALI DEI GAS E DEL EQUILIBRIO ACIDO- BASE NEL SANGUE ARTERIOSO INDICAZIONI ALL EGA Dispnea (cardiaca, respiratoria, metabolica) Dolore toracico (embolie polmonari
Funzioni. Regola composizione ionica plasmatica Volume plasmatico Osmolarità ph Rimuove I prodotti di scarto
 La Funzione Renale Funzioni Regola composizione ionica plasmatica Volume plasmatico Osmolarità ph Rimuove I prodotti di scarto Il Nefrone Distinguiamo un tubulo renale (trasporto) ed un corpuscolo renale
La Funzione Renale Funzioni Regola composizione ionica plasmatica Volume plasmatico Osmolarità ph Rimuove I prodotti di scarto Il Nefrone Distinguiamo un tubulo renale (trasporto) ed un corpuscolo renale
Equilibrio Acido-Base: interpretazione dati emogasanalitici
 Equilibrio Acido-Base: interpretazione dati emogasanalitici Dott.ssa M. Martino Corso di medicina generale Anno 2010 L EMOGASANALISI è stata definita dall OMS come l esame in assoluto con il miglior rapporto
Equilibrio Acido-Base: interpretazione dati emogasanalitici Dott.ssa M. Martino Corso di medicina generale Anno 2010 L EMOGASANALISI è stata definita dall OMS come l esame in assoluto con il miglior rapporto
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da
 Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Alterazione della capacità tampone nell'organismo. Alterazione capacità tampone rev. 0 - data: 5 luglio
 Alterazione della capacità tampone nell'organismo Alterazione capacità tampone rev. 0 - data: 5 luglio 2008 1 Il ph fisiologico dell'organismo è compreso tra 7.38 e 7.44 Nel liquido extracellulare sono
Alterazione della capacità tampone nell'organismo Alterazione capacità tampone rev. 0 - data: 5 luglio 2008 1 Il ph fisiologico dell'organismo è compreso tra 7.38 e 7.44 Nel liquido extracellulare sono
Sistema urinario: la funzione renale
 Sistema urinario: la funzione renale FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici, i reni ne regolano la concentrazione plasmatica
Sistema urinario: la funzione renale FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici, i reni ne regolano la concentrazione plasmatica
PRINCIPALI SISTEMI TAMPONE
 SISTEMI TAMPONE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE -------------------------------------------------------------------------------------------------------------- 3 2 PRINCIPALI SISTEMI TAMPONE
SISTEMI TAMPONE PROF.SSA AUSILIA ELCE Indice 1 INTRODUZIONE -------------------------------------------------------------------------------------------------------------- 3 2 PRINCIPALI SISTEMI TAMPONE
Escrezione renale di Na + e sua regolazione
 Escrezione renale di e sua regolazione L escrezione di dipende dal carico filtrato (e quindi dalla VFG) e dal carico riassorbito Il riassorbimento di avviene in tutti i segmenti del nefrone e nel nefrone
Escrezione renale di e sua regolazione L escrezione di dipende dal carico filtrato (e quindi dalla VFG) e dal carico riassorbito Il riassorbimento di avviene in tutti i segmenti del nefrone e nel nefrone
Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali:
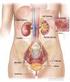 Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali: 1) Secerne Idrogenioni; 1a) Riassorbe il Bicarbonato Filtrato; 1b) Produce Nuovo Bicarbonato. 4320 meq/die
Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali: 1) Secerne Idrogenioni; 1a) Riassorbe il Bicarbonato Filtrato; 1b) Produce Nuovo Bicarbonato. 4320 meq/die
Gli equilibri omeodinamici: dalla fisiopatologia alla clinica pratica
 CONVEGNO SIMI Gli equilibri omeodinamici: dalla fisiopatologia alla clinica pratica Dr. Francesco Sgambato U. O. Complessa di Medicina Interna Ospedale Fatebenefratelli - Benevento sgambatof@gmail.com
CONVEGNO SIMI Gli equilibri omeodinamici: dalla fisiopatologia alla clinica pratica Dr. Francesco Sgambato U. O. Complessa di Medicina Interna Ospedale Fatebenefratelli - Benevento sgambatof@gmail.com
Equilibrio acido base
 Equilibrio acido base Le Acidosi e Alcalosi Respiratorie INTRODUZIONE ACIDOSI RESPIRATORIA - Cause - Sintomi - Terapia ALCALOSI RESPIRATORIA - Cause - Sintomi - Terapia INTRODUZIONE I prodotti terminali
Equilibrio acido base Le Acidosi e Alcalosi Respiratorie INTRODUZIONE ACIDOSI RESPIRATORIA - Cause - Sintomi - Terapia ALCALOSI RESPIRATORIA - Cause - Sintomi - Terapia INTRODUZIONE I prodotti terminali
I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg
 LEZIONE RENE 6 I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg BL 4.2mM 150mM BILANCIO DEL POTASSIO 4 moli di K nei compartimenti liquidi Liquido intracellulare
LEZIONE RENE 6 I VOLUMI DEI PRINCIPALI COMPARTIMENTI IDRICI DELL ORGANISMO CALCOLATI PER UN INDIVIDUO DI 70 Kg BL 4.2mM 150mM BILANCIO DEL POTASSIO 4 moli di K nei compartimenti liquidi Liquido intracellulare
Presentazione della collana (Ivo Casagranda)... Prefazione... Hanno collaborato...
 pag. Presentazione della collana (Ivo Casagranda).................. Prefazione............................................ Hanno collaborato....................................... XVII XIX XXI Capitolo
pag. Presentazione della collana (Ivo Casagranda).................. Prefazione............................................ Hanno collaborato....................................... XVII XIX XXI Capitolo
17/05/2010. Equilibrio idrico. Variazioni del volume ematico indicono risposte omeostatiche
 Equilibrio idrico Variazioni del volume ematico indicono risposte omeostatiche 1 Ruolo del rene nel bilancio idrico Variazioni dell osmolarità attraverso la midollare 2 Scambio per controcorrente nella
Equilibrio idrico Variazioni del volume ematico indicono risposte omeostatiche 1 Ruolo del rene nel bilancio idrico Variazioni dell osmolarità attraverso la midollare 2 Scambio per controcorrente nella
SCOPI DELL EMOGASANALISI
 EMOGASANALISI SCOPI DELL EMOGASANALISI La funzione principale della respirazione è quella di assicurare ossigeno all organismo e di eliminare l eccesso di anidride carbonica. L emogasanalisi arteriosa
EMOGASANALISI SCOPI DELL EMOGASANALISI La funzione principale della respirazione è quella di assicurare ossigeno all organismo e di eliminare l eccesso di anidride carbonica. L emogasanalisi arteriosa
Equilibrio idroelettrolitico
 Equilibrio idroelettrolitico Sodio Potassio Sodio e volume extracellulare Bilancio e distribuzione dell acqua corporea Regolazione del bilancio dell acqua Aumento dell osmolarità o Riduzione del volume
Equilibrio idroelettrolitico Sodio Potassio Sodio e volume extracellulare Bilancio e distribuzione dell acqua corporea Regolazione del bilancio dell acqua Aumento dell osmolarità o Riduzione del volume
Fisiologia Renale 8. Bilancio idro-elettrolitico III. Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona
 Fisiologia Renale 8. Bilancio idro-elettrolitico III Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona Obiettivi Bilancio del sodio e regolazione del volume extracellulare
Fisiologia Renale 8. Bilancio idro-elettrolitico III Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona Obiettivi Bilancio del sodio e regolazione del volume extracellulare
Sodio. L introduzione giornaliera con la dieta di sodio (200 meq/l) è maggiore del nostro fabbisogno (20 meq/l): è necessaria l escrezione urinaria
 Sodio L introduzione giornaliera con la dieta di sodio (200 meq/l) è maggiore del nostro fabbisogno (20 meq/l): è necessaria l escrezione urinaria E elemento principale per il controllo dell osmolalità
Sodio L introduzione giornaliera con la dieta di sodio (200 meq/l) è maggiore del nostro fabbisogno (20 meq/l): è necessaria l escrezione urinaria E elemento principale per il controllo dell osmolalità
acqua, CO 2, O 2, sali e ioni H +
 Legge dell Equilibrio di Massa Se la quantità di una sostanza nell organismo deve rimanere costante, ad ogni sua acquisizione deve corrispondere una perdita di eguale entità acqua, CO 2, O 2, sali e ioni
Legge dell Equilibrio di Massa Se la quantità di una sostanza nell organismo deve rimanere costante, ad ogni sua acquisizione deve corrispondere una perdita di eguale entità acqua, CO 2, O 2, sali e ioni
Dott.ssa Marta Tavecchia. COS E IL ph?
 Dott.ssa Marta Tavecchia COS E IL ph? IL RENE: COSA FA? Regola il bilancio idrico Regola il bilancio elettrolitico Regola l equilibrio acido base Elimina le scorie del metabolismo azotato Svolge un ruolo
Dott.ssa Marta Tavecchia COS E IL ph? IL RENE: COSA FA? Regola il bilancio idrico Regola il bilancio elettrolitico Regola l equilibrio acido base Elimina le scorie del metabolismo azotato Svolge un ruolo
FARMACI IN GRADO DI INFLUENZARE LA FUNZIONALITA RENALE: I DIURETICI
 FARMACI IN GRADO DI INFLUENZARE LA FUNZIONALITA RENALE: I DIURETICI DIURETICI Aumentano il flusso urinario e l escrezione dello ione Na + (e generalmente Cl - ) e vengono utilizzati per ripristinare il
FARMACI IN GRADO DI INFLUENZARE LA FUNZIONALITA RENALE: I DIURETICI DIURETICI Aumentano il flusso urinario e l escrezione dello ione Na + (e generalmente Cl - ) e vengono utilizzati per ripristinare il
DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE
 VOLUMI POLMONARI DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE DEFINIRE LE RESISTENZE POLMONARI DEFINIRE IL LAVORO POLMONARE Equazione
VOLUMI POLMONARI DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE DEFINIRE LE RESISTENZE POLMONARI DEFINIRE IL LAVORO POLMONARE Equazione
PROGRAMMA DEL CORSO. ipossica. ipossico-ipercapnica. Lo scambio dei gas. L Insufficienza respiratoria
 PROGRAMMA DEL CORSO Lo scambio dei gas L Insufficienza respiratoria ipossica ipossico-ipercapnica L equilibrio acido base e l emogasanalisi normale EGA:tecnica di esecuzione EGA:principi teorici e interpretazione
PROGRAMMA DEL CORSO Lo scambio dei gas L Insufficienza respiratoria ipossica ipossico-ipercapnica L equilibrio acido base e l emogasanalisi normale EGA:tecnica di esecuzione EGA:principi teorici e interpretazione
DEBOLE MEDIA FORTE FARMACI DIURETICI AD INTENSITÀ D AZIONE
 FARMACI DIURETICI AD INTENSITÀ D AZIONE a) osmotici mannitolo (Isotol), glicerina b) inibitori dell anidrasi carbonica acetazolamide (Diamox) c) risparmiatori di spironolattone (Aldactone, Spirolang),
FARMACI DIURETICI AD INTENSITÀ D AZIONE a) osmotici mannitolo (Isotol), glicerina b) inibitori dell anidrasi carbonica acetazolamide (Diamox) c) risparmiatori di spironolattone (Aldactone, Spirolang),
Sistema urinario: la funzione renale
 Sistema urinario: la funzione renale La principale funzione dei reni è il bilancio idrosalino FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici,
Sistema urinario: la funzione renale La principale funzione dei reni è il bilancio idrosalino FUNZIONI: Regolazione della composizione ionica del sangue: aumentando o diminuendo l escrezione di ioni specifici,
L anatomia dell apparato urinario
 L anatomia dell apparato urinario Le funzioni del rene Secrezione (escrezione) Equilibrio idrico (controllo della pressione arteriosa) Equilibrio salino (controllo della composizione elettrolitica) Endocrina
L anatomia dell apparato urinario Le funzioni del rene Secrezione (escrezione) Equilibrio idrico (controllo della pressione arteriosa) Equilibrio salino (controllo della composizione elettrolitica) Endocrina
2H 2 O >< H 3 O + + OH -
 Fisiologia dell equilibrio equilibrio acido-base Acidi: Specie chimiche in grado di cedere ioni H + (idrogenioni o protoni) in soluzione acquosa Basi: Specie chimiche i h in grado di accettare ioni i H
Fisiologia dell equilibrio equilibrio acido-base Acidi: Specie chimiche in grado di cedere ioni H + (idrogenioni o protoni) in soluzione acquosa Basi: Specie chimiche i h in grado di accettare ioni i H
 Trigliceridi Colesterolo Esteri del Colesterolo Fosfolipidi Trasporti attraverso le membrane Diffusione facilitata: Scambio dei cloruri o Scambio Cl - /HCO - 3 Cl - HCO3
Trigliceridi Colesterolo Esteri del Colesterolo Fosfolipidi Trasporti attraverso le membrane Diffusione facilitata: Scambio dei cloruri o Scambio Cl - /HCO - 3 Cl - HCO3
L AMBIENTE IPOBARICO ACCLIMATAZIONE ALL ALTA QUOTA
 L AMBIENTE IPOBARICO ACCLIMATAZIONE ALL ALTA QUOTA Durante le ascensioni in montagna ed i voli in quota l organismo umano viene sottoposto agli effetti della diminuzione della pressione barometrica e conseguentemente
L AMBIENTE IPOBARICO ACCLIMATAZIONE ALL ALTA QUOTA Durante le ascensioni in montagna ed i voli in quota l organismo umano viene sottoposto agli effetti della diminuzione della pressione barometrica e conseguentemente
Meccanismo di moltiplicazione controcorrente
 Equilibrio idroelettrolitico Dr. Alessandro Capitanini Meccanismo di moltiplicazione controcorrente Body Fluids 28 litri Acqua corporea totale in uomo di 70 kg = 42 litri Ambiente interno in equilibrio
Equilibrio idroelettrolitico Dr. Alessandro Capitanini Meccanismo di moltiplicazione controcorrente Body Fluids 28 litri Acqua corporea totale in uomo di 70 kg = 42 litri Ambiente interno in equilibrio
L EMOGASANALISI. P. Scavalli, M. Vitto, S. Mosillo
 L EMOGASANALISI P. Scavalli, M. Vitto, S. Mosillo EMOGASANALISI Consente la misurazione immediata dei due gas più importanti del sangue e di un terzo parametro fondamentale per la valutazione dell omeostasi
L EMOGASANALISI P. Scavalli, M. Vitto, S. Mosillo EMOGASANALISI Consente la misurazione immediata dei due gas più importanti del sangue e di un terzo parametro fondamentale per la valutazione dell omeostasi
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costanti volume ed osmolalità dei liquidi corporei, attraverso il bilancio tra assunzione ed eliminazione di H 2
1. Controllo dell equilibrio acido-base. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 1. Controllo dell equilibrio acido-base Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Misura dell acidità di una soluzione Definizione di acido: qualsiasi sostanza chimica che
1. Controllo dell equilibrio acido-base Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Misura dell acidità di una soluzione Definizione di acido: qualsiasi sostanza chimica che
Il processo di ultrafiltrazione è interamente passivo e dipende sostanzialmente da tre fattori:
 Il processo di ultrafiltrazione è interamente passivo e dipende sostanzialmente da tre fattori: 1) Dalla differenza netta di pressione tra il lume del capillare ed il lume della capsula di Bowman; 2) dalla
Il processo di ultrafiltrazione è interamente passivo e dipende sostanzialmente da tre fattori: 1) Dalla differenza netta di pressione tra il lume del capillare ed il lume della capsula di Bowman; 2) dalla
COMPLICANZE DEL DIABETE
 COMPLICANZE DEL DIABETE Prof. Alfonso Bellia ACUTE (prevalentemente metaboliche) Ipoglicemia acuta (
COMPLICANZE DEL DIABETE Prof. Alfonso Bellia ACUTE (prevalentemente metaboliche) Ipoglicemia acuta (
I compartimenti liquidi corporei
 Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costante il volume dei liquidi corporei attraverso il bilancio tra assunzione ed eliminazione di H 2 O. I reni giocano
Bilancio idrico I compartimenti liquidi corporei E essenziale per l omeostasi mantenere costante il volume dei liquidi corporei attraverso il bilancio tra assunzione ed eliminazione di H 2 O. I reni giocano
INDICE CAPITOLO 1. BASI BIOLOGICHE II. OMEOSTASI POTASSICA CONTENUTO TOTALE E DISTRIBUZIONE... 47
 INDICE Presentazione... 13 pag. Premesse... 15 Composizione degli oceani e comparsa della vita... 15 Apporto alimentare del sodio e del potassio e funzione escretoria renale dei due cationi... 16 Ipertensione
INDICE Presentazione... 13 pag. Premesse... 15 Composizione degli oceani e comparsa della vita... 15 Apporto alimentare del sodio e del potassio e funzione escretoria renale dei due cationi... 16 Ipertensione
aggiustamenti respiratori durante l esercizio fisico
 aggiustamenti respiratori durante l esercizio fisico 1 generalita durante l esercizio fisico aumento consumo O 2 e produzione CO 2 e calore e necessario portare piu O 2 ai tessuti e rimuovere piu CO 2
aggiustamenti respiratori durante l esercizio fisico 1 generalita durante l esercizio fisico aumento consumo O 2 e produzione CO 2 e calore e necessario portare piu O 2 ai tessuti e rimuovere piu CO 2
EQUILIBRIO IDRO-ELETTROLITICO ED ACIDO-BASE EQUILIBRIO IDRO-ELETTROLITICO IL SODIO CONTENUTO CORPOREO DI ACQUA IL SODIO
 EQUILIBRIO IDROELETTROLITICO ED ACIDOBASE EQUILIBRIO IDROELETTROLITICO CONTENUTO CORPOREO DI ACQUA PLASMA = 4 L INTERSTIZIO = 18 L INTRACELLULARE = 28 L IL SODIO E CONTENUTO SOPRATTUTTO NELLO SPAZIO EXTRACELLULARE
EQUILIBRIO IDROELETTROLITICO ED ACIDOBASE EQUILIBRIO IDROELETTROLITICO CONTENUTO CORPOREO DI ACQUA PLASMA = 4 L INTERSTIZIO = 18 L INTRACELLULARE = 28 L IL SODIO E CONTENUTO SOPRATTUTTO NELLO SPAZIO EXTRACELLULARE
LA GESTIONE DELLE URGENZE METABOLICHE DIABETOLOGICHE NELL AREA DELL EMERGENZA Protocolli diagnostico terapeutici e percorsi assistenziali
 LA GESTIONE DELLE URGENZE METABOLICHE DIABETOLOGICHE NELL AREA DELL EMERGENZA Protocolli diagnostico terapeutici e percorsi assistenziali Roma, 13 ottobre 2018 La dr.sa Maria Luisa Manca Bitti dichiara
LA GESTIONE DELLE URGENZE METABOLICHE DIABETOLOGICHE NELL AREA DELL EMERGENZA Protocolli diagnostico terapeutici e percorsi assistenziali Roma, 13 ottobre 2018 La dr.sa Maria Luisa Manca Bitti dichiara
INSUFFICIENZA RENALE ACUTA
 INSUFFICIENZA RENALE ACUTA Sindrome clinico-metabolica caratterizzata da una rapida (ore, giorni) riduzione del filtrato glomerulare (VFG) con conseguente ritenzione dei prodotti del catabolismo azotato
INSUFFICIENZA RENALE ACUTA Sindrome clinico-metabolica caratterizzata da una rapida (ore, giorni) riduzione del filtrato glomerulare (VFG) con conseguente ritenzione dei prodotti del catabolismo azotato
Trasporto epiteliale
 Trasporto epiteliale Rivestono le cavità e le superfici corporee: interfaccia tra gli spazi interni dell organismo e l ambiente Semplice rivestimento o funzione di regolazione (es:osmoregolazione) Trasporto
Trasporto epiteliale Rivestono le cavità e le superfici corporee: interfaccia tra gli spazi interni dell organismo e l ambiente Semplice rivestimento o funzione di regolazione (es:osmoregolazione) Trasporto
EQUILIBRIO ACIDO - BASE
 EQUILIBRIO ACIDO BASE Le reazioni metaboliche sono molto sensibili a cambiamenti del ph: il ph dei liquidi dell organismo è mantenuto entro un range di valori molto stretto. ph intracellulare è generalmente
EQUILIBRIO ACIDO BASE Le reazioni metaboliche sono molto sensibili a cambiamenti del ph: il ph dei liquidi dell organismo è mantenuto entro un range di valori molto stretto. ph intracellulare è generalmente
La spirometria. La spirometria
 La spirometria La spirometria studia a fondo la funzione polmonare. Con questo semplice esame infatti è possibile determinare numerosi parametri che guidano il medico nella diagnosi delle malattie polmonari.
La spirometria La spirometria studia a fondo la funzione polmonare. Con questo semplice esame infatti è possibile determinare numerosi parametri che guidano il medico nella diagnosi delle malattie polmonari.
EQUILIBRIO ACIDO - BASE
 EQUILIBRIO ACIDO - BASE da appunti del dott. Claudio Italiano, internista ospedaliero Che significa? Vuol dire che l organismo ha un suo equilibrio, detto omeòstasi, cioè il sangue deve necessariamente
EQUILIBRIO ACIDO - BASE da appunti del dott. Claudio Italiano, internista ospedaliero Che significa? Vuol dire che l organismo ha un suo equilibrio, detto omeòstasi, cioè il sangue deve necessariamente
Controllo nervoso del respiro
 Controllo nervoso del respiro La respirazione è una funzione involontaria controllata da 3 gruppi di neuroni (centri) localizzati nel tronco encefalico: Controllo nervoso del respiro Centro respiratorio
Controllo nervoso del respiro La respirazione è una funzione involontaria controllata da 3 gruppi di neuroni (centri) localizzati nel tronco encefalico: Controllo nervoso del respiro Centro respiratorio
EMOGASANALISI. Dr. Federico Olliveri Medicina d Urgenza H G. Bosco.
 EMOGASANALISI Dr. Federico Olliveri Medicina d Urgenza H G. Bosco Email: fed.olliveri@tin.it Gerarchia degli equilibri nell organismo: 1) equilibrio fra cariche elettriche 2) equilibrio osmolare 3) equilibrio
EMOGASANALISI Dr. Federico Olliveri Medicina d Urgenza H G. Bosco Email: fed.olliveri@tin.it Gerarchia degli equilibri nell organismo: 1) equilibrio fra cariche elettriche 2) equilibrio osmolare 3) equilibrio
Acqua: nutriente essenziale
 Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
distribuita in due settori fondamentali Uomo circa il 60% Donna circa il 50% (percentuale maggiore di tessuto adiposo)
 Obiettivi formativi : Descrivere la distribuzione dell H2O nell organismo Conoscere gli elementi che compongono il BI Individuare i fattori che favoriscono l alterazione del BI Registrare e calcolare il
Obiettivi formativi : Descrivere la distribuzione dell H2O nell organismo Conoscere gli elementi che compongono il BI Individuare i fattori che favoriscono l alterazione del BI Registrare e calcolare il
