Emeccanica=Ecinetica+Epotenziale
|
|
|
- Edmondo Colombo
- 7 anni fa
- Visualizzazioni
Transcript
1 IL LAVORO Dove non sono indicate operazioni, nelle formule, si deve considerare che è presente una moltiplicazione Il lavoro è un mezzo di trasformazione dell energia. Prodotto scalare=operazione tra 2 vettori che dà come risultato una grandezza scalare. (Lavoro) (Forza) (Spostamento) α=angolo compreso tra i 2 vettori Il cos di 0 è uguale a 1 (L=Fs) Il cos di 90è uguale a 0 (L=0) Il cos di 180 è uguale a -1 (L = -Fs) L unità di misura del lavoro è il Joule [J] L energia è la capacità di compiere un lavoro. L energia si misura in J. Il lavoro è un mezzo di trasformazione dell energia. ENERGIA MECCANICA, CINETICA E POTENZIALE Emeccanica=Ecinetica+Epotenziale Ec=1/2mv 2 m=massa Ep=mgh (energia di movimento) v=velocità (energia di posizione) g=acc. di gravità h=altezza L energia non si crea non si distrugge ma si trasforma. Principio di conservazione dell energia meccanica: l energia meccanica in assenza di attrito si conserva sempre. Quando c è l attrito una parte dell energia meccanica si trasforma in energia interna (energia meccanica microscopica). 1
2 PASSAGGIO concettuale ALLA TERMOLOGIA Agitazione termica: Em=Ep Ec=0 L oggetto inizia a cadere Ep Ec h No Attrito Quando l oggetto sta per toccare terra: Em=Ec Ep=0 trasformain energia cinetica Una volta che l oggetto cade al suolo l energia cinetica si trasforma in energia interna dell oggetto e del suolo. QUANTITA DI MOTO La Quantità di moto è una grandezza fisica vettoriale e derivata che si ottiene moltiplicando la massa per la velocità, si indica spesso con la lettera q: La quantità di moto gode di un importante principio di conservazione: in un sistema isolato (somma delle forse esterne pari a zero) la quantità di moto rimane costante Questa significa che se due oggetti (che supponiamo costituiscano il sistema), che non subiscono forze esterne, si urtano la loro quantità di moto (pari alla somma delle quantità di moto dei due oggetti) NON cambia. In formule: prima dell urto Dopo l urto (l apice indica la quantità di moto e la velocità dopo l urto, la massa non ha apice perché NON cambia) In base al principio di conservazione possiamo scrivere la seguente equazione Gli urti fra punti materiali possono essere di due tipi: elastici e anelastici. Gli urti elastici sono quegli urti in cui si conservano la quantità di moto e l energia cinetica Gli urti anelastici sono quelli in cui si conserva solo la quantità di moto. a) 2
3 Per gli urti anelastici vale l equazione a) mentre per gli urti elastici vale l equazione a) e quella b) qui sotto descritta: b) LA TEMPERATURA E una grandezza fisica scalare e fondamentale, si misura in Kelvin nel S.I. ma è di uso normale la scala Celsius. T t T=t Kelvin Gradi centigradi t=t Per le variazioni di temperatura non cambia nulla se si usano i kelvin o i gradi centigradi Es. t i =20 o C=293K t e =10 o C=283K t i -t e =10 o C=10K La temperatura si misura con il termometro. Esistono vari tipi di termometro. Comunemente usato è il termometro basato sulla dilatazione lineare e sull equilibrio termico (il term. legge la sua temperatura per cui per poter conoscere la temperatura del corpo a cui siamo interessati dobbiamo portare lo strumento alla stessa temperatura del corpo ed è per questo che il principio dell equilibrio termico è uno dei principi su cui si basa il funzionamento dei normali termometri). La temperatura è una grandezza fisica macroscopica legata all energia cinetica traslazionale (movimenti non di rotazione) media molecolare. Questo vuol dire che due quantità diverse dello stesso gas (il gas è solo a titolo di esempio) a temperature diverse hanno molecole che si muovono a velocità diverse, tanto maggiore è la temperatura tanto più grande è la velocità. LA DILATAZIONE LINEARE e VOLUMICA La dilatazione volumica avviene in tutte le direzioni, la dilatazione lineare in una direzione. In natura non si ha mai una vera e propria dilatazione lineare ma la si attribuisce a dilatazioni che avvengono prevalentemente in una direzione. 3
4 Δl=λl 0 Δt si può scrivere l-l 0 =λl 0 (t-t o ) ΔV=kV 0 Δt V-V 0 =kv 0 (t-t 0 ) l/v=lunghezza/volume finale l 0 /V 0 =lunghezza/volume iniziale t=temperatura finale t 0 =temperatura iniziale λ,k=coefficiente di dilatazione lineare/volumica (caratteristico per ogni sostanza, notiamo che (k 3*λ) LA LEGGE FONDAMENTALE DELLA TERMOLOGIA ΔE=cmΔt ΔE=calore o, in generale, energia scambiata c=calore specifico (quantità di calore che un 1Kg di una sostanza deve acquistare per aumentare la sua temperatura di 1K) m=massa Δt=variazione di temperatura C=capacità termica (quantità di calore che l intera massa di una sostanza deve acquistare per aumentare la sua temperatura di 1 K) Notiamo che C=cm ossia la capacità termica si ottiene moltiplicando il calore specifico per la massa. Se si fornisce la stessa quantità di calore a due corpi con capacità termica diversa il corpo con capacità termica maggiore subirà una crescita di temperatura inferiore all altro. EQUILIBRIO TERMICO Supponiamo di mettere a contatto in modo adiabatico (senza scambio di calore con l esterno) due sostanze a temperatura diversa. Proprio perché siamo in condizioni adiabatiche il calore ceduto dalla sostanza più calda (sostanza 2) sarà uguale (ma di segno opposto) a quello assorbito dalla sostanza più fredda (sostanza 1) -Q 2 =Q 1 -Calore ceduto = Calore acquistato La sostanza più calda cede calore e si raffredda: Q 2 =m 2 c 2 (t e -t 2 ) Il calore ceduto è negativo, perché t e è minore di t 2. 4
5 La sostanza fredda acquista calore e si riscalda: Q 1 =m 1 c 1 (t e -t 1 ) Il calore acquistato è una quantità positiva, perché t e è maggiore di t 2. Si ha quindi l equazione dell equilibrio termico: m 1 c 1 (t e -t 1 )= - m 2 c 2 (t e -t 2 ) partendo da questa relazione è possibile calcolare la temperatura di equilibrio o, eventualmente, qualora sia fornita questa, altre incognite richieste, invertendo la formula. Lascando agli studenti le inversioni più semplici, ricaviamo la formula della temperatura di equilibrio: PASSAGGI DI STATO La materia ha tre stati di aggregazione: solido, liquido e gassoso. Quando la materia T(C) Q=cmΔt Q=λ f m T f Q=c 1 mδt λ f =calore latente di fusione t(s) Durante il passaggio in rosso la temperatura si mantiene costante perché l energia viene usata completamente per spezzare i legami tra le molecole. Nella parte verde del tracciato l equazione che regola il comportamento della temperatura in base al calore scambiato è la medesima ma è cambiato il calore specifico, in quanto la medesima sostanza in stati diversi di aggregazione ha calori specifici diversi. 5
6 DIFFERENZE TRA EVAPORAZIONE ED EBOLLIZIONE Evaporazione Riguarda solo la superficie del liquido. Avviene a tutte le temperature in cui il Ebollizione Riguarda tutto il liquido. Avviene ad una temperatura precisa. materiale è liquido. Cresce al crescere della temperatura e diminuisce al crescere della pressione (poiché se la pressione La T di ebollizione aumenta all aumentare della pressione. aumenta un minor numero di molecole riesce a liberarsi ). CONDUZIONE E CONVEZIONE La conduzione e la convezioni sono due metodi di propagazione del calore la loro principale differenza e che nella convezione oltre allo scambio di calore avviene anche uno scambio di materia. Nella conduzione gli atomi della sostanza che acquisisce energia aumentano la loro energia cinetica media; l energia viene poi trasmessa agli atomi vicini per mezzo di urti, atomi che a loro volta li trasmettono agli atomi a loro vicini e così via. Il risultato di questo processo è uno spostamento di energia da una parte di sostanza ad un altra senza spostamento di materia poiché gli atomi mentre vibrano rimangono nelle loro posizioni di equilibrio. Nella convezione le molecole esposte al calore aumentano di velocità e tendono a salire verso l alto per il principio di Archimede mentre quelle fredde scendono prendendo il posto di quelle calde e originando delle correnti convettive. Nella convezione si ha quindi anche uno spostamento di materia. LA LEGGE DELLA CONDUZIONE Q=calore propagato K=coefficiente di conducibilità termica (caratteristico per ogni sostanza) A=area della parete ΔT=intervallo di temperatura Δt=intervallo di tempo d=spessore della parete 6
7 L IRRAGGIAMENTO L irraggiamento è un meccanismo di trasmissione dell energia che avviene mediante radiazioni elettromagnetiche. Qualunque corpo emette radiazioni elettromagnetiche ma solo i corpi più caldi riescono ad emettere radiazioni visibili. L irraggiamento avviene anche in assenza di materia e la potenza irradiata da un corpo caldo (cioè l energia emessa nell unità di tempo) è direttamente proporzionale all area della superficie che emette e alla quarta potenza della temperatura assoluta: potenza irradiata=ct 4 c=costante che dipende dal materiale di cui è costituita la superficie emittente. LA PRESSIONE P=F p /A F p =forza premente A=area della superficie La pressione si misura in pascal [Pa] o in atmosfere [atm]. 1 atm=1,013x10 5 Pa LE GRANDEZZE CARATTERISTICHE DEI GAS Le grandezze che definiscono lo stato di un gas sono 4 e sono: -pressione (legata agli urti che le molecole compiono contro le pareti del gas); -volume (lo spazio occupato dal gas); -temperatura (proporzionale all energia cinetica media translazionale del gas); -numero delle moli (proporzionale al numero di particelle che il gas contiene). L ENERGIA INTERNA DI UN CORPO: U L energia interna di un corpo è formata da tre elementi fondamentali: -l energia cinetica media translazionale molecolare; -l energia cinetica media rotazionale molecolare; -L energia potenziale. 7
8 I VARI TIPI DI TRASFORMAZIONI DI UN GAS Esistono quattro tipi di trasformazioni particolari di un gas: a volume costante (isovolumiche o isocore); a temperatura costante (isotermiche); a pressione costante (isobariche); senza scambio di calore con l esterno (adiabatiche). LA LEGGE DI BOYLE La legge di Boyle riguarda le trasformazioni isotermiche ed afferma che: A temperatura costante, il volume che occupa una certa quantità di gas è inversamente proporzionale alla pressione del gas. E cioè: che riferita a due stati si esprime così: pv=costante p 1 V 1 =p 2 V 2 Spiegazione della legge a livello microscopico: la temperatura si mantiene costante, il che significa che la velocità media delle molecole non cambia quindi per poter aumentare il numero di urti sulle pareti (a cui è legata la pressione) devono diminuire le distanze che le molecole devono percorrere (e quindi il volume). LE LEGGI DI GAY-LUSSAC Le leggi di Gay-Lussac riguardano trasformazioni isobariche ed isovolumiche: Trasformazione isobarica: in o C : in K: V=V 0 (1+αt) V=V 0 (1+α(T ))=V 0 (1+αT-1)=V 0 αt che riferita a due stati: V 1 = V 0 αt 1 V 2 = V 0 αt 2 8
9 Spiegazione della legge a livello microscopico: dovendo rimanere costante il numero di urti (p=cost), aumentando la temperatura e di conseguenza essendo maggiore la velocità media traslazionale, necessariamente devono aumentare le distanza percorse e quindi il volume. Trasformazione isovolumica: in o C: in K: p=p 0 (1+αt) p=p 0 (1+α(T ))=p 0 (1+αT-1)=p 0 αt p 1 = p 0 αt 1 p 2 = p 0 αt 2 Spiegazione della legge a livello microscopico: dovendo rimanere costanti gli spazi percorsi (V=cost), aumentando la temperatura e di conseguenza essendo maggiore la velocità media traslazionale, necessariamente aumenta l impulso sulle pareti e quindi la pressione. L EQUAZIONE DI STATO DEI GAS PERFETTI Si definisce gas perfetto un gas che sia lontano dal punto di liquefazione e che sia rarefatto, cioè che le sue molecole siano abbastanza distanti da non interagire e quindi non ha energia potenziale interna. n=numero delle moli R=costante universale dei gas (8.31J/mol*K) T=temperatura (SOLO in K) Oppure pv=nkt N=numero di molecole nel gas k=costante di Boltzmann (1.37*10-23 J/K) PV=nRT ENERGIA CINETICA MEDIA ED ENERGIA CINETICA INTERNA DI UN GAS PERFETTO L energia cinetica media di un gas perfetto monoatomico è uguale a: Ec=3/2KT per 1 molecola 9
10 Ec interna =3/2NKT per tutto il gas PRIMO PRINCIPIO DELLA TERMODINAMICA Il primo principio della termodinamica afferma che la variazione di energia interna di un corpo è uguale al calore scambiato meno il lavoro scambiato: Con la seguente convenzione di segni: Q assorbito + Q ceduto L fatto + L subito - ΔU=Q-L LAVORO IN UNA TRASFORMAZIONE TERMODINAMICA Le trasformazioni dei gas possono essere rappresentate graficamente in un grafico pressionevolume, detto piano di Clapeyron. Una trasformazione isotermica viene rappresentata mediante un iperbole. Una trasformazione isobarica viene rappresentata mediante un segmento parallelo all asse delle ascisse. Una trasformazione isovolumica (o isocora) viene rappresentata mediante un segmento parallelo all asse delle ordinate. In generale il lavoro in una trasformazione è pari all area sottesa dalla curva che rappresenta la trasformazione nel piano di Clapeyron, in particolare in una trasformazione isobarica il lavoro è uguale al prodotto tra pressione e variazione di volume: p V In una trasformazione isovolumica il lavoro è nullo poiché non c è variazione di volume. 10
11 In una trasformazione isotermica il lavoro è uguale all area compresa tra la curva e l asse del volume: p V Il primo principio per le trasformazioni particolari assume le seguenti forme: ΔU=Q per le isocore ΔU=Q-pΔV nelle isobare Q=L nelle isoterme IL SECONDO PRINCIPIO DELLA TERMODINAMICA Esistono due enunciati per il secondo principio della termodinamica quello di Kelvin e quello di Clausius. Enunciato di Kelvin: Ӗ impossibile realizzare una trasformazione il cui risultato sia solo quello di convertire in lavoro il calore prelevato da una sola sorgente. Quindi è impossibile avere una macchina termica il cui rendimento sia uguale ad 1. Enunciato di Clausius: Ӗ impossibile realizzare una trasformazione il cui unico risultato sia il passaggio di calore da un corpo a una data temperatura a un altro a temperatura maggiore del primo. IL RENDIMENTO DI UNA MACCHINA TERMICA Il rendimento di una macchina termica è dato dal rapporto fra il lavoro fatto dalla macchina ed il calore assorbito dalla sorgente a temperatura maggiore Una macchina termica NON può avere mai un rendimento uguale ad 1, come si evince confrontando la formula del rendimento con l enunciato di Kelvin. 11
L equilibrio dei gas. Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura
 Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
La temperatura. La materia può trovarsi in tre stati diversi di aggregazione diversi: solido, liquido e gassoso
 1 La temperatura La materia può trovarsi in tre stati diversi di aggregazione diversi: solido, liquido e gassoso Qualunque sia lo stato di aggregazione, le particelle (molecole o atomi) di cui è fatta
1 La temperatura La materia può trovarsi in tre stati diversi di aggregazione diversi: solido, liquido e gassoso Qualunque sia lo stato di aggregazione, le particelle (molecole o atomi) di cui è fatta
La misura della temperatura
 Calore e temperatura 1. La misura della temperatura 2. La dilatazione termica 3. La legge fondamentale della termologia 4. Il calore latente 5. La propagazione del calore La misura della temperatura La
Calore e temperatura 1. La misura della temperatura 2. La dilatazione termica 3. La legge fondamentale della termologia 4. Il calore latente 5. La propagazione del calore La misura della temperatura La
i tre stati di aggregazione
 Temperatura e Calore -temperatura -calore e calore specifico -lavoro in termodinamica -trasformazioni termodinamiche -trasformazioni di stato -energia interna 1 i tre stati di aggregazione solido Ordine
Temperatura e Calore -temperatura -calore e calore specifico -lavoro in termodinamica -trasformazioni termodinamiche -trasformazioni di stato -energia interna 1 i tre stati di aggregazione solido Ordine
V=kT e P=jT, dove k e j sono costanti a temperatura costante(isoterma):p*v=costante ( legge di Boyle) Per dei gas perfetti che obbediscono alle leggi
 La Termodinamica La temperatura è una grandezza fisica che misura lo stato termico di un corpo ed è misurata con un termometro ed esistono varie scale di misura: scala kelvin, Celsius, Rèaumur, Farenheit.
La Termodinamica La temperatura è una grandezza fisica che misura lo stato termico di un corpo ed è misurata con un termometro ed esistono varie scale di misura: scala kelvin, Celsius, Rèaumur, Farenheit.
Temperatura. Temperatura
 TERMOMETRIA E CALORE Che cos è la? Grandezza che misura l energia accumulata da un corpo come energia 2 La regola molti processi chimico fisici, quali ad esempio la formazione delle calotte polari, le
TERMOMETRIA E CALORE Che cos è la? Grandezza che misura l energia accumulata da un corpo come energia 2 La regola molti processi chimico fisici, quali ad esempio la formazione delle calotte polari, le
Fisica per scienze ed ingegneria
 Serway, Jewett Fisica per scienze ed ingegneria Capitolo 19 Temperatura e principio zero della termodinamica I nostri sensi non sono affidabili per definire lo stato termico dei corpi. Ocorre un metodo
Serway, Jewett Fisica per scienze ed ingegneria Capitolo 19 Temperatura e principio zero della termodinamica I nostri sensi non sono affidabili per definire lo stato termico dei corpi. Ocorre un metodo
SCALA TERMOMETRICA CELSIUS
 TERMOLOGIA TEMPERATURA LA TEMPERATURA E UN INDICE DELLA SENSAZIONE FISIOLOGICA DI CALDO/FREDDO. A LIVELLO MICROSCOPICO E INDICE DELLO STATO DI AGITAZIONE TERMICA MOLECOLARE, ESSENDO PROPORZIONALE ALLA
TERMOLOGIA TEMPERATURA LA TEMPERATURA E UN INDICE DELLA SENSAZIONE FISIOLOGICA DI CALDO/FREDDO. A LIVELLO MICROSCOPICO E INDICE DELLO STATO DI AGITAZIONE TERMICA MOLECOLARE, ESSENDO PROPORZIONALE ALLA
PRIMI ELEMENTI DI TERMODINAMICA. La termodinamica studia le leggi con cui i sistemi scambiano (cedono e ricevono) energia con l ambiente.
 PRIMI ELEMENTI DI TERMODINAMICA Un sistema è un insieme di corpi che possiamo immaginare avvolti da una superficie chiusa, ma permeabile alla materia e all energia. L ambiente è tutto ciò che si trova
PRIMI ELEMENTI DI TERMODINAMICA Un sistema è un insieme di corpi che possiamo immaginare avvolti da una superficie chiusa, ma permeabile alla materia e all energia. L ambiente è tutto ciò che si trova
Programma svolto a.s. 2015/2016. Materia: fisica
 Programma svolto a.s. 2015/2016 Classe: 4A Docente: Daniela Fadda Materia: fisica Dettagli programma Cinematica e dinamica: moto circolare uniforme (ripasso); moto armonico (ripasso); moto parabolico (ripasso);
Programma svolto a.s. 2015/2016 Classe: 4A Docente: Daniela Fadda Materia: fisica Dettagli programma Cinematica e dinamica: moto circolare uniforme (ripasso); moto armonico (ripasso); moto parabolico (ripasso);
approfondimento Fasi e cambiamenti di fase
 approfondimento Fasi e cambiamenti di fase Gas ideali e gas reali Teoria cinetica dei gas e conseguenze Cambiamenti di fase e conservazione della energia Gas ideali e gas reali In un gas ideale: l interazione
approfondimento Fasi e cambiamenti di fase Gas ideali e gas reali Teoria cinetica dei gas e conseguenze Cambiamenti di fase e conservazione della energia Gas ideali e gas reali In un gas ideale: l interazione
Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA
 Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
Fisica per scienze ed ingegneria
 Serway, Jewett Fisica per scienze ed ingegneria Capitolo 20 Fino a circa il 1850 su riteneva che la meccanica e la termodinamica fossero due scienze completamente distinte. La legge di conservazione dell
Serway, Jewett Fisica per scienze ed ingegneria Capitolo 20 Fino a circa il 1850 su riteneva che la meccanica e la termodinamica fossero due scienze completamente distinte. La legge di conservazione dell
IL CALORE. Il calore. Esperimento di Joule. Il calore
 l calore l calore Q è energia che sta transitando da un sistema all altro, e compare ogni volta che c è un dislivello di temperatura. L CALORE l corpo più caldo cede parte della sua energia interna al
l calore l calore Q è energia che sta transitando da un sistema all altro, e compare ogni volta che c è un dislivello di temperatura. L CALORE l corpo più caldo cede parte della sua energia interna al
GAS IDEALI E REALI. Prendiamo ora in considerazione un sistema particolare termodinamico: il gas. Un gas è un fluido con le seguenti caratteristiche:
 GAS IDEALI E REALI Gas ideale. Prendiamo ora in considerazione un sistema particolare termodinamico: il gas. Un gas è un fluido con le seguenti caratteristiche: - non ha forma, ne volume proprio; - e comprimibile.
GAS IDEALI E REALI Gas ideale. Prendiamo ora in considerazione un sistema particolare termodinamico: il gas. Un gas è un fluido con le seguenti caratteristiche: - non ha forma, ne volume proprio; - e comprimibile.
Università degli Studi di Milano. Facoltà di Scienze Matematiche Fisiche e Naturali
 Università degli Studi di Milano Facoltà di Scienze Matematiche Fisiche e Naturali Corsi di Laurea in: Informatica ed Informatica per le Telecomunicazioni Anno accademico 2010/11, Laurea Triennale, Edizione
Università degli Studi di Milano Facoltà di Scienze Matematiche Fisiche e Naturali Corsi di Laurea in: Informatica ed Informatica per le Telecomunicazioni Anno accademico 2010/11, Laurea Triennale, Edizione
CONVENZIONE SUI SEGNI
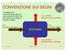 CONVENZIONE SUI SEGNI Si stabilisce una convenzione sui segni sia per gli scambi di calore che per il lavoro che il sistema compie o subisce L>0: LAVORO COMPIUTO DAL SISTEMA Q>0: CALORE ASSORBITO SISTEMA
CONVENZIONE SUI SEGNI Si stabilisce una convenzione sui segni sia per gli scambi di calore che per il lavoro che il sistema compie o subisce L>0: LAVORO COMPIUTO DAL SISTEMA Q>0: CALORE ASSORBITO SISTEMA
PDF Compressor Pro. Temperatura e calore. Prof Giovanni Ianne
 Temperatura e calore Prof Giovanni Ianne LA TEMPERATURA La temperatura è la grandezza fisica che si misura con il termometro. La temperatura nel Sistema Internazionale si misura in gradi Kelvin (simbolo
Temperatura e calore Prof Giovanni Ianne LA TEMPERATURA La temperatura è la grandezza fisica che si misura con il termometro. La temperatura nel Sistema Internazionale si misura in gradi Kelvin (simbolo
Fisica Main Training Lorenzo Manganaro
 Fisica Main Training 2016-2017 Lorenzo Manganaro 1. Temperatura e dilatazione termica 2. Calorimetria 3. Scambio di calore 30 25 20 Veterinaria Ottica e Optometria Odontoiatria Medicina 15 10 5 0 Vettori
Fisica Main Training 2016-2017 Lorenzo Manganaro 1. Temperatura e dilatazione termica 2. Calorimetria 3. Scambio di calore 30 25 20 Veterinaria Ottica e Optometria Odontoiatria Medicina 15 10 5 0 Vettori
1.Pressione di un Gas
 1.Pressione di un Gas Un gas è formato da molecole che si muovono in modo disordinato, urtandosi fra loro e urtando contro le pareti del recipiente che le contiene. Durante gli urti, le molecole esercitano
1.Pressione di un Gas Un gas è formato da molecole che si muovono in modo disordinato, urtandosi fra loro e urtando contro le pareti del recipiente che le contiene. Durante gli urti, le molecole esercitano
GAS IDEALI E MACCHINE TERMICHE. G. Pugliese 1
 GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
CALORIMETRIA E TERMODINAMICA. G. Roberti
 CALORIMETRIA E TERMODINAMICA G. Roberti 422. A due corpi, alla stessa temperatura, viene fornita la stessa quantità di calore. Al termine del riscaldamento i due corpi avranno ancora pari temperatura se:
CALORIMETRIA E TERMODINAMICA G. Roberti 422. A due corpi, alla stessa temperatura, viene fornita la stessa quantità di calore. Al termine del riscaldamento i due corpi avranno ancora pari temperatura se:
Leggi dei gas Equazione di stato dei gas perfetti
 Le leggi dei gas Quale descrizione fisico-matematica si può usare per i diversi stati di aggregazione della materia? Essa è tanto più semplice (equazioni) quanto meno interagenti sono fra loro le particelle
Le leggi dei gas Quale descrizione fisico-matematica si può usare per i diversi stati di aggregazione della materia? Essa è tanto più semplice (equazioni) quanto meno interagenti sono fra loro le particelle
PIANO DI STUDIO D ISTITUTO
 PIANO DI STUDIO D ISTITUTO Materia: FISICA Casse 2 1 Quadrimestre Modulo 1 - RIPASSO INIZIALE Rappresentare graficamente nel piano cartesiano i risultati di un esperimento. Distinguere fra massa e peso
PIANO DI STUDIO D ISTITUTO Materia: FISICA Casse 2 1 Quadrimestre Modulo 1 - RIPASSO INIZIALE Rappresentare graficamente nel piano cartesiano i risultati di un esperimento. Distinguere fra massa e peso
Termodinamica: introduzione
 Termodinamica: introduzione La Termodinamica studia i fenomeni che avvengono nei sistemi in seguito a scambi di calore (energia termica) ed energia meccanica, a livello macroscopico. Qualche concetto rilevante
Termodinamica: introduzione La Termodinamica studia i fenomeni che avvengono nei sistemi in seguito a scambi di calore (energia termica) ed energia meccanica, a livello macroscopico. Qualche concetto rilevante
Stati della materia. Esempio. Fusione e solidificazione. Esempio. Stati di aggregazione della materia
 Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5.
 Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Capitolo 16 L energia si trasferisce
 Capitolo 16 L energia si trasferisce 1. L «ABC» dei trasferimenti energetici 2. Le reazioni scambiano energia con l ambiente 3. Durante le reazioni varia l energia chimica del sistema 4. L energia chimica
Capitolo 16 L energia si trasferisce 1. L «ABC» dei trasferimenti energetici 2. Le reazioni scambiano energia con l ambiente 3. Durante le reazioni varia l energia chimica del sistema 4. L energia chimica
CALORE E TEMPERATURA
 CALORE E TEMPERATURA Indice Obiettivi L agitazione termica La dilatazione termica La misura della temperatura Lo stato fisico della materia Flussi di calore ed equilibrio termico La propagazione del calore
CALORE E TEMPERATURA Indice Obiettivi L agitazione termica La dilatazione termica La misura della temperatura Lo stato fisico della materia Flussi di calore ed equilibrio termico La propagazione del calore
Agli alunni della Classe 2 AN (Liceo Scientifico Tradizionale) A.S. 2011/2012
 Istituto Statale d Istruzione Superiore Francesco Gonzaga Liceo Scientifico, Liceo Classico, Liceo Linguistico. Istituto Tecnico Commerciale per Ragionieri IGEA e per Programmatori Mercurio Via F.lli Lodrini
Istituto Statale d Istruzione Superiore Francesco Gonzaga Liceo Scientifico, Liceo Classico, Liceo Linguistico. Istituto Tecnico Commerciale per Ragionieri IGEA e per Programmatori Mercurio Via F.lli Lodrini
IL LAVORO E LE ENERGIE Giuseppe Frangiamore con la collaborazione di Carmelo Bastillo
 Il lavoro IL LAVORO E LE ENERGIE Giuseppe Frangiamore con la collaborazione di Carmelo Bastillo Il lavoro è una grandezza scalare, ed è definito dal prodotto di forza per spostamento. L unità di misura
Il lavoro IL LAVORO E LE ENERGIE Giuseppe Frangiamore con la collaborazione di Carmelo Bastillo Il lavoro è una grandezza scalare, ed è definito dal prodotto di forza per spostamento. L unità di misura
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione
Temperatura Calore Trasformazioni termodinamiche
 I FENOMENI TERMICI Temperatura Calore Trasformazioni termodinamiche Gas perfetti Temperatura assoluta Gas reali Principi della Termodinamica Trasmissione i del calore Termoregolazione del corpo umano pag.1
I FENOMENI TERMICI Temperatura Calore Trasformazioni termodinamiche Gas perfetti Temperatura assoluta Gas reali Principi della Termodinamica Trasmissione i del calore Termoregolazione del corpo umano pag.1
Lavoro. Esempio. Definizione di lavoro. Lavoro motore e lavoro resistente. Lavoro compiuto da più forze ENERGIA, LAVORO E PRINCIPI DI CONSERVAZIONE
 Lavoro ENERGIA, LAVORO E PRINCIPI DI CONSERVAZIONE Cos è il lavoro? Il lavoro è la grandezza fisica che mette in relazione spostamento e forza. Il lavoro dipende sia dalla direzione della forza sia dalla
Lavoro ENERGIA, LAVORO E PRINCIPI DI CONSERVAZIONE Cos è il lavoro? Il lavoro è la grandezza fisica che mette in relazione spostamento e forza. Il lavoro dipende sia dalla direzione della forza sia dalla
Temperatura e calore. Principi della termodinamica Temperatura Calore Gas ideali
 Temperatura e calore Principi della termodinamica Temperatura Calore Gas ideali Termodinamica Termodinamica branca della fisica che descrive le trasformazioni subite da un sistema in seguito a processi
Temperatura e calore Principi della termodinamica Temperatura Calore Gas ideali Termodinamica Termodinamica branca della fisica che descrive le trasformazioni subite da un sistema in seguito a processi
Lezione 10. Cenni di Termodinamica. Temperatura e calore Definizione e misura della temperatura Calore Principi della Termodinamica
 Lezione 10 Cenni di Termodinamica Temperatura e calore Definizione e misura della temperatura Calore Principi della Termodinamica Trasporto del calore Fisica Generale per Architettura - G. Cantatore 1
Lezione 10 Cenni di Termodinamica Temperatura e calore Definizione e misura della temperatura Calore Principi della Termodinamica Trasporto del calore Fisica Generale per Architettura - G. Cantatore 1
FERRARI LUCI MARIANI PELISSETTO FISICA MECCANICA E TERMODINAMICA IDELSON-GNOCCHI
 FERRARI LUCI MARIANI PELISSETTO FISICA Volume Primo MECCANICA E TERMODINAMICA IDELSON-GNOCCHI Autori VALERIA FERRARI Professore Ordinario di Fisica Teorica Dipartimento di Fisica Sapienza Università di
FERRARI LUCI MARIANI PELISSETTO FISICA Volume Primo MECCANICA E TERMODINAMICA IDELSON-GNOCCHI Autori VALERIA FERRARI Professore Ordinario di Fisica Teorica Dipartimento di Fisica Sapienza Università di
ISTITUTO TECNICO AGRARIO STATALE E. SERENI ROMA
 ISTITUTO TECNICO AGRARIO STATALE E. SERENI ROMA ANNO SCOLASTICO 2016/2017 FISICA CLASSE II SEZ. Az PROGRAMMA SVOLTO DALL INSEGNANTE Prof. Alessandro Di Marco Testo adottato: FISICA 2 CON ACTIVE BOOK /
ISTITUTO TECNICO AGRARIO STATALE E. SERENI ROMA ANNO SCOLASTICO 2016/2017 FISICA CLASSE II SEZ. Az PROGRAMMA SVOLTO DALL INSEGNANTE Prof. Alessandro Di Marco Testo adottato: FISICA 2 CON ACTIVE BOOK /
Termodinamica. studia le modificazioni subite da un sistema a seguitodel trasferimento di energia sotto forma di calore e lavoro.
 Termodinamica studia le modificazioni subite da un sistema a seguitodel trasferimento di energia sotto forma di calore e lavoro. La termodinamica parte da osservazioni sperimentali e quindi si esprime
Termodinamica studia le modificazioni subite da un sistema a seguitodel trasferimento di energia sotto forma di calore e lavoro. La termodinamica parte da osservazioni sperimentali e quindi si esprime
TERMODINAMICA. Il sistema è il corpo o l insieme dei corpi sotto esame.
 TERMODINAMICA SISTEMI TERMODINAMICI Il sistema è il corpo o l insieme dei corpi sotto esame. L ambiente esterno è l insieme di tutti i corpi che possono interagire con il sistema. Tipi di sistemi termodinamici
TERMODINAMICA SISTEMI TERMODINAMICI Il sistema è il corpo o l insieme dei corpi sotto esame. L ambiente esterno è l insieme di tutti i corpi che possono interagire con il sistema. Tipi di sistemi termodinamici
Unità 1. La temperatura
 Unità 1 La temperatura 1. Il termometro La sensazione di caldo e di freddo è soggettiva: per renderla misurabile si usa il termoscopio. È un recipiente di vetro con tappo forato e tubicino, contenente
Unità 1 La temperatura 1. Il termometro La sensazione di caldo e di freddo è soggettiva: per renderla misurabile si usa il termoscopio. È un recipiente di vetro con tappo forato e tubicino, contenente
Fisica per Medicina. Lezione 9 - Termodinamica. Dr. Cristiano Fontana
 Fisica per Medicina Lezione 9 - Termodinamica Dr. Cristiano Fontana Dipartimento di Fisica ed Astronomia Galileo Galilei Università degli Studi di Padova 17 novembre 2016 Grandezze in gioco Trasporto di
Fisica per Medicina Lezione 9 - Termodinamica Dr. Cristiano Fontana Dipartimento di Fisica ed Astronomia Galileo Galilei Università degli Studi di Padova 17 novembre 2016 Grandezze in gioco Trasporto di
CALORE SPECIFICO E CAPACITÀ TERMICA
 1 CALORE SPECIFICO E CAPACITÀ TERMICA 1. (Da Veterinaria 2004) Una scatola di polistirolo (materiale sistemico bianco, leggero, a basso coefficiente di conducibilità termica) contiene 100 g di acqua a
1 CALORE SPECIFICO E CAPACITÀ TERMICA 1. (Da Veterinaria 2004) Una scatola di polistirolo (materiale sistemico bianco, leggero, a basso coefficiente di conducibilità termica) contiene 100 g di acqua a
Bilancio di energia: il Primo Principio della Termodinamica. Termodinamica dell Ingegneria Chimica
 Bilancio di energia: il Primo Principio della Termodinamica Termodinamica dell Ingegneria Chimica 1 I Sistemi termodinamici Un sistema è definito da una superficie di controllo, reale o immaginaria, che
Bilancio di energia: il Primo Principio della Termodinamica Termodinamica dell Ingegneria Chimica 1 I Sistemi termodinamici Un sistema è definito da una superficie di controllo, reale o immaginaria, che
Fisica Main Training Lorenzo Manganaro
 Fisica Main Training 2016-2017 Lorenzo Manganaro 1. Lavoro di una forza 2. Energia meccanica e legge di conservazione 3. Forze dissipative 4. Potenza 30 25 20 15 1. Conservazione dell energia 2. Potenza
Fisica Main Training 2016-2017 Lorenzo Manganaro 1. Lavoro di una forza 2. Energia meccanica e legge di conservazione 3. Forze dissipative 4. Potenza 30 25 20 15 1. Conservazione dell energia 2. Potenza
Il primo principio della termodinamica
 1 Il primo principio della termodinamica Il primo principio della termodinamica Nelle lezioni precedenti abbiamo visto che per far innalzare la temperatura di un sistema vi sono due possibilità: fornendo
1 Il primo principio della termodinamica Il primo principio della termodinamica Nelle lezioni precedenti abbiamo visto che per far innalzare la temperatura di un sistema vi sono due possibilità: fornendo
Lo stato si un gas è caratterizzato da determinanti valori di temperatura, volume e pressione, che rappresentano variabili di stato termodinamico
 Fisica (plus) dei Puffi prof. Angelo Vitiello T 1 Termodinamica La temperatura è una grandezza fisica scalare che si misura con il termometro. Rende oggettiva la sensazione corporea di freddo e di caldo.
Fisica (plus) dei Puffi prof. Angelo Vitiello T 1 Termodinamica La temperatura è una grandezza fisica scalare che si misura con il termometro. Rende oggettiva la sensazione corporea di freddo e di caldo.
TERMOLOGIA & TERMODINAMICA I
 TERMOLOGIA & TERMODINAMICA I 1 Meccanica: studia il moto dei corpi e le cause che lo genera Grandezze meccaniche: massa, velocità, accelerazione, forza, energia Struttura atomica dei gas: particelle tutte
TERMOLOGIA & TERMODINAMICA I 1 Meccanica: studia il moto dei corpi e le cause che lo genera Grandezze meccaniche: massa, velocità, accelerazione, forza, energia Struttura atomica dei gas: particelle tutte
PIANO DI LAVORO ANNUALE PROGETTAZIONE INDIVIDUALE PER SINGOLA DISCIPLINA E PER CLASSE
 PIANO DI LAVORO ANNUALE PROGETTAZIONE INDIVIDUALE PER SINGOLA DISCIPLINA E PER CLASSE Classe 2 A.S. 2016/2017 Disciplina: Scienze integrate - fisica Docente: prof. Gessuti Daniel Ore settimanali: 2 ore
PIANO DI LAVORO ANNUALE PROGETTAZIONE INDIVIDUALE PER SINGOLA DISCIPLINA E PER CLASSE Classe 2 A.S. 2016/2017 Disciplina: Scienze integrate - fisica Docente: prof. Gessuti Daniel Ore settimanali: 2 ore
Lo stato gassoso e le sue proprietà
 Lo stato gassoso e le sue proprietà Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1
Lo stato gassoso e le sue proprietà Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1
UNITÀ 1 La temperatura. Test
 Test 1 Quale delle seguenti affermazioni è vera? A Il termoscopio è un termometro con una scala graduata. B Il termometro è un termoscopio con la scala graduata. C Il termoscopio visualizza variazioni
Test 1 Quale delle seguenti affermazioni è vera? A Il termoscopio è un termometro con una scala graduata. B Il termometro è un termoscopio con la scala graduata. C Il termoscopio visualizza variazioni
Lezione 14 Termologia Cambiamenti di stato. Dilatazioni termiche. Trasmissione del calore.
 Lezione 14 Termologia Cambiamenti di stato. Dilatazioni termiche. Trasmissione del calore. Cambiamenti di stati di aggregazione Gli stati di aggregazione della materia sono: solido, liquido gassoso (e
Lezione 14 Termologia Cambiamenti di stato. Dilatazioni termiche. Trasmissione del calore. Cambiamenti di stati di aggregazione Gli stati di aggregazione della materia sono: solido, liquido gassoso (e
A.S. 2016/2017 PROGRAMMA SVOLTO E INDICAZIONI PER IL RECUPERO ESTIVO. Del prof. Gabriele Giovanardi (nome e cognome in stampatello) docente di Fisica
 A.S. 2016/2017 PROGRAMMA SVOLTO E INDICAZIONI PER IL RECUPERO ESTIVO Del prof. Gabriele Giovanardi (nome e cognome in stampatello) docente di Fisica Classe 2E Informatica e Telecomunicazioni Moduli Modulo
A.S. 2016/2017 PROGRAMMA SVOLTO E INDICAZIONI PER IL RECUPERO ESTIVO Del prof. Gabriele Giovanardi (nome e cognome in stampatello) docente di Fisica Classe 2E Informatica e Telecomunicazioni Moduli Modulo
TERMODINAMICA. trasmissione del calore
 TERMODINAMICA Lo studio delle proprietà e della Lo studio delle proprietà e della trasmissione del calore CALORE Il CALORE è una forma di energia e come tale può trasformarsi in altre forme di energia;
TERMODINAMICA Lo studio delle proprietà e della Lo studio delle proprietà e della trasmissione del calore CALORE Il CALORE è una forma di energia e come tale può trasformarsi in altre forme di energia;
Calore, lavoro e trasformazioni termodinamiche (1)
 Calore, lavoro e trasformazioni termodinamiche (1) Attraverso scambi di calore un sistema scambia energia con l ambiente. Tuttavia si scambia energia anche quando le forze (esterne e interne al sistema)
Calore, lavoro e trasformazioni termodinamiche (1) Attraverso scambi di calore un sistema scambia energia con l ambiente. Tuttavia si scambia energia anche quando le forze (esterne e interne al sistema)
Sistema termodinamico: porzione di universo separata da tutto il resto del mondo. Ambiente esterno confini del sistema
 Termodinamica: concetti di base Sistema termodinamico: porzione di universo separata da tutto il resto del mondo Ambiente esterno confini del sistema sistema Stato del sistema: definito dal valore delle
Termodinamica: concetti di base Sistema termodinamico: porzione di universo separata da tutto il resto del mondo Ambiente esterno confini del sistema sistema Stato del sistema: definito dal valore delle
Marco Panareo. Appunti di Fisica. Meccanica e Termodinamica. Università degli Studi del Salento, Facoltà di Ingegneria
 Marco Panareo Appunti di Fisica Meccanica e Termodinamica Università degli Studi del Salento, Facoltà di Ingegneria ii iii INTRODUZIONE Questa raccolta di appunti originati dalle lezioni di Fisica Generale
Marco Panareo Appunti di Fisica Meccanica e Termodinamica Università degli Studi del Salento, Facoltà di Ingegneria ii iii INTRODUZIONE Questa raccolta di appunti originati dalle lezioni di Fisica Generale
Il Gas Ideale. Il gas ideale é un'astrazione
 Il Gas Ideale a) le particelle sono animate da moto perenne, ed occupano omogeneamente tutto lo spazio a loro disposizione b) il movimento delle particelle è casuale c) le particelle hanno volume proprio
Il Gas Ideale a) le particelle sono animate da moto perenne, ed occupano omogeneamente tutto lo spazio a loro disposizione b) il movimento delle particelle è casuale c) le particelle hanno volume proprio
Esercitazione 7. Soluzione. Il sistema è isolato, quindi l energia totale si conserva. Applicando il primo principio della termodinamica si ottiene:
 Esercitazione 7 Esercizio 1 Una massa m g = 20 g di ghiaccio a 0 C è contenuta in un recipiente termicamente isolato. Successivamente viene aggiunta una massa m a = 80 di acqua a 80 C. Quale sarà, all
Esercitazione 7 Esercizio 1 Una massa m g = 20 g di ghiaccio a 0 C è contenuta in un recipiente termicamente isolato. Successivamente viene aggiunta una massa m a = 80 di acqua a 80 C. Quale sarà, all
Lez 15 22/11/2016. Lezioni in didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617
 Lez 15 22/11/2016 Lezioni in http://www.fisgeo.unipg.it/~fiandrin/ didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617 1 Energia interna di un gas ideale E. Fiandrini Fis. Sper. e 2 Energia
Lez 15 22/11/2016 Lezioni in http://www.fisgeo.unipg.it/~fiandrin/ didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617 1 Energia interna di un gas ideale E. Fiandrini Fis. Sper. e 2 Energia
Il calcolo vettoriale: ripasso della somma e delle differenza tra vettori; prodotto scalare; prodotto vettoriale.
 Anno scolastico: 2012-2013 Docente: Paola Carcano FISICA 2D Il calcolo vettoriale: ripasso della somma e delle differenza tra vettori; prodotto scalare; prodotto vettoriale. Le forze: le interazioni fondamentali;
Anno scolastico: 2012-2013 Docente: Paola Carcano FISICA 2D Il calcolo vettoriale: ripasso della somma e delle differenza tra vettori; prodotto scalare; prodotto vettoriale. Le forze: le interazioni fondamentali;
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 19 L energia si trasferisce 3 Sommario (I) 1. L «ABC» dei trasferimenti energetici 2. Durante le reazioni varia l energia chimica
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 19 L energia si trasferisce 3 Sommario (I) 1. L «ABC» dei trasferimenti energetici 2. Durante le reazioni varia l energia chimica
Temperatura, calore e prima legge termodinamica
 Temperatura, calore e prima legge termodinamica Principio di conservazione Energia ΔE tot = ΔE i = ΔT tot = ΔT j = L +Q +... Energia Termica - Calore Temperatura Conservazione energia Forme di energia
Temperatura, calore e prima legge termodinamica Principio di conservazione Energia ΔE tot = ΔE i = ΔT tot = ΔT j = L +Q +... Energia Termica - Calore Temperatura Conservazione energia Forme di energia
STATO GASSOSO. parte I a. - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio
 STATO GASSOSO parte I a - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio GAS PERFETTI molecole puntiformi (volume proprio nullo) urti elastici (stesse particelle prima e dopo l'urto) parametri
STATO GASSOSO parte I a - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio GAS PERFETTI molecole puntiformi (volume proprio nullo) urti elastici (stesse particelle prima e dopo l'urto) parametri
La temperatura e il calore
 La temperatura e il calore Questo simbolo significa che l esperimento si può realizzare con materiali o strumenti presenti nel nostro laboratorio Questo simbolo significa che l esperimento si può realizzare
La temperatura e il calore Questo simbolo significa che l esperimento si può realizzare con materiali o strumenti presenti nel nostro laboratorio Questo simbolo significa che l esperimento si può realizzare
Trasformazioni termodinamiche
 Trasformazioni termodinamiche Evoluzione di un sistema termodinamico -> trasformazione termodinamica Trasformazione quasi statica : stati successivi assunti dal sistema sono stati di equilibrio (parametri
Trasformazioni termodinamiche Evoluzione di un sistema termodinamico -> trasformazione termodinamica Trasformazione quasi statica : stati successivi assunti dal sistema sono stati di equilibrio (parametri
FISICA CLASSE 4ASU. CAPITOLO 10 Legge di conservazione della : se su un sistema non agiscono forze, la quantità di moto totale del sistema
 FISICA CLASSE 4ASU CAPITOLO 10 Legge di conservazione della : se su un sistema non agiscono forze, la quantità di moto totale del sistema.... Un urto si dice se in esso si conserva l energia totale dei
FISICA CLASSE 4ASU CAPITOLO 10 Legge di conservazione della : se su un sistema non agiscono forze, la quantità di moto totale del sistema.... Un urto si dice se in esso si conserva l energia totale dei
 http://www.fis.unipr.it/corsi/fisicacing/cinformatica/ Da compilare dal 15/10/06 in poi Termodinamica Temperatura e Calore I Principio della Termodinamica Teoria cinetica dei gas II Principio della
http://www.fis.unipr.it/corsi/fisicacing/cinformatica/ Da compilare dal 15/10/06 in poi Termodinamica Temperatura e Calore I Principio della Termodinamica Teoria cinetica dei gas II Principio della
Lezione 9 Termodinamica
 Argomenti della lezione: Lezione 9 Termodinamica introduzione misura della temperatura dilatazione termica calore / capacità termica, calore specifico, calore latente calore e lavoro primo principio della
Argomenti della lezione: Lezione 9 Termodinamica introduzione misura della temperatura dilatazione termica calore / capacità termica, calore specifico, calore latente calore e lavoro primo principio della
L ENERGIA CINETICA DELLE MOLECOLE DI UN GAS E LA TEMPERATURA Ogni molecola ha in media un'energia cinetica
 Primo principio- 1 - TERMODINAMICA ENERGIA INTERNA DI UN SISTEMA Ad ogni sistema fisico possiamo associare varie forme di energia, l energia cinetica delle molecole di cui è formato, energia potenziale,
Primo principio- 1 - TERMODINAMICA ENERGIA INTERNA DI UN SISTEMA Ad ogni sistema fisico possiamo associare varie forme di energia, l energia cinetica delle molecole di cui è formato, energia potenziale,
Gas ideale: velocità delle particelle e pressione (1)
 Gas ideale: velocità delle particelle e pressione (1) In un gas ideale le particelle sono considerate puntiformi e risentono di forze solo durante gli urti (perfettamente elastici) con le pareti del recipiente.
Gas ideale: velocità delle particelle e pressione (1) In un gas ideale le particelle sono considerate puntiformi e risentono di forze solo durante gli urti (perfettamente elastici) con le pareti del recipiente.
Conoscenze FISICA LES CLASSE TERZA SAPERI MINIMI
 FISICA LES SAPERI MINIMI CLASSE TERZA LE GRANDEZZE FISICHE E LA LORO MISURA Nuovi principi per indagare la natura. Il concetto di grandezza fisica. Misurare una grandezza fisica. L impossibilità di ottenere
FISICA LES SAPERI MINIMI CLASSE TERZA LE GRANDEZZE FISICHE E LA LORO MISURA Nuovi principi per indagare la natura. Il concetto di grandezza fisica. Misurare una grandezza fisica. L impossibilità di ottenere
Termodinamica: - cenni sui gas perfetti - macchine termiche - secondo principio. 18/12/2013 Macchine termiche e Secondo Principio della Termodinamica
 Termodinamica: - cenni sui gas perfetti - macchine termiche - secondo principio 1 Definizione di Gas Perfetto Un gas perfetto è un gas ideale il cui comportamento approssima quello dei gas reali a densità
Termodinamica: - cenni sui gas perfetti - macchine termiche - secondo principio 1 Definizione di Gas Perfetto Un gas perfetto è un gas ideale il cui comportamento approssima quello dei gas reali a densità
TERMODINAMICA. Studia le trasformazioni dei sistemi in relazione agli scambi di calore e lavoro. GENERALITÀ SUI SISTEMI TERMODINAMICI
 TERMODINAMICA Termodinamica: scienza che studia le proprietà e il comportamento dei sistemi, la loro evoluzione e interazione con l'ambiente esterno che li circonda. Studia le trasformazioni dei sistemi
TERMODINAMICA Termodinamica: scienza che studia le proprietà e il comportamento dei sistemi, la loro evoluzione e interazione con l'ambiente esterno che li circonda. Studia le trasformazioni dei sistemi
Stati di aggregazione della materia
 Stati di aggregazione della materia A seconda della natura dei legami tra gli atomi o delle forze tra le molecole si possono avere diversi stati di aggregazione della materia SOLIDO LIQUIDO GAS PLASMA
Stati di aggregazione della materia A seconda della natura dei legami tra gli atomi o delle forze tra le molecole si possono avere diversi stati di aggregazione della materia SOLIDO LIQUIDO GAS PLASMA
Riassunto fisica. Introduzione: La seconda legge di Newton =m a
 Statica Introduzione: La seconda legge di Newton =m a F =0 F =0 M ) fissare un riferimento (assi x e y) ) scoporre ogni forza in x e y 3) scegliere il punto in cui calcolare il Movimento (punto + complicato)
Statica Introduzione: La seconda legge di Newton =m a F =0 F =0 M ) fissare un riferimento (assi x e y) ) scoporre ogni forza in x e y 3) scegliere il punto in cui calcolare il Movimento (punto + complicato)
Per un sistema isolato la somma di energia potenziale ed energia cinetica si mantiene costante.
 All origine di tutto c è il teorema di conservazione dell energia totale meccanica: Per un sistema isolato la somma di energia potenziale ed energia cinetica si mantiene costante. Il teorema è tipicamente
All origine di tutto c è il teorema di conservazione dell energia totale meccanica: Per un sistema isolato la somma di energia potenziale ed energia cinetica si mantiene costante. Il teorema è tipicamente
FISICA E LABORATORIO INDIRIZZO C.A.T. CLASSE PRIMA. OBIETTIVI U. D. n 1.2: La rappresentazione di dati e fenomeni
 FISICA E LABORATORIO INDIRIZZO C.A.T. CLASSE PRIMA Le competenze di base a conclusione dell obbligo di istruzione sono le seguenti: Osservare, descrivere ed analizzare fenomeni appartenenti alla realtà
FISICA E LABORATORIO INDIRIZZO C.A.T. CLASSE PRIMA Le competenze di base a conclusione dell obbligo di istruzione sono le seguenti: Osservare, descrivere ed analizzare fenomeni appartenenti alla realtà
Riepilogo di calorimetria
 Riepilogo di calorimetria Applicate la conservazione dell energia: Calore assorbito = Calore ceduto Se non ci sono trasformazioni di fase: 1. Calore assorbito = massa x calore specifico x (T fin T iniz
Riepilogo di calorimetria Applicate la conservazione dell energia: Calore assorbito = Calore ceduto Se non ci sono trasformazioni di fase: 1. Calore assorbito = massa x calore specifico x (T fin T iniz
L energia cinetica si conserva solo negli urti elastici, mentre la quantità di moto si conserva in ogni urto.
 Saperi minimi di Fisica prof. Angelo Vitiello T 1 Generalità, Lavoro ed Energia Il lavoro è quella grandezza che si ottiene facendo il prodotto della forza agente su un punto per lo spostamento che esso
Saperi minimi di Fisica prof. Angelo Vitiello T 1 Generalità, Lavoro ed Energia Il lavoro è quella grandezza che si ottiene facendo il prodotto della forza agente su un punto per lo spostamento che esso
TERMOLOGIA TERMOMETRIA E CALORIMETRIA
 1 TERMOLOGIA La termologia è il settore della fisica che si interessa dei fenomeni termici, ovvero studia quei fenomeni in cui hanno una grande importanza la temperatura e il calore. Questa branca della
1 TERMOLOGIA La termologia è il settore della fisica che si interessa dei fenomeni termici, ovvero studia quei fenomeni in cui hanno una grande importanza la temperatura e il calore. Questa branca della
Università Politecnica delle Marche, Facoltà di Agraria. C.d.L. Scienze e Tecnologie Agrarie, A.A. 2015/2016, Fisica TERMODINAMICA
 TERMODINAMICA Temperatura: - è una grandezza macroscopica correlata al nostro senso di caldo e di freddo; - due persone diverse possono definire caldo o freddo lo stesso oggetto. - è quella grandezza che
TERMODINAMICA Temperatura: - è una grandezza macroscopica correlata al nostro senso di caldo e di freddo; - due persone diverse possono definire caldo o freddo lo stesso oggetto. - è quella grandezza che
-GAS IDEALI- Le particelle che costituiscono un gas ideale:
 -GAS IDEALI- Le particelle che costituiscono un gas ideale: sono in movimento continuo e casuale hanno un volume trascurabile rispetto al volume totale a disposizione del gas non interagiscono fra loro
-GAS IDEALI- Le particelle che costituiscono un gas ideale: sono in movimento continuo e casuale hanno un volume trascurabile rispetto al volume totale a disposizione del gas non interagiscono fra loro
Video introduzione Equilibrio termico Definizione di temperatura Esperimento di Joule. Primo principio della Termodinamica. Trasmissione del calore
 Primo principio della Termodinamica Video introduzione Equilibrio termico Definizione di temperatura Esperimento di Joule Primo principio della Termodinamica Trasmissione del calore Antonio Pierro @antonio_pierro_
Primo principio della Termodinamica Video introduzione Equilibrio termico Definizione di temperatura Esperimento di Joule Primo principio della Termodinamica Trasmissione del calore Antonio Pierro @antonio_pierro_
LAVORO, POTENZA ED ENERGIA
 LAVORO, POTENZA ED ENERGIA Giuseppe Frangiamore con la collaborazione di Leonardo Zaffuto Solitamente si dice di compiere un lavoro ogni volta che si esegue un attività di tipo fisico o mentale. Quando
LAVORO, POTENZA ED ENERGIA Giuseppe Frangiamore con la collaborazione di Leonardo Zaffuto Solitamente si dice di compiere un lavoro ogni volta che si esegue un attività di tipo fisico o mentale. Quando
GAS IDEALI (o gas perfetti )
 GAS IDEALI (o gas perfetti ) TEORIA CINETICA DEI GAS (modello di gas ideale ) molecole puntiformi moto rettilineo ed urti elastici forze attrattive - repulsive intermolecolari nulle PARAMETRI DELLO STATO
GAS IDEALI (o gas perfetti ) TEORIA CINETICA DEI GAS (modello di gas ideale ) molecole puntiformi moto rettilineo ed urti elastici forze attrattive - repulsive intermolecolari nulle PARAMETRI DELLO STATO
Test Esame di Fisica
 Test Esame di Fisica NOTA: per le domande a risposta multipla ogni risposta corretta viene valutata con un punto mentre una errata con -0.5 punti. 1) Una sola delle seguenti uguaglianze non e corretta?
Test Esame di Fisica NOTA: per le domande a risposta multipla ogni risposta corretta viene valutata con un punto mentre una errata con -0.5 punti. 1) Una sola delle seguenti uguaglianze non e corretta?
Calore e lavoro. 1 caloria = quantità di calore che bisogna cedere a 1 g di acqua per far passare la sua temperatura da 14.5 a 15.
 Calore e lavoro Nel 1700 si pensava al calore come qualcosa contenuto in un corpo, il calorico, che si trasmetteva da un corpo ad un altro. Sistema A T 1 Sistema B T 2 Parete conduttrice T 1 > T 2 Definizione
Calore e lavoro Nel 1700 si pensava al calore come qualcosa contenuto in un corpo, il calorico, che si trasmetteva da un corpo ad un altro. Sistema A T 1 Sistema B T 2 Parete conduttrice T 1 > T 2 Definizione
temperatura ambientale massa totale d aria contenuta nella stanza temperatura raggiunta nella stanza dalla massa d aria pressione atmosferica
 Esercizio n.21 di pagina 26. L 1 = 6 m L 2 = 8 m L 3 = 10 m t 0F = 20 F M = 28.8 kg/kmol = 28.8 g/mol m =? t 1F = 75 F p a = 1.013 10 5 Pa temperatura ambientale massa molecolare media dell aria massa
Esercizio n.21 di pagina 26. L 1 = 6 m L 2 = 8 m L 3 = 10 m t 0F = 20 F M = 28.8 kg/kmol = 28.8 g/mol m =? t 1F = 75 F p a = 1.013 10 5 Pa temperatura ambientale massa molecolare media dell aria massa
SCIENZE INTEGRATE (FISICA) - settore tecnologico COMPETENZE DISCIPLINARI CLASSI SECONDE
 SCIENZE INTEGRATE (FISICA) - settore tecnologico COMPETENZE DISCIPLINARI CLASSI SECONDE Saper analizzare un fenomeno o un problema riuscendo ad individuare gli elementi significativi e le relazioni coinvolte,
SCIENZE INTEGRATE (FISICA) - settore tecnologico COMPETENZE DISCIPLINARI CLASSI SECONDE Saper analizzare un fenomeno o un problema riuscendo ad individuare gli elementi significativi e le relazioni coinvolte,
Test Esame di Fisica
 Test Esame di Fisica NOTA: per le domande a risposta multipla ogni risposta corretta viene valutata con un punto mentre una errata con -0.5 punti. 1) Una sola delle seguenti uguaglianze non e corretta?
Test Esame di Fisica NOTA: per le domande a risposta multipla ogni risposta corretta viene valutata con un punto mentre una errata con -0.5 punti. 1) Una sola delle seguenti uguaglianze non e corretta?
PRINCIPI DELLA TERMODINAMICA. Bellucci, Bravetti, Pappalardo
 PRINCIPI DELLA TERMODINAMICA Bellucci, Bravetti, Pappalardo PRIMO PRINCIPIO DELLA TERMODINAMICA Un qualunque sistema di particelle può interagire con l esterno in quattro modi differenti : assorbendo o
PRINCIPI DELLA TERMODINAMICA Bellucci, Bravetti, Pappalardo PRIMO PRINCIPIO DELLA TERMODINAMICA Un qualunque sistema di particelle può interagire con l esterno in quattro modi differenti : assorbendo o
SECONDO PRINCIPIO DELLA TERMODINAMICA I DUE ENUNCIATI DEL SECONDO PRINCIPIO DELLA TERMODINAMICA
 SECONDO PRINCIPIO DELLA TERMODINAMICA I DUE ENUNCIATI DEL SECONDO PRINCIPIO DELLA TERMODINAMICA Enunciato di Clausius: È impossibile realizzare una trasformazione il cui unico risultato sia quello di fare
SECONDO PRINCIPIO DELLA TERMODINAMICA I DUE ENUNCIATI DEL SECONDO PRINCIPIO DELLA TERMODINAMICA Enunciato di Clausius: È impossibile realizzare una trasformazione il cui unico risultato sia quello di fare
Calore e Temperatura
 Calore 1 Calore e Temperatura La Temperatura riflette il movimento casuale delle particelle, ed è quindi correlata all energia cinetica delle molecole Il Calore coinvolge un trasferimento di energia tra
Calore 1 Calore e Temperatura La Temperatura riflette il movimento casuale delle particelle, ed è quindi correlata all energia cinetica delle molecole Il Calore coinvolge un trasferimento di energia tra
Esercitazione 13/5/2016
 Esercitazione 3/5/206 Esercizio Un anello di massa m e raggio r rotola senza strisciare su un piano orizzontale con velocità v CM costante. Ad un certo istante inizia a salire lungo un piano inclinato.
Esercitazione 3/5/206 Esercizio Un anello di massa m e raggio r rotola senza strisciare su un piano orizzontale con velocità v CM costante. Ad un certo istante inizia a salire lungo un piano inclinato.
10. LA MISURA DELLA TEMPERATURA
 1. LA MISURA DELLA TEMPERATURA 1.1 L organizzazione della materia Tutte le sostanze sono composte da atomi. Quando due o più atomi si legano assieme formano molecole. Atomi o molecole sono le unità (particelle)
1. LA MISURA DELLA TEMPERATURA 1.1 L organizzazione della materia Tutte le sostanze sono composte da atomi. Quando due o più atomi si legano assieme formano molecole. Atomi o molecole sono le unità (particelle)
LEGGE DI STOKES. Fisica Applicata, Area Infermieristica, M. Ruspa
 LEGGE DI STOKES La forza di attrito viscoso che agisce su un corpo sfrerico di raggio r che si muove con velocita v non elevata in un fluido di viscosita η in quite si puo calcolare come: SEDIMENTAZIONE
LEGGE DI STOKES La forza di attrito viscoso che agisce su un corpo sfrerico di raggio r che si muove con velocita v non elevata in un fluido di viscosita η in quite si puo calcolare come: SEDIMENTAZIONE
Lezione 10 Moto dei fluidi
 Lezione 10 Moto dei fluidi Caratterizzazione del moto Consideriamo soltanto il caso di liquidi in moto nei condotti. Parametri descrittivi del moto: Portata Q di un condotto: è il volume di liquido che
Lezione 10 Moto dei fluidi Caratterizzazione del moto Consideriamo soltanto il caso di liquidi in moto nei condotti. Parametri descrittivi del moto: Portata Q di un condotto: è il volume di liquido che
IL CALORE LA TEMPERATURA E I PASSAGGI DI STATO
 IL CALORE LA TEMPERATURA E I PASSAGGI DI STATO IL CALORE Se metti a contatto un oggetto meno caldo (acqua) con uno più caldo (chiodo), dopo un po di tempo quello meno caldo tende a scaldarsi e quello più
IL CALORE LA TEMPERATURA E I PASSAGGI DI STATO IL CALORE Se metti a contatto un oggetto meno caldo (acqua) con uno più caldo (chiodo), dopo un po di tempo quello meno caldo tende a scaldarsi e quello più
