Ad esempio un acido, come HCl, si dissocia in acqua per fornire idrogenioni nel seguente modo:
|
|
|
- Alfonso Martini
- 6 anni fa
- Visualizzazioni
Transcript
1 Fisiologia, fisiopatologia e terapia dei disturbi dell equilibrio acido-base. C. Terzano L obiettivo di questo capitolo è duplice: 1) fornire le basi necessarie per comprendere l equilibrio acidobase, le sue complicanze e l approccio terapeutico; 2) aiutare lo studente a superare l esame su un argomento reso, nella maggior parte dei casi, complesso. Al fine di raggiungere i suddetti scopi è necessario chiarire alcuni concetti chiave. Nel 1887 Svante Arrhenius, premio nobel nel 1903 per i suoi studi sugl elettroliti, si chiese quali ioni si potessero formare quando acidi e basi venivano disciolti in acqua. Arrivò pertanto alla conclusione che gli acidi si dissociano in acqua per dar luogo agli idrogenioni e che le basi si dissociano in acqua per dar luogo agli ioni idrossido. Ad esempio un acido, come HCl, si dissocia in acqua per fornire idrogenioni nel seguente modo: a) HCl H + + Cl - Mentre una base, come NaOH, si dissocia in acqua per fornire ioni idrossido b) NaOH Na + + OH - Acidi e basi si neutralizzano l uno con l altro in quanto idrogenioni e ioni idrossido si combinano fra loro per formare acqua (H 2O): 1
2 c) Neutralizzazione: H + + OH - H 2O HCl + NaOH H 2O + NaCl L equazione c rappresenta la versione ionica della neutralizzazione acido-base e mostra come un acido e una base si neutralizzano l un l altro per formare acqua e sali. Arrhenius definì pertando acido una sostanza capace di dissociarsi in acqua per fornire idrogenioni (H + ) e base una sostanza capace di dissociarsi in acqua per fornire ioni idrossido (OH - ). I limiti della teoria di Arrhenius sono che essa si applica solo alle soluzioni acquose e che esistono sostanze acide prive di ioni idrogeno e sostanze basiche prive di ioni idrossido. La teoria di Bronsted e Lowry del 1923 definisce un acido come una sostanza in grado di donare un H + ad un altra sostanza, senza richiedere una soluzione acquosa o la dissociazione in ioni. La sostanza che accetta H + dall acido è chiamata base. Una base, pertanto, rappresenta un accettore di protoni. Ad esempio, lo ione idrossido può accettare un protone per formare acqua: OH - + H + H 2O Ma anche uno ione carbonato può accettare uno ione idrogeno, o un protone, per diventare ione bicarbonato: CO H + HCO 3 - e le molecole di acqua possono funzionare come una base accettando protoni: H 2O + H + H 3O + L anidride carbonica (CO 2), nella teoria di Bronsted e Lowry non è considerata un acido, in quanto non possiede idrogenioni, tuttavia essa può essere considerata un acido considerando l acido carbonico ( H 2CO 3 ) come acido. Definiamo ora i termini più comuni. Neutro è il ph in cui si ha uguale numero di ioni [H + ] e ioni [OH - ]. 2
3 ph è il logaritmo negativo della concentrazione degli ioni idrogeno. L'acqua è più ionizzata alla temperatura corporea che alla temperatura ambiente; quindi il ph è neutro a 6.8 piuttosto che a 7.0. Questo è anche il ph medio all'interno della cellula. L'organismo preserva la neutralità all'interno delle nostre cellule, dove avviene la maggior parte delle reazioni chimiche dell'organismo, e mantiene il sangue a ph 7.4, cioè di 0.6 unità di ph sul versante alcalino rispetto alla neutralità. Il valore normale del ph extracellulare è di Pressione parziale di ossigeno nel sangue arterioso: PO2. La funzione più importante dell apparato respiratorio e vascolare è quella di rifornire in una quantità elevata di ossigeno le cellule del corpo umano ad una soddisfacente pressione paziale. La quantità di ossigeno resa disponibile in un minuto è nota come flusso di ossigeno, ed è uguale alla gittata cardiaca x il contenuto arterioso di ossigeno. La PO2 non indica quanto ossigeno è presente nel sangue, ma esclusivamente la pressione esercitata dalle molecole di O2 disciolte nei confronti dell elettrodo utilizzato per misurarla. I valori normali della PO2 variano con l età: respirando aria la PO2 di un soggetto di 20 anni è di mmhg, mentre a 65 anni è di 80 mmhg. Tab 1. Età (anni) mmhg (84-104) (81-101) (78-98) (74-94) (71-91) Tab. 1 : valori normali della PO2 arteriosa. Il rapporto fra la PO2 e la percentuale di saturazione dell emoglobina con l ossigeno (SaO2) è descritta dalla curva di dissociazione dell emoglobina. Fig. 1. 3
4 Fig.1 Curva di dissociazione dell emoglobina. La parte piatta superiore della curva indica che al ridursi dalla PO2 la SaO2 è mantenuta entro valori accettabili fino a valori di PO2 di circa 50 mmhg. Un ulteriore riduzione della PO2 al di sotto di tale valore comporterà una precipitosa caduta della SaO2 Vi sono quattro cause principali di ipossiemia ( riduzione della PO2) : 1) Ipoventilazione; 2) Alterazione della diffusione; 3) Shunt; 4) Disomogeneità del rapporto ventilazione / perfusione. Una quinta causa, riduzione della pressione parziale dell ossigeno nell aria inspirata, viene osservata solo in alcune circostanze particolari: durante il soggiorno ad elevate altitudini oppure quando viene inspirata una miscela a bassa concentrazione di O2. Abitualmente il sangue viene prelevato pungendo l arteria brachiale, radiale o femorale; viene quindi aspirato un singolo campione, oppure viene posto in arteria un piccolo catetere e i campioni vengono prelevati ripetutamente a seconda delle necessità. Lo spazio morto della siringa utilizzata per il prelievo deve essere riempito con eparina e l analisi eseguita possibilmente entro pochi minuti dal prelievo. -Fig. 2- In alcune occasioni il prelievo può essere effettuato a livello del lobo dell orecchio o ad un dito (prelievo capillare). 4
5 Fig. 2: Prelievo arterioso dall arteria radiale per l esecuzione dell emogasanalisi. FiO2. Frazione di ossigeno inspirata. Valore normale: 21% a qualsiasi altitudine. Durante l O2 terapia la frazione di ossigeno inspirata aumenta in rapporto all impostazione della FiO2 desiderata ( 24%, 28% ecc.) sfruttando il principio di Venturi e aggiustando per il flusso di gas da inalare, aria ambiente e flusso di ossigeno proveniente dall erogatore. Pressione parziale di anidride carbonica nel sangue arterioso: PCO2. Valore normale: 40 mmhg (34-45 mmhg). - HCO 3. Concentrazione di bicarbonati. Valore normale: 24 mmol/l ( mmol/l). BE: Eccesso di Basi. Quantità di acidi forti richiesta per riportare il ph a 7.4. Valore normale: + 2 mmol/l. Un valore positivo indica un eccesso di basi (o deficit di acidi), mentre un valore negativo indica un deficit di basi ( o un eccesso di acidi). Anidride carbonica (CO2): l acido respiratorio. L anidride carbonica non è un acido ma rappresenta l unico gas che può essere espirato. Per definizione l acidosi respiratoria è una condizione caratterizzata da una elevata PCO2. L'acido carbonico (H 2CO 3) si forma soltanto quando la CO2 si combina con l'acqua. La CO2 rappresenta pertanto un potenziale per creare una quantità equivalente di acido carbonico ed è il prodotto finale della completa ossidazione di carboidrati e acidi grassi. 5
6 Acidi metabolici e sistemi tampone. Gli acidi metabolici rappresentano tutti gli acidi non volatili prodotti dall organismo a partire soprattutto dalle proteine: lattato, fosfato, solfato,ecc. e sono escreti a livello renale. L acido carbonico è pertanto escluso da questa definizione. La risposta dell organismo alle variazioni dell equilibrio acido-base avviene rapidamente, nel giro di pochi minuti o ore, tramite una modificazione della ventilazione oppure, molto più lentamente ( giorni), tramite una modificazione della secrezione renale di bicarbonati. L iperventilazione aumenta l eliminazione del CO2 al fine di correggere un acidosi respiratoria, dar luogo ad un alcalosi respiratoria oppure per compensare un acidosi metabolica. Dal canto suo la risposta renale è responsabile dell escrezione degli acidi metabolici e delle variazioni compensatorie del HCO 3 plasmatico in presenza di alterazioni dell equilibrio acido-base respiratorio. La capacità dei polmoni di eliminare grandi quanità di anidride carbonica li abilita a compensare rapidamente. Per contro il rene è abituato a eliminare solo 100 meq di acido al giorno. Questa minore quantità corrisponde a una relativamente più bassa percentuale di compenso; un paziente può essere ventilato a una PCO 2 anormale per giorni prima che si raggiunga il tipico, parziale compenso. L'acidosi respiratoria pura (elevata PCO 2) implica una normale situazione metabolica e aumenta sia l'[hco 3- ] sia l'[h + ]. Le modificazioni degli [H + ] sono solo in parte dovute al tamponamento degli H +, soprattutto dall'emoglobina. Se, a questo livello di PCO 2, il rene compensa riducendo gli [H + ], allora gli [HCO 3- ] aumentano ulteriormente (cioè: l'acidosi respiratoria aumenta il livello di bicarbonato e il compenso metabolico lo aumenta ulteriormente). Similmente, l'acidosi metabolica pura implica una normale PCO 2; l'elevata concentrazione di [H + ] è associata a una proporzionale caduta degli [HCO 3- ]. In pratica il compenso respiratorio riduce prontamente la PCO 2, riducendo sia gli [H + ] che gli [HCO 3- ], (cioè: l'acidosi metabolica abbassa il livello di bicarbonati e il compenso respiratorio lo abbassa ulteriormente). In considerazione di questo effetto congiunto sulla concentrazione degli ioni bicarbonato, sembra logico evitare di usare il bicarbonato come misura sia delle anormalità metaboliche che respiratorie. Il corpo umano possiede quindi una grande capacità di tamponare le alterazioni dell equilibrio acido-base. I sistemi tampone nel sangue sono rappresentati dalle proteine e dal sistema tampone fosfato. Mentre quest ultimo non rappresenta, a causa delle concentrazioni troppo basse, un tampone importante, l emoglobina è un importante tampone ematico del CO2 grazie al suo elevato numero di residui di istidina per molecola. Poiché la CO2 è solubile nei lipidi ed attraversa rapidamente le membrane cellulari, le variazioni della pco2 inducono rapide variazioni di [H + ] nei fluidi corporei. A loro volta le variazioni della ventilazione alveolare sono inversamente correlate alle variazioni della pco2 arteriosa e direttamente proporzionali alla totale produzione corporea di CO2: 6
7 pco2 è proporzionale a V CO2 / V A dove pco2 = pressione parziale di anidride carbonica V CO2 = anidride carbonica prodotta dall organismo V A = ventilazione alveolare Le variazioni della pco2 arteriosa, invece, inducono variazioni del ph, così come difinito dall equazione di Henderson-Hasselbalch: ph = pka + log { [HCO3] / (0.03 x pco2) } Il sistema di controllo della regolazione respiratoria dell equilibrio acido-base è pertanto rappresentato: a) dalle modificazioni arteriose della pco2 che alterano il ph arterioso; b) dai chemorecettori centrali e periferici che rispondono alle variazioni della pco2 arteriosa; c) dalla risposta dei centri respiratori bulbari; d) dai muscoli respiratori che, aumentando la ventilazione/minuto, riducono la pco2 arteriosa attraverso un meccanismo a feedback negativo che tende a ripristinare i valori iniziali di pco2. Mentre i polmoni sono deputati all eliminazione del CO2, i reni si dedicano all escrezione degli acidi metabolici e al riassorbimento del bicarbonato che coinvolgono l escrezione di [H + ]. Solo l escrezione degli acidi metabolici è però causa di secrezione di [H + ] dall organismo. Al ridursi del ph nelle urine, i reni aumentano la secrezione di NH 4, ancora di più se presente un acidosi. L aumentata secrezione di NH 4 ha come obiettivo quello di aumentare il ph extracellulare e ricondurlo alla normalità. A sua volta l NH 4 presente nella circolazione ematica è metabolizzato a livello epatico in urea con produzione di un idrogenione per molecola di NH 4. Il corpo umano possiede pertanto due alternative per rimuovere l NH 4: a) sintesi di urea a livello epatico; b) escrezione di NH 4 a livello renale. La completa ossidazione di grassi e carboidrati a livello epatico produce CO2 ma non acidi metabolici e, poiché il fegato consuma il 20% di ossigeno del corpo umano, tale metabolismo epatico rappresenta il 20% della produzione totale di CO2. La CO2, reagendo con i globuli rossi, conduce alla produzione di H + e HCO 3-. Fig. 2 7
8 CO2 PLASMA Anidrasi carbonica CO2 + H2O H2CO3 H + HCO3 - H + + Hb HHb HCO 3 - Cl - GLOBULO ROSSO Fig. 2 : Trasporto di CO2 nel sangue ed effetto tampone dell emoglobina. La CO2 penetra nel globulo rosso per combinarsi con l acqua e formare acido carbonico. La reazione è catalizzata dall anidrasi carbonica. L acido carbonico di dissocia in bicarbonati e idrogenioni. Gli idrogenioni si legano all emoglobina ridotta per formare HHb. Gli HCO3 - generati da tale processo, si riversano nel plasma scambiandosi con gli ioni Cl -. Nei polmoni si osserva il fenomeno opposto: gli idrogenioni si ricombinano con i bicarbonati per formare CO2 che, a sua volta, passa negli alveoli, mentre l emoglobina ridotta è riformata per ritornare nei tessuti. Il fegato, inoltre, svolge un ruolo estremamente importante nella regolazione dell equilibrio acido-base, considerato che i più comuni disturbi nelle malattie croniche del fegato sono rappresentati dall alcalosi respiratoria e metabolica. Oltre a quanto detto, infatti, il fegato rappresenta il maggior produttore di proteine plasmatiche e, in particolare, la sintesi di albumina rappresenta il 50% circa della sintesi di proteine di provenienza epatica. L albumina svolge un ruolo importante nell equilibrio acido-base in quanto rappresenta un sistema tampone sia per l anidride carbonica sia per gli acidi metabolici. Il fegato può essere inoltre un grande produttore o consumatore di idrogenioni. Infatti: a) produce CO2; b) metabolizza acidi organici: lattato, chetoni e aminoacidi; c) metabolizza l NH 4; d) produce proteine plasmatiche. Acidosi Respiratoria. L'acidosi Respiratoria è una condizione caratterizzata da una elevata pco 2 ed è denominata, inizialmente, come acidosi respiratoria acuta. In seguito a compenso renale che compare dopo qualche giorno e alla normalizzazione del ph, la condizione prende il nome di acidosi respiratoria cronica. L aumento della pco2 è imputabile a: a) riduzione della ventilazione alveolare; b) aumento del CO2 inspirato; c) aumentata produzione di CO2 da parte dell organismo. Nella tab 2 sono riportate le cause di acidosi respiratoria. A sua volta l ipercapnia è causa di: a) aumento della ventilazione per stimolazione 8
9 dei chemorecettori centrali e periferici; b) vasodilatazione cerebrale e aumento della pressione intracranica associati a dispnea, confusione mentale, cefalea e, nei casi gravi, a coma; c) tachicardia, vasocostrizione periferica e sudorazione, quale conseguenza della stimolazione del sistema nervoso simpatico, associati ad aritmie soprattutto se presente grave ipossiemia ; d) depressione centrale, ad elevati livelli di CO2. Nel caso di ipercapnia acuta il tamponamento avviene prevalentemente a livello intracellulare. Nel caso di ipercapnia cronica, al tamponamento intracellulare si aggiunge la ritenzione renale di bicarbonati. Le proteine intracellulari, emoglobina inclusa, e i fosfati, rappresentano i tamponi più importanti per la CO2, in quanto assorbono l H + prodotto dalla dissociazione di H 2CO 3. Dal canto suo la risposta renale all aumento della CO2 impiega alcuni giorni per raggiungere il suo massimo livello. La risposta renale è la conseguenza dell aumento della pco2 intracellulare a livello delle cellule tubulari prossimali che provoca aumento della secrezione di H + nel lume tubulare. A seguito di ciò: a) aumenta la concentrazione plasmatica di HCO 3 e, di conseguenza, la quantità di bicarbonato filtrato a livello renale; b) aumenta il riassorbimento del Na che viene scambiato con l H + e, in minima parte, con il Cl -, con conseguente riduzione del Cl - plasmatico ; c) aumenta la produzione di NH 3 al fine di tamponare l H + nel lume tubulare, con conseguente aumento dell escrezione urinaria di NH 4Cl. Il trattamento dell acidosi respiratoria è rappresentato dal ristabilimento di un adeguata ventilazione alveolare attraverso la correzione della causa determinante e dall eventuale ricorso alla ventilazione non invasiva o invasiva. In alcuni casi, soprattutto nei pazienti con ritenzione cronica di CO 2, ad esempio da BPCO, è preferibile non riportare il paziente a valori di CO 2 di 40 mmhg tramite ventilazione meccanica (ipercapnia permissiva). In molti casi, infatti, un rapido ritorno a valori normali di pco 2 può associarsi a grave ipotensione arteriosa da riduzione della stimolazione simpatica indotta dagli elevati valori di pco 2. La riduzione del filtrato glomerulare e la deplezione di cloro, potassio e liquido extracellulare che si osserva in corso di acidosi respiratoria cronica rappresentato tutti fattori in grado di provocare la persistenza di elevati livelli di bicarbonati che, associata alla compromissione renale relativa al mantenimento di un adeguato livello di bicarbonati, è causa di alcalosi post-ipercapnica. In definitiva, una insufficiente ventilazione alveolare rappresenta il fattore principale che favorisce lo sviluppo di un acidosi respiratoria. Una ventilazione inadeguata, inoltre, è causa di ipossiemia. La somministrazione di ossigeno supplementare con maschera di Venturi può risultare utile per correggere o prevenire l ipossiemia. 9
10 Tab 2 Cause di Acidosi Respiratoria Da riduzione della ventilazione alveolare - Depressione farmacologica ( anestetici, oppiacei, sedativi) del centro del respiro - Traumi, tumori o emorragie encefaliche - Obesità ( ipoventilazione ad esempio Sindrome di Pickwick) - Lesioni al midollo spinale - Arresto cardiaco con ipossia cerebrale - Tetano - Poliomielite Malattie dei Nervi e dei muscoli - Malattie neuromuscolari ( ad esempio sclerosi laterale amiotrofica) - Miastenia grave - Farmaci miorilassanti - Organofosfati Malattie del polmone, del Torace e delle vie aeree - Broncopneumopatia cronica ostruttiva - Broncospasmo - Asma - Traumi del torace - Pneumotorace - Emotorace - Edema polmonare - Paralisi diaframmatica - Malattie restrittive - Sindrome da distress respiratorio dell adulto 10
11 - Laringospasmo - Ostruzione delle vie aeree superiori Fattori esterni - Ventilazione meccanica inadeguata - Aggiunta di CO2 al gas inspirato - Insufflazione di CO2 in cavità corporee a seguito di interventi chirurgici ( ad esempio laparoscopia) Acidi Metabolici e Acidosi Metabolica. L'espressione "acidi metabolici" indica tutti gli acidi dell'organismo con l esclusione dell'anidride carbonica. Gli acidi Metabolici non sono respirabili; essi devono essere neutralizzati, metabolizzati o escreti per via renale. L'acidosi Metabolica è una condizione caratterizzata da un aumento degli acidi metabolici e da un ph che è più acido in rapporto alla PCO 2 appropriata per quel punto specifico di ph. Questa definizione enfatizza l'importanza della componente respiratoria sul ph globale. Il ph è sempre un prodotto delle due componenti, respiratoria e metabolica, e la componente metabolica è valutata, calcolata e considerata tenendo conto dell'effetto della PCO 2. Per esempio ogni modifica del ph non spiegato dalla pco 2 indica una anormalità metabolica. L acidosi metabolica può rappresentare la conseguenza di un aumento di acidi forti, ad esempio chetoacidosi o infusione di NH 4Cl, oppure di una perdita di basi, come nel caso di diarrea o di acidosi tubulare renale. L acidosi metabolica tende a persistere fin quando non si risolve il problema che l ha determinata. Ad esempio, nel caso della chetoacidosi diabetica conseguente al deficit relativo o assoluto di insulina, il ph tende a ridursi fin quando il promblema non si risolve attraverso una rigenerazione di bicarbonati. Il compenso respiratorio all acidosi metabolica si realizza attraverso un iperventilazione compensatoria ( respiro di Kussmaul) e uno spostamento verso destra della curva di dissociazione dell emoglobina. L iperventilazione compensatoria si verifica in quanto l acidosi metabolica è rilevata sia a livello dei chemorecettori periferici sia a livello dei chemorecettori centrali, con la conseguenza di una stimolazione del centro del respiro. La riduzione della pco 2, conseguente all iperventilazione, è causa a sua volta di inibizione della risposta ventilatoria. Gli effetti a livello cardiovascolare dell acidosi metabolica sono rappresentati da: depressione della contrattilità miocardica; tachicardia; vasocostrizione; vasodilatazione arteriolare periferica; venocostrizione periferica; vasocostrizione delle arterie polmonari. La perdita cellulare di K +, che si osserva in corso di acidosi metabolica, è a sua volta causa di iperkaliemia che si traduce in una depressione della conduzione atrioventricolare e che può aggravarsi in seguito alla somministrazione di alcuni farmaci quali i diuretici (spironolattone) e gli antipertensivi (ACE inibitori), fino ad indurre la morte. Un paziente con grave acidosi metabolica rappresenta un serio problema medico in quanto il decesso può verificarsi anche quando è stata rispettata una gestione terapeutica ottimale. 11
12 La terapia dell acidosi metabolica è condizionata dalla malattia che l ha deteminata. Ad esempio, nel caso della chetoacidosi diabetica è necessario somministratre fluidi, insulina ed elettroliti ma non bicarbonati mentre, nel caso di insufficienza renale, è necessario somministrare bicarbonati e sottoporre il paziente a dialisi. In molti casi la somministrazione di bicarbonati, però, può non essere necessaria né utile, rivelandosi talora dannosa per il paziente. L obiettivo principale della terapia con bicarbonati è quello di neutralizzare l acidemia extracellulare, trattare l iperkaliemia nelle emergenze, favorire la diuresi alcalina (per favorire, ad esempio, l escrezione di salicilati nei casi di sovradosaggio o intossicazione). La somministrazione di bicarbonati può però essere, a sua volta, causa di: ipercapnia, ipokaliemia, ipernatriemia, sovraccarico volumetrico, alcalosi da effetto rebound, spostamento a sinistra della curva di dissociazione dell emoglobina, ecc. Oltre all emogasanalisi, una corretta valutazione dell acidosi metabolica è fornita attraverso l analisi di: urine per glucosio e chetoni, elettroliti e glicemia, urea, creatinina, lattati. Ioni Bicarbonato. Nelle determinazioni acido-base la concentrazione (in milliequivalenti/litro) di ioni bicarbonato (HCO 3- ) viene calcolata sulla base di PCO 2 e ph. Poichè essa è influenzata da entrambe le componenti respiratoria e metabolica, non si può considerare un parametro di misurazione ideale per entrambe le componenti. Per bicarbonati standard si intende una calcolata concentrazione di bicarbonati del campione esaminato, corretta ad una pco2 di 40 mmhg. Valori anormali sono imputabili alla componente metabolica dei disturbi dell equilibrio acido-base. Un valore elevato della concentrazione di bicarbonati standard indica un alcalosi metabolica, mentre un basso valore è indice di acidosi metabolica. Base Excess (BE) o Eccesso di Basi. Costituisce una misurazione del livello di acido metabolico e normalmente è zero. Le basi del sangue (basi totali) sono circa 48 mmol/l in rapporto alla concentrazione di emoglobina. Le modificazioni delle basi ematiche sono dette eccesso o deficit di basi. L'eccesso di basi può essere utilizzato per calcolare la quantità di trattamento (neutralizzazione) richiesta per contrastare l'acidosi (o l'alcalosi) metabolica. In altri termini, per eccesso di basi si definisce la quantità di acido ( in mmol) richiesta per riportare un litro di sangue al suo normale ph ad una pco2 di 40 mmhg. L eccesso di basi riflette esclusivamente la componente metabolica dei disturbi dell equilibrio acido-base. Infatti, se è presente un alcalosi metabolica sarà necessario aggiungere acidi per far ritornare il ph ematico nella norma: in tal caso il valore di eccesso di basi sarà positivo. Qualora, invece, è presente un acidosi metabolica, sarà necessario sottrarre acidi per far ritornare il ph ai suoi valori di normalità. In tal caso il valore di eccesso di basi sarà negativo. Alcalosi respiratoria. L alcalosi respiratoria è una condizione caratterizzata da una riduzione della pco2 ( < 40 mmhg ) e da un aumento del ph arterioso in assenza di compensazione e di altri disturbi dell equilibrio acido-base. L alcalosi respiratoria è sempre determinata da un aumento della ventilazione alveolare. Tuttavia un ipocapnia, cioè una riduzione della pco2, pur indicando un aumento della ventilazione alveolare può rappresentare una risposta compensatoria ad un acidosi metabolica. In tal caso, non 12
13 rappresentando un processo primario, non si può fare diagnosi di alcalosi respiratoria. Solo la riduzione della pco2 che si verifica come processo primario può pertanto essere definita come alcalosi respiratoria. Cause comuni di alcalosi respiratoria sono rappresentate da: embolia polmonare, asma, polmonite, edema polmonare, accidenti cerebrovascolari, iperventilazione da ansia o dolori intensi oppure stress, intossicazione da salicilati ( stimolazione del centro respiratorio risultante in un disturbo misto: acidosi metabolica associata ad alcalosi respiratoria ) o analettici. Alcalosi respiratoria si osserva anche in seguito all aumento del progesterone in corso di gravidanza che tende a stimolare il centro del respiro. Tale effetto è compensato dall escrezione renale di bicarbonati. Altre cause di alcalosi respiratoria sono rappresentate dalle malattie epatiche croniche, dalla stimolazione respiratoria da parte dei chemorecettori periferici quale conseguenza dell ipossiemia o, infine, da una eccessiva ventilazione meccanica. Gli effetti metabolici dell ipocapnia sono invece rappresentati da: inibizione del drive respiratoria attraverso i chemorecettori periferici e centrali; riduzione della contrattilità del miocardio e aritmie cardiache; irritabilità neuromuscolare: tetania, spasmi, parestesie, molte volte risolvibili facendo respirare il paziente, ad intermittenza al fine di evitare l ipossiemia, in un sacchetto di carta; lieve riduzione del K + plasmatico; spostamento a sinistra della curva di dissociazione dell emoglobina; riduzione del flusso ematico cerebrale ( 4% per mmhg di riduzione di pco 2). In corso di alcalosi respiratoria acuta si osserva una riduzione degli HCO3 - : 2 mmol/l ogni 10 mmhg di riduzione della pco 2. Livelli di bicarbonati inferiori a 18 mmol/l indicano una coesistente acidosi metabolica. Nell alcalosi respiratoria cronica la compensazione renale avviene nel giro di 2-3 giorni attraverso una riduzione di 5 mmol/l di HCO3 - per ogni 10 mmhg di riduzione della pco 2. In tal caso il limite della compensazione è mmol/l di HCO3 -. La riduzione della pco 2 tende ad inibire la ventilazione e ad aggravare l ipossiemia. L ipossiemia, a sua volta, rappresenta una causa importante di iperventilazione e conseguente alcalosi respiratoria. Per tale motivo, nel caso di alcalosi respiratoria, la somministrazione di ossigeno rappresenta un momento terapeutico prioritario. Alcalosi metabolica. Condizione primitiva nella quale si osserva un aumento dei bicarbonati plasmatici [HCO 3- ]. Pertanto l aumento dei bicarbonati, conseguente ad un acidosi respiratoria cronica, deve essere considerato come una risposta di compenso e mai come un alcalosi metabolica secondaria. Le cause più comuni di alcalosi metabolica sono quelle che provocano una perdita di Cl -, quali il vomito, l uso di diuretici e le condizioni post-ipercapniche. Altre cause sono rappresentate da: ipovolemia, somminisrazione e.v. di NaHCO3, grave ipoalbuminemia, uso indiscriminato di lassativi, massive trasfusioni di sangue e condizioni 13
14 che causano perdita di potassio. In quest ultimo caso si osserva un aumento del riassorbimento di bicarbonati a livello dei tubuli renali distali e prossimali nonché una riduzione della secrezione di aldosterone da parte del surrene. Cause di deplezione di K + sono rappresentate da: sindrome di Cushing, iperaldosteronismo, alcuni farmaci, sindrome di Barterr ed eccessivo uso di liquirizia. La perdita di K + è collegata ad uno shift di H + in cambio di K +. Gli effetti metabolici dell alcalosi metabolica sono legati alle cause che l hanno provocata: la deplezione di Cl - e K + e l ipovolemia. Gli effetti più frequenti sono rappresentati da: presenza di aritmie, ridotta contrattilità del miocardio, confusione mentale, eccitabilità neuromuscolare, spostamento a sinistra della curva di dissociazione dell ossigeno. La presenza di ipossiemia, conseguente all ipoventilazione di compenso in risposta all alcalosi respiratoria, alla presenza di microatelectasie conseguenti all ipoventilazione e all aumento del mismatch ventilo-perfusivo ( l alcalosi inibisce la vasocostrizione polmonare ipossica), impone la somministrazione di ossigeno. Ciò anche in considerazione del fatto che l aumento dell output cardiaco, quale meccanismo di compenso all ipossiemia, è vanificato dalla presenza di ipovolemia e dalla riduzione della contrattilità miocardica. La correzione dell alcalosi metabolica richiede la somministrazione di soluzioni isotoniche ( soluzioni saline) e soluzioni isosmotiche per via e.v. sia al fine di espandere il volume in caso di ipovolemia, sia, attraverso l utilizzazione di KCl, per compensare il deficit di K +. La correzione dell alcalosi comporterà una deviazione verso destra della curva di dissociazione dell ossigeno, favorendo l ossigenazione periferica dei tessuti. - Nella Tab. 3 sono riassunte le variazioni del ph, della PCO2, di HCO 3 e BE nei disordini dell equilibrio acidobase, mentre nelle Tab.4 e 5 sono riportate le interpretazioni dei disturbi dell equilibrio acido-base- 14
15 Tab. 3 : EMOGASANALISI ED EQUILIBRIO ACIDO-BASE VALORI NORMALI E VARIAZIONI NEI DISORDINI DELL EQUILIBRIO ACIDO-BASE EMOGASANALISI VALORI NORMALI parametri Unità di misura arteriosa venosa capillare ph 7,38-7,42 7,36-7,40 7,38-7,42 po2 mmhg >80 pco2 mmhg SaO2 % HCO3- mmol/l BE mmol/l -2 / +2-2 / +2-2 / +2 EQUILIBRIO ACIDO-BASE su sangue arterioso ph PCO2 HCO3- BE ACIDOSI RESPIRATORIA SCOMPENSATA (ACUTA) N N SUBACUTA COMPENSATA (CRONICA) N 15
16 ALCALOSI RESPIRATORIA SCOMPENSATA (ACUTA) N N SUBACUTA COMPENSATA (CRONICA) N ACIDOSI METABOLICA SCOMPENSATA (ACUTA) N SUBACUTA COMPENSATA (CRONICA) N ALCALOSI METABOLICA SCOMPENSATA (ACUTA) N SUBACUTA COMPENSATA (CRONICA) N 16
17 ph < 7.35 BE Positivo: > Acidosi respiratoria primitiva con compenso acidemia PCO2 < 34 mmhg PCO2 > 45 mmhg BE Nella norma: -2.4 / Acidosi respiratoria primitiva BE Negativo: < BE Negativo: < Acidosi respiratoria e metabolica PCO2 nella norma: mmhg Acidosi metabolica con compenso renale BE Negativo: < Acidosi metabolica promitiva Tab. 4 : Interpretazioni dei disturbi dell equilibrio acido-base: acidemia. BE = eccesso di basi. 17
18 ph > 7.45 alcalemia PCO2 < 34 mmhg PCO2 > 45 mmhg BE Negativo: < BE Nella norma: -2.4 / BE Positivo: > BE Positivo: > Alcalosi metabolica primitiva con PCO2 nella norma: mmhg Alcalosi respiratoria Alcalosi respiratoria Alcalosi metabolica BE Positivo: > Alcalosi metabolica primitiva Tab. 5 : Interpretazioni dei disturbi dell equilibrio acido-base: alcalemia. BE = eccesso di basi. 18
19 Letture consigliate Kellum JA. Determinants of plasma Acid-base balance.crit Care Clin Apr;21(2): Schlichtig R, Grogono AW, Severinghaus JW. Human PaCO 2 and standard base excess compensation for acid base imbalance. Crit Care Med 1998;26: Stewart PA. Modern quantitative acid base chemistry. Can J Physiol Pharmacol 1983;61: Albert M, Dell R, Winters R. Quantitative displacement of acid base equilibrium in metabolic acidosis. Ann Intern Med 1967;66: Kellum JA. Determinants of blood ph in health and disease. Crit Care. 2000; 4(1): Astrup P, Jorgensen K, Siggaard-Andersen O, et al. Acid base metabolism: new approach. Lancet 1960;i: Grogono AW, Byles PH, Hawke W. An in vivo representation of acid base balance. Lancet 1976;i: Brackett NC, Cohen JJ, Schwartz WB. Carbon dioxide titration curve of normal man. N Engl J Med 1965;272:6 12 Schlichtig, R.Acid base balance (quantitation). Textbook of Critical Care. Edited by Grenvik A, Shoemaker PK, Ayers S, Holbrook PR.Philadelphia, PA: WB Saunders Co, p
20 Magder, S.Pathophysiology of metabolic acid base disturbances in patients with critical illness. Critical Care Nephrology. Edited by Ronco C, Bellomo R. Dordrecht, The Netherlands: Kluwer Academic Publishers, p Gilfix BM, Bique M, Magder S. A physical chemical approach to the analysis of acid base balance in the clinical setting. J Crit Care 1993;8: Kellum, JA.Recent advances in acid base physiology applied to critical care. Yearbook of Intensive Care and Emergency Medicine. Edited by Vincent JL. Heidelberg: Springer-Verlag, p Anderson WG. Gaps in the Data - Anions and Osmoles. Intensive Care World. 1988; 5: Badrick T & Hickman PE. The Anion Gap: A Reappraisal. Am J Clin Path 1992; 98: Batlle DC, Hizon M, Cohen E, Gutterman C, Gupta R. The use of the urinary anion gap in the diagnosis of hyperchloremic metabolic acidosis. N Engl J Med Mar 10;318(10):
Rene ed equilibrio acido-base
 Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Interpretazione dell emogasanalisi
 Interpretazione dell emogasanalisi Guglielmo IMBRIACO Gaetano TAMMARO Rianimazione Terapia Intensiva Ospedale MAGGIORE - Bologna A cosa serve l emogasanalisi? Esame rapido Valutare la ventilazione Valutare
Interpretazione dell emogasanalisi Guglielmo IMBRIACO Gaetano TAMMARO Rianimazione Terapia Intensiva Ospedale MAGGIORE - Bologna A cosa serve l emogasanalisi? Esame rapido Valutare la ventilazione Valutare
Rene ed equilibrio acido base. La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica. Principali funzioni renali
 Rene ed equilibrio acido base La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica Savi Umberto Scuola di Specializzazione in Nefrologia S.C. di Nefrologia e Dialisi Cattinara
Rene ed equilibrio acido base La fisiologia e l'acidosi metabolica in corso di insufficienza renale cronica Savi Umberto Scuola di Specializzazione in Nefrologia S.C. di Nefrologia e Dialisi Cattinara
Gli scambi gassosi LA MISURA DELLA FUNZIONE RESPIRATORIA. OLTRE LA SPIROMETRIA Torino, 5 ottobre 2013
 LA MISURA DELLA FUNZIONE RESPIRATORIA OLTRE LA SPIROMETRIA Torino, 5 ottobre 2013 Gli scambi gassosi Claudio Norbiato AO Ordine Mauriziano SC Medicina Interna Emogasanalisi L emogasanalisi e l analisi
LA MISURA DELLA FUNZIONE RESPIRATORIA OLTRE LA SPIROMETRIA Torino, 5 ottobre 2013 Gli scambi gassosi Claudio Norbiato AO Ordine Mauriziano SC Medicina Interna Emogasanalisi L emogasanalisi e l analisi
ph = log 1/[H + ] = log [H + ]
![ph = log 1/[H + ] = log [H + ] ph = log 1/[H + ] = log [H + ]](/thumbs/49/24977942.jpg) ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
Alterazioni equilibrio acidobase
 Alterazioni equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Acidosi: rapporto HCO 3 /CO 2 ph. Se diminuzione dipende da: HCO 3 acidosi metabolica (nonrespiratoria)
Alterazioni equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Acidosi: rapporto HCO 3 /CO 2 ph. Se diminuzione dipende da: HCO 3 acidosi metabolica (nonrespiratoria)
La eliminazione dei protoni nelle urine permette il ripristino di bicarbonato nel circolo sistemico.
 ESCREZIONE URINARIA DI ACIDI : 1-1,5 meq/l Es. produzione endogena di ac. solforico o cloridrico, formazione di sodio solfato o cloruro, eliminazione urinaria di ammonio legato ai sali. La eliminazione
ESCREZIONE URINARIA DI ACIDI : 1-1,5 meq/l Es. produzione endogena di ac. solforico o cloridrico, formazione di sodio solfato o cloruro, eliminazione urinaria di ammonio legato ai sali. La eliminazione
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE
 FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
Trasporto di O 2 nel sangue
 Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Lo Shock CHE COSA È? Lo Shock QUANDO INSORGE? Lo Shock. Definizione. Lo Shock. Classificazione
 1 CHE COSA È? evento patologico acuto che causa una compromissione di organi vitali attraverso una riduzione della perfusione periferica 2 QUANDO INSORGE? in corso di processi patologici acuti (gravi traumi,
1 CHE COSA È? evento patologico acuto che causa una compromissione di organi vitali attraverso una riduzione della perfusione periferica 2 QUANDO INSORGE? in corso di processi patologici acuti (gravi traumi,
L EMOGASANALISI. P. Scavalli, M. Vitto, S. Mosillo
 L EMOGASANALISI P. Scavalli, M. Vitto, S. Mosillo EMOGASANALISI Consente la misurazione immediata dei due gas più importanti del sangue e di un terzo parametro fondamentale per la valutazione dell omeostasi
L EMOGASANALISI P. Scavalli, M. Vitto, S. Mosillo EMOGASANALISI Consente la misurazione immediata dei due gas più importanti del sangue e di un terzo parametro fondamentale per la valutazione dell omeostasi
EMOGASANALISI ARTERIOSA
 EMOGASANALISI ARTERIOSA Prelievo arterioso Il prelievo arterioso può essere eseguito nelle arterie RADIALE, BRACHIALE o FEMORALE. Attualmente viene eseguito più frequentemente il prelievo dall arteria
EMOGASANALISI ARTERIOSA Prelievo arterioso Il prelievo arterioso può essere eseguito nelle arterie RADIALE, BRACHIALE o FEMORALE. Attualmente viene eseguito più frequentemente il prelievo dall arteria
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da
 Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Le variazioni di ph nei liquidi organici devono mantenute entro limiti molto ristretti (mammiferi tra 6.8 7.8). La stabilità del ph è insidiata da acidi forti (solforico, cloridrico e fosforico) prodotti
Equilibrio acido-base
 Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
Equilibrio acidobase ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6
DEFINIZIONE ANALISI DELLE PRESSIONI PARZIALI DEI GAS E DEL EQUILIBRIO ACIDO- BASE NEL SANGUE ARTERIOSO
 DEFINIZIONE ANALISI DELLE PRESSIONI PARZIALI DEI GAS E DEL EQUILIBRIO ACIDO- BASE NEL SANGUE ARTERIOSO INDICAZIONI ALL EGA Dispnea (cardiaca, respiratoria, metabolica) Dolore toracico (embolie polmonari
DEFINIZIONE ANALISI DELLE PRESSIONI PARZIALI DEI GAS E DEL EQUILIBRIO ACIDO- BASE NEL SANGUE ARTERIOSO INDICAZIONI ALL EGA Dispnea (cardiaca, respiratoria, metabolica) Dolore toracico (embolie polmonari
Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE
 Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE Molti sali reagiscono con l acqua alterando il suo rapporto molare tra [H] e [OH] -
Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE Molti sali reagiscono con l acqua alterando il suo rapporto molare tra [H] e [OH] -
Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali:
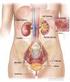 Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali: 1) Secerne Idrogenioni; 1a) Riassorbe il Bicarbonato Filtrato; 1b) Produce Nuovo Bicarbonato. 4320 meq/die
Il Rene Regola la Concentrazione di Idrogenioni nel LEC attraverso Tre Meccanismi Fondamentali: 1) Secerne Idrogenioni; 1a) Riassorbe il Bicarbonato Filtrato; 1b) Produce Nuovo Bicarbonato. 4320 meq/die
1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di
 Unità 19 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di soluzioni acide e
Unità 19 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di soluzioni acide e
EQUILIBRIO ACIDO - BASE
 EQUILIBRIO ACIDO - BASE da appunti del dott. Claudio Italiano, internista ospedaliero Che significa? Vuol dire che l organismo ha un suo equilibrio, detto omeòstasi, cioè il sangue deve necessariamente
EQUILIBRIO ACIDO - BASE da appunti del dott. Claudio Italiano, internista ospedaliero Che significa? Vuol dire che l organismo ha un suo equilibrio, detto omeòstasi, cioè il sangue deve necessariamente
1. Controllo dell equilibrio acido-base. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 1. Controllo dell equilibrio acido-base Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Misura dell acidità di una soluzione Definizione di acido: qualsiasi sostanza chimica che
1. Controllo dell equilibrio acido-base Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Misura dell acidità di una soluzione Definizione di acido: qualsiasi sostanza chimica che
Fisiologia Renale 5. Equilibrio acido-base: Fisiologia e fisiopatologia
 Fisiologia Renale 5. Equilibrio acidobase: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Produzione e bilancio
Fisiologia Renale 5. Equilibrio acidobase: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Produzione e bilancio
Misure di ph e titolazione acidobase con metodo potenziometrico
 - Laboratorio di Chimica 1 Misure di ph e titolazione acidobase con metodo potenziometrico PAS A.A. 2013-14 Obiettivi 2 Uso di un ph-metro per la misura del ph Titolazione acido-base: costruzione della
- Laboratorio di Chimica 1 Misure di ph e titolazione acidobase con metodo potenziometrico PAS A.A. 2013-14 Obiettivi 2 Uso di un ph-metro per la misura del ph Titolazione acido-base: costruzione della
EMOGASANALISI ARTERIOSA
 EMOGASANALISI ARTERIOSA L EGA rappresenta l esame principe dell urgenza, poiché è un ottima finestra su: VENTILAZIONE ALVEOLARE SCAMBIO GASSOSO PH ed EQUILIBRIO ACIDO-BASE In particolare l equilibrio acido-base
EMOGASANALISI ARTERIOSA L EGA rappresenta l esame principe dell urgenza, poiché è un ottima finestra su: VENTILAZIONE ALVEOLARE SCAMBIO GASSOSO PH ed EQUILIBRIO ACIDO-BASE In particolare l equilibrio acido-base
ph = log 1/[H+] = - log [H+]
![ph = log 1/[H+] = - log [H+] ph = log 1/[H+] = - log [H+]](/thumbs/34/16948015.jpg) ph = log 1/[H+] = log [H+] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = inizio 7,36 max 6.8) ph superiori = alcalosi (limite ph inizio 7,44 max 7.8) ph intracellulare
ph = log 1/[H+] = log [H+] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = inizio 7,36 max 6.8) ph superiori = alcalosi (limite ph inizio 7,44 max 7.8) ph intracellulare
FORZA DI ACIDI E BASI HA + :B HB + + A
 FORZA DI ACIDI E BASI n La forza di un acido è la misura della tendenza di una sostanza a cedere un protone. n La forza di una base è una misura dell'affinità di un composto ad accettare un protone. n
FORZA DI ACIDI E BASI n La forza di un acido è la misura della tendenza di una sostanza a cedere un protone. n La forza di una base è una misura dell'affinità di un composto ad accettare un protone. n
Broncopneumopatia Cronica Ostruttiva e Malattia Cardiovascolare
 V Giornata Mondiale BPCO 15 novembre 2006 Broncopneumopatia Cronica Ostruttiva Prof. Massimo Santini M.D., FESC, FACC Dipartimento Cardiovascolare Ospedale S. Filippo Neri Roma Coinvolgimento Cardiaco
V Giornata Mondiale BPCO 15 novembre 2006 Broncopneumopatia Cronica Ostruttiva Prof. Massimo Santini M.D., FESC, FACC Dipartimento Cardiovascolare Ospedale S. Filippo Neri Roma Coinvolgimento Cardiaco
Insufficienza Respiratoria
 Insufficienza Respiratoria Prof. Tommaso Todisco Specialista in Malattie dell Apparato Respiratorio Cardiologia e Reumatologia Medicina Interna INSUFFICIENZA RESPIRATORIA: DEFINIZIONE Ridotta efficacia
Insufficienza Respiratoria Prof. Tommaso Todisco Specialista in Malattie dell Apparato Respiratorio Cardiologia e Reumatologia Medicina Interna INSUFFICIENZA RESPIRATORIA: DEFINIZIONE Ridotta efficacia
CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq) + H 2 O (l)
 2. Titolazione di un acido debole con una base forte : CH 3 COOH (aq) + NaOH (aq) (a cura di Giuliano Moretti) La titolazione è descritta dalla seguente reazione CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq)
2. Titolazione di un acido debole con una base forte : CH 3 COOH (aq) + NaOH (aq) (a cura di Giuliano Moretti) La titolazione è descritta dalla seguente reazione CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq)
Trasporto dei gas. Pressioni Volumi
 Trasporto dei gas Pressioni Volumi Il 97% dell O 2 trasportato nel plasma si trova chimicamente legato all Hb nei globuli rossi, solo lo 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O
Trasporto dei gas Pressioni Volumi Il 97% dell O 2 trasportato nel plasma si trova chimicamente legato all Hb nei globuli rossi, solo lo 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O
Le Quattro Funzioni principali di eliminazione nel rene: I -Ultrafiltrazione (capsula di Bowman) II -Diffusione (riassorbimento) III -Secrezione per:
 Escrezione I Farmaci previa o meno biotrasformazione (metabolismo) possono essere escreti dal rene (urine), dal fegato e intestino (bile e feci), dal polmone (aria espirata), ma anche col latte materno,
Escrezione I Farmaci previa o meno biotrasformazione (metabolismo) possono essere escreti dal rene (urine), dal fegato e intestino (bile e feci), dal polmone (aria espirata), ma anche col latte materno,
Fisiologia della respirazione 12.Controllo della Respirazione-Controllo chimico e risposte funzionali
 Fisiologia della respirazione 12.Controllo della Respirazione-Controllo chimico e risposte funzionali Carlo Capelli Fisiologia Facoltà di Scienze Motorie-Università di Verona Obiettivi Chemocettori centrali
Fisiologia della respirazione 12.Controllo della Respirazione-Controllo chimico e risposte funzionali Carlo Capelli Fisiologia Facoltà di Scienze Motorie-Università di Verona Obiettivi Chemocettori centrali
Osmometria ed Emolisi
 Osmometria ed Emolisi 1 ADE: MISURA DELLA RESISTENZA OSMOTICA DEI GLOBULI ROSSI (2/12/08). Il globulo rosso è una piccola cellula del sangue deputata al trasporto dell'ossigeno e priva di nucleo e di organelli.
Osmometria ed Emolisi 1 ADE: MISURA DELLA RESISTENZA OSMOTICA DEI GLOBULI ROSSI (2/12/08). Il globulo rosso è una piccola cellula del sangue deputata al trasporto dell'ossigeno e priva di nucleo e di organelli.
FISIOLOGIA CdL in Medicina e Chirurgia. Regolazione del ph. Dott.ssa Michela Anna Pia Ciliberti
 FISIOLOGIA CdL in Medicina e Chirurgia Regolazione del ph Dott.ssa Michela Anna Pia Ciliberti FUNZIONI OMEOSTATICHE INTEGRATE regolazione della temperatura corporea; controllo del ph dell organismo; regolazione
FISIOLOGIA CdL in Medicina e Chirurgia Regolazione del ph Dott.ssa Michela Anna Pia Ciliberti FUNZIONI OMEOSTATICHE INTEGRATE regolazione della temperatura corporea; controllo del ph dell organismo; regolazione
Fisiologia Renale 4. Equilibrio acido-base: Fisiologia e fisiopatologia
 Fisiologia Renale 4. Equilibrio acido-base: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Tamponi fisiologici
Fisiologia Renale 4. Equilibrio acido-base: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Tamponi fisiologici
Il Potassio è il principale catione intracellulare (K+) Si verifica per il Potassio la situazione inversa a quella del Sodio.
 POTASSIO Il Potassio è il principale catione intracellulare (K+) I suoi sali sono molto solubili in acqua. Si verifica per il Potassio la situazione inversa a quella del Sodio. Il mantenimento del gradiente
POTASSIO Il Potassio è il principale catione intracellulare (K+) I suoi sali sono molto solubili in acqua. Si verifica per il Potassio la situazione inversa a quella del Sodio. Il mantenimento del gradiente
Dr. Mentasti Riccardo
 APPARATO RESPIRATORIO Anatomia, fisiologia, patologia Dr. Mentasti Riccardo Obiettivi Apprendere concetti di anatomia e fisiologia dell apparato respiratorio Principi di trattamento della difficoltà respiratoria
APPARATO RESPIRATORIO Anatomia, fisiologia, patologia Dr. Mentasti Riccardo Obiettivi Apprendere concetti di anatomia e fisiologia dell apparato respiratorio Principi di trattamento della difficoltà respiratoria
FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua
 FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie Università degli Studi Verona Obiettivi Funzioni
FISIOLOGIA RENALE 2. Funzioni tubulari, riassorbimento obbligatorio dell acqua Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie Università degli Studi Verona Obiettivi Funzioni
www.slidetube.it Il nefrone è costituito dal corpuscolo renale e dal tubulo
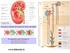 Il nefrone è costituito dal corpuscolo renale e dal tubulo Il corpuscolo renale è formato da : a) il glomerulo arterioso b) la capsula di Bowman www.slidetube.it Zona corticale Zona midollare Dall arteria
Il nefrone è costituito dal corpuscolo renale e dal tubulo Il corpuscolo renale è formato da : a) il glomerulo arterioso b) la capsula di Bowman www.slidetube.it Zona corticale Zona midollare Dall arteria
FISIOLOGIA DELLA RESPIRAZIONE
 FISIOLOGIA DELLA RESPIRAZIONE SCAMBIO E TRASPORTO DEI GAS La composizione dell aria alveolare differisce rispetto all aria ambiente. A livello alveolare si verifica la continua diffusione della del sangue
FISIOLOGIA DELLA RESPIRAZIONE SCAMBIO E TRASPORTO DEI GAS La composizione dell aria alveolare differisce rispetto all aria ambiente. A livello alveolare si verifica la continua diffusione della del sangue
Resistenze delle vie aeree
 Resistenze delle vie aeree Valutabili in condizioni dinamiche, quando si crea flusso. Anche per il flusso nelle vie aeree è applicabile l equazione di Poiseuille F = Pπr 4 /8ηl 70% delle resistenze nei
Resistenze delle vie aeree Valutabili in condizioni dinamiche, quando si crea flusso. Anche per il flusso nelle vie aeree è applicabile l equazione di Poiseuille F = Pπr 4 /8ηl 70% delle resistenze nei
Bilancio Sodio e Potassio
 Bilancio Sodio e Potassio Sodio E l elemento fondamentale per: Controllo osmolalità Mantenimento volume del LEC Mantenimento Pressione arteriosa L introduzione giornaliera di sodio con la dieta (200 meq/l)
Bilancio Sodio e Potassio Sodio E l elemento fondamentale per: Controllo osmolalità Mantenimento volume del LEC Mantenimento Pressione arteriosa L introduzione giornaliera di sodio con la dieta (200 meq/l)
Eliminare dall organismo prodotti di rifiuto e sostanze tossiche idrosolubili(soprattutto prodotti azotati e creatinina);
 Funzioni del rene Eliminare dall organismo prodotti di rifiuto e sostanze tossiche idrosolubili(soprattutto prodotti azotati e creatinina); Regolare il volume e la composizione del liquido extracellulare;
Funzioni del rene Eliminare dall organismo prodotti di rifiuto e sostanze tossiche idrosolubili(soprattutto prodotti azotati e creatinina); Regolare il volume e la composizione del liquido extracellulare;
Dott.ssa Marta Tavecchia. COS E IL ph?
 Dott.ssa Marta Tavecchia COS E IL ph? IL RENE: COSA FA? Regola il bilancio idrico Regola il bilancio elettrolitico Regola l equilibrio acido base Elimina le scorie del metabolismo azotato Svolge un ruolo
Dott.ssa Marta Tavecchia COS E IL ph? IL RENE: COSA FA? Regola il bilancio idrico Regola il bilancio elettrolitico Regola l equilibrio acido base Elimina le scorie del metabolismo azotato Svolge un ruolo
scaricato da www.sunhope.it 1
 INSUFFICIENZA RESPIRATORIA Situazione clinico-laboratoristica laboratoristica complessa, di vario livello ed entità, espressione di una utilizzazione endocellulare dell ossigeno non rispondente alle esigenze
INSUFFICIENZA RESPIRATORIA Situazione clinico-laboratoristica laboratoristica complessa, di vario livello ed entità, espressione di una utilizzazione endocellulare dell ossigeno non rispondente alle esigenze
Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica
 Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Definizione
Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Definizione
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro.
 Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
P aria (livello del mare) = 760 mmhg. Composizione: O 2 : 20.84% N 2 : 78.62% CO 2 : 0.04% po 2 = 159 mmhg. pn 2 = 597mmHg. pco 2 = 0.
 Scambi alveolari Aria atmosferica = miscela di gas (principalmente O 2, N 2, CO 2 ) La velocità di diffusione di un gas (quantità di gas che diffonde nell unità di tempo) è direttamente proporzionale alla
Scambi alveolari Aria atmosferica = miscela di gas (principalmente O 2, N 2, CO 2 ) La velocità di diffusione di un gas (quantità di gas che diffonde nell unità di tempo) è direttamente proporzionale alla
ALTERAZIONI IDROELETTROLITICHE ED ACIDO-BASE
 ALTERAZIONI IDROELETTROLITICHE ED ACIDO-BASE EQUILIBRIO IDROELETTROLITICO RUOLO DEL RENE: Il rene è l organo deputato al mantenimento dell equilibrio idrico ed elettrolitico dell organismo EQUILIBRIO IDROELETTROLITICO
ALTERAZIONI IDROELETTROLITICHE ED ACIDO-BASE EQUILIBRIO IDROELETTROLITICO RUOLO DEL RENE: Il rene è l organo deputato al mantenimento dell equilibrio idrico ed elettrolitico dell organismo EQUILIBRIO IDROELETTROLITICO
Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O 2 dagli alveoli al sangue e della
 Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O 2 dagli alveoli al sangue e della CO 2 in direzione opposta. L aria che respiriamo è una
Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O 2 dagli alveoli al sangue e della CO 2 in direzione opposta. L aria che respiriamo è una
a cura di : Alessandro Trevisan Croce Rossa Italiana Ambulanza ALS CRI-118
 a cura di : Alessandro Trevisan Croce Rossa Italiana Ambulanza ALS CRI-118 Importanza dell identificazione precoce del paziente critico Cause dell arresto cardiorespiratorio nell adulto Identificare e
a cura di : Alessandro Trevisan Croce Rossa Italiana Ambulanza ALS CRI-118 Importanza dell identificazione precoce del paziente critico Cause dell arresto cardiorespiratorio nell adulto Identificare e
La [H+], il PH e quello che l equazione di Kassirer- Bleich ci può dire nella pratica.
![La [H+], il PH e quello che l equazione di Kassirer- Bleich ci può dire nella pratica. La [H+], il PH e quello che l equazione di Kassirer- Bleich ci può dire nella pratica.](/thumbs/29/13365859.jpg) DISORDINI DELL EQUILIBRIO ACIDO-BASE : loro interpretazione Introduzione L interpretazione dei disordini dell equilibrio acido base (EAB) è stata spesso considerata dagli studenti del corso di laurea in
DISORDINI DELL EQUILIBRIO ACIDO-BASE : loro interpretazione Introduzione L interpretazione dei disordini dell equilibrio acido base (EAB) è stata spesso considerata dagli studenti del corso di laurea in
I compartimenti liquidi corporei
 I compartimenti liquidi corporei Il mantenimento di un volume relativamente costante e di una composizione stabile dei liquidi corporei è essenziale per l omeostasi. In condizioni di equilibrio, l assunzione
I compartimenti liquidi corporei Il mantenimento di un volume relativamente costante e di una composizione stabile dei liquidi corporei è essenziale per l omeostasi. In condizioni di equilibrio, l assunzione
La pressione diminuisce a causa dell ATTRITO
 Il gradiente pressorio generato dal cuore induce il sangue a scorrere nel sistema circolatorio Atrio destro La pressione diminuisce a causa dell ATTRITO PAM = 80 mmhg+1/3(120-80 mmhg) 1 Concetti base di
Il gradiente pressorio generato dal cuore induce il sangue a scorrere nel sistema circolatorio Atrio destro La pressione diminuisce a causa dell ATTRITO PAM = 80 mmhg+1/3(120-80 mmhg) 1 Concetti base di
Conosci I tuoi numeri. lyondellbasell.com
 Conosci I tuoi numeri 1 Prendi possesso della tua salute Conosci I tuoi numeri! La nostra vita è circondata da numeri importanti che dobbiamo conoscere Ma conosciamo I nostri Numeri in termini di salute?
Conosci I tuoi numeri 1 Prendi possesso della tua salute Conosci I tuoi numeri! La nostra vita è circondata da numeri importanti che dobbiamo conoscere Ma conosciamo I nostri Numeri in termini di salute?
domande iniziali Obiettivi della fluido terapia aspetti fisiologici solidi interstizio 14% LIC plasma transcellulare LEC = 20 %
 domande iniziali quando si deve praticare? quale tipo di soluz. impiegare? quanto liquido somministrare? con quale velocità di infusione? quale via di somministrazione? Obiettivi della fluido terapia Risoluzione
domande iniziali quando si deve praticare? quale tipo di soluz. impiegare? quanto liquido somministrare? con quale velocità di infusione? quale via di somministrazione? Obiettivi della fluido terapia Risoluzione
www.fisiokinesiterapia.biz
 Cause di IRC Alterazioni del controllo della ventilazione Funzionali: ipoventilazione alveolare centrale, sdr obesità-ipoventialzione ipoventialzione Strutturali: infarto o neoplasia del tronco encefalico
Cause di IRC Alterazioni del controllo della ventilazione Funzionali: ipoventilazione alveolare centrale, sdr obesità-ipoventialzione ipoventialzione Strutturali: infarto o neoplasia del tronco encefalico
600 mosm/dì 1200 mosm/l. = 0.5 l/dì
 Il rene elimina acqua in eccesso attraverso l escrezione di urina diluita Il rene trattiene acqua mediante l escrezione di urina concentrata Il rene controlla l osmolarità e la concentrazione del sodio
Il rene elimina acqua in eccesso attraverso l escrezione di urina diluita Il rene trattiene acqua mediante l escrezione di urina concentrata Il rene controlla l osmolarità e la concentrazione del sodio
La pompa sodio-potassio
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 La pompa sodio-potassio 14/3/2006 Efficienza del cuore Dipende dall ordinata sequenza di eccitazione e di contrazione che procede
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 La pompa sodio-potassio 14/3/2006 Efficienza del cuore Dipende dall ordinata sequenza di eccitazione e di contrazione che procede
U.O. Medicina e Chirurgia d Urgenza ed Accettazione Direttore Dott. Vito Procacci PROTOCOLLO OPERATIVO VENTILAZIONE MECCANICA NON INVASIVA
 U.O. Medicina e Chirurgia d Urgenza ed Accettazione Direttore Dott. Vito Procacci PROTOCOLLO OPERATIVO VENTILAZIONE MECCANICA NON INVASIVA VENTILAZIONE MECCANICA NON INVASIVA CPAP INSUFFICIENZA DI SCAMBIO
U.O. Medicina e Chirurgia d Urgenza ed Accettazione Direttore Dott. Vito Procacci PROTOCOLLO OPERATIVO VENTILAZIONE MECCANICA NON INVASIVA VENTILAZIONE MECCANICA NON INVASIVA CPAP INSUFFICIENZA DI SCAMBIO
FOCUS SU EQUILIBRI ACIDO-BASE
 1 Ci sono varie definizioni di acidi e basi, tra le quali meritano di essere ricordate quella di Bronsted e quella di Lewis. Per i nostri fini pratici, ovvero gli esercizi, ci basta però ricordare le definizioni
1 Ci sono varie definizioni di acidi e basi, tra le quali meritano di essere ricordate quella di Bronsted e quella di Lewis. Per i nostri fini pratici, ovvero gli esercizi, ci basta però ricordare le definizioni
L INSUFFICIENZA RESPIRATORIA NELLA PRATICA CLINICA
 Capitolo 2 L INSUFFICIENZA RESPIRATORIA NELLA PRATICA CLINICA 1. Definizione e classificazione clinica in urgenza La respirazione è un processo globale il cui obiettivo è assicurare la normale attività
Capitolo 2 L INSUFFICIENZA RESPIRATORIA NELLA PRATICA CLINICA 1. Definizione e classificazione clinica in urgenza La respirazione è un processo globale il cui obiettivo è assicurare la normale attività
Soluzioni. Definizioni. Unità di concentrazione. Si definisce soluzione una miscela omogenea di 2 o più componenti occupanti la stessa fase.
 Definizioni Si definisce soluzione una miscela omoenea di 2 o più componenti occupanti la stessa fase. Soluzioni Una soluzione può essere in: Fase solida (lehe metalliche) Fase liquida (as+liquido, liquido+liquido,
Definizioni Si definisce soluzione una miscela omoenea di 2 o più componenti occupanti la stessa fase. Soluzioni Una soluzione può essere in: Fase solida (lehe metalliche) Fase liquida (as+liquido, liquido+liquido,
Acute Respiratory Distress Syndrome (ARDS)
 Acute Respiratory Distress Syndrome (ARDS) E una sindrome di insufficienza polmonare severa associata a infiltrati polmonari simile alla malattia da membrane ialine L ARDS si definisce come la presenza
Acute Respiratory Distress Syndrome (ARDS) E una sindrome di insufficienza polmonare severa associata a infiltrati polmonari simile alla malattia da membrane ialine L ARDS si definisce come la presenza
Il modello strutturale dell atomo
 Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
regole d oro per la prevenzione della calcolosi renale
 10 regole d oro per la prevenzione della calcolosi renale La calcolosi renale è una patologia frequente, ricorrente e potenzialmente pericolosa se non adeguatamente inquadrata, prevenuta e trattata. Se
10 regole d oro per la prevenzione della calcolosi renale La calcolosi renale è una patologia frequente, ricorrente e potenzialmente pericolosa se non adeguatamente inquadrata, prevenuta e trattata. Se
Che cos'è il diabete? Sabato 05 Maggio 2007 08:16. Informazioni generali. Diabete tipo 1. Diabete tipo 2 1 / 5
 Informazioni generali Il diabete è una malattia cronica caratterizzata dalla presenza di elevati livelli di glucosio nel sangue (ipe Diabete tipo 1 Riguarda circa il 10% delle persone con diabete e in
Informazioni generali Il diabete è una malattia cronica caratterizzata dalla presenza di elevati livelli di glucosio nel sangue (ipe Diabete tipo 1 Riguarda circa il 10% delle persone con diabete e in
ASSISTENZA PERIOPERATORIA
 ASSISTENZA PERIOPERATORIA Fattori che influiscono sull assistenza La malattia e la risposta Intervento chirurgico Aspetti sociali e personali Interventi dei medici e infermieri FATTORE UMANO TIPI DI INTERVENTI
ASSISTENZA PERIOPERATORIA Fattori che influiscono sull assistenza La malattia e la risposta Intervento chirurgico Aspetti sociali e personali Interventi dei medici e infermieri FATTORE UMANO TIPI DI INTERVENTI
Sistema Muscolare. Scuola Secondaria Bolgare. Prof. Locatelli
 Sistema Muscolare Scuola Secondaria Bolgare. Prof. Locatelli 1 Proprietà dei Muscoli Qualsiasi movimento del nostro corpo è eseguito dai muscoli. In tutto il corpo ci sono circa 600 diversi muscoli Contrattitili
Sistema Muscolare Scuola Secondaria Bolgare. Prof. Locatelli 1 Proprietà dei Muscoli Qualsiasi movimento del nostro corpo è eseguito dai muscoli. In tutto il corpo ci sono circa 600 diversi muscoli Contrattitili
CENNI DI FISIOLOGIA UMANA
 CENNI DI FISIOLOGIA UMANA o L'APPARATO CARDIOCIRCOLATORIO o L'APPARATO RESPIRATORIO o L'APPARATO OSTEOARTICOLARE cuore cervello polmoni scheletro 1 La Fisiologia è la scienza che studia la funzionalità
CENNI DI FISIOLOGIA UMANA o L'APPARATO CARDIOCIRCOLATORIO o L'APPARATO RESPIRATORIO o L'APPARATO OSTEOARTICOLARE cuore cervello polmoni scheletro 1 La Fisiologia è la scienza che studia la funzionalità
Glossario. Intero quaderno di lavoro. Riferimento. Gli alunni scrivono come titolo i concetti che si riferiscono alle brevi spiegazioni.
 Livello 2 06 / Il sangue Informazione per gli insegnanti 1/7 Riferimento Intero quaderno di lavoro Compito Gli alunni scrivono come titolo i concetti che si riferiscono alle brevi spiegazioni. Materiale
Livello 2 06 / Il sangue Informazione per gli insegnanti 1/7 Riferimento Intero quaderno di lavoro Compito Gli alunni scrivono come titolo i concetti che si riferiscono alle brevi spiegazioni. Materiale
ENDOCRINOLOGIA DELL ESERCIZIO FISICO. Massimo Morè
 ENDOCRINOLOGIA DELL ESERCIZIO FISICO Massimo Morè ESERCIZIO FISICO E MODIFICAZIONI FISIOLOGICHE Attività fisica lieve o moderata : glicogeno muscolare glucosio plasmatico acidi grassi liberi impiego trifasico
ENDOCRINOLOGIA DELL ESERCIZIO FISICO Massimo Morè ESERCIZIO FISICO E MODIFICAZIONI FISIOLOGICHE Attività fisica lieve o moderata : glicogeno muscolare glucosio plasmatico acidi grassi liberi impiego trifasico
Glossario. Intero quaderno di lavoro. Riferimento
 Livello 1 06 / Il sangue Informazioni per gli insegnanti 1/5 Riferimento Intero quaderno di lavoro Compito Gli studenti cercano le spiegazioni che si riferiscono ai concetti numerati e annotano correttamente
Livello 1 06 / Il sangue Informazioni per gli insegnanti 1/5 Riferimento Intero quaderno di lavoro Compito Gli studenti cercano le spiegazioni che si riferiscono ai concetti numerati e annotano correttamente
Il feto in travaglio di parto
 Il feto in travaglio di parto WWW.FISIOKIENSITERAPIA.BIZ FCF: caratteristiche Frequenza di base Variabilità della frequenza di base Accelerazioni Decelerazioni Linea di base Frequenza cardiaca media in
Il feto in travaglio di parto WWW.FISIOKIENSITERAPIA.BIZ FCF: caratteristiche Frequenza di base Variabilità della frequenza di base Accelerazioni Decelerazioni Linea di base Frequenza cardiaca media in
IPERTENSIONE ARTERIOSA
 IPERTENSIONE ARTERIOSA FONTE : Claudio Rugarli Medicina interna sistematica Fattori fisici determinanti la pressione arteriosa è utile paragonare il sistema arterioso a un recipiente pieno di liquido,
IPERTENSIONE ARTERIOSA FONTE : Claudio Rugarli Medicina interna sistematica Fattori fisici determinanti la pressione arteriosa è utile paragonare il sistema arterioso a un recipiente pieno di liquido,
DISSOCIAZIONE DEGLI OSSIDI METALLICI NEI FORNI A VUOTO. Elio Gianotti - Trattamenti termici Ferioli & Gianotti S.p.A.
 DISSOCIAZIONE DEGLI OSSIDI METALLICI NEI FORNI A VUOTO Elio Gianotti - Trattamenti termici Ferioli & Gianotti S.p.A. Le basse pressioni unitamente alle temperature elevate che si possono raggiungere nei
DISSOCIAZIONE DEGLI OSSIDI METALLICI NEI FORNI A VUOTO Elio Gianotti - Trattamenti termici Ferioli & Gianotti S.p.A. Le basse pressioni unitamente alle temperature elevate che si possono raggiungere nei
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Scaricato da
 -Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
-Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
Alimentazione e ossigenazione cellulare
 Alimentazione e ossigenazione cellulare IL CIBO e L OSSIGENO L ossigeno è un nutriente essenziale nel corpo umano,è il terzo elemento chimico che entra nella composizione del nostro organismo,dopo il carbonio
Alimentazione e ossigenazione cellulare IL CIBO e L OSSIGENO L ossigeno è un nutriente essenziale nel corpo umano,è il terzo elemento chimico che entra nella composizione del nostro organismo,dopo il carbonio
Approccio al paziente con trauma toracico Trauma toracico Si associa spesso a danno diretto funzione respiratoria funzione cardio-vascolare Si associa
 APPROCCIO AL PAZIENTE CON TRAUMA TORACICO SUL TERRITORIO G. Lotti - M. Marcheschi emergenza territoriale asl 3 Pistoia 1 Approccio al paziente con trauma toracico Trauma toracico Si associa spesso a danno
APPROCCIO AL PAZIENTE CON TRAUMA TORACICO SUL TERRITORIO G. Lotti - M. Marcheschi emergenza territoriale asl 3 Pistoia 1 Approccio al paziente con trauma toracico Trauma toracico Si associa spesso a danno
Mappatura delle acque con particolare attenzione ai nitrati
 Mappatura delle acque con particolare attenzione ai nitrati L esperienza consiste nel determinare il valore di alcuni parametri di campioni di acque e poi riportarli su una carta della Sicilia per creare
Mappatura delle acque con particolare attenzione ai nitrati L esperienza consiste nel determinare il valore di alcuni parametri di campioni di acque e poi riportarli su una carta della Sicilia per creare
Ruolo del calcio nella cellula
 Ruolo del calcio nella cellula I meccanismi evolutivi hanno attribuito agli ioni fosfato un importanza fondamentale poiché sono necessari per sintetizzare ATP. Per questo motivo la loro concentrazione
Ruolo del calcio nella cellula I meccanismi evolutivi hanno attribuito agli ioni fosfato un importanza fondamentale poiché sono necessari per sintetizzare ATP. Per questo motivo la loro concentrazione
INSUFFICIENZA RESPIRATORIA
 INCAPACITA VENTILATORIA (flussi e/o volumi alterati alle PFR) INSUFFICIENZA RESPIRATORIA (compromissione dello scambio gassoso e/o della ventilazione alveolare) Lung failure (ipoossiemia) Pump failure
INCAPACITA VENTILATORIA (flussi e/o volumi alterati alle PFR) INSUFFICIENZA RESPIRATORIA (compromissione dello scambio gassoso e/o della ventilazione alveolare) Lung failure (ipoossiemia) Pump failure
INSUFFICIENZA RENALE CRONICA. Pogressivo deficit quantitativo della massa nefronica funzionante, indipendentemente dalle cause che lo hanno indotto.
 INSUFFICIENZA RENALE CRONICA Complessa condizione clinico-metabolica che consegue alla progressiva perdita dei nefroni. Pogressivo deficit quantitativo della massa nefronica funzionante, indipendentemente
INSUFFICIENZA RENALE CRONICA Complessa condizione clinico-metabolica che consegue alla progressiva perdita dei nefroni. Pogressivo deficit quantitativo della massa nefronica funzionante, indipendentemente
LA VALUTAZIONE DEL DANNO POLMONARE ANATOMICO E FUNZIONALE NELLA DISCINESIA CILIARE PRIMITIVA
 Dott.ssa Francesca Santamaria Dott.ssa Paola Iacotucci Dipartimento di Pediatria, Università Federico II, Napoli LA VALUTAZIONE DEL DANNO POLMONARE ANATOMICO E FUNZIONALE NELLA DISCINESIA CILIARE PRIMITIVA
Dott.ssa Francesca Santamaria Dott.ssa Paola Iacotucci Dipartimento di Pediatria, Università Federico II, Napoli LA VALUTAZIONE DEL DANNO POLMONARE ANATOMICO E FUNZIONALE NELLA DISCINESIA CILIARE PRIMITIVA
EMOGASANALISI ARTERIOSA
 EMOGASANALISI ARTERIOSA U.O.S PNEUMOLOGIA Ospedale «PISPICO» POGGIARDO Dott.ssa L.FERRAMOSCA EMOGASANALISI ARTERIOSA E FACILE DA ESEGUIRE E RAPIDA E SOLO LIMITATAMENTE INVASIVA COMPLICANZE INFREQUENTI
EMOGASANALISI ARTERIOSA U.O.S PNEUMOLOGIA Ospedale «PISPICO» POGGIARDO Dott.ssa L.FERRAMOSCA EMOGASANALISI ARTERIOSA E FACILE DA ESEGUIRE E RAPIDA E SOLO LIMITATAMENTE INVASIVA COMPLICANZE INFREQUENTI
La Circolazione ALESSIA JULIANO MAX RICCARDO 2^A TRIUGGIO
 La Circolazione ALESSIA JULIANO MAX RICCARDO 2^A TRIUGGIO APPARATO CARDIOCIRCOLATORIO CUORE ARTERIE VENE CAPILLARI SANGUE PLASMA, GLOBULI ROSSI, GLOBULI BIANCHI E PIASTRINE HA FUNZIONI NUTRITIVA E DIFENSIVA.
La Circolazione ALESSIA JULIANO MAX RICCARDO 2^A TRIUGGIO APPARATO CARDIOCIRCOLATORIO CUORE ARTERIE VENE CAPILLARI SANGUE PLASMA, GLOBULI ROSSI, GLOBULI BIANCHI E PIASTRINE HA FUNZIONI NUTRITIVA E DIFENSIVA.
IL CASO DI GIACOMO. Motivo dell accesso in PS
 UNIVERSITA DEGLI STUDI «La Sapienza» Roma Facoltà di Medicina e Chirurgia Master II livello Terapia intensiva dell età pediatrica (0-18 anni) Direttore prof Corrado Moretti AA 2014-2015 Una strana dispnea
UNIVERSITA DEGLI STUDI «La Sapienza» Roma Facoltà di Medicina e Chirurgia Master II livello Terapia intensiva dell età pediatrica (0-18 anni) Direttore prof Corrado Moretti AA 2014-2015 Una strana dispnea
Cause di malattia Genetiche:
 omeostasi Cause di malattia Genetiche: relativamente poche e derivano da alterazioni a carico di uno o più geni. Esempio: sindrome di Down (dovuta a trisomia del cromosoma 21); sindrome di Turner (dovuta
omeostasi Cause di malattia Genetiche: relativamente poche e derivano da alterazioni a carico di uno o più geni. Esempio: sindrome di Down (dovuta a trisomia del cromosoma 21); sindrome di Turner (dovuta
Luigi Aronne Disordini dell equilibrio acido-base
 Luigi Aronne Disordini dell equilibrio acido-base Per acidosi s intende una condizione che determinerebbe acidemia (ph < 7,36) se non fosse compensata Per alcalosi s intende una condizione che determinerebbe
Luigi Aronne Disordini dell equilibrio acido-base Per acidosi s intende una condizione che determinerebbe acidemia (ph < 7,36) se non fosse compensata Per alcalosi s intende una condizione che determinerebbe
Aggiungendo zinco a questa formula si stabilizza la molecola, che si unisce in esameri e diventa idrofila, Farmacocinetica e legame alle proteine
 Le differenze dell'insulina detemir rispetto all'insulina naturale sono la scomparsa del residuo aminoacido Aggiungendo zinco a questa formula si stabilizza la molecola, che si unisce in esameri e diventa
Le differenze dell'insulina detemir rispetto all'insulina naturale sono la scomparsa del residuo aminoacido Aggiungendo zinco a questa formula si stabilizza la molecola, che si unisce in esameri e diventa
Assorbimento, metabolismo ed escrezione dell eroina (pg.44) fig.1\pg.39 _Somministrazione: -via parentale (iniezioni sottocutanee o endovenose) -via
 Assorbimento, metabolismo ed escrezione dell eroina (pg.44) fig.1\pg.39 _Somministrazione: -via parentale (iniezioni sottocutanee o endovenose) -via inalatoria.- Chimica e Farmacologia del methadone (pg.49)
Assorbimento, metabolismo ed escrezione dell eroina (pg.44) fig.1\pg.39 _Somministrazione: -via parentale (iniezioni sottocutanee o endovenose) -via inalatoria.- Chimica e Farmacologia del methadone (pg.49)
LEZIONE 12. Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA. Scaricato da Sunhope.it
 LEZIONE 12 Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA Idrolisi salina Per IDROLISI SALINA si intende il fenomeno per il quale la dissoluzione in acqua di
LEZIONE 12 Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA Idrolisi salina Per IDROLISI SALINA si intende il fenomeno per il quale la dissoluzione in acqua di
Malattie dell Apparato Respiratorio. Prof. Plinio Carta
 Malattie dell Apparato Respiratorio 4 anno, 1 semestre [ aa 2006 2007 ] Prof. Plinio Carta Servizio di Medicina Preventiva dei Lavoratori e di Fisiopatologia Respiratoria Dipartimento di Sanità Pubblica
Malattie dell Apparato Respiratorio 4 anno, 1 semestre [ aa 2006 2007 ] Prof. Plinio Carta Servizio di Medicina Preventiva dei Lavoratori e di Fisiopatologia Respiratoria Dipartimento di Sanità Pubblica
SOLUZIONI. Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto).
 SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
La reazione da bilanciare è quindi: Cu + HNO 3 CuNO 3 + NO. Le due semireazioni da bilanciare saranno: HNO 3 NO (1) Cu CuNO 3 (2)
 Introducendo rame metallico (Cu) in acido nitrico diluito (HNO 3 ) si forma nitrato di rame (CuNO 3 ) e gas ossido nitrico (NO). Scrivere l equazione chimica bilanciata della reazione. La reazione da bilanciare
Introducendo rame metallico (Cu) in acido nitrico diluito (HNO 3 ) si forma nitrato di rame (CuNO 3 ) e gas ossido nitrico (NO). Scrivere l equazione chimica bilanciata della reazione. La reazione da bilanciare
Modulo di Chimica VII lezione. Acidi e basi Il ph
 Modulo di Chimica VII lezione Acidi e basi Il ph Un po di etimologia Acido: dal latino acidus (ac, essere pungente) Base: dal greco βασιξ (sostenere) Alcali: dall arabo al-qalì (potassa, dalle ceneri di
Modulo di Chimica VII lezione Acidi e basi Il ph Un po di etimologia Acido: dal latino acidus (ac, essere pungente) Base: dal greco βασιξ (sostenere) Alcali: dall arabo al-qalì (potassa, dalle ceneri di
 CORSO REGIONALE-118 EDEMA POLMONARE E SHOCK CARDIOGENO Dr. Ermanno Angelini U.O.Cardiologia Ospedale A. Perrino, BRINDISI. EDEMA POLMONARE DEFINIZIONE EPA CARDIOGENO E TRASUDAZIONE DI FLUIDO POVERO DI
CORSO REGIONALE-118 EDEMA POLMONARE E SHOCK CARDIOGENO Dr. Ermanno Angelini U.O.Cardiologia Ospedale A. Perrino, BRINDISI. EDEMA POLMONARE DEFINIZIONE EPA CARDIOGENO E TRASUDAZIONE DI FLUIDO POVERO DI
EMOGASANALISI ARTERIOSA 20/09/14. La valutazione degli scambi gassosi: EGA, saturimetria, CO 2 transcutanea, CO 2 espirata
 La valutazione degli scambi gassosi: EGA, saturimetria, CO 2 transcutanea, CO 2 espirata FtR Luciana Ptacinsky Is6tuto Palazzolo Fondazione Don Carlo Gnocchi Milano VALUTAZIONE DEGLI SCAMBI GASSOSI È uno
La valutazione degli scambi gassosi: EGA, saturimetria, CO 2 transcutanea, CO 2 espirata FtR Luciana Ptacinsky Is6tuto Palazzolo Fondazione Don Carlo Gnocchi Milano VALUTAZIONE DEGLI SCAMBI GASSOSI È uno
ENDOCRINOLOGIA E NUTRIZIONE UMANA LEZIONE 6 GHIANDOLE SURRENALI ZONE
 ENDOCRINOLOGIA E NUTRIZIONE UMANA LEZIONE 6 GHIANDOLE SURRENALI ZONE Struttura La porzione più esterna della corticale, la zona glomerulare, è costituita da piccole cellule mentre la porzione centrale,
ENDOCRINOLOGIA E NUTRIZIONE UMANA LEZIONE 6 GHIANDOLE SURRENALI ZONE Struttura La porzione più esterna della corticale, la zona glomerulare, è costituita da piccole cellule mentre la porzione centrale,
IPERTRIGLICERIDEMIA E PANCREATITE ACUTA
 SCUOLA REGIONALE DI FORMAZIONE SPECIFICA IN MEDICINA GENERALE, CORSO 2010/2013. PATOLOGIA DEL PANCREAS IPERTRIGLICERIDEMIA E PANCREATITE ACUTA Elisabetta Ascari Fabio Bassi Medicina III Gastroenterologia
SCUOLA REGIONALE DI FORMAZIONE SPECIFICA IN MEDICINA GENERALE, CORSO 2010/2013. PATOLOGIA DEL PANCREAS IPERTRIGLICERIDEMIA E PANCREATITE ACUTA Elisabetta Ascari Fabio Bassi Medicina III Gastroenterologia
