FISIOLOGIA CdL in Medicina e Chirurgia. Regolazione del ph. Dott.ssa Michela Anna Pia Ciliberti
|
|
|
- Virginio Vaccaro
- 8 anni fa
- Visualizzazioni
Transcript
1 FISIOLOGIA CdL in Medicina e Chirurgia Regolazione del ph Dott.ssa Michela Anna Pia Ciliberti
2 FUNZIONI OMEOSTATICHE INTEGRATE regolazione della temperatura corporea; controllo del ph dell organismo; regolazione endocrina del metabolismo di calcio, fosforo e glucosio; regolazione della pressione arteriosa; regolazione delle funzioni sessuali e riproduttiva.
3 In una soluzione acquosa una piccola parte delle molecole di acqua : OH - e H + (protoni). I protoni, la carica positiva elementare, alterano la distribuzione delle cariche in soluzione e lo stato delle cariche associate a molecole inorganiche e organiche (proteine). Allora la [protoni] deve essere mantenuta in ambiti molto ristretti di variazione in ogni liquido corporeo grazie a sistemi tampone e a meccanismi di trasporto di protoni.
4 ACIDI, BASI E P ACIDO: ACIDO: forma di molecola che può liberare un protone. BASE: forma di molecola che può legare un protone. ACIDI, BASI E Ph SOSTANZA ACIDA: forma non protonata molto più stabile di quella protonata. A - + H + AH Base Acido sostanza acida SOSTANZA BASICA o ALCALINA: forma protonata molto più stabile di quella non protonata B + H + BH Base Acido sostanza basica AH A - + H + tale sistema è in equilibrio quando k - = k+ k+: costante di associazione k-: costante di dissociazione K A: costante acida = [A - ]* [H + ]/ [AH] = k - / k+ = concentrazione di H + a cui forma acida e basica sono presenti in uguale concentrazione.
5 ACIDO(HA) FORTE: K A elevata, cioè buona parte della sostanza è all equilibrio in forma dissociata, cioè il sistema tende a liberare molti protoni. ACIDO(HA) DEBOLE: K A piccola, la frazione dissociata è bassa, scarsa capacità dell acido di cedere protoni. Maggiore è la [protoni], tanto più la reazione si sposta verso la forma acida. La concentrazione dei H + nei liquidi organici è in generale molto bassa, nell ordine di M, perciò si parla di ph, che è il logaritmo decimale negativo della concentrazione di H +. ph= -log 10 [H + ]. Per ogni sostanza si può definire una pk A = -log K A Per ogni sostanza le concentrazioni di acido e base sono uguali quando [H + ]= K A e quando ph= pk A.
6 SISTEMA TAMPONE DEL ph: un acido o una base debole (pk A non lontano da 7, valore neutro di ph), presente in rilevante concentrazione, tende a stabilizzare la [H+] attorno al suo valore di K A, potendo legare o cedere protoni senza che cambi molto il rapporto base/acido e compensando così l immissione o sottrazione di H + alla soluzione. Bisogna considerare : pk A del sistema, valore attorno a cui l efficienza del tampone è massima, cioè al valore di ph uguale al pka, metà del tampone è presente nelle due forme, protonata e non, e perciò la situazione compensa sia aumenti sia diminuzioni della [H + ]; capacità tampone, per sistema chiuso è tanto più alta quanto più alta è la [tampone]. SISTEMA TAMPONE APERTO, cioè i prodotti finali della/e reazione/i, che svolge la funzione tampone, non si accumulano o esauriscono.
7 IMPORTANZA DEL CONTROLLO DEL Ph Protoni + gruppi nucleofili di proteine - stato conformazionale, - equilibrio tra varie conformazioni, - struttura e funzione delle proteine. cambiamento di:
8 IMPORTANZA DEL CONTROLLO DEL Ph Assunzione ed eliminazione di acidi e basi con dieta, respirazione e produzione di urina modificazione del ph dei liquidi organici
9 ASSORBIMENTO E PRODUZIONE DI EQUIVALENTI ACIDI - PRODUZIONE - METABOLISMO CELLULARE substrati metabolici H 2 O + CO 2 H 2 CO 3 HCO 3- (ioni in soluz. bicarbonato) + H + (idrogenioni) CO 2 da combustione di substrati energetici= fonte di equivalenti acidi volatili - ASSORBIMENTO - DIETA fegato equivalenti acidi non volatili: - acido solforico (Aa con S, Met, Cys) - acido cloridrico (Aa cationici) - fosfato (direttamente in alimenti) Aa bicarbossilici anionici e anioni organici in dieta (citrato) bicarbonato (parte di HCO 3- contenuto e prodotto da alimenti è perso in feci) Acidi non volatili sono tamponati dal bicarbonato, che è rigenerato da CO 2 con escrezione attiva di H+ in urine.
10 - PRODUZIONE DI EQUIVALENTI ACIDI NON VOLATILI - METABOLISMO ENERGETICO Metabolismo energetico no fino a prodotti terminali perché no O 2 per ossidare substrati energetici (es. metab. glicolitico anaerobico del muscolo acido piruvico e acido lattico ) ELIMINAZIONE DI EQUIVALENTI ACIDI POLMONI: eliminazione di CO 2 prodotta da metabolismo cellulare, se eccessiva att. respiratoria alcalosi respiratoria (N.B. non tutti gli equiv. acidi non volatili in eccesso vanno neutralizzati, altrimenti si esaurisce la riserva di HCO 3-, princ. tampone dei LEC) RENI: porz. pross. di tubulo renale H + secreti + HCO 3- filtrato H 2 O + CO 2 che rientrano nella cellula epiteliale H + + HCO - 3 HCO 3- va nell interstizio con scambio con Cl - o con cotrasporto con Na + Risultato: riassorbimento netto di sodio bicarbonato e preservazione di riserva di HCO - 3
11
12 porz. dist. di tubulo renale- in cellula glutamina H+ H + + NH + bicarbonato 3 porz. dist. di tubulo renale in cellula: glutamina H + + NH 3 + bicarbonato con ATPasi protonica i H + vanno nel lume + NH 3 NH + 4 che non può rientrare passivamente bicarbonato va nell'interstizio e rimpiazza quello consumato nell'organismo per tamponare equivalenti acidi non volatili
13 RISERVA ALCALINA DELL ORGANISMO-RA: -Circa 350 meq di BICARBONATO per un LEC di circa 14 l in un soggetto normale di 70kg; -due processi la consumano: filtrazione renale, combinazione con protoni per neutralizzare gli acidi non volatili; -due processi compensatori: 1-riassorbimento, rene- anidrasi carbonica: in lume H 2 CO 3 H 2 O + CO 2 che rientrano in cellula H 2 CO 3 Ma servono protoni nel lume tubulare, che sono forniti su membr.apicale verso lume tubulare da: - scambio Na + - H + - secrezione attiva di H + allora riassorbimento di HCO 3- in parallelo con riassorbimento di Na + 2-sintesi de novo, per compensare quantità di bicarbonato perso per neutralizzare acidi non volatili rene- produzione di bicarbonato con produzione simultanea di H + o ione ammonio (NH 4+ ), prodotto dalla glutammina nelle cellule del tubulo contorto prossimale e distale e poi o è estruso al posto dei H + o si scinde in H + e ammoniaca (NH 3 ), che diffonde liberamente al lume, dove il basso ph ne favorisce la ricombinazione con protoni a generare NH 4+, che é intrappolato nel lume
14 ALTERAZIONI DELL EQUILIBRIO ACIDO-BASE ACIDOSI METABOLICA: riduzione di RA, aumento o meno di P co2 ALCALOSI METABOLICA: aumento di RA, diminuzione o meno di P co2 ACIDOSI RESPIRATORIA: aumento di RA, aumento di P co2, basso ph ALCALOSI RESPIRATORIA: diminuzione di RA, diminuzione di P co2, alto ph
15
16 Nella pratica clinica: ACIDOSI/ALCALOSI RESPIRATORIA: solo scostamenti di P co2 ACIDOSI/ALCALOSI METABOLICA: solo alterazioni RA ACIDOSI RESPIRATORIA: P co2 > 45 mmhg a livello arterioso per: - ridotta ventilazione alveolare con ridotta capacità di eliminare CO 2 es. patologie bronchiali e polmonari, ostruzioni di vie aeree, respirazione artificiale sotto anestesia, neuropatie; - eccessiva produzione metabolica di CO 2, es. iperpiressia maligna, iperpiressia, dieta ricca di carboidrati con parziale compromissione della ventilazione. ALCALOSI RESPIRATORIA: P co2 < 35mmHg per eliminazione eccessiva di CO 2, alterazione ventilazione/perfusione (V/Q) con conseguente ipossia e iperventilazione compensatoria e bassa pressione parziale di O 2 (P O2 ).
17
18 ACIDOSI METABOLICA: Eccesso di acidi (che consumano bicarbonato) per: - troppa produzione di acidi organici da metabolismo anaerobico per ipoperfusione (es. ipovolemia, shock cardiogeno); - sepsi o intossicazioni (cianuro) che interferiscono con l utilizzzo di O 2 ; - chetoacidosi diabetica (le cellule per carenza di insulina come fonte energetica usano, invece di glucosio, grassi producendo corpi chetonici); - inadeguata escrezione di protoni per disfunzione tubulare renale. Riduzione di RA (alterazioni renali che compromettono il riassorbimento o la neosintesi renale di bicarbonato- HCO 3- ) per: - perdita massiccia di HCO 3- per - perdita di contenuto intestinale, - diarrea persistente, - uso di farmaci che inibiscono l anidrasi carbonica (acetazolamide, mal di montagna e glaucoma). ALCALOSI METABOLICA: - eccessiva perdita di H + (vomito prolungato con perdita di secreto gastrico ricco di H + ); - eccessivo riassorbimento di HCO 3-, riduzione di Cl - per vomito prolungato (secrez.gastrica ha molto Cl - ), diuretici che comportano il riassorbimento di Cl - (es. tiazidici); - eccessiva assunzione di alcali es farmaci antiacidi.
19
20 RISPOSTE COMPENSATORIE 1- AZIONE TAMPONE CHIMICA Riduce lo scostamento di ph, che un carico acido o basico produce, ma si esaurisce subito tranne quando l escrezione dei H + è molto efficiente, altrimenti varia la [HCO 3- ] che può dare alcalosi/acidosi metabolica: azione efficace ma limitata. 2- COMPENSAZIONE RESPIRATORIA DELLE ALTERAZIONI DEL ph DI ORIGINE METABOLICA (maggior interesse clinico per ACIDOSI METABOLICA) Risposta dei centri respiratori del tronco encefalico, iperventilazione per ridurre P co2 e ristabilire il ph, ma non si ha compenso completo perché la P co2 non può scendere sotto un certo limite e si ha alcalosi respiratoria. 3- COMPENSAZIONE METABOLICA DELLE ALTERAZIONI DEL ph DI ORIGINE RESPIRATORIA -ACIDOSI RESPIRATORIA (aumento di P co2 ), si produce bicarbonato (HCO 3- ), si aumenta la riserva alcalina, si riduce il ph e si determina ALCALOSI METABOLICA. -ALCALOSI RESPIRATORIA (riduzione di P co2 ), si consuma bicarbonato, si riduce la riserva alcalina, si aumenta il ph e si determina ACIDOSI METABOLICA. 4- COMPENSAZIONE RENALE Modulazione del riassorbimento tubulare di HCO 3- e dell escrezione di H +, meccanismo lento (anche giorni) ma unico per ripristinare il valore corretto di RA.
21 VALUTAZIONE CLINICA DEGLI SQUILIBRI ACIDO-BASE 1- SEMPLICE MISURA DEL ph PLASMATICO 2- MISURAZIONE DI P co2 e MISURAZIONE DI RA equazione di Henderson-Hesselbach - ph= 6,1+log ([HCO 3- ]/0,03*P co2 ) ogni alterazione respiratoria, che alteri la P co2, oppure metabolica, che alteri i livelli plasmatici di bicarbonato, modifica il ph plasmatico. 3- MISURAZIONE DI GAP ANIONICO (soprattutto per acidosi metabolica): differenza tra [Na + ] e [Cl - + HCO 3- ], che in condizioni fisiologiche riflette le cariche negative associate alle proteine plasmatiche, perché gli altri cationi (K +, Ca 2+, Mg 2+ ) sono bilanciati da fosfati, solfato e anioni organici; gap anionico normale con acidosi per perdita extrarenale di HCO 3- (diarrea, vomito biliare) o per disfunzione renale (nefropatie). 4- MISURAZIONE DI ECCESSO DI BASI -BE (base excess, eccesso di basi): quantità di acido o base da aggiungere in vitro al sangue intero per riportare il ph a 7,4 mantenendo la P co2 fissa a 40 mmhg; - nel sangue: vari sistemi tampone (emoglobina, fosfati, albumina) allora - SBE (standard base excess, eccesso di basi standard); - HID (differenza titolabile di idrogenioni); - CSBE (standard base excess corretto).
22 CONTROLLO DEL Ph NEL LIC TAMPONE del Ph: 1- GRUPPI CARICHI DI PROTEINE E AMMINOACIDI 2- FOSFATI PRESENTI IN GRANDE [ ] NEL CITOSOL (sistemi tampone chiusi, i più importanti del LIC) H 3 PO 4 H 2 PO 4- + H + HPO H + fosfato monobasico fosfato bibasico
23 CONTROLLO DEL Ph NEI LEC Il sistema tampone deve essere aperto, cioè i prodotti finali della/e reazione/i che svolge la funzione tampone non si accumulano o esauriscono. RUOLO DI TAMPONE DI Ph: 1- AZIONE TAMPONE DELLE PROTEINE 2- TAMPONE EMOGLOBINA A LIVELLO PLASMATICO ph basso, < affinità per O 2, >affinità per CO 2, no accumulo di CO 2 nel plasma, sottrazione di CO 2 dalla soluzione circostante e tamponamento indiretto della produzione di protoni. 3- SISTEMA TAMPONE PRINCIPALE -ANIDRIDE CARBONICA-ACIDO CARBONICO- BICARBONATO CO 2 + H 2 0 H 2 CO 3 H + + HCO 3 - L organismo produce di continuo CO 2, ma l eccesso è eliminato dai polmoni con attività respiratoria. I protoni non accompagnati da HCO 3- sono escreti dal rene. Sistema aperto e come tale: - capacità tampone in condiz. fisiologiche è virtualmente illimitata; - la concentr. plasmatica delle due forme del tampone è regolata in modo indipendente, cioè la respirazione regola la P co2 e il rene mantiene le corrette [HCO 3- ].
24 TESTO CONSIGLIATO FISIOLOGIA MEDICA a cura di Fiorenzo Conti Volume 2, edi-ermes, Seconda edizione
25 CONTATTI Laboratorio di Fisiologia Dipartimento di Medicina Clinica e Sperimentale Università degli Studi di Foggia Viale L. Pinto, Foggia Tel / Tutorato: lunedì e giovedì
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE
 FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
Fisiologia Renale 5. Equilibrio acido-base: Fisiologia e fisiopatologia
 Fisiologia Renale 5. Equilibrio acidobase: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Produzione e bilancio
Fisiologia Renale 5. Equilibrio acidobase: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Produzione e bilancio
Alterazioni equilibrio acidobase
 Alterazioni equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Acidosi: rapporto HCO 3 /CO 2 ph. Se diminuzione dipende da: HCO 3 acidosi metabolica (nonrespiratoria)
Alterazioni equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Acidosi: rapporto HCO 3 /CO 2 ph. Se diminuzione dipende da: HCO 3 acidosi metabolica (nonrespiratoria)
ph = log 1/[H+] = - log [H+]
![ph = log 1/[H+] = - log [H+] ph = log 1/[H+] = - log [H+]](/thumbs/34/16948015.jpg) ph = log 1/[H+] = log [H+] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = inizio 7,36 max 6.8) ph superiori = alcalosi (limite ph inizio 7,44 max 7.8) ph intracellulare
ph = log 1/[H+] = log [H+] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = inizio 7,36 max 6.8) ph superiori = alcalosi (limite ph inizio 7,44 max 7.8) ph intracellulare
Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica
 Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Definizione
Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Definizione
Acqua: nutriente essenziale
 Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
OMEOSTASI DELLA TEMPERATURA CORPOREA
 OMEOSTASI DELLA TEMPERATURA CORPOREA Ruolo fisiologico del calcio Omeostasi del calcio ASSORBIMENTO INTESTINALE DEL CALCIO OMEOSTASI GLICEMICA Il livello normale di glicemia? 90 mg/100 ml Pancreas
OMEOSTASI DELLA TEMPERATURA CORPOREA Ruolo fisiologico del calcio Omeostasi del calcio ASSORBIMENTO INTESTINALE DEL CALCIO OMEOSTASI GLICEMICA Il livello normale di glicemia? 90 mg/100 ml Pancreas
EMOGASANALISI ARTERIOSA
 EMOGASANALISI ARTERIOSA Prelievo arterioso Il prelievo arterioso può essere eseguito nelle arterie RADIALE, BRACHIALE o FEMORALE. Attualmente viene eseguito più frequentemente il prelievo dall arteria
EMOGASANALISI ARTERIOSA Prelievo arterioso Il prelievo arterioso può essere eseguito nelle arterie RADIALE, BRACHIALE o FEMORALE. Attualmente viene eseguito più frequentemente il prelievo dall arteria
SISTEMI ENERGETICI. L ATP privato di uno dei suoi 3 radicali fosforici diventa ADP (adenosindifosfato).
 SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3. Idrolisi salina Soluzioni tampone Titolazioni acido-base
 Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
OSS Acidi e Basi. Acidi e basi. Il concetto di equilibrio:
 1 Acidi e basi Il concetto di equilibrio: Le reazioni chimiche sono generalmente irreversibili (non si può tornare alla situazione di partenza). Un esempio semplificato potrebbe essere il seguente: quando
1 Acidi e basi Il concetto di equilibrio: Le reazioni chimiche sono generalmente irreversibili (non si può tornare alla situazione di partenza). Un esempio semplificato potrebbe essere il seguente: quando
Plasma ph Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca
 Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
Bilancio Sodio e Potassio
 Bilancio Sodio e Potassio Sodio E l elemento fondamentale per: Controllo osmolalità Mantenimento volume del LEC Mantenimento Pressione arteriosa L introduzione giornaliera di sodio con la dieta (200 meq/l)
Bilancio Sodio e Potassio Sodio E l elemento fondamentale per: Controllo osmolalità Mantenimento volume del LEC Mantenimento Pressione arteriosa L introduzione giornaliera di sodio con la dieta (200 meq/l)
STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE
 STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE Dott. ssa Annalisa Caravaggi Biologo Nutrizionista sabato 15 febbraio 14 STRESS: Forma di adattamento dell organismo a stimoli chiamati STRESSOR.
STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE Dott. ssa Annalisa Caravaggi Biologo Nutrizionista sabato 15 febbraio 14 STRESS: Forma di adattamento dell organismo a stimoli chiamati STRESSOR.
Elettrolita forte = specie chimica che in soluzione si dissocia completamente (l equilibrio di dissociazione è completamente spostato verso destra)
 A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido
 Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido extracellulare e dalla loro regolazione. Membrana cellulare Ogni cellula presenta
Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido extracellulare e dalla loro regolazione. Membrana cellulare Ogni cellula presenta
IL ph E I RELATIVI CALCOLI: UN APPROCCIO DIDATTICO
 IL ph E I RELATIVI CALCOLI: UN APPROCCIO DIDATTICO G. Giacomo Guilizzoni Rivista: «Didattica delle Scienze» 4/1995 Gli insegnanti di chimica, durante l esposizione dei concetti fondamentali di acidità
IL ph E I RELATIVI CALCOLI: UN APPROCCIO DIDATTICO G. Giacomo Guilizzoni Rivista: «Didattica delle Scienze» 4/1995 Gli insegnanti di chimica, durante l esposizione dei concetti fondamentali di acidità
Rene ed equilibrio acido-base
 Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
Rene ed equilibrio acidobase Produzione H Acidi volatili (15.000 mmol/dì) CO 2 H 2 O H 2 CO 3 H HCO 3 non costituisce guadagno H perché CO 2 (volatile) eliminata con la respirazione Acidi fissi, non volatili
COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA.2015-16
 COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA.2015-16 OMEOSTASI Fisiologia Umana La fisiologia è la scienza che studia i meccanismi di funzionamento degli organismi viventi. E una scienza integrata che
COMUNICAZIONE TRA CELLULA ED AMBIENTE FGE AA.2015-16 OMEOSTASI Fisiologia Umana La fisiologia è la scienza che studia i meccanismi di funzionamento degli organismi viventi. E una scienza integrata che
K [H 2 O] 2 = K w = [H 3 O + ][OH ]
![K [H 2 O] 2 = K w = [H 3 O + ][OH ] K [H 2 O] 2 = K w = [H 3 O + ][OH ]](/thumbs/27/10717050.jpg) Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY
 DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
http://sds.coniliguria.it 1
 Aspetti metabolici dell esercizio fisico Genova 22 gennaio 2011 A cura di Attilio TRAVERSO http://sds.coniliguria.it 1 L allenamento produce modificazioni fisiologiche (adattamenti) in quasi tutti i sistemi
Aspetti metabolici dell esercizio fisico Genova 22 gennaio 2011 A cura di Attilio TRAVERSO http://sds.coniliguria.it 1 L allenamento produce modificazioni fisiologiche (adattamenti) in quasi tutti i sistemi
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
- WELKOME FITNESS 2013
 - WELKOME FITNESS 2013 Evoluzione e ricerca nel mondo degli integratori Equilibrio acido base una nuova esigenza per lo sport e per la salute Dott Marco Neri: Comitato Tecnico Nazionale FIPCF/CONI Comitato
- WELKOME FITNESS 2013 Evoluzione e ricerca nel mondo degli integratori Equilibrio acido base una nuova esigenza per lo sport e per la salute Dott Marco Neri: Comitato Tecnico Nazionale FIPCF/CONI Comitato
ANATOMIA E FISIO-PATOLOGIA L APPARATO URINARIO
 ANATOMIA E FISIO-PATOLOGIA L APPARATO URINARIO CORSO CORSO OSS DISCIPLINA: OSS DISCIPLINA: ANATOMIA PRIMO E FISIO-PATOLOGIA SOCCORSO MASSIMO MASSIMO FRANZIN FRANZIN COSTITUITO DA: DUE RENI DUE URETERI
ANATOMIA E FISIO-PATOLOGIA L APPARATO URINARIO CORSO CORSO OSS DISCIPLINA: OSS DISCIPLINA: ANATOMIA PRIMO E FISIO-PATOLOGIA SOCCORSO MASSIMO MASSIMO FRANZIN FRANZIN COSTITUITO DA: DUE RENI DUE URETERI
SDD - Seconde Equilibrio e ph. Equilibrio e ph. Obiettivo
 1 Obiettivo Capire che cosa è il ph, apprendere le leggi fondamentali che lo controllano e capire qualitativamente le applicazioni delle soluzioni tampone. Prerequisiti Il concetto di equilibrio (che comunque
1 Obiettivo Capire che cosa è il ph, apprendere le leggi fondamentali che lo controllano e capire qualitativamente le applicazioni delle soluzioni tampone. Prerequisiti Il concetto di equilibrio (che comunque
Prodotti delle Fermentazioni Ruminali
 Prodotti delle Fermentazioni Ruminali GAS Acidi Grassi Volatili CORPI MICROBICI 1) GAS prodotti dalle Fermentazioni Ruminali CO 2 ANIDRIDE CH 4 METANO ANIDRIDE CARBONICA ALTRI (NH 3, H 2 S ) (AMMONIACA,
Prodotti delle Fermentazioni Ruminali GAS Acidi Grassi Volatili CORPI MICROBICI 1) GAS prodotti dalle Fermentazioni Ruminali CO 2 ANIDRIDE CH 4 METANO ANIDRIDE CARBONICA ALTRI (NH 3, H 2 S ) (AMMONIACA,
a.a. 2017/18 Prof.ssa Pia Lucidi Laboratorio di Cognizione e Benessere Animale RICEVIMENTO: Lunedì 17:30-18:30
 a.a. 2017/18 Prof.ssa Pia Lucidi Laboratorio di Cognizione e Benessere Animale RICEVIMENTO: Lunedì 17:3018:30 Omeostasi acidobasica Gli enzimi operano ad un ph ottimale in un range molto ristretto (7.4
a.a. 2017/18 Prof.ssa Pia Lucidi Laboratorio di Cognizione e Benessere Animale RICEVIMENTO: Lunedì 17:3018:30 Omeostasi acidobasica Gli enzimi operano ad un ph ottimale in un range molto ristretto (7.4
Dipendenza della Solubilità dalla temperatura
 SOLUBILIZZAZIONE Simile scioglie il simile: le molecole di sostanze diverse si mescolano intimamente nelle miscele se possiedono forze intermolecolari simili (soluzioni ideali). Anche se le forze intermolecolari
SOLUBILIZZAZIONE Simile scioglie il simile: le molecole di sostanze diverse si mescolano intimamente nelle miscele se possiedono forze intermolecolari simili (soluzioni ideali). Anche se le forze intermolecolari
ENDOCRINOLOGIA E NUTRIZIONE UMANA LEZIONE 6 GHIANDOLE SURRENALI ZONE
 ENDOCRINOLOGIA E NUTRIZIONE UMANA LEZIONE 6 GHIANDOLE SURRENALI ZONE Struttura La porzione più esterna della corticale, la zona glomerulare, è costituita da piccole cellule mentre la porzione centrale,
ENDOCRINOLOGIA E NUTRIZIONE UMANA LEZIONE 6 GHIANDOLE SURRENALI ZONE Struttura La porzione più esterna della corticale, la zona glomerulare, è costituita da piccole cellule mentre la porzione centrale,
Trasporto O 2 nel sangue
 Trasporto O 2 nel sangue 97% legato all Hb nei globuli rossi 3% fisicamente disciolto, determina il valore di po 2 Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb SaturazioneHb 97% 0.3 ml/100ml 19.4
Trasporto O 2 nel sangue 97% legato all Hb nei globuli rossi 3% fisicamente disciolto, determina il valore di po 2 Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb SaturazioneHb 97% 0.3 ml/100ml 19.4
Metabolismo degli amminoacidi. Ciclo dell urea
 Metabolismo degli amminoacidi Ciclo dell urea Biosintesi di amminoacidiporfirine, creatina, carnitina, ormoni, nucleotidi Gli amminoacidi possono subire una degradazione ossidativa in 3 diverse situazioni
Metabolismo degli amminoacidi Ciclo dell urea Biosintesi di amminoacidiporfirine, creatina, carnitina, ormoni, nucleotidi Gli amminoacidi possono subire una degradazione ossidativa in 3 diverse situazioni
6d. EQUILIBRI IONICI IN SOLUZIONE II: EQUILIBRI ACIDO-BASE parte seconda
 6d. EQUILIBRI IONICI IN SOLUZIONE II: EQUILIBRI ACIDO-BASE parte seconda Autoionizzazione (o autoprotolisi) dell acqua. Prodotto ionico dell acqua M = mol/l AA1011 IN L6d p1! AA1011 IN L6d p2! NB: se si
6d. EQUILIBRI IONICI IN SOLUZIONE II: EQUILIBRI ACIDO-BASE parte seconda Autoionizzazione (o autoprotolisi) dell acqua. Prodotto ionico dell acqua M = mol/l AA1011 IN L6d p1! AA1011 IN L6d p2! NB: se si
Il Metabolismo Energetico 1. Bilancio Quantitativo tra Apporto di Energia e Dispendio Energetico
 Il Metabolismo Energetico 1. Bilancio Quantitativo tra Apporto di Energia e Dispendio Energetico Prof. Carlo Capelli Fisiologia Facoltà di Scienze Motorie, Università degli Studi Verona Obiettivi Energia
Il Metabolismo Energetico 1. Bilancio Quantitativo tra Apporto di Energia e Dispendio Energetico Prof. Carlo Capelli Fisiologia Facoltà di Scienze Motorie, Università degli Studi Verona Obiettivi Energia
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA
 PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
dieta vengono convertiti in composti dei corpi chetonici.
 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
ENZIMI CINETICA ENZIMATICA
 ENZIMI PERCHE UNA REAZIONE AVVENGA, SI DEVONO SODDISFARE TRE CONDIZIONI I SUBSTRATI DEVONO ENTRARE IN COLLISIONE LA COLLISIONE DEVE AVVENIRE CON ORIENTAMENTO CORRETTO I REAGENTI DEVONO AVERE ENERGIA SUFFICIENTE
ENZIMI PERCHE UNA REAZIONE AVVENGA, SI DEVONO SODDISFARE TRE CONDIZIONI I SUBSTRATI DEVONO ENTRARE IN COLLISIONE LA COLLISIONE DEVE AVVENIRE CON ORIENTAMENTO CORRETTO I REAGENTI DEVONO AVERE ENERGIA SUFFICIENTE
GLUCONEOGENESI. Sintesi (GENESI) di nuove (NEO) molecole di glucosio
 GLUCONEOGENESI Sintesi (GENESI) di nuove (NEO) molecole di glucosio CATABOLISMO ANABOLISMO OSSIDAZIONI Produzione di ATP RIDUZIONI Consumo di ATP La GLUCONEOGENESI è un PROCESSO ANABOLICO La gluconeogenesi
GLUCONEOGENESI Sintesi (GENESI) di nuove (NEO) molecole di glucosio CATABOLISMO ANABOLISMO OSSIDAZIONI Produzione di ATP RIDUZIONI Consumo di ATP La GLUCONEOGENESI è un PROCESSO ANABOLICO La gluconeogenesi
Equilibri di precipitazione
 Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
NEFROLITIASI ACUTA. Più raro dolore addominale prevalemtemete anteriore
 NEFROLITIASI ACUTA Dolore costante e non colico, localizzato al fianco eo irradiato all inguine. Micro-macroematuria. Sovente nausea e vomito. Più raro dolore addominale prevalemtemete anteriore NEFROLITIASI
NEFROLITIASI ACUTA Dolore costante e non colico, localizzato al fianco eo irradiato all inguine. Micro-macroematuria. Sovente nausea e vomito. Più raro dolore addominale prevalemtemete anteriore NEFROLITIASI
LEZIONE 12. Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA. Scaricato da Sunhope.it
 LEZIONE 12 Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA Idrolisi salina Per IDROLISI SALINA si intende il fenomeno per il quale la dissoluzione in acqua di
LEZIONE 12 Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA Idrolisi salina Per IDROLISI SALINA si intende il fenomeno per il quale la dissoluzione in acqua di
METABOLISMO DEL GLICOGENO
 METABOLISMO DEL GLICOGENO Struttura del glicogeno DEMOLIZIONE DEL GLICOGENO: GLICOGENOLISI 1) distacco progressivo di unità glucosidiche con formazione di glucosio-1- fosfato: enzima: glicogeno fosforilasi
METABOLISMO DEL GLICOGENO Struttura del glicogeno DEMOLIZIONE DEL GLICOGENO: GLICOGENOLISI 1) distacco progressivo di unità glucosidiche con formazione di glucosio-1- fosfato: enzima: glicogeno fosforilasi
Analisi delle acque dell isola di Favignana
 Analisi delle acque dell isola di Favignana Durante le attività svolte al campo scuola nell ambito del progetto Un mare di.. risorse, il nostro gruppo si è occupato di analizzare le acque del mare in diversi
Analisi delle acque dell isola di Favignana Durante le attività svolte al campo scuola nell ambito del progetto Un mare di.. risorse, il nostro gruppo si è occupato di analizzare le acque del mare in diversi
Farmacocinetica dell escrezione dei farmaci nel latte. I neurotrasmettitori nella moderna diagnostica. Piperazina e suoi derivati
 Farmacocinetica dell escrezione dei farmaci nel latte I neurotrasmettitori nella moderna diagnostica Piperazina e suoi derivati dr. Angelo Marzìa FARMACOCINETICA DELL ESCREZIONE DEI FARMACI NEL LATTE
Farmacocinetica dell escrezione dei farmaci nel latte I neurotrasmettitori nella moderna diagnostica Piperazina e suoi derivati dr. Angelo Marzìa FARMACOCINETICA DELL ESCREZIONE DEI FARMACI NEL LATTE
ASPETTI TERMODINAMICI DEI SISTEMI BIOLOGICI
 ASPETTI TERMODINAMICI DEI SISTEMI BIOLOGICI Sistemi biologici: soggetti a complessi processi di trasformazione e scambio di energia; I sistemi biologici sono costituiti perlopiù da quattro elementi: H,
ASPETTI TERMODINAMICI DEI SISTEMI BIOLOGICI Sistemi biologici: soggetti a complessi processi di trasformazione e scambio di energia; I sistemi biologici sono costituiti perlopiù da quattro elementi: H,
Equilibrio acido base
 Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
La digestione degli alimenti
 La digestione degli alimenti Le sostanze alimentari complesse (lipidi, glucidi, protidi) che vengono introdotte nell organismo, devono subire delle profonde modificazioni che le trasformano in sostanze
La digestione degli alimenti Le sostanze alimentari complesse (lipidi, glucidi, protidi) che vengono introdotte nell organismo, devono subire delle profonde modificazioni che le trasformano in sostanze
Potenziale di membrana: Differenza di potenziale elettrico a cavallo della membrana cellulare dovuta ad una diversa distribuzione ionica ai due lati
 Potenziale di membrana: Differenza di potenziale elettrico a cavallo della membrana cellulare dovuta ad una diversa distribuzione ionica ai due lati della membrana. Il potenziale di membrana (negativo
Potenziale di membrana: Differenza di potenziale elettrico a cavallo della membrana cellulare dovuta ad una diversa distribuzione ionica ai due lati della membrana. Il potenziale di membrana (negativo
Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ]
![Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ] Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ]](/thumbs/34/16945364.jpg) La molecola d acqua è un dipolo perché l atomo di ossigeno è molto elettronegativo ed attira più vicini a sé gli elettroni di legame. Questo, unito alla forma della molecola, produce un accumulo di carica
La molecola d acqua è un dipolo perché l atomo di ossigeno è molto elettronegativo ed attira più vicini a sé gli elettroni di legame. Questo, unito alla forma della molecola, produce un accumulo di carica
-assicurare il fabbisogno plastico necessario alla riparazione protezione e ricambio dei tessuti.
 Il principali compiti derivanti dall assunzione periodica di cibo sono: -assicurare il giusto fabbisogno energetico necessario alla vita ed all attività muscolare (tenendo conto che entrate ed uscite devono
Il principali compiti derivanti dall assunzione periodica di cibo sono: -assicurare il giusto fabbisogno energetico necessario alla vita ed all attività muscolare (tenendo conto che entrate ed uscite devono
L ACQUA : STRUTTURA E PROPRIETA
 L ACQUA : STRUTTURA E PROPRIETA 1. Sostanza più abbondante in tutti gli esseri viventi 2. Più del 70% del peso di tutti gli esseri viventi 3. Influenza la struttura e la proprietà di tutte le molecole
L ACQUA : STRUTTURA E PROPRIETA 1. Sostanza più abbondante in tutti gli esseri viventi 2. Più del 70% del peso di tutti gli esseri viventi 3. Influenza la struttura e la proprietà di tutte le molecole
EMOGASANALISI ARTERIOSA 20/09/14. La valutazione degli scambi gassosi: EGA, saturimetria, CO 2 transcutanea, CO 2 espirata
 La valutazione degli scambi gassosi: EGA, saturimetria, CO 2 transcutanea, CO 2 espirata FtR Luciana Ptacinsky Is6tuto Palazzolo Fondazione Don Carlo Gnocchi Milano VALUTAZIONE DEGLI SCAMBI GASSOSI È uno
La valutazione degli scambi gassosi: EGA, saturimetria, CO 2 transcutanea, CO 2 espirata FtR Luciana Ptacinsky Is6tuto Palazzolo Fondazione Don Carlo Gnocchi Milano VALUTAZIONE DEGLI SCAMBI GASSOSI È uno
CENNI DI ELETTROCHIMICA
 CENNI DI ELETTROCHIMICA Gli elettrodi a membrana sono elettrodi che permettono la determinazione rapida e selettiva, per potenziometria diretta, di numerosi cationi ed anioni. Il meccanismo di formazione
CENNI DI ELETTROCHIMICA Gli elettrodi a membrana sono elettrodi che permettono la determinazione rapida e selettiva, per potenziometria diretta, di numerosi cationi ed anioni. Il meccanismo di formazione
RIASSORBIMENTO PROF. ALESSANDRO MALFATTI. Corso di Fisiologia Speciale Veterinaria
 RIASSORBIMENTO RIASSORBIMENTO TUBULO CONTORTO PROSSIMALE RIASSORBIMENTO OBBLIGATO (indipendente dai sistemi di regolazione) Quantitativamente la gran parte della funzione di riassorbimento avviene a questo
RIASSORBIMENTO RIASSORBIMENTO TUBULO CONTORTO PROSSIMALE RIASSORBIMENTO OBBLIGATO (indipendente dai sistemi di regolazione) Quantitativamente la gran parte della funzione di riassorbimento avviene a questo
Fisiologia Renale 7. Bilancio idro-elettrolitico II. Carlo Capelli, Fisiologia Corso di Laurea in Scienze Motorie Università Verona
 Fisiologia Renale 7. Bilancio idro-elettrolitico II Carlo Capelli, Fisiologia Corso di Laurea in Scienze Motorie Università Verona Obiettivi Bilancio dell acqua Variazione del ACT e osmolalità Osmocettori
Fisiologia Renale 7. Bilancio idro-elettrolitico II Carlo Capelli, Fisiologia Corso di Laurea in Scienze Motorie Università Verona Obiettivi Bilancio dell acqua Variazione del ACT e osmolalità Osmocettori
FARMACOCINETICA 2 ELIMINAZIONE DEI FARMACI. L eliminazione di un farmaco avviene per escrezione del farmaco immodificato o dei suoi metaboliti.
 FARMACOCINETICA 2 Farmacologia generale 1 ELIMINAZIONE DEI FARMACI L eliminazione di un farmaco avviene per escrezione del farmaco immodificato o dei suoi metaboliti. Le principali vie di escrezione sono:
FARMACOCINETICA 2 Farmacologia generale 1 ELIMINAZIONE DEI FARMACI L eliminazione di un farmaco avviene per escrezione del farmaco immodificato o dei suoi metaboliti. Le principali vie di escrezione sono:
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I I TRASPORTI ATTRAVERSO MEMBRANE BIOLOGICHE Movimenti di piccoli soluti attraverso le membrane 2 categorie generali Trasporto
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I I TRASPORTI ATTRAVERSO MEMBRANE BIOLOGICHE Movimenti di piccoli soluti attraverso le membrane 2 categorie generali Trasporto
Capitolo 7. Le soluzioni
 Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
È importante quindi conoscere le proprietà chimiche dell acqua. Le reazioni acido base sono particolari esempi di equilibrio chimico in fase acquosa
 Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
EQUILIBRI SIMULTANEI
 EQUILIBRI SIMULTANEI 1. Soluzioni tampone. Per soluzione tampone si intende una soluzione acquosa in grado di mantenere pressoché inalterato il proprio ph, in seguito all'aggiunta di moderate quantità
EQUILIBRI SIMULTANEI 1. Soluzioni tampone. Per soluzione tampone si intende una soluzione acquosa in grado di mantenere pressoché inalterato il proprio ph, in seguito all'aggiunta di moderate quantità
 forme diabetiche Diabete di tipo I o magro o giovanile (IDDM): carenza primaria di insulina, più frequente nei giovani e nei bambini. Il deficit insulinico consegue (per predisposizione ereditaria o per
forme diabetiche Diabete di tipo I o magro o giovanile (IDDM): carenza primaria di insulina, più frequente nei giovani e nei bambini. Il deficit insulinico consegue (per predisposizione ereditaria o per
EQUILIBRIO ACIDO-BASICO. Chiunque conosca un pò di fisiologia umana sa che la biochimica del nostro corpo tende ad essere leggermente alcalina.
 EQUILIBRIO ACIDO-BASICO A cura del Dr. Rocco Palmisano (Laureato in Scienza della Salute, U.S.A. - Naturopata) Chiunque conosca un pò di fisiologia umana sa che la biochimica del nostro corpo tende ad
EQUILIBRIO ACIDO-BASICO A cura del Dr. Rocco Palmisano (Laureato in Scienza della Salute, U.S.A. - Naturopata) Chiunque conosca un pò di fisiologia umana sa che la biochimica del nostro corpo tende ad
DA MADRE. Èla madre che -
 DA MADRE a figlio 2 Èla madre che - durante la gravidanza e l allattamento - dona al figlio tutto il calcio necessario a formare lo scheletro. Durante la gravidanza, soprattutto nel terzo trimestre, il
DA MADRE a figlio 2 Èla madre che - durante la gravidanza e l allattamento - dona al figlio tutto il calcio necessario a formare lo scheletro. Durante la gravidanza, soprattutto nel terzo trimestre, il
Metabolismo degli aminoacidi
 Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
ph = log 1/[H + ] = log [H + ]
![ph = log 1/[H + ] = log [H + ] ph = log 1/[H + ] = log [H + ]](/thumbs/49/24977942.jpg) ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
Le reazioni metaboliche sono estremamente sensibili alla concentrazione degli ioni H + nel liquido in cui avvengono, perché gli ioni H + influenzano
 EQUILIBRIO ACIDOBASE Le reazioni metaboliche sono estremamente sensibili alla concentrazione degli ioni H + nel liquido in cui avvengono, perché gli ioni H + influenzano il funzionamento degli enzimi.
EQUILIBRIO ACIDOBASE Le reazioni metaboliche sono estremamente sensibili alla concentrazione degli ioni H + nel liquido in cui avvengono, perché gli ioni H + influenzano il funzionamento degli enzimi.
Concetti fondamentali su acidità e basicità delle soluzioni acquose
 Concetti fondamentali su acidità e basicità delle soluzioni acquose Le molecole H 2 O dell acqua liquida pura possono andare incontro a dissociazione. Il processo può essere descritto come una reazione
Concetti fondamentali su acidità e basicità delle soluzioni acquose Le molecole H 2 O dell acqua liquida pura possono andare incontro a dissociazione. Il processo può essere descritto come una reazione
2) Calcolare la molarità di una soluzione di acido solforico al 17%,d = 1.12 g/ml
 Bari,11 gennaio 1999 Compito di analisi dei farmaci I 1) 1 ml di H 2 O 2 viene titolato con KMnO 4. Sono necessari 18.1 ml. La soluzione di KMnO 4 è 0.1023 N e la densità dell acqua ossigenata è 1.01 g/ml.
Bari,11 gennaio 1999 Compito di analisi dei farmaci I 1) 1 ml di H 2 O 2 viene titolato con KMnO 4. Sono necessari 18.1 ml. La soluzione di KMnO 4 è 0.1023 N e la densità dell acqua ossigenata è 1.01 g/ml.
Regolazione del metabolismo del glucosio
 Regolazione del metabolismo del glucosio Regolazione coordinata di glicolisi e gluconeogenesi Glicolisi e gluconeogenesi sono regolate in modo reciproco La regolazione è a livello dei punti di deviazione
Regolazione del metabolismo del glucosio Regolazione coordinata di glicolisi e gluconeogenesi Glicolisi e gluconeogenesi sono regolate in modo reciproco La regolazione è a livello dei punti di deviazione
Quota introduzione liquidi. Volume liquidi corporei. Rene
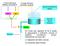 A breve termine Riflesso barocettivo A lungo termine Controllo volemia Quota introduzione liquidi RPT GC Pa Volume liquidi corporei Rene Diuresi Un modo per regolare la Pa è quello di aggiungere o sottrarre
A breve termine Riflesso barocettivo A lungo termine Controllo volemia Quota introduzione liquidi RPT GC Pa Volume liquidi corporei Rene Diuresi Un modo per regolare la Pa è quello di aggiungere o sottrarre
Luigi Aronne Disordini dell equilibrio acido-base
 Luigi Aronne Disordini dell equilibrio acido-base Per acidosi s intende una condizione che determinerebbe acidemia (ph < 7,36) se non fosse compensata Per alcalosi s intende una condizione che determinerebbe
Luigi Aronne Disordini dell equilibrio acido-base Per acidosi s intende una condizione che determinerebbe acidemia (ph < 7,36) se non fosse compensata Per alcalosi s intende una condizione che determinerebbe
VIE DI INTRODUZIONE ED ASSORBIMENTO DEI FARMACI
 VIE DI INTRODUZIONE ED ASSORBIMENTO DEI FARMACI I farmaci possono essere introdotti nell organismo per via enterale e per via parenterale.. Con la somministrazione enterale (enteron = intestino), il farmaco
VIE DI INTRODUZIONE ED ASSORBIMENTO DEI FARMACI I farmaci possono essere introdotti nell organismo per via enterale e per via parenterale.. Con la somministrazione enterale (enteron = intestino), il farmaco
Metalli in medicina. L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il
 Metalli in medicina L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il rame, per esempio, erano utilizzati nella Grecia antica. Già da secoli il Hg 2+ era utilizzato nel trattamento
Metalli in medicina L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il rame, per esempio, erano utilizzati nella Grecia antica. Già da secoli il Hg 2+ era utilizzato nel trattamento
Esercitazione 8. Gli equilibri acido-base: Ka, Kb. L autoprotolisi dell acqua. Misura del ph Soluzioni tampone 1,0 10-14
 Esercitazione 8 Misura del ph Soluzioni tampone Gli equilibri acido-base: Ka, Kb HA + H 2 O! H 3 O + + A - Ka = [H 3 O+ ][A - ] [HA] A - + H 2 O! OH - + HA Kb = [OH- ][HA] [A - ] Ka Kb = [ H 3 O + ] [
Esercitazione 8 Misura del ph Soluzioni tampone Gli equilibri acido-base: Ka, Kb HA + H 2 O! H 3 O + + A - Ka = [H 3 O+ ][A - ] [HA] A - + H 2 O! OH - + HA Kb = [OH- ][HA] [A - ] Ka Kb = [ H 3 O + ] [
Insufficienza Renale Cronica
 Insufficienza Renale Cronica Le nefropatie croniche si classificano in: - Nefropatia con filtrazione glomerulare (FG) normale [ > 90 ml/min/1,73 m²]; - Nefropatia con diminuzione lieve del FG [89-60 ML
Insufficienza Renale Cronica Le nefropatie croniche si classificano in: - Nefropatia con filtrazione glomerulare (FG) normale [ > 90 ml/min/1,73 m²]; - Nefropatia con diminuzione lieve del FG [89-60 ML
OBESITA. 11 Aprile 2013
 OBESITA 11 Aprile 2013 L obesità è una patologia cronica caratterizzata dall eccessivo accumulo di tessuto adiposo nell organismo ed è causata da fattori ereditari e non ereditari che determinano un introito
OBESITA 11 Aprile 2013 L obesità è una patologia cronica caratterizzata dall eccessivo accumulo di tessuto adiposo nell organismo ed è causata da fattori ereditari e non ereditari che determinano un introito
Dissociazione elettrolitica
 Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
Teoria di Arrhenius. Vengono definiti acidi quei composti che, in soluzione acquosa, sono in grado di dissociarsi liberando ioni H +
 Teoria di Arrhenius Vengono definiti acidi quei composti che, in soluzione acquosa, sono in grado di dissociarsi liberando ioni H + H-Cl H + + Cl - Vengono definiti basi quei composti che, in soluzione
Teoria di Arrhenius Vengono definiti acidi quei composti che, in soluzione acquosa, sono in grado di dissociarsi liberando ioni H + H-Cl H + + Cl - Vengono definiti basi quei composti che, in soluzione
a 25 C da cui si ricava che:
 Equilibrio di autoionizzazione dell acqua Come già osservato l acqua presenta caratteristiche anfotere, potendosi comportare tanto da acido (con una sostanza meno acida che si comporta da base) quanto
Equilibrio di autoionizzazione dell acqua Come già osservato l acqua presenta caratteristiche anfotere, potendosi comportare tanto da acido (con una sostanza meno acida che si comporta da base) quanto
N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi
 Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
www.fondazionedamico.org
 www.fondazionedamico.org COSA SONO Sono due organi situati nell addome, a forma di fagiolo, grandi poco più di un pugno, collegati alla vescica da un condotto chiamato uretere. L urina prodotta dai due
www.fondazionedamico.org COSA SONO Sono due organi situati nell addome, a forma di fagiolo, grandi poco più di un pugno, collegati alla vescica da un condotto chiamato uretere. L urina prodotta dai due
Helena Curtis N. Sue Barnes
 Helena Curtis N. Sue Barnes LA RESPIRAZIONE CELLULARE INDICE Demolizione del glucosio Glicolisi Fermentazione lattica Fermentazione alcolica Respirazione cellulare Ciclo di Krebs Catena di trasporto degli
Helena Curtis N. Sue Barnes LA RESPIRAZIONE CELLULARE INDICE Demolizione del glucosio Glicolisi Fermentazione lattica Fermentazione alcolica Respirazione cellulare Ciclo di Krebs Catena di trasporto degli
10) Se ad una soluzione aumentiamo la temperatura cosa succede? Dire quale delle seguenti affermazioni è corretta.
 Associazione di Promozione Sociale Lesina (FG) Cognome e Nome Sede: Via Principe di Piemonte, 93-71010 - Lesina (FG) - C.F. 93034730718 Tel. 0882.992808 E-mail: mail@antoniotucci.net - www.agora.lesina.org
Associazione di Promozione Sociale Lesina (FG) Cognome e Nome Sede: Via Principe di Piemonte, 93-71010 - Lesina (FG) - C.F. 93034730718 Tel. 0882.992808 E-mail: mail@antoniotucci.net - www.agora.lesina.org
Il Sistema Respiratorio. Fisica Medica
 Il Sistema Respiratorio La respirazione Trachea Bronchi Muscoli del diaframma I muscoli che controllano la respirazione fanno variare volume e pressione interna ai polmoni Fase Inspirazione Espirazione
Il Sistema Respiratorio La respirazione Trachea Bronchi Muscoli del diaframma I muscoli che controllano la respirazione fanno variare volume e pressione interna ai polmoni Fase Inspirazione Espirazione
Integrali (transmembrana), si estendono attraverso l intera membrana. Classificate in famiglie a seconda del numero di segmenti transmembrana.
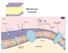 Membrana cellulare Proteine inserite nella membrana cellulare: Integrali (transmembrana), si estendono attraverso l intera membrana. Classificate in famiglie a seconda del numero di segmenti transmembrana.
Membrana cellulare Proteine inserite nella membrana cellulare: Integrali (transmembrana), si estendono attraverso l intera membrana. Classificate in famiglie a seconda del numero di segmenti transmembrana.
352&(662',&20%867,21(
 352&(662',&20%867,21( Il calore utilizzato come fonte energetica convertibile in lavoro nella maggior parte dei casi, è prodotto dalla combustione di sostanze (es. carbone, metano, gasolio) chiamate combustibili.
352&(662',&20%867,21( Il calore utilizzato come fonte energetica convertibile in lavoro nella maggior parte dei casi, è prodotto dalla combustione di sostanze (es. carbone, metano, gasolio) chiamate combustibili.
Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni
 Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni Una delle più importanti proprietà di una soluzione acquosa è la sua concentrazione di ioni idrogeno. Lo ione H + o
Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni Una delle più importanti proprietà di una soluzione acquosa è la sua concentrazione di ioni idrogeno. Lo ione H + o
Che cosa e l allenamento
 Che cosa e l allenamento teoria Definizione comportamento idoneo a modificare la capacità di prestazione motoria, fisica o psichica (cognitiva) fisiologia eccezione alla regola generale dell omeostasi
Che cosa e l allenamento teoria Definizione comportamento idoneo a modificare la capacità di prestazione motoria, fisica o psichica (cognitiva) fisiologia eccezione alla regola generale dell omeostasi
la base del benessere ph Basic AIUTA L EQUILIBRIO ACIDO-BASE
 la base del benessere ph Basic AIUTA L EQUILIBRIO ACIDO-BASE Il ph è l unità di misura dell acidità che va da 0 (acido) a 14 (basico o alcalino). 7 è il valore neutro. Il metodo più facile per avere un
la base del benessere ph Basic AIUTA L EQUILIBRIO ACIDO-BASE Il ph è l unità di misura dell acidità che va da 0 (acido) a 14 (basico o alcalino). 7 è il valore neutro. Il metodo più facile per avere un
Tamponi Biologici. AO/Febbraio 2016
 Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
Respirazione cellulare
 Respirazione cellulare L equazione generale della respirazione C 6 H 12 O 6 + 6 O 2! 6 CO 2 + 6 H 2 O + 36 ATP 1 molec zucchero 6 molec ossigeno 6 molec anidride carbonica 6 molec acqua + = + + 36 molecole
Respirazione cellulare L equazione generale della respirazione C 6 H 12 O 6 + 6 O 2! 6 CO 2 + 6 H 2 O + 36 ATP 1 molec zucchero 6 molec ossigeno 6 molec anidride carbonica 6 molec acqua + = + + 36 molecole
METABOLISMO E SISTEMI ENERGETICI
 METABOLISMO E SISTEMI ENERGETICI 1 Obiettivi della lezione 1) Capire come l organismo converta il cibo che ingeriamo in ATP per fornire ai muscoli l energia che essi necessitano per contrarsi. 2) Esaminare
METABOLISMO E SISTEMI ENERGETICI 1 Obiettivi della lezione 1) Capire come l organismo converta il cibo che ingeriamo in ATP per fornire ai muscoli l energia che essi necessitano per contrarsi. 2) Esaminare
Università degli Studi di Catania Dipartimento di Metodologie Fisiche e Chimiche per l Ingegneria
 Università degli Studi di Catania Dipartimento di Metodologie Fisiche e Chimiche per l Ingegneria Corso di laurea in Ingegneria Meccanica Corso di Tecnologie di Chimica Applicata LA CORROSIONE Nei terreni
Università degli Studi di Catania Dipartimento di Metodologie Fisiche e Chimiche per l Ingegneria Corso di laurea in Ingegneria Meccanica Corso di Tecnologie di Chimica Applicata LA CORROSIONE Nei terreni
Il ciclo nutrizione / digiuno
 Il ciclo nutrizione / digiuno Aspetti generali La fase di assorbimento è il periodo che va dalle 2 alle 4 ore successive all assunzione di un pasto. Durante questo intervallo si verifica un transitorio
Il ciclo nutrizione / digiuno Aspetti generali La fase di assorbimento è il periodo che va dalle 2 alle 4 ore successive all assunzione di un pasto. Durante questo intervallo si verifica un transitorio
www.fisiokinesiterapia.biz
 www.fisiokinesiterapia.biz FARMACOCINETICA La farmacocinetica è quella branca della farmacologia che studia il destino del farmaco nell organismo, dal momento in cui entra fino a quando sarà eliminato.
www.fisiokinesiterapia.biz FARMACOCINETICA La farmacocinetica è quella branca della farmacologia che studia il destino del farmaco nell organismo, dal momento in cui entra fino a quando sarà eliminato.
A cura di Elena Conti
 A cura di Elena Conti L acqua è l elemento principale delle cellule dell organismo, si trova fuori e dentro di esse. L ormone antidiuretico (Adh) regola i livelli di acqua nell organismo, aumentando il
A cura di Elena Conti L acqua è l elemento principale delle cellule dell organismo, si trova fuori e dentro di esse. L ormone antidiuretico (Adh) regola i livelli di acqua nell organismo, aumentando il
Attivitá e cinetica enzimatica
 Attivitá e cinetica enzimatica PAS : Classe di insegnamento A60 Biologia e scienze A.A. 2013/2014 09/05/2014 Cinetica Enzimatica La cinetica enzimatica è misurata come velocità di conversione del substrato
Attivitá e cinetica enzimatica PAS : Classe di insegnamento A60 Biologia e scienze A.A. 2013/2014 09/05/2014 Cinetica Enzimatica La cinetica enzimatica è misurata come velocità di conversione del substrato
