EQUILIBRIO ACIDO-BASICO. Chiunque conosca un pò di fisiologia umana sa che la biochimica del nostro corpo tende ad essere leggermente alcalina.
|
|
|
- Andrea Paolini
- 8 anni fa
- Visualizzazioni
Transcript
1 EQUILIBRIO ACIDO-BASICO A cura del Dr. Rocco Palmisano (Laureato in Scienza della Salute, U.S.A. - Naturopata) Chiunque conosca un pò di fisiologia umana sa che la biochimica del nostro corpo tende ad essere leggermente alcalina. Alcalino è anche e soprattutto il sangue arterioso, il cui range normale di ph ècompreso tra 7,30 e 7,45. Valori al di sotto di 7 e superiori a 8 sarebbero incompatibili con la vita e molti disturbi vengono a manifestarsi man mano ci si allontana dal valore ottimale di 7,4. Noi umani siamo un progetto genetico biochimico alcalino. Prima di procedere nell esposizione del presente argomento chiariremo il significato di ph, con cui si misura la concentrazione di idrogenioni (H + ) presenti in una soluzione od ovunque ci sia dell acqua. Una delle caratteristiche dell acqua maggiormente importanti per la vita è laionizzazione, processo chimico che consiste nella perdita o acquisto di uno o più elettroni da parte di un atomo o di una molecola. L attività biochimica cellulare è basata essenzialmente in un continuo processo di scissione della molecola d acqua (H 2 O) in ione H + (idrogenione) e ione OH - (ossidrile) e nella sua ricombinazione, catalizzando tutti gli altri processi biochimici, che ci permettono di vivere. Infatti, dopo l aria, l acqua è l elemento più essenziale per qualsiasi forma di vita sulla terra. Ebbene, questa caratteristica dell idrolisi e della sua ricombinazione sia nella cellula che fuori nel liquido extracellulare è uno dei fattori fondamentali per la vita. In una massa d acqua la quantità di ioni H + e di ioni OH - può variare per diversi motivi. L acqua che contiene più idrogenioni H + viene chiamata acqua acida;quella che contiene più ioni ossidrili OH - viene detta acqua alcalina; se il numero di ioni positivi e negativi si equivale, l acqua viene considerata neutra. In una determinata quantità d acqua neutra a temperatura ambiente (22 C) il rapporto sia degli ioni H + che degli ioni OH - con il totale delle molecole di quel volume d acqua è per entrambe di 1:10 7.
2 Se vogliamo conoscere il numero sia degli ioni H + che OH - nel predetto volume d acqua neutra, basta moltiplicare 1x10-7. Se aggiungiamo dell acido nella predetta soluzione neutra, il numero di ioni H + aumenta. Quando il numero aumenta a 1x10-6 (dieci volte più dell acqua neutra) la legge della Natura costringe il numero degli ioni OH - a diminuire a 1x10-8 unità. Poiché la somma degli esponenti delle suddette moltiplicazioni è sempre 14, al ph 6 corrisponde il poh 8. Pertanto nel valutare il ph di una soluzione viene sottinteso il rispettivo poh. La scala del ph si estende da 1 a 14, ove il valore 7 corrisponde al neutro; dal 7 in giù esprime valori sempre maggiori di acidità e dal 7 in su valori sempre maggiori di alcalinità. Poiché è una scala logaritmica negativa decadica, ogni punto che si allontana dal 7 nei due sensi corrisponde ad un valore 10 volte superiore al precedente. Per esempio un ph 6 esprime una concentrazione acida 10 volte maggiore di 7, mentre un ph 5 un valore 10 volte maggiore di 6 ma 100 volte maggiore di 7. Tutta la biochimica non può prescindere, in ogni suo processo, dalla presenza dell acqua. Una caratteristica interessante dell acqua è che essa si ionizza facilmente. La ionizzazione è quel processo chimico che comprende contestualmente reazioni d ossidazione e di riduzione. L ossidazione presuppone la cessione di elettroni, la riduzione contempla l assorbimento di elettroni. Non esiste ossidazione senza simultanea riduzione: questa combinazione di reazioni chimiche viene chiamata reazione REDOX. A questo punto possiamo riprendere il discorso sull importanza di una biochimica alcalina per la salute. Sappiamo che alla nascita un bambino sano ha una biochimica alcalina.alcalino è il latte materno, alcalina o appena acida è la sua urina. Ciò che permette al corpo di mantenersi sano ed alcalino, nonostante le cellule continuino a produrre costantemente acidi, è la sua capacità drenante e la sua riserva alcalina. La riserva alcalina è costituita principalmente dai minerali alcalini presenti nel sangue, nei tessuti, nei denti e nelle ossa. Quando la riserva alcalina del sangue e dei tessuti si esaurisce, il prelievo dei minerali alcalini necessari alla neutralizzazione dell acidosi avviene dai denti e dalle ossa.
3 Carie ed osteoporosi sono due condizioni specifiche dell acidosi metabolica e digestiva. E interessante notare come la Natura provvede a dotare il nascituro di riserva alcalina, prelevandola dalle riserve della madre: frequenti sono, infatti, carie ed osteoporosi nelle donne in gravidanza, le cui riserve alcaline sono carenti. Poiché il mantenimento del ph fisiologico è un fattore fondamentale per ogni altro corretto processo biologico, la Natura ha dotato il nostro organismo di vari sistemi tampone per assicurare la migliore condizione biologica possibile. I sistemi tampone intervengono per compensare l eccesso di acidità o di alcalinità. Purtroppo per il nostro innaturale stile di vita, soprattutto alimentare, l organismo si trova costretto a tamponare molto più frequentemente l eccesso di acidi, per cui in questo articolo ci occuperemo principalmente dei meccanismi di correzione dell acidosi metabolica e digestiva. SISTEMI MORFO-FISIOLOGICI DI CORREZIONE DEL ph Il ph fisiologico ematico è frutto di un meccanismo di controllo automaticoche si serve in primis del normale atto respiratorio, delle riserve ematicheacide (H 2 CO 3 ) ed alcaline (HCO 3 - ). Quando la normale respirazione non è sufficiente a compensare e smaltire l eccessiva acidità del sangue, in pochi minuti interviene una aumentata risposta respiratoria. La ventilazione polmonare svolge un ruolo fondamentale nella correzione del ph. Con la ventilazione polmonare, oltre all anidride carbonica (CO 2 ), vengono eliminati altri acidi organici presenti nel sangue in forma gassosa. La respirazione è un modo per espellere gli acidi La CO 2 prodotta dalle cellule si diffonde nel sangue, ove si trasforma in acido carbonico (H 2 CO 3 ), in modo da essere trasportata più facilmente fino agli alveoli polmonari, in cui si ritrasforma in CO 2 per essere eliminata dai polmoni. Durante l idratazione della CO 2 per merito dell anidrasi carbonica si formano ioni H + che devono essere tamponati per evitare una ricaduta di ph verso valori di acidità, incompatibili con la vita delle cellule. A fare ciò interviene in prima battuta l emoglobina, che è dotata di una efficientissima capacità tampone.
4 In condizioni fisiologiche le variazioni metaboliche di produzione di CO 2 sono prontamente controbilanciate dalle variazioni ventilatorie, in modo da mantenere costante la quantità di CO 2 nel sangue. L aumento della pco 2, la diminuzione del ph e della po 2 del sangue stimolano l iperventilazione, mentre una modificazione in senso opposto porta ad ipoventilazione. Per l equilibrio acido-basico plasmatico sono fondamentali due fattori: la concentrazione degli idrogenioni (H + ) espressa dal ph e la riserva alcalina del bicarbonato (HCO 3 - ), derivato dalla trasformazione della CO 2. A questi fattori si aggiungono, inoltre, costantemente sostanze acide ed alcaline derivate dal metabolismo intermedio e finale del processo digestivo. Poiché questi due fattori possono variare indipendentemente, si può parlare di equilibrio acido-basico solo quando c è il giusto rapporto tra riserva alcalina ed acidi. A far deragliare maggiormente e precocemente l equilibrio acido-basico è l abnorme mole di acidi prodotti dal metabolismo digestivo a causa dell alimentazione innaturale ed antifisiologica utilizzata ormai universalmente. L'alimentazione ha un ruolo fondamentale nell'equilibrio acido-basico Infatti con l eccessiva ed innaturale alimentazione si producono: A) Acido carbonico, risultato finale della combustione del carbonio contenuto nei cibi. B) Acido solforico, derivato dalla digestione delle proteine. C) Acido fosforico, derivato dall ossidazione dei fosfolipidi e nucleo-protidi. D) Acido acetacetico e beta-idrossibutirrico derivato dagli acidi grassi. E) Acido urico, derivato dal metabolismo dei nucleo-protidi. F) Acido lattico, prodotto dal metabolismo del glicogeno e vari altri acidi generati dall ossidazione incompleta degli zuccheri (spesso per la carenza di ossigeno). G) Acido ossalico, liberato da alcuni alimenti (cacao, spinaci, pomodori, ecc.). H) Anche gli acidi organici dei vegetali, inoltre, in carenza di ioni alcalini (sodio, potassio, magnesio, calcio), se non sono tamponati sufficientemente, aggiungono acidità a quella propria dell organismo. Tutti questi acidi, ma soprattutto gli acidi fissi, cioè quelli che non si trasformano in CO 2 e non sono in forma gassosa, eliminabili quindi con la respirazione e la traspirazione, devono comunque essere tamponati ed eliminati necessariamente dal nostro corpo.
5 La CO 2 ha caratteristiche bifasiche nel processo dell equilibrio acido-basico: da un lato è il prodotto acido quantitativamente più importante da cui il corpo si deve difendere per non abbassare il proprio ph ed a ciò provvedono principalmente, come abbiamo visto, i polmoni; dall altro lato provvede per circa la metà dell attività tampone in difesa del ph contro gli acidi fissi. Il sistema tampone acido-basico della CO 2 è detto sistema tampone primario, in quanto è di un importanza di gran lunga superiore agli altri. Quando nell acqua extracellulare sopraggiunge un acido forte, come per esempio l acido cloridrico (HCl), avviene la seguente reazione: HCl + NaHCO 3 = NaCl + H 2 CO 3. Dell acido carbonico prodotto in questa reazione una parte si trasforma in H 2 O + CO 2, ove la CO 2 verrà espulsa con la ventilazione, mentre un altra parte si trasforma in HCO H +, ove HCO 3 - sarà riassorbito a livello dei tubuli renali e reimmesso in circolo mentre H + sarà eliminato con le urine. La secrezione renale di H + rappresenta uno dei sistemi fondamentali per mantenere costante il ph fisiologico del corpo. Gli idrogenioni (H + ) secreti dal tubulo renale vengono eliminati con l urina. I reni partecipano al mantenimento dell equilibrio acido-basico tramite tre importanti sistemi tampone: - riassorbimento degli ioni di bicarbonato; - escrezione di acidi fissi (titolabili); - escrezione di NH 4 (ammonio); mentre l eliminazione di H + liberi è di poca entità. I reni contribuiscono a mantenere l'equilibrio acido-basico 1) Riassorbimento degli ioni HCO 3 -. I bicarbonati filtrati dai glomeruli vengono riassorbiti per circa l 80% nel tubulo prossimale ed il rimanente nel tubulo distale del nefrone. Numerosi sistemi possono influenzare la capacità di riassorbimento tubulare dei bicarbonati. I più importanti sono: volume extracellulare, pco 2, potassiemia, paratormone, calcemia, fosforemia. Ai fini dell equilibrio acido-basico all escrezione netta degli acidi deve corrispondere altrettanto riassorbimento di bicarbonati (HCO 3 - )
6 2) Escrezione di acidi fissi (titolabili) Tra gli acidi titolabili urinari i fosfati sono il sistema tampone più importante. Quando l urina si acidifica (per secrezione di H + ), gran parte del fosfato bibasico(hpo 4 -- ) si trasforma in monobasico (H 2 PO - ) secondo la seguente formula: HPO H + = H 2 PO -, che viene eliminato con l urina e con esso lo ione H + acquisito. In caso di alcalosi avverrebbe la reazione inversa, con relativo rilascio di H + da parte del fosfato monobasico. 3)Ecrezione di NH 4 + (ammonio) Alcuni acidi fissi (acido solforico, cloridrico, ossalico, ecc.) prodotti dall organismo o introdotti con l alimentazione sono acidi forti, che il rene è incapace di protonare (capacità di legare lo ione H + ) neanche ad un ph urinario di 4,5. Per compensare questa incapacità di protonazione degli acidi forti presenti nell urina, il rene produce un altro tampone, l ammoniaca (NH 3 ) per idrolisi della glutammina. La produzione di ammoniaca è correlata allo stato acido-basico dell organismo. Tutto il nefrone partecipa alla produzione di ammoniaca, ma se ne troverà maggiore quantità in quei segmenti del nefrone ove l acidità dell urina è maggiore, cioè nel tubulo distale e specialmente nel collettore. Pertanto la produzione e l escrezione renale di NH 3 rappresenta il sistema più valido per controllare l eliminazione degli acidi fissi. Infatti l escrezione di H + legato a NH 3 (come NH 4 + ) rappresenta più del 50% dell escrezione totale dell acidità urinaria e può aumentare fino all 80% in caso di forte acidosi. Per avere il ph ematico ottimale di 7,4 occorre un rapporto di 20:1 tra bicarbonato e acido carbonico. Pertanto l alterazione di questo rapporto influenzerà relativamente il ph ematico verso l acidità o verso l alcalinità. A mantenere costante questo rapporto contribuisco, come abbiamo visto finora: sistemi tampone sistemici, polmoni, reni e, come vedremo ora, l apparato digerente, di cui soprattutto lo stomaco. L attività biochimica dello stomaco riveste un importanza primaria nell equilibrio acido basico. Sicuramente sono importanti i sistemi tampone e gli organi analizzati fino adesso, ma se non ci fosse l apparato digerente, in cui entrano e vengono processate le sostanze basilari per la produzione degli acidi, delle basi, dei bicarbonati e dello stesso acido carbonico, non si potrebbe nemmeno immaginare una qualsivoglia altra attività vitale. Infatti, se non si mangia e soprattutto non si beve, sopraggiunge presto la morte.
7 Ruolo dello stomaco nell'equilibrio acido-basico Di tutto l apparato digestivo (bocca, stomaco, fegato, pancreas, intestino con tutte le sue ghiandole secretive di enorme importanza vitale) un ruolo di primaria importanza per l equilibrio acido-basico viene svolto dallo stomaco e precisamente dalle cellule parietali della parete (mucosa) gastrica. Le cellule parietali sono specializzate nella produzione dell acido cloridrico (HCl), che è essenziale non solo per l attività digestiva ma anche per l equilibrio acidobasico dell intero organismo. Infatti, le cellule parietali nel produrre HCl partecipano all equilibrio acido-basico generale con la produzione contestuale di altrettanto bicarbonato (HCO 3 - ), che viene riversato nel flusso sanguigno. Altre cellule della mucosa gastrica secernano muco, enzimi e molti altri fattori digestivi e non. A maggiore velocità di secrezione gastrica corrisponde maggiore acidità, ma fino al limite di concentrazione di HCl di 150 meq/l, sicuro limite d incolumità biologica. La secrezione parietale non contiene solo HCl, ma anche diversi cloruri (KCl, NaCl), che però diminuiscono man mano aumenta l acidità. Il meccanismo della produzione dell acido cloridrico più accreditato dai fisiologi è il seguente. Il citoplasma della cellula parietale funge da trasportatore di ioni Cl - ( oltre che di acqua e di vari cationi K +, Na +, ecc.) provenienti dal sangue verso i canalicoli ed il tubulo della cellula, ove avviene la sintesi dell acido cloridrico per la presenza di ioni H + secreti dalla stessa cellula parietale. Gli ioni H + deriverebbero dal processo d idrolisi della molecola d acqua nella cellula parietale secondo la seguente formula: H 2 O= H + + OH -. Lo ione H + esce dalla cellula scambiandosi con ioni K + e Na + diffusi nel canalicolo e qui si combina con Cl - diventando HCl (acido forte), che viene secreto nel lume gastrico. La base OH - si combina con la CO 2 presente nella cellula formando HCO 3 -, il quale viene immesso nel flusso sanguigno ove si combina con vari cationi (K +, Na +, Ca ++, Mg ++, ecc), determinando le migliori riserve alcaline ematiche. Sappiamo, quindi, dalla fisiologia che per la produzione dell acido cloridrico la cellula parietale ha bisogno di scambiare gli ioni H+ con dei cationi di minerali alcalini, che necessariamente devono essere introdotti con l alimentazione, che etimologicamente significa ciò che si porta al mento ossia cibo ed acqua.
8 Pertanto, se con l alimentazione (acqua e cibo) non introduciamo sufficienti quantità di minerali alcalini, avremo una carente produzione di acido cloridrico (ipocloridria), che paradossalmente ci procurerà acidità gastrica, derivante dalla fermentazione prodotta dalla maggiore permanenza del cibo nello stomaco e non dall eccesiva secrezione di HCl (ipercloridria). Come abbiamo visto precedentemente, la Natura ha predisposto un limite di sicurezza nella produzione di HCl. Lo studio della biochimica nutrizionale ci dimostra che l acqua, soprattutto se alcalina, ma anche i cibi alcalini, soprattutto se crudi e naturali, se masticati opportunamente, cedono più facilmente ed abbondantemente all organismo i cationi dei minerali alcalini, necessari, come abbiamo visto, per lo scambio con H+ ed apportano anche abbondanti ioni OH-, base necessaria per la produzione di bicarbonato. L attività digestiva è un processo biochimico complesso, che contempla non solo l acido cloridrico, ma anche enzimi, ormoni e vari fattori biochimici ed emotivi. La produzione di acido cloridrico è sotto induzione e controllo ormonale secondo il fabbisogno digestivo. Le cellule parietali non producono acido cloridrico, se non indotte dall introduzione di cibo da digerire, pur bevendo qualsiasi tipo e quantità di acqua. La produzione di HCl, come pure degli enzimi digestivi, è correlata al fabbisogno digestivo ed alla propria capacità secretiva. Infatti, la secrezione gastrica varia secondo la quantità e la qualità del cibo che ingeriamo. Pertanto, se mangiamo frutta e verdura non avverrà che una minima secrezione gastrica, mentre se mangiamo carne, pesce, uova, formaggi, cereali e legumi si verificherà un abbondante secrezione gastrica, a patto che le cellule parietali abbiano conservato la loro capacità funzionale e che l organismo possieda tutte le sostanze necessarie a bilanciare la produzione di HCl. Infatti, se lo stomaco non provvedesse alla corrispettiva produzione di bicarbonato necessario alle cellule mucose dello stomaco per difenderle dallo stesso acido cloridrico, indispensabile all attività del pancreas, del fegato e delle ghiandole alcalofile del duodeno e del tenue, il processo digestivo sarebbe incompleto e l equilibrio acido-basico generale dell organismo sarebbe presto compromesso.
9 L'ACQUA ALCALINA ELETTROENERGETICA IONIZZATA Bevendo qualsiasi quantità d acqua, anche se alcalina, le cellule parietali non saranno stimolate a produrre HCl, perché l acqua non necessita di essere digerita. L'Acqua alcalina non necessita di essere digerita Bevendo acqua, la concentrazione degli acidi presenti nello stomaco viene diluita momentaneamente, finché l acqua non viene riassorbita o eliminata completamente dallo stomaco. Se lo stomaco è vuoto, il suo riassorbimento sarà veloce ed il ph ritornerà ben presto al suo stato fisiologico precedente, ma senza nessun altra produzione di HCl, mentre se esso contiene cibo da digerire, le cellule parietali continueranno a produrre acido cloridrico proporzionalmente al tipo ed alla quantità di cibo ivi contenuto e l acqua con i suoi minerali, assieme ai minerali del cibo, contribuirà durante tutta la fase digestiva alla secrezione di HCl in proporzione alla quantità di bicarbonati e ioni minerali alcalini assorbiti dalla mucosa gastrica. E importante sapere che la capacità di assorbimento dell acqua da parte della parete gastrica nella fase secretiva è molto lenta, pertanto bere durante i pasti rallenta la digestione per effetto della diluizione dei succhi gastrici. Se l assunzione d acqua alcalina in sé stimolasse la produzione di HCl, più acqua si berrebbe, migliore sarebbe la digestione, ma sappiamo che ciò non è vero; come pure dovremmo avere bruciore di stomaco a fronte di assunzione di abbondanti quantità d acqua alcalina, ma vi assicuro che ciò non accade in condizioni di normalità organica. Quanto appena detto contraddice la convinzione di coloro che pensano che lo stomaco produce HCl sotto l induzione dell acqua alcalina. L assunzione di acqua non può stimolare la produzione immediata di acido cloridrico, perché questa funzione è correlata alla necessità di digerire il cibo: questa è la nostra fisiologia. Pertanto, bevendo acqua alcalina giammai si produrrà un eccesso di HCl nello stomaco, come alcuni critici vorrebbero far credere, mentre l assorbimento ematico di cationi alcalini e di ossigeno (OH - ), di cui l acqua alcalina abbonda, permetterà ai sistemi tampone sistemici e morfo-fisiologici di mantenere l equilibrio acido-basico e di permettere, al tempo opportuno, di produrre acido cloridrico. Il pregio dell acqua alcalina è quello di avere un abbondanza di molecole di idrossido di minerali alcalini ( es. KOH= K + + OH - ), che facilmente si scindono in ioni positivi e negativi, promuovendo un abbondante ed interessante attività REDOX, fondamentale per tutti i processi biochimici.
10 Se mai si riuscisse a bere tanta acqua alcalina da superare la capacità di riserva ematica dei minerali alcalini, questi sarebbero prontamente eliminati con l urina, come avviene naturalmente con l eliminazione dei minerali in eccesso presenti nell alimentazione quotidiana, della cui abbondanza non ci preoccupiamo. L'ACQUA ALCALINA ABBONDA IN NATURA L acqua potabile maggiormente disponibile per la vita animale, quindi anche nostra, è alcalina. Infatti, l acqua di mare è alcalina, l acqua dei fiumi, dei ruscelli, della maggior parte delle sorgenti, dei laghi e dei pozzi è alcalina. La Natura dispensa acqua acida con le piogge alle piante, mentre offre acqua alcalina agli animali ed agli uomini. Provate a mettere dei pesci in acqua acida e li vedrete ben presto morire. Non avrebbe avuto senso che la Natura ci avesse fornito di una fisiologia alcalina, come abbiamo visto, se poi non ci avesse dato l acqua ed il cibo necessari per soddisfare le esigenze fisiologiche. (Non è lo scopo di quest articolo quello di approfondire il tema dei cibi alcalini.) Dobbiamo riconoscere che la vita che conduciamo oggigiorno è molto distante dagli standard previsti dalla Natura per gli esseri umani. Anche questo argomento non rientra nelle motivazioni di questo articolo, anche se ci sarebbe molto da dire. Poiché la società tecnologica ci ha allontanato, un pò per forze maggiori, un pò per nostre scelte, dalle opportunità che la Natura ci offre, abbiamo la necessità di operare delle correzioni al nostro forsennato ed autolesionista stile di vita. Primaria importanza riveste il ruolo dell acqua nella nostra vita. Le fonti di approvvigionamento di acqua potabile sono sempre più inquinate da prodotti chimici e farmaci, oltre al fatto che stanno diventando proprietà private delle multinazionali. L inquinamento delle acque ha spinto l industria a costruire dei sistemi di purificazione tale da rendere più sicura l acqua potabile delle nostre case. V
11 L acqua alcalina ionizzata è un acqua viva, simile all acqua di sorgente perché la ionizzazione effettuata con l attuale tecnologia produce clusters d acqua molto più piccoli di ogni altra acqua potabile disponibile, permettendo una sua maggiore e più veloce penetrazione nella cellula. E importante comprendere la nozione di cluster. In natura non esiste una molecola d acqua isolata, bensì un determinato gruppo di molecole, unite da un legame elettromagnetico. La minore dimensione dei clusters dell acqua ionizzata agevolerà anche il trasporto di tutte le sostanze idrosolubili di cui la cellula necessita ed agevolerà il drenaggio dei cataboliti cellulari. Infatti, questi clusters possono avere un peso molecolare molto più piccolo (18) di altre molecole di grande importanza biologica come betacarotene (150), vitamina E (153), vitamina C (176). Un altra interessante caratteristica dell acqua alcalina ionizzata è la sua struttura molecolare cristallina, come ha dimostrato una ricerca di Masaru Emoto, che la rende viva. Dallo studio delle popolazioni più longeve al mondo si evince che queste popolazioni hanno come denominatore comune i seguenti fattori: - mangiano poco e con calma; - mangiano per lo più cibi alcalini ( frutta, verdura, cereali integrali), niente o pochi prodotti animali; - bevono acqua alcalina. Dopo queste osservazioni biochimiche, fisiologiche e sociologiche, mi sembrano alquanto sostenibili tutte quelle ricerche a favore dell acqua e dei cibi alcalini e non ci sono ragioni, se non faziose, per scoraggiare l uso dell acqua alcalina ionizzata da utilizzare sicuramente assieme a tutti gli altri fattori biologici che la Natura e la sana ricerca ci mette a disposizione.
Acqua e cibo alcalini perchè?
 Acqua e cibo alcalini perchè? Chiunque conosce un po di fisiologia umana sa che la biochimica del nostro corpo tende ad essere leggermente alcalina. Alcalino è anche e soprattutto il sangue arterioso,
Acqua e cibo alcalini perchè? Chiunque conosce un po di fisiologia umana sa che la biochimica del nostro corpo tende ad essere leggermente alcalina. Alcalino è anche e soprattutto il sangue arterioso,
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE
 FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
FISIOPATOLOGIA dell EQUILIBRIO ACIDO-BASE ACIDO = molecola contenente atomi di idrogeno capaci di rilasciare in soluzione ioni idrogeno (H( + ) BASE = ione o molecola che può accettare uno ione idrogeno
STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE
 STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE Dott. ssa Annalisa Caravaggi Biologo Nutrizionista sabato 15 febbraio 14 STRESS: Forma di adattamento dell organismo a stimoli chiamati STRESSOR.
STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE Dott. ssa Annalisa Caravaggi Biologo Nutrizionista sabato 15 febbraio 14 STRESS: Forma di adattamento dell organismo a stimoli chiamati STRESSOR.
la base del benessere ph Basic AIUTA L EQUILIBRIO ACIDO-BASE
 la base del benessere ph Basic AIUTA L EQUILIBRIO ACIDO-BASE Il ph è l unità di misura dell acidità che va da 0 (acido) a 14 (basico o alcalino). 7 è il valore neutro. Il metodo più facile per avere un
la base del benessere ph Basic AIUTA L EQUILIBRIO ACIDO-BASE Il ph è l unità di misura dell acidità che va da 0 (acido) a 14 (basico o alcalino). 7 è il valore neutro. Il metodo più facile per avere un
Mangiamo perché abbiamo bisogno di energia, di materiali con cui costruire il nostro corpo, di materiali per riparare parti del nostro corpo, di
 Mangiamo perché abbiamo bisogno di energia, di materiali con cui costruire il nostro corpo, di materiali per riparare parti del nostro corpo, di materiali per fare funzionare il nostro corpo È il carboidrato
Mangiamo perché abbiamo bisogno di energia, di materiali con cui costruire il nostro corpo, di materiali per riparare parti del nostro corpo, di materiali per fare funzionare il nostro corpo È il carboidrato
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Capitolo 7. Le soluzioni
 Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
IL VIAGGIO DEL CIBO. Quando arrivano nel corpo, gli alimenti compiono un lungo viaggio di trasformazione per diventare nutrienti.
 IL VIAGGIO DEL CIBO Quando arrivano nel corpo, gli alimenti compiono un lungo viaggio di trasformazione per diventare nutrienti. Dalla bocca passano nello stomaco e da qui all intestino per poi venire
IL VIAGGIO DEL CIBO Quando arrivano nel corpo, gli alimenti compiono un lungo viaggio di trasformazione per diventare nutrienti. Dalla bocca passano nello stomaco e da qui all intestino per poi venire
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ]
![Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ] Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ]](/thumbs/34/16945364.jpg) La molecola d acqua è un dipolo perché l atomo di ossigeno è molto elettronegativo ed attira più vicini a sé gli elettroni di legame. Questo, unito alla forma della molecola, produce un accumulo di carica
La molecola d acqua è un dipolo perché l atomo di ossigeno è molto elettronegativo ed attira più vicini a sé gli elettroni di legame. Questo, unito alla forma della molecola, produce un accumulo di carica
con la dissoluzione di rocce (magnesio, calcio, solfato, idrogeno) e altri elementi (CO2). Donat Written by l, d F Y H:i - Last Updated l, d F Y H:i
 Rogaška Slatina vanta una delle sorgenti più preziose in tutta Europa. Già da molti secoli viene scelta come meta da numerosi ospiti, che vogliono ripristinare nel proprio corpo l'equilibrio dei sali minerali
Rogaška Slatina vanta una delle sorgenti più preziose in tutta Europa. Già da molti secoli viene scelta come meta da numerosi ospiti, che vogliono ripristinare nel proprio corpo l'equilibrio dei sali minerali
Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas
 1 Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas Capitolo 7 Enzimi, le macchine della vita Piccole macchine regolano la funzione del corpo umano in un orchestrazione perfetta e a velocità
1 Tratto dal libro Come vivere 150 anni Dr. Dimitris Tsoukalas Capitolo 7 Enzimi, le macchine della vita Piccole macchine regolano la funzione del corpo umano in un orchestrazione perfetta e a velocità
SISTEMI ENERGETICI. L ATP privato di uno dei suoi 3 radicali fosforici diventa ADP (adenosindifosfato).
 SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
La digestione degli alimenti
 La digestione degli alimenti Le sostanze alimentari complesse (lipidi, glucidi, protidi) che vengono introdotte nell organismo, devono subire delle profonde modificazioni che le trasformano in sostanze
La digestione degli alimenti Le sostanze alimentari complesse (lipidi, glucidi, protidi) che vengono introdotte nell organismo, devono subire delle profonde modificazioni che le trasformano in sostanze
Acqua: nutriente essenziale
 Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
-assicurare il fabbisogno plastico necessario alla riparazione protezione e ricambio dei tessuti.
 Il principali compiti derivanti dall assunzione periodica di cibo sono: -assicurare il giusto fabbisogno energetico necessario alla vita ed all attività muscolare (tenendo conto che entrate ed uscite devono
Il principali compiti derivanti dall assunzione periodica di cibo sono: -assicurare il giusto fabbisogno energetico necessario alla vita ed all attività muscolare (tenendo conto che entrate ed uscite devono
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Il sale è un elemento fondamentale per l alimentazione umana ed è costituito da cloruro di sodio (NaCl). Una sua eccessiva introduzione però può
 Sale e salute Il sale è un elemento fondamentale per l alimentazione umana ed è costituito da cloruro di sodio (NaCl). Una sua eccessiva introduzione però può causare gravi problemi alla salute. La quantità
Sale e salute Il sale è un elemento fondamentale per l alimentazione umana ed è costituito da cloruro di sodio (NaCl). Una sua eccessiva introduzione però può causare gravi problemi alla salute. La quantità
GLI EFFETTI DELL ESERCIZIO IN ACQUA. Le risposte fisiologiche dell immersione
 GLI EFFETTI DELL ESERCIZIO IN ACQUA Le risposte fisiologiche dell immersione L acqua È importante che chi si occupa dell attività in acqua sappia che cosa essa provoca nell organismo EFFETTI DELL IMMERSIONE
GLI EFFETTI DELL ESERCIZIO IN ACQUA Le risposte fisiologiche dell immersione L acqua È importante che chi si occupa dell attività in acqua sappia che cosa essa provoca nell organismo EFFETTI DELL IMMERSIONE
ALIMENTAZIONE NELL UOMO
 ALIMENTAZIONE NELL UOMO Alimentazione e Nutrizione Corpo umano come macchina chimica che utilizza l energia chimica degli alimenti (quando si spezzano i legami chimici tra gli atomi che formano le macromolecole
ALIMENTAZIONE NELL UOMO Alimentazione e Nutrizione Corpo umano come macchina chimica che utilizza l energia chimica degli alimenti (quando si spezzano i legami chimici tra gli atomi che formano le macromolecole
Le proteine. Le proteine sono i mattoncini che costituiscono gli organismi viventi.
 Le proteine Le proteine sono i mattoncini che costituiscono gli organismi viventi. Per avere un idea più precisa, basti pensare che tutti i muscoli del nostro corpo sono composti da filamenti di proteine
Le proteine Le proteine sono i mattoncini che costituiscono gli organismi viventi. Per avere un idea più precisa, basti pensare che tutti i muscoli del nostro corpo sono composti da filamenti di proteine
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica
 Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Definizione
Fisiologia Renale 3. Equilibrio acido-base: Principi generali e fisico chimica Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Definizione
CO 2 aq l anidride carbonica disciolta, reagendo con l'acqua, forma acido carbonico secondo la reazione:
 DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
Capitolo 1. Dimagrimento e calo ponderale
 Introduzione Numerosi anni di esperienza nel settore Fitness come Personal Trainer mi hanno consentito di assistere ai meravigliosi e strabilianti mutamenti fisici di centinaia di persone; le loro manifestazioni
Introduzione Numerosi anni di esperienza nel settore Fitness come Personal Trainer mi hanno consentito di assistere ai meravigliosi e strabilianti mutamenti fisici di centinaia di persone; le loro manifestazioni
Alimentazione Fabbisogni 4.8
 08/2000 Alimentazione Fabbisogni 4.8 IL FOSFORO P di Cosmino Giovanni Basile Lo scheletro è la parte più ricca di fosforo di tutto l organismo. Nel tessuto osseo il P si trova sotto forma di fosfato tricalcico
08/2000 Alimentazione Fabbisogni 4.8 IL FOSFORO P di Cosmino Giovanni Basile Lo scheletro è la parte più ricca di fosforo di tutto l organismo. Nel tessuto osseo il P si trova sotto forma di fosfato tricalcico
SDD - Seconde Equilibrio e ph. Equilibrio e ph. Obiettivo
 1 Obiettivo Capire che cosa è il ph, apprendere le leggi fondamentali che lo controllano e capire qualitativamente le applicazioni delle soluzioni tampone. Prerequisiti Il concetto di equilibrio (che comunque
1 Obiettivo Capire che cosa è il ph, apprendere le leggi fondamentali che lo controllano e capire qualitativamente le applicazioni delle soluzioni tampone. Prerequisiti Il concetto di equilibrio (che comunque
È importante quindi conoscere le proprietà chimiche dell acqua. Le reazioni acido base sono particolari esempi di equilibrio chimico in fase acquosa
 Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Funzioni dello stomaco
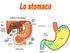 corpo antro Funzioni dello stomaco 1. Storage accumulo di cibo in seguito ad apertura del SEI 2. Mescolamento del cibo con le secrezioni gastriche fino a formare una poltiglia acida detta chimo 3. Digestione
corpo antro Funzioni dello stomaco 1. Storage accumulo di cibo in seguito ad apertura del SEI 2. Mescolamento del cibo con le secrezioni gastriche fino a formare una poltiglia acida detta chimo 3. Digestione
TEST BIOLOGIA 1 ANNO ABEI Da inviare a connesso@alice.it entro e non oltre il 6 novembre 2015
 1) I batteri sono organismi: a- bicellulari b- monocellulari c- pluricellulari 2) I virus: a- possono riprodursi solo nell acqua b- possono riprodursi solo sulla superficie di una cellula c- possono riprodursi
1) I batteri sono organismi: a- bicellulari b- monocellulari c- pluricellulari 2) I virus: a- possono riprodursi solo nell acqua b- possono riprodursi solo sulla superficie di una cellula c- possono riprodursi
DA MADRE. Èla madre che -
 DA MADRE a figlio 2 Èla madre che - durante la gravidanza e l allattamento - dona al figlio tutto il calcio necessario a formare lo scheletro. Durante la gravidanza, soprattutto nel terzo trimestre, il
DA MADRE a figlio 2 Èla madre che - durante la gravidanza e l allattamento - dona al figlio tutto il calcio necessario a formare lo scheletro. Durante la gravidanza, soprattutto nel terzo trimestre, il
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY
 DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido
 Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido extracellulare e dalla loro regolazione. Membrana cellulare Ogni cellula presenta
Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido extracellulare e dalla loro regolazione. Membrana cellulare Ogni cellula presenta
STOMACO. A livello dello stomaco si verifica un limitato assorbimento di alimenti, soprattutto di acqua, di alcuni sali, di alcool e di alcuni farmaci
 STOMACO Nel loro insieme i secreti delle ghiandole formano il succo gastrico, fortemente acido (ph circa 1). Nella mucosa gastrica sono disposte tra le ghiandole cellule mucose, che producono un muco che
STOMACO Nel loro insieme i secreti delle ghiandole formano il succo gastrico, fortemente acido (ph circa 1). Nella mucosa gastrica sono disposte tra le ghiandole cellule mucose, che producono un muco che
A cosa serve lo iodio?
 Iodio e Salute Che cos è lo iodio? Lo iodio, dal greco iodes (violetto), è un elemento (come l ossigeno, l idrogeno, il calcio ecc) diffuso nell ambiente in diverse forme chimiche. Lo iodio presente nelle
Iodio e Salute Che cos è lo iodio? Lo iodio, dal greco iodes (violetto), è un elemento (come l ossigeno, l idrogeno, il calcio ecc) diffuso nell ambiente in diverse forme chimiche. Lo iodio presente nelle
 L'Alimentazione (principi alimentari e consigli) Una Sana Alimentazione Ogni essere vivente introduce cibo nell'organismo: questo processo prende il nome di ALIMENTAZIONE. Introdurre cibo nel nostro corpo
L'Alimentazione (principi alimentari e consigli) Una Sana Alimentazione Ogni essere vivente introduce cibo nell'organismo: questo processo prende il nome di ALIMENTAZIONE. Introdurre cibo nel nostro corpo
PERCORSO DIDATTICO per conoscerla e rispettarla
 PERCORSO DIDATTICO per conoscerla e rispettarla Acqua in Tavola Scuole Elementari Nome del Gruppo Classe L acqua è un bene molto prezioso non solo per la vita di piante e animali ma anche per la nostra!
PERCORSO DIDATTICO per conoscerla e rispettarla Acqua in Tavola Scuole Elementari Nome del Gruppo Classe L acqua è un bene molto prezioso non solo per la vita di piante e animali ma anche per la nostra!
La percentuale massa/volume (%m/v) indica la quantità di soluto espressa in grammi presente in 100 ml di soluzione.
 La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
I L I P I D I. Lipidi complessi: fosfolipidi e glicolipidi; sono formati da CHO e altre sostanze.
 I L I P I D I ASPETTI GENERALI I Lipidi o grassi sono la riserva energetica del nostro organismo; nel corpo umano costituiscono mediamente il 17% del peso corporeo dove formano il tessuto adiposo. In generale
I L I P I D I ASPETTI GENERALI I Lipidi o grassi sono la riserva energetica del nostro organismo; nel corpo umano costituiscono mediamente il 17% del peso corporeo dove formano il tessuto adiposo. In generale
LE SOLUZIONI 1.molarità
 LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
L APPARATO DIGERENTE. un laboratorio chimico naturale
 L APPARATO DIGERENTE un laboratorio chimico naturale Come fa il nostro organismo a sfruttare i principi nutritivi nascosti nel cibo? Il nostro apparato digerente, attraverso la digestione, demolisce le
L APPARATO DIGERENTE un laboratorio chimico naturale Come fa il nostro organismo a sfruttare i principi nutritivi nascosti nel cibo? Il nostro apparato digerente, attraverso la digestione, demolisce le
K [H 2 O] 2 = K w = [H 3 O + ][OH ]
![K [H 2 O] 2 = K w = [H 3 O + ][OH ] K [H 2 O] 2 = K w = [H 3 O + ][OH ]](/thumbs/27/10717050.jpg) Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
Autoionizzazione dell acqua L acqua pura allo stato liquido è un debole elettrolita anfiprotico. L equilibrio di dissociazione è: 2H 2 O H 3 O + + OH - [H 3 O + ][OH ] K = [H 2 O] 2 Con K
Base di lavoro. Idea principale
 Base di lavoro Idea principale «Gli esseri viventi vivono in relazione tra loro e con l ambiente che li ospita, all interno di particolari ecosistemi dotati di un equilibrio ben preciso. Tutti gli organismi
Base di lavoro Idea principale «Gli esseri viventi vivono in relazione tra loro e con l ambiente che li ospita, all interno di particolari ecosistemi dotati di un equilibrio ben preciso. Tutti gli organismi
SCUOLA PRIMARIA CURRICOLO DI SCIENZE CLASSE PRIMA. INDICATORI COMPETENZE ABILITA CONOSCENZE 1. Esplorare e descrivere oggetti e materiali
 SCUOLA PRIMARIA CURRICOLO DI SCIENZE CLASSE PRIMA INDICATORI 1. Esplorare e descrivere oggetti e materiali 2. Osservare e sperimentare sul campo Sviluppa atteggiamenti di curiosità verso il mondo circostante
SCUOLA PRIMARIA CURRICOLO DI SCIENZE CLASSE PRIMA INDICATORI 1. Esplorare e descrivere oggetti e materiali 2. Osservare e sperimentare sul campo Sviluppa atteggiamenti di curiosità verso il mondo circostante
LA MATERIA Suggerimenti didattici e schede
 LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
OMEOSTASI DELLA TEMPERATURA CORPOREA
 OMEOSTASI DELLA TEMPERATURA CORPOREA Ruolo fisiologico del calcio Omeostasi del calcio ASSORBIMENTO INTESTINALE DEL CALCIO OMEOSTASI GLICEMICA Il livello normale di glicemia? 90 mg/100 ml Pancreas
OMEOSTASI DELLA TEMPERATURA CORPOREA Ruolo fisiologico del calcio Omeostasi del calcio ASSORBIMENTO INTESTINALE DEL CALCIO OMEOSTASI GLICEMICA Il livello normale di glicemia? 90 mg/100 ml Pancreas
www.fondazionedamico.org
 www.fondazionedamico.org COSA SONO Sono due organi situati nell addome, a forma di fagiolo, grandi poco più di un pugno, collegati alla vescica da un condotto chiamato uretere. L urina prodotta dai due
www.fondazionedamico.org COSA SONO Sono due organi situati nell addome, a forma di fagiolo, grandi poco più di un pugno, collegati alla vescica da un condotto chiamato uretere. L urina prodotta dai due
Analisi delle acque dell isola di Favignana
 Analisi delle acque dell isola di Favignana Durante le attività svolte al campo scuola nell ambito del progetto Un mare di.. risorse, il nostro gruppo si è occupato di analizzare le acque del mare in diversi
Analisi delle acque dell isola di Favignana Durante le attività svolte al campo scuola nell ambito del progetto Un mare di.. risorse, il nostro gruppo si è occupato di analizzare le acque del mare in diversi
CONOSCERE IL PROPRIO CORPO
 CONOSCERE IL PROPRIO CORPO Gli esseri viventi sono fatti di parti che funzionano assieme in modo diverso. Hanno parti diverse che fanno cose diverse. Il tuo corpo è fatto di molte parti diverse. Alcune
CONOSCERE IL PROPRIO CORPO Gli esseri viventi sono fatti di parti che funzionano assieme in modo diverso. Hanno parti diverse che fanno cose diverse. Il tuo corpo è fatto di molte parti diverse. Alcune
IL ph E I RELATIVI CALCOLI: UN APPROCCIO DIDATTICO
 IL ph E I RELATIVI CALCOLI: UN APPROCCIO DIDATTICO G. Giacomo Guilizzoni Rivista: «Didattica delle Scienze» 4/1995 Gli insegnanti di chimica, durante l esposizione dei concetti fondamentali di acidità
IL ph E I RELATIVI CALCOLI: UN APPROCCIO DIDATTICO G. Giacomo Guilizzoni Rivista: «Didattica delle Scienze» 4/1995 Gli insegnanti di chimica, durante l esposizione dei concetti fondamentali di acidità
A livello della loro struttura chimica, come i grassi, anche i carboidrati sono composti ternari, formati cioè da tre molecole:
 I carboidrati costituiscono la fonte di energia principale per lo svolgimento di tutte le funzioni organiche (mantenimento della temperatura corporea, battito cardiaco, funzioni cerebrali, digestione,
I carboidrati costituiscono la fonte di energia principale per lo svolgimento di tutte le funzioni organiche (mantenimento della temperatura corporea, battito cardiaco, funzioni cerebrali, digestione,
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
I macronutrienti. Nutrizione e Vita di Gallo dr Ubaldo - info@italianutrizione.it
 I macronutrienti 1 Ogni alimento può essere composto da: Carboidrati Proteine Grassi Questi sono conosciuti come macronutrienti 2 Il cibo va forse valutato solo in funzione del suo apporto calorico? ASSOLUTAMENTE
I macronutrienti 1 Ogni alimento può essere composto da: Carboidrati Proteine Grassi Questi sono conosciuti come macronutrienti 2 Il cibo va forse valutato solo in funzione del suo apporto calorico? ASSOLUTAMENTE
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
4. Conoscere il proprio corpo
 4. Conoscere il proprio corpo Gli esseri viventi sono fatti di parti che funzionano assieme in modo diverso. Hanno parti diverse che fanno cose diverse. Il tuo corpo è fatto di molte parti diverse. Alcune
4. Conoscere il proprio corpo Gli esseri viventi sono fatti di parti che funzionano assieme in modo diverso. Hanno parti diverse che fanno cose diverse. Il tuo corpo è fatto di molte parti diverse. Alcune
Quanto dura l effetto. Limite di età A partire dai 12 anni A partire dai 18 anni. Dove agisce. Modalità d assunzione
 Bruciore di stomaco? La conoscete? È quella sensazione bruciante dietro lo sterno, ad es. dopo aver mangiato determinati cibi o in situazioni di stress. Oppure quel liquido dal sapore acido o salato, nella
Bruciore di stomaco? La conoscete? È quella sensazione bruciante dietro lo sterno, ad es. dopo aver mangiato determinati cibi o in situazioni di stress. Oppure quel liquido dal sapore acido o salato, nella
SCALA DEI PESI ATOMICI RELATIVI E MEDI
 SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
FIACCHEZZA, STANCHEZZA, MALESSERE MORALE. Carenza di ferro molto diffusa e spesso sottovalutata
 FIACCHEZZA, STANCHEZZA, MALESSERE MORALE Carenza di ferro molto diffusa e spesso sottovalutata Cari pazienti! Vi sentite spesso fiacchi, stanchi, esauriti o giù di morale? Soffrite facilmente il freddo?
FIACCHEZZA, STANCHEZZA, MALESSERE MORALE Carenza di ferro molto diffusa e spesso sottovalutata Cari pazienti! Vi sentite spesso fiacchi, stanchi, esauriti o giù di morale? Soffrite facilmente il freddo?
Il bilanciamento delle reazioni chimiche
 1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
Istituto Comprensivo Castelverde - ROMA. Anno scolastico 2013/2014. Dott.sse Valeria Morena e patrizia leggeri
 PROGETTO FORMATIVO DI EDUCAZIONE ALIMENTARE Istituto Comprensivo Castelverde - ROMA Anno scolastico 2013/2014 DI UNA SANA E CORRETTA ALIMENTAZIONE Dott.sse Valeria Morena e patrizia leggeri Istituto Zooprofilattico
PROGETTO FORMATIVO DI EDUCAZIONE ALIMENTARE Istituto Comprensivo Castelverde - ROMA Anno scolastico 2013/2014 DI UNA SANA E CORRETTA ALIMENTAZIONE Dott.sse Valeria Morena e patrizia leggeri Istituto Zooprofilattico
Elettrolita forte = specie chimica che in soluzione si dissocia completamente (l equilibrio di dissociazione è completamente spostato verso destra)
 A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
L'IMPORTANZA DELL'ACQUA
 L'IMPORTANZA DELL'ACQUA L'acqua è il principale costituente del nostro corpo. Alla nascita il 90% del nostro peso è composto di acqua: nell'adulto è circa il 75% e nelle persone anziane circa il 50%; quindi
L'IMPORTANZA DELL'ACQUA L'acqua è il principale costituente del nostro corpo. Alla nascita il 90% del nostro peso è composto di acqua: nell'adulto è circa il 75% e nelle persone anziane circa il 50%; quindi
Dopo EXPO, il futuro dell educazione alimentare nella scuola. Dott.ssa Evelina Flachi Presidente Food Education Italy
 Dopo EXPO, il futuro dell educazione alimentare nella scuola Dott.ssa Evelina Flachi Presidente Food Education Italy Nel passato sono stati molti e forse troppi i soggetti che hanno promosso un educazione
Dopo EXPO, il futuro dell educazione alimentare nella scuola Dott.ssa Evelina Flachi Presidente Food Education Italy Nel passato sono stati molti e forse troppi i soggetti che hanno promosso un educazione
Perché il logaritmo è così importante?
 Esempio 1. Perché il logaritmo è così importante? (concentrazione di ioni di idrogeno in una soluzione, il ph) Un sistema solido o liquido, costituito da due o più componenti, (sale disciolto nell'acqua),
Esempio 1. Perché il logaritmo è così importante? (concentrazione di ioni di idrogeno in una soluzione, il ph) Un sistema solido o liquido, costituito da due o più componenti, (sale disciolto nell'acqua),
Breve guida per il paziente con insufficienza renale cronica
 Quando l insufficienza renale ti fa perdere l equilibrio, Fosforo Calcio cosa puoi fare per controllare il fosforo Breve guida per il paziente con insufficienza renale cronica ASSOCIAZIONE NAZIONALE EMODIALIZZATI
Quando l insufficienza renale ti fa perdere l equilibrio, Fosforo Calcio cosa puoi fare per controllare il fosforo Breve guida per il paziente con insufficienza renale cronica ASSOCIAZIONE NAZIONALE EMODIALIZZATI
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3. Idrolisi salina Soluzioni tampone Titolazioni acido-base
 Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
ASPETTI TERMODINAMICI DEI SISTEMI BIOLOGICI
 ASPETTI TERMODINAMICI DEI SISTEMI BIOLOGICI Sistemi biologici: soggetti a complessi processi di trasformazione e scambio di energia; I sistemi biologici sono costituiti perlopiù da quattro elementi: H,
ASPETTI TERMODINAMICI DEI SISTEMI BIOLOGICI Sistemi biologici: soggetti a complessi processi di trasformazione e scambio di energia; I sistemi biologici sono costituiti perlopiù da quattro elementi: H,
L apparato digerente
 L apparato digerente Distinguiamo le due fasi: DIGESTIONE e ASSORBIMENTO. Attraverso la digestione facciamo entrare i cibi nel nostro corpo, li spezziamo in molecole più piccole; con l assorbimento forniamo
L apparato digerente Distinguiamo le due fasi: DIGESTIONE e ASSORBIMENTO. Attraverso la digestione facciamo entrare i cibi nel nostro corpo, li spezziamo in molecole più piccole; con l assorbimento forniamo
Gli Alimenti Classificazione degli alimenti Alimenti semplici o principi alimentari o principi nutritivi o nutrienti inorganici organici
 Prof. Carlo Carrisi Gli Alimenti Classificazione degli alimenti Alimenti semplici o principi alimentari o principi nutritivi o nutrienti: servono a nutrire l organismo, derivano dalla digestione, vengono
Prof. Carlo Carrisi Gli Alimenti Classificazione degli alimenti Alimenti semplici o principi alimentari o principi nutritivi o nutrienti: servono a nutrire l organismo, derivano dalla digestione, vengono
Lo stomaco è suddiviso in quattro regioni:
 Lo stomaco comunica con l'esofago attraverso il cardias, e con l'intestino tenue attraverso il pil oro. Situato nella parte superiore sinistra della cavità addominale, lo stomaco è una dilatazione del
Lo stomaco comunica con l'esofago attraverso il cardias, e con l'intestino tenue attraverso il pil oro. Situato nella parte superiore sinistra della cavità addominale, lo stomaco è una dilatazione del
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
www.goherb.eu PERSONAL WELLNESS COACH
 L evoluzione della nutrizione negli ultimi decenni accompagna effetti nutrizionali positivi ma anche negativi! Gli scienziati hanno constatato una diminuzione della DENSITÁ delle vitamine e i minerali
L evoluzione della nutrizione negli ultimi decenni accompagna effetti nutrizionali positivi ma anche negativi! Gli scienziati hanno constatato una diminuzione della DENSITÁ delle vitamine e i minerali
1 a esperienza: il lievito produce anidride carbonica in presenza di zucchero
 1 a esperienza: il lievito produce anidride carbonica in presenza di zucchero DOMANDA DESTINATARI MATERIALE OCCORRENTE DESCRIZIONE DELL ESPERIMENTO La formazione di gas avviene in assenza di zucchero?
1 a esperienza: il lievito produce anidride carbonica in presenza di zucchero DOMANDA DESTINATARI MATERIALE OCCORRENTE DESCRIZIONE DELL ESPERIMENTO La formazione di gas avviene in assenza di zucchero?
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
OSSIGENO DISCIOLTO ED EUTROFIZZAZIONE
 OSSIGENO DISCIOLTO ED EUTROFIZZAZIONE Un esempio di misure di ossigeno e ph in acque contenenti piante acquatiche (alla luce e al buio) Misura (con un ossimetro) dell ossigeno disciolto all inizio di un
OSSIGENO DISCIOLTO ED EUTROFIZZAZIONE Un esempio di misure di ossigeno e ph in acque contenenti piante acquatiche (alla luce e al buio) Misura (con un ossimetro) dell ossigeno disciolto all inizio di un
OSS Acidi e Basi. Acidi e basi. Il concetto di equilibrio:
 1 Acidi e basi Il concetto di equilibrio: Le reazioni chimiche sono generalmente irreversibili (non si può tornare alla situazione di partenza). Un esempio semplificato potrebbe essere il seguente: quando
1 Acidi e basi Il concetto di equilibrio: Le reazioni chimiche sono generalmente irreversibili (non si può tornare alla situazione di partenza). Un esempio semplificato potrebbe essere il seguente: quando
Polipi precancerosi. Circa il 50% delle persone dai 60 anni in su avrà nel corso della vita almeno 1 polipo precanceroso di 1 cm o più di diametro.
 Polipi precancerosi I polipi sono piccole escrescenze dovute ad una proliferazione eccessiva delle cellule sane della mucosa intestinale che può causare lo sviluppo di polipi cosiddetti adenomatosi (anche
Polipi precancerosi I polipi sono piccole escrescenze dovute ad una proliferazione eccessiva delle cellule sane della mucosa intestinale che può causare lo sviluppo di polipi cosiddetti adenomatosi (anche
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
ph = log 1/[H+] = - log [H+]
![ph = log 1/[H+] = - log [H+] ph = log 1/[H+] = - log [H+]](/thumbs/34/16948015.jpg) ph = log 1/[H+] = log [H+] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = inizio 7,36 max 6.8) ph superiori = alcalosi (limite ph inizio 7,44 max 7.8) ph intracellulare
ph = log 1/[H+] = log [H+] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = inizio 7,36 max 6.8) ph superiori = alcalosi (limite ph inizio 7,44 max 7.8) ph intracellulare
DIPARTIMENTO DI SCIENZE INTEGRATE CHIMICA FISICA SCIENZE DELLA TERRA - BIOLOGIA
 IISS A. De Pace Lecce A.S. 2012-2013 DIPARTIMENTO DI SCIENZE INTEGRATE FISICA SCIENZE DELLA TERRA - BIOLOGIA PIANI DI STUDIO DELLE DISCIPLINE SECONDO ANNO Piano di studi della disciplina DESCRIZIONE Lo
IISS A. De Pace Lecce A.S. 2012-2013 DIPARTIMENTO DI SCIENZE INTEGRATE FISICA SCIENZE DELLA TERRA - BIOLOGIA PIANI DI STUDIO DELLE DISCIPLINE SECONDO ANNO Piano di studi della disciplina DESCRIZIONE Lo
Hanno partecipato. Ferrara Maria Piera. Serino Livia. Grafica a cura di. Serino Livia
 Hanno partecipato Ferrara Maria Piera Serino Livia Grafica a cura di Serino Livia Alimentazione e stili di vita Un incontro di grande interesse su un tema estremamente attuale. Giovedì 23 aprile alle 9.30
Hanno partecipato Ferrara Maria Piera Serino Livia Grafica a cura di Serino Livia Alimentazione e stili di vita Un incontro di grande interesse su un tema estremamente attuale. Giovedì 23 aprile alle 9.30
Istituto di Istruzione Superiore L. da Vinci Civitanova Marche. Anno scolastico 2014-2015. Programma svolto. Docente: Silvana Venditti
 Anno scolastico 2014-2015 Programma svolto Docente: Silvana Venditti Disciplina: Scienze Naturali Classe : IV sez. E - Indirizzo Linguistico ARTICOLAZIONE DEI CONTENUTI E DEGLI OBIETTIVI SECONDO UNITA
Anno scolastico 2014-2015 Programma svolto Docente: Silvana Venditti Disciplina: Scienze Naturali Classe : IV sez. E - Indirizzo Linguistico ARTICOLAZIONE DEI CONTENUTI E DEGLI OBIETTIVI SECONDO UNITA
Mais, riso, patate, granozucchero di canna o barbabietola Latte da zucchero Polisaccaride Amido - - Disaccaride Maltosio Saccarosio Lattosio
 Abbiamo visto che i carboidrati sono la principale fonte di energia nell'alimentazione umana. Nella nostra dieta, sono sopratutto presenti nella forma di amido, ma anche il saccarosio è presente in una
Abbiamo visto che i carboidrati sono la principale fonte di energia nell'alimentazione umana. Nella nostra dieta, sono sopratutto presenti nella forma di amido, ma anche il saccarosio è presente in una
PERCHE DIABETE MELLITO?
 PERCHE DIABETE MELLITO? La definizione di Diabete Mellito la si deve al medico inglese Willis, che nella seconda metà del XVIII secolo, scoprì, assaggiando l urina dei diabetici, che essa era dolce come
PERCHE DIABETE MELLITO? La definizione di Diabete Mellito la si deve al medico inglese Willis, che nella seconda metà del XVIII secolo, scoprì, assaggiando l urina dei diabetici, che essa era dolce come
SUPERALIMENTI ERBA D ORZO. www.nutrizionemotivazione.it
 SUPERALIMENTI ERBA D ORZO SUPERALIMENTI Erba d orzo Febbraio 2013 Realizzato in Italia Copyright 2013 nutrizionemotivazione.it Versione 1 (documento soggetto ad aggiornamento periodico) Tutti i diritti
SUPERALIMENTI ERBA D ORZO SUPERALIMENTI Erba d orzo Febbraio 2013 Realizzato in Italia Copyright 2013 nutrizionemotivazione.it Versione 1 (documento soggetto ad aggiornamento periodico) Tutti i diritti
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B
 Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
ITIS Castelli - Dipartimento di Chimica - a.s. 2010/11
 1 Nei laboratori di Chimica dell I.T.I.S. Castelli di Brescia sono stati eseguiti dei test miranti a determinare il residuo di calcinazione (cenere) sui campioni di lolla di riso puri o addizionati con
1 Nei laboratori di Chimica dell I.T.I.S. Castelli di Brescia sono stati eseguiti dei test miranti a determinare il residuo di calcinazione (cenere) sui campioni di lolla di riso puri o addizionati con
Classificazione della materia: Sostanze pure e miscugli
 Classificazione della materia: Sostanze pure e miscugli la composizione e quindi le proprietà intensive sono le stesse in ogni parte del sistema La composizione e le proprietà intensive variano da una
Classificazione della materia: Sostanze pure e miscugli la composizione e quindi le proprietà intensive sono le stesse in ogni parte del sistema La composizione e le proprietà intensive variano da una
CURRICOLO IN VERTICALE di SCIENZE SCUOLA SECONDARIA DI PRIMO GRADO CLASSE SECONDA
 CURRICOLO IN VERTICALE di SCIENZE SCUOLA SECONDARIA DI PRIMO GRADO CLASSE SECONDA SAPERI CONTENUTI Fisica: - La Luce - Le onde e i suoni - Meccanica (forze, leve, moti) Chimica: - Principi di chimica generale
CURRICOLO IN VERTICALE di SCIENZE SCUOLA SECONDARIA DI PRIMO GRADO CLASSE SECONDA SAPERI CONTENUTI Fisica: - La Luce - Le onde e i suoni - Meccanica (forze, leve, moti) Chimica: - Principi di chimica generale
4 3 4 = 4 x 10 2 + 3 x 10 1 + 4 x 10 0 aaa 10 2 10 1 10 0
 Rappresentazione dei numeri I numeri che siamo abituati ad utilizzare sono espressi utilizzando il sistema di numerazione decimale, che si chiama così perché utilizza 0 cifre (0,,2,3,4,5,6,7,8,9). Si dice
Rappresentazione dei numeri I numeri che siamo abituati ad utilizzare sono espressi utilizzando il sistema di numerazione decimale, che si chiama così perché utilizza 0 cifre (0,,2,3,4,5,6,7,8,9). Si dice
L APPARATO DIGERENTE. E formato da un insieme di organi e di strutture che servono a TRASFORMARE ( cioè DIGERIRE) gli alimenti per poterli ASSORBIRE.
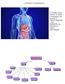 L APPARATO DIGERENTE E formato da un insieme di organi e di strutture che servono a TRASFORMARE ( cioè DIGERIRE) gli alimenti per poterli ASSORBIRE. Disegno molto semplificato ma efficace che rende bene
L APPARATO DIGERENTE E formato da un insieme di organi e di strutture che servono a TRASFORMARE ( cioè DIGERIRE) gli alimenti per poterli ASSORBIRE. Disegno molto semplificato ma efficace che rende bene
Termodinamica. Sistema termodinamico. Piano di Clapeyron. Sistema termodinamico. Esempio. Cosa è la termodinamica? TERMODINAMICA
 Termodinamica TERMODINAMICA Cosa è la termodinamica? La termodinamica studia la conversione del calore in lavoro meccanico Prof Crosetto Silvio 2 Prof Crosetto Silvio Il motore dell automobile trasforma
Termodinamica TERMODINAMICA Cosa è la termodinamica? La termodinamica studia la conversione del calore in lavoro meccanico Prof Crosetto Silvio 2 Prof Crosetto Silvio Il motore dell automobile trasforma
Alterazioni equilibrio acidobase
 Alterazioni equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Acidosi: rapporto HCO 3 /CO 2 ph. Se diminuzione dipende da: HCO 3 acidosi metabolica (nonrespiratoria)
Alterazioni equilibrio acidobase In base all equazione di HendersonHasselbalch ph = pk+ log [HCO 3 ] [CO 2 ] Acidosi: rapporto HCO 3 /CO 2 ph. Se diminuzione dipende da: HCO 3 acidosi metabolica (nonrespiratoria)
INDICE DI MASSA CORPOREA significato ed interpretazione
 INDICE DI MASSA CORPOREA significato ed interpretazione Sembrerà strano ma essere in sovrappeso non necessariamente significa avere grasso in eccesso; allo stesso modo essere normopeso non è sinonimo di
INDICE DI MASSA CORPOREA significato ed interpretazione Sembrerà strano ma essere in sovrappeso non necessariamente significa avere grasso in eccesso; allo stesso modo essere normopeso non è sinonimo di
ALIMENTAZIONE dell ATLETA. Sergio Crescenzi Gianfranco Colombo Antonio De Pascale
 ALIMENTAZIONE dell ATLETA Sergio Crescenzi Gianfranco Colombo Antonio De Pascale A CHE SERVE MANGIARE? Gli alimenti ci forniscono l energia per muoverci, per respirare,per il battito cardiaco, per il funzionamento
ALIMENTAZIONE dell ATLETA Sergio Crescenzi Gianfranco Colombo Antonio De Pascale A CHE SERVE MANGIARE? Gli alimenti ci forniscono l energia per muoverci, per respirare,per il battito cardiaco, per il funzionamento
DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto:
 Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Fisiologia Renale 5. Equilibrio acido-base: Fisiologia e fisiopatologia
 Fisiologia Renale 5. Equilibrio acidobase: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Produzione e bilancio
Fisiologia Renale 5. Equilibrio acidobase: Fisiologia e fisiopatologia Fisiologia Generale e dell Esercizio Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Produzione e bilancio
LA RISPOSTA ALL INSULINA NON E UGUALE PER TUTTI NOTA BENE: DOPO QUESTO ARTICOLO VI DARO IL MENU DI PAOLINO.
 LA RISPOSTA ALL INSULINA NON E UGUALE PER TUTTI NOTA BENE: DOPO QUESTO ARTICOLO VI DARO IL MENU DI PAOLINO.. MA SE AVRETE LETTO QUANTO SCRITTO FINORA, CAPIRETE ANCHE PERCHE PAOLINO MANGIA COSI. Ma soprattutto
LA RISPOSTA ALL INSULINA NON E UGUALE PER TUTTI NOTA BENE: DOPO QUESTO ARTICOLO VI DARO IL MENU DI PAOLINO.. MA SE AVRETE LETTO QUANTO SCRITTO FINORA, CAPIRETE ANCHE PERCHE PAOLINO MANGIA COSI. Ma soprattutto
2) Calcolare la molarità di una soluzione di acido solforico al 17%,d = 1.12 g/ml
 Bari,11 gennaio 1999 Compito di analisi dei farmaci I 1) 1 ml di H 2 O 2 viene titolato con KMnO 4. Sono necessari 18.1 ml. La soluzione di KMnO 4 è 0.1023 N e la densità dell acqua ossigenata è 1.01 g/ml.
Bari,11 gennaio 1999 Compito di analisi dei farmaci I 1) 1 ml di H 2 O 2 viene titolato con KMnO 4. Sono necessari 18.1 ml. La soluzione di KMnO 4 è 0.1023 N e la densità dell acqua ossigenata è 1.01 g/ml.
COS E IL DIABETE. Il diabete questo mondo sconosciuto:
 ASSOCIAZIONE DIABETICI DEL MEDIOBRENTA AULSS n.15 C.A.D. - Cittadella 35013 (Zona Pontarolo) Tel.049/9424646 Cod. Fisc. 90003450286 Associazione di Volontariato Sanitario 2 COS E IL DIABETE Il diabete
ASSOCIAZIONE DIABETICI DEL MEDIOBRENTA AULSS n.15 C.A.D. - Cittadella 35013 (Zona Pontarolo) Tel.049/9424646 Cod. Fisc. 90003450286 Associazione di Volontariato Sanitario 2 COS E IL DIABETE Il diabete
