Rita Giovannetti. Chimica dell'ambiente
|
|
|
- Saverio Bernardini
- 8 anni fa
- Visualizzazioni
Transcript
1 Chimica ambientale Rita Giovannetti
2 Distruzione dello strato di ozono L equilibrio fotochimico relativo alla produzione-distruzione distruzione dell ozono stratosferico è soggetto ad oscillazioni naturali legate all attività della parte più esterna del sole, al flusso di radiazione solare che raggiunge la stratosfera,
3 Distruzione dello strato di ozono Oltre al fenomeno naturale dovuto all assorbimento assorbimento delle radiazioni solari avviene attraverso un ciclo catalitico.
4 ALTRI MECCANISMI ALLA BASE DELLA DISTRUZIONE DELL OZONO: PROCESSI CATALITICI Esistono alcune specie atomiche e molecolari di tipo X (catalizzatori) che reagiscono efficacemente con O 3 sottraendo un atomo di ossigeno. X + O 3 XO +O 2 XO + O X +O 2 O 3 + O 2O 2
5 Chimicamente, tutti i catalizzatori di tipo X sono radicali liberi cioè atomi o molecole contenenti un numero dispari di elettroni. La distruzione catalitica di ozono si manifesta anche in atmosfera non inquinata poiché tali catalizzatori sono sempre presenti nell atmosfera. La specie chimica responsabile della maggior parte della distruzione dell ozono in un atmosfera non inquinata è la molecola dell ossido di azoto NO.
6 OH OH catalizzatore tipo X che svolge un ruolo fondamentale alla distruzione dell O 3 a quote superiori. E prodotto dalla reazione di atomi di ossigeno eccitati con molecole di acqua o metano: O* + CH 4 OH + CH 3 O* + H 2 O 2 OH
7 L ossido di azoto NO NO catalizzatore tipo X più importante nella parte centrale della stratosfera. E prodotto quando l ossido nitroso N 2 O che sale dalla troposfera alla stratosfera reagisce con atomi di ossigeno eccitati prodotti dalla decomposizione fotochimica dell O 3 : O* + N 2 O 2 NO NO + O 3 NO 2 + O 2 NO 2 + O NO + O 2 O 3 + O 2O 2
8 La decomposizione fotochimica dell O 3 da parte degli UV-B o dei catalizzatori di tipo X dipende dalla concentrazione dell ozono dall intensità della radiazione solare o dalla concentrazione del catalizzatore.
9 a parità di luce solare, la concentrazione O 3 aumenta fino a che la velocità di distruzione eguaglia quella di formazione: condizioni di STATO STRAZIONARIO.
10 CLORO E BROMO ATOMICI COME CATALIZZATORI DI TIPO X La decomposizione, nella stratosfera dei gas contenenti cloro, genera un continuo rifornimento di cloro con conseguente aumento del potenziale di distruzione dell ozono in questa regione.
11 CLORO E BROMO ATOMICI COME CATALIZZATORI DI TIPO X Le molecole di CH 3 Cl nella stratosfera: o decomposte dagli UV-C o attaccate dai radicali OH, per produrre in entrambi i casi cloro atomico Cl CH 3 Cl + hν (UV-C) Cl + CH 3 OH + CH 3 Cl Cl + altri prodotti
12 Gli atomi di cloro atomico Cl Sono efficienti catalizzatori di tipo X nella distruzione dell ozono: Cl + O 3 ClO + O 2 ClO + O Cl + O 2 O 3 + O 2 O 2
13 in ogni momento, tuttavia, il cloro presente (circa 99%) nella stratosfera si trova: ClONO 2 (gas cloronitrato): ClO + NO2 ClONO2 ClONO2 + hν (pochi giorni o ore) ClO + NO2 HCl Cl + CH4 HCl + CH3 forme attive OH + HCl H2O+ Cl
14 In natura vengono prodotte anche rilevanti quantità di metilbromuro CH 3 Br. Una parte di CH 3 Br può finire per raggiungere la stratosfera e decomporre fotochimicamente liberando bromo atomico Br. CH 3 Br + hν (UV-C) Br + CH 3 Br + O 3 BrO + O 2 Br forma attiva
15 Quasi tutto il bromo presente nella stratosfera rimane nella forma attiva!!! perché la reazione di formazione della forma inattiva HBr da bromo atomico Br e il metano CH 4 è molto lenta (endotermica) perché HBr è decomposto fotochimicamente.
16 In un confronto tra atomi Il bromo nella stratosfera è più efficiente del cloro nel distruggere l ozono ma la sua concentrazione è nettamente minore!!!
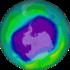
17 I buchi dell ozono Ogni anno l'ozono della stratosfera al di sopra dell'antartide si riduce fino al 50% per alcuni mesi soprattutto per azione del cloro: si forma un buco nello strato dell'ozono(dal 1979 ). può verificarsi da settembre all'inizio di novembre, i mesi che, al Polo sud, corrispondono alla primavera. le intense ricerche condotte alla fine degli anni '80 hanno permesso di chiarire la chimica di questo fenomeno.
18 I buchi dell ozono Il buco dell'ozono compare come effetto di particolari condizioni climatiche invernali nella bassa stratosfera, là dove di solito è maggiore la concentrazione dell'ozono; queste condizioni trasformano temporaneamente tutto il cloro presente nelle forme cataliticamente inattive HCl e CIONO 2, nelle forme attive Cl. e CIO. con provvisorio aumento delle specie chimiche attive con un'estesa, seppure temporanea, diminuzione dell'ozono.
19 I buchi dell ozono La conversione delle forme inattive del cloro in quelle attive avviene alla superficie di cristalli: formati da una soluzione di acqua e acido nitrico: da OH. e NO 2. gassosi. la condensazione di questi gas in goccioline liquide o in cristalli solidi di solito non si verifica nella stratosfera, dove la concentrazione dell'acqua è considerevolmente ridotta.
20 I buchi dell ozono Durante la notte polare Il consueto meccanismo di riscaldamento della stratosfera dovuto alla liberazione di calore nella reazione tra O 2 e O viene a mancare in conseguenza della mancata produzione di ossigeno atomico dall'o 2. Poiché la stratosfera al di sopra del Polo Sud diviene così fredda durante la notte polare della parte centrale dell'inverno, la pressione atmosferica cala nettamente come previsto dalla legge dei gas ideali, secondo cui essa è proporzionale alla temperatura espressa in gradi Kelvin.
21 I buchi dell ozono L effetto sulla pressione, la rotazione terrestre, producono un vortice: una massa di aria che ruota su sé stessa e in cui i venti possono superare la velocità di 300 km l'ora. Poiché in questo vortice non può entrare materia, l'aria contenuta al suo interno viene ad essere isolata e rimane molto fredda per mesi. Al Polo sud, il vortice si mantiene nella primavera (ottobre). Il vortice attorno al Polo nord di solito si interrompe a febbraio o all'inizio di marzo prima che in questa zona torni la massima luce solare.
22 I buchi dell ozono I cristalli prodotti dalla condensazione dei gas all'interno del vortice: formano le nubi polari stratosferiche, o PSC (polar stratospheric clouds). Quando la temperatura scende: i primi cristalli che si formano sono quelli del triidrato dell'acido nitrico, HNO 3 x 3H 2 O. Quando la temperatura dell'aria scende di poco sotto i - 80 C: si forma anche un altro tipo di cristalli, in cui il rapporto acqua/acido nitrico e le dimensioni sono maggiori.
23 I buchi dell ozono Schema illustrante la produzione di cloro molecolare dalle forme inattive, nella stratosfera, durante la primavera antartica.
24 I buchi dell ozono Durante i bui mesi invernali il cloro elementare si accumula diventando la specie chimica gassosa contenente cloro più abbondante. Quando ricompare il primo sole, all'inizio della primavera antartica, le molecole di Cl 2 vengono decomposte in cloro atomico ad opera della componente UV della luce: Cl 2 + luce UV 2 Cl.
25 I buchi dell ozono Allo stesso modo, la reazione di altre molecole di ClONO 2 con l'acqua contenuta nel tipo di cristalli di dimensioni maggiori produce HOCI che, per effetto della luce solare, si decompone in Cl.. e OH. : H 2 O (s)+ ClONO 2 (g) HOCl (g)+ HNO 3 (s) HOCl + luce UV OH. + Cl.
26 I buchi dell ozono i cristalli permangono mesi. gli atomi di cloro trasformati in HCl per reazione con molecole di metano vengono riconvertiti in Cl 2 sui cristalli in Cl. ad opera della luce solare. l'inattivazione del monossido di cloro per trasformazione in cloronitrato non si verifica fintantoché tutti i radicali NO., necessari per questa reazione non sono stati provvisoriamente legati ai cristalli in forma di acido nitrico.
27 I buchi dell ozono Molti dei cristalli di tipo più grande si spostano verso il basso, diretti nella parte superiore della tropo sfera, per effetto della gravità; durante questo spostamento, essi raccolgono i radicali NO 2. presenti nella parte inferiore della stratosfera al di sopra del Polo sud impedendo ulteriormente la disattivazione del cloro. Solo quando le PSC e il vortice si sono estinti il cloro può tornare prevalentemente nella forma inattiva.
28 I buchi dell ozono La liberazione di acido nitrico dai cristalli nella fase gassosa causa la trasformazione di questo acido in NO 2. per azione della luce solare: HNO 3 + luce UV NO 2. + OH. Inoltre quando, nella tarda primavera, il vortice si estingue, l'aria contenente NO. si mescola con quella polare. Il biossido di azoto si combina rapidamente con il monossido di cloro a formare il cloronitrato, cataliticamente inattivo.
29 I buchi dell ozono Poche settimane dopo che le PSC e il vortice sono scomparsi, i cicli di distruzione catalitica si arrestano e la concentrazione dell'ozono sale nuovamente fino ai normali livelli. L'effetto di tutto questo è che il buco dell'ozono si chiude per un altro anno. Prima che tutto questo accada, una parte della massa di aria povera di ozono può spostarsi dall'antartide mescolandosi con l'aria limitrofa, causando una temporanea diminuzione della concentrazione di ozono nella stratosfera in regioni geografiche vicine, quali l'australia, la Nuova Zelanda e le regioni più meridionali del Sud America.
30 I buchi dell ozono Il meccanismo chimico attraverso cui il cloro atomico catalizza la decomposizione dell'ozono negli strati inferiori della stratosfera sopra il Polo Sud inizia con la consueta reazione tra cloro e ozono: Tappa 1: Cl. + O 3 ClO. + O 2
31 I buchi dell ozono Concentrazione di ozono in funzione della latitudine in prossimità del polo Sud.
32 I buchi dell ozono A distanze sufficientemente grandi dal Polo sud (900 S), la concentrazione dell'ozono è relativamente elevata e quella del CIO. bassa, poiché il cloro si trova legato soprattutto nelle forme inattive. Avvicinandosi al Polo, la concentrazione di CIO. diviene improvvisamente alta si registra una netta riduzione di quella dell'o 3 : gran parte del cloro è stato attivato mentre la maggior parte dell'ozono è stato conseguentemente decomposto. La latitudine a cui cambiano nettamente entrambe le concentrazioni segna il confine del buco dell'ozono, che si estende attraverso il Polo sud.
33 I buchi dell ozono Nella parte inferiore della stratosfera la regione in cui si formano le PSC e le specie attivate del cloro la concentrazione degli atomi liberi di ossigeno è modesta; pochi atomi vengono prodotti in tale regione in conseguenza della scarsità delle radiazioni UV-C necessarie per dissociare l'o 2 gli atomi di ossigeno prodotti in questo modo collidono immediatamente con molecole di O 2 presenti in gran quantità, formando O 3. i meccanismi della distruzione dell'ozono basati sulla reazione O 3 + O 2 O 2 non appaiono importanti anche quando la reazione è catalizzata.
34 I buchi dell ozono le molecole di ClO. invece di reagire con l'ossigeno atomico: si combinano tra loro per formare dicloroperossido, ClOOCl (o Cl 2 O 2 ): Tappa 2: 2ClO. ClOOCl La velocità di questa reazione diviene importante ai fini della perdita dell'ozono poiché la concentrazione del monossido di cloro aumenta gradualmente in conseguenza dell'attivazione del cloro.
35 I buchi dell ozono Durante la primavera antartica, l'intensità della luce solare aumenta fino a raggiungere un'intensità apprezzabile, le molecole del dicloroperossido, ClOOCl assorbono le radiazioni UV liberando un atomo di cloro. Il radicale ClOO. risultante, instabile, si decompone (in una reazione che ha un tempo di dimezzamento di un giorno) liberando l'altro atomo di cloro: Tappa 3: ClOOCl + luce UV ClOO. + Cl. Tappa 4: ClOO. O 2 + Cl.
36 I buchi dell ozono Sommando tra loro le tappe 2, 3 e 4: Tappa 2: 2ClO. ClOOCl Tappa 3: ClOOCl + luce UV ClOO. + Cl. Tappa 4: ClOO. O 2 + Cl. 2 ClO. UV 2 Cl. + O 2 Così, attraverso queste reazioni, le molecole di CIO. tornano nella forma di Cl. capace di distruggere l'ozono anche senza l'intervento dell'ossigeno atomico.
37 I buchi dell ozono che, sommata con la tappa 1: 2 O 3 3 O 2 Quindi, un ciclo completo di distruzione catalitica dell'ozono: * può verificarsi nella parte inferiore della stratosfera * in presenza di condizioni meteorologiche particolari, cioè di un vortice.
38 I buchi dell ozono Circa i tre quarti della distruzione dell'ozono responsabile della formazione del buco dell'ozono sull'antartide si verifica attraverso il meccanismo consistente nella sequenza delle tappe da 1 a 4. La tappa più lenta del processo è quella numero 2: Tappa 2: 2ClO. ClOOCl Questa reazione segue una cinetica del secondo ordine in ClO. e procede quindi con una cinetica apprezzabile la velocità di distruzione dell ozono diviene significativa solo quando la concentrazione di ClO. è elevata.
39 I buchi dell ozono La formazione del buco dell ozono è dovuta anche ad una via di distruzione di questo elemento di minore importanza che implica la partecipazione del bromo. Nella prima tappa di questo meccanismo vengono distrutte due molecole di ozono, una ad opera di un atomo di cloro e l altra ad opera di un atomo di bromo. le molecole ClO. e BrO. prodotte in queste reazioni collidono quindi tra loro ridisponendo i loro atomi in modo da generare O 2 insieme a cloro e bromo atomici. Anche in questo caso la reazione netta mostra la trasformazione di due molecole di ozono in tre molecole di ossigeno, senza che alla reazione partecipi ossigeno atomico.
40 Riassumendo: I buchi dell ozono Ogni mese di settembre, a causa degli effetti combinati della sequenza di reazioni catalizzate principale e secondaria, si registra una velocità di distruzione dell ozono nella parte inferiore della stratosfera al di sopra dell Antartide pari a circa il 2% al giorno. In conseguenza di questo, all inizio di ottobre è scomparso quasi tutto l ozono presente a quote comprese tra 15 e 20 Km, le regioni in cui normalmente esso è presente in concentrazione maggiore sopra al Polo.
41 I buchi dell ozono L'evoluzione nel tempo della chimica del cloro nella stratosfera al di sopra dell'artico durante l'inverno e la primavera.
42 I buchi dell ozono Riassunto schematico del ciclo di reazioni di decomposizione dell'ozono l'ozono cui partecipa il cloro.
43 Il ruolo degli agenti chimici nella distruzione dell ozono Il continuo e graduale impoverimento dell ozono della stratosfera può essere senz altro essere ricondotto alla presenza in atmosfera di un gran numero di composti chimici in grado di attaccare l ozono. Queste sostanze vengono anche definite ODS: Ozone Depleting Substances (sostanze che distruggono l ozono). sono generalmente molto stabili nella troposfera e si degradano solamente per l intensa azione della luce ultravioletta nella stratosfera; quando si spezzano, rilasciano atomi di cloro e di bromo che danneggiano l ozono.
44 Il ruolo degli agenti chimici nella distruzione dell ozono Il continuo e graduale impoverimento dell ozono della stratosfera può essere senz altro essere ricondotto alla presenza in atmosfera di un gran numero di composti chimici in grado di attaccare l ozono. Queste sostanze vengono anche definite ODS: Ozone Depleting Substances (sostanze che distruggono l ozono). sono generalmente molto stabili nella troposfera e si degradano solamente per l intensa azione della luce ultravioletta nella stratosfera; quando si spezzano, rilasciano atomi di cloro e di bromo che danneggiano l ozono.
45 I Clorofluorocarburi CFC Le sostanze più implicate nel fenomeno del buco dell ozono e più in generale nella riduzione dell ozono stratosferico. I CFC sono la causa principale del recente aumento di cloro nella stratosfera. Tali composti contengono esclusivamente cloro, fluoro e carbonio. Questi composti sono comunemente utilizzati come refrigeranti, solventi ed agenti propellenti. I più comuni CFC sono i CFC-11, CFC-12, CFC-113, CFC-114 e il CFC Il potenziale di danno all ozono (ODP) per ognuno dei CFC è: 1; 1; 0,8; 1 e 0,6.
46 I CLOROFLUOROCARBURI I nomi: CFC = 101 C H F Il numero di atomi di cloro è dedotto per differenza tenuto conto della valenza del carbonio.
47 CFC-11 CFC-12 CFC forti (non contengono idrogeno) CFC-113 Sono forti in quanto per essi non esiste alcun pozzo nella troposfera cioè non è noto alcun processo naturale di rimozione come ad esempio la dissoluzione nelle gocce di pioggia.
48 Dopo pochi anni i CFC finiscono per salire nella stratosfera e, nel giro di decenni (moto verticale molto lento), nella parte superiore, dove subiscono decomposizione fotochimica ad opera delle radiazioni UV-C della luce solare con liberazione di atomi di cloro
49 CF 2 Cl 2 + hν (UV-C) CF 2 Cl + Cl Devono quindi salire fino alla parte centrale della stratosfera prima di decomporsi: gli UV-C penetrano scarsamente a quote inferiori.
50 Il CFC-11 decompone fotochimicamente a quote più basse del CFC-12 ed è quindi responsabile della distruzione dell ozono alle quote inferiori laddove la concentrazione di ozono è maggiore. Attualmente i CFC-11 e 12 sono i maggiori responsabili della distruzione di ozono ad opera dei CFC.
51 Il tetracloruro di carbonio CCl 4 è utilizzato come solvente (in passato nel lavaggio a secco) come intermedio nella produzione di CFC-11 e 12, durante la quale si perde nell atmosfera. Anche per il CCl 4 non esiste pozzo nella troposfera ma viene decomposto fotochimicamente nella stratosfera è responsabile della deplezione dell ozono da cloro.
52 Il metil-cloroformio CH 3 CCl 3 è prodotto in grande quantità e viene utilizzato nella pulitura dei metalli: una grande quantità finisce nell atmosfera: una parte di esso è allontanato dalla troposfera per reazione con i radicali OH la quota residua è sufficiente a partecipare in modo significativo alla deplezione dell ozono dopo essere migrata nella stratosfera.
53 I CFC forti e il CCl 4 non hanno quindi sistemi di smaltimento nella troposfera: non solubili in H 2 O non vengono allontanati dall aria con la pioggia non sono attaccati dai radicali OH né da altri composti gassosi presenti nell atmosfera, né vengono quindi decomposti fotochimicamente dalla luce UV-VIS.
54 I possibili sostituti dei CFC contengono tutti atomi di H legati ad atomi di carbonio. La maggior parte delle molecole di questi possono così essere allontanate dalla troposfera: per reazione con i radicali OH attraverso una sequenza di reazioni che inizia con la sottrazione di H ad opera di OH.
55 Composti contenenti bromo: Halon I gas Halon: Bromofluorocarburi, sono composti costituiti da bromo, fluoro e carbonio. sono utilizzati come agenti estinguenti del fuoco sia in sistemi fissi che in estintori portatili. causano la riduzione della fascia di ozono Il potenziale di eliminazione dell ozono del halon 1301 e del 1211 sono rispettivamente 13 e 4. Dato che nella troposfera non esistono sistemi di smaltimento di questi composti, essi finiscono per raggiungere la stratosfera, ove vengono decomposti fotochimicamente rilasciando bromo (e cioro) atomico
56 Composti contenenti bromo: Halon Anche altre sostanze sono implicate nella degradazione dell ozono: il metilcloroformio ed il tetracloruro di carbonio (comuni solventi industriali) ed in definitiva tutti quei composti volatili che comprendono nella loro struttura atomi di cloro o bromo. In natura vengono prodotte anche rilevanti quantità di metilbromuro, CH 3 Br. Il metilbromuro viene usato commercialmente come fumigante del suolo per eliminare i parassiti. e per tale motivo la sua liberazione nell atmosfera è in aumento. Tutte queste molecole finiscono per raggiungere la stratosfera, dove vengono foto dissociate liberando bromo atomico, in grado di distruggere l ozono.
57 ALTRI PROCESSI CHIMICI NELLA PARTE INFERIORE DELLA STRATOSFERA (15-25 Km) La concentrazione degli atomi di ossigeno O è modesta i meccanismi di distruzione dell O 3 basati sulla reazione O 3 + O 2O 2 anche in presenza di catalizzatori, non sono significativi. Gran parte della perdita di O 3 in questa regione si verifica attraverso la reazione complessiva: 2O 3 3O 2
58 Il medesimo processo complessivo è catalizzato dai radicali OH e HOO ognuno dei quali reagisce con l ozono in una sequenza a due stadi: OH + O 3 HOO + O 2 HOO + O 3 OH + 2O 2 2O 3 3O 2 Il radicale HOO può però reagire reversibilmente con l NO 2 per produrre una molecola di HOONO 2 : HOO + NO 2 HOONO 2
59 Al contrario, nella parte centrale e superiore della stratosfera NO riduce la concentrazione dell ozono: poiché reagisce a tale livello con l ossigeno come una specie chimica di tipo X per completare il meccanismo di distruzione catalitico a due stadi.
60 In ogni momento gran parte degli ossidi di azoto presenti nella stratosfera si trovano in forma inattiva come HNO 3 in conseguenza della reazione: OH + NO 2 HNO 3 L HNO 3 nelle ore diurne subisce decomposizione fotochimica che inverte questa reazione e produce specie chimiche cataliticamente attive nella distruzione dell ozono.
61 Alla diminuzione di O 3 può contribuire un meccanismo indiretto che implica la partecipazione delle goccioline di H 2 SO 4 e deriva da una velocità di denitrificazione dell aria stratosferica insolitamente elevata.
62 L ozono trasforma parte del biossido di azoto NO 2 in triossido NO 3 che insieme formano il pentossido di diazoto N 2 O 5 : NO 2 + O 3 NO 3 + O 2 Processo reversibile NO 2 + NO 3 N 2 O 5 In presenza di goccioline liquide di H 2 SO 4 stratosfera si verifica una conversione ad HNO 3 : nella N 2 O 5 + H 2 O 2HNO 3 In goccioline di H 2 SO 4 da SO 2 immesso dai vulcani nella stratosfera dopo ossidazione.
63 Con questo meccanismo, gran parte di NO 2, normalmente disponibile per legare ClONO 2, diviene non disponibile a tale scopo con una maggiore presenza di Cl nella forma cataliticamente attiva.
64 Riassumendo in questo gruppo di equazioni chimiche esistono delle regolarità: molte delle specie chimiche presenti nella stratosfera possiedono solo un atomo di ossigeno debolmente legato; tale atomo può essere facilmente staccato dal resto della molecola (Y) in molti modi caratteristici.
65 Riassumendo Molecole contenenti atomi di ossigeno labili
66 Riassumendo La dissociazione di questo atomo di ossigeno richiede molta meno energia di quella necessaria per rompere qualunque altro legame presente nella molecola: la risultante specie chimica Y rimane stabile. le specie chimiche del tipo di Y, diverse dall'o 2, sono i radicali liberi del tipo X. In termini di struttura elettronica: tutti gli atomi di ossigeno debolmente legati sono uniti con un legame semplice ad un altro atomo elettronegativo fornito di uno o più doppietti elettronici liberi. L'interazione tra i doppietti elettronici di questo atomo e quelli presenti sull'atomo di ossigeno indebolisce il legame semplice.
67 Riassumendo Le reazioni caratteristiche che implicano la partecipazione di atomi di ossigeno debolmente legati: 1. Reazioni con ossigeno atomico In questo caso l'atomo di ossigeno causa il distacco dell'atomo di ossigeno labile combinandosi con esso: Y-O + O Y + O 2 Queste reazioni sono tutte esotermiche poiché il legame O=O è molto più stabile del legame Y=O.
68 Riassumendo 2. Decomposizione fotochimica La specie chimica YO assorbe dalla luce solare le radiazioni UV-B o radiazioni di lunghezza d'onda ancora maggiore per poi liberare l'atomo di ossigeno labile: Y-O + luce solare Y + O 3. Reazione con NO L'ossido di azoto sottrae l'atomo di ossigeno labile: Y-O + NO Y + NO 2 reazione esotermica: la forza del legame ON-O è la massima fra quelle relative ad atomi di ossigeno labili. (le reazioni esotermiche a carico di radicali liberi sono relativamente veloci.)
69 Riassumendo 4. Sottrazione di ossigeno dall'ozono - La sottrazione dell'atomo labile dalla molecola dell'ozono solo per formare la specie chimica Y-O è caratteristico di OH., Cl., Br. e NO. tutti questi radicali agiscono da decompositori catalitici dell'ozono del tipo X: O 2 -O + X O 2 +XO La reazione cui partecipa l'ozono è esotermica vi partecipa il più debole dei legami caratteristici di un atomo di ossigeno labile. L'altra specie chimica YO non va incontro a questa reazione in misura significativamente importante: Perché la reazione a suo carico è endotermica e quindi la sua velocità trascurabile oppure perché la specie chimica X reagisce più rapidamente con altre specie chimiche.
70 Riassumendo 5. Combinazione di due molecole YO Se la concentrazione delle specie chimiche del tipo YO diviene alta esse possono reagire per collisione di due molecole (identiche o di tipo differente). Se almeno una di esse è O 3 oppure ROO,e viene a crearsi una catena instabile di tre o più atomi di ossigeno, gli atomi di ossigeno labili si combinano per formare una o più molecole di O 2 : 2 O 2 -O 3 O 2 2HO-O HOOH +O 2 HO-O + O-O 2 OH + 2 O 2 HO-O + O-Cl HOCl + O 2...
71 Riassumendo 5. Combinazione di due molecole YO Nel caso in cui nessuna di esse è ROO oppure ozono: le due molecole YO si combinano formando una molecola più grande che successivamente spesso si decompone fotochimicamente: 2 NO 2 N 2 O 4 2 ClO ClOOCl UV 2 Cl + O 2 ClO + NO 2 ClONO 2 (luce solare) ClO + BrO Cl + Br + O 2 Le molecole del tipo YOOY hanno una modesta stabilità termica anche a temperature moderate possono dissociarsi nei loro componenti YO prima che abbiano il tempo di assorbire la luce e dare fotolisi. *
72 La chimica e l inquinamento dell aria a livello del suolo Le condizioni di smog che si verificano nelle grandi città di tutto il mondo: gli esempi meglio conosciuti di inquinamento dell'aria I reagenti che producono un tipo di smog soprattutto le sostanze emesse dagli scarichi degli autoveicoli che producono il massimo inquinamento. La più comune manifestazione di questo tipo di smog è una foschia di colore giallo-bruno dovuta alla presenza, in sospensione nell'aria, di minuscole goccioline di acqua contenenti in soluzione i prodotti delle reazioni chimiche che si verificano tra gli inquinanti presenti nell'aria. Questa foschia, familiare a tutti coloro che vivono in aree urbane, ancora oggi è in via di estensione ad aree in precedenza incontaminate.
73 La chimica e l inquinamento dell aria a livello del suolo Lo smog spesso ha uno sgradevole odore a causa di qualcuno dei suoi componenti gassosi gli intermedi e i prodotti finali delle reazioni che avvengono nello smog possono arrecare danni alla salute dell'uomo, nonché alle piante e a certi materiali.
74 La chimica e l inquinamento dell aria a livello del suolo l'atmosfera terrestre rappresenta un ambiente ossidante a causa della elevata concentrazione di ossigeno biatomico. quasi tutte le sostanze gassose che vengono liberate nell'aria, finiscono per essere ossidate completamente nell'aria i prodotti secondari di queste reazioni si depositano sulla superficie terrestre. Le reazioni di ossidazione hanno, quindi, una fondamentale importanza per la pulizia dell'aria.
75 Interconversione delle unità di concentrazione dei gas Nelle scienze che studiano l'ambiente, la concentrazione dei gas presenti nell'aria viene espressa comunemente in unità diverse dalle moli per litro (molarità) Il sistema «parti per» ppm= parti per milione: una concentrazione pari a 100 molecole di un gas quale il biossido di carbonio disperse in un milione (10 6 ) di molecole di aria sarà espressa come «100 parti per milione», cioè «100 ppm». ppb e ppt stanno, rispettivamente, per «parti per miliardo» (10 9, in inglese billion) e «parti per trilione» (10 12 ). la concentrazione può essere espressa come pphm «parti per cento milioni» (10 8, dall'inglese hundred million).
76 Interconversione delle unità di concentrazione dei gas Il sistema «parti per» per i gas, queste unità esprimono il numero di molecole di un agente inquinante (cioè, in termini chimici, del «soluto») presenti in un milione o in un miliardo di molecole di aria. Poiché, secondo la legge dei gas ideali, il volume di un gas è proporzionale al numero di molecole in esso contenute, le scale espresse in termini di «parti per» rappresentano anche il volume che un agente inquinante occuperebbe rispetto ad un determinato volume di aria se l'inquinante stesso potesse essere isolato e compresso ad una pressione uguale a quella dell'aria. Per sottolineare che la scala delle concentrazioni è basata su molecole o volumi piuttosto che sulla massa, talvolta nell'abbreviazione dell'unità compare una v (per volume); per esempio, 100 ppmv o ppm.
77 Interconversione delle unità di concentrazione dei gas Altre unità di misura Spesso tuttavia si incontrano altre unità di misura, diverse tra loro e da quelle del sistema «parti per»: 1) molecole di gas per centimetro cubo di aria; 2) microgrammi di una sostanza (gassosa o no) per metro cubo di aria; 3) moli di un gas per litro di aria. è importante saper convertire le concentrazioni di un gas da un sistema di unità all'altro.
78 Interconversione delle unità di concentrazione dei gas Il numero di moli di una sostanza è proporzionale al numero di molecole di essa (con la costante di proporzionalità rappresentata dal numero di Avogadro, 6,02 x ) la pressione parziale di un gas è proporzionale al numero di moli una concentrazione, per esempio, di 2 ppm di un inquinante nell'aria significa: 2 molecole di inquinante in un milione di molecole di aria; 2 moli di inquinante in un milione (10 6 ) di moli di aria (cioè l'inquinante è 2/10 6 del totale delle moli presenti, o 2 x 10-6 ); una pressione parziale dell'inquinante pari a 2 x 10-6 atmosfere, considerando che la pressione totale dell'aria è pari a 1atmosfera; 2 litri di inquinante in 1 milione di litri di aria (in uguali condizioni di pressione parziale e temperatura dell'inquinante e dell'aria).
79 Interconversione delle unità di concentrazione dei gas Convertiamo una concentrazione di 2 ppm nel suo valore espresso come molecole (di inquinante) per centimetro cubo (cm 3 ) di aria in condizioni di pressione totale dell'aria di 1 atmosfera e a 25 C. 1. bisogna stabilire il volume, in centimetri cubi, occupato da 1 milione di molecole di aria (10 6 molecole).
80 Interconversione delle unità di concentrazione dei gas bisogna stabilire il volume, in centimetri cubi, occupato da 1 milione di molecole di aria (10 6 molecole). usando la legge dei gas ideali (PV = nrt) e sapendo che: P = 1.0 atmosfere T= = 298 K n = 10 6 molecole / 6.02 x molecole mol -1 = 1.66 x mol e la costante dei gas R = l atm mol-l K -1. V = nrt/p = 1.66 x mol x 0.82 l atm mol -1 K -1 x 298 K / 1 atm = 4.06 x l Poiché 1 litro = 1000 cm 3 V = 4,06 x cm 3. 2 molecole di inquinante occupano 4,06 x cm 3 la concentrazione, espressa nelle nuove unità sarà: 2,0 molecole/4,06 x cm 3, o 4,9 X molecole per cm 3.
81 Interconversione delle unità di concentrazione dei gas Per trasformare un valore espresso in ppm o molecole per cm 3 nelle corrispondenti moli per litro, occorre trasformare il numero delle molecole di inquinante nel corrispondente numero di moli; per una concentrazione di inquinante di 2 ppm possiamo scrivere: moli di inquinante = 2 molecole x 1 mole/6,02 x molecole = 3.3 x moli Così la molarità è 3,3 x moli /4,06 x 10-7 l cioè 8,2 x 10-8 M.
82 Interconversione delle unità di concentrazione dei gas Un modo alternativo per effettuare le conversioni: utilizzare la definizione che 2 ppm significa 2 litri di inquinante per 1 milione di litri di aria trovare il numero di moli e di molecole di inquinante contenute in un volume di 2 litri alla temperatura e pressione definite.
83 Interconversione delle unità di concentrazione dei gas Una unità che viene spesso utilizzata per esprimere le concentrazioni nell'aria inquinata i microgrammi per m 3. nota la massa molecolare, possiamo interconvertire questi valori in quelli corrispondenti espressi in termini di molarità o di «parti per».
84 Interconversione delle unità di concentrazione dei gas Esempio: P= 1.0 atm e T= 27 C. C= 320 µg/m 3 SO 2 = ppb SO 2? 1. calcolare il numero di molecole di SO 2 (PM= 64.1 g): g ( mole/ 64.1g) ( molecole/1mole) = molecole SO2 3. il numero di moli di aria 4. Il numero di molecole di aria: 40.7moli molecole/ mole ) = l 1.0atm 1.0m 3 n = PV / RT = 0.1m = 40. 7moli aria l atm mol 300K molecole o miliardi di molecole aria Così, la concentrazione è: molecole SO miliardi molecole aria 2 = 123ppb
85 Il destino chimico dei gas presenti in traccia nell aria non inquinata oltre ai costituenti stabili dell atmosfera N 2, O 2, Ar, CO 2, H 2 O la troposfera contiene un numero di altre sostanze gassose presenti in concentrazioni minime esistendo per esse efficienti pozzi che ne impediscono l accumulo. dalle attività biologiche e vulcaniche l atmosfera riceve regolarmente rifornimenti di gas parzialmente ossidati il monossido di carbonio CO, il biossido di zolfo (o anidride solforosa) SO 2, altri gas come H 2 S e NH 3
86 Il destino chimico dei gas presenti in traccia nell aria non inquinata Gas emessi nell atmosfera da fonti naturali Formula Nome Principali fonti naturali Emivita nell atmosfera NH 3 Ammoniaca Decomposizione biologica anaerobia Giorni H 2 S Solfuro di idrogeno Decomposizione biologica anaerobia Giorni HCl Acido cloridrico Decomposizione biologica anaerobia Giorni SO 2 NO CO CH 4 Biossido di zolfo Ossido di azoto Monossido di carbonio Metano Vulcani Lampi e fulmini Ossidazione di CH4, incendi Decomposizione biologica anaerobia Giorni Giorni Mesi Anni CH 3 Cl CH 3 Br CH 3 I Metilcloruro Metilbromuro Metilioduro Oceani Oceani Oceani Anni Anni Anni
87 Il destino chimico dei gas presenti in traccia nell aria non inquinata Sebbene gran parte di questi gas naturali sia gradualmente ossidata all aria, nessuno di loro reagisce direttamente con l ossigeno biatomico; le loro reazioni iniziano tutte con l attacco del radicale libero ossidrile, OH, nonostante la concentrazione di questa specie chimica nell aria sia estremamente ridotta, in media circa un milione di molecole per cm 3. Nell aria troposferica non inquinata, il radicale OH viene prodotto per reazione del vapore acqueo con una piccola frazione degli atomi di ossigeno eccitati prodotti dalla decomposizione fotochimica delle quantità di ozono atmosferico; la reazione comporta l estrazione di un atomo di idrogeno da ogni molecola di acqua che reagisce: UV B O3 O2 + O* O * + H2O 2OH
88 Il destino chimico dei gas presenti in traccia nell aria non inquinata La vita media nella troposfera di un radicale ossidrile è di circa un secondo esso reagisce rapidamente con uno o l altro dei numerosi gas dell atmosfera. Poiché la vita media di un radicale ossidrile è breve, ed è necessaria la luce solare per produrne, la concentrazione di OH cade rapidamente di notte. Il radicale libero OH è reattivo nei confronti di un ampia varietà di altre molecole, tra cui gli idruri del carbonio, dell azoto e dello zolfo di molte molecole contenenti legami multipli (doppi o tripli) compresi CO e SO 2.
89 Il destino chimico dei gas presenti in traccia nell aria non inquinata Sebbene a lungo sospettata di svolgere un ruolo fondamentale nella chimica dell aria, la presenza dei radicali OH nella troposfera è stata confermata solo recentemente poiché la concentrazione di questo radicale è estremamente bassa. La grande importanza del radicale OH nella chimica della troposfera deriva dal fatto che esso, non l O 2, inizia la reazione di ossidazione di tutti i gas della tabella (con eccezione di HCl). In assenza di OH, e della specie reattiva correlata HOO, questi gas non potrebbero essere efficacemente allontanati dalla troposfera e con essi molti gas inquinanti quali gli idrocarburi incombusti emessi dai veicoli.
90 Il destino chimico dei gas presenti in traccia nell aria non inquinata Il radicale OH l aspirapolvere o il detergente dell atmosfera. Le reazioni cui esso da il via rappresentano la combustione senza fiamma a temperatura ambiente dei gas ridotti nella bassa atmosfera. Se questi gas si accumulassero, la composizione dell atmosfera sarebbe assai differente e così le forme di vita capaci di vivere sulla Terra.
91 Il destino chimico dei gas presenti in traccia nell aria non inquinata Il radicale OH non reagisce con l ossigeno molecolare, al contrario di molti altri radicali liberi, né con l azoto molecolare esso può sopravvivere abbastanza a lungo per poter reagire con molte altre specie chimiche. Un esempio di reazione cui da il via il radicale OH l ossidazione netta del gas metano, CH 4, nel prodotto della sua completa ossidazione, il biossido di carbonio, CO 2 : OH CH4 + 2 O2 CO2 + 2H Gli alogenuri di idrogeno (HF, HCl, HBr) e gas completamente ossidati come il biossido di carbonio nella troposfera, sono relativamente non reattivi finiscono per essere depositati alla superficie terrestre, spesso dopo essere stati disciolti nell acqua della pioggia. 2 O
92 L ozono nelle città: il processo dello smog fotochimico L inquinamento atmosferico la presenza in atmosfera di sostanze che nella naturale composizione dell aria non sono presenti o sono presenti ad un livello di concentrazione inferiore, e che producono un effetto misurabile sull uomo, sugli animali, sulla vegetazione o i materiali. Responsabili principali dell'inquinamento atmosferico sono i veicoli con motore a scoppio, le industrie, le centrali termoelettriche, i combustibili per il riscaldamento domestico, la combustione dei rifiuti specie se realizzata senza di adatti impianti di abbattimento delle polveri e di depurazione dei fumi
93 L ozono nelle città: il processo dello smog fotochimico I principali inquinanti primari emessi dai processi di combustione di qualunque natura: idrocarburi incombusti, il monossido di carbonio, gli ossidi di azoto (principalmente sotto forma di monossido) materiale particellare. anidride solforosa nel caso in cui i combustibili contengano zolfo A seguito dell emissione in atmosfera, gli inquinanti primari sono soggetti a: processi di diffusione, trasporto e deposizione, processi di trasformazione chimico-fisica che possono portare alla formazione di nuove specie inquinanti, che spesso risultano più tossici e di più vasto raggio d'azione degli inquinanti originari.
94 L ozono nelle città: il processo dello smog fotochimico La dispersione degli inquinanti in atmosfera, determinata dai fenomeni di diffusione turbolenta e di trasporto delle masse d aria, la loro rimozione, determinata dai processi di deposizione, sono strettamente dipendenti dal comportamento dinamico dei bassi strati dell atmosfera. Per lo studio del comportamento degli inquinanti primari è necessario sia conoscere il profilo qualitativo, quantitativo e temporale delle emissioni, avere informazioni sui processi meteorologici che regolano il comportamento dinamico della bassa troposfera (classi di stabilità, direzione ed intensità del vento).
95 L ozono nelle città: il processo dello smog fotochimico In molte aree urbane del mondo si verificano episodi di inquinamento atmosferico in conseguenza di reazioni foto-chimiche a carico degli inquinanti. vengono raggiunti valori relativamente elevati di concentrazione a livello del suolo dell'ozono, O 3, - un costituente dell'aria indesiderabile alle basse quote Questo fenomeno è detto smog fotochimico è definito come «strato dell'ozono nel posto sbagliato» per distinguerlo dal problema della diminuzione dell'ozono atmosferico discusso precedentemente.
96 Fra i processi di formazione di inquinanti secondari, particolare importanza è assunta dalla serie di reazioni che avvengono fra gli ossidi di azoto gli idrocarburi in presenza di luce solare.
97 SMOG FOTOCHIMICO Lo smog si forma attraverso un processo che implica centinaia di reazioni diverse che avvengono contemporaneamente a cui partecipano dozzine di prodotti chimici.
98 SMOG FOTOCHIMICO una delle forme di inquinamento più dannose per l ecosistema. L uso del termine SMOG è dovuto alla forte riduzione della visibilità che si determina nel corso degli episodi di inquinamento fotochimico, dovuta alla formazione di un grande numero di particelle di notevoli dimensioni.
99 Smog fotochimico: ingredienti I principali prodotti che innescano un episodio di smog fotochimico ossido di azoto, NO, molecole incombuste di idrocarburi (cioè composti contenenti solo carbonio e idrogeno) La concentrazione di queste sostanze è ordini di grandezza superiore a quella delle stesse nell'aria non inquinata. composti organici volatili, o COV (le sostanze comprendenti gli idrocarburi, e i loro derivati che evaporano con facilità) la luce solare, che aumenta la concentrazione dei radicali liberi che partecipano ai processi chimici di formazione dello smog.
100 Smog fotochimico: prodotti I prodotti finali dello smog sono ozono, acido nitrico, composti organici parzialmente ossidati e, in alcuni casi, nitrati.
101 Smog fotochimico: prodotti NO., idrocarburi e altri COV emessi inizialmente nell'aria inquinanti primari, i prodotti, quali O 3 e HNO 3, in cui essi si trasformano, inquinanti secondari. I più reattivi tra i COV presenti nell'aria delle città gli idrocarburi contenenti un doppio legame C=C in quanto tali composti possono generare radicali liberi. Anche altri idrocarburi sono presenti e possono reagire, ma la velocità delle loro reazioni è modesta le reazioni di queste sostanze possono divenire importanti nelle fasi più avanzate degli episodi di smog fotochimico.
102 Smog fotochimico: prodotti I gas inquinanti contenenti ossidi di azoto sono prodotti da qualsiasi combustione con fiamma di combustibili fossili in presenza di aria. Alle elevate temperature così raggiunte parte dell'azoto e dell'ossigeno gassosi presenti nell'aria si combinano tra loro per formare ossido di azoto, NO: Quanto più elevata è la temperatura della fiamma tanto maggiore è la quantità di NO. prodotta. L'ossido di azoto viene gradualmente ossidato a biossido di azoto, NO 2, in tempi variabili da minuti a ore, a seconda della concentrazione dei gas inquinanti.
103 Smog fotochimico: prodotti Nel loro insieme, NO e NO 2 : ossidi di azoto, NOx. Le modeste quantità di NOx presenti nell'aria non inquinata dalla reazione che si verifica nell'ambiente altamente energetico causato dai fulmini in parte dalla liberazione da fonti biologiche. la reazione tra N 2 e O 2 è trascurabile (ha una elevata energia di attivazione), e procede lentamente eccetto che alle elevate temperature che si verificano nei motori a combustione degli autoveicoli (in particolare durante la marcia ad elevata velocità) nelle centrali elettriche. Quindi tra i processi di formazione di inquinanti secondari, particolare importanza è assunta dalla serie di reazioni che avvengono fra gli ossidi di azoto e gli idrocarburi in presenza di luce solare.
104 Questa catena di reazioni porta: all ossidazione del monossido di azoto (NO) a biossido di azoto (NO 2 ), alla produzione di ozono (O 3 ) all ossidazione degli idrocarburi, con formazione di perossiacetilnitrato (PAN), formaldeide, acido nitrico, nitrati e nitroderivati in fase particellare, e centinaia di altre specie chimiche minori.
105 Come si innesca un processo luce solare, di SMOG FOTOCHIMICO ossidi di azoto e composti organici volatili; il processo è favorito da una temperatura atmosferica elevata.
106 Gli ossidi di azoto i composti organici volatili sono fra i componenti principali delle emissioni nelle aree urbane. quindi le città poste nelle aree geografiche caratterizzate da radiazione solare intensa e temperatura elevata, come aree mediterranee, costituiscono dei candidati ideali allo sviluppo di episodi di inquinamento fotochimico intenso.
107 NELLA BASSA STRATOSFERA l ozono si forma dalla reazione dell ossigeno atmosferico con l ossigeno atomico prodotto dalla fotolisi del biossido di azoto, NO 2 (UV) NO + O O + O 2 + M O 3 + M l ozono formato viene a sua volta rimosso dal monossido di azoto, con nuova formazione di NO 2 : O 3 + NO O 2 + NO 2
108 Nelle atmosfere non inquinate, ove non sono presenti altre specie chimiche in concentrazione apprezzabile, questa serie di reazioni costituisce ciclo fotostazionario dell ozono senza possibilità di inquinamento fotochimico.
109 Il passaggio fondamentale affinché l atmosfera si possa arricchire di ozono e di altre specie fotossidanti è costituito dalla formazione di NO 2 attraverso vie alternative, che non implicano la rimozione di ozono. La principale via alternativa per la formazione di NO 2 è costituita dall ossidazione di NO ad opera dei radicali perossido (RO 2 ): si formano dalla degradazione di molecole di idrocarburi volatili (RH) e dalla loro successiva reazione con l ossigeno atmosferico. RH + OH. R. + H 2 O R. + O 2 RO 2. RO 2. + NO RO. + NO 2
110 L OZONO l ozono non è solo il prodotto quantitativamente più importante dei processi di inquinamento fotochimico, ma è anche parte del "combustibile" che attiva il processo l acido nitroso e la formaldeide, sono precursori di radicali OH hanno a loro volta una via di formazione essenzialmente secondaria a partire da specie coinvolte nei processi fotochimici biossido di azoto per l acido nitroso idrocarburi e radicali oppure ozono per la formaldeide.
111 La genesi di un evento di smog fotochimico 1. Un atmosfera ricca di inquinanti primari: ossidi di azoto e idrocarburi volatili precursori di radicali OH, come acido nitroso, formaldeide e ozono viene investita dalla radiazione solare UV
112 La genesi di un evento di smog fotochimico 2. La radiazione UV provoca la fotolisi di acido nitroso, formaldeide ed ozono (in ordine crescente di livello di energia ultravioletta necessaria per la fotolisi), con produzione di radicali OH.
113 La genesi di un evento di smog fotochimico 3. I radicali OH attaccano varie specie di idrocarburi volatili reattivi, innescando una serie di reazioni a catena degradazione delle molecole di idrocarburi formazione di radicali perossido.
114 La genesi di un evento di smog fotochimico 4. il biossido di azoto, per fotolisi, produce ozono, rigenerando una molecola di NO che torna ad essere disponibile per una nuova ossidazione
115 La genesi di un evento di smog fotochimico 5. i radicali RO 2 ossidano il monossido di azoto, producendo NO 2 ogni radicale partecipa a parecchi cicli di conversione di NO ad NO 2 prima di estinguersi.
116 La genesi di un evento di smog fotochimico In alternativa, il biossido di azoto reagisce con radicali OH, formando acido nitrico, o con radicali perossiacetile formando perossiacetilnitrato (prodotti terminali che esauriscono la catena di reazioni) e viene in tal caso rimosso dal ciclo fotochimico. *
Ozono Stratosferico ( u B co d ell O z O o z no)
 Ozono Stratosferico (Buco dell Ozono) Ozono Uno dei gas più interessanti O 3 Stratosferico: funzione protettiva O 3 Troposferico: inquinante 90 % in stratosfera 10 % in troposfera Ozono O 3 Forma allotropica
Ozono Stratosferico (Buco dell Ozono) Ozono Uno dei gas più interessanti O 3 Stratosferico: funzione protettiva O 3 Troposferico: inquinante 90 % in stratosfera 10 % in troposfera Ozono O 3 Forma allotropica
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti.
 Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA
 EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
2. L INQUINAMENTO ATMOSFERICO
 2. L INQUINAMENTO ATMOSFERICO L aria è una miscela eterogenea formata da gas e particelle di varia natura e dimensioni. La sua composizione si modifica nello spazio e nel tempo per cause naturali e non,
2. L INQUINAMENTO ATMOSFERICO L aria è una miscela eterogenea formata da gas e particelle di varia natura e dimensioni. La sua composizione si modifica nello spazio e nel tempo per cause naturali e non,
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
Intorno alla Terra è presente un atmosfera diversa da quella degli altri pianeti rende possibile la vita fornendo ossigeno e diossido di carbonio
 L Atmosfera Intorno alla Terra è presente un atmosfera diversa da quella degli altri pianeti rende possibile la vita fornendo ossigeno e diossido di carbonio Protegge la superficie terrestre da temperature
L Atmosfera Intorno alla Terra è presente un atmosfera diversa da quella degli altri pianeti rende possibile la vita fornendo ossigeno e diossido di carbonio Protegge la superficie terrestre da temperature
È importante quindi conoscere le proprietà chimiche dell acqua. Le reazioni acido base sono particolari esempi di equilibrio chimico in fase acquosa
 Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
 Il Sole Variazioni dell energia solare entrante: Obliquità orbitale Attualmente l asse di rotazione terrestre è inclinato di 23.4 rispetto alla perpendicolare sul piano orbitale terrestre. Ogni 41 000
Il Sole Variazioni dell energia solare entrante: Obliquità orbitale Attualmente l asse di rotazione terrestre è inclinato di 23.4 rispetto alla perpendicolare sul piano orbitale terrestre. Ogni 41 000
La scuola integra culture. Scheda3c
 Scheda3c Gli ELEMENTI DEL CLIMA che caratterizzano le condizioni meteorologiche di una regione sono: la temperatura, la pressione atmosferica, i venti, l umidità e le precipitazioni. La temperatura è data
Scheda3c Gli ELEMENTI DEL CLIMA che caratterizzano le condizioni meteorologiche di una regione sono: la temperatura, la pressione atmosferica, i venti, l umidità e le precipitazioni. La temperatura è data
Oggetto: Campagna di rilevamento di inquinanti atmosferici mediante analizzatore LAVOISIER TM presso il casello di Beinasco (Torino).
 Oggetto: Campagna di rilevamento di inquinanti atmosferici mediante analizzatore LAVOISIER TM presso il casello di Beinasco (Torino). La campagna di monitoraggio si è svolta presso il casello autostradale
Oggetto: Campagna di rilevamento di inquinanti atmosferici mediante analizzatore LAVOISIER TM presso il casello di Beinasco (Torino). La campagna di monitoraggio si è svolta presso il casello autostradale
Definiamo Entalpia la funzione: DH = DU + PDV. Variando lo stato del sistema possiamo misurare la variazione di entalpia: DU = Q - PDV.
 Problemi Una mole di molecole di gas ideale a 292 K e 3 atm si espandono da 8 a 20 L e a una pressione finale di 1,20 atm seguendo 2 percorsi differenti. Il percorso A è un espansione isotermica e reversibile;
Problemi Una mole di molecole di gas ideale a 292 K e 3 atm si espandono da 8 a 20 L e a una pressione finale di 1,20 atm seguendo 2 percorsi differenti. Il percorso A è un espansione isotermica e reversibile;
Spettrofotometria. Le onde luminose consistono in campi magnetici e campi elettrici oscillanti, fra loro perpendicolari.
 Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
CO 2 aq l anidride carbonica disciolta, reagendo con l'acqua, forma acido carbonico secondo la reazione:
 DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
PREVENZIONE INCENDI. Celsino Govoni
 PREVENZIONE INCENDI Celsino Govoni Che cos è un ESPLOSIONE? Cosa c era dentro a quell ambulatorio? Cosa è rimasto di quel centro medico posto in quel paesino!! La causa, a volte, è di piccole dimensioni
PREVENZIONE INCENDI Celsino Govoni Che cos è un ESPLOSIONE? Cosa c era dentro a quell ambulatorio? Cosa è rimasto di quel centro medico posto in quel paesino!! La causa, a volte, è di piccole dimensioni
Esperienze di sicurezza ambientale
 Esperienze di sicurezza ambientale Progetto Analisi statistica dell inquinamento atmosferico Istituto Tecnico Settore Tecnologico Marie Curie - Napoli Allievi Relatori: Francesco Capasso, Roberta Avolio,
Esperienze di sicurezza ambientale Progetto Analisi statistica dell inquinamento atmosferico Istituto Tecnico Settore Tecnologico Marie Curie - Napoli Allievi Relatori: Francesco Capasso, Roberta Avolio,
La combustione ed i combustibili
 La combustione ed i combustibili Concetti di base Potere calorifico Aria teorica di combustione Fumi: volume e composizione Temperatura teorica di combustione Perdita al camino Combustibili Gassosi Solidi
La combustione ed i combustibili Concetti di base Potere calorifico Aria teorica di combustione Fumi: volume e composizione Temperatura teorica di combustione Perdita al camino Combustibili Gassosi Solidi
Analisi delle serie storiche. Monossido di Carbonio Biossido d Azoto Particolato Totale Sospeso Ozono Piombo Biossido di Zolfo Benzene
 Analisi delle serie storiche Monossido di Carbonio Biossido d Azoto Particolato Totale Sospeso Ozono Piombo Biossido di Zolfo Benzene Al fine di rendersi conto dell evoluzione delle concentrazioni di alcuni
Analisi delle serie storiche Monossido di Carbonio Biossido d Azoto Particolato Totale Sospeso Ozono Piombo Biossido di Zolfo Benzene Al fine di rendersi conto dell evoluzione delle concentrazioni di alcuni
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He. 2) L'acqua è:
 1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
LEZIONE 1. Materia: Proprietà e Misura
 LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato gassoso
 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
352&(662',&20%867,21(
 352&(662',&20%867,21( Il calore utilizzato come fonte energetica convertibile in lavoro nella maggior parte dei casi, è prodotto dalla combustione di sostanze (es. carbone, metano, gasolio) chiamate combustibili.
352&(662',&20%867,21( Il calore utilizzato come fonte energetica convertibile in lavoro nella maggior parte dei casi, è prodotto dalla combustione di sostanze (es. carbone, metano, gasolio) chiamate combustibili.
LA CORRENTE ELETTRICA
 L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
Genova 15 01 14 TIPOLOGIE DI LAMPADE
 Genova 15 01 14 TIPOLOGIE DI LAMPADE Le lampade a vapori di mercurio sono sicuramente le sorgenti di radiazione UV più utilizzate nella disinfezione delle acque destinate al consumo umano in quanto offrono
Genova 15 01 14 TIPOLOGIE DI LAMPADE Le lampade a vapori di mercurio sono sicuramente le sorgenti di radiazione UV più utilizzate nella disinfezione delle acque destinate al consumo umano in quanto offrono
Emissioni di composti volatili non metanici dalle discariche dell area vasta di Giugliano: il progetto BioQuAr RISULTATI PRELIMINARI
 Emissioni di composti volatili non metanici dalle discariche dell area vasta di Giugliano: il progetto BioQuAr RISULTATI PRELIMINARI Premessa I composti organici non metanici (COV), pur rappresentando
Emissioni di composti volatili non metanici dalle discariche dell area vasta di Giugliano: il progetto BioQuAr RISULTATI PRELIMINARI Premessa I composti organici non metanici (COV), pur rappresentando
Stati di aggregazione della materia unità 2, modulo A del libro
 Stati di aggregazione della materia unità 2, modulo A del libro Gli stati di aggregazione della materia sono tre: solido, liquido e gassoso, e sono caratterizzati dalle seguenti grandezze: Quantità --->
Stati di aggregazione della materia unità 2, modulo A del libro Gli stati di aggregazione della materia sono tre: solido, liquido e gassoso, e sono caratterizzati dalle seguenti grandezze: Quantità --->
Metano. Dalla combustione di un metro cubo standard di metano si ottengono circa 36 MJ (8940 Kcal)
 Metano Caratteristiche chimico fisiche e origini Il metano è un idrocarburo semplice (alcano) formato da un atomo di carbonio e 4 di idrogeno, la sua formula chimica è CH 4, si trova in natura sotto forma
Metano Caratteristiche chimico fisiche e origini Il metano è un idrocarburo semplice (alcano) formato da un atomo di carbonio e 4 di idrogeno, la sua formula chimica è CH 4, si trova in natura sotto forma
GAS NATURALE O METANO
 Composto prevalentemente da un idrocarburo: metano da da cui prende il nome. GAS NATURALE O METANO Alto potere calorifico. Mancanza di tossicità e impurità. È un'ottima risorsa energetica. È l'energia
Composto prevalentemente da un idrocarburo: metano da da cui prende il nome. GAS NATURALE O METANO Alto potere calorifico. Mancanza di tossicità e impurità. È un'ottima risorsa energetica. È l'energia
CHIMICA GENERALE MODULO
 Corso di Scienze Naturali CHIMICA GENERALE MODULO 6 Termodinamica Entalpia Entropia Energia libera - Spontaneità Relatore: Prof. Finelli Mario Scienza che studia i flussi energetici tra un sistema e l
Corso di Scienze Naturali CHIMICA GENERALE MODULO 6 Termodinamica Entalpia Entropia Energia libera - Spontaneità Relatore: Prof. Finelli Mario Scienza che studia i flussi energetici tra un sistema e l
Inquinanti atmosferici. Ossidi di zolfo Ossidi di azoto Monossido di carbonio Particolato (polveri) Altri (metalli, VOC, etc)
 Inquinanti atmosferici Ossidi di zolfo Ossidi di azoto Monossido di carbonio Particolato (polveri) Altri (metalli, VOC, etc) ZOLFO I composti dello zolfo di interesse ai fini dell inquinamento atmosferico
Inquinanti atmosferici Ossidi di zolfo Ossidi di azoto Monossido di carbonio Particolato (polveri) Altri (metalli, VOC, etc) ZOLFO I composti dello zolfo di interesse ai fini dell inquinamento atmosferico
Combustione energia termica trasmissione del calore
 Scheda riassuntiva 6 capitoli 3-4 Combustione energia termica trasmissione del calore Combustibili e combustione Combustione Reazione chimica rapida e con forte produzione di energia termica (esotermica)
Scheda riassuntiva 6 capitoli 3-4 Combustione energia termica trasmissione del calore Combustibili e combustione Combustione Reazione chimica rapida e con forte produzione di energia termica (esotermica)
Energy in our life. 6. Perché risparmiare energia? 1. Forme di energia:
 Energy in our life 1. Forme di energia: Energia meccanica; Energia nucleare; Energia elettrica; Energia chimica; Energia termica; 1. Consumi nel mondo; 2. Consumi in italia; 3. Consumi in Sicilia; 4. Energia
Energy in our life 1. Forme di energia: Energia meccanica; Energia nucleare; Energia elettrica; Energia chimica; Energia termica; 1. Consumi nel mondo; 2. Consumi in italia; 3. Consumi in Sicilia; 4. Energia
13 La temperatura - 8. Il gas perfetto
 La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
Gas. Vapore. Forma e volume del recipiente in cui è contenuto. un gas liquido a temperatura e pressione ambiente. microscopico MACROSCOPICO
 Lo Stato Gassoso Gas Vapore Forma e volume del recipiente in cui è contenuto. un gas liquido a temperatura e pressione ambiente MACROSCOPICO microscopico bassa densità molto comprimibile distribuzione
Lo Stato Gassoso Gas Vapore Forma e volume del recipiente in cui è contenuto. un gas liquido a temperatura e pressione ambiente MACROSCOPICO microscopico bassa densità molto comprimibile distribuzione
Acqua azzurra, acqua chiara. Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao
 Acqua azzurra, acqua chiara Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao Proprietà fisiche Ecosistemi acquatici Origine della vita Ciclo dell acqua Acqua Scoperte Sensazioni Leggi La
Acqua azzurra, acqua chiara Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao Proprietà fisiche Ecosistemi acquatici Origine della vita Ciclo dell acqua Acqua Scoperte Sensazioni Leggi La
Unità di misura. Perché servono le unità di misura nella pratica di laboratorio e in corsia? Le unità di misura sono molto importanti
 Unità di misura Le unità di misura sono molto importanti 1000 è solo un numero 1000 lire unità di misura monetaria 1000 unità di misura monetaria ma il valore di acquisto è molto diverso 1000/mese unità
Unità di misura Le unità di misura sono molto importanti 1000 è solo un numero 1000 lire unità di misura monetaria 1000 unità di misura monetaria ma il valore di acquisto è molto diverso 1000/mese unità
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola.
 Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
L energia che consumo. Fabio Peron. Combustione. Aria di combustione. Combustione
 Corso di Progettazione Ambientale prof. Fabio Peron Combustione L energia che consumo Fabio Peron Università IUAV - Venezia Combustione Aria di combustione Si dice combustione qualunque reazione chimica
Corso di Progettazione Ambientale prof. Fabio Peron Combustione L energia che consumo Fabio Peron Università IUAV - Venezia Combustione Aria di combustione Si dice combustione qualunque reazione chimica
Affinché un incendio si sviluppi, è necessario che si verifichino tre condizioni indicate nel "cerchio del fuoco".
 Via Tatti, 5 20029 Turbigo (MI) Ing. Marco Cagelli Teoria della combustione Nozioni base Il cerchio del fuoco Affinché un incendio si sviluppi, è necessario che si verifichino tre condizioni indicate nel
Via Tatti, 5 20029 Turbigo (MI) Ing. Marco Cagelli Teoria della combustione Nozioni base Il cerchio del fuoco Affinché un incendio si sviluppi, è necessario che si verifichino tre condizioni indicate nel
RICHIAMI DI TERMOCHIMICA
 CAPITOLO 5 RICHIAMI DI TERMOCHIMICA ARIA TEORICA DI COMBUSTIONE Una reazione di combustione risulta completa se il combustibile ha ossigeno sufficiente per ossidarsi completamente. Si ha combustione completa
CAPITOLO 5 RICHIAMI DI TERMOCHIMICA ARIA TEORICA DI COMBUSTIONE Una reazione di combustione risulta completa se il combustibile ha ossigeno sufficiente per ossidarsi completamente. Si ha combustione completa
Cambiamento climatico. EMISSIONI DI GAS SERRA: Cosa ha contribuito in maniera significativa alla loro riduzione?
 Cambiamento climatico EMISSIONI DI GAS SERRA: Cosa ha contribuito in maniera significativa alla loro riduzione? La sostituzione dei CFC! Un ruolo chiave è stato quello degli idrofluorocarburi (HFC) I CFC,
Cambiamento climatico EMISSIONI DI GAS SERRA: Cosa ha contribuito in maniera significativa alla loro riduzione? La sostituzione dei CFC! Un ruolo chiave è stato quello degli idrofluorocarburi (HFC) I CFC,
LO STATO GASSOSO. Proprietà fisiche dei gas Leggi dei gas Legge dei gas ideali Teoria cinetico-molecolare dei gas Solubilità dei gas nei liquidi
 LO STATO GASSOSO Proprietà fisiche dei gas Leggi dei gas Legge dei gas ideali Teoria cinetico-molecolare dei gas Solubilità dei gas nei liquidi STATO GASSOSO Un sistema gassoso è costituito da molecole
LO STATO GASSOSO Proprietà fisiche dei gas Leggi dei gas Legge dei gas ideali Teoria cinetico-molecolare dei gas Solubilità dei gas nei liquidi STATO GASSOSO Un sistema gassoso è costituito da molecole
MISURE DI POTERE CALORIFICO E COMPOSIZIONE
 MISURE DI POTERE CALORIFICO E COMPOSIZIONE Potere calorifico dei combustibili: bomba calorimetrica e calorimetro di Junkers Composizione: gascromatografia Composizione dei gas combusti: o Sonda λ o Strumenti
MISURE DI POTERE CALORIFICO E COMPOSIZIONE Potere calorifico dei combustibili: bomba calorimetrica e calorimetro di Junkers Composizione: gascromatografia Composizione dei gas combusti: o Sonda λ o Strumenti
Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose.
 Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose. 2.1 Spettro di emissione Lo spettro di emissione di
Capitolo 2 Caratteristiche delle sorgenti luminose In questo capitolo sono descritte alcune grandezze utili per caratterizzare le sorgenti luminose. 2.1 Spettro di emissione Lo spettro di emissione di
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Università degli Studi di Catania Dipartimento di Metodologie Fisiche e Chimiche per l Ingegneria
 Università degli Studi di Catania Dipartimento di Metodologie Fisiche e Chimiche per l Ingegneria Corso di laurea in Ingegneria Meccanica Corso di Tecnologie di Chimica Applicata LA CORROSIONE Nei terreni
Università degli Studi di Catania Dipartimento di Metodologie Fisiche e Chimiche per l Ingegneria Corso di laurea in Ingegneria Meccanica Corso di Tecnologie di Chimica Applicata LA CORROSIONE Nei terreni
SISTEMA BINARIO DI DUE LIQUIDI VOLATILI TOTALMENTE MISCIBILI che seguono Raoult
 SISTEM INRIO DI DUE IQUIDI OTII MENTE MISCIII che seguono Raoult Consideriamo due liquidi e totalmente miscibili di composizione χ e χ presenti in un contenitore ad una certa temperatura T=T 1. o strato
SISTEM INRIO DI DUE IQUIDI OTII MENTE MISCIII che seguono Raoult Consideriamo due liquidi e totalmente miscibili di composizione χ e χ presenti in un contenitore ad una certa temperatura T=T 1. o strato
Analisi delle acque dell isola di Favignana
 Analisi delle acque dell isola di Favignana Durante le attività svolte al campo scuola nell ambito del progetto Un mare di.. risorse, il nostro gruppo si è occupato di analizzare le acque del mare in diversi
Analisi delle acque dell isola di Favignana Durante le attività svolte al campo scuola nell ambito del progetto Un mare di.. risorse, il nostro gruppo si è occupato di analizzare le acque del mare in diversi
NAOHG LIVING WATER www.naohg.com
 NAOHG LIVING WATER www.naohg.com LE GRANDI TRASFORMAZIONI ECONOMICHE DELLA STORIA AVVENGONO QUANDO UNA NUOVA TECNOLOGIA DI COMUNICAZIONE CONVERGE CON UN NUOVO SISTEMA ENERGETICO www.naohg.com COMPANY Registrata
NAOHG LIVING WATER www.naohg.com LE GRANDI TRASFORMAZIONI ECONOMICHE DELLA STORIA AVVENGONO QUANDO UNA NUOVA TECNOLOGIA DI COMUNICAZIONE CONVERGE CON UN NUOVO SISTEMA ENERGETICO www.naohg.com COMPANY Registrata
COMPONENTI TERMODINAMICI APERTI
 CAPITOLO NONO COMPONENTI TERMODINAMICI APERTI Esempi applicativi Vengono di seguito esaminati alcuni componenti di macchine termiche che possono essere considerati come sistemi aperti A) Macchina termica
CAPITOLO NONO COMPONENTI TERMODINAMICI APERTI Esempi applicativi Vengono di seguito esaminati alcuni componenti di macchine termiche che possono essere considerati come sistemi aperti A) Macchina termica
INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca
 INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca La ricerca come strumento per lo sviluppo aziendale: sinergia tra università e industria
INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca La ricerca come strumento per lo sviluppo aziendale: sinergia tra università e industria
Come funziona una centrale a ciclo combinato? Aggiungere l immagine sotto e fare un mix dei due testi di spiegazione del funzionamento
 LA TECNOLOGIA DEL CICLO COMBINATO A GAS NATURALE La maggiore quantità di energia elettrica generata da Edison è prodotta da 28 centrali termoelettriche. Edison sviluppa, progetta e costruisce interamente,
LA TECNOLOGIA DEL CICLO COMBINATO A GAS NATURALE La maggiore quantità di energia elettrica generata da Edison è prodotta da 28 centrali termoelettriche. Edison sviluppa, progetta e costruisce interamente,
L Ozono è un gas altamente reattivo, di odore pungente e ad elevate concentrazioni di colore blu, dotato di un elevato potere ossidante.
 Ozono (O 3 ) Che cos è Danni causati Evoluzione Metodo di misura Che cos è L Ozono è un gas altamente reattivo, di odore pungente e ad elevate concentrazioni di colore blu, dotato di un elevato potere
Ozono (O 3 ) Che cos è Danni causati Evoluzione Metodo di misura Che cos è L Ozono è un gas altamente reattivo, di odore pungente e ad elevate concentrazioni di colore blu, dotato di un elevato potere
La raffinazione del petrolio
 La raffinazione del petrolio Approfondimento sulla distillazione per la I^ Itis Prof. Maurizi Franco Itis Einstein Roma ( foto ed immagini reperiti da internet, eventuali detentori di diritti sono pregati
La raffinazione del petrolio Approfondimento sulla distillazione per la I^ Itis Prof. Maurizi Franco Itis Einstein Roma ( foto ed immagini reperiti da internet, eventuali detentori di diritti sono pregati
CHIMICA. Una teoria è scientifica solo se è falsificabile (cioè se è possibile sperimentalmente smentire le sue previsioni)
 CHIMICA SCIENZA SPERIMENTALE: cioè si basa sul metodo sperimentale (Galileo è il precursore). Osservazione dei fenomeni (raccolta e interpretazioni dati) Formulazione ipotesi Verifica sperimentale (eventualmente
CHIMICA SCIENZA SPERIMENTALE: cioè si basa sul metodo sperimentale (Galileo è il precursore). Osservazione dei fenomeni (raccolta e interpretazioni dati) Formulazione ipotesi Verifica sperimentale (eventualmente
SCALA DEI PESI ATOMICI RELATIVI E MEDI
 SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
L acqua. Quando tantissime molecole di acqua si fondono insieme possiamo vedere l'acqua e berla o usarla.
 L acqua L'acqua è una sostanza molto importante, poiché forma la maggior parte dell'organismo umano. E' fatta di particelle molto piccole, gli ATOMI. Uno di questi atomi è chiamato IDROGENO (H) e l'altro
L acqua L'acqua è una sostanza molto importante, poiché forma la maggior parte dell'organismo umano. E' fatta di particelle molto piccole, gli ATOMI. Uno di questi atomi è chiamato IDROGENO (H) e l'altro
Esercizi di analisi della combustione
 Esercizi di analisi della combustione Esercizio n. 1 Un combustibile gassoso abbia la seguente composizione volumetrica: CH 4 84,1% C 2 H 6 (etano) 6,7% CO 2 0,8% N 2 8,4% Si calcoli l aria stechiometrica
Esercizi di analisi della combustione Esercizio n. 1 Un combustibile gassoso abbia la seguente composizione volumetrica: CH 4 84,1% C 2 H 6 (etano) 6,7% CO 2 0,8% N 2 8,4% Si calcoli l aria stechiometrica
Cos'è e come funziona una discarica.
 Cos'è e come funziona una discarica. La discarica di rifiuti è un luogo dove vengono depositati in modo non differenziato i rifiuti solidi urbani e tutti i rifiuti provenienti dalle attività umane. La
Cos'è e come funziona una discarica. La discarica di rifiuti è un luogo dove vengono depositati in modo non differenziato i rifiuti solidi urbani e tutti i rifiuti provenienti dalle attività umane. La
Applicazioni della Termochimica: Combustioni
 CHIMICA APPLICATA Applicazioni della Termochimica: Combustioni Combustioni Il comburente più comune è l ossigeno dell aria Aria secca:! 78% N 2 21% O 2 1% gas rari Combustioni Parametri importanti:! 1.Potere
CHIMICA APPLICATA Applicazioni della Termochimica: Combustioni Combustioni Il comburente più comune è l ossigeno dell aria Aria secca:! 78% N 2 21% O 2 1% gas rari Combustioni Parametri importanti:! 1.Potere
PIANO ISS INSEGNARE SCIENZE SPERIMENTALI 4 PRESIDIO TERRITORIALE- BR
 PIANO ISS INSEGNARE SCIENZE SPERIMENTALI 4 PRESIDIO TERRITORIALE- BR Tema: La combustione Attività: Combustione e... dintorni Istituto Tecnico Commerciale Statale G:Calò Francavilla Fontana (BR) www.itccalo.it
PIANO ISS INSEGNARE SCIENZE SPERIMENTALI 4 PRESIDIO TERRITORIALE- BR Tema: La combustione Attività: Combustione e... dintorni Istituto Tecnico Commerciale Statale G:Calò Francavilla Fontana (BR) www.itccalo.it
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
IL SOLE. Il Sole è una stella cioè un corpo che emette luce ed energia ed è formato da gas, principalmente idrogeno (74%) ed elio (24%)
 IL SOLE Il Sole è una stella cioè un corpo che emette luce ed energia ed è formato da gas, principalmente idrogeno (74%) ed elio (24%) Struttura del Sole 0 - nel NUCLEO viene prodotta l energia emessa
IL SOLE Il Sole è una stella cioè un corpo che emette luce ed energia ed è formato da gas, principalmente idrogeno (74%) ed elio (24%) Struttura del Sole 0 - nel NUCLEO viene prodotta l energia emessa
COME SI SONO PRODOTTE? Tutte le fonti di energia rinnovabili ed esauribili, oggi a nostra disposizione si sono generate dal sole.
 LE FONTI DI ENERGIA COSA SONO? Le fonti di energia sono sostanze in cui all origine è immagazzinata l energia che gli uomini utilizzano. Le fonti di energia più importanti sono quelle che sono in grado
LE FONTI DI ENERGIA COSA SONO? Le fonti di energia sono sostanze in cui all origine è immagazzinata l energia che gli uomini utilizzano. Le fonti di energia più importanti sono quelle che sono in grado
9. Urti e conservazione della quantità di moto.
 9. Urti e conservazione della quantità di moto. 1 Conservazione dell impulso m1 v1 v2 m2 Prima Consideriamo due punti materiali di massa m 1 e m 2 che si muovono in una dimensione. Supponiamo che i due
9. Urti e conservazione della quantità di moto. 1 Conservazione dell impulso m1 v1 v2 m2 Prima Consideriamo due punti materiali di massa m 1 e m 2 che si muovono in una dimensione. Supponiamo che i due
Liquidi, Solidi e Forze Intermolecolari
 Liquidi, Solidi e Forze Intermolecolari Distanze tra molecole Stati Fisici (Fase) Comportamento atipico La maggiore differenza tra liquidi e solidi consiste nella libertà di movimento delle loro molecole
Liquidi, Solidi e Forze Intermolecolari Distanze tra molecole Stati Fisici (Fase) Comportamento atipico La maggiore differenza tra liquidi e solidi consiste nella libertà di movimento delle loro molecole
2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà. I liquidi e loro proprietà
 2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà 1 I liquidi e loro proprietà 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito. I gas occupano i loro contenitori uniformemente
2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà 1 I liquidi e loro proprietà 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito. I gas occupano i loro contenitori uniformemente
Simulazione test di ingresso Ingegneria Industriale Viterbo. Quesiti di Logica, Chimica e Fisica. Logica
 Simulazione test di ingresso Ingegneria Industriale Viterbo Quesiti di Logica, Chimica e Fisica Logica L1 - Come si conclude questa serie di numeri? 9, 16, 25, 36,... A) 47 B) 49 C) 48 D) 45 L2 - Quale
Simulazione test di ingresso Ingegneria Industriale Viterbo Quesiti di Logica, Chimica e Fisica Logica L1 - Come si conclude questa serie di numeri? 9, 16, 25, 36,... A) 47 B) 49 C) 48 D) 45 L2 - Quale
Il controllo dei gas di combustione degli impianti termici
 AUTONOME PROVINZ BOZEN - SÜDTIRO L Landesagentur für Umwelt PROVINCIA AUTONOMA DI BOLZANO - ALTO ADIGE Agenzia provinciale per l ambiente Il controllo dei gas di combustione degli impianti termici Nel
AUTONOME PROVINZ BOZEN - SÜDTIRO L Landesagentur für Umwelt PROVINCIA AUTONOMA DI BOLZANO - ALTO ADIGE Agenzia provinciale per l ambiente Il controllo dei gas di combustione degli impianti termici Nel
TOTEDA FRANCESCO 2 OPA
 TOTEDA FRANCESCO 2 OPA Che cos è l energia Che cosa sono le fonti rinnovabili Energia solare Pannello solare termico Pannello fotovoltaico Energia eolica Centrali idroelettriche Forme di energia non rinnovabili
TOTEDA FRANCESCO 2 OPA Che cos è l energia Che cosa sono le fonti rinnovabili Energia solare Pannello solare termico Pannello fotovoltaico Energia eolica Centrali idroelettriche Forme di energia non rinnovabili
Lavori intelligenti per il risparmio energetico
 Città di San Donà di Piave Assessorato all Ambiente SPORTELLO ENERGIA Lavori intelligenti per il risparmio energetico SOLARE TERMICO Un impianto a collettori solari (anche detto a pannelli solari termici
Città di San Donà di Piave Assessorato all Ambiente SPORTELLO ENERGIA Lavori intelligenti per il risparmio energetico SOLARE TERMICO Un impianto a collettori solari (anche detto a pannelli solari termici
'RPDQGHFRQFHWWXDOL Alcuni interrogativi su fenomeni fisici e chimici
 ,OPDWHULDOHGLGDWWLFRFKHVHJXHqVWDWRVFHOWRWUDGRWWRHDGDWWDWRGDO*UXSSRGLFKLPLFD GHOO,7,60DMRUDQDGL*UXJOLDVFR7RULQR0DUFR)DODVFD$QJHOR&LPHQLV3DROD&RVFLD /RUHGDQD$QJHOHUL$QWRQHOOD0DUWLQL'DULR*D]]ROD*UD]LD5L]]R*LXVL'L'LR
,OPDWHULDOHGLGDWWLFRFKHVHJXHqVWDWRVFHOWRWUDGRWWRHDGDWWDWRGDO*UXSSRGLFKLPLFD GHOO,7,60DMRUDQDGL*UXJOLDVFR7RULQR0DUFR)DODVFD$QJHOR&LPHQLV3DROD&RVFLD /RUHGDQD$QJHOHUL$QWRQHOOD0DUWLQL'DULR*D]]ROD*UD]LD5L]]R*LXVL'L'LR
COGENERAZIONE A BIOGAS
 COGENERAZIONE A BIOGAS Aspetti ambientali L evoluzione del biogas per un agricoltura più sostenibile BOLOGNA, 6 Luglio 2011 INTERGEN Divisione energia di IML Impianti s.r.l. - via garcía lorca 25-23871
COGENERAZIONE A BIOGAS Aspetti ambientali L evoluzione del biogas per un agricoltura più sostenibile BOLOGNA, 6 Luglio 2011 INTERGEN Divisione energia di IML Impianti s.r.l. - via garcía lorca 25-23871
Tali fluidi, utilizzati in prossimità del punto di produzione, o trasportati a distanza, possono essere utilizzati per diversi impieghi:
 LA COGENERAZIONE TERMICA ED ELETTRICA 1. Introduzione 2. Turbine a Gas 3. Turbine a vapore a ciclo combinato 4. Motori alternativi 5. Confronto tra le diverse soluzioni 6. Benefici ambientali 7. Vantaggi
LA COGENERAZIONE TERMICA ED ELETTRICA 1. Introduzione 2. Turbine a Gas 3. Turbine a vapore a ciclo combinato 4. Motori alternativi 5. Confronto tra le diverse soluzioni 6. Benefici ambientali 7. Vantaggi
ENERGIA COMBUSTIBILI FOSSILI
 ENERGIA COMBUSTIBILI FOSSILI COMBUSTIBILI FOSSILI CARBONE, PETROLIO, GAS METANO COMBUSTIBILI: bruciano in presenza di ossigeno e producono calore FOSSILI: si sono formati nel corso di milioni di anni nel
ENERGIA COMBUSTIBILI FOSSILI COMBUSTIBILI FOSSILI CARBONE, PETROLIO, GAS METANO COMBUSTIBILI: bruciano in presenza di ossigeno e producono calore FOSSILI: si sono formati nel corso di milioni di anni nel
CENTRALI TERMOELETTRICHE
 CENTRALI TERMOELETTRICHE Le centrali termoelettriche sono impianti che utilizzano l energia chimica dei combustibili per trasformarla in energia elettrica. Nelle centrali termoelettriche la produzione
CENTRALI TERMOELETTRICHE Le centrali termoelettriche sono impianti che utilizzano l energia chimica dei combustibili per trasformarla in energia elettrica. Nelle centrali termoelettriche la produzione
Capitolo 7. Le soluzioni
 Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
6.1. Risultati simulazioni termovalorizzatore Osmannoro2000
 pag. 217 6. Risultati Di seguito si riportano i risultati relativi alle diverse simulazioni di diffusione atmosferica degli inquinanti effettuate. In particolare sono riportati i risultati sotto forma
pag. 217 6. Risultati Di seguito si riportano i risultati relativi alle diverse simulazioni di diffusione atmosferica degli inquinanti effettuate. In particolare sono riportati i risultati sotto forma
Selezione test GIOCHI DELLA CHIMICA
 Selezione test GIOCHI DELLA CHIMICA CLASSE A Velocità - Equilibrio - Energia Regionali 2010 36. Se il valore della costante di equilibrio di una reazione chimica diminuisce al crescere della temperatura,
Selezione test GIOCHI DELLA CHIMICA CLASSE A Velocità - Equilibrio - Energia Regionali 2010 36. Se il valore della costante di equilibrio di una reazione chimica diminuisce al crescere della temperatura,
CALORE. Compie lavoro. Il calore è energia. Temperatura e calore. L energia è la capacità di un corpo di compiere un lavoro
 Cos è il calore? Per rispondere si osservino le seguenti immagini Temperatura e calore Il calore del termosifone fa girare una girandola Il calore del termosifone fa scoppiare un palloncino Il calore del
Cos è il calore? Per rispondere si osservino le seguenti immagini Temperatura e calore Il calore del termosifone fa girare una girandola Il calore del termosifone fa scoppiare un palloncino Il calore del
Determinazione della composizione elementare dello ione molecolare. Metodo dell abbondanza isotopica. Misure di massa esatta
 Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
Cos è una. pompa di calore?
 Cos è una pompa di calore? !? La pompa di calore aria/acqua La pompa di calore (PDC) aria-acqua è una macchina in grado di trasferire energia termica (calore) dall aria esterna all acqua dell impianto
Cos è una pompa di calore? !? La pompa di calore aria/acqua La pompa di calore (PDC) aria-acqua è una macchina in grado di trasferire energia termica (calore) dall aria esterna all acqua dell impianto
Quando si parla di inquinamento dell'acqua, si intende sia l'inquinamento dell'acqua superficiale (fiumi, laghi, mare) sia dell'acqua presente sotto
 L'acqua inquinata Quando si parla di inquinamento dell'acqua, si intende sia l'inquinamento dell'acqua superficiale (fiumi, laghi, mare) sia dell'acqua presente sotto il suolo (falde acquifere). Va tenuto
L'acqua inquinata Quando si parla di inquinamento dell'acqua, si intende sia l'inquinamento dell'acqua superficiale (fiumi, laghi, mare) sia dell'acqua presente sotto il suolo (falde acquifere). Va tenuto
SICUREZZA DELLE VIE DI FUGA NEI PICCOLI LUOGHI DI LAVORO
 SICUREZZA DELLE VIE DI FUGA NEI PICCOLI LUOGHI DI LAVORO Le vie di esodo costituiscono il primo problema da affrontare quando si progetta la sicurezza di un edificio. Infatti, la sicurezza delle persone
SICUREZZA DELLE VIE DI FUGA NEI PICCOLI LUOGHI DI LAVORO Le vie di esodo costituiscono il primo problema da affrontare quando si progetta la sicurezza di un edificio. Infatti, la sicurezza delle persone
V= R*I. LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro.
 LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
OSSIGENO DISCIOLTO ED EUTROFIZZAZIONE
 OSSIGENO DISCIOLTO ED EUTROFIZZAZIONE Un esempio di misure di ossigeno e ph in acque contenenti piante acquatiche (alla luce e al buio) Misura (con un ossimetro) dell ossigeno disciolto all inizio di un
OSSIGENO DISCIOLTO ED EUTROFIZZAZIONE Un esempio di misure di ossigeno e ph in acque contenenti piante acquatiche (alla luce e al buio) Misura (con un ossimetro) dell ossigeno disciolto all inizio di un
Fresco con il sol e 60% de risparmio energetico. SOLARCOOL TECNOLOGIA Spiegazione termodinamica
 Fresco con il sol e 60% de risparmio energetico SOLARCOOL TECNOLOGIA Spiegazione termodinamica L efficienza del sistema Solar Cool è possibile grazie ad un effetto fisico del flusso di massa, che è un
Fresco con il sol e 60% de risparmio energetico SOLARCOOL TECNOLOGIA Spiegazione termodinamica L efficienza del sistema Solar Cool è possibile grazie ad un effetto fisico del flusso di massa, che è un
LA MATERIA MATERIA. COMPOSIZIONE (struttura) Atomi che la compongono
 LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
J.H. C. Classe I B Virgilio. C.G. Classe V B Virgilio
 J.H. C. Classe I B Virgilio C.G. Classe V B Virgilio Classe V A Virgilio Il suolo è uno dei beni più preziosi dell umanità. Consente la vita dei vegetali, degli animali e dell uomo sulla superficie della
J.H. C. Classe I B Virgilio C.G. Classe V B Virgilio Classe V A Virgilio Il suolo è uno dei beni più preziosi dell umanità. Consente la vita dei vegetali, degli animali e dell uomo sulla superficie della
Auto, moto, scooter, biciclette, urban mobility elettrici e ibridi, la mobilità è ad una svolta!! Ma cosa sono e come funzionano?
 Auto, moto, scooter, biciclette, urban mobility elettrici e ibridi, la mobilità è ad una svolta!! Ma cosa sono e come funzionano? Vediamo di conoscerli un po meglio!! Come è costituito un mezzo elettrico
Auto, moto, scooter, biciclette, urban mobility elettrici e ibridi, la mobilità è ad una svolta!! Ma cosa sono e come funzionano? Vediamo di conoscerli un po meglio!! Come è costituito un mezzo elettrico
Temperatura e Calore
 Temperatura e Calore 1 Temperatura e Calore Stati di Aggregazione Temperatura Scale Termometriche Dilatazione Termica Il Calore L Equilibrio Termico La Propagazione del Calore I Passaggi di Stato 2 Gli
Temperatura e Calore 1 Temperatura e Calore Stati di Aggregazione Temperatura Scale Termometriche Dilatazione Termica Il Calore L Equilibrio Termico La Propagazione del Calore I Passaggi di Stato 2 Gli
STABILIMENTO DI TARANTO. Febbraio 2007. Allegato D10
 STABILIMENTO DI TARANTO Febbraio 2007 Analisi energetica dello Stabilimento Siderurgico ILVA di Taranto Lo stabilimento siderurgico di Taranto consuma, nel suo assetto attuale, c.a. 181.000 Tj/anno in
STABILIMENTO DI TARANTO Febbraio 2007 Analisi energetica dello Stabilimento Siderurgico ILVA di Taranto Lo stabilimento siderurgico di Taranto consuma, nel suo assetto attuale, c.a. 181.000 Tj/anno in
AUTOPROTETTORI. cenni sulla respirazione umana
 AUTOPROTETTORI cenni sulla respirazione umana L aria che noi respiriamo è una miscela gassosa di ossigeno (20,9%) e di azoto (78,1% in volume), con quantità variabili di vapore acqueo, anidride carbonica,
AUTOPROTETTORI cenni sulla respirazione umana L aria che noi respiriamo è una miscela gassosa di ossigeno (20,9%) e di azoto (78,1% in volume), con quantità variabili di vapore acqueo, anidride carbonica,
SISTEMI ENERGETICI. L ATP privato di uno dei suoi 3 radicali fosforici diventa ADP (adenosindifosfato).
 SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
Sistemi di controllo catalitico dell inquinamento atmosferico per la rimozione di sostanze organiche volatili (VOCs)
 Sistemi di controllo catalitico dell inquinamento atmosferico per la rimozione di sostanze organiche volatili (VOCs) Bietigheim-, 02.08.2010 I metodi catalitici per trattare gli inquinanti atmosferici
Sistemi di controllo catalitico dell inquinamento atmosferico per la rimozione di sostanze organiche volatili (VOCs) Bietigheim-, 02.08.2010 I metodi catalitici per trattare gli inquinanti atmosferici
FOTOSINTESI: LA FASE LUMINOSA
 FOTOSINTESI: LA FASE LUMINOSA Un video : Clic Premessa (I) In questa lezione si esamina in dettaglio la serie di reazioni che trasformano l'energia solare in energia chimica fino alla sintesi di ATP e
FOTOSINTESI: LA FASE LUMINOSA Un video : Clic Premessa (I) In questa lezione si esamina in dettaglio la serie di reazioni che trasformano l'energia solare in energia chimica fino alla sintesi di ATP e
STATO LIQUIDO. Si definisce tensione superficiale (γ) il lavoro che bisogna fare per aumentare di 1 cm 2 la superficie del liquido.
 STTO LIQUIDO Una sostanza liquida è formata da particelle in continuo movimento casuale, come in un gas, tuttavia le particelle restano a contatto le une alle altre e risentono sempre delle notevoli forze
STTO LIQUIDO Una sostanza liquida è formata da particelle in continuo movimento casuale, come in un gas, tuttavia le particelle restano a contatto le une alle altre e risentono sempre delle notevoli forze
