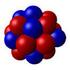
Figura 1.7 la rappresentazione dei nuclei stabili nel piano Z-N
|
|
|
- Carolina Gaetana Sassi
- 5 anni fa
- Visualizzazioni
Transcript
1 Figura 1.7 la rappresentazione dei nuclei stabili nel piano Z-N
2
3 Stabiltà e instabilità nucleare Se analizziamo attentamente la carta dei nuclidi, vediamo che in essa sono rappresentati, oltre ai nuclei stabili, anche vari nuclei instabili. Con il termine instabile si intende definire un nucleo che spontaneamente subisce una trasformazione per raggiungere uno stato stabile (o più stabile). Così, nuclei che nel piano N-Z hanno un eccesso di protoni rispetto a quanto previsto dalla curva di stabilità, tenderanno a trasformare un protone in un neutrone, e viceversa tenderanno a fare i nuclei con un eccesso di neutroni. Le trasformazioni spontanee più comuni sono: decadimento α il nucleo emette una particella α, cioè un nucleo di Elio4. L Elio è infatti molto stabile, avendo un valore B/A=7.07 MeV, molto alto rispetto a tutti gli altri nuclei leggeri. decadimento β - : n p + e - + ν decadimento β + : cattura elettronica ε: p n + e + + ν p + e - n + ν
4 Le reazioni indicate sopra riguardano trasformazioni di singoli protoni e neutroni all interno del nucleo. Gli elettroni, negativo o positivo (positrone), emessi si chiamano particelle beta, ma a parte l origine nucleare, sono del tutto identici all elettrone o positrone atomico. Nella cattura elettronica, un elettrone atomico (generalmente della shell K, più interna) avente una funzione d onda sensibilmente diversa da zero nel volume del nucleo, viene catturato da un protone nucleare: le due particelle si trasformano in un neutrone nucleare. La particella che si accompagna all elettrone è il neutrino o l anti-neutrino. Vedremo nel seguito in dettaglio questi decadimenti: per ora vogliamo solo analizzarli dal punto di vista energetico, stabilire cioè mediante l utilizzo delle tavole delle masse quali e quando sono possibili. Nei conti che seguono consideriamo nulla la massa del neutrino.
5 decadimento β - : n p + e - +ν A X A Z Z+1 Y + β + ν Nel bilancio energetico vanno considerate le masse nucleari. Affinché la reazione avvenga deve ovviamente essere: m(z,a) m(z+1,a)+m e Tuttavia, nella maggior parte delle tabelle sono riportate le masse atomiche, non quelle nucleari. Risulta quindi utile ragionare in termini di masse atomiche. Se aggiungiamo Zm e ad entrambi i membri: m(z,a) + Zm e m(z+1,a) + (Z+1)m e ossia: M(Z,A) M(Z+1,A) Introducendo le masse atomiche abbiamo considerato legato anche lo (Z+1)-esimo elettrone (pochi ev). decadimento β + : p n + e + + ν A X A Z Z 1 Y + β + + ν Deve ovviamente essere: m(z,a) m(z-1,a)+m e Se aggiungiamo Zm e ad entrambi i membri: m(z,a) + Zm e m(z-1,a) + Zm e + m e = m(z-1,a) + (Z-1)m e +2m e ossia: M(Z,A) M(Z-1,A) + 2m e Qui abbiamo invece considerato libero un elettrone che in effetti è legato (pochi ev).
6 cattura elettronica ε: p + e - n + ν Deve risultare: m(z,a) + m e m(z-1,a) Se aggiungiamo (Z-1)m e ad entrambi i membri: A X + e A Z Z 1 Y + ν m(z,a) + (Z-1)m e + m e = m(z,a) + Zm e m(z-1,a) + (Z-1)m e Ossia: M(Z,A) M(Z-1,A) decadimento α A A X 4 Z Z 2 Y He m(z,a) m(z-2,a-4) + m( 4 He) Se aggiungiamo Zm e ad entrambi i membri: m(z,a) + Zm e m(z-2,a-4) +(Z-2)m e + m( 4 He) + 2m e ossia: M(Z,A) M(Z-2,A-4) + M( 4 He) trascurando la diversa energia di legame degli elettroni nei nuclei X,Y ed He
7 Riassumendo, e indicando al solito rispettivamente con M e m le masse atomiche e nucleari: M(Z,A) M(Z+1,A) > 0 m(z,a) m(z+1,a) > m e M(Z,A) M(Z-1,A) > 0 m(z,a) + m e m(z-1,a) M(Z,A) M(Z-1,A) > 2m e m(z,a) m(z-1,a) > m e M(Z,A) M(Z-2,A-4) > M( 4 He) m(z,a) m(z-2,a-4) > m( 4 He) decadimento β - possibile cattura elettronica ε possibile decadimento β + e cattura elettronica possibili decadimento α possibile
8 Energia Z-2 Z-1 Z Z+1 A X A Z Z+1 Y + β + ν Z -> Z + 1 A X A Z Z 1 Y + β + + ν e A X + e A Z Z 1 Y + ν Z -> Z - 1 A A X 4 Z Z 2 Y He Z -> Z - 2
9 Energia Z-2 Z-1 Z Z+1 M(Z,A) M(Z+1,A) > 0 m(z,a) m(z+1,a) > m e
10 Energia Z-2 Z-1 Z Z+1 M(Z,A) M(Z-1,A) > 0 m(z,a) + m e m(z-1,a) M(Z,A) M(Z-1,A) > 2m e m(z,a) m(z-1,a) > m e
11 Energia Z-2 Z-1 Z Z+1 M(Z,A) M(Z-2,A-4) > M( 4 He) m(z,a) m(z-2,a-4) > m( 4 He)
12 Vediamo qualche esempio: ( ) E ν = m( 22 Na) m * ( 22 Ne) = m( 22 Na) m( 22 Ne) + E ecc T max β + = m 22 Na ( ) m e ( ) m( 22 Ne) + E ecc
13 T max = m 60 Co β1 T max β2 = m 60 Co ( ) ( ) m( 60 Ni) ( ) ( ) m( 60 Ni)
14 ΔE Δτ ΔE = Δτ = c cδτ = = MeV
15
16 Il neutrone è instabile per decadimento beta? Dalle tavole ricaviamo che: m n > m p + m e e precisamente: m n = MeV, m p = MeV, m e = MeV pertanto il decadimento beta del neutrone isolato è possibile. In effetti si osserva sperimentalmente: la massima energia dell elettrone emesso (per una trattazione più estesa si rimanda al capitolo che descrive in maggior dettaglio il decadimento beta) è appunto pari a: T emax = m n - m p - m e = MeV. Il neutrone libero ha una vita media di circa 15 minuti (885 ± 0.8 s). Prendiamo in esame il nucleo: Na 12 Può avvenire qualche decadimento? β - : 23 Na Mg 11 + e + ν β + : 23 Na Ne 13 + e + + ν α : 23 Na F He 2
17 Le masse dei nuclidi eventualmente coinvolti sono: M( Na ) = MeV M( Mg ) = MeV M( Ne ) = MeV M( 19 9 F ) = MeV M( 2 4 He ) = MeV M( 19 9 F ) + M( 4 2 He ) = MeV Facendo i conti, si vede che nessuno dei decadimenti è energeticamente possibile. Pertanto, come c era da aspettarsi, il nucleo Na è stabile.
18 Vediamo ora con un altro isotopo del sodio: Na Può avvenire qualche decadimento? β - : 22 Na Mg + e + ν β + : 22 Na Ne + e + + ν α : 22 Na Ne + α Le masse dei nuclidi eventualmente coinvolti sono: M( Na ) = MeV M( Mg ) = MeV M( Ne ) = MeV M( 9 M( 2 4 He ) = MeV M( 9 18 F ) = MeV 18 F ) + M( 2 4 He ) = MeV Facendo i conti, si vede che sono energeticamente possibili il decadimento β + e di conseguenza la cattura elettronica ε.
19 Terzo esempio: 14 C 6 Dai conti sulle masse si ricava che il nucleo Carbonio 14 è instabile per decadimento β - : 14 C N + e + ν La differenza delle masse vale: M( 14 6 C ) - M( 14 7 N ) = = MeV Pertanto la massima energia cinetica dell elettrone emesso potrà valere 156 kev (vedi nel seguito le teoria del decadimento beta).
20 Ultimo esempio. 40 K 19 β - : K Ca + e + ν β + : K Ar + e + + ν ε : K + e Ar + ν I valori della masse atomiche sono i seguenti: M( 40 K) = M( 40 Ca) = M( 40 A) = Dai valori riportati si verifica che sono possibili sia il decadimento β - che la cattura elettronica, che si osservano sperimentalmente. Per la verità è energeticamente possibile anche il decadimento β +, che però non si osserva (per maggiori dettagli vedi il capitolo 7 sul decadimento beta).
21 Le leggi del decadimento radioattivo Già nel 1900 era nota la radioattività naturale a Rutherford e Soddy che studiarono quantitativamente la variazione temporale di attività del Radon 222 riportato in figura. (La trasformazione è: 222 Rn 218 Po + α ) Fig. 3.1 andamento temporale delle quantità Radon e Polonio in un campione radioattivo
22 Le curve riportate nelle figure rappresentano degli esponenziali del tipo: A X = A 0 X e λt per il Th A = A 0 ( 1 e λt ) per l U Queste osservazioni portarono a formulare una teoria sul decadimento radioattivo: la radioattività rappresenta un cambiamento dell atomo individuale. Si tratta di un processo puramente statistico. nel senso che è impossibile prevedere in quale istante un certo nucleo si trasformerà, ma è possibile prevedere quanti nuclei saranno decaduti in media dopo un certo intervallo di tempo. Sia N P (t) il numero di atomi parents (genitori) radioattivi presente nel campione al tempo t. Se i decadimenti sono indipendenti (nel senso che il decadimento di un atomo non influenza i decadimenti degli altri atomi della sorgente), il numero di atomi che decadranno in un intervallo di tempo dt è dato da: dn p = λn p dt dove, caratteristica di ogni nuclide radioattivo, è detta costante di decadimento, ed il segno meno sta a indicare che N P (t) decresce con il tempo.
23 Separando le variabili: dn p N p = λ dt che integrata dà appunto: N p = N 0 e λt N P (t) rappresenta il numero di nuclei radioattivi parents presenti al tempo t (non ancora decaduti), essendo N O il numero di atomi presenti al tempo t=0. Attività Si definisce attività di un campione il numero di decadimenti subiti nell unità di tempo. Essa risulta quindi: a = dn dt, dove il valore assoluto è necessario perché l attività è definita positiva. Risulta pertanto: a = λn 0 e λt = λn p cioè l attività è proporzionale al numero di nuclei radioattivi presenti nel campione ed alla probabilità di decadimento per unità di tempo λ.
24 Allo stesso modo per quanto riguarda la formazione del nuovo elemento daughter (figlio), la variazione nel tempo dn d /dt è la stessa ma di segno opposto: dn d = +λ N p dt (infatti deve ovviamente essere: dn p +dn d =0) Allora: dn d dt = +λ N = λ N p 0 e λt che risolta con la condizione che per t=0 era N d =0, dà: N d = N 0 ( 1 e λt ) Ovviamente ad ogni istante risulta: N p + N d = N 0. λ è detta costante di decadimento ed ha le dimensioni dell inverso di un tempo: rappresenta la probabilità di decadimento per unità di tempo di ogni singolo atomo del campione; τ = 1/λ è la vita media, il cui significato fisico è il seguente:
25 per t=τ risulta N( τ) = N 0 e 1, e quindi in un intervallo di tempo τ, il numero di atomi radioattivi, e quindi l attività del campione si riduce di un fattore e, circa 3. τ è detta vita media: infatti, per trovare la media dei tempi di vita di tutti gli atomi, si deve calcolare: < t > = 1 N 0 t dn = 1 N 0 λt N 0 e λt dt = 1 λ = τ Si definisce tempo di dimezzamento T 1/2 il tempo nel quale il numero di atomi radioattivi, e quindi l attività si dimezza. N( T 1/ 2 ) = N 0 e λt 1/ 2 = N 0 2 e λt 1/ 2 = 2 1, e quindi: T = ln2 1/ 2 λ = λ = τ
26 Decadimenti successivi. Famiglie radioattive Supponiamo che anche i nuclei formati siano radioattivi, e quindi essi stessi decadano. Si potrà avere un decadimento a cascata del tipo: X 1 X 2 X 3 X N
27 Vediamo un caso più semplice: X 1 X 2, con X 2 stabile. Bisogna risolvere il sistema di equazioni differenziali seguente: dn 1 = λ 1 N 1 dt Dalla prima si ottiene subito: N 1 = N 10 e λ 1 t dn 2 dt = +λ 1 N 1 che inserito nella seconda, dà: dn 2 = λ 1 N 1 dt = λ 1 N 10 e λ 1 t dt integrando ambo i membri: dn 2 = λ 1 N 10 e λ t 1 dt N 2 = N 20 + N 10 ( 1 e λ t 1 )
28 Vediamo ora il caso: X 1 X 2 X 3, con X 3 stabile. Le equazioni differenziali da risolvere sono ora tre: dn 1 dt dn 2 dt dn 3 dt = λ 1 N 1 = λ 1 N 1 N 2 = N 2 Svolgendo i calcoli: N 1 = N 10 e λ 1 t dn 2 = λ 1 N 10 e λ t 1 N 2 dt dn 2 + N 2 = λ 1 N 10 e λ t 1 dt
29 moltiplicando per e t : e t dn 2 che si può riscrivere come: Integrando: N 2 e λ t 2 = λ 1 ( N 10 e λ +λ 1 2 )t λ 1 + C d dt N 2 dt ( + e λ t 2 N 2 = λ 1 N 10 e λ +λ 1 2 )t ( ( t ) e λ t ) 2 = λ N e λ +λ ( )t N 2 = λ 1 λ 1 N 10 e λ 1 t + C e t Il valore della costante C si ricava sapendo che per t=0, N 2 = N 20 : C = λ 1 λ 1 N 10 + N 20 N 2 = N 20 e λ t 2 + λ 1 λ 1 N 10 ( e λ t 1 e λ t ) 2
30 ricaviamo ora N 3 (t): dn 3 = N 2 dt = N 20 e t dt + λ 1 λ 1 N 10 N 3 = N 30 + N 20 e λ t 2 t 0 + N 10 e λ t 1 λ 1 ( N 3 = N 30 + N 20 1 e λ t ) 2 + N 1 + λ 1 e λ 10 λ 1 t 0 ( e λ t 1 e λ t ) 2 dt + λ 1 N 10 e λ λ 1 2 t Nel caso particolare che per t=0 sia N 20 = N 30 = 0: N 1 = N 10 e λ 1 t 2 t λ 1 e λ 1 t t 0 N 2 = λ 1 λ 1 N 10 ( e λ t 1 e λ t ) 2 N 3 = N λ 1 λ 1 e t λ 1 e λ 1 t. (N 3(0) = 0 per qualsiasi valore di N 10 )
31 Vediamo ora il caso: X 1 X 2 X 3... X N-1 X N, con X N stabile. In generale, per una catena di decadimenti, si scrivono le seguenti equazioni differenziali: dn 1 = λ 1 N 1 dt dn 2 = λ 1 N 1 N 2 dt dn 3 = N 2 λ 3 N 3 dt... dn N = λ N 1 N N 1 dt Se per t=0 si ha: N 20 = N 30 =.. = N N0 = 0, si può scrivere: N i = C 1 i e λ 1 t + C 2 i e t C i i e λ i t
32 dove: C 1 i = λ 1...λ i 1 ( λ ) 1 ( λ 1 )... ( λ i λ ) 1 C 2 i = λ 1...λ i 1 ( λ 1 λ ) 2 ( λ 3 )... ( λ i λ ) 2... C i i = λ 1...λ i 1 ( λ 1 λ ) i ( λ i )... ( λ i 1 λ ) i ovviamente essendo λ N = 0 (nucleo stabile).
33 Equilibrio secolare. Consideriamo per semplicità di nuovo il caso: : X 1 X 2 X 3, con X 3 stabile. e supponiamo che sia: λ 1 << (ossia τ 1 >> τ 2 ). Allora: N 2 = λ 1 λ 1 N 10 ( e λ t 1 e λ t ) 2 λ 1 N 10 e λ t 1 = λ 1 N 1 Ossia: λ 1 N 1 = N ( 2 t) e quindi: a 1 = a ( 2 t)
34 Se in generale se in una catena radioattiva X 1 X 2 X 3... X N-1 X N risulta: λ i << λ i+1, λ i+2, λ N-1 per tutti i nuclei che seguono l i-esimo decadimento vale la relazione: a i (t) = a i+1 (t ) =.. = a N-1 (t ) e si dice che i nuclidi si trovano in condizioni di equilibrio secolare. Naturalmente, se la condizione è vera a partire dal capostipite, cioè se: λ 1 << λ i, per ogni i, tutta la catena radioattiva si trova in equilibrio secolare. Per gli elementi naturali (vedi Uranio, Torio, Radio,..) è vera quest ultima condizione perché gli eventuali capostipiti a vita media breve, dal momento della loro formazione sarebbero ormai decaduti.
35 L unità di misura dell attività è il Bequerel (Bq), pari a un decadimento al secondo. Molto usata tutt oggi è la vecchia unità, il Curie (Ci) 1 Ci = disintegrazioni al secondo. L origine storica di questo valore è dovuta al fatto che il Curie è l attività di un grammo di 226 Ra 1 Bq = 2, Ci 1 Ci = Bq Abbiamo visto che l attività è data da: a = dn dt = λn Il numero di atomi N in un campione di massa M e peso atomico A, si ricava dalla relazione: N = N Av M dove N Av è il numero di Avogadro. A a = λn = λn Av M A = MN Av τa = ln2 MN Av T 1/ 2 A
36 Vediamo ora alcuni esempi. Calcolare la massa di 214 Pb corrispondente all attività di 1 Ci. Il 214 Pb decade β - con un tempo di dimezzamento T 1/2 = 26.8 min (τ =38.7 min = sec; λ= sec -1 ) M = aa λn Av = = g = 30 ng Vediamo ora nel caso di 1 Ci di 238 U: l U-238 decade α con un tempo di dimezzamento T 1/2 = anni, pertanto risulta λ= sec -1. M = aa λn Av = = g Vediamo a che massa corrisponde 1 Ci di 24 Na T 1/2 = 14.8 h, λ= sec -1 M = g =0.1 µg e a che massa corrisponde 1 Ci di 32 P: T 1/2 = 14.5 d, λ = sec -1 M = g
37 Naturalmente, per 1 Ci di 226 Ra otteniamo: Il 226 Ra decade α con un tempo di dimezzamento T 1/2 = 1620 anni, pertanto risulta λ= sec -1. M = aa λn Av = = 1.00 g Determinare la massa in grammi di una sorgente di 60 Co da 5000 Ci, supponendo che sia costituita esclusivamente di atomi radioattivi. Il 60 Co decade β - con T 1/2 = 5.26 y (pertanto risulta: λ = sec -1 ) M = aa λn Av = = 4.4 g Trovare la variazione oraria di massa di una sorgente di 1 Ci di 210 Po Il 210 Po decade α in 206 Pb con T 1/2 = d (pertanto risulta λ = sec -1 ). Il 206 Pb è stabile. Dobbiamo calcolare quanti atomi di 210 Po decadono in un ora.
38 Poichè l intervallo di un ora è molto breve rispetto a T 1/2, possiamo con ottima approssimazione considerare costante l attività della sorgente durante l intervallo di un ora e scrivere: a = dn dt = ΔN Δt ΔN = aδt = = Ad ogni decadimento un nucleo di 210 Po si trasforma in un nucleo di 206 Pb più una particella α. La variazione di massa è pari a: m = M fin -M iniz = M(α)+M( 206 Pb)-M( 210 Po) = = amu = g cioè circa 1/100 della massa di un protone! (1 amu = g) la variazione totale di massa sarà allora: ΔM = mδn= 1, , = g =2.2 pg Notiamo che una sorgente da 1Ci di 210 Po ha una massa pari a: M = aa λn Av = = g la variazione di massa oraria è quindi di una parte su 100 milioni.
39 Misura di vita media (o di costante di decadimento). Per vite medie brevi è apprezzabile la variazione di attività della sorgente nel tempo. Si effettuano quindi più (almeno due) misure di attività della sorgente, distanziate tra loro di un certo intervallo di tempo. Indicando con Δt la durata delle singole misure e con C 1 e C 2 i conteggi totali registrati in esse: C 1 = t 1 + Δt a dt = λ N dt = N 0 e λt 1 1 e λδt t 1 t 1 + Δt t 1 ( ) C 2 = t 2 + Δt a dt = λ N dt = N 0 e λt 2 1 e λδt t 2 t 2 + Δt t 2 ( ) dove t 1 e t 2 (ignoti) rappresentano il tempo trascorso tra un istante di riferimento e l inizio delle due misure.
40 Facendo il rapporto: C 1 C 2 = e λt 1 e λt 2 = e λ ( t t 2 1 ) Ossia: λ = 1 ln C 1 t 2 t 1 C 2 t 2 -t 1 rappresenta l intervallo di tempo intercorso tra le due misure. S noti che, ai fini della determinazione della vita media, è sufficiente conoscere l intervallo t 2 -t 1 e non i tempi assoluti. Esempio. Una sorgente radioattiva viene misurata due volte per un tempo di misura Δt=30 minuti a distanza di t 2 -t 1 =24 ore. Si sono ricavati i seguenti valori: C 1 = 9800 e C 2 = Calcolare il tempo di dimezzamento della sorgente. λ = 1 ln C 1 t 2 t 1 = ln = s C 2 Pertanto: τ = s, e T 1/2 = = 2.44 d.
41 Per vite medie lunghe, spesso non è apprezzabile la variazione di attività nel tempo. Allora la misura della vita media, o della costante di decadimento, viene effettuata usando la relazione: a = dn dt = λn λ = a N λ si determina allora da un unica misura di attività e dalla conoscenza di N. Esempio: per trovare la vita media del 147 Sm si è usata una sorgente da 1.000±0.001 grammi e sono stati misurati a=680±4 decadimenti al secondo. Determinare la vita media del Samario con il suo errore τ = N a = N Av M a A = = s = y L indeterminazione relativa su τ è: Δτ τ = Δa a 2 + ΔM M 2 =
42 Quanto tempo è durata la misura? Supponendo nullo l errore sul tempo di misura, l errore relativo sull intensità di conteggi è dato proprio da ΔC/C = Δa/a = 4/680 = E poiché l errore assoluto di un conteggio è dato dal valore della radice quadrata del conteggio stesso (statistica di Poisson), avremo: ΔC C = C C = 1 C = ossia: C = E poiché C=aΔt, il tempo di misura risulta essere stato: Δt = C/a = 42.5 s. Avendo a disposizione 1 Ci di 226 Ra (T 1/2 = 1620 y), determinare quanto 222 Rn (T 1/2 = 8.32 d ) volatile si è formato in 5 anni. Valutare la quantità di Rn sia in grammi che in cm 3 (in condizioni STP).
43 226 Ra α 222 Rn T =1620 y 1/ 2 α 218 Po... T =8.32 d 1/ 2 T 1/2 =1620 y T 1/2 =8.32 d λ 1 = s = s N 2 = λ 1 λ 1 N 10 ( e λ t 1 e λ t ) 2 Ed essendo λ 1 >> : N 2 = λ 1 N 1 = a 1 M 2 : N 2 (t) = A 2 : N Av
44 M 2 = A 2 N 2 N Av = A 2 a 1 N Av = = g In condizioni STP il volume occupato è dato da: V 0 : A = V : M V = V 0 M A = = = 1.43 mm 3 Una sorgente pesa 20 g ed ha una attività di dis/minuto. Si ha il dubbio che tale sorgente sia: a) 230 Th T 1/2 = y λ = s -1 b) 232 Th T 1/2 = y λ = s -1 c) 228 Th T 1/2 = 1.91 y λ = s -1 ricavare il tipo di sorgente dai dati a disposizione.
45 Dalla solita relazione: a = dn dt = λn λ = a N è possibile ricavare la costante di decadimento e confrontarla con i valori tabulati: a = dis/min = dis/s Se consideriamo che il peso atomico della sorgente sia sempre A=230 nei tre casi, commettiamo in ogni caso un errore inferiore all 1% N = N Av M A = = atomi λ = a N = = s 1 La sorgente è quindi 232 Th
46 Se un certo materiale contiene 1 g di 40 K (T 1/2 = y) e si sa che è vecchio di 2.6 milioni di anni, quale è il massimo numero di millilitri di Argon ( 40 K β A ) che può essersi accumulato nel materiale (in condizioni STP)? Il numero di decadimenti avvenuti nel campione in un tempo (2.6 milioni di anni) è dato da: ( ) = a dt = n Δt Δt ( ) λ dt = N 0 λ N t e λt dt = N 0 1 e λδt Δt ma poichè Δt << T 1/2 e quindi λ Δt << 1 si può approssimare: ( ) N Av M N Av M A 1 e λδt A λδt = N Av Δt ln2 M Δt A T 1/ 2 ( ) M = N ( ) Av A 1 e λδt pertanto: ( ) = N Av ln2 M Δt n Δt A T 1/ 2 = atomi che in condizioni STP occupano un volume dato dalla relazione: V = n = = 0.78 cm 3 N Av
47 Una sorgente radioattiva è una mistura 64 Cu (T 1/2 = 12.8 h) e rame stabile (circa 69% di 63 Cu e 31% di 65 Cu). La massa della sorgente e la sua attività sono rispettivamente 100 mg e 28 mci. Ricavare il rapporto in peso tra gli atomi radioattivi e gli atomi stabili presenti nella sorgente. a = = Bq λ = ln = s 1 N = a λ = atomi di 64 Cu M = N N Av A = = grammi di 64 Cu M rad M stab = = , pari a 0.07 ppm (parti per milione).
Le leggi del decadimento radioattivo. Figura 1.7 la rappresentazione dei nuclei stabili nel piano Z-N
 Le leggi del decadimento radioattivo Figura 1.7 la rappresentazione dei nuclei stabili nel piano Z-N Stabiltà e instabilità nucleare Se analizziamo attentamente la carta dei nuclidi, vediamo che in essa
Le leggi del decadimento radioattivo Figura 1.7 la rappresentazione dei nuclei stabili nel piano Z-N Stabiltà e instabilità nucleare Se analizziamo attentamente la carta dei nuclidi, vediamo che in essa
ARGOMENTO: Cenni di Fisica del Nucleo
 UNIVERSITA DEGLI STUDI DI GENOVA C.L. TECNICHE DIAGNOSTICHE RADIOLOGICHE CORSO INTEGRATO: MISURE ELETTRICHE ED ELETTRONICHE MATERIA: FISICA APPLICATA 2 (2 anno 1 sem) ARGOMENTO: Cenni di Fisica del Nucleo
UNIVERSITA DEGLI STUDI DI GENOVA C.L. TECNICHE DIAGNOSTICHE RADIOLOGICHE CORSO INTEGRATO: MISURE ELETTRICHE ED ELETTRONICHE MATERIA: FISICA APPLICATA 2 (2 anno 1 sem) ARGOMENTO: Cenni di Fisica del Nucleo
FISICA delle APPARECCHIATURE per MEDICINA NUCLEARE
 Anno Accademico 2012-2013 Corso di Laurea in Tecniche Sanitarie di Radiologia Medica per Immagini e Radioterapia FISICA delle APPARECCHIATURE per MEDICINA NUCLEARE (lezione I, 07.05.13) Marta Ruspa 1 L
Anno Accademico 2012-2013 Corso di Laurea in Tecniche Sanitarie di Radiologia Medica per Immagini e Radioterapia FISICA delle APPARECCHIATURE per MEDICINA NUCLEARE (lezione I, 07.05.13) Marta Ruspa 1 L
ARGOMENTO: Cenni di Fisica del Nucleo
 UNIVERSIT DEGLI STUDI DI GENOV C.L. TECNICHE DIGNOSTICHE RDIOLOGICHE CORSO INTEGRTO: MISURE ELETTRICHE ED ELETTRONICHE MTERI: FISIC PPLICT 2 (1 anno 2 sem) RGOMENTO: Cenni di Fisica del Nucleo M.Claudia
UNIVERSIT DEGLI STUDI DI GENOV C.L. TECNICHE DIGNOSTICHE RDIOLOGICHE CORSO INTEGRTO: MISURE ELETTRICHE ED ELETTRONICHE MTERI: FISIC PPLICT 2 (1 anno 2 sem) RGOMENTO: Cenni di Fisica del Nucleo M.Claudia
NUCLEO ATOMICO. Ogni nucleo è costituito da protoni e neutroni legati da forze attrattive molto intense, dette forze nucleari forti.
 NUCLEO TOMICO Ogni nucleo è costituito da protoni e neutroni legati da forze attrattive molto intense, dette forze nucleari forti. Massa Carica Protone p 1.67 10 27 kg 1.6 10 19 C Neutrone n 1.67 10 27
NUCLEO TOMICO Ogni nucleo è costituito da protoni e neutroni legati da forze attrattive molto intense, dette forze nucleari forti. Massa Carica Protone p 1.67 10 27 kg 1.6 10 19 C Neutrone n 1.67 10 27
Radioattività. 1. Massa dei nuclei. 2. Decadimenti nucleari. 3. Legge del decadimento XVI - 0. A. Contin - Fisica Generale Avanzata
 Radioattività 1. Massa dei nuclei 2. Decadimenti nucleari 3. Legge del decadimento XVI - 0 Nucleoni Protoni e neutroni sono chiamati, indifferentemente, nucleoni. Il numero di protoni (e quindi di elettroni
Radioattività 1. Massa dei nuclei 2. Decadimenti nucleari 3. Legge del decadimento XVI - 0 Nucleoni Protoni e neutroni sono chiamati, indifferentemente, nucleoni. Il numero di protoni (e quindi di elettroni
I decadimenti radioattivi
 Istituzioni di Fisica Nucleare e Subnucleare Prof. A. Andreazza Lezione 3 I decadimenti radioattivi Radioattività naturale Osservazione di Bequerel della presenza di trasmutazioni di atomi. Osservazione
Istituzioni di Fisica Nucleare e Subnucleare Prof. A. Andreazza Lezione 3 I decadimenti radioattivi Radioattività naturale Osservazione di Bequerel della presenza di trasmutazioni di atomi. Osservazione
Esercizi su Chimica Nucleare e Nucleogenesi
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi su Chimica Nucleare e Nucleogenesi Prof. Dipartimento CMIC Giulio Natta http://chimicaverde.vosi.org/citterio/it//
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi su Chimica Nucleare e Nucleogenesi Prof. Dipartimento CMIC Giulio Natta http://chimicaverde.vosi.org/citterio/it//
Elio GIROLETTI - Università degli Studi di Pavia - Dip. Fisica nucleare e teorica marzo 2005
 UNIVERSITÀ DEGLI STUDI DI PVI dip. Fisica nucleare e teorica via assi 6, 271 Pavia, Italy tel. 38298.795 - girolett@unipv.it - www.unipv.it/webgiro webgiro elio giroletti radioattività (cenni) ELEMENTI
UNIVERSITÀ DEGLI STUDI DI PVI dip. Fisica nucleare e teorica via assi 6, 271 Pavia, Italy tel. 38298.795 - girolett@unipv.it - www.unipv.it/webgiro webgiro elio giroletti radioattività (cenni) ELEMENTI
TECNICHE RADIOCHIMICHE
 TECNICHE RADIOCHIMICHE L ATOMO - Un atomo e costituito da un nucleo carico positivamente, circondato da una nuvola di elettroni carichi negativamente. - I nuclei atomici sono costituiti da due particelle:
TECNICHE RADIOCHIMICHE L ATOMO - Un atomo e costituito da un nucleo carico positivamente, circondato da una nuvola di elettroni carichi negativamente. - I nuclei atomici sono costituiti da due particelle:
Scale dei tempi nucleari
 Scale dei tempi nucleari Ci sono vari tempi che posso caratterizzare un nucleo! Un tempo caratteristico è quello che impiega la luce ad attraversare le dimensioni di un nucleo: t = r/c ~ 10-23 s dove c
Scale dei tempi nucleari Ci sono vari tempi che posso caratterizzare un nucleo! Un tempo caratteristico è quello che impiega la luce ad attraversare le dimensioni di un nucleo: t = r/c ~ 10-23 s dove c
Radioattività artificiale Origine e impieghi
 ORIGIE DELL RDIOTTIVIT Radioattività naturale Raggi cosmici (primari e secondari) Radionuclidi primordiali (isolati) Famiglie radioattive naturali Radioattività artificiale Origine e impieghi L L RDIOTTIVIT
ORIGIE DELL RDIOTTIVIT Radioattività naturale Raggi cosmici (primari e secondari) Radionuclidi primordiali (isolati) Famiglie radioattive naturali Radioattività artificiale Origine e impieghi L L RDIOTTIVIT
Il nucleo dell atomo
 Il nucleo dell atomo Ci sono quattro interazioni(forze) i i(f tra le particelle: Gravita ElettroMagnetica Nucleare Forte Nucleare Debole Le forze La forza nucleare forte è responsabile del legame tra i
Il nucleo dell atomo Ci sono quattro interazioni(forze) i i(f tra le particelle: Gravita ElettroMagnetica Nucleare Forte Nucleare Debole Le forze La forza nucleare forte è responsabile del legame tra i
FNPA1 Prova parziale del 16/04/2012
 FNPA1 Prova parziale del 16/04/01 Problema 1 L energia di legame dei nuclei 4 He e 7 3 Li è rispettivamente 8.3 e 39.3 MeV. a) Verificare se la reazione p + 7 3 Li 4 3 He + 4 3 He è esotermica o endotermica.
FNPA1 Prova parziale del 16/04/01 Problema 1 L energia di legame dei nuclei 4 He e 7 3 Li è rispettivamente 8.3 e 39.3 MeV. a) Verificare se la reazione p + 7 3 Li 4 3 He + 4 3 He è esotermica o endotermica.
Il nucleo dell atomo
 Il nucleo dell atomo Ci sono quattro interazioni(forze) i i(f tra le particelle: Gravita ElettroMagnetica Nucleare Forte Nucleare Debole Le forze La forza nucleare forte è responsabile del legame tra i
Il nucleo dell atomo Ci sono quattro interazioni(forze) i i(f tra le particelle: Gravita ElettroMagnetica Nucleare Forte Nucleare Debole Le forze La forza nucleare forte è responsabile del legame tra i
LA STRUTTURA DELL ATOMO
 Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Lezione 2 Anno Accademico 2010-2011 Docente: Dimitrios Fessas LA STRUTTURA DELL ATOMO IL NUCLEO In fisica
Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Lezione 2 Anno Accademico 2010-2011 Docente: Dimitrios Fessas LA STRUTTURA DELL ATOMO IL NUCLEO In fisica
Caratterizzazione del nuclide. Elio GIROLETTI - Università degli Studi di Pavia - Dip. Fisica nucleare e teorica febbraio 2009
 UNIVERSITÀ DEGLI STUDI DI PVI dip. Fisica nucleare e teorica via assi 6, 271 Pavia, Italy tel. 38298.795 - girolett@unipv.it - www.unipv.it/webgiro elio giroletti Elio GIROLETTI dip. Fisica nucleare e
UNIVERSITÀ DEGLI STUDI DI PVI dip. Fisica nucleare e teorica via assi 6, 271 Pavia, Italy tel. 38298.795 - girolett@unipv.it - www.unipv.it/webgiro elio giroletti Elio GIROLETTI dip. Fisica nucleare e
La Radioattività. da:ispra istituto superiore per la ricerca e protezione ambientale
 La Radioattività da:ispra istituto superiore per la ricerca e protezione ambientale Isotopi: Nuclei diversi del medesimo elemento chimico Vi sono elementi con atomi che, a parità di numero di protoni,
La Radioattività da:ispra istituto superiore per la ricerca e protezione ambientale Isotopi: Nuclei diversi del medesimo elemento chimico Vi sono elementi con atomi che, a parità di numero di protoni,
Mg. Lo stato fondamentale del 10. Mg sono riportati qui di seguito.
 Esercizio 1 Il 24 10 Ne decade β - in 24 11 Na, che a sua volta decade β - in 24 12 Mg. Lo stato fondamentale del 10 da: J Π = 0 +. Gli schemi dei livelli dei nuclei 24 11 Na e 24 12 Mg sono riportati
Esercizio 1 Il 24 10 Ne decade β - in 24 11 Na, che a sua volta decade β - in 24 12 Mg. Lo stato fondamentale del 10 da: J Π = 0 +. Gli schemi dei livelli dei nuclei 24 11 Na e 24 12 Mg sono riportati
Emissione α. La sua carica elettrica è pari a +2e La sua massa a riposo è circa 7x10-27 kg.
 Reazioni nucleari Un nucleo instabile può raggiungere una nuova condizione di stabilità attraverso una serie di decadimenti con emissione di particelle α, β, γ o di frammenti nucleari (fissione). Emissione
Reazioni nucleari Un nucleo instabile può raggiungere una nuova condizione di stabilità attraverso una serie di decadimenti con emissione di particelle α, β, γ o di frammenti nucleari (fissione). Emissione
Il modello a shell fallisce nella predizione dello spin totale del nucleo 6 3
 Problema 1 Il modello a shell fallisce nella predizione dello spin totale del nucleo 6 3 Li. Tuttavia la misura del suo momento magnetico fornisce il valore µ = 0.82 µ N. I momenti magnetici del protone
Problema 1 Il modello a shell fallisce nella predizione dello spin totale del nucleo 6 3 Li. Tuttavia la misura del suo momento magnetico fornisce il valore µ = 0.82 µ N. I momenti magnetici del protone
Il nucleo e la radiazione nucleare
 e la radiazione nucleare Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi I decadimenti α, β, γ La legge del decadimento
e la radiazione nucleare Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi I decadimenti α, β, γ La legge del decadimento
La datazione mediante radioisotopi
 : Le trasformazioni nucleari: La datazione mediante radioisotopi Lezioni d'autore VIDEO Premessa (I) I processi radioattivi sono reazioni che dipendono dalla struttura nucleare degli atomi. Il rapporto
: Le trasformazioni nucleari: La datazione mediante radioisotopi Lezioni d'autore VIDEO Premessa (I) I processi radioattivi sono reazioni che dipendono dalla struttura nucleare degli atomi. Il rapporto
Applicazioni della fisica nucleare: il metodo dell attivazione neutronica
 Applicazioni della fisica nucleare: il metodo dell attivazione neutronica Il processo di attivazione neutronica consiste nella produzione di un isotopo instabile attraverso l assorbimento di neutroni da
Applicazioni della fisica nucleare: il metodo dell attivazione neutronica Il processo di attivazione neutronica consiste nella produzione di un isotopo instabile attraverso l assorbimento di neutroni da
Lezione 19 Fisica nucleare
 Lezione 19 Fisica nucleare Nucleo Il nucleo atomico è costituito da nucleoni (N), ovvero: protoni (p) e neutroni (n). Il numero di p è caratteristico di ogni elemento; è detto numero atomico ed è indicato
Lezione 19 Fisica nucleare Nucleo Il nucleo atomico è costituito da nucleoni (N), ovvero: protoni (p) e neutroni (n). Il numero di p è caratteristico di ogni elemento; è detto numero atomico ed è indicato
Un po' di fisica nucleare: La radioattività
 Un po' di fisica nucleare: La radioattività at e ve de n d o.. = La radioattività La radioattività è il fenomeno per cui alcuni nuclei si trasformano in altri emettendo particelle. La radioattività non
Un po' di fisica nucleare: La radioattività at e ve de n d o.. = La radioattività La radioattività è il fenomeno per cui alcuni nuclei si trasformano in altri emettendo particelle. La radioattività non
CAPITOLO 20 LA CHIMICA NUCLEARE
 CAPITOLO 20 LA CHIMICA NUCLEARE 20.5 (a) La soma dei numeri atomici e la somma dei numeri di massa, da entrambi i lati dell equazione nucleare, deve coincidere. Dalla parte sinistra di questa equazione
CAPITOLO 20 LA CHIMICA NUCLEARE 20.5 (a) La soma dei numeri atomici e la somma dei numeri di massa, da entrambi i lati dell equazione nucleare, deve coincidere. Dalla parte sinistra di questa equazione
Caratterizzazione del nuclide. Elio GIROLETTI - Università degli Studi di Pavia - Dip. Fisica nucleare e teorica. ottobre 2008
 UNIVERSITÀ DEGLI STUDI DI PVI dip. Fisica nucleare e teorica via assi 6, 271 Pavia, Italy tel. 38298.795 - girolett@unipv.it - www.unipv.it/webgiro elio giroletti radioattività e radiazioni RISCHI FISICI
UNIVERSITÀ DEGLI STUDI DI PVI dip. Fisica nucleare e teorica via assi 6, 271 Pavia, Italy tel. 38298.795 - girolett@unipv.it - www.unipv.it/webgiro elio giroletti radioattività e radiazioni RISCHI FISICI
Radiazioni ionizzanti
 Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Radiazioni ionizzanti 11/3/2005 Struttura atomica Atomo Nucleo Protone 10 10 m 10 14 m 10 15 m ev MeV GeV 3 3,0 0,3 0 0 0 Atomo Dimensioni lineari
Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Radiazioni ionizzanti 11/3/2005 Struttura atomica Atomo Nucleo Protone 10 10 m 10 14 m 10 15 m ev MeV GeV 3 3,0 0,3 0 0 0 Atomo Dimensioni lineari
GEOCRONOLOGIA. Il prima problema affrontato fu quello dell età della Terra legato inevitabilmente all età dell Universo.
 GEOCRONOLOGIA L esigenza di conoscere i tempi di occorrenza di fenomeni naturali (l età della Terra, formazione di rocce, nascita e morte di alcune specie animali, ecc) ha portato a cercare METODI affidabili
GEOCRONOLOGIA L esigenza di conoscere i tempi di occorrenza di fenomeni naturali (l età della Terra, formazione di rocce, nascita e morte di alcune specie animali, ecc) ha portato a cercare METODI affidabili
Chimica Nucleare. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Chimica Nucleare Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. 1 Riassunto Numero Atomico (Z) = numero di protoni nel nucleo Numero di Massa (A) = numero di
Chimica Nucleare Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. 1 Riassunto Numero Atomico (Z) = numero di protoni nel nucleo Numero di Massa (A) = numero di
Paolo Montagna, Paolo Vitulo
 - radioattività naturale - legge del decadimento radioattivo - equilibrio secolare Stage per le scuole superiori Dipartimento di Fisica 10 giugno 2013 Paolo Montagna, Paolo Vitulo Dipartimento di Fisica
- radioattività naturale - legge del decadimento radioattivo - equilibrio secolare Stage per le scuole superiori Dipartimento di Fisica 10 giugno 2013 Paolo Montagna, Paolo Vitulo Dipartimento di Fisica
1.1 Struttura dell atomo
 CAPITOLO I Richiami di fisica generale e descrizione delle radiazioni ionizzanti. Struttura dell atomo L atomo è la più piccola porzione di un elemento chimico, che conserva le proprietà dell elemento
CAPITOLO I Richiami di fisica generale e descrizione delle radiazioni ionizzanti. Struttura dell atomo L atomo è la più piccola porzione di un elemento chimico, che conserva le proprietà dell elemento
ELEMENTI di CHIMICA NUCLEARE. La FISSIONE NUCLEARE
 ELEMENTI di CHIMICA NUCLEARE La FISSIONE NUCLEARE Lo scienziato Otto Hahn nel 938 scoprì che l'uranio 35 9U è fissile. La fissione è una rottura dei nuclei pesanti e può avvenire quando un neutrone lento
ELEMENTI di CHIMICA NUCLEARE La FISSIONE NUCLEARE Lo scienziato Otto Hahn nel 938 scoprì che l'uranio 35 9U è fissile. La fissione è una rottura dei nuclei pesanti e può avvenire quando un neutrone lento
La radioattività. La radioattività è il fenomeno per cui alcuni nuclei si trasformano in altri emettendo particelle e/ radiazioneni elettromagnetiche.
 La radioattività La radioattività è il fenomeno per cui alcuni nuclei si trasformano in altri emettendo particelle e/ radiazioneni elettromagnetiche. La radioattività: isotopi. Il numero totale di protoni
La radioattività La radioattività è il fenomeno per cui alcuni nuclei si trasformano in altri emettendo particelle e/ radiazioneni elettromagnetiche. La radioattività: isotopi. Il numero totale di protoni
A Z. radioattività e radiazioni. Caratterizzazione del nuclide. elio giroletti. ottobre 2006
 UNIVERSITÀ DEGLI STUDI DI PVI dip. Fisica nucleare e teorica via assi 6, 271 Pavia, Italy tel. 38298.795 - girolett@unipv.it - www.unipv.it/webgiro webgiro 1 elio giroletti radioattività e radiazioni FISIC
UNIVERSITÀ DEGLI STUDI DI PVI dip. Fisica nucleare e teorica via assi 6, 271 Pavia, Italy tel. 38298.795 - girolett@unipv.it - www.unipv.it/webgiro webgiro 1 elio giroletti radioattività e radiazioni FISIC
Il Nucleo. Dimensioni del nucleo dell'ordine di 10. m Il raggio nucleare R = R 0 -15
 Il Nucleo Nucleo e' costituito da nucleoni (protoni e neutroni). Mentre i neutroni liberi sono abbastanza instabili tendono a decadere in un protone ed un elettrone (t 1/2 circa 900 s), i protoni sono
Il Nucleo Nucleo e' costituito da nucleoni (protoni e neutroni). Mentre i neutroni liberi sono abbastanza instabili tendono a decadere in un protone ed un elettrone (t 1/2 circa 900 s), i protoni sono
La misura della radioattivita γ lezione 1. Cristiana Peroni Corsi di LS in Scienze Biomolecolari Universita di Torino Anno accademico
 La misura della radioattivita γ lezione 1 Cristiana Peroni Corsi di LS in Scienze Biomolecolari Universita di Torino Anno accademico 2007-2008 1 Generalita sul corso 2 Misure di radioattivita con un rivelatore
La misura della radioattivita γ lezione 1 Cristiana Peroni Corsi di LS in Scienze Biomolecolari Universita di Torino Anno accademico 2007-2008 1 Generalita sul corso 2 Misure di radioattivita con un rivelatore
M. Marengo LA RADIOATTIVITA. Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna
 M. Marengo LA RADIOATTIVITA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna Rev Febbraio 2010 mario.marengo@unibo.it La radioattività + Bequerel osservò che alcuni materiali
M. Marengo LA RADIOATTIVITA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna Rev Febbraio 2010 mario.marengo@unibo.it La radioattività + Bequerel osservò che alcuni materiali
Il numero di protoni presenti in un atomo si chiama numero atomico = Z elemento differisce per il numero Z. H deuterio (6000 volte abbondante)
 Il numero di protoni presenti in un atomo si chiama numero atomico = Z elemento differisce per il numero Z ogni ISOTOPI atomi di uno stesso elemento ma con un N di neutroni x es. 14 C e 12 C l H ha 3 isotopi:
Il numero di protoni presenti in un atomo si chiama numero atomico = Z elemento differisce per il numero Z ogni ISOTOPI atomi di uno stesso elemento ma con un N di neutroni x es. 14 C e 12 C l H ha 3 isotopi:
Onde elettromagnetiche ed altre storie
 Onde elettromagnetiche ed altre storie Onde elettromagnetiche Un onda elettromagnetica è una oscillazione del campo elettromagnetico che si propaga nello spazio. Le onde elettromagnetiche si propagano
Onde elettromagnetiche ed altre storie Onde elettromagnetiche Un onda elettromagnetica è una oscillazione del campo elettromagnetico che si propaga nello spazio. Le onde elettromagnetiche si propagano
P. Sapia Università della Calabria. a.a. 2009/10
 FISICA PER I BENI CULTURALI Ii MATERIA E INTERAZIONE CON LA RADIAZIONE P. Sapia Università della Calabria a.a. 2009/10 Interazioni fondamentali Gravitazionale Debolmente attrattiva, tra tutte le particelle
FISICA PER I BENI CULTURALI Ii MATERIA E INTERAZIONE CON LA RADIAZIONE P. Sapia Università della Calabria a.a. 2009/10 Interazioni fondamentali Gravitazionale Debolmente attrattiva, tra tutte le particelle
Capitolo 6 : Decadimenti, Risonanze, Modello di Yukawa, Interazioni tra Particelle
 Capitolo 6 : Decadimenti, Risonanze, Modello di Yukawa, Interazioni tra Particelle Corso di Fisica Nucleare e Subnucleare I Professor Carlo Dionisi A.A. 2004-2005 1 Legge di decadimento Decadimento di
Capitolo 6 : Decadimenti, Risonanze, Modello di Yukawa, Interazioni tra Particelle Corso di Fisica Nucleare e Subnucleare I Professor Carlo Dionisi A.A. 2004-2005 1 Legge di decadimento Decadimento di
Grandezze e unità di misura
 Grandezze e unità di misura La misura di una grandezza è costituita da un valore numerico e un appropriata unità di misura Esiste un sistema metrico denominato Sistema Internazionale di Unità (SI) basato
Grandezze e unità di misura La misura di una grandezza è costituita da un valore numerico e un appropriata unità di misura Esiste un sistema metrico denominato Sistema Internazionale di Unità (SI) basato
Applicazioni della fisica nucleare: il metodo dell attivazione neutronica
 Applicazioni della fisica nucleare: il metodo dell attivazione neutronica Il processo di attivazione neutronica consiste nella produzione di un isotopo instabile attraverso l assorbimento di neutroni da
Applicazioni della fisica nucleare: il metodo dell attivazione neutronica Il processo di attivazione neutronica consiste nella produzione di un isotopo instabile attraverso l assorbimento di neutroni da
FNPA1 prova scritta del 22/06/2011
 FNPA1 prova scritta del 22/06/2011 Problema 1 Il nucleo di deuterio, 1 2 H, ha energia di legame Bd = 2.23 MeV. Il nucleo di trizio, 1 3 H, ha energia di legame Bt = 8.48 MeV. Calcolare lʼenergia che occorre
FNPA1 prova scritta del 22/06/2011 Problema 1 Il nucleo di deuterio, 1 2 H, ha energia di legame Bd = 2.23 MeV. Il nucleo di trizio, 1 3 H, ha energia di legame Bt = 8.48 MeV. Calcolare lʼenergia che occorre
La radioattività può avere un origine sia artificiale che naturale.
 http://www.isprambiente.gov.it/it/temi/radioattivita-e-radiazioni/ radioattivita/radioattivita-naturale-e-artificiale La radioattività può avere un origine sia artificiale che naturale. La radioattività
http://www.isprambiente.gov.it/it/temi/radioattivita-e-radiazioni/ radioattivita/radioattivita-naturale-e-artificiale La radioattività può avere un origine sia artificiale che naturale. La radioattività
Sm, T 1/ 2. Il decadimento alfa
 Il decadimento alfa L emissione di particelle α da parte di vari radionuclidi rappresenta una delle prime scoperte della fisica moderna: nel 1908 utherford dimostrò che tale radiazione è costituita da
Il decadimento alfa L emissione di particelle α da parte di vari radionuclidi rappresenta una delle prime scoperte della fisica moderna: nel 1908 utherford dimostrò che tale radiazione è costituita da
Il nucleo dell'atomo
 Il nucleo dell'atomo L'atomo si può considerare suddiviso in due regioni: Il nucleo, carico positivamente: è formato di protoni e neutroni La nuvola elettronica, carica negativamente: lo spazio intorno
Il nucleo dell'atomo L'atomo si può considerare suddiviso in due regioni: Il nucleo, carico positivamente: è formato di protoni e neutroni La nuvola elettronica, carica negativamente: lo spazio intorno
Un nuclide è un atomo caratterizzato dal numero atomico Z (numero di protoni) e dal numero di massa A (numero di neutroni e di protoni).
 L atomo Il nucleo è costituito da neutroni e protoni (nucleoni). Il neutrone non ha carica e la sua massa è,675 0-27 Kg. Il protone ha una carica positiva di,6022 0-9 C e una massa di,673 0-27 Kg. L'elettrone
L atomo Il nucleo è costituito da neutroni e protoni (nucleoni). Il neutrone non ha carica e la sua massa è,675 0-27 Kg. Il protone ha una carica positiva di,6022 0-9 C e una massa di,673 0-27 Kg. L'elettrone
RADIAZIONI IL TRASPORTO DI ENERGIA ASSOCIATO ALLA PROPAGAZIONE DI PARTICELLE O DI UN ONDA ELETTROMAGNETICA E DESCRITTO DAL TERMINE RADIAZIONE
 RADIAZIONI RADIAZIONI IL TRASPORTO DI ENERGIA ASSOCIATO ALLA PROPAGAZIONE DI PARTICELLE O DI UN ONDA ELETTROMAGNETICA E DESCRITTO DAL TERMINE RADIAZIONE Radiazioni elettromagnetiche Ø Raggi X e raggi γ
RADIAZIONI RADIAZIONI IL TRASPORTO DI ENERGIA ASSOCIATO ALLA PROPAGAZIONE DI PARTICELLE O DI UN ONDA ELETTROMAGNETICA E DESCRITTO DAL TERMINE RADIAZIONE Radiazioni elettromagnetiche Ø Raggi X e raggi γ
La chimica nucleare. A cura della prof. ssa. Barone Antonina
 La chimica nucleare A cura della prof. ssa Barone Antonina La radioattività Nella seconda metà dell 800, Henry Becquerel, Pierre e Marie Curie, scoprirono che alcuni elementi( uranio, torio, radio) emettevano
La chimica nucleare A cura della prof. ssa Barone Antonina La radioattività Nella seconda metà dell 800, Henry Becquerel, Pierre e Marie Curie, scoprirono che alcuni elementi( uranio, torio, radio) emettevano
Il nucleo dell'atomo
 Il nucleo dell'atomo L'atomo si può considerare suddiviso in due regioni: Il nucleo, carico positivamente: è formato di protoni e neutroni La nuvola elettronica, carica negativamente: lo spazio intorno
Il nucleo dell'atomo L'atomo si può considerare suddiviso in due regioni: Il nucleo, carico positivamente: è formato di protoni e neutroni La nuvola elettronica, carica negativamente: lo spazio intorno
SORGENTI DI RADIAZIONE
 SORGENTI DI RADIAZIONE (da laboratorio) ORIGINE processi atomici processi nucleari produzione agli acceleratori 4 CATEGORIE GENERALI particelle cariche Elettroni veloci Particelle pesanti cariche m 1 a.m.u.
SORGENTI DI RADIAZIONE (da laboratorio) ORIGINE processi atomici processi nucleari produzione agli acceleratori 4 CATEGORIE GENERALI particelle cariche Elettroni veloci Particelle pesanti cariche m 1 a.m.u.
Esercizi. Fisica nucleare
 Esercizi Fisica nucleare Qual è la differenza tra una reazione chimica e una reazione nucleare? In una reazione chimica vengono coinvolti esclusivamente alcuni elettroni degli atomi reagenti, per cui gli
Esercizi Fisica nucleare Qual è la differenza tra una reazione chimica e una reazione nucleare? In una reazione chimica vengono coinvolti esclusivamente alcuni elettroni degli atomi reagenti, per cui gli
Breve Introduzione al laboratorio: Vedere le particelle. di Donato Di Ferdinando
 Breve Introduzione al laboratorio: Vedere le particelle di Donato Di Ferdinando COSTITUENTI FONDAMENTALI DELLA MATERIA L Atomo e costituito da un nucleo attorno al quale orbitano gli elettroni. Il nucleo
Breve Introduzione al laboratorio: Vedere le particelle di Donato Di Ferdinando COSTITUENTI FONDAMENTALI DELLA MATERIA L Atomo e costituito da un nucleo attorno al quale orbitano gli elettroni. Il nucleo
dal 18 al 22/06/2012 Gerti Xhixha
 dal 18 al 22/06/2012 Gerti Xhixha (xhixha@fe.infn.it) 1 Introduzione alla fisica nucleare Breve storia dell atomo I costituenti dei nuclei atomici Leggi di conservazione Scale di lunghezza, massa e tempo
dal 18 al 22/06/2012 Gerti Xhixha (xhixha@fe.infn.it) 1 Introduzione alla fisica nucleare Breve storia dell atomo I costituenti dei nuclei atomici Leggi di conservazione Scale di lunghezza, massa e tempo
Sommario della lezione 4. Proprietà periodiche. Massa atomica e massa molecolare. Concetto di mole. Prime esercitazioni
 Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Proprietà periodiche Il raggio atomico è definito come la metà della distanza minima
Le radiazioni e la loro misura
 Le radiazioni e la loro misura Le radiazioni e le radiazioni ionizzanti Nuclei, radioattività, reazioni nucleari Einstein, la legge E = mc 2 e l'energia nucleare Uso degli strumenti di misura Che cosa
Le radiazioni e la loro misura Le radiazioni e le radiazioni ionizzanti Nuclei, radioattività, reazioni nucleari Einstein, la legge E = mc 2 e l'energia nucleare Uso degli strumenti di misura Che cosa
sezione d urto di interazione neutroni - 12 C
 Interazione dei neutroni con la materia Poiché il neutrone ha carica nulla esso non interagisce elettricamente con gli elettroni dell atomo, ma subisce solo interazioni nucleari con i nuclei della materia
Interazione dei neutroni con la materia Poiché il neutrone ha carica nulla esso non interagisce elettricamente con gli elettroni dell atomo, ma subisce solo interazioni nucleari con i nuclei della materia
Principi della RadioDatazione
 Principi della RadioDatazione Datazione di un manufatto contenente Smalto a base di Ossido di Uranio Lodovico Lappetito RadioDatazione - 14/07/2015 Pag. 1 Sommario Uranio... 3 RadioDatazione mediante confronto
Principi della RadioDatazione Datazione di un manufatto contenente Smalto a base di Ossido di Uranio Lodovico Lappetito RadioDatazione - 14/07/2015 Pag. 1 Sommario Uranio... 3 RadioDatazione mediante confronto
Capitolo 4: CAMBIAMENTO DI SISTEMA DI UNITÀ
 Capitolo 4: CAMBIAMENTO DI SISTEMA DI UNITÀ 4.1 Grandezze fondamentali e derivate Come abbiamo già osservato la scelta di un Sistema di unità di misura è largamente arbitraria e dettata in gran parte da
Capitolo 4: CAMBIAMENTO DI SISTEMA DI UNITÀ 4.1 Grandezze fondamentali e derivate Come abbiamo già osservato la scelta di un Sistema di unità di misura è largamente arbitraria e dettata in gran parte da
Cenni di Fisica del Nucleo
 Capitolo 8 Cenni di Fisica del Nucleo 8.1 Proprietà generali dei nuclei In questo capitolo affrontiamo lo studio dei nuclei. Un nucleo è un insieme di neutroni e protoni legati insieme ( incollati ) dalla
Capitolo 8 Cenni di Fisica del Nucleo 8.1 Proprietà generali dei nuclei In questo capitolo affrontiamo lo studio dei nuclei. Un nucleo è un insieme di neutroni e protoni legati insieme ( incollati ) dalla
Lezione 1 ELEMENTI DI FISICA NUCLEARE APPLICATA ALLA MEDICINA
 Lezione 1 ELEMENTI DI FISICA NUCLEARE APPLICATA ALLA MEDICINA RADIAZIONE=PROPAGAZIONE DI ENERGIA NELLO SPAZIO L energia può essere associata: a particelle materiali (radiazione corpuscolare), a vibrazioni
Lezione 1 ELEMENTI DI FISICA NUCLEARE APPLICATA ALLA MEDICINA RADIAZIONE=PROPAGAZIONE DI ENERGIA NELLO SPAZIO L energia può essere associata: a particelle materiali (radiazione corpuscolare), a vibrazioni
LT In Scienza dei Materiali Corso di Fisica Applicata. Prova di esame del 22/04/15. n. Matricola:
 LT In Scienza dei Materiali Corso di Fisica Applicata Prova di esame del 22/04/15 Nome n. Matricola: 1) Struttura del Nucleo atomico Qual è la relazione tra difetto di massa ed energia di legame di un
LT In Scienza dei Materiali Corso di Fisica Applicata Prova di esame del 22/04/15 Nome n. Matricola: 1) Struttura del Nucleo atomico Qual è la relazione tra difetto di massa ed energia di legame di un
e, non dipendendo da A, è la stessa per tutti i nuclei. 3A 4πr 3 0 n = A V = A = cm -3
 Modelli nucleari collettivi: il modello a goccia di liquido Già nel 1911 Rutherford, per spiegare i risultati del suo esperimento di diffusione di particelle α da nuclei pesanti ricavò che il nucleo è
Modelli nucleari collettivi: il modello a goccia di liquido Già nel 1911 Rutherford, per spiegare i risultati del suo esperimento di diffusione di particelle α da nuclei pesanti ricavò che il nucleo è
La fisica nucleare. Capitolo. Concetti da rivedere 24.1 LA STRUTTURA NUCLEARE
 24txtI:GIAMBATTISTA 14-12-2007 12:06 Pagina 943 Capitolo 24 La fisica nucleare Forze fondamentali (Paragrafo 2.9) Funzioni esponenziali (Appendice A.3, Paragrafo 17.10) Concetti da rivedere 24.1 LA STRUTTURA
24txtI:GIAMBATTISTA 14-12-2007 12:06 Pagina 943 Capitolo 24 La fisica nucleare Forze fondamentali (Paragrafo 2.9) Funzioni esponenziali (Appendice A.3, Paragrafo 17.10) Concetti da rivedere 24.1 LA STRUTTURA
La struttura elettronica degli atomi
 1 In unità atomiche: a 0 me 0,59A unità di lunghezza e H 7, ev a H=Hartree unità di energia L energia dell atomo di idrogeno nello stato fondamentale espresso in unità atomiche è: 4 0 me 1 e 1 E H 13,
1 In unità atomiche: a 0 me 0,59A unità di lunghezza e H 7, ev a H=Hartree unità di energia L energia dell atomo di idrogeno nello stato fondamentale espresso in unità atomiche è: 4 0 me 1 e 1 E H 13,
Fisica Nucleare e Subnucleare
 Fisica Nucleare e Subnucleare Prova Scritta, 17 Febbraio 2015 Modulo I 1) Una trasformazione di Lorentz collega le coordinate dello spazio tempo di due sistemi di riferimento inerziali e può essere scritta
Fisica Nucleare e Subnucleare Prova Scritta, 17 Febbraio 2015 Modulo I 1) Una trasformazione di Lorentz collega le coordinate dello spazio tempo di due sistemi di riferimento inerziali e può essere scritta
geometria di un apparato di conteggio
 La Sezione d urto Supponiamo di avere un fascio di particelle (protoni, elettroni, fotoni o qualsiasi altra particella) di ben definita energia che incide su un bersaglio (target). L intensità I di un
La Sezione d urto Supponiamo di avere un fascio di particelle (protoni, elettroni, fotoni o qualsiasi altra particella) di ben definita energia che incide su un bersaglio (target). L intensità I di un
ed infine le interazioni nucleari forte e debole? dove E rappresenta l energia cinetica della particella α, e K è: K = e2 2Z
 Introduzione 1. Stima il valore delle energie dei fotoni necessarie per risolvere distanze atomiche, e poi nucleari. 2. Per quali ragioni fisiche le interazioni fondamentali sono state storicamente identificate
Introduzione 1. Stima il valore delle energie dei fotoni necessarie per risolvere distanze atomiche, e poi nucleari. 2. Per quali ragioni fisiche le interazioni fondamentali sono state storicamente identificate
92 elemento della tavola di Mendeleiev
 L URANIO E LA RADIOATTIVITÀ NATURALE 9 elemento della tavola di Mendeleiev Oggi: reattori, bombe nucleari, alicazioni militari (testate roiettili) ma anche diffuso in natura (rocce, muri, coro umano) Storicamente:
L URANIO E LA RADIOATTIVITÀ NATURALE 9 elemento della tavola di Mendeleiev Oggi: reattori, bombe nucleari, alicazioni militari (testate roiettili) ma anche diffuso in natura (rocce, muri, coro umano) Storicamente:
m p 6, j m 1 2 m e 3, j m 1 2 5, m 2 82, N w
 Teoria della carica elettrica e calcolo del valore teorico Questa relazione è stata ricavata senza porre alcuna ipotesi restrittiva e dunque risulta di validità universale, applicabile in ogni circostanza
Teoria della carica elettrica e calcolo del valore teorico Questa relazione è stata ricavata senza porre alcuna ipotesi restrittiva e dunque risulta di validità universale, applicabile in ogni circostanza
I conteggi in fisica. Appendice D. D.1 Urti di particelle
 Appendice D I conteggi in fisica Il conteggio di eventi è un importante modalità di indagine delle leggi che governano alcuni fenomeni fisici. In un esperimento di conteggio si raccolgono e analizzano
Appendice D I conteggi in fisica Il conteggio di eventi è un importante modalità di indagine delle leggi che governano alcuni fenomeni fisici. In un esperimento di conteggio si raccolgono e analizzano
Paolo Montagna, Paolo Vitulo
 - radioattività naturale - legge del decadimento radioattivo - equilibrio secolare Stage per le scuole superiori Dipartimento di Fisica 13 giugno 2016 Paolo Montagna, Paolo Vitulo Dipartimento di Fisica
- radioattività naturale - legge del decadimento radioattivo - equilibrio secolare Stage per le scuole superiori Dipartimento di Fisica 13 giugno 2016 Paolo Montagna, Paolo Vitulo Dipartimento di Fisica
Introduzione alla Fisica Nucleare. Josè Javier Valiente Dobon Rosanna Depalo Alberto Boso
 STAGE ai LNL EDIZIONE 2016 Introduzione alla Fisica Nucleare Josè Javier Valiente Dobon Rosanna Depalo Alberto Boso 21 Giugno 2016 STAGE ai LNL EDIZIONE 2016 Lezione 1 Storia dell' atomo I costituenti
STAGE ai LNL EDIZIONE 2016 Introduzione alla Fisica Nucleare Josè Javier Valiente Dobon Rosanna Depalo Alberto Boso 21 Giugno 2016 STAGE ai LNL EDIZIONE 2016 Lezione 1 Storia dell' atomo I costituenti
Il numero di protoni presenti in un atomo si chiama numero atomico = Z elemento differisce per il numero Z. H deuterio (6000 volte abbondante)
 Il numero di protoni presenti in un atomo si chiama numero atomico = Z elemento differisce per il numero Z ogni ISOTOPI atomi di uno stesso elemento ma con un N di neutroni x es. 14 C e 12 C l H ha 3 isotopi:
Il numero di protoni presenti in un atomo si chiama numero atomico = Z elemento differisce per il numero Z ogni ISOTOPI atomi di uno stesso elemento ma con un N di neutroni x es. 14 C e 12 C l H ha 3 isotopi:
Fisica per Medicina. Lezione 25 - Ottica e Fisica Moderna. Dr. Cristiano Fontana
 Fisica per Medicina Lezione 25 - Ottica e Fisica Moderna Dr. Cristiano Fontana Dipartimento di Fisica ed Astronomia Galileo Galilei Università degli Studi di Padova 12 dicembre 2017 Indice Onde Ottica
Fisica per Medicina Lezione 25 - Ottica e Fisica Moderna Dr. Cristiano Fontana Dipartimento di Fisica ed Astronomia Galileo Galilei Università degli Studi di Padova 12 dicembre 2017 Indice Onde Ottica
Camera a Ioni. Misure di Radon. Sistema Theremino Rev.1. Sistema Theremino IonChamber_ITA - 22/06/2015 Pag. 1
 Camera a Ioni Misure di Radon Sistema Theremino Rev.1 Sistema Theremino IonChamber_ITA - 22/06/2015 Pag. 1 Sommario Misure con Camera a Ioni... 3 Teoria... 3 Apparecchiature... 3 Radon in abitazione -
Camera a Ioni Misure di Radon Sistema Theremino Rev.1 Sistema Theremino IonChamber_ITA - 22/06/2015 Pag. 1 Sommario Misure con Camera a Ioni... 3 Teoria... 3 Apparecchiature... 3 Radon in abitazione -
Corso di formazione sulla radioprotezione
 Corso di formazione sulla radioprotezione Il decadimento radioattivo Radioisotopi naturali e artificiali Radioisotopi impiegati in campo bio-medico Università degli Studi di Cagliari Servizio di Fisica
Corso di formazione sulla radioprotezione Il decadimento radioattivo Radioisotopi naturali e artificiali Radioisotopi impiegati in campo bio-medico Università degli Studi di Cagliari Servizio di Fisica
COMPLEMENTI DI CHIMICA II Preludio al primo compitino
 COMPLEMENTI DI CHIMICA II Preludio al primo compitino 1. Quale fenomeno è responsabile per il massimo di temperatura registrato al confine superiore della stratosfera? 2. Descrivere la funzione del terzo
COMPLEMENTI DI CHIMICA II Preludio al primo compitino 1. Quale fenomeno è responsabile per il massimo di temperatura registrato al confine superiore della stratosfera? 2. Descrivere la funzione del terzo
Energia nucleare per livello ( valori corretti ), per l uso del sistema periodico dei nuclidi
 Energia nucleare per livello ( valori corretti ), per l uso del sistema periodico dei nuclidi Trattando la teoria generale degli spazi rotanti atomico e nucleare, abbiamo ricavato l espressione teorica
Energia nucleare per livello ( valori corretti ), per l uso del sistema periodico dei nuclidi Trattando la teoria generale degli spazi rotanti atomico e nucleare, abbiamo ricavato l espressione teorica
INTRODUZIONE ALLA RELATIVITÀ SPECIALE: Dalla seconda legge di Newton a E = mc 2. 8 marzo 2017
 INTRODUZIONE ALLA RELATIVITÀ SPECIALE: Dalla seconda legge di Newton a E = mc 2 8 marzo 2017 Piano della presentazione Trasformazioni di Lorentz Red Shift Relatività e leggi di Newton Galileo Seconda Legge
INTRODUZIONE ALLA RELATIVITÀ SPECIALE: Dalla seconda legge di Newton a E = mc 2 8 marzo 2017 Piano della presentazione Trasformazioni di Lorentz Red Shift Relatività e leggi di Newton Galileo Seconda Legge
La fisica del XX secolo ovvero la tecnologia consente di eseguire esperimenti sempre più spinti e. tutto deve essere messo in discussione
 ovvero la tecnologia consente di eseguire esperimenti sempre più spinti e. tutto deve essere messo in discussione The fundamental cause of the trouble is that in the modern world the stupid are cocksure
ovvero la tecnologia consente di eseguire esperimenti sempre più spinti e. tutto deve essere messo in discussione The fundamental cause of the trouble is that in the modern world the stupid are cocksure
Capitolo 3 Modelli nucleari collettivi: il modello a goccia di liquido
 Capitolo 3 Modelli nucleari collettivi: il modello a goccia di liquido 3.1 Introduzione Già nel 1911 Rutherford, per spiegare i risultati del suo esperimento di diffusione di particelle α da nuclei pesanti
Capitolo 3 Modelli nucleari collettivi: il modello a goccia di liquido 3.1 Introduzione Già nel 1911 Rutherford, per spiegare i risultati del suo esperimento di diffusione di particelle α da nuclei pesanti
Richiami di radioattività e radiazioni ionizzanti
 Richiami di radioattività e radiazioni ionizzanti Corso di formazione dei lavoratori Dott. Roberto Falcone GSP4 ION IRP Casaccia Generalità particelle - beta β - (o β + ) - è un elettrone ( o un antielettrone)
Richiami di radioattività e radiazioni ionizzanti Corso di formazione dei lavoratori Dott. Roberto Falcone GSP4 ION IRP Casaccia Generalità particelle - beta β - (o β + ) - è un elettrone ( o un antielettrone)
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia. Massa atomica MOLE. a.a.
 Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia Massa atomica MOLE a.a. 2016-17 MATERIA costituita da ATOMI Miscele OMOGENEE o soluzioni Hanno la
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia Massa atomica MOLE a.a. 2016-17 MATERIA costituita da ATOMI Miscele OMOGENEE o soluzioni Hanno la
Esercizio 1 I mesoni K + possono essere prodotti attraverso la reazione γ + p K + + Λ su protoni fermi.
 Esercizio 1 I mesoni K + possono essere prodotti attraverso la reazione γ + p K + + Λ su protoni fermi. Determinare l energia minima del fotone nel laboratorio per cui la reazione avviene Λ decade in volo
Esercizio 1 I mesoni K + possono essere prodotti attraverso la reazione γ + p K + + Λ su protoni fermi. Determinare l energia minima del fotone nel laboratorio per cui la reazione avviene Λ decade in volo
Il nucleare non è il diavolo. Il problema:
 2005 Anno Mondiale della Fisica Il nucleare non è il diavolo Progetto di monitoraggio della radioattività ambientale nelle scuole Sezione di Torino dell INFN e Dipartimenti di Fisica dell Università di
2005 Anno Mondiale della Fisica Il nucleare non è il diavolo Progetto di monitoraggio della radioattività ambientale nelle scuole Sezione di Torino dell INFN e Dipartimenti di Fisica dell Università di
Sommario della lezione 4. Proprietà periodiche. Massa atomica e massa molecolare. Concetto di mole. Prime esercitazioni
 Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Configurazione elettronica e Tabella Periodica Negli elementi di transizione, il numero
Sommario della lezione 4 Proprietà periodiche Massa atomica e massa molecolare Concetto di mole Prime esercitazioni Configurazione elettronica e Tabella Periodica Negli elementi di transizione, il numero
e, non dipendendo da A, è la stessa per tutti i nuclei. 3A 4πr 3 0 n = A V = A = cm -3
 Modelli nucleari collettivi: il modello a goccia di liquido Già nel 1911 Rutherford, per spiegare i risultati del suo esperimento di diffusione di particelle α da nuclei pesanti ricavò che il nucleo è
Modelli nucleari collettivi: il modello a goccia di liquido Già nel 1911 Rutherford, per spiegare i risultati del suo esperimento di diffusione di particelle α da nuclei pesanti ricavò che il nucleo è
Capitolo 20 Applicazioni della fisica nucleare: il metodo dell attivazione neutronica
 Capitolo 20 Applicazioni della fisica nucleare: il metodo dell attivazione neutronica 20.1 Generalità Il processo di attivazione neutronica consiste nella produzione di un isotopo instabile attraverso
Capitolo 20 Applicazioni della fisica nucleare: il metodo dell attivazione neutronica 20.1 Generalità Il processo di attivazione neutronica consiste nella produzione di un isotopo instabile attraverso
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 7 Le particelle dell atomo 3 Sommario (I) 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 7 Le particelle dell atomo 3 Sommario (I) 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le
A 2 Z A 2 Z. PROTONI: carica +e, massa 1840 m e NEUTRONI: carica nulla, massa 1842 m e
 PROTONI: carica +e, massa 1840 m e NEUTRONI: carica nulla, massa 184 m e Z = numero atomico = numero dei protoni (elettroni) proprietà chimiche A = numero di massa = numero dei protoni + neutroni massa
PROTONI: carica +e, massa 1840 m e NEUTRONI: carica nulla, massa 184 m e Z = numero atomico = numero dei protoni (elettroni) proprietà chimiche A = numero di massa = numero dei protoni + neutroni massa
VELOCITA di REAZIONE. Quali sono le dimensioni di una velocità di reazione?? E una definizione che ha senso NON all equilibrio!!!
 VELOCITA di REAZIONE Quali sono le dimensioni di una velocità di reazione?? E una definizione che ha senso NON all equilibrio!!! Data la reazione: aa + bb cc + dd v = - 1 Δ[A] = - 1 Δ[B] = 1 Δ[C] = 1 Δ[D]
VELOCITA di REAZIONE Quali sono le dimensioni di una velocità di reazione?? E una definizione che ha senso NON all equilibrio!!! Data la reazione: aa + bb cc + dd v = - 1 Δ[A] = - 1 Δ[B] = 1 Δ[C] = 1 Δ[D]
dal 15 al 26/06/2015 Gerti Xhixha LEZIONE DI MARTEDI 16 GIUGNO 2015
 dal 15 al 26/06/2015 Gerti Xhixha xhixha@fe.infn.it LEZIONE DI MARTEDI 16 GIUGNO 2015 1 Introduzione alla fisica nucleare Breve storia dell atomo I costituenti dei nuclei atomici Leggi di conservazione
dal 15 al 26/06/2015 Gerti Xhixha xhixha@fe.infn.it LEZIONE DI MARTEDI 16 GIUGNO 2015 1 Introduzione alla fisica nucleare Breve storia dell atomo I costituenti dei nuclei atomici Leggi di conservazione
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 4. Modelli e configurazione SEGUI LA MAPPA e distinguere di massa (A) Spettri 1 e
Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 4. Modelli e configurazione SEGUI LA MAPPA e distinguere di massa (A) Spettri 1 e
Applicazioni della radioattività: le datazioni archeologiche e geologiche
 Applicazioni della radioattività: le datazioni archeologiche e geologiche Criterio di base della radiodatazione Dato un campione di materiale contenente all istante t = 0 n 0 nuclei di una sostanza radioattiva,
Applicazioni della radioattività: le datazioni archeologiche e geologiche Criterio di base della radiodatazione Dato un campione di materiale contenente all istante t = 0 n 0 nuclei di una sostanza radioattiva,
LEZIONE 10. Esercizio La media di tre numeri reali può essere maggiore del massimo dei tre numeri?
 10 LEZIONE 10 Esercizio 10.1. La media di tre numeri reali può essere maggiore del massimo dei tre numeri? Siano a, b, c tre numeri reali, senza perdita di generalità possiamo assumere che sia a il massimo
10 LEZIONE 10 Esercizio 10.1. La media di tre numeri reali può essere maggiore del massimo dei tre numeri? Siano a, b, c tre numeri reali, senza perdita di generalità possiamo assumere che sia a il massimo
1 FEBBRAIO 2013 MODELLI ESPONENZIALI
 1 FEBBRAIO 2013 MODELLI ESPONENZIALI COS E UN MODELLO? La ricerca scientifica ha tra i suoi principali obiettivi quelli di comprendere descrivere come si svolgono I FENOMENI nel mondo che ci circonda MODELLI
1 FEBBRAIO 2013 MODELLI ESPONENZIALI COS E UN MODELLO? La ricerca scientifica ha tra i suoi principali obiettivi quelli di comprendere descrivere come si svolgono I FENOMENI nel mondo che ci circonda MODELLI
