Gli enzimi. Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici
|
|
|
- Natalia Fantini
- 7 anni fa
- Visualizzazioni
Transcript
1 Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che promuove una reazione chimica senza subire alcuna modificazione permanente
2 1. Catalisi acido-basica La catalisi acida generale è un processo in cui il trasferimento temporaneo di un protone da un acido abbassa l energia libera dello stato di transizione di una reazione Si parla di catalisi basica generale se la velocità di reazione viene accelerata dalla sottrazione temporanea di un protone da parte di una base
3 2. Catalisi covalente (nucleofilica) La catalisi covalente coinvolge la formazione di un legame covalente transitorio tra l enzima e il substrato
4 3. Catalisi favorita da ioni metallici Gli ioni metallici possono : 1. Legarsi al substrato in modo da orientarlo correttamente 2. Partecipare a reazioni di ossido-riduzione mediante cambiamento reversibile del numero di ossidazione del metallo 3. Stabilizzare elettrostaticamente cariche negative
5 Cinetica enzimatica
6 [E] limitante [S] in eccesso
7 Tutti gli enzimi possono essere analizzati per quantificare sia la loro velocità di reazione che la loro efficienza La relazione tra queste due grandezze è descritta dall equazione di Michaelis-Menten
8 From Wikipedia, the free encyclopedia Leonor Michaelis (January 16, 1875 October 8, 1949) was a German biochemist and physician famous for his work with Maud Menten in enzyme kinetics and Michaelis-Menten kinetics. Born in Berlin (Germany), he studied medicine in Freiburg, where he graduated in In 1914 he published a paper suggesting that Emil Abderhalden's notorious pregnancy tests could not be reproduced, a paper which fatally compromised Michaelis' position as an academic in Germany (.) Besides his role in the formulation of the Michaelis-Menten equation (1913) he discovered Janus green as a supravital stain for mitochondria and the Michaelis-Gutmann body in urinary tract infections (1902) and found that thioglycolic acid could dissolve keratin, making him the father of the permanent wave.
9 From Wikipedia, the free encyclopedia Maud Leonora Menten (March 20, 1879 July 26, 1960) was a Canadian medical scientist who made significant contributions to enzyme kinetics and histochemistry. Her name is associated with the famous Michaelis- Menten equation in biochemistry. She was among the first women in Canada to earn a medical doctorate. She completed her thesis work at University of Chicago. At that time women were not allowed to do research in Canada, so she decided to do research in other countries such as the United States and Germany. In 1912 she moved to Berlin where she worked with Leonor Michaelis, obtaining a Ph.D. in ( ) Her most famous work ( ) resulted in the Michaelis-Menten equations. Menten also invented the azo-dye coupling reaction for alkaline phosphatase, which is still used in histochemistry. She characterised bacterial toxins from B. paratyphosus, S. scarlatinae and Salmonella ssp.) and conducted the first electrophoretic separation of proteins in She worked on the properties of hemoglobin, regulation of blood sugar level, and kidney function. She was also an accomplished musician and painter.
10 Leonor Michaelis e Maud Menten (1913) La cinetica di Michaelis-Menten descrive l'andamento della velocità di una reazione catalizzata da enzimi, al variare della concentrazione di substrato. (Questo modello è valido per enzimi non allosterici.) ES è un intermedio di reazione il cui basso valore di energia di attivazione permette di fare avvenire una specifica reazione catalizzata. Quando ES assume un valore di concentrazione che si mantiene costante nel tempo, si dice che è stato raggiunto lo stato stazionario (steady state).
11 Quando [S] è tale che tutto E si trova in ES la seconda tappa limita la velocità complessiva della reazione, che diviene insensibile ad un aumento ulteriore di [S]
12 L equazione di Michaelis-Menten K M è uguale alla concentrazione di substrato a cui la Velocità di reazione è pari alla metà di quella massima (mol/l)
13 La costante di Michaelis-Menten è una grandezza caratteristica di ciascun enzima. K M indica l'affinità tra un enzima e il suo substrato: < valore di K M < [S] per cui V = V max /2 (alta affinità dell'enzima per il substrato). Viceversa > valore di K M > [S] per cui V = V max /2 (minore affinità dell'enzima per il substrato).
14 Quando tutto l enzima (cioè l enzima totale, E tot ) partecipa alla reazione, ovvero la concentrazione del complesso Enzima-Substrato [ES] diventa [E] tot, la velocità della reazione catalizzata corrisponderà alla velocità massima Vmax. Si può allora definire una nuova costante : Kcat = Vmax / [E TOT ]
15 Kcat = Vmax / [E TOT ] La costante catalitica K cat indica la velocità del processo catalitico (il numero di molecole trasformate in un secondo) ed è detta anche numero di turnover Kcat = rappresenta una misura diretta della formazione del prodotto in condizioni ottimali (s -1 ) Kcat/K M = è una costante di velocità di secondo ordine ((mol/l) s -1 ) e fornisce una misura dell efficienza e della specificità di un enzima
16 Per unità di enzima (EU) si intende: la quantità di enzima che trasforma 1 μmole di substrato in 1 minuto primo a temperatura definita (di norma 37 C).
17 Ogni enzima ha valori delle costanti caratteristici La SOD1 ha la più alta Kcat/K M di ogni altro enzima conosciuto (~7 x 10 9 M -1 s -1 )
18 La determinazione sperimentale di V Max (e quindi di K M ) è necessariamente imprecisa. Tuttavia, l'equazione di Michaelis-Menten può essere espressa nella forma
19 Grafico dei doppi reciproci (o di Lineweaver-Burk) Rappresentazione grafica dell'andamento di 1/V in funzione di 1/[S] retta con -1/K M intercetta sull'asse delle ascisse 1/Vmax intercetta sull'asse delle ordinate K M /V max = coefficiente angolare
20 Anche la rappresentazione di Lineweaver-Burk causa imprecisioni nella determinazione di K M e V MAX, però è molto utile per descrivere il tipo di inibizione di un enzima Gli inibitori enzimatici sono molecole che si legano ad un enzima e causano la diminuzione della sua attività. Molti inibitori sono studiati come farmaci. Proteasi di HIV con ritonavir
21 Gli inibitori sono classificati come reversibili e irreversibili. Gli inibitori reversibili si legano non covalentemente a E o a ES (attraverso legami ionici o idrogeno o per interazioni idrofobiche) Gli inibitori irreversibili modificano covalentemente aminoacidi presenti nel sito attivo di E
22 Gli inibitori sono anche classificati come Competitivi Non-competitivi Incompetitivi Misti
23 Inibizione competitiva
24 Gli inibitori competitivi legano E nello stesso sito del substrato e hanno la stessa intercetta sull asse y dell enzima non inibito (Vmax non cambia) ma la pendenza è diversa e la intercetta sull asse x cambia rispetto all enzima non inibito (K M cambia).
25 Inibizione non competitiva e incompetitiva Inibizione incompetitiva
26 Gli inibitori non competitivi legano E in un sito diverso da quello del substrato e hanno la stessa affinità per E ed ES. K M non cambia ma Vmax diminuisce
27 Gli inibitori incompetitivi legano solo ES Il complesso EIS è enzimaticamente inattivo Vmax e K M sono minori.
28 Gli inibitori misti legano sia E che ES ma con affinità differente Vmax diminuisce e K M aumenta
29 La regolazione dell attività enzimatica Le vie metaboliche sono costituite da serie di reazioni catalizzate E1 E2 E3 A B C D La velocità di una via metabolica è spesso regolata da una tappa di comando che accende/spegne la via stessa
30 La velocità della tappa di comando è regolata in diverse maniere: LENTAMENTE (ore o giorni) 1. Controllo genetico della concentrazione dell enzima. VELOCEMENTE (secondi o minuti) 1. Controllo allosterico (da substrati, coenzimi, prodotti anche di reazioni successive) 2. Modificazione covalente (ad es. fosforilazione) 3. Cicli del substrato (variazione della velocità di due reazioni opposte catalizzate da due enzimi diversi)
31 Controllo (epi)genetico della concentrazione di un enzima. A livello trascrizionale : struttura della cromatina, attivazione/disattivazione di un promotore A livello del processamento dell mrna splicing alternativo, stabilità A livello della traduzione localizzazione dell mrna, conservazione in RNP
32 Controllo post-traduzionale della concentrazione di un enzima Ripiegamento tridimensionale corretto Assemblaggio delle subunità peptidiche Formazione di legami S-S fra gruppi laterali di cisteine Rimozione di aminoacidi: o sequenze segnale di indirizzamento o metionina iniziale o sequenze presenti nei precursori Aggiunta di carboidrati e successiva elaborazione Aggiunta di code lipidiche Aggiunta di cofattori Modificazioni covalenti
33
34 Modificazioni post-traduzionali L attività di molti enzimi è regolata da modificazioni post-traduzionali, che modificano l affinità dell enzima per il suo substrato
35
36
37
38
39
40
41 - Glicosilazione; - Acetilazione (ad es. degli istoni); - Miristilazione (attacco di un ac. miristico, in genere in N-term); - fosforilazione/defosforilazione di residui -OH di Tyr, Ser o Thr (mediata da chinasi e fosfatasi) - Acilazione (a livello del C-term a livello del ER e del Golgi). - Gipilazione (attacco di Glicosil Fosfatidil Inositolo, GPI). - Formazione di ponti di solfuro (disolfuro isomerasi) - Metilazione (ad es. istoni, importante per il silenziamento geni) - Idrossilazione (per la formazione di ponti H fra proteine; es. proline nel collageno)
42 Modificazioni covalenti comuni delle proteine Modification Donor molecule Example of modified protein Phosphorylation ATP Glycogen phosphorylase Protein function Glucose homeostasis; energy transduction Acetylation Acetyl CoA Histones DNA packing; transcription Myristoylation Myristoyl CoA Src Signal transduction ADP-ribosylation NAD RNA polymerase Transcription Farnesylation Farnesyl pyrophosphate Ras Signal transduction γ-carboxylation HCO 3 - Thrombin Blood clotting Sulfation 3 -Phosphoadenosine- 5 -phosphosulfate Fibrinogen Blood-clot formation Ubiquitination Ubiquitin Cyclin Control of cell cycle
43 Controllo della attività della glicogeno fosforilasi
44 Controllo allosterico (da substrati, coenzimi, prodotti)
45 Regolazione mediante retroinibizione da prodotto (feedback inhibition ) E1 E2 E3 A B C D La concentrazione di un prodotto (finale/intermedio) della via metabolica regola l attività di un E a monte Se [D] è alta, E1 viene inibito da D stesso
46 Enzimi allosterici (L equazione di Michaelis-Menten non è valida) La regolazione allosterica (o allosteria) è la regolazione di un enzima o di una proteina (multimerica) mediata da una molecola detta effettore allosterico, che svolge tale funzione legandosi presso il sito allosterico. Un enzima dotato di siti allosterici è detto enzima allosterico. Il termine allosteria deriva dal greco allos, cioè "altro", e stereos, "struttura, solido", in riferimento alla separazione del sito allosterico di una proteina dal suo sito attivo.
47 Quando l'effettore di una proteina è diverso dal suo substrato si parla di allosteria eterotropica, quando coincide si parla di allosteria omotropica. Un modulatore allosterico omotropico è tipicamente un attivatore, un modulatore allosterico eterotropico può essere un attivatore o un inibitore I modulatori allosterici inducono cambiamenti conformazionali (anche a lunga distanza) nella proteina legata.
48
49 L'ossigeno è sia il substrato che l'effettore dell Hb. Il sito allosterico è il sito attivo di una subunità contigua. Il legarsi dell'ossigeno ad una subunità induce un cambio conformazionale in quella subunità, che forza i restanti siti attivi accrescendo la loro affinità per ossigeno. Stato T Stato R Bassa affinità per O 2 Alta affinità per O 2 (deossiemoglobina) (ossieomoglobina)
50 Il BPG diminuisce l affinità della Hb per l O 2 e quindi favorisce la forma deossi- Nei capillari, il BPG favorisce il rilascio di O 2 Il BPG è un modulatore allosterico eterotropico dell Hb.
51 Il cambiamento conformazionale indotto dal modulatore allosterico causa una variazione di affinità dell enzima per il substrato o della proteina per il ligando.
52 La Fosfofruttochinasi controlla la via glicolitica (nel muscolo scheletrico) 1. PFK è un tetramero con due stati conformazionali (T e R) in equilibrio tra loro L ATP è sia substrato che inibitore (2 siti di legame diversi) AMP, ADP e fruttosio-2,6- bifosfato sono attivatori
53 La regolazione allosterica viene talvolta sfruttata in farmacologia. Ad es. gli ansiolitici benzodiazepine (ad es : Valium, Xanax, Librium e Ativan) potenziano l attività del neurotrasmettitore acido gammaaminobutirrico (GABA) legando il suo recettore GABA R in un sito diverso dal GABA e attivandolo (il GABA R è un canale inibitorio, quando è attivato diminuisce l attività neuronale).
REGOLAZIONE DELL ATTIVITA ENZIMATICA 1) MODULAZIONE ALLOSTERICA NON-COVALENTE (REVERSIBILE)
 REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
REGOLAZIONE ENZIMATICA
 REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30)
 TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
BIOCHIMICA APPLICATA e CLINICA
 BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
GLI ENZIMI: proteine con attività CATALITICA
 Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
Funzioni dei nucleotidi
 Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
FUNZIONI delle PROTEINE
 FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più
 Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Glycogen Synthesis Glicogeno sintesi UTP UDP + 2 P i glycogen (n) + glucose-1-p glycogen (n + 1) Glycogen Phosphorylase P i Glicogeno lisi
 Glycogen Synthesis Glicogeno sintesi UTP UDP + 2 P i glycogen (n) + glucose-1-p glycogen (n + 1) Glycogen Phosphorylase P i Glicogeno lisi Se entrambe le vie fossero attive simultaneamente nella cellula
Glycogen Synthesis Glicogeno sintesi UTP UDP + 2 P i glycogen (n) + glucose-1-p glycogen (n + 1) Glycogen Phosphorylase P i Glicogeno lisi Se entrambe le vie fossero attive simultaneamente nella cellula
BIOLOGIA GENERALE 19 dicembre 2006
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
INIBIZIONE ENZIMATICA REVERSIBILE
 INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
Il trasporto del glucosio
 Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe.
 INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe. Gli inibitori reversibili si legano all enzima mediante
INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe. Gli inibitori reversibili si legano all enzima mediante
Inibizione Enzimatica
 Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre
 Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
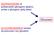
Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe. Substrato
 Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe Substrato Nelson Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright 2014 6 11
Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe Substrato Nelson Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright 2014 6 11
La termodinamica studia i flussi/trasformazioni di energia. Bioenergetica: termodinamica applicata ai sistemi biologici
 LA CAPACITÀ DI USARE ENERGIA È CARATTERISTICA DEI SISTEMI VIVENTI Bisogni degli esseri viventi: Energia (luce, molecole organiche) Catalizzatori biologici (enzimi) La termodinamica studia i flussi/trasformazioni
LA CAPACITÀ DI USARE ENERGIA È CARATTERISTICA DEI SISTEMI VIVENTI Bisogni degli esseri viventi: Energia (luce, molecole organiche) Catalizzatori biologici (enzimi) La termodinamica studia i flussi/trasformazioni
TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA
 TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA Lo studio della cinetica enzimatica inizia nel 1909 con ADRIAN BROWN
TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA Lo studio della cinetica enzimatica inizia nel 1909 con ADRIAN BROWN
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
FUNZIONI BIOLOGICHE DELLE PROTEINE
 FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
Metabolismo del Glucosio
 Metabolismo del Glucosio Schema generale del metabolismo del glucosio Una panoramica della glicolisi Conce2 chiave La glicolisi consiste nella degradazione del glucosio a piruvato e utilizza, al contempo,
Metabolismo del Glucosio Schema generale del metabolismo del glucosio Una panoramica della glicolisi Conce2 chiave La glicolisi consiste nella degradazione del glucosio a piruvato e utilizza, al contempo,
Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio
 Cinetica enzimatica Cenni alla cinetica delle reazioni Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio OVVERO: CINETICA ENZIMATICA LO
Cinetica enzimatica Cenni alla cinetica delle reazioni Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio OVVERO: CINETICA ENZIMATICA LO
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi.
 ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
Regolazione ormonale del metabolismo energetico. Lezione del 11 marzo 2014
 Regolazione ormonale del metabolismo energetico Lezione del 11 marzo 2014 Effetti fisiologici e metabolici dell adrenalina: preparazione all azione EFFETTO IMMEDIATO EFFETTO COMPLESSIVO Effetto fisiologico
Regolazione ormonale del metabolismo energetico Lezione del 11 marzo 2014 Effetti fisiologici e metabolici dell adrenalina: preparazione all azione EFFETTO IMMEDIATO EFFETTO COMPLESSIVO Effetto fisiologico
Utilizzo del glucosio: la glicolisi
 Utilizzo del glucosio: la glicolisi GLUCOSIO Sistema rapido, reversibile, GLICOLISI avviene anche in assenza di ossigeno. Produce poca energia OSSIDAZIONE PIRUVATO Fermentazione LATTATO ACETATO CICLO DI
Utilizzo del glucosio: la glicolisi GLUCOSIO Sistema rapido, reversibile, GLICOLISI avviene anche in assenza di ossigeno. Produce poca energia OSSIDAZIONE PIRUVATO Fermentazione LATTATO ACETATO CICLO DI
catabolismo anabolismo
 Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
2015 /2016. scaricato da
 Enzimi Prof Spina Riabilitativa 2015 /2016 Gli enzimi i sono catalizzatori t i biologici i i molto efficienti: i caratterizzati da potere catalitico e specificità, possegono una porzione dedicata: il
Enzimi Prof Spina Riabilitativa 2015 /2016 Gli enzimi i sono catalizzatori t i biologici i i molto efficienti: i caratterizzati da potere catalitico e specificità, possegono una porzione dedicata: il
Università di Roma Tor Vergata Scienze della Nutrizione Umana Biochimica della Nutrizione - Prof.ssa Luciana Avigliano A.A.
 Università di Roma Tor Vergata Scienze della Nutrizione Umana Biochimica della Nutrizione - Prof.ssa Luciana Avigliano A.A. 2011-12 Nutrienti quali regolatori delle funzioni cellulari AZIONE REGOLATORIA
Università di Roma Tor Vergata Scienze della Nutrizione Umana Biochimica della Nutrizione - Prof.ssa Luciana Avigliano A.A. 2011-12 Nutrienti quali regolatori delle funzioni cellulari AZIONE REGOLATORIA
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
NADH e NADPH. ATP = 1 moneta (energetica) della cellula NADH, NADPH = 2 moneta (potere riducente)
 NADH e NADPH ATP = 1 moneta (energetica) della cellula NADH, NADPH = 2 moneta (potere riducente) NADH e NADPH non sono funzionalmente intercambiabili. [NAD + ]/[NADH] ~ 1000 favorisce ossidazione [NADP
NADH e NADPH ATP = 1 moneta (energetica) della cellula NADH, NADPH = 2 moneta (potere riducente) NADH e NADPH non sono funzionalmente intercambiabili. [NAD + ]/[NADH] ~ 1000 favorisce ossidazione [NADP
Enzimi come catalizzatori biologici
 Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
I catalizzatori della cellula: gli ENZIMI
 I catalizzatori della cellula: gli ENZIMI LA CATALISI ENZIMATICA E NECESSARIA PER PERMETTERE A MOLTE REAZIONI BIOCHIMICHE DI PROCEDERE AD UNA VELOCITA CONVENIENTE IN CONDIZIONI BIOLOGICHE UNA REAZIONE
I catalizzatori della cellula: gli ENZIMI LA CATALISI ENZIMATICA E NECESSARIA PER PERMETTERE A MOLTE REAZIONI BIOCHIMICHE DI PROCEDERE AD UNA VELOCITA CONVENIENTE IN CONDIZIONI BIOLOGICHE UNA REAZIONE
Velocità di reazione
 1 Velocità di reazione A B V = - d[a] dt = d[b] dt V= Velocità istantanea: coefficiente angolare della retta tangente alla curva in quel punto Quando t=0 la velocità istantanea sarà massima (V 0 ) 2 Energia
1 Velocità di reazione A B V = - d[a] dt = d[b] dt V= Velocità istantanea: coefficiente angolare della retta tangente alla curva in quel punto Quando t=0 la velocità istantanea sarà massima (V 0 ) 2 Energia
Catabolismo dei carboidrati Glicolisi
 Catabolismo dei carboidrati Glicolisi Principali vie di utilizzo del Glucosio L estrazione dell energia dai composti organici può essere divisa in tre stadi Metabolismo del glucosio C 6 H 12 O 6 + 6O 2
Catabolismo dei carboidrati Glicolisi Principali vie di utilizzo del Glucosio L estrazione dell energia dai composti organici può essere divisa in tre stadi Metabolismo del glucosio C 6 H 12 O 6 + 6O 2
TRASDUZIONE DEL SEGNALE CELLULARE
 TRASDUZIONE DEL SEGNALE CELLULARE RECETTORI I recettori ormonali sono proteine (spesso glicoproteine) capaci di riconoscere e legare l ormone L interazione tra ormone e recettore è estremamente specifica
TRASDUZIONE DEL SEGNALE CELLULARE RECETTORI I recettori ormonali sono proteine (spesso glicoproteine) capaci di riconoscere e legare l ormone L interazione tra ormone e recettore è estremamente specifica
Cap.16 GLICOLISI. Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP H 2 O 2 NAD + 2 NADH + 2H +
 Cap.16 GLICOLISI Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP 2 + 2 H 2 O 2 NAD + 2 NADH + 2H + Via metabolica in 10 tappe (reazioni) La glicolisi può
Cap.16 GLICOLISI Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP 2 + 2 H 2 O 2 NAD + 2 NADH + 2H + Via metabolica in 10 tappe (reazioni) La glicolisi può
OBIETTIVI FORMATIVI: LEZIONI Temi e competenze acquisite Argomenti Contenuti specifici Ore 1. STRUTTURA E FUNZIONE DELLE MACROMOLECOLE BIOLOGICHE
 Insegnamento: BIOCHIMICA (cod. 65951; 6. CFU; 60. ore) A.A. 2014-2015 Corso di laurea: Tecnologie Alimentari (T.A.) Scuola di Agraria e Medicina Veterinaria - Campus di Cesena Prof.ssa Romana Fato OBIETTIVI
Insegnamento: BIOCHIMICA (cod. 65951; 6. CFU; 60. ore) A.A. 2014-2015 Corso di laurea: Tecnologie Alimentari (T.A.) Scuola di Agraria e Medicina Veterinaria - Campus di Cesena Prof.ssa Romana Fato OBIETTIVI
di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori.
 Enzimi Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
Enzimi Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro.
 Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
Lezione n. 11. Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
Biosintesi dei carboidrati
 Biosintesi dei carboidrati Gluconeogenesi: sintesi di glucosio da precursori non saccaridici La riserva di glucosio dell organismo (glucosio + glicogeno) è sufficiente per circa 1 giorno. La via gluconeogenetica
Biosintesi dei carboidrati Gluconeogenesi: sintesi di glucosio da precursori non saccaridici La riserva di glucosio dell organismo (glucosio + glicogeno) è sufficiente per circa 1 giorno. La via gluconeogenetica
GLICOLISI ADP ATP. Condizioni aerobiche. Condizioni anaerobiche ATP
 GLICOLISI È la parte iniziale del processo di degradazione ossidativa dei carboidrati. Durante la loro ossidazione l energia immagazzinata nel loro scheletro carbonioso è utilizzata per produrre ATP e
GLICOLISI È la parte iniziale del processo di degradazione ossidativa dei carboidrati. Durante la loro ossidazione l energia immagazzinata nel loro scheletro carbonioso è utilizzata per produrre ATP e
Energia di attivazione
 1 ENZIMI Caratteristiche fondamentali della catalisi enzimatica e del meccanismo di azione degli enzimi Componenti strutturali e funzionali degli enzimi Nomenclatura e classificazione internazionale degli
1 ENZIMI Caratteristiche fondamentali della catalisi enzimatica e del meccanismo di azione degli enzimi Componenti strutturali e funzionali degli enzimi Nomenclatura e classificazione internazionale degli
INTRODUZIONE AL METABOLISMO. dal gr. metabolè = trasformazione
 INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
La via per accelerare i processi biologici
 La via per accelerare i processi biologici ENZIMI Sono delle proteine altamente specializzare con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa.
La via per accelerare i processi biologici ENZIMI Sono delle proteine altamente specializzare con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa.
Fondamenti di Chimica Farmaceutica. Recettori come bersagli dei farmaci
 Fondamenti di Chimica Farmaceutica Recettori come bersagli dei farmaci Recettori come bersaglio dei farmaci I farmaci che agiscono sui recettori: a somiglianza dei farmaci che agiscono sugli enzimi vanno
Fondamenti di Chimica Farmaceutica Recettori come bersagli dei farmaci Recettori come bersaglio dei farmaci I farmaci che agiscono sui recettori: a somiglianza dei farmaci che agiscono sugli enzimi vanno
- CINETICA ENZIMATICA
 - CINETICA ENZIMATICA ENZIMI: - CATALIZZATORI aumenta la V di una reazione chimica senza subire trasformazioni durante l intero processo - PROTEINE gli enzimi sono proteine di struttura 3 o talora 4 -
- CINETICA ENZIMATICA ENZIMI: - CATALIZZATORI aumenta la V di una reazione chimica senza subire trasformazioni durante l intero processo - PROTEINE gli enzimi sono proteine di struttura 3 o talora 4 -
Esempi di funzioni svolte dalle proteine
 Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio. GLUCONEOGENESI (sintesi da precursori non glucidici)
 DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) 1 2 Il glucosio viene trasportato all interno della cellula
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) 1 2 Il glucosio viene trasportato all interno della cellula
METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI
 METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI Glicolisi: Glucosio Glucosio Piruvato Piruvato Gluconeogenesi La Glicolisi (dal greco glykys dolce e lysis scissione) E` la via metabolica che
METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI Glicolisi: Glucosio Glucosio Piruvato Piruvato Gluconeogenesi La Glicolisi (dal greco glykys dolce e lysis scissione) E` la via metabolica che
Una risposta cellulare specifica può essere determinata dalla presenza di mediatori chimici (ormoni o altre molecole), dall interazione con altre
 Una risposta cellulare specifica può essere determinata dalla presenza di mediatori chimici (ormoni o altre molecole), dall interazione con altre cellule (contatto cellula-cellula) o con strutture extracellulari
Una risposta cellulare specifica può essere determinata dalla presenza di mediatori chimici (ormoni o altre molecole), dall interazione con altre cellule (contatto cellula-cellula) o con strutture extracellulari
Enzimi: catalizzatori biologici
 Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
Il flusso e la regolazione dell informazione genica. Lezione nr. 8 Psicobiologia
 Il flusso e la regolazione dell informazione genica Lezione nr. 8 Psicobiologia L informazione che viene trascritta non riguarda tutto il DNA ma solo delle particolari sequenze definite GENI. Tipologie
Il flusso e la regolazione dell informazione genica Lezione nr. 8 Psicobiologia L informazione che viene trascritta non riguarda tutto il DNA ma solo delle particolari sequenze definite GENI. Tipologie
Chimica Fisica Biologica
 Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
INTRODUZIONE AL METABOLISMO
 INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
SOLUZIONI DEGLI ESERCIZI
 Niccolò Taddei - Biochimica Capitolo 4 GLI ENZIMI 1 Un enzima è un particolare tipo di proteina con funzione di catalizzatore, cioè è in grado di aumentare la velocità di una reazione chimica. Gli enzimi
Niccolò Taddei - Biochimica Capitolo 4 GLI ENZIMI 1 Un enzima è un particolare tipo di proteina con funzione di catalizzatore, cioè è in grado di aumentare la velocità di una reazione chimica. Gli enzimi
Termodinamica ENTALPIA...6
 Termodinamica ORGANISMI PRIMO VIVENTI ED ENERGIA...2 PRINCIPIO DELLA TERMODINAMICA...5 ENTALPIA...6 SECONDO PRINCIPIO DELLA TERMODINAMICA... 7 energia libera di Gibbs (G)...9 Variazione di energia libera
Termodinamica ORGANISMI PRIMO VIVENTI ED ENERGIA...2 PRINCIPIO DELLA TERMODINAMICA...5 ENTALPIA...6 SECONDO PRINCIPIO DELLA TERMODINAMICA... 7 energia libera di Gibbs (G)...9 Variazione di energia libera
Regolazione della Glicolisi
 Regolazione della Glicolisi Enzimi regolati della glicolisi: 1) esochinasi. da: Champe La esochinasi: ha bassa Km per Glu 0,2mM: questo assicura la captazione anche di poche molecole di glucosio, presenti
Regolazione della Glicolisi Enzimi regolati della glicolisi: 1) esochinasi. da: Champe La esochinasi: ha bassa Km per Glu 0,2mM: questo assicura la captazione anche di poche molecole di glucosio, presenti
Chimica Biologica A.A Cinetica Enzimatica. Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano
 Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Gli Enzimi. catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche
 catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche Gli Enzimi Sono le proteine più importanti e più specializzate Presentano un elevato grado di specificità per
catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche Gli Enzimi Sono le proteine più importanti e più specializzate Presentano un elevato grado di specificità per
I ribosomi liberi nel citoplasma sintetizzano le proteine destinate alla via citoplasmatica, cioè quelle destinate a:
 I ribosomi liberi nel citoplasma sintetizzano le proteine destinate alla via citoplasmatica, cioè quelle destinate a: filmato Rimanere nel citoplasma Essere trasportate dal citoplasma al nucleo Essere
I ribosomi liberi nel citoplasma sintetizzano le proteine destinate alla via citoplasmatica, cioè quelle destinate a: filmato Rimanere nel citoplasma Essere trasportate dal citoplasma al nucleo Essere
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
Catalisi. Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A Modulo di Biologia Strutturale
 Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Catalisi Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie
Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Catalisi Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie
Biosintesi non ribosomiale di metaboliti peptidici bioattivi
 Biosintesi non ribosomiale di metaboliti peptidici bioattivi Strutture di alcuni peptidi bioattivi prodotti da batteri e funghi Come vengono prodotti questi peptidi? Hanno strutture complesse (spesso
Biosintesi non ribosomiale di metaboliti peptidici bioattivi Strutture di alcuni peptidi bioattivi prodotti da batteri e funghi Come vengono prodotti questi peptidi? Hanno strutture complesse (spesso
Carboidrati! Oligosaccaridi Polisaccaridi. B) Carboidrati complessi
 Carboidrati! Sono i composti organici più abbondanti sulla terra Contengono: C, H, O Sono Aldeidi o Chetoni poliossidrilici Possono essere suddivisi in: A) Zuccheri semplici Monosaccaridi B) Carboidrati
Carboidrati! Sono i composti organici più abbondanti sulla terra Contengono: C, H, O Sono Aldeidi o Chetoni poliossidrilici Possono essere suddivisi in: A) Zuccheri semplici Monosaccaridi B) Carboidrati
La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia.
 La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia. Il ciclo dell acido citrico è una via metabolica centrale
La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia. Il ciclo dell acido citrico è una via metabolica centrale
Ioni metallici: Cu 2+, Fe 3+, Zn 2+ Coenzimi : NAD +, FAD + COSUBSTRATI GRUPPI PROSTETICI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
STRUTTURA TRIDIMENSIONALE DELLE PROTEINE
 STRUTTURA TRIDIMENSIONALE DELLE PROTEINE Biologia della Cellula Animale 2016 1 STRUTTURA PROTEINE Cooper: The Cell, a Molecular Approach, 2 nd ed. http://en.wikipedia.org/wiki/protein_structure STRUTTURA
STRUTTURA TRIDIMENSIONALE DELLE PROTEINE Biologia della Cellula Animale 2016 1 STRUTTURA PROTEINE Cooper: The Cell, a Molecular Approach, 2 nd ed. http://en.wikipedia.org/wiki/protein_structure STRUTTURA
ENZIMI. A + B AB (100 Kcal= E. Attiv.) A + B AB (50 Kcal) SUBSTRATO ENZIMA E N E R G I A
 ENZIMI 1) sono catalizzatori di natura biologica e sono proteine 2) gli enzimi abbassano l energia di attivazione di un solo tipo di reazione senza intervenire nella reazione stessa cioè senza esserne
ENZIMI 1) sono catalizzatori di natura biologica e sono proteine 2) gli enzimi abbassano l energia di attivazione di un solo tipo di reazione senza intervenire nella reazione stessa cioè senza esserne
Corso di Chimica e Propedeutica Biochimica Cinetica chimica ed enzimatica
 Corso di Chimica e Propedeutica Biochimica Cinetica chimica ed enzimatica 2 H 2 (g) + 2 (g) 2 H 2 (g) 1 Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007,
Corso di Chimica e Propedeutica Biochimica Cinetica chimica ed enzimatica 2 H 2 (g) + 2 (g) 2 H 2 (g) 1 Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007,
Gli ENZIMI sono proteine (eccezioni: RIBOZIMI = RNA con attività catalitica) che sono strutturalmente suddivise in due classi:
 ENZIMI Gli ENZIMI sono proteine (eccezioni: RIBOZIMI = RNA con attività catalitica) che sono strutturalmente suddivise in due classi: PROTEINE SEMPLICI (costituite solo dalla parte di natura proteica)
ENZIMI Gli ENZIMI sono proteine (eccezioni: RIBOZIMI = RNA con attività catalitica) che sono strutturalmente suddivise in due classi: PROTEINE SEMPLICI (costituite solo dalla parte di natura proteica)
all codons are used in protein synthesis 20 amino acids 3 termination (stop) codons: UAA, UAG, UGA
 Il Codice Genetico The genetic code consists of 64 triplet codons (A, G, C, U) 4 3 = 64 all codons are used in protein synthesis 20 amino acids 3 termination (stop) codons: UAA, UAG, UGA AUG (methionine)
Il Codice Genetico The genetic code consists of 64 triplet codons (A, G, C, U) 4 3 = 64 all codons are used in protein synthesis 20 amino acids 3 termination (stop) codons: UAA, UAG, UGA AUG (methionine)
Le proteine che legano ossigeno:
 Le proteine che legano ossigeno: . I cristalli si ottengono per precipitazione lenta della molecola da una soluzione, in condizioni che non dovrebbero alterare la sua struttura Un cristallo proteico È
Le proteine che legano ossigeno: . I cristalli si ottengono per precipitazione lenta della molecola da una soluzione, in condizioni che non dovrebbero alterare la sua struttura Un cristallo proteico È
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
1/v
 1. Nel seguente grafico sono descritti i risultati di cinetica enzimatica ottenuti in 3 esperimenti condotti in assenza di inibitori e in presenza di un inibitore a due diverse concentrazioni. a) Individuare
1. Nel seguente grafico sono descritti i risultati di cinetica enzimatica ottenuti in 3 esperimenti condotti in assenza di inibitori e in presenza di un inibitore a due diverse concentrazioni. a) Individuare
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio. GLUCONEOGENESI (sintesi da precursori non glucidici)
 DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
Lattato. Glicolisi. Piruvato
 Lattato Glicolisi Piruvato REAZIONI MITOCONDRIALI DEL PIRUVATO + Piruvato Deidrogenasi + CO 2 + H 2 O ATP ADP + Pi Piruvato Carbossilasi + 2 H + ossalacetato La Piruvato Carbossilasi è una proteina Mitocondriale
Lattato Glicolisi Piruvato REAZIONI MITOCONDRIALI DEL PIRUVATO + Piruvato Deidrogenasi + CO 2 + H 2 O ATP ADP + Pi Piruvato Carbossilasi + 2 H + ossalacetato La Piruvato Carbossilasi è una proteina Mitocondriale
Cine%ca enzima%ca. Copyright 2013 Zanichelli editore S.p.A.
 Cine%ca enzima%ca Copyright 2013 Zanichelli editore S.p.A. La cinetica delle reazioni Conce, chiave Le semplici equazioni di velocità descrivono il progredire delle reazioni di primo e di secondo ordine.
Cine%ca enzima%ca Copyright 2013 Zanichelli editore S.p.A. La cinetica delle reazioni Conce, chiave Le semplici equazioni di velocità descrivono il progredire delle reazioni di primo e di secondo ordine.
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Ioni metallici: Cu 2+, Fe 3+, Zn 2+ Coenzimi : NAD +, FAD + COSUBSTRATI GRUPPI PROSTETICI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica
 Brevetti Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica Committente:
Brevetti Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica Committente:
Ioni inorganici (Mg 2+, Zn 2+ ), o molecole organiche o metallorganiche (coenzimi)
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
La catalisi enzimatica. Copyright 2013 Zanichelli editore S.p.A.
 La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Concetti chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Concetti chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
Biosintesi degli aminoacidi
 Biosintesi degli aminoacidi Per l uomo la fonte principale di gruppi NH 4 + sono gli AA contenuti nelle proteine della dieta Parte di NH 4 + che si genera dalla degradazione degli AA viene riciclata e
Biosintesi degli aminoacidi Per l uomo la fonte principale di gruppi NH 4 + sono gli AA contenuti nelle proteine della dieta Parte di NH 4 + che si genera dalla degradazione degli AA viene riciclata e
Il metabolismo: concetti di base
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Il metabolismo: concetti di base Caratteristiche generali Strategie Trofiche Il metabolismo:
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Il metabolismo: concetti di base Caratteristiche generali Strategie Trofiche Il metabolismo:
METABOLISMO DEL GLICOGENO
 METABOLISMO DEL GLICOGENO GLICOGENO: Polisaccaride di riserva del regno animale Organi principali: FEGATO MUSCOLO SCHELETRICO Glicogeno Glucosio Glucosio-6P Via del pentoso fosfato Glucosio Fruttosio-6P
METABOLISMO DEL GLICOGENO GLICOGENO: Polisaccaride di riserva del regno animale Organi principali: FEGATO MUSCOLO SCHELETRICO Glicogeno Glucosio Glucosio-6P Via del pentoso fosfato Glucosio Fruttosio-6P
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Energia e metabolismi energetici
 Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
Lezione 1: Atomi e molecole:
 Lezione 1: Atomi e molecole: La materia è costituita da elementi chimici in forma pura o in combinazioni dette composti. La vita richiede circa 25 elementi chimici. La struttura atomica determina il comportamento
Lezione 1: Atomi e molecole: La materia è costituita da elementi chimici in forma pura o in combinazioni dette composti. La vita richiede circa 25 elementi chimici. La struttura atomica determina il comportamento
Tirosin chinasi senza o con funzione recettoriale
 Tirosin chinasi senza o con funzione recettoriale elica di poliprolina Il dominio chinasico di Src è mantenuto nello stato inattivo mediante due distinte interazioni intramolecolari: il legame del dominio
Tirosin chinasi senza o con funzione recettoriale elica di poliprolina Il dominio chinasico di Src è mantenuto nello stato inattivo mediante due distinte interazioni intramolecolari: il legame del dominio
ENZIMI. Catalizzatori delle reazioni biologiche
 ENZIMI Catalizzatori delle reazioni biologiche Le tre proprietà distintive degli enzimi sono A capacità catalitica B specificità C regolazione NOMENCLATURA Gli enzimi sono classificati in base alle reazioni
ENZIMI Catalizzatori delle reazioni biologiche Le tre proprietà distintive degli enzimi sono A capacità catalitica B specificità C regolazione NOMENCLATURA Gli enzimi sono classificati in base alle reazioni
REGOLAZIONE DEL METABOLISMO GLUCIDICO
 REGOLAZIONE DEL METABOLISMO GLUCIDICO IL METABOLISMO DEL GLICOGENO E FINEMENTE REGOLATO: Quando è attiva la sua sintesi non è attiva la sua demolizione e viceversa I principali ormoni che controllano il
REGOLAZIONE DEL METABOLISMO GLUCIDICO IL METABOLISMO DEL GLICOGENO E FINEMENTE REGOLATO: Quando è attiva la sua sintesi non è attiva la sua demolizione e viceversa I principali ormoni che controllano il
