giorni da dedicare alla vita non alla psoriasi
|
|
|
- Albana Clemente
- 7 anni fa
- Visualizzazioni
Transcript
1 Depositato presso AIFA in data 03/09/2010 RCP in allegato * giorni da dedicare alla vita non alla psoriasi Primo di una nuova classe di farmaci biologici che agisce selettivamente su IL-12 e IL-23, per il trattamento della psoriasi a placche moderata-grave 1 * 4 = terapia di mantenimento dopo 2 dosi di induzione 1. Stelara Riassunto delle caratteritiche del prodotto.
2 Stelara (ustekinumab): primo di una classe di biologici con meccanismo d azione unico, altamente selettivo 1-5 Struttura Anticorpo monoclonale interamente umano Anti-p40 umano Target Subunità p40 di IL-12 e IL-23 Meccanismo d azione - ipotesi Blocca il legame di IL-12 e IL-23 con il recettore IL-12Rβ1 sulle cellule T indifferenziate Impedisce la differenziazione/espansione clonale delle sottopopolazioni linfocitarie Th1 e Th17 coinvolte nella patogenesi della psoriasi IgG 1. Stelara Riassunto delle caratteritiche del prodotto. 2. Gately MK et al. Annu Rev Immunol. 1998;16: Wilson NJ et al. Nat Immunol. 2007;8(9): Nickoloff BJ, Nestle FO. J Clin Invest. 2004;113(12): Nestle FO et al. J Invest Dermatol. 2004; 123:xiv-xv.
3 IL-12 e IL-23 6,7: come agiscono normalmente 6. Torti DC, Feldman SR. J Am Acad Dermatol. 2007;57(6): Trinchieri G, Nat Rev Immunol. 2003;3(2):
4 Inibizione di IL-12 e IL-23 con anticorpo anti-p Nestle FO, Conrad C. J Invest Dermatol. 2004;123(6):xiv-xv. 6. Torti DC, Feldman SR. J Am Acad Dermatol. 2007;57(6):
5 Stelara ha un meccanismo d azione unico, altamente selettivo 2-5 L anticorpo si lega alla subunità p40 di IL-12 e IL-23, impedendo il legame con i loro recettori di superficie Viene limitata la differenziazione e l espansione clonale di Th1 e Th17 Down-regolazione delle citochine infiammatorie 2. Gately MK et al. Annu Rev Immunol. 1998;16: Wilson NJ et al. Nat Immunol. 2007;8(9): Nickoloff BJ, Nestle FO. J Clin Invest. 2004;113(12): Nestle FO et al. J Invest Dermatol. 2004; 123:xiv-xv.
6 Clearance Efficacia rapida, significativa e prolungata 8,9 8. Leonardi CL et al. Lancet. 2008;371: Papp K et al. Lancet. 2008;371:
7 PHOENIX 1 e PHOENIX 2 Gli Obiettivi 8,9 Studi di Fase 3, in doppio cieco, controllati verso placebo, multicentrici, su pazienti, che hanno valutato efficacia e sicurezza di nel trattamento di pazienti con psoriasi a placche di grado da moderato a grave 1,2 Obiettivo primario: Percentuale di pazienti che hanno raggiunto un miglioramento PASI >75% dal basale alla settimana 12 Obiettivi secondari: Percentuale di pazienti con malattia eliminata o minima secondo Physician Global Assessment (PGA) alla settimana 12 Miglioramento del Dermatology Life Quality Index (DLQI) Tempo alla perdita della risposta nei soggetti randomizzati a continuare il trattamento di mantenimento o a placebo (PHOENIX 1) N visite con risposta PASI 75 (settimane 40-52) nei pazienti trattati con ustekinumab ogni 8 settimane e in quelli trattati ogni 12 settimane (PHOENIX 2) 8. Leonardi CL et al. Lancet. 2008;371: Papp K, et al. Lancet. 2008;371:
8 Criteri di inclusione 8,9 Età 18 anni PHOENIX 1 e PHOENIX 2 Criteri di inclusione ed esclusione Diagnosi di psoriasi a placche da almeno 6 mesi Candidato per fototerapia o trattamento sistemico della psoriasi PASI 12 BSA 10% Anamnesi negativa o assenza di sintomi di TB attiva Criteri di esclusione 8,9 8. Leonardi CL et al. Lancet. 2008;371: Papp K, et al. Lancet. 2008;371: Forme di psoriasi non a placche Recente infezione grave, sistemica o locale Neoplasia nota (eccetto carcinoma cutaneo basocellulare o squamocellulare trattato da almeno 5 anni) Precedente trattamento con un farmaco anti-il-12 o anti-il-23 Assunzione di farmaci biologici o sperimentali entro i 3 mesi precedenti Trattamento con terapia sistemica convenzionale per la psoriasi o fototerapia entro le 4 settimane precedenti Trattamento topico per la psoriasi entro le 2 settimane precedenti
9 PHOENIX 1 Caratteristiche demografiche simili al basale 45 mg PHOENIX 1 - Totale 8 90 mg Placebo Pazienti randomizzati Maschi, n (%) 175 (68,6%) 173 (67,6%) 183 (71,8%) Età (anni) * 44,8 (12,5) 46,2 (11,3) 44,8 (11,3) Peso (kg) * 93,7 (23,8) 93,8 (23,9) 94,2 (23,5) Trattamento precedente con: Topici 245 (96,1%) 239 (93,4%) 242 (94,9%) Fototerapia 173 (67,8%) 169 (66,0%) 150 (58,8%) Sistemici convenzionali 141 (55,3%) 141 (55,1%) 142 (55,7%) Biologici 134 (52,5%) 130 (50,8%) 128 (50,2%) Pazienti con tubercolosi latente 8 (3,1%) 7 (2,7%) 10 (3,9%) *Media (DS) 8. Leonardi CL et al. Lancet. 2008;371:
10 PHOENIX 2 Caratteristiche demografiche simili al basale 45 mg PHOENIX 2 - Totale 9 90 mg Placebo Pazienti randomizzati Maschi, n (%) 283 (69,2%) 274 (66,7%) 283 (69,0%) Età (anni) * 45,1 (12,1) 46,6 (12,1) 47,0 (12,5) Peso (kg) * 90,3 (21,0) 91,5 (21,3) 91,1 (21,6) Trattamento precedente con: Topici 393 (96,1%) 384 (93,4%) 396 (96,6%) Fototerapia 286 (69,9%) 267 (65,0%) 276 (67,3%) Sistemici convenzionali 223 (54,5%) 224 (54,5%) 241 (58,8%) Biologici 157 (38,4%) 150 (36,5%) 159 (38,8%) Pazienti con tubercolosi latente 16 (3,9%) 16 (3,9%) 11 (2,7%) *Media (DS) 9. Papp K et al. Lancet. 2008;371:
11 PHOENIX 1 Gravità della malattia simile al basale 45 mg PHOENIX 1 - Totale 8 90 mg Placebo Pazienti randomizzati Durata della psoriasi (anni) * 19,7 (11,7) 19,6 (11,1) 20,4 (11,7) BSA (%) * 27,2% (17,5) 25,2% (15,0) 27,7% (17,4) Artrite psoriasica, n (%) 74 (29,0%) 94 (36,7%) 90 (35,3%) Punteggio PASI (0-72) * 20,5 (8,6) 19,7 (7,6) 20,4 (8,6) PGA Marcato o Grave, n (%) 114 (44,7%) 109 (42,6%) 112 (43,9%) Punteggio DLQI (0-30) * 11,1 (7,1) 11,6 (6,9) 11,8 (7,4) *Media (DS) 8. Leonardi CL et al. Lancet. 2008;371:
12 PHOENIX 2 Gravità della malattia simile al basale 45 mg PHOENIX 2 - Totale 9 90 mg Placebo Pazienti randomizzati Durata della psoriasi (anni) * 19,3 (11,7) 20,3 (12,3) 20,8 (12,2) BSA (%) * 25,9% (15,5) 27,1% (17,4) 26,1% (17,4) Artrite psoriasica, n (%) 107 (26,2%) 94 (22,9%) 105 (25,6%) Punteggio PASI (0-72) * 19,4 (6,8) 20,1 (7,5) 19,4 (7,5) PGA Marcato o Grave, n (%) 169 (41,3%) 159 (38,7%) 160 (39,0%) Punteggio DLQI (0-30) * 12,2 (7,1) 12,6 (7,3) 12,3 (6,9) *Media (DS) 9. Papp K et al. Lancet. 2008;371:
13 PHOENIX 1: disegno dello studio 8 Interruzione vs mantenimento del trattamento nel lungo termine 8. Leonardi CL et al. Lancet. 2008;371:
14 PHOENIX 2: disegno dello studio 9 Frequenze diverse di somministrazione 9. Papp K et al. Lancet. 2008;371:
15 Pazienti (%) Clearance rapida e significativa con solo 2 somministrazioni sottocutanee Risposta PASI 75 rapida già alla settimana % ,1% 79% 71% Settimane 45 mg 90 mg Iniezione di ustekinumab 8. Leonardi CL et al. Lancet. 2008;371:
16 Pazienti (%) Risposta PASI 75 a 12 settimane: PHOENIX 1 simile a PHOENIX 2 PASI 75 alla settimana 12 Endpoint primario in PHOENIX 1 e PHOENIX 2 8,9 100 PHOENIX 1 PHOENIX ,1* 66,4* 80 66,7* 75,7* ,1 0 0 Placebo (n=255) 45 mg (n=255) 90 mg (n=256) *p< vs placebo per ogni confronto 3,7 Placebo (n=410) 45 mg (n=409) 90 mg (n=411) 8. Leonardi CL et al. Lancet. 2008;371: Papp K et al. Lancet. 2008;371:
17 Pazienti (%) Risposta PASI 75 a 28 settimane: PHOENIX 1 simile a PHOENIX PASI 75 alla settimana 28 (iniezioni alla settimana 0, 4 e 16) PHOENIX 1 8 PHOENIX ,2 78, ,5 78, mg 90 mg 0 45 mg 90 mg 8. Leonardi CL et al. Lancet. 2008;371: Papp K et al. Lancet. 2008;371:
18 Pazienti (%) Effetto massimo raggiunto dopo soltanto 3 somministrazioni sottocutanee 100 PASI 75 alla settimana 40 (iniezioni alla settimana 0, 4, 16 e 28) 8 85% ,1% Massima efficacia osservata a 24 settimane 79% 71% Settimane 45 mg 90 mg Iniezione di ustekinumab 8 Leonardi CL et al. Lancet. 2008;371:
19 Pazienti (%) Risposta PGA : PHOENIX 1 simile a PHOENIX PGA psoriasi eliminata o minima a 28 settimane PHOENIX 1 8 PHOENIX ,8 66, , mg 90 mg 0 45 mg 90 mg 8. Leonardi CL et al. Lancet. 2008;371: Papp K et al. Lancet. 2008;371:
20 Miglioramento dell onicopatia psoriasica in pazienti con psoriasi da moderata a severa 10 Percentuale di pazienti con punteggio PGA ungueale assente o lieve dopo 12 e 24 settimane di trattamento 10. Rich P et al. Poster presented at EADV, Sep , Paris. Poster FP1007.
21 Mediana (%) Risposta al trattamento mantenuta con una somministrazione ogni 12 settimane 8 Miglioramento percentuale mediano del punteggio PASI rispetto al basale (settimane 40-76)* Placebo 45 mg ogni 12 settimane Placebo 90 mg ogni 12 settimane *Tutti i pazienti randomizzati alla terapia di mantenimento o all interruzione del trattamento alla settimana Leonardi CL et al. Lancet. 2008;371:
22 Pazienti (%) Efficacia nei pazienti naive paragonabile a quella dei pazienti trattati in precedenza con altre terapie PASI 75 a 12 settimane in base al precedente trattamento con altre terapie ,8* 67,6* 67,7* 70,4* 74,3* 63* Terapie sistemiche convenzionali Fototerapia (n=436) (n=895) Biologici (n=760) (n=571) (n=602) (n=729) *p<0.001 vs placebo Naïve a trattamenti precedenti Precedenti trattamenti 11. Papp K et al. Poster presented at EADV, Sep , Paris. Poster FP1388.
23 Punteggio medio DLQI al basale Per i pazienti con psoriasi la pelle può essere solo una parte del problema Negli studi clinici PHOENIX 1 e PHOENIX 2 i pazienti al basale mostravano una compromissione della qualità di vita valutata con l indice DLQI 12 Punteggio DLQI al basale delle popolazioni degli studi PHOENIX 1 e PHOENIX 2 8, ,1 11,6 12,2 12, ,5 0 PHOENIX 1 8 PHOENIX 2 9 Punteggio medio in volontari sani 1 Stelara 45 mg Stelara 90 mg 12. Finlay AY, Khan GK. Clin Exp Dermatol. 1994;19: Leonardi CL et al. Lancet. 2008;371: Papp K et al. Lancet. 2008;371:
24 Pazienti (%) Miglioramento significativo della qualità di vita già dopo 2 somministrazioni sottocutanee 13 Pazienti con miglioramento clinicamente significativo ( 5 punti) del punteggio DLQI a 12 settimane (iniezioni alle settimane 0 e 4) ,8* 76,9* ,4 0 Placebo 45 mg 90 mg *p<0.001 vs placebo Una riduzione 5 rispetto al basale è considerata clinicamente significativa Langley R et al. Presented at WCD, Sep 30 Oct , Buenos Aires. 26. Khilji FA et al. Br J Dermatol. 2002;147(Suppl 2):50.
25 Miglioramento medio Miglioramento significativo della qualità di vita già dopo 2 somministrazioni sottocutanee 13 10,0 8,0 Miglioramento medio rispetto al basale dei punteggi DLQI, SF-36 PCS e MCS* a 12 settimane 8,0** 8,7** 6,0 4,0 2,0 0,6 2,0** 3,2** 2,1** 2,5** 0,0-2,0 DLQI -0,5 PCS -1,3 MCS Placebo 45 mg 90 mg *PCS: componente fisica del questionario SF-36; MCS: componente psicologica del questionario SF-36 **p<0.001 vs placebo 13 - Lebwohl M et al. Poster presented at EADV, Sep , Paris. Poster FP1362.
26 ACCEPT Il primo studio di confronto diretto tra biologici nella psoriasi disegnato per superiorità 15 Obiettivo primario: confrontare l efficacia di ustekinumab e di etanercept Gruppi di trattamento*: 45 mg, alle settimane 0 e 4 90 mg, alle settimane 0 e 4 Etanercept 50 mg, due volte alla settimana fino a 12 settimane *confronto diretto tra ustekinumab ed etanercept nelle prime 12 settimane dello studio. 15. Griffiths C et al. N Engl J Med. 2010;362:
27 ACCEPT Endpoint principali Endpoint primario 15 Percentuale di pazienti che hanno raggiunto una risposta PASI 75 alla settimana 12 Endpoint secondari principali 15 Percentuale di pazienti con punteggio PGA di psoriasi eliminata (0) o minima (1) alla settimana 12 Percentuale di pazienti con risposta PASI 90 alla settimana Griffiths C et al. N Engl J Med. 2010;362:
28 Criteri di inclusione 15 Età 18 anni ACCEPT Criteri di inclusione ed esclusione Diagnosi di psoriasi a placche da almeno 6 mesi PASI 12 BSA 10% PGA 3 Candidato per fototerapia o terapia sistemica Mancata risposta, controindicazione o intolleranza ad almeno una terapia sistemica convenzionale (metotrexate, ciclosporina o PUVA) Criteri di esclusione 15 Forme di psoriasi non a placche o forme iatrogene Terapia con biologici entro 3 mesi o 5 emivite del farmaco dall arroulamento Precedente trattamento con etanercept o ustekinumab Farmaci sistemici per la psoriasi o fototerapia entro 4 settimane dall arruolamento Farmaci topici per la psoriasi entro 2 settimane dall arruolamento Infezione seria recente o storia pregressa di infezioni croniche o ricorrenti. Neoplasia (eccetto tumore a cellule basali, tumore a cellule squamose o cancro cervicale in situ trattati e senza evidenza di recidiva almeno negli ultimi 5 anni) 15. Griffiths C et al. N Engl J Med. 2010;362:
29 ACCEPT Studio in doppio cieco vs controllo attivo Griffiths C et al. N Engl J Med. 2010;362:
30 Pazienti (%) ACCEPT: Efficacia di ustekinumab statisticamente superiore ad etanercept dopo 12 settimane PASI PASI ,5* 73,8** , ,4** 44,7** 23, Etanercept (n=347) 45 mg (n=209) 90 mg (n=347) N di iniezioni Etanercept (n=347) 45 mg (n=209) 90 mg (n=347) *p=0.01 per la superiorità vs etanercept; **p<0.001 per la superiorità vs etanercept 15. Griffiths C et al. N Engl J Med. 2010;362:
31 Pazienti (%) ACCEPT: Efficacia di ustekinumab statisticamente superiore ad etanercept dopo 12 settimane PGA psoriasi minima o eliminata 80 65* 71* Etanercept (n=347) 45 mg (n=209) 90 mg (n=347) *p<0.001 per la superiorità vs etanercept 15. Griffiths C et al. N Engl J Med. 2010;362:
32 Pazienti (%) ACCEPT Consistenza di risposta di ustekinumab ed etanercept negli studi clinici sulla psoriasi 100 Risposte PASI 75 a 12 settimane Papp K et al 16 PHOENIX PHOENIX ACCEPT 15 Etanercept 50 mg 45 mg 90 mg 16. Papp KA et al. Br J Dermatol. 2005; 152: ; 8. Leonardi CL et al. Lancet. 2008;371: ; 9. Papp K et al. Lancet. 2008;371: ; 15 Griffiths C et al. N Engl J Med. 2010;362:
33 ACCEPT - Conclusioni Primo studio di confronto diretto, disegnato per superiorità, tra due farmaci biologici per il trattamento della psoriasi Alla settimana 12 ustekinumab 45 mg o 90 mg con 2 iniezioni, alle settimane 0 e 4, ha mostrato un efficacia superiore ad etanercept 50 mg, due volte la settimana ed etanercept sono risultati ben tollerati con profili di sicurezza simili nelle 12 settimane di confronto L efficacia nello studio ACCEPT è paragonabile a quella osservata negli altri studi clinici su ustekinumab 15. Griffiths C et al. N Engl J Med. 2010;362:
34 Affidabilità Sicurezza e tollerabilità simili a placebo 8,9 8. Leonardi CL et al. Lancet. 2008;371: Papp K et al. Lancet. 2008;371:
35 Profilo di sicurezza simile a placebo nel breve termine PHOENIX 1 8 Eventi avversi (EA) fino alla settimana mg (n=255) 90 mg (n=255) Placebo (n=255) Pazienti con 1 EA 147 (57,6%) 131 (51,4%) 123 (48,2%) EA causa di interruzione del farmaco in studio 1 (0,4%) 4 (1,6%) 6 (2,4%) EA Seri 2 (0,8%) 4 (1,6%) 2 (0,8%) Infezioni 80 (31,4%) 66 (25,9%) 68 (26,7%) Infezioni serie 0 (0%) 2 (0,8%) 1 (0,4%) Neoplasie cutanee 0 (0%) 0 (0%) 0 (0%) Neoplasie non-cutanee 0 (0%) 0 (0%) 0 (0%) Eventi cardiovascolari 1 (0,4%) 0 (0%) 0 (0%) I dati sono espressi come numero di pazienti (%) 8. Leonardi CL et al. Lancet. 2008;371:
36 Profilo di sicurezza simile a placebo nel breve termine PHOENIX 1 8 Eventi avversi (EA) con frequenza 5% in uno qualunque dei gruppi fino alla settimana mg (n=255) 90 mg (n=255) Placebo (n=255) Infezione delle vie respiratorie superiori 18 (7,1%) 16 (6,3%) 16 (6,3%) Nasofaringite 26 (10,2%) 21 (8,2%) 22 (8,6%) Artralgia 7 (2,7%) 6 (2,4%) 7 (2,7%) Cefalea 14 (5,5%) 13 (5,1%) 6 (2,4%) Tosse Eritema nel sito di iniezione I dati sono espressi come numero di pazienti (%) 8. Leonardi CL et al. Lancet. 2008;371:
37 Profilo di sicurezza simile a placebo nel breve termine PHOENIX 2 9 Eventi avversi (EA) fino alla settimana mg (n=409) 90 mg (n=411) Placebo (n=410) Pazienti con 1 EA 217 (53,1%) 197 (47,9%) 204 (49,8%) EA causa di interruzione del farmaco in studio 1 (0,2%) 6 (1,5%) 8 (2,0%) EA Seri 8 (2,0%) 5 (1,2%) 8 (2,0%) Infezioni 88 (21,5%) 92 (22,4%) 82 (20,0%) Infezioni serie 0 (0%) 1 (0,2%) 2 (0,5%) Neoplasie cutanee 0 (0%) 1 (0,2%) 1 (0,2%) Neoplasie non-cutanee 0 (0%) 0 (0%) 1 (0,2%) Eventi cardiovascolari 0 (0%) 1 (0,2%) 0 (0%) I dati sono espressi come numero di pazienti (%) 9. Papp K et al. Lancet. 2008;371:
38 Profilo di sicurezza simile a placebo nel breve termine PHOENIX 2 9 Eventi avversi (EA) con frequenza 5% in uno qualunque dei gruppi fino alla settimana mg (n=409) 90 mg (n=411) Placebo (n=410) Infezione delle vie respiratorie superiori 18 (4,4%) 12 (2,9%) 14 (3,4%) Nasofaringite 30 (7,3%) 28 (6,8%) 29 (7,1%) Artralgia 14 (3,4%) 10 (2,4%) 12 (2,9%) Cefalea 19 (4,6%) 19 (4,6%) 17 (4,1%) Tosse 3 (0,7%) 4 (1,0%) 7 (1,7%) Eritema nel sito di iniezione 6 (1,5%) 6 (1,5%) 1 (0,2%) I dati sono espressi come numero di pazienti (%) 9. Papp K et al. Lancet. 2008;371:
39 ACCEPT Eventi avversi fino a 12 settimane Etanercept 45 mg 90 mg Pazienti trattati, n Durata media del follow-up, n di settimane 12,1 12,1 12,2 Esposizione media, n di somministrazioni 23,2 2,0 2,0 Reazioni al sito di iniezione, n (%) 86 (24,8%) 9 (4,3%) 13 (3,7%) Pazienti con 1 EA, n (%) 243 (70,0%) 138 (66,0%) 240 (69,2%) EA seri, n (%) 4 (1,2%) 4 (1,9%) 4 (1,2%) EA causa di interruzione del trattamento, n (%) 8 (2,3%) 4 (1,9%) 4 (1,2%) Infezioni, n (%) 101 (29,1%) 64 (30,6%) 103 (29,7%) Infezioni che richiedono trattamento, n (%) 34 (9,8%) 18 (8,6%) 33 (9,5%) Neoplasie, n (%) - NMSC 0 (0%) 2 (1,0%) 1 (0,3%) - Altre neoplasie 0 (0%) 1 (0,5%) 0 (0%) NMSC: tumore cutaneo non melanoma 15. Griffiths C et al. N Engl J Med. 2010;362:
40 Profilo di sicurezza simile a placebo nel lungo termine Eventi avversi durante la terapia a lungo termine (settimane 40 76) 8. Leonardi CL et al. Lancet. 2008;371: Terapia di mantenimento (ustekinumab) (n=161) Terapia interrotta (Placebo) (n=160) Pazienti con uno o più eventi avversi (EA) 108 (67,1%) 121 (75,6%) EA comuni*: - Infezione delle vie respiratorie superiori 22 (13,7%) 21 (13,1%) - Nasofaringite 16 (9,9%) 17 (10,6%) - Artralgia 3 (1,9%) 12 (7,5%) - Cefalea 6 (3,7%) 4 (2,5%) EA causa di interruzione del trattamento 3 (1,9%) 3 (1,9%) EA seri 1 (0,6%) 7 (4,4%) EA di particolare interesse: - Infezioni 71 (44,1%) 76 (47,5%) - Infezioni serie 0 (0%) 2 (1,3%) - Carcinomi cutanei 2 (1,2%) 0 (0%) - Neoplasie non-cutanee 0 (0%) 1 (0,6%) - Eventi cardiovascolari 0 (0%) 0 (0%) I dati sono espressi come numero di pazienti (%) *EA occorsi in almeno il 5% dei pazienti di uno qualunque dei gruppi di trattamento
41 Una terapia ben tollerata Anticorpi anti-ustekinumab: PHOENIX 1 8 PHOENIX 2 9 Pazienti con anticorpi 5,1% (38/746) 5,4% (65/1202) Titolo Basso (<1/320) Non disponibile Reazioni nel sito di iniezione: 0,7% (32/4559) Lieve (32/32) 1% (56/5632) Lieve (55/56) Placebo 0,23% (37/16,063) 0,4% (67/14,919) Reazioni anafilattiche o malattia da siero Nessuna Nessuna 8. Leonardi CL et al. Lancet. 2008;371: Papp K et al. Lancet. 2008;371:
42 Incidenza per 100 A-p (IC 95%) Profilo di sicurezza a 3 anni: il rischio di infezioni è basso e stabile nel tempo 17 3,0 Infezioni serie 2,0 1, (0.35, 4.96) 0.49 (0.01, 2.75) 1.97 (0.54,5.03) 1.23 (0.40, 2.97) (0.56, 1.88) (0.54, 1.84) (0.68, 1.59) 0.82 (0.49, 1.30) 1.50 (0.07, 2.05) 1.19 (0.90, 1.64) 0,0 Periodo controllato 1,5 anni 3 anni N Anni-paziente # di eventi Placebo 45 mg 90 mg combinato 17. Gordon K et al. Poster presented at EADV, Oct 7-11, 2009, Berlin. P1170.
43 Incidenza per 100 A-p Profilo di sicurezza a 3 anni: il rischio di infezioni è basso e stabile nel tempo 17 Infezioni che hanno richiesto terapia antinfettiva Periodo controllato 1,5 anni 3 anni N Anni-paziente Placebo 45 mg 90 mg combinato 17. Gordon K et al. Poster presented at EADV, Oct 7-11, 2009, Berlin. P1170.
44 Incidenza per 100 A-p (IC 95%) Profilo di sicurezza a 3 anni: il rischio di carcinoma cutaneo non melanoma (NMSC) è basso e stabile nel tempo 17 3,0 2,0 1, (0.14, 4.09) 0.98 (0.12, 3.55) 0.49 (0.01, 2.75) 0.74 (0.15, 2.16) 0.63 (0.25, 1.30) 0.97 (0.48, 1.74) 0.80 (0.48, 1.27) (0.47, 1.19) (0.35, 1.08) (0.49, 1.00) 0,0 Periodo controllato 1,5 anni 3 anni N Anni-paziente # di eventi Placebo 45 mg 90 mg combinato 17. Gordon K et al. Poster presented at EADV, Oct 7-11, 2009, Berlin. P1170.
45 Incidenza per 100 A-p (IC 95%) Profilo di sicurezza a 3 anni: il rischio di altre neoplasie è basso e stabile nel tempo 17 3,0 2,0 1,0 0, (0.01, 3.15) 0.49 (0.01, 2.75) 0.25 (0.01, 1.37) 0.00 (0.00, 1.47) Periodo controllato 0.63 (0.25, 1.30) 0.09 (0.00, 0.49) 0.36 (0.15, 0.70) (0.39, 1.13) 0.46 (0.37, 0.82) (0.24, 0.81) 1,5 anni 3 anni N Anni-paziente # di eventi Placebo 45 mg 90 mg combinato I tassi di neoplasie non NMSC in 3 anni sono stati in linea con quelli attesi nella popolazione generale del database SEER (che copre circa il 26% della popolazione statunitense) SIR (IC 95%)= 1.05 ( ) 17. Gordon K et al. Poster presented at EADV, Oct 7-11, 2009, Berlin. P1170.
46 Incidenza per 100 A-p (IC 95%) Profilo di sicurezza a 3 anni: il rischio di eventi avversi cardiovascolari maggiori* è basso e stabile nel tempo 17 3,0 2,0 1,0 0, (0.00, 1.69) 0.98 (0.12, 3.56) 1.47 (0.30, 4.31) Periodo controllato 1.23 (0.40, 2.87) (0.01, 3.06) (0.20, 1.17) (0.21, 0.82) (0.10, 0.90) 0.41 (0.19, 0.78) 1,5 anni 3 anni 0.35 (0.16, 0.66) 0.38 (0.22, 0.59) N Anni-paziente # di eventi Placebo 45 mg 90 mg combinato I tassi di IM e ictus erano simili o inferiori a quelli attesi nella popolazione generale del database Framingham SIR (IC 95%)=0.52 ( ) 17. Gordon K et al. Poster presented at EADV, Oct 7-11, 2009, Berlin. P1170. * IM, ictus e morte CV
47 Parametri di laboratorio: analisi integrata della sicurezza Nessun impatto di sui parametri delle analisi di routine 18 Emocromo completo inclusa formula leucocitaria Ematochimica: elettroliti, funzionalità epatica e renale Nessuna variazione sostanziale nei seguenti parametri: 18,19 Livelli sierici di TN alfa e altre citochine Percentuale di linfociti T (CLA) (antigene linfocitario cutaneo) Risposta Th1/Th2 a stimoli esterni 18. Disponibile su: Reddy M et al. J Dermatol 2010; 37:
48 Depositato presso AIFA in data 03/09/2010 Risposta ai vaccini: analisi integrata della sicurezza 20 Nessun impatto sulla risposta al vaccino antitetanico e a Pneumovax (Fase 1) Tossicologia nei primati: Risposta normale alla risposta vaccinale cellule T-dipendente nei primati (KLH) 20. Brodmerkel C et al., J Drugs Dermatol 2010; 9 (6):
49 Praticità Solo 1 dose ogni 12 settimane* * dopo 2 dosi di induzione
50 Minimizza il tempo impiegato per assumere la terapia 21 Dopo 2 dosi iniziali, le iniezioni sottocutanee di Stelara si somministrano ogni 12 settimane 21 Dose aggiustata in base al peso corporeo 21 Gennaio Febbraio Marzo Aprile Inizio della terapia* Maggio Giugno Luglio Agosto Peso del paziente 100kg >100kg Dose di Stelara raccomandata 45 mg 90 mg Settembre Ottobre Novembre Dicembre Dose di mantenimento (ogni 12 settimane) La posologia raccomandata di STELARA è una dose iniziale di 45 mg somministrata per via sottocutanea alla settimana 0, seguita da una dose di 45 mg alla settimana 4 e, successivamente, ogni 12 settimane. In pazienti con un peso superiore a 100 kg la dose da somministrare è di 90 mg per via sottocutanea alla settimana 0, seguiti da una dose di 90 mg alla settimana 4 e, successivamente, ogni 12 settimane. È stato dimostrato che la dose di 45 mg è efficace anche in pazienti con un peso >100 kg. Tuttavia, per questa categoria di pazienti, la dose di 90 mg ha evidenziato una maggiore efficacia Stelara Riassunto delle caratteritiche del prodotto
Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 2330/2008) Documento relativo a: USTEKINUMAB
 Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 2330/2008) Documento relativo a: USTEKINUMAB Giugno 2010 Assessorato Politiche per la salute Commissione Regionale del Farmaco Ustekinumab Indicazioni
Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 2330/2008) Documento relativo a: USTEKINUMAB Giugno 2010 Assessorato Politiche per la salute Commissione Regionale del Farmaco Ustekinumab Indicazioni
Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE.
 Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE. Renato Bertini Malgarini, Giuseppe Pimpinella, Luca Pani 10 dicembre 2012- Istituto Superiore di Sanità
Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE. Renato Bertini Malgarini, Giuseppe Pimpinella, Luca Pani 10 dicembre 2012- Istituto Superiore di Sanità
SCHEDA DI VALUTAZIONE PER L INSERIMENTO DI FARMACI NON PRESENTI NEL PTR
 RICHIESTA DI INSERIMENTO IN PTR DI USTEKINUMAB L04AC05 (STELARA ) Presentata da Dott.ssa F. Cottoni Direttore dell Istituto di Dermatologia AOU Sassari In data marzo 2010 Per le seguenti motivazioni (sintesi)
RICHIESTA DI INSERIMENTO IN PTR DI USTEKINUMAB L04AC05 (STELARA ) Presentata da Dott.ssa F. Cottoni Direttore dell Istituto di Dermatologia AOU Sassari In data marzo 2010 Per le seguenti motivazioni (sintesi)
Ustekinumab Vs Etanercept nella psoriasi: Risultati dello studio ACCEPT
 Ustekinumab Vs Etanercept nella psoriasi: Risultati dello studio ACCEPT I nuovi agenti biologici offrono un alternativa importante nel della psoriasi; spesso però, il profilo rischio-beneficio non è bene
Ustekinumab Vs Etanercept nella psoriasi: Risultati dello studio ACCEPT I nuovi agenti biologici offrono un alternativa importante nel della psoriasi; spesso però, il profilo rischio-beneficio non è bene
Trattamento sistemico della psoriasi cronica a placche moderata-grave
 Linee guida terapeutiche /1 Trattamento sistemico della psoriasi cronica a placche moderata-grave Il posto in terapia di ustekinumab A cura del gruppo di lavoro multidisciplinare sui Farmaci Biologici
Linee guida terapeutiche /1 Trattamento sistemico della psoriasi cronica a placche moderata-grave Il posto in terapia di ustekinumab A cura del gruppo di lavoro multidisciplinare sui Farmaci Biologici
ALLEGATO A3.1.b Dgr n. del pag. 1/8
 giunta regionale 9^ legislatura ALLEGATO A3.1.b Dgr n. del pag. 1/8 PRESCRIZIONE FARMACI BIOLOGICI REGIONE del VENETO Psoriasi a Placche REGISTRAZIONE Cognome:..Nome:.. Codice Fiscale Sesso: M F Luogo
giunta regionale 9^ legislatura ALLEGATO A3.1.b Dgr n. del pag. 1/8 PRESCRIZIONE FARMACI BIOLOGICI REGIONE del VENETO Psoriasi a Placche REGISTRAZIONE Cognome:..Nome:.. Codice Fiscale Sesso: M F Luogo
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
Commissione Regionale Farmaco LAPATINIB
 Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 490 dell 11 aprile 2011) Documento relativo a: LAPATINIB Settembre 2011 Indicazioni registrate Lapatinib Il lapatinib ha ricevuto la seguente estensione
Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 490 dell 11 aprile 2011) Documento relativo a: LAPATINIB Settembre 2011 Indicazioni registrate Lapatinib Il lapatinib ha ricevuto la seguente estensione
29 OTTOBRE GIORNATA MONDIALE DELLA PSORIASI. Stefano Catrani Azienda USL della Romagna Rimini
 29 OTTOBRE 2016 - GIORNATA MONDIALE DELLA PSORIASI Stefano Catrani Azienda USL della Romagna Rimini 29 OTTOBRE 2016 - GIORNATA MONDIALE DELLA PSORIASI Stefano Catrani Azienda USL della Romagna Rimini Psoriasi
29 OTTOBRE 2016 - GIORNATA MONDIALE DELLA PSORIASI Stefano Catrani Azienda USL della Romagna Rimini 29 OTTOBRE 2016 - GIORNATA MONDIALE DELLA PSORIASI Stefano Catrani Azienda USL della Romagna Rimini Psoriasi
EFFICACIA DI DULOXETINA E PREGABALIN NELLA TERAPIA A BREVE TERMINE DELLA NEUROPATIA DIABETICA
 EFFICACIA DI DULOXETINA E PREGABALIN NELLA TERAPIA A BREVE TERMINE DELLA NEUROPATIA DIABETICA In Italia sono attualmente approvati per il trattamento del DPNP soltanto tre farmaci; tra questi i due più
EFFICACIA DI DULOXETINA E PREGABALIN NELLA TERAPIA A BREVE TERMINE DELLA NEUROPATIA DIABETICA In Italia sono attualmente approvati per il trattamento del DPNP soltanto tre farmaci; tra questi i due più
Studio SENIORS Trial sull effetto di nebivololo su mortalità e ospedalizzazioni per malattie cardiovascolari in pazienti anziani con insufficienza
 Trial sull effetto di nebivololo su mortalità e ospedalizzazioni per malattie cardiovascolari in pazienti anziani con insufficienza cardiaca (1) Introduzione (1) Età media dei pazienti con insufficienza
Trial sull effetto di nebivololo su mortalità e ospedalizzazioni per malattie cardiovascolari in pazienti anziani con insufficienza cardiaca (1) Introduzione (1) Età media dei pazienti con insufficienza
RoActemra. tocilizumab. Che cos è RoActemra? Per che cosa si usa RoActemra? Riassunto destinato al pubblico
 EMA/18167/2014 EMEA/H/C/000955 Riassunto destinato al pubblico tocilizumab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
EMA/18167/2014 EMEA/H/C/000955 Riassunto destinato al pubblico tocilizumab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
Trattamento Sistemico dell Artrite Reumatoide nell Adulto con particolare riferimento ai farmaci biologici
 Trattamento Sistemico dell Artrite Reumatoide nell Adulto con particolare riferimento ai farmaci biologici Gruppo Multidisciplinare sui Farmaci Biologici in Reumatologia Regione Emilia Romagna C. Salvarani,
Trattamento Sistemico dell Artrite Reumatoide nell Adulto con particolare riferimento ai farmaci biologici Gruppo Multidisciplinare sui Farmaci Biologici in Reumatologia Regione Emilia Romagna C. Salvarani,
 SCHEDA PER LA PRESCRIZIONE DI ENBREL nella PSORIASI Farmaco H REGIONE LAZIO Paziente (Nome /Cognome) Codice Fiscale Data di Nascita sesso M F Regione di residenza dell assistito Azienda USL Domicilio:
SCHEDA PER LA PRESCRIZIONE DI ENBREL nella PSORIASI Farmaco H REGIONE LAZIO Paziente (Nome /Cognome) Codice Fiscale Data di Nascita sesso M F Regione di residenza dell assistito Azienda USL Domicilio:
FARMACOSORVEGLIANZA DEI PAZIENTI IN TERAPIA CON EVOLOCUMAB
 FARMACOSORVEGLIANZA DEI PAZIENTI IN TERAPIA CON EVOLOCUMAB Francesca Bambara IL RUOLO DELL INFERMIERE Le malattie cardiovascolari (CVD) hanno una mortalità pari a 4 milioni di persone ogni anno solo in
FARMACOSORVEGLIANZA DEI PAZIENTI IN TERAPIA CON EVOLOCUMAB Francesca Bambara IL RUOLO DELL INFERMIERE Le malattie cardiovascolari (CVD) hanno una mortalità pari a 4 milioni di persone ogni anno solo in
PRESCRIZIONE FARMACI BIOLOGICI REGIONE del VENETO Psoriasi a Placche. Cognome:..Nome:.. Codice Fiscale Sesso: M F
 Servizio Sanitario Nazionale - Regione Veneto AZIENDA ULSS N. 6 VICENZA Viale F. Rodolfi n. 37 36100 VICENZA COD. REGIONE 050 COD. U.L.SS. 006 COD.FISC. E P.IVA 02441500242 PRESCRIZIONE FARMACI BIOLOGICI
Servizio Sanitario Nazionale - Regione Veneto AZIENDA ULSS N. 6 VICENZA Viale F. Rodolfi n. 37 36100 VICENZA COD. REGIONE 050 COD. U.L.SS. 006 COD.FISC. E P.IVA 02441500242 PRESCRIZIONE FARMACI BIOLOGICI
PAZIENTI AMBULATORIALI VIA LIVIGNO A.O. ICP MI - PAD. C A.O. SAN GERARDO 1 SETTEMBRE NOVEMBRE 2013
 PAZIENTI AMBULATORIALI VIA LIVIGNO A.O. ICP MI - PAD. C A.O. SAN GERARDO 1 SETTEMBRE 2013-15 NOVEMBRE 2013 PAZIENTI DERMATOLOGICI TOTALI 981 : 432 MASCHI E 549 FEMMINE PAZIENTI AFFETTI DA PSORIASI 71:
PAZIENTI AMBULATORIALI VIA LIVIGNO A.O. ICP MI - PAD. C A.O. SAN GERARDO 1 SETTEMBRE 2013-15 NOVEMBRE 2013 PAZIENTI DERMATOLOGICI TOTALI 981 : 432 MASCHI E 549 FEMMINE PAZIENTI AFFETTI DA PSORIASI 71:
USTEKINUMAB (12-04-2010)
 USTEKINUMAB (12-04-2010) Specialità: Stelara (Janssen - Cilag) Forma farmaceutica: soluzione per infusione 45 mg - Prezzo: euro 5198.79 soluzione per infusione 90 mg - Prezzo: euro 5198.79 ATC: L04AC05
USTEKINUMAB (12-04-2010) Specialità: Stelara (Janssen - Cilag) Forma farmaceutica: soluzione per infusione 45 mg - Prezzo: euro 5198.79 soluzione per infusione 90 mg - Prezzo: euro 5198.79 ATC: L04AC05
La vaccinazione come prevenzione primaria delle patologie correlate all infezione da HPV
 La vaccinazione come prevenzione primaria delle patologie correlate all infezione da HPV Marta Ciofi degli Atti Reparto Epidemiologia delle Malattie Infettive/CNESP Istituto Superiore di Sanità Composizione
La vaccinazione come prevenzione primaria delle patologie correlate all infezione da HPV Marta Ciofi degli Atti Reparto Epidemiologia delle Malattie Infettive/CNESP Istituto Superiore di Sanità Composizione
Utilizzo dei farmaci biologici in Regione Liguria: sostenibilità del sistema. Dott.ssa Maria Susanna Rivetti
 Utilizzo dei farmaci biologici in Regione Liguria: sostenibilità del sistema Dott.ssa Maria Susanna Rivetti 1 D.L.vo 219/2006 e s.m.i. Definizione Medicinali biologici Medicinali il cui principio attivo
Utilizzo dei farmaci biologici in Regione Liguria: sostenibilità del sistema Dott.ssa Maria Susanna Rivetti 1 D.L.vo 219/2006 e s.m.i. Definizione Medicinali biologici Medicinali il cui principio attivo
LA STRATEGIA TERAPEUTICA ADIUVANTE. Luciano Galletto
 I TUMORI DEL CORPO DELL UTERO: STRATEGIE TERAPEUTICHE IN EVOLUZIONE Torino, 26 Febbraio 2010 LA STRATEGIA TERAPEUTICA ADIUVANTE Luciano Galletto Proporzione dei tumori del corpo dell utero vs proporzione
I TUMORI DEL CORPO DELL UTERO: STRATEGIE TERAPEUTICHE IN EVOLUZIONE Torino, 26 Febbraio 2010 LA STRATEGIA TERAPEUTICA ADIUVANTE Luciano Galletto Proporzione dei tumori del corpo dell utero vs proporzione
Adalimumab nel trattamento a lungo termine della psoriasi
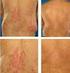 Suppl. al n. 25/21 di www.pharmastar.it Adalimumab nel trattamento a lungo termine della psoriasi Dott. Marco Romanelli Clinica Dermatologica Università degli Studi di Pisa www.pharmastar.it Congress News
Suppl. al n. 25/21 di www.pharmastar.it Adalimumab nel trattamento a lungo termine della psoriasi Dott. Marco Romanelli Clinica Dermatologica Università degli Studi di Pisa www.pharmastar.it Congress News
Terzo Meeting di Ematologia non Oncologica Firenze gennaio
 Dichiarazione di Trasparenza dei Rapporti Commerciali: La sottoscritta in qualità di Relatore, ai sensi dell art. 3.3 sul conflitto di interessi, dichiara che negli ultimi due anni non ha intrattenuto
Dichiarazione di Trasparenza dei Rapporti Commerciali: La sottoscritta in qualità di Relatore, ai sensi dell art. 3.3 sul conflitto di interessi, dichiara che negli ultimi due anni non ha intrattenuto
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
La principale innovazione farmacologica in Dermatologia è rappresenta dall Introduzione nella pratica clinica dei farmaci biologici
 Farmaci innovativi i in Dermatologia Sergio Chimenti Clinica Dermatologica Università degli Studi di Roma Tor Vergata La principale innovazione farmacologica in Dermatologia è rappresenta dall Introduzione
Farmaci innovativi i in Dermatologia Sergio Chimenti Clinica Dermatologica Università degli Studi di Roma Tor Vergata La principale innovazione farmacologica in Dermatologia è rappresenta dall Introduzione
2017: le novità nella mastocitosi e nella ipereosinofilia
 Settima Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche Sabato 13 Maggio 2017 CRIMM Centro di Ricerca e Innovazione per le Malattie Mieloproliferative AOU Careggi 2017:
Settima Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche Sabato 13 Maggio 2017 CRIMM Centro di Ricerca e Innovazione per le Malattie Mieloproliferative AOU Careggi 2017:
Humira. adalimumab. Che cos è Humira? Per che cosa si usa Humira? Riassunto destinato al pubblico
 EMA/65420/2013 EMEA/H/C/000481 Riassunto destinato al pubblico adalimumab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
EMA/65420/2013 EMEA/H/C/000481 Riassunto destinato al pubblico adalimumab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
FARMACI BIOLOGICI NELLE PATOLOGIE INFIAMMATORIE SISTEMICHE Belluno 25 05 2013 PSORIASI. B.Benvegnù-Dermatologia Belluno
 FARMACI BIOLOGICI NELLE PATOLOGIE INFIAMMATORIE SISTEMICHE Belluno 25 05 2013 PSORIASI B.Benvegnù-Dermatologia Belluno Prevalenza della psoriasi Dermatologia Belluno Psoriasi colpisce circa il 2% della
FARMACI BIOLOGICI NELLE PATOLOGIE INFIAMMATORIE SISTEMICHE Belluno 25 05 2013 PSORIASI B.Benvegnù-Dermatologia Belluno Prevalenza della psoriasi Dermatologia Belluno Psoriasi colpisce circa il 2% della
Allegato IV. Conclusioni scientifiche
 Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Il 7 giugno 2017, la Commissione europea (CE) è stata informata di un caso mortale di insufficienza epatica fulminante in un paziente trattato
Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Il 7 giugno 2017, la Commissione europea (CE) è stata informata di un caso mortale di insufficienza epatica fulminante in un paziente trattato
Produttività, capacità di attrarre risorse e trasferibilità
 Produttività, capacità di attrarre Trials clinici Anno 2008 Studio Gisas: aripiprazolo, olanzapina e aloperidolo nel trattamento a lungo termine della schizofrenia Lo studio si propone di valutare l utilità
Produttività, capacità di attrarre Trials clinici Anno 2008 Studio Gisas: aripiprazolo, olanzapina e aloperidolo nel trattamento a lungo termine della schizofrenia Lo studio si propone di valutare l utilità
STUDI CLINICI IN CORSO nella MIELOFIBROSI
 Quinta Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche Sabato 9 Maggio 2015 STUDI CLINICI IN CORSO nella MIELOFIBROSI Paola Guglielmelli Laboratorio Congiunto MMPC, AOU
Quinta Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche Sabato 9 Maggio 2015 STUDI CLINICI IN CORSO nella MIELOFIBROSI Paola Guglielmelli Laboratorio Congiunto MMPC, AOU
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE STELARA 130 mg concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni flaconcino
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE STELARA 130 mg concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni flaconcino
STUDIO PROSPETTICO SUL TRATTAMENTO INTENSIVO DELL ARTRITE REUMATOIDE PRECOCE: INDUZIONE E MANTENIMENTO DELLA REMISSIONE - CURE
 STUDIO PROSPETTICO SUL TRATTAMENTO INTENSIVO DELL ARTRITE REUMATOIDE PRECOCE: INDUZIONE E MANTENIMENTO DELLA REMISSIONE - CURE L artrite reumatoide (AR) è una malattia infiammatoria cronica, a carattere
STUDIO PROSPETTICO SUL TRATTAMENTO INTENSIVO DELL ARTRITE REUMATOIDE PRECOCE: INDUZIONE E MANTENIMENTO DELLA REMISSIONE - CURE L artrite reumatoide (AR) è una malattia infiammatoria cronica, a carattere
Dermatite atopica e medicina low dose
 XXV CONGRESSO NAZIONALE SIPPS REGALIAMO FUTURO Bari 12-14 settembre 2013 Dermatite atopica e medicina low dose Pediatra, Esperta in CAM La dermatite atopica fa parte del gruppo degli eczemi ECZEMA Patologia
XXV CONGRESSO NAZIONALE SIPPS REGALIAMO FUTURO Bari 12-14 settembre 2013 Dermatite atopica e medicina low dose Pediatra, Esperta in CAM La dermatite atopica fa parte del gruppo degli eczemi ECZEMA Patologia
Humira. adalimumab. Che cos è Humira? Per che cosa si usa Humira? Riassunto destinato al pubblico
 EMA/722238/2012 EMEA/H/C/000481 Riassunto destinato al pubblico adalimumab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
EMA/722238/2012 EMEA/H/C/000481 Riassunto destinato al pubblico adalimumab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
Specialità: Mabthera (Roche SpA) Forma farmaceutica: 1fl ev 500mg - Prezzo: euro fl 10ml 100mg - Prezzo: euro
 RITUXIMAB Linfoma non-hodgkin: La terapia di mantenimento per pazienti con linfoma follicolare ricaduto/refrattario che rispondono a terapia di induzione con chemioterapia con o senza Rituximab. (09-01-2007)
RITUXIMAB Linfoma non-hodgkin: La terapia di mantenimento per pazienti con linfoma follicolare ricaduto/refrattario che rispondono a terapia di induzione con chemioterapia con o senza Rituximab. (09-01-2007)
Allegato III Modifiche al riassunto delle caratteristiche del prodotto e al foglio illustrativo
 Allegato III Modifiche al riassunto delle caratteristiche del prodotto e al foglio illustrativo Nota: le modifiche di questo riassunto delle caratteristiche del prodotto e del foglio illustrativo sono
Allegato III Modifiche al riassunto delle caratteristiche del prodotto e al foglio illustrativo Nota: le modifiche di questo riassunto delle caratteristiche del prodotto e del foglio illustrativo sono
Etanercept nel trattamento della psoriasi in età pediatrica
 Linee guida terapeutiche /1 Trattamento sistemico della psoriasi cronica a placche moderata-grave Etanercept nel trattamento della psoriasi in età pediatrica Aggiornamento Febbraio 2012 A cura del gruppo
Linee guida terapeutiche /1 Trattamento sistemico della psoriasi cronica a placche moderata-grave Etanercept nel trattamento della psoriasi in età pediatrica Aggiornamento Febbraio 2012 A cura del gruppo
Lezione 2 Come leggere l articolo scientifico
 Analisi critica della letteratura scientifica Lezione 2 Come leggere l articolo scientifico Struttura dell articolo Introduzione Metodi Risultati e Discussione Perché è stato fatto? Come è stato condotto?
Analisi critica della letteratura scientifica Lezione 2 Come leggere l articolo scientifico Struttura dell articolo Introduzione Metodi Risultati e Discussione Perché è stato fatto? Come è stato condotto?
RITUXIMAB in associazione a metotressato è indicato per il trattamento dell artrite reumatoide attiva di grado severo in pazienti adulti.
 RITUXIMAB in associazione a metotressato è indicato per il trattamento dell artrite reumatoide attiva di grado severo in pazienti adulti. (28-02-2007) Specialità: Mabthera (Roche SpA) Forma farmaceutica:
RITUXIMAB in associazione a metotressato è indicato per il trattamento dell artrite reumatoide attiva di grado severo in pazienti adulti. (28-02-2007) Specialità: Mabthera (Roche SpA) Forma farmaceutica:
Documento PTR n. 119 relativo a:
 Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n. 119 relativo a: MEDICINALI ORIGINATOR E BIOSIMILARI DELL ERITROPOIETINA
Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n. 119 relativo a: MEDICINALI ORIGINATOR E BIOSIMILARI DELL ERITROPOIETINA
EMR Merck KGaA, Darmstadt, Germania. Fase clinica IIIb
 1/7 Sinossi Titolo della Numero della NEXT NSCLC ErbituX Trial Sperimentazione in aperto, randomizzata, multinazionale, di fase IIIb, di valutazione dell attività e della sicurezza di cetuximab come terapia
1/7 Sinossi Titolo della Numero della NEXT NSCLC ErbituX Trial Sperimentazione in aperto, randomizzata, multinazionale, di fase IIIb, di valutazione dell attività e della sicurezza di cetuximab come terapia
SORVEGLIANZA ATTIVA DEGLI EVENTI AVVERSI DOPO VACCINAZIONE ANTI-HPV SCHEDA CLINICA INDIVIDUALE
 ALLEGATO 1 SORVEGLIANZA ATTIVA DEGLI EVENTI AVVERSI DOPO VACCINAZIONE ANTI-HPV SCHEDA CLINICA INDIVIDUALE Cognome Nome Regione Comune ASL Codice fiscale Data di Nascita DATI ANAGRAFICI ED INFORMAZIONI
ALLEGATO 1 SORVEGLIANZA ATTIVA DEGLI EVENTI AVVERSI DOPO VACCINAZIONE ANTI-HPV SCHEDA CLINICA INDIVIDUALE Cognome Nome Regione Comune ASL Codice fiscale Data di Nascita DATI ANAGRAFICI ED INFORMAZIONI
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
PROTOCOLLO DELLO STUDIO
 PROTOCOLLO DELLO STUDIO TITOLO DELLO STUDIO TRATTAMENTO CON IMMUNOGLOBULINE NELLA SINDROME POST-POLIO DISEGNO DELLO STUDIO Studio clinico randomizzato, in doppio cieco, a due bracci (trattamento vs placebo)
PROTOCOLLO DELLO STUDIO TITOLO DELLO STUDIO TRATTAMENTO CON IMMUNOGLOBULINE NELLA SINDROME POST-POLIO DISEGNO DELLO STUDIO Studio clinico randomizzato, in doppio cieco, a due bracci (trattamento vs placebo)
Casi di tubercolosi familiare prevenzione nelle scuole
 Casi di tubercolosi familiare prevenzione nelle scuole Ponte di Piave 17 dicembre 2012 Cosa è successo Il 6 dicembre è stato segnalato un sospetto caso di TB in una donna i controlli successivi hanno identificato
Casi di tubercolosi familiare prevenzione nelle scuole Ponte di Piave 17 dicembre 2012 Cosa è successo Il 6 dicembre è stato segnalato un sospetto caso di TB in una donna i controlli successivi hanno identificato
ALLEGATOA alla Dgr n del 03 novembre 2014 pag. 1/5
 giunta regionale 9^ legislatura ALLEGATOA alla Dgr n. 2056 del 03 novembre 2014 pag. 1/5 PRESCRIZIONE DI PRODOTTI IMMUNOTERAPICI PROVVISTI DI AIC INDICATI NEL TRATTAMENTO DELLA RINITE ALLERGICA NELLA REGIONE
giunta regionale 9^ legislatura ALLEGATOA alla Dgr n. 2056 del 03 novembre 2014 pag. 1/5 PRESCRIZIONE DI PRODOTTI IMMUNOTERAPICI PROVVISTI DI AIC INDICATI NEL TRATTAMENTO DELLA RINITE ALLERGICA NELLA REGIONE
Allegato III. Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo
 Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
DR.ANTONELLO ARRIGHI Specialista in Pediatria
 NUOVE SOLUZIONI TERAPEUTICHE NELLA PREVENZIONE DELLA SINDROME INFLUENZALE IN ETÀ PEDIATRICA DR.ANTONELLO ARRIGHI Specialista in Pediatria Docente A.I.O.T. Associazione Medica Italiana di Omotossicologia
NUOVE SOLUZIONI TERAPEUTICHE NELLA PREVENZIONE DELLA SINDROME INFLUENZALE IN ETÀ PEDIATRICA DR.ANTONELLO ARRIGHI Specialista in Pediatria Docente A.I.O.T. Associazione Medica Italiana di Omotossicologia
L USO RAZIONALE DEGLI
 ADHD: per una condivisione dei percorsi diagnostico-terapeutici Milano, 29 maggio 2013 L USO RAZIONALE DEGLI PSICOFARMACI SESSIONE: TERAPIA Azienda Ospedaliera SPEDALI CIVILI BRESCIA Antonio Clavenna IRCCS,
ADHD: per una condivisione dei percorsi diagnostico-terapeutici Milano, 29 maggio 2013 L USO RAZIONALE DEGLI PSICOFARMACI SESSIONE: TERAPIA Azienda Ospedaliera SPEDALI CIVILI BRESCIA Antonio Clavenna IRCCS,
RIVISTA: lnt Journal of lmpotence Research (2006) 18, MJ. Dresser, D. Desai, S. Gidwani, AD. Seftel, NB. Modi O B I E T T I V I
 I D E N T I F I C A T I V O A R T I C O L O TITOLO: Dapoxetine, a novel treatment for premature ejaculation, does not have pharmacokinetic interactions with phosphodiesterase-5 inhibitors Dapoxetina, nuovo
I D E N T I F I C A T I V O A R T I C O L O TITOLO: Dapoxetine, a novel treatment for premature ejaculation, does not have pharmacokinetic interactions with phosphodiesterase-5 inhibitors Dapoxetina, nuovo
Le Linee Guida ALS ERC del 2015 non contengono sostanziali cambiamenti rispetto alle precedenti linee guida ERC pubblicate nel 2010
 I Farmaci Tommaso Pellis Anestesia, Terapia Intensiva e C.O. 118 AAS 5 Friuli Occidentale Ospedale Santa Maria degli Angeli Pordenone Direttore: F. Bassi thomas.pellis@gmail.com COI: Nessuno Le Linee Guida
I Farmaci Tommaso Pellis Anestesia, Terapia Intensiva e C.O. 118 AAS 5 Friuli Occidentale Ospedale Santa Maria degli Angeli Pordenone Direttore: F. Bassi thomas.pellis@gmail.com COI: Nessuno Le Linee Guida
La vaccinazione per l influenza stagionale
 La vaccinazione per l influenza stagionale Sigismondo Ferrante 1 12 settembre 2009 2 Roma, 23 luglio2009 1 Obiettivi della campagna vaccinale stagionale contro l influenza riduzione del rischio individuale
La vaccinazione per l influenza stagionale Sigismondo Ferrante 1 12 settembre 2009 2 Roma, 23 luglio2009 1 Obiettivi della campagna vaccinale stagionale contro l influenza riduzione del rischio individuale
La vaccinazione HPV in Friuli Venezia Giulia
 La vaccinazione HPV in Friuli Venezia Giulia T. Gallo Azienda Sanitaria Universitaria Integrata Udine Trieste, 12 giugno 2017 Strategia vaccinale contro l HPV in Italia Intesa Stato-Regioni 20/12/2007:
La vaccinazione HPV in Friuli Venezia Giulia T. Gallo Azienda Sanitaria Universitaria Integrata Udine Trieste, 12 giugno 2017 Strategia vaccinale contro l HPV in Italia Intesa Stato-Regioni 20/12/2007:
PSORIASI E PSORIASI ARTROPATICA: MALATTIE AUTOIMMUNITARIE? La psoriasi è un disordine cutaneo ad andamento cronico caratterizzato da lesioni
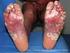 PSORIASI E PSORIASI ARTROPATICA: MALATTIE AUTOIMMUNITARIE? La psoriasi è un disordine cutaneo ad andamento cronico caratterizzato da lesioni eritemato-squamose localizzate prevalentemente sui gomiti, le
PSORIASI E PSORIASI ARTROPATICA: MALATTIE AUTOIMMUNITARIE? La psoriasi è un disordine cutaneo ad andamento cronico caratterizzato da lesioni eritemato-squamose localizzate prevalentemente sui gomiti, le
Studi clinici in corso nella Policitemia Vera
 Sesta Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche 9 aprile 2016 Studi clinici in corso nella Policitemia Vera Emanuela Sant Antonio CRIMM, Centro di Ricerca e Innovazione
Sesta Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche 9 aprile 2016 Studi clinici in corso nella Policitemia Vera Emanuela Sant Antonio CRIMM, Centro di Ricerca e Innovazione
AZIENDA OSPEDALIERA S. CROCE E CARLE - CUNEO. Il protocollo vaccinale per la malattia invasiva da Streptococcus pneumoniae
 AZIENDA OSPEDALIERA S. CROCE E CARLE - CUNEO Il protocollo vaccinale per la malattia invasiva da Streptococcus pneumoniae A cura del C.I.O. (C. Bonada, P.Pellegrino, G. Raineri) giugno 2015 Condizioni
AZIENDA OSPEDALIERA S. CROCE E CARLE - CUNEO Il protocollo vaccinale per la malattia invasiva da Streptococcus pneumoniae A cura del C.I.O. (C. Bonada, P.Pellegrino, G. Raineri) giugno 2015 Condizioni
Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 2330/2008) Documento relativo a: LIRAGLUTIDE
 Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 2330/2008) Documento relativo a: LIRAGLUTIDE Settembre 2010 1 Indicazioni registrate Liraglutide La liraglutide è indicata per il trattamento di
Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 2330/2008) Documento relativo a: LIRAGLUTIDE Settembre 2010 1 Indicazioni registrate Liraglutide La liraglutide è indicata per il trattamento di
ETANERCEPT (ALLARGAMENTI INDICAZIONI) (25-01-2005)
 ETANERCEPT (ALLARGAMENTI INDICAZIONI) (25-01-2005) Specialità: Enbrel (Wieth Lederle) Forma farmaceutica: sc 4 fl 25 mg + 4 sir Prezzo: euro 805.08 sc 4 fl 50 mg + 4 sir Prezzo: euro 1610.15 Prezzi da
ETANERCEPT (ALLARGAMENTI INDICAZIONI) (25-01-2005) Specialità: Enbrel (Wieth Lederle) Forma farmaceutica: sc 4 fl 25 mg + 4 sir Prezzo: euro 805.08 sc 4 fl 50 mg + 4 sir Prezzo: euro 1610.15 Prezzi da
TUTORATO 2 Test di significatività e intervalli di confidenza
 TUTORATO 2 Test di significatività e intervalli di confidenza 1) Nel corso della sperimentazione del farmaco si rilevò la frequenza cardiaca in 9 pazienti, prima e dopo il trattamento, riscontrando i valori
TUTORATO 2 Test di significatività e intervalli di confidenza 1) Nel corso della sperimentazione del farmaco si rilevò la frequenza cardiaca in 9 pazienti, prima e dopo il trattamento, riscontrando i valori
IN THE LA SOLUZIONE RAPIDA PER I SINTOMI DELL HERPES GENITALE
 HERPES IN THE CITY? NOVITÀ LA SOLUZIONE RAPIDA PER I SINTOMI DELL HERPES GENITALE Riduce sin dai primi giorni di applicazione i sintomi dolorosi dell Herpes Riduce gli altri sintomi soggettivi dell Herpes
HERPES IN THE CITY? NOVITÀ LA SOLUZIONE RAPIDA PER I SINTOMI DELL HERPES GENITALE Riduce sin dai primi giorni di applicazione i sintomi dolorosi dell Herpes Riduce gli altri sintomi soggettivi dell Herpes
PROGETTO MONDIALE ARIA
 PROGETTO MONDIALE ARIA Linee-Guida Italiane Firenze, Marzo 2015 GARD Participant 2011 76 Putative mechanism of allergen immunotherapy Casale TB & Stokes JR JACI 2011 Il meccanismo di azione è complesso,
PROGETTO MONDIALE ARIA Linee-Guida Italiane Firenze, Marzo 2015 GARD Participant 2011 76 Putative mechanism of allergen immunotherapy Casale TB & Stokes JR JACI 2011 Il meccanismo di azione è complesso,
Leucocitoaferesi e IBD: la Clinica. Maria di Girolamo, Alessandro Sartini, Erica Villa Azienda Ospedaliero-Universitaria di Modena
 Leucocitoaferesi e IBD: la Clinica Maria di Girolamo, Alessandro Sartini, Erica Villa Azienda Ospedaliero-Universitaria di Modena Le malattie infiammatorie croniche intestinali (MICI) sono un gruppo eterogeneo
Leucocitoaferesi e IBD: la Clinica Maria di Girolamo, Alessandro Sartini, Erica Villa Azienda Ospedaliero-Universitaria di Modena Le malattie infiammatorie croniche intestinali (MICI) sono un gruppo eterogeneo
Colchicina nella prevenzione degli eventi cardiovascolari
 Revisione Cochrane 2016 Colchicina nella prevenzione degli eventi cardiovascolari Hemkens LG, Ewald H, Gloy VL, et al. Colchicine for prevention of cardiovascular events. Cochrane Database Syst Rev 2016;1:CD011047.
Revisione Cochrane 2016 Colchicina nella prevenzione degli eventi cardiovascolari Hemkens LG, Ewald H, Gloy VL, et al. Colchicine for prevention of cardiovascular events. Cochrane Database Syst Rev 2016;1:CD011047.
ERLOTINIB ( )
 ERLOTINIB (17-10-2006) Specialità: Tarceva (Roche) Forma Farmaceutica: 30 cpr Dosaggio: 100mg Prezzo: 2.596,41 30 cpr Dosaggio: 150mg Prezzo: 3.239,24 Prezzo al pubblico da banca dati Farmadati Marzo 2007
ERLOTINIB (17-10-2006) Specialità: Tarceva (Roche) Forma Farmaceutica: 30 cpr Dosaggio: 100mg Prezzo: 2.596,41 30 cpr Dosaggio: 150mg Prezzo: 3.239,24 Prezzo al pubblico da banca dati Farmadati Marzo 2007
Allegato III. Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
29/03/2015. FtR LAZZERI MARTA. 7.5 milioni gli italiani con malattie respiratorie croniche come asma o BPCO
 FtR LAZZERI MARTA 7.5 milioni gli italiani con malattie respiratorie croniche come asma o BPCO 1 OSTRUZIONE POLMONARE Cos è l asma Malattia infiammatoria cronica caratterizzata da attacchi acuti ( mancanza
FtR LAZZERI MARTA 7.5 milioni gli italiani con malattie respiratorie croniche come asma o BPCO 1 OSTRUZIONE POLMONARE Cos è l asma Malattia infiammatoria cronica caratterizzata da attacchi acuti ( mancanza
PROTOCOLLO SPERIMENTALE DI IMPIEGO CLINICO MN3
 PROTOCOLLO SPERIMENTALE DI IMPIEGO CLINICO MN3 DIAGNOSTICA CON ANALOGHI DELLA SOMATOSTATINA MARCATI CON 68 Ga DI TUMORI CON PROBABILE ESPRESSIONE DI RECETTORI SSTR2 e/o 5, DA INDIRIZZARE AL TRATTAMENTO
PROTOCOLLO SPERIMENTALE DI IMPIEGO CLINICO MN3 DIAGNOSTICA CON ANALOGHI DELLA SOMATOSTATINA MARCATI CON 68 Ga DI TUMORI CON PROBABILE ESPRESSIONE DI RECETTORI SSTR2 e/o 5, DA INDIRIZZARE AL TRATTAMENTO
RICERCA E SVILUPPO DI NUOVI FARMACI
 RICERCA E SVILUPPO DI NUOVI FARMACI In passato le scoperte dei farmaci erano occasionali. Si trattava di sostanze di derivazione vegetale o animale STRATEGIE DI RICERCA: Quali sono i fattori che influenzano
RICERCA E SVILUPPO DI NUOVI FARMACI In passato le scoperte dei farmaci erano occasionali. Si trattava di sostanze di derivazione vegetale o animale STRATEGIE DI RICERCA: Quali sono i fattori che influenzano
Milano, 13 gennaio 2017
 Milano, 13 gennaio 2017 L esperienza della ASST di Brescia U.O. Farmacia Spedali Civili di Brescia Daria Bettoni Responsabile del Settore Farmaci e Farmacovigilanza Progetto Spedali Civili, criticità e
Milano, 13 gennaio 2017 L esperienza della ASST di Brescia U.O. Farmacia Spedali Civili di Brescia Daria Bettoni Responsabile del Settore Farmaci e Farmacovigilanza Progetto Spedali Civili, criticità e
O.R.I.A. OSSERVATORIO RICERCA E INNOVAZIONE AZIENDALE. Reggio Emilia 4 giugno 2008
 O.R.I.A. OSSERVATORIO RICERCA E INNOVAZIONE AZIENDALE Reggio Emilia 4 giugno 2008 Protocollo I.R.M.A. Innovazione in Radioterapia Mammaria CARCINOMA DELLA MAMMELLA A BASSO RISCHIO DI RECIDIVA LOCALE: IRRADIAZIONE
O.R.I.A. OSSERVATORIO RICERCA E INNOVAZIONE AZIENDALE Reggio Emilia 4 giugno 2008 Protocollo I.R.M.A. Innovazione in Radioterapia Mammaria CARCINOMA DELLA MAMMELLA A BASSO RISCHIO DI RECIDIVA LOCALE: IRRADIAZIONE
IMMUNITA RIMOZIONE DELL AGENTE INFETTIVO. Riconoscimento da parte di effettori preformati non
 IMMUNITA INFEZIONE Immunità innata specifici RIMOZIONE DELL AGENTE INFETTIVO Riconoscimento da parte di effettori preformati non (risposta immediata 0-4 ore) Risposta indotta precoce Riconoscimento, Reclutamento
IMMUNITA INFEZIONE Immunità innata specifici RIMOZIONE DELL AGENTE INFETTIVO Riconoscimento da parte di effettori preformati non (risposta immediata 0-4 ore) Risposta indotta precoce Riconoscimento, Reclutamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Novembre 2015 TECFIDERA (DIMETILFUMARATO): NUOVE MISURE PER MINIMIZZARE IL RISCHIO DI
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Novembre 2015 TECFIDERA (DIMETILFUMARATO): NUOVE MISURE PER MINIMIZZARE IL RISCHIO DI
secukinumab: un nuovo paradigma di efficacia per il trattamento della psoriasi Dr.ssa Gabriella Castellino Medical Adviser, Novartis Farma Premio
 secukinumab: un nuovo paradigma di efficacia per il trattamento della psoriasi Dr.ssa Gabriella Castellino Medical Adviser, Novartis Farma Premio Galeno, Milano, 25 Novembre 215 Perché una nuova molecola?
secukinumab: un nuovo paradigma di efficacia per il trattamento della psoriasi Dr.ssa Gabriella Castellino Medical Adviser, Novartis Farma Premio Galeno, Milano, 25 Novembre 215 Perché una nuova molecola?
Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali. Meccanismo di azione e interazioni farmacologiche
 A06 Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali Meccanismo di azione e interazioni farmacologiche Copyright MMXV Aracne editrice int.le S.r.l. www.aracneeditrice.it info@aracneeditrice.it
A06 Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali Meccanismo di azione e interazioni farmacologiche Copyright MMXV Aracne editrice int.le S.r.l. www.aracneeditrice.it info@aracneeditrice.it
Allegato II. Conclusioni scientifiche e motivi della variazione dei termini dell autorizzazione all immissione in commercio
 Allegato II Conclusioni scientifiche e motivi della variazione dei termini dell autorizzazione all immissione in commercio 21 Conclusioni scientifiche Sintesi generale della valutazione scientifica di
Allegato II Conclusioni scientifiche e motivi della variazione dei termini dell autorizzazione all immissione in commercio 21 Conclusioni scientifiche Sintesi generale della valutazione scientifica di
RENDERE PIÙ SEMPLICE LA SCELTA DELLA TERAPIA ANTICOAGULANTE: NAO KNOW HOW. Dott. Domenico Pecora Brescia
 RENDERE PIÙ SEMPLICE LA SCELTA DELLA TERAPIA ANTICOAGULANTE: NAO KNOW HOW Dott. Domenico Pecora Brescia Scelta del NAO Scheda tecnica Piani terapeutici AIFA Linee guida Position paper Rimborsabilità NAO
RENDERE PIÙ SEMPLICE LA SCELTA DELLA TERAPIA ANTICOAGULANTE: NAO KNOW HOW Dott. Domenico Pecora Brescia Scelta del NAO Scheda tecnica Piani terapeutici AIFA Linee guida Position paper Rimborsabilità NAO
SCHEDA DI SEGNALAZIONE DI CASO PER ESPOSIZIONE IN OPERATORE SANITARIO
 Le schede per la segnalazione di caso di profilassi post.-esposizione (PPE) ad HIV sono due; una per le esposizioni occupazionali in operatore sanitario, l altra per le esposizioni occupazionali in non
Le schede per la segnalazione di caso di profilassi post.-esposizione (PPE) ad HIV sono due; una per le esposizioni occupazionali in operatore sanitario, l altra per le esposizioni occupazionali in non
SCHEDA DI VALUTAZIONE PER L INSERIMENTO DI FARMACI NON PRESENTI NEL PTR
 RICHIESTA DI INSERIMENTO IN PTR DI SORAFENIB L01XE05 (Nexavar ) Presentata da Commissione Terapeutica Provinciale di Sassari In data gennaio 2009 Per le seguenti motivazioni: Sorafenib modifica lo standard
RICHIESTA DI INSERIMENTO IN PTR DI SORAFENIB L01XE05 (Nexavar ) Presentata da Commissione Terapeutica Provinciale di Sassari In data gennaio 2009 Per le seguenti motivazioni: Sorafenib modifica lo standard
SCHEDA DI PRESCRIZIONE DELLA TERAPIA
 ALLEGATO A-1 SCHEDA DI PRESCRIZIONE DELLA TERAPIA PRESCRIZIONE FARMACI BIOLOGICI REGIONE CALABRIA Artrite Reumatoide, Artrite Psoriasica, Spondiloartriti Cognome: Nome:. Codice Fiscale Sesso: M F Luogo
ALLEGATO A-1 SCHEDA DI PRESCRIZIONE DELLA TERAPIA PRESCRIZIONE FARMACI BIOLOGICI REGIONE CALABRIA Artrite Reumatoide, Artrite Psoriasica, Spondiloartriti Cognome: Nome:. Codice Fiscale Sesso: M F Luogo
SCHEDA DI VALUTAZIONE PER L INSERIMENTO DI FARMACI NON PRESENTI NEL PTR
 RICHIESTA DI INSERIMENTO IN PTR DI SILDENAFIL G04BE03 (REVATIO ) Presentata da Commissione Terapeutica Provinciale Sassari In data novembre 2008 Per le seguenti motivazioni (sintesi) Trattamento di pazienti
RICHIESTA DI INSERIMENTO IN PTR DI SILDENAFIL G04BE03 (REVATIO ) Presentata da Commissione Terapeutica Provinciale Sassari In data novembre 2008 Per le seguenti motivazioni (sintesi) Trattamento di pazienti
epidemiologia del melanoma
 epidemiologia del melanoma Il Melanoma metastatico: tra efficacia delle terapie e governance Palace Hotel Como 17 dicembre 2013 UO Registro Tumori e Screening dr.ssa Gemma Gola Prevenzione Primaria Prima
epidemiologia del melanoma Il Melanoma metastatico: tra efficacia delle terapie e governance Palace Hotel Como 17 dicembre 2013 UO Registro Tumori e Screening dr.ssa Gemma Gola Prevenzione Primaria Prima
IL NODO (tumorale) AL SENO: QUANDO LA TERAPIA FARMACOLOGICA?
 IL NODO (tumorale) AL SENO: QUANDO LA TERAPIA FARMACOLOGICA? Dr. Giorgio Bonciarelli Oncologia Medica Azienda ULSS17 Monselice, 8 Marzo 2014 ALCUNI NUMERI IN EUROPA In ITALIA, nel 2013, sono stati stimati
IL NODO (tumorale) AL SENO: QUANDO LA TERAPIA FARMACOLOGICA? Dr. Giorgio Bonciarelli Oncologia Medica Azienda ULSS17 Monselice, 8 Marzo 2014 ALCUNI NUMERI IN EUROPA In ITALIA, nel 2013, sono stati stimati
Azione integrata nella terapia della psoriasi. WELLPHARMAsrl
 Azione integrata nella terapia della psoriasi WELLPHARMAsrl Il processo infiammatorio nel paziente con psoriasi Nelle lesioni cutanee dei pazienti affetti da psoriasi sono presenti elevati livelli di acido
Azione integrata nella terapia della psoriasi WELLPHARMAsrl Il processo infiammatorio nel paziente con psoriasi Nelle lesioni cutanee dei pazienti affetti da psoriasi sono presenti elevati livelli di acido
INDICAZIONI CLINICHE ALL USO DI ULIPRISTAL ACETATO
 Terapie ormonali: Novità e prospettive INDICAZIONI CLINICHE ALL USO DI ULIPRISTAL ACETATO FEDERICA ROSATI U.O. OSTERICIA E GINECOLOGIA RIMINI Dir. G. Battagliarin UPA INDICAZIONE TERAPEUTICA INDICAZIONE
Terapie ormonali: Novità e prospettive INDICAZIONI CLINICHE ALL USO DI ULIPRISTAL ACETATO FEDERICA ROSATI U.O. OSTERICIA E GINECOLOGIA RIMINI Dir. G. Battagliarin UPA INDICAZIONE TERAPEUTICA INDICAZIONE
Una Medicina su Misura
 2 aprile 2011 Una Medicina su Misura Ogni paziente ha la sua Malattia Dott.ssa Sara Mazzoldi Una Medicina su Misura per In questa parte prenderemo in esame 3 tipi di pazienti: paziente con diabete mellito
2 aprile 2011 Una Medicina su Misura Ogni paziente ha la sua Malattia Dott.ssa Sara Mazzoldi Una Medicina su Misura per In questa parte prenderemo in esame 3 tipi di pazienti: paziente con diabete mellito
La BPCO e le comorbilità. Federico Sciarra
 La BPCO e le comorbilità Federico Sciarra La BPCO, essendo una malattia cronica con caratteristiche di infiammazione sistemica, facilmente coesiste con altre patologie sia acute che croniche, che influenzano
La BPCO e le comorbilità Federico Sciarra La BPCO, essendo una malattia cronica con caratteristiche di infiammazione sistemica, facilmente coesiste con altre patologie sia acute che croniche, che influenzano
FARMACOTERAPIA DELL ASMA
 FARMACOTERAPIA DELL ASMA 1-3% delle visite ambulatoriali 500000 ricoveri ospedalieri Più ricoveri pediatrici di qualsiasi altra malattia singola Più di 500000 morti annuali Delfino, Univ. Perugia TRATTAMENTO
FARMACOTERAPIA DELL ASMA 1-3% delle visite ambulatoriali 500000 ricoveri ospedalieri Più ricoveri pediatrici di qualsiasi altra malattia singola Più di 500000 morti annuali Delfino, Univ. Perugia TRATTAMENTO
PATOLOGIE DELLA PELLE:
 AIMAV Associazione Italiana di Medicina dell Assicurazione Vita, Malattia e Danni alla Persona Milano 4 ottobre 2016 GIORNATA DI FORMAZIONE SULL ASSUNZIONE DEL RISCHIO E LA GESTIONE DEI SINISTRI PATOLOGIE
AIMAV Associazione Italiana di Medicina dell Assicurazione Vita, Malattia e Danni alla Persona Milano 4 ottobre 2016 GIORNATA DI FORMAZIONE SULL ASSUNZIONE DEL RISCHIO E LA GESTIONE DEI SINISTRI PATOLOGIE
GAZZETTA UFFICIALE DELLA REPUBBLICA ITALIANA Serie generale n. 115
 AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Maggio 2007 Modifica degli stampati dei medicinali contenenti farmaci antinfiammatori non steroidei (FANS) non selettivi per uso sistemico - ATC M01A. omissis
AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Maggio 2007 Modifica degli stampati dei medicinali contenenti farmaci antinfiammatori non steroidei (FANS) non selettivi per uso sistemico - ATC M01A. omissis
AULA ROSSA STUDI CLINICI IN CORSO
 Terza Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche AULA ROSSA STUDI CLINICI IN CORSO Che cosa è uno studio clinico e a cosa serve? Si definisce sperimentazione clinica,
Terza Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche AULA ROSSA STUDI CLINICI IN CORSO Che cosa è uno studio clinico e a cosa serve? Si definisce sperimentazione clinica,
SCHEDA DI VALUTAZIONE PER L INSERIMENTO DI FARMACI NON PRESENTI NEL PTR
 RICHIESTA DI INSERIMENTO IN PTR DI METILAMINOLEVULINATO L01XD (Metvix ) Presentata da Commissione Terapeutica Provinciale di Cagliari In data novembre 2008 Per le seguenti motivazioni: Terapia delle neoplasie
RICHIESTA DI INSERIMENTO IN PTR DI METILAMINOLEVULINATO L01XD (Metvix ) Presentata da Commissione Terapeutica Provinciale di Cagliari In data novembre 2008 Per le seguenti motivazioni: Terapia delle neoplasie
Dr. Vincenzo Provenzano
 Dr. Vincenzo Provenzano OBIETTIVO DELLO STUDIO 5 GRUPPI : MATERIALI E METODI * 1) utenti con eta inferiore a 5 ANNI (34) * 2) utenti con eta tra 5 ed inferiore a 12 ANNI (75) * 3) utenti con eta tra 12-18
Dr. Vincenzo Provenzano OBIETTIVO DELLO STUDIO 5 GRUPPI : MATERIALI E METODI * 1) utenti con eta inferiore a 5 ANNI (34) * 2) utenti con eta tra 5 ed inferiore a 12 ANNI (75) * 3) utenti con eta tra 12-18
La MESALAZINA è, ad oggi, una delle molecole raccomandate nell induzione e nel mantenimento della remissione nella Rettocolite Ulcerosa in fase di
 La MESALAZINA è, ad oggi, una delle molecole raccomandate nell induzione e nel mantenimento della remissione nella Rettocolite Ulcerosa in fase di attività lieve e moderata. Il farmaco, somministrato per
La MESALAZINA è, ad oggi, una delle molecole raccomandate nell induzione e nel mantenimento della remissione nella Rettocolite Ulcerosa in fase di attività lieve e moderata. Il farmaco, somministrato per
Il Registro Nazionale per il Metilfenidato
 Il Registro Nazionale per il Metilfenidato Uno strumento di sanità pubblica Dante Besana Direttore di Struttura Complessa di Neuropsichiatria Infantile Milano 13 maggio 2005 Premesse giugno 2002 - CD SINPIA:
Il Registro Nazionale per il Metilfenidato Uno strumento di sanità pubblica Dante Besana Direttore di Struttura Complessa di Neuropsichiatria Infantile Milano 13 maggio 2005 Premesse giugno 2002 - CD SINPIA:
GOLIMUMAB (Indicazione: Spondilite Anchilosante) ( )
 GOLIMUMAB (Indicazione: Spondilite Anchilosante) (05-04-2011) Specialità: Simponi (Centocor) Forma farmaceutica: 1 PEN 50mg, 0,5ml - Prezzo: euro 1723.33 1 SIR 50mg, 0,5ml - Prezzo: euro 1723.33 ATC: L04AB06
GOLIMUMAB (Indicazione: Spondilite Anchilosante) (05-04-2011) Specialità: Simponi (Centocor) Forma farmaceutica: 1 PEN 50mg, 0,5ml - Prezzo: euro 1723.33 1 SIR 50mg, 0,5ml - Prezzo: euro 1723.33 ATC: L04AB06
ALLEGATOB1 alla Dgr n del 01 luglio 2014 pag. 1/5
 giunta regionale 9^ legislatura ALLEGATOB1 alla Dgr n. 1098 del 01 luglio 2014 pag. 1/5 SCHEDA RACCOLTA DATI EMICRANIA CRONICA REFRATTARIA PARTE I- SELEZIONE DEI PAZIENTI CANDIDATI A NEUROSTIMOLAZIONE
giunta regionale 9^ legislatura ALLEGATOB1 alla Dgr n. 1098 del 01 luglio 2014 pag. 1/5 SCHEDA RACCOLTA DATI EMICRANIA CRONICA REFRATTARIA PARTE I- SELEZIONE DEI PAZIENTI CANDIDATI A NEUROSTIMOLAZIONE
Gli Antagonisti degli oppiodi. Dr. S. Di Santo
 Gli Antagonisti degli oppiodi Dr. S. Di Santo Definizione - Un farmaco è detto antagonista quando, legandosi ad un recettore non lo attiva ma lo "blocca". - L'antagonista tende ad impedire all agonista
Gli Antagonisti degli oppiodi Dr. S. Di Santo Definizione - Un farmaco è detto antagonista quando, legandosi ad un recettore non lo attiva ma lo "blocca". - L'antagonista tende ad impedire all agonista
INFORMATI VACCINATI PROTETTI VACCINO VARICELLA
 VARICELLA SEI SICURO DI USARE MISURE DI PREVENZIONE ADEGUATE PER PROTEGGERTI DALLA VARICELLA? INFORMATI VACCINATI PROTETTI VACCINO VARICELLA RICORDA CHE: La varicella contratta in età adulta può comportare
VARICELLA SEI SICURO DI USARE MISURE DI PREVENZIONE ADEGUATE PER PROTEGGERTI DALLA VARICELLA? INFORMATI VACCINATI PROTETTI VACCINO VARICELLA RICORDA CHE: La varicella contratta in età adulta può comportare
