PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE
|
|
|
- Leone Rossetti
- 6 anni fa
- Visualizzazioni
Transcript
1 Università di Roma Tor Vergata - Scienze della Nutrizione Umana Biochimica della nutrizione - Prof.ssa Luciana Avigliano A.A PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE
2 componente essenziale per la vita amminoacidi proteine nucleotidi acidi nucleici AZOTO In natura - N 2 atmosferico (N.B. N N triplo legame, alta energia per metabolizzarlo) - ione nitrato NO 3 presente nel suolo Nei sistemi biologici sono presenti le forme ridotte - ione ammonio NH gruppo amminico -NH 2 e gruppo ammidico -NH-C=O presenti in composti organici Gli animali non sono in grado di fissare l N 2 (come alcuni batteri anaerobi, simbionti nelle radici delle leguminose con produzione di NH 4+ ) o di utilizzare NO 3 (come alcuni batteri e molte piante con produzione di NH 4 + e composti organici azotati) perciò gli animali dipendono da microorganismi e piante
3 Fonte primaria di azoto: amminoacidi forniti dalle proteine alimentari
4 Funzioni degli L-α-amminoacidi Substrati per la sintesi proteica 20 a.a - con codone - riconoscimento via trna 21 a.a. selenocisteina - seril-trna --> Se-cisteinil trna più numerosi in seguito a modificazione post-sintetica idrossiprolina N-metil istidina acido γcarbossiglutammico Componenti di peptidi Intermedi metabolici Fonte energetica glutatione (GSH) γglu-cys-gly ornitina a.a. glucogenici, a.a. chetogenici Regolatori del turnover proteico leucina, glutammina Trasporto di azoto glutammina, alanina
5 Precursori per la biosintesi degli altri composti contenti azoto COMPOSTI DERIVATI AMMINOACIDI PRECURSORI Eme Nucleotidi Carnitina Creatina glicina (+ succinil CoA) glutammina, glicina, acido aspartico lisina, metionina arginina, glicina, metionina Ammine biogene (ormoni, neurotrasmettitori, ammine di interesse farmacologico istidina, triptofano, tirosina, glutammato Tiroxina, adrenalina Taurina (sali biliari, neuromodulatore) Glucosammina (amminozuccheri) tirosina cisteina glutammina Ossido nitrico (NO) (vasodilatatore, inibisce aggregazione piastrinica) arginina Niacina triptofano (1mg vit equivale a 60 mg a.a.)
6 Classificazione in base alla struttura
7 CLASSIFICAZIONE NUTRIZIONALE AMMINOACIDI ESSENZIALI : devono necessariamente essere introdotti preformati con la dieta valina* leucina* isoleucina* * possono essere ottenuti per transaminazione metionina* dai rispettivi α-chetoacidi fenilalanina* triptofano* istidina lisina gli altri tre vanno introdotti come tali treonina AMMINOACIDI NON ESSENZIALI semi-indispensabili risparmiano i precursori essenziali tirosina (sintetizzata da fenilalanina) cisteina (sintetizzata da metionina)
8 condizionatamente essenziali glicina, serina, prolina, glutammina, arginina possono non essere sufficienti in alcuni stati particolari quali infezioni, traumi, bambini prematuri,.. non essenziali alanina, aspartato, asparagina, glutammato Le reazioni di transaminazione, reversibili, permettono di ridistribuire il gruppo NH 3 fra gli amminoacidi Vanno comunque integrati con la dieta e l apporto deve essere bilanciato in quanto: - Il pool di amminoacidi non è totalmente riutilizzabile - NH 3 principalmente prodotto di rifiuto, anche se vi è un riutilizzo limitato a riformare amminoacidi
9 α-amminoacido O II C O I H C NH 3 I R Flusso generale TRANSAMINAZIONE transaminasi piridossalfosfato α -chetoacido O II C O I H C = O I R + + α-chetoglutarato glutammato α-chetoglutarato DEAMINAZIONE OSSIDATIVA glutammato deidrogenasi NAD + glutammato C=O NH 2 NH 3 UREA NH 2
10 BIOSINTESI DEGLI AMMINOACIDI NON ESSENZIALI piruvato alanina ossalacetato aspartato (+ glutammina) asparagina α-chetoglutarato glutammato + (NH 3 ) glutammina glutammato prolina, arginina 3-fosfoglicerato serina glicina fenilalanina tirosina carenza Phe idrossilasi causa fenilchetonuria: porta a ritardo mentale 1: % popolazione portatori sani - screening di routine sui neonati - (si formano fenilpiruvato, fenillattato, fenilacetato 1-2 g/die nelle urine) Dieta povera in Phe e ricca in Tyr (aspartame Asp-Phe-metanolo) metionina cisteina La velocità di sintesi può non essere sufficiente malati, stress, neonati a basso peso, ustionati,
11 Ammoniaca può essere in parte riutilizzata α -chetoglutarato + NH + 4 glutammato glutammato + NH ATP glutammina + ADP + Pi NH CO 2 + folato glicina Urea può essere ritrasformata in ammoniaca dalla microflora intestinale: non è chiaro l eventuale contributo
12 con le urine perdita obbligatoria di azoto Urea g/die dipende quantità proteine alimentari NH 3 0,4-1,2 g/die dipende equilibrio acido-base Amminoacidi 0,3-1,2 g/die Acido urico 0,2-0,7 g/die dipende dalla dieta Creatinina 0,3-0,8 g/die dipende dalla massa muscolare (indice del turnover proteico del muscolo) secrezioni intestinali, turnover enterociti, desquamazione pelle, NH 3 deriva dal catabolismo degli amminoacidi basi puriniche (tramite deaminasi) basi pirimidiniche
13 Metabolismo della catena carboniosa degli amminoacidi Lo scheletro carbonioso fornisce energia attraverso l interazione con la via glicolitica ed il ciclo di Krebs In condizioni fisiologiche esiste una relazione tra il livello dei carboidrati nella dieta ed il metabolismo degli amminoacidi Aumenta quando l'apporto di energia è sufficiente ma viene fornito da proteine a scapito dei carboidrati e dei lipidi L efficienza (i.e. molecole di ATP prodotte) è inferiore rispetto alla degradazione degli altri due substrati (carboidrati e lipidi) in quanto: - non tutto lo scheletro carbonioso degli amminoacidi è soggetto ad ossidazione - la formazione di urea (il prodotto finale del catabolismo azotato) richiede il consumo di 3 molecole di ATP
14 - gli aa che sono degradati ad aceticoa o acetoacetil CoA sono chetogenici - gli a.a. che sono degradati ad intermedi del ciclo di Krebs sono glucogenici la suddivisione non è netta: alcuni a.a. sono chetogenici e glicogenici glicina, alanina, serina, cisteina, arginina, glutammina, istidina, prolina triptofano leucina isoleucina piruvato acetil-coa acetoacetil-coa isocitrato citrato ossalacetato glutammato propionil~co A a-chetoglutato biotina B12 succinil~coa succinato isoleucina valina metionina treonina leucina lisina malato fumarato fenilalanina tirosina asparagina, aspartato fenilalanina tirosina in giallo a.a glucosio in celeste a.a. corpi chetonici in rosa a.a. glucosio e corpi chetonici
15 Formazione di acidi non volatili dal catabolismo di a.a. solforati, metionina, cisteina SO 4 2- fosfoproteine fosfati fosfolipidi acidi grassi e glucosio acetoacetato, β-idrossibutirrato, lattato acidi nucleici basi puriniche urati nutrienti con anioni inorganici (superiori alla quantità di cationi inorganici) Richiede l escrezione di un catione NH 4 + (fornito dalla glutammina) per permettere all organismo di conservare cationi quali Na +, K +, Ca 2+, dieta ricca in proteine genera acidi non volatili
16 PROTEINE
17 Aminoacidi e proteine sono in rapporto dinamico proteine corporee sintesi degradazione Quota dei derivati non proteici minoritaria e non si calcola nel bilancio azotato; ma quota significativa in condizioni di privazione di proteine Proteine della dieta digestione Amminoacidi N C Derivati non proteici glucosio, glicogeno NH 3 urea intermedi del Ciclo di Krebs CO 2 + energia acidi grassi trigliceridi
18 bilancio di azoto o bilancio proteico: dipende dalla somma delle velocità di entrata ed uscita dal pool di amminoacidi liberi a b PROTEINE ALIMENTARI POOL AA d PROTEINE CORPOREE flusso in entrata = dieta + degradazione proteica (a + b) rimozione a.a. = sintesi proteica + ossidazione (c + d) a + b = c + d costante mantenimento nell adulto a + d > b + c bilancio positivo accrescimento; masse muscolari; gestazione b + c > a + d bilancio negativo insufficiente apporto energia e/o proteine; malattia c POOL DI DERIVATI
19 I sistemi enzimatici deputati al metabolismo di proteine ed amminoacidi sono regolati da meccanismi adattativi :
20 In media le proteine contengono il 16% di azoto E abbastanza facile misurare la quantità di azoto, per cui i cambiamenti nella quantità proteica corporea vengono misurati come differenza fra azoto introdotto ed azoto escreto azoto x 6,25 (cioè 100/16) = proteina
21 UOMO ADULTO : proteine corporee circa 12 Kg 40% nel muscolo di cui 65% miosina ed actina per locomozione e lavoro muscolare, ma anche come fonte di amminoacidi in condizioni di stress. Ma proteine muscolari non sono forma di riserva come glicogeno e lipidi ed una loro perdita porta a perdità di proteine funzionali. 10% tessuti viscerali (fegato, intestino) non mobilizzate rapidamente in condizioni di stress per le loro funzioni vitali 30% nelle pelle e nel sangue lesioni delle pelle ed anemia sono presenti in deficit di proteine alimentari 4 proteine: miosina, actina, collagene (strutturali), emoglobina (trasporto O 2 ) costituiscono circa la metà di tutte le proteine
22 CONTINUO RICAMBIO PROTEICO Serve energia sia per la sintesi che per la degradazione: % del bilancio energetico La continua demolizione e sintesi è fondamentale per degradare e rimpiazzare proteine danneggiate modificare la quantità relativa di differenti proteine in base alle necessità nutrizionali e fisiologiche rapido adattamento metabolico La regolazione del turnover proteico è influenzata da: stato nutrizionale (energetico e proteico) da alcuni ormoni (insulina, glucocorticoidi, ormoni tiroidei, ormone della crescita, citochine)
23 ORGANISMO Ricambio giornaliero 1-2% proteine totali Amminoacidi 70-80% riutilizzati 20-30% metabolizzati Proteine dalla dieta 70 grammi/giorno Proteine metabolizzate 250 grammi/giorno % ricambio muscolo 30-50% fegato 25% leucociti emoglobina diversa emivita pochi minuti: proteine regolatorie 300 giorni: collageno
24 SISTEMI DI PROTEOLISI ATP-indipendente LISOSOMIALE contribuisce per il 15% Enzimi: catepsine, attive a ph 5, non selettive -proteine extracellulari (via endocitosi) - proteine di membrana autofagia - indotta nel digiuno - proteine intracellulari a lunga vita o in carenza di a.a. -organelli danneggiati (es mitocondri) (per bassi livelli di insulina) ATP-dipendente CITOSOLICO- sistema ubiquitina proteasoma selettivo - proteine a vita breve - proteine regolatorie - proteine difettose (neo -sintetizzate per errori nella sintesi o per ripiegamento sbagliato; invecchiate) Ca-dipendente CITOSOLICO sistema calpaina (enzima)- calpastatina (inibitore) idrolisi parziale di miofibrille - via regolatoria più che digestiva coinvolto in processi cellulari quali proliferazione, motilità,.
25 Premio Nobel 2004 L ubiquitina come suggerisce il nome è una proteina presente in tutti gli eucarioti L ubiquitina si lega alla proteina da degradare in una via ATP dipendente che utilizza 3 enzimi E1 + ATP E1-Ubiquitina E2 proteina di trasporto dell ubiquitina E3 lega l ubiquitina attivata alla proteina da degradare Come si riconosce la proteina da eliminare? Varie ipotesi - sequenze PEST prolina (P)-glutammato (E)-serina (S)-treonina (T) - amminoacido N-terminale destabilizzane qual Met, Tyr, Trp, Leu Glu, Gli, Glu - proteina danneggiate per ossidazione (ROS, Fe+2)
26 La proteina marcata va al proteasoma Proteine regolatorie per il riconoscimento e selezione di protine ubiquitilinate grossa struttura polimerica Proteine degradate in modo progressivo dalle subunità catalitiche β subunità 7 α 7 β 7 β 7 α Attività tipo chimotripsina a.a. idrofobici Attività tipo tripsina a.a. basici Attività per a.a. acidi oligopeptidi di 3-25 a.a. scissi da protesi citosoliche
27 L attività del proteasoma è sotto controllo ormonale INSULINA inibisce il proteasoma GLUCOCORTICOIDI attivano il proteasoma azione coordinata per la mobilizzazione di amminoacidi muscolari e per la gluconeogenesi epatica ORMONI TIROIDEI attivano il proteasoma CITOCHINE attivano il proteasoma sepsi, febbre, ustioni, cancro, Aumento delle proteine della fase acuta ed aumento del catabolismo proteico delle miofibrille mediato da un aumento delle citochine TNF-α, IL-1, IL-6
28 Degradazione delle proteine via proteasoma Aumenta digiuno a breve termine diabete ipertiroidismo Iperfunzione ghiandole surrenali immobilizzazione (nel muscolo attivo aumenta la sintesi di proteine e cala la degradazione) malattie neuromuscolari trauma cancro infezioni Diminuisce assunzione di glucidi ed azione dell insulina digiuno prolungato
29 Adattamenti metabolici nelle condizioni di digiuno L adattamento dell organismo al digiuno costituisce uno degli esempi più tipici di adattamento metabolico. Gli adattamento metabolici al digiuno sono continui ma si possono schematicamente suddividere in diversi periodi in base al tipo di substrato energetico maggiormente usato Digiuno fisiologico notturno Digiuno prolungato Prima fase inizia ore dall ultimo pasto ed occupa le due giornate dall ultimo pasto Seconda fase dura circa 3 settimane Terza fase che si protrae fino ad esaurimento delle scorte lipidiche
30 Fonti di glucosio nelle varie fasi del digiuno
31 Digiuno breve programma adattativo per favorire il risparmio di glucosio a spese della degradazione di proteine (sotto controllo di insulina e glucagone) mobilizzazione di proteine muscolari che vanno a fegato; a.a. usati come fonte energia e gluconeogenesi (aumenta l escrezione di azoto urinario) il basso livello di insulina inibisce la captazione di glucosio dal muscolo (glucosio risparmiato per il cervello) fegato: calo della attvità della piruvato deidrogenasi (piruvato acetilcoa) per preservare i precursori della gluconeogenesi inizio ossidazione acidi grassi e formazione corpi chetonici
32 Digiuno prolungato Dopo giorni di digiuno si ha un programma adattativo per conservare proteine muscolari e cellulari ed a.a essenziali che altrimenti si esaurirebbero rapidamente. Effetti mediati da ulteriore calo di insulina ed aumento di glucacone; inoltre calo degli ormoni tiroidei con conseguente calo della degradazione proteica da parte di lisosomi e proteasoma uso dei corpi chetonici che riducono la gluconeogenesi, necessaria per tessuti obbligatoriamente glicolitici (globuli rossi, midollare del surrene) riduzione della sintesi proteica; inibizione del proteolisi cellulare e della ossidazione degli a.a; si riflette in un calo drastico dell N urinario riduzione del consumo di ossigeno e del metabolismo basale per calo di sintesi delle proteine mitocondriali coinvolte nella fosforilazione ossidativa Fase finale esauriti i grassi di riserva, ricomincia l utilizzo delle proteine muscolari e delle proteine corporee, sostenibile per breve tempo; poi sopraggiunge la morte
33 Iponutrizione prolungata in energia e proteine ha punti in comune con il digiuno, con ridotto turnover di proteine e diminuita ossidazione degli a.a. Diminiscono i livelli di albumina; il fegato utilizza gli a.a. per proteine più vitali Il livello ematico di albumina viene spesso usato come indicatore dello stato nutrizionale (anche se è influenzato da altri fattori) Depressionde del sistema immunitario Calo di immunoglobuline e linfociti (anch essi indicatori dello stato nutrizionale)
34 Perdita di proteine in cancro, infezioni, traumi, ustioni,.. A differenza del digiuno, dove diminuisce la richiesta energetica, queste condizioni sono ipermetaboliche e non vi è adattamento all uso dei corpi chetonici: Gli a.a. continuano ad essere usati come fonte energetica per dare glucosio RICERCA deve - capire come il metabolismo proteico è alterato in una particolare patologia - capire come funzionano i geni che regolano il differenziamento muscolare - sapere come intervenire a livello nutrizionale
PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE (a)
 Università di Roma Tor Vergata - Scienze della Nutrizione Umana Biochimica della Nutrizione Prof.ssa Luciana Avigliano 2011 PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE (a) amminoacidi proteine
Università di Roma Tor Vergata - Scienze della Nutrizione Umana Biochimica della Nutrizione Prof.ssa Luciana Avigliano 2011 PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE (a) amminoacidi proteine
PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE (b)
 Università di Roma Tor Vergata - Scienze della Nutrizione Umana Biochimica della Nutrizione Prof.ssa Luciana Avigliano 2011 PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE (b) PROTEINE Aminoacidi
Università di Roma Tor Vergata - Scienze della Nutrizione Umana Biochimica della Nutrizione Prof.ssa Luciana Avigliano 2011 PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE (b) PROTEINE Aminoacidi
La fissazione dell azoto
 La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
Svolgono funzioni biologiche di fondamentale importanza e possono essere divise in 7 gruppi principali:
 Svolgono funzioni biologiche di fondamentale importanza e possono essere divise in 7 gruppi principali: proteine strutturali (collagene, cheratine); proteine catalitiche (enzimi); proteine di trasporto
Svolgono funzioni biologiche di fondamentale importanza e possono essere divise in 7 gruppi principali: proteine strutturali (collagene, cheratine); proteine catalitiche (enzimi); proteine di trasporto
Metabolismo. Metabolismo. Il complesso di tutte le reazioni organiche di trasformazioni tra energia e materia viene definito come metabolismo.
 Metabolismo Dr. Augusto Innocenti, PhD Biologo Nutrizionista Prof. a contratto Università di Parma Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Metabolismo
Metabolismo Dr. Augusto Innocenti, PhD Biologo Nutrizionista Prof. a contratto Università di Parma Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Metabolismo
Biochimica e Biologia per le professioni sanitarie, McGraw-Hill
 Biochimica e Biologia per le professioni sanitarie, McGrawHill Tab. 20.1 Amminoacidi essenziali per l uomo Arginina Istidina Isoleucina Leucina Lisina Metionina Fenilalanina Treonina Triptofano Valina
Biochimica e Biologia per le professioni sanitarie, McGrawHill Tab. 20.1 Amminoacidi essenziali per l uomo Arginina Istidina Isoleucina Leucina Lisina Metionina Fenilalanina Treonina Triptofano Valina
I mammiferi sono privi dell enzima nitrogenasi, in grado di fissare l azoto atmosferico N2 NH3.
 Le proteine della dieta vengono scisse, nello stomaco e nell intestino, da diversi enzimi (pepsina, chimotripsina, carbossipeptidasi, elastasi) e i singoli amminoacidi sono assorbiti dalla parete intestinale.
Le proteine della dieta vengono scisse, nello stomaco e nell intestino, da diversi enzimi (pepsina, chimotripsina, carbossipeptidasi, elastasi) e i singoli amminoacidi sono assorbiti dalla parete intestinale.
METABOLISMO DEGLI AMMINOACIDI
 PRINCIPI NUTRITIVI METABOLISMO DEGLI AMMINOACIDI Nel corso della digestione le proteine vengono degradate in amminoacidi. Contrariamente ai carboidrati, gli amminoacidi non vengono immagazzinati, ma vengono
PRINCIPI NUTRITIVI METABOLISMO DEGLI AMMINOACIDI Nel corso della digestione le proteine vengono degradate in amminoacidi. Contrariamente ai carboidrati, gli amminoacidi non vengono immagazzinati, ma vengono
PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE
 Università di Roma Tor Vergata - Scienze della Nutrizione Umana Biochimica della Nutrizione Prof.ssa Luciana Avigliano 2011 PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE amminoacidi proteine
Università di Roma Tor Vergata - Scienze della Nutrizione Umana Biochimica della Nutrizione Prof.ssa Luciana Avigliano 2011 PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE amminoacidi proteine
FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI
 FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI ZIMOGENI ATTIVATI NEL LUME INTESTINALE DURANTE LA DIGESTIONE DELLE PROTEINE ESOGENE Tripsina, chimotripsina,
FONTI DI AMMINOACIDI: PROTEINE ASSUNTE CON GLI ALIMENTI PROTEINE ENDOGENE (TURNOVER) BIOSINTESI ZIMOGENI ATTIVATI NEL LUME INTESTINALE DURANTE LA DIGESTIONE DELLE PROTEINE ESOGENE Tripsina, chimotripsina,
Il metabolismo dell azoto
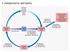 Il metabolismo dell azoto La fissazione dell azoto Radici di una leguminosa e il simbionte Rhizobium leguminosarum. Microrganismi azotofissatori : ad es. batteri appartenenti ai generi Clostridium e Azotobacter.
Il metabolismo dell azoto La fissazione dell azoto Radici di una leguminosa e il simbionte Rhizobium leguminosarum. Microrganismi azotofissatori : ad es. batteri appartenenti ai generi Clostridium e Azotobacter.
L integrazione proteica nelle diverse fisiopatologie
 Università degli Studi di Napoli Federico II Corso di Laurea in Scienze della Nutrizione Umana Corso di: Chimica degli Alimenti L integrazione proteica nelle diverse fisiopatologie Prof. Gian Carlo Tenore
Università degli Studi di Napoli Federico II Corso di Laurea in Scienze della Nutrizione Umana Corso di: Chimica degli Alimenti L integrazione proteica nelle diverse fisiopatologie Prof. Gian Carlo Tenore
METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI
 METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI Glicolisi: Glucosio Glucosio Piruvato Piruvato Gluconeogenesi La Glicolisi (dal greco glykys dolce e lysis scissione) E` la via metabolica che
METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI Glicolisi: Glucosio Glucosio Piruvato Piruvato Gluconeogenesi La Glicolisi (dal greco glykys dolce e lysis scissione) E` la via metabolica che
Ossidazione degli amminoacidi e produzione dell urea
 Ossidazione degli amminoacidi e produzione dell urea Gli amminoacidi sono, con gli zuccheri ed i lipidi, la terza classe di molecole che, attraverso la degradazione ossidativa, contribuiscono significativamente
Ossidazione degli amminoacidi e produzione dell urea Gli amminoacidi sono, con gli zuccheri ed i lipidi, la terza classe di molecole che, attraverso la degradazione ossidativa, contribuiscono significativamente
Nella Biosfera viene mantenuto un un equilibrio tra l azoto totale inorganico e quello organico
 Gli a.a. oltre ad essere i costituenti delle proteine giocano numerosi ruoli metabolici: precursori di ormoni, vitamine, coenzimi, porfirine, pigmenti e neurotrasmettitori L esistenza di 20 a.a. nelle
Gli a.a. oltre ad essere i costituenti delle proteine giocano numerosi ruoli metabolici: precursori di ormoni, vitamine, coenzimi, porfirine, pigmenti e neurotrasmettitori L esistenza di 20 a.a. nelle
Capitolo 4: Le proteine: ossidazione degli amminoacidi, produzione dell urea e biosintesi degli amminoacidi
 Capitolo 4: Le proteine: ossidazione degli amminoacidi, produzione dell urea e biosintesi degli amminoacidi proteine della dieta nucleotidi, ammine biologiche amminoacidi proteine intracellulari ciclo
Capitolo 4: Le proteine: ossidazione degli amminoacidi, produzione dell urea e biosintesi degli amminoacidi proteine della dieta nucleotidi, ammine biologiche amminoacidi proteine intracellulari ciclo
Indice generale 1. Introduzione alla biochimica 2. Acqua, ph, acidi, basi, sali, tamponi
 Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
Utilizzazione metabolica dei nutrienti
 Utilizzazione metabolica dei nutrienti Il rifornimento di substrati è discontinuo Fase postprandiale utilizzazione dei nutrienti esogeni e messa in riserva Fase postassorbitiva (digiuno) mobilizzazione
Utilizzazione metabolica dei nutrienti Il rifornimento di substrati è discontinuo Fase postprandiale utilizzazione dei nutrienti esogeni e messa in riserva Fase postassorbitiva (digiuno) mobilizzazione
Lattato. Glicolisi. Piruvato
 Lattato Glicolisi Piruvato REAZIONI MITOCONDRIALI DEL PIRUVATO + Piruvato Deidrogenasi + CO 2 + H 2 O ATP ADP + Pi Piruvato Carbossilasi + 2 H + ossalacetato La Piruvato Carbossilasi è una proteina Mitocondriale
Lattato Glicolisi Piruvato REAZIONI MITOCONDRIALI DEL PIRUVATO + Piruvato Deidrogenasi + CO 2 + H 2 O ATP ADP + Pi Piruvato Carbossilasi + 2 H + ossalacetato La Piruvato Carbossilasi è una proteina Mitocondriale
Catabolismo di proteine
 Catabolismo di proteine Digestione di proteine dalla dieta Turn-over di proteine endogene Digiuno prolungato DIGESTIONE DI PROTEINE ESOGENE L organismo ricava la maggior parte degli aminoacidi di cui ha
Catabolismo di proteine Digestione di proteine dalla dieta Turn-over di proteine endogene Digiuno prolungato DIGESTIONE DI PROTEINE ESOGENE L organismo ricava la maggior parte degli aminoacidi di cui ha
Catabolismo di proteine
 Catabolismo di proteine Digestione di proteine dalla dieta Turn-over di proteine endogene Digiuno prolungato DIGESTIONE DI PROTEINE ESOGENE L organismo ricava la maggior parte degli aminoacidi di cui ha
Catabolismo di proteine Digestione di proteine dalla dieta Turn-over di proteine endogene Digiuno prolungato DIGESTIONE DI PROTEINE ESOGENE L organismo ricava la maggior parte degli aminoacidi di cui ha
Digestione delle proteine: 6 fasi
 orletto a spazzola Digestione delle proteine: 6 fasi 1. Idrolisi gastrica del legame peptidico 2. Digestione a peptidi più piccoli da parte delle proteasi pancreatiche nel lume dell intestino tenue 3.
orletto a spazzola Digestione delle proteine: 6 fasi 1. Idrolisi gastrica del legame peptidico 2. Digestione a peptidi più piccoli da parte delle proteasi pancreatiche nel lume dell intestino tenue 3.
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
Metabolismo degli Ammino Acidi
 Metabolismo degli Ammino Acidi R 1 C C - R 2 C C - N 3 Transaminasi R 1 C C - R 2 C C - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due a-cheto acidi.
Metabolismo degli Ammino Acidi R 1 C C - R 2 C C - N 3 Transaminasi R 1 C C - R 2 C C - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due a-cheto acidi.
Proteine strutturali Sostegno meccanico Cheratina: costituisce i capelli Collagene: costituisce le cartilagini Proteine di immagazzinamento
 Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
I LIPIDI. Circa il 95% dei lipidi introdotti con la dieta è rappresentato da trigliceridi
 Metabolismo Lipidi I LIPIDI Circa il 95% dei lipidi introdotti con la dieta è rappresentato da trigliceridi In media il 40% o anche più dell energia richiesta giornalmente dall uomo nei paesi industrializzati
Metabolismo Lipidi I LIPIDI Circa il 95% dei lipidi introdotti con la dieta è rappresentato da trigliceridi In media il 40% o anche più dell energia richiesta giornalmente dall uomo nei paesi industrializzati
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. DiSTABiF. Corso di Laurea in Scienze Biologiche. Insegnamento di. Anno Accademico
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Prof. Antimo Di Maro Anno Accademico 2016-17 Lezione 14 Ciclo di Krebs L ossidazione
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Prof. Antimo Di Maro Anno Accademico 2016-17 Lezione 14 Ciclo di Krebs L ossidazione
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2015-16 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2015-16 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Ruolo del fegato nella nutrizione
 Ruolo del fegato nella nutrizione Centro di distribuzione dei nutrienti per tutti gli altri organi Annulla le fluttuazioni del metabolismo determinate dall assunzione intermittente del cibo Funge da deposito
Ruolo del fegato nella nutrizione Centro di distribuzione dei nutrienti per tutti gli altri organi Annulla le fluttuazioni del metabolismo determinate dall assunzione intermittente del cibo Funge da deposito
Fegato e metabolismo lipidico
 Fegato e metabolismo lipidico LIPIDI : Acidi grassi liberi o esterificati ad Acil gliceroli ( mono, di, tri) Fosfolipidi e colesterolo FONTI : Grassi della dieta Depositati sotto forma di goccioline (tessuto
Fegato e metabolismo lipidico LIPIDI : Acidi grassi liberi o esterificati ad Acil gliceroli ( mono, di, tri) Fosfolipidi e colesterolo FONTI : Grassi della dieta Depositati sotto forma di goccioline (tessuto
INTRODUZIONE AL METABOLISMO. dal gr. metabolè = trasformazione
 INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
PROTEINE. L-amminoacidi uniti tra loro da legame peptidico
 PROTEINE L-amminoacidi uniti tra loro da legame peptidico gruppo amminico (NH 2 ), gruppo carbossilico (COOH) e gruppo R caratterizzante i singoli amminoacidi. Il gruppo R influenza la solubilità dell
PROTEINE L-amminoacidi uniti tra loro da legame peptidico gruppo amminico (NH 2 ), gruppo carbossilico (COOH) e gruppo R caratterizzante i singoli amminoacidi. Il gruppo R influenza la solubilità dell
CATABOLISMO AMMINOACIDI
 CATABOLISMO AMMINOACIDI 1 Catabolismo aminoacidi Digestione di proteone dalla dieta Turnover delle proteine Digiuno prolungato 2 Digestione delle proteine dalla dieta L organismo ricava la maggior parte
CATABOLISMO AMMINOACIDI 1 Catabolismo aminoacidi Digestione di proteone dalla dieta Turnover delle proteine Digiuno prolungato 2 Digestione delle proteine dalla dieta L organismo ricava la maggior parte
Metabolismo degli Ammino Acidi
 Metabolismo degli Ammino Acidi R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due α-cheto acidi. Amminotransferasi
Metabolismo degli Ammino Acidi R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi) catalizza il trasferimento reversibile di un ammino gruppo tra due α-cheto acidi. Amminotransferasi
N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi
 Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Digestione e assorbimento delle proteine
 Digestione e assorbimento delle proteine Metabolismo delle proteine Le proteine sono formate da catene di α- aminoacidi della serie L uniti tra loro dal legame peptidico Le proteine sono composte da 20
Digestione e assorbimento delle proteine Metabolismo delle proteine Le proteine sono formate da catene di α- aminoacidi della serie L uniti tra loro dal legame peptidico Le proteine sono composte da 20
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Biosintesi dei carboidrati
 Biosintesi dei carboidrati Gluconeogenesi: sintesi di glucosio da precursori non saccaridici La riserva di glucosio dell organismo (glucosio + glicogeno) è sufficiente per circa 1 giorno. La via gluconeogenetica
Biosintesi dei carboidrati Gluconeogenesi: sintesi di glucosio da precursori non saccaridici La riserva di glucosio dell organismo (glucosio + glicogeno) è sufficiente per circa 1 giorno. La via gluconeogenetica
 METABOLISMO DEGLI AMMINOACIDI 1.Quali tra i seguenti sono amminoacidi semiessenziali: -Arginina e istidina -valina e treonina -fenilalanina e metionina -glicina e alanina Cosa si intende per semi essenziali?
METABOLISMO DEGLI AMMINOACIDI 1.Quali tra i seguenti sono amminoacidi semiessenziali: -Arginina e istidina -valina e treonina -fenilalanina e metionina -glicina e alanina Cosa si intende per semi essenziali?
Il Fegato - ruolo centrale nel metabolismo
 Il Fegato - ruolo centrale nel metabolismo 1) È una ghiandola esocrina: produce bile cistifellea intestino tenue 2) È un organo a secrezione interna (endocrina): prodotti metabolici torrente circolatorio
Il Fegato - ruolo centrale nel metabolismo 1) È una ghiandola esocrina: produce bile cistifellea intestino tenue 2) È un organo a secrezione interna (endocrina): prodotti metabolici torrente circolatorio
Connessioni. Le cellule cardiache sono unite tra loro da parti più ispessite del sarcolemma dette: Gap - junction
 Muscolo cardiaco Le fibrocellule cardiache sono simili alle fibrocellule muscolari di tipo I (fibre rosse), ma si differenziano, infatti: Sono più piccole Non sono polinucleate Minor massa fibrillare (50%
Muscolo cardiaco Le fibrocellule cardiache sono simili alle fibrocellule muscolari di tipo I (fibre rosse), ma si differenziano, infatti: Sono più piccole Non sono polinucleate Minor massa fibrillare (50%
Metabolismo dei composti azotati: aminoacidi e nucleotidi
 Metabolismo dei composti azotati: aminoacidi e nucleotidi Metabolismo degli aminoacidi I composti azotati L azoto contenuto nella cellula è presente soprattutto negli AMINOACIDI delle proteine e nelle
Metabolismo dei composti azotati: aminoacidi e nucleotidi Metabolismo degli aminoacidi I composti azotati L azoto contenuto nella cellula è presente soprattutto negli AMINOACIDI delle proteine e nelle
FABBISOGNO CALORICO kcal kcal
 FABBISOGNO CALORICO DONNA UOMO 1500-2000 kcal 2000-2500 kcal Al contrario di quanto accade per i carboidrati e i lipidi non esistono riserve di proteine. Le proteine, come tutti i componenti cellulari,
FABBISOGNO CALORICO DONNA UOMO 1500-2000 kcal 2000-2500 kcal Al contrario di quanto accade per i carboidrati e i lipidi non esistono riserve di proteine. Le proteine, come tutti i componenti cellulari,
TRANSAMINASI (AMINOTRANSFERASI) agiscono con un meccanismo ping-pong. sono presenti sia nel citosol che nei mitocondri
 TRANSAMINASI (AMINOTRANSFERASI) sono PLP-dipendenti agiscono con un meccanismo ping-pong catalizzano reazioni reversibili sono presenti sia nel citosol che nei mitocondri Seguiamo le fasi di una reazione
TRANSAMINASI (AMINOTRANSFERASI) sono PLP-dipendenti agiscono con un meccanismo ping-pong catalizzano reazioni reversibili sono presenti sia nel citosol che nei mitocondri Seguiamo le fasi di una reazione
Metabolismo degli aminoacidi
 Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Metabolismo glucidico
 Metabolismo glucidico Glicogeno glicogenolisi Riboso-5P (NADPH) Colesterolo glicogenosintesi shunt pentoso fosfati Glucoso Glucoso-6P glicolisi Piruvato gluconeogenesi CO 2 -ossidazione Trigliceridi Acidi
Metabolismo glucidico Glicogeno glicogenolisi Riboso-5P (NADPH) Colesterolo glicogenosintesi shunt pentoso fosfati Glucoso Glucoso-6P glicolisi Piruvato gluconeogenesi CO 2 -ossidazione Trigliceridi Acidi
IL GLUCOSIO PUO ESSERE SINTETIZZATO DA PRECURSORI NON GLUCIDICI
 GLUCONEOGENESI IL GLUCOSIO PUO ESSERE SINTETIZZATO DA PRECURSORI NON GLUCIDICI Quando la quantità di glucosio fornito dagli alimenti o dalle riserve è insufficiente, i diversi organismi sintetizzano glucosio
GLUCONEOGENESI IL GLUCOSIO PUO ESSERE SINTETIZZATO DA PRECURSORI NON GLUCIDICI Quando la quantità di glucosio fornito dagli alimenti o dalle riserve è insufficiente, i diversi organismi sintetizzano glucosio
AGISCONO NEL SISTEMA NAVETTA 2 ISOFORME DELL ENZIMA: UNA FORMA MITOCONDRIALE ( MEMBRANA MIT. INTERNA) FAD-dipendente
 METABOLISMO AEROBIO I NADH prodotti durante la glicolisi nel citosol, in condizioni aerobiche (respirazione mitocondriale attiva), possono trasferire elettroni all interno del mitocondrio attraverso i
METABOLISMO AEROBIO I NADH prodotti durante la glicolisi nel citosol, in condizioni aerobiche (respirazione mitocondriale attiva), possono trasferire elettroni all interno del mitocondrio attraverso i
Cap.19. Ciclo di Krebs. o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico
 Cap.19 Ciclo di Krebs o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico Acetil-CoA OSSIDAZIONE DEL GLUCOSIO C 6 H 12 O 6 (glucosio) + 6O 2.. 6CO 2 + 6H 2 O I tappa: GLICOLISI 2 + 2 H 2 O II
Cap.19 Ciclo di Krebs o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico Acetil-CoA OSSIDAZIONE DEL GLUCOSIO C 6 H 12 O 6 (glucosio) + 6O 2.. 6CO 2 + 6H 2 O I tappa: GLICOLISI 2 + 2 H 2 O II
Complesso della piruvato deidrogenasi (1) Stechiometria della reazione finale
 Ciclo di Krebs 1 Complesso della piruvato deidrogenasi (1) Stechiometria della reazione finale 2 Complesso della piruvato deidrogenasi (2) FAD Diidrolipoil deidrogenasi Piruvato decarbossilasi E 3 Diidrolipoil
Ciclo di Krebs 1 Complesso della piruvato deidrogenasi (1) Stechiometria della reazione finale 2 Complesso della piruvato deidrogenasi (2) FAD Diidrolipoil deidrogenasi Piruvato decarbossilasi E 3 Diidrolipoil
Fosforilazione a livello del substrato
 10 piruvato chinasi Fosfoenolpiruvato Rib Adenina Piruvato ADP Rib ATP Adenina Fosforilazione a livello del substrato 3 Fosfofruttochinasi-1 (PFK-1) Fruttosio 6-fosfato Fruttosio 1,6-bisfosfato 1 esochinasi
10 piruvato chinasi Fosfoenolpiruvato Rib Adenina Piruvato ADP Rib ATP Adenina Fosforilazione a livello del substrato 3 Fosfofruttochinasi-1 (PFK-1) Fruttosio 6-fosfato Fruttosio 1,6-bisfosfato 1 esochinasi
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
Attività cellulare altamente coordinata svolta da sistemi multienzimatici, con i seguenti scopi: ottenere energia chimica dall ambiente attraverso la
 Metabolismo Attività cellulare altamente coordinata svolta da sistemi multienzimatici, con i seguenti scopi: ottenere energia chimica dall ambiente attraverso la degradazione di nutrienti operare la sintesi
Metabolismo Attività cellulare altamente coordinata svolta da sistemi multienzimatici, con i seguenti scopi: ottenere energia chimica dall ambiente attraverso la degradazione di nutrienti operare la sintesi
IL METABOLISMO. Dal carbonio agli OGM Capitolo 2
 IL METABOLISMO Dal carbonio agli OGM Capitolo 2 IL METABOLISMO L'insieme delle trasformazioni chimiche ed energetiche che si verificano nelle cellule di un organismo vivente e ne garantiscono la conservazione,
IL METABOLISMO Dal carbonio agli OGM Capitolo 2 IL METABOLISMO L'insieme delle trasformazioni chimiche ed energetiche che si verificano nelle cellule di un organismo vivente e ne garantiscono la conservazione,
Vittoria Patti MACROMOLECOLE BIOLOGICHE. 4. proteine
 Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Somministrazione o assunzione di alimenti allo scopo di nutrire l organismo
 Definizioni Alimentazione Somministrazione o assunzione di alimenti allo scopo di nutrire l organismo Nutrizione complesso di processi biologici che consentono o condizionano la conservazione, l accrescimento,
Definizioni Alimentazione Somministrazione o assunzione di alimenti allo scopo di nutrire l organismo Nutrizione complesso di processi biologici che consentono o condizionano la conservazione, l accrescimento,
Cap.21 CATABOLISMO DEI LIPIDI
 Cap.21 CATABOLISMO DEI LIPIDI Glucosio= forma di energia immediatamente disponibile LIPIDI= Deposito energetico utilizzabile da tutti i tessuti, tranne cervello e globuli rossi Rispetto ai carboidrati,
Cap.21 CATABOLISMO DEI LIPIDI Glucosio= forma di energia immediatamente disponibile LIPIDI= Deposito energetico utilizzabile da tutti i tessuti, tranne cervello e globuli rossi Rispetto ai carboidrati,
Biosintesi degli aminoacidi
 Biosintesi degli aminoacidi Per l uomo la fonte principale di gruppi NH 4 + sono gli AA contenuti nelle proteine della dieta Parte di NH 4 + che si genera dalla degradazione degli AA viene riciclata e
Biosintesi degli aminoacidi Per l uomo la fonte principale di gruppi NH 4 + sono gli AA contenuti nelle proteine della dieta Parte di NH 4 + che si genera dalla degradazione degli AA viene riciclata e
fornire energia chimica in vettori attivati ATP e NADH e NADPH e FADH.
 Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Amminoacidi: l eliminazione dell azoto
 Amminoacidi: l eliminazione dell azoto P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006 Gli aa. Non sono conservati nell organismo, quelli che eccedono
Amminoacidi: l eliminazione dell azoto P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006 Gli aa. Non sono conservati nell organismo, quelli che eccedono
Attenzione: Lunedì 15 la lezione sarà dalle 14 alle 16 (al posto di L. Migliore)
 Attenzione: Lunedì 15 la lezione sarà dalle 14 alle 16 (al posto di L. Migliore) La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato
Attenzione: Lunedì 15 la lezione sarà dalle 14 alle 16 (al posto di L. Migliore) La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato
Malnutrizione in Eccesso e in Difetto
 Malnutrizione in Eccesso e in Difetto Augusto Innocenti Dottore in Biologia Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia 1 Bilancio Energetico La risultanza
Malnutrizione in Eccesso e in Difetto Augusto Innocenti Dottore in Biologia Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia 1 Bilancio Energetico La risultanza
La scienza nell alimentazione
 La scienza nell alimentazione Intorno al 1800 la chimica prese parte all alimentazione dando al cibo un sapore migliore ma allo stesso tempo più dannoso per il corpo umano. La materia di studio della Scienza
La scienza nell alimentazione Intorno al 1800 la chimica prese parte all alimentazione dando al cibo un sapore migliore ma allo stesso tempo più dannoso per il corpo umano. La materia di studio della Scienza
PROTIDI: LE PROTEINE E GLI AMMINOACIDI
 PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
MANTENIMENTO DELLA STRUTTURA CRESCITA SVILUPPO RIPRODUZIONE
 BIOENERGETICA MANTENIMENTO DELLA STRUTTURA CRESCITA SVILUPPO RIPRODUZIONE GLI ORGANISMI VIVENTI POSSONO UTILIZZARE SOLO DUE FORME DI ENERGIA: LUMINOSA (radiazioni di determinate lunghezze d onda) (ORGANISMI
BIOENERGETICA MANTENIMENTO DELLA STRUTTURA CRESCITA SVILUPPO RIPRODUZIONE GLI ORGANISMI VIVENTI POSSONO UTILIZZARE SOLO DUE FORME DI ENERGIA: LUMINOSA (radiazioni di determinate lunghezze d onda) (ORGANISMI
L NH 3 è prodotta da tutti i tessuti durante il metabolismo di diversi composti, ma solo il fegato èin grado di eliminarla sotto forma di urea
 L NH 3 è prodotta da tutti i tessuti durante il metabolismo di diversi composti, ma solo il fegato èin grado di eliminarla sotto forma di urea L NH 3 è estremamente tossica per il cervello: un aumento
L NH 3 è prodotta da tutti i tessuti durante il metabolismo di diversi composti, ma solo il fegato èin grado di eliminarla sotto forma di urea L NH 3 è estremamente tossica per il cervello: un aumento
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre
 Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Il FEGATO Cardarera, cap.3
 Il FEGATO Cardarera, cap.3 2.5% della massa corporea 1,6-1.8 Kg nel maschio 1.3-1.4 Kg nella femmina Tramite la vena porta, è il primo organo a ricevere il sangue arricchito di nutrienti assorbiti dall
Il FEGATO Cardarera, cap.3 2.5% della massa corporea 1,6-1.8 Kg nel maschio 1.3-1.4 Kg nella femmina Tramite la vena porta, è il primo organo a ricevere il sangue arricchito di nutrienti assorbiti dall
NADH e NADPH. ATP = 1 moneta (energetica) della cellula NADH, NADPH = 2 moneta (potere riducente)
 NADH e NADPH ATP = 1 moneta (energetica) della cellula NADH, NADPH = 2 moneta (potere riducente) NADH e NADPH non sono funzionalmente intercambiabili. [NAD + ]/[NADH] ~ 1000 favorisce ossidazione [NADP
NADH e NADPH ATP = 1 moneta (energetica) della cellula NADH, NADPH = 2 moneta (potere riducente) NADH e NADPH non sono funzionalmente intercambiabili. [NAD + ]/[NADH] ~ 1000 favorisce ossidazione [NADP
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio. GLUCONEOGENESI (sintesi da precursori non glucidici)
 DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
Il trasporto del glucosio
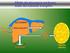 Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
α-amminoacidi O α O α R CH C O - NH 3 forma ionizzata sale interno (zwitterione) OH NH 2 forma non ionizzata (non esistente in realtà)
 Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
Amminoacidi 2 forma non ionizzata (non esistente in realtà) 3 forma ionizzata sale interno (zwitterione) In soluzione acquosa c'è equilibrio tra tre forme 3 forma cationica p molto acidi 3 forma zwitterionica
ricerca Lista di lavoro del Progetto Enzimi - Wikipedia https://it.wikipedia.org/wiki/progetto:bi o/enzimi/lista_nomi_accettati/4
 ricerca Lista di lavoro del Progetto Enzimi - Wikipedia https://it.wikipedia.org/wiki/progetto:bi o/enzimi/lista_nomi_accettati/4 Il destino dello scheletro carbonioso dipende dallo STATO METABOLICO e
ricerca Lista di lavoro del Progetto Enzimi - Wikipedia https://it.wikipedia.org/wiki/progetto:bi o/enzimi/lista_nomi_accettati/4 Il destino dello scheletro carbonioso dipende dallo STATO METABOLICO e
(2 x) (2 x) (2 x) Il NADH prodotto in questa reazione DEVE essere ri-ossidato affinché la glicolisi non si fermi. Gliceraldeide 3-fosfato deidrogenasi
 Il NADH prodotto in questa reazione DEVE essere ri-ossidato affinché la glicolisi non si fermi (2 x) (2 x) Gliceraldeide 3-fosfato Fosfato inorganico Gliceraldeide 3-fosfato deidrogenasi Reazione di ossidoriduzione:
Il NADH prodotto in questa reazione DEVE essere ri-ossidato affinché la glicolisi non si fermi (2 x) (2 x) Gliceraldeide 3-fosfato Fosfato inorganico Gliceraldeide 3-fosfato deidrogenasi Reazione di ossidoriduzione:
Alle proteine è legato il concetto di principio elementare plastico per eccellenza Ruolo svolto dalle proteine:
 Alle proteine è legato il concetto di principio elementare plastico per eccellenza Ruolo svolto dalle proteine: 1. Componenti strutturali essenziali 2. Enzimi 3. Ormoni 4. Proteine plasmatiche 5. Trasporto
Alle proteine è legato il concetto di principio elementare plastico per eccellenza Ruolo svolto dalle proteine: 1. Componenti strutturali essenziali 2. Enzimi 3. Ormoni 4. Proteine plasmatiche 5. Trasporto
Utilizzo del glucosio: la glicolisi
 Utilizzo del glucosio: la glicolisi GLUCOSIO Sistema rapido, reversibile, GLICOLISI avviene anche in assenza di ossigeno. Produce poca energia OSSIDAZIONE PIRUVATO Fermentazione LATTATO ACETATO CICLO DI
Utilizzo del glucosio: la glicolisi GLUCOSIO Sistema rapido, reversibile, GLICOLISI avviene anche in assenza di ossigeno. Produce poca energia OSSIDAZIONE PIRUVATO Fermentazione LATTATO ACETATO CICLO DI
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi 1 2 Glicina, Serina, Alanina e Cisteina sono degradate a piruvato 3 Il glutammato è un amminoacido glucogenico glutammato H O H O - OOC-C-CH 2 -CH 2 -C-NH 2 NH 3 glutammina
Metabolismo degli amminoacidi 1 2 Glicina, Serina, Alanina e Cisteina sono degradate a piruvato 3 Il glutammato è un amminoacido glucogenico glutammato H O H O - OOC-C-CH 2 -CH 2 -C-NH 2 NH 3 glutammina
scaricato da www.sunhope.it
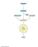 CICLO DEGLI ACIDI TRICARBOSSILICI o CICLO DELL ACIDO CITRICO o CICLO DI KREBS scaricato da www.sunhope.it IL CICLO DI KREBS È LA VIA OSSIDATIVA FINALE DEL CATABOLISMO DI GLUCIDI LIPIDI PROTEINE IL CICLO
CICLO DEGLI ACIDI TRICARBOSSILICI o CICLO DELL ACIDO CITRICO o CICLO DI KREBS scaricato da www.sunhope.it IL CICLO DI KREBS È LA VIA OSSIDATIVA FINALE DEL CATABOLISMO DI GLUCIDI LIPIDI PROTEINE IL CICLO
(b) Nutrienti quali regolatori delle funzioni cellulari. Colesterolo. Digestione dei lipidi. Fitosteroli
 Università di Roma Tor Vergata- Scienze della Nutrizione Umana Biochimica Prof.ssa Luciana Avigliano 2011 (b) Nutrienti quali regolatori delle funzioni cellulari Colesterolo Digestione dei lipidi Fitosteroli
Università di Roma Tor Vergata- Scienze della Nutrizione Umana Biochimica Prof.ssa Luciana Avigliano 2011 (b) Nutrienti quali regolatori delle funzioni cellulari Colesterolo Digestione dei lipidi Fitosteroli
Università di Roma Tor Vergata Scienze della Nutrizione Umana Biochimica della Nutrizione - Prof.ssa Luciana Avigliano A.A.
 Università di Roma Tor Vergata Scienze della Nutrizione Umana Biochimica della Nutrizione - Prof.ssa Luciana Avigliano A.A. 2011-12 Nutrienti quali regolatori delle funzioni cellulari AZIONE REGOLATORIA
Università di Roma Tor Vergata Scienze della Nutrizione Umana Biochimica della Nutrizione - Prof.ssa Luciana Avigliano A.A. 2011-12 Nutrienti quali regolatori delle funzioni cellulari AZIONE REGOLATORIA
Digestione e assorbimento dei lipidi. β-ossidazione degli acidi grassi
 Digestione e assorbimento dei lipidi β-ossidazione degli acidi grassi I grassi della dieta sono assorbiti nell intestino tenue Il diametro della particella dei chilomicroni varia da circa 100 a circa 500
Digestione e assorbimento dei lipidi β-ossidazione degli acidi grassi I grassi della dieta sono assorbiti nell intestino tenue Il diametro della particella dei chilomicroni varia da circa 100 a circa 500
PROTEINE. DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico.
 LE PROTEINE PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI: Strutturale: costruzione delle strutture cellulari Funzionale: Catalizzatori
LE PROTEINE PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI: Strutturale: costruzione delle strutture cellulari Funzionale: Catalizzatori
Carboidrati! Oligosaccaridi Polisaccaridi. B) Carboidrati complessi
 Carboidrati! Sono i composti organici più abbondanti sulla terra Contengono: C, H, O Sono Aldeidi o Chetoni poliossidrilici Possono essere suddivisi in: A) Zuccheri semplici Monosaccaridi B) Carboidrati
Carboidrati! Sono i composti organici più abbondanti sulla terra Contengono: C, H, O Sono Aldeidi o Chetoni poliossidrilici Possono essere suddivisi in: A) Zuccheri semplici Monosaccaridi B) Carboidrati
Scaricato da 21/01/2011
 1 2 Le due principali vie di rimozione del gruppo -NH 2 sono TRANSAMINAZIONE - transaminazione - deaminazione ossidativa La transaminazione è la prima tappa del catabolismo della maggior parte degli aa
1 2 Le due principali vie di rimozione del gruppo -NH 2 sono TRANSAMINAZIONE - transaminazione - deaminazione ossidativa La transaminazione è la prima tappa del catabolismo della maggior parte degli aa
Apparato endocrino. Controllo della glicemia. Il pancreas endocrino. Università degli Studi di Perugia
 Università degli Studi di Perugia Dipartimento di Medicina Sperimentale Sezione di Fisiologia e Biochimica Apparato endocrino Controllo della glicemia Il pancreas endocrino 1 Insulina: struttura e biosintesi
Università degli Studi di Perugia Dipartimento di Medicina Sperimentale Sezione di Fisiologia e Biochimica Apparato endocrino Controllo della glicemia Il pancreas endocrino 1 Insulina: struttura e biosintesi
Regolazione ormonale del metabolismo energetico. Lezione del 11 marzo 2014
 Regolazione ormonale del metabolismo energetico Lezione del 11 marzo 2014 Effetti fisiologici e metabolici dell adrenalina: preparazione all azione EFFETTO IMMEDIATO EFFETTO COMPLESSIVO Effetto fisiologico
Regolazione ormonale del metabolismo energetico Lezione del 11 marzo 2014 Effetti fisiologici e metabolici dell adrenalina: preparazione all azione EFFETTO IMMEDIATO EFFETTO COMPLESSIVO Effetto fisiologico
FISIOLOGIA dell ALLENAMENTO. dai processi fisiologici alle metodiche di allenamento
 FISIOLOGIA dell ALLENAMENTO dai processi fisiologici alle metodiche di allenamento Introduzione alla fisiologia Metabolismo cellulare Il sistema cardiovascolare: funzione cardiaca vasi, flusso, pressione
FISIOLOGIA dell ALLENAMENTO dai processi fisiologici alle metodiche di allenamento Introduzione alla fisiologia Metabolismo cellulare Il sistema cardiovascolare: funzione cardiaca vasi, flusso, pressione
CICLO DI KREBS (o DELL ACIDO CITRICO)
 CICLO DI KREBS (o DELL ACIDO CITRICO) È un processo ossidativo che ha un ruolo centrale nel metabolismo energetico delle cellule eucariotiche. Avviene nella matrice mitocondriale. È alimentato soprattutto
CICLO DI KREBS (o DELL ACIDO CITRICO) È un processo ossidativo che ha un ruolo centrale nel metabolismo energetico delle cellule eucariotiche. Avviene nella matrice mitocondriale. È alimentato soprattutto
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH. ) ed un gruppo carbossilico ( COOH) nella stessa molecola
 Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( NH 2 ) ed un gruppo carbossilico ( COOH) nella stessa molecola CH 3 NH 2 C H α * COOH Acido 2-ammino propanoico (acido α-ammino propionico) 1 Amminoacidi
catabolismo anabolismo
 Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
METABOLISMO OSSIDATIVO VIE METABOLICHE CONVERGENTI
 METABOLISMO OSSIDATIVO VIE METABOLICHE CONVERGENTI Nelle piante l ossidazione degli acidi grassi avviene nei perossisomi delle foglie e nei gliossisomi dei semi Nelle cellule animali il sito principale
METABOLISMO OSSIDATIVO VIE METABOLICHE CONVERGENTI Nelle piante l ossidazione degli acidi grassi avviene nei perossisomi delle foglie e nei gliossisomi dei semi Nelle cellule animali il sito principale
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Una risposta cellulare specifica può essere determinata dalla presenza di mediatori chimici (ormoni o altre molecole), dall interazione con altre
 Una risposta cellulare specifica può essere determinata dalla presenza di mediatori chimici (ormoni o altre molecole), dall interazione con altre cellule (contatto cellula-cellula) o con strutture extracellulari
Una risposta cellulare specifica può essere determinata dalla presenza di mediatori chimici (ormoni o altre molecole), dall interazione con altre cellule (contatto cellula-cellula) o con strutture extracellulari
La quantità di glu presente nei liquidi extracellulari è di circa 20g, 80kcal.
 I principali nutrienti metabolici sono il glucosio e gli acidi grassi. In circostanze normali il glucosio è l unico nutriente che possa essere utilizzato dal cervello. E anche utilizzato preferenzialmente
I principali nutrienti metabolici sono il glucosio e gli acidi grassi. In circostanze normali il glucosio è l unico nutriente che possa essere utilizzato dal cervello. E anche utilizzato preferenzialmente
Degradazione degli acidi grassi
 Degradazione degli acidi grassi I grassi della dieta sono assorbiti nell intestino tenue Il diametro della particella dei chilomicroni varia da circa 100 a circa 500 nm. Mobilizzazione dei triacilgliceroli
Degradazione degli acidi grassi I grassi della dieta sono assorbiti nell intestino tenue Il diametro della particella dei chilomicroni varia da circa 100 a circa 500 nm. Mobilizzazione dei triacilgliceroli
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
I PROTIDI ASPETTI GENERALI
 I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
