Turn-over delle proteine
|
|
|
- Filomena Angelini
- 6 anni fa
- Visualizzazioni
Transcript
1 Prof. Giorgio Sartor Turn-over delle proteine Copyright by Giorgio Sartor. All rights reserved. M07 - Versione 1.4 nov 2013 Turn-over delle proteine Le proteine cellulari vengono regolarmente degradate e sintetizzate. Il tempo di semi-vita di un enzima nel fegato di ratto varia da 10 minuti a una settimana. In media il tempo di semi-vita di una proteina è correlato con il residuo -terminale: Proteine con -terminale come Met, Ser, Ala, Thr, Val, o Gly hanno un tempo di semi-vita maggiore di 20 ore. Proteine con -terminale Phe, Leu, Asp, Lys, o Arg hanno un tempo di semi-vita di 3 minuti o meno. gsartor v.1.3 M07 - Turn-over delle proteine - 2-1
2 Turn-over delle proteine È stato dimostrato che le proteine ricche in Pro (P), Glu (E), Ser (S) and Thr (T), chiamate proteine PEST, sono degradate più rapidamente che le altre proteine. La degradazione di specifiche proteine può essere regolata: egli eucarioti il ciclo cellulare è controllato, alcuni enzimi regolatori del ciclo sono degradati in fasi particolari del ciclo cellulare in risposta a segnali intra o extra-cellulari. gsartor v.1.3 M07 - Turn-over delle proteine Proteolisi: meccanismo generale n n+1 n n+1 '' '' ' u: C'' u+ ' C'' n n+1 '' n n+1 '' ' u: C'' 2 ' u C'' gsartor v.1.3 M07 - Turn-over delle proteine - 4-2
3 Enzimi proteolici Classi di enzimi proteolitici: Proteasi a serina: enzimi digestivi come tripsina, chimotripsina, elastasi... Differiscono nella specificità del substrato: Chimotripsina: privilegia il taglio del legame peptidico nel quale l AA che impegna il C= ha una catena laterale. Tripsina: preferisce un AA carico positivamente (Lys o Arg) nella stessa posizione. gsartor v.1.3 M07 - Turn-over delle proteine Enzimi proteolici: proteasi a serina Il sito attivo (tripsina bovina 3BTK) è fatto da un residuo di serina (Ser195), uno di istidina (is57) e uno di aspartato (Asp102). Durante la catalisi vi è un attacco nucleofilo del della serina sul carbonio del carbonile del legame peptidico che deve essere tagliato. Durante la reazione un + è trasferito dalla serina all anello imidazolico dell istidina, l aspartato forma un legame con l istidina. Ser195 is57 Asp102 gsartor v.1.3 M07 - Turn-over delle proteine - 6-3
4 Centro catalitico Asp102 is57 Ser195 gsartor v.1.3 M07 - Turn-over delle proteine Meccanismo delle proteasi a serina Asp102 E is57 Ser195 Gly193 Sito Specifico gsartor v.1.3 M07 - Turn-over delle proteine - 8-4
5 Meccanismo delle proteasi a serina Asp102 ES is57 Ser195 Gly193 Sito Specifico gsartor v.1.3 M07 - Turn-over delle proteine Meccanismo delle proteasi a serina Asp102 Intermedio tetraedrico + is57 Ser195 Gly193 Sito Specifico gsartor v.1.3 M07 - Turn-over delle proteine
6 Meccanismo delle proteasi a serina Asp102 + is57 Ser195 Gly193 Sito Specifico gsartor v.1.3 M07 - Turn-over delle proteine Meccanismo delle proteasi a serina Asp102 is57 Ser195 Gly193 Acilenzima Sito Specifico gsartor v.1.3 M07 - Turn-over delle proteine
7 Meccanismo delle proteasi a serina Asp102 is57 Sito Specifico Ser195 Gly193 gsartor v.1.3 M07 - Turn-over delle proteine Meccanismo delle proteasi a serina Asp102 is57 Ser195 Gly193 Sito Specifico gsartor v.1.3 M07 - Turn-over delle proteine
8 Meccanismo delle proteasi a serina Asp102 is57 + Intermedio tetraedrico Ser195 Gly193 Sito Specifico gsartor v.1.3 M07 - Turn-over delle proteine Meccanismo delle proteasi a serina Asp102 is57 + Ser195 Gly193 Sito Specifico gsartor v.1.3 M07 - Turn-over delle proteine
9 Meccanismo delle proteasi a serina Asp102 is57 Ser195 Gly193 Sito Specifico gsartor v.1.3 M07 - Turn-over delle proteine Meccanismo delle proteasi a serina Asp102 is57 Ser195 Gly193 Sito Specifico gsartor v.1.3 M07 - Turn-over delle proteine
10 Meccanismo delle proteasi a serina gsartor v.1.3 M07 - Turn-over delle proteine Proteasi a serina (1AX) gsartor v.1.3 M07 - Turn-over delle proteine
11 Proteasi a serina (1AX) Gly193 Ser195 is57 gsartor v.1.3 M07 - Turn-over delle proteine Enzimi proteolici: proteasi a aspartato Le proteasi ad aspartato comprendono: La pepsina (enzima digestivo). Alcune proteasi lisosomiali. L enzima renale renina. Le proteasi dell IV. Due residui di aspartato sembra partecipino alla catalisi acido/base nel sito attivo. Un aspartato accetta + da una molecola di 2 nel sito attivo che attacca il carbonio carbonilico del legame peptidico. Simultaneamente l altro aspartato cede l + all ossigeno del carbonile del legame peptidico. gsartor v.1.3 M07 - Turn-over delle proteine
12 Pepsina Secreta dalle cellule della mucosa gastrica (che secernono anche Cl) come pepsinogeno inattivo (40 kd): Pepsinogeno p acido Pepsina -42AA -AA-AA-AA-AA- AA + AA-AA + AA-AA-AA Taglia con maggior frequenza legami tra aminoacidi aromatici, Met, Leu e produce peptidi e pochi aminoacidi liberi. gsartor v.1.3 M07 - Turn-over delle proteine Meccanismo delle proteasi ad aspartato gsartor v.1.3 M07 - Turn-over delle proteine
13 Enzimi proteolici: metallo proteasi Appartengono alla classe delle proteasi a Zinco (metalloproteasi): La carbossipeptidasi (enzima digestivo). Le metalloproteasi della matrice (collagenasi), coinvolte nella degradazione della matrice extra cellulare durante la crescita dei tessuti. Una proteasi lisosomiale. el sito attivo è presente uno zinc binding motif, con due residui di istidina il cui imidazolo complessa lo ione Zn ++. ella catalisi lo Zn ++ interagisce con l ossigeno del C= promuovendo l attacco nucleofilo dell ossigeno di una molecola di acqua nel sito attivo al carbonio del C=. ella carbossipeptidasi un residuo di glutamato facilita la reazione estraendo un + dall acqua. gsartor v.1.3 M07 - Turn-over delle proteine Peptidasi intestinali Procarbossipeptidasi A e B Carbossipeptidasi A B Leucina aminopetidasi Lys Arg 3 + Leu gsartor v.1.3 M07 - Turn-over delle proteine
14 Metallo (zinco) proteasi Uno ione Zn ++ è coordinato con due atomi di azoto di due is, il carbonile di un Glu e 2 Lo ione Zn ++ promuove l attacco nucleofilo sul carbonio carbonilico da parte dell atomo di ossigeno dell acqua legata nel sito attivo Il residuo di Glu agisce come base facilita la reazione estraendo un + dall 2. Zn ++ gsartor v.1.3 M07 - Turn-over delle proteine Enzimi proteolici: proteasi a cisteina Appartengono alla classe delle proteasi a Cisteina: La papaina (della Carica Papaya). Alcune protesi lisosomiali (catepsine). Le caspasi che si occupano della degradazione delle proteine dell apoptosi (morte cellulare programmata). Le proteasi lisosomiali a cisteina sono omologhe alla papaina. Sono una famiglia molto grande con svariata specificità di substrato. Le caspasi tagliano il lato carbossilico di un aspartato. Il meccanismo delle proteasi a cisteina si pensa che coinvolga la deprotonazione del S di una cisteina da parte di un residuo vicino di istidina seguito da un attacco nucleofilo dello zolfo al carbonio carbonilico. gsartor v.1.3 M07 - Turn-over delle proteine
15 Attivazione delle proteasi Attivazione delle proteasi: La maggior parte delle protesi sono sintetizzate come proenzimi di maggiori dimensioni. L attivazione consiste nella rimozione di un segmento inibitorio nel proenzima. L attivazione può avvenire dopo che la proteasi è stata secreta nell apposito compartimento cellulare o nella matrice extracellulare. In alcuni casi (attivazione dell apoptosi) l attivazione può essere a cascata e portare all attivazione di proteasi specifiche. gsartor v.1.3 M07 - Turn-over delle proteine Degradazione delle proteine Ci sono tre principali sistemi di degradazione delle proteine (nel muscolo): Ubiquitina-proteosoma Le proteine sono marcate per la degradazione da unità di ubiquitina. I proteosoma 20S inattivo viene attivato da una proteina regolatrice diventando proteosoma 26S Il proteosoma 26S rompe la proteina in peptidi I peptidi sono scissi in aminoacidi liberi da altri processi nella cellula Lisosomi Le proteine entrano nei lisosomi via endocitosi La catepsina e le proteasi degradano i legami peptidici in ambiente acido. Calpaina Proteasi attivate da calcio nel citosol della cellula I differenti isomeri sono attivati da differenti concentrazioni di calcio. gsartor v.1.3 M07 - Turn-over delle proteine
16 Sistema Ubiquitina-proteosoma Ubiquitina: Le proteine sono marcate per la proteolisi selettiva dall ubiquitina, una proteina ubiquitaria altamente conservata. Si forma un legame isopeptidico tra il carbossiterminale dell ubiquitina e un gruppo 2 di una lisina della proteina da degradare. Il processo è ATP dipendente. Sono coinvolti tre enzimi (E1, E2 e E3). gsartor v.1.3 M07 - Turn-over delle proteine Sistema Ubiquitina-proteosoma Inizialmente il carbossiteminale dell ubiquitina è legato con un legame tioestere al Ubiquitin- Activating Enzyme (E1) attraverso una reazione ATP dipendente L ubiquitina vien quindi trasferita ad un gruppo sulfidrilico del Ubiquitin-Conjugating Enzyme (E2). Una Ubiquitin-Protein Ligase (E3) trasferisce l ubiquitina attivata al gruppo ε-amino di una lisina formando un legame isopeptidico. Ci sono diverse ligasi dell ubiquitina che differiscono per la specificità. gsartor v.1.3 M07 - Turn-over delle proteine
17 Sistema Ubiquitina-proteosoma Più ubiquitine sono legate per formare una catena. La Gly carbossiterminale forma un legame con il gruppo ε-amino della Lys48 di una catena adiacente di ubiquitina. 1UBQ gsartor v.1.3 M07 - Turn-over delle proteine Sistema Ubiquitina-proteosoma gsartor v.1.3 M07 - Turn-over delle proteine
18 Sistema Ubiquitina-proteosoma Alcune proteine (per esempio le cicline, coinvolte nella regolazione del ciclo cellulare) presentano una sequenza chiamata destruction box, riconosciuta da un dominio del corrispondente E3. L interazione dell ubiquitina ligasi con il suo bersaglio è regolata, in alcuni casi, dalla fosforilazione della proteina bersaglio e può coinvolgere altre proteine adattatrici. 2 C gsartor v.1.3 M07 - Turn-over delle proteine Sistema Ubiquitina-proteosoma Alcune proteine (per esempio le cicline, coinvolte nella regolazione del ciclo cellulare) presentano una sequenza chiamata destruction box, riconosciuta da un dominio del corrispondente E3. L interazione dell ubiquitina ligasi con il suo bersaglio è regolata, in alcuni casi, dalla fosforilazione della proteina bersaglio e può coinvolgere altre proteine adattatrici. gsartor v.1.3 M07 - Turn-over delle proteine
19 E1-E2-E3 gsartor v.1.3 M07 - Turn-over delle proteine E1-E2-E3 E1 è l enzima che attiva il processo attivando la molecola di ubiquitina attraverso un legame ad un S di una Cys. Il processo richiede ATP. Diversi E2 ricevono la molecola di ubiquitina così attivata e vengono riconosciuti da diversi E3 è un enzima che riconosce, e lega, la proteina da ubiquitinare e trasferisce su di essa l ubiquitina legandola ad una Lys bersaglio. gsartor v.1.3 M07 - Turn-over delle proteine
20 E1-E2-E3 14 1FXT 1FQV 1LDK gsartor v.1.3 M07 - Turn-over delle proteine E3 ECT: olologous to E6 AP C Terminus IG: eally Interesting ew Gene gsartor v.1.3 M07 - Turn-over delle proteine
21 gsartor v.1.3 M07 - Turn-over delle proteine Sistema Ubiquitina-proteosoma La degradazione selettiva di una proteina avviene nel proteosoma. Un complesso proteico presente nella cellula. Il core complex del proteosoma, ha un coefficiente di sedimentazione di 20S ed è costituito di 14 subunità di due tipi (α 7 β 7 ). Le sette subunità α formano un anello a struttura cilindrica. Le sette subunità β formano l anello centrale. α 7 β 7 { α β 1JD2 α 7 β 7 { β α gsartor v.1.3 M07 - Turn-over delle proteine
22 Sistema Ubiquitina-proteosoma Il core complex del proteosoma racchiude una cavità fatta di tre compartimenti collegati da uno stretto passaggio. L attività proteasica è associata a tre delle subunità β ognuna con differente specificità per il substrato. α β β α gsartor v.1.3 M07 - Turn-over delle proteine Sistema Ubiquitina-proteosoma 1. Una subunità β ha una attività simile alla chimotripsina con preferenza per Tyr o Phe come AA al carbonile del legame peptidico. 2. Una subunità β ha una attività simile alla tripsina con preferenza per Arg o Lys al carbonile del legame peptidico. 3. Una subunità β ha una attività post-glutamil con preferenza per glutamato o altro residuo acido. on sono coinvolti residui di cisteina o serina. L attività idrolasica del proteosoma costituisce una famiglia di proteasi a treonina. gsartor v.1.3 M07 - Turn-over delle proteine
23 Sistema Ubiquitina-proteosoma ella struttura del core complex del proteosoma non ci sono apparenti aperture verso l esterno. È presente un cap complex ( cappello ) che apra il passaggio verso l esterno e permetta alla proteina di entrare consumando ATP. È stato cristallizzato il core complex 20S del proteosoma con il cap complex 11S. L interazione del cap complex 11S altera la conformazione del dominio -terminale delle subunità α del core complex permettendo l accesso dall esterno. gsartor v.1.3 1FT M07 - Turn-over delle proteine Sistema Ubiquitina-proteosoma Ad ognuna delle estremità del core complex un motore ad ATP svolge la proteina da degradare e la inserisce nel core complex Al di sopra di questo ci sono i sistemi di controllo che riconoscono la proteina etichettata con ubiquitina. gsartor v.1.3 M07 - Turn-over delle proteine
24 gsartor v.1.3 M07 - Turn-over delle proteine gsartor v.1.3 M07 - Turn-over delle proteine
25 gsartor v.1.3 M07 - Turn-over delle proteine Differente cappello Alcune cellule usano il core del proteosoma corredandolo con un cappello diverso a secondo delle proprie necessità. on usano ATP per procedere all inserimento della proteina da degradare. on è molto chiara la funzione di questi sistemi che sembrano avere una predilezione per peptidi più corti e per proteine normalmente non foldate. gsartor v.1.3 M07 - Turn-over delle proteine
26 Caspasi Le caspasi sono le proteine che eseguono l apoptosi. Sono delle proteasi a cisteina che usano il gruppo S come nucleofilo per l idrolisi del legame peptidico. Idrolizzano il legame peptidico a livello di residui di Asp. gsartor v.1.3 M07 - Turn-over delle proteine Caspasi Esistono almeno una dozzina di Caspasi conosciute ognuna delle quali svolge una funzione definita Caspasi-1 (interleukin-1β-converting enzyme) è stata la prima ad essere identificata. on è coinvolta nell apoptosi. Come le altre Caspasi è fatta di due catene ognuna delle quali viene tagliata in due pezzi. Caspasi-9 è legata ad un inibitore che la mantiene inattiva. Viene attivata ad un altra subunità. La Caspasi-9 è un iniziatore di apoptosi che attiva un effettore come la Caspasi-3 la quale, insieme ad altri effettori, inizia il lavoro di disassemblaggio della cellula. Caspasi-1 (1ice) Caspasi-9 (1nw9) Caspasi-3 (1pau) gsartor v.1.3 M07 - Turn-over delle proteine
27 Lisosomi I lisosomi contengono enzimi idrolitici che degradano le proteine e altre sostanze catturate per endocitosi. I lisosomi hanno un valore di p interno basso (acido a causa di un trasporto di protoni pilotato da una V-ATPasi. Tutti gli enzimi idrolitici lisosomali hanno un optimum a p acido. Le catepsine (proteasi a cisteina) sono attivate dalla scissione di proenzimi che può essere catalizzata da altri enzimi lisosomali o dall ambiente acido Enzimi idrolitici p acido ATP + ADP + P i gsartor v.1.3 M07 - Turn-over delle proteine Lisosomi: sistemi di protezione Le cistatine inibiscono le catepsine lisosomali. Sono presenti nel citosol e nello spazio extracellulare. Le cistatine si legano al sito attivo delle catepsine competendo con il substrato e proteggono la cellula dalle catepsine eventualmente uscite dai lisosomi. Autofagia: se una porzione del citoplasma viene incapsulata dai lisosomi si ha la degradazione delle proteine. Questo meccanismo non è il meccanismo di elezione per la degradazione selettiva delle proteine. gsartor v.1.3 M07 - Turn-over delle proteine
28 Calpaine ei mammiferi le calpaine più conosciute solo le Calpaina-1 e Calpain-2 (micro-calpaina e M-calpaina), sono espresse ubiquitariamente. L attività delle calpaine e è strettamente controllata dall inibitore endogeno calpastatina che è una proteina intrinsecamente non strutturata che si lega alle calpaine in modo reversibile e solo in presenza di Ca ++. on è ancora ben chiaro come una proteina non strutturata possa funzionare da inibitore delle proteasi senza essere a sua volta scissa in peptidi. Ciò che si osserva è che la Calpastatina occupa entrambi i lati del sito catalitico senza interagire con esso direttamente gsartor v.1.3 M07 - Turn-over delle proteine M-Calpaina 3BW Calpastatina 1DF0 gsartor v.1.3 M07 - Turn-over delle proteine
29 Apoptosi gsartor v.1.4 M07 - Turn-over delle proteine Crediti e autorizzazioni all utilizzo Questo materiale è stato assemblato da informazioni raccolte dai seguenti testi di Biochimica: CAMPE Pamela, AVEY ichard, FEIE Denise. LE BASI DELLA BICIMICA [ISB ] Zanichelli ELS David L., CX Michael M. I PICIPI DI BICIMICA DI LEIGE - Zanichelli GAETT eginald., GISAM Charles M. BICIMICA con aspetti molecolari della Biologia cellulare - Zanichelli VET Donald, VET Judith G, PATT Charlotte W FDAMETI DI BICIMICA [ISB ] - Zanichelli E dalla consultazione di svariate risorse in rete, tra le quali: Kegg: Kyoto Encyclopedia of Genes and Genomes Brenda: Protein Data Bank: ensselaer Polytechnic Institute: Il materiale è stato inoltre rivisto e corretto dalla Prof. Giancarla rlandini dell Università di Parma alla quale va il mio sentito ringraziamento. Questo ed altro materiale può essere reperito a partire da: oppure da gsartor.org/ Il materiale di questa presentazione è di libero uso per didattica e ricerca e può essere usato senza limitazione, purché venga riconosciuto l autore usando questa frase: Materiale ottenuto dal Prof. Giorgio Sartor Università di Bologna Alma Mater Giorgio Sartor - giorgio.sartor@unibo.it 29
Prof. Giorgio Sartor. Invertebrati marini. I nutrienti. Fonti di carbonio ed energia. Fonte di carbonio. Fonte di energia. Composti organici.
 Prof. Giorgio Sartor Invertebrati marini I nutrienti Copyright 2001-2008 by Giorgio Sartor. All rights reserved. Versione 1.1 nov 2008 Fonti di carbonio ed energia Organismo Fonte di carbonio Fonte di
Prof. Giorgio Sartor Invertebrati marini I nutrienti Copyright 2001-2008 by Giorgio Sartor. All rights reserved. Versione 1.1 nov 2008 Fonti di carbonio ed energia Organismo Fonte di carbonio Fonte di
MOVIMENTO. Motori molecolari. IV Movimento Miosina e actina. Prof. Giorgio Sartor. P04 - Versione 2.0 oct 2013
 Prof. Giorgio Sartor Motori molecolari IV Movimento Miosina e actina Copyright 2001-2013 by Giorgio Sartor. All rights reserved. P04 - Versione 2.0 oct 2013 MOVIMENTO Miosina Actina P04 v. 2.0 gsartor
Prof. Giorgio Sartor Motori molecolari IV Movimento Miosina e actina Copyright 2001-2013 by Giorgio Sartor. All rights reserved. P04 - Versione 2.0 oct 2013 MOVIMENTO Miosina Actina P04 v. 2.0 gsartor
Metabolismo dei nucleotidi
 rof. Giorgio Sartor Metabolismo dei nucleotidi 1: introduzione 2: biosintesi de-novo delle purine 3: biosintesi de-novo delle pirimidine 4: catabolismo delle purine 5: catabolismo delle pirimidine 6: sintesi
rof. Giorgio Sartor Metabolismo dei nucleotidi 1: introduzione 2: biosintesi de-novo delle purine 3: biosintesi de-novo delle pirimidine 4: catabolismo delle purine 5: catabolismo delle pirimidine 6: sintesi
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
La fissazione dell azoto
 La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
Turn-over delle proteine. proteine
 Prof. Giorgio Sartor Turn-over delle proteine Copyright 2001-2016 by Giorgio Sartor. All rights reserved. M07 - Versione 2.2.2 Dec-16 Turn-over delle proteine Le proteine vengono regolarmente sintetizzate
Prof. Giorgio Sartor Turn-over delle proteine Copyright 2001-2016 by Giorgio Sartor. All rights reserved. M07 - Versione 2.2.2 Dec-16 Turn-over delle proteine Le proteine vengono regolarmente sintetizzate
Prof. Giorgio Sartor. Il metabolismo. Metabolismo. È il processo che permette di ricavare energia da legami chimici (sottoforma di
 Prof. Giorgio Sartor Il metabolismo Copyright 2001-2008 by Giorgio Sartor. All rights reserved. Versione 1.4 oct 2008 Metabolismo È il processo che permette di ricavare energia da legami chimici (sottoforma
Prof. Giorgio Sartor Il metabolismo Copyright 2001-2008 by Giorgio Sartor. All rights reserved. Versione 1.4 oct 2008 Metabolismo È il processo che permette di ricavare energia da legami chimici (sottoforma
Proteasi Serina proteasi Serina proteasi-coagulazione del sangue
 Proteasi Serina proteasi Serina proteasi-coagulazione del sangue PROTEASI Le proteasi catalizzano la scissione idrolitica di un legame peptidico Peptide bond -carboxyl group & -amino group La reazione
Proteasi Serina proteasi Serina proteasi-coagulazione del sangue PROTEASI Le proteasi catalizzano la scissione idrolitica di un legame peptidico Peptide bond -carboxyl group & -amino group La reazione
Sintesi e degradazione delle proteine
 Prof. Giorgio Sartor Sintesi e degradazione delle proteine Copyright 2001-2012 by Giorgio Sartor. All rights reserved. B15 - Versione 1.4.2 may 2012 Trasmissione dell informazione L informazione è contenuta
Prof. Giorgio Sartor Sintesi e degradazione delle proteine Copyright 2001-2012 by Giorgio Sartor. All rights reserved. B15 - Versione 1.4.2 may 2012 Trasmissione dell informazione L informazione è contenuta
FABBISOGNO CALORICO kcal kcal
 FABBISOGNO CALORICO DONNA UOMO 1500-2000 kcal 2000-2500 kcal Al contrario di quanto accade per i carboidrati e i lipidi non esistono riserve di proteine. Le proteine, come tutti i componenti cellulari,
FABBISOGNO CALORICO DONNA UOMO 1500-2000 kcal 2000-2500 kcal Al contrario di quanto accade per i carboidrati e i lipidi non esistono riserve di proteine. Le proteine, come tutti i componenti cellulari,
Continua. Peptidasi H 2 O
 Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Prof. Giorgio Sartor. Il metabolismo. Metabolismo. È il processo che permette di ricavare energia da legami chimici (sottoforma di
 Prof. Giorgio Sartor Il metabolismo Copyright 2001-2017 by Giorgio Sartor. All rights reserved. Versione 1.6.1 Mar-17 Metabolismo È il processo che permette di ricavare energia da legami chimici (sottoforma
Prof. Giorgio Sartor Il metabolismo Copyright 2001-2017 by Giorgio Sartor. All rights reserved. Versione 1.6.1 Mar-17 Metabolismo È il processo che permette di ricavare energia da legami chimici (sottoforma
Struttura delle proteine
 Struttura delle proteine I II III Copyright 2001-2015 by Giorgio Sartor. All rights reserved. Versione 1.0.2 oct 2015 Struttura quaternaria Èil livello di organizzazione per il quale si formano strutture
Struttura delle proteine I II III Copyright 2001-2015 by Giorgio Sartor. All rights reserved. Versione 1.0.2 oct 2015 Struttura quaternaria Èil livello di organizzazione per il quale si formano strutture
Emivita delle proteine
 Emivita delle proteine Ornitina decarbossilasi: 30 min, HMGCoA red: ~ 2-4 h Possiedono alto turn over inoltre: Enzimi nella biosintesi dei nucleotidi timinici (Ribonucleotide red, timidilato sintetasi)
Emivita delle proteine Ornitina decarbossilasi: 30 min, HMGCoA red: ~ 2-4 h Possiedono alto turn over inoltre: Enzimi nella biosintesi dei nucleotidi timinici (Ribonucleotide red, timidilato sintetasi)
REGOLAZIONE DELL ATTIVITA ENZIMATICA 1) MODULAZIONE ALLOSTERICA NON-COVALENTE (REVERSIBILE)
 REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
Il metabolismo dell azoto
 Il metabolismo dell azoto La fissazione dell azoto Radici di una leguminosa e il simbionte Rhizobium leguminosarum. Microrganismi azotofissatori : ad es. batteri appartenenti ai generi Clostridium e Azotobacter.
Il metabolismo dell azoto La fissazione dell azoto Radici di una leguminosa e il simbionte Rhizobium leguminosarum. Microrganismi azotofissatori : ad es. batteri appartenenti ai generi Clostridium e Azotobacter.
Applicazioni biotecnologiche degli enzimi: le proteasi
 Applicazioni biotecnologiche degli enzimi: le proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento più o meno elevata 4 classi sulla
Applicazioni biotecnologiche degli enzimi: le proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento più o meno elevata 4 classi sulla
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
Metabolismo degli amminoacidi Bilancio azotato Differenza fra l azoto introdotto e quello eliminato Positivo (gravidanza) Negativo In equilibrio ghiandole salivari bocca amilasi gastrina l (p 1) pepsinogeno
Enzimi: catalizzatori biologici
 Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
DEGRADAZIONE DELLA MATRICE
 DEGRADAZIONE DELLA MATRICE http://www.nature.com/nature/journal/v459/n7245/box/nature08146_bx1.html Regolazione degli enzimi di rimodellamento della ECM e consequenze biologiche della dinamica della ECM
DEGRADAZIONE DELLA MATRICE http://www.nature.com/nature/journal/v459/n7245/box/nature08146_bx1.html Regolazione degli enzimi di rimodellamento della ECM e consequenze biologiche della dinamica della ECM
FUNZIONI BIOLOGICHE DELLE PROTEINE
 FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
Gli enzimi. Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici
 Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
Proteasi (peptidasi)
 DEGRADAZIONE DELLA MATRICE PROTEASI http://www.fastbleep.com/assets/notes/image/8820_1.jpg Proteasi (peptidasi) Qualsiasi enzima che catalizza la proteolisi, ossia, inizia il catabolismo delle proteine
DEGRADAZIONE DELLA MATRICE PROTEASI http://www.fastbleep.com/assets/notes/image/8820_1.jpg Proteasi (peptidasi) Qualsiasi enzima che catalizza la proteolisi, ossia, inizia il catabolismo delle proteine
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
Applicazioni biotecnologiche degli enzimi: le proteasi
 Applicazioni biotecnologiche degli enzimi: le proteasi Campi di applicazione delle proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento
Applicazioni biotecnologiche degli enzimi: le proteasi Campi di applicazione delle proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento
Sintesi e degradazione delle proteine
 Prof. Giorgio Sartor Sintesi e degradazione delle proteine Copyright 2001- by Giorgio Sartor. All rights reserved. B15 - Versione 1.4.1 may Trasmissione dell informazione L informazione è contenuta nel
Prof. Giorgio Sartor Sintesi e degradazione delle proteine Copyright 2001- by Giorgio Sartor. All rights reserved. B15 - Versione 1.4.1 may Trasmissione dell informazione L informazione è contenuta nel
MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine. Solo per uso didattico, vietata la riproduzione, la diffusione o la vendita
 MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine MFN0366-A1 (I. Perroteau) -traduzione delle proteine trna Traduzione: mrna -------> proteine mrna MFN0366-A1 (I. Perroteau) -traduzione
MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine MFN0366-A1 (I. Perroteau) -traduzione delle proteine trna Traduzione: mrna -------> proteine mrna MFN0366-A1 (I. Perroteau) -traduzione
06_citologia_SER_golgi 1
 1 La sintesi proteica inizia sempre nello stesso modo: aggancio della piccola subunità ribosomale al estremità 5 dell mrna. si aggancio la grande subunità ribosomale In corrispondenza del codone di inizio
1 La sintesi proteica inizia sempre nello stesso modo: aggancio della piccola subunità ribosomale al estremità 5 dell mrna. si aggancio la grande subunità ribosomale In corrispondenza del codone di inizio
MACROMOLECOLE. Polimeri (lipidi a parte)
 MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
Caratteristiche generali
 AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
AMMINOACIDI Gli amminoacidi sono le unità costruttive (building blocks) delle proteine. Come dice il termine, gli amminoacidi naturali sono costituiti da un gruppo amminico (-NH 2 ) e da un gruppo carbossilico
dieta vengono convertiti in composti dei corpi chetonici.
 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
REGOLAZIONE DEL CICLO CELLULARE
 REGOLAZIONE DEL CICLO CELLULARE Il sistema di controllo che regola la progressione del ciclo cellulare deve: 1) Garantire che tutti i processi associati con le diverse fasi siano portati a termine al tempo
REGOLAZIONE DEL CICLO CELLULARE Il sistema di controllo che regola la progressione del ciclo cellulare deve: 1) Garantire che tutti i processi associati con le diverse fasi siano portati a termine al tempo
Chimica Biologica A.A α-elica foglietto β reverse turn
 Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
Chimica Biologica A.A. 2010-2011 α-elica foglietto β reverse turn Str. Secondaria sperimentalmente osservata: Si distinguono fondamentalmente tre tipi di strutture secondarie: α elica foglietto β reverse
TOSSINE BATTERICHE I
 Prof. Giorgio Sartor TSSIE BATTEICE I Copyright 2001-2017 by Giorgio Sartor. All rights reserved. Versione 0.2.3 Mar-17 Patologie alimentari Intossicazioni Infezioni Avvelenamento chimico Intossicazioni
Prof. Giorgio Sartor TSSIE BATTEICE I Copyright 2001-2017 by Giorgio Sartor. All rights reserved. Versione 0.2.3 Mar-17 Patologie alimentari Intossicazioni Infezioni Avvelenamento chimico Intossicazioni
FATTORI DI CRESCITA COME MESSAGGERI
 RECETTORI ASSOCIATI A PROTEINE CHINASI Sono proteine che hanno sia funzione di recettore che attività enzimatica chinasica. L interazione con il ligando specifico stimola l attività della chinasi e il
RECETTORI ASSOCIATI A PROTEINE CHINASI Sono proteine che hanno sia funzione di recettore che attività enzimatica chinasica. L interazione con il ligando specifico stimola l attività della chinasi e il
Macromolecole Biologiche. La struttura secondaria (III)
 La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
La struttura secondaria (III) Reverse turn Le proteine globulari hanno una forma compatta, dovuta a numerose inversioni della direzione della catena polipeptidica che le compone. Molte di queste inversioni
MIOSINA. Motori molecolari. II Strutture per il movimento Miosina, Kinesina e Dineina. Una struttura per il movimento. Prof.
 Prof. Giorgio Sartor Motori molecolari II Strutture per il movimento Miosina, Kinesina e Dineina Copyright 2001-2013 by Giorgio Sartor. All rights reserved. P02 - Versione 2.0 oct 2013 MIOSINA Una struttura
Prof. Giorgio Sartor Motori molecolari II Strutture per il movimento Miosina, Kinesina e Dineina Copyright 2001-2013 by Giorgio Sartor. All rights reserved. P02 - Versione 2.0 oct 2013 MIOSINA Una struttura
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Prof. Giorgio Sartor. Le proteine PROTEINE POLISACCARIDI LIPIDI. ADP + Pi. ADP + Pi ATP ATP. Aminoacidi Esosi; Pentosi Ac. Grassi; Glicerolo.
 rof. Giorgio Sartor Le proteine Copyright 2001-2008 by Giorgio Sartor. All rights reserved. L02 - Versione 1.2.1 nov 2008 RTEIE LISACCARIDI LIIDI Aminoacidi Esosi; entosi Ac. Grassi; Glicerolo I FASE IDRLITICA
rof. Giorgio Sartor Le proteine Copyright 2001-2008 by Giorgio Sartor. All rights reserved. L02 - Versione 1.2.1 nov 2008 RTEIE LISACCARIDI LIIDI Aminoacidi Esosi; entosi Ac. Grassi; Glicerolo I FASE IDRLITICA
Proteine strutturali Sostegno meccanico Cheratina: costituisce i capelli Collagene: costituisce le cartilagini Proteine di immagazzinamento
 Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Meccanismi effettori dei linfociti T citotossici
 Meccanismi effettori dei linfociti T citotossici Immunità specifica: caratteristiche generali Immunità umorale - Riconoscimento dell antigene mediante anticorpi - Rimozione patogeni e tossine extracellulari
Meccanismi effettori dei linfociti T citotossici Immunità specifica: caratteristiche generali Immunità umorale - Riconoscimento dell antigene mediante anticorpi - Rimozione patogeni e tossine extracellulari
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
PROTIDI: LE PROTEINE E GLI AMMINOACIDI
 PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
PROTIDI: LE PROTEINE E GLI AMMINOACIDI GLI AMMINOACIDI Struttura generica di un amminoacido. R rappresenta un gruppo laterale specifico di ogni amminoacido. In chimica, gli amminoacidi (impropriamente
REPLICAZIONE DEL DNA
 REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
REPLICAZIONE DEL DNA La replicazione (o anche duplicazione) è il meccanismo molecolare attraverso cui il DNA produce una copia di sé stesso. Ogni volta che una cellula si divide, infatti, l'intero genoma
I mammiferi sono privi dell enzima nitrogenasi, in grado di fissare l azoto atmosferico N2 NH3.
 Le proteine della dieta vengono scisse, nello stomaco e nell intestino, da diversi enzimi (pepsina, chimotripsina, carbossipeptidasi, elastasi) e i singoli amminoacidi sono assorbiti dalla parete intestinale.
Le proteine della dieta vengono scisse, nello stomaco e nell intestino, da diversi enzimi (pepsina, chimotripsina, carbossipeptidasi, elastasi) e i singoli amminoacidi sono assorbiti dalla parete intestinale.
Vittoria Patti MACROMOLECOLE BIOLOGICHE. 4. proteine
 Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Vittoria Patti MACROMOLECOLE BIOLOGICHE 4. proteine 1 Funzioni principali delle proteine funzione cosa significa esempi ENZIMATICA STRUTTURALE TRASPORTO MOVIMENTO DIFESA IMMUNITARIA ORMONALE catalizzare
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 5
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 5 Il legame peptidico Concetti chiave: In un polipeptide gli amminoacidi sono uniti dai legami peptidici. Il legame
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 5 Il legame peptidico Concetti chiave: In un polipeptide gli amminoacidi sono uniti dai legami peptidici. Il legame
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Scaricato da 21/01/2011
 Al contrario di quanto accade per glucidi e lipidi non esistono riserve di proteine. 1 2 Gli aa in eccesso non vengono messi in riserva ma utilizzati come combustibili metabolici. Non più del 10-15% dell
Al contrario di quanto accade per glucidi e lipidi non esistono riserve di proteine. 1 2 Gli aa in eccesso non vengono messi in riserva ma utilizzati come combustibili metabolici. Non più del 10-15% dell
Aminoacidi e proteine
 Prof. Giorgio Sartor Aminoacidi e proteine Copyright 2001-2012 by Giorgio Sartor. Versione 1.7.1 mar 2012 All rights reserved. Le cellule V.1.7.1 gsartor 2001-2012 Aminoacidi e proteine -2- Aminoacidi
Prof. Giorgio Sartor Aminoacidi e proteine Copyright 2001-2012 by Giorgio Sartor. Versione 1.7.1 mar 2012 All rights reserved. Le cellule V.1.7.1 gsartor 2001-2012 Aminoacidi e proteine -2- Aminoacidi
KINESINA. Motori molecolari. V Movimento Kinesina, Dineina su microtubuli. Prof. Giorgio Sartor. P05 - Versione 2.0 oct 2013
 Prof. Giorgio Sartor Motori molecolari V Movimento Kinesina, Dineina su microtubuli Copyright 2001-2013 by Giorgio Sartor. All rights reserved. P05 - Versione 2.0 oct 2013 KINESINA C-terminale (coda) Kinesina
Prof. Giorgio Sartor Motori molecolari V Movimento Kinesina, Dineina su microtubuli Copyright 2001-2013 by Giorgio Sartor. All rights reserved. P05 - Versione 2.0 oct 2013 KINESINA C-terminale (coda) Kinesina
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
Traduzione dell informazione genetica (1)
 Traduzione dell informazione genetica (1) 1 Traduzione dell informazione genetica (2) Il processo negli eucarioti richiede: 70 diverse proteine ribosomiali >20 enzimi che attivano i precursori degli amminoacidi
Traduzione dell informazione genetica (1) 1 Traduzione dell informazione genetica (2) Il processo negli eucarioti richiede: 70 diverse proteine ribosomiali >20 enzimi che attivano i precursori degli amminoacidi
amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente
 Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
Gli amminoacidi naturali sono α-amminoacidi : il gruppo amminico è legato all atomo di carbonio immediatamente adiacente al gruppo carbonilico e hanno la seguente formula generale: gruppo funzionale carbossilico
METABOLISMO DEGLI AMMINOACIDI
 PRINCIPI NUTRITIVI METABOLISMO DEGLI AMMINOACIDI Nel corso della digestione le proteine vengono degradate in amminoacidi. Contrariamente ai carboidrati, gli amminoacidi non vengono immagazzinati, ma vengono
PRINCIPI NUTRITIVI METABOLISMO DEGLI AMMINOACIDI Nel corso della digestione le proteine vengono degradate in amminoacidi. Contrariamente ai carboidrati, gli amminoacidi non vengono immagazzinati, ma vengono
Funzioni dei nucleotidi
 Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Le proteine. Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico.
 Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Seminario. Ciclo di Krebs 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A
 Seminario PASSO PER PASSO 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A Il ciclo dell acido citrico inizia con la reazione di condensazione di un unità con 4
Seminario PASSO PER PASSO 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A Il ciclo dell acido citrico inizia con la reazione di condensazione di un unità con 4
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
Esempi di funzioni svolte dalle proteine
 Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
Tirosin chinasi senza o con funzione recettoriale
 Tirosin chinasi senza o con funzione recettoriale elica di poliprolina Il dominio chinasico di Src è mantenuto nello stato inattivo mediante due distinte interazioni intramolecolari: il legame del dominio
Tirosin chinasi senza o con funzione recettoriale elica di poliprolina Il dominio chinasico di Src è mantenuto nello stato inattivo mediante due distinte interazioni intramolecolari: il legame del dominio
Digestione e assorbimento dei lipidi. β-ossidazione degli acidi grassi
 Digestione e assorbimento dei lipidi β-ossidazione degli acidi grassi I grassi della dieta sono assorbiti nell intestino tenue Il diametro della particella dei chilomicroni varia da circa 100 a circa 500
Digestione e assorbimento dei lipidi β-ossidazione degli acidi grassi I grassi della dieta sono assorbiti nell intestino tenue Il diametro della particella dei chilomicroni varia da circa 100 a circa 500
fornire energia chimica in vettori attivati ATP e NADH e NADPH e FADH.
 Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
Le cellule eucariotiche svolgono durante la loro vita una serie ordinata. Ciclo Cellulare
 Le cellule eucariotiche svolgono durante la loro vita una serie ordinata di eventi che costituiscono il Ciclo Cellulare Interfase comprende le fasi G 1, S, and G 2 Sintesi di macromolecole durante la
Le cellule eucariotiche svolgono durante la loro vita una serie ordinata di eventi che costituiscono il Ciclo Cellulare Interfase comprende le fasi G 1, S, and G 2 Sintesi di macromolecole durante la
AGR- VET 18 - IL PROSCIUTTO CRUDO
 AGR- VET 18 - IL PROSCIUTTO CRUDO docente Patrizia Cattaneo Bibliografia: C. Cantoni, S. d Aubert: Il prosciutto San Daniele. Eurocarni, Parti I, II, III: 1987, 5, 46-61; 6, 52-55; 7, 52-57 Prosciutto
AGR- VET 18 - IL PROSCIUTTO CRUDO docente Patrizia Cattaneo Bibliografia: C. Cantoni, S. d Aubert: Il prosciutto San Daniele. Eurocarni, Parti I, II, III: 1987, 5, 46-61; 6, 52-55; 7, 52-57 Prosciutto
I FLAGELLI NEI BATTERI
 Prof. Giorgio Sartor Motori molecolari VI Flagello batterico Copyright 2001-2013 by Giorgio Sartor. All rights reserved. P06 - Versione 2.0 oct 2013 I FLAGELLI NEI BATTERI Un diverso movimento Un diverso
Prof. Giorgio Sartor Motori molecolari VI Flagello batterico Copyright 2001-2013 by Giorgio Sartor. All rights reserved. P06 - Versione 2.0 oct 2013 I FLAGELLI NEI BATTERI Un diverso movimento Un diverso
DOGMA CENTRALE DELLA BIOLOGIA. Secondo il dogma centrale della biologia, il DNA dirige la. sintesi del RNA che a sua volta guida la sintesi delle
 DOGMA CENTRALE DELLA BIOLOGIA Secondo il dogma centrale della biologia, il DNA dirige la sintesi del RNA che a sua volta guida la sintesi delle proteine. Tuttavia il flusso unidirezionale di informazioni
DOGMA CENTRALE DELLA BIOLOGIA Secondo il dogma centrale della biologia, il DNA dirige la sintesi del RNA che a sua volta guida la sintesi delle proteine. Tuttavia il flusso unidirezionale di informazioni
Catabolismo di proteine
 Catabolismo di proteine Digestione di proteine dalla dieta Turn-over di proteine endogene Digiuno prolungato DIGESTIONE DI PROTEINE ESOGENE L organismo ricava la maggior parte degli aminoacidi di cui ha
Catabolismo di proteine Digestione di proteine dalla dieta Turn-over di proteine endogene Digiuno prolungato DIGESTIONE DI PROTEINE ESOGENE L organismo ricava la maggior parte degli aminoacidi di cui ha
Acido maleico anidride maleica acido ftalico andidride ftalica
 Le anidridi si ottengono per disidratazione da due molecole di acido (la reazione è particolarmente facile per ottenere anidridi cicliche) Acido maleico anidride maleica acido ftalico andidride ftalica
Le anidridi si ottengono per disidratazione da due molecole di acido (la reazione è particolarmente facile per ottenere anidridi cicliche) Acido maleico anidride maleica acido ftalico andidride ftalica
Degradazione degli acidi grassi
 Degradazione degli acidi grassi I grassi della dieta sono assorbiti nell intestino tenue Il diametro della particella dei chilomicroni varia da circa 100 a circa 500 nm. Mobilizzazione dei triacilgliceroli
Degradazione degli acidi grassi I grassi della dieta sono assorbiti nell intestino tenue Il diametro della particella dei chilomicroni varia da circa 100 a circa 500 nm. Mobilizzazione dei triacilgliceroli
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Riconoscimento dell antigene
 Riconoscimento dell antigene Risposta immune adattativa La risposta immune innata è molto efficiente ma non sempre riesce ad impedire il diffondersi dell infezione È essenziale quindi che subentri la risposta
Riconoscimento dell antigene Risposta immune adattativa La risposta immune innata è molto efficiente ma non sempre riesce ad impedire il diffondersi dell infezione È essenziale quindi che subentri la risposta
Svolgono funzioni biologiche di fondamentale importanza e possono essere divise in 7 gruppi principali:
 Svolgono funzioni biologiche di fondamentale importanza e possono essere divise in 7 gruppi principali: proteine strutturali (collagene, cheratine); proteine catalitiche (enzimi); proteine di trasporto
Svolgono funzioni biologiche di fondamentale importanza e possono essere divise in 7 gruppi principali: proteine strutturali (collagene, cheratine); proteine catalitiche (enzimi); proteine di trasporto
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Classe 3: idrolasi. Prof. G. Gilardi - Biological Chemistry
 Classe 3: idrolasi Le idrolasi in maggior parte o non hanno un gruppo prostetico o hanno solo un metallo di transizione( che destabilizza)? in tutti i casi: favorita l introduzione dell acqua come reagente.
Classe 3: idrolasi Le idrolasi in maggior parte o non hanno un gruppo prostetico o hanno solo un metallo di transizione( che destabilizza)? in tutti i casi: favorita l introduzione dell acqua come reagente.
REGOLAZIONE ENZIMATICA
 REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008. Eloise Mastrangelo
 Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008 Eloise Mastrangelo Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle
Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008 Eloise Mastrangelo Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle
I FLAGELLI NEI BATTERI
 Prof. Giorgio Sartor Motori molecolari V Flagello batterico Copyright 2001-2015 by Giorgio Sartor. All rights reserved. M09 - Versione 1.7 oct 2015 I FLAGELLI NEI BATTERI Un diverso movimento Un diverso
Prof. Giorgio Sartor Motori molecolari V Flagello batterico Copyright 2001-2015 by Giorgio Sartor. All rights reserved. M09 - Versione 1.7 oct 2015 I FLAGELLI NEI BATTERI Un diverso movimento Un diverso
SUBUNITA MAGGIORE = 60S (rrna 28S, 5.8S e 5S + 45 proteine) SUBUNITA MAGGIORE = 50S (rrna 23S e 5S + 34 proteine)
 TRADUZIONE I RIBOSOMI I Ribosomi hanno un diametro di circa 15-30 nm, sono costituiti da proteine ed rrna e sia nei Procarioti che negli Eucarioti, sono costituiti da una subunità maggiore e da una subunità
TRADUZIONE I RIBOSOMI I Ribosomi hanno un diametro di circa 15-30 nm, sono costituiti da proteine ed rrna e sia nei Procarioti che negli Eucarioti, sono costituiti da una subunità maggiore e da una subunità
all codons are used in protein synthesis 20 amino acids 3 termination (stop) codons: UAA, UAG, UGA
 Il Codice Genetico The genetic code consists of 64 triplet codons (A, G, C, U) 4 3 = 64 all codons are used in protein synthesis 20 amino acids 3 termination (stop) codons: UAA, UAG, UGA AUG (methionine)
Il Codice Genetico The genetic code consists of 64 triplet codons (A, G, C, U) 4 3 = 64 all codons are used in protein synthesis 20 amino acids 3 termination (stop) codons: UAA, UAG, UGA AUG (methionine)
CATABOLISMO AMMINOACIDI
 CATABOLISMO AMMINOACIDI 1 Catabolismo aminoacidi Digestione di proteone dalla dieta Turnover delle proteine Digiuno prolungato 2 Digestione delle proteine dalla dieta L organismo ricava la maggior parte
CATABOLISMO AMMINOACIDI 1 Catabolismo aminoacidi Digestione di proteone dalla dieta Turnover delle proteine Digiuno prolungato 2 Digestione delle proteine dalla dieta L organismo ricava la maggior parte
N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi
 Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Termodinamica ENTALPIA...6
 Termodinamica ORGANISMI PRIMO VIVENTI ED ENERGIA...2 PRINCIPIO DELLA TERMODINAMICA...5 ENTALPIA...6 SECONDO PRINCIPIO DELLA TERMODINAMICA... 7 energia libera di Gibbs (G)...9 Variazione di energia libera
Termodinamica ORGANISMI PRIMO VIVENTI ED ENERGIA...2 PRINCIPIO DELLA TERMODINAMICA...5 ENTALPIA...6 SECONDO PRINCIPIO DELLA TERMODINAMICA... 7 energia libera di Gibbs (G)...9 Variazione di energia libera
E. Giordano 16/09/2010
 GRUPPO NAZIONALE DI BIOINGEGNERIA XXIX Scuola Annuale BIOLOGIA SINTETICA Bressanone 13-17 settembre 2010 1/41 COSTITUENTI MOLECOLARI DELLO CHASSIS CELLULARE Emanuele GIORDANO II Facoltà di Ingegneria Dipartimento
GRUPPO NAZIONALE DI BIOINGEGNERIA XXIX Scuola Annuale BIOLOGIA SINTETICA Bressanone 13-17 settembre 2010 1/41 COSTITUENTI MOLECOLARI DELLO CHASSIS CELLULARE Emanuele GIORDANO II Facoltà di Ingegneria Dipartimento
I ribosomi liberi nel citoplasma sintetizzano le proteine destinate alla via citoplasmatica, cioè quelle destinate a:
 I ribosomi liberi nel citoplasma sintetizzano le proteine destinate alla via citoplasmatica, cioè quelle destinate a: filmato Rimanere nel citoplasma Essere trasportate dal citoplasma al nucleo Essere
I ribosomi liberi nel citoplasma sintetizzano le proteine destinate alla via citoplasmatica, cioè quelle destinate a: filmato Rimanere nel citoplasma Essere trasportate dal citoplasma al nucleo Essere
Biosintesi non ribosomiale di metaboliti peptidici bioattivi
 Biosintesi non ribosomiale di metaboliti peptidici bioattivi Strutture di alcuni peptidi bioattivi prodotti da batteri e funghi Come vengono prodotti questi peptidi? Hanno strutture complesse (spesso
Biosintesi non ribosomiale di metaboliti peptidici bioattivi Strutture di alcuni peptidi bioattivi prodotti da batteri e funghi Come vengono prodotti questi peptidi? Hanno strutture complesse (spesso
IL GRUPPO EME. PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici.
 IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE (b)
 Università di Roma Tor Vergata - Scienze della Nutrizione Umana Biochimica della Nutrizione Prof.ssa Luciana Avigliano 2011 PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE (b) PROTEINE Aminoacidi
Università di Roma Tor Vergata - Scienze della Nutrizione Umana Biochimica della Nutrizione Prof.ssa Luciana Avigliano 2011 PROTEINE ed AMMINOACIDI: RUOLO METABOLICO E NUTRIZIONALE (b) PROTEINE Aminoacidi
Fattori di crescita. Membrana citoplasmatica. Recettori di fattori di crescita. Proteine trasduttrici del segnale. Nucleo. Fattori trascrizionali
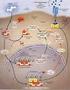 Fattori di crescita Recettori di fattori di crescita Membrana citoplasmatica roteine trasduttrici del segnale Nucleo Fattori trascrizionali roteine del ciclo cellulare Ciclo di divisione cellulare Fattori
Fattori di crescita Recettori di fattori di crescita Membrana citoplasmatica roteine trasduttrici del segnale Nucleo Fattori trascrizionali roteine del ciclo cellulare Ciclo di divisione cellulare Fattori
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( OO) nella stessa molecola 3 N 2 α * OO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-himica Organica 1 Amminoacidi
Glycogen Synthesis Glicogeno sintesi UTP UDP + 2 P i glycogen (n) + glucose-1-p glycogen (n + 1) Glycogen Phosphorylase P i Glicogeno lisi
 Glycogen Synthesis Glicogeno sintesi UTP UDP + 2 P i glycogen (n) + glucose-1-p glycogen (n + 1) Glycogen Phosphorylase P i Glicogeno lisi Se entrambe le vie fossero attive simultaneamente nella cellula
Glycogen Synthesis Glicogeno sintesi UTP UDP + 2 P i glycogen (n) + glucose-1-p glycogen (n + 1) Glycogen Phosphorylase P i Glicogeno lisi Se entrambe le vie fossero attive simultaneamente nella cellula
BIOCHIMICA APPLICATA e CLINICA
 BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
Struttura delle Proteine
 Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
Chimica Biologica A.A. 2010-2011 Struttura delle Proteine Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Struttura Proteine Proteine:
BETA OSSIDAZIONE DEGLI ACIDI GRASSI
 Mitocondri SEMINARIO BETA OSSIDAZIONE DEGLI ACIDI GRASSI http://oregonstate.edu/instruct/bb350/textmaterials/21/slide08.jpg 1 Acidi grassi [1] Sono le principali fonti di energia per alcuni tessuti (es.
Mitocondri SEMINARIO BETA OSSIDAZIONE DEGLI ACIDI GRASSI http://oregonstate.edu/instruct/bb350/textmaterials/21/slide08.jpg 1 Acidi grassi [1] Sono le principali fonti di energia per alcuni tessuti (es.
Smistamento delle proteine nella cellula
 SMISTAMENTO DELLE PROTEINE LE PROTEINE VENGONO SMISTATE A PEROSSISOMI, NUCLEO, MITOCONDRI E RE IN MODO INDIPENDENTE E AUTONOMO. DAL RE, INVECE, SI DIPARTE LA VIA DI SMISTAMENTO CHE PORTA LE PROTEINE A
SMISTAMENTO DELLE PROTEINE LE PROTEINE VENGONO SMISTATE A PEROSSISOMI, NUCLEO, MITOCONDRI E RE IN MODO INDIPENDENTE E AUTONOMO. DAL RE, INVECE, SI DIPARTE LA VIA DI SMISTAMENTO CHE PORTA LE PROTEINE A
CICLO DI KREBS (o DELL ACIDO CITRICO)
 CICLO DI KREBS (o DELL ACIDO CITRICO) È un processo ossidativo che ha un ruolo centrale nel metabolismo energetico delle cellule eucariotiche. Avviene nella matrice mitocondriale. È alimentato soprattutto
CICLO DI KREBS (o DELL ACIDO CITRICO) È un processo ossidativo che ha un ruolo centrale nel metabolismo energetico delle cellule eucariotiche. Avviene nella matrice mitocondriale. È alimentato soprattutto
IPOTESI UN GENE-UN ENZIMA
 IPOTESI UN GENE-UN ENZIMA DNA: contiene tutte le informazioni per definire lo sviluppo e la fisiologia della cellula: ma come svolge questa funzione? Beadle e Tatum (1941): studiando mutanti della comune
IPOTESI UN GENE-UN ENZIMA DNA: contiene tutte le informazioni per definire lo sviluppo e la fisiologia della cellula: ma come svolge questa funzione? Beadle e Tatum (1941): studiando mutanti della comune
Macromolecole Biologiche. La struttura secondaria (I)
 La struttura secondaria (I) La struttura secondaria Struttura primaria PRPLVALLDGRDETVEMPILKDVATVAFCDAQSTQEIHE Struttura secondaria La struttura secondaria Le strutture secondarie sono disposizioni regolari
La struttura secondaria (I) La struttura secondaria Struttura primaria PRPLVALLDGRDETVEMPILKDVATVAFCDAQSTQEIHE Struttura secondaria La struttura secondaria Le strutture secondarie sono disposizioni regolari
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
Complesso Maggiore di Istocompatibilita (MHC)
 Complesso Maggiore di Istocompatibilita (MHC) Scoperta dell MHC I geni dell MHC sono stati inizialmente identificati come responsabili del rapido rigetto dei tessuti trapiantati. I geni dell MHC sono polimorfi:
Complesso Maggiore di Istocompatibilita (MHC) Scoperta dell MHC I geni dell MHC sono stati inizialmente identificati come responsabili del rapido rigetto dei tessuti trapiantati. I geni dell MHC sono polimorfi:
