La demolizione delle proteine è fondamentale quanto la loro costruzione:
|
|
|
- Timoteo Calabrese
- 6 anni fa
- Visualizzazioni
Transcript
1
2 La demolizione delle proteine è fondamentale quanto la loro costruzione: la pepsina, la tripsina, insieme ad altri enzimi proteolitici, spezzettano le proteine complesse del cibo in amminoacidi, passaggio indispensabile per l assimilazione, che avviene nello stomaco e nell intestino. L eliminazione delle proteine è essenziale anche nel ciclo riproduttivo delle cellule, nella riparazione degli errori di copiatura del DNA e nelle reazioni del sistema immunitario che ci difendono dalle infezioni e dalle aggressioni dell ambiente. Anche in malattie come il cancro e la fibrosi cistica il ruolo dell ubiquitina è determinante. Errori nella demolizione di proteine alterate sono all origine di molte malattie, ed è per questo motivo che le scoperte compiute dai tre ricercatori premiati con il Nobel possono aprire la strada a nuovi farmaci, in grado di curarle alla radice.
3
4
5
6
7
8 In realtà l operazione è più complessa e richiede l intervento di tre enzimi. Il primo, chiamato E1, attiva la molecola di ubiquitina, e questa reazione richiede energia, liberata da una molecola di ATP. Il secondo enzima, E2, si lega all ubiquitina attivata e il terzo, E3, individua l oggetto da demolire. Il complesso ubiquitina-e2 aderisce strettamente alla proteina ed E3 rilascia la proteina marcata con l ubiquitina. L operazione si ripete finché si apre il proteosoma, cioè il tritatutto, che staccando l ubiquitina (che sarà di nuovo disponibile per il suo lavoro), smonterà la proteina pezzo a pezzo. Il meccanismo è stato chiarito da Rose, Ciechanover ed Hershko nel 1983 con esperimenti su topi transgenici.
9
10 Per alcune proteine gli chaperoni molecolari partecipano al processo di avvolgimento, questa classe di molecole : contribuiscono al corretto avvolgimento di una proteina nascente consentono alle proteine ripiegate in modo non corretto di raggiungere la conformazione nativa
11 Esistono due classi di chaperoni molecolari : la famiglia Hsp70 e le chaperonine (Hps60 o GroEL ed o Hsp10 GroES )
12
13 Le chaperonine sono costituite da due tipi di proteine HP60 (GroEL) e HP10 (GroES) GroEL 14 subunità identiche (549 aa) disposte in due anelli sovrapposti (7+7) GroES 7 subunità identiche (97aa) formano un anello eptamerico
14 L informazione per il folding della proteina è contenuta nella sequenza
15 Proteine denaturare al calore, con acidi, o chimici perdono la struttura terziaria e secondaria e la funzione biologica. Il processo è reversibile
16 Le chaperonine assistono le proteine nella fase di folding, prevenendo il legame con ligandi inappropriati.
17 Molte malattie sono dovute al difettoso ripiegamento di una proteina Alcune patologie derivano da proteine che non sono in grado di raggiungere la loro struttura funzionale e che tendono a formare grossi aggregati (fibrille o forme amiloidi): Alzheimer, Parkinson, encefalopatia spongiforme, diabete di tipo II. In altri casi mutazioni puntiformi generano proteine che non raggiungono la loro locazione finale o che non sono più in grado di svolgere la loro funzione perché incapaci di legare i loro substrati. La fibrosi cistica è un difetto nella proteina transmembrana che agisce come un canale degli ioni cloro nelle cellule epiteliali (CFTR: 1480 amminoacidi). La mutazione più comune è la delezione di un amminoacido (Phe 508) e la proteina mutata non si avvolge correttamente.
18 Proteine conformate in modo aberrante sono implicate nello sviluppo di patologie Una placca amiloide nella malattia di Alzheimer è un agglomerato di filamenti proteici
19 L omologia delle sequenze suggerisce relazioni funzionali ed evolutive tra le proteine
20 Comparazione sequenze Hum aglobina: Bovis: Pig: mvlspadktn vkaawgkvga hageygaeal mvlsaadkgn vkaawgkvgg haaeygaeal vlsaadkan vkaawgkvgg qagahgaeal ermflsfptt ktyfphfdls hgsaqvkghg kkvadaltna vahvddmpna ermflsfptt ktyfphfdls hgsaqvkghg akvaaaltka vehlddlpga ermflgfptt ktyfphfnls hgsdqvkahg kvadaltka vghlddlpga lsalsdlhah klrvdpvnfk llshcllvtl aahlpaeftp avhasldkfl lselsdlhah klrvdpvnfk llshsllvtl ashlpsdftp avhasldkfl lsalsdlhah klrvdpvnfk llshcllvtl aahhpddfnp svhasldkfl asvstvltsk yr anvstvltsk yr anvstvltsk yr
21 Degradazione Proteica Regolata Sistema autofagico lisosomiale Sistema Calpaina-Calpastatina Sistema Ubiquitina-Proteasoma
22
23 Il sistema proteolitico calpaina/calpastatina è espresso nel citosol di tutte le cellule di mammifero ed è costituito da uno o più membri della famiglia delle calpaine e da una o più forme dell'inibitore calpastatina. La famiglia della calpaine è costituita da circa 15 membri che hanno in comune una serie di proprietà catalitiche e regolatrici. Una delle caratteristiche comune a tutte le forme di calpaina è la suddivisione del dominio catalitico in due sottodomini.
24 Modificato da: La Stampa, 7 ottobre 2004 Il premio Nobel per la Chimica 2004 è stato attribuito ai tre ricercatori che più hanno contribuito alla scoperta della«catena di smontaggio» delle proteine: sono l americano Irwin Rose, Università della California, e gli israeliani Aaron Ciechanover e Avram Hershko, entrambi dell Institute of Technology di Haifa.
25 Il collagene (o collageno) è la principale proteina del tessuto connettivo negli animali. È la proteina più abbondante nei mammiferi (circa il 25% della massa proteica totale), rappresentando nell'uomo circa il 6% del peso corporeo. L'unità strutturale del collagene è rappresentata dal tropocollagene, proteina con una massa molecolare di circa 285 KD formata da tre catene polipeptidiche con andamento sinistrorso che si associano a formare una tripla elica destrorsa (trans di tipo - 2). Solitamente, per il collagene di tipo I, sono presenti due catene alfa 1 e una catena alfa 2. Tutte le unità di tropocollagene hanno la stessa lunghezza e la stessa ripetitività di amminoacidi, che si caratterizzano per una tripletta gly-pro-x, molto rappresentata nella sequenza delle singole catene alfa 1 e alfa2
26 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
27 glicina-prolina-x glicina-x-idrossiprolina dove X è un qualsiasi altro amminoacido. P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
28 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
29 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
30 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
31 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
32 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
33 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
34 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
35 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
36 Vit. C P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
37 a a a (vitc) P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
38 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
39
40
41
42
43
44
45 Idrossilazione di prolina P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
46 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
47 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
48 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
49 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
50 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
51 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
52 Il collagene ha una conformazione a tripla elica dx, la presenza della prolina è un fattore determinante per questa conformazione, le singole eliche sono stabilizzate da legami idrogeno. Resi possibili dalle glicine e dalle modifiche post-traduzionali di lisina e prolina. Entrambi questi amminoacidi subiscono un'idrossilazione (OH). La pro è modificata a HO-pro dall'enzima Prolil Idrossilasi; mentre la lisina è modificata a idrossilisina dall'enzima Lisil Idrossilasi, che inserisce il gruppo OH nella catena laterale della lisina. Entrambi gli enzimi agiscono in presenza del cofattore acido ascorbico e del co-substrato alfa-chetoglutarato. Queste modifiche sono necessarie per aumentare la possibilità di formazione dei legami H e per diminuire l'ingombro sterico. Le tre unità strutturali assumono una forma simile a una treccia. Le varie fibre sono legate da legami crociati tra due allisine o tra una lisina e un'allisina. La lisina è convertita in allisina dall'enzima Lisina Ossidasi, che inserisce al posto del gruppo amminico della catena laterale della lisina in corrispondenza dell'ultimo carbonio (carbonio epsilon) un gruppo aldeidico. Quando avviene il legame crociato si verifica una condensazione tra il gruppo amminico e il gruppo aldeidico che unisce le due catene con un legame imminico P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
53
54
55
56
57
58
59 Idrossilazione della lisina
60 La biosintesi del collagene avviene ad opera di diversi tipi cellulari (ad esempio fibroblasti nel tessuto connettivo, osteoblasti nell osso). I inizia con la trascrizione del gene o dei geni e la maturazione dell mrna. Sono presenti sequenze che codificano per lunghi peptidi in eccesso rispetto alle molecole di collagene mature, quindi il collagene nasce come procollagene, prodotto che possiede rispetto al collagene due telomeri, uno N-Terminale e uno C-Terminale, che hanno struttura globulare. La traduzione avviene a livello dei ribosomi a ridosso della parete del RER (reticolo endoplasmatico rugoso) e la catena nascente di procollagene subisce rimozione del peptide segnale e idrossilazione di specifici residui di prolina e lisina ad idrossiprolina e idrossilisina (ad opera di idrossilasi, con cofattore essenziale la vitamina C), con la produzione di catene alfa di procollagene. Tre di queste catene si avvolgono a formare una tripla elica, stabilizzata da legame a idrogeno tra amminoacidi idrossilati (legami crociati). Questa elica passa nell apparato del Golgi dove viene completata la glicosilazione e da qui, attraverso vescicole di secrezione la molecola viene secreta all esterno. All esterno della cellula la molecola subisce l azione di alcune procollageno peptidasi, che rimuovono i residui N-terminali e C-terminali trasformando il procollagene in tropocollageno 2 telomeri, uno N-terminale e uno C-terminale P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
61 Le molecole di tropocollagene si dispongono in file parallele a formare fibrille. Le fibrille infine possono disporsi in fasci ondulati o paralleli per formare fibre e le fibre possono formare fasci di fibre. P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
62 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
63 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
64 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
65 Più di 1000 mutazioni nei 22 geni che cod. per il collageno e la sua sintesi, sono causa di molte patologie. La sindrome di Ehlers-Danlos (EDS) si origina da: Carenza di lisil/prolil idrossilasi o carenza di procoll. peptidasi, o da mutazioni puntiformi della sequenza aminoacidica. Mutazioni del collageno di tipo III, importante componente delle arterie, è causa di disturbi vascolari potenzialmente letali. Si associa anche a lassità della cute, oltre che articolare. P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
66 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
67 Osteogenesi imperfetta (OI) o sindrome delle ossa di vetro, comprende un gruppo eterogeneo di patologie ereditarie. Tipo I, OI tardiva, si manifesta nella prima infanzia con fratture secondarie a traumi di minore entità, si può ipotizzare se l ecografia prenatale mostra incurvature o fratture nelle ossa lunghe. OI di tipo II o congenita, I pazienti muoiono prima della nascita o subito dopo il parto per insufficienza respiratoria P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
68 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
69 ELASTINA L'elastina è una proteina costituente il tessuto connettivo che è elastica e permette a molti tessuti dell'organismo di tornare alla loro forma originaria dopo essere stati sottoposti a forze di stiramento o di contrazione. L'elastina è un costituente fondamentale della pelle, conferendole la caratteristica risposta elastica quando il tessuto è sottoposto a tensioni meccaniche. Il locus è Chr. 7 q , P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
70 Composizione L'elastina è principalmente composta dagli amminoacidi glicina, valina, alanina e prolina. Strutturalmente è formata da molte molecole di tropoelastina (ad alfa-elica), idrosolubile e con massa molecolare di circa dalton, legate da legame covalente formatosi in seguito a reazione catalizzata da lisil ossidasi. Il prodotto finale consiste in un voluminoso composto insolubile con resistenti legami crociati di lisina. Desmosina e isodesmosina sono proteine entrambe riscontrate nell'elastina. P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
71 Localizzazione L'elastina svolge un ruolo importante nelle arterie ed è particolarmente abbondante nei grandi vasi sanguigni come l aorta. È anche un costituente strutturale molto importante dei polmoni, dei legamenti, della pelle, della vescica e della cartilagine. P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
72 L Elastina è un polimero insolubile formato da tropoelastina, una proteina lineare di 700aa., prevalentemente piccoli e apolari (gly, ala, val). Inoltre presenta pro, e lys, ma solo tracce di HyPro e manca di HYLYs. La tropoelastina viene secreta dalle cellule nello spazio extracellulare dove interagisce con una glicoproteina, la fibrillina, che ha funzione di impalcatura. Le lys di tre catene di tropoelastina vengono deaminate (D. Ossidativa) e le allisine di 3 catene di tropoelastina contigue con una lys, non modificata formano un legame crociato di desmosina P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
73 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
74 Sindrome di Marfan dovuta ad una elastina sbagliata: Le cause: La MFS è una malattia genetica, dovuta all alterazione di un gene. All inizio degli anni 90, è stato identificato sul cromosoma 15 il difetto genetico che causa la MFS. Si tratta di alterazioni (mutazioni) del gene della fibrillina-1 (FBN1). La fibrillina-1 è una grossa glicoproteina, che costituisce una componente importante delle fibre elastiche presenti nel tessuto connettivo. Le mutazioni che causano la MFS, e quindi una fibrillina-1 difettosa, sono numerose: a tutt oggi sono note circa 500 diverse mutazioni del gene FBN1 e questo rende particolarmente difficile effettuare una diagnosi genetica per identificare la presenza di una mutazione. Mutazioni nel gene della fibrillina-1 sono responsabili anche di altre malattie come la lussazione isolata familiare del cristallino e, in parte, dell aneurisma aortico-toracico familiare, mentre un altro gene della fibrillina, localizzato sul cromosoma 5, è associato alla Sindrome di Beals. Disturbi cardiovascolari. I disturbi più severi riguardano il sistema cardiovascolare. Il problema maggiore è costituito dalla dilatazione dell aorta Disturbi dell apparato scheletrico. Le persone affette da MFS hanno un aspetto dinoccolato e longilineo, con arti e mani lunghe e sottili. Le articolazioni sono lasse, con lussazioni spesso ricorrenti. Spesso è presente piede piatto. Si possono avere anche deformità della gabbia toracica come il petto carenato (sterno all infuori) e il petto escavato (sterno verso l interno), e problemi alla spina dorsale come scoliosi e lordosi di gravità variabile. Un altro difetto frequente è la miopia. P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
75 P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
76 L antitripsina a (a1-at), prodotta da fegato, ma anche monociti e macrofagi alveolari impedisce la degradazione dell elastina nelle pareti alveolari. Una a 1-AT difettosa può causare enfisema. Dal 2 al 5% dei pazienti affetti da enfisema negli USA, c è una predisposizione genetica per difetto del gene per a1- antitripsina. P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006
Scaricato da
 1 2 3 4 www.sunhope.it 1 Sinistrorsa destrorso 5 6 7 8 www.sunhope.it 2 9 10 11 12 www.sunhope.it 3 13 14 15 16 www.sunhope.it 4 17 18 19 20 www.sunhope.it 5 Idrossilazione della lisina 21 22 23 24 www.sunhope.it
1 2 3 4 www.sunhope.it 1 Sinistrorsa destrorso 5 6 7 8 www.sunhope.it 2 9 10 11 12 www.sunhope.it 3 13 14 15 16 www.sunhope.it 4 17 18 19 20 www.sunhope.it 5 Idrossilazione della lisina 21 22 23 24 www.sunhope.it
Collagene, Emoglobina e
 Collagene, Emoglobina e Mioglobina WWW.SUNHOPE.IT Vit. C WWW.SUNHOPE.IT a a a (vitc) WWW.SUNHOPE.IT Idrossilazione di prolina Per garantire la privacy, è stato impedito il download
Collagene, Emoglobina e Mioglobina WWW.SUNHOPE.IT Vit. C WWW.SUNHOPE.IT a a a (vitc) WWW.SUNHOPE.IT Idrossilazione di prolina Per garantire la privacy, è stato impedito il download
Sinistrorsa. destrorso
 Sinistrorsa destrorso Collageno Glicoproteina insolubile del tessuto connettivo, tendini, denti, cartilagine, matrice organica, osso, cornea L unità strutturale del collageno è il TROPOCOLLAGENO costituito
Sinistrorsa destrorso Collageno Glicoproteina insolubile del tessuto connettivo, tendini, denti, cartilagine, matrice organica, osso, cornea L unità strutturale del collageno è il TROPOCOLLAGENO costituito
Riepilogo di Emoglobina, collagene, elastina e antitripsina
 Riepilogo di Emoglobina, collagene, elastina e antitripsina Vi sono altri fattori che possono influire sulla capacità dell emoglobina di legarsi all ossigeno, uno di questi è la concentrazione di
Riepilogo di Emoglobina, collagene, elastina e antitripsina Vi sono altri fattori che possono influire sulla capacità dell emoglobina di legarsi all ossigeno, uno di questi è la concentrazione di
Sinistrorsa. destrorso
 Sinistrorsa destrorso P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006 Collageno Glicoproteina insolubile del tessuto connettivo, tendini, denti,
Sinistrorsa destrorso P. Champe, R. Harvey, D. R. Ferrier, LE BASI DELLA BIOCHIMICA, Zanichelli Editore S.p.A. Copyright 2006 Collageno Glicoproteina insolubile del tessuto connettivo, tendini, denti,
su uno stesso piano, a 0
 2 lezione Gli angoli e variano da 180 (+ o -) quando i piani della proteina sono allineati su uno stesso piano, a 0 L asse di legame C -C può compiere una rotazione completa da -180 a 0 ( ) Quando gli
2 lezione Gli angoli e variano da 180 (+ o -) quando i piani della proteina sono allineati su uno stesso piano, a 0 L asse di legame C -C può compiere una rotazione completa da -180 a 0 ( ) Quando gli
SOSTEGNO proteine strutturali (collagene, cheratina, elastina, fibroina) CATALISI (enzimi)
 PROTEINE STRUTTURA E FUNZIONE DELLE PROTEINE Forma e funzione Stretta correlazione fra forma e funzione delle proteine È la conformazione tridimensionale che conferisce alla proteina l'attività biologica
PROTEINE STRUTTURA E FUNZIONE DELLE PROTEINE Forma e funzione Stretta correlazione fra forma e funzione delle proteine È la conformazione tridimensionale che conferisce alla proteina l'attività biologica
La struttura quaternaria della deossiemoglobina prende il nome di : forma T (tesa) mentre quella della ossiemoglobina viene chiamata forma R
 La struttura quaternaria della deossiemoglobina prende il nome di : forma T (tesa) mentre quella della ossiemoglobina viene chiamata forma R (rilasciata); nello stato teso vi sono una serie di interazioni
La struttura quaternaria della deossiemoglobina prende il nome di : forma T (tesa) mentre quella della ossiemoglobina viene chiamata forma R (rilasciata); nello stato teso vi sono una serie di interazioni
IL COLLAGENO. E la specie proteica più abbondante nella maggior parte dei vertebrati, in tutti gli organi è presente la molecola di collageno.
 IL COLLAGENO E la specie proteica più abbondante nella maggior parte dei vertebrati, in tutti gli organi è presente la molecola di collageno. Fibre di collageno formano la matrice dell osso su cui precipitano
IL COLLAGENO E la specie proteica più abbondante nella maggior parte dei vertebrati, in tutti gli organi è presente la molecola di collageno. Fibre di collageno formano la matrice dell osso su cui precipitano
Riepilogo 1^ lezione
 Riepilogo 1^ lezione I 20 amminoacidi che si trovano comunemente nelle proteine sono uniti l uno all altro da legami peptidici. La sequenza lineare degli amminoacidi legati contiene l informazione necessaria
Riepilogo 1^ lezione I 20 amminoacidi che si trovano comunemente nelle proteine sono uniti l uno all altro da legami peptidici. La sequenza lineare degli amminoacidi legati contiene l informazione necessaria
RUOLI BIOLOGICI DELLE PROTEINE. Biochimica
 RUOLI BIOLOGICI DELLE PROTEINE Biochimica Il collagene una proteina strutturale Il collagene è un componente principale di tessuti quali la pelle, i capelli, i tendini, le ossa, il cartilagine, i vasi
RUOLI BIOLOGICI DELLE PROTEINE Biochimica Il collagene una proteina strutturale Il collagene è un componente principale di tessuti quali la pelle, i capelli, i tendini, le ossa, il cartilagine, i vasi
Polimorfismo genetico del collageno
 COLLAGENO È la proteina più abbondante del nostro corpo costituendo il 25% delle proteine totali. È la proteina principale dei tessuti connettivi, la cui matrice extracellulare contiene anche: -proteoglicani
COLLAGENO È la proteina più abbondante del nostro corpo costituendo il 25% delle proteine totali. È la proteina principale dei tessuti connettivi, la cui matrice extracellulare contiene anche: -proteoglicani
 COMPOSIZIONE: - Semplici - Coniugate: Apolipoproteine Glicoproteine Nucleoproteine Metalloproteine Cromoproteine STRUTTURA: - Fibrose forma molecolare allungata struttura II - Globulari: forma molecolare
COMPOSIZIONE: - Semplici - Coniugate: Apolipoproteine Glicoproteine Nucleoproteine Metalloproteine Cromoproteine STRUTTURA: - Fibrose forma molecolare allungata struttura II - Globulari: forma molecolare
LE PROTEINE DEL CONNETTIVO: IL COLLAGENO, L ELASTINA.
 UNITÀ BIOTEC. DIDATTICA DI BIOCHIMICA GENERALE LE PROTEINE DEL CONNETTIVO: IL COLLAGENO, L ELASTINA. Roberto Giacominelli Stuffler IL COLLAGENO 2 IL COLLAGENO E una famiglia di proteine fibrose con ruolo
UNITÀ BIOTEC. DIDATTICA DI BIOCHIMICA GENERALE LE PROTEINE DEL CONNETTIVO: IL COLLAGENO, L ELASTINA. Roberto Giacominelli Stuffler IL COLLAGENO 2 IL COLLAGENO E una famiglia di proteine fibrose con ruolo
CORSO MONODISCIPLINARE DI BIOCHIMICA (6 CFU)
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE DI BIOCHIMICA (6 CFU) Roberto Giacominelli Stuffler IL CORSO MONODISCIPLINARE DI BIOCHIMICA È SUDDIVISO IN DUE UNITÀ
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE DI BIOCHIMICA (6 CFU) Roberto Giacominelli Stuffler IL CORSO MONODISCIPLINARE DI BIOCHIMICA È SUDDIVISO IN DUE UNITÀ
L'importanza dei legami crociati dovuti alla lisil ossidasi. - è somministrato l'inibitore β-aminopropionitrile.
 L'importanza dei legami crociati dovuti alla lisil ossidasi è dimostrata da studi su animali a cui: - non è fornito con la dieta il Cu 2+ o - è somministrato l'inibitore β-aminopropionitrile. Le conseguenze
L'importanza dei legami crociati dovuti alla lisil ossidasi è dimostrata da studi su animali a cui: - non è fornito con la dieta il Cu 2+ o - è somministrato l'inibitore β-aminopropionitrile. Le conseguenze
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi. Possono assumere forme diverse a seconda della funzione
 Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
I ribosomi liberi nel citoplasma sintetizzano le proteine destinate alla via citoplasmatica, cioè quelle destinate a:
 I ribosomi liberi nel citoplasma sintetizzano le proteine destinate alla via citoplasmatica, cioè quelle destinate a: filmato Rimanere nel citoplasma Essere trasportate dal citoplasma al nucleo Essere
I ribosomi liberi nel citoplasma sintetizzano le proteine destinate alla via citoplasmatica, cioè quelle destinate a: filmato Rimanere nel citoplasma Essere trasportate dal citoplasma al nucleo Essere
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE Forma e funzione Stretta correlazione fra forma e funzione delle proteine È la conformazione tridimensionale che conferisce alla proteina l'attività biologica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE Forma e funzione Stretta correlazione fra forma e funzione delle proteine È la conformazione tridimensionale che conferisce alla proteina l'attività biologica
L organizzazione sfalsata dà origine alla tipica striatura di una fibrilla vista al ME in colorazione negativa.
 Le unità di tropocollageno si dispongono testa-coda su file parallele, sfalsandosi di circa 1/4 della loro lunghezza (60-70 nm). In ciascuna fila le unità sono separate da spazi di 35-40 nm, che nell osso
Le unità di tropocollageno si dispongono testa-coda su file parallele, sfalsandosi di circa 1/4 della loro lunghezza (60-70 nm). In ciascuna fila le unità sono separate da spazi di 35-40 nm, che nell osso
La struttura delle proteine
 La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
La struttura delle proteine Funzioni delle proteine Strutturali Contrattili Trasporto Riserva Ormonali Enzimatiche Protezione Struttura della proteina Struttura secondaria: ripiegamento locale della catena
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
Funzioni delle proteine
 Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
La caratteristica fondamentale del tessuto connettivo è quella di essere costituito da cellule e sostanza intercellulare
 generalità La caratteristica fondamentale del tessuto connettivo è quella di essere costituito da cellule e sostanza intercellulare La sostanza intercellulare a sua volta è costituita da fibre e sostanza
generalità La caratteristica fondamentale del tessuto connettivo è quella di essere costituito da cellule e sostanza intercellulare La sostanza intercellulare a sua volta è costituita da fibre e sostanza
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
Il Collageno tessuto connettivo
 Il Collageno Costituente del tessuto connettivo, insieme a elastina, fibrillina e proteoglicani, tutti prodotti da fibroblasti, condroblasti, osteoblasti La proteina + abbondante nei mammiferi (25% del
Il Collageno Costituente del tessuto connettivo, insieme a elastina, fibrillina e proteoglicani, tutti prodotti da fibroblasti, condroblasti, osteoblasti La proteina + abbondante nei mammiferi (25% del
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
STRUTTURA TERZIARIA. H 3 N + COO - β-foglietto
 STRUTTURA TERZIARIA α-eliche H 3 N + COO - β-foglietto La catena polipeptidica delle proteine GLOBULARI oltre ad organizzarsi in strutture di tipo secondario va incontro ad un ulteriore ripiegamento sino
STRUTTURA TERZIARIA α-eliche H 3 N + COO - β-foglietto La catena polipeptidica delle proteine GLOBULARI oltre ad organizzarsi in strutture di tipo secondario va incontro ad un ulteriore ripiegamento sino
α-cheratine (α-elica) collageni e cheratine β-cheratine (conformazione β) M.N. Gadaleta
 Per la scoperta delle conformazioni più comuni delle catene polipeptidiche cioè α-elica e β-conformazione è stato particolarmente importante lo studio delle cheratine, proteine fibrose, e l analisi della
Per la scoperta delle conformazioni più comuni delle catene polipeptidiche cioè α-elica e β-conformazione è stato particolarmente importante lo studio delle cheratine, proteine fibrose, e l analisi della
Modificazioni delle proteine
 Modificazioni delle proteine POST-TRADUZIONALI = avvengono dopo la sintesi proteica CO-TRADUZIONALI = avvengono durante la sintesi proteica Sono modificazioni chimiche della catena polipeptidica ad opera,
Modificazioni delle proteine POST-TRADUZIONALI = avvengono dopo la sintesi proteica CO-TRADUZIONALI = avvengono durante la sintesi proteica Sono modificazioni chimiche della catena polipeptidica ad opera,
 TESSUTO CONNETTIVO PROPRIAMENTE DETTO CELLULE + SOSTANZA INTERCELLULARE CELLULE Fibroblasti: secernono tutti i componenti dellasostanzaintercellulare. Fusati o stellati Cellule provenienti dal sangue:
TESSUTO CONNETTIVO PROPRIAMENTE DETTO CELLULE + SOSTANZA INTERCELLULARE CELLULE Fibroblasti: secernono tutti i componenti dellasostanzaintercellulare. Fusati o stellati Cellule provenienti dal sangue:
PROTEINE DEFINIZIONE:
 Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
Cap.4 Le PROTEINE DEFINIZIONE: Macromolecole formate di AA della serie L uniti tra loro da un legame peptidico. FUNZIONI DELLE PROTEINE Enzimi Proteine di riconoscimento Proteine di trasporto Proteine
ECM matrice extra-cellulare
 ECM matrice extra-cellulare I tessuti biologici possono essere considerati come materiali compositi costituiti da un numero variabile di cellule legate ad una sostanza complessa denominata matrice extracellulare
ECM matrice extra-cellulare I tessuti biologici possono essere considerati come materiali compositi costituiti da un numero variabile di cellule legate ad una sostanza complessa denominata matrice extracellulare
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
30/10/2015. Molte proteine sono. intrinsecamente disordinate. o destrutturate (IDP/IUP), cioè non hanno una struttura
 Molte proteine sono intrinsecamente disordinate o destrutturate (IDP/IUP), cioè non hanno una struttura terziaria e/o secondaria stabile. Le IUP sono caratterizzate da - scarso contenuto in aa apolari,
Molte proteine sono intrinsecamente disordinate o destrutturate (IDP/IUP), cioè non hanno una struttura terziaria e/o secondaria stabile. Le IUP sono caratterizzate da - scarso contenuto in aa apolari,
Jay Phelan, Maria Cristina Pignocchino. Scopriamo la biologia
 Jay Phelan, Maria Cristina Pignocchino Scopriamo la biologia Capitolo 2 Le molecole della vita 3 1. Le classi delle biomolecole Le biomolecole sono composti organici formati da: catene di atomi di carbonio,
Jay Phelan, Maria Cristina Pignocchino Scopriamo la biologia Capitolo 2 Le molecole della vita 3 1. Le classi delle biomolecole Le biomolecole sono composti organici formati da: catene di atomi di carbonio,
Le macromolecole dei tessuti - 1
 Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
Le macromolecole dei tessuti - 1 Che cosa sono le proteine? Sono macromolecole complesse ad alta informazione Sono costituite da una o più catene polipeptidiche Ogni catena peptidica è composta da centinaia
Tessuto connettivo. Robbins & Cotran: Pathologic Basis of Disease
 Tessuto connettivo I maggiori componenti della Matrice extracellulare sono i COLLAGENI, i PROTEOGLICANI, le GLICOPROTEINE ADESIVE, l ELASTINA. Sia le cellule epiteliali che mesenchimali interagiscono con
Tessuto connettivo I maggiori componenti della Matrice extracellulare sono i COLLAGENI, i PROTEOGLICANI, le GLICOPROTEINE ADESIVE, l ELASTINA. Sia le cellule epiteliali che mesenchimali interagiscono con
scaricato da I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE
 Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
I PROTIDI ASPETTI GENERALI
 I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
La caratteristica fondamentale del tessuto connettivo è quella di essere costituito da cellule e sostanza intercellulare
 generalità La caratteristica fondamentale del tessuto connettivo è quella di essere costituito da cellule e sostanza intercellulare La sostanza intercellulare a sua volta è costituita da fibre e sostanza
generalità La caratteristica fondamentale del tessuto connettivo è quella di essere costituito da cellule e sostanza intercellulare La sostanza intercellulare a sua volta è costituita da fibre e sostanza
PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA
 PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA PROTEINE Una proteina è basilarmente una catena polipeptidica (che in termini chimici può anche essere definita
PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA PROTEINE Una proteina è basilarmente una catena polipeptidica (che in termini chimici può anche essere definita
Schemi delle lezioni 1
 Schemi delle lezioni 1 Detti anche proteine sono i composti organici maggiormente presenti nelle cellule, dato che costituiscono circa il 50% del loro peso secco. Nell uomo adulto rappresentano circa
Schemi delle lezioni 1 Detti anche proteine sono i composti organici maggiormente presenti nelle cellule, dato che costituiscono circa il 50% del loro peso secco. Nell uomo adulto rappresentano circa
Sintesi e maturazione del collageno
 Sintesi e maturazione del collageno Modifiche intracellulari - idrossilazione (RE) - glicosilazione (RE) - formazione dei ponti S-S (Golgi) - formazione della tripla elica (Golgi) GLICOSILAZIONE I due
Sintesi e maturazione del collageno Modifiche intracellulari - idrossilazione (RE) - glicosilazione (RE) - formazione dei ponti S-S (Golgi) - formazione della tripla elica (Golgi) GLICOSILAZIONE I due
Proprietà comuni. Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici
 Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Gli aminoacidi Proprietà comuni Il gruppo α-carbossilico b è un acido più forte del gruppo carbossilico degli acidi alifatici paragonabili Il gruppo α-aminico è un acido più forte (o una base più debole
Le proteine o protidi
 Le proteine o protidi A differenza di glucidi e lipidi (che di regola non contengono azoto), le proteine sono composti organici quaternari, che possiedono sempre atomi di azoto nella loro molecola (quasi
Le proteine o protidi A differenza di glucidi e lipidi (che di regola non contengono azoto), le proteine sono composti organici quaternari, che possiedono sempre atomi di azoto nella loro molecola (quasi
LE PROTEINE -struttura tridimensionale-
 LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
dominio strutturale dominio modulo
 Riepilogo 2^lezione DOMINI Si definisce dominio strutturale (o dominio o modulo) di una proteina: un'unità globulare o fibrosa formata da catene polipeptidiche ripiegate in più regioni compatte le quali
Riepilogo 2^lezione DOMINI Si definisce dominio strutturale (o dominio o modulo) di una proteina: un'unità globulare o fibrosa formata da catene polipeptidiche ripiegate in più regioni compatte le quali
LE PROTEINE SINTESI PROTEICA. funzione delle proteine nel nostro organismo
 LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
LE PTEIE Le proteine sono sostanze organiche presenti in tutte le cellule di tutti gli organismi viventi Le proteine sono costituite da,,,, (S) Struttura delle proteine Le proteine sono macromolecole (
Le proteine. Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico.
 Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Le proteine Sono polimeri di amminoacidi dispos$ in sequenza. Due amminoacidi si legano tra loro formando un legame pep-dico. Cur$s et al. Invito alla biologia.blu Zanichelli editore 2011 1 Struttura e
Formazione del legame peptidico:
 Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
Formazione del legame peptidico: Planare, ha una forza intermedia tra il legame semplice ed il legame doppio. 2^ lezione N R C C O O O + R N R C O C O O N R C C N C C O Ogni piano delle unità peptidiche
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Percorsi di chimica organica - Soluzioni degli esercizi del testo
 ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
ercorsi di chimica organica - Soluzioni degli esercizi del testo AITL 14 1. Il prefisso α negli α-amminoacidi sta ad indicare che il gruppo amminico, - 2, si trova sul carbonio alfa (carbonio legato al
I TESSUTI CONNETTIVI. Tessuti connettivi propriamente detti; Tessuto adiposo; Sangue; Tessuto cartilagineo; Tessuto osseo. A cura di Tiziano Baroni
 I TESSUTI CONNETTIVI 1) 2) 3) 4) 5) Tessuti connettivi propriamente detti; Tessuto adiposo; Sangue; Tessuto cartilagineo; Tessuto osseo A cura di Tiziano Baroni TESSUTI CONNETTIVI Gruppo di tessuti con
I TESSUTI CONNETTIVI 1) 2) 3) 4) 5) Tessuti connettivi propriamente detti; Tessuto adiposo; Sangue; Tessuto cartilagineo; Tessuto osseo A cura di Tiziano Baroni TESSUTI CONNETTIVI Gruppo di tessuti con
Le biomolecole si trovano negli organismi viventi
 Le biomolecole si trovano negli organismi viventi I viventi sono formati per la maggior parte da acqua e molecole, chiamate biomolecole. Le biomolecole sono sostanze contenenti carbonio. I composti del
Le biomolecole si trovano negli organismi viventi I viventi sono formati per la maggior parte da acqua e molecole, chiamate biomolecole. Le biomolecole sono sostanze contenenti carbonio. I composti del
COMPOSTI AZOTATI. derivanti dall ammoniaca AMMINE. desinenza -INA AMMIDE
 COMPOSTI AZOTATI derivanti dall ammoniaca AMMINE desinenza -INA AMMIDE ANCORA AMMIDI RISONANZA A M M I D I Il legame ammidico ha parziale carattere di doppio legame per la seguente risonanza: Ammidi H
COMPOSTI AZOTATI derivanti dall ammoniaca AMMINE desinenza -INA AMMIDE ANCORA AMMIDI RISONANZA A M M I D I Il legame ammidico ha parziale carattere di doppio legame per la seguente risonanza: Ammidi H
TRASCRIZIONE e TRADUZIONE
 TRASCRIZIONE e TRADUZIONE Trascrizione e traduzione Dogma centrale della biologia molecolare: processo con cui l informazione contenuta nel DNA dirige la sintesi delle proteine. Trascrizione Maturazione
TRASCRIZIONE e TRADUZIONE Trascrizione e traduzione Dogma centrale della biologia molecolare: processo con cui l informazione contenuta nel DNA dirige la sintesi delle proteine. Trascrizione Maturazione
Aminoacidi. Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α
 Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
Aminoacidi Gli α-aminoacidi sono molecole con almeno due gruppi funzionali legati al carbonio α 1 Isomeria ottica Tutti gli AA, esclusa la glicina, presentano almeno un atomo di carbonio asimmetrico, il
MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine. Solo per uso didattico, vietata la riproduzione, la diffusione o la vendita
 MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine MFN0366-A1 (I. Perroteau) -traduzione delle proteine trna Traduzione: mrna -------> proteine mrna MFN0366-A1 (I. Perroteau) -traduzione
MFN0366-A1 (I. Perroteau) -traduzione e indirizzamento delle proteine MFN0366-A1 (I. Perroteau) -traduzione delle proteine trna Traduzione: mrna -------> proteine mrna MFN0366-A1 (I. Perroteau) -traduzione
1. I nucleotidi sono i «mattoni» del DNA. I nucleotidi sono costituiti da una base azotata; uno zucchero; un gruppo fosfato.
 1. I nucleotidi sono i «mattoni» del DNA I nucleotidi sono costituiti da una base azotata; uno zucchero; un gruppo fosfato. 1. I nucleotidi sono i «mattoni» del DNA Le basi azotate, che sono adenina, timina,
1. I nucleotidi sono i «mattoni» del DNA I nucleotidi sono costituiti da una base azotata; uno zucchero; un gruppo fosfato. 1. I nucleotidi sono i «mattoni» del DNA Le basi azotate, che sono adenina, timina,
Corso di recupero Fisiologia cellulare/ Laboratorio di colture cellulari
 Corso di laurea magistrale in BIOTECNOLOGIE DELLA RIPRODUZIONE UNIVERSITA DEGLI STUDI DI TERAMO Corso di recupero Fisiologia cellulare/ Laboratorio di colture cellulari Prof.ssa Luisa Gioia Matrice ExtraCellulare
Corso di laurea magistrale in BIOTECNOLOGIE DELLA RIPRODUZIONE UNIVERSITA DEGLI STUDI DI TERAMO Corso di recupero Fisiologia cellulare/ Laboratorio di colture cellulari Prof.ssa Luisa Gioia Matrice ExtraCellulare
COMPARTIMENTI INTRACELLULARI
 COMPARTIMENTI INTRACELLULARI ogni organello è delimitato da una, o due membrane: ciascuna di esse è costituita da un doppio strato fosfolipidico con stessa struttura della membrana plasmatica ma composizione
COMPARTIMENTI INTRACELLULARI ogni organello è delimitato da una, o due membrane: ciascuna di esse è costituita da un doppio strato fosfolipidico con stessa struttura della membrana plasmatica ma composizione
Definizione Composti quaternari: C H O N S P Fe Mg I
 PROTIDI Definizione Composti quaternari: C H O N S P Fe Mg I ORIGINE cellulare ogni cellula sintetizza le sue prote CARATTERISTICHE insolubili in acqua sensibili a variazioni di ph coagulano in presenza
PROTIDI Definizione Composti quaternari: C H O N S P Fe Mg I ORIGINE cellulare ogni cellula sintetizza le sue prote CARATTERISTICHE insolubili in acqua sensibili a variazioni di ph coagulano in presenza
Le due subunità ribosomali sono formate nel nucleolo dall associazione tra rrna e proteine
 Le due subunità ribosomali sono formate nel nucleolo dall associazione tra rrna e proteine 5S 28S 18S 5.8S 60S 40S I poliribosomi Numerosi ribosomi possono legarsi in sequenza su una stessa molecola di
Le due subunità ribosomali sono formate nel nucleolo dall associazione tra rrna e proteine 5S 28S 18S 5.8S 60S 40S I poliribosomi Numerosi ribosomi possono legarsi in sequenza su una stessa molecola di
06_citologia_SER_golgi 1
 1 La sintesi proteica inizia sempre nello stesso modo: aggancio della piccola subunità ribosomale al estremità 5 dell mrna. si aggancio la grande subunità ribosomale In corrispondenza del codone di inizio
1 La sintesi proteica inizia sempre nello stesso modo: aggancio della piccola subunità ribosomale al estremità 5 dell mrna. si aggancio la grande subunità ribosomale In corrispondenza del codone di inizio
Il legame peptidico è polare
 Scaricato da Il legame peptidico è polare SONO FAVORITE QUELLE CONFIGURAZIONI CHE CONSENTONO IL MAGGIOR NUMERO DI INTERAZIONI TRA LE PARTI DELLA CATENA POLIPEPTIDICA. A CAUSA DELLA POLARITA' DEL LEGAME
Scaricato da Il legame peptidico è polare SONO FAVORITE QUELLE CONFIGURAZIONI CHE CONSENTONO IL MAGGIOR NUMERO DI INTERAZIONI TRA LE PARTI DELLA CATENA POLIPEPTIDICA. A CAUSA DELLA POLARITA' DEL LEGAME
Costituenti chimici della materia vivente
 Costituenti chimici della materia vivente Le macromolecole biologiche Macromolecole (dal greco macros = grande) biologiche. Classi di composti biologici multifunzionali: Polisaccaridi proteine acidi
Costituenti chimici della materia vivente Le macromolecole biologiche Macromolecole (dal greco macros = grande) biologiche. Classi di composti biologici multifunzionali: Polisaccaridi proteine acidi
Basi cellulari e molecolari della vita Prof. Dr. Stefano Martellucci
 Basi cellulari e molecolari della vita Prof. Dr. Stefano Martellucci Trascrizione e Traduzione dal gene alla proteina Trascrizione e Traduzione dal gene alla proteina La trascrizione e la traduzione avvengono
Basi cellulari e molecolari della vita Prof. Dr. Stefano Martellucci Trascrizione e Traduzione dal gene alla proteina Trascrizione e Traduzione dal gene alla proteina La trascrizione e la traduzione avvengono
TESSUTI CONNETTIVI. Gruppo di tessuti con caratteristiche comuni: Origine embrionale (mesoderma mesenchima)
 TESSUTI CONNETTIVI Gruppo di tessuti con caratteristiche comuni: Origine embrionale (mesoderma mesenchima) Organizzazione strutturale Funzioni: connessione di altri tessuti, fz. meccanica (sostegno), fz.
TESSUTI CONNETTIVI Gruppo di tessuti con caratteristiche comuni: Origine embrionale (mesoderma mesenchima) Organizzazione strutturale Funzioni: connessione di altri tessuti, fz. meccanica (sostegno), fz.
OLIGOMERICHE Sono costituite cioè da più catene polipeptidiche PROTOMERI O SUBUNITÀ
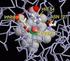 Scaricato da Le proteine con peso molecolare superiore a 50.000 sono OLIGOMERICHE Sono costituite cioè da più catene polipeptidiche PROTOMERI O SUBUNITÀ SunHope.it 1 Scaricato da Le proteine oligomeriche
Scaricato da Le proteine con peso molecolare superiore a 50.000 sono OLIGOMERICHE Sono costituite cioè da più catene polipeptidiche PROTOMERI O SUBUNITÀ SunHope.it 1 Scaricato da Le proteine oligomeriche
Il carbonio è l elemento di base delle biomolecole. Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici.
 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 1 Il carbonio deve acquistare quattro elettroni per essere stabile
Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti organici. 1 Il carbonio deve acquistare quattro elettroni per essere stabile
LE PROTEINE: POLIMERI COSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOACIDI
 LE PROTEINE: POLIMERI OSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOAIDI OGNI PROTEINA PUO ESSERE FORMATA DA MOLTE DEINE O ENTINAIA DI AMINOAIDI E SI LEGANO A FORMARE UNA ATENA NON RAMIFIATA La catena di
LE PROTEINE: POLIMERI OSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOAIDI OGNI PROTEINA PUO ESSERE FORMATA DA MOLTE DEINE O ENTINAIA DI AMINOAIDI E SI LEGANO A FORMARE UNA ATENA NON RAMIFIATA La catena di
COSTITUENTI DELLE PROTEINE: AMINOACIDI
 2^ lezione Proteine COSTITUENTI DELLE PROTEINE: AMINOACIDI Nell organismo umano ne sono presenti centinaia ma solo 20 nelle proteine. Per la sintesi di una proteina devono essere presenti tutti contemporaneamente.
2^ lezione Proteine COSTITUENTI DELLE PROTEINE: AMINOACIDI Nell organismo umano ne sono presenti centinaia ma solo 20 nelle proteine. Per la sintesi di una proteina devono essere presenti tutti contemporaneamente.
SOLUZIONI DEGLI ESERCIZI
 Dal carbonio agli OGM Biochimica e biotecnologie SOLUZIONI DEGLI ESERCIZI Capitolo 0 Il mondo del carbonio 1. b, e 2. d 3. 7 4. 5. 6. 7. a) Isomeria di posizione; b) i due composti non sono isomeri; c)
Dal carbonio agli OGM Biochimica e biotecnologie SOLUZIONI DEGLI ESERCIZI Capitolo 0 Il mondo del carbonio 1. b, e 2. d 3. 7 4. 5. 6. 7. a) Isomeria di posizione; b) i due composti non sono isomeri; c)
TESSUTI ANIMALI, MATRICE EXTRACELLULARE E GIUNZIONI CELLULARI MATRICE EXTRACELLULARE MATRICE EXTRACELLULARE COLLAGENI ED ELASTINA
 TESSUTI ANIMALI, MATRICE EXTRACELLULARE E GIUNZIONI CELLULARI CELLULE E TESSUTI Negli organismi pluricellulari, le cellule sono organizzate in tessuti. Nei vertebrati abbiamo 4 principali tessuti: epiteliale,
TESSUTI ANIMALI, MATRICE EXTRACELLULARE E GIUNZIONI CELLULARI CELLULE E TESSUTI Negli organismi pluricellulari, le cellule sono organizzate in tessuti. Nei vertebrati abbiamo 4 principali tessuti: epiteliale,
STRUTTURA TERZIARIA. H 3 N + COO - β-foglietto. La catena polipeptidica delle proteine globulari oltre ad organizzarsi in
 STRUTTURA TERZIARIA α-eliche H 3 N + COO - β-foglietto La catena polipeptidica delle proteine globulari oltre ad organizzarsi in strutture di tipo secondario va incontro ad un ulteriore RIPIEGAMENTO sino
STRUTTURA TERZIARIA α-eliche H 3 N + COO - β-foglietto La catena polipeptidica delle proteine globulari oltre ad organizzarsi in strutture di tipo secondario va incontro ad un ulteriore RIPIEGAMENTO sino
lati esterni altamente Idrofilici
 I due filamenti complementari del DNA sono antiparalleli: uno è in direzione 5-3 e l altro in direzione 3-5. parte interna idrofobica lati esterni altamente Idrofilici APPAIAMENTO DELLE BASI AZOTATE: 2
I due filamenti complementari del DNA sono antiparalleli: uno è in direzione 5-3 e l altro in direzione 3-5. parte interna idrofobica lati esterni altamente Idrofilici APPAIAMENTO DELLE BASI AZOTATE: 2
DNA E PROTEINE IL DNA E RACCHIUSO NEL NUCLEO, MENTRE LA SINTESI PROTEICA SI SVOLGE NEL CITOPLASMA: COME VIENE TRASPORTATA L INFORMAZIONE?
 DNA E PROTEINE NUMEROSI DATI SUGGERISCONO CHE IL DNA SVOLGA IL SUO RUOLO GENETICO CONTROLLANDO LA SINTESI DELLE PROTEINE, IN PARTICOLARE DETERMINANDONE LA SEQUENZA IN AMINOACIDI E NECESSARIO RISPONDERE
DNA E PROTEINE NUMEROSI DATI SUGGERISCONO CHE IL DNA SVOLGA IL SUO RUOLO GENETICO CONTROLLANDO LA SINTESI DELLE PROTEINE, IN PARTICOLARE DETERMINANDONE LA SEQUENZA IN AMINOACIDI E NECESSARIO RISPONDERE
Fisiologia cellulare e Laboratorio di Colture cellulari
 Corso di laurea BIOTECNOLOGIE UNIVERSITA DEGLI STUDI DI TERAMO Fisiologia cellulare e Laboratorio di Colture cellulari Prof.ssa Luisa Gioia Corso di laurea BIOTECNOLOGIE Fisiologia cellulare e Laboratorio
Corso di laurea BIOTECNOLOGIE UNIVERSITA DEGLI STUDI DI TERAMO Fisiologia cellulare e Laboratorio di Colture cellulari Prof.ssa Luisa Gioia Corso di laurea BIOTECNOLOGIE Fisiologia cellulare e Laboratorio
Difetti nei recettori delle proteine Ipercolesterolemia familiare - AD
 Difetti nei recettori delle proteine Ipercolesterolemia familiare - AD Mutazioni gene Recettore LDL molto comune (1:500) Placche ateromatose, cardiopatia, xantomi (depositi di colesterolo) Effetto di dosaggio
Difetti nei recettori delle proteine Ipercolesterolemia familiare - AD Mutazioni gene Recettore LDL molto comune (1:500) Placche ateromatose, cardiopatia, xantomi (depositi di colesterolo) Effetto di dosaggio
Immagini e concetti della biologia
 Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Marcatura con proteina citoplasmatica. GFP-lamin. Citologia Animale e Vegetale (corso A - I. Perroteau) - l involucro nucleare
 Citologia Animale e Vegetale (corso A - I. Perroteau) - l involucro nucleare Alla membrana interna è legata una fitta maglia incrociata chiamata lamina nucleare, composta da quattro tipi di lamina nucleare
Citologia Animale e Vegetale (corso A - I. Perroteau) - l involucro nucleare Alla membrana interna è legata una fitta maglia incrociata chiamata lamina nucleare, composta da quattro tipi di lamina nucleare
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
a differenza degli epiteli
 cellule molto più rade a differenza degli epiteli abbondante materiale extracellulare (matrice) presenza di vasi sanguigni I tessuti connettivi Gruppo di tessuti con caratteristiche comuni: Organizzazione
cellule molto più rade a differenza degli epiteli abbondante materiale extracellulare (matrice) presenza di vasi sanguigni I tessuti connettivi Gruppo di tessuti con caratteristiche comuni: Organizzazione
Formazione. di un peptide.
 Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
Formazione. di un peptide. Quando due aminoacidi si uniscono si forma un legame peptidico. In questo caso il dipeptide glicilalanina (Gly-Ala) viene mostrato come se si stesse formando in seguito a eliminazione
MFN0366-A1 (I. Perroteau) - Trascrizione. Solo per uso didattico, vietata la riproduzione, la diffusione o la vendita.
 MFN0366-A1 (I. Perroteau) - Trascrizione 09_bct_2011 1 MFN0366-A1 (I. Perroteau) - Trascrizione NUCLEOLO Molti nuclei, contengono una o più strutture estremamente dense chiamate nucleoli, che sono i siti
MFN0366-A1 (I. Perroteau) - Trascrizione 09_bct_2011 1 MFN0366-A1 (I. Perroteau) - Trascrizione NUCLEOLO Molti nuclei, contengono una o più strutture estremamente dense chiamate nucleoli, che sono i siti
Proteine strutturali Sostegno meccanico Cheratina: costituisce i capelli Collagene: costituisce le cartilagini Proteine di immagazzinamento
 Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Tipo Funzione Esempi Enzimi Accelerano le reazioni chimiche Saccarasi: posiziona il saccarosio in modo che possa essere scisso nelle due unità di glucosio e fruttosio che lo formano Ormoni Messaggeri chimici
Parametri dell α-elica. residui/giro 3.6. passo dell elica
 GRAFICO DI RAMACHANDRAN Parametri dell α-elica residui/giro 3.6 spazio/residuo passo dell elica 1.5 Å 5.4 Å 1 L α-elica può essere destabilizzata da interazioni tra i gruppi R: repulsione/attrazione elettrostatica
GRAFICO DI RAMACHANDRAN Parametri dell α-elica residui/giro 3.6 spazio/residuo passo dell elica 1.5 Å 5.4 Å 1 L α-elica può essere destabilizzata da interazioni tra i gruppi R: repulsione/attrazione elettrostatica
La fissazione dell azoto
 La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
LE PROTEINE SINTETIZZATE VENGONO SOTTOPOSTE AD UN CONTROLLO DI QUALITA
 LE PROTEINE SINTETIZZATE VENGONO SOTTOPOSTE AD UN CONTROLLO DI QUALITA LE PROTEINE CON STRUTTURA NON NATIVA VENGONO DEGRADATE ATTRAVERSO LA VIA UBIQUITINA- PROTEASOMA IL CONTROLLO DI QUALITA GARANTISCE
LE PROTEINE SINTETIZZATE VENGONO SOTTOPOSTE AD UN CONTROLLO DI QUALITA LE PROTEINE CON STRUTTURA NON NATIVA VENGONO DEGRADATE ATTRAVERSO LA VIA UBIQUITINA- PROTEASOMA IL CONTROLLO DI QUALITA GARANTISCE
PARTE A BIOLOGIA MOLECOLARE
 Percorso formativo disciplinare Disciplina: SCIENZE NATURALI CLASSE 3 Cm LICEO CLASSICO Anno scolastico 2016/2017 PARTE A BIOLOGIA MOLECOLARE UNITA 1 LA BIOLOGIA MOLECOLARE DEL GENE: TEMA n 1: la struttura
Percorso formativo disciplinare Disciplina: SCIENZE NATURALI CLASSE 3 Cm LICEO CLASSICO Anno scolastico 2016/2017 PARTE A BIOLOGIA MOLECOLARE UNITA 1 LA BIOLOGIA MOLECOLARE DEL GENE: TEMA n 1: la struttura
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) L atomo del carbonio (C).. C. Atomo tetravalente. C C C C Gli idrocarburi I legami del carbonio 109.5 gradi
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
TRAFFICO INTRACELLULARE E COMUNICAZIONE TRA LE CELLULE
 TRAFFICO INTRACELLULARE E COMUNICAZIONE TRA LE CELLULE Carboidrati proteine Glicolipide Regione ad α-elica di proteina transmembrana Acido grasso Doppio strato Fosfolipidico 5-8 nm Proteina integrale di
TRAFFICO INTRACELLULARE E COMUNICAZIONE TRA LE CELLULE Carboidrati proteine Glicolipide Regione ad α-elica di proteina transmembrana Acido grasso Doppio strato Fosfolipidico 5-8 nm Proteina integrale di
Dall RNA alle proteine. La traduzione nei procarioti e negli eucarioti
 Dall RNA alle proteine La traduzione nei procarioti e negli eucarioti Codice genetico La sequenza dell mrna viene decodificata a gruppi di tre nucleotidi, e tradotta in una sequenza di amminoacidi 4 x
Dall RNA alle proteine La traduzione nei procarioti e negli eucarioti Codice genetico La sequenza dell mrna viene decodificata a gruppi di tre nucleotidi, e tradotta in una sequenza di amminoacidi 4 x
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
Capitolo 3 Le biomolecole
 apitolo 3 Le biomolecole I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare quattro legami covalenti. Questi
apitolo 3 Le biomolecole I composti organici e i loro polimeri 3.1 La diversità molecolare della vita è basata sulle proprietà del carbonio Un atomo di carbonio può formare quattro legami covalenti. Questi
Le strutture extracellulari consistono principalmente di macromolecole secrete dalla cellula stessa. La natura chimica di queste molecole differisce
 Le strutture extracellulari consistono principalmente di macromolecole secrete dalla cellula stessa. La natura chimica di queste molecole differisce tra i vari organismi, ma le strutture extracellulari
Le strutture extracellulari consistono principalmente di macromolecole secrete dalla cellula stessa. La natura chimica di queste molecole differisce tra i vari organismi, ma le strutture extracellulari
