Ricerca clinica e conflitti di interesse
|
|
|
- Tommaso Colucci
- 5 anni fa
- Visualizzazioni
Transcript
1 Ricerca clinica e conflitti di interesse Il caso Avastin - Lucentis Il provvedimento dell Antitrust sull uso intravitreale nella Degenerazione Maculare senile ANNA MARIA MARATA 1-2, NICOLA MAGRINI 1 1 Area Valutazione del Farmaco, Agenzia Sociale e Sanitaria, Regione Emilia Romagna 2 Coordinatore Commissione Regionale farmaco Breve premessa farmacologica Bevacizumab (Avastin prodotto da Roche) e Ranibizumab (Lucentis prodotto da Novartis) sono due farmaci cosiddetti anti-vegf cioè che inibiscono la crescita di nuovi vasi sanguigni (l eccessiva proliferazione di vasi sanguigni si determina sia nelle neoplasie maligne sia nella degenerazione maculare legata all età: DMLE). Avastin è stato commercializzato negli Stati Uniti nel 2004 (in Italia nel 2005) per trattare il carcinoma del colon, ma già nel Luglio 2005 venivano comunicati i primi risultati positivi per l uso intravitreale nella DMLE. Lucentis è stato scoperto dalla stessa ditta che ha per prima isolato Avastin (Genentech) è in realtà costituito da una parte della molecola di Avastin ; è stato commercializzato in Italia nel La differenza fondamentale fra l uso di Avastin a scopo antitumorale rispetto all uso nella patologia oculistica sta nel fatto che nel primo caso il farmaco viene somministrato per via endovenosa a dosi elevate (da 5 a 15mg/ Kg ogni 2-3 settimane che per un paziente di 70kg significa mg ogni somministrazione) mentre nel secondo caso viene somministrato a livello endoculare in dosi molto piccole (1,25mg al mese per 3-6 mesi), dosaggi quindi per l occhio 500 volte inferiori e ciò giustifica differenze rilevanti di tossicità e rende l uso oculare sicuro e i rischi legati alla iniezione intravitreale comunque minimi se confrontati con l efficacia di questi farmaci. Le differenze farmacologiche fra l uso intravitreale di Avastin e Lucentis sono minime o assenti: lo dimostrano i numerosi studi clinici randomizzati (indipendenti, vale a dire finanziati con fondi pubblici) di confronto diretto (vale a dire che hanno confrontato i due farmaci testa a testa) in quanto tali confronti non sono stati fatti al momento della commercializzazione di Lucentis perché tale confronto non era di interesse commerciale per i produttori. I risultati dei numerosi studi pubblicati sono coerenti tra loro e dimostrano una sostanziale sovrapponibilità dei due farmaci in termini di efficacia e sicurezza. La cronistoria delle tappe principali che hanno caratterizzato i rapporti fra la Regione Emilia Romagna, la sua Commissione Regionale del Farmaco ed AIFA in merito all utilizzo di Bevacizumab intraoculare per il trattamento della degenerazione maculare legata all età (DMLE) è riportata integralmente sul sito Che cosa ha evidenziato (e sanzionato) l Antitrust Il caso Avastin - Lucentis, due farmaci per il trattamento di una malattia degenerativa della retina che può portare alla cecità, si è concluso con una multa di 182 milioni di euro a carico delle multinazionali Roche e Novartis per aver posto in essere accordi restrittivi della concorrenza, volti a limitare il consumo del farmaco meno costoso, restringere la libertà di scelta dei consumatori e condizionare il giudizio e la scelta terapeutica dei medici. Per gli addetti ai lavori sembra una quasi inevitabile piega del sistema di approvazione che consente al detentore di un brevetto di non chiedere la registrazione del proprio farmaco per una nuova indicazione (commercialmente poco attraente) e contemporaneamente a un altra industria (o come più tecnicamente afferma EMA quando ci si riferisce alle industrie farmaceutiche, il MAH, Marketing Authorization Holder, colui che detiene l autorizzazione all immissione in commercio) di svilupparlo in esclusiva garantendo in questo modo prezzi elevati e quindi enormi profitti. Ma quando le ditte si accordano, a danno del mercato, per una strategia comune di artificiosa differenziazione fra prodotti sostanzialmente sovrapponibili e per farlo utilizzano metodi censurabili quali creare per 52 Ricerca clinica e conflitti di interesse IsF - anno 38, n. 2, 2014
2 il farmaco meno costoso (Avastin ) un immagine di farmaco meno sicuro e rendere l arrivo dei risultati favorevoli alla sovrapponibilità dei due farmaci (studio CATT) un non-evento ecco che si lede il mercato e non si favorisce l accesso a trattamenti efficaci disponibili. Per quasi 5 anni il SSN non ha potuto utilizzare, seppur applicando le regole dell off-label, un farmaco efficace in quanto ne era disponibile un altro registrato per tale indicazione e ciò ha comportato il pagamento di un elevato differenziale di prezzo che attualmente è di 40 volte maggiore, ma che all inizio della commercializzazione era di oltre 70 volte superiore. Ciò è stato favorito dal fatto che in Italia la legislazione sull off-label già particolarmente rigida è stata ulteriormente complicata col famoso comma 796 lettera z della Finanziaria 2007 che impedisce l uso sistematico di un farmaco off-label quando disponibile un farmaco in-label per la stessa indicazione. Ecco quindi che, dopo una serie di indagini molto accurate dell Antitrust, emerge come le due ditte pur di favorire l uso del farmaco più costose si sono accordate su una ampia serie di azioni e lobbismi sul livello politico e legislativo, sul versante scientifico e delle autorità regolatorie e infine sulla informazione ai medici. Leggendo il provvedimento dell Antitrust abbiamo saputo che L Antitrust ha svolto un lavoro davvero eccezionale e di altissimo livello tecnico e documentale. Ha infatti condotto un indagine senza tentennamenti su un tema tecnicamente molto complesso e di straordinarie dimensioni, economiche e sociali e di rilevanza internazionale. Il provvedimento dimostra la determinazione con la quale le due aziende hanno sfruttato le smagliature del quadro normativo-regolamentare italiano per massimizzare i loro profitti. Gli scambi di mail tra alcuni alti dirigenti delle due industrie hanno inequivocabilmente dimostrato una alleanza strutturata, pervasiva e duratura nel tempo a diversi livelli: attività congiunte su come non sviluppare un prodotto e attività collusive su come differenziare i due farmaci vale a dire come rendere artificialmente diverso un farmaco dall altro (a fronte di dati robusti che ne dimostravano la sostanziale sovrapponibilità); attività organizzate per rendere innocue le evidenze scientifiche. Dopo cioè la pubblicazione dello studio americano CATT indipendente (finanziato con fondi pubblici), che mostrava chiaramente la sovrapponibilità dei due farmaci, le due ditte si sono accordate su come rendere tale studio un non-evento ; attività congiunte e comuni dei due uffici legali. Alcune considerazioni e proposte Da questa vicenda prima e dopo il provvedimento dell Antitrust abbiamo appreso che: quando studi clinici, in modo particolare se finanziati da governi o enti pubblici, dimostrano il favorevole profilo benefici-rischi di un farmaco off-label, tali evidenze scientifiche dovrebbero essere ritenute un bene comune che può, anzi deve essere utilizzato ai fini della promozione della salute pubblica e della autorizzazione alla concedibilità e rimborsabilità da parte di un SSN o SSR; questo caso esemplare per portata e per gli interessi commerciali in esso concentrati, dimostra con chiarezza ineludibile la necessità che si cancelli la lettera zeta della finanziaria 2007; l opportunità di una nuova legge fatta non in condizioni d urgenza che consenta al SSN/SSR di fornire sotto la propria responsabilità trattamenti off-label con farmaci ancora coperti da brevetto, per le esigenze superiori della salute pubblica e del buon uso delle risorse del sistema sanitario pubblico provenienti dalla fiscalità generale; l opportunitá di rendere disponibili sotto la responsabilità del SSN farmaci documentati da buone evidenze e privi di una reale interesse commerciale da parte dell industria; l opportunitá di individuare farmaci che hanno dati iniziali (semplici segnalazioni di casi) e da svilup-pare ulteriormente per i quali consentire usi off-label in assenza di alternative terapeutiche o sui quali avviare programmi di ricerca indipendente; l opportunitá di individuare usi off-label di farmaci di documentata inefficacia o pericolosità sui quali esercitare azioni di controllo e diniego dell uso e farne oggetto di controlli e verifiche di appropriatezza. Le implicazioni del provvedimento La possibilità per il SSN o i SSR di richiedere i danni per avere dovuto acquistare un farmaco enormemente più costoso è la prima e più visibile conseguenza della sentenza. Per chi come la regione Emilia-Romagna aveva deliberato a favore dell utilizzo del farmaco meno costoso e parimenti efficace e sicuro si rende coerente la possibilità di riattivare quella delibera o comunque di richiedere con forza ad AIFA di inserire il bevacizumab nella lista dei farmaci ad uso consolidato in attesa che la Corte Costituzionale decida in merito ai ricorsi in essere anche al fine del miglior uso delle risorse pubbliche. Dal decreto Lorenzin all emendamento approvato alla Camera Il DL del 20 marzo 2014 proponeva anzi di fatto introduceva, in quanto decreto legge, una macchinosa procedura che costituiva un unicum a livello interna zionale. Infatti, nel disciplinare il caso di un farmaco offlabel per il quale vi sia motivato interesse pubblico al IsF - anno 38, n. 2, 2014 Ricerca clinica e conflitti di interesse 53
3 suo utilizzo (per una indicazione terapeutica diversa da quella sviluppata e registrata dall industria), il decreto legge prospettava tre diverse opzioni: 1. l AIFA procede alla registrazione della indicazione terapeutica, previa cessione a titolo gratuito al Ministero della Salute dei diritti su tale indicazione da parte del titolare dell Autorizzazione all Immissione in Commercio (AIC). Questa novità assoluta nel panorama legale internazionale degli usi offlabel sarebbe stata davvero stupefacente: improvvisamente infatti i farmaci off-label non si possono più toccare senza l assenso preventivo del titolare del brevetto che addirittura ne avrebbe dovuto cedere i diritti a titolo gratuito (cedendoli a chi non chiede/gestisce diritti e cioè il Ministero o il SSN). Secondo i legali è una scelta discutibile o poco lineare: la cessione è un negozio giuridico, come tale volontario, e quindi non può essere imposta, tantomeno a titolo gratuito. Se l industria vuole cedere i diritti allo Stato, e a titolo gratuito, non c è bisogno di una legge. Al Servizio Sanitario Nazionale non interessa l autorizzazione all immissione in commercio (AIC) né la commercializzazione del prodotto, ma semplicemente l autorizzazione all uso interno (del Servizio Sanitario), per fini di salute pubblica, di un farmaco efficace e sicuro, assumendosene la responsabilità e la rimborsabilità. 2. Il decreto proseguiva ipotizzando una seconda opzione nella quale il titolare dell AIC (ovvero l industria) procede direttamente alla registrazione dell indicazione e definisce con l AIFA i termini e le modalità di avvio degli studi registrativi ; questo era certamente il paragrafo meno condivisibile in quanto si prospettava che l industria fino a quel momento non interessata alla registrazione del farmaco decidesse improvvisamente di farlo su suggerimento di una agenzia regolatoria pianificando, in collaborazione con questa, studi clinici registrativi (pur essendo come in questo caso già disponibili numerosi studi clinici indipendenti). 3. Infine il decreto ipotizzava una terza possibilità in cui il titolare dell AIC si opponeva immotivatamente alla registrazione e di ciò si dava pubblica notizia sul sito web di AIFA. Questa ammonizione pubblica era per l appunto la dimostrazione della impotenza in cui si relegava il Sistema Sanitario rispetto ai farmaci che sono anche beni a tutela della salute pubblica. Il nuovo testo approvato alla Camera il 29 aprile cancella tutte e tre queste ipotesi e definisce in un nuovo articolo come si possono usare i farmaci off-label ben documentati pur in presenza di un farmaco già registrato e recita così: 1. All articolo 48, comma 19, lettera b), numero 3), del decreto legge 30 settembre 2003, n. 269, convertito, con modificazioni, dalla legge 24 novembre 2003, n. 326, sono aggiunte, in fine, le seguenti parole: «e, anche su richiesta delle regioni e delle province autonome di Trento e di Bolzano o delle società scientifiche nazionali del settore clinico di specifico interesse, sentito il Consiglio superiore di sanità, alla sperimentazione clinica di medicinali per un impiego non compreso nell autorizzazione all immissione in commercio». 2. Dopo il comma 4 dell articolo 1 del decreto-legge 21 ottobre 1996, n. 536, convertito dalla legge 23 dicembre 1996, n. 648, è inserito il seguente: «4- bis. Anche se sussista altra alternativa terapeutica nell ambito dei medicinali autorizzati, previa valutazione dell Agenzia italiana del farmaco (AIFA), sono inseriti nell elenco di cui al comma 4, con conseguente erogazione a carico del Servizio sanitario nazionale, i medicinali che possono essere utilizzati per una indicazione terapeutica diversa da quella autorizzata, purché tale indicazione sia nota e conforme a ricerche condotte nell ambito della comunità medico scientifica nazionale e internazionale, secondo parametri di economicità e appropriatezza. In tal caso l AIFA attiva idonei strumenti di monitoraggio a tutela della sicurezza dei pazienti e assume tempestivamente le necessarie determinazioni». Questo testo viene quindi ad aggiungere un nuovo comma alla L. 648 (che definisce le modalità d uso off-label dei farmaci). Il testo approvato alla Camera è quindi un buon compromesso che dovrebbe consentire, dopo il parere di AIFA, un uso dei farmaci per indicazioni non registrate, ma con adeguate evidenze a supporto della loro efficacia e sicurezza. Abbiamo, ancora una volta, perso l occasione di riformare più compiutamente la legislazione sugli usi off- label che in Italia è ridondante ed eccessivamente restrittiva anche per effetto del caso Di Bella. È infatti molto diverso utilizzare un farmaco per un uso off-label in presenza di solide prove di efficacia, in presenza di dati incoraggianti o in completa assenza di prove e sarebbe importante che le regole d uso tenessero conto di ciò. È in fine utile riflettere sul fatto che in generale i nuovi farmaci vengono autorizzati dalle Agenzie regolatorie con un numero di prove di efficacia minore (spesso senza studi di confronto diretto con lo standard di cura) rispetto a quelle di cui dispone, ormai da tempo, l Avastin intraoculare. Il nuovo testo dà semaforo verde all AIFA per approvare l Avastin per gli usi intraoculari speriamo che lo faccia presto. A mo di conclusioni L industria farmaceutica ha fatto grandi scoperte e ha contribuito agli straordinari progressi che hanno cambiato il mondo in questi ultimi decenni: dai farmaci per l Aids ai nuovi farmaci per l epatite C, dagli anticoagulanti ai vaccini, dagli antibiotici agli antitumorali sino alla pillola anticoncezionale (forse quest ultimo un po datato, ma sempre uno straordinario esempio). Che l industria contrasti così fortemente la presa in carico da 54 Ricerca clinica e conflitti di interesse IsF - anno 38, n. 2, 2014
4 parte del Servizio Sanitario di usi off-label di farmaci con efficacia e sicurezza ben documentata e utili alla salute pubblica è una battaglia di retroguardia che oscura tali importanti meriti. In presenza di studi di buona qualità è semplicemente irragionevole e incomprensibile rendere così difficile l uso di farmaci off-label in quanto lesivo del diritto alla salute e alla integrità fisica dei cittadini. Il nostro Paese può quindi essere orgoglioso del lavoro svolto dall Antitrust e la gravità dei comportamenti svelati dall inchiesta non può che essere motivo di preoccupazione e amarezza. Cosa dicono le evidenze sul caso Avastin-Lucentis - una rapida sintesi Dopo una lunga serie di studi di piccole dimensioni molti dei quali osservazionali fra il 2011 e il 2013 sono stati pubblicati due studi clinici randomizzati (sono il tipo di studi che ha maggiore probabilità di dimostrare differenze se queste esistono) indipendenti, di grandi dimensioni e di qualità metodologica adeguata che hanno effettuato un confronto diretto fra Avastin e Lucentis nel trattamento della DMLE: sono gli studi CATT e IVAN. Entrambi avevano un disegno fattoriale e vale a dire confrontavano sia i due farmaci sia due diverse modalità di somministrazione di entrambi e cioè quella mensile rispetto a quella al bisogno che comporta una somministrazione meno frequente di entrambi i farmaci in studio. Per i due studi è stata pubblicata un analisi dei risultati dopo 1 anno e 2 anni di somministrazione e una analisi che raggruppa in un unica valutazione i risultati di entrambi gli studi (metanalisi). Lo studio CATT che ha randomizzato pazienti ai due farmaci Avastin o Lucentis (finanziato dal NIH statunitense quindi uno studio particolarmente rilevanti anche perché indipendente cioè finanziato con fondi pubblici) i cui risultati hanno quindi maggiore credibilità per assenza di conflitto di interessi (Coi): Efficacia (obiettivo principale dello studio): la sostanziale sovrapponibilità dei risultati in termini di miglioramento dell acuità visiva (esito primario) e una ottima efficacia per entrambi i farmaci (bevacizuamb e ranibizumab) con la somministrazione mensile rispetto alla somministrazione al bisogno (indicativamente ogni 2 mesi). Sicurezza: non si sono evidenziate differenze di rilevanza clinica rispetto agli eventi avversi dovuti alla somministrazione intravitreale e a quelli legati al meccanismo d azione del farmaco (infarti del miocardio, ictus e mortalità per eventi vascolari). Si è invece osservata una maggior frequenza di eventi avversi gravi, non correlabili al meccanismo d azione (ospedalizzazioni) ampiamente sottolineata nei documenti di AIFA che secondo gli autori dello studio e la maggior parte dei commentatori è da considerare dovuta al caso (vedi commento successivo). I dati a 2 anni hanno sostanzialmente confermato i risultati ad 1 anno. Lo studio IVAN su 610 pazienti (finanziato con fondi pubblici del programma di HTA inglese) presentano i seguenti dati a 2 anni: Efficacia (obiettivo principale): l efficacia si è dimostrata sovrapponibile tra i due farmaci (bevacizumab e ranibizumab) assunti mensilmente; una certa minore efficacia per entrambi i farmaci si è osservata nella somministrazione al bisogno rispetto a quella mensile. Sicurezza: si è osservata una sovrapponibilità della mortalità per tutte le cause, degli eventi avversi trombotici di tipo arterioso correlati al meccanismo d azione del farmaco (infarti del miocardio, ictus e mortalità per eventi vascolari), dei ricoveri per scompenso cardiaco e in generale di tutti i tipi di eventi avversi gravi. La metanalisi comprensiva dei risultati degli studi IVAN a due anni e CATT (risultati in parte a due anni parte ad un anno) pubblicata nel 2013 ha confermato i risultati precedentemente descritti: Efficacia: nei pazienti trattati mensilmente Avastin è risultato analogo a Lucentis rispetto all esito principale di efficacia. Nella modalità di somministrazione al bisogno per entrambi i farmaci i risultati sul miglioramento dell acuità visiva sono risultati inferiori rispetto alla modalità di trattamento mensile; il trattamento continuo sembra comunque provocare più zone di atrofia retinica rispetto al trattamento discontinuo. Sicurezza/rischi: nei pazienti trattati mensilmente si è osservata una mortalità simile tra i due farmaci e una analoga incidenza di eventi avversi trombotici di tipo arterioso correlati al meccanismo d azione (infarti del miocardio, ictus) e una maggior frequenza di almeno un evento avverso sistemico grave. IsF - anno 38, n. 2, 2014 Ricerca clinica e conflitti di interesse 55
5 Commento: La differenza riscontrata per gli eventi avversi gravi è molto aspecifica e non molto preoccupante in quanto questa categoria comprende tutti i ricoveri in ospedale (di qualunque tipo e per qualunque causa), che sono molto comuni in una popolazione molto anziana come quella affetta da AMD (80 anni età media). Questo dato è ben noto e proviene principalmente dallo studio CATT a 1 anno (non è infatti presente nei risultati dello studio IVAN) e fu spiegato fin dalla prima pubblicazione del CATT come effetto del caso o di uno sbilanciamento dei fattori prognostici non bilanciato dalla randomizzazione. L asserzione che il maggior numero di eventi avversi complessivi osservati nei pazienti trattati con bevacizumab sia dovuta alle differenze farmacologiche fra i due farmaci e in particolare al fatto che ciò condiziona una maggior presenza di Avastin in circolo non è avvalorata da dati. Nella modalità di somministrazione al bisogno (discontinua) si è osservato per entrambi i farmaci un aumento della mortalità per tutte le cause rispetto alla somministrazione mensile. Commento: Tale osservazione non plausibile dal punto di vista fisiopatologico (chi assume meno farmaco ha più eventi) attende una interpretazione e comunque non può essere imputata ad una aumentata tossicità dell Avastin. Esistono poi studi osservazionali eseguiti negli stati Uniti ed in Canada dove Avastin endovitreale viene ampiamente utilizzato. Di seguito ne vengono citati due di elevata numerosità: Medicare Claims Database Study (Curtis LH, Hammi/1 BG, Schulman KA, Cousins SW. Risks of mortality, myocardial infarction, bleeding, and stroke associated with therapies for age-related macular degeneration. Arch Ophthalmol 2010; 128(10): ). Lo studio osservazionale retrospettivo ha valutato la mortalità per tutte le cause, i nuovi casi di infarto del miocardio, di stroke e di sanguinamento su una coorte di soggetti > 65 anni trattati con iniezioni intravitreali di pegaptanib, ranibizumab o bevacizumab o con terapia fotodinamica (gruppo di controllo) fra gennaio 2004 e dicembre Lo studio non ha evidenziato differenze statisticamente significative nella mortalità, nei casi di infarto del miocardio, nei casi di stroke e nei sanguinamenti fra i trattamenti valutati Studio canadese caso controllo sulla sicurezza dei due farmaci (Campbell R. J. Adverse events with intravitreal injection of vascular endothelial growth factor inhibitors: nested case control study. BMJ 2012; 345:e4203 doi: /bmj. e4203 (Published 4 July 2012) condotto su una casistica di pazienti ricoverati nella regione canadese dell Ontario). Lo studio condotto utilizzando le diagnosi cliniche non ha evidenziato alcuna sostanziale differenza in termini di infarti del miocardio, ictus ischemici, casi di scompenso cardiaco congestizio e di trombo embolismo venoso nei pazienti esposti a bevacizumab o ranibizumab e nessuna differenza fra gli esposti all uno o all altro farmaco. Per quanto riguarda questo specifico riguardo, e cioè la sicurezza o il confronto degli effetti indesiderati dei due farmaci (in particolare il dato, preso molto seriamente da AIFA, dell aumento aspecifico dei ricoveri per cause non attribuibili ai farmaci in questione, richiamato anche nella comunicazione di cancellazione di AVASTIN dalla L. 648) riportiamo quanto affermato nel rapporto tecnico dell'agenzia Europea su Avastin e Lucentis pubblicato nel luglio del 2012, che dopo aver analizzato tutti gli eventi avversi degli studi al momento disponibili nonché le segnalazioni di farmacovigilanza così conclude (EMA/CHMP/332848/2012): "le informazioni dettagliate sulla sicurezza fornite dagli studi CATT e IVAN sono rassicuranti e non ci sono evidenze che il bevacizumab sia dal punto di vista sistemico meno sicuro del ranibizumab e viceversa". In altre parole, i dati sono rassicuranti e non ci sono differenze rilevanti tra i due farmaci. Nel corso del 2013 sono stati pubblicati altri 3 studi indipendenti randomizzati di confronto tra Avastin e Lucentis effettuati in diversi paesi europei: studio MANTA (finanziato dal Sistema Sanitario Austriaco); studio GEFAL (finanziato dal Sistema Sanitario Francese); studio LUCAS (finanziato dal Sistema Sanitario Norvegese). Questi studi confermano sostanzialmente i dati degli studi CATT e IVAN senza evidenziare alcuna differenza tra i due farmaci nei diversi parametri (outcomes) di sicurezza anche per quanto riguarda la frequenza di eventi avversi non correlati al meccanismo d azione del farmaco. 56 Ricerca clinica e conflitti di interesse IsF - anno 38, n. 2, 2014
Luca Leonardi VI Congresso SIFACT Milano Ottobre 2018
 VI Congresso SIFACT La centralità del paziente nei percorsi di cura: quali risposte dalle sanità regionali? MILANO 11-13 OTTOBRE 2018 MICO Fiera Milano City Sicurezza dell uso intravitreale di Bevacizumab
VI Congresso SIFACT La centralità del paziente nei percorsi di cura: quali risposte dalle sanità regionali? MILANO 11-13 OTTOBRE 2018 MICO Fiera Milano City Sicurezza dell uso intravitreale di Bevacizumab
Terapie senza AIC e non in CTs LEGGE 648. Maggio
 Terapie senza AIC e non in CTs LEGGE 648 Maggio 2012 1 Quadro normativo Legge 648 del 1996: rimborso per farmaci: Non ancora autorizzati in Italia In sperimentazione clinica ma ancora senza AIC Per indicazioni
Terapie senza AIC e non in CTs LEGGE 648 Maggio 2012 1 Quadro normativo Legge 648 del 1996: rimborso per farmaci: Non ancora autorizzati in Italia In sperimentazione clinica ma ancora senza AIC Per indicazioni
di sicurezza di bevacizumab e ranibizumab per uso intravitreale
 XXIII Seminario Nazionale LA VALUTAZIONE DELL USO E DELLA SICUREZZA DEI FARMACI: ESPERIENZE IN ITALIA Roma, ISS 9 dicembre 2014 Revisione sistematica delle evidenze di sicurezza di bevacizumab e ranibizumab
XXIII Seminario Nazionale LA VALUTAZIONE DELL USO E DELLA SICUREZZA DEI FARMACI: ESPERIENZE IN ITALIA Roma, ISS 9 dicembre 2014 Revisione sistematica delle evidenze di sicurezza di bevacizumab e ranibizumab
AUDIZIONE Camera dei Deputati. Malattie rare. Pierluigi Russo. Roma, 29 Aprile 2015
 AUDIZIONE Camera dei Deputati Malattie rare Pierluigi Russo Roma, 29 Aprile 2015 Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono personali e non impegnano in alcun
AUDIZIONE Camera dei Deputati Malattie rare Pierluigi Russo Roma, 29 Aprile 2015 Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono personali e non impegnano in alcun
Interrogazione a risposta scritta. Il sottoscritto consigliere. visti
 Interrogazione a risposta scritta Il sottoscritto consigliere visti l art. 32 della Costituzione che stabilisce che la Repubblica tutela il diritto fondamentale alla salute; la legge n. 94, dell 8 aprile
Interrogazione a risposta scritta Il sottoscritto consigliere visti l art. 32 della Costituzione che stabilisce che la Repubblica tutela il diritto fondamentale alla salute; la legge n. 94, dell 8 aprile
Bevacizumab vs Ranibizumab: esperienze dello studio CATT
 Bevacizumab vs Ranibizumab: esperienze dello studio CATT E stato pubblicato sul New England Journal of Medicine il risultato di un trial clinico randomizzato, multicentrico il cui scopo era confrontare
Bevacizumab vs Ranibizumab: esperienze dello studio CATT E stato pubblicato sul New England Journal of Medicine il risultato di un trial clinico randomizzato, multicentrico il cui scopo era confrontare
FARMACI BIOSIMILARI IN ONCOLOGIA
 FARMACI BIOSIMILARI IN ONCOLOGIA Opuscolo per cittadini e pazienti Ottobre 2018 Associazione Italiana di Oncologia Medica Associazione Italiana di Oncologia Medica In questo opuscolo troverà informazioni,
FARMACI BIOSIMILARI IN ONCOLOGIA Opuscolo per cittadini e pazienti Ottobre 2018 Associazione Italiana di Oncologia Medica Associazione Italiana di Oncologia Medica In questo opuscolo troverà informazioni,
RICERCA E SVILUPPO DI NUOVI FARMACI
 RICERCA E SVILUPPO DI NUOVI FARMACI In passato le scoperte dei farmaci erano occasionali. Si trattava di sostanze di derivazione vegetale o animale STRATEGIE DI RICERCA: Quali sono i fattori che influenzano
RICERCA E SVILUPPO DI NUOVI FARMACI In passato le scoperte dei farmaci erano occasionali. Si trattava di sostanze di derivazione vegetale o animale STRATEGIE DI RICERCA: Quali sono i fattori che influenzano
Allegato A Prescrizione, impiego ed erogazione di farmaci off-label
 Allegato A Prescrizione, impiego ed erogazione di farmaci off-label PREMESSA L'autorizzazione all'immissione in commercio (AIC) per un medicinale viene rilasciata, dagli enti regolatori preposti, a seguito
Allegato A Prescrizione, impiego ed erogazione di farmaci off-label PREMESSA L'autorizzazione all'immissione in commercio (AIC) per un medicinale viene rilasciata, dagli enti regolatori preposti, a seguito
SENATO DELLA REPUBBLICA
 SENATO DELLA REPUBBLICA Attesto che il Senato della Repubblica, il 14 maggio 2014, ha approvato il seguente disegno di legge, d iniziativa del Governo, già approvato dalla Camera dei deputati: Conversione
SENATO DELLA REPUBBLICA Attesto che il Senato della Repubblica, il 14 maggio 2014, ha approvato il seguente disegno di legge, d iniziativa del Governo, già approvato dalla Camera dei deputati: Conversione
Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE.
 Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE. Renato Bertini Malgarini, Giuseppe Pimpinella, Luca Pani 10 dicembre 2012- Istituto Superiore di Sanità
Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE. Renato Bertini Malgarini, Giuseppe Pimpinella, Luca Pani 10 dicembre 2012- Istituto Superiore di Sanità
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
UTILIZZO DEI MEDICINALI FUORI INDICAZIONE (OFF-LABEL)
 Azienda Ospedaliero- Universitaria Maggiore della Carità di Novara DIREZIONE SANITARIA S.C.D.O. FARMACIA DATA: 20.02.2008 REV. N 00 PAG. 1/8 UTILIZZO DEI MEDICINALI FUORI INDICAZIONE (OFF-LABEL) REDATTO
Azienda Ospedaliero- Universitaria Maggiore della Carità di Novara DIREZIONE SANITARIA S.C.D.O. FARMACIA DATA: 20.02.2008 REV. N 00 PAG. 1/8 UTILIZZO DEI MEDICINALI FUORI INDICAZIONE (OFF-LABEL) REDATTO
Componente e Responsabile Qualità Comitato di Etica ASL Salerno Segretario Scientifico Commissione Terapeutica Aziendale ASL Salerno
 L IMPIEGO OFF-LABEL DEI FARMACI Verona 30 novembre 2013 Brunella Piucci Farmacista P.O. Nocera Inferiore - Salerno Componente e Responsabile Qualità Comitato di Etica ASL Salerno Segretario Scientifico
L IMPIEGO OFF-LABEL DEI FARMACI Verona 30 novembre 2013 Brunella Piucci Farmacista P.O. Nocera Inferiore - Salerno Componente e Responsabile Qualità Comitato di Etica ASL Salerno Segretario Scientifico
Dr.ssa Margherita Andretta Dirigente Farmacista Servizio Farmaceutico Territoriale ULSS 20 Verona
 Dr.ssa Margherita Andretta Dirigente Farmacista Servizio Farmaceutico Territoriale ULSS 20 Verona Farmacoepidemiologia Studi di farmacoepidemiologia in risposta ai bisogni emersi sia in ambito territoriale
Dr.ssa Margherita Andretta Dirigente Farmacista Servizio Farmaceutico Territoriale ULSS 20 Verona Farmacoepidemiologia Studi di farmacoepidemiologia in risposta ai bisogni emersi sia in ambito territoriale
AGENZIA ITALIANA DEL FARMACO
 AGENZIA ITALIANA DEL FARMACO DETERMINA 28 aprile 2017 Inserimento di una indicazione terapeutica del medicinale per uso umano «Bevacizumab Avastin» nell'elenco ex lege n. 648/1996 parziale modifica alla
AGENZIA ITALIANA DEL FARMACO DETERMINA 28 aprile 2017 Inserimento di una indicazione terapeutica del medicinale per uso umano «Bevacizumab Avastin» nell'elenco ex lege n. 648/1996 parziale modifica alla
Scheda unica di segnalazione di sospetta reazione avversa
 DIPARTIMENTO ASSISTENZA FARMACEUTICA Scheda unica di segnalazione di sospetta reazione avversa Dott.ssa Elisa Iori Responsabile di farmacovigilanza Assicura la qualità dei dati delle schede Gestisce il
DIPARTIMENTO ASSISTENZA FARMACEUTICA Scheda unica di segnalazione di sospetta reazione avversa Dott.ssa Elisa Iori Responsabile di farmacovigilanza Assicura la qualità dei dati delle schede Gestisce il
Proseguendo con i fondamentali: la normativa Italiana ed Europea
 Proseguendo con i fondamentali: la normativa Italiana ed Europea Manuela Monti Clinical Research Coordinator IRST-IRCCS Meldola manuela.monti@irst.emr.it Regolamento: si applica in tutti i paesi dell
Proseguendo con i fondamentali: la normativa Italiana ed Europea Manuela Monti Clinical Research Coordinator IRST-IRCCS Meldola manuela.monti@irst.emr.it Regolamento: si applica in tutti i paesi dell
CRITERI PER LA VALUTAZIONE DEI FARMACI C(nn) DA PARTE DELLA COMMISSIONE REGIONALE DEL FARMACO (CRF)
 Direzione Generale Cura della Persona, Salute e Welfare Commissione Regionale Farmaco (D.G.R. 1540/2006 e 392/2015) Documento PTR n. 211 relativo a: CRITERI PER LA VALUTAZIONE DEI FARMACI C(nn) DA PARTE
Direzione Generale Cura della Persona, Salute e Welfare Commissione Regionale Farmaco (D.G.R. 1540/2006 e 392/2015) Documento PTR n. 211 relativo a: CRITERI PER LA VALUTAZIONE DEI FARMACI C(nn) DA PARTE
LINEE DI INDIRIZZO DELLA REGIONE TOSCANA SULL UTILIZZO DI FARMACI AL DI FUORI DELLE INDICAZIONI DI REGISTRAZIONE
 Regione Toscana A Allegato LINEE DI INDIRIZZO DELLA REGIONE TOSCANA SULL UTILIZZO DI FARMACI AL DI FUORI DELLE INDICAZIONI DI REGISTRAZIONE PREMESSA L'uso di terapie farmacologiche per indicazioni diverse
Regione Toscana A Allegato LINEE DI INDIRIZZO DELLA REGIONE TOSCANA SULL UTILIZZO DI FARMACI AL DI FUORI DELLE INDICAZIONI DI REGISTRAZIONE PREMESSA L'uso di terapie farmacologiche per indicazioni diverse
L applicazione della metodologia HTA nella farmacoterapia
 L applicazione della metodologia HTA nella farmacoterapia Roma -16 giugno 2010 Marisa Dell Aera U.O. Farmacia A.O.U. Policlinico - Bari Farmaci cosa? selezione capitolati tecnici di gara protocolli d uso
L applicazione della metodologia HTA nella farmacoterapia Roma -16 giugno 2010 Marisa Dell Aera U.O. Farmacia A.O.U. Policlinico - Bari Farmaci cosa? selezione capitolati tecnici di gara protocolli d uso
Indagine conoscitiva sulla sostenibilità del SSN
 Indagine conoscitiva sulla sostenibilità del SSN Ulteriori Approfondimenti Prof. Luca Pani Direttore Generale Roma, 30 luglio 2013 Vaccini Spesa per vaccini 2010 2011 2012 Spesa vaccini (milioni di euro)
Indagine conoscitiva sulla sostenibilità del SSN Ulteriori Approfondimenti Prof. Luca Pani Direttore Generale Roma, 30 luglio 2013 Vaccini Spesa per vaccini 2010 2011 2012 Spesa vaccini (milioni di euro)
L aggiornamento pubblicato nel marzo del 2007 è stato integrato con la pubblicazione della prima lista di farmaci essenziali ad uso pediatrico
 Nel 1977, l Organizzazione Mondiale della Sanità (OMS) pubblica il primo report sui farmaci essenziali. Indicato con l acronimo WHO TRS 615, il report tecnico costituisce la prima lista di farmaci essenziali
Nel 1977, l Organizzazione Mondiale della Sanità (OMS) pubblica il primo report sui farmaci essenziali. Indicato con l acronimo WHO TRS 615, il report tecnico costituisce la prima lista di farmaci essenziali
I. R. C. C.S. Rev. 0 Pag. 1/12
 Pag. 1/12 REDAZIONE VERIFICA APPROVAZIONE DATA FUNZIONE FIRMA DIRETTORE SANITARIO DI PRESIDIO DIRETTORE SANITARIO DI PRESIDIO DIRETTORE SANITARIO DI PRESIDIO 1 Pag. 2/12 INDICE 1. INTRODUZIONE 2. DEFINIZIONE
Pag. 1/12 REDAZIONE VERIFICA APPROVAZIONE DATA FUNZIONE FIRMA DIRETTORE SANITARIO DI PRESIDIO DIRETTORE SANITARIO DI PRESIDIO DIRETTORE SANITARIO DI PRESIDIO 1 Pag. 2/12 INDICE 1. INTRODUZIONE 2. DEFINIZIONE
Arrivano le nuove linee guida italiana per la diagnosi e la terapia del diabete Mercoledì 28 Maggio :30
 L intervento di Simona Frontoni, co-coordinatrice degli Standard per la SID e responsabile UOC endocrinologia e diabetologia Ospedale Fatebenefratelli Isola Tiberina Roma,al XXV Congresso della Società
L intervento di Simona Frontoni, co-coordinatrice degli Standard per la SID e responsabile UOC endocrinologia e diabetologia Ospedale Fatebenefratelli Isola Tiberina Roma,al XXV Congresso della Società
MODIFICAZIONI APPORTATE IN SEDE DI CONVERSIONE AL DECRETO-LEGGE 20 MARZO 2014, N. 36
 MODIFICAZIONI APPORTATE IN SEDE DI CONVERSIONE AL DECRETO-LEGGE 20 MARZO 2014, N. 36 All'articolo 1: al comma 1, lettera a), le parole: «la Presidenza del Consiglio dei ministri -- Dipartimento nazionale
MODIFICAZIONI APPORTATE IN SEDE DI CONVERSIONE AL DECRETO-LEGGE 20 MARZO 2014, N. 36 All'articolo 1: al comma 1, lettera a), le parole: «la Presidenza del Consiglio dei ministri -- Dipartimento nazionale
ALLEGATO TECNICO PER PROGETTI DI FARMACOVIGILANZA ATTIVA FINANZIABILI ATTRAVERSO I FONDI FV 2010/11
 Allegato B ALLEGATO TECNICO PER PROGETTI DI FARMACOVIGILANZA ATTIVA FINANZIABILI ATTRAVERSO I FONDI FV 2010/11 REGIONE: Sardegna RESPONSABILI TECNICO-SCIENTIFICO DEL PROGETTO nome: Michela cognome: Pellecchia
Allegato B ALLEGATO TECNICO PER PROGETTI DI FARMACOVIGILANZA ATTIVA FINANZIABILI ATTRAVERSO I FONDI FV 2010/11 REGIONE: Sardegna RESPONSABILI TECNICO-SCIENTIFICO DEL PROGETTO nome: Michela cognome: Pellecchia
Medicinale non più autorizzato. Allegato I
 Allegato I Conclusioni scientifiche e motivi per la sospensione dell autorizzazione all immissione in commercio presentati dall Agenzia europea per i medicinali 1 Conclusioni scientifiche Riassunto generale
Allegato I Conclusioni scientifiche e motivi per la sospensione dell autorizzazione all immissione in commercio presentati dall Agenzia europea per i medicinali 1 Conclusioni scientifiche Riassunto generale
DISEGNO DI LEGGE. Senato della Repubblica XVI LEGISLATURA N. 9. Disposizioni a sostegno dei pazienti anticoagulati
 Senato della Repubblica LEGISLATURA N. 9 DISEGNO DI LEGGE d iniziativa del senatore Ignazio MARINO COMUNICATO ALLA PRESIDENZA IL 29 APRILE 2008 (*) Disposizioni a sostegno dei pazienti anticoagulati (*)
Senato della Repubblica LEGISLATURA N. 9 DISEGNO DI LEGGE d iniziativa del senatore Ignazio MARINO COMUNICATO ALLA PRESIDENZA IL 29 APRILE 2008 (*) Disposizioni a sostegno dei pazienti anticoagulati (*)
-Applicazione della terminologia MeDRA alla codifica delle ADR -La FV negli studi osservazionali e nei registri dei farmaci sottoposti a monitoraggio
 Centro Regionale di Farmacovigilanza -Applicazione della terminologia MeDRA alla codifica delle ADR -La FV negli studi osservazionali e nei registri dei farmaci sottoposti a monitoraggio Seminario multi-tematico
Centro Regionale di Farmacovigilanza -Applicazione della terminologia MeDRA alla codifica delle ADR -La FV negli studi osservazionali e nei registri dei farmaci sottoposti a monitoraggio Seminario multi-tematico
Farmaci Biosimilari. Un alleanza tra Farmacisti e Reumatologi Per la Sostenibilità del SSR. 13 gennaio 2017 Palazzo Pirelli
 Farmaci Biosimilari Un alleanza tra Farmacisti e Reumatologi Per la Sostenibilità del SSR 13 gennaio 2017 Palazzo Pirelli Cosa Chiedono il SSN e il SSR? Massimo Medaglia Direzione Generale Welfare Regione
Farmaci Biosimilari Un alleanza tra Farmacisti e Reumatologi Per la Sostenibilità del SSR 13 gennaio 2017 Palazzo Pirelli Cosa Chiedono il SSN e il SSR? Massimo Medaglia Direzione Generale Welfare Regione
Studi Clinici in Pediatria e nelle Malattie Orfane
 Studi Clinici in Pediatria e nelle Malattie Orfane Valeria Antenucci OPBG Clinical & Research Services Verona, 19 Giugno 2014 Sperimentazione Clinica La sperimentazione farmacologica sull'uomo impone sempre
Studi Clinici in Pediatria e nelle Malattie Orfane Valeria Antenucci OPBG Clinical & Research Services Verona, 19 Giugno 2014 Sperimentazione Clinica La sperimentazione farmacologica sull'uomo impone sempre
I SESSIONE: FOCUS SULLE MALATTIE RARE
 CORSO DI FORMAZIONE SUL CAMPO A CURA DELL OSSERVATORIO NAZIONALE SIFO Torino, 5 Giugno 2015 I SESSIONE: FOCUS SULLE MALATTIE RARE Erica Daina Coordinamento Malattie Rare Regione Lombardia Centro di Ricerche
CORSO DI FORMAZIONE SUL CAMPO A CURA DELL OSSERVATORIO NAZIONALE SIFO Torino, 5 Giugno 2015 I SESSIONE: FOCUS SULLE MALATTIE RARE Erica Daina Coordinamento Malattie Rare Regione Lombardia Centro di Ricerche
Il Farmaco Veterinario: l utilizzo off-label e i generici
 Audizione Commissione Senato Roma, 14 marzo 2017 Il Farmaco Veterinario: l utilizzo off-label e i generici M. Fornasier Medico Veterinario - SIVAL Disegno di legge n. 540 e 499: che cosa deve fare il veterinario?
Audizione Commissione Senato Roma, 14 marzo 2017 Il Farmaco Veterinario: l utilizzo off-label e i generici M. Fornasier Medico Veterinario - SIVAL Disegno di legge n. 540 e 499: che cosa deve fare il veterinario?
Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 1/7
 giunta regionale Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 1/7 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO
giunta regionale Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 1/7 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO
FARMACI: EMA, NEL 2012 RICEVUTE 96 RICHIESTE AIC, 59 PARERI POSITIVI CHMP = IL BILANCIO ANNUALE DELL' ATTIVITA' DELL' AGENZIA REGOLATORIA UE
 FARMACI: EMA, NEL 2012 RICEVUTE 96 RICHIESTE AIC, 59 PARERI POSITIVI CHMP = IL BILANCIO ANNUALE DELL' ATTIVITA' DELL' AGENZIA REGOLATORIA UE Roma, 17 apr. (Adnkronos Salute) - L' Agenzia europea dei medicinali
FARMACI: EMA, NEL 2012 RICEVUTE 96 RICHIESTE AIC, 59 PARERI POSITIVI CHMP = IL BILANCIO ANNUALE DELL' ATTIVITA' DELL' AGENZIA REGOLATORIA UE Roma, 17 apr. (Adnkronos Salute) - L' Agenzia europea dei medicinali
DIRITTO alla SCELTA LIBERA e CONSAPEVOLE dei MEZZI di CONTRASTO
 SOCIETÀ ITALIANA di RADIOLOGIA MEDICA Documenti SIRM 2015 DIRITTO alla SCELTA LIBERA e CONSAPEVOLE dei MEZZI di CONTRASTO in Radiodiagnostica a cura di Laura Romanini - Luca Brunese - Roberto Grassi Documento
SOCIETÀ ITALIANA di RADIOLOGIA MEDICA Documenti SIRM 2015 DIRITTO alla SCELTA LIBERA e CONSAPEVOLE dei MEZZI di CONTRASTO in Radiodiagnostica a cura di Laura Romanini - Luca Brunese - Roberto Grassi Documento
Politica del Farmaco e la Rete
 Politica del Farmaco e la Rete Dr Filippo de Braud Direttore Unità Farmacologia Clinica e Sviluppo Nuovi farmaci- Istituto Europeo di Oncologia Milano Membro CTS AIFA e Coordinatore Commissione Sperimentazione
Politica del Farmaco e la Rete Dr Filippo de Braud Direttore Unità Farmacologia Clinica e Sviluppo Nuovi farmaci- Istituto Europeo di Oncologia Milano Membro CTS AIFA e Coordinatore Commissione Sperimentazione
ATTO D ACQUISTO N. 6/SPE DEL
 ATTO D ACQUISTO OGGETTO: Fornitura annuale, dalla data del presente atto, del farmaco OZURDEX 700 mcg. impianto intravitreale (p.a. Desametasone) Il Direttore di Farmacia Ospedaliera, Dottoressa Daniela
ATTO D ACQUISTO OGGETTO: Fornitura annuale, dalla data del presente atto, del farmaco OZURDEX 700 mcg. impianto intravitreale (p.a. Desametasone) Il Direttore di Farmacia Ospedaliera, Dottoressa Daniela
Farmacovigilanza. Obbligo segnalazioni avverse entro 48h. Il Decreto in Gazzetta Ufficiale
 Farmacovigilanza. Obbligo segnalazioni avverse entro 48h. Il Decreto in Gazzetta Ufficiale Il provvedimento recepisce le direttive europee sulla farmacovigilanza. Tempi ridotti a 36 ore per segnalazione
Farmacovigilanza. Obbligo segnalazioni avverse entro 48h. Il Decreto in Gazzetta Ufficiale Il provvedimento recepisce le direttive europee sulla farmacovigilanza. Tempi ridotti a 36 ore per segnalazione
Diritto alla salute e sostenibilità in una sanità federale. La SIFO interroga e propone
 Diritto alla salute e sostenibilità in una sanità federale. La SIFO interroga e propone XXXI Congresso Nazionale SIFO Cagliari 6-8 ottobre 2010 Tavola rotonda Regole e strumenti di sistema e di indirizzo.
Diritto alla salute e sostenibilità in una sanità federale. La SIFO interroga e propone XXXI Congresso Nazionale SIFO Cagliari 6-8 ottobre 2010 Tavola rotonda Regole e strumenti di sistema e di indirizzo.
Centro Regionale di documentazione e informazione sul farmaco
 La segnalazione di Reazioni Avverse in Calabria: Resoconto del 2011. Introduzione L obiettivo principale della Farmacovigilanza è l incremento della segnalazione spontanea delle reazioni avverse ai farmaci.
La segnalazione di Reazioni Avverse in Calabria: Resoconto del 2011. Introduzione L obiettivo principale della Farmacovigilanza è l incremento della segnalazione spontanea delle reazioni avverse ai farmaci.
Farmaci bioequivalenti o generici: ostacolo o opportunità per l innovazione terapeutica?
 Farmaci bioequivalenti o generici: ostacolo o opportunità per l innovazione terapeutica? Roberto Trevisan USC Malattie Endocrine - Diabetologia ASST Papa Giovanni XXIII (Bergamo) Background I farmaci costano.
Farmaci bioequivalenti o generici: ostacolo o opportunità per l innovazione terapeutica? Roberto Trevisan USC Malattie Endocrine - Diabetologia ASST Papa Giovanni XXIII (Bergamo) Background I farmaci costano.
I progetti di farmacovigilanza a livello regionale: quale contributo?
 Workshop: Valutazione comparativa di efficacia e sicurezza tra farmaci: il ruolo degli studi osservazionali I progetti di farmacovigilanza a livello regionale: quale contributo? Mauro Venegoni Centro Regionale
Workshop: Valutazione comparativa di efficacia e sicurezza tra farmaci: il ruolo degli studi osservazionali I progetti di farmacovigilanza a livello regionale: quale contributo? Mauro Venegoni Centro Regionale
Requisiti necessari per la richiesta:
 Procedura per la richiesta uso terapeutico di farmaco sottoposto a sperimentazione ai sensi del DECRETO 7 settembre 2017 Disciplina dell'uso terapeutico di medicinale sottoposto a sperimentazione clinica.
Procedura per la richiesta uso terapeutico di farmaco sottoposto a sperimentazione ai sensi del DECRETO 7 settembre 2017 Disciplina dell'uso terapeutico di medicinale sottoposto a sperimentazione clinica.
Allegato A al Decreto n. 145 del 21 DICEMBRE 2017 pag. 1/8
 giunta regionale Allegato A al Decreto n. 145 del 21 DICEMBRE 2017 pag. 1/8 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO Aggiornamento novembre 2017 FOGLIO
giunta regionale Allegato A al Decreto n. 145 del 21 DICEMBRE 2017 pag. 1/8 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO Aggiornamento novembre 2017 FOGLIO
Allegato IV. Conclusioni scientifiche
 Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Il 7 giugno 2017, la Commissione europea (CE) è stata informata di un caso mortale di insufficienza epatica fulminante in un paziente trattato
Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Il 7 giugno 2017, la Commissione europea (CE) è stata informata di un caso mortale di insufficienza epatica fulminante in un paziente trattato
Legislazione sui farmaci equivalenti, provvedimenti regionali, risparmi. farmaci genericati. Dott.ssa Maria Susanna Rivetti
 Legislazione sui farmaci equivalenti, provvedimenti regionali, risparmi realizzati e possibili con l uso dei farmaci genericati Dott.ssa Maria Susanna Rivetti NORMATIVA DI RIFERIMENTO LA LEGGE 425/1996
Legislazione sui farmaci equivalenti, provvedimenti regionali, risparmi realizzati e possibili con l uso dei farmaci genericati Dott.ssa Maria Susanna Rivetti NORMATIVA DI RIFERIMENTO LA LEGGE 425/1996
Determina AIFA 2015 sui requisiti minimi necessari per le strutture sanitarie che eseguono sperimentazioni di fase I: scopi ed aspetti generali
 Determina AIFA 2015 sui requisiti minimi necessari per le strutture sanitarie che eseguono sperimentazioni di fase I: scopi ed aspetti generali Angela Del Vecchio Direttore Ufficio Attività Ispettive GCP
Determina AIFA 2015 sui requisiti minimi necessari per le strutture sanitarie che eseguono sperimentazioni di fase I: scopi ed aspetti generali Angela Del Vecchio Direttore Ufficio Attività Ispettive GCP
Roma, 3 settembre 2015 Al Presidente Dell Istituto Superiore di Sanità SEDE Oggetto: comunicazione di precisazioni non essenziali al Protocollo dello
 Roma, 3 settembre 2015 Al Presidente Dell Istituto Superiore di Sanità SEDE Oggetto: comunicazione di precisazioni non essenziali al Protocollo dello studio di coorte PITER (Piattaforma Italiana per lo
Roma, 3 settembre 2015 Al Presidente Dell Istituto Superiore di Sanità SEDE Oggetto: comunicazione di precisazioni non essenziali al Protocollo dello studio di coorte PITER (Piattaforma Italiana per lo
Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali. Meccanismo di azione e interazioni farmacologiche
 A06 Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali Meccanismo di azione e interazioni farmacologiche Copyright MMXV Aracne editrice int.le S.r.l. www.aracneeditrice.it info@aracneeditrice.it
A06 Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali Meccanismo di azione e interazioni farmacologiche Copyright MMXV Aracne editrice int.le S.r.l. www.aracneeditrice.it info@aracneeditrice.it
Cosa cambia: il punto di vista della Farmacia Ospedaliera
 Dott. Adriano Cristinziano UOC Farmacia Monaldi AZIENDA OSPEDALIERA DEI COLLI - NAPOLI L appropriatezza terapeutica nella degenerazione maculare legata all età Cosa cambia: il punto di vista della Farmacia
Dott. Adriano Cristinziano UOC Farmacia Monaldi AZIENDA OSPEDALIERA DEI COLLI - NAPOLI L appropriatezza terapeutica nella degenerazione maculare legata all età Cosa cambia: il punto di vista della Farmacia
Farmaci : la lunga strada per l immissione in commercio. Problematiche post negoziazione e differenziazione regionale.
 Farmaci : la lunga strada per l immissione in commercio. Problematiche post negoziazione e differenziazione regionale. Dott. Giuseppe Gambale Cardiologo ASL RM/B Roma 26.11.2013 Art. 32 della Costituzione
Farmaci : la lunga strada per l immissione in commercio. Problematiche post negoziazione e differenziazione regionale. Dott. Giuseppe Gambale Cardiologo ASL RM/B Roma 26.11.2013 Art. 32 della Costituzione
NEL PIENO DELLE DANZE: FARMACOVIGILANZA. Veronica Franchina
 CORSO INTRODUZIONE ALLA RICERCA CLINICA MILANO 14-15 GIUGNO 2018 NEL PIENO DELLE DANZE: FARMACOVIGILANZA Veronica Franchina Coordinatore di ricerca clinica, U.O.C. Oncologia Medica A.O. Papardo Messina
CORSO INTRODUZIONE ALLA RICERCA CLINICA MILANO 14-15 GIUGNO 2018 NEL PIENO DELLE DANZE: FARMACOVIGILANZA Veronica Franchina Coordinatore di ricerca clinica, U.O.C. Oncologia Medica A.O. Papardo Messina
La nuova legislazione sulla Farmacovigilanza. Trasparenza e comunicazione nella farmacovigilanza. Carmela Macchiarulo. Roma, 13 settembre 2012
 La nuova legislazione sulla Farmacovigilanza Trasparenza e comunicazione nella farmacovigilanza Carmela Macchiarulo Roma, 13 settembre 2012 Dichiarazione di trasparenza/interessi* Le opinioni espresse
La nuova legislazione sulla Farmacovigilanza Trasparenza e comunicazione nella farmacovigilanza Carmela Macchiarulo Roma, 13 settembre 2012 Dichiarazione di trasparenza/interessi* Le opinioni espresse
Rischi e trappole: i farmaci off-label. Adima Lamborghini
 Rischi e trappole: i farmaci off-label Adima Lamborghini A.I.C. Quando il nuovo farmaco ha dimostrato di avere un efficacia sufficiente in rapporto agli eventuali rischi (rapporto rischio/beneficio), tutti
Rischi e trappole: i farmaci off-label Adima Lamborghini A.I.C. Quando il nuovo farmaco ha dimostrato di avere un efficacia sufficiente in rapporto agli eventuali rischi (rapporto rischio/beneficio), tutti
Le potenzialità degli studi registrativi e post marketing
 Dr.ssa Silvia Adami Area Sanità e Sociale Settore Farmaceutico-Protesica -Dispositivi medici Rio Novo Dorsoduro, 3493 30123 -Venezia 1 Studio Clinico - Classificazioni per fasi degli studi clinici La classificazione
Dr.ssa Silvia Adami Area Sanità e Sociale Settore Farmaceutico-Protesica -Dispositivi medici Rio Novo Dorsoduro, 3493 30123 -Venezia 1 Studio Clinico - Classificazioni per fasi degli studi clinici La classificazione
PROCEDURA AZIENDALE PER LA RICHIESTA DI MEDICINALI UTILIZZATI AL DI FUORI DELLE INDICAZIONI TERAPEUTICHE AUTORIZZATE
 UTILIZZATI AL DI FUORI DATA REVISIONE REDAZIONE VALIDAZIONE AUTORIZZAZIONE N ARCHIVIAZIONE Maggio 2016 Dott. Paolo Marchi (Specializzando 3 anno SSFO) Dott.ssa M. G. Moretti (Dirigente Farmacista) Dott.ssa
UTILIZZATI AL DI FUORI DATA REVISIONE REDAZIONE VALIDAZIONE AUTORIZZAZIONE N ARCHIVIAZIONE Maggio 2016 Dott. Paolo Marchi (Specializzando 3 anno SSFO) Dott.ssa M. G. Moretti (Dirigente Farmacista) Dott.ssa
DOCUMENTO DI CONFRONTO DEI PREZZI TRA ALTERNATIVE TERAPEUTICHE AD ELEVATO IMPATTO ECONOMICO REGIONALE
 DOCUMENTO DI CONFRONTO DEI PREZZI TRA ALTERNATIVE TERAPEUTICHE AD ELEVATO IMPATTO ECONOMICO REGIONALE PREMESSA Esistono molte aree terapeutiche per le quali sono disponibili farmaci differenti registrati
DOCUMENTO DI CONFRONTO DEI PREZZI TRA ALTERNATIVE TERAPEUTICHE AD ELEVATO IMPATTO ECONOMICO REGIONALE PREMESSA Esistono molte aree terapeutiche per le quali sono disponibili farmaci differenti registrati
Uso appropriato e sicuro dei medicinali nei pazienti anziani trattati in ambito territoriale o istituzionalizzati in case residenza per anziani
 Progetto Multicentrico Regionale di Farmacovigilanza Attiva (Fondi AIFA 2010-2011) Uso appropriato e sicuro dei medicinali nei pazienti anziani trattati in ambito territoriale o istituzionalizzati in case
Progetto Multicentrico Regionale di Farmacovigilanza Attiva (Fondi AIFA 2010-2011) Uso appropriato e sicuro dei medicinali nei pazienti anziani trattati in ambito territoriale o istituzionalizzati in case
A luglio 2012 sono entrate in vigore due nuove disposizioni in tema di sicurezza dei medicinali, dopo più di 10 anni dall ultima normativa europea in
 La normativa europea in materia di farmacovigilanza è stata modificata con l adozione nel 2010, del Regolamento UE 1235/2010, la cui applicazione è operativa dal 2 luglio 2012, e della Direttiva 2010/84/UE,
La normativa europea in materia di farmacovigilanza è stata modificata con l adozione nel 2010, del Regolamento UE 1235/2010, la cui applicazione è operativa dal 2 luglio 2012, e della Direttiva 2010/84/UE,
Rispetto delle indicazioni registrate Malattie Rare. Alessandra Ferretti Dip. Assistenza Farmaceutica AUSL Reggio Emilia
 Rispetto delle indicazioni registrate Malattie Rare Alessandra Ferretti Dip. Assistenza Farmaceutica AUSL Reggio Emilia Ricettazione in MG Reggio Emilia 25 febbraio 2009 INDICAZIONI TERAPEUTICHE AUTORIZZATE
Rispetto delle indicazioni registrate Malattie Rare Alessandra Ferretti Dip. Assistenza Farmaceutica AUSL Reggio Emilia Ricettazione in MG Reggio Emilia 25 febbraio 2009 INDICAZIONI TERAPEUTICHE AUTORIZZATE
Normativa Regolamento UE 1235/2010 Direttiva 2010/84/UE
 Implementazione delle nuove linee guida dell AIFA e principali modifiche introdotte dalla nuova normativa europea di Farmacovigilanza CEFPAS 24 marzo 2015 Claudia La Cavera Normativa Regolamento UE 1235/2010
Implementazione delle nuove linee guida dell AIFA e principali modifiche introdotte dalla nuova normativa europea di Farmacovigilanza CEFPAS 24 marzo 2015 Claudia La Cavera Normativa Regolamento UE 1235/2010
AIFA Agenzia Italiana Del Farmaco Becaplermina (Regranex)
 AIFA - Becaplermina (Regranex) 19/02/2010 (Livello 2) AIFA Agenzia Italiana Del Farmaco Becaplermina (Regranex) Comunicato Stampa EMEA Domande e Risposte (FAQ) file:///c /documenti/reg1571.htm [19/02/2010
AIFA - Becaplermina (Regranex) 19/02/2010 (Livello 2) AIFA Agenzia Italiana Del Farmaco Becaplermina (Regranex) Comunicato Stampa EMEA Domande e Risposte (FAQ) file:///c /documenti/reg1571.htm [19/02/2010
MEDICINALI CONTENENTI IODOCASEINA/TIAMINA CON AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO NELL'UNIONE EUROPEA. Nome di fantasia
 ALLEGATO I ELENCO DEL NOME DEL MEDICINALE, DELLA FORMA FARMACEUTICA, DEL DOSAGGIO, DELLA VIA DI SOMMINISTRAZIONE, DEL RICHIEDENTE, DEL TITOLARE DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO NEGLI STATI
ALLEGATO I ELENCO DEL NOME DEL MEDICINALE, DELLA FORMA FARMACEUTICA, DEL DOSAGGIO, DELLA VIA DI SOMMINISTRAZIONE, DEL RICHIEDENTE, DEL TITOLARE DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO NEGLI STATI
DRGs: trasparenza, efficienza, qualità
 1 DRGs: trasparenza, efficienza, qualità Come noto il sistema dei DRGs (Diagnosis-related groups) è stato sviluppato agli inizi degli anni '70 da alcuni ricercatori dell'università di Yale, con l'obiettivo
1 DRGs: trasparenza, efficienza, qualità Come noto il sistema dei DRGs (Diagnosis-related groups) è stato sviluppato agli inizi degli anni '70 da alcuni ricercatori dell'università di Yale, con l'obiettivo
RICHIESTA DI PARERE STUDIO OSSERVAZIONALE DISPOSITIVI MEDICI. lì, Al Direttore Generale A Segreteria del Comitato Etico
 RICHIESTA DI PARERE STUDIO OSSERVAZIONALE DISPOSITIVI MEDICI lì, Al Direttore Generale A Segreteria del Comitato Etico Il Sottoscritto in qualità di: Promotore e Sperimentatore Promotore CHIEDE IL PARERE
RICHIESTA DI PARERE STUDIO OSSERVAZIONALE DISPOSITIVI MEDICI lì, Al Direttore Generale A Segreteria del Comitato Etico Il Sottoscritto in qualità di: Promotore e Sperimentatore Promotore CHIEDE IL PARERE
n.4 LA SALUTE È UN DIRITTO DI TUTTI. I farmaci generici: UN ALTERNATIVA DI QUALITÀ E i farmaci generici danno il loro contributo
 n.4 I farmaci generici: UN ALTERNATIVA DI QUALITÀ IN EVIDENZA Quanto risparmia UNA FAMIGLIA? Una soluzione al problema dei FARMACI INTROVABILI LA SALUTE È UN DIRITTO DI TUTTI. E i farmaci generici danno
n.4 I farmaci generici: UN ALTERNATIVA DI QUALITÀ IN EVIDENZA Quanto risparmia UNA FAMIGLIA? Una soluzione al problema dei FARMACI INTROVABILI LA SALUTE È UN DIRITTO DI TUTTI. E i farmaci generici danno
DALLA FARMACOVIGILANZA AGLI INTERVENTI REGOLATORI
 Farmacovigilanza, FAD e farmacisti: i risultati del Progetto della Regione Toscana DALLA FARMACOVIGILANZA AGLI INTERVENTI REGOLATORI Loredano Giorni Monteriggioni, Il Piccolo Castello Hotel, 9 Maggio 2009
Farmacovigilanza, FAD e farmacisti: i risultati del Progetto della Regione Toscana DALLA FARMACOVIGILANZA AGLI INTERVENTI REGOLATORI Loredano Giorni Monteriggioni, Il Piccolo Castello Hotel, 9 Maggio 2009
Dottoressa Angioni Anna Rita Diabetologia Oristano UN ESORDIO COMPLICATO
 Dottoressa Angioni Anna Rita Diabetologia Oristano UN ESORDIO COMPLICATO ANGELO ü 68 aa ü da 14 aa in pensione ü non familiarità per diabete, IA e dislipidemia Durante la vita lavorativa ha praticato annualmente
Dottoressa Angioni Anna Rita Diabetologia Oristano UN ESORDIO COMPLICATO ANGELO ü 68 aa ü da 14 aa in pensione ü non familiarità per diabete, IA e dislipidemia Durante la vita lavorativa ha praticato annualmente
PROGETTO DI FARMACOVIGILANZA ATTIVA
 Centro Regionale di Documentazione e Informazione sul Farmaco PROGETTO DI FARMACOVIGILANZA ATTIVA Studio multiregionale di Farmacovigilanza attiva per valutazione di sicurezza ed appropriatezza prescrittiva
Centro Regionale di Documentazione e Informazione sul Farmaco PROGETTO DI FARMACOVIGILANZA ATTIVA Studio multiregionale di Farmacovigilanza attiva per valutazione di sicurezza ed appropriatezza prescrittiva
Retinopatia diabetica: una lotta possibile SOCIAL MANIFESTO
 Retinopatia diabetica: una lotta possibile SOCIAL MANIFESTO 2 Retinopatia diabetica: una lotta possibile SOCIAL MANIFESTO Negli ultimi anni, sono stati realizzati diversi studi promossi da organismi di
Retinopatia diabetica: una lotta possibile SOCIAL MANIFESTO 2 Retinopatia diabetica: una lotta possibile SOCIAL MANIFESTO Negli ultimi anni, sono stati realizzati diversi studi promossi da organismi di
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
Stato dell assistenza alle persone con malattia rara in Italia: il contributo delle Regioni
 Stato dell assistenza alle persone con malattia rara in Italia: il contributo delle Regioni Le somministrazioni domiciliari dei farmaci orfani Giuseppe Secchi, Farmindustria Roma, 21 aprile 2015 Le imprese
Stato dell assistenza alle persone con malattia rara in Italia: il contributo delle Regioni Le somministrazioni domiciliari dei farmaci orfani Giuseppe Secchi, Farmindustria Roma, 21 aprile 2015 Le imprese
Modalità di presentazione e tipologia dei dati da inserire nelle banche dati per il monitoraggio della terapia genica e cellulare somatica
 Modalità di presentazione e tipologia dei dati da inserire nelle banche dati per il monitoraggio della terapia genica e cellulare somatica IL PRESIDENTE DELL ISTITUTO SUPERIORE DI SANITÀ VISTO il decreto
Modalità di presentazione e tipologia dei dati da inserire nelle banche dati per il monitoraggio della terapia genica e cellulare somatica IL PRESIDENTE DELL ISTITUTO SUPERIORE DI SANITÀ VISTO il decreto
FARMACI E GENERE: GLI ASPETTI REGOLATORI Prof. Pani Agenzia Italiana del Farmaco
 FARMACI E GENERE: GLI ASPETTI REGOLATORI Prof. Pani Agenzia Italiana del Farmaco L immissione in commercio di un medicinale passa necessariamente attraverso una corretta valutazione della popolazione in
FARMACI E GENERE: GLI ASPETTI REGOLATORI Prof. Pani Agenzia Italiana del Farmaco L immissione in commercio di un medicinale passa necessariamente attraverso una corretta valutazione della popolazione in
Il nuovo Position Paper AIFA sui farmaci biosimilari. Mario
 Il nuovo Position Paper AIFA sui farmaci biosimilari Mario Melazzini m.melazzini@aifa.gov.it @mmelazzini Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono personali
Il nuovo Position Paper AIFA sui farmaci biosimilari Mario Melazzini m.melazzini@aifa.gov.it @mmelazzini Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono personali
CONFERENZA DELLE REGIONI E DELLE PROVINCE AUTONOME 14/041/CR7f/C7
 CONFERENZA DELLE REGIONI E DELLE PROVINCE AUTONOME 14/041/CR7f/C7 DECRETO-LEGGE 20 MARZO 2014, N. 36, RECANTE DISPOSIZIONI URGENTI IN MATERIA DI DISCIPLINA DEGLI STUPEFACENTI E SOSTANZE PSICOTROPE, PREVENZIONE,
CONFERENZA DELLE REGIONI E DELLE PROVINCE AUTONOME 14/041/CR7f/C7 DECRETO-LEGGE 20 MARZO 2014, N. 36, RECANTE DISPOSIZIONI URGENTI IN MATERIA DI DISCIPLINA DEGLI STUPEFACENTI E SOSTANZE PSICOTROPE, PREVENZIONE,
Un esempio: CE Policlinico Gemelli
 Un esempio: CE Policlinico Gemelli Tipologia degli studi 32% 2% 3% 4% Farmacologici 41% 3% 9% 6% Diagnostici Chirurgici Anestesiologici Osservazionali Studi di laboratorio Dispositivi medici Radioterapia
Un esempio: CE Policlinico Gemelli Tipologia degli studi 32% 2% 3% 4% Farmacologici 41% 3% 9% 6% Diagnostici Chirurgici Anestesiologici Osservazionali Studi di laboratorio Dispositivi medici Radioterapia
Allegato B al Decreto n. 147 del 19 agosto 2014 pag. 1/6
 giunta regionale Allegato B al Decreto n. 147 del 19 agosto 2014 pag. 1/6 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO
giunta regionale Allegato B al Decreto n. 147 del 19 agosto 2014 pag. 1/6 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO
Registri AIFA: strumento di gestione Dott.ssa Stefania Esposito U.O.C. Farmacia A.O.U. Mater Domini-Catanzaro
 IL VALORE DELL'INNOVAZIONE: DALLA VALUTAZIONE ALLA GESTIONE DELLE CRITICITA' Catanzaro, 20 giugno 2017 Registri AIFA: strumento di gestione Dott.ssa Stefania Esposito U.O.C. Farmacia A.O.U. Mater Domini-Catanzaro
IL VALORE DELL'INNOVAZIONE: DALLA VALUTAZIONE ALLA GESTIONE DELLE CRITICITA' Catanzaro, 20 giugno 2017 Registri AIFA: strumento di gestione Dott.ssa Stefania Esposito U.O.C. Farmacia A.O.U. Mater Domini-Catanzaro
DEGENERAZIONE MACULARE SENILE
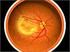
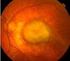 DEGENERAZIONE MACULARE SENILE E una malattia della retina centrale legata all età E la più frequente causa di cecità legale (cecità centrale non cecità assoluta!) che interessa la popolazione anziana -
DEGENERAZIONE MACULARE SENILE E una malattia della retina centrale legata all età E la più frequente causa di cecità legale (cecità centrale non cecità assoluta!) che interessa la popolazione anziana -
Dosaggio Forma farmaceutica Via di somministrazione Contenuto (concentrazione) Danimarca Valera Pharmaceuticals. fantasia
 ALLEGATO I ELENCO DEI NOMI DEI MEDICINALI, DELLA FORMA FARMACEUTICA, DEL DOSAGGIO, DELLA VIA DI SOMMINISTRAZIONE, DEL RICHIEDENTE, DEL TITOLARE DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO NEGLI STATI
ALLEGATO I ELENCO DEI NOMI DEI MEDICINALI, DELLA FORMA FARMACEUTICA, DEL DOSAGGIO, DELLA VIA DI SOMMINISTRAZIONE, DEL RICHIEDENTE, DEL TITOLARE DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO NEGLI STATI
Linee guida per la classificazione e conduzione degli studi osservazionali sui farmaci. Istituto Superiore di Sanità 8 maggio 2015
 Linee guida per la classificazione e conduzione degli studi osservazionali sui farmaci Giuseppe Guaglianone Istituto Superiore di Sanità 8 maggio 2015 Venezia da un punto di osservazione Studi Osservazionali
Linee guida per la classificazione e conduzione degli studi osservazionali sui farmaci Giuseppe Guaglianone Istituto Superiore di Sanità 8 maggio 2015 Venezia da un punto di osservazione Studi Osservazionali
LA COMPETENZA INFERMIERISTICA NELLA GESTIONE DELLA TERAPIA ANTICOAGULANTE ALLA LUCE DELLA INTRODUZIONE DEI NUOVI ANTICOAGULANTI ORALI
 LA COMPETENZA INFERMIERISTICA NELLA GESTIONE DELLA TERAPIA ANTICOAGULANTE ALLA LUCE DELLA INTRODUZIONE DEI NUOVI ANTICOAGULANTI ORALI Il sottoscritto Battaglieri Alessandro In qualità di relatore all'
LA COMPETENZA INFERMIERISTICA NELLA GESTIONE DELLA TERAPIA ANTICOAGULANTE ALLA LUCE DELLA INTRODUZIONE DEI NUOVI ANTICOAGULANTI ORALI Il sottoscritto Battaglieri Alessandro In qualità di relatore all'
Biosimilari e patologie croniche a maggiore prevalenza: utilizzo nella pratica clinica.
 Biosimilari e patologie croniche a maggiore prevalenza: utilizzo nella pratica clinica. Massimo Morosetti Direttore UOC Nefrologia e Dialisi Ospedale GB Grassi Roma 4 Processo sulla responsabilità d'impresa
Biosimilari e patologie croniche a maggiore prevalenza: utilizzo nella pratica clinica. Massimo Morosetti Direttore UOC Nefrologia e Dialisi Ospedale GB Grassi Roma 4 Processo sulla responsabilità d'impresa
Ministero della Salute
 Ministero della Salute Disposizioni in materia di medicinali per terapie avanzate preparati su IL MINISTRO Visto il decreto legislativo 24 aprile 2006, n. 219 successive direttive di modifica) relativa
Ministero della Salute Disposizioni in materia di medicinali per terapie avanzate preparati su IL MINISTRO Visto il decreto legislativo 24 aprile 2006, n. 219 successive direttive di modifica) relativa
Il Registro Nazionale per il Metilfenidato
 Il Registro Nazionale per il Metilfenidato Uno strumento di sanità pubblica Dante Besana Direttore di Struttura Complessa di Neuropsichiatria Infantile Milano 13 maggio 2005 Premesse giugno 2002 - CD SINPIA:
Il Registro Nazionale per il Metilfenidato Uno strumento di sanità pubblica Dante Besana Direttore di Struttura Complessa di Neuropsichiatria Infantile Milano 13 maggio 2005 Premesse giugno 2002 - CD SINPIA:
- per F. Hoffmann-La Roche Ltd. e Roche S.p.a., in solido, euro; - per Novartis AG e Novartis Farma S.p.a., in solido,
 SENATO DELLA REPUBBLICA GRUPPO PARLAMENTARE "MOVIMENTO 5 STELLE" -------- MOZIONE DI SFIDUCIA INDIVIDUALE NEI CONFRONTI DEL MINISTRO DELLA SALUTE, BEATRICE LORENZIN Il Senato, premesso che: il 3 ottobre
SENATO DELLA REPUBBLICA GRUPPO PARLAMENTARE "MOVIMENTO 5 STELLE" -------- MOZIONE DI SFIDUCIA INDIVIDUALE NEI CONFRONTI DEL MINISTRO DELLA SALUTE, BEATRICE LORENZIN Il Senato, premesso che: il 3 ottobre
8 Aderenza. Le Guide di I FARMACI GENERICI. Registrazione del Tribunale di Milano n 357 del 08/06/2001
 Le Guide di 8 Registrazione del Tribunale di Milano n 357 del 08/06/2001 Direttore editoriale: Nicola Miglino Direttore responsabile: Giorgio Albonetti Coordinamento editoriale: Ilaria Pedretti DICA33
Le Guide di 8 Registrazione del Tribunale di Milano n 357 del 08/06/2001 Direttore editoriale: Nicola Miglino Direttore responsabile: Giorgio Albonetti Coordinamento editoriale: Ilaria Pedretti DICA33
Strategie per l inserimento in Prontuario dei farmaci respiratori in Emilia Romagna
 Strategie per l inserimento in Prontuario dei farmaci respiratori in Emilia Romagna Anna Maria Marata Servizio Assistenza Territoriale Area Farmaco e Dispositivi Medici Il sistema regolatorio: premessa
Strategie per l inserimento in Prontuario dei farmaci respiratori in Emilia Romagna Anna Maria Marata Servizio Assistenza Territoriale Area Farmaco e Dispositivi Medici Il sistema regolatorio: premessa
Farmaci Orfani. Luisa Muscolo, Pietro Folino Gallo. Ufficio Coordinamento OsMed e attività HTA. Istituto Superiore di Sanità 7 luglio 2011
 Farmaci Orfani Luisa Muscolo, Pietro Folino Gallo Ufficio Coordinamento OsMed e attività HTA Istituto Superiore di Sanità 7 luglio 2011 Definizioni Malattia rara: è una patologia che colpisce un numero
Farmaci Orfani Luisa Muscolo, Pietro Folino Gallo Ufficio Coordinamento OsMed e attività HTA Istituto Superiore di Sanità 7 luglio 2011 Definizioni Malattia rara: è una patologia che colpisce un numero
Bergamo, 06 Giugno Dr.ssa Chiricosta
 Progetto INFOLOGIC : Interazioni farmacologiche evitabili tra i farmaci prescritti in regime di SSN ai pazienti in politerapia, affetti da patologie croniche Bergamo, 06 Giugno 2014 - Dr.ssa Chiricosta
Progetto INFOLOGIC : Interazioni farmacologiche evitabili tra i farmaci prescritti in regime di SSN ai pazienti in politerapia, affetti da patologie croniche Bergamo, 06 Giugno 2014 - Dr.ssa Chiricosta
Punto di vista del Medico
 Roma, 28 Gennaio 2016 Seminario di aggiornamento Uso compassionevole del farmaco: il punto di vista degli stakeholders Punto di vista del Medico Lisa Salvatore Polo Oncologico Azienda Ospedaliero Universitaria
Roma, 28 Gennaio 2016 Seminario di aggiornamento Uso compassionevole del farmaco: il punto di vista degli stakeholders Punto di vista del Medico Lisa Salvatore Polo Oncologico Azienda Ospedaliero Universitaria
La nuova legislazione sulla Farmacovigilanza. Il sistema di qualità di farmacovigilanza in AIFA. Pietro Erba. Roma, 13 settembre 2012
 La nuova legislazione sulla Farmacovigilanza Il sistema di qualità di farmacovigilanza in AIFA Pietro Erba Roma, 13 settembre 2012 Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa
La nuova legislazione sulla Farmacovigilanza Il sistema di qualità di farmacovigilanza in AIFA Pietro Erba Roma, 13 settembre 2012 Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa
DEGENERAZIONE MACULARE LEGATA ALL ETA (INDICAZIONI PER LA GESTIONE)
 April 2007 International Council of Ophthalmology ICO International Clinical Guidelines DEGENERAZIONE MACULARE LEGATA ALL ETA (INDICAZIONI PER LA GESTIONE) (Valutazioni: A: estremamente importante, B:
April 2007 International Council of Ophthalmology ICO International Clinical Guidelines DEGENERAZIONE MACULARE LEGATA ALL ETA (INDICAZIONI PER LA GESTIONE) (Valutazioni: A: estremamente importante, B:
Il paziente diabetico e iperglicemico ospedalizzato. Alfonso Bellia. UNIVERSITA DI ROMA TOR VERGATA Dipartimento di Medicina dei Sistemi
 Il paziente diabetico e iperglicemico ospedalizzato Alfonso Bellia UNIVERSITA DI ROMA TOR VERGATA Dipartimento di Medicina dei Sistemi POLICLINICO TOR VERGATA UOC di Endocrinologia e Diabetologia Dichiarazione
Il paziente diabetico e iperglicemico ospedalizzato Alfonso Bellia UNIVERSITA DI ROMA TOR VERGATA Dipartimento di Medicina dei Sistemi POLICLINICO TOR VERGATA UOC di Endocrinologia e Diabetologia Dichiarazione
