Massa del composto (le molecole dell analita vengono ionizzate e gli ioni analizzati, cioè separati, in base al rapporto m/z)
|
|
|
- Muzio Corti
- 8 anni fa
- Visualizzazioni
Transcript
1
2 Massa del composto (le molecole dell analita vengono ionizzate e gli ioni analizzati, cioè separati, in base al rapporto m/z) Informazioni sulla struttura molecolare (attraverso la caratterizzazione dei meccanismi di frammentazione delle molecole) Formula bruta degli analiti (misurando lo spettro di massa ad alta risoluzione) analisi elementare non più necessaria
3 Gli strumenti MS sono composti da tre moduli: una sorgente di ioni, che può convertire molecole di campione in fase gassosa in ioni (o, nel caso di ionizzazione via elettrospray, spostare ioni presenti in soluzione nella fase gassosa) un analizzatore di massa, che separa e ordina gli ioni in base alle loro masse mediante l'applicazione di campi elettromagnetici un rivelatore, che misura il valore di un indicatore in modo quantitativo e quindi fornisce i dati per calcolare le abbondanze di ciascuna specie di ioni
4 1. Il campione viene caricato nello strumento MS e subisce vaporizzazione 2. Le componenti del campione vengono ionizzate attraverso una varietà di metodi (per esempio, da un impatto con un fascio di elettroni), e si determina la formazione di particelle cariche, o ioni (ionizzazione) 3. Gli ioni vengono separati in base al loro rapporto massa/carica (m/z) all interno dell analizzatore, attraverso l applicazione di opportuni campi elettromagnetici 4. Gli ioni vengono rilevati, solitamente con un metodo quantitativo 5. Il segnale viene trasformato in uno spettro di massa degli ioni
5 Uno spettro di massa è un grafico contenente barre verticali, in cui ogni barra rappresenta uno ione avente un determinato rapporto massa-carica (m/z) e la lunghezza della barra indica la relativa abbondanza dello ione. Allo ione più abbondante è assegnata un'abbondanza di 100, e la sua barra è indicata come il picco di base. La maggior parte degli ioni generati in uno spettrometro di massa ha una singola carica; in questo caso il rapporto m/z è equivalente alla massa stessa.
6 In spettrometria di massa si definisce la risoluzione necessaria a separare due picchi A e B come dove R= M/ΔM = risoluzione ΔM = potere risolvente M è il valore del rapporto massa carica m/z del picco A ΔM è la differenza tra i valori di m/z di due picchi contigui picco B e picco A All'aumentare della risoluzione corrisponde un aumento della separazione tra i picchi. Due picchi adiacenti si dicono separati o risolti quando h/hx100 10, quindi l altezza della valle tra i due picchi è inferiore al 10% dell altezza dei picchi. Strumenti a bassa risoluzione separano masse unitarie fino a 2000
7 RISOLVERE MASSE PICCOLE È PIÙ FACILE CHE RISOLVERE MASSE GRANDI PERCHÉ LA DIFFERENZA PERCENTUALE TRA LE ENERGIE CINETICHE POSSEDUTE DA DUE IONI, CHE È PROPORZIONALE A (ΔM/M), È TANTO MINORE QUANTO MAGGIORE È LA MASSA Non tutti gli ioni con lo stesso rapporto m/z possiedono la stessa energia cinetica dopo l accelerazione IL POTERE RISOLVENTE DI UNO SPETTROMETRO PUÒ ESSERE AUMENTATO SOLO ESSENDO IN GRADO DI SELEZIONARE IONI CON LA STESSA ENERGIA CINETICA Strumenti a doppio analizzatore (vedi descrizione specifica più avanti) distinguono 4 cifre decimali con masse di centinaia di Da Distinuguono per esempio C 16 H 26 O 2 da C 15 H 24 NO 2 : R = /( ) =
8 Peso atomico: media della massa dei nuclidi pesata in base all abbondanza isotopica. Nuclide: singola specie nucleare, caratterizzata da un numero atomico Z e da un numero di massa A. I vari nuclidi di un particolare elemento chimico con uguale numero di protoni (numero atomico), ma diverso numero di neutroni sono chiamati isotopi di questo elemento. Le masse dei nuclidi non sono numeri interi! Elemento Peso Atomico Massa nuclide 1 H C (rif.) 14 N O
9 La massa vede la somma esatta dei pesi dei nuclidi, non vede il peso atomico medio. Esistono inoltre i picchi isotopici la cui abbondanza è significativa Nel caso di Cl e Br sono presenti picchi M + 2 Il cloro è presente in natura con due isotopi: 35 Cl, 75% circa, e 37 Cl, 25% circa. Gli ioni contenenti un atomo di cloro producono due picchi, uno a peso molecolare M ed uno a peso molecolare M+2 in rapporto 3:1. Il bromo è presente in natura con due isotopi: 79 Br, 51% circa, e 81 Br, 49% circa. Gli ioni contenenti un atomo di bromo producono due picchi, uno a peso molecolare M ed uno a peso molecolare M+2 in rapporto circa 1:1.
10
11 Nella camera di ionizzazione c'è un filamento, di solito in tungsteno o renio sottoposto a una differenza di potenziale regolabile a seconda del grado di ionizzazione desiderato. Le molecole vengono bombardate dagli elettroni emessi dal filamento e si ionizzano generando un radical catione detto "ione molecolare": M + e - M+ + 2e - dove M è la molecola dell analita che deve essere ionizzata, e - è l'elettrone e M + è lo ione risultante. (Si formano anche ioni negativi, ma in quantità molto minore rispetto a quelli positivi).
12 Gli elettroni vengono accelerati a 70 ev nella regione tra il filamento e l'ingresso alla sorgente di ioni. Gli elettroni accelerati vengono poi concentrati in un fascio e attratti verso l'elettrodo trappola. Il campione viene introdotto nella sorgente di ioni in una direzione perpendicolare al fascio di elettroni. Lo stretto passaggio di elettroni altamente energetici provoca ampie fluttuazioni del campo elettrico intorno alle molecole neutre e ne induce ionizzazione e frammentazione. I cationi radicali prodotti sono poi diretti verso l'analizzatore di massa tramite un elettrodo repulsore.
13 L'efficienza di ionizzazione e la produzione di ioni frammento dipende fortemente dalla chimica dell'analita e dall'energia degli elettroni. A basse energie (intorno a 20 ev), l interazione tra gli elettroni e le molecole di analita non trasferisce energia sufficiente a provocare la ionizzazione (o quasi). A circa 70 ev, la lunghezza d'onda di de Broglie degli elettroni corrisponde alla lunghezza di legami tipici delle molecole organiche (circa 0,14 nm) e il trasferimento dell'energia alle molecole organiche è massimizzato, portando alla ionizzazione più forte possibile e alla frammentazione. In queste condizioni, circa 1/1000 delle molecole di analita nella sorgente sono ionizzate. A energie più alte, la lunghezza d'onda di de Broglie degli elettroni diventa inferiore alle lunghezze di legame degli analiti; le molecole diventano "trasparenti" per gli elettroni e l'efficienza di ionizzazione diminuisce
14 Picco dello ione molecolare basso, a volte non visibile Tecnica altamente energetica: frammentazione Informazioni sulla struttura molecolare dalla frammentazione
15 Gli ioni generati nella sorgente EI hanno alta energia, e possono spezzarsi in frammenti prima di arrivare all analizzatore. Lo spettro di massa non contiene solo lo ione molecolare M + ed i suoi picchi isotopici, ma anche ioni a massa minore: i frammenti della molecola analizzata. La frammentazione fornisce importanti informazioni sulla struttura della molecola, poiché il modo in cui la molecola frammenta dipende dalla sua struttura. Se però la frammentazione è eccessiva, può essere impossibile identificare lo ione molecolare e determinare la massa della molecola.
16 Lo ione radicale è una specie ad energia molto alta. L elettrone mancante è delocalizzato su tutta la molecola. In molecole insature o con eteroatomi l elettrone mancante presumibilmente è uno degli elettroni π o di non legame. Modi di rappresentare lo ione molecolare di un alcano (a sinistra), di un alchene (a destra) e di un alcol (in basso).
17 La frammentazione è un fenomeno velocissimo (tra e 10-3 s) e quindi difficile da studiare. Le reazioni di frammentazione sono reazioni chimiche unimolecolari, dato che a pressioni molto basse (ricordiamoci che all interno degli strumenti di massa viene fatto alto vuoto) è improbabile che due molecole si incontrino. Poiché si parte da radicali, si ha spostamento di elettroni spaiati, che è descritto da frecce a mezza punta.
18 Tipi di frammentazione Esistono due grandi classi di frammentazioni: 1. Semplici scissioni omolitiche di un legame della molecola. 2. Riarrangiamenti (si rompono dei legami, ma se ne formano anche di nuovi). Solo uno dei due frammenti conserva la carica positiva. Questo è chiamato ione frammento, e dà luogo ad un picco nello spettro di massa L altro frammento è neutro, per cui non dà luogo ad un picco nello spettro di massa. Questo è chiamato frammento perso, e la sua massa può essere dedotta dalla differenza tra la massa dello ione molecolare e quella dello ione frammento.
19 I prodotti di scissioni semplici e riarrangiamenti sono diversi. 1. Le scissioni semplici portano alla formazione di uno ione a elettroni pari F +, ed ad un radicale neutro F. 2. I riarrangiamenti portano alla formazione di un nuovo ione radicale più leggero F +, e ad una molecola neutra F. Gli ioni frammento possono ulteriormente frammentare perdendo molecole neutre. Frammenti prodotti dai vari tipi di frammentazione. I frammenti carichi (in verde) sono visibili nello spettro, i frammenti neutri (in rosso) non lo sono.
20 Scissioni semplici Ogni legame della molecola può rompersi per dare uno ione e un radicale. Alcune frammentazioni sono però più facili e danno quindi luogo a picchi più intensi. Sono favorite le frammentazioni che portano a frammenti stabili. È importante soprattutto la stabilità del frammento carico.
21 Scissioni semplici favorite In una catena alchilica la frammentazione in α ad una ramificazione è favorita. Il distacco di una catena laterale da un anello è favorito. La frammentazione del legame α-β rispetto ad un eteroatomo o ad un doppio legame è favorita, perché si formano carbocationi stabilizzati per risonanza. A parità di altre condizioni, tende a staccarsi come radicale il gruppo alchilico più grande.
22 Lo ione tropilio Anche negli alchilbenzeni è favorita la scissione del legame α,β rispetto all anello aromatico. In questo caso però il catione benzilico traspone a catione tropilio (m/z 91), un catione aromatico a 7 termini molto stabile. Questa è spesso la frammentazione più importante per gli alchilbenzeni.
23 I riarrangiamenti I riarrangiamenti sono frammentazioni più complesse in cui si formano anche nuovi legami. Tra questi: la retro-diels-alder osservata in composti cicloesenici; la perdita di piccole molecole (H 2 O, CO, etilene) osservata in molti composti. In composti senza N, i frammenti originati da scissioni semplici hanno massa intera dispari, e quelli originati da riarrangiamenti hanno massa intera pari.
24 Il riarrangiamento di McLafferty Il riarrangiamento di McLafferty si osserva in composti carbonilici. Il legame α,β rispetto al CO si rompe, e contemporaneamente un H si trasferisce all O carbonilico dal C in γ al CO, attraverso uno stato di transizione a 6 termini. Il riarrangiamento può avvenire solo se è presente un H in γ al CO. Riarrangiamenti simili avvengono anche per alcheni ed alchilbenzeni con un H in γ al C=C o benzene.
25 Alcani Ione molecolare poco intenso ma visibile Frammentazione di tutti i C-C: serie di picchi separati da 14 unità di massa con intensità massima per i cationi con 3-4 carboni. Presenti anche i picchi a C n H 2n e C n H 2n-1
26 Negli alcani ramificati le intensità presentano una discontinuità (la scissione in α ad una ramificazione è favorita e la carica rimane sul C secondario) La spettrometria di massa consente di localizzare le posizioni delle ramificazioni all interno delle catene alchiliche
27 Alcheni Lo ione molecolare è generalmente ben visibile; anche se in linea di principio il doppio legame dovrebbe favorire alcune frammentazioni, la facile migrazione del doppio legame nello ione molecolare rende impossibile localizzare la posizione originale del doppio legame; per esempio, lo spettro del 2-ottene e quello del 4-ottene sono praticamente identici.
28 Idrocarburi aromatici Ione molecolare intenso. Alchilbenzeni: ione tropilio a m/z 91 (anche m/z 105, 119, ecc, se ci sono α-ramificazioni). Picco a m/z 92 se la catena alchilica è almeno C3 (riarrangiamento tipo McLafferty). Cluster di picchi a m/z 77 (C 6 H 5+ ), 78 (C 6 H 6+ ), e 79 (C 6 H 7 +). Ione tropilio Riarrangiamento tipo McLafferty
29 Alcoli alifatici Lo ione molecolare è sempre molto debole o assente. Primari: m/z 31, alcoli secondari: m/z 45, 59, 73, ecc., alcoli terziari: m/z 59, 73, 81, ecc. (rottura del legame α,β rispetto all OH). Ione M 1, e anche ioni M 2 e M 3. Picco M 18 (cioè M-H 2 O, perdita di acqua). Anche M H 2 O alchene e M H 2 O alchene alchene Rottura del legame α,β rispetto all OH in alcoli primari e secondari Perdita di H 2 O e di H 2 O e alchene
30
31 Chetoni Frammentazione C-CO (rottura del legame α,β rispetto ad un ossigeno) m/z 57, 71, 85, ecc: uguali a quelli degli alcani!). Riarrangiamento di McLafferty: m/z 58 (metilchetoni), o 72 (etilchetoni), o 86, o 100, ecc.. Chetoni aromatici: frammentazione molto favorita C CO con perdita del radicale alchilico, e successiva perdita di CO. Scissioni semplici favorite (sopra) e riarrangiamento di McLafferty (sotto) Frammentazione favorita dei chetoni aromatici
32 Aldeidi Picco ad M 1 (piuttosto caratteristico), picco a m/z 29 (CHO + ). Altri picchi caratteristici sono M 18 (perdita di acqua), M 28, M 43 e M 44. Riarrangiamento di McLafferty (m/z 44, se non c è ramificazione in α). Scissioni semplici favorite (sopra) e riarrangiamento di McLafferty (sotto) Spettro di massa del nonale
33 Acidi carbossilici Riarrangiamento di McLafferty (m/z 60 per acidi non ramificati in α, spesso il picco base). Rotture delle catene alchiliche con ritenzione della carica dal lato del carbossile (ioni del tipo C n H 2n-1 O 2+, cioè a m/z 45, 59, 73, ecc.). Riarrangiamento di McLafferty (sopra) e scissioni semplici degli acidi carbossilici Spettro di massa dell acido esanoico
34 Esteri (parte acilica dominante, p.e. esteri metilici) Lo ione molecolare è sempre visibile. Riarrangiamento di McLafferty (m/z 74 per esteri metilici non ramificati in a, spesso il picco base). Ioni del tipo C n H 2n-1 O 2 + (come negli acidi). Perdita del radicale RO e formazione dello ione acilio (M 31 per esteri metilici). Esteri aromatici: frammentazione C CO molto favorita, con perdita del radicale RO, e successiva perdita di CO. Riarr. di McLafferty (sopra), perdita del radicale alcossido per esteri alifatici (al centro) e aromatici (sotto) Spettro di massa dell ottanoato di metile
35 Esteri (parte alcolica dominante, p.e. acetati) Ione molecolare debole o assente. Frammentazione simile ai relativi alcoli: negli acetati, perdita di acido acetico (M 60) invece che di acqua. Spettro di massa dell acetato di dodecile
36 Ammine Ione molecolare è a massa dispari (regola dell azoto: molecole con massa pari contengono o nessun atomo di azoto oppure un numero pari di atomi di azoto). Ione molecolare è debole, e a volte assente. La frammentazione ricorda quella degli alcoli. Rottura del legame α,β all N (m/z 30, CH 2 =NH 2+, per ammine primarie non ramificate in α). In ammine secondarie o ramificate m/z 44, 58, 72, ecc. Oltre ai frammenti alchilici, ioni contenenti il gruppo amminico C n H 2n+2 N + (m/z 44, 58, 72, ecc). Rottura del legame α,β all N nelle ammine primarie Spettro di massa dell esilammina
37 La sorgente EI ha due tipi di problemi: 1. Non si può usare se il composto non è sufficientemente volatile. Possibili rimedi: derivatizzazione (zuccheri e composti poliossidrilati; acidi carbossilici). 2. Lo ione molecolare non è visibile se la frammentazione è eccessiva. Possibili rimedi: energia di ionizzazione più bassa di 70 ev La derivatizzazione di alcoli e acidi carbossilici rende i composti più volatili
38 La CI consiste generalmente nel trasferimento di un protone da un gas reagente (GH), precedentemente ionizzato, alla molecola neutra M da analizzare per formare uno ione molecolare protonato [M+H] +. GH + + M MH + + G La particolarità è che nello spettro vedremo lo ione molecolare con un unità di massa in più (M+1) In un esperimento CI, gli ioni vengono prodotti attraverso la collisione dell'analita con ioni di un gas reagente che sono presenti nella sorgente di ioni. Alcuni gas reagenti comuni includono: metano, ammoniaca, e isobutano. All'interno della sorgente di ioni, il gas reagente è presente in grande eccesso rispetto all'analita. Gli elettroni che entrano nella sorgente ionizzeranno preferenzialmente il gas reagente. Le collisioni con altre molecole di gas reagente genereranno un plasma di ionizzazione. Ioni positivi e negativi dell'analita sono generati per reazione con questo plasma.
39 Il gas G deve avere affinità protonica MINORE di quella di M altrimenti non è in grado di cedere il protone alla molecola M L energia trasferita dai vari ioni secondari (metano, isobutano e ammoniaca) diminuisce nell ordine: CH 5 + > i-c 4 H 9 + > NH 4 + Lo ione NH 4 + trasferisce meno energia allo ione MH + che di conseguenza si frammenterà meno. Si può modulare il grado di frammentazione attraverso la scelta del gas CI una ionizzazione soft. Questa tecnica di ionizzazione genera uno ione molecolare MH + con un bassissimo eccesso di energia (< a 5 ev), e le reazioni di frammentazione sono quindi poco importanti. CI spesso usata in modo complementare alla EI
40 Il campione è sciolto in una matrice (solvente protico e poco volatile: glicerolo, 1-tioglicerolo, alcol 3-nitrobenzilico, trietanolammina). La soluzione è investita da un flusso di atomi di Xe (o ioni Cs + ) ad alta energia cinetica, che provocano la volatilizzazione. La ionizzazione è dovuta a reazioni acido-base prima e durante questo processo. Si formano ioni pseudomolecolari [M+H] + (FAB+) e [M H] (FAB ).
41 Il FAB è adatto a molecole polari, che possono subire reazioni acido-base: glicosidi, peptidi, oligonucleotidi, alcaloidi. Oggi è spesso sostituito dalla sorgente electrospray. Lo spettro FAB forma ioni stabili: lo ione molecolare è sempre visibile ed intenso, ma sono spesso visibili anche picchi di frammentazione (soprattutto per molecola grandi) che possono dare utili informazioni strutturali. Oltre allo ione pseuomolecolare [M+H] +, nel FAB+ sono spesso visibili ioni del tipo [M+Na] + e [M+K] +, dovute all addizione alla molecola di uno ione Na + o K + invece che di un protone. Un problema del FAB è l elevato rumore di fondo: anche la matrice (S) ionizza e dà luogo ad un intenso picco [S+H] +, e anche picchi del tipo [2S+H] +, [3S+H] +, [4S+H] +, [5S+H] + (m/z 93, 185, 277, 369, 461, ecc per la glicerina). Si possono incontrare problemi con sostanze con peso molecolare al di sotto di 400, poiché al di sotto di questo valore il rumore di fondo è molto elevato. Il limite superiore dipende essenzialmente dalla capacità dell analizzatore, ma anche con analizzatori adatti si nota comunque una perdita di sensibilità nella ionizzazione di molecole con massa elevata.
42 E possibile ottenere lo spettro di massa di un peptide, che è assolutamente non volatile e quindi non analizzabile con la sorgente EI. Lo ione molecolare è sempre ben evidente, ma ci sono anche dei picchi di frammentazione.
43 Tecnica di ionizzazione soft, poco energetica, particolarmente adatta a proteine ed in generale biomolecole No frammentazione Interfacciabile con HPLC Il campione è sciolto in un solvente volatile protico (miscele di acqua e MeOH, di acqua e acetonitrile, MeOH), con eventuale aggiunta di acidi organici (formico, trifluoroacetico) e/o tamponi.
44 La soluzione passa per un ago capillare con un forte potenziale positivo (3-4 kv), e forma uno spray di goccioline con eccesso di carica positiva. La carica positiva delle goccioline è data da un eccesso di ioni H +. All interno delle goccioline, le molecole vengono protonate, e nel frattempo il solvente evapora e la densità di carica della gocciolina aumenta. Gli ioni vengono espulsi dalla superficie della gocciolina per repulsione elettrostatica. Se l ago ha potenziale negativo si formano, in maniera analoga, ioni negativi. Questo processo avviene a pressione atmosferica, quindi all esterno della zona ad alto vuoto dello spettrometro. Gli ioni che si formano entrano nello spettrometro attraverso una serie di fenditure fino ad arrivare nella zona a bassa pressione dello spettrometro di massa, dove sono accelerate ed inviate all analizzatore.
45 Ioni multicarica Se la molecola ha molti siti protonabili, la sorgente electrospray genera ioni a carica multipla. Nel caso di peptidi grandi e proteine, si possono ottenere ioni con decine di cariche. Questo è importante perché abbassa il rapporto m/z degli ioni, permettendo di analizzare ioni anche molto pesanti con analizzatori standard. A parità di peso molecolare, ioni a carica multipla hanno un rapporto m/z minore Quando si formano ioni a carica multipla, non tutti gli ioni generati hanno lo stesso numero di cariche. Se il composto ha massa molto grande si formano molti tipi di ioni e lo spettro può presentare molti picchi.
46 Il numero e tipo di picchi dipende anche dallo spettrometro e dal solvente usati. Spettri di massa del lisozima acquisiti in condizioni diverse
47 Determinazione della massa molecolare Quando gli ioni prodotti dalla sorgente ESI hanno più di una carica, bisogna conoscere il numero di cariche z per calcolare la massa m dal rapporto m/z misurato. È ovvio che la carica di due picchi vicini differisce di una unità: quindi, per due picchi contigui, m è lo stesso, mentre z differisce di 1. Si hanno due equazioni e due incognite (m e z1), si può quindi calcolare m. (m+z 1 )/z 1 = a (m+z 2 )/z 2 = b = (m+z 1 +1)/(z 1 +1) b a Due picchi contigui hanno carica differente di 1, e quindi z 2 = z Risolvendo questo sistema si calcola m
48 E una sorgente adatta alla maggior parte dei composti, dalle piccole molecole organiche (anche non volatili) fino a macromolecole come proteine (purché esse abbiano disponibili molti siti ionizzabili). Solo composti estremamente apolari come gli idrocarburi non sono analizzabili. La sensibilità non diminuisce sostanzialmente all aumentare della massa della sostanza analizzata. L electrospray generalmente produce solo ioni pseudomolecolari; in qualche caso è possibile osservare anche ioni frammento, ed in alcuni spettrometri è anche possibile favorire la frammentazione in sorgente agendo sulle condizioni sperimentali. La presenza di metalli alcalini non è particolarmente fastidiosa per l analisi di piccole molecole organiche: si formano ioni [M+Na] + e [M+K] +. È invece molto dannosa per ioni poliprotonati: infatti se uno o più Na + sostituiscono gli H +, si formano ioni aggiuntivi che complicano lo spettro e riducono la sensibilità.
49 L impiego di questo tipo di ionizzazione consente l accoppiamento con l eluizione del campione in HPLC. Tipicamente la fase mobile contenente l analita eluito viene riscaldata a temperature relativamente elevate (superiori a 400 C), spruzzato con un flusso molto forte d'azoto e la nube di aerosol così ottenuta viene sottoposta a scarica a effetto corona che genera gli ioni. La ionizzazione avviene in fase gas, a differenza dell ESI, nel cui caso la ionizzazione avviene in fase liquida. E così possibile usare un solvente non polare come fase mobile, invece di un solvente polare, poiché il solvente e le molecole di interesse vengono convertiti in stato gassoso prima di raggiungere l elettrodo a corona. Tipicamente, l APCI è una tecnica meno "soft" dell ESI, poiché genera più ioni frammento rispetto agli ioni genitore.
50
51 La ionizzazione della molecola da analizzare è indotta da un brevissimo (ns) ma intenso impulso di luce laser ultravioletta. Per essere efficace, la radiazione ultravioletta deve essere assorbita, per cui il campione è cocristallizzato con una matrice solida che assorbe alla lunghezza d onda (337 nm) prodotta da un laser ad azoto. L impulso è concentrato su una superficie di pochi μm 2, e con un microscopio si può scegliere il punto esatto del cristallo su cui mandare l impulso laser. L energia dell impulso laser è in grado di indurre sia la volatilizzazione che la ionizzazione dell analita Si formano ioni pseudomolecolari a singola carica positivi e negativi. Il MALDI è una tecnica di ionizzazione soft e ionizza bene sia piccole molecole che macromolecole senza provocare frammentazione.
52
53 Le matrici più usate sono il DHB, l acido sinapinico e l HCCA. Il campione è preparato sciogliendo l analita e la matrice in un solvente organico volatile. Una goccia (1 μl o meno) della soluzione è posta su uno dei pozzetti del target (una piastra di acciaio) e lasciata evaporare. La matrice cristallizza formando una soluzione solida con l analita. La sorgente MALDI è una sorgente ad impulsi, cioè non genera un flusso continuo di ioni, ma una grande quantità di ioni tutti in una volta. Una sorgente del genere non può essere usata con analizzatori come quello magnetico (vedi prossima sezione), che funzionano da filtri, perché questo richiedono un flusso continuo di ioni.
54
55 Porta gli ioni a percorrere traiettorie circolari, il cui raggio dipende dal rapporto m/z dello ione. Cambiando le traiettorie degli ioni mediante variazioni del campo magnetico applicato, ioni con diverso rapporto m/z possono essere focalizzati sul rivelatore.
56 E costituito da un tubo lungo circa 1 metro, piegato con un raggio di curvatura r' ed immerso in un campo magnetico di intensità B. Quando gli ioni che escono dalla camera di ionizzazione entrano nel tubo analizzatore, per effetto del campo magnetico B subiscono una deviazione (deflessione) dalla loro traiettoria rettilinea che viene curvata. All'uscita della camera di ionizzazione il fascio di ioni è accelerato attraverso un potenziale V di Volt. Gli ioni vengono espulsi, attraverso una fenditura di uscita, con circa la stessa energia cinetica pari a: E c = 1/2mv 2 = zv
57 Quando gli ioni positivi entrano tra le sue espansioni polari vengono sottoposti ad una forza centripeta Bzv che fa loro percorrere un raggio r; la forza centripeta è bilanciata dalla forza centifuga mv 2 /r, per cui quindi mv 2 /r = Bzv v 2 = 2zV/m = B 2 z 2 r 2 /m 2 da cui m/z = B 2 r 2 /2V Per ogni valore di B 2 /V verranno portati al rivelatore solo gli ioni che possiedono il rapporto m/z che soddisfa tale equazione. Aumentando l intensità di B (facendone una scansione) verranno portati all analizzatore ioni di massa via via crescente.
58 E' un analizzatore che consente di ottenere risoluzioni elevatissime (massa esatta ed alta risoluzione). Aggiungendo prima dell'analizzatore magnetico un analizzatore elettrostatico (ESA) il percorso degli ioni positivi viene focalizzato ulteriormente in direzione dal campo elettrico statico.
59 Nel settore elettrostatico (ES) gli ioni non vengono separati in funzione del rapporto massa/carica, ma solo focalizzati in base alla loro Energia Traslazionale. Gli ioni generati nella camera di ionizzazione possono essere dotati di energia cinetica iniziale diversa da 0. L'energia cinetica totale di uno ione dopo accelerazione nel campo V sarà quindi la somma di due componenti: energia cinetica iniziale ed energia cinetica guadagnata durante l'accelerazione. Il settore elettrostatico si limita ad uniformare le energie translazionali degli ioni che hanno uguale m/z, compensando differenze di velocità iniziale; se così non fosse, nel settore successivo, quello magnetico, ioni con ugual rapporto m/z ma differente energia traslazionale seguirebbero traiettorie diverse, diminuendo la risoluzione dello strumento.
60 L analizzatore a quadrupolo consiste in un tubo rettilineo in cui è fatto il vuoto ed in cui sono presenti quattro barre parallele di sezione circolare oppure iperbolica. Le barre opposte sono in contatto elettrico tra di loro, mentre tra barre adiacenti c è un voltaggio formato da una componente continua (che possiamo chiamare U) e una oscillante ad alta frequenza (Vcos(ωt) ).
61 I campi elettrici continuo ed oscillante spingono gli ioni a seguire una traiettoria a spirale, fino ad uscire dall altro lato dell analizzatore. Tuttavia regolando U e V si può fare sì che la traiettoria sia stabile solo per ioni i cui rapporti m/z sono compresi in un piccolo intervallo, mentre tutti gli altri ioni sbattono sulle pareti del tubo. Gli ioni percorrono una traiettoria a spirale nell analizzatore a quadrupolo
62 Caratteristiche dell analizzatore a quadrupolo L analizzatore a quadrupolo funziona da filtro come l analizzatore magnetico. Può essere accoppiato a sorgenti EI, FAB ed electrospray, ma non MALDI. È meno costoso, meno ingombrante, consuma meno elettricità e necessita di minore regolazioni dell analizzatore magnetico. Ha un limite superiore per il rapporto m/z piuttosto basso (spesso solo , raramente più di ). Non riesce a raggiungere una risoluzione sufficiente ad effettuare misure di massa esatta. Per questo, è usato molto spesso negli spettrometri di massa più economici quando non servono misure di massa esatta.
63 La trappola ionica (Ion Trap) può essere considerata come un analizzatore a quadrupolo curvato su se stesso in modo da formare un anello (o una ciambella). L elettrodo centrale (il buco della ciambella ) è eliminato, ed il voltaggio continuo ed alternato sono applicati tra l elettrodo esterno (che è un anello) e gli elettrodi inferiore e superiore, che sono due superfici convesse.
64 Utilizzando come nel quadrupolo dei voltaggi costanti U ed oscillanti V cos(ωt), è possibile intrappolare per un tempo lungo a piacere gli ioni che provengono dalla sorgente. Una piccola quantità di elio all interno della trappola aiuta questo processo, diminuendo l energia cinetica degli ioni e facendoli rimanere nei pressi del centro della trappola e lontani dalle pareti. Oltre che per conservare gli ioni, la ion-trap può essere utilizzata come analizzatore: aumentando progressivamente la radiofrequenza V, le traiettorie di ioni a rapporti m/z via via crescenti diventano instabili e escono dalla trappola. Come analizzatore la ion-trap offre prestazioni pari a quelle di un quadrupolo, e non è molto più costoso, ma è meno adatto ad applicazioni quantitative. Aumentando V la traiettoria di alcuni ioni diventa instabile
65 La sorgente MALDI è una sorgente ad impulsi: non genera un flusso continuo di ioni, ma una grande quantità di ioni in pochissimo tempo. Questa sorgente necessita di un particolare analizzatore, l analizzatore a tempo di volo. Questo analizzatore misura il rapporto m/z degli ioni sulla base del tempo che essi impiegano ad arrivare al detector Analizzatore a tempo di volo (TOF). Gli ioni più leggeri arrivano al detector prima degli ioni più pesanti
66 L analizzatore TOF è un tubo rettilineo di cm. Ad un estremità del tubo c è un campo elettrico, che accelera gli ioni provenienti dalla sorgente. Gli ioni attraversano poi una regione rettilinea senza campo. Gli ioni sono sottoposti tutti allo stesso campo elettrico, e assumono la stessa energia cinetica. Essendo Ec = 1/2mv 2, a parità di energia cinetica gli ioni con rapporto m/z maggiore (più pesanti) hanno velocità minore rispetto agli ioni con rapporto m/z minore (più leggeri), e quindi impiegano più tempo ad arrivare al detector. Per questo il tempo di volo dei vari ioni misura il loro rapporto m/z. Il TOF può funzionare solo se è noto il momento di partenza degli ioni, cioè se la sorgente è ad impulsi. Principio di funzionamento dell analizzatore TOF
67 Vantaggi e svantaggi dell analizzatore TOF Non ha praticamente nessun limite superiore per la massa analizzabile, basta aspettare tempo a sufficienza e anche gli ioni più pesanti giungono al detector. È un analizzatore molto sensibile, poiché tutti gli ioni generati dalla sorgente arrivano al detector (al contrario degli analizzatori che funzionano come filtro). Con opportuni accorgimenti, può raggiungere risoluzione sufficiente per misure di massa esatta. Il principale svantaggio è che richiede una sorgente ad impulsi (tipicamente MALDI, ma anche l electrospray può essere reso ad impulsi).
68 La risoluzione del TOF I primi analizzatori TOF avevano risoluzione bassa. Il motivo è essenzialmente l energia cinetica con cui gli ioni sono desorbiti dalla matrice dopo l impulso del laser, e che si somma a quella fornita dal campo elettrico. Ioni con la stessa massa ma con energia cinetica iniziale diversa arrivano al detector in momenti leggermente diversi. Questo allarga i picchi e diminuisce la risoluzione.
69 reflectron e delayed extraction La risoluzione degli attuali analizzatori TOF è invece molto buona grazie a due accorgimenti: 1. Il primo è il reflectron, uno specchio elettrostatico che inverte la direzione degli ioni. Il reflectron ritarda gli ioni a energia cinetica maggiore (che percorrono una traiettoria più lunga al suo interno) e li fa arrivare al detector insieme a quelli ad energia cinetica minore. Il TOF con reflectron ha migliore risoluzione del TOF lineare (senza reflectron)
70 2. L altro accorgimento è la delayed extraction (estrazione ritardata). Il campo elettrico che accelera gli ioni non è acceso esattamente al momento dell impulso laser, ma alcuni microsecondi più tardi. Gli ioni che hanno già una elevata velocità si trovano più avanti quando il potenziale elettrostatico è acceso, e vengono accelerati per un minore intervallo di spazio e quindi in misura minore. La delayed extraction compensa la diversa velocità iniziale degli ioni
71 In questo recente spettro MALDI-TOF la risoluzione è molto maggiore
72 Uno ione in un campo magnetico uniforme segue una traiettoria circolare. Il numero di giri al secondo percorsi dagli ioni, cioè la frequenza di rotazione degli ioni, è detta frequenza di ciclotrone. La frequenza di ciclotrone è inversamente proporzionale al rapporto m/z (ma è indipendente dal raggio dell orbita). Misurare la frequenza di ciclotrone equivale quindi a misurare il rapporto m/z degli ioni. Gli ioni sono cariche in movimento, e ruotando generano un campo elettrico (e un campo magnetico) oscillante: una radiofrequenza (rf). Questa rf può essere rivelata da una coppia di elettrodi posti ai lati della cella.
73 Se però gli ioni sono distribuiti uniformemente lungo l orbita, non si genera alcun segnale. Perché si osservi un segnale, ioni devono essere raggruppati in modo da formare un pacchetto di ioni in rotazione. La frequenza della rf è pari alla frequenza di ciclotrone (quindi è diversa per ogni ione, ed è inversamente proporzionale al suo rapporto m/z). Gli ioni vengono introdotti nella cella, e all inizio sono a riposo al centro della cella (1). Il pacchetto di ioni è generato da una radiofrequenza alla frequenza di ciclotrone degli ioni, che cede energia agli ioni aumentando il raggio della loro orbita, e soprattutto li mette tutti in fase (2). A questo punto si spegne la radiofrequenza (3), e si registra il segnale emesso dagli ioni (4).
74 Se nella cella c è uno solo tipo di ione, questo emette alla sua frequenza di ciclotrone (con intensità che decresce nel tempo), che può essere misurata. Se nella cella ci sono due o più tipi di ioni (come succede quasi sempre) ogni tipo di ione emette alla sua frequenza di ciclotrone. Il segnale emesso è perciò la somma di più radiofrequenze a frequenze diverse. Esiste una procedura matematica, detta Trasformata di Fourier (FT) che permette di ricavare le frequenze di ognuna delle radiofrequenze. Ricavare le frequenze equivale a ricavare i rapporti m/z, per cui la trasformata di Fourier del segnale emesso dagli ioni dà lo spettro di massa degli ioni presenti nella cella.
75 Caratteristiche della FT-ICR L analizzatore FT-ICR ha la risoluzione più alta tra tutti gli analizzatori. Può facilmente raggiungere per un m/z di È quindi ideale per determinare la formula molecolare anche per molecole piuttosto grandi. Il limite superiore di massa è abbastanza elevato, intorno a m/z Gli strumenti FT-ICR sono costosi, perché richiedono un campo magnetico molto intenso (si usano magneti superconduttori, come vedremo per l NMR). Gli strumenti FT-ICR sono molto sensibili, e hanno il vantaggio di non distruggere gli ioni nella misura.
76
77 La prima informazione utile per giungere all identificazione di un polipeptide si può ottenere mediante peptide mass fingerprinting. L impronta altro non è che lo spettro di massa degli oligopeptidi generabili da quel polipeptide adottando una determinata procedura chimica o enzimatica di frammentazione. Il metodo si basa sul confronto per omologia tra i dati sperimentali (lo spettro di massa) e i dati ottenuti dalla digestione in silico (o virtuale) delle proteine presenti nelle banche dati disponibili in rete. La digestione con un enzima proteolitico, nella maggior parte dei casi tripsina, va a frammentare il polipeptide o la miscela di proteine in oligopeptidi. L analisi spettrometrica dei frammenti ottenuti fornisce una misura accurata dei loro valori di massa nella forma di uno spettro di massa
78 Se si sottopone a proteolisi con tripsina un determinato polipeptide, la miscela di oligopeptidi che si ottiene come prodotto è del tutto riproducibile in quanto la tripsina frammenta la catena polipeptidica agendo quasi esclusivamente sui legami peptidici in cui lisina e arginina impegnano la loro funzione carbossilica. Spettro di massa MALDI-TOF di un digerito triptico di β-caseina. Una ricerca in database tramite PMF è solitamente utilizzata in esperimenti che utilizzano spettrometria di massa MALDI-TOF, in cui i peptidi vengono rilevate come specie cariche singolarmente ([M+H]+). In ascisse si trovano i valori di m/z corrispondenti ai peptidi rilevati.
79 Le masse degli oligopeptidi ottenuti dalla digestione triptica vengono messi a confronto con database proteomici disponibili in rete. Viene effettuato il confronto fra le masse dei frammenti ottenuti in vitro dalla proteina incognita e le masse dei frammenti ottenuti dalla digestione in silico di tutte le proteine presenti in bancadati. I risultati che si ottengono vengono successivamente valutati per identificare la sequenza per cui la corrispondenza dei valori è massima. Dal grado di sovrapposizione tra il set di dati sperimentali e il set di dati ottenuti in silico viene ricavato, mediante semplici procedimenti matematici e statistici, un punteggio (score) che definisce la probabilità che l identificazione sia corretta. Il vantaggio del metodo sta nel fatto che si può identificare una proteina senza determinarne la sequenza amminoacidica ma semplicemente conoscendo le masse dei peptidi ottenuti per proteolisi. La principale limitazione è che la proteina incognita non può essere identificata se la sua sequenza non è contenuta nella banca-dati a cui si fa riferimento
80 Nella sua forma più semplice, uno spettrometro di massa tandem risulta praticamente costituito dalla combinazione di due spettrometri di massa: il primo spettrometro seleziona una singola massa (ione precursore). lo ione selezionato passa attraverso una camera di collisione; in questa camera, per frammentazione causata da collisioni con molecole di un gas inerte, dallo ione precursore si originano ioni figli; gli ioni figli vengono separati nel secondo quadrupolo. Elaborando i dati analitici con software dedicati, il processo di frammentazione dello ione genitore consente di effettuarne in maniera del tutto strumentale il sequenziamento.
81 Uno spettrometro di massa tandem ha due analizzatori, e una camera di collisione. Il primo analizzatore seleziona un certo ione molecolare (ione genitore). La camera di collisione serve a provocare la frammentazione dello ione. Il secondo analizzatore misura la massa dei frammenti prodotti. Nella camera di collisione possono essere frammentati tre diversi tipi di legame della sequenza amminoacidica: I legami NH-CH, CH- CO e CO-NH. Per rottura di ciascun legame si ottengono due frammenti: il primo è neutro mentre l altro (l unico da considerare perché rilevabile dallo spettrometro) è carico. La carica può trovarsi in uno qualsiasi dei due frammenti; quale dei due dipende dalla loro affinità relativa per il protone.
82 I frammenti che si possono ottenere sono convenzionalmente indicati con le lettere a, b, o c se la carica è trattenuta nel frammento N-terminale e con le lettere x, y o z se la carica è mantenuta nel frammento C-terminale. Il pedice indica il numero di residui amminoacidici contenuti nel frammento mentre l apice è talora utilizzato per indicare perdite neutre (* per la perdita di ammoniaca, per la perdita di acqua). Per ogni amminoacido della catena ci sono sei possibili ioni prodotti dalla frammentazione: gli ioni a, b e c, con la carica elettrica nel frammento N-terminale, e gli ioni x, y e z che hanno la carica nel frammento C-terminale. Il sito di frammentazione più probabile è il legame peptidico, cioè legame CO-NH, e quindi i frammenti carichi più probabili sono b e/o y. La differenza di massa fra due ioni b o y adiacenti, dà la misura della massa di quel particolare residuo amminoacidico.
83 Il secondo quadrupolo dello spettrometro di massa tandem, usando la stessa logica descritta in precedenza, rileva i valori m/z di tutti i frammenti figlio, fornendo così un impronta digitale del peptide analizzato molto più affidabile di quella ottenibile con uno spettrometro di massa ad un solo quadrupolo. In uno spettrometro MS/MS a triplo quadrupolo la camera di collisione è anch essa un quadrupolo, ma regolato in modo da far passare tutti gli ioni, e contenente una certa quantità di gas che provoca la frammentazione.
84 Negli spettri ESI di campioni proteici esiste una correlazione tra lo stato di carica delle proteine ripiegate e l estensione della superficie accessibile al solvente della struttura nativa delle proteine stesse. Ciò consente di ricavare fondamentali informazioni su: lo stato di folding delle proteine (e quindi i processi di cambiamento conformazionale, denaturazione, rinaturazione, unfolding) la formazione di complessi non covalenti (oligomerizzazione, interazioni ligando-proteina)
85 Le proteine folded sono caratterizzate da CSD strette con valore di m/z relativamente elevati le proteine unfolded danno CDS larghe spostate verso m/z minori CSD: charge-state distribution
86 La formazione di complessi non covalenti viene rilevata da uno shift della massa dal valore relativo allo stato free a quello relativo allo stato bound per interazioni proteinapiccolo ligando la massa del complesso normalmente corrisponde alla somma esatta delle masse delle componenti molecolari nel caso degli oligomeri si osserveranno picchi specifici per una data stechiometria; al crescere del numero di subunità la CSD è caratterizzata da più picchi «ammucchiati»
Analizzatore a tempo di volo (TOF)
 La sorgente MALDI è una sorgente ad impulsi: non genera un flusso continuo di ioni, ma una grande quantità di ioni in pochissimo tempo. Questa sorgente necessita di un particolare analizzatore, l analizzatore
La sorgente MALDI è una sorgente ad impulsi: non genera un flusso continuo di ioni, ma una grande quantità di ioni in pochissimo tempo. Questa sorgente necessita di un particolare analizzatore, l analizzatore
ione molecolare poco intenso ma visibile frammentazioni di tutti i legami C-C: serie di picchi separati di 14 u.m.a. (C n
 Alcani ione molecolare poco intenso ma visibile frammentazioni di tutti i legami C-C: serie di picchi separati di 14 u.m.a. (C n H 2n+1, m/z 43, 57, 71, 85, 99 ), con intensità massima per i cationi a
Alcani ione molecolare poco intenso ma visibile frammentazioni di tutti i legami C-C: serie di picchi separati di 14 u.m.a. (C n H 2n+1, m/z 43, 57, 71, 85, 99 ), con intensità massima per i cationi a
LA SPETTROMETRIA DI MASSA
 LA SPETTROMETRIA DI MASSA Tecnica che consente di caratterizzare e identificare composti sconosciuti e noti in base alla determinazione della loro massa molecolare e alla loro caratterizzazione strutturale
LA SPETTROMETRIA DI MASSA Tecnica che consente di caratterizzare e identificare composti sconosciuti e noti in base alla determinazione della loro massa molecolare e alla loro caratterizzazione strutturale
Spettrometria di massa tandem
 Spettrometria di massa tandem Sorgenti come electrospray e MALDI hanno il vantaggio di provocare poche o nessuna frammentazione, e quindi: garantiscono la misura del peso molecolare possono essere usate
Spettrometria di massa tandem Sorgenti come electrospray e MALDI hanno il vantaggio di provocare poche o nessuna frammentazione, e quindi: garantiscono la misura del peso molecolare possono essere usate
ESERCIZI SPETTROMETRIA DI MASSA
 ESERCIZI SPETTROMETRIA DI MASSA A SPUNTI DI RIFLESSIONE 1. In cosa differiscono le tecniche soft da quelle strong? 2. Con quali tecniche si hanno maggiori probabilità di ottenere ioni molecolari? 3. Per
ESERCIZI SPETTROMETRIA DI MASSA A SPUNTI DI RIFLESSIONE 1. In cosa differiscono le tecniche soft da quelle strong? 2. Con quali tecniche si hanno maggiori probabilità di ottenere ioni molecolari? 3. Per
6 ZEPPA G. BELVISO S.
 Appunti di Tecniche avanzate per il controllo degli alimenti Parte 6 ZEPPA G. BELVISO S. Università degli Studi di Torino Spettrometria di massa Zeppa G. Università degli Studi di Torino Tra i rivelatori
Appunti di Tecniche avanzate per il controllo degli alimenti Parte 6 ZEPPA G. BELVISO S. Università degli Studi di Torino Spettrometria di massa Zeppa G. Università degli Studi di Torino Tra i rivelatori
Spettrometria di massa (principi fondamentali)
 Spettrometria di massa (principi fondamentali) Rilevamento con spettrometria di massa (MS) Una tecnica più raffinata del PID è la spettrometria di massa che prevede l analisi in massa di ioni formati (con
Spettrometria di massa (principi fondamentali) Rilevamento con spettrometria di massa (MS) Una tecnica più raffinata del PID è la spettrometria di massa che prevede l analisi in massa di ioni formati (con
Principali tipi di ioni
 Principali tipi di ioni Ione molecolare Ioni di frammentazione Ioni di riarrangiamento Ioni a carica multipla Ioni metastabili Ioni negativi Ioni di interazione ione-molecola 1 Lo ione molecolare Lo ione
Principali tipi di ioni Ione molecolare Ioni di frammentazione Ioni di riarrangiamento Ioni a carica multipla Ioni metastabili Ioni negativi Ioni di interazione ione-molecola 1 Lo ione molecolare Lo ione
Visita agli spettrometri di massa Dott. Fabio Hollan
 Visita agli spettrometri di massa Dott. Fabio Hollan Strumento a ionizzazione ESI: Electrospray Ionization (formazione di particelle liquide cariche dalle quali gli ioni vengono emessi per desorbimento
Visita agli spettrometri di massa Dott. Fabio Hollan Strumento a ionizzazione ESI: Electrospray Ionization (formazione di particelle liquide cariche dalle quali gli ioni vengono emessi per desorbimento
Componenti di uno spettrometro di massa
 Componenti di uno spettrometro di massa Camera di ionizzazione La biomolecola da analizzare viene ionizzata (i) mediante irraggiamento laser della biomolecola stessa dispersa in una matrice cristallina
Componenti di uno spettrometro di massa Camera di ionizzazione La biomolecola da analizzare viene ionizzata (i) mediante irraggiamento laser della biomolecola stessa dispersa in una matrice cristallina
METODI FISICI IN CHIMICA ORGANICA
 METODI FISICI IN CHIMICA ORGANICA Prima parte Composizione elementare e formula bruta - analisi elementare - grado di insaturazione - spettrometria di massa (parte I) 1 Metodi Fisici in Chimica Organica-La
METODI FISICI IN CHIMICA ORGANICA Prima parte Composizione elementare e formula bruta - analisi elementare - grado di insaturazione - spettrometria di massa (parte I) 1 Metodi Fisici in Chimica Organica-La
Risonanza Magnetica Nucleare NMR
 Risonanza Magnetica Nucleare NMR Numeri quantici di spin di alcuni nuclei Gli isotopi più abbondanti di C e O non hanno spin Element 1 H 2 H 12 C 13 C 14 N 16 O 17 O 19 F N.ro quantico di Spin 1/2 1 0
Risonanza Magnetica Nucleare NMR Numeri quantici di spin di alcuni nuclei Gli isotopi più abbondanti di C e O non hanno spin Element 1 H 2 H 12 C 13 C 14 N 16 O 17 O 19 F N.ro quantico di Spin 1/2 1 0
SPETTROMETRIA DI MASSA. Prof. Antonio Lavecchia
 SPETTROMETRIA DI MASSA Prof. Antonio Lavecchia Spettrometria di Massa E una tecnica analitica che permette di determinare: la formula molecolare la massa delle sostanze, misurando il rapporto massa/carica
SPETTROMETRIA DI MASSA Prof. Antonio Lavecchia Spettrometria di Massa E una tecnica analitica che permette di determinare: la formula molecolare la massa delle sostanze, misurando il rapporto massa/carica
Spettrometria di massa
 Spettrometria di massa Serve a misurare la massa delle molecole. Fornisce la massa molecolare, e anche la formula molecolare La molecola deve essere ionizzata, così da misurare il rapporto massa/carica
Spettrometria di massa Serve a misurare la massa delle molecole. Fornisce la massa molecolare, e anche la formula molecolare La molecola deve essere ionizzata, così da misurare il rapporto massa/carica
MODULO: TECNICHE DI ANALISI Matrix Assisted Laser Desorption Ionisation MALDI. C. Daniel
 MODULO: TECNICHE DI ANALISI Matrix Assisted Laser Desorption Ionisation MALDI C. Daniel La spettrometria di massaèampiamente usata per l analisi delle biomolecole (proteine, polisaccaridi) ma èsempre stata
MODULO: TECNICHE DI ANALISI Matrix Assisted Laser Desorption Ionisation MALDI C. Daniel La spettrometria di massaèampiamente usata per l analisi delle biomolecole (proteine, polisaccaridi) ma èsempre stata
Reazioni di decomposizione
 Reazioni di decomposizione Uno ione ad elett.. dispari Ione a elett.. pari + radicale Uno ione ad elett.. dispari Ione a elett.. dispari + molecola neutra Uno ione ad elett.. pari Ione a elett.. pari +
Reazioni di decomposizione Uno ione ad elett.. dispari Ione a elett.. pari + radicale Uno ione ad elett.. dispari Ione a elett.. dispari + molecola neutra Uno ione ad elett.. pari Ione a elett.. pari +
S P E T T R O S C O P I A. Dispense di Chimica Fisica per Biotecnologie Dr.ssa Rosa Terracciano
 S P E T T R O S C O P I A SPETTROSCOPIA II PARTE Spettroscopia IR Spettroscopia NMR Spettrometria di massa SPETTROSCOPIA INFRAROSSA Le radiazioni infrarosse non hanno sufficiente energia da eccitare gli
S P E T T R O S C O P I A SPETTROSCOPIA II PARTE Spettroscopia IR Spettroscopia NMR Spettrometria di massa SPETTROSCOPIA INFRAROSSA Le radiazioni infrarosse non hanno sufficiente energia da eccitare gli
Diametro del nucleo: m. Diametro dell atomo: m
 Diametro del nucleo: 10 15 m Diametro dell atomo: 10 9-10 10 m The nuclear atom Thomson (Premio Nobel per la Fisica nel 1907) scopre l elettrone nel 1897 Rutherford (Premio Nobel per la Chimica nel 1908)
Diametro del nucleo: 10 15 m Diametro dell atomo: 10 9-10 10 m The nuclear atom Thomson (Premio Nobel per la Fisica nel 1907) scopre l elettrone nel 1897 Rutherford (Premio Nobel per la Chimica nel 1908)
La risoluzione di un buon spettrometro di massa è 1 amu (atomic mass number) su10 4 amu.
 PRINCIPI DELLA SPETTROMETRIA DI MASSA A differenza delle altre tecniche analitiche (IR, UV-vis, NMR) in cui il campione rimane intatto dopo l analisi, la spettrometria di massa, che forma ed utilizza ioni
PRINCIPI DELLA SPETTROMETRIA DI MASSA A differenza delle altre tecniche analitiche (IR, UV-vis, NMR) in cui il campione rimane intatto dopo l analisi, la spettrometria di massa, che forma ed utilizza ioni
METODI FISICI IN CHIMICA ORGANICA
 METODI FISICI IN CHIMICA ORGANICA Prima parte Composizione elementare e formula bruta - analisi elementare - grado di insaturazione - spettrometria di massa 1 Metodi Fisici in Chimica Organica-La formula
METODI FISICI IN CHIMICA ORGANICA Prima parte Composizione elementare e formula bruta - analisi elementare - grado di insaturazione - spettrometria di massa 1 Metodi Fisici in Chimica Organica-La formula
SPETTROMETRIA DI MASSA
 SPETTROMETRIA DI MASSA La spettrometria di massa è una tecnica che permette di misurare la massa di una molecola (e in alcuni casi di suoi frammenti). In uno spettrometro di massa, la molecola deve essere
SPETTROMETRIA DI MASSA La spettrometria di massa è una tecnica che permette di misurare la massa di una molecola (e in alcuni casi di suoi frammenti). In uno spettrometro di massa, la molecola deve essere
Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo
 Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo spettrometria di massa elettroforesi Spettrometria di massa Tecnica per indagine che si basa sulla ionizzazione di una molecola
Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo spettrometria di massa elettroforesi Spettrometria di massa Tecnica per indagine che si basa sulla ionizzazione di una molecola
Relazione spettro struttura della molecola organica. Ciascuna sostanza una volta ionizzata, si FRAMMENTA secondo
 Relazione spettro struttura della molecola organica Ciascuna sostanza una volta ionizzata, si FRAMMENTA secondo regole di frammentazione ben precise,, che dipendono dalla struttura della molecola stessa
Relazione spettro struttura della molecola organica Ciascuna sostanza una volta ionizzata, si FRAMMENTA secondo regole di frammentazione ben precise,, che dipendono dalla struttura della molecola stessa
Peso Atomico. Tre problemi da risolvere!! (2) Quale unità di misura conviene adottare?
 Peso Atomico Tre problemi da risolvere!! (1) Difetto di massa (2) Quale unità di misura conviene adottare? (3) Come tener conto della miscela isotopica naturale per ciascun elemento? Il difetto di massa
Peso Atomico Tre problemi da risolvere!! (1) Difetto di massa (2) Quale unità di misura conviene adottare? (3) Come tener conto della miscela isotopica naturale per ciascun elemento? Il difetto di massa
Aldeidi e chetoni. 1) Rottura α 2) Rottura i. Più pronunciate nei chetoni. 3) Rottura β con trasposizione di H in γ (McLafferty)
 Aldeidi e chetoni Hanno potenziale di ionizzazione inferiore a quello degli alcooli dunque lo ione molecolare è più intenso e più facilmente osservabile anche in aldeidi e chetoni superiori. 1) Rottura
Aldeidi e chetoni Hanno potenziale di ionizzazione inferiore a quello degli alcooli dunque lo ione molecolare è più intenso e più facilmente osservabile anche in aldeidi e chetoni superiori. 1) Rottura
Theory Italiano (Italy)
 Q3-1 Large Hadron Collider (10 punti) Prima di iniziare questo problema, leggi le istruzioni generali nella busta a parte. In questo problema è discussa la fisica dell acceleratore di particelle del CERN
Q3-1 Large Hadron Collider (10 punti) Prima di iniziare questo problema, leggi le istruzioni generali nella busta a parte. In questo problema è discussa la fisica dell acceleratore di particelle del CERN
GASCROMATOGRAFIA INTRODUZIONE
 GASCROMATOGRAFIA INTRODUZIONE La Gascromatografia è una tecnica analitica utile per separare componenti o soluti di una miscela, sulla base delle quantità relative di ogni soluto, distribuite fra un carrier
GASCROMATOGRAFIA INTRODUZIONE La Gascromatografia è una tecnica analitica utile per separare componenti o soluti di una miscela, sulla base delle quantità relative di ogni soluto, distribuite fra un carrier
Il modello strutturale dell atomo
 Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Cos è un trasformazione chimica?
 Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
Chimica Lezione 1 Cos è un trasformazione chimica? Una reazione chimica è una trasformazione della materia che avviene senza variazioni misurabili di massa, in cui uno o più reagenti iniziali modificano
SPETTROMETRIA DI MASSA
 SPETTROMETRIA DI MASSA La spettrometria di massa è una tecnica analitica potente usata per identificare prodotti incogniti, per determinazioni quantitative di composti noti e per r chiarire le proprietà
SPETTROMETRIA DI MASSA La spettrometria di massa è una tecnica analitica potente usata per identificare prodotti incogniti, per determinazioni quantitative di composti noti e per r chiarire le proprietà
La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione.
 Tecniche di analisi chimica Prof. Marcello Romagnoli Titolazione La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione. Una quantità nota del
Tecniche di analisi chimica Prof. Marcello Romagnoli Titolazione La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione. Una quantità nota del
Classificazione della materia 3 STATI DI AGGREGAZIONE
 Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Sommario della lezione 2. Materia e definizioni. Struttura dell atomo
 Sommario della lezione 2 Materia e definizioni Struttura dell atomo La materia è qualsiasi cosa abbia una massa e occupi uno spazio. Esiste in tre stati: Solido Forma e volume determinati Liquido Volume
Sommario della lezione 2 Materia e definizioni Struttura dell atomo La materia è qualsiasi cosa abbia una massa e occupi uno spazio. Esiste in tre stati: Solido Forma e volume determinati Liquido Volume
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare
 Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Elementi e composti Pesi atomici e pesi molecolari Mole e massa molare 2 a lezione 17 ottobre 2016 Elementi ed atomi Una sostanza viene definita «elemento» quando non è scomponibile in altre sostanze Un
Chimica del carbonio. 1. Composti contenenti azoto (C,H,N) ammine. Aromatici (derivati del benzene di formula C 6 H 6 )
 himica del carbonio Il carbonio forma con 4 atomi diversi 4 legami covalenti equivalenti posti a 109,5, oppure con 3 atomi diversi 3 legami posti a 120, di cui uno doppio, oppure 2 legami covalenti con
himica del carbonio Il carbonio forma con 4 atomi diversi 4 legami covalenti equivalenti posti a 109,5, oppure con 3 atomi diversi 3 legami posti a 120, di cui uno doppio, oppure 2 legami covalenti con
COMPETENZE ABILITÀ CONOSCENZE. descrivere la. Comprendere ed applicare analogie relative ai concetti presi in analisi. struttura.
 ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
ca descrivere la struttura dell atomo, la tavola periodica e le sue caratteristiche per spiegare le differenze tra i vari tipi di legami, descrivendoli e interpretandoli alla luce degli elettroni di valenza
U.M.A. e le masse ATOMICHE
 U.M.A. e le masse ATOMICHE L unità di massa atomica (u.m.a.) viene definita come 1/12 della massa del 12 C Il peso atomico (massa atomica relativa) di un atomo viene definito come: massa atomo considerato
U.M.A. e le masse ATOMICHE L unità di massa atomica (u.m.a.) viene definita come 1/12 della massa del 12 C Il peso atomico (massa atomica relativa) di un atomo viene definito come: massa atomo considerato
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
combinazione di atomi tenuti insieme da forze più o meno un insieme caratteristico di proprietà
 IL LEGAME CHIMICO La regola dell ottetto sebbene una semplificazione rende conto del perchè gli atomi reagiscono. In natura, solo i gas nobili sono presenti come specie monoatomiche. Anche le sostanze
IL LEGAME CHIMICO La regola dell ottetto sebbene una semplificazione rende conto del perchè gli atomi reagiscono. In natura, solo i gas nobili sono presenti come specie monoatomiche. Anche le sostanze
Spettrometria di massa
 Spettrometria di massa La spettrometria di massa e una tecnica che consente di misurare il peso di atomi o molecole. La determinazione della massa, o del peso molecolare e sempre utile per individuare
Spettrometria di massa La spettrometria di massa e una tecnica che consente di misurare il peso di atomi o molecole. La determinazione della massa, o del peso molecolare e sempre utile per individuare
Ionizzazione electrospray (ESI)
 Ionizzazione electrospray (ESI) Campione in fase liquida Analizzatore e - - Il potenziale applicato alla fine dell ago e e sufficientemente alto da nebulizzare la soluzione in una miriade di goccioline
Ionizzazione electrospray (ESI) Campione in fase liquida Analizzatore e - - Il potenziale applicato alla fine dell ago e e sufficientemente alto da nebulizzare la soluzione in una miriade di goccioline
Fenomeni di Rilassamento
 Fenomeni di Rilassamento z z B 0 x Impulso rf a 90 x y y B 0 z x y Rilassamento Il sistema perturbato ritorna all equilibrio mediante i processi di rilassamento: Longitudinale conduce al ripristino del
Fenomeni di Rilassamento z z B 0 x Impulso rf a 90 x y y B 0 z x y Rilassamento Il sistema perturbato ritorna all equilibrio mediante i processi di rilassamento: Longitudinale conduce al ripristino del
Applicazione della tecnica ESI-MS/MS all identificazione e quantificazione di molecole complesse Carla Zannoni
 Applicazione della tecnica ESI-MS/MS all identificazione e quantificazione di molecole complesse Carla Zannoni Eni SpA Spettrometria di massa con campione in fase liquida: principi di funzionamento ed
Applicazione della tecnica ESI-MS/MS all identificazione e quantificazione di molecole complesse Carla Zannoni Eni SpA Spettrometria di massa con campione in fase liquida: principi di funzionamento ed
Struttura dell atomo e Sistema Periodico degli elementi unità 1, 2 e 3, modulo C del libro
 Struttura dell atomo e Sistema Periodico degli elementi unità 1, 2 e 3, modulo C del libro Gli atomi di tutti gli elementi sono formati da tre tipi di particelle elementari: elettrone, protone e neutrone.
Struttura dell atomo e Sistema Periodico degli elementi unità 1, 2 e 3, modulo C del libro Gli atomi di tutti gli elementi sono formati da tre tipi di particelle elementari: elettrone, protone e neutrone.
le SOSTANZE Sostanze elementari (ELEMENTI) COMPOSTI Costituiti da due o più atomi DIVERSI tra loro
 Il legame chimico In natura gli atomi sono solitamente legati ad altri in unità più complesse che, se aggregate fra loro costituiscono quello che macroscopicamente percepiamo come materia, le SOSTANZE
Il legame chimico In natura gli atomi sono solitamente legati ad altri in unità più complesse che, se aggregate fra loro costituiscono quello che macroscopicamente percepiamo come materia, le SOSTANZE
Formazione di orbitali π. La differenza di energia tra due orbitali π è minore di quella tra due orbitali. Orbitali di non legame, n
 Spettroscopia Studia le interazione tra le radiazioni elettromagnetiche e la materia. Come sono fatti questi sistemi? La formazione dei legami chimici viene spiegata in termini di interazioni di orbitali
Spettroscopia Studia le interazione tra le radiazioni elettromagnetiche e la materia. Come sono fatti questi sistemi? La formazione dei legami chimici viene spiegata in termini di interazioni di orbitali
Roberta Pierattelli. Metalli in Biologia. Qualche richiamo di chimica generale e inorganica
 Roberta Pierattelli Metalli in Biologia Qualche richiamo di chimica generale e inorganica Le proprietà periodiche n =1 n =2 n =3 n =4 n =5 n =6 n =7 Il numero del gruppo corrisponde alla somma degli elettroni
Roberta Pierattelli Metalli in Biologia Qualche richiamo di chimica generale e inorganica Le proprietà periodiche n =1 n =2 n =3 n =4 n =5 n =6 n =7 Il numero del gruppo corrisponde alla somma degli elettroni
Idrocarburi Saturi. Reazioni
 Idrocarburi Saturi Reazioni Fonti ed usi Gli alcani lineari, ramificati e ciclici si ottengono principalmente dalla lavorazione (frazionamento, cracking, etc.), del petrolio. Fonti ed usi Gli alcani, soprattutto
Idrocarburi Saturi Reazioni Fonti ed usi Gli alcani lineari, ramificati e ciclici si ottengono principalmente dalla lavorazione (frazionamento, cracking, etc.), del petrolio. Fonti ed usi Gli alcani, soprattutto
IDROCARBURI I ALCANI ANALISI CONFORMAZIONALE
 IDROCARBURI I ALCANI NOMENCLATURA ANALISI CONFORMAZIONALE REAZIONI GLI IDROCARBURI CONTENGONO SOLO CARBONIO ED IDROGENO VENGONO DISTINTI IN TRE CLASSI 1. SATURI: SOLO LEGAMI SEMPLICI C-C SE SATURI ED ACICLICI:
IDROCARBURI I ALCANI NOMENCLATURA ANALISI CONFORMAZIONALE REAZIONI GLI IDROCARBURI CONTENGONO SOLO CARBONIO ED IDROGENO VENGONO DISTINTI IN TRE CLASSI 1. SATURI: SOLO LEGAMI SEMPLICI C-C SE SATURI ED ACICLICI:
Spettrometria di massa
 La spettrometria di massa è una tecnica analitica di delucidazione strutturale basata sulla ionizzazione di una molecola e sulla sua successiva frammentazione in ioni di diverso rapporto massa/carica (M/z)
La spettrometria di massa è una tecnica analitica di delucidazione strutturale basata sulla ionizzazione di una molecola e sulla sua successiva frammentazione in ioni di diverso rapporto massa/carica (M/z)
LA TEORIA ATOMICA E L ATOMO Da pagina 81 a pagina 107
 LA TEORIA ATOMICA E L ATOMO Da pagina 81 a pagina 107 4.1 LA TEORIA ATOMICA La materia è formata da atomi, a loro volta costituiti da particelle subatomiche; Esistono tanti tipi di atomi quanti sono gli
LA TEORIA ATOMICA E L ATOMO Da pagina 81 a pagina 107 4.1 LA TEORIA ATOMICA La materia è formata da atomi, a loro volta costituiti da particelle subatomiche; Esistono tanti tipi di atomi quanti sono gli
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
TECNICHE SPETTROSCOPICHE
 TECNICHE SPETTROSCOPICHE L interazione delle radiazioni elettromagnetiche con la materia e essenzialmente un fenomeno quantico, che dipende sia dalle proprieta della radiazione sia dalla natura della materia
TECNICHE SPETTROSCOPICHE L interazione delle radiazioni elettromagnetiche con la materia e essenzialmente un fenomeno quantico, che dipende sia dalle proprieta della radiazione sia dalla natura della materia
Prof.ssa Stacca Prof.ssa Stacca
 La bassa differenza di elettronegatività tra C e H fa sì che i legami presenti negli alcani siano legami covalenti quasi omopolari; di conseguenza gli alcani sono composti apolari. La bassa differenza
La bassa differenza di elettronegatività tra C e H fa sì che i legami presenti negli alcani siano legami covalenti quasi omopolari; di conseguenza gli alcani sono composti apolari. La bassa differenza
Tipi di fiamma. Velocità di combustione troppo elevate comportano atomizzazione incompleta e quindi minore sensibilità
 Tipi di fiamma Velocità di combustione troppo elevate comportano atomizzazione incompleta e quindi minore sensibilità Assorbanza e fiamma ossidazione Equazione di Boltzmann: mette in relazione il rapporto
Tipi di fiamma Velocità di combustione troppo elevate comportano atomizzazione incompleta e quindi minore sensibilità Assorbanza e fiamma ossidazione Equazione di Boltzmann: mette in relazione il rapporto
satura SOLUZIONE concentrata diluita MISCUGLIO ETEROGENEO Sospensione (acqua e polvere di marmo) Miscuglio solido (es. sabbia)
 MISCUGLIO ETEROGENEO: è un insieme di due o più sostanze che, pur essendo mescolate tra loro conservano ciascuna le proprie caratteristiche fisiche e chimiche. MISCUGLIO ETEROGENEO Miscuglio solido (es.
MISCUGLIO ETEROGENEO: è un insieme di due o più sostanze che, pur essendo mescolate tra loro conservano ciascuna le proprie caratteristiche fisiche e chimiche. MISCUGLIO ETEROGENEO Miscuglio solido (es.
Identificazione di un composto organico:
 Identificazione di un composto organico: Laboratorio di Chimica Organica II? O O NO 2 Identificazione di un composto organico: Laboratorio di Chimica Organica II? Analisi elementare: formula bruta (C x
Identificazione di un composto organico: Laboratorio di Chimica Organica II? O O NO 2 Identificazione di un composto organico: Laboratorio di Chimica Organica II? Analisi elementare: formula bruta (C x
9065X Chimica. Modello esame svolto. Esempio di compito scritto di Chimica. Politecnico di Torino CeTeM
 svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
CLASSIFICAZIONE DELLE BANDE DI ASSORBIMENTO. Fig. 4
 CLASSIFICAZIONE DELLE BANDE DI ASSORBIMENTO Fig. 4 1 E PERCE BANDE E NON RIGE? E 3 Nell pratica : E 2 E 1 E 0 4000 600 cm -1 4000 600 cm -1 Tra 2 livelli vibrazionali puliti Sottolivelli rotazionali 2
CLASSIFICAZIONE DELLE BANDE DI ASSORBIMENTO Fig. 4 1 E PERCE BANDE E NON RIGE? E 3 Nell pratica : E 2 E 1 E 0 4000 600 cm -1 4000 600 cm -1 Tra 2 livelli vibrazionali puliti Sottolivelli rotazionali 2
Sorgenti di ioni negativi
 Sorgenti di ioni negativi Fabio Scarpa INFN Laboratori Nazionali di Legnaro Fabio Scarpa 1 Argomenti Trattati Cenni di richiamo sugli ioni Affinità elettronica Metodi e procedure di ionizzazione Sputtering
Sorgenti di ioni negativi Fabio Scarpa INFN Laboratori Nazionali di Legnaro Fabio Scarpa 1 Argomenti Trattati Cenni di richiamo sugli ioni Affinità elettronica Metodi e procedure di ionizzazione Sputtering
Diagramma a blocchi: tipi di analizzatori
 Diagramma a blocchi: tipi di analizzatori Sistema di vuoto Introduzione Sorgente di ioni Analizzatore Detector Data System Diagramma a blocchi: tipi di analizzatori Sistema di vuoto Introduzione Sorgente
Diagramma a blocchi: tipi di analizzatori Sistema di vuoto Introduzione Sorgente di ioni Analizzatore Detector Data System Diagramma a blocchi: tipi di analizzatori Sistema di vuoto Introduzione Sorgente
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO
 I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
03/04/2019 METODI SPETTROSCOPICI - 3. Risonanza magnetica elettronica (EPR O ESR) CHIMICA ANALITICA UNIVERSITÀ DEGLI STUDI DI TERAMO
 UNIVERSITÀ DEGLI STUDI DI TERAMO CL in BIOTECNOLOGIE Anno Accademico 2016/2017 CHIMICA ANALITICA METODI SPETTROSCOPICI - 3 La risonanza magnetica elettronica è una branca della spettroscopia nella quale
UNIVERSITÀ DEGLI STUDI DI TERAMO CL in BIOTECNOLOGIE Anno Accademico 2016/2017 CHIMICA ANALITICA METODI SPETTROSCOPICI - 3 La risonanza magnetica elettronica è una branca della spettroscopia nella quale
STRUTTURA ATOMICA. tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica
 STRUTTURA ATOMICA tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica il nucleo è composto da protoni e neutroni che hanno massa = 1 nella scala dei pesi atomici
STRUTTURA ATOMICA tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica il nucleo è composto da protoni e neutroni che hanno massa = 1 nella scala dei pesi atomici
Esercitazioni di Elementi di Chimica. Modulo 2 Struttura della Materia
 Esercitazioni di Elementi di Chimica Modulo 2 Struttura della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Qual è lo stato fisico
Esercitazioni di Elementi di Chimica Modulo 2 Struttura della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Qual è lo stato fisico
5.1 SPETTROMETRIA DI MASSA
 5.1 SPETTROMETRIA DI MASSA La spettrometria di massa è una tecnica analitica che fornisce informazioni utili sulla struttura chimica dei composti esaminati, permettendone l identificazione e la determinazione
5.1 SPETTROMETRIA DI MASSA La spettrometria di massa è una tecnica analitica che fornisce informazioni utili sulla struttura chimica dei composti esaminati, permettendone l identificazione e la determinazione
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Rivelazione, identificazione, caratterizzazione strutturale
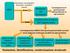 HPLC Separazione cromatografica di proteine e peptidi in miscela Eluato Rivelatore UV (fotodiodi) Cromatogramma UV (picchi generati dall assorbimento di ogni proteina) Eluato Spettrometro di massa ESI-Trappola
HPLC Separazione cromatografica di proteine e peptidi in miscela Eluato Rivelatore UV (fotodiodi) Cromatogramma UV (picchi generati dall assorbimento di ogni proteina) Eluato Spettrometro di massa ESI-Trappola
Numero atomico Z : numero di protoni presenti nell atomo di quell elemento. Numero di massa A : somma dei protoni e dei neutroni in un atomo
 ATOMI E TAVOLA PERIODICA ATOMO: è il più piccolo costituente di un elemento che ne conservi le proprietà chimiche ELEMENTO: sostanza che non può essere scissa in una sostanza più semplice mediante reazione
ATOMI E TAVOLA PERIODICA ATOMO: è il più piccolo costituente di un elemento che ne conservi le proprietà chimiche ELEMENTO: sostanza che non può essere scissa in una sostanza più semplice mediante reazione
FISICA delle APPARECCHIATURE per RADIOTERAPIA
 Anno Accademico 2012-2013 Corso di Laurea in Tecniche Sanitarie di Radiologia Medica per Immagini e Radioterapia FISICA delle APPARECCHIATURE per RADIOTERAPIA Marta Ruspa 20.01.13 M. Ruspa 1 ONDE ELETTROMAGNETICHE
Anno Accademico 2012-2013 Corso di Laurea in Tecniche Sanitarie di Radiologia Medica per Immagini e Radioterapia FISICA delle APPARECCHIATURE per RADIOTERAPIA Marta Ruspa 20.01.13 M. Ruspa 1 ONDE ELETTROMAGNETICHE
Chimica: Studio della materia e delle sue interazioni.
 Chimica: Studio della materia e delle sue interazioni. La descrizione della materia viene affrontata da: punto di vista microscopico: studio di atomi e molecole le loro interazioni e le reazioni chimiche
Chimica: Studio della materia e delle sue interazioni. La descrizione della materia viene affrontata da: punto di vista microscopico: studio di atomi e molecole le loro interazioni e le reazioni chimiche
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero La vita è una reazione chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola
La Vita è una Reazione Chimica Acqua Oro Zucchero La vita è una reazione chimica ü ü ü ü ü ü ü ü ü ü Cosa studia la chimica? Classificazione della materia Stati della materia Formule chimiche Atomo Tavola
L Atomo Nucleare. Rutherford protoni James Chadwick neutroni 1932
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Università degli Studi di Perugia Facoltà di Scienze Matematiche Fisiche e Naturali
 Università degli Studi di Perugia Facoltà di Scienze Matematiche Fisiche e Naturali Corso di Laurea in Chimica A.A. 2012/13 Test di autovalutazione 2 ottobre 2012 Cognome: Nome: Matematica e logica 1.
Università degli Studi di Perugia Facoltà di Scienze Matematiche Fisiche e Naturali Corso di Laurea in Chimica A.A. 2012/13 Test di autovalutazione 2 ottobre 2012 Cognome: Nome: Matematica e logica 1.
ISOTOPI. STRUTTURA DELL ATOMO Gli atomi sono costituiti da un nucleo e da. che si muovono intorno ad esso.
 ISOTOPI STRUTTURA DELL ATOMO Gli atomi sono costituiti da un nucleo e da. che si muovono intorno ad esso. Il nucleo atomico è costituito da PROTONI,, che hanno una carica elettrica positiva, e da NEUTRONI,,
ISOTOPI STRUTTURA DELL ATOMO Gli atomi sono costituiti da un nucleo e da. che si muovono intorno ad esso. Il nucleo atomico è costituito da PROTONI,, che hanno una carica elettrica positiva, e da NEUTRONI,,
Atomi, molecole e ioni
 Atomi, molecole e ioni anione + - catione Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento
Atomi, molecole e ioni anione + - catione Teoria atomica di Dalton 1. Un elemento è composto da particelle minuscole chiamate atomi. 2. In una normale reazione chimica, nessun atomo di nessun elemento
Spettroscopia di Massa
 Spettroscopia di Massa Joseph John Thomson 1906 Nobel Prize for Physics "in recognition of the great merits of his theoretical and experimental investigations on the conduction of electricity by gases"
Spettroscopia di Massa Joseph John Thomson 1906 Nobel Prize for Physics "in recognition of the great merits of his theoretical and experimental investigations on the conduction of electricity by gases"
Principio dell Aufbau (riempimento)
 LA TABELLA PERIODICA DEGLI ELEMENTI Principio dell Aufbau (riempimento) Schema semplificato dei livelli energetici atomici Distribuzione energetica reale dei livelli energetici atomici 7p Schema empirico
LA TABELLA PERIODICA DEGLI ELEMENTI Principio dell Aufbau (riempimento) Schema semplificato dei livelli energetici atomici Distribuzione energetica reale dei livelli energetici atomici 7p Schema empirico
Ammidi. Le frammentazioni di conseguenza possono essere originare dai due siti in cui è possibile localizzare la carica e il radicale NH 2
 Ammidi Hanno un comportamento simile a quello degli acidi o esteri metilenici Con la ionizzazione la carica e radicale si localizzano sull ossigeno del carbonile o sull azoto Le frammentazioni di conseguenza
Ammidi Hanno un comportamento simile a quello degli acidi o esteri metilenici Con la ionizzazione la carica e radicale si localizzano sull ossigeno del carbonile o sull azoto Le frammentazioni di conseguenza
Alogenuri alchilici. Alogenuri alchilici: funzioni. Varietà di funzione dei composti alogenati. Figura
 Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: nomenclatura Alogenuri alchilici o aloalcani Bromo Alogenuri alchilici: struttura
Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: nomenclatura Alogenuri alchilici o aloalcani Bromo Alogenuri alchilici: struttura
Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe
 1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
1 Verifica di chimica su: Atomo, tavola periodica, legame chimico Nome cognome data classe 21) Quanti neutroni, protoni ed elettroni ha l elemento con numero atomico Z = 23 e numero di massa A = 51? P=23,
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
Magnete. Campo magnetico. Fenomeni magnetici. Esempio. Esempio. Che cos è un magnete? FENOMENI MAGNETICI
 Magnete FENOMENI MAGNETICI Che cos è un magnete? Un magnete è un materiale in grado di attrarre pezzi di ferro Prof. Crosetto Silvio 2 Prof. Crosetto Silvio Quando si avvicina ad un pezzo di magnetite
Magnete FENOMENI MAGNETICI Che cos è un magnete? Un magnete è un materiale in grado di attrarre pezzi di ferro Prof. Crosetto Silvio 2 Prof. Crosetto Silvio Quando si avvicina ad un pezzo di magnetite
Scienziati in Erba Chimica
 Scienziati in Erba Chimica Acqua Oro Zucchero L atomo Acqua Oro Zucchero La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti
Scienziati in Erba Chimica Acqua Oro Zucchero L atomo Acqua Oro Zucchero La Teoria Atomica di Dalton (1808) 1. Gli Elementi sono composti da particelle estremamente piccole, denominate atomi. 2. Tutti
Unità 7. La corrente elettrica nei liquidi e nei gas
 Unità 7 La corrente elettrica nei liquidi e nei gas 1. Le soluzioni elettrolitiche M. Faraday scoprì che una soluzione di acqua (di per sé isolante) con un sale, una base o un acido è conduttrice di elettricità;
Unità 7 La corrente elettrica nei liquidi e nei gas 1. Le soluzioni elettrolitiche M. Faraday scoprì che una soluzione di acqua (di per sé isolante) con un sale, una base o un acido è conduttrice di elettricità;
Introduzione alla Chimica Organica V Ed.
 William H. Brown - Thomas Poon Introduzione alla Chimica Organica V Ed. Capitolo 2 2.1 Cosa sono gli acidi e le basi secondo Arrhenius? Un Acido di Arrhenius è una sostanze che sciolta in acqua produce
William H. Brown - Thomas Poon Introduzione alla Chimica Organica V Ed. Capitolo 2 2.1 Cosa sono gli acidi e le basi secondo Arrhenius? Un Acido di Arrhenius è una sostanze che sciolta in acqua produce
Molecole e legami. Chimica generale
 Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
I rivelatori. Osservare il microcosmo. EEE- Cosmic Box proff.: M.Cottino, P.Porta
 I rivelatori Osservare il microcosmo Cose prima mai viste L occhio umano non riesce a distinguere oggetti con dimensioni inferiori a 0,1 mm (10-4 m). I primi microscopi vennero prodotti in Olanda alla
I rivelatori Osservare il microcosmo Cose prima mai viste L occhio umano non riesce a distinguere oggetti con dimensioni inferiori a 0,1 mm (10-4 m). I primi microscopi vennero prodotti in Olanda alla
gruppo ELEMENTI periodo
 gruppo ELEMENTI periodo METALLI NON-METALLI Metalli: duttili, malleabili, conducono corrente elettrica e calore, sono lucenti. Se un elemento non possiede nessuna delle proprietà sopra elencate è
gruppo ELEMENTI periodo METALLI NON-METALLI Metalli: duttili, malleabili, conducono corrente elettrica e calore, sono lucenti. Se un elemento non possiede nessuna delle proprietà sopra elencate è
RIASSUNTI DI CHIMICA
 Tecla Spelgatti RIASSUNTI DI CHIMICA per il liceo scientifico 2 - LA TAVOLA PERIODICA Questo testo è distribuito con licenza Common Creative: http://creativecommons.org/licenses/ CC BY-NC-ND Attribuzione
Tecla Spelgatti RIASSUNTI DI CHIMICA per il liceo scientifico 2 - LA TAVOLA PERIODICA Questo testo è distribuito con licenza Common Creative: http://creativecommons.org/licenses/ CC BY-NC-ND Attribuzione
Capitolo 24 Dai gruppi funzionali ai polimeri
 Capitolo 24 Dai gruppi funzionali ai polimeri 1. I gruppi funzionali 2. Alcoli, fenoli ed eteri 3. Le reazioni di alcoli e fenoli 4. Alcoli e fenoli di particolare interesse 5. Aldeidi e chetoni 6. Gli
Capitolo 24 Dai gruppi funzionali ai polimeri 1. I gruppi funzionali 2. Alcoli, fenoli ed eteri 3. Le reazioni di alcoli e fenoli 4. Alcoli e fenoli di particolare interesse 5. Aldeidi e chetoni 6. Gli
Carica e massa di particelle atomiche
 Carica e massa di particelle atomiche Protone Elettrone Neutrone Carica (Coulomb) + 1,602. 10-19 - 1,602. 10-19 0 Carica relativa a 1,602. 10-19 + 1-1 0 Massa (Kg) 1,673. 10-27 9,109. 10-31 1,675.10-27
Carica e massa di particelle atomiche Protone Elettrone Neutrone Carica (Coulomb) + 1,602. 10-19 - 1,602. 10-19 0 Carica relativa a 1,602. 10-19 + 1-1 0 Massa (Kg) 1,673. 10-27 9,109. 10-31 1,675.10-27
La Chimica Organica idrogeno carbonio azoto ossigeno composti covalenti catene di atomi di carbonio strutture covalenti e debolmente polarizzate
 LA IMIA ORGANIA La himica Organica I quattro elementi idrogeno, carbonio, azoto e ossigeno rappresentano più del 95% dei costituenti della materia vivente. I composti organici sono composti covalenti che
LA IMIA ORGANIA La himica Organica I quattro elementi idrogeno, carbonio, azoto e ossigeno rappresentano più del 95% dei costituenti della materia vivente. I composti organici sono composti covalenti che
determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Determinazione della sequenza aminoacilica di una
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Determinazione della sequenza aminoacilica di una
SPETTROMETRIA DI ASSORBIMENTO ATOMICO
 SPETTROMETRIA DI ASSORBIMENTO ATOMICO E una metodica spettroscopica atta alla determinazione qualiquantitativa di metalli. E basata sull assorbimento di radiazioni elettromagnetiche da parte di atomi nell
SPETTROMETRIA DI ASSORBIMENTO ATOMICO E una metodica spettroscopica atta alla determinazione qualiquantitativa di metalli. E basata sull assorbimento di radiazioni elettromagnetiche da parte di atomi nell
Alchini (C n H 2n-2 ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio doppi.
 himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
Lezione 1 ELEMENTI DI FISICA NUCLEARE APPLICATA ALLA MEDICINA
 Lezione 1 ELEMENTI DI FISICA NUCLEARE APPLICATA ALLA MEDICINA RADIAZIONE=PROPAGAZIONE DI ENERGIA NELLO SPAZIO L energia può essere associata: a particelle materiali (radiazione corpuscolare), a vibrazioni
Lezione 1 ELEMENTI DI FISICA NUCLEARE APPLICATA ALLA MEDICINA RADIAZIONE=PROPAGAZIONE DI ENERGIA NELLO SPAZIO L energia può essere associata: a particelle materiali (radiazione corpuscolare), a vibrazioni
