Prescrivere News - NUOVE ENTITA TERAPEUTICHE - IN OSPEDALE
|
|
|
- Gianleone Miele
- 7 anni fa
- Visualizzazioni
Transcript
1 IL NOSTRO GIUZIZIO PEGAPTANIB NON SIAMO D ACCORDO Sostanze contro le malattie vascolari oculari S01LA03 Macugen PFIZER intravitreo 0,3 mg/90 microl 1 sir preriempita 697,5 (prezzo ex factory IVA esclusa) Classe C Tipo ricetta: OSP-1 Tipo di registrazione: procedura centralizzata europea Indicazioni Trattamento della degenerazione maculare neovascolare (essudativa) correlata all età (AMD). IL NOSTRO GIUDIZIO Pegaptanib è un oligonucleotide peghilato che inibisce il fattore di crescita vascolare endoteliale (VEGF) 4, il cui ruolo sembra prominente nell eziologia della degenerazione maculare neovascolare correlata all età (AMD) di tipo essudativo ma anche nell angiogenesi a livello extraoculare. La sua soppressione potrebbe compromettere la guarigione da un ischemia miocardica o cerebrale 8. I 2 RCT registrativi, vs placebo, della durata di un anno, avevano un identico disegno e sono stati condotti contemporaneamente su pazienti con tutti i tipi di lesione di AMD 10 e pubblicati come unico trial (VISION) 12. Il farmaco è stato ulteriormente valutato per altre 48 settimane su pazienti 13,14. Non si dispone di dati di confronto con la terapia fotodinamica con verteporfina o la fotocoagulazione classica 7,10 né verso altri anti-vegf (ranibizumab o bevacizumab) 16. A 54 settimane il tasso di responder con pegaptanib è stato del 70% alla dose di 0,3 mg, del 71% con 1 mg e del 65% con 3 mg, risultati tutti statisticamente significativi rispetto al placebo (55%) 10,12. Tuttavia, dalla 54 a alla 102 a settimana, la percentuale di responder è stata la stessa (14%) sia nei pazienti che avevano continuato a ricevere pegaptanib 0,3 mg sia in quelli mai trattati prima, aspetto evidenziato dall EMEA 10 e dal NICE 14 che ha considerato sfavorevole il rapporto costo/efficacia del farmaco. Le ADR oculari più frequenti rispetto a placebo a 54 settimane di terapia sono state dolore oculare, mosche volanti, cheratite puntata, cataratta, infiammazione della camera anteriore, ed edema corneale i casi di endoftalmite, evento che invece non si è verificato nel controllo, 6 i casi di distacco di retina e 5 di danno traumatico della cornea 7,12. L FDA ha rilevato altre 4 endoftalmiti durante la sperimentazione definendo il corrispondente tasso di infezione relativo alla procedura iniettiva con pegaptanib 10 volte maggiore di quello evidenziato con la chirurgia della cataratta 18. Nella fase post-marketing sono state segnalate reazioni allergiche e anafilattiche che hanno richiesto la modifica del RCP in USA 23. Rimane incerto l effetto sistemico del farmaco, visto l aumento del rischio di malattie cardiovascolari proprio dell AMD 19,20 e il ruolo cruciale di VEGF in diversi distretti corporei 18,19. Sebbene durante gli studi non siano state segnalate ADR cardio-cerebrovascolari ciò non rassicura sugli effetti sistemici del farmaco, in quanto gli studi effettuati escludevano i pazienti con comorbidità cardiovascolari 19. DIALOGO SUI FARMACI n. 4/2007 (profilo aggiornato al 26 settembre 2007) 1
2 COSTO Un ciclo di trattamento di 3 mesi con pegaptanib costa 1.395, circa un terzo rispetto a ranibizumab ( 3.690) e 334 in più rispetto a verteporfina ( 1.060,20). Il farmaco più economico è bevacizumab, che per tale indicazione è inserito nell elenco della legge 648/96. Il costo di un iniezione intravitreale è di e pertanto una terapia trimestrale (1 iniezione/mese) costa quasi 20 volte in meno rispetto a pegaptanib. I prezzi sono stati calcolati considerando il costo ex factory. Al costo della terapia con pegaptanib va aggiunto quello relativo all impiego di un anestetico e di un antibiotico ad ampio spettro. CONFRONTO DEI COSTI PER 3 MESI DI TRATTAMENTO pegaptanib 0,3 mg/6 sett 1.395,00 ranibizumab 0,5 mg/mese 3.690,00 verteporfina* 1 sir ogni 3 mesi 1.060,20 bevacizumab 1 fl/mese 60,00-75, *utilizzato solamente per lesioni subfoveali. La dose calcolata considera un paziente di 65 Kg. farmaco inserito nella legge 648/96; il costo ad iniezione è stato calcolato di (Bif 2007; 3:103-7). ( ) VISTO DAGLI ALTRI La Revue Prescrire 2007; 272: 333. Non siamo d accordo. The Medical Letter 2005; 17: 70. Pegaptanib può rallentare la perdita della vista in una piccola % di pazienti. L efficacia si riduce nel 2 anno di trattamento. DTB 2007; 7: Rimangono da stabilire l efficacia e la sicurezza nel lungo termine. Informazione sui Farmaci 2007; 1. Non esistono studi di confronto con verteporfina che ha un impatto superiore sulla qualità di vita. Scottish Medicine Consortium L uso di pegaptanib dovrebbe essere limitato a pazienti con acuità visiva 6/12-6/60 e interrotto al di sotto di 6/60 o nel caso di severa perdita della visione. Cedac Final Recommendation Vista l elevata percentuale di drop-out con pegaptanib durante il 2 anno degli RCT, non è possibile accertare la reale efficacia del farmaco oltre il 1 anno di terapia. Gli effetti complessivi sulla visione non sono chiari. NUOVO PRINCIPIO ATTIVO La degenerazione maculare correlata all età (Age-related Macular Degeneration, AMD) è una malattia degenerativa della porzione centrale della retina (macula) il cui esito principale è la perdita progressiva della visione centrale 1. Nei paesi industrializzati, la prevalenza della AMD viene stimata nel 2% dei soggetti >50 anni, con un incremento all aumentare dell età 2. I principali fattori di rischio sono l età, l ipertensione, le malattie cardiovascolari, il fumo e una storia familiare della malattia 2,3. Si DIALOGO SUI FARMACI n. 4/2007 (profilo aggiornato al 26 settembre 2007) 2
3 distinguono due forme principali di AMD 4,5 : la forma secca (atrofica), che costituisce il 90% dei casi e quella umida (essudativa o neovascolare), molto più rara ma con la maggiore incidenza di cecità legale a. Rispetto alla forma secca, la cui progressione è lenta (tempo di insorgenza di cecità altamente variabile, 5-10 anni), la AMD essudativa è maggiormente caratterizzata da una severa perdita di visione fino a cecità totale e sviluppo di un difetto centrale del campo visivo (scotoma) 2. La visione periferica rimane preservata permettendo libertà di movimento; una volta che la AMD colpisce uno degli occhi la probabilità che anche l altro si ammali è molto elevata (incidenza del 42% a 5 anni) 2. La forma essudativa è caratterizzata da neovascolarizzazione coroidale (NCV); nei casi più gravi si sviluppano microemorragie dovute alla formazione di nuovi vasi che portano alla perdita progressiva della vista 5. Nell AMD essudativa sembra rivestire un ruolo chiave il fattore di crescita vascolare endoteliale (VEGF) 4, responsabile dello sviluppo fisiopatologico di nuovi vasi sanguigni, della permeabilità vascolare e dell infiammazione 6 ; il VEGF, comunque, regola l angiogenesi anche nei tessuti extraoculari e la sua soppressione potrebbe compromettere la guarigione da un ischemia miocardica o cerebrale 8. Al contrario della forma secca per la quale attualmente non è disponibile alcun trattamento di provata efficacia 4, l AMD essudativa dispone di diverse opzioni: la fotocoagulazione termica con laser (nelle lesioni visibili ed extrafoveali ma non subfoveali) 7, la terapia fotodinamica con verteporfina (nelle lesioni subfoveali; è possibile trattare simultaneamente entrambi gli occhi) 7 e gli inibitori dell angiogenesi 5. Esponenti di questa nuova classe terapeutica sono, oltre a pegaptanib, ranibizumab, recentemente autorizzato in Italia, e bevacizumab, già in commercio per la terapia del carcinoma metastatico del colon-retto e del carcinoma mammario metastatico ed incluso da a Cecità legale: acuità visiva <20/200; nella carta di Snellen una capacità di lettura di 20/200 piedi (6/600 in metri) significa che un soggetto è in grado di vedere a 20 piedi (6 metri) quello che un altro con una vista normale vede a 200 piedi (60 metri) 2. maggio 2007 nell elenco dei farmaci erogabili ai sensi della Legge 648/96 per il trattamento delle maculopatie essudative e del glaucoma neovascolare 9. Pegaptanib è un oligonucleotide peghilato modificato a lunga emivita (10 giorni) che si lega selettivamente al VEGF165 extracellulare, isoforma ritenuta preferenzialmente coinvolta nella neovascolarizzazione oculare, inibendone l attività 10. In Italia, l AIFA ha approvato la commercializzazione di pegaptanib in classe C OSP-1 per sfavorevole rapporto costo/beneficio 5. Posologia: pegaptanib 0,3 mg deve essere somministrato 1 volta ogni 6 settimane (9 iniezioni all anno) attraverso iniezione intravitreale nell occhio da trattare da oftalmologi esperti e in condizioni asettiche. Prima di effettuare l iniezione si deve indurre un adeguata anestesia e somministrare un antibiotico ad ampio spettro 11. EFFICACIA L autorizzazione all immissione in commercio di pegaptanib si è basata su 2 RCT vs placebo, in doppio cieco, con identico disegno, della durata di 1 anno, condotti contemporaneamente su un totale di pazienti con tutti i tipi di lesione di AMD 10 e pubblicati come unico trial (VISION) 12. L efficacia e la sicurezza del farmaco sono state ulteriormente valutate per altre 48 settimane 13,14. Non si dispone di dati di confronto verso la terapia fotodinamica con verteporfina o la fotocoagulazione classica 7,10. Nello studio VISION 12 sono state confrontate 3 dosi diverse di pegaptanib (0,3 mg, 1 mg, 3 mg) vs un iniezione fittizia, somministrate per via intravitreale in un solo occhio per paziente ogni 6 settimane per 48 settimane (9 iniezioni in totale). A discrezione dello sperimentatore era consentito il trattamento aggiuntivo con verteporfina nei soggetti con lesioni classiche. L end point I era la percentuale di pazienti (pazienti responder) che alla 54 a settimana aveva perso <15 lettere di acuità visiva (<3 linee alla tavola ETDRS b ) mentre quello b Tavola ETDRS (Early Treatment of Diabetic Retinopathy Study) : ottotipi per lontano nei quali le dimensioni dei caratteri hanno una progressione DIALOGO SUI FARMACI n. 4/2007 (profilo aggiornato al 26 settembre 2007) 3
4 secondario composito era costituito dal mantenimento o guadagno in acuità visiva ( 1 lettera), perdita grave della visone ( 30 lettere o 6 linee nell occhio in studio), o cecità legale a. A 54 settimane il tasso di responder con pegaptanib è stato del 70% alla dose di 0,3 mg, 71% con 1 mg e 65% con 3 mg vs 55% con placebo 10,12, con una differenza statisticamente significativa rispetto al controllo per tutte e 3 le dosi del farmaco (p<0,001 per 0,3 e 1 mg, p=0,03 per la dose da 3 mg) 12. La risposta al trattamento non è stata influenzata dai diversi sottotipi di lesione 10,12. Rispetto al baseline, il guadagno 15 lettere di acuità visiva si è verificato nel 6% dei pazienti randomizzati a pegaptanib 0,3 mg, 7% con 1 mg e 4% con 3 mg vs 2% con l iniezione fittizia, con una differenza statisticamente significativa per tutti i confronti, tranne per la dose maggiore 12. ll mantenimento dell acuità visiva con le 3 dosi di pegaptanib è stato, rispettivamente, del 33%, 31% e 37% rispetto al 23% del controllo. La percentuale di soggetti con perdita grave della visione durante il trattamento con pegaptanib è stata del 10% alla dose di 0,3 mg, 8% con 1 mg e 14% con 3 mg rispetto al 22% del controllo 12. Il tasso di cecità legale è risultato elevato e statisticamente significativo vs placebo con le tre dosi di farmaco: 38% con 0,3 mg, 43% con 1 mg e 44% con 3 mg vs 56% con placebo (p<0,001). Al fine di valutare se un ulteriore anno di trattamento arrecava benefici addizionali, dei pazienti che avevano partecipato allo studio precedente sono stati randomizzati per altre 48 settimane 13. I soggetti assegnati originariamente al controllo sono stati ri-randomizzati a continuare con il placebo, ad interrompere o a ricevere una delle 3 dosi di pegaptanib, ogni 6 settimane per un totale di 8 somministrazioni 6,13. I pazienti originariamente trattati con il farmaco sono stati nuovamente randomizzati a ricevere altre 8 somministrazioni della dose logaritmica, in cui la variazione percentuale della dimensione del carattere tra lettere adiacenti è la stessa per tutti i livelli di acuità visiva. È ancora poco usata nella pratica clinica quotidiana, mentre è richiesta, per la sua precisione ed attendibilità soprattutto nelle acuità visive basse, nella maggior parte degli studi clinici. precedentemente assunta o a interrompere la terapia 6,13. La perdita di 15 lettere di acuità visiva dalla 54 a alla 102 a settimana (end point I) riportata con la dose da 0,3 mg è stata del 14% sia nei pazienti che hanno continuato a ricevere pegaptanib che in quelli che non avevano mai assunto il farmaco 13, aspetto evidenziato anche dall EMEA 10. Tra i trattati con pegaptanib 0,3 mg la progressione verso la cecità legale a è stata del 35% alla 102 a settimana rispetto al 34% alla fine del primo anno di terapia 13. Un analisi retrospettiva per sottogruppi dello studio pivotal 12 ha valutato l efficacia della dose da 0,3 mg di pegaptanib vs un iniezione fittizia a 54 settimane in pazienti con lesioni visibili (n=62) e occulte (n=65) di AMD in fase precoce 15. Il tasso di responder nel primo sottogruppo di pazienti è stato del 76% con pegaptanib 0,3 mg vs 50% del controllo (p=0,03) mentre nel secondo la percentuale di responder è stata l 80% tra i trattati vs il 57% del controllo (p=0,05) 15. Una revisione sistematica 16 ha confrontato gli studi a supporto dell efficacia di pegaptanib e di ranibizumab; non è stato possibile effettuare una metanalisi o un confronto indiretto tra i 2 farmaci a causa della mancanza di studi di confronto diretto e della eterogenicità della popolazione inclusa relativamente ai diversi sottotipi di lesioni e degli outcome misurati. Il confronto grezzo delle evidenze disponibili, tuttavia, ha rilevato un beneficio maggiore di ranibizumab vs pegaptanib 16. SICUREZZA E TOLLERABILITÀ Durante lo studio principale 12, nell 84% dei pazienti trattati con pegaptanib alla dose di 0,3 mg per 1 anno (n=294) si sono verificati eventi avversi correlati alla procedura di iniezione (di cui il 27% considerati correlati al farmaco in studio), di cui il 3% erano ADR gravi; il tasso di drop-out per reazioni avverse è stato dell 1% sia nei trattati che nel controllo 10,12. I più comuni eventi avversi oculari verificatisi con una maggiore incidenza con il farmaco (a tutte e 3 le dosi somministrate) rispetto al controllo sono stati dolore oculare (34% vs 28%), mosche volanti (33% vs 8%), cheratite puntata (32% vs 27%), cataratta (20 vs 18%), infiammazione della camera anteriore (14% vs DIALOGO SUI FARMACI n. 4/2007 (profilo aggiornato al 26 settembre 2007) 4
5 6%), edema corneale (10% vs 7%) 12. Tre gli eventi avversi gravi sul totale dei soggetti randomizzati alle 3 dosi di farmaco (n=890): 12 casi di endoftalmite versus nessun caso con il controllo (1,3%, tra cui 1 paziente che ha perso 30 lettere di acuità visiva); 6 casi di distacco della retina (0,7%) e 5 di danno traumatico della cornea (0,6%) 7,12. Secondo gli sperimentatori dello studio 8/12 casi di endoftalmite erano associati a violazioni di protocollo correlate al mancato mantenimento di condizioni di sterilità durante la somministrazione. Dalla 54 a settimana alla 102 a non si sono verificati ulteriori casi di endoftalmite anche perché sono state implementate, tramite un emendamento al protocollo, delle procedure che assicurassero una maggiore sterilità 17. L FDA riporta altri 4 casi di endoftalmite durante un altro studio ancora in corso e ritiene che il tasso dell infezione rilevato durante la sperimentazione clinica sia molto più alto di quello atteso per le procedure iniettive intravitreali (10 volte maggiore del tasso rilevato nella chirurgia della cataratta); l Agenzia ritiene ancora significativo il rischio di endoftalmite 18, anche in seguito all implementazione di modifiche della procedura di iniezione. Il ruolo extraoculare del VEGF è cruciale in diversi distretti corporei ed, inoltre, è fondamentale nel mantenimento della perfusione dei tessuti ischemici in seguito ad infarto del miocardio 18,19. I pazienti affetti da AMD, di per sè, possono presentare un aumento del rischio di malattie cardiovascolari (incremento del rischio di infarto del miocardio di quasi il 20%) 18. Nello studio principale 12, a 1 anno, l incidenza di eventi trombotici è risultata simile tra i trattati con il farmaco e il controllo (6%) 17,19. Bisogna, tuttavia, mettere in evidenza che i risultati relativi all incidenza di eventi avversi sistemici di tipo cardiocerebrovascolare non possono essere estesi alla reale pratica clinica a causa dell esclusione dalla sperimentazione dei pazienti con malattie o fattori di rischio cardiovascolari 19,20. In uno studio di fase II, su 147 trattati con pegaptanib alla dose di 1 mg o 3 mg, privi di comorbidità di tipo cardiovascolare, non è stata rilevata alcuna soppressione sistemica della concentrazione di VEGF 21. In questo contesto, si colloca la decisione del Royal College of Ophthalmology britannico che raccomanda cautela nell uso di pegaptanib, a causa della mancanza di evidenze di sicurezza nel lungo termine con gli inibitori del VEGF e considerando che l AMD stessa costituisce un fattore di rischio cardiovascolare 22. In un recente documento (aprile 2007), il NICE 22 non ha espresso parere favorevole su pegaptanib definendolo non costo-efficace 23. In USA, nel marzo 2006, l FDA ha modificato l RCP di pegaptanib rendendo noto che durante l esperienza post-marketing sono stati rilevati dei rari casi di reazioni anafilattiche (incluso angioedema) la cui relazione causale con il farmaco non è stata stabilita 23. In letteratura 24 sono presenti due case report di reazioni allergiche da pegaptanib: nel primo, l insorgenza di orticaria e angioedema si è verificata 35 minuti dopo l iniezione di pegaptanib, nel secondo 12 ore dopo (orticaria generalizzata). Il Risk Management Plan sottoposto all EMEA 10 include il monitoraggio degli eventi avversi durante gli studi che saranno completati nei prossimi 5 anni, la conduzione di 2 studi epidemiologici (1 in USA sui dati Medicare e 1 europeo con l obiettivo di definire fattori di rischio e sottogruppi di pazienti maggiormente esposti ad eventi avversi) e l attuazione di un piano educazionale rivolto agli operatori sanitari (protocollo per la procedura iniettiva) e ai pazienti (guida per il paziente) già implementato mediante distribuzione di materiale informativo. STUDI IN CORSO Risultano in corso 5 studi di fase I/II per condizioni differenti dalla AMD (edema maculare in seguito ad intervento di cataratta, edema maculare diabetico, retinopatia diabetica), 6 studi di fase III (di cui 5 nella AMD essudativa, dei quali solo uno è controllato e prevede un confronto con bevacizumab, e 1 nell edema maculare da occlusione della vena retinica) e lo studio epidemiologico europeo incluso nel Risk Management Plan sottoposto all EMEA 25,26. In Italia sono in corso 2 studi 27, entrambi di fase III, di cui uno per il DIALOGO SUI FARMACI n. 4/2007 (profilo aggiornato al 26 settembre 2007) 5
6 trattamento della degenerazione maculare senile ed uno dose finding per l edema maculare diabetico. BIBLIOGRAFIA 1. Arroyo JG. Age-related macular degeneration. UpToDate Age related macular degeneration. Clinical Evidence 2006; 15: Weir E. Age-related macular degeneration: armed against ARMD. CMAJ 2004; 170: Royal College of Ophthalmologists. AMD interim guidelines: the Royal College of Ophthalmologists interim raccomandations for the management of patients with agerelated macular degeneration (AMD). Updated 7 th June m_guidelines-wma-june_2007.pdf (accesso del ). 5. Terapia della degenerazione maculare correlata all età. BIF 2007; 3: A view on new drugs for macular degeneration. DTB 2007; 7: Pegaptanib. La Revue Prescrire 2007; 272: Pegaptanib sodico per la degenerazione maculare. The Medical Letter 2005; 17: GU n. 122 del 28/05/ Macugen. European Public Assessment Report (EPAR)- EMEA. H-620-en6.pdf (accesso del ). 11. Macugen. Riassunto delle caratteristiche del prodotto. 12. Gragoudas ES et al. Pegaptanib for neovascular agerelated macular degeneration. N Engl J Med 2004; 351: V.I.S.I.O.N. Clinical Trial Group. Year 2 efficacy results of 2 randomized controlled clinical trials of pegaptanib for neovascular age-related macular degeneration. Ophthalmology 2006; 113: Ranibizumab and pegaptanib for age-related macular degeneration. NICE (accesso del ). 15. Gonzales CR; the VEGF Inhibition Study in Ocular Neovascularization (VISION) Clinical Trial Group. Enhanced efficacy associated with early treatment of neovascular ade-related macular degeneration with pegaptanib sodium: an exploratory analysis. Retina 2005; 25: Takeda AL et al. Pegaptanib and ranibizumab for neovascular age-related macular degeneration: a systematic review. BJO 2007, online first as /bjo (accesso del ). 17. V.I.S.I.O.N. Clinical Trial Group. Pegaptanib sodium for neovascular age-related macular degeneration. Two-year safety results of the two prospective, multicenter, controlled clinical trials. Ophthalmol 2006; 113: Pegaptanib- Medical Review. (accesso del ). 19. Wong TY et al. Clinical update: new treatments for agerelated macular degeneration. Lancet 2007; 370: Van Wijngaarden P et al. Inhibitors of ocular neovascularization. Promises and potential problems. JAMA 2005; 293: Macugen Diabetic Retinopathy Study Group. Pegaptanib 1- year systemic safety results from a safety-pharmacokinetic trial in pazients with neovascular age-related macular degeneration. Ophtalmol 2007; doi: /jophtha , in press. 22. Macular degeneration, patients groups, and pharma. Lancet 2007; 370: Medwatch - March Pegaptanib. f (accesso del ). 24. Steffensmeier ACG et al. Vitreosus injections of pegaptanib sodium triggering allergic reactions. Am J Ophthalmol 2007; 143: US National Institutes of Health. (accesso del ). 26. ISRCTN Register. (accesso del ). 27. Osservatorio Nazionale sulla Sperimentazione Clinica dei medicinali. (accesso del ). DIALOGO SUI FARMACI n. 4/2007 (profilo aggiornato al 26 settembre 2007) 6
Prescrivere News - NUOVE ENTITA TERAPEUTICHE - IN OSPEDALE
 RANIBIZUMAB IL NOSTRO GIUDIZIO RUOLO INCERTO Sostanze contro le malattie vascolari oculari S01LA04 Lucentis NOVARTIS iniet 10 mg/ml 1 flaconcino 0,3 ml 1.230,00 (prezzo ospedaliero) Classe C Tipo ricetta:
RANIBIZUMAB IL NOSTRO GIUDIZIO RUOLO INCERTO Sostanze contro le malattie vascolari oculari S01LA04 Lucentis NOVARTIS iniet 10 mg/ml 1 flaconcino 0,3 ml 1.230,00 (prezzo ospedaliero) Classe C Tipo ricetta:
SCHEDA DI VALUTAZIONE PER L INSERIMENTO DI FARMACI NON PRESENTI NEL PTR
 RICHIESTA DI INSERIMENTO IN PTR DI PEGAPTANIB, RANIBIZUMAB (MACUGEN, LUCENTIS ) Presentata dalla Commissione Terapeutica Provinciale di Cagliari e Commissione Terapeutica Provinciale di Sassari In data
RICHIESTA DI INSERIMENTO IN PTR DI PEGAPTANIB, RANIBIZUMAB (MACUGEN, LUCENTIS ) Presentata dalla Commissione Terapeutica Provinciale di Cagliari e Commissione Terapeutica Provinciale di Sassari In data
MINI SCHEDA HTA AFLIBERCEPT (EYLEA )
 MINI SCHEDA HTA AFLIBERCEPT (EYLEA ) 1/9 NOME COMMERCIALE Principio Attivo Ditta Produttrice ATC Formulazione Dosaggio Categoria Terapeutica Indicazione in Esame Classificazione ai fini della rimborsabilità
MINI SCHEDA HTA AFLIBERCEPT (EYLEA ) 1/9 NOME COMMERCIALE Principio Attivo Ditta Produttrice ATC Formulazione Dosaggio Categoria Terapeutica Indicazione in Esame Classificazione ai fini della rimborsabilità
Bevacizumab vs Ranibizumab: esperienze dello studio CATT
 Bevacizumab vs Ranibizumab: esperienze dello studio CATT E stato pubblicato sul New England Journal of Medicine il risultato di un trial clinico randomizzato, multicentrico il cui scopo era confrontare
Bevacizumab vs Ranibizumab: esperienze dello studio CATT E stato pubblicato sul New England Journal of Medicine il risultato di un trial clinico randomizzato, multicentrico il cui scopo era confrontare
RANIBIZUMAB (Rivalutazione del 07 aprile 2009) ( )
 RANIBIZUMAB (Rivalutazione del 07 aprile 2009) (17-04-2009) Specialità: LUCENTIS (NOVARTIS FARMA SPA) Forma farmaceutica: 1 flaconcino da 0,23 ml 10 mg/ml - Prezzo: euro 1638.45 ATC: S01LA04 Categoria
RANIBIZUMAB (Rivalutazione del 07 aprile 2009) (17-04-2009) Specialità: LUCENTIS (NOVARTIS FARMA SPA) Forma farmaceutica: 1 flaconcino da 0,23 ml 10 mg/ml - Prezzo: euro 1638.45 ATC: S01LA04 Categoria
DEGENERAZIONE MACULARE SENILE
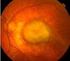 DEGENERAZIONE MACULARE SENILE E una malattia della retina centrale legata all età E la più frequente causa di cecità legale (cecità centrale non cecità assoluta!) che interessa la popolazione anziana -
DEGENERAZIONE MACULARE SENILE E una malattia della retina centrale legata all età E la più frequente causa di cecità legale (cecità centrale non cecità assoluta!) che interessa la popolazione anziana -
Allegato A al Decreto n. 145 del 21 DICEMBRE 2017 pag. 1/8
 giunta regionale Allegato A al Decreto n. 145 del 21 DICEMBRE 2017 pag. 1/8 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO Aggiornamento novembre 2017 FOGLIO
giunta regionale Allegato A al Decreto n. 145 del 21 DICEMBRE 2017 pag. 1/8 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO Aggiornamento novembre 2017 FOGLIO
Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 1/7
 giunta regionale Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 1/7 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO
giunta regionale Allegato B al Decreto n. 113 del 5 settembre 2017 pag. 1/7 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO
di sicurezza di bevacizumab e ranibizumab per uso intravitreale
 XXIII Seminario Nazionale LA VALUTAZIONE DELL USO E DELLA SICUREZZA DEI FARMACI: ESPERIENZE IN ITALIA Roma, ISS 9 dicembre 2014 Revisione sistematica delle evidenze di sicurezza di bevacizumab e ranibizumab
XXIII Seminario Nazionale LA VALUTAZIONE DELL USO E DELLA SICUREZZA DEI FARMACI: ESPERIENZE IN ITALIA Roma, ISS 9 dicembre 2014 Revisione sistematica delle evidenze di sicurezza di bevacizumab e ranibizumab
Occhioallaretina.it, Il Magazine Italiano delle Patologie della Retina Numero
 di Massimo Nicolò Il trattamento della Degenerazione Maculare legata all età essudativa: da dove siamo partiti e a che punto siamo. Più di mezzo secolo fa, Ago, Chao e Flocks, negli animali, e Novotony
di Massimo Nicolò Il trattamento della Degenerazione Maculare legata all età essudativa: da dove siamo partiti e a che punto siamo. Più di mezzo secolo fa, Ago, Chao e Flocks, negli animali, e Novotony
Allegato B al Decreto n. 147 del 19 agosto 2014 pag. 1/6
 giunta regionale Allegato B al Decreto n. 147 del 19 agosto 2014 pag. 1/6 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO
giunta regionale Allegato B al Decreto n. 147 del 19 agosto 2014 pag. 1/6 RACCOMANDAZIONI PER LA FORMULAZIONE DEL FOGLIO INFORMATIVO E DEL MODULO DI CONSENSO INFORMATO FOGLIO INFORMATIVO PER IL TRATTAMENTO
Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE.
 Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE. Renato Bertini Malgarini, Giuseppe Pimpinella, Luca Pani 10 dicembre 2012- Istituto Superiore di Sanità
Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE. Renato Bertini Malgarini, Giuseppe Pimpinella, Luca Pani 10 dicembre 2012- Istituto Superiore di Sanità
DEGENERAZIONE MACULARE LEGATA ALL ETA (INDICAZIONI PER LA GESTIONE)
 April 2007 International Council of Ophthalmology ICO International Clinical Guidelines DEGENERAZIONE MACULARE LEGATA ALL ETA (INDICAZIONI PER LA GESTIONE) (Valutazioni: A: estremamente importante, B:
April 2007 International Council of Ophthalmology ICO International Clinical Guidelines DEGENERAZIONE MACULARE LEGATA ALL ETA (INDICAZIONI PER LA GESTIONE) (Valutazioni: A: estremamente importante, B:
Clinica e terapia. malattie. retiniche. delle. Direttore Scientifico Alfredo Pece
 Clinica e terapia delle malattie retiniche Direttore Scientifico Alfredo Pece 5 Terapie: Laser TERAPIE PER L AMD NEOVASCOLARE Fotocoagulazione laser Terapia Fotodinamica con verteporfina Terapie antiangiogeniche
Clinica e terapia delle malattie retiniche Direttore Scientifico Alfredo Pece 5 Terapie: Laser TERAPIE PER L AMD NEOVASCOLARE Fotocoagulazione laser Terapia Fotodinamica con verteporfina Terapie antiangiogeniche
Dottoressa Angioni Anna Rita Diabetologia Oristano UN ESORDIO COMPLICATO
 Dottoressa Angioni Anna Rita Diabetologia Oristano UN ESORDIO COMPLICATO ANGELO ü 68 aa ü da 14 aa in pensione ü non familiarità per diabete, IA e dislipidemia Durante la vita lavorativa ha praticato annualmente
Dottoressa Angioni Anna Rita Diabetologia Oristano UN ESORDIO COMPLICATO ANGELO ü 68 aa ü da 14 aa in pensione ü non familiarità per diabete, IA e dislipidemia Durante la vita lavorativa ha praticato annualmente
Commissione Regionale Farmaco LAPATINIB
 Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 490 dell 11 aprile 2011) Documento relativo a: LAPATINIB Settembre 2011 Indicazioni registrate Lapatinib Il lapatinib ha ricevuto la seguente estensione
Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 490 dell 11 aprile 2011) Documento relativo a: LAPATINIB Settembre 2011 Indicazioni registrate Lapatinib Il lapatinib ha ricevuto la seguente estensione
Loading phase: ancora attuale? Alessandro Randazzo MD Humanitas Research Hospital Rozzano
 Loading phase: ancora attuale? Alessandro Randazzo MD Humanitas Research Hospital Rozzano No ho interessi finanziari in questa comunicazione Alessandro Randazzo MD Humanitas Research Hospital Rozzano MARINA
Loading phase: ancora attuale? Alessandro Randazzo MD Humanitas Research Hospital Rozzano No ho interessi finanziari in questa comunicazione Alessandro Randazzo MD Humanitas Research Hospital Rozzano MARINA
CONGRESSO NAZIONALE SIR - SOCIETA ITALIANA DELLA RETINA
 CONGRESSO NAZIONALE SIR - SOCIETA ITALIANA DELLA RETINA Venezia, venerdì 7 dicembre 2012 TEST DI APPRENDIMENTO Il test si supera se le risposte esatte sono 25 sul totale dei 31 quesiti. Barrare una sola
CONGRESSO NAZIONALE SIR - SOCIETA ITALIANA DELLA RETINA Venezia, venerdì 7 dicembre 2012 TEST DI APPRENDIMENTO Il test si supera se le risposte esatte sono 25 sul totale dei 31 quesiti. Barrare una sola
SCHEDA FARMACO. (a cura di UOS Farmacoeconomia e HTA, Area Centro. Nepafenac. Prezzo: 18,50 euro. Regime rimborsabilità: H
 SCHEDA FARMACO (a cura di UOS Farmacoeconomia e HTA, Area Centro Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Nepafenac (nevanac)
SCHEDA FARMACO (a cura di UOS Farmacoeconomia e HTA, Area Centro Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Nepafenac (nevanac)
La Retinopatia Diabetica. Edoardo Midena Università degli Studi di Padova
 La Retinopatia Diabetica Edoardo Midena Università degli Studi di Padova Il diabete mellito Diabete mellito: l epidemia del XXI secolo 439 milioni diabetici nel 2030 Un nuovo diabetico ogni 9,9 secondi
La Retinopatia Diabetica Edoardo Midena Università degli Studi di Padova Il diabete mellito Diabete mellito: l epidemia del XXI secolo 439 milioni diabetici nel 2030 Un nuovo diabetico ogni 9,9 secondi
Medicinale non più autorizzato. Allegato I
 Allegato I Conclusioni scientifiche e motivi per la sospensione dell autorizzazione all immissione in commercio presentati dall Agenzia europea per i medicinali 1 Conclusioni scientifiche Riassunto generale
Allegato I Conclusioni scientifiche e motivi per la sospensione dell autorizzazione all immissione in commercio presentati dall Agenzia europea per i medicinali 1 Conclusioni scientifiche Riassunto generale
Gentile Signora/e, I disturbi che Lei ha notato nella Sua visione sono dovuti ad una condizione patologica chiamata:
 Gentile Signora/e, I disturbi che Lei ha notato nella Sua visione sono dovuti ad una condizione patologica chiamata: La malattia che La affligge ha una evoluzione naturale peggiorativa che causa gravi
Gentile Signora/e, I disturbi che Lei ha notato nella Sua visione sono dovuti ad una condizione patologica chiamata: La malattia che La affligge ha una evoluzione naturale peggiorativa che causa gravi
Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali
 Allegato II Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali Il Riassunto delle Caratteristiche del Prodotto e il foglio
Allegato II Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali Il Riassunto delle Caratteristiche del Prodotto e il foglio
 www.fisiokinesiterapia.biz DIABETE MELLITO Ne sono affetti 14 milioni di americani Ogni anno 8.000 individui vanno incontro a cecità da retinopatia Patogenesi Elevati livelli glicemici potrebbero danneggiare
www.fisiokinesiterapia.biz DIABETE MELLITO Ne sono affetti 14 milioni di americani Ogni anno 8.000 individui vanno incontro a cecità da retinopatia Patogenesi Elevati livelli glicemici potrebbero danneggiare
Coccaglio (BS), 2 Marzo 2018 LA PROGRAMMAZIONE DELLA GRAVIDANZA NELLA DONNA CON DIABETE PREGESTAZIONALE COMPLICATO. L. Giannì
 Coccaglio (BS), 2 Marzo 2018 LA PROGRAMMAZIONE DELLA GRAVIDANZA NELLA DONNA CON DIABETE PREGESTAZIONALE COMPLICATO LA GRAVIDANZA NELLA PAZIENTE COMPLICATA DA RETINOPATIA DIABETICA I SESSIONE L. Giannì
Coccaglio (BS), 2 Marzo 2018 LA PROGRAMMAZIONE DELLA GRAVIDANZA NELLA DONNA CON DIABETE PREGESTAZIONALE COMPLICATO LA GRAVIDANZA NELLA PAZIENTE COMPLICATA DA RETINOPATIA DIABETICA I SESSIONE L. Giannì
Documento PTR n. 167 relativo a:
 Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n. 167 relativo a: DESAMETASONE IMPIANTO INTRAVITREALE Settembre 2012
Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n. 167 relativo a: DESAMETASONE IMPIANTO INTRAVITREALE Settembre 2012
Medicina di genere e appropriatezza nel setting della Medicina Generale e Cure Primarie
 Medicina di genere e appropriatezza nel setting della Medicina Generale e Cure Primarie Dr Marchi Rita Medico di Medicina Generale Presidente S.I.M.G di Ferrara 24 settembre 2016 Dati ISTAT 2012-2013,
Medicina di genere e appropriatezza nel setting della Medicina Generale e Cure Primarie Dr Marchi Rita Medico di Medicina Generale Presidente S.I.M.G di Ferrara 24 settembre 2016 Dati ISTAT 2012-2013,
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE MEDIANTE SOMMINISTRAZIONE DI PEGAPTANIB (MACUGEN, Pfizer) PER VIA INTRAVITREALE
 SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE MEDIANTE SOMMINISTRAZIONE DI PEGAPTANIB (MACUGEN, Pfizer) PER VIA INTRAVITREALE Approvato dalla Società Oftalmologica Italiana - Marzo 2007 Primo
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE MEDIANTE SOMMINISTRAZIONE DI PEGAPTANIB (MACUGEN, Pfizer) PER VIA INTRAVITREALE Approvato dalla Società Oftalmologica Italiana - Marzo 2007 Primo
LA DEGENERAZIONE MACULARE SENILE. Dr. S. SANTORO Direttore della Struttura Complessa di Oculistica Ospedale S. Maria degli Angeli Putignano
 LA DEGENERAZIONE MACULARE SENILE Dr. S. SANTORO Direttore della Struttura Complessa di Oculistica Ospedale S. Maria degli Angeli Putignano Che cosa è la degenerazione maculare senile? Comprende un gruppo
LA DEGENERAZIONE MACULARE SENILE Dr. S. SANTORO Direttore della Struttura Complessa di Oculistica Ospedale S. Maria degli Angeli Putignano Che cosa è la degenerazione maculare senile? Comprende un gruppo
Efficacia e sicurezza di una nuova formulazione di Triamcinolone Acetonide nella risoluzione dell edema maculare diabetico
 Azienda Ospedaliero-Universitaria Policlinico - Vittorio Emanuele Ospedale Santa Marta, Catania Direttore Prof. T. Avitabile Efficacia e sicurezza di una nuova formulazione di Triamcinolone Acetonide nella
Azienda Ospedaliero-Universitaria Policlinico - Vittorio Emanuele Ospedale Santa Marta, Catania Direttore Prof. T. Avitabile Efficacia e sicurezza di una nuova formulazione di Triamcinolone Acetonide nella
FOLLOW-UP DELL ORGANO DELLA VISTA. Dott. Elena Piozzi Direttore S.C. OCULISTICA PEDIATRICA A.O.OSPEDALE NIGUARDA MILANO
 FOLLOW-UP DELL ORGANO DELLA VISTA Dott. Elena Piozzi Direttore S.C. OCULISTICA PEDIATRICA A.O.OSPEDALE NIGUARDA MILANO La retinopatia del pretermine è causa ancor oggi di cecità nei paesi industrializzati:
FOLLOW-UP DELL ORGANO DELLA VISTA Dott. Elena Piozzi Direttore S.C. OCULISTICA PEDIATRICA A.O.OSPEDALE NIGUARDA MILANO La retinopatia del pretermine è causa ancor oggi di cecità nei paesi industrializzati:
MEDICINA BASATA SULL EVIDENZA (EBM)
 www.fisiokinesiterapia.biz MEDICINA BASATA SULL EVIDENZA (EBM) JAMA 1992;268:2420-2425 Evidence-Based Medicine Working Group Evidence-based medicine. A new approach to teaching the practice of medicine.
www.fisiokinesiterapia.biz MEDICINA BASATA SULL EVIDENZA (EBM) JAMA 1992;268:2420-2425 Evidence-Based Medicine Working Group Evidence-based medicine. A new approach to teaching the practice of medicine.
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
Luca Leonardi VI Congresso SIFACT Milano Ottobre 2018
 VI Congresso SIFACT La centralità del paziente nei percorsi di cura: quali risposte dalle sanità regionali? MILANO 11-13 OTTOBRE 2018 MICO Fiera Milano City Sicurezza dell uso intravitreale di Bevacizumab
VI Congresso SIFACT La centralità del paziente nei percorsi di cura: quali risposte dalle sanità regionali? MILANO 11-13 OTTOBRE 2018 MICO Fiera Milano City Sicurezza dell uso intravitreale di Bevacizumab
Stefano Miglior. Il glaucoma neovascolare SMI
 Stefano Miglior Il glaucoma neovascolare Glaucoma Neovascolare e un glaucoma secondario ad angolo chiuso Inizialmente una membrana fibrovascolare si sviluppa davanti al trabecolato a tal punto l angolo
Stefano Miglior Il glaucoma neovascolare Glaucoma Neovascolare e un glaucoma secondario ad angolo chiuso Inizialmente una membrana fibrovascolare si sviluppa davanti al trabecolato a tal punto l angolo
PEGAPTANIB (Rivalutazione del 07 aprile 2009) (07-04-2009)
 PEGAPTANIB (Rivalutazione del 07 aprile 2009) (07-04-2009) Specialità: MACUGEN (PFIZER) Forma farmaceutica: 1 siringa 0.3 mg - Prezzo: euro 1.122 ATC: S01LA03 Categoria terapeutica: Sostanze antineovascolarizzanti
PEGAPTANIB (Rivalutazione del 07 aprile 2009) (07-04-2009) Specialità: MACUGEN (PFIZER) Forma farmaceutica: 1 siringa 0.3 mg - Prezzo: euro 1.122 ATC: S01LA03 Categoria terapeutica: Sostanze antineovascolarizzanti
Approccio Terapeutico all iperglicemia a digiuno e postprandiale. Irene Brandolin S.C. Medicina Interna E.O. Ospedali Galliera Savona, 23 Marzo 2013
 Approccio Terapeutico all iperglicemia a digiuno e postprandiale Irene Brandolin S.C. Medicina Interna E.O. Ospedali Galliera Savona, 23 Marzo 2013 La triade glicemica nella gestione del diabete Glicemia
Approccio Terapeutico all iperglicemia a digiuno e postprandiale Irene Brandolin S.C. Medicina Interna E.O. Ospedali Galliera Savona, 23 Marzo 2013 La triade glicemica nella gestione del diabete Glicemia
Gestione POST-CHIRURGICA nel paziente diabetico operato di cataratta
 Gestione POST-CHIRURGICA nel paziente diabetico operato di cataratta G. Addabbo ASL TA P.O. CENTRALE Stabilimento San G. Moscati Struttura Complessa di Oftalmologia La gestione post-operatoria nel paziente
Gestione POST-CHIRURGICA nel paziente diabetico operato di cataratta G. Addabbo ASL TA P.O. CENTRALE Stabilimento San G. Moscati Struttura Complessa di Oftalmologia La gestione post-operatoria nel paziente
Terapia intravitrale. Anti VEGF verso quale scelta? Dott. Marcello Prantera
 + Terapia intravitrale. Anti VEGF verso quale scelta? Dott. Marcello Prantera + 4 th cause of blindness 50 million people worldwide Proportion of cases of blindness due to each major cause (2008) Principali
+ Terapia intravitrale. Anti VEGF verso quale scelta? Dott. Marcello Prantera + 4 th cause of blindness 50 million people worldwide Proportion of cases of blindness due to each major cause (2008) Principali
Neuropatia Ottica Ischemica Anteriore Diagnosi Differenziale Terapia
 Neuropatia Ottica Ischemica Anteriore Diagnosi Differenziale Terapia Fai clic per aggiungere del testo Dott.ssa Eleonora Baldi UO Neurologia Dip Neuroscienze/Riabilitazione AOU S.Anna Diagnosi differenziale
Neuropatia Ottica Ischemica Anteriore Diagnosi Differenziale Terapia Fai clic per aggiungere del testo Dott.ssa Eleonora Baldi UO Neurologia Dip Neuroscienze/Riabilitazione AOU S.Anna Diagnosi differenziale
Questa scheda informativa è destinata ai genitori del bambino/a affetto da Retinopatia del Pretermine o agli aventi diritto
 SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLA RETINOPATIA DEL PRETERMINE MEDIANTE SOMMINISTRAZIONE DI BEVACIZUMAB (AVASTIN, Roche) PER VIA INTRAVITREALE Redatte dal Gruppo di Studio Italiano per la Retinopatia
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLA RETINOPATIA DEL PRETERMINE MEDIANTE SOMMINISTRAZIONE DI BEVACIZUMAB (AVASTIN, Roche) PER VIA INTRAVITREALE Redatte dal Gruppo di Studio Italiano per la Retinopatia
MONOGRAFIA SINTESI. IBRANCE (palbociclib) Carcinoma Mammario. A cura della Commissione Terapeutica Oncologica
 MONOGRAFIA SINTESI IBRANCE (palbociclib) Carcinoma Mammario A cura della Commissione Terapeutica Oncologica 1 SINTESI DELLA VALUTAZIONE 1.1 SINTESI DELLE EVIDENZE Palbociclib è indicato per il trattamento
MONOGRAFIA SINTESI IBRANCE (palbociclib) Carcinoma Mammario A cura della Commissione Terapeutica Oncologica 1 SINTESI DELLA VALUTAZIONE 1.1 SINTESI DELLE EVIDENZE Palbociclib è indicato per il trattamento
UN PERCORSO CONDIVISO PER LO SCREENING DI PRIMO LIVELLO E LE MEDICAZIONI DI BASE
 Azienda Unità Sanitaria Locale di Parma UN PERCORSO CONDIVISO PER LO SCREENING DI PRIMO LIVELLO E LE MEDICAZIONI DI BASE Piano regionale della Prevenzione e PDTA regionale per la presa in carico del piede
Azienda Unità Sanitaria Locale di Parma UN PERCORSO CONDIVISO PER LO SCREENING DI PRIMO LIVELLO E LE MEDICAZIONI DI BASE Piano regionale della Prevenzione e PDTA regionale per la presa in carico del piede
Laser-terapia. Terapia della retinopatia diabetica: quando e come. G. Addabbo. Bari, 7-10 novembre 2013
 Terapia della retinopatia diabetica: quando e come Laser-terapia G. Addabbo Bari, 7-10 novembre 2013 ASL TA P.O. Centrale Stabilimento San G. Moscati S.C. di Oftalmologia Cos è il laser Ligth Amplification
Terapia della retinopatia diabetica: quando e come Laser-terapia G. Addabbo Bari, 7-10 novembre 2013 ASL TA P.O. Centrale Stabilimento San G. Moscati S.C. di Oftalmologia Cos è il laser Ligth Amplification
SCHEDA INFORMATIVA PER LA SOMMINISTRAZIONE DI FARMACI ANTI-VEGF PER VIA INTRA- O PERI-OCULARE
 SCHEDA INFORMATIVA PER LA SOMMINISTRAZIONE DI FARMACI ANTI-VEGF PER VIA INTRA- O PERI-OCULARE In base a numerose evidenze derivanti dalla letteratura scientifica, i farmaci anti-vegf sono utilizzati da
SCHEDA INFORMATIVA PER LA SOMMINISTRAZIONE DI FARMACI ANTI-VEGF PER VIA INTRA- O PERI-OCULARE In base a numerose evidenze derivanti dalla letteratura scientifica, i farmaci anti-vegf sono utilizzati da
Allegato IV. Conclusioni scientifiche
 Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Il 7 giugno 2017, la Commissione europea (CE) è stata informata di un caso mortale di insufficienza epatica fulminante in un paziente trattato
Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Il 7 giugno 2017, la Commissione europea (CE) è stata informata di un caso mortale di insufficienza epatica fulminante in un paziente trattato
Interrogazione a risposta scritta. Il sottoscritto consigliere. visti
 Interrogazione a risposta scritta Il sottoscritto consigliere visti l art. 32 della Costituzione che stabilisce che la Repubblica tutela il diritto fondamentale alla salute; la legge n. 94, dell 8 aprile
Interrogazione a risposta scritta Il sottoscritto consigliere visti l art. 32 della Costituzione che stabilisce che la Repubblica tutela il diritto fondamentale alla salute; la legge n. 94, dell 8 aprile
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
Farmaci biologici ed edema maculare diabetico. Prof. Giovanni Calabria Università di Genova
 Farmaci biologici ed edema maculare diabetico Prof. Giovanni Calabria Università di Genova Edema maculare diabetico L'edema maculare diabetico si osserva in entrambe le forme di diabete (tipo I e II) e
Farmaci biologici ed edema maculare diabetico Prof. Giovanni Calabria Università di Genova Edema maculare diabetico L'edema maculare diabetico si osserva in entrambe le forme di diabete (tipo I e II) e
Clinica Oculistica dell Università degli Studi di Ancona. Eye Department of the Osimo Hospital, ITALY
 Cesare Mariotti Via Veneto 46 60122 Ancona ITALY Home: (+39) 071-20-0340 Cell: (+39) 335-56-1198-6 mariottic@libero.it Date of Birth: 13/11/1958 Specialty: Ophthalmology Credentials Medical License, Università
Cesare Mariotti Via Veneto 46 60122 Ancona ITALY Home: (+39) 071-20-0340 Cell: (+39) 335-56-1198-6 mariottic@libero.it Date of Birth: 13/11/1958 Specialty: Ophthalmology Credentials Medical License, Università
Gestione e follow-up del paziente con degenerazione maculare
 Gestione e follow-up del paziente con degenerazione maculare Ranibizumab: linee guida Mean change in VA (letters) Mean change in VA (letters) I migliori risultati si hanno con un trattamento più frequente
Gestione e follow-up del paziente con degenerazione maculare Ranibizumab: linee guida Mean change in VA (letters) Mean change in VA (letters) I migliori risultati si hanno con un trattamento più frequente
EFFICACIA E SICUREZZA DEI TRATTAMENTI DISPONIBILI PER L EDEMA MACULARE DIABETICO. a cura della Dr.ssa Mariarosanna De Fina
 EFFICACIA E SICUREZZA DEI TRATTAMENTI DISPONIBILI PER L EDEMA MACULARE DIABETICO a cura della Dr.ssa Mariarosanna De Fina BACKGROUND La Degenerazione Maculare (MD) è una malattia retinica che provoca un
EFFICACIA E SICUREZZA DEI TRATTAMENTI DISPONIBILI PER L EDEMA MACULARE DIABETICO a cura della Dr.ssa Mariarosanna De Fina BACKGROUND La Degenerazione Maculare (MD) è una malattia retinica che provoca un
ALLEGATO CONCLUSIONI SCIENTIFICHE PRESENTATE DALL'EMEA
 ALLEGATO CONCLUSIONI SCIENTIFICHE PRESENTATE DALL'EMEA 1 CONCLUSIONI SCIENTIFICHE PRESENTATE DALL EMEA RIASSUNTO COMPLESSIVO DELLA VALUTAZIONE SCIENTIFICA DI RESCUPASE Qualità Si ritiene che la qualità
ALLEGATO CONCLUSIONI SCIENTIFICHE PRESENTATE DALL'EMEA 1 CONCLUSIONI SCIENTIFICHE PRESENTATE DALL EMEA RIASSUNTO COMPLESSIVO DELLA VALUTAZIONE SCIENTIFICA DI RESCUPASE Qualità Si ritiene che la qualità
REPORT DI VALUTAZIONE AFLIBERCEPT
 REPORT DI VALUTAZIONE AFLIBERCEPT Aflibercept (Eylea flac.no) richiesto dal dott. Roberto Fozzer (U.O. Oculistica Ospedale Trento) con la seguente motivazione: il trattamento negli adulti della degenerazione
REPORT DI VALUTAZIONE AFLIBERCEPT Aflibercept (Eylea flac.no) richiesto dal dott. Roberto Fozzer (U.O. Oculistica Ospedale Trento) con la seguente motivazione: il trattamento negli adulti della degenerazione
Le Linee Guida ALS ERC del 2015 non contengono sostanziali cambiamenti rispetto alle precedenti linee guida ERC pubblicate nel 2010
 I Farmaci Tommaso Pellis Anestesia, Terapia Intensiva e C.O. 118 AAS 5 Friuli Occidentale Ospedale Santa Maria degli Angeli Pordenone Direttore: F. Bassi thomas.pellis@gmail.com COI: Nessuno Le Linee Guida
I Farmaci Tommaso Pellis Anestesia, Terapia Intensiva e C.O. 118 AAS 5 Friuli Occidentale Ospedale Santa Maria degli Angeli Pordenone Direttore: F. Bassi thomas.pellis@gmail.com COI: Nessuno Le Linee Guida
LA PREVENZIONE DELLE MALATTIE OCULARI
 LA PREVENZIONE DELLE MALATTIE OCULARI I A P B I T A L I A O N L U S P E R A M O R E D E L L A V I S T A LA PREVENZIONE DELLE MALATTIE OCULARI Che cosa è la medicina preventiva? sclera Campagna informativa
LA PREVENZIONE DELLE MALATTIE OCULARI I A P B I T A L I A O N L U S P E R A M O R E D E L L A V I S T A LA PREVENZIONE DELLE MALATTIE OCULARI Che cosa è la medicina preventiva? sclera Campagna informativa
Eylea. aflibercept. Che cos'è Eylea? Per che cosa si usa Eylea? Riassunto destinato al pubblico
 EMA/677928/2015 EMEA/H/C/002392 Riassunto destinato al pubblico aflibercept Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
EMA/677928/2015 EMEA/H/C/002392 Riassunto destinato al pubblico aflibercept Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
Macugen deve essere somministrato solo da oftalmologi esperti in iniezioni intravitreali.
 1. DENOMINAZIONE DEL MEDICINALE Macugen 0,3 mg soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Siringa pre-riempita in singola dose che rilascia 1,65 mg di pegaptanib sodico, corrispondente
1. DENOMINAZIONE DEL MEDICINALE Macugen 0,3 mg soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Siringa pre-riempita in singola dose che rilascia 1,65 mg di pegaptanib sodico, corrispondente
Maria Lucia Specchia, Giuseppe La Torre, Silvio Capizzi, Nicola Nicolotti, Walter Ricciardi
 Aspetti organizzativi e gestionali Maria Lucia Specchia, Giuseppe La Torre, Silvio Capizzi, Nicola Nicolotti, Walter Ricciardi Introduzione La degenerazione maculare senile (AMD) rappresenta nei Paesi
Aspetti organizzativi e gestionali Maria Lucia Specchia, Giuseppe La Torre, Silvio Capizzi, Nicola Nicolotti, Walter Ricciardi Introduzione La degenerazione maculare senile (AMD) rappresenta nei Paesi
Allegato I. Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione/delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione/delle autorizzazioni all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione
Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione/delle autorizzazioni all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione
! Per i clinici è frequente andare incontro a delle difficoltà nel tradurre i risultati della ricerca sperimentale sulle terapie nella loro pratica
 ! Per i clinici è frequente andare incontro a delle difficoltà nel tradurre i risultati della ricerca sperimentale sulle terapie nella loro pratica clinica.! I risultati dei clinical trial sono descritti
! Per i clinici è frequente andare incontro a delle difficoltà nel tradurre i risultati della ricerca sperimentale sulle terapie nella loro pratica clinica.! I risultati dei clinical trial sono descritti
Occlusioni, Terapia Iniettiva e Cataratta: Cosa Prima, Cosa Dopo
 Subspecialty Day SOI Le Occlusioni Venose Occlusioni, Terapia Iniettiva e Cataratta: Cosa Prima, Cosa Dopo Fabrizio Camesasca Non ho interessi economici pertinenti questa presentazione UOC Oculistica Humanitas
Subspecialty Day SOI Le Occlusioni Venose Occlusioni, Terapia Iniettiva e Cataratta: Cosa Prima, Cosa Dopo Fabrizio Camesasca Non ho interessi economici pertinenti questa presentazione UOC Oculistica Humanitas
Regione del Veneto Coordinamento Regionale Unico sul Farmaco - CRUF
 giunta regionale Allegato A al Decreto n. 97 del 8 agosto 2017 pag. 1/17 Regione del Veneto Coordinamento Regionale Unico sul Farmaco - CRUF Linee di indirizzo regionali per l impiego dei farmaci intravitreali
giunta regionale Allegato A al Decreto n. 97 del 8 agosto 2017 pag. 1/17 Regione del Veneto Coordinamento Regionale Unico sul Farmaco - CRUF Linee di indirizzo regionali per l impiego dei farmaci intravitreali
Schema dello studio clinico di Fase 2b
 Sommario dei risultati dello studio clinico di Fase 2b di Ataluren presentato in occasione dell American Academy of Neurology Meeting il 16 Aprile 2010 Toronto, 16 Aprile 2010 - Un nuovo farmaco sperimentale
Sommario dei risultati dello studio clinico di Fase 2b di Ataluren presentato in occasione dell American Academy of Neurology Meeting il 16 Aprile 2010 Toronto, 16 Aprile 2010 - Un nuovo farmaco sperimentale
Trapianto di cellule dell epitelio pigmentato retinico nella malattia di Stargardt
 Trapianto di cellule dell epitelio pigmentato retinico nella malattia di Stargardt E in corso di pubblicazione sulla rivista Ophthalmology un articolo che descrive i risultati ottenuti con il trapianto
Trapianto di cellule dell epitelio pigmentato retinico nella malattia di Stargardt E in corso di pubblicazione sulla rivista Ophthalmology un articolo che descrive i risultati ottenuti con il trapianto
Come è nata la Commissione per il Prontuario Terapeutico dell Azienda Provinciale per i Servizi Sanitari
 Come è nata la Commissione per il Prontuario Terapeutico dell Azienda Provinciale per i Servizi Sanitari Annalisa Campomori UO Farmacia Ospedale di Trento, Direttore Vice Presidente Commissione Terapeutica
Come è nata la Commissione per il Prontuario Terapeutico dell Azienda Provinciale per i Servizi Sanitari Annalisa Campomori UO Farmacia Ospedale di Trento, Direttore Vice Presidente Commissione Terapeutica
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Eylea 40 mg/ml soluzione iniettabile in siringa preriempita. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Eylea 40 mg/ml soluzione iniettabile in siringa preriempita. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione
REPORT HTA REGIONALE REGISTRO AIFA: NO. MODALITA PRESCRITTIVE: Osp-uso ospedaliero.
 REPORT HTA REGIONALE Decisioni CTR Data riunione: 20/12/2011 Decisione: Inserito con compilazione della scheda di monitoraggio regionale. Nota ufficiale: La prescrizione dovrà avvenire previa compilazione
REPORT HTA REGIONALE Decisioni CTR Data riunione: 20/12/2011 Decisione: Inserito con compilazione della scheda di monitoraggio regionale. Nota ufficiale: La prescrizione dovrà avvenire previa compilazione
per uso intravitreale
 Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n.224 relativo a: FLIBERCEPT per uso intravitreale ggiornamento Luglio
Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n.224 relativo a: FLIBERCEPT per uso intravitreale ggiornamento Luglio
AIFA - Agenzia Italiana del Farmaco
 Giugno 2013 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Limitazioni all uso di TROBALT (retigabina) il trattamento può comportare
Giugno 2013 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Limitazioni all uso di TROBALT (retigabina) il trattamento può comportare
L. Stuppia, Genetica Medica Università G. d Annunzio, Chieti - Pescara
 L. Stuppia, Genetica Medica Università G. d Annunzio, Chieti - Pescara I trelivellidellaprevenzione Prevenzione Primaria: adozione di interventi e comportamenti in grado di evitare o ridurre l'insorgenza
L. Stuppia, Genetica Medica Università G. d Annunzio, Chieti - Pescara I trelivellidellaprevenzione Prevenzione Primaria: adozione di interventi e comportamenti in grado di evitare o ridurre l'insorgenza
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE MEDIANTE SOMMINISTRAZIONE DI BEVACIZUMAB (AVASTIN, Roche) PER VIA INTRAVITREALE
 Approvato dalla Società Oftalmologica Italiana - Marzo 2007 Primo Aggiornamento Ottobre 2007 Secondo Aggiornamento Giugno 2008 Terzo Aggiornamento Aprile 2011 Quarto Aggiornamento - Ottobre 2012 Quinto
Approvato dalla Società Oftalmologica Italiana - Marzo 2007 Primo Aggiornamento Ottobre 2007 Secondo Aggiornamento Giugno 2008 Terzo Aggiornamento Aprile 2011 Quarto Aggiornamento - Ottobre 2012 Quinto
Congresso ROMA Gennaio20 Roma Eventi
 1 SOR Congresso ROMA 20 24-25 Gennaio20 Roma Eventi RETINA MEDICA Venerdì, 24 Gennaio OCT evoluzione tecnologica e nuove frontiere Nuovi antivegf: un arma in più per l oftalmologo Importanza del PDTA nella
1 SOR Congresso ROMA 20 24-25 Gennaio20 Roma Eventi RETINA MEDICA Venerdì, 24 Gennaio OCT evoluzione tecnologica e nuove frontiere Nuovi antivegf: un arma in più per l oftalmologo Importanza del PDTA nella
Follow up a lungo termine di pazienti affetti da degenerazione maculare senile trattati con iniezioni intravitreali di Macugen
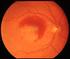 Bollettino della Società Medico Chirurgica di Pavia 124(2):261-265 Comunicazione all adunanza del 1 aprile 2011 Follow up a lungo termine di pazienti affetti da degenerazione maculare senile trattati con
Bollettino della Società Medico Chirurgica di Pavia 124(2):261-265 Comunicazione all adunanza del 1 aprile 2011 Follow up a lungo termine di pazienti affetti da degenerazione maculare senile trattati con
NEL PIENO DELLE DANZE: FARMACOVIGILANZA. Veronica Franchina
 CORSO INTRODUZIONE ALLA RICERCA CLINICA MILANO 14-15 GIUGNO 2018 NEL PIENO DELLE DANZE: FARMACOVIGILANZA Veronica Franchina Coordinatore di ricerca clinica, U.O.C. Oncologia Medica A.O. Papardo Messina
CORSO INTRODUZIONE ALLA RICERCA CLINICA MILANO 14-15 GIUGNO 2018 NEL PIENO DELLE DANZE: FARMACOVIGILANZA Veronica Franchina Coordinatore di ricerca clinica, U.O.C. Oncologia Medica A.O. Papardo Messina
DOMUS NOVA Ospedale Privato Accreditato. SAN FRANCESCO Ospedale Privato Accreditato. Gentile Sig./Sig.ra
 SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE C079 Rev.0 data applicazione 16/10/2018 Pag. 1 a 5 Approvato dalla Società Oftalmologica Italiana - Marzo 2007 Primo Aggiornamento Ottobre 2007 Secondo Aggiornamento
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE C079 Rev.0 data applicazione 16/10/2018 Pag. 1 a 5 Approvato dalla Società Oftalmologica Italiana - Marzo 2007 Primo Aggiornamento Ottobre 2007 Secondo Aggiornamento
GAZZETTA UFFICIALE DELLA REPUBBLICA ITALIANA Serie generale n. 115
 AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Maggio 2007 Modifica degli stampati dei medicinali contenenti farmaci antinfiammatori non steroidei (FANS) non selettivi per uso sistemico - ATC M01A. omissis
AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Maggio 2007 Modifica degli stampati dei medicinali contenenti farmaci antinfiammatori non steroidei (FANS) non selettivi per uso sistemico - ATC M01A. omissis
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Eylea 40 mg/ml soluzione iniettabile in siringa preriempita. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Eylea 40 mg/ml soluzione iniettabile in siringa preriempita. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di soluzione
Colchicina nella prevenzione degli eventi cardiovascolari
 Revisione Cochrane 2016 Colchicina nella prevenzione degli eventi cardiovascolari Hemkens LG, Ewald H, Gloy VL, et al. Colchicine for prevention of cardiovascular events. Cochrane Database Syst Rev 2016;1:CD011047.
Revisione Cochrane 2016 Colchicina nella prevenzione degli eventi cardiovascolari Hemkens LG, Ewald H, Gloy VL, et al. Colchicine for prevention of cardiovascular events. Cochrane Database Syst Rev 2016;1:CD011047.
Università del Piemonte Orientale. Corso di Laurea in Medicina e Chirurgia. Corso di Statistica Medica. I modelli di studio
 Università del Piemonte Orientale Corso di Laurea in Medicina e Chirurgia Corso di Statistica Medica I modelli di studio Corso di laurea in medicina e chirurgia - Statistica Medica Disegno dello studio
Università del Piemonte Orientale Corso di Laurea in Medicina e Chirurgia Corso di Statistica Medica I modelli di studio Corso di laurea in medicina e chirurgia - Statistica Medica Disegno dello studio
RoActemra. tocilizumab. Che cos è RoActemra? Per che cosa si usa RoActemra? Riassunto destinato al pubblico
 EMA/18167/2014 EMEA/H/C/000955 Riassunto destinato al pubblico tocilizumab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
EMA/18167/2014 EMEA/H/C/000955 Riassunto destinato al pubblico tocilizumab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE MEDIANTE SOMMINISTRAZIONE DI PEGAPTANIB (MACUGEN, Pfizer) PER VIA INTRAVITREALE
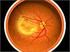 SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE MEDIANTE SOMMINISTRAZIONE DI PEGAPTANIB (MACUGEN, Pfizer) PER VIA INTRAVITREALE Primo Aggiornamento Ottobre 2007 Secondo Aggiornamento Giugno 2008
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE MEDIANTE SOMMINISTRAZIONE DI PEGAPTANIB (MACUGEN, Pfizer) PER VIA INTRAVITREALE Primo Aggiornamento Ottobre 2007 Secondo Aggiornamento Giugno 2008
I medici non devono più prescrivere medicinali contenenti calcitonina in forma di spray nasale per il trattamento dell'osteoporosi.
 20 Luglio 2012 EMA/CHMP/483874/2012 L Agenzia Europea del Medicinali raccomanda la limitazione dell uso a lungo termine di medicinali a base di calcitonina Ritiro della formulazione intranasale per il
20 Luglio 2012 EMA/CHMP/483874/2012 L Agenzia Europea del Medicinali raccomanda la limitazione dell uso a lungo termine di medicinali a base di calcitonina Ritiro della formulazione intranasale per il
Intensive prospective monitoring of anti-diabetic drugs in type
 Intensive prospective monitoring of anti-diabetic drugs in type II diabetes mellitus: a comparison between general practice and diabetologists in Sicily V. Pizzimenti 1, V. Ientile 1, G. Fava 1, I. Lo
Intensive prospective monitoring of anti-diabetic drugs in type II diabetes mellitus: a comparison between general practice and diabetologists in Sicily V. Pizzimenti 1, V. Ientile 1, G. Fava 1, I. Lo
Allegato III. Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo
 Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
SCHEDA INFORMATIVA INTERVENTO LASER DELLA RETINA APPROVATA DALLA SOCIETA' OFTALMOLOGICA ITALIANA NEL LUGLIO 2003
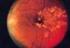 SCHEDA INFORMATIVA INTERVENTO LASER DELLA RETINA APPROVATA DALLA SOCIETA' OFTALMOLOGICA ITALIANA NEL LUGLIO 2003 Gentile Signora, Signore, Lei soffre di una affezione della retina responsabile dei suoi
SCHEDA INFORMATIVA INTERVENTO LASER DELLA RETINA APPROVATA DALLA SOCIETA' OFTALMOLOGICA ITALIANA NEL LUGLIO 2003 Gentile Signora, Signore, Lei soffre di una affezione della retina responsabile dei suoi
Capitolo 4. I confronti indiretti tra i Nuovi Anticoagulanti Orali (NOACs)
 I confronti indiretti tra i Nuovi Anticoagulanti Orali (NOACs) 171 I diversi Nuovi Anticoagulanti Orali sono stati studiati in trial e popolazioni non comparabili I trial di comparazione dei Nuovi Anticoagulanti
I confronti indiretti tra i Nuovi Anticoagulanti Orali (NOACs) 171 I diversi Nuovi Anticoagulanti Orali sono stati studiati in trial e popolazioni non comparabili I trial di comparazione dei Nuovi Anticoagulanti
A. Dalle Piagge. La paziente, unica nel Gruppo, registra l arresto della progressione della DMS.
 A. Dalle Piagge CASE REPORT RIASSUNTO La Maculopatia degenerativa senile (DMS) è una malattia che colpisce selettivamente la parte centrale della retina, la macula. La DMS interessa oltre il 10-15% delle
A. Dalle Piagge CASE REPORT RIASSUNTO La Maculopatia degenerativa senile (DMS) è una malattia che colpisce selettivamente la parte centrale della retina, la macula. La DMS interessa oltre il 10-15% delle
DEGENERAZIONE MACULARE SENILE
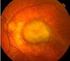 DEGENERAZIONE MACULARE SENILE La degenerazione maculare senile è ad oggi nei Paesi Occidentali, la principale causa di abbassamento progressivo ed irreversibile della capacità visiva nelle persone con
DEGENERAZIONE MACULARE SENILE La degenerazione maculare senile è ad oggi nei Paesi Occidentali, la principale causa di abbassamento progressivo ed irreversibile della capacità visiva nelle persone con
RETINA MALATTIE DELLA RETINA. Foro maculare
 MALATTIE DELLA RETINA Foro maculare RETINA La macula è la porzione centrale della retina responsabile dei dettagli e del colore della visione. La degenerazione del vitreo e del tessuto retinico può portare
MALATTIE DELLA RETINA Foro maculare RETINA La macula è la porzione centrale della retina responsabile dei dettagli e del colore della visione. La degenerazione del vitreo e del tessuto retinico può portare
Studio per verificare se BI migliora le capacità mentali nei soggetti con morbo di Alzheimer in forma lieve e difficoltà nelle funzioni mentali
 Studio per verificare se BI 409306 migliora le capacità mentali nei soggetti con morbo di Alzheimer in forma lieve e difficoltà nelle funzioni mentali Questo è il riassunto di uno studio clinico sul morbo
Studio per verificare se BI 409306 migliora le capacità mentali nei soggetti con morbo di Alzheimer in forma lieve e difficoltà nelle funzioni mentali Questo è il riassunto di uno studio clinico sul morbo
SCHEDA INFORMATIVA PER IL TRATTAMENTO DELLE MACULOPATIE
 Gentile Sig./Sig.ra Lei è affetto in OD/OS/OO da Questa scheda contiene le informazioni sul trattamento che Le viene proposto, sui risultati e sui rischi. Questo documento è la sintesi di una relazione
Gentile Sig./Sig.ra Lei è affetto in OD/OS/OO da Questa scheda contiene le informazioni sul trattamento che Le viene proposto, sui risultati e sui rischi. Questo documento è la sintesi di una relazione
RISPOSTA E RESISTENZA:QUANDO FERMARSI? RAFFAELE FORMICOLA MICHELE MELILLO C.D.C. FABIA MATER ROMA OPI NAPOLI 2016
 RISPOSTA E RESISTENZA:QUANDO FERMARSI? RAFFAELE FORMICOLA MICHELE MELILLO C.D.C. FABIA MATER ROMA OPI NAPOLI 2016 L antivegf rappresenta la terapia a lungo termine maggiormente impiegata dell amd neovascolare*
RISPOSTA E RESISTENZA:QUANDO FERMARSI? RAFFAELE FORMICOLA MICHELE MELILLO C.D.C. FABIA MATER ROMA OPI NAPOLI 2016 L antivegf rappresenta la terapia a lungo termine maggiormente impiegata dell amd neovascolare*
ALLEGATO TECNICO PER PROGETTI DI FARMACOVIGILANZA ATTIVA FINANZIABILI ATTRAVERSO I FONDI FV 2010/11
 Allegato B ALLEGATO TECNICO PER PROGETTI DI FARMACOVIGILANZA ATTIVA FINANZIABILI ATTRAVERSO I FONDI FV 2010/11 REGIONE: Sardegna RESPONSABILI TECNICO-SCIENTIFICO DEL PROGETTO nome: Michela cognome: Pellecchia
Allegato B ALLEGATO TECNICO PER PROGETTI DI FARMACOVIGILANZA ATTIVA FINANZIABILI ATTRAVERSO I FONDI FV 2010/11 REGIONE: Sardegna RESPONSABILI TECNICO-SCIENTIFICO DEL PROGETTO nome: Michela cognome: Pellecchia
AULA GIALLA STUDI CLINICI IN CORSO
 Terza Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche AULA GIALLA STUDI CLINICI IN CORSO Che cosa è uno studio clinico e a cosa serve? Si definisce sperimentazione clinica,
Terza Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche AULA GIALLA STUDI CLINICI IN CORSO Che cosa è uno studio clinico e a cosa serve? Si definisce sperimentazione clinica,
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Settembre 2012 Comunicazione diretta agli operatori sanitari su Macugen (pegaptanib sodico)
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Settembre 2012 Comunicazione diretta agli operatori sanitari su Macugen (pegaptanib sodico)
Capitolo 3.2. La valutazione economica dei Nuovi Anticoagulanti Orali (NOACs) nella prevenzione di ictus in pazienti con fibrillazione atriale (SPAF)
 La valutazione economica dei Nuovi Anticoagulanti Orali (NOACs) nella prevenzione di ictus in pazienti con fibrillazione atriale (SPAF) Analisi di Budget Impact a livello nazionale e regionale 159 Analisi
La valutazione economica dei Nuovi Anticoagulanti Orali (NOACs) nella prevenzione di ictus in pazienti con fibrillazione atriale (SPAF) Analisi di Budget Impact a livello nazionale e regionale 159 Analisi
SCHEDA FARMACO. Principio attivo (nome commerciale) Ponatinib. (Iclusig) 30 cpr da 45 mg 60cpr da 15 mg
 Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Ponatinib SCHEDA FARMACO (Iclusig) 30 cpr da 45 mg 60cpr da 15 mg Posologia: La dose
Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Ponatinib SCHEDA FARMACO (Iclusig) 30 cpr da 45 mg 60cpr da 15 mg Posologia: La dose
