RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
|
|
|
- Fausto Rubino
- 7 anni fa
- Visualizzazioni
Transcript
1 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ramipril e idroclorotiazide GERMED 2,5 mg + 12,5 mg compresse Ramipril e idroclorotiazide GERMED 5 mg + 25 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ramipril e idroclorotiazide GERMED 2,5 mg + 12,5 mg compresse: ogni compressa contiene 2,5 mg di ramipril e 12, 5 mg di idroclorotiazide. Ramipril e idroclorotiazide GERMED 5 mg + 25 mg compresse: ogni compressa contiene 5 mg di ramipril e 25 mg di idroclorotiazide. Eccipienti: Ramipril e idroclorotiazide GERMED 2,5 mg + 12,5 mg compresse: lattosio monoidrato 64,5 mg. Ramipril e idroclorotiazide GERMED 5 mg + 25 mg compresse: lattosio monoidrato 129 mg. Per l elenco completo degli eccipienti, vedere paragrafo FORMA FARMACEUTICA Compressa Ramipril e idroclorotiazide GERMED 2,5 mg + 12,5 mg compresse: compresse da bianche a biancastre, a forma di capsula, non rivestite, piatte, 4 x 8 mm, con un incisione su un lato. Sull altro lato, in rilievo 12,5. La compresse non è fatta per essere divisa. Ramipril e idroclorotiazide GERMED 5 mg + 25 mg compresse: Compresse da bianche a biancastre, a forma di capsula, non rivestite, piatte, 5 x 10 mm, con un incisione su un lato e con bordi su entrambi i lati. Sull altro lato, in rilievo 25. La compressa può essere divisa in due metà uguali. 4. INFORMAZIONI CLINICHE 4.1 Indicazioni terapeutiche Trattamento dell ipertensione essenziale. L associazione a dose fissa di ramipril e idroclorotiazide è indicata in pazienti la cui pressione sanguigna non è controllata in modo adeguato dal ramipril da solo o dall idroclorotiazide da sola. 4.2 Posologia e modo di somministrazione L associazione a dose fissa non è adatta per la terapia iniziale. Generale: Devono essere corretti deficit elettrolitici e/o di fluidi. Adulti: La somministrazione dell associazione a dose fissa Ramipril e idroclorotiazide GERMED è raccomandata solo dopo una titolazione individuale della dose dei singoli componenti.
2 La dose può essere aumentata con intervalli di almeno 3 settimane. La dose iniziale abituale è 2,5 mg di ramipril e 12,5 mg di idroclorotiazide una volta al giorno. La dose di mantenimento abituale è 2,5 mg di ramipril e 12,5 mg di idroclorotiazide o 5 mg di ramipril e 25 mg di idroclorotiazide. La dose massima raccomandata è 5 mg di ramipril e 25 mg di idroclorotiazide. Pazienti anziani e pazienti con funzionalità renale compromessa: Si raccomanda di determinare la funzionalità renale all inizio del trattamento. Il potassio e la creatinina devono essere monitorati periodicamente in questi pazienti, per esempio ogni due mesi quando il trattamento è stato stabilizzato (vedere paragrafo 4.4). Nei pazienti anziani e nei pazienti con clearance della creatinina tra 30 e 60 ml/min, i singoli componenti individuali di ramipril e idroclorotiazide vengono titolati individualmente con particolare attenzione, prima di passare a Ramipril e idroclorotiazide GERMED 2,5 mg + 12,5 mg compresse e 5 mg + 25 mg compresse. Nel caso in cui il paziente abbia avuto benefici da un precedente trattamento con un diuretico, può insorgere ipotensione sintomatica dopo la dose iniziale del prodotto, specialmente in pazienti con deplezione di sali (iponatriemia) e/o ipovolemia, causata da un trattamento diuretico precedente. Il diuretico deve essere interrotto 2 o 3 giorni prima dell inizio del trattamento con Ramipril e idroclorotiazide GERMED 2,5 mg + 12,5 mg compresse e 5 mg + 25 mg compresse; in pazienti in cui la sospensione del diuretico è impossibile, il trattamento deve iniziare con ramipril alla dose di 2,5 mg. La dose di Ramipril e idroclorotiazide GERMED deve essere mantenuta il più bassa possibile. La dose massima giornaliera è 5 mg di ramipril e 25 mg di idroclorotiazide. Ramipril e idroclorotiazide GERMED è controindicato in pazienti con funzionalità renale gravemente compromessa (clearance della creatinina < 30 ml/min/1,73 mq di superficie corporea) (vedere anche paragrafo 4.3). Funzionalità epatica compromessa: In pazienti con compromissione della funzionalità epatica da media a moderata, la dose di ramipril deve essere titolata prima di passare a Ramipril e idroclorotiazide GERMED. Ramipril e idroclorotiazide GERMED non deve essere utilizzato in pazienti con funzionalità epatica gravemente compromessa e/o colestasi (vedere paragrafo 4.3). Bambini e adolescenti (<18 anni di età): Ramipril e idroclorotiazide GERMED non è raccomandato per l uso in bambini e adolescenti al di sotto dei 18 anni a causa della mancanza di dati sulla sicurezza e sull efficacia (vedere paragrafo 5.1) Somministrazione: Ramipril e idroclorotiazide GERMED deve essere assunto come dose singola la mattina con una sufficiente quantità di liquido. Le compresse possono essere assunte con o senza cibo. I pazienti ad alto rischio di ipotensione acuta grave devono essere monitorati dal punto di vista medico preferibilmente in ospedale, fino a quando si attende il massimo effetto dopo la somministrazione della prima dose e ogni qual volta la dose di ACE inibitore e diuretico viene aumentata. Questo si applica anche a pazienti con angina pectoris o malattia cerebrovascolare, nei quali un eccessiva ipotensione può portare ad infarto del miocardio o accidente cerebrovascolare. In pazienti con ipertensione maligna o insufficienza cardiaca grave l inizio della terapia e gli aggiustamenti della dose devono essere effettuati in ospedale. 4.3 Controindicazioni Ipersensibilità al ramipril, ad altri ACE inibitori, alle tiazidi o ad altri derivati sulfonamidici o a uno qualsiasi degli eccipienti Anamnesi di edema angioneurotico relativo ad un precedente trattamento con un ACE inibitore Edema angioneurotico ereditario/idiopatico Funzionalità renale gravemente compromessa (clearance della creatinina 30ml/min /1,73 m 2 di superficie corporea) o anuria.
3 Funzionalità epatica gravemente compromessa e/o colestasi Sia durante il secondo o il terzo trimestre di gravidanza, sia durante l allattamento (vedere paragrafo 4.6). 4.4 Avvertenze speciali e precauzioni di impiego Ramipril Ipotensione sintomatica Si verifica ipotensione sintomatica raramente in pazienti con ipertensione non complicata. In pazienti ipertesi che assumono ramipril, l ipotensione si verifica più frequentemente in pazienti ipovolemici (per es. a causa di una terapia diuretica, restrizione di sale nella dieta, dialisi, diarrea o vomito), o che soffrono di ipertensione renina-dipendente (vedere paragrafi 4.5 e 4.8). É stata osservata in pazienti con insufficienza cardiaca, con o senza insufficienza renale associata. Questo si verifica con più probabilità in pazienti con gradi più gravi di insufficienza cardiaca, come conseguenza dell uso di alte dosi di diuretici dell ansa, o in chi soffre di iponatriemia o compromissione della funzionalità renale. Poiché ramipril/idroclorotiazide contiene idroclorotiazide, il trattamento con altri diuretici deve, se possibile essere interrotto prima di iniziare il trattamento. In pazienti con rischio aumentato di ipotensione sintomatica, l inizio della terapia e l aggiustamento della dose devono essere monitorati attentamente. Simili considerazioni si applicano a pazienti con malattia ischemica cardiaca o malattia cerebrovascolare, nei quali una caduta eccessiva della pressione sanguigna può portare ad infarto del miocardio o ad accidente cerebrovascolare. Se si verifica ipotensione, il paziente deve essere sistemato in posizione supina e, se necessario, ricevere un infusione endovenosa di una normale soluzione salina. Una risposta ipotensiva transitoria non è una controindicazione per ulteriori dosi, che di solito possono essere somministrate senza complicazioni una volta che la pressione sanguigna è aumentata dopo l espansione di volume. In alcuni pazienti con insufficienza cardiaca che hanno una pressione sanguigna nella norma o bassa, si può verificare, con il ramipril una diminuzione ulteriore della pressione sanguigna sistolica. Questo effetto è previsto e di solito non richiede un interruzione del trattamento. Se l ipotensione diventa sintomatica, può essere necessaria una riduzione della dose o un interruzione del trattamento con ramipril. Stenosi della valvola aortica e della valvola mitrale/cardiomiopatia ipertrofica Come con altri ACE inibitori, ramipril deve essere somministrato con cautela in pazienti con stenosi della valvola mitrale e ostruzione del flusso in uscita del ventricolo sinistro, come stenosi aortica o cardiomiopatia ipertrofica. In caso di rilevanza emodinamica non deve essere somministrata una combinazione fissa di ramipril e idroclorotiazide. Aldosteronismo primario (sindrome di Conn) L uso di una combinazione fissa di ramipril/ idroclorotiazide è controindicato, poiché i pazienti con aldosteronismo primario non rispondono agli agenti ipertensivi con l inibizione del sistema reninaangiotensina. Compromissione renale/stenosi dell arteria renale Vedere paragrafo 4.2. In pazienti con insufficienza cardiaca, l ipotensione a seguito dell inizio della terapia con ACE inibitori può portare a un ulteriore riduzione della funzionalità renale. È stata segnalata in questa situazione insufficienza renale acuta, di solito reversibile. La combinazione fissa di ramipril e idroclorotiazide è controindicata nella stenosi dell arteria renale. Se si sospetta una stenosi dell arteria renale, deve essere eseguita una renografia prima di iniziare il trattamento.
4 In alcuni pazienti con stenosi bilaterale dell arteria renale o con una stenosi dell arteria di un solo rene, che sono stati trattati con ACE inibitori, si sono verificati aumenti dell urea e della creatinina sierica nel sangue, di solito reversibile dopo interruzione del trattamento. Questo rischio è più alto in pazienti con insufficienza renale. Se il paziente soffre contemporaneamente di ipertensione renovascolare, c è un rischio aumentato di ipotensione grave e insufficienza renale. In questi pazienti, si deve iniziare il trattamento sotto stretto controllo medico con dosi basse e con un attenta titolazione della dose. Poiché il trattamento con diuretici può dare un contributo agli eventi sopracitati, questi medicinali devono essere interrotti e deve essere monitorata la funzionalità renale durante le prime settimane di terapia con ramipril. Sono stati osservati aumenti dell urea nel sangue e della creatinina sierica in alcuni pazienti ipertesi senza una preesistente malattia renale vascolare, di solito minori e transitorie in particolar modo quando ramipril è stato somministrato contemporaneamente ad un diuretico. Questo si verifica più probabilmente in pazienti con una preesistente compromissione renale. Può essere richiesta una riduzione della dose e/o un interruzione del diuretico e/o del ramipril. Pazienti con trapianto renale Poiché non c è esperienza sull uso di ramipril in pazienti con un trapianto renale recente, non si raccomanda la somministrazione di ramipril per questo gruppo di pazienti. Ipersensibilità/angioedema Sono stati segnalati raramente angioedema del viso, delle estremità, delle labbra, della lingua, della glottide e/o della laringe in pazienti trattati con ACE inibitori, incluso il ramipril. Questo si può verificare in qualsiasi momento durante la terapia. In questi casi, il ramipril deve essere interrotto tempestivamente e si deve iniziare un trattamento appropriato e il monitoraggio per assicurare la completa risoluzione di tutti i sintomi prima di dimettere il paziente. Anche nel caso in cui sia gonfia solo la lingua, senza affanno, può essere richiesta una prolungata osservazione del paziente poiché il trattamento con antiistaminici e corticosteroidi può essere insufficiente. Molto raramente, sono stati segnalati casi di morte improvvisa dovuti ad angioedema, associati a edema laringeo o edema della lingua. Edema che coinvolge la lingua, la glottide o la laringe, probabilmente è causa di ostruzione delle vie aeree, in particolar modo in pazienti con storia di interventi alle vie aeree. In questi casi deve essere tempestivamente somministrata una terapia di emergenza. Questo può includere la somministrazione di adrenalina e/o il mantenimento della pervietà delle vie aeree. Il paziente deve rimanere sotto stretto controllo medico fino alla completa e sostenuta risoluzione dei sintomi. I pazienti con un anamnesi di angioedema non correlata alla terapia con ACE inibitori possono essere esposti a rischio maggiore di angioedema mentre assumono un ACE inibitore (vedere paragrafo 4.3). Reazioni anafilattoidi in pazienti emodializzati Sono state segnalate reazioni anafilattoidi in pazienti dializzati con membrane ad alto flusso (per es. AN69) e trattati contemporaneamente con un ACE inibitore. In questi pazienti deve essere utilizzato un tipo diverso di membrane da dialisi o una classe diversa di agenti antiipertensivi. Reazioni anafilattoidi LDL aferesi In rari casi, pazienti che assumevano ACE inibitori durante l LDL-aferesi (LDL= lipoproteine a bassa densità) con destrano solfato hanno avuto esperienza di reazioni anafilattoidi rischiose per la vita. Queste reazioni venivano evitate dalla sospensione temporanea della terapia con ACE inibitori prima di ciascuna aferesi. Desensibilizzazione Pazienti che assumevano ACE inibitori durante il trattamento di desensibilizzazione (es. dal veleno degli imenotteri) hanno avuto reazioni anafilattoidi. Negli stessi pazienti, queste reazioni sono state evitate quando
5 gli ACE inibitori venivano interrotti temporaneamente ma ricomparivano con una somministrazione involontaria del medicinale. Insufficienza epatica In casi molto rari gli ACE inibitori sono stati associati a una sindrome che inizia con ittero colestatico o epatite e porta a necrosi fulminante e (a volte) morte. Il meccanismo di questa sindrome non è stato compreso. In pazienti che assumono ACE inibitori che sviluppano ittero o aumenti significativi degli enzimi epatici, il ramipril deve essere interrotto e deve essere stabilito un follow-up medico. Neutropenia/agranulocitosi Sono state segnalate neutropenia/agranulocitosi, trombocitopenia e anemia in pazienti che assumevano ACE inibitori. Nei pazienti con funzionalità renale normale e nessun altro fattore di complicazione, si verifica raramente neutropenia. La neutropenia e l agranulocitosi sono reversibili a seguito dell interruzione dell ACE inibitore. Il ramipril deve essere utilizzato con estrema cautela in pazienti con malattia vascolare del collagene, in terapia immunosoppressiva, in trattamento con allopurinolo o procainamide, o una combinazione di questi fattori di complicazione, in particolar modo se è presente una funzionalità renale compromessa preesistente. Alcuni di questi pazienti sviluppano gravi infezioni, che in pochi casi non rispondono alla terapia intensiva con antibiotici. Se il ramipril viene utilizzato in questi pazienti, si raccomanda il monitoraggio periodico della conta dei globuli bianchi e i pazienti devono essere invitati a segnalare qualsiasi segno di infezione. Razza Gli ACE inibitori possono causare una frequenza più alta di angioedema nei pazienti neri che in pazienti non neri. Come per gli altri ACE inibitori, il ramipril può essere meno efficace nell abbassare la pressione sanguigna nei pazienti neri rispetto a quelli non neri, probabilmente a causa di una più alta prevalenza di stati di bassa renina nella popolazione nera ipertesa. Tosse È stata segnalata tosse con l uso di ACE inibitori. Tipicamente, la tosse è non produttiva, persistente e si risolve dopo l interruzione della terapia. La tosse indotta da ACE inibitori deve essere considerata parte della diagnosi differenziale di tosse. Insufficienza cardiaca grave In pazienti con insufficienza cardiaca grave (classe IV) il trattamento deve essere iniziato con una attenta supervisione medica, e la dose iniziale deve essere bassa. Chirurgia/anestesia Il ramipril può causare ipotensione o shock ipotensivo in pazienti sottoposti a chirurgia maggiore o che sono sotto anestesia, come risultato del potenziamento degli anestetici, che possono causare ipotensione. Il trattamento appropriato in questi casi è la ricostituzione del volume. Le tiazidi possono ridurre la risposta arteriosa alla noradrenalina. Nelle operazioni di emergenza la dose di premedicazione e di anestetico devono essere ridotte. Le tiazidi possono aumentare la risposta alla tubocurarina. Il trattamento con un associazione fissa di ramipril e idroclorotiazide deve, se possibile, essere interrotto prima dell intervento chirurgico, in alternativa deve essere prestata particolare attenzione per affrontare l ostruzione del flusso in uscita dal ventricolo sinistro. Iperkaliemia Sono stati osservati aumenti del potassio sierico in alcuni pazienti trattati con ACE inibitori, incluso ramipril. I pazienti a rischio per lo sviluppo di iperkaliemia includono quelli con insufficienza renale, diabete mellito, o quelli che usano contemporaneamente diuretici risparmiatori di potassio, integratori di potassio o sostituti del sale contenenti potassio, o quei pazienti che assumono altri farmaci associati a un aumento del potassio sierico (ad es. eparina). Se l uso concomitante degli agenti sopracitati è ritenuto appropriato, si raccomanda un regolare monitoraggio del potassio sierico (vedere 4.5). Pazienti diabetici
6 Nei pazienti diabetici trattati con altri agenti antidiabetici orali o insulina, durante il primo mese di trattamento con un ACE inibitore il controllo glicemico deve essere strettamente monitorato. (vedere 4.5). Litio La combinazione di litio e ramipril generalmente non è raccomandata (vedere 4.5). Integratori di potassio, diuretici risparmiatori di potassio e sostituti del sale contenenti potassio Sebbene i livelli di potassio, di solito, negli studi clinici con gli ACE inibitori rimangano entro i limiti normali, alcuni pazienti hanno avuto esperienza di iperkaliemia, dopotutto. I fattori di rischio per lo sviluppo di iperkaliemia includono insufficienza renale, diabete mellito e uso concomitante di diuretici risparmiatori di potassio (per es. spironolattone, triamterene o amiloride), integratori di potassio o sostituti del sale contenenti potassio. In particolar modo in pazienti con ridotta funzionalità renale, gli integratori di potassio, i diuretici risparmiatori di potassio o i sostitutii del sale contenenti potassio possono portare ad un significativo aumento di potassio serico. Il ramipril somministrato contemporaneamente ai diuretici risparmiatori di potassio, può risultare in una ipokaliemia indotta da diuretici. Proteinuria: Si può verificare in particolar modo in pazienti con una compromissione esistente della funzionalità renale o su dosi relativamente alte di ACE inibitori. Idroclorotiazide Funzionalità renale compromessa In pazienti con ridotta funzionalità renale, le tiazidi possono precipitare l azotemia. In pazienti con funzionalità renale compromessa, si possono verificare effetti cumulativi del medicinale. Se si sviluppa insufficienza renale progressiva, caratterizzata da un incremento dell azoto non proteico, è necessaria un attenta valutazione della terapia, e deve essere tenuta in considerazione l interruzione della terapia diuretica (vedere paragrafo 4.3). Funzionalità epatica compromessa Le tiazidi devono essere utilizzate con cautela in pazienti con funzionalità renale compromessa o disturbi progressivi della funzionalità epatica, poiché piccole variazioni dell equilibrio di liquidi ed elettroliti possono portare a coma epatico. (vedere paragrafo 4.3). Effetti metabolici ed endocrini La terapia con tiazidi può ridurre la tolleranza al glucosio. Nel diabete possono essere necessari aggiustamenti della dose di insulina o farmaci ipoglicemizzanti orali. Un diabete mellito latente può diventare manifesto durante al terapia con tiazidi. Alla terapia diuretica con tiazidi sono stati associati aumenti dei livelli di colesterolo e trigliceridi. In alcuni pazienti trattati con diuretici tiazidici si può verificare iperuricemia, o si può sviluppare gotta evidente. Gotta In alcuni pazienti, il trattamento con tiazidi può causare iperuricemia e/o gotta. Comunque, il ramipril può aumentare l escrezione di acido urico, e questo attenua l effetto di iperuricemia dell idroclorotiazide. Squilibri elettrolitici Deve essere eseguita una determinazione periodica degli elettroliti sierici a intervalli appropriati, per ogni paziente trattato con diuretici. Le tiazidi, inclusa l idroclorotiazide, possono causare squilibrio di liquidi ed elettroliti (ipokaliemia, iponatriemia e alcalosi ipocloremica). Segnali di avvertimento dello squilibrio di liquidi ed elettroliti sono secchezza delle fauci, sete, debolezza, letargia, sonnolenza, irrequietezza, mialgia, o crampi muscolari, fatica muscolare, ipotensione, oliguria, tachicardia e disordini gastrointestinali come nausea e vomito.
7 Sebbene si possa sviluppare ipokaliemia durante il trattamento con diuretici tiazidici, l uso concomitante di ramipril può diminuire l ipokaliemia indotta da diuretici. Il rischio di ipokaliemia è più probabile nei pazienti con cirrosi epatica, in pazienti che soffrono di diuresi rapida, in pazienti che hanno un assunzione orale di elettroliti inadeguata e in pazienti trattati contemporaneamente con corticosteroidi o ACTH (vedere 4.5). Quando fa caldo si può verificare iponatriemia in pazienti edematosi. La carenza di cloro è generalmente lieve e non necessita di trattamento. Il potassio sierico deve essere determinato prima che sia iniziato il trattamento, dopo una settimana di trattamento, e poi misurato a intervalli regolari in seguito. L uso concomitante di diuretici risparmiatori di potassio, integratori di potassio, sostituti del sale contenenti potassio o altri medicinali che possono aumentare il potassio sierico (es. eparina sodica) possono causare un aumento dei livelli di potassio sierico. In pazienti con lungo intervallo QT idiopatico o causata da un medicinale, sia ipokaliemia e bradicardia sono fattori di rischio che possono causare torsioni di punta. In questi casi il potassio sierico deve essere monitorato a frequenti intervalli. Le tiazidi possono ridurre l escrezione di potassio e causare un lieve intermittente aumento dei livelli di calcio sierico anche in assenza di disordini noti del metabolismo del calcio. Una spiccata ipercalcemia può essere un indizio di un iperparatiroidismo nascosto. Le tiazidi devono essere interrotte prima che vengano effettuati i test della funzionalità paratiroidea. Le tiazidi si sono dimostrate aumentare l escrezione renale di magnesio, che può portare ad ipomagnesia. Neutropenia/Agranulocitosi La dose fissa di combinazione di ramipril e idroclorotiazide deve essere interrotta se si scopre o si sospetta neutropenia (neutrofili minori di 1000/mm 3 ). Test antidoping L idroclorotiazide contenuta in questo medicinale può determinare positività ai test anti-doping Altro Si possono verificare reazioni di ipersensibilità in pazienti con o senza un anamnesi di asma allergico o bronchiale. Sono state segnalate possibilità di un peggioramento o di un attivazione del lupus eritematoso sistemico. L associazione fissa di ramipril e idroclorotiazide può essere utilizzata solo dopo una attenta valutazione del rapporto rischio/beneficio sotto un regolare monitoraggio di parametri clinici e di laboratorio rappresentativi in caso di: - disturbo delle reazioni immunitarie o malattia del collagene (es. lupus eritematoso, scleroderma) - terapia sistemica concomitante con medicinali che sopprimono le reazioni immunitarie (es. corticoidi, citostatici, antimetaboliti), allopurinolo, procainamide o litio) - gotta Questo medicinale contiene lattosio monoidrato. I pazienti con rari problemi ereditari di intolleranza al galattosio, deficit di Lapp lattasi o malassorbimento di glucosio-galattosio non devono assumere questo medicinale. 4.5 Interazioni con altri medicinali ed altre forme di interazione Sono state segnalate le seguenti interazioni tra ramipril/idroclorotiazide compresse, altri ACE inibitori o prodotti che contengono idroclorotiazide. Ramipril Diuretici Quando viene aggiunto un diuretico alla terapia di un paziente che assume ramipril, l effetto antiipertensivo è di solito additivo. I pazienti che già assumono diuretici e in particolar modo quelli nei quali la terapia con diuretici è stata istituita recentemente, possono occasionalmente soffrire di una eccessiva riduzione della pressione sanguigna
8 quando viene aggiunto ramipril. La possibilità di ipotensione sintomatica con ramipril può essere minimizzata interrompendo il diuretico prima dell inizio del trattamento con ramipril (vedere paragrafo 4.4). Antinfiammatori non steroidei (FANS), compreso acido acetilsalicilico <3g/die La somministrazione cronica di FANS può ridurre l effetto antiipertensivo di un ACE inibitore. I FANS e gli ACE inibitori esercitano un effetto additivo sull aumento del potassio sierico e possono portare a deterioramento della funzionalità renale. Questi effetti sono solitamente reversibili. Raramente, si può verificare insufficienza renale acuta, in particolar modo in pazienti con funzionalità renale compromessa come negli anziani o nelle persone disidratate. Altri antiipertensivi L uso concomitante di questi medicinali può aumentare l effetto ipotensivo di ramipril. L uso concomitante di trinitroglicerina e altri nitrati, o altri vasodilatatori, può ridurre ulteriormente la pressione sanguigna. Antidepressivi triciclici/antipsicotici/anestetici L uso concomitante di alcuni medicinali anestetici, antidepressivi triciclici e antipsicotici con ACE inibitori può portare a ulteriore riduzione della pressione sanguigna (vedere paragrafo 4.4). Simpaticomimetici I simpaticomimetici possono ridurre l effetto ipotensivo degli ACE inibitori; i pazienti devono essere monitorati attentamente. Antidiabetici Studi epidemiologici hanno suggerito che la somministrazione concomitante di ACE inibitori e medicinali antidiabetici (insulina, ipoglicemizzanti orali) può causare un aumento dell effetto di diminuzione del glucosio nel sangue con rischio di ipoglicemia. Questo fenomeno sembrava verificarsi con più probabilità durante le prime settimane di trattamento combinato in pazienti con compromissione renale. Allopurinolo La somministrazione concomitante di ACE inibitori e allopurinolo aumenta il rischio di insufficienza renale e può portare a un aumento del rischio di leucopenia. Ciclosporina La somministrazione concomitante di ACE inibitori e ciclosporina aumenta il rischio di insufficienza renale e iperkaliemia. Lovastatina La somministrazione concomitante di ACE inibitori e lovastatina aumenta il rischio di iperkaliemia. Procainamide, citostatici o medicinali immunosoppressori La somministrazione concomitante con ACE inibitori può portare ad un rischio aumentato di leucopenia. Emodialisi Ramipril/Idroclorotiazide non è indicato in pazienti che richiedono dialisi poiché è stata segnalata un alta incidenza di reazioni anafilattoidi in pazienti dializzati con membrane ad alto flusso e trattati contemporaneamente con ACE inibitori. Idroclorotiazide Amfotericina B (parenterale), carbenoxolone, corticosteroidi, corticotropina (ACTH) o lassativi stimolanti L idroclorotiazide può causare squilibri elettrolitici, specialmente ipokaliemia. Sali di calcio/vitamina D Si può verificare un aumento dei livelli di calcio sierico come risultato di una diminuita escrezione se somministrati contemporaneamente a diuretici tiazidici.
9 Glicosidi cardiaci Un aumentato rischio di intossicazione da digitatici insieme a tiazidi induce ipokaliemia. Gli effetti e gli effetti indesiderati (potenziamento di effetti cardiotossici) di glicosidi digitalici e agenti antiaritmici può essere potenziato se c è una preesistente carenza di potassio e/o carenza di magnesio. Colestiramina e colestipolo Queste possono ridurre o rallentare l assorbimento di idroclorotiazide. Quindi i diuretici sulfonamidici devono essere assunti almeno un ora prima o da quattro a sei ore dopo questi farmaci. Rilassanti muscolari non depolarizzanti (es. derivati del curaro) L effetto di questi medicinali può essere aumentato dall idroclorotiazide. Medicinali associati a torsione di punta A causa del rischio di ipokaliemia, deve essere prestata attenzione se viene somministrata idroclorotiazide contemporaneamente a medicinali associati a torsione di punta quali ad es. alcuni antipsicotici e altri medicinali che sono noti per indurre torsioni di punta. Sotalolo L ipokaliemia indotta da tiazidi può aumentare il rischio di aritmie indotte da sotalolo. Ramipril/Idroclorotiazide Integratori di potassio, diuretici risparmiatori di potassio e sostituti del sale contenenti potassio Anche se i livelli di potassio rimanevano di solito entro i limiti normali negli studi clinici con ACE inibitori, alcuni pazienti hanno avuto comunque episodi di iperkaliemia. I fattori di rischio per lo sviluppo di iperkaliemia includono insufficienza renale, diabete mellito e uso contemporaneo di diuretici risparmiatori di potassio (es. spironolattone, triamterene o amiloride), integratori di potassio o sostituti del sale contenenti potassio. In particolar modo in pazienti con ridotta funzionalità renale gli integratori di potassio, i diuretici risparmiatori di potassio, i sostituti del sale contenenti potassio possono portare ad aumenti significativi di potassio sierico. Il ramipril somministrato contemporaneamente a diuretici risparmiatori di potassio, può portare a un miglioramento dell ipokaliemia indotta da diuretici. Litio Sono stati segnalati aumenti reversibili delle concentrazioni di litio sierico e tossicità, durante la somministrazione concomitante di litio e ACE inibitori. L uso concomitante di diuretici tiazidici può aumentare il rischio di tossicità da litio e incrementare la già aumentata tossicità da litio con ACE inibitori. L uso di ramipril con il litio non è raccomandato, ma se si rende necessaria l associazione, deve essere effettuato un attento monitoraggio dei livelli di litio sierico (vedere paragrafo 4.4). Trimetoprim La somministrazione concomitante di ACE inibitori e tiazidi con trimetoprim aumentano il rischio di iperkaliemia. Agenti antidiabetici orali (es. sulfaniluree/biguanidi come la metformina) insulina L idroclorotiazide può probabilmente ridurre l effetto di questi medicinali e il ramipril può pronunciare l effetto ipoglicemizzante. Sodio cloruro Riduce l effetto antiipertensivo dell associazione fissa di ramipril e idroclorotiazide. Trattamento con alte dosi di salicilati(>3 g/die) L idroclorotiazide può potenziare l effetto tossico sul SNC dei salicilati Alcool
10 L associazione fissa di ramipril e idroclorotiazide può potenziare l effetto dell alcool. La concomitante assunzione di alcool può peggiorare l ipotensione ortostatica. Liquirizia La liquirizia può portare a perdita di potassio e di magnesio. Metildopa È stata descritta emolisi dovuta alla formazione di anticorpi contro il componente efficace idroclorotiazide. Ipnotici, stupefacenti, anestetici Peggioramento dell ipotensione (ortostatica) (gli anestesisti devono essere informati del trattamento con la combinazione fissa di ramipril e idroclorotiazide, vedere anche paragrafo 4.4). Mezzi di contrasto contenenti iodio Aumentato rischio di insufficienza renale acuta, in particolar modo con alte dosi di mezzi di contrasto contenenti iodio. 4.6 Gravidanza e allattamento Gravidanza Ramipril/Idroclorotiazide non è raccomandato durante il primo trimestre di gravidanza. Quando si programma o viene confermata una gravidanza, deve essere iniziato un trattamento alternativo prima possibile. Non sono stati condotti studi controllati con ACE inibitori sugli uomini, ma un numero di casi limitati di esposizione nel primo trimestre di gravidanza non ha evidenziato malformazioni. Ramipril/Idroclorotiazide può causare, quando somministrato a donne in gravidanza morbilità fetale e neonatale. Alcune dozzine di casi sono stati segnalati nella letteratura mondiale. L esposizione prolungata durante il secondo e il terzo trimestre può indurre tossicità nei feti (diminuita funzionalità renale, oligoidramnios, ritardo nell ossificazione del cranio) e nei neonati (insufficienza renale neonatale, ipotensione e iperkaliemia). In più, l uso di ACE inibitori (incluso Ramipril/Idroclorotiazide) è stato associato ad un potenziale aumento del rischio di difetti della nascita. Quando la gravidanza è certa, gli ACE inibitori devono essere interrotti il prima possibile e deve essere condotto regolarmente un monitoraggio dello sviluppo fetale. Nelle donne che stanno programmando una gravidanza, gli ACE inibitori (incluso ramipril/idroclorotiazide) non devono essere utilizzati. Donne in età fertile devono essere rese consapevoli dei potenziali rischi e gli ACE inibitori (incluso ramipril/idroclorotiazide) devono essere somministrati solo dopo un attento consiglio e dopo la considerazione dei rischi e dei benefici individuali. L idroclorotiazide in caso di prolungata esposizione durante il terzo trimestre di gravidanza può causare ischemia feto-placentare e rischio di ritardo della crescita. In più, sono stati segnalati casi rari di ipoglicemia, ittero e trombocitopenia nei neonati in caso di esposizione vicino al termine. Altri effetti indesiderati visti negli adulti possono anche verificarsi nei neonati. L idroclorotiazide può ridurre sia il volume di plasma, sia il flusso sanguigno uteroplacentare. Allattamento Ramipril/Idroclorotiazide è controindicato nel periodo di allattamento. Sia il ramipril, sia l idroclorotiazide sono escreti nel latte umano. Nelle madri che allattano, le tiazidi sono state associate a diminuzione o anche a soppressione dell allattamento. Si possono verificare ipersensibilità ai derivati sulfonamidici, ipokaliemia e ittero nucleare. A causa della potenziali gravi reazioni avverse nei lattanti da parte di entrambi i farmaci, si deve decidere se interrompere l allattamento o interrompere la terapia tenendo conto dell importanza di questa terapia per la madre. 4.7 Effetti sulla capacità di guidare veicoli e sull uso di macchinari Ramipril e idroclorotiazide GERMED hanno influenza lieve o moderata sulla capacità di guidare veicoli o di usare macchinari
11 A causa delle reazioni individuali differenti, la capacità di guidare o usare macchinari o lavorare in sicurezza può essere compromessa. Questo si applica in particolar modo all inizio del trattamento dopo aver aumentato il dosaggio, nel cambiare la preparazione, o durante la concomitante assunzione di etanolo. 4.8 Effetti indesiderati I seguenti effetti indesiderati sono stati osservati in associazione alla terapia con ACE inibitori, ramipril o idroclorotiazide: sintomi quali vertigini, debolezza generale, visione offuscata si sono verificati raramente con disturbi dello stato di coscienza (sincope). Si è verificata ipotensione grave dopo l inizio o l aumento della terapia. Questo si verifica in particolar modo in alcuni gruppi a rischio (vedere paragrafo 4.4). Sono stati segnalati casi isolati di tachicardia, palpitazioni, aritmie, angina pectoris, infarto del miocardio, grave ipotensione con shock, attacchi ischemici transitori e emorragia cerebrale, e infarto cerebrale ischemico, per gli ACE inibitori in associazione a ipotensione. Sono state utilizzate le seguenti terminologie per classificare il verificarsi di effetti indesiderati: Molto comune( 1/10) Comune ( 1/100 a <1/10) Non comune ( 1/1000 a <1/100) Raro ( 1/ a <1/1000) Molto raro ( 1/10.000), non nota (la frequenza non può essere definita sulla base dei dati disponibili) Frequenza Classificazione sistemica organica Comune Non comune Raro Molto raro Patologie cardiache Angina pectoris, infarto del miocardio, aritmia, palpitazioni, tachicardia. Patologie del sistema emolinfopoietico Patologie del sistema nervoso Patologie dell occhio Patologie respiratorie, toraciche mediastiniche Patologie gastrointestinali Patologie renali e urinarie e Vertigini, fatica, mal di testa, debolezza Tosse, bronchite Nausea, dolore addominale, vomito, indigestione Sonnolenza Congiuntivite/bl efarite* Crampi epigastrici, sete, costipazione, diarrea, perdita di appetito Proteinuria Diminuzione dell emoglobina, ematocrito, leucopenia, trombocitopenia. Irrequietezza, disordini dell olfatto, disturbi dell equilibrio, parestesia Miopia transitoria, visione offuscata Dispnea, sinusite, rinite, faringite, glossite, broncospasmo, polmonite interstiziale allergica Secchezza delle fauci, vomito, disturbi del gusto, infiammazione delle membrane mucose della bocca e della lingua, sialadenite, glossite Deterioramento della funzionalità renale, aumentato azoto ureico nel sangue Agranulocitosi, pancitopenia, eosinofilia, anemia emolitica in pazienti con G-6-PDH. Attacchi ischemici transitori, emorragia cerebrale Edema angioneurotico con ostruzione fatale delle vie respiratorie 1,edema polmonare causato ad ipersensibilità all idroclorotiazide Ileo, pancreatite (emorragica) Insufficienza renale (acuta), nefrosi, nefrite interstiziale, oliguria
12 Patologie della cute e del tessuto sottocutaneo 3 Patologie del sistema muscoloscheletrico Disturbi del metabolismo e della nutrizione Reazioni come cutanea allergiche eruzione Ipokaliemia, iperuricemia,con aumento dell urea e della creatinina, iperglicemia, gotta Fotosensibilità, prurito, orticaria Iperkaliemia, iponatriemia, ipomagnesiemia, ipercloremia, ipercalcemia (BUN), urea nel sangue, e creatinina sierica, disidratazione Vampate, diaforesi, edema angioneurotico Crampi muscolari, mialgia, artralgia, debolezza muscolare, artrite Disturbi dell equilibrio dei liquidi ed elettrolitico (in particolar modo in pazienti con malattia renale preesistente), ipocloremia, alcalosi metabolica Patologie vascolari ipotensione Malattia tromboembolica, sincope Patologie sistemiche e condizioni relative alla sede di somministrazione Patologie epatobiliari Patologie dell apparato riproduttivo e della mammella Disturbi psichiatrici Libido diminuita Apatia, nervosismo Tinnito Aumento degli enzimi epatici e/o della bilirubina Impotenza Ansia, confusione, depressione, disturbi del sonno Eritema multiforme, sindrome di Stevens- Johnson, necrolisi epidermica tossica reazioni cutanee psoriasiformi o pemfigoidi, lupus eritematoso, alopecia*, peggioramento della psoriasi, onicolisi Paresi Trigliceridi elevati, ipercolesterolemia, aumento dell amilasi, peggioramento del diabete Attacchi ischemici transitori, ictus, peggioramento della sindrome di Raynaud, disordini alle vene, infiammazioni venose, trombosi, emboli Reazioni anafilattiche, edema angioneurotico 1 Ittero col estatico/ittero, epatite, ittero 2, colecistite (in caso di preesistente calcolosi biliare), necrosi epatica 1 Incidenza aumentata di edema angioneurotico in persone nere, gli ACE inibitori sono stati associati all insorgenza di edema angioneurotico compresi viso e tessuto orofaringeo in un gruppo minore di pazienti 2 Il monitoraggio medico del paziente è richiesto quando si verificano ittero o enzimi epatici elevati. 3 In caso di gravi reazioni cutanee è necessario contattare il medico immediatamente. È stato segnalato un insieme di sintomi associato a uno o più dei seguenti sintomi: Febbre, vasculite, mialgia, artralgia/artrite, test ANA per gli anticorpi antinucleo positivo, aumentata sedimentazione dei globuli rossi (ESR), eosinofilia e leucocitosi, eruzione cutanea, fotosensibilità o altre manifestazioni dermatologiche. 4.9 Sovradosaggio Sintomi di intossicazione:
13 In modo dipendente dalla misura del sovradosaggio si possono verificare i seguenti sintomi: diuresi ritardata, disturbi elettrolitici, ipotensione grave, stato di coscienza compromesso (incluso coma), convulsioni, paresi, aritmie cardiache, bradicardia, shock circolatorio, insufficienza renale, e ileo paralitico. Trattamento In caso si verifichino sovradosaggio o intossicazione, il trattamento dipende dal modo e dal tempo di assunzione e dal tipo e dalla gravità dei sintomi. In aggiunta alle misure generali che vengono utilizzate per l eliminazione delle sostanze (es. lavanda gastrica, sostanze adsorbenti e sodio solfato) entro 30 minuti dopo l assunzione di ramipril/idroclorotiazide, devono essere monitorati i parametri vitali, e se necessario aggiustati nell unità di cura intensiva. Il componente ramipril può raramente essere eliminato dalla dialisi (vedere paragrafo 4.4 Reazioni anafilattoidi nei pazienti in emodialisi) In caso di ipotensione prima di tutto deve essere implementato il ricambio di fluidi con cloruro di sodio. Se la risposta è inadeguata, devono essere somministrate catecolamine per endovena. Può essere preso in considerazione il trattamento con angiotensina II. In caso di bradicardia refrattaria deve essere istituito il trattamento pacemaker. Il monitoraggio costante dell acqua, dell equilibrio elettrolitico e acido/base, del glucosio del sangue e delle sostanze nelle urine è essenziale. In caso di ipokaliemia, è necessaria un integrazione di potassio. In caso di edema angioneurotico rischioso per la vita, con coinvolgimento della lingua, della glottide e/o della laringe si raccomandano i seguenti trattamenti di emergenza: -Immediata somministrazione sottocutanea di 0,3-0,5 mg di adrenalina o una lenta somministrazione endovena di adrenalina mentre si registra ECG e si misura la pressione sanguigna. -Glucocorticoidi somministrati endovena o intramuscolo -Si raccomanda inoltre di somministrare per via endovenosa antistaminici e antagonisti dei recettori H 2. -In aggiunta all uso di adrenalina si può prendere in considerazione la somministrazione di inattivatore C 1, se c è una carenza nota di inattivatore C PROPRIETÀ FARMACOLOGICHE 5.1 Proprietà farmacodinamiche Categoria farmacoterapeutica: ACE inibitori e diuretici, codice ATC: C 09 BA 05 Ramipril/idroclorotiazide ha un effetto antiipertensivo e un effetto diuretico. Ramipril e idroclorotiazide sono utilizzati da soli o in associazioni come terapia antiipertensiva. Gli effetti antiipertensivi di entrambe le sostanze si completano a vicenda. Gli effetti antiipertensivi di entrambe le sostanze sono pressoché additivi, mentre la perdita di potassio causata dall idroclorotiazide viene ridotta dal ramipril Ramipril: Il ramiprilato, metabolita attivo del profarmaco ramipril, inibisce l enzima dipeptidilcarbossipeptidasi I (sinonimo: enzima di conversione dell angiotensina, kininasi II). Questo enzima catalizza nel plasma la conversione tessutale dell angiotensina I nel vasocostrittore attivo angiotensina II e anche la degradazione del vasodilatatore attivo bradichinina. La ridotta formazione di angiotensina II e l inibizione della degradazione della bradichinina portano a vasodilatazione. Poiché l angiotensina II stimola anche la liberazione di aldosterone, il ramiprilato causa una riduzione della liberazione di aldosterone. Si è notato in studi su animali un aumento dell attività della bradichinina, che contribuisce probabilmente agli effetti cardioprotettivi ed endotelioprotettivi. Fino a che punto ciò sia anche responsabile di alcune reazioni avverse (ad es. tosse secca), ancora non è stato compreso.
14 L uso del ramipril causa una riduzione marcata nella resistenza periferica delle arterie. Di solito, non si verificano cambiamenti più grandi del flusso plasmatico renale e della velocità di filtrazione glomerulare. La somministrazione di ramipril a pazienti ipertesi porta a una riduzione della pressione sanguigna in posizione sia eretta sia supina senza un aumento compensatorio delle pulsazioni. L effetto antiipertensivo è evidente in 1 o 2 ore dopo la somministrazione di una dose singola nella maggior parte dei pazienti. L effetto massimo si osserva dopo 3-6 ore a seguito dell assunzione di una dose singola. L effetto antiipertensivo a seguito di una dose singola si mantiene di solito per almeno 24 ore. Durante il trattamento continuato con il ramipril, l effetto antiipertensivo massimo di solito si raggiunge entro 2-4 settimane. È stato dimostrato che l effetto antiipertensivo si mantiene durante il trattamento a lungo termine di 2 anni. Una brusca interruzione dell assunzione di ramipril non causa come conseguenza un rapido ed eccessivo aumento della pressione sanguigna. Idroclorotiazide L idroclorotiazide è un diuretico tiazidico. Inibisce il riassorbimento di sodio e cloro nei tubuli distali. L aumentata escrezione renale di questi ioni è accompagnata da un aumentata escrezione renale di urina (dovuta al legame osmotico di acqua). L escrezione di potassio e di magnesio è aumentato mentre l escrezione di acido urico è ridotta. Dosi massicce causano una escrezione aumentata di bicarbonato e durante il trattamento a lungo termine riduce l escrezione di calcio. I possibili meccanismi di azione possono essere: variazione nell equilibrio del sodio, riduzione dell acqua extracellulare e del volume plasmatici, cambiamento nella resistenza renale vascolare e anche ridotta risposta alla noradrenalina e all angiotensina II. L escrezione di elettroliti e di acqua inizia approssimativamente 2 ore dopo la somministrazione, il massimo si raggiunge dopo 3-6 ore e si mantiene per 6-12 ore. L effetto antiipertensivo si dimostra dopo 3-4 giorni e si mantiene fino a una settimana dopo l interruzione del trattamento. Nel trattamento a lungo termine, l effetto di abbassamento della pressione sanguigna si vede anche a dosi più basse rispetto alle dosi necessarie per raggiungere un effetto diuretico. L effetto di diminuzione della pressione sanguigna è accompagnato da un lieve aumento della frazione filtrata, della resistenza renovascolare e dell attività della renina nel plasma. Singole dosi elevate di idroclorotiazide causano una riduzione del volume plasmatico, del tasso di filtrazione glomerulare, del flusso renale plasmatico e della pressione arteriosa media. Durante il trattamento a lungo termine con basse dosi, il volume plasmatico rimane diminuito, mentre il flusso cardiaco in uscita e la velocità di filtrazione glomerulare ritorna ai valori base come prima dell inizio del trattamento. La pressione sanguigna arteriosa media e la resistenza vascolare sistemica rimangono diminuite. I diuretici tiazidici possono inibire l allattamento. Trattamento combinato con ramipril e idroclorotiazide L attività plasmatica dell ACE era quasi totalmente inibita da dosi singole di 5 mg di ramipril, quando somministrato da solo o in associazione con 25 mg di idroclorotiazide. Anche la diuresi era la stessa dopo la somministrazione di 25 mg di idroclorotiazide, da sola o in associazione con 5 mg di ramipril. Non era presente interazione farmacodinamica tra i due farmaci nell inibizione dell ACE. Dopo la somministrazione di dosi ripetute non sono state osservate interazioni farmacodinamiche riguardanti al volume di diuresi. Comunque, dopo il quarto giorno di trattamento, il flusso urinario massimo era significativamente più alto con l associazione che con idroclorotiazide da sola. Questo effetto può rappresentare un vantaggio nell uso terapeutico. È stato osservato un lieve incremento della natriuresi con l associazione, in confronto con l idroclorotiazide da sola. Questo può contribuire all effetto antiipertensivo additivo dell associazione. Una lieve riduzione dell escrezione di potassio è stata registrata dopo l associazione di ramipril alla terapia con idroclorotiazide da sola. L associazione compensa anche la diminuzione del flusso plasmatico renale osservato in monoterapia con idroclorotiazide. Il tasso di filtrazione glomerulare (GFR) non era coinvolto.
15 5.2 Proprietà farmacocinetiche Ramipril Il ramipril viene rapidamente assorbito dopo somministrazione orale. Determinato come radioattività ritrovata nelle urine, che rappresenta solo una delle vie di eliminazione, l assorbimento di ramipril è almeno il 56%. L assunzione concomitante di cibo non ha influenza sull assorbimento. Il profarmaco ramipril viene sottoposto a esteso metabolismo epatico di primo passaggio, che è importante per la formazione (per idrolisi, principalmente nel fegato) del solo metabolita attivo, ramiprilato. Insieme a questa attivazione a ramiprilato, il ramipril viene glucuronato e trasformato in ramipril dichetopiperazina (estere). Il ramipril viene glucuronato e trasformato in ramipril dichetopiperazina (acido). A causa di questa attivazione/metabolizzazione del profarmaco, circa il 20% della dose somministrata per os è biodisponibile. A seguito della somministrazione orale di 2,5 mg e 5 mg, la biodisponibilità del ramiprilato è circa 45% rispetto alla biodisponibilità dopo somministrazione endovena delle stesse dosi di ramipril. La concentrazione plasmatica massima a seguito della somministrazione orale viene raggiunta in 1 ora. L emivita di eliminazione è di circa 1 ora. La concentrazione plasmatica massima di ramiprilato è raggiunta entro 2-4 ore a seguito della somministrazione orale di ramipril. L emivita di eliminazione di ramipril è circa 1 ora. Dopo somministrazione endovena, il volume di distribuzione del ramipril è circa 90 litri (1,2 l/kg), e quella del ramiprilato circa 500 litri (6,7 l/kg). Il legame di ramipril e ramiprilato con le proteine è di circa il 73% e 56%, rispettivamente. Gli studi su animali che allattano hanno dimostrato che il ramipril passa nel latte materno. Le concentrazioni plasmatiche di ramiprilato diminuiscono in modo polifasico. La fase iniziale di distribuzione ed eliminazione ha emivita di circa 3 ore. È seguito da una fase intermedia con emivita di eliminazione di circa 15 ore e da una fase terminale con concentrazioni plasmatiche di ramiprilato molto basse ed emivita di circa 4-5 giorni. Questa fase terminale è dovuta alla lenta dissociazione del ramiprilato dal legame forte ma saturo all ACE. Nonostante la lunga fase terminale, le concentrazioni plasmatiche del ramipril allo stato stazionario vengono raggiunte dopo circa 4 giorni dopo una singola dose giornaliera di 2,5 mg di ramipril o più. L emivita di eliminazione effettiva, rilevante per il dosaggio, è ore dopo dosi ripetute. A seguito della somministrazione orale di 10 mg di ramipril radioattivo, circa il 40% viene escreto nelle feci e circa il 60% nelle urine. A seguito della somministrazione endovena di ramipril, circa il 50-60% della dose viene trovata nelle urine (come ramipril e metaboliti), e circa il 50% era apparentemente eliminata attraverso una via non renale. Dopo somministrazione endovena di ramiprilato, circa il 70% della sostanza e dei suoi metaboliti vengono ritrovati nelle urine, indicando che circa il 30% dell escrezione del ramipril non avviene per via renale. Dopo la somministrazione di 5 mg di ramipril in pazienti con drenaggio del dotto biliare, circa la stessa quantità di ramipril e dei suoi metaboliti sono escreti nelle urine e nella bile durante le prime 24 ore. Circa l 80-90% dei metaboliti escreti nelle urine e nella bile erano identificati come ramiprilato o metaboliti del ramiprilato. Il ramipril glucuronide e il ramipril dichetopiperaziona rappresentavano circa il 10-20% del totale, mentre il ramipril non metabolizzato rappresentava circa il 2%. La cinetiche di ramipril e ramiprilato in adulti sani di età tra 65 e 76 anni corrispondono alla cinetica di ramipril e ramiprilato in individui giovani sani. Nei pazienti con funzionalità renale compromessa, l escrezione renale di ramiprilato è ridotta. La clearance renale del ramiprilato è correlata in modo proporzionale alla clearance della creatinina. Questo porta a un aumento delle concentrazioni plasmatiche e ritarda l eliminazione del ramiprilato rispetto ai pazienti con funzionalità renale normale. Quando il ramipril viene somministrato ad alte dosi (10 mg), una funzionalità epatica compromessa ritarda l attivazione del ramipril a ramiprilato, portando a un aumento delle concentrazioni plasmatiche di ramipril. L eliminazione del ramiprilato è diminuita. Neanche in adulti sani, pazienti ipertesi o pazienti che soffrono di insufficienza cardiaca, è stato trovato accumulo rilevante di ramipril e ramiprilato dopo somministrazione orale di 5 mg una volta al giorno per due settimane. Idroclorotiazide
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. Una compressa di Torasemide GERMED 10 mg contiene 10 mg di torasemide.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Torasemide GERMED 10 mg Compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa di Torasemide GERMED 10 mg contiene
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Torasemide GERMED 10 mg Compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa di Torasemide GERMED 10 mg contiene
LISINOPRIL e IDROCLOROTIAZIDE RATIOPHARM 20 mg + 12,5mg compresse
 1. DENOMINAZIONE DEL MEDICINALE LISINOPRIL e IDROCLOROTIAZIDE RATIOPHARM 20 mg + 12,5mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA LISINOPRIL e IDROCLOROTIAZIDE RATIOPHARM 20 mg + 12,5mg compresse
1. DENOMINAZIONE DEL MEDICINALE LISINOPRIL e IDROCLOROTIAZIDE RATIOPHARM 20 mg + 12,5mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA LISINOPRIL e IDROCLOROTIAZIDE RATIOPHARM 20 mg + 12,5mg compresse
Allegato III. Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
Allegato III. Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Queste modifiche ai paragrafi pertinenti del Riassunto delle Caratteristiche
Allegato III Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Queste modifiche ai paragrafi pertinenti del Riassunto delle Caratteristiche
Allegato III. Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo
 Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
Allegato III. Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
FOGLIO ILLUSTRATIVO confezione 50 compresse. Sodio bicarbonato Sella 500 mg compresse. CATEGORIA FARMACOTERAPEUTICA Antiacidi con sodio bicarbonato
 FOGLIO ILLUSTRATIVO confezione 50 compresse Sodio bicarbonato Sella 500 mg compresse CATEGORIA FARMACOTERAPEUTICA Antiacidi con sodio bicarbonato INDICAZIONI TERAPEUTICHE Trattamento a breve termine dell
FOGLIO ILLUSTRATIVO confezione 50 compresse Sodio bicarbonato Sella 500 mg compresse CATEGORIA FARMACOTERAPEUTICA Antiacidi con sodio bicarbonato INDICAZIONI TERAPEUTICHE Trattamento a breve termine dell
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
FOGLIO ILLUSTRATIVO. QUINAZIDE 20 mg + 6,25 mg compresse rivestite con film quinapril cloridrato + idroclorotiazide
 FOGLIO ILLUSTRATIVO QUINAZIDE 20 mg + 6,25 mg compresse rivestite con film quinapril cloridrato + idroclorotiazide CATEGORIA FARMACOTERAPEUTICA Inibitore dell'enzima di conversione dell'angiotensina (ACE-inibitore)
FOGLIO ILLUSTRATIVO QUINAZIDE 20 mg + 6,25 mg compresse rivestite con film quinapril cloridrato + idroclorotiazide CATEGORIA FARMACOTERAPEUTICA Inibitore dell'enzima di conversione dell'angiotensina (ACE-inibitore)
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio Acetato 29.4 g (ogni ml contiene 3 meq di K + )
 1. DENOMINAZIONE DEL MEDICINALE Potassio Acetato MONICO 3 meq/ml Concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio
1. DENOMINAZIONE DEL MEDICINALE Potassio Acetato MONICO 3 meq/ml Concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di soluzione contengono: Principio attivo: Potassio
INSUFFICIENZA RENALE ACUTA
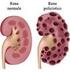 INSUFFICIENZA RENALE ACUTA Sindrome clinico-metabolica caratterizzata da una rapida (ore, giorni) riduzione del filtrato glomerulare (VFG) con conseguente ritenzione dei prodotti del catabolismo azotato
INSUFFICIENZA RENALE ACUTA Sindrome clinico-metabolica caratterizzata da una rapida (ore, giorni) riduzione del filtrato glomerulare (VFG) con conseguente ritenzione dei prodotti del catabolismo azotato
LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
FARMACOVIGILANZA LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
ACESISTEM 20 mg + 12,5 mg COMPRESSE enalapril maleato + idroclorotiazide
 ACESISTEM 20 mg + 12,5 mg COMPRESSE enalapril maleato + idroclorotiazide Categoria farmaco terapeutica ACESISTEM è un antipertensivo, associazione di un inibitore dell'enzima di conversione dell'angiotensina
ACESISTEM 20 mg + 12,5 mg COMPRESSE enalapril maleato + idroclorotiazide Categoria farmaco terapeutica ACESISTEM è un antipertensivo, associazione di un inibitore dell'enzima di conversione dell'angiotensina
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE FOSINOPRIL e IDROCLOROTIAZIDE DOC Generici 20 mg + 12,5 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE FOSINOPRIL e IDROCLOROTIAZIDE DOC Generici 20 mg + 12,5 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa
Felodipina ratiopharm 5 mg compresse a rilascio prolungato Felodipina ratiopharm 10 mg compresse a rilascio prolungato.
 1. DENOMINAZIONE DEL MEDICINALE Felodipina ratiopharm 5 mg compresse a rilascio prolungato Felodipina ratiopharm 10 mg compresse a rilascio prolungato. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Felodipina
1. DENOMINAZIONE DEL MEDICINALE Felodipina ratiopharm 5 mg compresse a rilascio prolungato Felodipina ratiopharm 10 mg compresse a rilascio prolungato. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Felodipina
DEBOLE MEDIA FORTE FARMACI DIURETICI AD INTENSITÀ D AZIONE
 FARMACI DIURETICI AD INTENSITÀ D AZIONE a) osmotici mannitolo (Isotol), glicerina b) inibitori dell anidrasi carbonica acetazolamide (Diamox) c) risparmiatori di spironolattone (Aldactone, Spirolang),
FARMACI DIURETICI AD INTENSITÀ D AZIONE a) osmotici mannitolo (Isotol), glicerina b) inibitori dell anidrasi carbonica acetazolamide (Diamox) c) risparmiatori di spironolattone (Aldactone, Spirolang),
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 1. DENOMINAZIONE DEL MEDICINALE RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO LISINOPRIL e IDROCLOROTIAZIDE DOC Generici 20 + 12,5 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa
1. DENOMINAZIONE DEL MEDICINALE RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO LISINOPRIL e IDROCLOROTIAZIDE DOC Generici 20 + 12,5 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa
GAZZETTA UFFICIALE DELLA REPUBBLICA ITALIANA Serie generale n. 115
 AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Maggio 2007 Modifica degli stampati dei medicinali contenenti farmaci antinfiammatori non steroidei (FANS) non selettivi per uso sistemico - ATC M01A. omissis
AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Maggio 2007 Modifica degli stampati dei medicinali contenenti farmaci antinfiammatori non steroidei (FANS) non selettivi per uso sistemico - ATC M01A. omissis
Conclusioni scientifiche
 ALLEGATO II CONCLUSIONI SCIENTIFICHE E MOTIVI PER LA RICHIESTA DI MODIFICA DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO, DELL'ETICHETTATURA E DEL FOGLIO ILLUSTRATIVO PRESENTATA DALL'AGENZIA EUROPEA
ALLEGATO II CONCLUSIONI SCIENTIFICHE E MOTIVI PER LA RICHIESTA DI MODIFICA DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO, DELL'ETICHETTATURA E DEL FOGLIO ILLUSTRATIVO PRESENTATA DALL'AGENZIA EUROPEA
ASSISTENZA PERIOPERATORIA
 ASSISTENZA PERIOPERATORIA Fattori che influiscono sull assistenza La malattia e la risposta Intervento chirurgico Aspetti sociali e personali Interventi dei medici e infermieri FATTORE UMANO TIPI DI INTERVENTI
ASSISTENZA PERIOPERATORIA Fattori che influiscono sull assistenza La malattia e la risposta Intervento chirurgico Aspetti sociali e personali Interventi dei medici e infermieri FATTORE UMANO TIPI DI INTERVENTI
Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA VENLAFAXINA ZENTIVA 37,5 MG CAPSULE RIGIDE A RILASCIO PROLUNGATO VENLAFAXINA ZENTIVA 75 MG CAPSULE RIGIDE A RILASCIO PROLUNGATO VENLAFAXINA ZENTIVA 150 MG CAPSULE RIGIDE A RILASCIO PROLUNGATO
FARMACOVIGILANZA VENLAFAXINA ZENTIVA 37,5 MG CAPSULE RIGIDE A RILASCIO PROLUNGATO VENLAFAXINA ZENTIVA 75 MG CAPSULE RIGIDE A RILASCIO PROLUNGATO VENLAFAXINA ZENTIVA 150 MG CAPSULE RIGIDE A RILASCIO PROLUNGATO
INSUFFICIENZA RENALE ACUTA. Classificazione. Prerenale. Post-renale. Renale
 INSUFFICIENZA RENALE ACUTA Improvvisa e grave compromissione di funzionalità renale Accumulo acuto di liquidi e sostanze tossiche nel sangue Sovraccarico acuto e uremia Classificazione 1) Prerenale :una
INSUFFICIENZA RENALE ACUTA Improvvisa e grave compromissione di funzionalità renale Accumulo acuto di liquidi e sostanze tossiche nel sangue Sovraccarico acuto e uremia Classificazione 1) Prerenale :una
Fisiologia Renale 8. Bilancio idro-elettrolitico III. Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona
 Fisiologia Renale 8. Bilancio idro-elettrolitico III Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona Obiettivi Bilancio del sodio e regolazione del volume extracellulare
Fisiologia Renale 8. Bilancio idro-elettrolitico III Carlo Capelli, Fisiologia Generale e dell Esercizio Facoltà di Scienze Motorie di Verona Obiettivi Bilancio del sodio e regolazione del volume extracellulare
TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE
 FARMACOVIGILANZA TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono
FARMACOVIGILANZA TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono
GLUCOBAY 50 mg compresse GLUCOBAY 100 mg compresse acarbose
 GLUCOBAY 50 mg compresse GLUCOBAY 100 mg compresse acarbose Categoria farmacoterapeutica Farmaco usato nel diabete; ipoglicemizzanti orali. Indicazioni terapeutiche Diabete mellito non-insulino-dipendente
GLUCOBAY 50 mg compresse GLUCOBAY 100 mg compresse acarbose Categoria farmacoterapeutica Farmaco usato nel diabete; ipoglicemizzanti orali. Indicazioni terapeutiche Diabete mellito non-insulino-dipendente
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE VERMOX 500mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa contiene: Principio attivo: Mebendazolo 500
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE VERMOX 500mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa contiene: Principio attivo: Mebendazolo 500
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
IRC: ANTIBIOTICI,MA SOPRATTUTTO CON PRUDENZA? Dott. Maurizio Gherzi S.C. Nefrologia e Dialisi Ospedale di Ceva
 IRC: QUALI ANTIBIOTICI O TUTTI GLI ANTIBIOTICI,MA SOPRATTUTTO CON PRUDENZA? I Dott. Maurizio Gherzi S.C. Nefrologia e Dialisi Ospedale di Ceva PERCHE SI SVILUPPA NEFROTOSSICITA? (1) Il flusso di sangue
IRC: QUALI ANTIBIOTICI O TUTTI GLI ANTIBIOTICI,MA SOPRATTUTTO CON PRUDENZA? I Dott. Maurizio Gherzi S.C. Nefrologia e Dialisi Ospedale di Ceva PERCHE SI SVILUPPA NEFROTOSSICITA? (1) Il flusso di sangue
Acido ascorbico Medicinale equivalente
 Foglio illustrativo: informazioni per l utilizzatore Acido ascorbico Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per
Foglio illustrativo: informazioni per l utilizzatore Acido ascorbico Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale perché contiene importanti informazioni per
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Sodio Cloruro Fresenius Kabi Italia 0,9%, soluzione per infusione Sodio Cloruro Fresenius Kabi Italia 2%, soluzione per infusione
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Sodio Cloruro Fresenius Kabi Italia 0,9%, soluzione per infusione Sodio Cloruro Fresenius Kabi Italia 2%, soluzione per infusione
INDICAZIONI TERAPEUTICHE
 FOGLIO ILLUSTRATIVO Potassio cloruro S.A.L.F. 2 meq/ml concentrato per soluzione per infusione CATEGORIA FARMACOTERAPEUTICA Soluzioni elettrolitiche. INDICAZIONI TERAPEUTICHE Trattamento di deficienze
FOGLIO ILLUSTRATIVO Potassio cloruro S.A.L.F. 2 meq/ml concentrato per soluzione per infusione CATEGORIA FARMACOTERAPEUTICA Soluzioni elettrolitiche. INDICAZIONI TERAPEUTICHE Trattamento di deficienze
Foglio illustrativo. In caso di reazioni da ipersensibilità il trattamento deve essere interrotto immediatamente e non ripreso.
 Foglio illustrativo IMMUCYTAL Compresse IMMUCYTAL Granulato per soluzione orale Categoria Farmacoterapeutica Vaccini batterici. Indicazioni terapeutiche Profilassi delle infezioni batteriche ricorrenti
Foglio illustrativo IMMUCYTAL Compresse IMMUCYTAL Granulato per soluzione orale Categoria Farmacoterapeutica Vaccini batterici. Indicazioni terapeutiche Profilassi delle infezioni batteriche ricorrenti
Edema da ascite epatico
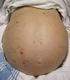 Diuretici I diuretici trovano applicazione clinica in varie situazioni tra cui spiccano: l ipertensione arteriosa la risoluzione degli edemi derivanti da diverse cause Cirrosi epatica Ostruzione portale
Diuretici I diuretici trovano applicazione clinica in varie situazioni tra cui spiccano: l ipertensione arteriosa la risoluzione degli edemi derivanti da diverse cause Cirrosi epatica Ostruzione portale
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE FOSINOPRIL DOC Generici 10 mg compresse FOSINOPRIL DOC Generici 20 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE FOSINOPRIL DOC Generici 10 mg compresse FOSINOPRIL DOC Generici 20 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni
DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla
FARMACOVIGILANZA DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla
Classificazione dei principali Diuretici
 Classificazione dei principali Diuretici 1. Diuretici Osmotici 2. Inibitori dell Anidrasi Carbonica 3. Tiazidici 4. Diuretici dell ansa 5. Risparmiatori di potassio Tiazidi Agenti risparmiatori di potassio
Classificazione dei principali Diuretici 1. Diuretici Osmotici 2. Inibitori dell Anidrasi Carbonica 3. Tiazidici 4. Diuretici dell ansa 5. Risparmiatori di potassio Tiazidi Agenti risparmiatori di potassio
Trattamento farmacologico dell ulcera gastro-duodenale L. 29
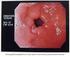 Trattamento farmacologico dell ulcera gastroduodenale L. 29 Fisiologia della secrezione acida dello stomaco vago PI 2 K + + M 3 2 + Cellula Antrale D peptidi Cellula Antrale elicobacter pylori vago Antiacidi
Trattamento farmacologico dell ulcera gastroduodenale L. 29 Fisiologia della secrezione acida dello stomaco vago PI 2 K + + M 3 2 + Cellula Antrale D peptidi Cellula Antrale elicobacter pylori vago Antiacidi
Foglio illustrativo: informazioni per il paziente. CALCIO CARBONATO VITAMINA D3 EG 1000 mg U.I. Granulato effervescente. Medicinale equivalente
 Foglio illustrativo: informazioni per il paziente CALCIO CARBONATO VITAMINA D3 EG 1000 mg + 880 U.I. Granulato effervescente Medicinale equivalente Legga attentamente questo foglio prima di prendere questo
Foglio illustrativo: informazioni per il paziente CALCIO CARBONATO VITAMINA D3 EG 1000 mg + 880 U.I. Granulato effervescente Medicinale equivalente Legga attentamente questo foglio prima di prendere questo
Foglio illustrativo: informazioni per il paziente. LEVODROPROPIZINA EG30 mg/5 ml sciroppo. Medicinale equivalente
 Foglio illustrativo: informazioni per il paziente LEVODROPROPIZINA EG30 mg/5 ml sciroppo Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti
Foglio illustrativo: informazioni per il paziente LEVODROPROPIZINA EG30 mg/5 ml sciroppo Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti
COMPLICANZE DEL DIABETE
 COMPLICANZE DEL DIABETE Prof. Alfonso Bellia ACUTE (prevalentemente metaboliche) Ipoglicemia acuta (
COMPLICANZE DEL DIABETE Prof. Alfonso Bellia ACUTE (prevalentemente metaboliche) Ipoglicemia acuta (
LO SHOCK ANAFILATTICO
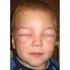 LO SHOCK ANAFILATTICO LO SHOCK - DEFINIZIONE Si definisce come una grave e diffusa alterazione della perfusione tessutale, che determina danno e morte cellulare GLI SHOCK - CLASSIFICAZIONE 1. IPOVOLEMICO
LO SHOCK ANAFILATTICO LO SHOCK - DEFINIZIONE Si definisce come una grave e diffusa alterazione della perfusione tessutale, che determina danno e morte cellulare GLI SHOCK - CLASSIFICAZIONE 1. IPOVOLEMICO
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. RAMIPRIL E IDROCLOROTIAZIDE PENSA compresse 2,5 mg + 12,5 mg
 1. DENOMINAZIONE DEL MEDICINALE RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO RAMIPRIL E IDROCLOROTIAZIDE PENSA compresse 2,5 mg + 12,5 mg RAMIPRIL E IDROCLOROTIAZIDE PENSA compresse 5 mg + 25 mg 2. COMPOSIZIONE
1. DENOMINAZIONE DEL MEDICINALE RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO RAMIPRIL E IDROCLOROTIAZIDE PENSA compresse 2,5 mg + 12,5 mg RAMIPRIL E IDROCLOROTIAZIDE PENSA compresse 5 mg + 25 mg 2. COMPOSIZIONE
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
Equilibrio idroelettrolitico
 Equilibrio idroelettrolitico Sodio Potassio Sodio e volume extracellulare Bilancio e distribuzione dell acqua corporea Regolazione del bilancio dell acqua Aumento dell osmolarità o Riduzione del volume
Equilibrio idroelettrolitico Sodio Potassio Sodio e volume extracellulare Bilancio e distribuzione dell acqua corporea Regolazione del bilancio dell acqua Aumento dell osmolarità o Riduzione del volume
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRENTAL 600 mg compresse a rilascio modificato. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa a rilascio modificato
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRENTAL 600 mg compresse a rilascio modificato. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa a rilascio modificato
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 1. DENOMINAZIONE DEL MEDICINALE LISINOPRIL DOC Generici 5 mg compresse LISINOPRIL DOC Generici 20 mg compresse RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una
1. DENOMINAZIONE DEL MEDICINALE LISINOPRIL DOC Generici 5 mg compresse LISINOPRIL DOC Generici 20 mg compresse RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una
Foglio illustrativo: informazioni per il paziente. Calcium Sandoz 1000 mg granulato effervescente Calcio lattato gluconato e calcio carbonato
 Foglio illustrativo: informazioni per il paziente Calcium Sandoz 1000 mg granulato effervescente Calcio lattato gluconato e calcio carbonato Legga attentamente questo foglio prima di prendere questo medicinale
Foglio illustrativo: informazioni per il paziente Calcium Sandoz 1000 mg granulato effervescente Calcio lattato gluconato e calcio carbonato Legga attentamente questo foglio prima di prendere questo medicinale
Flusso x resistenza = pressione IPERTENSIONE ARTERIOSA. Meccanismi di regolazione della pressione arteriosa
 IPERTENSIONE ARTERIOSA Flusso x resistenza = pressione Gettata cardiaca x resistenze vascolari = pressione arteriosa Meccanismi di regolazione della pressione arteriosa 1) Sistema nervoso simpatico ( controllo
IPERTENSIONE ARTERIOSA Flusso x resistenza = pressione Gettata cardiaca x resistenze vascolari = pressione arteriosa Meccanismi di regolazione della pressione arteriosa 1) Sistema nervoso simpatico ( controllo
Le compresse devono essere assunte con una sufficiente quantità di liquido (ad es. un bicchiere d acqua).
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Lisinopril e Idroclorotiazide Zentiva 20 mg + 12,5 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Lisinopril e Idroclorotiazide
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Lisinopril e Idroclorotiazide Zentiva 20 mg + 12,5 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Lisinopril e Idroclorotiazide
1. DENOMINAZIONE DEL MEDICINALE
 1. DENOMINAZIONE DEL MEDICINALE Telmisartan Teva Italia 20 mg, compresse Telmisartan Teva Italia 40 mg, compresse Telmisartan Teva Italia 80 mg, compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni
1. DENOMINAZIONE DEL MEDICINALE Telmisartan Teva Italia 20 mg, compresse Telmisartan Teva Italia 40 mg, compresse Telmisartan Teva Italia 80 mg, compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni
Foglio illustrativo: informazioni per il paziente. ATENOLOLO EG 50 mg compresse ATENOLOLO EG 100 mg compresse. Medicinale equivalente
 Foglio illustrativo: informazioni per il paziente ATENOLOLO EG 50 mg compresse ATENOLOLO EG 100 mg compresse Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale
Foglio illustrativo: informazioni per il paziente ATENOLOLO EG 50 mg compresse ATENOLOLO EG 100 mg compresse Medicinale equivalente Legga attentamente questo foglio prima di prendere questo medicinale
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Atover 20 mg/20 mg compresse rivestite con film. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa rivestita con film
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Atover 20 mg/20 mg compresse rivestite con film. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa rivestita con film
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 1. DENOMINAZIONE DEL MEDICINALE PERINDOPRIL DOC Generici 4 mg compresse RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Perindopril tert-butilamina. Ciascuna compressa
1. DENOMINAZIONE DEL MEDICINALE PERINDOPRIL DOC Generici 4 mg compresse RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Perindopril tert-butilamina. Ciascuna compressa
1. L INSUFFICIENZA RENALE CRONICA (IRC)
 1. L INSUFFICIENZA RENALE CRONICA (IRC) L insufficienza renale cronica (IRC) è caratterizzata dalla perdita progressiva ed irreversibile della funzione renale in conseguenza della riduzione di tessuto
1. L INSUFFICIENZA RENALE CRONICA (IRC) L insufficienza renale cronica (IRC) è caratterizzata dalla perdita progressiva ed irreversibile della funzione renale in conseguenza della riduzione di tessuto
La BPCO e le comorbilità. Federico Sciarra
 La BPCO e le comorbilità Federico Sciarra La BPCO, essendo una malattia cronica con caratteristiche di infiammazione sistemica, facilmente coesiste con altre patologie sia acute che croniche, che influenzano
La BPCO e le comorbilità Federico Sciarra La BPCO, essendo una malattia cronica con caratteristiche di infiammazione sistemica, facilmente coesiste con altre patologie sia acute che croniche, che influenzano
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OLMESARTAN DOC Generici 10 mg compresse rivestite con film OLMESARTAN DOC Generici 20 mg compresse rivestite con film OLMESARTAN
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OLMESARTAN DOC Generici 10 mg compresse rivestite con film OLMESARTAN DOC Generici 20 mg compresse rivestite con film OLMESARTAN
Dialoghi in Farmacologia Medica
 Dialoghi in Farmacologia Medica Tempesta Nimesulide e non solo cosa sta succedendo ai FANS? Brescia 10 luglio 2007 Istituto Clinico Città di Brescia ASPIRINA Intolleranza gastrica Disturbi sul sistema
Dialoghi in Farmacologia Medica Tempesta Nimesulide e non solo cosa sta succedendo ai FANS? Brescia 10 luglio 2007 Istituto Clinico Città di Brescia ASPIRINA Intolleranza gastrica Disturbi sul sistema
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Perindopril Teva Italia 2,5 mg compresse rivestite con film Perindopril Teva Italia 5 mg compresse rivestite con film Perindopril
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Perindopril Teva Italia 2,5 mg compresse rivestite con film Perindopril Teva Italia 5 mg compresse rivestite con film Perindopril
INSUFFICIENZA RENALE CRONICA ASPETTI ASSICURATIVI
 Associazione Italiana di Medicina dell Assicurazione Vita, Malattia e Danni alla Persona Milano 6 ottobre 2015 GIORNATA DI FORMAZIONE SULL ASSUNZIONE DEL RISCHIO E LA GESTIONE DEI SINISTRI INSUFFICIENZA
Associazione Italiana di Medicina dell Assicurazione Vita, Malattia e Danni alla Persona Milano 6 ottobre 2015 GIORNATA DI FORMAZIONE SULL ASSUNZIONE DEL RISCHIO E LA GESTIONE DEI SINISTRI INSUFFICIENZA
Foglio illustrativo: informazioni per il paziente. DISSENTEN 2 mg compresse loperamide
 Foglio illustrativo: informazioni per il paziente DISSENTEN 2 mg compresse loperamide Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni per lei.
Foglio illustrativo: informazioni per il paziente DISSENTEN 2 mg compresse loperamide Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni per lei.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE MAALOX 400 mg + 400 mg compresse masticabili senza zucchero 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa contiene:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE MAALOX 400 mg + 400 mg compresse masticabili senza zucchero 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa contiene:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIOTONDOL 2,5% gel 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 g di gel contengono: Principio attivo: ketoprofene 2,5 g.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIOTONDOL 2,5% gel 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 g di gel contengono: Principio attivo: ketoprofene 2,5 g.
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE. SODIO LATTATO MONICO 1,87% soluzione per infusione Sodio lattato. Medicinale equivalente
 FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE SODIO LATTATO MONICO 1,87% soluzione per infusione Sodio lattato Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE SODIO LATTATO MONICO 1,87% soluzione per infusione Sodio lattato Medicinale equivalente Legga attentamente questo foglio prima di usare questo medicinale
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE BICALUTAMIDE DOC Generici 50 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa contiene
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE BICALUTAMIDE DOC Generici 50 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una compressa contiene
1. DENOMINAZIONE DEL MEDICINALE ATENOLOLO-CLORTALIDONE ratiopharm 50 mg/12,5 mg compresse
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ATENOLOLO-CLORTALIDONE ratiopharm 50 mg/12,5 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ATENOLOLO-CLORTALIDONE ratiopharm 50 mg/12,5 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE METFORMINA RATIOPHARM ITALIA 850 mg compresse rivestite con film METFORMINA RATIOPHARM ITALIA 1000 mg compresse rivestite con
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE METFORMINA RATIOPHARM ITALIA 850 mg compresse rivestite con film METFORMINA RATIOPHARM ITALIA 1000 mg compresse rivestite con
1.0 DENOMINAZIONE DEL MEDICINALE 2.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA 3.0 FORMA FARMACEUTICA
 1.0 DENOMINAZIONE DEL MEDICINALE METBAY 500MG 2.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA Metbay 500 mg compresse Ogni compressa contiene: Principio attivo: metformina cloridrato 500 mg, pari a 390 mg
1.0 DENOMINAZIONE DEL MEDICINALE METBAY 500MG 2.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA Metbay 500 mg compresse Ogni compressa contiene: Principio attivo: metformina cloridrato 500 mg, pari a 390 mg
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE. Enalapril Mylan Generics 5 mg compresse Enalapril Mylan Generics 20 mg compresse
 FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE Enalapril Mylan Generics 5 mg compresse Enalapril Mylan Generics 20 mg compresse Medicinale equivalente Legga attentamente questo foglio prima di prendere
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER L UTILIZZATORE Enalapril Mylan Generics 5 mg compresse Enalapril Mylan Generics 20 mg compresse Medicinale equivalente Legga attentamente questo foglio prima di prendere
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Candesartan Ranbaxy 8 mg compresse Candesartan Ranbaxy 16 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Candesartan
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Candesartan Ranbaxy 8 mg compresse Candesartan Ranbaxy 16 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Candesartan
FOGLIO ILLUSTRATIVO. GLUCOBLOC 80 mg compresse ATC: A10BB09 Gliclazide
 FOGLIO ILLUSTRATIVO ATC: A10BB09 Gliclazide COMPOSIZIONE 1 compressa contiene: Principio attivo: Gliclazide 80,0 mg. Eccipienti: lattosio, polivinilpirrolidone, glicerolo behenato, silice colloidale, magnesio
FOGLIO ILLUSTRATIVO ATC: A10BB09 Gliclazide COMPOSIZIONE 1 compressa contiene: Principio attivo: Gliclazide 80,0 mg. Eccipienti: lattosio, polivinilpirrolidone, glicerolo behenato, silice colloidale, magnesio
CEFODIE Cefonicid. Categoria farmacoterapeutica Antibiotico iniettabile.
 Foglio illustrativo CEFODIE Cefonicid Denominazione del medicinale CEFODIE 500 mg/2 ml polvere e solvente per soluzione iniettabile per uso intramuscolare. CEFODIE 1 g/2,5 ml polvere e solvente per soluzione
Foglio illustrativo CEFODIE Cefonicid Denominazione del medicinale CEFODIE 500 mg/2 ml polvere e solvente per soluzione iniettabile per uso intramuscolare. CEFODIE 1 g/2,5 ml polvere e solvente per soluzione
INTERAZIONI FARMACOLOGICHE
 INTERAZIONI FARMACOLOGICHE Università degli studi di Cagliari Facoltà di Medicina e Chirurgia Dipartimento di Neuroscienze B. B. Brodie Sezione Farmacologia Clinica Prof.ssa Maria Del Zompo INTERAZIONI
INTERAZIONI FARMACOLOGICHE Università degli studi di Cagliari Facoltà di Medicina e Chirurgia Dipartimento di Neuroscienze B. B. Brodie Sezione Farmacologia Clinica Prof.ssa Maria Del Zompo INTERAZIONI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE RAMIPRIL e IDROCLOROTIAZIDE DOC Generici 2,5/12,5 mg compresse RAMIPRIL e IDROCLOROTIAZIDE DOC Generici 5/25 mg compresse 2.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE RAMIPRIL e IDROCLOROTIAZIDE DOC Generici 2,5/12,5 mg compresse RAMIPRIL e IDROCLOROTIAZIDE DOC Generici 5/25 mg compresse 2.
Fattori di rischio per Aterosclerosi: IPERTENSIONE ARTERIOSA E DISLIPIDEMIE
 Fattori di rischio per Aterosclerosi: IPERTENSIONE ARTERIOSA E DISLIPIDEMIE Definizione L ipertensione arteriosa è definita da un aumento dei livelli pressori al di sopra dei valori che sono comuni nella
Fattori di rischio per Aterosclerosi: IPERTENSIONE ARTERIOSA E DISLIPIDEMIE Definizione L ipertensione arteriosa è definita da un aumento dei livelli pressori al di sopra dei valori che sono comuni nella
Ipertensione essenziale Angina pectoris stabile cronica Trattamento aggiuntivo dell insufficienza cardiaca cronica stabile da moderata a grave
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Carvedilolo GERMED 3,125 mg compresse Carvedilolo GERMED 6,25 mg compresse Carvedilolo GERMED 12,5 mg compresse Carvedilolo
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Carvedilolo GERMED 3,125 mg compresse Carvedilolo GERMED 6,25 mg compresse Carvedilolo GERMED 12,5 mg compresse Carvedilolo
ALLEGATOA alla Dgr n del 03 novembre 2014 pag. 1/5
 giunta regionale 9^ legislatura ALLEGATOA alla Dgr n. 2056 del 03 novembre 2014 pag. 1/5 PRESCRIZIONE DI PRODOTTI IMMUNOTERAPICI PROVVISTI DI AIC INDICATI NEL TRATTAMENTO DELLA RINITE ALLERGICA NELLA REGIONE
giunta regionale 9^ legislatura ALLEGATOA alla Dgr n. 2056 del 03 novembre 2014 pag. 1/5 PRESCRIZIONE DI PRODOTTI IMMUNOTERAPICI PROVVISTI DI AIC INDICATI NEL TRATTAMENTO DELLA RINITE ALLERGICA NELLA REGIONE
PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO
 Foglio illustrativo PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che può essere usato per curare disturbi lievi
Foglio illustrativo PRIMA DELL USO LEGGETE CON ATTENZIONE TUTTE LE INFORMAZIONI CONTENUTE NEL FOGLIO ILLUSTRATIVO Questo è un medicinale di AUTOMEDICAZIONE che può essere usato per curare disturbi lievi
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE BRONCHENOLO TOSSE 1,54 mg/ml sciroppo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di sciroppo contengono: Principio attivo:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE BRONCHENOLO TOSSE 1,54 mg/ml sciroppo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 100 ml di sciroppo contengono: Principio attivo:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE BENFER 50 mg/ml gocce orali, soluzione Soluzione orale da somministrarsi in gocce, contenente complesso di ferro polimaltosato
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE BENFER 50 mg/ml gocce orali, soluzione Soluzione orale da somministrarsi in gocce, contenente complesso di ferro polimaltosato
Modulo 4. Manifestazioni cliniche e possibili complicanze dell'asma allergico
 Modulo 4 Manifestazioni cliniche e possibili complicanze dell'asma allergico Classificazione di gravità prima dell inizio del trattamento STEP 4 Grave persistente STEP 3 Moderato persistente STEP 2 Lieve
Modulo 4 Manifestazioni cliniche e possibili complicanze dell'asma allergico Classificazione di gravità prima dell inizio del trattamento STEP 4 Grave persistente STEP 3 Moderato persistente STEP 2 Lieve
Foglio illustrativo: informazioni per il paziente. MODURETIC 5 mg + 50 mg compresse amiloride cloridrato biidrato + idroclorotiazide
 Foglio illustrativo: informazioni per il paziente MODURETIC 5 mg + 50 mg compresse amiloride cloridrato biidrato + idroclorotiazide Legga attentamente questo foglio, prima di prendere questo medicinale
Foglio illustrativo: informazioni per il paziente MODURETIC 5 mg + 50 mg compresse amiloride cloridrato biidrato + idroclorotiazide Legga attentamente questo foglio, prima di prendere questo medicinale
Università degli studi di Genova Facoltà di Medicina e Chirurgia Corso di Laurea in Medicina e Chirurgia
 Università degli studi di Genova Facoltà di Medicina e Chirurgia Corso di Laurea in Medicina e Chirurgia Relatori: Chiar.ma Prof.ssa Antonietta Piana Chiar.mo Dott. Andrea Stimamiglio Candidata: Oliveri
Università degli studi di Genova Facoltà di Medicina e Chirurgia Corso di Laurea in Medicina e Chirurgia Relatori: Chiar.ma Prof.ssa Antonietta Piana Chiar.mo Dott. Andrea Stimamiglio Candidata: Oliveri
aggiustamenti respiratori durante l esercizio fisico
 aggiustamenti respiratori durante l esercizio fisico 1 generalita durante l esercizio fisico aumento consumo O 2 e produzione CO 2 e calore e necessario portare piu O 2 ai tessuti e rimuovere piu CO 2
aggiustamenti respiratori durante l esercizio fisico 1 generalita durante l esercizio fisico aumento consumo O 2 e produzione CO 2 e calore e necessario portare piu O 2 ai tessuti e rimuovere piu CO 2
Prima dei 15 anni il dosaggio di paracetamolo dipende dal peso del bambino e deve essere compreso tra i 10 e i 15 mg/kg/dose; l intervallo tra una
 1 2 Prima dei 15 anni il dosaggio di paracetamolo dipende dal peso del bambino e deve essere compreso tra i 10 e i 15 mg/kg/dose; l intervallo tra una dose e l altra deve essere sempre almeno di 4 ore.
1 2 Prima dei 15 anni il dosaggio di paracetamolo dipende dal peso del bambino e deve essere compreso tra i 10 e i 15 mg/kg/dose; l intervallo tra una dose e l altra deve essere sempre almeno di 4 ore.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Quinapril Idroclorotiazide Aurobindo 10/12,5 mg compresse rivestite con film Quinapril Idroclorotiazide Aurobindo 20/12,5 mg
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Quinapril Idroclorotiazide Aurobindo 10/12,5 mg compresse rivestite con film Quinapril Idroclorotiazide Aurobindo 20/12,5 mg
Compressa. La compressa è di forma rotonda, di colore giallo chiaro.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1-DENOMINAZIONE DEL MEDICINALE BALFOLIC 400 microgrammi compresse 2-COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene: Principio attivo : Acido
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1-DENOMINAZIONE DEL MEDICINALE BALFOLIC 400 microgrammi compresse 2-COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene: Principio attivo : Acido
VET-KETOFEN, 100 mg/ml Soluzione iniettabile per bovini, cavalli e suini. Ketoprofene
 VET-KETOFEN, 100 mg/ml Soluzione iniettabile per bovini, cavalli e suini (Ketoprofene) Il ketoprofene è un antinfiammatorio non steroideo, dotato di una forte attività antinfiammatoria, antalgica ed antipiretica.
VET-KETOFEN, 100 mg/ml Soluzione iniettabile per bovini, cavalli e suini (Ketoprofene) Il ketoprofene è un antinfiammatorio non steroideo, dotato di una forte attività antinfiammatoria, antalgica ed antipiretica.
Acqua: nutriente essenziale
 Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Acqua: nutriente essenziale Funzioni dell acqua 1. Solvente delle reazioni metaboliche; 2. Regola il volume cellulare; 3. Regola la temperatura corporea; 4. Permette il trasporto dei nutrienti; 5. Permette
Effetti degli NSAIDs sulla pressione arteriosa
 Effetti degli NSAIDs sulla pressione arteriosa Le malattie cardiovascolari sono le cause più comuni di morte nel mondo e la valutazione dell ipertensione è uno dei parametri più importanti da valutare.
Effetti degli NSAIDs sulla pressione arteriosa Le malattie cardiovascolari sono le cause più comuni di morte nel mondo e la valutazione dell ipertensione è uno dei parametri più importanti da valutare.
SINDROME DA ANTICORPI ANTI-FOSFOLIPIDI
 SINDROME DA ANTICORPI ANTI-FOSFOLIPIDI Malattia caratterizzata da trombosi arteriose e/o venose ricorrenti, aborti ripetuti, trombocitopenia,, in associazione a titoli medio-alti di anticorpi anti-fosfolipidi
SINDROME DA ANTICORPI ANTI-FOSFOLIPIDI Malattia caratterizzata da trombosi arteriose e/o venose ricorrenti, aborti ripetuti, trombocitopenia,, in associazione a titoli medio-alti di anticorpi anti-fosfolipidi
Losartan Idroclorotiazide Alter 50 mg/12,5 mg, compresse rivestite con film (50 mg losartan potassio e 12,5 mg idroclorotiazide)
 FOGLIO ILLUSTRATIVO: INFORMAZIONI PER IL PAZIENTE Losartan Idroclorotiazide Alter 50 mg/12,5 mg, compresse rivestite con film (50 mg losartan potassio e 12,5 mg idroclorotiazide) Losartan Idroclorotiazide
FOGLIO ILLUSTRATIVO: INFORMAZIONI PER IL PAZIENTE Losartan Idroclorotiazide Alter 50 mg/12,5 mg, compresse rivestite con film (50 mg losartan potassio e 12,5 mg idroclorotiazide) Losartan Idroclorotiazide
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Acarphage 50 mg compresse Acarphage 100 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa di Acarphage
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Acarphage 50 mg compresse Acarphage 100 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa di Acarphage
INSUFFICIENZA RENALE CRONICA. Pogressivo deficit quantitativo della massa nefronica funzionante, indipendentemente dalle cause che lo hanno indotto.
 INSUFFICIENZA RENALE CRONICA Complessa condizione clinico-metabolica che consegue alla progressiva perdita dei nefroni. Pogressivo deficit quantitativo della massa nefronica funzionante, indipendentemente
INSUFFICIENZA RENALE CRONICA Complessa condizione clinico-metabolica che consegue alla progressiva perdita dei nefroni. Pogressivo deficit quantitativo della massa nefronica funzionante, indipendentemente
Foglio illustrativo: informazioni per l utilizzatore
 Foglio illustrativo: informazioni per l utilizzatore ACCUPRIN 5 mg compresse rivestite con film ACCUPRIN 10 mg compresse rivestite con film ACCUPRIN 20 mg compresse rivestite con film ACCUPRIN 40 mg compresse
Foglio illustrativo: informazioni per l utilizzatore ACCUPRIN 5 mg compresse rivestite con film ACCUPRIN 10 mg compresse rivestite con film ACCUPRIN 20 mg compresse rivestite con film ACCUPRIN 40 mg compresse
Allegato III Modifiche al riassunto delle caratteristiche del prodotto e al foglio illustrativo
 Allegato III Modifiche al riassunto delle caratteristiche del prodotto e al foglio illustrativo Nota: le modifiche di questo riassunto delle caratteristiche del prodotto e del foglio illustrativo sono
Allegato III Modifiche al riassunto delle caratteristiche del prodotto e al foglio illustrativo Nota: le modifiche di questo riassunto delle caratteristiche del prodotto e del foglio illustrativo sono
FOGLIO ILLUSTRATIVO. Sodio bicarbonato S.A.L.F. 1,4% soluzione per infusione Sodio bicarbonato S.A.L.F. 8,4% soluzione per infusione
 FOGLIO ILLUSTRATIVO Sodio bicarbonato S.A.L.F. 1,4% soluzione per infusione Sodio bicarbonato S.A.L.F. 8,4% soluzione per infusione CATEGORIA FARMACOTERAPEUTICA Elettroliti. INDICAZIONI TERAPEUTICHE Trattamento
FOGLIO ILLUSTRATIVO Sodio bicarbonato S.A.L.F. 1,4% soluzione per infusione Sodio bicarbonato S.A.L.F. 8,4% soluzione per infusione CATEGORIA FARMACOTERAPEUTICA Elettroliti. INDICAZIONI TERAPEUTICHE Trattamento

 FONTE : http://www.msd-italia.it/altre/manuale/sez01/0040059e.html MALATTIA DI WILSON Tossicosi da rame Il morbo di Wilson è una malattia progressiva e costantemente fatale del metabolismo del rame che
FONTE : http://www.msd-italia.it/altre/manuale/sez01/0040059e.html MALATTIA DI WILSON Tossicosi da rame Il morbo di Wilson è una malattia progressiva e costantemente fatale del metabolismo del rame che