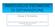
ΔT<0 materie prime decomposizione e fusione vetro
|
|
|
- Lino Marchetti
- 8 anni fa
- Visualizzazioni
Transcript
1 Fusione del vetro Produzione di vetro: per via chimica (Physical Vapour Deposition - PVD, Chemical Vapour Deposition - CVD) da soluzione (sol-gel) da polvere (sinterizzazione) da fuso ΔT>0 ΔT<0 materie prime decomposizione e fusione vetro La fusione di materie prime vetrificabili rappresenta la tecnica più utilizzata per la produzione di manufatti in vetro. Le tecniche PVD, CVD e sol-gel sono utilizzate in applicazioni specifiche dove vengono richieste elevate purezze (come nel caso delle fibre ottiche). Più raramente si fa ricorso alla sinterizzazione di polveri di vetro. 1
2 1. Chemical vapour deposition Per la produzione di fibre ottiche o rivestimenti 2. Sol-gel Per la produzione di rivestimenti o fibre Soluzione acquosa di alcossidi (Si(OR) 4 ) Sol Gel ΔT >0 Vetro Si(OR) 4 + H 2 O (OR) 3 Si-OH + ROH (OR) 3 Si-OH + Si(OR) 4 (OR) 3 Si-O-Si(OR) 3 + ROH (OR) 3 Si-OH + (OR) 3 Si-OH (OR) 3 Si-O-Si(OR) 3 + H 2 O Ceramics and Glasses, Engineered Materials Handbook, vol. 4, ASM international, USA, Tecnica PVD. Utilizzando reagenti come i cloruri di silicio, germanio e boro si possono produrre, per reazione con l ossigeno ad elevata temperatura, i corrispondenti ossidi (gassosi) che vengono a depositarsi sulla superficie da rivestire ottenendo un vetro purissimo. 2. Tecnica sol - gel. Si parte da una soluzione acquosa di alcossidi. Per reazione con acqua questi formano idrossidi (sol) e quindi una struttura interconnessa e più viscosa (gel). Per successivo riscaldamento si ottiene il vetro corrispondente. 2
3 Materie prime per processi da fuso Fattore gravimetrico = quantità necessaria per ottenere una quantità ponderale unitaria del componente Miscela vetrificabile o carica: formatori flussanti modificatori di proprietà coloranti affinanti Introduction to glass science and technology, J. E. Shelby, The Royal Society of Chemistry, 1997 Le materie prime tipicamente utilizzate nei processi di fusione non sono pure e, in genere, non sono nemmeno ossidi. Risulta utile conoscere per ciascuna di esse la resa in ossido, corrispondente al fattore gravimetrico (= quantità di materia prima per ottenere una quantità unitaria di ossido). Esempio: Albite Per avere 1 kg di Na 2 O si può partire da 8.46 kg di di albite; tuttavia l uso dell albite comporta anche la presenza di SiO 2 e Al 2. In una miscela vetrificabile (ovvero che porta alla formazione di vetro), detta anche carica, sono in genere presenti: formatori (garantiscono la formazione del reticolo vetroso), flussanti (riducono la temperatura di fusione della miscela), modificatori di proprietà, coloranti e affinanti (permettono l ottenimento di un vetro omogeneo ed esente da bolle). 3
4 Formatori - silice (SiO 2 ) - anidride borica (B 2 ) - anidride fosforica (P 2 O 5 ) formano vetro da soli quarziti, sabbie silicee (impurezze %!) feldspati, silicati (altri ossidi!!) borace (Na 2 O!), acido borico fosfati (NaO, CaO!) rottame (10-60%) - ossidi di Ge, As, Sb, Al, V - S, Se, Te, BeF 2, ZrF 4 formano vetro se miscelati con altri ossidi formatori Le materie prime apportatrici di formatori possono introdurre altri ossidi a causa delle impurezze (come nel caso delle sabbie quarzifere) o della loro composizione chimica (come per la borace, i feldspati, ecc., che introducono quantità significative di modificatori). Nella carica può essere introdotto un tenore variabile (10-60%) di rottame che garantisce la produzione di fase liquida a più bassa temperatura. Questo è utile se proveniente da rottame interno (della stessa produzione) non influenzando composizione chimica e colore. Più attenzione va fatta nell uso del rottame esterno. Nella produzione di vetro cavo la normativa impone l uso di rottame superiore al 50%! 4
5 Flussanti permettono temperature di processo < 1600 C - ossidi alcalini (Na 2 O, K 2 O) - PbO ossidi carbonati, solfati, nitrati, idrossidi feldspati, silicati (altri ossidi!!) borace (B 2!) Formazione del liquido eutettico (vetro sodico-calcico 800 C) solubilizzazione delle materie prime dimensione delle particelle aumento della viscosità aumento della temperatura acceleranti di fusione - Na 2 C - Na 2 S, NaOH, NaF (eutettici basso-fondenti) - composti idratati OH nel reticolo (riduzione di viscosità) Alcune materie prime fonte di flussanti decompongono durante il riscaldamento prima di arrivare al fusione: carbonati, solfati, idrossidi, nitrati. L ossido di piombo, pur essendo molto usato, è tossico e si trova già come ossido. Per utilizzare i diagrammi di stato nell identificazione dei punti di fusione è importante che vi sia intimo contatto tra i vari componenti e questo dipende dalla granulometria della carica. La formazione iniziale di fase liquida è legata alla presenza di eutettici bassofondenti tra le materie prime. Una volta formata della fase liquida, questa solubilizza altri ossidi aumentando la propria viscosità in quanto il liquido si sposta nel diagramma di stato. Un ulteriore aumento di temperatura permette che la solubilizzazione possa continuare, coinvolgendo tutta la massa. Nella produzione di vetro silico-sodico-calcico (il più comune), nel quale Na 2 O è in genere inferiore al 20%, l eutettico cade attorno agli 800 C. L utilizzo di solfato di sodio e fluoruro di sodio (che fondono a temperature più basse) impone attenzione in quanto i prodotti di decomposizione sono corrosivi (HF, H 2 SO 4 ). Nel caso di composti idrati si ha la presenza di gruppi OH nel reticolo che abbassa la viscosità e la resistenza chimica del vetro. 5
6 15% Na 2 O vetro silico-sodico vetro alluminosilicato vetro silico-sodico-calcico Introduction to ceramics, W. D. Kingery, H. K. Bowen and D. R. Uhlmann, J. Wiley & Sons, 1975 Nei diagrammi di stato è evidenziata la diminuzione della temperatura in presenza di ossidi modificatori. In genere si fa riferimento agli eutettici per definire la prima fase liquida ma, una volta iniziata la solubilizzazione delle altre materie prime, la temperatura di esercizio dipenderà strettamente dalla composizione globale. 6
7 Flussanti - stabilità del vetro formazione di vetro viscosità a T m The technology of glass and ceramics, An introduction, J. Hlavac, Elsevier, 1983 L aggiunta di flussanti (modificatori di reticolo) può causare una diminuzione della viscosità tale da impedire la formazione di vetro. Questo accade per esempio utilizzando in un vetro a base di silice più del 15% di Na 2 O. D altro lato la glass forming ability (= propensione a dare vetro, calcolata come incapacità di formare cristalli), dipende fortemente dal tipo di flussante. Il suo andamento è sostanzialmente uguale e opposto a quello della curva liquidus nel diagramma di stato. Sia la viscosità che la glass-forming-ability vanno considerate nella scelta della composizione. 7
8 fase liquida Schiumosità: bolle di gas materie prime macinate finemente rottame più grossolano Ceramics and Glasses, Engineered Materials Handbook, vol. 4, ASM international, USA, 2000 La figura illustra una tipica situazione di carica in fase di fusione. La gran parte del calore arriva per irraggiamento sul bordo superiore. Qui le polveri più fini iniziano a formare fase liquida spugnosa ( foamy, a causa del concomitante sviluppo di gas dalla decomposizione di alcune sostanze. La fase liquida scorre verso il basso. Nella massa solida i gas prodotti possono essere eliminati attraverso canalicoli preferenziali generati dalla presenza di materie prime più grossolane (in genere rottame costituito da vetro). 8
9 Modificatori di proprietà Modificano le proprietà di durabilità - ossidi alcalino-terrosi (CaO, MgO) - ossidi dei metalli di transizione - allumina (Al 2 ) calcare, dolomite, ossidi feldspati, silico-alluminati Coloranti - ossidi dei metalli di transizione (3d) - ossidi di terre rare (4f) - zolfo, oro e argento (colloidi) decoloranti (ZrSiO 4 ) aggiunti in quantità < 1% Il vetro silico-sodico (silice + ossido di sodio) è solubile in acqua!! L aggiunta di ossido di calcio ne migliora drasticamente la durabilità chimica. In genere, i modificatori di proprietà (soprattutto l allumina) oltre alla durabilità abbassano anche la T m e alzano la viscosità. L allumina aumenta anche la stabilità del vetro (alla cirstallizzazione). I colloidi sono particelle microscopiche (dell ordine dei nanometri) che costituiscono una seconda fase nel vetro. Lo zircone inibisce l effetto colorante di molti metalli di transizione o terre rare. 9
10 Affinanti Promuovono la rimozione delle bolle dal fuso - nitrati di Na, K - NaCl, CaF 2, NaF, Na 3 AlF 6 - solfati - ossidi di As, Sb aggiunti in quantità < 1% eliminazione di calore Rilascio di gas da composti igroscopici (B 2 H 3 B, CaO Ca(OH) 2 ) da composti idratati (NaOH, Al(OH) 3, borace (NaB 4 O 7. 10H 2 O)) - a bassa temperatura (<500 C) da carbonati, solfati e nitrati - a elevata temperatura (>500 C) da ossido-riduzioni (Fe 3+ Fe 2+ ) volatilizzazione di composti dal fuso - ossidi alcalini (Li < Cs) - ossidi di B, Pb, P formazione di bolle, miscelazione, espansione Come già visto, le materie prime possono decomporre dando luogo a fasi gassose nel fluido. La decomposizione dei composti è anche causa di assorbimento e dissipazione di calore. Alcuni ossidi (alcalini, di piombo, ecc.) posseggono una tensione di vapore elevata ed evaporano prima di arrivare a fusione. Con l uso di affinanti si creano grosse bolle che, conglobando quelle piccole, risalgono più facilmente. Quindi gli affinanti non influiscono direttamente sulle proprietà finali del materiale, ma vengono introdotti solo per eliminare le bolle dal fuso. Nota: Fe 2 2 FeO + 1/2 O 2 a circa 1000 C 10
11 Rimozione delle bolle legge di Stoke: velocità di salita della bolla all interno del fluido densità 2 2g!" r v s = 9# viscosità raggio agenti affinanti bolle più grosse 4 KN + 2As 2 2 K 2 O + 2 As 2 O NO + O 2 As 2 O 5 As 2 + O 2 Na 2 SO 4 + nsio 2 Na 2 O-nSiO 2 + S 2 S 2 SO 2 + O 2 Problema: contrazione delle bolle più piccole (p = 2 γ /r) Secondo la legge di Stokes, la velocità di salita di una bolla in un liquido aumenta con il raggio. In genere non si riesce ad agire sulla densità mentre più facile è lavorare sulla viscosità. Se la viscosità è troppo alta restano delle bolle nel fuso. Con gli affinanti si generano bolle grosse che inglobano quelle piccole e risalendo rimescolano (affinazione) anche il liquido. Sulla base delle reazioni di decomposizione riportate viene prodotto molto gas in un solo punto e questo produce bolle più grosse. L ossido di arsenico è molto efficace (più del solfato di sodio) ma non viene più usato perché tossico. Un problema è quello della contrazione delle bolle molto piccole a causa della loro pressione interna che promuove la diffusione e solubilizzazione del gas nel vetro liquido (legge di Laplace). Tale gas può nuovamente formare bolle in fasi successive del processo. 11
12 Tipi di vetro commerciale Introduction to glass science and technology, J. E. Shelby, The Royal Society of Chemistry, 1997 Le frecce nere indicano i formatori, quelle blu i flussanti e quelle verdi i modificatori di proprietà. Formatori: SiO 2 sostanza principe ; B 2 in alcuni casi Flussanti: Na 2 O, K 2 O derivano da ossidi alcalini. Modificatori:Al 2 sempre presente, solitamente 1-5% ; CaO solitamente~10% assieme all MgO se provengono dalla stessa materia prima. Note: 1) l ossido di ferro deriva dalle impurezze (quasi sempre presenti) della sabbia silicea; 2) l ossido di piombo garantisce elevato indice di rifrazione; 3) se presenti, CdO e CuO sono usati per ottenere colorazioni rosse. 4) S proviene dalla decomposizione dei solfati (non tutto evolve in fase gassosa). 5) F 2 deriva dalla fluorite che viene impiegata come affinante. 12
13 Vetri più comuni Glass science, 2nd edition, R.H. Doremus, J. Wiley and sons, 1994 Note: 1) vetro sodico-calcico 2) vetro boro-silicato 3) vetro al piombo 4) vetro piombo-alcalino 5) vetro allumino-silicato 13
14 Calcolo della carica Esempio 1 1. Composizione del vetro (molare): 20 Na 2 O - 5 Al 2-75 SiO 2 2. Peso molecolare dei componenti: Na 2 O = 61.98, Al 2 = , SiO 2 = Peso molecolare del vetro: (0.2 x 61.98) + (0.05 x ) + (0.75 x 60.09) = g/mole 4. Frazione in peso dei componenti: Na 2 O = (0.20 x ) / = = 19.8% Al 2 = (0.05 x ) / = 0/082 = 8.2% SiO 2 = (0.75 x 60.09) / = 0.72 = 72% se la composizione in peso è già nota, iniziare da qui Carica materia prima che viene impiegata per creare un vetro a composizione nota. Fattore gravimetrico quantità di materia prima necessaria per dare l unità dell ossido di riferimento. 14
15 5. Scelta delle materie prime a. feldspato sodico ( albite) - fg Na2O = 8.46, fg SiO2 = 1.45, fg Al2O3 = 5.14 su 100 g: Al 2 : 8.2 g x 5.14 = g di albite Na 2 O: 19.8 g x 8.46 = g di albite*** SiO 2 : 72 g x 1.45 = g di albite*** g di albite: 8.2 g di Al 2 + (42.15/8.46) g di Na 2 O + (42.15/1.45) g di SiO g di Al g di Na 2 O g di SiO 2 b. carbonato di sodio - fg Na2O = 1.71 Na 2 O: ( ) g x 1.71 = g di carbonato di sodio c. sabbia silicea - fg SiO2 = 1 SiO 2 : ( ) g x 1 = g di sabbia silicea Nota: ***Dovrei usarne troppa. Dato che il feldspato non si decompone e quindi non produce gas utile all affinazione, è opportuno usare NaC (che evolve CO 2 ) quale fonte di NaO. 15
16 Esempio 2 1. Composizione in peso dei componenti: vetro al piombo per bicchieri SiO 2 = 66%; Al 2 = 1%; CaO = 1%; Na 2 O = 6%; K 2 O = 10%; PbO = 15%; B 2 = 1% 2. Scelta delle materie prime a. feldspato potassico (microclino) - fg K2O = 5.91, fg SiO2 = 1.54, fg Al2O3 = 5.46 su 100 g: Al 2 : 1 g x 5.46 = 5.46 g di microclino 1 g di Al 2 + (5.46/5.91) g di K 2 O + (5.46/1.54) g di SiO 2 = 1 g di Al g di K 2 O g di SiO 2 b. borace - fg B2O3 = 2.74, fg Na2O = 6.14 su 100 g: B 2 : 1 g x 2.74 = 2.74 g di borace Na 2 O: 6 g x 6.14 = g di borace 2.74 g di borace: 1 g di B 2 + (2.74/6.14) g di Na 2 O = 1 g di B g di Na 2 O 16
17 c. litargirio - fg PbO = 1 su 100 g: PbO: 15 g x 1 = 15 g di litargirio d. potassa (K 2 C ) - fg K2O = 1.47 su 100 g: K 2 O: (10-0.9) g x 1.47 = g di potassa e. soda (Na 2 C ) - fg Na2O = 1.71 su 100 g: Na 2 O: (6-0.4) g x 1.71 = 9.58 g di soda f. calcare (CaC ) - fg CaO = 1.79 su 100 g: CaO: 1 g x 1.79 = 1.79 g di calcare g. sabbia silicea - fg SiO2 = 1 su 100 g: SiO 2 : (66-3.5) g x 1 = 62.5 g di sabbia silicea Carica: 5.46 g di microclino g di borace + 15 g di litargirio g di potassa g di soda g di calcare g di sabbia silicea Nota: La carica si calcola solo su formatori, flussanti e modificatori. Successivamente si addizionano affinanti e coloranti, in quantità molto più piccole. 17
La fusione di materie prime vetrificabili rappresenta la tecnica più utilizzata per la produzione di manufatti in vetro.
 La fusione di materie prime vetrificabili rappresenta la tecnica più utilizzata per la produzione di manufatti in vetro. Le tecniche PVD, CVD e sol-gel sono utilizzate in applicazioni specifiche dove vengono
La fusione di materie prime vetrificabili rappresenta la tecnica più utilizzata per la produzione di manufatti in vetro. Le tecniche PVD, CVD e sol-gel sono utilizzate in applicazioni specifiche dove vengono
La fusione di materie prime vetrificabili rappresenta la tecnica più utilizzata per la produzione di manufatti in vetro.
 La fusione di materie prime vetrificabili rappresenta la tecnica più utilizzata per la produzione di manufatti in vetro. Le tecniche PVD, CVD e sol-gel sono utilizzate in applicazioni specifiche dove vengono
La fusione di materie prime vetrificabili rappresenta la tecnica più utilizzata per la produzione di manufatti in vetro. Le tecniche PVD, CVD e sol-gel sono utilizzate in applicazioni specifiche dove vengono
PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI
 PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI DEFINIZIONE DI VETRO LO STATO VETROSO È QUELLO DI UN SOLIDO BLOCCATO NELLA STRUTTURA DISORDINATA DI UN LIQUIDO (FASE AMORFA) SOLIDO:ORDINE A LUNGO RAGGIO
PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI DEFINIZIONE DI VETRO LO STATO VETROSO È QUELLO DI UN SOLIDO BLOCCATO NELLA STRUTTURA DISORDINATA DI UN LIQUIDO (FASE AMORFA) SOLIDO:ORDINE A LUNGO RAGGIO
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI
 PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI Cos è un vetro? COS È UN VETRO? SOLIDO? LIQUIDO? ALTRO? GLI STATI DELLA MATERIA Volume specifico Liquido Vetro Tg CAMBIAMENTO DI VOLUME Tf Tf =TEMPERATURA
PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI Cos è un vetro? COS È UN VETRO? SOLIDO? LIQUIDO? ALTRO? GLI STATI DELLA MATERIA Volume specifico Liquido Vetro Tg CAMBIAMENTO DI VOLUME Tf Tf =TEMPERATURA
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
GEOLOGIA (studio della litosfera) Essa si divide in MINERALOGIA (studio dei minerali) e PETROGRAFIA ( studio delle rocce)
 GEOLOGIA (studio della litosfera) Essa si divide in MINERALOGIA (studio dei minerali) e PETROGRAFIA ( studio delle rocce) I MINERALI I minerali sono sostanze solide omogenee, inorganiche, esprimibili mediante
GEOLOGIA (studio della litosfera) Essa si divide in MINERALOGIA (studio dei minerali) e PETROGRAFIA ( studio delle rocce) I MINERALI I minerali sono sostanze solide omogenee, inorganiche, esprimibili mediante
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Classificazione della materia: Sostanze pure e miscugli
 Classificazione della materia: Sostanze pure e miscugli la composizione e quindi le proprietà intensive sono le stesse in ogni parte del sistema La composizione e le proprietà intensive variano da una
Classificazione della materia: Sostanze pure e miscugli la composizione e quindi le proprietà intensive sono le stesse in ogni parte del sistema La composizione e le proprietà intensive variano da una
Università di Pisa Facoltà di Ingegneria. Leghe non ferrose. Chimica Applicata. Prof. Cristiano Nicolella
 Università di Pisa Facoltà di Ingegneria Leghe non ferrose Chimica Applicata Prof. Cristiano Nicolella Leghe non ferrose Minerali di alluminio L alluminio è uno degli elementi più abbondanti sulla crosta
Università di Pisa Facoltà di Ingegneria Leghe non ferrose Chimica Applicata Prof. Cristiano Nicolella Leghe non ferrose Minerali di alluminio L alluminio è uno degli elementi più abbondanti sulla crosta
Le argille sono costituite da silice + allumina + acqua, ovviamente solo in termini di sostanze chimiche e non di struttura. Non sempre (o, meglio,
 Le argille sono costituite da silice + allumina + acqua, ovviamente solo in termini di sostanze chimiche e non di struttura. Non sempre (o, meglio, quasi mai) si può parlare di H 2 O molecolare; piuttosto
Le argille sono costituite da silice + allumina + acqua, ovviamente solo in termini di sostanze chimiche e non di struttura. Non sempre (o, meglio, quasi mai) si può parlare di H 2 O molecolare; piuttosto
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
DALLA MOLE AI CALCOLI STECHIOMETRICI
 Conversione Massa Moli DALLA MOLE AI CALCOLI STECHIOMETRICI - ESERCIZI GUIDATI - LEGENDA DEI SIMBOLI: M = Peso molecolare m(g) = quantità in g di elemento o di composto n = numero di moli Ricorda che l'unità
Conversione Massa Moli DALLA MOLE AI CALCOLI STECHIOMETRICI - ESERCIZI GUIDATI - LEGENDA DEI SIMBOLI: M = Peso molecolare m(g) = quantità in g di elemento o di composto n = numero di moli Ricorda che l'unità
LEZIONE 1. Materia: Proprietà e Misura
 LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
MODULO 3 - LA MATERIA: COMPOSIZIONE E TRASFORMAZIONI
 MODULO 3 - LA MATERIA: COMPOSIZIONE E TRASFORMAZIONI La materia è tutto ciò che ha una massa, energia e occupa spazio, cioè ha un volume; essa si classifica in base alla sua composizione chimica ed in
MODULO 3 - LA MATERIA: COMPOSIZIONE E TRASFORMAZIONI La materia è tutto ciò che ha una massa, energia e occupa spazio, cioè ha un volume; essa si classifica in base alla sua composizione chimica ed in
Scritto Chimica generale 13.02.2012 Gruppo A
 Scritto Chimica generale 13.02.2012 Gruppo A 1. Calcolare il ph di una soluzione ottenuta mescolando 12.0 ml di una soluzione 1.00 M di nitrato di calcio, 150 ml di una soluzione 1.00 M di acido cloridrico,
Scritto Chimica generale 13.02.2012 Gruppo A 1. Calcolare il ph di una soluzione ottenuta mescolando 12.0 ml di una soluzione 1.00 M di nitrato di calcio, 150 ml di una soluzione 1.00 M di acido cloridrico,
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Tecnologia Meccanica prof. Luigi Carrino. Diagrammi di stato
 Diagrammi di stato Introduzione Fase: regione in un materiale che è diversa per struttura e funzione da altre regioni. Diagramma di stato: rappresenta le fasi presenti nel metallo in diverse condizioni
Diagrammi di stato Introduzione Fase: regione in un materiale che è diversa per struttura e funzione da altre regioni. Diagramma di stato: rappresenta le fasi presenti nel metallo in diverse condizioni
La percentuale massa/volume (%m/v) indica la quantità di soluto espressa in grammi presente in 100 ml di soluzione.
 La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
I MINERALI DELLA CROSTA TERRESTRE
 I MINERALI DELLA CROSTA TERRESTRE Sono solidi cristallini, di origine inorganica, caratterizzati da una precisa formula chimica. Una sostanza è un minerale se: si presenta come solido cristallino, cioè
I MINERALI DELLA CROSTA TERRESTRE Sono solidi cristallini, di origine inorganica, caratterizzati da una precisa formula chimica. Una sostanza è un minerale se: si presenta come solido cristallino, cioè
Minerali e rocce. La Terra solida è formata da minerali.
 1.4 Minerali e rocce La Terra solida è formata da minerali. Un minerale è un corpo solido cristallino naturale omogeneo, costituito da un elemento o da un composto chimico inorganico e caratterizzato da
1.4 Minerali e rocce La Terra solida è formata da minerali. Un minerale è un corpo solido cristallino naturale omogeneo, costituito da un elemento o da un composto chimico inorganico e caratterizzato da
SCALA DEI PESI ATOMICI RELATIVI E MEDI
 SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
I GAS GAS IDEALI. PV=nRT. Pressione Volume numero di moli Temperatura Costante dei gas. P V n T R. n, T= cost Legge di Boyle
 I GAS Pressione Volume numero di moli Temperatura Costante dei gas GAS IDEALI P V n T R n = 1 Isoterma: pv = cost Isobara: V/T = cost. Isocora: P/t = cost. n, T= cost Legge di Boyle n, P = cost Legge di
I GAS Pressione Volume numero di moli Temperatura Costante dei gas GAS IDEALI P V n T R n = 1 Isoterma: pv = cost Isobara: V/T = cost. Isocora: P/t = cost. n, T= cost Legge di Boyle n, P = cost Legge di
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
'RPDQGHFRQFHWWXDOL Alcuni interrogativi su fenomeni fisici e chimici
 ,OPDWHULDOHGLGDWWLFRFKHVHJXHqVWDWRVFHOWRWUDGRWWRHDGDWWDWRGDO*UXSSRGLFKLPLFD GHOO,7,60DMRUDQDGL*UXJOLDVFR7RULQR0DUFR)DODVFD$QJHOR&LPHQLV3DROD&RVFLD /RUHGDQD$QJHOHUL$QWRQHOOD0DUWLQL'DULR*D]]ROD*UD]LD5L]]R*LXVL'L'LR
,OPDWHULDOHGLGDWWLFRFKHVHJXHqVWDWRVFHOWRWUDGRWWRHDGDWWDWRGDO*UXSSRGLFKLPLFD GHOO,7,60DMRUDQDGL*UXJOLDVFR7RULQR0DUFR)DODVFD$QJHOR&LPHQLV3DROD&RVFLD /RUHGDQD$QJHOHUL$QWRQHOOD0DUWLQL'DULR*D]]ROD*UD]LD5L]]R*LXVL'L'LR
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola.
 Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
Capitolo 7. Le soluzioni
 Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He. 2) L'acqua è:
 1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
I processi di tempra sono condotti sul manufatto finito per generare sforzi residui di compressione in superficie. Vengono sfruttate allo scopo
 I processi di tempra sono condotti sul manufatto finito per generare sforzi residui di compressione in superficie. Vengono sfruttate allo scopo diverse metodologie. 1 La tempra termica (o fisica) si basa
I processi di tempra sono condotti sul manufatto finito per generare sforzi residui di compressione in superficie. Vengono sfruttate allo scopo diverse metodologie. 1 La tempra termica (o fisica) si basa
Esercizi di Chimica (2 a prova in itinere)
 Esercizi di Chimica (2 a prova in itinere) 3) Calcolare la normalità (N) di una soluzione ottenuta sciogliendo 3,5 g di H 3 PO 4 in 900 ml di acqua [0,119 N] 4) Quanti grammi di soluto sono contenuti in
Esercizi di Chimica (2 a prova in itinere) 3) Calcolare la normalità (N) di una soluzione ottenuta sciogliendo 3,5 g di H 3 PO 4 in 900 ml di acqua [0,119 N] 4) Quanti grammi di soluto sono contenuti in
Proprietà del vetro. Composizione Processo produttivo Successivi trattamenti
 Proprietà del vetro Densità Proprietà termiche Conducibilità elettrica Resistenza chimica Proprietà ottiche Proprietà meccaniche Composizione Processo produttivo Successivi trattamenti Le proprietà di
Proprietà del vetro Densità Proprietà termiche Conducibilità elettrica Resistenza chimica Proprietà ottiche Proprietà meccaniche Composizione Processo produttivo Successivi trattamenti Le proprietà di
I materiali di rivestimento. di Maximillian Vegetti, Federico Maffioli e Davide Biganzoli
 I materiali di rivestimento di Maximillian Vegetti, Federico Maffioli e Davide Biganzoli Porosità della ceramica -Le ceramiche hanno la caratteristica di essere porose, un fattore che non le ha rese utilizzabili
I materiali di rivestimento di Maximillian Vegetti, Federico Maffioli e Davide Biganzoli Porosità della ceramica -Le ceramiche hanno la caratteristica di essere porose, un fattore che non le ha rese utilizzabili
METALLI FERROSI GHISA ACCIAIO
 METALLI FERROSI I metalli ferrosi sono i metalli e le leghe metalliche che contengono ferro. Le leghe ferrose più importanti sono l acciaio e la ghisa. ACCIAIO: lega metallica costituita da ferro e carbonio,
METALLI FERROSI I metalli ferrosi sono i metalli e le leghe metalliche che contengono ferro. Le leghe ferrose più importanti sono l acciaio e la ghisa. ACCIAIO: lega metallica costituita da ferro e carbonio,
CAFFE` Il segreto è nel fisico
 CAFFE` Il segreto è nel fisico Preparata la macchina del caffè, e messala sul fuoco: L acqua raggiunge rapidamente la temperatura di ebollizione (100 C). Lo spazio del serbatoio lasciato libero viene occupato
CAFFE` Il segreto è nel fisico Preparata la macchina del caffè, e messala sul fuoco: L acqua raggiunge rapidamente la temperatura di ebollizione (100 C). Lo spazio del serbatoio lasciato libero viene occupato
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
LA MATERIA Suggerimenti didattici e schede
 LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
IMPIEGO DEL FELDSPATO GS60 ADDIZIONATO CON VETRO IN UNA PRODUZIONE INDUSTRIALE DI GRES PORCELLANATO
 IMPIEGO DEL FELDSPATO GS60 ADDIZIONATO CON VETRO IN UNA PRODUZIONE INDUSTRIALE DI GRES PORCELLANATO Relatori: C. Carbonchi, P. Danasino, R. Riveriti Una giornata su Le materie prime di qualità per piastrelle
IMPIEGO DEL FELDSPATO GS60 ADDIZIONATO CON VETRO IN UNA PRODUZIONE INDUSTRIALE DI GRES PORCELLANATO Relatori: C. Carbonchi, P. Danasino, R. Riveriti Una giornata su Le materie prime di qualità per piastrelle
LE SOLUZIONI 1.molarità
 LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato gassoso
 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
Chimica. Ingegneria Meccanica, Elettrica e Civile Simulazione d'esame
 Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI
 DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI - si sfrutta una proprietà chimico-fisica o fisica che varia nel corso della titolazione - tale proprietà è in genere proporzionale
DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI - si sfrutta una proprietà chimico-fisica o fisica che varia nel corso della titolazione - tale proprietà è in genere proporzionale
Applicazioni della Termochimica: Combustioni
 CHIMICA APPLICATA Applicazioni della Termochimica: Combustioni Combustioni Il comburente più comune è l ossigeno dell aria Aria secca:! 78% N 2 21% O 2 1% gas rari Combustioni Parametri importanti:! 1.Potere
CHIMICA APPLICATA Applicazioni della Termochimica: Combustioni Combustioni Il comburente più comune è l ossigeno dell aria Aria secca:! 78% N 2 21% O 2 1% gas rari Combustioni Parametri importanti:! 1.Potere
INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca
 INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca La ricerca come strumento per lo sviluppo aziendale: sinergia tra università e industria
INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca La ricerca come strumento per lo sviluppo aziendale: sinergia tra università e industria
= 9,3 10-5 M = 1,05 10-5 M
 - Calcolare la solubilità molare di CaCO 3 ( = 8,7 10-9 ). La reazione di solubilizzazione di CaCO 3 (carbonato di calcio) è: CaCO 3 (s) Ca 2+ + CO 3 L espressione della sarà quindi: = [Ca 2+ ] [CO 3 ]
- Calcolare la solubilità molare di CaCO 3 ( = 8,7 10-9 ). La reazione di solubilizzazione di CaCO 3 (carbonato di calcio) è: CaCO 3 (s) Ca 2+ + CO 3 L espressione della sarà quindi: = [Ca 2+ ] [CO 3 ]
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti.
 Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Il bilanciamento delle reazioni chimiche
 1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
Equilibri di precipitazione
 Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Temperatura e Calore
 Temperatura e Calore 1 Temperatura e Calore Stati di Aggregazione Temperatura Scale Termometriche Dilatazione Termica Il Calore L Equilibrio Termico La Propagazione del Calore I Passaggi di Stato 2 Gli
Temperatura e Calore 1 Temperatura e Calore Stati di Aggregazione Temperatura Scale Termometriche Dilatazione Termica Il Calore L Equilibrio Termico La Propagazione del Calore I Passaggi di Stato 2 Gli
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
CALORE. Compie lavoro. Il calore è energia. Temperatura e calore. L energia è la capacità di un corpo di compiere un lavoro
 Cos è il calore? Per rispondere si osservino le seguenti immagini Temperatura e calore Il calore del termosifone fa girare una girandola Il calore del termosifone fa scoppiare un palloncino Il calore del
Cos è il calore? Per rispondere si osservino le seguenti immagini Temperatura e calore Il calore del termosifone fa girare una girandola Il calore del termosifone fa scoppiare un palloncino Il calore del
Osteointegrazione. Definizione della American Academy of Implants Dentistry:
 Osteointegrazione 1 Osteointegrazione Definizione della American Academy of Implants Dentistry: "Contatto che interviene senza interposizione di tessuto non osseo tra osso normale rimodellato e un impianto
Osteointegrazione 1 Osteointegrazione Definizione della American Academy of Implants Dentistry: "Contatto che interviene senza interposizione di tessuto non osseo tra osso normale rimodellato e un impianto
Sistema di filtrazione abbinato ad una pompa del vuoto. Sistema semplice per la filtrazione
 Filtrazione: definizioni La FILTRAZIONE è un comune metodo di separazione basato sul seguente principio: le particelle più piccole di una determinata dimensione passano attraverso i pori di un filtro,
Filtrazione: definizioni La FILTRAZIONE è un comune metodo di separazione basato sul seguente principio: le particelle più piccole di una determinata dimensione passano attraverso i pori di un filtro,
Quando un composto ionico viene immesso in acqua si dissocia formando uno ione negativo ed uno positivo.
 I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
Gas perfetti e sue variabili
 Gas perfetti e sue variabili Un gas è detto perfetto quando: 1. è lontano dal punto di condensazione, e quindi è molto rarefatto 2. su di esso non agiscono forze esterne 3. gli urti tra le molecole del
Gas perfetti e sue variabili Un gas è detto perfetto quando: 1. è lontano dal punto di condensazione, e quindi è molto rarefatto 2. su di esso non agiscono forze esterne 3. gli urti tra le molecole del
V= R*I. LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro.
 LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
SICUREZZA DELLE VIE DI FUGA NEI PICCOLI LUOGHI DI LAVORO
 SICUREZZA DELLE VIE DI FUGA NEI PICCOLI LUOGHI DI LAVORO Le vie di esodo costituiscono il primo problema da affrontare quando si progetta la sicurezza di un edificio. Infatti, la sicurezza delle persone
SICUREZZA DELLE VIE DI FUGA NEI PICCOLI LUOGHI DI LAVORO Le vie di esodo costituiscono il primo problema da affrontare quando si progetta la sicurezza di un edificio. Infatti, la sicurezza delle persone
SISTEMA BINARIO DI DUE LIQUIDI VOLATILI TOTALMENTE MISCIBILI che seguono Raoult
 SISTEM INRIO DI DUE IQUIDI OTII MENTE MISCIII che seguono Raoult Consideriamo due liquidi e totalmente miscibili di composizione χ e χ presenti in un contenitore ad una certa temperatura T=T 1. o strato
SISTEM INRIO DI DUE IQUIDI OTII MENTE MISCIII che seguono Raoult Consideriamo due liquidi e totalmente miscibili di composizione χ e χ presenti in un contenitore ad una certa temperatura T=T 1. o strato
Esperienza A: idrofilicità e idrofobicità
 Esperienza A: idrofilicità e idrofobicità Obiettivo: Fare osservare che alcune sostanze, mescolate all'acqua, danno luogo a soluzioni omogenee mentre altre danno miscele eterogenee. Dalla descrizione delle
Esperienza A: idrofilicità e idrofobicità Obiettivo: Fare osservare che alcune sostanze, mescolate all'acqua, danno luogo a soluzioni omogenee mentre altre danno miscele eterogenee. Dalla descrizione delle
La marcature CE della Calce da Costruzione
 La marcature CE della Calce da Costruzione Andrea Rattazzi In Italia la marcatura CE per la calce da costruzione di calce è obbligatoria. Questo articolo presenta una panoramica della norma UN EN 459-1:2002
La marcature CE della Calce da Costruzione Andrea Rattazzi In Italia la marcatura CE per la calce da costruzione di calce è obbligatoria. Questo articolo presenta una panoramica della norma UN EN 459-1:2002
3ULQFLSLGHOODFRPEXVWLRQH,FRPEXVWLELOL
 ,FRPEXVWLELOL I FRPEXVWLELOL sono sostanze capaci di bruciare, cioè in grado di dar luogo alla reazione chimica sopra descritta. Possono essere:,frpexvwlelol Solidi: ad esempio legno, carbone, carta, tessuto,
,FRPEXVWLELOL I FRPEXVWLELOL sono sostanze capaci di bruciare, cioè in grado di dar luogo alla reazione chimica sopra descritta. Possono essere:,frpexvwlelol Solidi: ad esempio legno, carbone, carta, tessuto,
CAPITOLO 11 Materiali ceramici ESERCIZI CON SOLUZIONE SVOLTA. Problemi di conoscenza e comprensione
 CAPITOLO 11 Materiali ceramici ESERCIZI CON SOLUZIONE SVOLTA Problemi di conoscenza e comprensione 11.10 (a) Le strutture a isola dei silicati si formano quando ioni positivi, come Mg 2+ e Fe 2+, si legano
CAPITOLO 11 Materiali ceramici ESERCIZI CON SOLUZIONE SVOLTA Problemi di conoscenza e comprensione 11.10 (a) Le strutture a isola dei silicati si formano quando ioni positivi, come Mg 2+ e Fe 2+, si legano
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Lezione 15 metodi di analisi termici legati alla separazione di fase. Separazione di fase. Fasi della materia: solido, liquido, gas
 Lezione 15 metodi di analisi termici legati alla separazione di fase Separazione di fase Fasi della materia: solido, liquido, gas SOLIDO Scioglimento solidificazione LIQUIDO evaporazione condensazione
Lezione 15 metodi di analisi termici legati alla separazione di fase Separazione di fase Fasi della materia: solido, liquido, gas SOLIDO Scioglimento solidificazione LIQUIDO evaporazione condensazione
LEAD-COLOURED LEAD-FREE
 PROGETTO LIFE09 ENV/IT/000427 Replacement of toxic lead compounds by new non-toxic substitutes as brilliant aid agent in polychromatic glazes LEAD-COLOURED LEAD-FREE FINAL REPORT Coordinating beneficiary:
PROGETTO LIFE09 ENV/IT/000427 Replacement of toxic lead compounds by new non-toxic substitutes as brilliant aid agent in polychromatic glazes LEAD-COLOURED LEAD-FREE FINAL REPORT Coordinating beneficiary:
Sostanze estinguenti in relazione al tipo di incendio
 Sostanze estinguenti in relazione al tipo di incendio L estinzione dell incendio si ottiene per raffreddamento, sottrazione del combustibile soffocamento. Tali azioni possono essere ottenute singolarmente
Sostanze estinguenti in relazione al tipo di incendio L estinzione dell incendio si ottiene per raffreddamento, sottrazione del combustibile soffocamento. Tali azioni possono essere ottenute singolarmente
STATO LIQUIDO. Si definisce tensione superficiale (γ) il lavoro che bisogna fare per aumentare di 1 cm 2 la superficie del liquido.
 STTO LIQUIDO Una sostanza liquida è formata da particelle in continuo movimento casuale, come in un gas, tuttavia le particelle restano a contatto le une alle altre e risentono sempre delle notevoli forze
STTO LIQUIDO Una sostanza liquida è formata da particelle in continuo movimento casuale, come in un gas, tuttavia le particelle restano a contatto le une alle altre e risentono sempre delle notevoli forze
modulo: CHIMICA DEI POLIMERI
 CORSO PON Esperto nella progettazione, caratterizzazione e lavorazione di termoplastici modulo: CHIMICA DEI POLIMERI Vincenzo Venditto influenza delle caratteristiche strutturali, microstrutturali e morfologiche
CORSO PON Esperto nella progettazione, caratterizzazione e lavorazione di termoplastici modulo: CHIMICA DEI POLIMERI Vincenzo Venditto influenza delle caratteristiche strutturali, microstrutturali e morfologiche
DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto:
 Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Correnti e circuiti a corrente continua. La corrente elettrica
 Correnti e circuiti a corrente continua La corrente elettrica Corrente elettrica: carica che fluisce attraverso la sezione di un conduttore in una unità di tempo Q t Q lim t 0 t ntensità di corrente media
Correnti e circuiti a corrente continua La corrente elettrica Corrente elettrica: carica che fluisce attraverso la sezione di un conduttore in una unità di tempo Q t Q lim t 0 t ntensità di corrente media
È importante quindi conoscere le proprietà chimiche dell acqua. Le reazioni acido base sono particolari esempi di equilibrio chimico in fase acquosa
 Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Liquidi, Solidi e Forze Intermolecolari
 Liquidi, Solidi e Forze Intermolecolari Distanze tra molecole Stati Fisici (Fase) Comportamento atipico La maggiore differenza tra liquidi e solidi consiste nella libertà di movimento delle loro molecole
Liquidi, Solidi e Forze Intermolecolari Distanze tra molecole Stati Fisici (Fase) Comportamento atipico La maggiore differenza tra liquidi e solidi consiste nella libertà di movimento delle loro molecole
Breve compendio delle ceramiche esistenti e delle loro qualità.
 Breve compendio delle ceramiche esistenti e delle loro qualità. Materiale sintetico parzialmente o totalmente cristallino solido, inorganico, non metallico, formato a freddo e consolidato per trattamento
Breve compendio delle ceramiche esistenti e delle loro qualità. Materiale sintetico parzialmente o totalmente cristallino solido, inorganico, non metallico, formato a freddo e consolidato per trattamento
Acqua azzurra, acqua chiara. Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao
 Acqua azzurra, acqua chiara Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao Proprietà fisiche Ecosistemi acquatici Origine della vita Ciclo dell acqua Acqua Scoperte Sensazioni Leggi La
Acqua azzurra, acqua chiara Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao Proprietà fisiche Ecosistemi acquatici Origine della vita Ciclo dell acqua Acqua Scoperte Sensazioni Leggi La
La corrente elettrica La resistenza elettrica La seconda legge di Ohm Resistività e temperatura L effetto termico della corrente
 Unità G16 - La corrente elettrica continua La corrente elettrica La resistenza elettrica La seconda legge di Ohm Resistività e temperatura L effetto termico della corrente 1 Lezione 1 - La corrente elettrica
Unità G16 - La corrente elettrica continua La corrente elettrica La resistenza elettrica La seconda legge di Ohm Resistività e temperatura L effetto termico della corrente 1 Lezione 1 - La corrente elettrica
Termologia. Introduzione Scale Termometriche Espansione termica Capacità termica e calori specifici Cambiamenti di fase e calori latenti
 Termologia Introduzione Scale Termometriche Espansione termica Capacità termica e calori specifici Cambiamenti di fase e calori latenti Trasmissione del calore Legge di Wien Legge di Stefan-Boltzmann Gas
Termologia Introduzione Scale Termometriche Espansione termica Capacità termica e calori specifici Cambiamenti di fase e calori latenti Trasmissione del calore Legge di Wien Legge di Stefan-Boltzmann Gas
CO 2 aq l anidride carbonica disciolta, reagendo con l'acqua, forma acido carbonico secondo la reazione:
 DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
Che cosa sono? Che forma hanno?
 Che cosa sono? Parti solide della crosta terrestre formate da Atomi - Ioni Molecole che sono disposti secondo un ordine Che forma hanno? Possono presentarsi in masse informi o sotto l aspetto di Poliedri
Che cosa sono? Parti solide della crosta terrestre formate da Atomi - Ioni Molecole che sono disposti secondo un ordine Che forma hanno? Possono presentarsi in masse informi o sotto l aspetto di Poliedri
Definiamo Entalpia la funzione: DH = DU + PDV. Variando lo stato del sistema possiamo misurare la variazione di entalpia: DU = Q - PDV.
 Problemi Una mole di molecole di gas ideale a 292 K e 3 atm si espandono da 8 a 20 L e a una pressione finale di 1,20 atm seguendo 2 percorsi differenti. Il percorso A è un espansione isotermica e reversibile;
Problemi Una mole di molecole di gas ideale a 292 K e 3 atm si espandono da 8 a 20 L e a una pressione finale di 1,20 atm seguendo 2 percorsi differenti. Il percorso A è un espansione isotermica e reversibile;
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
STOCCAGGIO DI IDROGENO NEI SOLIDI ATTIVITA DI RICERCA PRESSO IL POLITECNICO DI TORINO
 STOCCAGGIO DI IDROGENO NEI SOLIDI ATTIVITA DI RICERCA PRESSO IL POLITECNICO DI TORINO A. TAGLIAFERROT LAQ In.Te.S.E. Politecnico di Torino SOMMARIO Il problema Le possibili tecnologie Il contributo del
STOCCAGGIO DI IDROGENO NEI SOLIDI ATTIVITA DI RICERCA PRESSO IL POLITECNICO DI TORINO A. TAGLIAFERROT LAQ In.Te.S.E. Politecnico di Torino SOMMARIO Il problema Le possibili tecnologie Il contributo del
Materiali per alte temperature
 Materiali per alte temperature Prof. Barbara Rivolta Dipartimento di Meccanica Politecnico di Milano 14 Novembre 2013, Lecco Fenomeni metallurgici ad alta temperatura 2 Fenomeni meccanici: sovrasollecitazioni
Materiali per alte temperature Prof. Barbara Rivolta Dipartimento di Meccanica Politecnico di Milano 14 Novembre 2013, Lecco Fenomeni metallurgici ad alta temperatura 2 Fenomeni meccanici: sovrasollecitazioni
ESERCIZI DI CHIMICA. 5. Calcolare le masse in grammi di: a) 0,30 moli di HNO 3 ; b) 2,50 moli di Na 2 SO 4. [19 g di HNO 3 ; 355 g di Na 2 SO 4 ]
![ESERCIZI DI CHIMICA. 5. Calcolare le masse in grammi di: a) 0,30 moli di HNO 3 ; b) 2,50 moli di Na 2 SO 4. [19 g di HNO 3 ; 355 g di Na 2 SO 4 ] ESERCIZI DI CHIMICA. 5. Calcolare le masse in grammi di: a) 0,30 moli di HNO 3 ; b) 2,50 moli di Na 2 SO 4. [19 g di HNO 3 ; 355 g di Na 2 SO 4 ]](/thumbs/19/303703.jpg) ESERCIZI DI CHIMICA 1. Calcolare:a) le moli di H 2 O e le moli di atomi d idrogeno ed ossigeno contenuti in 10g di H 2 O; b) il numero di molecole di H 2 O e di atomi di idrogeno e di ossigeno. [0,55 moli;
ESERCIZI DI CHIMICA 1. Calcolare:a) le moli di H 2 O e le moli di atomi d idrogeno ed ossigeno contenuti in 10g di H 2 O; b) il numero di molecole di H 2 O e di atomi di idrogeno e di ossigeno. [0,55 moli;
La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di
 La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di un solido (polvere) che diverrà il ceramico, con un
La base di partenza per la maggior parte dei processi produttivi di materiali ceramici sono le sospensioni. Queste si ottengono dalla miscelazione di un solido (polvere) che diverrà il ceramico, con un
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05
 I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3.
 Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
CORRENTE E TENSIONE ELETTRICA LA CORRENTE ELETTRICA
 CORRENTE E TENSIONE ELETTRICA La conoscenza delle grandezze elettriche fondamentali (corrente e tensione) è indispensabile per definire lo stato di un circuito elettrico. LA CORRENTE ELETTRICA DEFINIZIONE:
CORRENTE E TENSIONE ELETTRICA La conoscenza delle grandezze elettriche fondamentali (corrente e tensione) è indispensabile per definire lo stato di un circuito elettrico. LA CORRENTE ELETTRICA DEFINIZIONE:
LA FRAZIONE SOLIDA INORGANICA
 LA FRAZIONE SOLIDA INORGANICA ROCCE MINERALI Classe Alogenuri Solfati Solfuri Ossidi ed idrossidi (Al, Fe, Mn, Ti) Carbonati Nitrati Fosfati Silicati (fillosilicati) Minerale Cloruro di sodio Gesso Pirite
LA FRAZIONE SOLIDA INORGANICA ROCCE MINERALI Classe Alogenuri Solfati Solfuri Ossidi ed idrossidi (Al, Fe, Mn, Ti) Carbonati Nitrati Fosfati Silicati (fillosilicati) Minerale Cloruro di sodio Gesso Pirite
tecnologia PROPRIETÀ DEI METALLI Scuola secondaria primo grado. classi prime Autore: Giuseppe FRANZÈ
 tecnologia PROPRIETÀ DEI METALLI Scuola secondaria primo grado. classi prime Autore: Giuseppe FRANZÈ LE PROPRIETÀ DEI MATERIALI DA COSTRUZIONE Si possono considerare come l'insieme delle caratteristiche
tecnologia PROPRIETÀ DEI METALLI Scuola secondaria primo grado. classi prime Autore: Giuseppe FRANZÈ LE PROPRIETÀ DEI MATERIALI DA COSTRUZIONE Si possono considerare come l'insieme delle caratteristiche
MISCUGLI E TECNICHE DI SEPARAZIONE
 MISCUGLI E TECNICHE DI SEPARAZIONE Classe 1^A Grafico Questo documento è solo una presentazione e non deve ritenersi completo se non è accompagnato dalla lezione in classe. Prof. Zarini Marta CLASSIFICAZIONE
MISCUGLI E TECNICHE DI SEPARAZIONE Classe 1^A Grafico Questo documento è solo una presentazione e non deve ritenersi completo se non è accompagnato dalla lezione in classe. Prof. Zarini Marta CLASSIFICAZIONE
Formatura. vetro: liquido fluido viscoso solido. Definizioni convenzionali: 1 Pa s = 10 P η H2O. T 1 / 25 C = 10-2 P = 1 cp
 Formatura vetro: liquido fluido viscoso solido T 1 / viscosità 1 Pa s = 10 P η H2O @ 25 C = 10-2 P = 1 cp intervallo di lavorazione 10 4-10 7.6 P Definizioni convenzionali: vetri duri - morbidi ΔT per
Formatura vetro: liquido fluido viscoso solido T 1 / viscosità 1 Pa s = 10 P η H2O @ 25 C = 10-2 P = 1 cp intervallo di lavorazione 10 4-10 7.6 P Definizioni convenzionali: vetri duri - morbidi ΔT per
13 La temperatura - 8. Il gas perfetto
 La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
La combustione. Docente: prof.ssa Lobello Carmela
 La combustione Percorso didattico realizzato dalla classe II D Istituto d Istruzione secondaria di I grado S Francesco d Assisi Francavilla Fontana (Br) Docente: prof.ssa Lobello Carmela Perché la combustione?
La combustione Percorso didattico realizzato dalla classe II D Istituto d Istruzione secondaria di I grado S Francesco d Assisi Francavilla Fontana (Br) Docente: prof.ssa Lobello Carmela Perché la combustione?
SOLUZIONI E MISCUGLI PERCORSO PER LA SCUOLA ELEMENTARE
 SOLUZIONI E MISCUGLI PERCORSO PER LA SCUOLA ELEMENTARE 1 STADIO Identificazione e definizione delle soluzioni Obiettivo : il bambino, attraverso un approccio fenomenologico, impara il concetto di SOLUZIONE
SOLUZIONI E MISCUGLI PERCORSO PER LA SCUOLA ELEMENTARE 1 STADIO Identificazione e definizione delle soluzioni Obiettivo : il bambino, attraverso un approccio fenomenologico, impara il concetto di SOLUZIONE
Fibra Ceramica. Catalogo generale
 Fibra Ceramica Catalogo generale La storia della società KERAUNION Nel 1, in Bohemia (oggi Repubblica Ceca) viene fondata la ditta Keraunion per produrre vasellame ed oggetti in vetro e cristallo. Dal
Fibra Ceramica Catalogo generale La storia della società KERAUNION Nel 1, in Bohemia (oggi Repubblica Ceca) viene fondata la ditta Keraunion per produrre vasellame ed oggetti in vetro e cristallo. Dal
La granulazione permette di ottenere granuli (aggregati di alcune decine di micron con DPS<1) dalle polveri. I granuli scorrono meglio della polvere,
 1 La granulazione permette di ottenere granuli (aggregati di alcune decine di micron con DPS
1 La granulazione permette di ottenere granuli (aggregati di alcune decine di micron con DPS
PROGRAMMAZIONE GENERALE SCIENZA DEI MATERIALI DENTALI CLASSE IVE ODONTOTECNICA anno scolastico 2014/2015
 PROGRAMMAZIONE GENERALE SCIENZA DEI MATERIALI DENTALI CLASSE IVE ODONTOTECNICA anno scolastico 2014/2015 Competenze da conseguire al termine del quinto anno: applicare le metodologie e le tecniche della
PROGRAMMAZIONE GENERALE SCIENZA DEI MATERIALI DENTALI CLASSE IVE ODONTOTECNICA anno scolastico 2014/2015 Competenze da conseguire al termine del quinto anno: applicare le metodologie e le tecniche della
Tecniche di Analisi Termica e Diffrazione di Raggi X
 ESERCITAZIONI DI CHIMICA FISICA A.A 2010/2011 I MODULO 6 crediti (Anna Corrias) Tecniche di Analisi Termica e Diffrazione di Raggi X Analisi Termica Cenni teorici Descrizione esperienze di laboratorio
ESERCITAZIONI DI CHIMICA FISICA A.A 2010/2011 I MODULO 6 crediti (Anna Corrias) Tecniche di Analisi Termica e Diffrazione di Raggi X Analisi Termica Cenni teorici Descrizione esperienze di laboratorio
La resistenza di un materiale dal comportamento fragile va analizzata attraverso gli strumenti della meccanica della frattura.
 La resistenza di un materiale dal comportamento fragile va analizzata attraverso gli strumenti della meccanica della frattura. Il sistema di riferimento è quello di un componente soggetto a carichi esterni
La resistenza di un materiale dal comportamento fragile va analizzata attraverso gli strumenti della meccanica della frattura. Il sistema di riferimento è quello di un componente soggetto a carichi esterni
Materiali, Sviluppo, Soluzioni. Prodotti di Molibdeno per la industria del vetro
 Materiali, Sviluppo, Soluzioni Prodotti di Molibdeno per la industria del vetro H.C. Starck, Molibdeno Materiali come il molibdeno e il tungsteno, sono vitali per le applicazioni di fusione, omogeneizzazione
Materiali, Sviluppo, Soluzioni Prodotti di Molibdeno per la industria del vetro H.C. Starck, Molibdeno Materiali come il molibdeno e il tungsteno, sono vitali per le applicazioni di fusione, omogeneizzazione
