CORSO MONODISCIPLINARE DI BIOCHIMICA (6 CFU)
|
|
|
- Ivo Cipriani
- 5 anni fa
- Visualizzazioni
Transcript
1 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE DI BIOCHIMICA (6 CFU) Roberto Giacominelli Stuffler
2 IL CORSO MONODISCIPLINARE DI BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) LE MOLECOLE BIOLOGICHE B) ENZIMOLOGIA ED ELEMENTI DI BIOLOGIA MOLECOLARE 2
3 L UNITÀ DIDATTICA LE MOLECOLE BIOLOGICHE COMPRENDE: 1) I LIPIDI 2) I CARBOIDRATI 3) GLI AMMINOACIDI E LE PROTEINE 4) LE PROTEINE DEL CONNETTIVO 5) LA MIOGLOBINA E L EMOGLOBINAL 3
4 L UNITÀ DIDATTICA ENZIMOLOGIA ED ELEMENTI DI BIOLOGIA MOLECOLARE COMPRENDE: 1) ENZIMOLOGIA 2) LA BIOLOGIA MOLECOLARE DEI PROCARIOTI 3) LA BIOLOGIA MOLECOLARE DEGLI EUCARIOTI 4) L EVOLUZIONEL 4
5 UNITÀ DIDATTICA LE MOLECOLE BIOLOGICHE 5
6 UNITÀ BIOTEC. DIDATTICA LE MOLECOLE BIOLOGICHE LA MIOGLOBINA e L EMOGLOBINA Roberto Giacominelli Stuffler
7 LA MIOGLOBINA E L EMOGLOBINAL I vertebrati hanno selezionato due meccanismi principali per rifornire le loro cellule di ossigeno: 1) il sistema circolatorio 2) le molecole che legano l ossigeno: A) L EMOGLOBINA L (Hb( Hb), B) LA MIOGLOBINA (Mb). 7
8 LA MIOGLOBINA E L EMOGLOBINAL Esse appartengono alla famiglia delle globine, la mioglobina è la proteina di immagazzinamento dell O 2 le specie animali, in tutte l emoglobina emoglobina trasporta l O 2 in tutti i vertebrati ed in alcuni invertebrati; essa rimuove anche la CO 2 dai tessuti. 8
9 LA MIOGLOBINA 9
10 LA STRUTTURA TRIDIMENSIONALE DELLA MIOGLOBINA 10
11 L EMOGLOBINA 11
12 L EMOGLOBINA L emoglobina é una proteina tetramerica, costituita da quattro subunitá, ciascuna delle quali somiglia fortemente alla mioglobina. 12
13 L EMOGLOBINA 13
14 LA MIOGLOBINA E L EMOGLOBINAL Esse devono essere in grado di: 1) legare l O 2, 2) impedire che esso ossidi altre sostanze (che ridurrebbero l O 2 ), 3) rilasciarlo in risposta a specifiche richieste. 14
15 LA MIOGLOBINA E L EMOGLOBINAL Alcuni metalli di transizione, nei loro stati di ossidazione più bassi (es. Fe 2+, Cu + ), hanno la tendenza a legare l ossigeno, l evoluzione ha prodotto una modalità con cui il Fe 2+ (ione ferroso) essere legato alle proteine (Mb e Hb), per creare siti di legame per l O (ione ferroso) può 15
16 LA STRUTTURA TERZIARIA DELLA MIOGLOBINA DI CAPODOGLIO 16
17 LA MIOGLOBINA La struttura della mioglobina e del suo gruppo eme. La mioglobina comprende una parte polipeptidica (globina) ed un gruppo prostetico: il gruppo eme. Il gruppo eme è formato da: una parte organica la protoporfirina IX ed un atomo di ferro. 17
18 IL GRUPPO EME L eme si lega in modo non covalente alla molecola, accomodato in una tasca idrofobica. 18
19 IL GRUPPO EME 19
20 IL GRUPPO EME La protoporfirina IX è formata da 4 anelli pirrolici, legati tra di loro a formare un anello tetrapirrolico, con legati 4 gruppi metilici, 2 gruppi vinilici e 2 gruppi propionici; l atomo di ferro forma 6 legami di coordinazione: i primi 4 con gli atomi di azoto dell anello tetrapirrolico, gli altri 2, addizionali, su ciascun lato del piano dell eme, sono il 5 con l His prossimale (F8), il 6 con l O 2, oppure con altre molecole. 20
21 IL GRUPPO EME DELLA Mb ED Hb 21
22 IL GRUPPO EME L atomo di ferro é di 0.03 nm al di fuori del piano della porfirina, quando la sesta posizione di coordinazione é vuota. 22
23 IL GRUPPO EME É LOCALIZZATO IN UNA CAVITÀ PRESENTE NELLA MOLECOLA DELLA Mb 23
24 IL GRUPPO EME DELLA Mb ED Hb 24
25 I GRUPPI PROPIONICI DELL EME EME SONO ALLA SUPERFICIE DELLA Mb 25
26 LA MIOGLOBINA (4,5 3,5 3,5 2,5nm) Il 75% della catena (globina) é in conformazione ad -elica. Ci sono 8 segmenti elicoidali maggiori (da A ad H) e 5 segmenti non elicoidali (AB, CD, EF, FG, GH) raccordano le varie eliche. 26
27 LE FORME PIÙ IMPORTANTI DELLA MIOGLOBINA Forma Stato di ossidazione del ferro V posizione di coordinazione VI posizione di coordinazione Deossimioglobina 2 + His F8 Vuota Ossimioglobina 2 + His F8 O 2 Ferrimioglobina 3 + His F8 H 2 O Fe Fe 2+ (ione ferroso) Fe3+ (ione ferrico) 27
28 LA DINAMICA DEL RILASCIO DELL OSSIGENO DA PARTE DELLA MIOGLOBINA L ossigeno rilasciato sfugge all esterno, se le fluttuazioni della struttura proteica determinano l apertura di un varco. 28
29 LA MIOGLOBINA Se la Mb (o l Hb) è conservata a contatto con l aria, al di fuori dell ambiente cellulare, il ferro si ossida a formare la metamioglobina (ferrimioglobina) o la metemoglobina, il sito di legame viene inattivato e si lega una molecola d acqua al posto dell O 2. 29
30 LA MIOGLOBINA Un gruppo eme libero lega l O 2 per un periodo molto breve, poiché l O 2 ossida molto rapidamente il Fe 2+ (ione ferroso) a Fe 3+ (ione ferrico), che non é più in grado di legare O 2. In questa reazione si ha l intermedio: eme-o 2 -eme Il gruppo eme presente nella mioglobina è molto meno ossidabile, perché difficilmente due molecole di Mb si potranno avvicinare tanto da permettere la formazione del complesso eme-o 2 -eme. 30
31 LA MIOGLOBINA Quindi, la ragione funzionale dell esistenza della componente proteica della Mb e dell Hb è la protezione del ferro dall ossidazione irreversibile; Mb ed Hb creano ambienti in cui è permesso il primo passaggio di una reazione di ossidazione (il legame dell ossigeno), ma è impedito il passaggio finale (l ossidazione). 31
32 LA MIOGLOBINA Un eme stericamente protetto è essenziale per la funzione biologica della Mb. La vicinanza della valina (E11) e della fenilalanina (CD1) permette che l eme si trovi in una tasca idrofobica stericamente ostruita. Il ferro subisce quindi solo un ossigenazione reversibile e non non una vera e propria ossidazione. 32
33 LA MIOGLOBINA L ossidazione é infatti impossibilitata dall impedimento sterico che presenta l ambiente attorno al complesso ferroporfirinico, l eme libero, invece, può facilmente ossidarsi, perché non esiste in questo caso alcuna protezione sterica. 33
34 I COMPOSTI SINTETICI I fattori sterici sono molto importanti nel complesso ferro-porfirina porfirina, infatti i picchetti (ostacoli) impediscono la formazione del dimero eme-o 2 -eme. 34
35 FORMULA DI STRUTTURA DI UNA FERRO-PORFIRINA CON PICCHETTI DI RECINZIONE Si crea un microambiente che permette l ossigenazione. 35
36 LA TOSSICITA DEL MONOSSIDO DI CARBONIO (CO) La tasca dell eme può accogliere sia l O 2 sia il CO, che ha dimensioni analoghe. Il CO ha un affinità di legame per la Mb (e l Hb) maggiore dell O 2 ed il legame non è facilmente reversibile. Per questo motivo il CO è molto tossico. Nel gruppo eme isolato, l asse dell O 2 presenta un angolo con l asse del legame Fe-O, creando un legame più debole rispetto a quello del CO, in cui gli atomi Fe-C-O sono disposti in modo lineare. 36
37 LA TOSSICITA DEL MONOSSIDO DI CARBONIO (CO) Quando l eme é all interno della tasca della globina, il legame del CO è diminuito dalla presenza dell istidina distale, mentre l O 2 si lega allo stesso modo, sia alla Hb, sia alle ferro-porfirine isolate. Questo é un vantaggio per l O 2, che é in competizione con il CO per il legame con il ferro. 37
38 LA TOSSICITA DEL MONOSSIDO DI CARBONIO (CO) In conclusione, mentre il gruppo eme isolato forma un legame con il CO volte più forte rispetto a quello con l O 2, Mb e Hb formano un legame con il CO solo 200 volte più forte rispetto a quello con l O 2. In una cellula, il CO blocca l 1% dei siti della Mb ed Hb. 38
39 IL GENE DELLA Mb Il gene della mioglobina è costituito da tre esoni: l esone I codifica gli aminoacidi da 1 a 30, l esone II codifica gli aminoacidi da 31 a 105, l esone III codifica gli aminoacidi da 106 a 153. La minimioglobina, ottenuta con l enzima proteolitico clostripaina, è costituita da 107 aminoacidi (da 32 a 139) ed ha un comportamento simile a quello della mioglobina. 39
40 L EVOLUZIONE DI Mb ED Hb L emoglobina e la mioglobina sono evolute da una stessa proteina ancestrale, probabilmente, un errato appaiamento dei cromosomi omologhi portò alla formazione di un cromosoma contenente i due geni identici, che hanno subito mutazioni ed evoluzioni indipendenti l uno dall altro. 40
41 CONFRONTO TRA Mb ED Hb L Hb ha un organizzazione approssimativamente tetraedrica 41
42 MIOGLOBINA ED EMOGLOBINA 42
43 LE EMOGLOBINE PIU IMPORTANTI Sono stati identificati vari tipi di catene che danno origine ad emoglobine diverse. Hb embrionale Hb Gower Hb Gower Hb Portland 2 2 Hb fetale Hb F Ultimi 2-3 mesi 2 2 della vita fetale Hb adulto Hb A 2 2 Hb A ±2% 43
44 L EMOGLOBINA A (P.M.64500) L emoglobina è una proteina tetramerica, costituita da due subunità e due subunità, ognuna delle quali presenta un gruppo prostetico eme (Fe 2+ ), ed una catena polipeptidica. La globina (la componente proteica) é formata da: 2 catene (141 residui), 2 catene (146 residui). 44
45 LE SEQUENZE AMMINOACIDICHE DELLA MIOGLOBINA DI CAPODOGLIO E DELLE CATENE α E β DELL EMOGLOBINA EMOGLOBINA UMANA La struttura terziaria della Mb e delle 2 subunità α e β della Hb sono molto simili, nonostante solo il 18% dei corrispondenti residui siano identici. 45
46 L AVVOLGIMENTO GLOBINICO (Hb ed Mb) È l intricato ripiegamento della catena polipeptidica, che consente di porre il gruppo eme in un ambiente da permettere il legame reversibile dell ossigeno. 46
47 Esistono due forme di emoglobina: forma T (deossihb( deossihb) ha scarsa affinità per l O 2 forma R (ossihb( ossihb) ha elevata affinità per l O 2 (cooperatività di legame) 47
48 L EMOGLOBINA 48
49 L EMOGLOBINA I residui invarianti sono particolarmente importanti per la funzione dell emoglobina: ecco i principali residui invarianti in più di 60 specie F8 Istidina His prossimale legata all eme E7 Istidina His distale vicina all eme CD1 Fenilalanina Contatti con il gruppo eme F4 Leucina Contatti con il gruppo eme B6 Glicina Permette una stretta vicinanza tra le eliche B ed E C2 Prolina Termine dell elica H2 Tirosina Legami crociati tra le eliche H ed F C4 Treonina Incerto H10 Lisina Incerto 49
50 IL LEGAME DELL OSSIGENO DA PARTE DELLA Mb 50
51 IL LEGAME DELL OSSIGENO DA PARTE DELLA Mb Nei tessuti (muscolo), la Mb lega l ossigeno l rilasciato dalla Hb presente nel circolo arterioso ed a sua volta lo cede agli organuli cellulari (i mitocondri). Mb + O 2 MbO 2 51
52 LA MIOGLOBINA Il legame di un ligando (O 2 ) ad un sito singolo di una proteina (Mb) può essere descritto da una curva di legame iperbolica. Mb + O 2 MbO 2 52
53 LA CURVA DI LEGAME DELL O 2 ALLA Mb La curva iperbolica è espressa dall equazione: Y = po 2 po 2 +P +P 50 a 100 torr la YO 2 é 0.97, a 20 torr la YO 2 é La pressione parziale di O 2 èespressa in torr, l O 2 si lega saldamente alla Mb con una P 50 di soli 2,8 torr. 53
54 SATURAZIONE (Y)( È la frazione di siti occupati dall ossigeno e corrisponde alla percentuale di Mb ossigenata. Il valore di y può variare da 0 a 1. È il termine che esprime la pressione parziale di ossigeno in cui il 50% dei siti sono occupati (y=0,5). Indica l affinità per l ossigeno della Mb. P 50 54
55 TORR È l unità di misura della pressione, equivalente alla pressione esercitata da una colonna di Hg di 1 mm, a 0 C ed a gravità normale. 55
56 IL LEGAME DELL OSSIGENO DA PARTE DELLA Hb 56
57 LE CURVE DI LEGAME RICHIESTE DA UNA PROTEINA DA TRASPORTO 57
58 L EMOGLOBINA L efficienza nel trasporto di ossigeno è ottenuta attraverso il legame cooperativo da parte di proteine dotate di più siti, descritto da una curva di legame sigmoide; nella linea evolutiva che ha portato ai vertebrati, la proteina utilizzata per il trasporto di O 2 é l emoglobina. 58
59 L EMOGLOBINA L Hb è il trasportatore di ossigeno molecolare, una proteina trasportatrice di O 2 ideale dovrebbe essere quasi completamente saturata a 100 mmhg (pressione parziale di O 2 nei polmoni o nelle branchie) e trovarsi quasi totalmente in forma dissociata a circa mmhg (pressione parziale dei tessuti). 59
60 LA CURVA DI SATURAZIONE DELLA Hb CON L OSSIGENO É SIGMOIDE Una curva di legame di tipo sigmoide può essere considerata come una curva ibrida, che riflette la presenza di forme a bassa affinità e ad alta affinità. Per la Hb il valore di P 50 écirca 26 torr, a 100 torr la YO 2 é 0.97, a 20 torr la YO 2 é
61 Le proteine che legano il substrato (ligando) in modo cooperativo danno curve di tipo sigmoide e sono chiamate proteine allosteriche. A basse concentrazioni di [S], la molecola si comporta come se avesse una debole capacità di legame (K 0.5 elevata); all aumentare di [S] viene indotto un aumento della quantità di ligando legato e quindi di efficienza della molecola. Le proprietà cinetiche delle proteine allosteriche non seguono le cinetiche di Michaelis-Menten (che danno le curve di legame iperboliche). 61
62 LE PROTEINE ALLOSTERICHE L emoglobina è una proteina allosterica; il termine allosterico deriva dal greco (állos = altro; stereós = forma). Le proteine così definite possono assumere altre conformazioni indotte dal legame di opportuni modulatori; in una proteina allosterica, il legame di un ligando ad un sito modifica le proprietà di un altro sito sulla stessa molecola, le molecole allosteriche sono proteine oligomeriche, costituite da due o più subunità e con diversi siti attivi, le interazioni allosteriche (cooperative) avvengono quando il legame di un ligando ad un sito specifico viene influenzato dal legame di un altro ligando,, detto effettore o modulatore,, a livello di siti diversi, nella proteina. 62
63 L Hb É UNA PROTEINA ALLOSTERICA Quando più subunità si uniscono, emergono nuove proprietà di fondamentale importanza biologica, l Hb è più complicata e sensibile della Mb, ogni molecola di Hb può legare 4 molecole di O 2, perché sono presenti 4 siti di legame. 63
64 L Hb É UNA PROTEINA ALLOSTERICA Nella Hb esiste una cooperatività di legame, essa è possibile perché lo stato di ossigenazione di un sito può essere comunicato agli altri siti, questo é un esempio di effetto allosterico, dove l occupazione di uno dei siti da parte del ligando (O 2 ) influisce sull affinità di quelli rimasti liberi; le molecole che legano il substrato in modo cooperativo danno curve di tipo sigmoide. 64
65 L Hb É UNA PROTEINA ALLOSTERICA Quando il normale ligando (O 2 nel caso della Hb) di una proteina allosterica è anche un modulatore, l interazione viene detta omotropica, se invece il modulatore è una molecola diversa dal ligando normale, l interazione viene detta eterotropica, questi effetti possono essere sia positivi sia negativi, a seconda che il ligando aumenti o diminuisca l affinità della proteina per il ligando stesso. 65
66 L Hb HA UNA COOPERATIVITA OMOTROPICA POSITIVA La sua cooperatività positiva deriva dalle modificazioni che il legame di un ligando (O 2, effettore omotropico positivo) ad un gruppo eme può indurre sull affinità di legame per il ligando in un altro gruppo eme dell Hb. 66
67 LA Mb HA UN AFFINIT AFFINITÀ PER L OL 2 MAGGIORE DI QUELLA DELLA Hb Curva iperbolica per la Mb, curva sigmoide per la Hb. La quarta molecola di O 2 si lega all Hb con una affinità 100 volte superiore a quella della prima molecola di O 2 (effetto della globina). 67
68 LE PROPRIETA ALLOSTERICHE DELL EMOGLOBINA EMOGLOBINA 1) Il legame dell O 2 alla Hb favorisce il legame di altro O 2 alla stessa molecola: cooperatività positiva, 2) l affinità della Hb per l O 2 dipende anche dal ph e dalla CO 2, che sono effettori eterotropici negativi, 3) l affinità della Hb per l O 2 é inoltre regolata dal 2,3 bisfosfoglicerato (BPG), uneffettore eterotropico negativo. 68
69 IL COEFFICIENTE DI HILL Il coefficiente di Hill (n) è un parametro correlato al grado di cooperatività tra le subunità di una proteina; in una proteina costituita da subunitá, ognuna in grado di legare una molecola di substrato (ligando), n aumenta con il grado di cooperativitá: se n=1 non c è cooperatività (ramo di iperbole), se n>1 c è cooperatività positiva (curva sigmoide), se n<1 c è cooperatività negativa. 69
70 QUANDO n=1, NON C É COOPERATIVITÀ In questo caso, i siti di legame per l ossigeno sono completamente indipendenti nel loro comportamento, questa situazione é anche di una proteina con un singolo sito di legame (es. la mioglobina). 70
71 QUANDO n>1, C É COOPERATIVITÀ POSITIVA La cooperatività diventa infinita (situazione ipotetica), quando la proteina ha tutti i siti (o nessun sito) di legame per il ligando occupati contemporaneamente, in questo caso, n tende ad essere uguale al n dei siti di legame per il ligande presenti nella proteina e la molecola è completamente cooperativa. 71
72 IL COEFFICIENTE DI HILL Nel caso dell emoglobina n é 2,8. La curva sigmoide dell Hb indica il legame cooperativo dell ossigeno alla proteina, rendendo più efficace il trasporto dell ossigeno. La curva può essere espressa dall equazione: y = (po 2 ) n (po 2 ) n + (P ) n 72
73 LA FUNZIONE DEL COEFFICIENTE DI HILL La saturazione della Hb varia più rapidamente in seguito a variazioni della po 2 di quello che potrebbe, se i siti di legame avessero un comportamento indipendente gli uni dagli altri. 73
74 LA FUNZIONE DEL COEFFICIENTE DI HILL La po 2 alveolare = 100 torr La po 2 dei capillari di muscolo in attività = 20 torr La P 50 Hb = 26 torr Il coefficiente di Hill (n) = 2,8 Y alveoli = 0.97 Y muscolo in attività = 0.32 Valori ottenuti utilizzando la seguente equazione: y = (po 2 ) n (po 2 ) n + (P ) n 74
75 IL COEFFICIENTE DI HILL Il grafico di Hill per il legame dell ossigeno alla mioglobina (blu) ed all emoglobina (rosso). 75
76 L EMOGLOBINA DeossiHb OssiHb (più compatta) 76
77 LE PROPRIETA ALLOSTERICHE DELL EMOGLOBINA EMOGLOBINA Le proprietà allosteriche dell Hb derivano dalle interazioni tra le sue subunità, le catene isolate si comportano come la Mb, le catene isolate formano un tetramero mancante di proprietà allosteriche (HbH). 77
78 LE INTERAZIONI FRA LE SUBUNITA DELL Hb Le subunità sono disposte ai vertici di un tetraedro, esistono notevoli interazioni tra le subunità di tipo diverso: le interfacce 1 1 e 2 2 comprendono 35 residui, le interfacce 1 2 e 2 1 comprendono 19 residui. 78
79 LE INTERAZIONI FRA LE SUBUNITA DELL Hb Esse sono principalmente interazioni di carattere idrofobico, sono presenti anche leg.h ed alcune coppie ioniche, i contatti tra le subunità dello stesso tipo sono pochi e prevalentemente polari; infatti, sono separate da un canale di 20A pieno di solvente. 79
80 LA TRANSIZIONE T RT L Hb possiede due stati di struttura quaternaria: 1) la forma deossi (stato T), 2) la forma ossi (stato R), che ha affinità superiore per l ossigeno, giustificando la cooperatività di legame. 80
81 LO SPETTRO DI ASSORBIMENTO DELLA LUCE VISIBILE DELLA OSSIHb E DEOSSIHb 81
82 LA TRANSIZIONE T RT L ossigenazione determina un cambiamento nella struttura quaternaria, accompagnato ad un cambiamento della struttura terziaria della Hb, una coppia ruota e scivola rispetto all altra. Questo movimento porta le catene più vicine tra loro e restringe la cavità centrale della molecola. 82
83 DEOSSIHb OSSIHb 83
84 LA TRANSIZIONE T R Durante l ossigenazione, la coppia α1 β1 ruota di 15 rispetto all altra coppia. 84
85 LA TRANSIZIONE T RT Durante l ossigenazione, i contatti α 1 β 1 e α 2 β 2 rimangono immodificati, numerose modificazioni strutturali avvengono a livello delle regioni di contatto α 1 β 2 e α 2 β 1. 85
86 LA TRANSIZIONE T RT 86
87 LA TRANSIZIONE T RT Il legame dell O 2 ad una subunità determina cambiamenti nella sua struttura terziaria a partire dall eme, che da una forma curvata assume una forma appiattita. Questo provoca una tensione ed un conseguente cambiamento nella struttura circostante, in particolare nelle zone critiche dell interfaccia. 87
88 LA TRANSIZIONE T RT Il legame dell O 2 determina una contrazione di circa 0.1A dei legami Fe-N porfirina ed il conseguente abbassamento della cupola dell eme. 88
89 LA TRANSIZIONE T RT Il legame dell ossigeno attira il ferro all interno del piano dell eme, appiattendolo e provocando tensione, che é attenuata da una variazione nell orientamento della His F8 e ciò é in parte mediato dalla spinta verso destra della val FG5. Il cambiamento di struttura terziaria dell eme viene comunicato all angolo FG. 89
90 IL MOVIMENTO DEL FERRO ALL INTERNO DELL EME, EME, CHE DIVENTA PIÙ PLANARE, VIENE TRASMESSO ALLE ALTRE SUBUNITÀ ATTRAVERSO MODIFICAZIONI CONFORMAZIONALI ALLE LORO INTERFACCE. 90
91 LA TRANSIZIONE T RT Il rimaneggiamento della struttura terziaria di una subunitá porta ad un accumulo di tensione che determina una transizione quaternaria (T R). 91
92 I CONTATTI ALL INTERFACCIA αβ Le regioni di contatto tra due subunità agiscono come un interruttore in grado di innescare due strutture diverse. Le due strutture sono stabilizzate da gruppi diversi di legami H; H in entrambe le conformazioni, le protuberanze di una subunità si adattano esattamente agli incavi presenti nell altra subunità. 92
93 OTTO COPPIE IONICHE (PONTI SALINI) STABILIZZANO LO STATO T DELLA DEOSSIEMOGLOBINA 93
94 IL RETICOLO DI COPPIE IONICHE E LEGAMI IDROGENO NELLA DEOSSIEMOGLOBINA 94
95 GLI OTTO LEGAMI SALINI FRA LE SUBUNITÀ DELLA DEOSSIEMOGLOBINA La transizione T R determina la rottura dei ponti salini. 95
96 UN MODELLO RECENTE PER LA TRANSIZIONE COOPERATIVA DELL EMOGLOBINA. EMOGLOBINA. 96
97 LA TRANSIZIONE T RT A=modello concertato B=modello sequenziale 97
98 IL MOVIMENTO DELL O 2 ATTRAVERSO IL SISTEMA RESPIRATORIO E CIRCOLATORIO 98
99 99
100 L EFFETTO BOHR L effetto della variazione del ph sull Hb. Una caduta del ph nei capillari tessutali ha l effetto di abbassare l affinità dell Hb per l ossigeno, permettendo un rilascio ancora più efficiente delle ultime tracce di ossigeno legato. L effetto reciproco avviene nei capillari dei polmoni. Il ph é un effettore eterotropico negativo. 100
101 L EFFETTO BOHR NELL Hb L efficienza di rilascio dell O 2 aumenta fortemente con la diminuzione del ph. Quando il sangue circola dai polmoni (giallo) ai tessuti (azzurro), il basso valore di ph sposta il legame dell O 2 verso le curve a più bassa affinità. Nel caso della Mb, l effetto Bohr è scarso. 101
102 L EFFETTO BOHR Durante la respirazione, 0,8 molecole di CO 2 sono formate per ogni molecola di O 2 consumata; la CO 2 diffonde dai tessuti ai capillari. Nei globuli rossi: CO 2 +H 2 0 H 2 CO 3 HCO 3- +H + 102
103 L EFFETTO BOHR NEL GLOBULO ROSSO Gli ioni H + vengono assunti dalla Hb che viene indotta a rilasciare l O 2 che ha legato. Al contrario, nei polmoni, dove la po 2 è elevata, il legame dell ossigeno all Hb determina il rilascio dei protoni implicati nell effetto Bohr. 103
104 LA PROTEINA TRASPORTATRICE DEGLI ANIONI NELL ERITROCITA ERITROCITA 104
105 IL RUOLO DEGLI GLI IONI H + ASSUNTI DALL Hb Gli ioni H + permettono l interazione tra l His 146 (cat.β 1 ) e l Asp 94 (cat.β 1 ), stabilizzando lo stato T (deossi) dell Hb. C terminale Protone aggiunto 105
106 RIASSUNTO DELL EFFETTO EFFETTO BOHR NEL GLOBULO ROSSO 106
107 L EFFETTO BOHR La reazione complessiva è: nh + + Hb 4O 2 Hb nh + + 4O 2 dove n ha un valore poco superiore a 2 Nei capillari tessutali, gli ioni H + promuovono il rilascio di O 2, spostando l equilibrio della reazione verso destra. Nei capillari polmonari, l ossigenazione provoca il rilascio di H +,spostando l equazione a sinistra. In seguito al legame dell O 2, l Hb diventa un acido più forte. A sua volta, l H + tende a liberare la CO 2 dal bicarbonato disciolto nel sangue. La CO 2 può così essere espirata. 107
108 L EFFETTO BOHR NEL GLOBULO ROSSO CO 2 CO 2 +H 2 0 H 2 CO 3 HCO 3- H + ossihb H + deossihb + O 2 O 2 Canale per gli anioni Cl - 108
109 IL RUOLO DELLA CO 2 La CO 2 é un effettore eterotropico negativo per il legame dell O 2 all Hb, la CO 2 rilasciata dai tessuti abbassa, infatti, la sua affinità per l O 2 in due modi: 1) con la formazione di bicarbonato (gli H + rilasciati contribuiscono all effetto Bohr), 2) con la formazione di carbamati, le cui interazioni elettrostatiche con gli amminogruppi N-terminali delle catene stabilizzano la deossihb. 109
110 IL TRASPORTO DELLA CO 2 DAI TESSUTI AI POLMONI 1) Esso é fondamentalmente un fenomeno passivo (ione bicarbonato). 2) R-NH 2 +CO 2 R-NH-COO - + H + carbamato Il carbamato forma interazioni elettrostatiche stabilizzanti la deossihb con gli amminogruppi N-terminali delle catene, l equilibrio della reazione dipende dalla [CO 2 ]. 3) CO 2 disciolta (in piccola quantità, perchè è poco solubile). 110
111 IL RUOLO DELL Hb E DELLA Mb NEL TRASPORTO DELL O 2 DAI POLMONI AI TESSUTI CHE RESPIRANO E DELLA CO 2 (SOTTO FORMA DI HCO 3- ) DAI TESSUTI AI POLMONI. 111
112 IL RUOLO DEL BPG Il BPG (bisfosfoglicerato) è un effettore eterotropico negativo dell Hb, perché diminuisce la sua affinità per l O
113 IL BISFOSFOGLICERATO (BPG) L effetto del BPG sul legame dell ossigeno all emoglobina. 113
114 IL LEGAME DEL BPG ALLA DEOSSIHb Il BPG si lega alla deossihb (in un rapporto di 1:1) nella cavità tra le catene, formando interazioni elettrostatiche con i gruppi carichi positivamente, presenti attorno a questa apertura. 114
115 IL LEGAME DEL BPG ALLA DEOSSIHb 115
116 IL LEGAME DEL BPG ALLA DEOSSIHb subunità 1 subunità 2 TR 116
117 IL RUOLO DEL BPG Il BPG è stereochimicamente complementare alle sei cariche positive presenti nella cavità centrale, formate da 3 residui di ciascuna catena β. Il BPG stabilizza la deossihb, diminuendo l affinità della deossihb per l ossigeno. I cambiamenti conformazionali che hanno luogo con l ossigenazione rompono il sito di legame. 117
118 IL RUOLO DEL BPG Legame del BPG alla deossiemoglobina A e B = deossihb C = ossihb 118
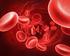
119 IL RUOLO DEL BPG Il BPG non si adatta alla forma ossihb, infatti, durante l ossigenazione, esso viene rilasciato per il restringimento della cavità centrale, maggiore è il contenuto di BPG negli eritrociti, più stabile è la struttura della deossihb, il BPG regola i cambiamenti a lungo termine nell affinità per l O 2. Un esempio è il suo aumento di concentrazione negli individui che si recano ad alte quote. 119
120 L EMOGLOBINA FETALE (HbF( HbF) Essa ha un ruolo nel passaggio di O 2 dalla madre al feto attraverso la placenta. L Hb fetale (α 2 γ 2 ) lega meno saldamente dell Hb adulta il BPG, perché un residuo di serina (non carico),in ogni catena γ, sostituisce l istidina (con carica positiva), presente in ogni catena β, nel sito di legame con il BPG, ne consegue una minore formazione di legami ionici (da 6 a 4); quindi, l HbF presenta una maggiore affinità per l ossigeno rispetto all HbA. La curva sigmoide é spostata a sinistra. 120
121 LE EMOGLOBINE ANORMALI E PATOLOGICHE Esse possono riguardare: alterazioni sulla superficie della molecola, alterazione del sito attivo, alterazione della struttura terziaria, alterazione della struttura quaternaria. 121
122 LE EMOGLOBINE ANORMALI E PATOLOGICHE La presenza di emoglobine anormali e patologiche è dovuta ad alterazioni della parte proteica della molecola. Sono possibili 1) Modificazioni: A) nelle catene o, B) nelle catene o. 122
123 LE EMOGLOBINE ANORMALI E PATOLOGICHE 2) Sostituzione di intere catene dovute a loro difetti di sintesi: i: A) le emoglobine tetramere (HbH), con catene tutte uguali (es. β4), B) le talassemie. 123
124 L ELENCO DI ALCUNE MUTAZIONI NELLE EMOGLOBINE UMANE 124
125 L ANEMIA A CELLULE FALCIFORMI I globuli rossi, in presenza di basse concentrazioni di O 2, assumono una forma allungata a falce, questa deformazione è conseguente alla tendenza dell Hb mutante, nel suo stato deossigenato, ad aggregarsi in lunghe strutture a bastoncino, le cellule allungate formatesi tendono a bloccare i capillari, causando infiammazioni e dolore. 125
126 L ANEMIA A CELLULE FALCIFORMI Confronto tra eritrociti di un soggetto normale (a) e quelli di un paziente affetto da anemia falciforme (b). 126
127 L ANEMIA A CELLULE FALCIFORMI Tali cellule sono fragili e la loro rottura porta ad anemia, rendendo la persona sensibile ad infezioni e malattie; questa é una malattia genetica, gli omozigoti per la mutazione falciforme spesso non sopravvivono fino all età adulta, o la raggiungono gravemente debilitati, gli eterozigoti, che possono produrre l Hb normale, presentano di norma disturbi solo in condizioni di grave carenza di ossigeno. 127
128 L ANEMIA A CELLULE FALCIFORMI Confronto tra gli eritrociti di un soggetto normale e quelli di un paziente affetto da anemia falciforme. 128
129 L ANEMIA A CELLULE FALCIFORMI I soggetti, che sono malati per anemia a C.F., sono omozigoti per un gene autosomico, i soggetti, che presentano il tratto a cellule falciformi, sono eterozigoti per lo stesso gene autosomico e sono di norma asintomatici, la patologia si manifesta nel circolo venoso (quando l Hb é in forma deossi), nella circolazione venosa di un omozigote il 50% dei globuli rossi è a falce, negli eterozigoti solo l 1% 1%. 129
130 L ANEMIA A CELLULE FALCIFORMI L anemia falciforme é trasmessa geneticamente ed è per lo più limitata alla popolazioni tropicali (l incidenza tra le persone nere é circa il 4%o), il tratto a cellule falciformi é presente in 1 nero su 10, éuna patologia cronica ed emolitica, le cellule a falce rimangono intrappolate nei piccoli vasi sanguigni, creando danni agli organi. 130
131 L HbS La solubilità della deossihb nei globuli rossi falciformi è anormalmente bassa (soltanto il 4% della deossihb normale). Si produce un abbondante precipitato fibroso con deformazione dei globuli rossi, che assumono una forma a falce. L Hb delle cellule falciformi é chiamata HbS (sickle = falce). 131
132 L HbS HA UNA DIVERSA MOBILITÀ ELETTROFORETICA RISPETTO ALL HbA P.I. HBA = 6.87 P.I. HBS = 7.09 (Elettroforesi eseguita a ph 8,6). 132
133 IL CONFRONTO TRA HbA (NORMALE) ED HbS (ANEMIA FALCIFORME) L anemia a cellule falciformi é una malattia molecolare. Le piccole differenze di conformazione tra Hb normale ed HbS derivano dalla sostituzione di un solo amminoacido nelle catene β. 133
134 L ANEMIA A CELLULE FALCIFORMI La patologia, infatti, dipende da una singola mutazione di una base azotata nelle catene, che porta alla sostituzione in posizione 6 dell acido glutammico con la valina. 134
135 L ANEMIA A CELLULE FALCIFORMI Per individuare la presenza di tale sostituzione, é stata utilizzata la tecnica del fingerprint, l Hb viene tagliata in singoli frammenti, impiegando la tripsina; il trattamento triptico produce 28 diversi peptidi dal dimero αβ. 135
136 LA TECNICA DEL FINGERPRINT Dal trattamento triptico si ottiene cosí un miscuglio di 28 frammenti sia dalla HbA, sia dalla HbS; si eseguono poi l elettroforesi e la cromatografia, che permettono di evidenziare l amminoacido mutato nell HbS. 136
137 L HbS La valina idrofobica si inserisce in una tasca nell angolo EF della catena di un altra Hb e così Hb adiacenti possono adattarsi l una all altra formando una fibra elicoidale, tale riarrangiamento si ha solo per la deossihb, perché nella forma ossi il riarrangiamento delle subunità rende la tasca inaccessibile. 137
138 L HbS Un sito idrofofico, complementare alla zona appiccicosa (valina), compare in ogni catena β delle HbS e HbA nella loro forma deossigenata. Nelle rispettive forme ossigenate, il sito complementare é nascosto. 138
139 L HbS Il sito complementare di HbS deossigenata può legarsi alla zona appiccicosa di un altra deossi-hbs, con formazione di lunghe fibre, che trasformano i G.R. in cellule a falce, le quali distorcono il vaso sanguigno. 139
140 L HbS Il blocco di un vaso determina una zona a bassa concentrazione di ossigeno, che porta ad una ulteriore deossigenazione dell HbS con produzione prima di altre fibre e conseguentemente di nuove cellule a falce; ha così origine un circolo vizioso. 140
141 IL TRATTO A CELLULE FALCIFORMI Una persona eterozigote è normalmente asintomatica, avendo solo il 50% dell HbS, che é insufficiente per produrre tante fibre da trasformare i G.R. in cellule a falce, la forma a falce é deossi-s. infatti causata da un alta concentrazione di 141
142 LE FASI DI NUCLEAZIONE NELLA FORMAZIONE DELLE FIBRE DI DEOSSI HbS La HbS ha una regione idrofobica sulla superficie, che causa un aggregazione di queste molecole in catene, che si organizzano in fibre insolubili. 142
143 LE FASI DI NUCLEAZIONE NELLA FORMAZIONE DELLE FIBRE DI DEOSSI HbS La forma a falce degli eritrociti è dovuta quindi alla polimerizzazione della deossi HbS sotto forma di fibre rigide, che si estendono per tutta la lunghezza della cellula. 143
144 LE FASI DI NUCLEAZIONE NELLA FORMAZIONE DELLE FIBRE DI DEOSSI HbS 1) Si forma un nucleo di molecole di deossi HbS. 2) Quando la fibra si è formata, essa può nucleare la crescita di altre fibre, di conseguenza, il processo diventa autocatalitico. Se il tempo per la formazione della fibra è superiore al tempo di transito dei globuli rossi dai capillari periferici agli alveoli polmonari, non si formeranno le cellule a falce e non ci sarà alcun blocco del flusso sanguigno. 144
145 SI FORMA UNA FIBRA ELICOIDALE A 14 ELEMENTI 145
146 LE MODIFICAZIONI CHE PORTANO ALLA FORMAZIONE DI AGGREGATI Emoglobina A Emoglobina S 2 1 Glu6 Val6 2 Glu6 1 Val6 Interazione tra molecole Formazione di fibre insolubili 146
147 L ANEMIA FALCIFORME E LA MALARIA La malaria è una malattia parassitaria trasmessa dalla zanzara tropicale anofele, il plasmodium falciparum è un potozoo che sta nei globuli rossi per la maggior parte del ciclo vitale (48 ore), aumentandone l acidità e determinandone l adesione ad una specifica proteina sulla parete dei vasi, esso crea quindi un impedimento del flusso sanguigno nell organo in cui esso é presente (es. malaria cerebrale). 147
148 L ANEMIA FALCIFORME E LA MALARIA L anemia falciforme è limitata alle popolazioni originarie della zone tropicali, con alta incidenza della malaria, gli individui eterozigoti per l HbS presentano una maggiore resistenza alla malaria rispetto agli individui che non portano tale mutazione; perché? in essi, la presenza dell infezione determina un aumento delle cellule a falce dal 2% fino al 40%, poiché la maggiore acidificazone, causata dall infezione, aumenta la formazione di deossihbs (per l effetto Bohr). 148
149 L ANEMIA FALCIFORME E LA MALARIA Un globulo rosso normale mantiene alta la concentrazione di potassio; l aumentata fragilità delle cellule falciformi porta invece ad un rilascio dello ione, il parassita spesso interrompe il suo ciclo vitale, poiché necessita di alte concentrazioni di potassio, quindi, il tratto per l anemia falciforme risulta essere un adattamento vantaggioso in ambiente malarico. 149
150 L ANEMIA FALCIFORME E LA MALARIA Gli eterozigoti hanno maggiori possibilità di sopravvivenza e quindi maggiore possibilità di trasmettere i propri geni nelle regioni infestate dalla malaria, questo porta anche alla nascita di un gran numero di individui omozigoti per il tratto mutante. 150
151 L Hb DI HAMMERSMITH Essa é un altro esempio di Hb patologica. In posizione CD1 la Phe é sostituita da una serina, con la riduzione del legame dell eme (esso tende a perdersi). 151
152 LE TALASSEMIE Sono difetti genetici, in cui una o più catene non sono prodotte o sono prodotte in piccole quantità. Si distinguono le -talassemie e -talassemie. 152
153 IL FLUSSO DELL INFORMAZIONE GENETICA 153
154 LE TALASSEMIE Le sindromi talassemiche possono insorgere nei seguenti casi: 1) uno o più geni codificanti per le catene dell Hb hanno subito una delezione completa, 2) uno o più geni presentano una mutazione non senso (con conseguente catena polipeptidica accorciata), o della fase di lettura, che produce una catena non funzionale, 3) i geni sono presenti, ma c è una mutazione al di fuori della regione codificante, che determina il blocco della trascrizione, oppure un errato riarrangiamento del pre-mrna. 154
155 L -TALASSEMIA Si ha quando il gene della -globina è stato perduto, o non può essere espresso, il basso livello di -Hb è parzialmente compensato dalla formazione di HbH ( 4) e Hb di Bart ( 4), questi tetrameri trasportano l ossigenol ossigeno, ma non mostrano la transizione allosterica (sono sempre nello stato R) e mancano dell effetto Bohr, la totale assenza di -Hb è incompatibile con la vita. 155
156 LA β-talassemia Si ha quando il gene della -globina è stato perduto, o non può essere espresso, negli omozigoti, è una condizione patologica molto grave che causa la morte del soggetto affetto, prima della maturità, in caso di eterozigosi, il gene della -globina è ancora funzionante, esistono anche talassemie più leggere, in cui la produzione di β- globina é ridotta, ma non completamente soppressa. 156
157 LE TIPOLOGIE DELLA -TALASSEMIA 1) maior essa si manifesta negli omozigoti, nei quali HbF è circa il 90%, é chiamata morbo di Cooley o Anemia Mediterranea 2) minor 3) minima 157
LA MIOGLOBINA e L EMOGLOBINA
 UNITÀ VET. DIDATTICA DI PROPEDEUTICA BIOCHIMICA LA MIOGLOBINA e L EMOGLOBINA Roberto Giacominelli Stuffler LA MIOGLOBINA E L EMOGLOBINAL I vertebrati hanno selezionato due meccanismi principali per rifornire
UNITÀ VET. DIDATTICA DI PROPEDEUTICA BIOCHIMICA LA MIOGLOBINA e L EMOGLOBINA Roberto Giacominelli Stuffler LA MIOGLOBINA E L EMOGLOBINAL I vertebrati hanno selezionato due meccanismi principali per rifornire
Mioglobina Emoglobina
 Mioglobina Emoglobina RESPIRAZIONE : assunzione di O 2 dall ambiente e rilascio di CO 2 La RESPIRAZIONE CELLULARE è un processo redox attraverso il quale vengono trasferiti atomi di idrogeno da un composto
Mioglobina Emoglobina RESPIRAZIONE : assunzione di O 2 dall ambiente e rilascio di CO 2 La RESPIRAZIONE CELLULARE è un processo redox attraverso il quale vengono trasferiti atomi di idrogeno da un composto
IL GRUPPO EME. PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici.
 IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
Le proteine che legano l ossigenol
 Le proteine che legano l ossigenol Protoporfirina IX EME (Fe-protoporfirina IX) L atomo di ferro del gruppo eme può formare sei legami Struttura della mioglobina di capodoglio (J. Kendrew, anni 50)
Le proteine che legano l ossigenol Protoporfirina IX EME (Fe-protoporfirina IX) L atomo di ferro del gruppo eme può formare sei legami Struttura della mioglobina di capodoglio (J. Kendrew, anni 50)
Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro.
 Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
Trasporto di CO 2. ed effetto Bohr. . La CO 2. nei tessuti produce CO 2. Il consumo di O 2. deve essere rimossa e portata ai polmoni (o alle branchie)
 Trasporto di CO 2 ed effetto Bohr Il consumo di O 2 nei tessuti produce CO 2. La CO 2 deve essere rimossa e portata ai polmoni (o alle branchie) Anidrasi carbonica POLMONI La CO 2 abbassa il ph negli eritrociti
Trasporto di CO 2 ed effetto Bohr Il consumo di O 2 nei tessuti produce CO 2. La CO 2 deve essere rimossa e portata ai polmoni (o alle branchie) Anidrasi carbonica POLMONI La CO 2 abbassa il ph negli eritrociti
La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine:
 La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina
La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina
FUNZIONI delle PROTEINE
 FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
Il BPG è un importante modulatore dell affinità di Hb per l O 2. - curva iperbolica. - P50 = 1 mm Hg
 L Hb è una proteina allosterica che presenta: - regolazione omotropica O 2 è sia il normale ligando sia il modulatore omotropico - regolazione eterotropica H +, CO 2 e BPG sono modulatori eterotropici
L Hb è una proteina allosterica che presenta: - regolazione omotropica O 2 è sia il normale ligando sia il modulatore omotropico - regolazione eterotropica H +, CO 2 e BPG sono modulatori eterotropici
Modulo 4. Una proteina in azione
 Modulo 4 Una proteina in azione Mioglobina ed emoglobina: un esempio di funzionamento di una proteina La funzione della maggior parte della proteine globulari è mediata dall interazione reversibile con
Modulo 4 Una proteina in azione Mioglobina ed emoglobina: un esempio di funzionamento di una proteina La funzione della maggior parte della proteine globulari è mediata dall interazione reversibile con
Mioglobina Emoglobina
 Mioglobina Emoglobina Eventi successivi i alla comparsa dell O 2 Possibilità di ottenere circa 20 volte più energia dalla combustione del glucosio Sviluppo di un sistema circolatorio per la distribuzione
Mioglobina Emoglobina Eventi successivi i alla comparsa dell O 2 Possibilità di ottenere circa 20 volte più energia dalla combustione del glucosio Sviluppo di un sistema circolatorio per la distribuzione
GLI ENZIMI ALLOSTERICI hanno più subunità che agiscono in maniera cooperativa. La cinetica enzimatica ha un andamento SIGMOIDE (non MM)
 Effetti allosterici - Modelli d azione GLI ENZIMI ALLOSEICI hanno più subunità che agiscono in maniera cooperativa. La cinetica enzimatica ha un andamento SIGMOIDE (non MM) Negli enzimi allosterici le
Effetti allosterici - Modelli d azione GLI ENZIMI ALLOSEICI hanno più subunità che agiscono in maniera cooperativa. La cinetica enzimatica ha un andamento SIGMOIDE (non MM) Negli enzimi allosterici le
Esempi di proteine: Mioglobina ed Emoglobina
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Esempi di proteine: Mioglobina ed Emoglobina Mioglobina: caratteristiche generali, funzione
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Esempi di proteine: Mioglobina ed Emoglobina Mioglobina: caratteristiche generali, funzione
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO
 EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Trasporto dell ossigeno In tutti gli animali superiori, il metabolismo è aerobico L energia che si può estrarre dal glucosio
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Trasporto dell ossigeno In tutti gli animali superiori, il metabolismo è aerobico L energia che si può estrarre dal glucosio
Emoglobina e mioglobina
 Emoglobina e mioglobina Per molti organismi, l O 2 è una molecola di importanza vitale: l'ossigeno è infatti l'accettore finale degli elettroni, che "fluendo" attraverso i complessi della catena respiratoria,
Emoglobina e mioglobina Per molti organismi, l O 2 è una molecola di importanza vitale: l'ossigeno è infatti l'accettore finale degli elettroni, che "fluendo" attraverso i complessi della catena respiratoria,
Ripiegamento e stabilità delle proteine
 Ripiegamento e stabilità delle proteine Ripiegamento e stabilità delle proteine La conformazione nativa di una proteina è quella a cui si associa la sua funzione biologica. Il termine stabilità può essere
Ripiegamento e stabilità delle proteine Ripiegamento e stabilità delle proteine La conformazione nativa di una proteina è quella a cui si associa la sua funzione biologica. Il termine stabilità può essere
Esempi di proteine: Mioglobina ed Emoglobina
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica Organica e Biochimica Esempi di proteine: Mioglobina ed Emoglobina Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica Organica e Biochimica Esempi di proteine: Mioglobina ed Emoglobina Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base
STRUTTURA E FUNZIONE
 STRUTTURA E FUNZIONE O 2 non solubile in acqua Esistono due proteine che permettono il trasporto di O 2 nel corpo emoglobina (Hb) si trova nei globuli rossi Trasporta anche CO 2 and H + Mioglobina (Mb)
STRUTTURA E FUNZIONE O 2 non solubile in acqua Esistono due proteine che permettono il trasporto di O 2 nel corpo emoglobina (Hb) si trova nei globuli rossi Trasporta anche CO 2 and H + Mioglobina (Mb)
Emoglobina e mioglobina
 Emoglobina e mioglobina Per poter parlare in modo comprensibile dell emoglobina (Hb), è utile occuparsi prima della mioglobina (Mb) che è molto simile all emoglobina ma è molto più semplice. Tra emoglobina
Emoglobina e mioglobina Per poter parlare in modo comprensibile dell emoglobina (Hb), è utile occuparsi prima della mioglobina (Mb) che è molto simile all emoglobina ma è molto più semplice. Tra emoglobina
Ruolo delle globine nel trasporto e nell immagazzinamento dell ossigeno
 Ruolo delle globine nel trasporto e nell immagazzinamento dell ossigeno Eritrociti umani Ciascun eritrocita contiene circa 300 milioni di molecole di emoglobina Possiedono un motivo strutturale comune.
Ruolo delle globine nel trasporto e nell immagazzinamento dell ossigeno Eritrociti umani Ciascun eritrocita contiene circa 300 milioni di molecole di emoglobina Possiedono un motivo strutturale comune.
Mioglobina ed emoglobina
 Mioglobina ed emoglobina α β Muscolo Deposito di O 2 Alta affinità per O 2 β α Globulo rosso Trasporto di O 2 Bassa affinità per O 2 Cooperativa ed allosterica Animali Mb-knockout (2003) : funzionalità
Mioglobina ed emoglobina α β Muscolo Deposito di O 2 Alta affinità per O 2 β α Globulo rosso Trasporto di O 2 Bassa affinità per O 2 Cooperativa ed allosterica Animali Mb-knockout (2003) : funzionalità
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Nel corso dell evoluzione, con il passaggio dalla. progressivamente differenziati due meccanismi. un sistema circolatorio adeguato;
 PROTEINE RESPIRATORIE EMOGLOBINA & MIOGLOBINA Nel corso dell evoluzione, con il passaggio dalla vita anaerobia alla vita aerobia si sono progressivamente differenziati due meccanismi che sono in grado
PROTEINE RESPIRATORIE EMOGLOBINA & MIOGLOBINA Nel corso dell evoluzione, con il passaggio dalla vita anaerobia alla vita aerobia si sono progressivamente differenziati due meccanismi che sono in grado
Regolano il metabolismo, sia come enzimi, sia come ormoni (insulina, glucagone, ecc.)
 Grazie alla elevata dinamicità delle strutture proteiche (gli atomi sono in continuo movimento fluttuante) e per la capacità che hanno di legarsi in modo selettivo ad altre molecole, le proteine svolgono
Grazie alla elevata dinamicità delle strutture proteiche (gli atomi sono in continuo movimento fluttuante) e per la capacità che hanno di legarsi in modo selettivo ad altre molecole, le proteine svolgono
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO
 EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Trasporto dell ossigeno In tutti gli animali superiori, il metabolismo è aerobico L energia che si può estrarre dal glucosio
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Trasporto dell ossigeno In tutti gli animali superiori, il metabolismo è aerobico L energia che si può estrarre dal glucosio
- natura riduttiva - richiede energia
 - natura ossidativa - produce energia - natura riduttiva - richiede energia 1 L O 2 è poco solubile in acqua (10 ml/l a 20 C): se esso fosse semplicemente disciolto, potrebbe diffondere efficacemente solo
- natura ossidativa - produce energia - natura riduttiva - richiede energia 1 L O 2 è poco solubile in acqua (10 ml/l a 20 C): se esso fosse semplicemente disciolto, potrebbe diffondere efficacemente solo
Il metalloma Struttura e reattività di metalloproteine. Il trasporto dell O 2
 Il metalloma Struttura e reattività di metalloproteine Il trasporto dell O 2 Il trasporto dell ossigeno Nel sangue la solubilità dell O 2 è molto maggiore che in H 2 O In H 2 O la solubilità è 6.59 cm
Il metalloma Struttura e reattività di metalloproteine Il trasporto dell O 2 Il trasporto dell ossigeno Nel sangue la solubilità dell O 2 è molto maggiore che in H 2 O In H 2 O la solubilità è 6.59 cm
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA
 PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Legano reversibilmente l OSSIGENO. La mioglobina (monomerica) è presente nelle cellule muscolari. L emoglobina (tetramerica) è presente negli
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Legano reversibilmente l OSSIGENO. La mioglobina (monomerica) è presente nelle cellule muscolari. L emoglobina (tetramerica) è presente negli
EMOGLOBINA (Hb) nei globuli rossi e
 Nel metabolismo aerobio l O 2 è l accettore finale nel mitocondrio degli elettroni liberati dai composti carboniosi Proteine leganti l O 2 sono EMOGLOBINA (Hb) nei globuli rossi e MIOGLOBINA nelle fibre
Nel metabolismo aerobio l O 2 è l accettore finale nel mitocondrio degli elettroni liberati dai composti carboniosi Proteine leganti l O 2 sono EMOGLOBINA (Hb) nei globuli rossi e MIOGLOBINA nelle fibre
EME (Fe-PROTOPORFIRINA IX)
 EME (Fe-PROTOPORFIRINA IX) 1,3,5,8-tetrametil 2,4-divinil 6,7-dipropionil-porfirina 1 Il ferro può formare sei legami di coordinazione 4 con gli azoti dell anello tetrapirrolico 2 perpendicolari al piano
EME (Fe-PROTOPORFIRINA IX) 1,3,5,8-tetrametil 2,4-divinil 6,7-dipropionil-porfirina 1 Il ferro può formare sei legami di coordinazione 4 con gli azoti dell anello tetrapirrolico 2 perpendicolari al piano
Eventi successivi alla comparsa dell O 2
 Eventi successivi alla comparsa dell O 2 Possibilità di ottenere circa 20 volte più energia dalla combustione del glucosio Sviluppo di un sistema circolatorio per la distribuzione dell ossigeno: infatti,
Eventi successivi alla comparsa dell O 2 Possibilità di ottenere circa 20 volte più energia dalla combustione del glucosio Sviluppo di un sistema circolatorio per la distribuzione dell ossigeno: infatti,
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE
 FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE Principi basilari: 1.Le funzioni di molte proteine richiedono il legame reversibile con altre molecole (LIGANDO) Un ligando può essere di natura diversa,
FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE Principi basilari: 1.Le funzioni di molte proteine richiedono il legame reversibile con altre molecole (LIGANDO) Un ligando può essere di natura diversa,
LEZIONE 25: EMOGLOBINA L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO
 LEZIONE 25: EMOGLOBINA L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 25_emoglobina 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata
LEZIONE 25: EMOGLOBINA L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 25_emoglobina 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata
EMOGLOBINA (Hb) nei globuli rossi e
 Nel metabolismo aerobio l O 2 è l accettore finale nel mitocondrio degli elettroni liberati dai composti carboniosi Proteine leganti l O 2 sono EMOGLOBINA (Hb) nei globuli rossi e MIOGLOBINA nelle fibre
Nel metabolismo aerobio l O 2 è l accettore finale nel mitocondrio degli elettroni liberati dai composti carboniosi Proteine leganti l O 2 sono EMOGLOBINA (Hb) nei globuli rossi e MIOGLOBINA nelle fibre
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO
 L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
Emoglobina e mioglobina
 Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
Il legame dell O 2 con l eme di una subunità determina un cambio conformazionale che facilita l attacco dell O 2 agli altri gruppi eme.
 1 Forma T Forma R Il legame dell O 2 con l eme di una subunità determina un cambio conformazionale che facilita l attacco dell O 2 agli altri gruppi eme. 2 1 3 La forma sigmoide della curva indica che
1 Forma T Forma R Il legame dell O 2 con l eme di una subunità determina un cambio conformazionale che facilita l attacco dell O 2 agli altri gruppi eme. 2 1 3 La forma sigmoide della curva indica che
Trasporto gas nel sangue
 Trasporto gas nel sangue Trasporto O2 97% legato all Hb nei globuli rossi 3% fisicamente disciolto, determina il valore di po 2 97% 3% O 2 disciolto nel plasma O 2 legato ad Hb Saturazione Hb 97% 0.3 ml/100ml
Trasporto gas nel sangue Trasporto O2 97% legato all Hb nei globuli rossi 3% fisicamente disciolto, determina il valore di po 2 97% 3% O 2 disciolto nel plasma O 2 legato ad Hb Saturazione Hb 97% 0.3 ml/100ml
Le proteine che legano ossigeno:
 Le proteine che legano ossigeno: . I cristalli si ottengono per precipitazione lenta della molecola da una soluzione, in condizioni che non dovrebbero alterare la sua struttura Un cristallo proteico È
Le proteine che legano ossigeno: . I cristalli si ottengono per precipitazione lenta della molecola da una soluzione, in condizioni che non dovrebbero alterare la sua struttura Un cristallo proteico È
Trasporto di O 2 nel sangue
 Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA
 PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA PROTEINE Una proteina è basilarmente una catena polipeptidica (che in termini chimici può anche essere definita
PROTEINE: STRUTTURA, ESEMPI E FUNZIONAMENTO TUTORATO 1 GIULIANO F. PATANÈ COLLEGIO A. VOLTA PROTEINE Una proteina è basilarmente una catena polipeptidica (che in termini chimici può anche essere definita
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
degli eritrociti è una proteina di trasporto indispensabile per veicolare l ossigeno l l anidride carbonica tra i polmoni e i tessuti
 l emoglobina degli eritrociti è una proteina di trasporto indispensabile per veicolare l ossigeno l e l anidride carbonica tra i polmoni e i tessuti Mioglobina, proteina di deposito,, presente nelle fibrocellule
l emoglobina degli eritrociti è una proteina di trasporto indispensabile per veicolare l ossigeno l e l anidride carbonica tra i polmoni e i tessuti Mioglobina, proteina di deposito,, presente nelle fibrocellule
Le proteine III. Corso di Biochimica 1. Prof. Giuseppina Pitari
 Le proteine III Corso di Biochimica 1 Prof. Giuseppina Pitari Ossi-mioglobina legame idrogeno lato distale La mioglobina L eme quindi consiste di una struttura organica alla quale è legato un atomo di
Le proteine III Corso di Biochimica 1 Prof. Giuseppina Pitari Ossi-mioglobina legame idrogeno lato distale La mioglobina L eme quindi consiste di una struttura organica alla quale è legato un atomo di
Ogni globina ha una tasca in cui lega un gruppo EME, quindi l Hb può legare e trasportare 4 molecole di O 2
 Emoglobina (Hb): tetramero (le globine si associano formando due copie di dimeri αβ (α 1 β 1 e α 2 β 2 ) che si associano a formare un tetramero attraverso interazioni idrofobiche, legami H e ponti salini
Emoglobina (Hb): tetramero (le globine si associano formando due copie di dimeri αβ (α 1 β 1 e α 2 β 2 ) che si associano a formare un tetramero attraverso interazioni idrofobiche, legami H e ponti salini
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU)
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
Emoglobina e mioglobina
 Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
Trasporto dei gas. Pressioni Volumi
 Trasporto dei gas Pressioni Volumi Il 97% dell O 2 trasportato nel plasma si trova chimicamente legato all Hb nei globuli rossi, solo lo 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O
Trasporto dei gas Pressioni Volumi Il 97% dell O 2 trasportato nel plasma si trova chimicamente legato all Hb nei globuli rossi, solo lo 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O
Gli Enzimi. catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche
 catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche Gli Enzimi Sono le proteine più importanti e più specializzate Presentano un elevato grado di specificità per
catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche Gli Enzimi Sono le proteine più importanti e più specializzate Presentano un elevato grado di specificità per
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
θ = (siti occupati)/(siti disponibili totali) Al numeratore ritrovo solo la mioglobina che ha complessato l'ossigeno, solo l'ossigenata)
 LEZIONE DEL 03/04/2017 Emoglobina - complesso del metallo di transizione (ferro protoporfirina IX) complesso metallorganico. Derivazione della curva di legame iperbolica dell'ossigeno della mioglobina
LEZIONE DEL 03/04/2017 Emoglobina - complesso del metallo di transizione (ferro protoporfirina IX) complesso metallorganico. Derivazione della curva di legame iperbolica dell'ossigeno della mioglobina
scaricato da I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE
 Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Legame peptidico I peptidi risultano dall unione di due o più aminoacidi mediante un legame COVALENTE tra il gruppo amminico di un aminoacido ed il gruppo carbossilico di un altro. 1 Catene contenenti
Regolazione allosterica
 Macromolecole Biologiche Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Regolazione allosterica Marco Nardini Dipartimento
Macromolecole Biologiche Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Regolazione allosterica Marco Nardini Dipartimento
MIOGLOBINA ED EMOGLOBINA
 MIOGLOBINA ED EMOGLOBINA Il passaggio dalla vita anaerobia al metabolismo di tipo aerobico ha rappresentato un vantaggio energetico incredibile. L ossigeno è assolutamente indispensabile per il metabolismo,
MIOGLOBINA ED EMOGLOBINA Il passaggio dalla vita anaerobia al metabolismo di tipo aerobico ha rappresentato un vantaggio energetico incredibile. L ossigeno è assolutamente indispensabile per il metabolismo,
Trasporto O 2 nel sangue
 Trasporto O 2 nel sangue 97% legato all Hb nei globuli rossi 3% fisicamente disciolto (determina il valore di po 2 ) Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb Saturazione Hb 97% 0.3 ml/100ml
Trasporto O 2 nel sangue 97% legato all Hb nei globuli rossi 3% fisicamente disciolto (determina il valore di po 2 ) Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb Saturazione Hb 97% 0.3 ml/100ml
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. Prof. Augusto Parente. Lezione 7. DiSTABiF. Corso di Laurea in SCIENZE BIOLOGICHE
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in SCIENZE BIOLOGICHE Insegnamento di CHIMICA BIOLOGICA Prof. Augusto Parente Anno Accademico 2014-15 Lezione 7 Mioglobina Emoglobina po
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in SCIENZE BIOLOGICHE Insegnamento di CHIMICA BIOLOGICA Prof. Augusto Parente Anno Accademico 2014-15 Lezione 7 Mioglobina Emoglobina po
COMPOSTI AZOTATI. derivanti dall ammoniaca AMMINE. desinenza -INA AMMIDE
 COMPOSTI AZOTATI derivanti dall ammoniaca AMMINE desinenza -INA AMMIDE ANCORA AMMIDI RISONANZA A M M I D I Il legame ammidico ha parziale carattere di doppio legame per la seguente risonanza: Ammidi H
COMPOSTI AZOTATI derivanti dall ammoniaca AMMINE desinenza -INA AMMIDE ANCORA AMMIDI RISONANZA A M M I D I Il legame ammidico ha parziale carattere di doppio legame per la seguente risonanza: Ammidi H
ACQUISIZIONE SPERIMENTALE DELLA CONOSCENZA NELLE SCIENZE DELLA NATURA.
 CLM C IN MEDICINA E CHIRURGIA C.I. Metodologia medico-scientifica di base II (Scienze umane 2 Epistemologia) A.A. 2013-2014 I anno, 2 semestre ACQUISIZIONE SPERIMENTALE DELLA CONOSCENZA NELLE SCIENZE DELLA
CLM C IN MEDICINA E CHIRURGIA C.I. Metodologia medico-scientifica di base II (Scienze umane 2 Epistemologia) A.A. 2013-2014 I anno, 2 semestre ACQUISIZIONE SPERIMENTALE DELLA CONOSCENZA NELLE SCIENZE DELLA
Gli Enzimi. catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche
 catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche Gli Enzimi Sono le proteine più importanti e più specializzate Presentano un elevato grado di specificità per
catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche Gli Enzimi Sono le proteine più importanti e più specializzate Presentano un elevato grado di specificità per
Lo scambio gassoso negli animali
 Lo scambio gassoso negli animali Durante la RESPIRAZIONE CELLULARE (mitocondri) le cellule consumano O2 e producono CO2 L approvvigionamento di O2 e la rimozione della CO2 avvengono tramite SCAMBI GASSOSI
Lo scambio gassoso negli animali Durante la RESPIRAZIONE CELLULARE (mitocondri) le cellule consumano O2 e producono CO2 L approvvigionamento di O2 e la rimozione della CO2 avvengono tramite SCAMBI GASSOSI
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 10
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 10 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 10 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
Dipartimento di Biochimica e Biofisica F. Cedrangolo Emoglobina ed introduzione alle emoglobinopatie.
 Dipartimento di Biochimica e Biofisica F. Cedrangolo Emoglobina ed introduzione alle emoglobinopatie. Trasportatori di Ossigeno nei Vertebrati Mioglobina Emoglobina Muscoli Sangue L Emoglobina (Hb) Struttura
Dipartimento di Biochimica e Biofisica F. Cedrangolo Emoglobina ed introduzione alle emoglobinopatie. Trasportatori di Ossigeno nei Vertebrati Mioglobina Emoglobina Muscoli Sangue L Emoglobina (Hb) Struttura
Riabilitativa 2015/2016
 Emoglobina e collageno Spina Riabilitativa 2015/2016 WWW.SUNHOPE.IT Alla grande varietà di strutture tridimensionali corrisponde una grande varietà di funzioni Ogni proteina presenta diversi livelli di
Emoglobina e collageno Spina Riabilitativa 2015/2016 WWW.SUNHOPE.IT Alla grande varietà di strutture tridimensionali corrisponde una grande varietà di funzioni Ogni proteina presenta diversi livelli di
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
Fisiologia della Respirazione 8.Trasporto dei gas nel sangue. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 Fisiologia della Respirazione 8.Trasporto dei gas nel sangue Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Obiettivi Necessità di un sistema di trasporto chimico ad alta capacità
Fisiologia della Respirazione 8.Trasporto dei gas nel sangue Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Obiettivi Necessità di un sistema di trasporto chimico ad alta capacità
Fisiologia della Respirazione
 Fisiologia della Respirazione 8.Trasporto dei gas nel sangue FGE aa.2016-17 Obiettivi Necessità di un sistema di trasporto chimico ad alta capacità dell O 2 nel sangue: l emoglobina Curva di dissociazione
Fisiologia della Respirazione 8.Trasporto dei gas nel sangue FGE aa.2016-17 Obiettivi Necessità di un sistema di trasporto chimico ad alta capacità dell O 2 nel sangue: l emoglobina Curva di dissociazione
LE PROTEINE: POLIMERI COSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOACIDI
 LE PROTEINE: POLIMERI OSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOAIDI OGNI PROTEINA PUO ESSERE FORMATA DA MOLTE DEINE O ENTINAIA DI AMINOAIDI E SI LEGANO A FORMARE UNA ATENA NON RAMIFIATA La catena di
LE PROTEINE: POLIMERI OSTITUITI DA 20 TIPI DI MONOMERI, I 20 AMINOAIDI OGNI PROTEINA PUO ESSERE FORMATA DA MOLTE DEINE O ENTINAIA DI AMINOAIDI E SI LEGANO A FORMARE UNA ATENA NON RAMIFIATA La catena di
Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O2 dagli alveoli al sangue e della
 Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O2 dagli alveoli al sangue e della CO2 in direzione opposta. R = quoziente respiratorio,
Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O2 dagli alveoli al sangue e della CO2 in direzione opposta. R = quoziente respiratorio,
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi. Possono assumere forme diverse a seconda della funzione
 Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
Le proteine sono polimeri lineari costituiti da unità base formate da oltre 40 amminoacidi Hanno elevato PM Possono assumere forme diverse a seconda della funzione svolgono molteplici funzioni Tra le proteine
AMMINOACIDI. Gli amminoacidi si distinguono in base alla diversità della catena laterale R in ciascuno di essi.
 AMMINOACIDI Gli amminoacidi sono composti polifunzionali, infatti essi presentano sia un gruppo carbossilico, che conferisce loro caratteristiche acide, sia un gruppo amminico, che conferisce loro caratteristiche
AMMINOACIDI Gli amminoacidi sono composti polifunzionali, infatti essi presentano sia un gruppo carbossilico, che conferisce loro caratteristiche acide, sia un gruppo amminico, che conferisce loro caratteristiche
20/12/ tipi di amino acidi: parecchie combinazioni
 20 tipi di amino acidi: parecchie combinazioni Le proteine sono polimeri di amino acidi 1 SEMPLICI : costituite solo da amino acidi PROTEINE CONIUGATE Apoproteina = parte proteica Gruppo prostetico = parte
20 tipi di amino acidi: parecchie combinazioni Le proteine sono polimeri di amino acidi 1 SEMPLICI : costituite solo da amino acidi PROTEINE CONIUGATE Apoproteina = parte proteica Gruppo prostetico = parte
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
LE PROTEINE -struttura tridimensionale-
 LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Ceruloplasmina Cosa sono??? Sono biopolimeri con forme ben definite. composti da molteplici amminoacidi, legati con legami peptidici
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
 Gruppo EME α β δ ϒ ζ ε A A2 α2β2 97-98 α2δ2 2-3 F Gower1 Gower2 Portland α2 ϒ2 < 1 ζ2ε2 0 α2ε2 0 ζ2ϒ2 0 Periodo fetale Periodo postnatale Varianti strutturali dell emoglobina Emoglobina anomala HbS
Gruppo EME α β δ ϒ ζ ε A A2 α2β2 97-98 α2δ2 2-3 F Gower1 Gower2 Portland α2 ϒ2 < 1 ζ2ε2 0 α2ε2 0 ζ2ϒ2 0 Periodo fetale Periodo postnatale Varianti strutturali dell emoglobina Emoglobina anomala HbS
Regolazione dell attività enzimatica. Allosteria Modificazioni covalenti Isoenzimi
 Regolazione dell attività enzimatica Allosteria Modificazioni covalenti Isoenzimi Regolazione della attività enzimatica L attività enzimatica deve potere essere regolata in base alle specifiche richieste
Regolazione dell attività enzimatica Allosteria Modificazioni covalenti Isoenzimi Regolazione della attività enzimatica L attività enzimatica deve potere essere regolata in base alle specifiche richieste
STRUTTURA TRIDIMENSIONALE DELLE PROTEINE
 STRUTTURA TRIDIMENSIONALE DELLE PROTEINE Biologia della Cellula Animale 2016 1 STRUTTURA PROTEINE Cooper: The Cell, a Molecular Approach, 2 nd ed. http://en.wikipedia.org/wiki/protein_structure STRUTTURA
STRUTTURA TRIDIMENSIONALE DELLE PROTEINE Biologia della Cellula Animale 2016 1 STRUTTURA PROTEINE Cooper: The Cell, a Molecular Approach, 2 nd ed. http://en.wikipedia.org/wiki/protein_structure STRUTTURA
Principali meccanismi attraverso i quali una mutazione provoca una patologia
 Principali meccanismi attraverso i quali una mutazione provoca una patologia v Perdita di funzione v Acquisizione di funzione v Produzione di un peptide che, oltre a non svolgere la normale funzione, interferisce
Principali meccanismi attraverso i quali una mutazione provoca una patologia v Perdita di funzione v Acquisizione di funzione v Produzione di un peptide che, oltre a non svolgere la normale funzione, interferisce
Foto funzioni apparato respiratorio
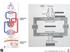 RESPIRAZIONE ESTERNA Foto funzioni apparato respiratorio RESPIRAZIONE INTERNA GLI SCAMBI GASSOSI QUOZIENTE RESPIRATORIO = CO 2 PRODOTTA O 2 CONSUMATO A riposo: Epitelio alveolare 200 ml/min 250 ml/min
RESPIRAZIONE ESTERNA Foto funzioni apparato respiratorio RESPIRAZIONE INTERNA GLI SCAMBI GASSOSI QUOZIENTE RESPIRATORIO = CO 2 PRODOTTA O 2 CONSUMATO A riposo: Epitelio alveolare 200 ml/min 250 ml/min
MACROMOLECOLE. Polimeri (lipidi a parte)
 MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
MACROMOLECOLE Monomeri Polimeri (lipidi a parte) Le caratteristiche strutturali e funzionali di una cellula o di un organismo sono determinate principalmente dalle sue proteine. Ad esempio: Le proteine
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA
 PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
a) un movimento contro gradiente di concentrazione che utilizza fonti primarie di energia
 1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
Ruolo chiave nella Protein Science Cristallizzata nel 1840 Handbook of Hb crystals 1909 (Reichert & Brown)
 Mb & Hb EMOGLOBINA Ruolo chiave nella Protein Science Cristallizzata nel 1840 Handbook of Hb crystals 1909 (Reichert & Brown) 1 proteina caratterizzata t in ultracentrifuga t 1 proteina a funzione fisiologica
Mb & Hb EMOGLOBINA Ruolo chiave nella Protein Science Cristallizzata nel 1840 Handbook of Hb crystals 1909 (Reichert & Brown) 1 proteina caratterizzata t in ultracentrifuga t 1 proteina a funzione fisiologica
Proteine: struttura e funzione
 Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
Funzioni delle proteine
 Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
Funzioni delle proteine ENZIMI Proteine di trasporto Proteine di riserva Proteine contrattili o motili Proteine strutturali Proteine di difesa Proteine regolatrici Proteine di trasporto Emoglobina Lipoproteine
Cara1eris4che della Hb
 Emoglobina A (α2β2) Cara1eris4che della Hb Legame Eme-catena polipeptidica dovuto alla coniugazione del Fe con l anello imidazolico della istidina in posizione 58 per α e 63 per β. L eme è una protoporfirina
Emoglobina A (α2β2) Cara1eris4che della Hb Legame Eme-catena polipeptidica dovuto alla coniugazione del Fe con l anello imidazolico della istidina in posizione 58 per α e 63 per β. L eme è una protoporfirina
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
end-on (h 1 ) L = NH 3, CN - L Chimica Inorganica Biologica Il diossigeno O 2 Reazioni tra O 2 e metalli: ossidoriduzioni e complessi
 Il diossigeno O 2 Reazioni tra O 2 e metalli: ossidoriduzioni e complessi 4Fe 2+ + O 2 + 2H 2 O + 8 OH - 4(FeOH) 3 2Fe 2 O 3 + H 2 O O 2 interagisce con i metalli ossidandoli e passando allo stato di ox
Il diossigeno O 2 Reazioni tra O 2 e metalli: ossidoriduzioni e complessi 4Fe 2+ + O 2 + 2H 2 O + 8 OH - 4(FeOH) 3 2Fe 2 O 3 + H 2 O O 2 interagisce con i metalli ossidandoli e passando allo stato di ox
I PROTIDI ASPETTI GENERALI
 I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
ammoniaca ammina primaria ammina terziaria ammina secondaria R N H 2
 gruppo funzionale amminico N ammoniaca R N R N R R N R R ammina primaria ammina secondaria ammina terziaria R N 2 Le ammine, come l ammoniaca, hanno carattere basico ed in soluzione acquosa accettano un
gruppo funzionale amminico N ammoniaca R N R N R R N R R ammina primaria ammina secondaria ammina terziaria R N 2 Le ammine, come l ammoniaca, hanno carattere basico ed in soluzione acquosa accettano un
Aminoacidi. Struttura generale Sono 20 e formano le
 Aminoacidi Struttura generale Sono 20 e formano le proteine. Oltre a questi ne esistono altri meno comuni Alcuni subiscono modificazioni dopo essere stati inseriti nelle proteine Altri stanno nell organismo
Aminoacidi Struttura generale Sono 20 e formano le proteine. Oltre a questi ne esistono altri meno comuni Alcuni subiscono modificazioni dopo essere stati inseriti nelle proteine Altri stanno nell organismo
CORSO MONODISCIPLINARE DI BIOCHIMICA (6 CFU)
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE DI BIOCHIMICA (6 CFU) Roberto Giacominelli Stuffler IL CORSO MONODISCIPLINARE DI BIOCHIMICA È SUDDIVISO IN DUE UNITÀ
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE DI BIOCHIMICA (6 CFU) Roberto Giacominelli Stuffler IL CORSO MONODISCIPLINARE DI BIOCHIMICA È SUDDIVISO IN DUE UNITÀ
