PROCESSI DI CONCENTRAZIONE PER MEMBRANA
|
|
|
- Clementina Marchetti
- 7 anni fa
- Visualizzazioni
Transcript
1 PROCESSI DI CONCENTRAZIONE PER MEMBRANA
2 Soluzioni stessa concentrazione isotoniche Concentrazioni diverse: quella a concentrazione maggiore ipertonica quella a concentrazione minore ipotonica
3 LA CONCENTRAZIONE OSMOTICA OSMOSI DIRETTA: flusso spontaneo di solvente (acqua) da una soluzione più diluita ad una più concentrata, separate una dall altra da una membrana adatta. membrana deve consentire il passaggio del solvente ma non dei saluti disciolti semipermeabilità Un processo "osmotico" è quindi caratterizzato da presenza di: soluzioni a diversa concentrazione membrana semipermeabile flusso di materia
4 b a =1 (potenziale chimico dell acqua pura) <1 potenziale chimico dell acqua + soluti b a <1 =1 b a OSMOSI Forza motrice
5 a a b b Se le due soluzioni hanno la stessa concentrazione in soluti, i potenziali chimici di a e b sono uguali e quindi attraverso la membrana non si verifica alcun flusso d acqua. Se la soluzione a è più concentrata in soluti, allora avrà un minor quantitativo di acqua, un minore potenziale chimico e dunque l acqua fluisce dalla soluzione b a quella a N.B. Quando i due potenziali chimici si eguagliano il processo osmotico si arresta
6 PRESSIONE OSMOTICA h a b πv= n RT equazione di Van't Hoff L aumento di volume in a determina un aumento della pressione idrostatica, che insiste sulla parete della membrana. Tale pressione equilibra e quindi fornisce la misura della pressione (osmotica) esercitata dal solvente che tende a passare dalla soluzione più diluita b alla più concentrata a π = pressione osmotica V = volume della soluzione R = costante costante dei gas perfetti T = temperatura assoluta n = n moli di soluto presenti in soluzione
7 APPLICAZIONI DELL'OSMOSI DIRETTA AGLI ALIMENTI Il processo osmotico può essere utilizzato nell'industria alimentare per ottenere una parziale disidratazione o concentrazione di alimenti aventi un elevato tenore in acqua. Ponendo infatti il materiale da disidratare ("soluzione ipotonica") a contatto con una soluzione ipertonica (ipertonica compatibile, atossica) Si viene a creare una flusso spontaneo di acqua (solvente) dall'interno del prodotto verso la soluzione concentrata. N.B. Le membrane cellulari (plasmatica e vacuolare) agiscono come membrane semipermeabili (es. la struttura cellulare superficiale dei pezzi di frutta agisce come una vera e propria membrana semipermeabile)
8
9 Vantaggi del processo di disidratazione osmotica processo effettuato a temperatura ambiente o poco superiore vengono minimizzati i danni termici a carico di colore, aroma, nutrienti termosensibili; miglioramento delle caratteristiche sensoriali (aroma, sapore, consistenza, ecc.) lo "strato" di zucchero intorno ai pezzi di frutta riduce l'imbrunimento enzimatico diminuzione acidità
10 Svantaggi del processo di disidratazione osmotica diminuzione dell'acidità può essere uno svantaggio per certi prodotti aggiunta di opportune quantità di acidi allo sciroppo disidratante; lo zucchero che residua sulla superficie del prodotto può essere indesiderato lavaggio in acqua corrente al termine del processo. eccessiva "lentezza" del processo a temperatura ambiente; scarsa "flessibilità" del processo dal punto di vista della scelta della temperatura: Problema riciclo e smaltimento sciroppi
11 Dipende da : VELOCITA' DI RIMOZIONE DELL'ACQUA Natura e concentrazione dell agente osmotico tempo di trattamento pressione Temperatura : per T >50 C pericolo NEB ed alterazione dei caratteri organolettici (sapore e aroma) agitazione
12 COMBINAZIONE CON ALTRE TECNICHE DI CONSERVAZIONE/TRASFORMAZIONE OSMOREFRIGERAZIONE OSMOCONGELAMETO OSMOESSICCAMENTO OSMOLIOFILIZZAZIONE BLANCHING (OSMOSI HTST)
13 OSMOSI INVERSA E ULTRAFILTRAZIONE L'osmosi inversa e l'ultrafiltrazione sono tecniche di concentrazione e separazione a livello molecolare caratterizzate dall'impiego di membrane altamente selettive sotto un gradiente di pressione come "forza motrice". I PRINCIPI DELL'OSMOSI INVERSA L'osmosi inversa è una tecnica che consente la separazione dell'acqua dalle sostanze in essa disciolte, siano esse molecole o ioni. - elemento filtrante membrana semipermeabile -di messa a punto relativamente recente - costituite da polimeri di sintesi (generalmente acetato di cellulosa).
14 La forza motrice che agisce nell'osmosi inversa non è la pressione applicata, ma la differenza (P - ) fra la pressione applicata e la pressione osmotica della soluzione che agisce in senso contrario. P a b
15 MEMBRANE CARATTERI S T A B I L I T A` TERMICA MECCANICA CHIMICA I a GENERAZIONE: ACETATO DI scarsa scarsa scarsa CELLULOSA (ph 3/8) II a GENERAZIONE: POLIMERI buona buona scarsa ai DI SINTESI detergenti (ph 2/12) III a GENERAZIONE: COMPONENTI ottima ottima buona MINERALI fino a 400 C tutti i ph
16 Le applicazioni pratiche nell'industria alimentare sono essenzialmente la concentrazione di succhi, estratti e soluzioni a temperatura ambiente. non si ricorre quindi all'allontanamento dell'acqua per evaporazione che comporta l'uso del calore e di conseguenza effetti negativi sulla qualità del prodotto.
17 DETERMINAZIONE DELLA PRESSIONE OSMOTICA DI UNA SOLUZIONE (per soluzioni diluite) = c RT /M equazione di Van't Hoff (dove T = K ; R = kpa m -3 mol -1 K -1 ; M = peso molecolare; c= concentrazione Kg / m 3 ; = kpa) Es.: soluzione di un monosaccaride con p.m. 180 e una conc. di 100 kg/ m 3 a temperatura ambiente (20 C=293 K). = 100/ = N/m 2 13 atm Es.: soluzione di saccarosio (p.m. = 342), stessa concentrazione = 100/ = N/m2 7 atm
18 = c RT /M la pressione osmotica è tanto più elevata quanto più piccola è la molecola considerata, quindi a parità di concentrazione, quanto più è elevato il numero di molecole in soluzione (proprietà colligativa). soluzioni di macromolecole hanno pressioni osmotiche molto basse, e ciò significa che in ultrafiltrazione i fenomeni osmotici sono trascurabili. N.B. Ad alte concentrazioni l'equazione di Van't Hoff fornisce dati non molto attendibili.
19 -Una espressione più accurata della pressione osmotica (valida per un range di concentrazione in soluti maggiore), è la seguente: = - (RT ln X A )/ V m equazione di Gibb dove V m = volume molare del solvente puro (m 3 /Kmol); X A = frazione molare del solvente puro Per frazione molare si intende il numero di moli di un componente in rapporto alle moli totali presenti (na / ntot = X A ) Es.: succo d arancia con 11% di solidi (PM 180) a temperatura ambiente (20 C=293 K) Kg solidi/ Kg di prodotto 0.89 Kg acqua / Kg di prodotto 0.89/18 X A = = / /180 1/V m = (0.89/18) V m = 0,019m 3 /mole = -[(8, )/0.019]ln = kpa kpa
20 kpa=15.52 atm kpa =15,62atm
21 La pressione osmotica dei liquidi zuccherini è molto elevata, e aumenta rapidamente all'aumentare della concentrazione. Il processo di osmosi inversa prevede quindi l'applicazione di pressioni molto elevate - di qualche decina di atmosfere più grandi delle pressioni osmotiche dei liquidi da concentrare - mentre la "forza motrice" del processo tende a ridursi rapidamente all'aumentare della concentrazione.
22 PERMEABILITÀ DELLE MEMBRANE Esprime la quantità di acqua separata per unità di superficie filtrante e per unità di tempo (in genere l/m 2 h). - concentrato è la soluzione che viene ritenuta - permeato è l'acqua che passa attraverso la membrana. equazione della permeabilità in osmosi inversa d V / d t = K A ( p - ) K = costante di permeabilità dipendente dalle caratteristiche della membrana e della soluzione trattata p = differenza di pressione idraulica ai due lati della membrana = differenza di pressione osmotica ai due lati della membrana
23 Meccanismo di trasporto dell'acqua attraverso la membrana L'opinione prevalente è che si tratti di un meccanismo di diffusione l'acqua dissolverebbe nel polimero della membrana e la sua migrazione avverrebbe per effetto del gradiente di pressione (meccanismo che avviene solo con membrane che possiedono una forte affinità per l'acqua: es. acetato di cellulosa, che finora ha dato i migliori risultati).
24 Bisogna però considerare che le membrane reali non sono perfettamente semipermeabili, infatti una quantità di soluto, sia pur minima, passa nel permeato. Si definisce ritenzione il valore: dove: R = 1 - Cp / Cs Cs è la concentrazione di una specie ionica nella soluzione Cp è la sua concentrazione nel permeato.
25 Spesso si considera la ritenzione percentuale. membrana perfettamente semipermeabile: Cp =0 e R = 100% membrana porosa: Cp = Cs e R = 0% (senza capacità di ritenzione per molecole e ioni). ritenzione inferiore al 100 % imperfezioni della membrana micropori (lasciano passare la soluzione tal quale). sostanze con comportamento simile all'acqua proprietà di dissolversi nel polimero passaggio nel permeato con lo stesso meccanismo ritenzione molto bassa, specie se hanno basso peso molecolare
26 Es: alcoli metilico ed etilico, acido acetico -composti organici polari di piccolo p.m. hanno ritenzione zero o molto piccola. zuccheri mono e disaccaridi - ritenzione anche del 100% per la difficoltà di passare nei micropori e la bassa velocità di migrazione nel polimero. % di ritenzione funzione di: 1. tipo di membrana 2. tipo di soluto 3. condizioni operative (pressione). aumento di pressione aumento di ritenzione compattamento della membrana (riduce gli effetti dovuti ai micropori) esaltata capacità di diffusione dell'acqua rispetto ai soluti.
27 Apparato di permeazione per osmosi inversa
28 ULTRAFILTRAZIONE
29
30 Particolato in sospensione microfiltrazione ultrafiltrazione macromolecole Sali, zuccheri osmosi inversa CUT OFF acqua
31 I PRINCIPI DELL'ULTRAFILTRAZIONE L'ultrafiltrazione agisce con un meccanismo di setacciamento del tutto identico a quello della filtrazione su membrana. Nell'ultrafiltrazione, a differenza della microfiltrazione, i pori delle membrane sono molto piccoli(dell'ordine dei millimicron) quindi 1000 volte più sottili delle membrane sterilizzanti. permettono la ritenzione delle macromolecole e lasciano passare le sostanze a basso peso molecolare Le applicazioni pratiche sono: concentrazione e purificazione di macromolecole in soluzioni complesse: vengono eliminati sali, acidi, zuccheri e qualunque altro composto a basso peso molecolare. Es: recupero delle proteine del siero di latte separazione dei sali, del lattosio, dell'acido lattico, ecc.
32 Fenomeni di polarizzazione La concentrazione della soluzione a contatto della membrana risulta, nel corso del processo, più alta della concentrazione media della massa del liquido fenomeno chiamato concentrazione di polarizzazione - Cs: concentrazione media della soluzione trattata; - Cpo: concentrazione nello strato polarizzato a contatto con la membrana; - Cpe: concentrazione media nel permeato. Cpe<Cs<Cpo Gli effetti pratici della concentrazione di polarizzazione sono negativi sia in osmosi inversa che in ultrafiltrazione.
33 in osmosi inversa: 1. diminuzione di permeabilità 2. diminuzione di ritenzione dei soluti. in ultrafiltrazione: 1. concentrazione di macromolecole alla superficie della membrana (può eventualmente aumentare la ritenzione dei costituenti in conseguenza dell'intasamento dei pori). 2. fenomeni di colmataggio che riducono la permeabilità.
34 Per minimizzare gli effetti della concentrazione di polarizzazione 1. si realizzano gli impianti di osmosi inversa e ultrafiltrazione con passaggio della soluzione tangenzialmente alla membrana e non alimentandola in direzione normale come per filtrazione tradizionale. 2. ottimizzazione condizioni del moto aumentando la velocità di passaggio della soluzione e turbolenza: più intenso rimescolamento negli strati a contatto della membrana e più rapida ridistribuzione delle molecole ritenute in tutta la massa della soluzione.
35 APPLICAZIONI DELL'OSMOSI INVERSA E DELL'ULTRAFILTRAZIONE NELL'INDUSTRIA ALIMENTARE APPLICAZIONI DELL'OSMOSI INVERSA L' O.I. consente la concentrazione di succhi e liquidi zuccherini senza provocare le alterazioni connesse ai normali processi di concentrazione per evaporazione. L'eliminazione dell'acqua avviene per pressione - senza passaggio di stato- quindi il costo energetico del processo dovrebbe essere inferiore a quello per evaporazione. - Ciò non sempre è vero e vanno distinte le singole applicazioni
36 LIMITI 1. concentrazione dei succhi di frutta - il processo prevede l'applicazione di pressioni molto elevate, essendo elevate le pressioni osmotiche in gioco. -es. un succo di mela o di arancia al 45% di solidi (valore relativamente basso per i concentrati di questi succhi) ha una p. o. vicina alle 100 atm, per cui, considerando gli effetti della concentrazione di polarizzazione, si deduce che non esistono impianti capaci di raggiungere tali livelli di pressione. 2. caratteristiche delle membrane -in genere sono di acetato di cellulosa, quindi molto delicate; inoltre non possono essere lavate e sanificate con i normali detergenti e disinfettanti. Ciò pone problemi di costo e problemi operativi non semplici.
37 3. effetti del colmataggio -possono essere rilevanti, specie quando i materiali (succhi) da concentrare contengono sostanze coloranti e fenoliche di natura tannica, che per affinità con la membrana si fissano alla superficie determinandone il rapido bloccaggio, anche dopo un eventuale lavaggio. 4. difficoltà nel controllo dello sviluppo microbico -a causa dei lunghi tempi del processo e delle temperature a cui esso viene condotto. In più non sempre è possibile l'aggiunta di sostante antisettiche.
38 Date queste limitazioni si possono avere le seguenti applicazioni: a) trattamento di soluzioni fortemente diluite ad es. concentrazione dall'1% al 5% in solidi poi evaporazione ( In questo caso l'osmosi inversa può risultare una tecnica più economica dell'evaporazione). trattamento di effluenti delle industrie dolciarie o dei succhi zuccherini, dove livelli dell'1% sono carichi inquinanti notevoli. preconcentrazione del siero di latte dal 6% fino al 15-20% in solidi poi concentrazione per evaporazione e successivo essiccamento. anche in questo caso si realizzano risparmi rispetto ad altre tecniche.
39 b) conseguimento di bassi rapporti di concentrazione di succhi pregiati destinati ad ulteriori elaborazioni miglioramento dell'economia di processi di liofilizzazione di succhi di frutta (es. arancia) preconcentrando il succo non oltre i Bx non si pregiudicano le fasi di congelamento e la stabilità del prodotto e si evitano successivi fenomeni di collassamento. concentrazione di mosti d'uva destinati a vinificazioni di qualità si porta il livello degli zuccheri al 18-20%, concentrazione più adeguata alla qualità del vino che si vuole ottenere. In questo caso il prodotto risulta migliore del mosto concentrato ottenuto per evaporazione.
40 c) trattamento acque di scarico - processi diretti o combinati con depurazione biologica si ottiene acqua depurata, mentre le sostanze biodegradabili vanno alle vasche di depurazione. d) trattamento di acque salmastre - nella produzione di acqua "ultrapura" (< 30 ppm) per l'alimentazione di caldaie o nella preparazione di soluzioni per dialisi.
41 Applicazioni dell'ultrafiltrazione stadio di applicazione industriale molto più avanzato rispetto all'osmosi inversa. diversi motivi: - l ultrafiltrazione svolge una funzione di separazione e purificazione non attuabile con altre tecniche. - l'o.i. è una tecnica di concentrazione, quindi in concorrenza con l'evaporazione, tecnica molto evoluta ed affidabile. - le membrane per u.f. sono costituite da polimeri resistenti a condizioni di ph estreme, quindi più affidabili e flessibili (lavaggio, detergenza, sanificazione ecc.), resistenti ad alte temperature e durevoli nel tempo (fino ad oltre 1 anno).
42 ultrafiltrazione del siero di latte - è l'applicazione che ha ricevuto il massimo interesse -sono presenti molti impianti nel mondo, con capacità fino ai 3000 qli/giorno di siero trattato. siero sottoprodotto della caseificazione, contiene lattosio, sali e proteine solubili, tutte sostanze di grande interesse alimentare per u.f. del siero si ottengono concentrati proteici: - elevato valore nutritivo delle proteine - interessanti caratteristiche funzionali come miglioratore e coadiuvante tecnologico
43 ALTRE APPLICAZIONI DELL'ULTRAFILTRAZIONE: latticello sottoprodotto della burrificazione recupero di proteine e grassi latte polveri ad alto titolo di proteine pretrattamento prima della caseificazione miglioramento della qualità della cagliata risparmio enzimi presamici più efficiente utilizzazione degli impianti ultrafiltrazione spinta fino alla eliminazione del % del permeato; il concentrato si trasforma direttamente in cagliata e passa come tale alla fase di maturazione. concentrazione e purificazione di enzimi. concentrazione dell'albume d'uovo, della gelatina, delle pectine, di proteine da estratti e sieri di estrazione di proteine vegetali, di proteine da plasma di sangue, ecc.
44 recupero dell'enzima, del substrato e separazione dei prodotti di reazione nei reattori enzimatici (es. idrolisi del lattosio nel latte, nel siero e nei relativi permeati di ultrafiltrazione, per inversione del saccarosio). chiarificazione di sciroppi, succhi e prodotti fermentati (vengono eliminati i microrganismi, ma anche i composti macromolecolari non flocculati). trattamento effluenti dell'industria della carne e del pesce con abbattimento del carico inquinante e recupero delle proteine. separazione di oli e grassi da emulsioni acquose (acque di lavaggio nella produzione di grassi animali, acque di vegetazione delle olive, recupero di trigliceridi dalle acque saponose di neutralizzazione degli oli).
45
46
47
48
49
50
51 TIPOLOGIE DI MEMBRANE
52
53
54 Membrane a spirale
55
56 La configurazione a spirale avvolta è scelta per la sua efficienza ed economia. È composta da due fogli di membrana e da particolari reti di spaziatura, il tutto arrotolato su di un tubo plastico forato (tubo permeato). La membrana è mantenuta rigida da una ricopertura esterna in vetroresina oppure da una rete rigida. Il liquido da trattare viene alimentato in pressione da un lato dell elemento. Per effetto della componente radiale della pressione, parte del liquido permea attraverso la membrana. Sempre per effetto della componente tangenziale della pressione il liquido non permeato viene spinto verso l uscita della membrana raccogliendo le particelle troppo grosse per essere filtrate e ripulendo di conseguenza la membrana stessa.
57 Membrane piane
58
59 Membrane tubolari
60
61
62
63 ELETTRODIALISI L'elettrodialisi è un processo elettrochimico di separazione applicata a soluzioni acquose nelle quali, sostanze chimiche sia inorganiche che organiche, si sciolgono e si dissociano in ioni rispettivamente positivi e negativi. La basilare proprietà di una soluzione acquosa di sostanze disciolte e dissociate (idrolisi) è quella di condurre elettricità, dando quindi luogo ad una conduttività elettrica. Immergendo nella soluzione due elettrodi di polarità opposta (positiva e negativa) è possibile far migrare gli ioni positivi verso l'elettrodo negativo e gli ioni negativi verso l'elettrodo positivo. Per impedire il rimescolamento degli ioni separati elettricamente si impiegano membrane permoselettive opportunamente collocate tra gli elettrodi.
64
65 Le membrane partecipano al processo in quanto nei loro microcanali sono presenti rispettivamente gruppi funzionali positivi (membrane anioniche) che permettono soltanto il passaggio di ioni con carica negativa, e gruppi funzionali negativi (membrane cationiche) che permettono soltanto il passaggio di ioni con carica positiva. Attraverso la migrazione ionica selettiva è possibile raccogliere, ricostruire e/o concentrare in celle adiacenti alla cella del grezzo da trattare, la sostanza che si intende isolare. La separazione più elementare di un sale inorganico, ad esempio cloruro sodico, da un grezzo di lavorazione, è schematicamente rappresentata nella figura qui sotto.
66 A differenza di tutti gli altri sistemi di separazione/ concentrazione per membrana, l elettrodialisi utilizza membrane permeabili agli ioni ma non all acqua. Il processo di elettrodialisi non rimuove materiali colloidali, batteri e sostanze non ioniche. Utilizzato per la desalificazione delle acqua
Le attrezzature di filtrazione e la filtrazione tangenziale
 Le attrezzature di filtrazione e la filtrazione tangenziale Dott.ssa Valentina Canuti GESAAFvia Donizetti, 6 Firenze Sez. Tecnologie Alimentari e Microbiologia email valentina.canuti@unifi.it Classificazione
Le attrezzature di filtrazione e la filtrazione tangenziale Dott.ssa Valentina Canuti GESAAFvia Donizetti, 6 Firenze Sez. Tecnologie Alimentari e Microbiologia email valentina.canuti@unifi.it Classificazione
pressione esercitata dalle molecole di gas in equilibrio con Si consideri una soluzione di B in A. Per una soluzione ideale
 PROPRIETA COLLIGATIVE Proprietà che dipendono solo dal numero di particelle presenti in soluzione 1. TENSIONE DI VAPORE 2. INNALZAMENTO EBULLIOSCOPICO 3. ABBASSAMENTO CRIOSCOPICO 4. PRESSIONE OSMOTICA
PROPRIETA COLLIGATIVE Proprietà che dipendono solo dal numero di particelle presenti in soluzione 1. TENSIONE DI VAPORE 2. INNALZAMENTO EBULLIOSCOPICO 3. ABBASSAMENTO CRIOSCOPICO 4. PRESSIONE OSMOTICA
PROPRIETA DELLE SOLUZIONI ACQUOSE. Prof.ssa Patrizia Gallucci
 PROPRIETA DELLE SOLUZIONI ACQUOSE Prof.ssa Patrizia Gallucci L'acqua è un composto chimicamente semplice, formato da due atomi di idrogeno e uno di ossigeno (H2O), che riveste fondamentale importanza in
PROPRIETA DELLE SOLUZIONI ACQUOSE Prof.ssa Patrizia Gallucci L'acqua è un composto chimicamente semplice, formato da due atomi di idrogeno e uno di ossigeno (H2O), che riveste fondamentale importanza in
Le proprietà colligative delle soluzioni
 1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
1 Approfondimento 1.3 Le proprietà colligative delle soluzioni In un solvente puro, cioè senza soluti disciolti in esso, le molecole sono libere di interagire tra loro, attraendosi. L aggiunta di un soluto
Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea.
 Le Miscele Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea. Se le proprietà sono uniformi, la miscela è una miscela omogenea
Le Miscele Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea. Se le proprietà sono uniformi, la miscela è una miscela omogenea
Proprietà colligative
 Proprietà colligative Le proprietà che dipendono dalla proporzione tra le molecole del soluto e quelle del solvente ma non dall identità chimica del soluto si dicono proprietà colligative. Le proprietà
Proprietà colligative Le proprietà che dipendono dalla proporzione tra le molecole del soluto e quelle del solvente ma non dall identità chimica del soluto si dicono proprietà colligative. Le proprietà
1. Perché le sostanze si sciolgono?
 1. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
1. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
Capitolo 14 Le proprietà delle soluzioni
 Capitolo 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Capitolo 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 17 Le proprietà delle soluzioni 3 Sommario (I) 1. Perché le sostanze si sciolgono? 2. Soluzioni acquose ed elettroliti 3. La
1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le
 Unità n 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
Unità n 14 Le proprietà delle soluzioni 1. Perché le sostanze si sciolgono 2. Soluzioni acquose ed elettroliti 3. La concentrazione delle soluzioni 4. L effetto del soluto sul solvente: le proprietà colligative
STATO LIQUIDO. Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso
 STATO LIQUIDO Caratteristiche: Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso intermolecolare I legami intermolecolari sono responsabili
STATO LIQUIDO Caratteristiche: Volume proprio Forma non definita Particelle moderatamente ordinate Energia cinetica delle particelle è dello stesso intermolecolare I legami intermolecolari sono responsabili
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
Università degli Studi Guglielmo Marconi
 Osmosi inversa, ultrafiltrazione e flottazione Introduzione all osmosi inversa La pressione osmotica L osmosi inversa Calcolo della pressione osmotica Argomenti Peso molecolare e pressione osmotica Calcolo
Osmosi inversa, ultrafiltrazione e flottazione Introduzione all osmosi inversa La pressione osmotica L osmosi inversa Calcolo della pressione osmotica Argomenti Peso molecolare e pressione osmotica Calcolo
Sommario della lezione 18. Proprietà colligative
 Sommario della lezione 18 Proprietà colligative Interazioni soluto-solvente Interazioni soluto-solvente La solubilità di un soluto in un particolare solvente dipende da: la natura delle particelle di solvente
Sommario della lezione 18 Proprietà colligative Interazioni soluto-solvente Interazioni soluto-solvente La solubilità di un soluto in un particolare solvente dipende da: la natura delle particelle di solvente
Le soluzioni e il loro comportamento
 2017 Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli soluto / volume soluzione MOLALITA (m) moli soluto
2017 Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli soluto / volume soluzione MOLALITA (m) moli soluto
Lo stato liquido. i liquidi molecolari con legami a idrogeno: le interazioni tra le molecole si stabiliscono soprattutto attraverso legami a idrogeno
 Lo stato liquido Le particelle sono in continuo movimento, anche se questo risulta più limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle particelle è chiamato moto Browniano.
Lo stato liquido Le particelle sono in continuo movimento, anche se questo risulta più limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle particelle è chiamato moto Browniano.
PROPRIETA DELLE SOLUZIONI
 1 11 PROPRIETA DELLE SOLUZIONI 2 SOLUZIONI IDEALI H mix = 0 le interazioni fra le molecole di soluto e di solvente puri sono paragonabili a quelle fra soluto e solvente; durante il processo di dissoluzione
1 11 PROPRIETA DELLE SOLUZIONI 2 SOLUZIONI IDEALI H mix = 0 le interazioni fra le molecole di soluto e di solvente puri sono paragonabili a quelle fra soluto e solvente; durante il processo di dissoluzione
Diffusione e osmosi. Roberto Cirio. Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico Corso di Fisica
 Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
L ACQUA E LE CELLULE VEGETALI
 L ACQUA E LE CELLULE VEGETALI Importanza dell acqua per le cellule vegetali compromesso fotosintesi/traspirazione: la necessità fotosintetica espone le piante al rischio di disidratazione Il deficit idrico
L ACQUA E LE CELLULE VEGETALI Importanza dell acqua per le cellule vegetali compromesso fotosintesi/traspirazione: la necessità fotosintetica espone le piante al rischio di disidratazione Il deficit idrico
POTENZA METABOLICA. Fisica Applicata, Area Infermieristica, M. Ruspa
 POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
POTENZA METABOLICA La potenza metabolica (MR) e l energia prodotta all interno del corpo umano nell unita di tempo. Se con U indichiamo l energia interna del nostro organismo L energia minima per unita
Il binomio di van t Hoff Le proprietà colligative dipendono dal numero di particelle effettivamente presenti nella soluzione. Nel caso in cui il solut
 Proprietà colligative di soluzioni ideali Si definiscono proprietà colligative alcune proprietà delle soluzioni indipendenti dalla natura del soluto ma che dipendono soltanto dal numero delle particelle
Proprietà colligative di soluzioni ideali Si definiscono proprietà colligative alcune proprietà delle soluzioni indipendenti dalla natura del soluto ma che dipendono soltanto dal numero delle particelle
Distillazione + Separazione con Membrane Distillazione + Adsorbimento
 Distillazione + Separazione con Membrane Distillazione + Adsorbimento Membrana Barriera semipermeabile tra due fasi che separa i composti a diversa permeabilità ermeato => frazione che passa attraverso
Distillazione + Separazione con Membrane Distillazione + Adsorbimento Membrana Barriera semipermeabile tra due fasi che separa i composti a diversa permeabilità ermeato => frazione che passa attraverso
Soluzioni e miscugli eterogenei. Soluzioni e miscugli eterogenei. Soluzioni e miscugli eterogenei
 Le soluzioni Soluzioni e miscugli eterogenei Un sistema formato da due o più componenti è chiamato miscuglio. I miscugli possono essere : miscugli eterogenei; miscugli omogenei o soluzioni. 2 4 Soluzioni
Le soluzioni Soluzioni e miscugli eterogenei Un sistema formato da due o più componenti è chiamato miscuglio. I miscugli possono essere : miscugli eterogenei; miscugli omogenei o soluzioni. 2 4 Soluzioni
Lezione n. 12. Proprietà colligative Variazione del punto crioscopico. Pressione osmotica. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 12 Proprietà colligative Variazione del punto ebullioscopico Variazione del punto crioscopico Pressione osmotica 02/03/2008 Antonino Polimeno
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 12 Proprietà colligative Variazione del punto ebullioscopico Variazione del punto crioscopico Pressione osmotica 02/03/2008 Antonino Polimeno
Si definisce soluzione un sistema omogeneo (costituito da una sola fase) con più di un componente
 Lezione 14 1.Soluzioni 2.Concentrazione 3.Proprietà colligative 1.Legge di Raoult 2.Abbassamento crioscopico 3.Innalzamento ebullioscopico 4.Pressione osmotica Le Soluzioni Si definisce soluzione un sistema
Lezione 14 1.Soluzioni 2.Concentrazione 3.Proprietà colligative 1.Legge di Raoult 2.Abbassamento crioscopico 3.Innalzamento ebullioscopico 4.Pressione osmotica Le Soluzioni Si definisce soluzione un sistema
Trasporto di membrana
 Trasporto di membrana CdL Tecnici di Lab Biomedico AA. 2011/12 Prof.ssa Frabetti Trasporto di membrana molecole piccole molecole grosse trasporto passivo trasporto attivo (con pompe o cotrasportatori)
Trasporto di membrana CdL Tecnici di Lab Biomedico AA. 2011/12 Prof.ssa Frabetti Trasporto di membrana molecole piccole molecole grosse trasporto passivo trasporto attivo (con pompe o cotrasportatori)
Esercizi Concentrazioni e diluizioni
 Esercizi Concentrazioni e diluizioni Una soluzione 0.300 m di acido fosforico ha densità 1.010 g/ml. Calcolare la frazione molare, la percentuale in peso, la molarità. Molalità 0.300 m 0.300 moli di acido
Esercizi Concentrazioni e diluizioni Una soluzione 0.300 m di acido fosforico ha densità 1.010 g/ml. Calcolare la frazione molare, la percentuale in peso, la molarità. Molalità 0.300 m 0.300 moli di acido
Impianti a Membrana per l'industria Lattiero-Casearia
 Impianti a Membrana per l'industria Lattiero-Casearia IMPIANTI A MEMBRANA PER CASEIFICI E ZOOTECNIA La TECN.A., per il settore lattiero-caseario, realizza un'ampia gamma di impianti di filtrazione tangenziale
Impianti a Membrana per l'industria Lattiero-Casearia IMPIANTI A MEMBRANA PER CASEIFICI E ZOOTECNIA La TECN.A., per il settore lattiero-caseario, realizza un'ampia gamma di impianti di filtrazione tangenziale
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro.
 Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
FANGHI BIOLOGICI NORMATIVA E CONTROLLO
 FANGHI BIOLOGICI NORMATIVA E CONTROLLO COSA SONO I FANGHI BIOLOGICI: CARATTERISTICHE, ORIGINE, QUANTITÀ PRODOTTE Milano, 02/05/2017 L IMPEGNO DI A2A CICLO IDRICO SOSTENIBILITÀ EFFICIENZA ECONOMICA PROTEZIONE
FANGHI BIOLOGICI NORMATIVA E CONTROLLO COSA SONO I FANGHI BIOLOGICI: CARATTERISTICHE, ORIGINE, QUANTITÀ PRODOTTE Milano, 02/05/2017 L IMPEGNO DI A2A CICLO IDRICO SOSTENIBILITÀ EFFICIENZA ECONOMICA PROTEZIONE
Lezione 11 Soluzioni. Diffusione ed osmosi.
 Lezione 11 Soluzioni. Diffusione ed osmosi. Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici
Lezione 11 Soluzioni. Diffusione ed osmosi. Soluzioni Una soluzione è formata da un insieme di molecole di uno o più soluti (eventualmente dissociati in ioni), disciolti in un solvente (nei sistemi biologici
 positiva, endotermico (la soluzione si raffredda) negativa, esotermico (la soluzione si scalda). DH sol = E ret + E solv concentrazione Molare Esempio: Preparare mezzo litro (0,5 l) di soluzione acquosa
positiva, endotermico (la soluzione si raffredda) negativa, esotermico (la soluzione si scalda). DH sol = E ret + E solv concentrazione Molare Esempio: Preparare mezzo litro (0,5 l) di soluzione acquosa
Fisicaa Applicata, Area Tecnica, M. Ruspa Esercizio. Data una massa m = 8,8 mg di CO 2, calcolare: 1) il numero di moli. 2) il numero di molecole
 Esercizio Data una massa m = 8,8 mg di CO 2, calcolare: 1) il numero di moli 2) il numero di molecole 1 GAS PERFETTO volume occupato dalle molecole è trascurabile; forze di attrazione tra molecole sono
Esercizio Data una massa m = 8,8 mg di CO 2, calcolare: 1) il numero di moli 2) il numero di molecole 1 GAS PERFETTO volume occupato dalle molecole è trascurabile; forze di attrazione tra molecole sono
SOLUZIONI. Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto).
 SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
Rapporto tra soluto e solvente o soluzione
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
LE PROPRIETÀ DELLE SOLUZIONI
 LE PROPRIETÀ DELLE SOLUZIONI Le Soluzioni o Miscugli omogenei Solvente e soluto Energia sprigionata e acquisita Solvatazione e idratazione Le Soluzioni 3) 1. Composti Ionici (Dissociazione) 2. Composti
LE PROPRIETÀ DELLE SOLUZIONI Le Soluzioni o Miscugli omogenei Solvente e soluto Energia sprigionata e acquisita Solvatazione e idratazione Le Soluzioni 3) 1. Composti Ionici (Dissociazione) 2. Composti
Stabilizzazione tartarica attraverso l'impiego di resina a scambio ionico
 Stabilizzazione tartarica attraverso l'impiego di resina a scambio ionico Angelo Bertacchini Riduzione del ph contestuale alla stabilizzazione tartarica Cos'è lo scambio ionico Lo scambio ionico è un fenomeno
Stabilizzazione tartarica attraverso l'impiego di resina a scambio ionico Angelo Bertacchini Riduzione del ph contestuale alla stabilizzazione tartarica Cos'è lo scambio ionico Lo scambio ionico è un fenomeno
FISIOLOGIA VEGETALE. I movimenti dell acqua e dei soluti
 FISIOLOGIA VEGETALE I movimenti dell acqua e dei soluti MOVIMENTI DELL ACQUA E DEI SOLUTI L acqua si muove seguente delle differenze di potenziali di energia Il potenziale di energia è l energia che viene
FISIOLOGIA VEGETALE I movimenti dell acqua e dei soluti MOVIMENTI DELL ACQUA E DEI SOLUTI L acqua si muove seguente delle differenze di potenziali di energia Il potenziale di energia è l energia che viene
ALLEGATO. del REGOLAMENTO DELEGATO DELLA COMMISSIONE
 COMMISSIONE EUROPEA Bruxelles, 31.1.2017 C(2017) 403 final ANNEX 1 ALLEGATO del REGOLAMENTO DELEGATO DELLA COMMISSIONE che integra il regolamento (UE) n. 251/2014 del Parlamento europeo e del Consiglio
COMMISSIONE EUROPEA Bruxelles, 31.1.2017 C(2017) 403 final ANNEX 1 ALLEGATO del REGOLAMENTO DELEGATO DELLA COMMISSIONE che integra il regolamento (UE) n. 251/2014 del Parlamento europeo e del Consiglio
Temperatura. Il legame con le grandezze microscopiche è di tipo statistico. Pressione Volume Temperatura
 Temperatura La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero di particelle):
Temperatura La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero di particelle):
GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato liquido
 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato liquido Lo stato liquido Liquidi: energia dei moti termici confrontabile con quella delle forze coesive. Limitata libertà di movimento delle molecole, che
GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato liquido Lo stato liquido Liquidi: energia dei moti termici confrontabile con quella delle forze coesive. Limitata libertà di movimento delle molecole, che
Tecnologie Disponibili per Depurazione di Aria Inquinata da Composti Organici Solubili in Acqua. Schema di principio: Assorbimento + Trattamenti
 Tecnologie Disponibili per Depurazione di Aria Inquinata da Composti Organici Solubili in Acqua Si descrivono le tecnologie disponibili per realizzare una depurazione di aria inquinata da composti organici
Tecnologie Disponibili per Depurazione di Aria Inquinata da Composti Organici Solubili in Acqua Si descrivono le tecnologie disponibili per realizzare una depurazione di aria inquinata da composti organici
Elemento fondamentale
 Acqua Elemento fondamentale Usata x 90% Produzione Malteria Caldaie frigoriferi Lavaggio e sterilizzazione Ruoli dell acqua Permette il trasporto e la distribuzione nelle cellule delle sostanze Garantisce
Acqua Elemento fondamentale Usata x 90% Produzione Malteria Caldaie frigoriferi Lavaggio e sterilizzazione Ruoli dell acqua Permette il trasporto e la distribuzione nelle cellule delle sostanze Garantisce
SOLUZIONI e DILUIZIONI
 SOLUZIONI e DILUIZIONI Introduzione In chimica viene definita soluzione un sistema in cui due o più sostanze formano un miscuglio omogeneo. Nella maggior parte dei casi una soluzione è costituita da due
SOLUZIONI e DILUIZIONI Introduzione In chimica viene definita soluzione un sistema in cui due o più sostanze formano un miscuglio omogeneo. Nella maggior parte dei casi una soluzione è costituita da due
Soluzioni unità 3, modulo D del libro
 Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Soluzioni, elettroliti e non
 Soluzioni, elettroliti e non Il processo di solubilizzazione è un processo complesso, per interpretarlo occorre conoscere la natura ei legami chimici coinvolti COSA CONSIDERARE? 1) Interazioni soluto -
Soluzioni, elettroliti e non Il processo di solubilizzazione è un processo complesso, per interpretarlo occorre conoscere la natura ei legami chimici coinvolti COSA CONSIDERARE? 1) Interazioni soluto -
SOLUZIONI. solide (es. leghe)
 SOLUZIONI Definizione: Miscela omogenea (una sola fase) di due o più componenti Soluzioni liquide (es. bevande alcoliche) gassose (es. aria) solide (es. leghe) 1 Unità di misura della concentrazione %
SOLUZIONI Definizione: Miscela omogenea (una sola fase) di due o più componenti Soluzioni liquide (es. bevande alcoliche) gassose (es. aria) solide (es. leghe) 1 Unità di misura della concentrazione %
Impianto a membrane. Principio di funzionamento. - Applicazioni delle membrane sintetiche
 Impianto a membrane Principio di funzionamento Numerosi processi di depurazione delle acque fanno uso di membrane. La membrana è una sottile barriera che permette un passaggio selettivo di massa. Il termine
Impianto a membrane Principio di funzionamento Numerosi processi di depurazione delle acque fanno uso di membrane. La membrana è una sottile barriera che permette un passaggio selettivo di massa. Il termine
Le soluzioni e il loro comportamento
 A. A. 2016 2017 1 CCS Scienze geologiche CCS Biologia Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli
A. A. 2016 2017 1 CCS Scienze geologiche CCS Biologia Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli
Soluzioni. Miscele: (gas in gas) Leghe: (solidi in solidi) Soluzioni p.d: (solventi liquidi)
 Soluzioni Sono miscele omogenee in cui si riconoscono 2 componenti o fasi: il soluto, presente in quantità minore il solvente presente in quantità maggiore. Tipi di soluzioni: Miscele: (gas in gas) Leghe:
Soluzioni Sono miscele omogenee in cui si riconoscono 2 componenti o fasi: il soluto, presente in quantità minore il solvente presente in quantità maggiore. Tipi di soluzioni: Miscele: (gas in gas) Leghe:
UNIVERSITÀ DEGLI STUDI DI NAPOLI FEDERICO II
 UNIVERSITÀ DEGLI STUDI DI NAPOLI FEDERICO II Scuola Politecnica delle Scienze di Base Dipartimento di Ingegneria Chimica, dei Materiali e della Produzione Industriale CORSO DI LAUREA IN INGEGNERIA PER
UNIVERSITÀ DEGLI STUDI DI NAPOLI FEDERICO II Scuola Politecnica delle Scienze di Base Dipartimento di Ingegneria Chimica, dei Materiali e della Produzione Industriale CORSO DI LAUREA IN INGEGNERIA PER
Termodinamica Chimica
 Universita degli Studi dell Insubria Corsi di Laurea in Scienze Chimiche e Chimica Industriale Termodinamica Chimica Miscele e Soluzioni dario.bressanini@uninsubria.it http://scienze-como.uninsubria.it/bressanini
Universita degli Studi dell Insubria Corsi di Laurea in Scienze Chimiche e Chimica Industriale Termodinamica Chimica Miscele e Soluzioni dario.bressanini@uninsubria.it http://scienze-como.uninsubria.it/bressanini
UNIVERSITÀ DEGLI STUDI DI NAPOLI FEDEDICO II
 UNIVERSITÀ DEGLI STUDI DI NAPOLI FEDEDICO II Scuola Politecnica e delle Scienze di Base Dipartimento di Ingegneria Civile, Edile e Ambientale Corso di Laurea in Ingegneria per l Ambiente e il Territorio
UNIVERSITÀ DEGLI STUDI DI NAPOLI FEDEDICO II Scuola Politecnica e delle Scienze di Base Dipartimento di Ingegneria Civile, Edile e Ambientale Corso di Laurea in Ingegneria per l Ambiente e il Territorio
Esercitazioni di Elementi di Chimica. Modulo 3 Trasformazioni della Materia
 Esercitazioni di Elementi di Chimica Modulo 3 Trasformazioni della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Quale/i dei seguenti
Esercitazioni di Elementi di Chimica Modulo 3 Trasformazioni della Materia Esempi di quiz a risposta multipla e questionari a completamento L esame finale sarà composto da problemi simili Quale/i dei seguenti
Esercitazioni Infermieristica
 Esercitazioni Infermieristica Novara: Gruppo A 28/1 9-13 29/1 14-18 Gruppo B 28/1 14-18 29/1 9-13 Alba 7/12/2012 11-13 14-17 25/01/2013 15-18 a Novara Alessandria 18/12/2012 10-13 14-16 14/01/2013 10-13
Esercitazioni Infermieristica Novara: Gruppo A 28/1 9-13 29/1 14-18 Gruppo B 28/1 14-18 29/1 9-13 Alba 7/12/2012 11-13 14-17 25/01/2013 15-18 a Novara Alessandria 18/12/2012 10-13 14-16 14/01/2013 10-13
Proprietà delle Soluzioni
 Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
Scaricato da
 -Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
-Equilibrio diffusivo (chimico): in seguito alla diffusione la concentrazione delle molecole è uguale in tutte le parti del sistema C 1 Equilibrio diffusivo Le membrane cellulari sono selettivamente permeabili,
Crioconcentrazione Si congela una parte dell acqua presente in un alimento, quindi si separano i cristalli dalla soluzione concentrata. E molto adatto
 Appunti del corso di Istituzioni di tecnologia alimentare Parte 6 Crioconcentrazione Osmosi Liofilizzazione ZEPPA G. Università degli Studi di Torino Crioconcentrazione Si congela una parte dell acqua
Appunti del corso di Istituzioni di tecnologia alimentare Parte 6 Crioconcentrazione Osmosi Liofilizzazione ZEPPA G. Università degli Studi di Torino Crioconcentrazione Si congela una parte dell acqua
Organizzazione della materia
 Organizzazione della materia Elementi: sostanze che non possono essere scisse in altre più semplici mediante reazioni chimiche ordinarie. Atomo: è la porzione più piccola di un elemento, formato da 3 particelle
Organizzazione della materia Elementi: sostanze che non possono essere scisse in altre più semplici mediante reazioni chimiche ordinarie. Atomo: è la porzione più piccola di un elemento, formato da 3 particelle
Movimenti dell acqua e dei soluti nella cellula vegetale
 Movimenti dell acqua e dei soluti nella cellula vegetale L acqua si sposta in funzione dell energia potenziale in essa contenuta o Potenziale idrico Si sposta da una regione dove il potenziale idrico è
Movimenti dell acqua e dei soluti nella cellula vegetale L acqua si sposta in funzione dell energia potenziale in essa contenuta o Potenziale idrico Si sposta da una regione dove il potenziale idrico è
Corso di Laurea Magistrale in Medicina e Chirurgia. Biofisica e Fisiologia I A.A ESERCITAZIONE. Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 ESERCITAZIONE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I A.A. 2016-17 ESERCITAZIONE Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale clara.iannuzzi@unina2.it
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 9. L unità di misura dei chimici: la mole SEGUI LA MAPPA La concentrazione delle
Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 9. L unità di misura dei chimici: la mole SEGUI LA MAPPA La concentrazione delle
Le membrane cellulari
 Le membrane cellulari La struttura delle membrane biologiche Le membrane cellulari sono formate da un doppio strato fosfolipidico dove si trovano varie proteine, che possono essere: periferiche: si trovano
Le membrane cellulari La struttura delle membrane biologiche Le membrane cellulari sono formate da un doppio strato fosfolipidico dove si trovano varie proteine, che possono essere: periferiche: si trovano
La pompa sodio-potassio
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 La pompa sodio-potassio 14/3/2006 Efficienza del cuore Dipende dall ordinata sequenza di eccitazione e di contrazione che procede
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 La pompa sodio-potassio 14/3/2006 Efficienza del cuore Dipende dall ordinata sequenza di eccitazione e di contrazione che procede
Articolo 32. «Lo Stato tutela la salute dei cittadini» Valerio GIACCONE Presentazione modulo di Tecnologia degli Alimenti
 Costituzione Italia Articolo 32 «Lo Stato tutela la salute dei cittadini» Valerio GIACCONE Presentazione modulo di Tecnologia degli Alimenti Malattie Danni alla alimentari salute Dismetabolie ALIMENTO
Costituzione Italia Articolo 32 «Lo Stato tutela la salute dei cittadini» Valerio GIACCONE Presentazione modulo di Tecnologia degli Alimenti Malattie Danni alla alimentari salute Dismetabolie ALIMENTO
L acqua nel suolo. Gassosa (vapore acqueo, solitamente meno di 5 g/kg Solida (ghiaccio) Liquida Non è mai pura Si può definire soluzione circolante
 La fase liquida L acqua nel suolo Gassosa (vapore acqueo, solitamente meno di 5 g/kg Solida (ghiaccio) Liquida Non è mai pura Si può definire soluzione circolante La fase liquida è composta dalla soluzione
La fase liquida L acqua nel suolo Gassosa (vapore acqueo, solitamente meno di 5 g/kg Solida (ghiaccio) Liquida Non è mai pura Si può definire soluzione circolante La fase liquida è composta dalla soluzione
Biologia cellulare vegetale
 Biologia cellulare vegetale Comparti cellulari comuni a cellule animali e vegetali Funzioni specifiche dei comparti cellulari comuni nelle cellule vegetali Molti comparti cellulari sono presenti sia nelle
Biologia cellulare vegetale Comparti cellulari comuni a cellule animali e vegetali Funzioni specifiche dei comparti cellulari comuni nelle cellule vegetali Molti comparti cellulari sono presenti sia nelle
Preparazione del campione analitico
 Preparazione del campione analitico Workflow per l analisi farmaceutica Lotto Totalità del materiale Campionamento Il campione deve essere rappresentativo del lotto Conservazione Preparazione campione
Preparazione del campione analitico Workflow per l analisi farmaceutica Lotto Totalità del materiale Campionamento Il campione deve essere rappresentativo del lotto Conservazione Preparazione campione
GLI STATI DELLA MATERIA
 GLI STATI DELLA MATERIA E LE SOLUZIONI Stati di aggregazione della materia Cambiamenti di stato La temperatura del cubetto di ghiaccio aumenta fino a raggiungere un valore detto PUNTO (O TEMPERATURA) DI
GLI STATI DELLA MATERIA E LE SOLUZIONI Stati di aggregazione della materia Cambiamenti di stato La temperatura del cubetto di ghiaccio aumenta fino a raggiungere un valore detto PUNTO (O TEMPERATURA) DI
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
Proprietà colligative
 roprietà colligative Fra i sistemi reali è utile esaminare il comportamento di soluzioni diluite ottenuti da solidi o liquidi poco volatili rispetto al solvente. Le proprietà di tali soluzioni dipendono
roprietà colligative Fra i sistemi reali è utile esaminare il comportamento di soluzioni diluite ottenuti da solidi o liquidi poco volatili rispetto al solvente. Le proprietà di tali soluzioni dipendono
Le alte temperature. Le alte temperature hanno. I metodi più usati sono la e la
 1 Le alte temperature L uso del calore è un sistema efficace per l eliminazione dei microrganismi e l inattivazione definitiva degli enzimi che causano l alterazione degli alimenti Le alte temperature
1 Le alte temperature L uso del calore è un sistema efficace per l eliminazione dei microrganismi e l inattivazione definitiva degli enzimi che causano l alterazione degli alimenti Le alte temperature
Molti comparti cellulari sono presenti sia nelle cellule animali che vegetali
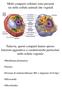 Molti comparti cellulari sono presenti sia nelle cellule animali che vegetali Tuttavia, questi comparti hanno spesso funzioni aggiuntive o caratteristiche particolari nella cellula vegetale Membrana plasmatica
Molti comparti cellulari sono presenti sia nelle cellule animali che vegetali Tuttavia, questi comparti hanno spesso funzioni aggiuntive o caratteristiche particolari nella cellula vegetale Membrana plasmatica
Questionario di verifica
 Questionario di verifica 1. Per i batteri termofili il range ottimale di temperatura è: a. 15 20 C b. 25 40 C c. 45 60 C 2. La pastorizzazione è: a. un trattamento termico che elimina le forme patogene
Questionario di verifica 1. Per i batteri termofili il range ottimale di temperatura è: a. 15 20 C b. 25 40 C c. 45 60 C 2. La pastorizzazione è: a. un trattamento termico che elimina le forme patogene
Le soluzioni. possono essere. solide (leghe) liquide aeriformi
 Le soluzioni Sono miscele omogenee di due o più sostanze (in forma di molecole, atomi, ioni) di cui quella presente in quantità maggiore è definita solvente, le altre soluti. possono essere solide (leghe)
Le soluzioni Sono miscele omogenee di due o più sostanze (in forma di molecole, atomi, ioni) di cui quella presente in quantità maggiore è definita solvente, le altre soluti. possono essere solide (leghe)
Le proprietà colligative
 Le proprietà colligative Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Abbassamento
Le proprietà colligative Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1 Abbassamento
Espressioni di concentrazione di una soluzione
 SOLUZIONI Una soluzione è un sistema fisicamente omogeneo costituito da due o più componenti: il solvente e il soluto (o i soluti. Il solvente è il componente presente, in genere ma non di regola, in maggior
SOLUZIONI Una soluzione è un sistema fisicamente omogeneo costituito da due o più componenti: il solvente e il soluto (o i soluti. Il solvente è il componente presente, in genere ma non di regola, in maggior
Soluzioni RAGIONAMENTO LOGICO E CULTURA GENERALE. Risposta. Risposta. Risposta. Risposta. Risposta. Risposta. Risposta. Risposta. Risposta.
 Soluzioni 1 A 2 B 3 B 4 E 5 D 6 E 7 B 8 D 9 C 10 B 11 D 12 B 13 E 14 D 15 C 16 C 17 B 18 D 19 A 20 C 21 D 22 C 23 D 24 C 25 E 26 C 27 D 28 C 29 B 30 B 31 D 32 E 33 B 34 C 35 E 36 A 37 D 38 B 39 C 40 D
Soluzioni 1 A 2 B 3 B 4 E 5 D 6 E 7 B 8 D 9 C 10 B 11 D 12 B 13 E 14 D 15 C 16 C 17 B 18 D 19 A 20 C 21 D 22 C 23 D 24 C 25 E 26 C 27 D 28 C 29 B 30 B 31 D 32 E 33 B 34 C 35 E 36 A 37 D 38 B 39 C 40 D
9065X Chimica. Modello esame svolto. Esempio di compito scritto di Chimica. Politecnico di Torino CeTeM
 svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
CdL Professioni Sanitarie A.A. 2012/2013. Unità 9: Gas e processi di diffusione
 L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
LA SANIFICAZIONE NELL INDUSTRIA ALIMENTARE. Erucon - ERUditio et CONsultum
 LA SANIFICAZIONE NELL INDUSTRIA ALIMENTARE CONTAMINAZIONE PRIMARIA Per i prodotti vegetali: terra, aria, acqua,animali selvatici, insetti locali, di prima lavorazione, mezzi di trasporto Per i prodotti
LA SANIFICAZIONE NELL INDUSTRIA ALIMENTARE CONTAMINAZIONE PRIMARIA Per i prodotti vegetali: terra, aria, acqua,animali selvatici, insetti locali, di prima lavorazione, mezzi di trasporto Per i prodotti
Liofilizzazione LEZIONI DI CONTROLLO E SICUREZZA DEI PROCESSI PRODUTTIVI. PROF.SSA MAURIZIA SEGGIANI tel:
 Liofilizzazione LEZIONI DI CONTROLLO E SICUREZZA DEI PROCESSI PRODUTTIVI IN AMBITO FARMACEUTICO PROF.SSA MAURIZIA SEGGIANI maurizia.seggiani@unipi.it tel: 050 2217881 La liofilizzazione (freeze-drying)
Liofilizzazione LEZIONI DI CONTROLLO E SICUREZZA DEI PROCESSI PRODUTTIVI IN AMBITO FARMACEUTICO PROF.SSA MAURIZIA SEGGIANI maurizia.seggiani@unipi.it tel: 050 2217881 La liofilizzazione (freeze-drying)
Diagramma di stato di H 2 O
 Lezione 13 1. Pressione e temperatura 2. Leggi dei gas 3. Teoria cinetica ei gas 4. Gas ideali e gas reali 5. Miscele gassose: legge di Dalton 6. Frazioni molari Diagramma di stato di H 2 O Diagrammi di
Lezione 13 1. Pressione e temperatura 2. Leggi dei gas 3. Teoria cinetica ei gas 4. Gas ideali e gas reali 5. Miscele gassose: legge di Dalton 6. Frazioni molari Diagramma di stato di H 2 O Diagrammi di
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento
 TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezione 29-30 2010 Programma: a che punto siamo? Elettrochimica Elettrochimica è lo studio delle reazioni chimiche che producono
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezione 29-30 2010 Programma: a che punto siamo? Elettrochimica Elettrochimica è lo studio delle reazioni chimiche che producono
ESERCITAZIONE 11 SOLUZIONI DI ELETTROLITI
 ESERCITAZIONE 11 SOLUZIONI DI ELETTROLITI Sono elettroliti gli acidi, le basi e i sali. Quando sono in soluzione le loro molecole sono parzialmente o totalmente scisse in particelle dotate di carica (ioni).
ESERCITAZIONE 11 SOLUZIONI DI ELETTROLITI Sono elettroliti gli acidi, le basi e i sali. Quando sono in soluzione le loro molecole sono parzialmente o totalmente scisse in particelle dotate di carica (ioni).
Modalità di trasporto di acqua attraverso la membrana plasmatica
 Modalità di trasporto di acqua attraverso la membrana plasmatica Membrana plasmatica H 2 O H 2 O acquaporina In genere la membrana plasmatica che riveste tutte le cellule di un organismo è permeabile all
Modalità di trasporto di acqua attraverso la membrana plasmatica Membrana plasmatica H 2 O H 2 O acquaporina In genere la membrana plasmatica che riveste tutte le cellule di un organismo è permeabile all
Prof. Clara Iannuzzi
 Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
Corso di Laurea Magistrale in Medicina e Chirurgia Fisiologia e Biofisica I A.A. 2015/2016 Prof. Clara Iannuzzi Dipartimento di Biochimica, Biofisica e Patologia Generale Via L. De Crecchio 7, Napoli Seconda
ESERCIZI sulle SOLUZIONI
 ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
Importanza dell acqua per le cellule vegetali
 L ACQUA E LE CELLULE VEGETALI Importanza dell acqua per le cellule vegetali compromesso fotosintesi/traspirazione: la necessità fotosintetica espone le piante al rischio di disidratazione Il deficit idrico
L ACQUA E LE CELLULE VEGETALI Importanza dell acqua per le cellule vegetali compromesso fotosintesi/traspirazione: la necessità fotosintetica espone le piante al rischio di disidratazione Il deficit idrico
L APPLICAZIONE DEL D. LGS. 31/01 AI PICCOLI SISTEMI ACQUEDOTTISTICI
 L APPLICAZIONE DEL D. LGS. 31/01 AI PICCOLI SISTEMI ACQUEDOTTISTICI L applicazione dei processi innovativi di trattamento delle acque ai piccoli sistemi acquedottistici Giuseppe Genon Mondovì 12 Novembre
L APPLICAZIONE DEL D. LGS. 31/01 AI PICCOLI SISTEMI ACQUEDOTTISTICI L applicazione dei processi innovativi di trattamento delle acque ai piccoli sistemi acquedottistici Giuseppe Genon Mondovì 12 Novembre
UNITA DI MISURA DEL CALORE
 UNITA DI MISURA DEL CALORE S.I >>> Unita pratica: caloria Esercizio Trasformare 2500 cal in J CAMBIAMENTI DI STATO I cambiamenti di stato avvengono a temperatura costante! CALORE LATENTE Il calore fornito
UNITA DI MISURA DEL CALORE S.I >>> Unita pratica: caloria Esercizio Trasformare 2500 cal in J CAMBIAMENTI DI STATO I cambiamenti di stato avvengono a temperatura costante! CALORE LATENTE Il calore fornito
Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente
 Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente Soluzioni Sistema Omogeneo (presenta le stesse proprietà in qualsiasi sua porzione) Monofasico Nella fase omogenea
Miscela omogenea monofasica i cui costituenti non è possibile separare meccanicamente Soluzioni Sistema Omogeneo (presenta le stesse proprietà in qualsiasi sua porzione) Monofasico Nella fase omogenea
Appunti del corso di Istituzioni di tecnologia alimentare
 Appunti del corso di Istituzioni di tecnologia alimentare Parte 6 Crioconcentrazione Osmosi Liofilizzazione ZEPPA G. Università degli Studi di Torino Crioconcentrazione Si congela una parte dell acqua
Appunti del corso di Istituzioni di tecnologia alimentare Parte 6 Crioconcentrazione Osmosi Liofilizzazione ZEPPA G. Università degli Studi di Torino Crioconcentrazione Si congela una parte dell acqua
Si parla di tannino nativo riferendosi a quello dell'uva e di tannino neoformato in riferimento a quello del vino.
 I tannini sono composti fenolici presenti in diverse piante di interesse alimentare, abbondanti nel tè, nel caffè, nel cacao, nel vino, nei mirtilli, ecc sono meno rappresentati nei cereali. I tannini
I tannini sono composti fenolici presenti in diverse piante di interesse alimentare, abbondanti nel tè, nel caffè, nel cacao, nel vino, nei mirtilli, ecc sono meno rappresentati nei cereali. I tannini
SISTEMI EXTRACORPOREI
 SISTEMI EXTRACORPOREI CORSO: BIOTECNOLOGIE INDUSTRIALI MODULO: BIOINGEGNERIA CHIMICA Corso di Laurea Triennale INGEGNERIA BIOMEDICA AA 2005-06 APPLICAZIONI Fino ad oggi sono state sviluppate varie tipologie
SISTEMI EXTRACORPOREI CORSO: BIOTECNOLOGIE INDUSTRIALI MODULO: BIOINGEGNERIA CHIMICA Corso di Laurea Triennale INGEGNERIA BIOMEDICA AA 2005-06 APPLICAZIONI Fino ad oggi sono state sviluppate varie tipologie
SOLUZIONI E CONCENTRAZIONE
 SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
-PROPRIETA COLLIGATIVE-
 -PROPRIETA COLLIGATIVE- Le proprietà colligative sono proprietà delle soluzioni e sono funzioni del numero e non della natura delle particelle di soluto che le compongono. Abbassamento della pressione
-PROPRIETA COLLIGATIVE- Le proprietà colligative sono proprietà delle soluzioni e sono funzioni del numero e non della natura delle particelle di soluto che le compongono. Abbassamento della pressione
