CHIMICA DELLE SUPERFICI ED INTERFASI
|
|
|
- Timoteo Molinari
- 7 anni fa
- Visualizzazioni
Transcript
1 CHIMICA DELLE SUPERFICI ED INTERFASI DOTT. GIULIA FIORAVANTI UNIVERSITÀ DEGLI STUDI DELL AQUILA LAUREA MAGISTRALE IN INGEGNERIA CHIMICA A.A TECNICA DEL VUOTO Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 2 1
2 Tutti gli studi di superficie sono effettuati in condizioni di ultra alto vuoto: perché??? IMPORTANZA DEL VUOTO (UHV) Otto von Guericke SI DEFINISCE VUOTO LA SITUAZIONE FISICA IN CUI LA PRESSIONE È INFERIORE A QUELLA ATMOSFERICA ( 1 atm= Pa) IL VUOTO (PIÙ O MENO SPINTO) ESISTE IN NATURA (SULLA SUPERFICIE LUNARE LA PRESSIONE È DI CIRCA 10-6 Pa, MENTRE NELLO SPAZIO INTERSTELLARE LA PRESSIONE È TALMENTE BASSA CHE SI PREFERISCE DARE LA DENSITÀ DI MOLECOLE PER m 3, PARI A CIRCA 1 MOLECOLA/cm 3 ) MA IL VUOTO PUÒ ESSERE PRODOTTO ARTIFICIALMENTE PER SCOPI INDUSTRIALI O SCIENTIFICI, E OGGI I MODI PER PRODURRE E MISURARE IL VUOTO HANNO ASSUNTO GRANDE IMPORTANZA NELLA MODERNA TECNOLOGIA IN SVARIATI CAMPI (INDUSTRIA MICROELETTRONICA, ALIMENTARE, METALLURGICA, FARMACEUTICA ) Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 3 VANTAGGI DEL VUOTO a) IMPEDIRE PROCESSI CHIMICO-FISICI CAUSATI DALL AZIONE DEI GAS ATMOSFERICI (PER ES. DURANTE LA FUSIONE DI PARTICOLARI METALLI REATTIVI, COME IL Ti; IN TUBI TERMOIONICI PER PERMETTERE UN ELEVATO CAMMINO MEDIO DEGLI ELETTRONI) b) ACCRESCERE NOTEVOLMENTE IL LIBERO CAMMINO MEDIO DELLE MOLECOLE DI GAS O VAPORI ONDE PERMETTERE ALLE MOLECOLE, ATOMI O IONI DI RAGGIUNGERE UNA SUPERFICIE O UN BERSAGLIO OPPORTUNO, SENZA URTI CON MOLECOLE ESTRANEE (AD ES. NEI PROCESSI DI METALLIZZAZIONE SOTTO VUOTO E NELLE MACCHINE ACCELERATRICI DI PARTICELLE). c) FAVORIRE L ISOLAMENTO TERMICO (PER ES. DEWARS) Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 4 2
3 VANTAGGI DEL VUOTO d) ELIMINARE I GAS DISCIOLTI O CERTE SOSTANZE CONTENUTE IN UN DATO MATERIALE (PER ES. DEGASSAZIONE DI OLI E LIOFILIZZAZIONE) e) RIDURRE LA CONCENTRAZIONE DI UNO O PIÙ GAS PARTICOLARI AL DI SOTTO DI UN LIVELLO CRITICO (PER ES. RIDUZIONI DI O 2, H 2 O E IDROCARBURI IN TUBI ELETTRONICI). f) SIMULARE PARTICOLARI SITUAZIONI FISICHE (CAMERE DI SIMULAZIONE SPAZIALE PER PROVE SU SATELLITI E NAVI SPAZIALI). Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 5 LIVELLI DI VUOTO Esempi di applicazione del vuoto Intervallo di pressione in cui si opera comunemente (Pa) Simulazione spaziale Preparazione di film sottili Tubi elettronici (cinescopi, valvole termoioniche, collettori solari, ecc.) Metallurgia (fusioni e leghe sotto vuoto, metallizzazione, ecc.) Macchine acceleratrici di particelle Fisica dei plasmi e macchine per fusione nucleare Studio di superficie (struttura, composizione) Catalisi eterogenea (studio di meccanismi di reazione, superfici) Liofilizzazione Isolamento termico Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 6 3
4 COME SI FA IL VUOTO? PER OTTENERE IL VUOTO È NECESSARIO UTILIZZARE POMPE (UNA O PIÙ A SECONDA DEL LIVELLO DESIDERATO). Pompe a getto di liquido o gas Pompe meccaniche Pompe a vapore Pompe ad assorbimento, criopompe, ioniche, getter, a sublimazione Principio fisico Tipo Pressione (Pa) Si sfrutta la trasformazione di "energia di velocità" di un fluido in "energia di pressione" Realizzano l'aspirazione e lo scarico del gas mediante parti meccaniche in movimento Basate sul trasferimento di quantità di moto tra le molecole di una corrente di vapore e le molecole di un altro aeriforme Il gas da evacuare viene fissato senza essere espulso dalla camera (non hanno uscita di scarico) Pompe a getto d'acqua Pompe a getto di aria Pompe rotative Pompe a diaframma Pompe turbomolecolari Pompe booster a vapore Pompe a diffusione Pompe ioniche Pompe a sublimazione di Titanio Criopompe fino a fino a Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 7 TIPICI INTERVALLI DI VUOTO (Pa) 1 atm = 760 Torr = bar = Pa 1 Pa = 1 N/m 2 = 10-5 bar = atm = Torr Basso Medio Alto Molto alto Ultra alto Aspirapolvere Alta Atmosfera Spazio interstellare Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 8 4
5 LE RAGIONI PER CUI SI DESIDERA PRODURRE IL VUOTO SONO LEGATE ALLA NATURA DELL APPLICAZIONE CONSIDERATA, E POSSONO ESSERE MOLTEPLICI. AVERE SUPERFICI PULITE E MANTENERLE TALI DURANTE LA FASE DI STUDIO USARE TECNICHE SPERIMENTALI A BASSA ENERGIA BASATE SU ELETTRONI O IONI, SENZA AVERE INTERFERENZE DA SCATTERING RALLENTARE I PROCESSI DI DECOMPOSIZIONE ELIMINARE GAS DISCIOLTI CONTENUTI IN UN MATERIALE VEDIAMO I PARAMETRI DA CONSIDERARE. Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 9 1. DENSITÀ DEI GAS: può essere stimata dalla legge dei gas perfetti n = = ( N / V ) = p/ (kt)( [ molecole m -3 ] n = N/N A dove: p - pressione [N m -2 ] k - Constante Boltzmann (R/N A = J K -1 ) T - temperatura [K] Considerando un qualsiasi gas a 20 C ( K) si avrà: n = p(pa) x molecole/cm 3 = p(pa) x molecole/m 3 Considerando un qualsiasi gas a c.n. (p = 1 atm = Pa; T = 0 C K) si avrà: n = molecole/cm 3 = molecole/m 3 Considerando un gas in UHV (p = 10-7 Pa) si avrà n = molecole/cm 3 (sempre elevato!!!) Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 10 5
6 Densità dei Gas (molecole/cm 3 ) Densità dei Gas (molecole/m 3 ) c.n. T = K, p = Pa c.s. T = K, p = Pa UHV T = K, p = 10-7 Pa UHV T = K, p = 10-7 Pa n = p / (k T) Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti CAMMINO LIBERO MEDIO DELLE PARTICELLE: RAPPRESENTA LA DISTANZA MEDIA PERCORSA DA UNA PARTICELLA, IN FASE GASSOSA, FRA DUE URTI SUCCESSIVI. =, [m] dove: p - pressione [N m -2 ] k - Constante Boltzmann ( = J K -1 ) T - temperatura [K] σ sezione d urto [m 2 ] Considerando l aria a c.n. (p = 1 atm = Pa; T = 0 C K) si avrà: c.n. λ 0 = m (cosa significa? strumentazione ) NEL UHV λ = 10 5 m PER CUI SI POSSONO TRASCURARE SICURAMENTE LE COLLISIONI INTERMOLECOLARI IN FASE GAS!!! λ 50 km 10-6 m cioè λ diminuisce con l altitudine e a circa 100 km si avrà λ 100 km 10-1 m e si entra nella regione dell atmosfera rarefatta. Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 12 6
7 Densità dei Gas (molecole/m 3 ) Cammino libero medio delle particelle (m) c.n. T = K, p = Pa c.s. T = K, p = Pa UHV T = K, p = 10-7 Pa UHV T = K, p = 10-7 Pa = n = p / (k T), Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti FLUSSO DI MOLECOLE INCIDENTI SULLA SUPERFICIE: UNO DEI FATTORI CRUCIALI NEL DETERMINARE PER QUANTO TEMPO UNA SUPERFICIE PUÒ ESSERE MANTENUTA PULITA È IL NUMERO DI MOLECOLE DI GAS CHE IMPATTANO SULLA SUPERFICIE DALLA FASE GASSOSA. IL FLUSSO INCIDENTE È DATO DAL NUMERO DI MOLECOLE DI INCIDENTI PER UNITÀ DI TEMPO PER UNITÀ DI SUPERFICIE. dove : n densità gas [molecole m -3 ] v velocità media [m s -1 ] Φ= [molecole m-2 s -1 ] (NOTA - il flusso non tiene conto dell'angolo di incidenza, è semplicemente una sommatoria di tutte le molecole che arrivano su tutti i possibili angoli di incidenza) CONSIDERANDO LA DISTRIBUZIONE DELLE VELOCITÀ DI MAXWELL-BOLTZMANN: = [m s -1 ] Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 14 dove : m massa molecolare [kg] k - Constante Boltzmann ( = J K -1 ) T - temperatura [K] 7
8 3. FLUSSO DI MOLECOLE INCIDENTI SULLA SUPERFICIE: PER UN DATO INSIEME DI CONDIZIONI (p, T, ecc), IL FLUSSO È FACILMENTE CALCOLATO UTILIZZANDO L'EQUAZIONE DEL GAS IDEALE E LA DISTRIBUZIONE DI VELOCITÀ DEL GAS DI MAXWELL-BOLTZMANN: n =(N/V)=p/(kT) = Φ= (NOTA - il flusso risulta direttamente proporzionale alla pressione) [molecole m -2 s -1 ] Per l'aria a 20 C risultav = 440 m/s ed Φ p(pa) (molecole m -2 s -1 ) = p(pa) (molecole cm -2 s -1 ). Ad 1 atmosfera (1 atm = Pa), circa molecole colpiranno ogni cm 2 di superficie per secondo! CIÒ SIGNIFICA CHE OGNI ATOMO SUPERFICIE È COLPITO, IN MEDIA, UNA VOLTA OGNI 10 NANOSECONDI. Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 15 Densità dei Gas c.n. T = K, p = Pa c.s. T = K, p = Pa UHV T = K, p = 10-7 Pa UHV T = K, p = 10-7 Pa (molecole/m 3 ) Cammino libero medio delle particelle (m) 2.90 Flusso di molecole incidenti sulla superficie (molecole m -2 s -1 ) n = p / (k T) = Φ=, Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 16 8
9 4. ESPOSIZIONE DI UNA SUPERFICIE AD UN GAS: QUANTITÀ DI GAS A CUI È SOTTOPOSTA UNA SUPERFICIE, PARI AL PRODOTTO TRA LA PRESSIONE ED IL TEMPO DI ESPOSIZIONE. Esposizione = f(p, t) [L = Langmuir] (se la pressione è costante, o più in generale calcolando l'integrale della pressione durante il periodo di tempo di interesse.) 1 L = p t 10 6 (in Torr) = p t (in Pa) ASSUMENDO CHE OGNI MOLECOLA DI GAS CHE GIUNGE SULLA SUPERFICIE VI SI ATTACCA, 1 L COMPORTA LA FORMAZIONE DI CIRCA UN MONOSTRATO DI MOLECOLE DI GAS ADSORBITE DALLA SUPERFICIE. 1 Torr = 133 Pa 1 Pa = Torr Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti ESPOSIZIONE DI UNA SUPERFICIE AD UN GAS: QUANTITÀ DI GAS A CUI È SOTTOPOSTA UNA SUPERFICIE, PARI AL PRODOTTO TRA LA PRESSIONE ED IL TEMPO DI ESPOSIZIONE. 1 L = p t 10 6 (in Torr) A quale pressione si ottiene il completo ricoprimento di una superficie per l'esposizione ad un gas per un tempo di 1200 secondi? Considerando un tempo di 1200 secondi (20 min, tempo tipico di un esperimento) si ottiene1 Langmuir alla pressione di circa 10-7 Pa. p = 1 / ( ) = Torr = 10-7 Pa A pressione atmosferica (760 Torr = Pa) un monostrato si otterrà in s (1 ns). t(s) = 1 / ( ) = s In UHV (10-9 Torr 10-7 Pa) un monostrato si otterrà in 10 3 s (circa 20 min). t(s) = 1 / ( ) = 10 3 s Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 18 9
10 5. COEFFICIENTE DI «STICKING» E RICOPRIMENTO SUPERFICIALE: IL COEFFICIENTE DI ADSORBIMENTO, S (STICKING), È UNA MISURA DELLA FRAZIONE DI MOLECOLE INCIDENTI CHE ADSORBONO SULLA SUPERFICIE, CIOÈ È UNA PROBABILITÀ E VARIA TRA 0-1 (dove i limiti corrispondono a nessun adsorbimento e completare adsorbimento di tutte le molecole incidenti rispettivamente). IN GENERALE, S DIPENDE DA MOLTE VARIABILI S = f(ricoprimento superficiale, T, Faccia del cristallo...) IL RICOPRIMENTO SUPERFICIALE DI UNA SPECIE ADSORBITA PUÒ ESSERE SPECIFICATO IN DIVERSI MODI: NUMERO DI SPECIE ADSORBITE PER UNITÀ DI AREA DI SUPERFICIE (AD ESEMPIO IN molecole cm -2 ). FRAZIONE DEL MASSIMO DI SUPERFICIE RICOPRIBILE (0 < θ < 1) θ = DENSITÀ ATOMICA NELLO STRATO PIÙ ESTERNO DEL SUBSTRATO (SOLITAMENTE θ <1) Nota: un monostrato (1 ML) di adsorbato è la massima concentrazione superficiale ottenibile da specie adsorbite, legate al substrato. à θ = Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 19 QUANTO TEMPO CI VORRÀ PERCHÈ UNA SUPERFICIE PULITA VENGA RICOPERTA DA UN MONOSTRATO COMPLETO DI ADSORBATO? È POSSIBILE OTTENERE UNA STIMA MINIMA DEL TEMPO RICHIESTO IPOTIZZANDO UNA PROBABILITÀ DI STACKING PARI AD 1 (CIOÈ S = 1) E CONSIDERANDO CHE PER AVERE UN RICOPRIMENTO TOTALE (MONOSTRATO) SERVONO FLUSSI GENERALMENTE DELL'ORDINE DI PER cm 2 O PER m 2. TEMPO / ML ~ (10 19 / Φ) [s] Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 20 10
11 Flusso di molecole incidenti sulla superficie (molecole m -2 s -1 ) Flusso di molecole incidenti sulla superficie (molecole cm -2 s -1 ) c.n. T = K, p = Pa c.s. T = K, p = Pa UHV T = K, p = 10-7 Pa UHV T = K, p = 10-7 Pa Φ= Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 21 CHE PRESSIONE SERVE PER LAVORARE CON SUPERFICI PULITE? AD 1 ATMOSFERA (1 atm = Pa), CIRCA MOLECOLE COLPIRANNO OGNi cm 2 DI SUPERFICIE PER SECONDO! QUESTO NUMERO È TROPPO GRANDE DA IMMAGINARE, CERCHIAMO QUINDI UNA RELAZIONE COL NUMERO DI ATOMI IN UNA SUPERFICIE, Σ ~ n b 2/3 DOVE n b È IL NUMERO DI ATOMI PER CENTIMETRO CUBO NEL SOLIDO (Σ DIPENDE DALLA DIREZIONE CRISTALLOGRAFICA DEI CRISTALLI E DALLA TOPOGRAFIA DELLA SUPERFICIE). n b = N A x δ/mm [molecole cm -3 ] dove : N A numero di Avogadro [ molecole/mol] δ densità [g cm -3 ] MM massa molecolare [uma] solitamente si considera δ / MM 0.1 Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 22 11
12 CHE PRESSIONE SERVE PER LAVORARE CON SUPERFICI PULITE? QUINDI LA DENSITÀ DELLE MOLECOLE IN SUPERFICIE SARÀ: Σ n 2/3 b [molecole cm -2 ] E SI AVRÀ: Φ / Σ ~ CIÒ SIGNIFICA CHE A PRESSIONE ATMOSFERICA, A LIVELLO DEL MARE, CIASCUNA MOLECOLA SULLA SUPERFICIE VIENE COLPITA 200 MILIONI DI VOLTE AL SECONDO, CIOÈ UNA VOLTA OGNI 5 NANOSECONDI : 1 s = 1 collisione : x con x = 5 ns DOBBIAMO CONFRONTARE QUESTO CON IL TEMPO IN GENERE NECESSARIO PER FARE UN ESPERIMENTO, CIRCA 20 MINUTI. Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 23 CHE PRESSIONE SERVE PER LAVORARE CON SUPERFICI PULITE? SE INVECE CI TROVIAMO IN CONDIZIONI DI UHV SI AVRÀ: Σ n b 2/ [molecole cm -2 ], Φ = [molecole cm -2 s -1 ] Φ / Σ ~ CIOÈ OGNI ATOMO SARÀ COLPITO UNA VOLTA OGNI 10 5 s (CONTRO UNA VOLTA OGNI 5 ns A PRESSIONE ORDINARIA). DURANTE IL TEMPO DELL ESPERIMENTO (20 min =1200 s), NON VOGLIAMO CHE UN NUMERO SIGNIFICATIVO DI MOLECOLE COLPISCA LA SUPERFICIE IN QUANTO POSSONO ATTACCARSI O PRODURRE ALTRI CAMBIAMENTI. Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 24 12
13 CHE PRESSIONE SERVE PER LAVORARE CON SUPERFICI PULITE? SE ABBIAMO BISOGNO DI AVERE SOLTANTO UNA PROBABILITÀ DEL 10% CHE UNA MOLECOLA DI SUPERFICIE VENGA COLPITA DURANTE QUESTO TEMPO, LA VELOCITÀ DI COLLISIONE DEVE ESSERE PIÙ PICCOLA DI UN FATTORE DI CIRCA: 200 minuti (=12000 s) / 5 nanosecondi, cioè CIÒ RICHIEDE UNA PRESSIONE DI CIRCA 10-8 Pa. SE LE MOLECOLE NON SI ATTACCANO ALLA SUPERFICIE OGNI VOLTA CHE VIENE COLPITA, I REQUISITI DI VUOTO SONO MINORI. CIOÈ, SE LA PROBABILITÀ CHE SI ATTACCHI È DI 0.1 SI PUÒ LAVORARE CON UN VUOTO DI 10-7 Pa. UHV È TIPICAMENTE CONSIDERATO SOTTO 10-7 Pa. ANCHE A VUOTO PIÙ SPINTO, CI SONO ANCORA MOLTE MOLECOLE IN FASE GASSOSA, CIRCA PER cm 3. NELLO SPAZIO INTERSTELLARE, LA DENSITÀ DELLE MOLECOLE PUÒ ARRIVARE A POCHE MOLECOLE PER cm 3, CORRISPONDENTI A CIRCA Pa. Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 25 VARIAZIONE DEI PARAMETRI CON LA PRESSIONE Livello di vuoto Pressione (Pa) Densità Gas (molecole m -3 ) Cammino libero medio (m) Tempo / ML (s) Atmosferico x x Basso x x Medio x x Alto x UltraAlto x x Assenza collisioni p < 10 1 Pa Superficie pulita p < 10-7 Pa Per le tecniche spettroscopiche, il cammino libero medio delle particelle nel vuoto deve essere significativamente maggiore delle dimensioni dell'apparecchiatura in modo che queste particelle possono viaggiare verso la superficie e dalla superficie al rivelatore senza subire alcuna interazione con le molecole di gas residue. Questo richiede p < 10 1 Pa (10-4 atm). Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 26 13
14 VARIAZIONE DEI PARAMETRI CON LA PRESSIONE Assenza collisioni p < 10 1 Pa Superficie pulita p < 10-7 Pa LA MAGGIOR PARTE DELLE TECNICHE SPETTROSCOPICHE SONO ANCHE IN GRADO DI RILEVARE MOLECOLE IN FASE GAS; IN QUESTI CASI È PREFERIBILE CHE IL NUMERO DI SPECIE PRESENTI SULLA SUPERFICIE SUPERI SOSTANZIALMENTE QUELLE PRESENTI NELLA FASE GASSOSA IMMEDIATAMENTE SOPRA LA SUPERFICIE. Per ottenere una discriminazione tra superficie/fase gas migliore di 10:1 nell'analisi di ca. 1% di un monostrato su una superficie piana, questo richiede che la concentrazione in fase gas sia inferiore a ca molecole cm -3 (= molecole m -3 ), cioè che la pressione (parziale) sia dell'ordine di 10 Pa o inferiore (cioè p <10 1 Pa). Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 27 VARIAZIONE DEI PARAMETRI CON LA PRESSIONE Assenza collisioni p < 10 1 Pa Superficie pulita p < 10-7 Pa PER EFFETTUARE ESPERIMENTI CON UNA SUPERFICIE PULITA RIPRODUCIBILE, E PER EVITARE UNA CONTAMINAZIONE SIGNIFICATIVA DURANTE UN ESPERIMENTO A CAUSA DEL GAS RESIDUO, LA PRESSIONE DEVE ESSERE TALE CHE IL TEMPO NECESSARIO PER CONTAMINANTE SIA SOSTANZIALMENTE MAGGIORE DI QUELLO NECESSARIO A CONDURRE L'ESPERIMENTO, (IN GENERE DELL'ORDINE DI ORE). La pressione necessaria dipende dalla natura della superficie, ma per superfici molto reattive si richiede l'uso dell UHV (cioè p <10-7 Pa). Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 28 14
15 VUOTO IN REALTÀ NON SIGNIFICA CHE NON VI È NULLA!!! Abbassando la pressione fino all UHV non vuol dire avere una superficie incontaminata. Questo perché c'è sempre del gas adsorbito sulla superficie che, a causa della sua bassa pressione di vapore o velocità di sublimazione, non sarà desorbito in un tempo ragionevole. Gas tipici sono il VAPORE ACQUEO, che può essere rimosso mediante «cottura» (se l integrità del campione lo consente), e CONTAMINANTI IDROCARBURICI da inquinamento atmosferico. La contaminazione da idrocarburi è onnipresente e non può rimossa tramite «cottura». È importante notare che qualsiasi superficie esposta all'atmosfera, anche se poco reattiva come l oro, è coperta da uno strato contaminante di idrocarburi. Questo significa che per studiare le superfici elementari si deve prima produrle (crescita) o pulirle sotto vuoto (sputtering). Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 29 COME SI OTTIENE UHV? IL RAGGIUNGIMENTO DI UHV RICHIEDE ATTREZZATURE SPECIALIZZATE E PROCEDURE RIGOROSE. Solitamente nei sistemi UHV si lavora a temperatura ambiente (alcuni set up consentono l uso di basse t). Caratteristiche richieste per un sistema UHV: Sistemi a prova di tenuta (misura della perdita eventuale) Non devono contenere materiali che sono permeabili ai gas (come guarnizioni di gomma) Rimozione del vapore acqueo dalle pareti interne (cottura a temperature di circa 100 C o superiori, ma con tempi più brevi, perché le velocità di desorbimento variano in modo esponenziale con la temperatura) v D (T) = f(t) exp(- E/kT) Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 30 15
16 INFLUENZA DELLA TEMPERATURA PICCOLI CAMBIAMENTI DI TEMPERATURA SIGNIFICANO GRANDI CAMBIAMENTI NELLA VELOCITÀ DI DESORBIMENTO. v D (T) = f(t) exp(- E D /kt) dove E D è Energia di Desorbimento f(t) varia lentamente con la T ed è il termine esponenziale a predominare. A temperatura ambiente (T = 25 C, kt = J = 0,0256 ev) si ottiene, per una energia di desorbimento pari a E D = J = 0.5 ev, tipica del vapore acqueo, si avrà v D (T) = e -19,47 ~ Aumentando la temperatura fino a 150 C otteniamo v D (T) = e = 10-6, con un incremento di quasi tre ordini di grandezza. Riscaldare la superficie per migliorare il desorbimento limita però la scelta dei materiali che possono essere utilizzati nella costruzione del sistema. Non potranno essere usati materiali con bassa tensione di vapore, come materiali plastici od oli. Inoltre anche la superficie stessa può subire deterioramento a causa della elevata temperatura; anche per questo la temperatura massima usata è di 250 C, ma riducendo i tempi dell esperimento. Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 31 Corso di Chimica delle Superfici ed Interfasi - G. Fioravanti 32 16
CHIMICA DELLE SUPERFICI ED INTERFASI
 CHIMICA DELLE SUPERFICI ED INTERFASI DOTT. GIULIA FIORAVANTI UNIVERSITÀ DEGLI STUDI DELL AQUILA LAUREA MAGISTRALE IN INGEGNERIA CHIMICA LAUREA MAGISTRALE IN SCIENZE CHIMICHE TECNICA DEL VUOTO Corso di
CHIMICA DELLE SUPERFICI ED INTERFASI DOTT. GIULIA FIORAVANTI UNIVERSITÀ DEGLI STUDI DELL AQUILA LAUREA MAGISTRALE IN INGEGNERIA CHIMICA LAUREA MAGISTRALE IN SCIENZE CHIMICHE TECNICA DEL VUOTO Corso di
Il Vuoto Fisico. un invito al laboratorio. Andrea Fontana, INFN Pavia
 Il Vuoto Fisico un invito al laboratorio Andrea Fontana, INFN Pavia Il più potente acceleratore di particelle: LHC LHC ha la particolarità di non avere uno solo, ma tre sistemi di vuoto: 1. vuoto per i
Il Vuoto Fisico un invito al laboratorio Andrea Fontana, INFN Pavia Il più potente acceleratore di particelle: LHC LHC ha la particolarità di non avere uno solo, ma tre sistemi di vuoto: 1. vuoto per i
Classificazione della materia 3 STATI DI AGGREGAZIONE
 Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Lo stato gassoso. Particelle con volume proprio trascurabile puntiformi
 Lo stato gassoso Gas ideale (o perfetto) Particelle in movimento (casuale) Particelle con volume proprio trascurabile puntiformi Assenza di interazioni tra le particelle trasformazioni fisiche e non chimiche
Lo stato gassoso Gas ideale (o perfetto) Particelle in movimento (casuale) Particelle con volume proprio trascurabile puntiformi Assenza di interazioni tra le particelle trasformazioni fisiche e non chimiche
La Tecnologia del Vuoto
 La Tecnologia del Vuoto Dr. Stefania Benedetti Corso di Laurea Specialistica/Magistrale in Fisica Università di Ferrara 1 Cos è il Vuoto Zona con pressione inferiore a 1 atm A cosa serve? evitare interazione
La Tecnologia del Vuoto Dr. Stefania Benedetti Corso di Laurea Specialistica/Magistrale in Fisica Università di Ferrara 1 Cos è il Vuoto Zona con pressione inferiore a 1 atm A cosa serve? evitare interazione
LE PROPRIETA DELLA MATERIA
 LE PROPRIETA DELLA MATERIA Gli aspetti macroscopico, microscopico e particellare della materia La materia è tutto ciò che possiede una massa e occupa un volume, cioè una porzione di spazio Un campione
LE PROPRIETA DELLA MATERIA Gli aspetti macroscopico, microscopico e particellare della materia La materia è tutto ciò che possiede una massa e occupa un volume, cioè una porzione di spazio Un campione
La teoria cinetica dei gas
 La teoria cinetica dei gas Gas: un numero grandissimo gandissimodi molecole in moto caotico. Interazione tra molecole solo in caso di urto. Calcolando la pressione come dovuta all urto di tutte le molecole
La teoria cinetica dei gas Gas: un numero grandissimo gandissimodi molecole in moto caotico. Interazione tra molecole solo in caso di urto. Calcolando la pressione come dovuta all urto di tutte le molecole
Il Gas Ideale. Il gas ideale é un'astrazione
 Il Gas Ideale a) le particelle sono animate da moto perenne, ed occupano omogeneamente tutto lo spazio a loro disposizione b) il movimento delle particelle è casuale c) le particelle hanno volume proprio
Il Gas Ideale a) le particelle sono animate da moto perenne, ed occupano omogeneamente tutto lo spazio a loro disposizione b) il movimento delle particelle è casuale c) le particelle hanno volume proprio
Diagramma di stato di H 2 O
 Lezione 13 1. Pressione e temperatura 2. Leggi dei gas 3. Teoria cinetica ei gas 4. Gas ideali e gas reali 5. Miscele gassose: legge di Dalton 6. Frazioni molari Diagramma di stato di H 2 O Diagrammi di
Lezione 13 1. Pressione e temperatura 2. Leggi dei gas 3. Teoria cinetica ei gas 4. Gas ideali e gas reali 5. Miscele gassose: legge di Dalton 6. Frazioni molari Diagramma di stato di H 2 O Diagrammi di
Stati di aggregazione della materia. dal microscopico al macroscopico: struttura. interazioni GASSOSO. proprietà SOLIDO LIQUIDO
 Stati di aggregazione della materia GASSOSO dal microscopico al macroscopico: struttura interazioni proprietà SOLIDO LIQUIDO Lo stato gassoso È uno dei tre stati di aggregazione della materia, caratterizzato
Stati di aggregazione della materia GASSOSO dal microscopico al macroscopico: struttura interazioni proprietà SOLIDO LIQUIDO Lo stato gassoso È uno dei tre stati di aggregazione della materia, caratterizzato
Corso di Chimica Generale CL Biotecnologie
 Corso di Chimica Generale CL Biotecnologie STATI DELLA MATERIA Prof. Manuel Sergi MATERIA ALLO STATO GASSOSO MOLECOLE AD ALTA ENERGIA CINETICA GRANDE DISTANZA TRA LE MOLECOLE LEGAMI INTERMOLECOLARI DEBOLI
Corso di Chimica Generale CL Biotecnologie STATI DELLA MATERIA Prof. Manuel Sergi MATERIA ALLO STATO GASSOSO MOLECOLE AD ALTA ENERGIA CINETICA GRANDE DISTANZA TRA LE MOLECOLE LEGAMI INTERMOLECOLARI DEBOLI
TIROCINIO ESTIVO 2010
 TIROCINIO ESTIVO 2010 FBK - UNITA DI RICERCA PAM-SE (Plasma Advanced Materials and Surface Engineering research unit) La ricerca scientifica: metodi e strumenti per fare di un idea una realtà Il ruolo
TIROCINIO ESTIVO 2010 FBK - UNITA DI RICERCA PAM-SE (Plasma Advanced Materials and Surface Engineering research unit) La ricerca scientifica: metodi e strumenti per fare di un idea una realtà Il ruolo
DINAMICA DEGLI INQUINANTI A.A PROPRIETA DELL ATMOSFERA PROF. RENATO BACIOCCHI
 DINAMICA DEGLI INQUINANTI A.A. 2012 2013 PROPRIETA DELL ATMOSFERA PROF. RENATO BACIOCCHI ARGOMENTI TRATTATI: 1. ATMOSFERA Estensione e struttura dell atmosfera Composizione dell aria Principali parametri
DINAMICA DEGLI INQUINANTI A.A. 2012 2013 PROPRIETA DELL ATMOSFERA PROF. RENATO BACIOCCHI ARGOMENTI TRATTATI: 1. ATMOSFERA Estensione e struttura dell atmosfera Composizione dell aria Principali parametri
Chimica generale. Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologia agroalimentare PARTE 3
 Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologia agroalimentare PARTE 3 1 GLI STATI DI AGGREGAZIONE DELLA MATERIA 2 I composti chimici
Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologia agroalimentare PARTE 3 1 GLI STATI DI AGGREGAZIONE DELLA MATERIA 2 I composti chimici
PROPRIETÁ DEI LIQUIDI
 PROPRIETÁ DEI LIQUIDI Viscosità: resistenza di un fluido al flusso, ossia scorrimento relativo delle molecole Una semplice misura (indiretta) è il tempo di efflusso di un dato volume di liquido attraverso
PROPRIETÁ DEI LIQUIDI Viscosità: resistenza di un fluido al flusso, ossia scorrimento relativo delle molecole Una semplice misura (indiretta) è il tempo di efflusso di un dato volume di liquido attraverso
CAMPIONAMENTO fondamentale analisi campionamento omogenei stessa composizione variazione l abilità persona variabilità metodo analitico realtà
 CAMPIONAMENTO Un momento fondamentale di una analisi è rappresentato dal campionamento, generalmente si pensa che i campioni da analizzare siano omogenei e che abbiano in ogni punto la stessa composizione,
CAMPIONAMENTO Un momento fondamentale di una analisi è rappresentato dal campionamento, generalmente si pensa che i campioni da analizzare siano omogenei e che abbiano in ogni punto la stessa composizione,
INTRODUZIONE ALLA TERMODINAMICA. Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta
 INTRODUZIONE ALLA TERMODINAMICA Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta in un recipiente, ad esempio 5g di ossigeno. Dato l elevato numero di molecole
INTRODUZIONE ALLA TERMODINAMICA Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta in un recipiente, ad esempio 5g di ossigeno. Dato l elevato numero di molecole
Fiocchi di neve. temperature di -40 C. 1 nelle nubi la densità e la pressione possono essere tali da mantenere l acqua allo stato di vapore anche a
 Fiocchi di neve C è tutto un mondo di forme diverse di cristalli nascosto nella neve. I fiocchi che scendono, a seconda di molteplici fattori fisici e chimici, sono costituiti da cristalli che assumono
Fiocchi di neve C è tutto un mondo di forme diverse di cristalli nascosto nella neve. I fiocchi che scendono, a seconda di molteplici fattori fisici e chimici, sono costituiti da cristalli che assumono
U.M.A. e le masse ATOMICHE
 U.M.A. e le masse ATOMICHE L unità di massa atomica (u.m.a.) viene definita come 1/12 della massa del 12 C Il peso atomico (massa atomica relativa) di un atomo viene definito come: massa atomo considerato
U.M.A. e le masse ATOMICHE L unità di massa atomica (u.m.a.) viene definita come 1/12 della massa del 12 C Il peso atomico (massa atomica relativa) di un atomo viene definito come: massa atomo considerato
Ultima verifica pentamestre. 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!
 Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
Il microscopio elettronico: oltre la lunghezza d onda della luce visibile
 Il microscopio elettronico: oltre la lunghezza d onda della luce visibile Perché utilizzare gli elettroni come radiazione: - si possono produrre facilmente (fotoemissione, emissione termoionica, elettroni
Il microscopio elettronico: oltre la lunghezza d onda della luce visibile Perché utilizzare gli elettroni come radiazione: - si possono produrre facilmente (fotoemissione, emissione termoionica, elettroni
Stati di aggregazione della materia. Luca Stanco - Fisica 2015/16 Corso di Laurea in Igiene Dentale - Lezione 5
 Fluidi 1 Stati di aggregazione della materia 2 Densità (II) n La densità assoluta è definita dal rapporto tra la massa M di una sostanza omogenea ed il suo volume V: d = M / V n Nel sistema internazionale
Fluidi 1 Stati di aggregazione della materia 2 Densità (II) n La densità assoluta è definita dal rapporto tra la massa M di una sostanza omogenea ed il suo volume V: d = M / V n Nel sistema internazionale
LISTA DEI SIMBOLI. Simboli latini
 LISTA DEI SIMBOLI Simboli latini Accelerazione [m/s] Area di raccolta degli elettroni [m 2 ] Accelerazione dovuta alla forza di Coulomb [m/s] Area del collimatore [m 2 ] Area della sezione dell elemento
LISTA DEI SIMBOLI Simboli latini Accelerazione [m/s] Area di raccolta degli elettroni [m 2 ] Accelerazione dovuta alla forza di Coulomb [m/s] Area del collimatore [m 2 ] Area della sezione dell elemento
GAS. Forze di legame intermolecolari ridotte Stato altamente disordinato
 I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
Esame di Chimica Generale 13 Gennaio 2017
 Esame di Chimica Generale 13 Gennaio 2017 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 13 Gennaio 2017 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Teoria Cinetica Molecolare dei Gas Ideali
 Teoria Cinetica Molecolare dei Gas Ideali Un gas è composto da molecole molto lontane tra di loro in confronto alle loro dimensioni e possono essere considerate puntiformi, quindi prive di volume. Le molecole
Teoria Cinetica Molecolare dei Gas Ideali Un gas è composto da molecole molto lontane tra di loro in confronto alle loro dimensioni e possono essere considerate puntiformi, quindi prive di volume. Le molecole
14. Transizioni di Fase_a.a. 2009/2010 TRANSIZIONI DI FASE
 TRANSIZIONI DI FASE Fase: qualsiasi parte di un sistema omogenea, di composizione chimica costante e in un determinato stato fisico. Una fase può avere le stesse variabili intensive (P, T etc) ma ha diverse
TRANSIZIONI DI FASE Fase: qualsiasi parte di un sistema omogenea, di composizione chimica costante e in un determinato stato fisico. Una fase può avere le stesse variabili intensive (P, T etc) ma ha diverse
Fenomeno di trasporto di materiale per movimento di atomi
 Diffusione Fenomeno di trasporto di materiale per movimento di atomi Reazioni e processi (es. termici) basati sul trasferimento di massa all interno di uno stesso solido (autodiffusione) tra solido e liquido
Diffusione Fenomeno di trasporto di materiale per movimento di atomi Reazioni e processi (es. termici) basati sul trasferimento di massa all interno di uno stesso solido (autodiffusione) tra solido e liquido
CO 2 NO 2 SO 2 CH 4. He Ne Ar H 2 N 2 O 2 Cl 2
 Lo stato gassoso I gas sono materiali caratterizzati dalla mancanza di forma e volume propri. Assumono la forma ed il volume del recipiente che li contiene e sono facilmente comprimibili. Le sostanze gassose
Lo stato gassoso I gas sono materiali caratterizzati dalla mancanza di forma e volume propri. Assumono la forma ed il volume del recipiente che li contiene e sono facilmente comprimibili. Le sostanze gassose
Un modello per il gas ideale
 Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
Equazioni differenziali ordinarie del primo ordine
 Equazioni differenziali ordinarie del primo ordine 1.Integrazione di un equazione cinetica: idrolisi di un alogenuro alchilico terziario....cinetica di adsorbimento di Langmuir...4 1 1.Integrazione di
Equazioni differenziali ordinarie del primo ordine 1.Integrazione di un equazione cinetica: idrolisi di un alogenuro alchilico terziario....cinetica di adsorbimento di Langmuir...4 1 1.Integrazione di
Misure di pressione. Misura diretta. Misura indiretta. Lab di rivelatori LS. Misure di pressione (Ciullo G.) Lab di rivelatori LS
 Misure di pressione Misura diretta» Fenomeni di trasporto Misura indiretta» Ionizzazione Misura diretta Manometri capacitivi Baratron Piezo Membranovac Diaframma capacitivo: Misuratori tra i più ال precisi
Misure di pressione Misura diretta» Fenomeni di trasporto Misura indiretta» Ionizzazione Misura diretta Manometri capacitivi Baratron Piezo Membranovac Diaframma capacitivo: Misuratori tra i più ال precisi
Leggi ricavate da osservazioni sperimentali : mantenendo costante due dei 4 parametri, come variano gli altri due?
 Le leggi dei gas Lo stato gassoso è caratterizzato da mancanza di forma e volume propri, e dalla tendenza a occupare tutto il volume disponibile. Lo stato di un gas dipende da 4 parametri: Volume (V) Pressione
Le leggi dei gas Lo stato gassoso è caratterizzato da mancanza di forma e volume propri, e dalla tendenza a occupare tutto il volume disponibile. Lo stato di un gas dipende da 4 parametri: Volume (V) Pressione
GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato liquido
 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato liquido Lo stato liquido Liquidi: energia dei moti termici confrontabile con quella delle forze coesive. Limitata libertà di movimento delle molecole, che
GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato liquido Lo stato liquido Liquidi: energia dei moti termici confrontabile con quella delle forze coesive. Limitata libertà di movimento delle molecole, che
Lo stato gassoso. L atmosfera terrestre è il sistema gassoso in cui siamo immersi
 Lo stato gassoso L atmosfera terrestre è il sistema gassoso in cui siamo immersi I gas sono comprimibili (ampi spazi vuoti tra le particelle?) I gas si espandono facilmente riempiendo rapidamente lo spazio
Lo stato gassoso L atmosfera terrestre è il sistema gassoso in cui siamo immersi I gas sono comprimibili (ampi spazi vuoti tra le particelle?) I gas si espandono facilmente riempiendo rapidamente lo spazio
Equilibri chimici. Chimica
 Chimica Silvia LICOCCIA Professore Ordinario di Fondamenti Chimici per le Tecnologie Dipartimento di Scienze e Tecnologie Chimiche Università di Roma Tor Vergata Equilibri chimici Equilibrio Chimico Studio
Chimica Silvia LICOCCIA Professore Ordinario di Fondamenti Chimici per le Tecnologie Dipartimento di Scienze e Tecnologie Chimiche Università di Roma Tor Vergata Equilibri chimici Equilibrio Chimico Studio
Lo stato gassoso gas. Caratteristiche dello stato gassoso. liquido. solido. assenza di volume proprio forma fluida
 Lo stato gassoso gas liquido solido assenza di volume proprio forma fluida Caratteristiche dello stato gassoso Capacità di occupare tutto lo spazio a disposizione Distanze molto grandi tra le particelle
Lo stato gassoso gas liquido solido assenza di volume proprio forma fluida Caratteristiche dello stato gassoso Capacità di occupare tutto lo spazio a disposizione Distanze molto grandi tra le particelle
Figura 2.1: Semiconduttori.
 Capitolo 2 Semiconduttori 2.1 Semiconduttori Con il termine semiconduttori si indicano alcuni elementi delle colonne III, IV e V della tavola periodica, caratterizzati da una resistività elettrica ρ intermedia
Capitolo 2 Semiconduttori 2.1 Semiconduttori Con il termine semiconduttori si indicano alcuni elementi delle colonne III, IV e V della tavola periodica, caratterizzati da una resistività elettrica ρ intermedia
Misure di pressione. Lab di rivelatori LS. Tecnologia del vuoto sistemi di pompaggio(ciullo G.)
 Misure di pressione Misura diretta Misura indiretta Misura diretta Manometri capacitivi Baratron Piezo Membranovac Diaframma capacitivo: لا Misuratori tra i più precisi esistenti sul mercato 0.15.%» 1100-10
Misure di pressione Misura diretta Misura indiretta Misura diretta Manometri capacitivi Baratron Piezo Membranovac Diaframma capacitivo: لا Misuratori tra i più precisi esistenti sul mercato 0.15.%» 1100-10
SOLUZIONI e DILUIZIONI
 SOLUZIONI e DILUIZIONI Introduzione In chimica viene definita soluzione un sistema in cui due o più sostanze formano un miscuglio omogeneo. Nella maggior parte dei casi una soluzione è costituita da due
SOLUZIONI e DILUIZIONI Introduzione In chimica viene definita soluzione un sistema in cui due o più sostanze formano un miscuglio omogeneo. Nella maggior parte dei casi una soluzione è costituita da due
Soluzioni unità 3, modulo D del libro
 Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
Soluzioni unità 3, modulo D del libro SOLUZIONE: miscela omogenea di 2 o più sostanze Particelle dei componenti di dimensioni molecolari Componenti distribuiti in maniera caotica Se manca uno di questi
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2008-2009 Prova scritta del corso di Chimica A-K Compito prova
 CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2008-2009 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2008-2009 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
La fisica del fenomeno meteorico
 Mario Sandri mario.sandri@katamail.com http://grrat.cjb.net/ http://www.iaragroup.org/ La fisica del fenomeno meteorico Quando un meteoroide giunge in prossimità della Terra inizia ad interagire con l
Mario Sandri mario.sandri@katamail.com http://grrat.cjb.net/ http://www.iaragroup.org/ La fisica del fenomeno meteorico Quando un meteoroide giunge in prossimità della Terra inizia ad interagire con l
Lo stato liquido. Un liquido non ha una forma propria, ma ha la forma del recipiente che lo contiene; ha però volume proprio e non è comprimibile.
 I liquidi Lo stato liquido Lo stato liquido rappresenta una condizione intermedia tra stato aeriforme e stato solido, tra lo stato di massimo disordine e quello di perfetto ordine Un liquido non ha una
I liquidi Lo stato liquido Lo stato liquido rappresenta una condizione intermedia tra stato aeriforme e stato solido, tra lo stato di massimo disordine e quello di perfetto ordine Un liquido non ha una
SOLUZIONE ESERCIZIO 1.1
 SOLUZIONE ESERCIZIO 1.1 La temperatura di fusione ed il coefficiente di espansione termica di alcuni metalli sono riportati nella tabella e nel diagramma sottostante: Metallo Temperatura di fusione [ C]
SOLUZIONE ESERCIZIO 1.1 La temperatura di fusione ed il coefficiente di espansione termica di alcuni metalli sono riportati nella tabella e nel diagramma sottostante: Metallo Temperatura di fusione [ C]
III Modulo Corso Istruttori I Livello. Meteorologia 1
 III Modulo Corso Istruttori I Livello Meteorologia 1 Programma Fondamenti di Fisica Origine del Vento Campi Barici Le brezze Scale Beaufort e Douglas I vettori sono comunemente usati in fisica per indicare
III Modulo Corso Istruttori I Livello Meteorologia 1 Programma Fondamenti di Fisica Origine del Vento Campi Barici Le brezze Scale Beaufort e Douglas I vettori sono comunemente usati in fisica per indicare
GAS IDEALI E REALI. Prendiamo ora in considerazione un sistema particolare termodinamico: il gas. Un gas è un fluido con le seguenti caratteristiche:
 GAS IDEALI E REALI Gas ideale. Prendiamo ora in considerazione un sistema particolare termodinamico: il gas. Un gas è un fluido con le seguenti caratteristiche: - non ha forma, ne volume proprio; - e comprimibile.
GAS IDEALI E REALI Gas ideale. Prendiamo ora in considerazione un sistema particolare termodinamico: il gas. Un gas è un fluido con le seguenti caratteristiche: - non ha forma, ne volume proprio; - e comprimibile.
La legge dei gas perfetti
 La legge dei gas perfetti In condizioni normali l aria ambiente secca contiene approssimativamente 78,08% di azoto (N2), 20,94% di ossigeno (O2), 0,93% di argon (Ar), 0,04% di biossido di carbonio (CO2)
La legge dei gas perfetti In condizioni normali l aria ambiente secca contiene approssimativamente 78,08% di azoto (N2), 20,94% di ossigeno (O2), 0,93% di argon (Ar), 0,04% di biossido di carbonio (CO2)
LA MATERIA ED I SUOI STATI
 LA MATERIA ED I SUOI STATI GAS COMPOSIZIONE DELL ARIA 1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l energia cinetica media delle particelle è proporzionale
LA MATERIA ED I SUOI STATI GAS COMPOSIZIONE DELL ARIA 1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l energia cinetica media delle particelle è proporzionale
CAPITOLO 2 CICLO BRAYTON TURBINE A GAS
 CAPITOLO 2 CICLO BRAYTON TURBINE A GAS 1 CICLO BRAYTON IL CICLO TERMODINAMICO BRAYTON E COMPOSTO DA QUATTRO TRASFORMAZIONI PRINCIPALI (COMPRESSIONE, RISCALDAMENTO, ESPANSIONE E RAFFREDDAMENTO), PIÙ ALTRE
CAPITOLO 2 CICLO BRAYTON TURBINE A GAS 1 CICLO BRAYTON IL CICLO TERMODINAMICO BRAYTON E COMPOSTO DA QUATTRO TRASFORMAZIONI PRINCIPALI (COMPRESSIONE, RISCALDAMENTO, ESPANSIONE E RAFFREDDAMENTO), PIÙ ALTRE
STATI DI AGGREGAZIONE DELLA MATERIA E PROPRIETÀ DEI FLUIDI
 STATI DI AGGREGAZIONE DELLA MATERIA E PROPRIETÀ DEI FLUIDI 14/01/2014 2 Una porzione di materia costituita da una sostanza la cui composizione chimica non varia da un punto all altro si dice costituita
STATI DI AGGREGAZIONE DELLA MATERIA E PROPRIETÀ DEI FLUIDI 14/01/2014 2 Una porzione di materia costituita da una sostanza la cui composizione chimica non varia da un punto all altro si dice costituita
Chimica. Gli stati di aggregazione della materia
 Chimica Gli stati di aggregazione della materia La materia si presenta in natura in tre modelli di aggregazione dei suoi costituenti (atomi, molecole o ioni): solido, liquido, aeriforme. Da un punto di
Chimica Gli stati di aggregazione della materia La materia si presenta in natura in tre modelli di aggregazione dei suoi costituenti (atomi, molecole o ioni): solido, liquido, aeriforme. Da un punto di
IL FATTORE DI BOLTZMANN ATTRAVERSO ESPERIMENTI E SIMULAZIONI
 University of Palermo Physics Education Research Group IL FATTORE DI BOLTZMANN ATTRAVERSO ESPERIMENTI E SIMULAZIONI Onofrio R. Battaglia,, R. M. Sperandeo Mineo GRIAF (Gruppo di Ricerca sull Insegnamento/Apprendimento
University of Palermo Physics Education Research Group IL FATTORE DI BOLTZMANN ATTRAVERSO ESPERIMENTI E SIMULAZIONI Onofrio R. Battaglia,, R. M. Sperandeo Mineo GRIAF (Gruppo di Ricerca sull Insegnamento/Apprendimento
Lo stato liquido. i liquidi molecolari con legami a idrogeno: le interazioni tra le molecole si stabiliscono soprattutto attraverso legami a idrogeno
 Lo stato liquido Le particelle sono in continuo movimento, anche se questo risulta più limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle particelle è chiamato moto Browniano.
Lo stato liquido Le particelle sono in continuo movimento, anche se questo risulta più limitato rispetto al caso dei gas. Il movimento caratteristico a zig-zag delle particelle è chiamato moto Browniano.
Corso di laboratorio di fisica della materia Prof. Mario Rocca AA Il progresso delle conoscenze in Fisica è indissolubilmente legato al
 Corso di laboratorio di fisica della materia Prof. Mario Rocca AA 2012-2013 Il progresso delle conoscenze in Fisica è indissolubilmente legato al progresso nei metodi di indagine sperimentale. Il corso
Corso di laboratorio di fisica della materia Prof. Mario Rocca AA 2012-2013 Il progresso delle conoscenze in Fisica è indissolubilmente legato al progresso nei metodi di indagine sperimentale. Il corso
LA DIFFUSIONE. M At 1 A. dm dt
 LA DIFFUSIONE Il trasferimento di massa, all interno di un solido, di un liquido o di un gas o di un altra fase solida è detto diffusione ( trasporto di materiale mediante movimento di atomi). La diffusione
LA DIFFUSIONE Il trasferimento di massa, all interno di un solido, di un liquido o di un gas o di un altra fase solida è detto diffusione ( trasporto di materiale mediante movimento di atomi). La diffusione
LAVORAZIONE DEI POLIMERI I processi per trasformare granuli e pastiglie in prodotti finiti sono numerosi.
 LAVORAZIONE DEI POLIMERI I processi per trasformare granuli e pastiglie in prodotti finiti sono numerosi. Generalmente i polimeri non vengono trasformati allo stato puro, ma miscelati con additivi che
LAVORAZIONE DEI POLIMERI I processi per trasformare granuli e pastiglie in prodotti finiti sono numerosi. Generalmente i polimeri non vengono trasformati allo stato puro, ma miscelati con additivi che
L elettromagnetismo nella ricerca per l energia da fusione nucleare di plasma d idrogeno
 L elettromagnetismo nella ricerca per l energia da fusione nucleare di plasma d idrogeno Roberto Cesario Associazione EURATOM-ENEA sulla Fusione Centro Ricerche ENEA Frascati Sommario del corso integrativo
L elettromagnetismo nella ricerca per l energia da fusione nucleare di plasma d idrogeno Roberto Cesario Associazione EURATOM-ENEA sulla Fusione Centro Ricerche ENEA Frascati Sommario del corso integrativo
1. CALCOLO DELLA QUANTITÀ D'ARIA NECESSARIA ALLA COMBUSTIONE DI UN DATO COMBUSTIBILE
 1. ALL DELLA QUANTITÀ D'ARIA NEESSARIA ALLA MBUSTINE DI UN DAT MBUSTIBILE 1.1. Reazioni di combustione stechiometrica di un idrocarburo m omponente Simbolo Peso molecolare (M) arbonio (12) Idrogeno 2 (2)
1. ALL DELLA QUANTITÀ D'ARIA NEESSARIA ALLA MBUSTINE DI UN DAT MBUSTIBILE 1.1. Reazioni di combustione stechiometrica di un idrocarburo m omponente Simbolo Peso molecolare (M) arbonio (12) Idrogeno 2 (2)
VELOCITA di REAZIONE. Quali sono le dimensioni di una velocità di reazione?? E una definizione che ha senso NON all equilibrio!!!
 VELOCITA di REAZIONE Quali sono le dimensioni di una velocità di reazione?? E una definizione che ha senso NON all equilibrio!!! Data la reazione: aa + bb cc + dd v = - 1 Δ[A] = - 1 Δ[B] = 1 Δ[C] = 1 Δ[D]
VELOCITA di REAZIONE Quali sono le dimensioni di una velocità di reazione?? E una definizione che ha senso NON all equilibrio!!! Data la reazione: aa + bb cc + dd v = - 1 Δ[A] = - 1 Δ[B] = 1 Δ[C] = 1 Δ[D]
2. CALCOLO DELL'ANIDRIDE CARBONICA NEI GAS DI SCARICO
 2. CALCOLO DELL'ANIDRIDE CARBONICA NEI GAS DI SCARICO E' noto che la combustione di un combustibile fossile produce anidride carbonica (CO 2 ), rinvenibile dunque nei prodotti della combustione. Nella
2. CALCOLO DELL'ANIDRIDE CARBONICA NEI GAS DI SCARICO E' noto che la combustione di un combustibile fossile produce anidride carbonica (CO 2 ), rinvenibile dunque nei prodotti della combustione. Nella
Dinamica delle reazioni chimiche (attenzione: mancano i disegni)
 Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
Termodinamica (2) gas ideali Lezione 13, 19/11/2018, JW
 Termodinamica (2) gas ideali Lezione 13, 19/11/2018, JW 16.1-16.2 1 1. Gas ideali In un gas ideale l interazione tra le molecole può essere trascurata. Cerchiamo l'equazione di stato dei gas ideali, cioè
Termodinamica (2) gas ideali Lezione 13, 19/11/2018, JW 16.1-16.2 1 1. Gas ideali In un gas ideale l interazione tra le molecole può essere trascurata. Cerchiamo l'equazione di stato dei gas ideali, cioè
Gas. Caratteristiche tipiche dei gas rispetto a solidi e liquidi. Leggi dei gas: legge di Boyle, legge di Charles, legge di Avogadro
 Gas Caratteristiche tipiche dei gas rispetto a solidi e liquidi Definizione di pressione Unità di misura della pressione Leggi dei gas: legge di Boyle, legge di Charles, legge di Avogadro Equazione di
Gas Caratteristiche tipiche dei gas rispetto a solidi e liquidi Definizione di pressione Unità di misura della pressione Leggi dei gas: legge di Boyle, legge di Charles, legge di Avogadro Equazione di
LE PROPRIETA DEI GAS
 LE PROPRIETA DEI GAS Per definire lo stato di un gas, bisogna definire le tre grandezze fisiche, chiamate variabili di stato, che lo caratterizzano: volume, pressione e temperatura. E' possibile descrivere
LE PROPRIETA DEI GAS Per definire lo stato di un gas, bisogna definire le tre grandezze fisiche, chiamate variabili di stato, che lo caratterizzano: volume, pressione e temperatura. E' possibile descrivere
Lo stato gassoso e le sue proprietà
 Lo stato gassoso e le sue proprietà Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1
Lo stato gassoso e le sue proprietà Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1
Fondamenti di Meteorologia e Climatologia
 Università degli studi di Trento Facoltà di Ingegneria Corso di Laurea in Ingegneria per l Ambiente e il Territorio Prof. Dino Zardi Dipartimento di Ingegneria Civile ed Ambientale Fondamenti di Meteorologia
Università degli studi di Trento Facoltà di Ingegneria Corso di Laurea in Ingegneria per l Ambiente e il Territorio Prof. Dino Zardi Dipartimento di Ingegneria Civile ed Ambientale Fondamenti di Meteorologia
Massa assoluta e relativa e mole
 Massa assoluta e relativa e mole Massa atomica assoluta.. Massa di un atomo di un dato elemento. In questo caso si parla spesso di peso atomico assoluto, che viene espresso in grammi: l'ordine dei valori
Massa assoluta e relativa e mole Massa atomica assoluta.. Massa di un atomo di un dato elemento. In questo caso si parla spesso di peso atomico assoluto, che viene espresso in grammi: l'ordine dei valori
Sommario della lezione 18. Proprietà colligative
 Sommario della lezione 18 Proprietà colligative Interazioni soluto-solvente Interazioni soluto-solvente La solubilità di un soluto in un particolare solvente dipende da: la natura delle particelle di solvente
Sommario della lezione 18 Proprietà colligative Interazioni soluto-solvente Interazioni soluto-solvente La solubilità di un soluto in un particolare solvente dipende da: la natura delle particelle di solvente
La sublimazione rappresenta il passaggio di una sostanza dallo stato. solido direttamente allo stato vapore senza formazione dell'intermedio
 La sublimazione rappresenta il passaggio di una sostanza dallo stato solido direttamente allo stato vapore senza formazione dell'intermedio stato liquido. La purificazione per sublimazione si basa sull
La sublimazione rappresenta il passaggio di una sostanza dallo stato solido direttamente allo stato vapore senza formazione dell'intermedio stato liquido. La purificazione per sublimazione si basa sull
Misura della velocita di deriva degli elettroni nella miscela gassosa di un rivelatore di particelle a filo. P. Campana M. Anelli R.
 Misura della velocita di deriva degli elettroni nella miscela gassosa di un rivelatore di particelle a filo P. Campana M. Anelli R. Rosellini Urti random tra la particella e gli atomi di gas (cammino
Misura della velocita di deriva degli elettroni nella miscela gassosa di un rivelatore di particelle a filo P. Campana M. Anelli R. Rosellini Urti random tra la particella e gli atomi di gas (cammino
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici
 La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
i tre stati di aggregazione
 Temperatura e Calore -temperatura -calore e calore specifico -lavoro in termodinamica -trasformazioni termodinamiche -trasformazioni di stato -energia interna 1 i tre stati di aggregazione solido Ordine
Temperatura e Calore -temperatura -calore e calore specifico -lavoro in termodinamica -trasformazioni termodinamiche -trasformazioni di stato -energia interna 1 i tre stati di aggregazione solido Ordine
Lez 13 15/11/2016. Lezioni in didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617
 Lez 13 15/11/2016 Lezioni in http://www.fisgeo.unipg.it/~fiandrin/ didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617 1 Il Calore ed energia q La temperatura di un corpo cambia come risultato
Lez 13 15/11/2016 Lezioni in http://www.fisgeo.unipg.it/~fiandrin/ didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617 1 Il Calore ed energia q La temperatura di un corpo cambia come risultato
pressione esercitata dalle molecole di gas in equilibrio con Si consideri una soluzione di B in A. Per una soluzione ideale
 PROPRIETA COLLIGATIVE Proprietà che dipendono solo dal numero di particelle presenti in soluzione 1. TENSIONE DI VAPORE 2. INNALZAMENTO EBULLIOSCOPICO 3. ABBASSAMENTO CRIOSCOPICO 4. PRESSIONE OSMOTICA
PROPRIETA COLLIGATIVE Proprietà che dipendono solo dal numero di particelle presenti in soluzione 1. TENSIONE DI VAPORE 2. INNALZAMENTO EBULLIOSCOPICO 3. ABBASSAMENTO CRIOSCOPICO 4. PRESSIONE OSMOTICA
Lez 14 16/11/2016. Lezioni in didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617
 Lez 14 16/11/2016 Lezioni in http://www.fisgeo.unipg.it/~fiandrin/ didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617 1 Esperienza di Joule E. Fiandrini Fis. Sper. e 2 Esperienza di Joule
Lez 14 16/11/2016 Lezioni in http://www.fisgeo.unipg.it/~fiandrin/ didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617 1 Esperienza di Joule E. Fiandrini Fis. Sper. e 2 Esperienza di Joule
Chimica Generale ed Inorganica: Programma del Corso
 Chimica Generale ed Inorganica: Programma del Corso Gli atomi I legami chimici Forma e struttura delle molecole Le proprietà dei gas Liquidi e solidi Termodinamica Equilibri fisici Equilibri chimici Equilibri
Chimica Generale ed Inorganica: Programma del Corso Gli atomi I legami chimici Forma e struttura delle molecole Le proprietà dei gas Liquidi e solidi Termodinamica Equilibri fisici Equilibri chimici Equilibri
Lezioni del Corso di Misure Meccaniche e Termiche
 Facoltà di Ingegneria Lezioni del Corso di Misure Meccaniche e Termiche 03. I Sensori di Umidità Igrometri relativi meccanici principio di misura Basato sul fenomeno dell'elongazione di capelli umani in
Facoltà di Ingegneria Lezioni del Corso di Misure Meccaniche e Termiche 03. I Sensori di Umidità Igrometri relativi meccanici principio di misura Basato sul fenomeno dell'elongazione di capelli umani in
TERMODINAMICA. Il sistema è il corpo o l insieme dei corpi sotto esame.
 TERMODINAMICA SISTEMI TERMODINAMICI Il sistema è il corpo o l insieme dei corpi sotto esame. L ambiente esterno è l insieme di tutti i corpi che possono interagire con il sistema. Tipi di sistemi termodinamici
TERMODINAMICA SISTEMI TERMODINAMICI Il sistema è il corpo o l insieme dei corpi sotto esame. L ambiente esterno è l insieme di tutti i corpi che possono interagire con il sistema. Tipi di sistemi termodinamici
L energia assorbita dall atomo durante l urto iniziale è la stessa del fotone che sarebbe emesso nel passaggio inverso, e quindi vale: m
 QUESITI 1 Quesito Nell esperimento di Rutherford, una sottile lamina d oro fu bombardata con particelle alfa (positive) emesse da una sorgente radioattiva. Secondo il modello atomico di Thompson le particelle
QUESITI 1 Quesito Nell esperimento di Rutherford, una sottile lamina d oro fu bombardata con particelle alfa (positive) emesse da una sorgente radioattiva. Secondo il modello atomico di Thompson le particelle
1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5.
 Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Stati di aggregazione della materia. GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti
 9. I Gas Farmacia Stati di aggregazione della materia GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti Stato solido Nello stato solido l energia di
9. I Gas Farmacia Stati di aggregazione della materia GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti Stato solido Nello stato solido l energia di
Misure e Unità di Misura
 2. La Mole Misure e Unità di Misura L Incertezza delle Misure - come utilizzare le cifre significative nel calcolo Le Quantità Chimiche - la MOLE - la MASSA MOLARE - la misura dei composti La Determinazione
2. La Mole Misure e Unità di Misura L Incertezza delle Misure - come utilizzare le cifre significative nel calcolo Le Quantità Chimiche - la MOLE - la MASSA MOLARE - la misura dei composti La Determinazione
Densita. FLUIDI : liquidi o gas. macroscop.:
 6-SBAC Fisica 1/10 FLUIDI : liquidi o gas macroscop.: microscop.: sostanza che prende la forma del contenitore che la occupa insieme di molecole tenute insieme da deboli forze di coesione (primi vicini)
6-SBAC Fisica 1/10 FLUIDI : liquidi o gas macroscop.: microscop.: sostanza che prende la forma del contenitore che la occupa insieme di molecole tenute insieme da deboli forze di coesione (primi vicini)
Conduttanza Q Δ. m s P > P 1 P 2 Q > Vuoto e Spettrometria di Massa
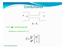 Conduttanza P P 2 Q > Se ΔP P 0 ; si ha flusso di gas (Q): P > P 2 Si definisce conduttanza ( C ): Q C= Δ P 3 m s Altre equazioni maestre Per dimensionare un sistema da vuoto, individuata la grandezza
Conduttanza P P 2 Q > Se ΔP P 0 ; si ha flusso di gas (Q): P > P 2 Si definisce conduttanza ( C ): Q C= Δ P 3 m s Altre equazioni maestre Per dimensionare un sistema da vuoto, individuata la grandezza
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia. Massa atomica MOLE. a.a.
 Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia Massa atomica MOLE a.a. 2016-17 MATERIA costituita da ATOMI Miscele OMOGENEE o soluzioni Hanno la
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia Massa atomica MOLE a.a. 2016-17 MATERIA costituita da ATOMI Miscele OMOGENEE o soluzioni Hanno la
SPETTROSCOPIA ATOMICA
 SPETTROSCOPIA ATOMICA È la tecnica più usata per l analisi (specialmente quantitativa) degli elementi in tracce, in tutte le matrici. Il campione viene atomizzato e gli atomi presenti in esso vengono riconosciuti
SPETTROSCOPIA ATOMICA È la tecnica più usata per l analisi (specialmente quantitativa) degli elementi in tracce, in tutte le matrici. Il campione viene atomizzato e gli atomi presenti in esso vengono riconosciuti
Temperatura. Il legame con le grandezze microscopiche è di tipo statistico. Pressione Volume Temperatura
 Temperatura La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero di particelle):
Temperatura La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero di particelle):
Proprietà elettriche della materia
 Proprietà elettriche della materia Conduttori Materiali in cui le cariche elettriche scorrono con facilità. In un metallo gli elettroni più esterni di ciascun atomo formano una specie di gas all interno
Proprietà elettriche della materia Conduttori Materiali in cui le cariche elettriche scorrono con facilità. In un metallo gli elettroni più esterni di ciascun atomo formano una specie di gas all interno
DATABASE SOSTANZE Modulo TOXI
 DATABASE SOSTANZE Modulo TOXI All interno del modulo TOXI è stato previsto un Database sostanze che potesse raccogliere al suo interno tutti composti tossici d interesse per l utente e le loro proprietà
DATABASE SOSTANZE Modulo TOXI All interno del modulo TOXI è stato previsto un Database sostanze che potesse raccogliere al suo interno tutti composti tossici d interesse per l utente e le loro proprietà
La cinetica chimica. Si occupa dello studio dei meccanismi di reazione con i quali i reagenti si trasformano in prodotti (kinesis = movimento)
 La cinetica chimica Si occupa dello studio dei meccanismi di reazione con i quali i reagenti si trasformano in prodotti (kinesis = movimento) omogenee Reazioni eterogenee Termodinamica: permette di prevedere
La cinetica chimica Si occupa dello studio dei meccanismi di reazione con i quali i reagenti si trasformano in prodotti (kinesis = movimento) omogenee Reazioni eterogenee Termodinamica: permette di prevedere
GAS. Forze di legame intermolecolari ridotte Stato altamente disordinato
 I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
Dipartimento di Scienze Chimiche. Ambiente. Sistema
 Descrizione macroscopica dei sistemi materiali Sistema: materia compresa entro una superficie chiusa (ad esempio la superficie interna di un contenitore, ma può essere anche una superficie matematica,
Descrizione macroscopica dei sistemi materiali Sistema: materia compresa entro una superficie chiusa (ad esempio la superficie interna di un contenitore, ma può essere anche una superficie matematica,
- Equilibri omogenei: tutte le sostanze che partecipano alla reazione fanno parte della stessa fase:
 ESERCITAZIONE 9 EQUILIBRI Reazioni di equilibrio: reazioni che possono avvenire in entrambi i sensi; la reazione diretta di formazione dei prodotti ha una velocità proporzionale alla concentrazione iniziale
ESERCITAZIONE 9 EQUILIBRI Reazioni di equilibrio: reazioni che possono avvenire in entrambi i sensi; la reazione diretta di formazione dei prodotti ha una velocità proporzionale alla concentrazione iniziale
Il potenziale elettrico
 Il elettrico Ingegneria Energetica Docente: Angelo Carbone Energia del elettrico e differenza di Relazione tra il elettrico e il Il elettrico dovuto a cariche puntiformi Il elettrico dovuto a una generica
Il elettrico Ingegneria Energetica Docente: Angelo Carbone Energia del elettrico e differenza di Relazione tra il elettrico e il Il elettrico dovuto a cariche puntiformi Il elettrico dovuto a una generica
Teorie per il calcolo dei coefficienti di trasporto di materia (interfaccia fluido-fluido) Fenomeni di Trasporto
 Teorie per il calcolo dei coefficienti di trasporto di materia (interfaccia fluido-fluido) Fenomeni di Trasporto 1 Teoria del film (Lewis, 1924) Si assume che il trasporto di materia avvenga in uno strato
Teorie per il calcolo dei coefficienti di trasporto di materia (interfaccia fluido-fluido) Fenomeni di Trasporto 1 Teoria del film (Lewis, 1924) Si assume che il trasporto di materia avvenga in uno strato
La cinetica chimica studia la velocità con cui avviene una reazione chimica. dc dt. dn dt. per reazioni che avvengono a V costante
 Cinetica chimica La cinetica chimica studia la velocità con cui avviene una reazione chimica. a A + b B + l L + m M +... Velocità di reazione rispetto al componente i-esimo: v 1 = ± V dn dt (+) velocità
Cinetica chimica La cinetica chimica studia la velocità con cui avviene una reazione chimica. a A + b B + l L + m M +... Velocità di reazione rispetto al componente i-esimo: v 1 = ± V dn dt (+) velocità
Proprietà volumetriche delle sostanze pure. Principi di Ingegneria Chimica Ambientale
 Proprietà volumetriche delle sostanze pure Principi di Ingegneria Chimica Ambientale le fasi di una specie pura Una sostanza la cui composizione chimica non varia in tutta la massa presa in considerazione
Proprietà volumetriche delle sostanze pure Principi di Ingegneria Chimica Ambientale le fasi di una specie pura Una sostanza la cui composizione chimica non varia in tutta la massa presa in considerazione
