CUBICIN (DAPTOMICINA) POLVERE PER SOLUZIONE INIETTABILE O PER INFUSIONE
|
|
|
- Sabrina Fiorini
- 5 anni fa
- Visualizzazioni
Transcript
1 Cubicin Guida alla posologia CUBICIN (DAPTOMICINA) POLVERE PER SOLUZIONE INIETTABILE O PER INFUSIONE INDICAZIONI (vedere l Allegato 2 per l RCP) 1 : u Cubicin è indicato per il trattamento delle seguenti infezioni (vedere paragrafi 4.4 e 5.1 dell RCP). Pazienti adulti e pediatrici (da 1 a 17 anni) con infezioni complicate della cute e dei tessuti molli (cssti). Pazienti adulti con endocardite infettiva del cuore destro (RIE) da Staphylococcus aureus. Si raccomanda che la decisione di utilizzare daptomicina sia presa considerando la sensibilità antibatterica dell organismo e basata sul parere di un esperto. Vedere paragrafi 4.4 e 5.1. Pazienti adulti e pediatrici (da 1 a 17 anni) con batteriemia da Staphylococcus aureus (SAB). Negli adulti, l utilizzo nel trattamento nella batteriemia deve essere associato a RIE o a cssti; mentre nei pazienti pediatrici, l utilizzo nella batteriemia deve essere associato a cssti. u Attività battericida 2 nei confronti di un ampio spettro di batteri Gram-positivi 3,4 u Nelle infezioni miste in cui si sospetta la presenza di batteri Gram-negativi e/o di alcuni tipi di batteri anaerobi, Cubicin deve essere co-somministrato con uno o più agenti antibatterici appropriati u Somministrazione una volta al giorno.
2 RACCOMANDAZIONI (vedere l Allegato 2 per l RCP) u Durante la terapia con Cubicin (daptomicina), sono stati segnalati aumenti dei livelli plasmatici di creatinfosfochinasi (CPK) associati a eventi avversi di natura muscoloscheletrica La somministrazione di Cubicin in associazione ad altri medicinali correlati allo sviluppo di miopatia (ad es., statine, fibrati e ciclosporina) deve essere evitata, a meno che non si ritenga che il beneficio per il paziente superi il rischio Durante la terapia, in tutti i pazienti, la CPK deve essere misurata al basale e, successivamente a intervalli regolari (almeno una volta alla settimana) Misurare i livelli di CPK con frequenza superiore a una volta alla settimana (ad es., ogni 2-3 giorni, almeno per le prime due settimane di trattamento) nei pazienti che presentano un rischio più elevato di insorgenza di miopatia: Pazienti con qualsiasi grado di insufficienza renale (clearance della creatinina <80 ml/min) Pazienti che assumono altri medicinali notoriamente associati a miopatia. u Sono stati riportati casi di interferenza tra Cubicin e particolari reagenti (tromboplastina ricombinante) impiegati in alcuni saggi per determinare i fattori di coagulazione (tempo di protrombina [PT], rapporto internazionale normalizzato [INR]). L interferenza causa falsi risultati, con un apparente prolungamento del PT e un aumento dell INR. Prelievi di sangue effettuati vicino al tempo della concentrazione plasmatica di valle di Cubicin possono minimizzare il potenziale di risultati erronei u I risultati degli studi più recenti 1,5 sulla popolazione pediatrica indicano che, rispetto agli adulti, i bambini mostrano una clearance di daptomicina progressivamente più elevata e un maggior volume di distribuzione con l abbassarsi dell età. Pertanto, nei bambini saranno richieste dosi più elevate che varieranno in base alla fascia di età al fine di ottenere esposizioni equivalenti a quelle efficaci osservate negli adulti Nella popolazione pediatrica, daptomicina somministrata alla dose di 5 mg/kg (da 12 a 17 anni), 7 mg/kg (da 7 a 11 anni), 9 mg/kg (da 2 a 6 anni) e 10 mg/kg (da 1 a <2 anni) fino a 14 giorni ha dimostrato un profilo rischio beneficio positivo nel trattamento delle cssti causate da patogeni Gram-positivi Nella popolazione pediatrica, daptomicina somministrata alla dose di 7 mg/kg (da 12 a 17 anni), 9 mg/kg (da 7 a 11 anni) o 12 mg/kg (da 1 a 6 anni) fino a 42 giorni ha dimostrato un profilo rischio beneficio positivo nel trattamento della batteriemia da Staphylococcus aureus associata a cssti. u A causa della maggiore clearance di daptomicina osservata in precedenti studi pediatrici di farmacocinetica a singola dose 6,7,8 e nei più recenti studi pediatrici descritti in precedenza 1,5 Le dosi di daptomicina aggiustate in base all età sono state somministrate una volta al giorno per 14 giorni al fine di ottenere un esposizione equivalente a quella osservata negli studi su adulti affetti da cssti Le dosi di daptomicina aggiustate in base all età sono state somministrate una volta al giorno per 42 giorni al fine di ottenere un esposizione equivalente a quella osservata negli studi su adulti affetti da SAB Il dosaggio è età-dipendente e peso-dipendente Sia i risultati di sicurezza sia quelli di efficacia sono coerenti con quelli degli studi condotti sugli adulti e con i dati provenienti dalla letteratura
3 CUBICIN 4 mg/kg INDICAZIONI (1) u cssti nei pazienti adulti senza batteriemia da Staphylococcus aureus (vedere l Allegato 2 per l RCP) DOSAGGIO Cubicin 4 mg/kg: somministrazione una volta al giorno tramite iniezione endovenosa EV in 2 minuti o infusione endovenosa EV in 30 minuti Per ottenere una concentrazione di 50 mg/ml, Cubicin deve essere ricostituito con: Flaconcino da 350 mg: 7 ml di soluzione iniettabile di cloruro di sodio allo 0,9% (iniezione o infusione) Flaconcino da 500 mg: 10 ml di soluzione iniettabile di cloruro di sodio allo 0,9% (iniezione o infusione) Volume di soluzione richiesta di Cubicin 50 mg/ml: Volume in ml = Peso corporeo (kg) x 4/50 Questo volume può essere somministrato tramite iniezione endovenosa in 2 minuti o diluito con cloruro di sodio allo 0,9% (volume tipico di 50 ml) per infusione in 30 minuti
4 CUBICIN 4 mg/kg Peso (kg) Dose (ml) Peso (kg) Dose (ml) Peso (kg) Dose (ml) Peso (kg) Dose (ml) 46 3, , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , ,92 AGGIUSTAMENTI DELLA DOSE IN PAZIENTI ADULTI CON DANNO RENALE Indicazione d uso Clearance della creatinina Raccomandazione posologica Commenti cssti senza batteriemia da S. aureus 30 ml/min 4 mg/kg una volta al giorno <30 ml/min 4 mg/kg ogni 48 ore (1, 2) (1) La sicurezza e l efficacia dell aggiustamento dell intervallo di dose non sono state valutate in sperimentazioni cliniche controllate e le raccomandazioni derivano da studi di farmacocinetica e dai risultati di modelli farmacocinetici (2) Gli stessi aggiustamenti della dose derivanti dai dati di farmacocinetica nei volontari inclusi i risultati dei modelli farmacocinetici, sono raccomandati per pazienti adulti in emodialisi (HD) o in dialisi peritoneale ambulatoriale continua (CAPD). Quando possibile, Cubicin (daptomicina) deve essere somministrato alla fine della dialisi nel giorno della dialisi u La risposta al trattamento, la funzionalità renale e la CPK plasmatica devono essere attentamente monitorate in tutti i pazienti con danno renale.
5 CUBICIN 6 mg/kg INDICAZIONI (1) u RIE da Staphylococcus aureus nei pazienti adulti (vedere l Allegato 2 per l RCP) u Batteriemia da Staphylococcus aureus quando associata a RIE o cssti nei pazienti adulti (vedere l Allegato 2 per l RCP) DOSAGGIO Cubicin 6 mg/kg: somministrazione una volta al giorno tramite iniezione EV in 2 minuti o infusione EV in 30 minuti Per ottenere una concentrazione di 50 mg/ml, Cubicin deve essere ricostituito con: Flaconcino da 350 mg: 7 ml di soluzione iniettabile di cloruro di sodio allo 0,9% (iniezione o infusione) Flaconcino da 500 mg: 10 ml di soluzione iniettabile di cloruro di sodio allo 0,9% (iniezione o infusione) Volume di soluzione richiesta di Cubicin 50 mg/ml: Volume in ml = Peso corporeo (kg) x 6/50 Questo volume può essere somministrato tramite iniezione endovenosa in 2 minuti o diluito con cloruro di sodio allo 0,9% (volume tipico di 50 ml) per infusione in 30 minuti
6 CUBICIN 6 mg/kg Peso (kg) Dose (ml) Peso (kg) Dose (ml) Peso (kg) Dose (ml) Peso (kg) Dose (ml) 46 5, , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , , ,88 AGGIUSTAMENTO DELLA DOSE IN PAZIENTI ADULTI CON DANNO RENALE Indicazione d uso Clearance della creatinina Raccomandazione posologica Commenti RIE o cssti associata a batteriemia da S. aureus 30 ml/min 6 mg/kg una volta al giorno <30 ml/min 6 mg/kg ogni 48 ore (1, 2) (1) La sicurezza e l efficacia dell aggiustamento dell intervallo di dose non sono state valutate in sperimentazioni cliniche controllate e le raccomandazioni derivano da studi e da risultati di modelli farmacocinetici (2) Gli stessi aggiustamenti della dose derivanti dai dati di farmacocinetica nei volontari inclusi i risultati dei modelli farmacocinetici, sono raccomandati per pazienti adulti in emodialisi (HD) o in dialisi peritoneale ambulatoriale continua (CAPD). Quando possibile, Cubicin (daptomicina) deve essere somministrato alla fine della dialisi nel giorno della dialisi u La risposta al trattamento, la funzionalità renale e la CPK plasmatica devono essere attentamente monitorate in tutti i pazienti con danno renale.
7 DOSAGGIO DI CUBICIN NEI PAZIENTI PEDIATRICI PER IL TRATTAMENTO DI cssti SENZA BATTERIEMIA DA STAPHYLOCOCCUS AUREUS DOSAGGIO Nei pazienti pediatrici (da 1 a 17 anni) con infezioni complicate della cute e dei tessuti molli (cssti) non in associazione con batteriemia da S. aureus, Cubicin è somministrato tramite infusione endovenosa (EV) per un periodo che varia dai minuti in base all età del paziente (vedere anche paragrafo dosaggio e somministrazione nei Pazienti Pediatrici nell RCP nell Allegato 2). Età Dose di daptomicina Tempo di infusione Da 12 a 17 anni 5 mg/kg una volta al giorno 30 minuti Da 7 a 11 anni 7 mg/kg una volta al giorno 30 minuti Da 2 a 6 anni 9 mg/kg una volta al giorno 60 minuti Durata del trattamento Fino a 14 giorni Da 1 a <2 anni 10 mg/kg una volta al giorno 60 minuti DOSAGGIO DI CUBICIN NEI PAZIENTI PEDIATRICI PER IL TRATTAMENTO DELLA BATTERIEMIA DA STAPHYLOCOCCUS AUREUS, QUANDO ASSOCIATA A cssti DOSAGGIO Nei pazienti pediatrici (da 1 a 17 anni) con batteriemia da S. aureus quando associata a infezioni complicate della cute e dei tessuti molli (cssti), Cubicin è somministrato tramite infusione endovenosa (EV) per un periodo che varia dai minuti in base all età del paziente (vedere anche paragrafo dosaggio e somministrazione nei Pazienti Pediatrici nell RCP nell Allegato 2): Età Dose di daptomicina Tempo di infusione Da 12 a 17 anni 7 mg/kg una volta al giorno 30 minuti Da 7 a 11 anni 9 mg/kg una volta al giorno 30 minuti Durata del trattamento Fino a 42 giorni Da 1 a 6 anni 12 mg/kg una volta al giorno 60 minuti
8 Cubicin non deve essere somministrato a pazienti pediatrici di età inferiore a un anno a causa del rischio di potenziali effetti sui sistemi muscolare, neuromuscolare, e/o nervoso (sia periferico che centrale) che sono stati osservati in cani neonati. Il regime posologico di Cubicin nei pazienti pediatrici con danno renale non è stato stabilito. Fare riferimento al Riassunto delle Caratteristiche del Prodotto (RCP) prima di prescrivere Cubicin. Bibliografia 1. [Rif : P017] 2. [Rif. 5.4: 04J2D7] 3. [Rif. 5.4: 04J2D8] Clinical Study Report: An Evaluation of the Safety, Efficacy and Pharmacokinetics of Daptomycin in Pediatric Subjects Aged one to Seventeen Years with Complicated Skin and Skin Structure Infections Caused by Gram-positive Pathogens (Protocol 017). Kirkpatrick P, Raja A, LaBonte J, Lebbos J. Daptomycin. Nat Rev Drug Discov Dec;2(12): Rybak MJ, Hershberger E, Moldovan T, Grucz RG. In vitro activities of daptomycin, vancomycin, linezolid, and quinupristin-dalfopristin against Staphylococci and Enterococci, including vancomycin- intermediate and -resistant strains. Antimicrob Agents Chemother Apr;44(4): [Rif. 5.4: 04J2DC] Tedesco KL, Rybak MJ. Daptomycin. Pharmacotherapy Jan;24(1): [Rif : 04L997] Clinical Study Report, Multicenter Study: A Comparative Evaluation of the Safety and Efficacy of Daptomycin Versus Standard of Care in Pediatric Subjects One - Seventeen Years of Age with Bacteremia Caused by Staphylococcus aureus (Protocol 005). 6. [Rif : 04FTKP] Clinical Study Report, Multicenter Study: An Evaluation of the Pharmacokinetics of a Single Dose Of Daptomycin (4 mg/kg) in Pediatric Patients Aged Two to Seventeen Years Who Are Concurrently Receiving Standard Antibiotic Therapy for Proven or Suspected Gram-Positive Infection (Protocol 028). 7. [Rif : 04FVHB] Clinical Study Report, Multicenter Study: An Evaluation of the Pharmacokinetic Profile and Safety of a Single Dose of Daptomycin in Pediatric Subjects Aged Two to Six Years Who are Concurrently Receiving Standard Antibiotic Therapy for Proven or Suspected Gram-positive Infection (Protocol 023). 8. [Rif : 04FVN7] Clinical Study Report, Multicenter Study: An Evaluation of the Pharmacokinetic Profile and Safety of a Single Dose of Daptomycin in Pediatric Subjects Aged 3 Months to Twenty-four Months Who are Concurrently Receiving Standard Antibiotic Therapy for Proven or Suspected Bacterial Infection (Protocol 018). MSD Italia S.r.l Via Vitorchiano 151, Roma La segnalazione delle reazioni avverse sospette che si verificano dopo l autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema nazionale di segnalazione all indirizzo gov.it/content/come-segnalare-una-sospetta-reazione-avversa Materiale educazionale autorizzato da AIFA in data 05/03/2018 nell ambito nazionale del Risk Management Plan approvato da EMA. AINF CUB-BT-01/2020
SCHEDA DI VALUTAZIONE PER L INSERIMENTO DI FARMACI NON PRESENTI NEL PTR DAPTOMICINA
 RICHIESTA DI INSERIMENTO IN PTR DI ATC J01XX09 (CUBICIN ) Presentata da : Commissione Prontuario terapeutico provinciale Cagliari In data novembre 2007 Per le seguenti motivazioni : La daptomicina possiede
RICHIESTA DI INSERIMENTO IN PTR DI ATC J01XX09 (CUBICIN ) Presentata da : Commissione Prontuario terapeutico provinciale Cagliari In data novembre 2007 Per le seguenti motivazioni : La daptomicina possiede
Linee guida per il dosaggio e l infusione Informazioni sulla preparazione e somministrazione di Elaprase
 Linee guida per il dosaggio e l infusione Informazioni sulla preparazione e somministrazione di Elaprase ELAPRASE (idursulfasi) Terapia enzimatica sostitutiva per il trattamento a lungo termine dei pazienti
Linee guida per il dosaggio e l infusione Informazioni sulla preparazione e somministrazione di Elaprase ELAPRASE (idursulfasi) Terapia enzimatica sostitutiva per il trattamento a lungo termine dei pazienti
TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE
 FARMACOVIGILANZA TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono
FARMACOVIGILANZA TIMECEF 1 G/4 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono
TARGOSID 200 MG/3 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE TARGOSID 400 MG/3 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE
 FARMACOVIGILANZA TARGOSID 200 MG/3 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE TARGOSID 400 MG/3 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE Variazioni degli stampati relativamente agli aspetti
FARMACOVIGILANZA TARGOSID 200 MG/3 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE TARGOSID 400 MG/3 ML POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE Variazioni degli stampati relativamente agli aspetti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
Allegato II. Conclusioni scientifiche e motivazioni della variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato II Conclusioni scientifiche e motivazioni della variazione dei termini delle autorizzazioni all immissione in commercio 17 Conclusioni scientifiche Sintesi generale della valutazione scientifica
Allegato II Conclusioni scientifiche e motivazioni della variazione dei termini delle autorizzazioni all immissione in commercio 17 Conclusioni scientifiche Sintesi generale della valutazione scientifica
SPINRAZA. NUSINERSEN Terapia farmacologica: presupposti per il meccanismo d azione, vie di somministrazione
 SPINRAZA NUSINERSEN Terapia farmacologica: presupposti per il meccanismo d azione, vie di somministrazione SSD Farmacia e Farmacologia Clinica IRCCS Burlo Garofolo Dott.ssa Alessandra Maestro Dott. Davide
SPINRAZA NUSINERSEN Terapia farmacologica: presupposti per il meccanismo d azione, vie di somministrazione SSD Farmacia e Farmacologia Clinica IRCCS Burlo Garofolo Dott.ssa Alessandra Maestro Dott. Davide
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Cubicin 350 mg polvere per soluzione iniettabile o per infusione Cubicin 500 mg polvere per soluzione iniettabile o per infusione
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Cubicin 350 mg polvere per soluzione iniettabile o per infusione Cubicin 500 mg polvere per soluzione iniettabile o per infusione
Conclusioni scientifiche
 Allegato II Conclusioni scientifiche e motivi della modifica del riassunto delle caratteristiche del prodotto, dell etichettatura e del foglio illustrativo presentati dall Agenzia europea per i medicinali
Allegato II Conclusioni scientifiche e motivi della modifica del riassunto delle caratteristiche del prodotto, dell etichettatura e del foglio illustrativo presentati dall Agenzia europea per i medicinali
Allegato III. Modifiche ai paragrafi rilevanti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Modifiche ai paragrafi rilevanti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Le sezioni relative delle Caratteristiche del Prodotto e Foglio Illustrativo
Allegato III Modifiche ai paragrafi rilevanti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Le sezioni relative delle Caratteristiche del Prodotto e Foglio Illustrativo
Presentazione dei dati
 Presentazione dei dati Per ogni principio attivo, per il quale è stato possibile reperire informazioni riguardanti il passaggio nel latte materno, è stata creata una scheda monografica con informazioni
Presentazione dei dati Per ogni principio attivo, per il quale è stato possibile reperire informazioni riguardanti il passaggio nel latte materno, è stata creata una scheda monografica con informazioni
Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali
 Allegato II Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali Il Riassunto delle Caratteristiche del Prodotto e il foglio
Allegato II Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali Il Riassunto delle Caratteristiche del Prodotto e il foglio
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Cubicin 350 mg polvere per soluzione iniettabile o per infusione Cubicin 500 mg polvere per soluzione iniettabile
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Cubicin 350 mg polvere per soluzione iniettabile o per infusione Cubicin 500 mg polvere per soluzione iniettabile
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Cubicin 350 mg polvere per soluzione iniettabile o per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Cubicin 350 mg polvere per soluzione iniettabile o per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni
Allegato II. Conclusioni scientifiche e motivazioni della variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato II Conclusioni scientifiche e motivazioni della variazione dei termini delle autorizzazioni all immissione in commercio 26 Conclusioni scientifiche Sintesi generale della valutazione scientifica
Allegato II Conclusioni scientifiche e motivazioni della variazione dei termini delle autorizzazioni all immissione in commercio 26 Conclusioni scientifiche Sintesi generale della valutazione scientifica
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Daptomicina Hospira 350 mg polvere per soluzione iniettabile o per infusione Daptomicina Hospira 500 mg polvere
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Daptomicina Hospira 350 mg polvere per soluzione iniettabile o per infusione Daptomicina Hospira 500 mg polvere
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE CUBICIN, 350 mg polvere per concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE CUBICIN, 350 mg polvere per concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA) 4 settembre 2017 FLOLAN (epoprostenolo) - Introduzione di un nuovo solvente sterile con diverso ph: temporanea disponibilità
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA) 4 settembre 2017 FLOLAN (epoprostenolo) - Introduzione di un nuovo solvente sterile con diverso ph: temporanea disponibilità
INTRODUZIONE E CONTESTO CLINICO DI UTILIZZO APPROPRIATO
 INTRODUZIONE E CONTESTO CLINICO DI UTILIZZO APPROPRIATO Gli effetti anticoagulanti di Pradaxa sono importanti e salvavita per alcuni pazienti, ma ci sono situazioni in cui e necessario inattivare rapidamente
INTRODUZIONE E CONTESTO CLINICO DI UTILIZZO APPROPRIATO Gli effetti anticoagulanti di Pradaxa sono importanti e salvavita per alcuni pazienti, ma ci sono situazioni in cui e necessario inattivare rapidamente
Nome di fantasia Nome. Dosaggio. Ciprofloxacin 2 mg/ml Soluzione per infusione. Ciprofloxacin Nycomed. Ciprofloxacin Nycomed. Ciprofloxacin Nycomed
 ALLEGATO I ELENCO DEI NOMI DEI MEDICINALI, DELLA(DELLE) FORMA(E) FARMACEUTICA(CHE), DEI (DEL) DOSAGGI(O), DELLA(DELLE) VIA(E) DI SOMMINISTRAZIONE, DEL(DEI) RICHIEDENTE(I), DEL (DEI) TITOLARE(I) DELL AUTORIZZAZIONE
ALLEGATO I ELENCO DEI NOMI DEI MEDICINALI, DELLA(DELLE) FORMA(E) FARMACEUTICA(CHE), DEI (DEL) DOSAGGI(O), DELLA(DELLE) VIA(E) DI SOMMINISTRAZIONE, DEL(DEI) RICHIEDENTE(I), DEL (DEI) TITOLARE(I) DELL AUTORIZZAZIONE
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE AUREOMICINA 1 % Crema Oftalmica Tubo 3,5 g 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di crema oftalmica contiene:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE AUREOMICINA 1 % Crema Oftalmica Tubo 3,5 g 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di crema oftalmica contiene:
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
Prima dei 15 anni il dosaggio di paracetamolo dipende dal peso del bambino e deve essere compreso tra i 10 e i 15 mg/kg/dose; l intervallo tra una
 1 2 Prima dei 15 anni il dosaggio di paracetamolo dipende dal peso del bambino e deve essere compreso tra i 10 e i 15 mg/kg/dose; l intervallo tra una dose e l altra deve essere sempre almeno di 4 ore.
1 2 Prima dei 15 anni il dosaggio di paracetamolo dipende dal peso del bambino e deve essere compreso tra i 10 e i 15 mg/kg/dose; l intervallo tra una dose e l altra deve essere sempre almeno di 4 ore.
Il significato degli esami di coagulazione. Walter Ageno
 Il significato degli esami di coagulazione Walter Ageno Principali caratteristiche dei nuovi anticoagulanti Via orale di somministrazione Ampia finestra terapeutica Farmacocinetica e farmacodinamica prevedibili
Il significato degli esami di coagulazione Walter Ageno Principali caratteristiche dei nuovi anticoagulanti Via orale di somministrazione Ampia finestra terapeutica Farmacocinetica e farmacodinamica prevedibili
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Roma, Aprile 2015 Avviso agli operatori sanitari di cessata commercializzazione
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Roma, Aprile 2015 Avviso agli operatori sanitari di cessata commercializzazione
Allegato III. Modifiche alle sezioni rilevanti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Modifiche alle sezioni rilevanti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Il riassunto delle caratteristiche del prodotto e il foglio illustrativo potrebbero
Allegato III Modifiche alle sezioni rilevanti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Il riassunto delle caratteristiche del prodotto e il foglio illustrativo potrebbero
Allegato III. Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
AIFA - Agenzia Italiana del Farmaco
 Giugno 2013 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Limitazioni all uso di TROBALT (retigabina) il trattamento può comportare
Giugno 2013 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Limitazioni all uso di TROBALT (retigabina) il trattamento può comportare
CEFODIE Cefonicid. Categoria farmacoterapeutica Antibiotico iniettabile.
 Foglio illustrativo CEFODIE Cefonicid Denominazione del medicinale CEFODIE 500 mg/2 ml polvere e solvente per soluzione iniettabile per uso intramuscolare. CEFODIE 1 g/2,5 ml polvere e solvente per soluzione
Foglio illustrativo CEFODIE Cefonicid Denominazione del medicinale CEFODIE 500 mg/2 ml polvere e solvente per soluzione iniettabile per uso intramuscolare. CEFODIE 1 g/2,5 ml polvere e solvente per soluzione
Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta
 Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta SCHEDA FARMACO Ceftarolina fosamil (Zinforo) Polvere per concentrato per soluzione
Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta SCHEDA FARMACO Ceftarolina fosamil (Zinforo) Polvere per concentrato per soluzione
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) 31 gennaio 2011 Importanti informazioni di sicurezza su Optimark (gadoversetamide) e fibrosi
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) 31 gennaio 2011 Importanti informazioni di sicurezza su Optimark (gadoversetamide) e fibrosi
Recenti novità sull impiego pediatrico di paracetamolo all insegna dell appropriatezza
 Recenti novità sull impiego pediatrico di paracetamolo all insegna dell appropriatezza Fonte: de Martino, M, Chiarugi A. Recent advances in pediatric use of oral paracetamol in fever and pain management.
Recenti novità sull impiego pediatrico di paracetamolo all insegna dell appropriatezza Fonte: de Martino, M, Chiarugi A. Recent advances in pediatric use of oral paracetamol in fever and pain management.
REVISIONE DELLE ATTITUDINI PRESCRITTIVE VERSO UN APPROCCIO CARBAPENEM-SPARING NELLA ASP ISTITUTI MARTINITT E STELLINE E PIO ALBERGO TRIVULZIO
 REVISIONE DELLE ATTITUDINI PRESCRITTIVE VERSO UN APPROCCIO CARBAPENEM-SPARING NELLA ASP ISTITUTI MARTINITT E STELLINE E PIO ALBERGO TRIVULZIO Dr. Marco Bellizzi Azienda Per I Servizi Alla Persona Istituti
REVISIONE DELLE ATTITUDINI PRESCRITTIVE VERSO UN APPROCCIO CARBAPENEM-SPARING NELLA ASP ISTITUTI MARTINITT E STELLINE E PIO ALBERGO TRIVULZIO Dr. Marco Bellizzi Azienda Per I Servizi Alla Persona Istituti
Allegato II. Conclusioni scientifiche e motivi della variazione dei termini dell autorizzazione all immissione in commercio
 Allegato II Conclusioni scientifiche e motivi della variazione dei termini dell autorizzazione all immissione in commercio 6 Conclusioni scientifiche Riassunto generale della valutazione scientifica di
Allegato II Conclusioni scientifiche e motivi della variazione dei termini dell autorizzazione all immissione in commercio 6 Conclusioni scientifiche Riassunto generale della valutazione scientifica di
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TEICOMID 200 mg/3 ml polvere e solvente per soluzione iniettabile TEICOMID 400 mg/3 ml polvere e solvente per soluzione iniettabile
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TEICOMID 200 mg/3 ml polvere e solvente per soluzione iniettabile TEICOMID 400 mg/3 ml polvere e solvente per soluzione iniettabile
Legnano, 28 Novembre Gruppo infermieristico U.O. Malattie Infettive A.O. Legnano
 Legnano, 28 Novembre 2013 Gruppo infermieristico U.O. Malattie Infettive A.O. Legnano IL RUOLO DELL INFERMIERE NELLA CORRETTA GESTIONE DELLA TERAPIA ANTIBIOTICA L infermiere garantisce la corretta applicazione
Legnano, 28 Novembre 2013 Gruppo infermieristico U.O. Malattie Infettive A.O. Legnano IL RUOLO DELL INFERMIERE NELLA CORRETTA GESTIONE DELLA TERAPIA ANTIBIOTICA L infermiere garantisce la corretta applicazione
Prescrivere News - NUOVE ENTITA TERAPEUTICHE - IN OSPEDALE
 DAPTOMICINA IL NOSTRO GIUZIZIO RUOLO INCERTO Antibatterici per uso sistemico J01XX09 Cubicin NOVARTIS ev 50 mg/ml 10 ml 1 fiala 71,80 (ex factory IVA esclusa) Classe H Dispensazione su richiesta motivata
DAPTOMICINA IL NOSTRO GIUZIZIO RUOLO INCERTO Antibatterici per uso sistemico J01XX09 Cubicin NOVARTIS ev 50 mg/ml 10 ml 1 fiala 71,80 (ex factory IVA esclusa) Classe H Dispensazione su richiesta motivata
L aggiornamento pubblicato nel marzo del 2007 è stato integrato con la pubblicazione della prima lista di farmaci essenziali ad uso pediatrico
 Nel 1977, l Organizzazione Mondiale della Sanità (OMS) pubblica il primo report sui farmaci essenziali. Indicato con l acronimo WHO TRS 615, il report tecnico costituisce la prima lista di farmaci essenziali
Nel 1977, l Organizzazione Mondiale della Sanità (OMS) pubblica il primo report sui farmaci essenziali. Indicato con l acronimo WHO TRS 615, il report tecnico costituisce la prima lista di farmaci essenziali
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti
 Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv siringa preriempita 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi:
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv siringa preriempita 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi:
TARGOSID Riassunto delle caratteristiche del prodotto (RCP)
 TARGOSID Riassunto delle caratteristiche del prodotto (RCP) 01.0 DENOMINAZIONE DEL MEDICINALE. TARGOSID 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA. Un flaconcino di polvere contiene: Targosid 200 mg
TARGOSID Riassunto delle caratteristiche del prodotto (RCP) 01.0 DENOMINAZIONE DEL MEDICINALE. TARGOSID 02.0 COMPOSIZIONE QUALITATIVA E QUANTITATIVA. Un flaconcino di polvere contiene: Targosid 200 mg
Daptomicina per una recidiva di sepsi da Staphylococcus aureus
 Daptomicina per una recidiva di sepsi da Staphylococcus aureus oxacillina-resistente complicata da ascesso del muscolo iliaco non responsiva alla terapia con vancomicina Paolo Carfagna, Francesca De Marco*
Daptomicina per una recidiva di sepsi da Staphylococcus aureus oxacillina-resistente complicata da ascesso del muscolo iliaco non responsiva alla terapia con vancomicina Paolo Carfagna, Francesca De Marco*
AIFA Agenzia Italiana Del Farmaco Nota Informnativa Importante su Tachipirina e Medicinali Contenenti Paracetamolo da Solo e/o in Associazione
 AIFA - Tachipirina e Paracetamolo 20/01/2010 (Livello 2) AIFA Agenzia Italiana Del Farmaco Nota Informnativa Importante su Tachipirina e Medicinali Contenenti Paracetamolo da Solo e/o in Associazione Nota
AIFA - Tachipirina e Paracetamolo 20/01/2010 (Livello 2) AIFA Agenzia Italiana Del Farmaco Nota Informnativa Importante su Tachipirina e Medicinali Contenenti Paracetamolo da Solo e/o in Associazione Nota
Terapia antibiotica RICONOSCERE E GESTIRE LA SEPSI. a brand of SPEDALI CIVILI DI BRESCIA AZIENDA OSPEDALIERA
 Terapia antibiotica RICONOSCERE E GESTIRE LA SEPSI a brand of SPEDALI CIVILI DI BRESCIA AZIENDA OSPEDALIERA Sommario Introduzione... 1 La terapia empirica ad ampio spettro... 2 Terapia mirata... 2 Principi
Terapia antibiotica RICONOSCERE E GESTIRE LA SEPSI a brand of SPEDALI CIVILI DI BRESCIA AZIENDA OSPEDALIERA Sommario Introduzione... 1 La terapia empirica ad ampio spettro... 2 Terapia mirata... 2 Principi
Confezione 100 mg/50 ml soluzione per infusione 5 flaconi in PE da 50 ml AIC n /M (in base 10) 13PKHL (in base 32)
 Autorizzazione all immissione in commercio del medicinale «Ciproß oxacina Kabi» MEDICINALE CIPROFLOXACINA KABI TITOLARE AIC: Fresenius Kabi Italia S.r.l. Via Camagre, 41 I-37063 Isola della Scala (Verona)
Autorizzazione all immissione in commercio del medicinale «Ciproß oxacina Kabi» MEDICINALE CIPROFLOXACINA KABI TITOLARE AIC: Fresenius Kabi Italia S.r.l. Via Camagre, 41 I-37063 Isola della Scala (Verona)
Allegato II. Conclusioni scientifiche
 Allegato II Conclusioni scientifiche 7 Conclusioni scientifiche Solu-Medrol 40 mg polvere e solvente per soluzione per iniezione (di seguito «Solu-Medrol») contiene metilprednisolone e, come eccipiente,
Allegato II Conclusioni scientifiche 7 Conclusioni scientifiche Solu-Medrol 40 mg polvere e solvente per soluzione per iniezione (di seguito «Solu-Medrol») contiene metilprednisolone e, come eccipiente,
Prof.ssa D. De Vito Ordinario di Igiene Università degli Studi di Bari
 Prof.ssa D. De Vito Ordinario di Igiene Università degli Studi di Bari Meticillina Meropenem Penicillina G Amoxicillina Ciprofloxacina Invasione batterica delle vie urinarie inferiori I batteri possono
Prof.ssa D. De Vito Ordinario di Igiene Università degli Studi di Bari Meticillina Meropenem Penicillina G Amoxicillina Ciprofloxacina Invasione batterica delle vie urinarie inferiori I batteri possono
Allegato III. Modifiche a paragrafi rilevanti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Modifiche a paragrafi rilevanti del riassunto delle caratteristiche del prodotto e del foglio illustrativo 23 Modifiche approvate dal CHMP alle informazioni sul prodotto per medicinali iniettabili
Allegato III Modifiche a paragrafi rilevanti del riassunto delle caratteristiche del prodotto e del foglio illustrativo 23 Modifiche approvate dal CHMP alle informazioni sul prodotto per medicinali iniettabili
I Nuovi Antibiotici Prof. Andrea Giacometti Università Politecnica delle Marche Dipartimento di Scienze Biomediche e Sanità Pubblica Sezione Malattie
 I Nuovi Antibiotici Prof. Andrea Giacometti Università Politecnica delle Marche Dipartimento di Scienze Biomediche e Sanità Pubblica Sezione Malattie Infettive MORTI/ANNO ATTRIBUIBILI ALLA RESISTENZA ANTI-MICROBICA
I Nuovi Antibiotici Prof. Andrea Giacometti Università Politecnica delle Marche Dipartimento di Scienze Biomediche e Sanità Pubblica Sezione Malattie Infettive MORTI/ANNO ATTRIBUIBILI ALLA RESISTENZA ANTI-MICROBICA
Allegato II. Conclusioni scientifiche
 Allegato II Conclusioni scientifiche 13 Conclusioni scientifiche Haldol, che contiene il principio attivo aloperidolo, è un antipsicotico appartenente al gruppo del butirrofenone. È un potente antagonista
Allegato II Conclusioni scientifiche 13 Conclusioni scientifiche Haldol, che contiene il principio attivo aloperidolo, è un antipsicotico appartenente al gruppo del butirrofenone. È un potente antagonista
RICHIESTA PERSONALIZZATA PER TERAPIA ANTIBIOTICA-ANTIMICOTICA INIETTIVA
 RICHIESTA PERSONALIZZATA PER TERAPIA ANTIBIOTICA-ANTIMICOTICA INIETTIVA U.O. MEDICINA Data Paziente (iniziali) Cod. N cartella clinica Infezione diagnosticata Si richiede il seguente farmaco: Gruppo chimico
RICHIESTA PERSONALIZZATA PER TERAPIA ANTIBIOTICA-ANTIMICOTICA INIETTIVA U.O. MEDICINA Data Paziente (iniziali) Cod. N cartella clinica Infezione diagnosticata Si richiede il seguente farmaco: Gruppo chimico
Dopo la ricostituzione con 7 ml di soluzione di cloruro di sodio 9 mg/ml (0,9%) 1 ml contiene 50 mg di daptomicina.
 1. DENOMINAZIONE DEL MEDICINALE Cubicin 350 mg polvere per soluzione iniettabile o per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni flaconcino contiene daptomicina 350 mg. Dopo la ricostituzione
1. DENOMINAZIONE DEL MEDICINALE Cubicin 350 mg polvere per soluzione iniettabile o per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni flaconcino contiene daptomicina 350 mg. Dopo la ricostituzione
COME GESTIRE LE ASSOCIAZIONI FRA ANTIBIOTICI LE VIE DI SOMMINISTRAZIONE DEGLI
 COME GESTIRE LE ASSOCIAZIONI FRA ANTIBIOTICI. LE VIE DI SOMMINISTRAZIONE DEGLI ANTIBIOTICI Francesco Vitale SC Medicina Interna Saluzzo Infettivologo Gruppo Operativo CIO ASL CN1 RAZIONALE DI IMPIEGO Two
COME GESTIRE LE ASSOCIAZIONI FRA ANTIBIOTICI. LE VIE DI SOMMINISTRAZIONE DEGLI ANTIBIOTICI Francesco Vitale SC Medicina Interna Saluzzo Infettivologo Gruppo Operativo CIO ASL CN1 RAZIONALE DI IMPIEGO Two
Conduzione della terapia insulinica nel paziente con insufficienza renale
 Conduzione della terapia insulinica nel paziente con insufficienza renale Olga Eugenia Disoteo SSD Diabetologia A.O. Ospedale Niguarda Milano Cuneo, 25 gennaio 2014 Diabete Mellito e IRC Alterazioni del
Conduzione della terapia insulinica nel paziente con insufficienza renale Olga Eugenia Disoteo SSD Diabetologia A.O. Ospedale Niguarda Milano Cuneo, 25 gennaio 2014 Diabete Mellito e IRC Alterazioni del
SCHEDA REGIONALE PER LA PRESCRIZIONE ORENCIA 250 MG Farmaco HOSP2
 ORENCIA 250 MG Nome Cognome Codice Fiscale dell Assistito Data di nascita / / Sesso M F Indirizzo trattamento di pazienti adulti affetti da artrite reumatoide grave in fase attiva in associazione con il
ORENCIA 250 MG Nome Cognome Codice Fiscale dell Assistito Data di nascita / / Sesso M F Indirizzo trattamento di pazienti adulti affetti da artrite reumatoide grave in fase attiva in associazione con il
Quali sono le novità nella terapia ormonale sostitutiva nell insufficienza delle ghiandole surrenaliche?
 ANDREA GIUSTINA Direttore Cattedra Endocrinologia Università degli Studi di Brescia Quali sono le novità nella terapia ormonale sostitutiva nell insufficienza delle ghiandole surrenaliche? Come da determinazione
ANDREA GIUSTINA Direttore Cattedra Endocrinologia Università degli Studi di Brescia Quali sono le novità nella terapia ormonale sostitutiva nell insufficienza delle ghiandole surrenaliche? Come da determinazione
Farmaci antiblastici nei pazienti oncologici dializzati: ruolo del farmacologo clinico
 Farmaci antiblastici nei pazienti oncologici dializzati: ruolo del farmacologo clinico Gianluigi Lunardi UOC Oncologia Medica Osp. Sacro Cuore Don Calabria Negrar Farmacologia Clinica Disciplina di frontiera
Farmaci antiblastici nei pazienti oncologici dializzati: ruolo del farmacologo clinico Gianluigi Lunardi UOC Oncologia Medica Osp. Sacro Cuore Don Calabria Negrar Farmacologia Clinica Disciplina di frontiera
MALATTIA EMORRAGICA DA DEFICIT DI VITAMINA K
 MALATTIA EMORRAGICA DA DEFICIT DI VITAMINA K Vitamina K Esistono 3 forme di vitamina K K1 (fillochinone o fitomenandione) presente nelle piante superiori K2 (menachinone) prodotto dai batteri intestinali
MALATTIA EMORRAGICA DA DEFICIT DI VITAMINA K Vitamina K Esistono 3 forme di vitamina K K1 (fillochinone o fitomenandione) presente nelle piante superiori K2 (menachinone) prodotto dai batteri intestinali
4.2 Indicazioni per l utilizzazione specificando le specie di destinazione
 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Melovem 5 mg/ml soluzione iniettabile per bovini e suini 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml contiene: Principio attivo: Meloxicam 5 mg Eccipiente(i):
1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Melovem 5 mg/ml soluzione iniettabile per bovini e suini 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml contiene: Principio attivo: Meloxicam 5 mg Eccipiente(i):
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIDO-HYAL A 25 U.I. e LIDO-HYAL B 175 U.I. soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN PRINCIPI ATTIVI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIDO-HYAL A 25 U.I. e LIDO-HYAL B 175 U.I. soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN PRINCIPI ATTIVI
Farmaco di nuova registrazione THORINANE. Codice ATC Principio Attivo: B01AB05 Enoxaparina Titolare: PHARMATHEN S.A.
 A LLEGATO Inserimento, in accordo all articolo 12, comma 5 della Legge 189/2012, in apposita sezione (denominataclassec(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilitànelle more della presentazione
A LLEGATO Inserimento, in accordo all articolo 12, comma 5 della Legge 189/2012, in apposita sezione (denominataclassec(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilitànelle more della presentazione
Ogni flaconcino contiene ceftarolina fosamil acido acetico monoidrato solvatato equivalente a 600 mg di ceftarolina fosamil.
 1. DENOMINAZIONE DEL MEDICINALE Zinforo 600 mg polvere per concentrato per soluzione per infusione. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni flaconcino contiene ceftarolina fosamil acido acetico
1. DENOMINAZIONE DEL MEDICINALE Zinforo 600 mg polvere per concentrato per soluzione per infusione. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni flaconcino contiene ceftarolina fosamil acido acetico
Allegato I. Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione del Comitato
Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio 1 Conclusioni scientifiche Tenendo conto della valutazione del Comitato
Uso dei farmaci in ambito neonatologico Dott.ssa Lidia Fares S.C. Farmacia Azienda Ospedaliera IRCCS di Reggio Emilia
 Uso dei farmaci in ambito neonatologico Dott.ssa Lidia Fares S.C. Farmacia Azienda Ospedaliera IRCCS di Reggio Emilia Bologna 17/11/2015 Background Il neonato ed il lattante presentano caratteristiche
Uso dei farmaci in ambito neonatologico Dott.ssa Lidia Fares S.C. Farmacia Azienda Ospedaliera IRCCS di Reggio Emilia Bologna 17/11/2015 Background Il neonato ed il lattante presentano caratteristiche
DALLA FARMACOVIGILANZA AGLI INTERVENTI REGOLATORI
 Farmacovigilanza, FAD e farmacisti: i risultati del Progetto della Regione Toscana DALLA FARMACOVIGILANZA AGLI INTERVENTI REGOLATORI Loredano Giorni Monteriggioni, Il Piccolo Castello Hotel, 9 Maggio 2009
Farmacovigilanza, FAD e farmacisti: i risultati del Progetto della Regione Toscana DALLA FARMACOVIGILANZA AGLI INTERVENTI REGOLATORI Loredano Giorni Monteriggioni, Il Piccolo Castello Hotel, 9 Maggio 2009
Medicinale non più autorizzato. Allegato I
 Allegato I Conclusioni scientifiche e motivi per la sospensione dell autorizzazione all immissione in commercio presentati dall Agenzia europea per i medicinali 1 Conclusioni scientifiche Riassunto generale
Allegato I Conclusioni scientifiche e motivi per la sospensione dell autorizzazione all immissione in commercio presentati dall Agenzia europea per i medicinali 1 Conclusioni scientifiche Riassunto generale
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE REKORD B12 polvere e solvente per sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il tappo contiene: Principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE REKORD B12 polvere e solvente per sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il tappo contiene: Principi attivi:
LA FARMACOVIGILANZA E GLI ERRORI DI TERAPIA
 LA FARMACOVIGILANZA E GLI ERRORI DI TERAPIA Maria Trapanese, Ester Sapigni, Laura Marzi Servizio Assistenza Territoriale Area farmaco e Dispositivi medici Regione Emilia-Romagna FARMACOVIGILANZA The science
LA FARMACOVIGILANZA E GLI ERRORI DI TERAPIA Maria Trapanese, Ester Sapigni, Laura Marzi Servizio Assistenza Territoriale Area farmaco e Dispositivi medici Regione Emilia-Romagna FARMACOVIGILANZA The science
MODIFICA ALL'ELENCO DEI FARMACI SOGGETTI A PREZZO DI RIFERIMENTO - In vigore dal p.v.
 AI SIGNORI PRESIDENTI DELLE ASSOCIAZIONI PROVINCIALI LORO SEDI Roma, 20 aprile 2015 Prot. n. 73 MODIFICA ALL'ELENCO DEI FARMACI SOGGETTI A PREZZO DI RIFERIMENTO - In vigore dal 22.04 p.v. ATTENZIONE: raccomandazioni
AI SIGNORI PRESIDENTI DELLE ASSOCIAZIONI PROVINCIALI LORO SEDI Roma, 20 aprile 2015 Prot. n. 73 MODIFICA ALL'ELENCO DEI FARMACI SOGGETTI A PREZZO DI RIFERIMENTO - In vigore dal 22.04 p.v. ATTENZIONE: raccomandazioni
P. De Iaco Oncologia Ginecologica Policlinico S.Orsola - Bologna
 Protocolli di terapia antibiotica in ginecologia: dalla flogosi pelvica non chirurgica alla complicanza post operatoria. P. De Iaco Oncologia Ginecologica Policlinico S.Orsola - Bologna Chirurgia generale
Protocolli di terapia antibiotica in ginecologia: dalla flogosi pelvica non chirurgica alla complicanza post operatoria. P. De Iaco Oncologia Ginecologica Policlinico S.Orsola - Bologna Chirurgia generale
Ruolo dei vecchi e nuovi antibiotici nel trattamento della EI da Stafilococchi. Magnani Giacomo
 Ruolo dei vecchi e nuovi antibiotici nel trattamento della EI da Stafilococchi Magnani Giacomo U.O. di Malattie Infettive Arcispedale SMN di Reggio Emilia Endocardite infettiva: cenni epidemiologici Incidenza
Ruolo dei vecchi e nuovi antibiotici nel trattamento della EI da Stafilococchi Magnani Giacomo U.O. di Malattie Infettive Arcispedale SMN di Reggio Emilia Endocardite infettiva: cenni epidemiologici Incidenza
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE SEMIPENIL 4 g Polvere per soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Flacone Polvere per soluzione iniettabile
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE SEMIPENIL 4 g Polvere per soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Flacone Polvere per soluzione iniettabile
L antibioticoterapia: indicazioni, efficacia e profilo di sicurezza
 5 5 L antibioticoterapia: indicazioni, efficacia e profilo di sicurezza Gli agenti antimicrobici sono tra i farmaci più ampiamente e, spesso, impropriamente usati in tutto il mondo. Nel prescrivere una
5 5 L antibioticoterapia: indicazioni, efficacia e profilo di sicurezza Gli agenti antimicrobici sono tra i farmaci più ampiamente e, spesso, impropriamente usati in tutto il mondo. Nel prescrivere una
Facoltà di Scienze Motorie Università degli Studi di Verona. Corso di Farmacologia Lezione 5: Farmacocinetica (livelli ematici)
 Facoltà di Scienze Motorie Università degli Studi di Verona Corso di Farmacologia Lezione 5: Farmacocinetica (livelli ematici) LIVELLI EMATICI (CONCENTRAZIONI EMATICHE) DEI FARMACI Ø Rappresentano la quantità
Facoltà di Scienze Motorie Università degli Studi di Verona Corso di Farmacologia Lezione 5: Farmacocinetica (livelli ematici) LIVELLI EMATICI (CONCENTRAZIONI EMATICHE) DEI FARMACI Ø Rappresentano la quantità
Farmaci equivalenti: aspetti farmacologici
 Farmaci equivalenti: aspetti farmacologici Prof. Alberto Corsini Università degli Studi di Milano Definizione di medicinale generico/equivalente Un medicinale che ha la stessa composizione qualitativa
Farmaci equivalenti: aspetti farmacologici Prof. Alberto Corsini Università degli Studi di Milano Definizione di medicinale generico/equivalente Un medicinale che ha la stessa composizione qualitativa
Oggetto : Sicurezza d uso di Olimel (aminoacidi elettroliti glucosio anidro lipidi)
 Regione Lombardia - Giunta DIREZIONE GENERALE SALUTE GOVERNO DEI DATI, DELLE STRATEGIE E PIANI DEL SISTEMA SANITARIO FARMACEUTICA, PROTESICA E DISPOSITIVI MEDICI Piazza Città di Lombardia n.1 20124 Milano
Regione Lombardia - Giunta DIREZIONE GENERALE SALUTE GOVERNO DEI DATI, DELLE STRATEGIE E PIANI DEL SISTEMA SANITARIO FARMACEUTICA, PROTESICA E DISPOSITIVI MEDICI Piazza Città di Lombardia n.1 20124 Milano
Altre condizioni e requisiti dell'autorizzazione all'immissione in commercio Rapporti periodici di aggiornamento sulla sicurezza
 Allegato Inserimento, in accordo all articolo 12, comma 5 della Legge 189/2012, in apposita sezione (denominata Classe C (nn)) dedicata ai farmaci non ancora valutati ai fini della rimborsabilità nelle
Allegato Inserimento, in accordo all articolo 12, comma 5 della Legge 189/2012, in apposita sezione (denominata Classe C (nn)) dedicata ai farmaci non ancora valutati ai fini della rimborsabilità nelle
SCHEDA FARMACO. Principio attivo (nome commerciale) Ponatinib. (Iclusig) 30 cpr da 45 mg 60cpr da 15 mg
 Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Ponatinib SCHEDA FARMACO (Iclusig) 30 cpr da 45 mg 60cpr da 15 mg Posologia: La dose
Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Ponatinib SCHEDA FARMACO (Iclusig) 30 cpr da 45 mg 60cpr da 15 mg Posologia: La dose
AIFA Agenzia Italiana del Farmaco Natalizumab (Tysabri)
 AIFA - Natalizumab (Tysabri) 18/02/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Natalizumab (Tysabri) Nota Informativa Importante Del 18 Febbraio 2010 file:///c /documenti/notys120.htm [18/02/2010
AIFA - Natalizumab (Tysabri) 18/02/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Natalizumab (Tysabri) Nota Informativa Importante Del 18 Febbraio 2010 file:///c /documenti/notys120.htm [18/02/2010
Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione
 Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione Beniamino Micheloni U.O.C. Oncologia Medica Ospedale Sacro Cuore Don Calabria Negrar
Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione Beniamino Micheloni U.O.C. Oncologia Medica Ospedale Sacro Cuore Don Calabria Negrar
Allegato III Riassunti delle caratteristiche del prodotto, Etichettatura e fogli illustrativi
 Allegato III Riassunti delle caratteristiche del prodotto, Etichettatura e fogli illustrativi Nota: Questi RCP, etichette e fogli illustrativi sono la versione valida al momento della Decisione della Commissione.
Allegato III Riassunti delle caratteristiche del prodotto, Etichettatura e fogli illustrativi Nota: Questi RCP, etichette e fogli illustrativi sono la versione valida al momento della Decisione della Commissione.
VALUTAZIONE DEL LIVELLO DELLA FUNZIONE RENALE
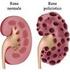 VALUTAZIONE DEL LIVELLO DELLA FUNZIONE RENALE La stima del Filtrato Glomerulare (FG) èil miglior indicatore complessivo della funzione renale. La sola creatininemia non deve essere usata come indice di
VALUTAZIONE DEL LIVELLO DELLA FUNZIONE RENALE La stima del Filtrato Glomerulare (FG) èil miglior indicatore complessivo della funzione renale. La sola creatininemia non deve essere usata come indice di
ALLEGATO CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE DEL FARMACO CHE DEVONO ESSERE IMPLEMENTATE DAGLI STATI MEMBRI
 ALLEGATO CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE DEL FARMACO CHE DEVONO ESSERE IMPLEMENTATE DAGLI STATI MEMBRI CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE
ALLEGATO CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE DEL FARMACO CHE DEVONO ESSERE IMPLEMENTATE DAGLI STATI MEMBRI CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE
Normativa Regolamento UE 1235/2010 Direttiva 2010/84/UE
 Implementazione delle nuove linee guida dell AIFA e principali modifiche introdotte dalla nuova normativa europea di Farmacovigilanza CEFPAS 24 marzo 2015 Claudia La Cavera Normativa Regolamento UE 1235/2010
Implementazione delle nuove linee guida dell AIFA e principali modifiche introdotte dalla nuova normativa europea di Farmacovigilanza CEFPAS 24 marzo 2015 Claudia La Cavera Normativa Regolamento UE 1235/2010
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. (Guideline III/9163/89)
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO (Guideline III/9163/89) 1. DENOMINAZIONE DELLA SPECIALITÀ MEDICINALE Ancotil 2.5 g/250 ml soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO (Guideline III/9163/89) 1. DENOMINAZIONE DELLA SPECIALITÀ MEDICINALE Ancotil 2.5 g/250 ml soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Il trattamento con EXJADE deve essere iniziato e mantenuto da medici esperti nel trattamento del sovraccarico cronico di ferro.
 A LLEGATO Inserimento, in accordo all articolo 12, comma 5 della Legge 189/2012, in apposita sezione (denominata Classe C (nn)) dedicata ai farmaci non ancora valutati ai fini della rimborsabilità nelle
A LLEGATO Inserimento, in accordo all articolo 12, comma 5 della Legge 189/2012, in apposita sezione (denominata Classe C (nn)) dedicata ai farmaci non ancora valutati ai fini della rimborsabilità nelle
La scheda di gestione tempestiva del paziente con sepsi severa/shock settico
 Progetto Laser 2009 Procedure di gestione paziente La scheda di gestione tempestiva del paziente con sepsi severa/shock settico Dott.ssa Giovanna Ratti U.O.C. Malattie Infettive AUSL Piacenza Che cosa
Progetto Laser 2009 Procedure di gestione paziente La scheda di gestione tempestiva del paziente con sepsi severa/shock settico Dott.ssa Giovanna Ratti U.O.C. Malattie Infettive AUSL Piacenza Che cosa
APPROPRIATEZZA PRESCRITTIVA IN OSPEDALE REV. 1 Pag. 1 / 5 SOLUZIONI CONCENTRATE DI POTASSIO
 OSPEDALE REV. 1 Pag. 1 / 5 Stato delle Modifiche Rev. Data Causale 0 14/05/2011 Prima emissione 1) PREMESSA: - Il Ministero della Salute ha emanato una raccomandazione sul corretto utilizzo delle soluzioni
OSPEDALE REV. 1 Pag. 1 / 5 Stato delle Modifiche Rev. Data Causale 0 14/05/2011 Prima emissione 1) PREMESSA: - Il Ministero della Salute ha emanato una raccomandazione sul corretto utilizzo delle soluzioni
Risk Management e Antibiotico terapia
 P.O. San Francesco Nuoro Risk Management e Antibiotico terapia Antonio M. Pinna Risk Manager Errori di terapia Ogni evento prevenibile nel quale l uso di un farmaco ha dato come risultato un effetto indesiderato
P.O. San Francesco Nuoro Risk Management e Antibiotico terapia Antonio M. Pinna Risk Manager Errori di terapia Ogni evento prevenibile nel quale l uso di un farmaco ha dato come risultato un effetto indesiderato
A. ETICHETTATURA TEMPLATE ETICHETTA/FOGLIO ILLUSTRATIVO
 A. ETICHETTATURA TEMPLATE ETICHETTA/FOGLIO ILLUSTRATIVO (Tutte le confezioni registrate in Italia presentano un unico template contenente tutte le informazioni previste dal foglio illustrativo ed etichetta)
A. ETICHETTATURA TEMPLATE ETICHETTA/FOGLIO ILLUSTRATIVO (Tutte le confezioni registrate in Italia presentano un unico template contenente tutte le informazioni previste dal foglio illustrativo ed etichetta)
RoActemra. tocilizumab. Che cos è RoActemra? Per che cosa si usa RoActemra? Riassunto destinato al pubblico
 EMA/18167/2014 EMEA/H/C/000955 Riassunto destinato al pubblico tocilizumab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
EMA/18167/2014 EMEA/H/C/000955 Riassunto destinato al pubblico tocilizumab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
Approfondimenti scientifici
 Approfondimenti scientifici 2 J. Studi comparativi di farmacocinetica e sicurezza di capsule orali e compresse orodispersibili di lansoprazolo in soggetti sani W. FRESTON Aliment Pharmacol Ther 2003; 17:
Approfondimenti scientifici 2 J. Studi comparativi di farmacocinetica e sicurezza di capsule orali e compresse orodispersibili di lansoprazolo in soggetti sani W. FRESTON Aliment Pharmacol Ther 2003; 17:
LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
FARMACOVIGILANZA LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
Elenco dei sinonimi e delle voci correlate...2 Modulistica in uso...3 Norme generali per il prelievo...3
 Pag 1/8 20/09/2010 SOMMARIO Elenco dei sinonimi e delle voci correlate...2 Modulistica in uso...3 Norme per il prelievo...3 FIRMA DI APPROVAZIONE: 20.09.2010 Prof. Gualtiero Palareti Pag 2/8 20/09/2010
Pag 1/8 20/09/2010 SOMMARIO Elenco dei sinonimi e delle voci correlate...2 Modulistica in uso...3 Norme per il prelievo...3 FIRMA DI APPROVAZIONE: 20.09.2010 Prof. Gualtiero Palareti Pag 2/8 20/09/2010
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Maggio 2013 Nuove importanti restrizioni all uso di Protelos/Osseor (ranelato di
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Maggio 2013 Nuove importanti restrizioni all uso di Protelos/Osseor (ranelato di
Le terapia della CAP secondo LG. Oreste CAPELLI, M.D.
 Le terapia della CAP secondo LG Oreste CAPELLI, M.D. LG ATS/IDSA (2007) e BTS (2009) Eziologia della CAP Sia per i pazienti trattati a domicilio che per i pazienti ricoverati l agente eziologico più frequente
Le terapia della CAP secondo LG Oreste CAPELLI, M.D. LG ATS/IDSA (2007) e BTS (2009) Eziologia della CAP Sia per i pazienti trattati a domicilio che per i pazienti ricoverati l agente eziologico più frequente
Le terapia della CAP secondo LG. Oreste CAPELLI, M.D.
 Le terapia della CAP secondo LG Oreste CAPELLI, M.D. LG ATS/IDSA (2007) e BTS (2009) Eziologia della CAP Sia per i pazienti trattati a domicilio che per i pazienti ricoverati l agente eziologico più frequente
Le terapia della CAP secondo LG Oreste CAPELLI, M.D. LG ATS/IDSA (2007) e BTS (2009) Eziologia della CAP Sia per i pazienti trattati a domicilio che per i pazienti ricoverati l agente eziologico più frequente
