Biochimica degli Ormoni
|
|
|
- Ottavia Fiorini
- 5 anni fa
- Visualizzazioni
Transcript
1 Biochimica degli rmoni Appunti per studenti di medicina ver (3 ottobre 2014) Generato con L A TEX
2 ii Questo documento è copyright Lorenzo Bandieri. Alcuni diritti riservati. I diritti d autore sull opera appartengono a Lorenzo Bandieri e sono disciplinati nei termini della licenza Creative Commons BY-NC-SA (Attribuzione-Non Commerciale- Condividi allo stesso modo) 2.5 Italia, il cui testo integrale è disponibile all indirizzo cbea In pratica, questo documento può essere riprodotto e distribuito in tutto o in parte, con ogni mezzo fisico o elettronico, purché questo avviso di copyright sia mantenuto su tutte le copie e l autore sia debitamente citato. La ridistribuzione commerciale non è permessa. gni traduzione, lavoro derivato o comprendente questo documento deve contenere questo stesso avviso di copyright: per esempio, non si possono produrre lavori derivati da questo documento ed imporre restrizioni aggiuntive sulla sua distribuzione. Per tutte le condizioni non esplicitamente menzionate si prega di consultare il testo della licenza. Per ulteriori informazioni si prega di contattare l autore all indirizzo lorenzopuntbandieriatgmailpuntcom.
3 iii FAQ (Frequently Asked Questions) Q: Cos è questo documento? A: È una risorsa per gli studenti di medicina che devono preparare l esame di biochimica. Non sono sbobinature, né appunti riordinati delle lezioni. Probabilmete "dispense" è il termine che più si adatta. Ho scritto questi appunti partendo da articoli e testi vari che per esigenze tecniche non erano citati interamente nella versione iniziale di questo documento. Dalla versione il testo è stato convertito in un formato più adatto. Questo mi ha permesso di inserire una parziale bibliografia, che sarà ampliata in futuro. In ogni caso, qualunque errore contenuto in queste pagine è unicamente mia responsabilità. Q: Perché scriverlo? A: Perché nel programma dell esame di biochimica c è una parte dedicata agli ormoni, che sui classici testi (Lehninger, ma anche altri) non sono trattati in maniera sistematica, oppure sono trattati in maniera eccessivamente superficiale. Inoltre l aver prodotto documento e illustrazioni consente di poterlo distribuire in maniera libera, gratuitamente, anche via internet, sotto licenza Creative Commons. Q: k, fantastico. Io però volevo solo stampare queste dispense. Ho scaricato uno *.zip, ma ci sono dentro un sacco di file. Quale diavolo devo stampare? A: Se stai leggendo questo, hai già trovato il file da stampare. L archivio *.zip contiene: 1. 2 file PDF: questa è l ultima versione della Biochimica degli rmoni. L unica differenza tra i due è che uno è solo fronte, mentre l altro è fronte-retro (cambiano solo i margini e l orientamento dei numeri di pagina). In pratica: se vuoi stamparlo e rilegarlo, stampa il fronte-retro; se vuoi vederlo su pc, tablet o simili prendi solo fronte. 2. CHANGELG.txt: questo file contiene un registro dei cambiamenti introdotti con le varie versioni. 3. source: questa cartella contiene i sorgenti da cui vengono generati i PDF. Puoi ignorarla. Q: Come faccio a sapere se questa è la versione più recente e aggiornata? A: Carico sempre la versione più recente su Scribd e Medwiki (cercando su google si trovano facilmente i link); se la versione (sulla copertina) è la stessa, il documento è alla versione più recente. Nel dubbio, mandami pure una mail. Q: Cos è cambiato rispetto alla precedente versione del documento?
4 iv A: In linea di massima, viene rilasciata una nuova versione quando ci sono delle correzioni. Per sapere esattamente cosa è cambiato da una versione all altra, puoi andare a vedere il file CHANGELG.txt nel file zip scaricabile da MedWiki. Q: Come posso fare per dare una mano? A: Puoi dare una mano in qualunque modo tu riesca a immaginare. Per me è molto importante la semplice segnalazione di errori o di parti poco comprensibili, o consigli su argomenti che andrebbero espansi/ridotti/riscritti. anche schemi/immagini. Il tuo contributo è particolarmente importante nel caso in cui all esame ti venga chiesto qualcosa che non è incluso qui. Ci vogliono pochi minuti per scrivere una mail e segnalare un errore, ma è una cosa utilissima che puoi fare per rendere migliore lo studio per gli altri. Q: Ho trovato un errore/ho un suggerimento/vorrei fare due chiacchiere/vorrei insultarti. Come posso contattarti? A: Puoi contattarmi scrivendo una mail a lorenzopuntbandieriatgmail.com.
5 v Ringraziamenti Prof.ssa Paola Chiarugi; Veronica Gironi (kalendy); Raffaello Bonacchi; Daniele Rizzo; Fiammetta Maria Colla; Federica Perini; Virginia Lotti.
6 Indice 1 Generalità Il concetto di ormone Classificazione degli ormoni Classificazione degli ormoni in base alla solubilità Classificazione degli ormoni in base alla natura chimica Classificazione degli ormoni in base alla modalità di diffusione Chi sintetizza gli ormoni? rmoni proteici e peptidici rmoni dell asse ipotalamo-ipofisi Generalità ssitocina Vasopressina (ADH, ormone antidiuretico) Releasing hormones ipotalamici rmoni dell adenoipofisi rmoni dell apparato digerente Insulina Glucagone rmoni della tiroide e delle paratiroidi Paratormone (PTH) Calcitonina rmoni derivati da aminoacidi Generalità rmoni della zona midollare della ghiandola surrenale Catecolamine rmoni della tiroide Triiodotironina e tetraiodotironina rmoni derivati dall acido arachidonico rigine degli eicosanoidi Classificazione e nomenclatura
7 Indice vii 4.3 Sede di elaborazione Biosintesi Secrezione e regolazione Secrezione, trasporto nel plasma e degradazione Recettore Effetti fisiologici degli eicosanoidi rmoni derivati dalla vitamina D rmoni del rene Calcitriolo rmoni steroidei Struttura e generalità rmoni della corteccia della ghiandola surrenale Corticosteroidi: mineralcorticoidi e glucocorticoidi rmoni delle gonadi Androgeni ed estrogeni
8 Elenco delle figure 1.1 Le modalità di diffusione degli ormoni rmoni dell ipofisi anteriore e posteriore Influenze dell ipotalamo sull ipofisi anteriore e posteriore Schema dei circuiti di feedback tra ipotalamo, ipofisi, e tessuto periferico Struttura aminoacidica dell ossitocina Struttura aminoacidica dell ADH Releasing hormones ipotalamici Rappresentazione schematica della pre-pmc Peptidi derivati dal PMC Pathway di trasduzione del segnale del GH Asse ipotalamo-ipofisi-tiroide Asse ipotalamo-ipofisi-gonadi Asse ipotalamo-ipofisi-surrene Struttura tridimensionale dell insulina Insulina Pathway segnalatori del recettore insulinico Regolazione della glicogeno fosforilasi Regolazione della glicogeno fosforilasi da parte dell insulina Regolazione della glicogeno sintasi Regolazione della glicogeno sintasi da parte dell insulina Schema riassuntivo della regolazione del glicogeno da parte dell insulina Regolazione della glicolisi e della gluconeogenesi nel fegato Regolazione della lipasi ormone sensibile Regolazione della glicogeno fosforilasi da parte del glucagone Regolazione della glicogeno sintasi da parte del glucagone Schema riassuntivo della regolazione del glicogeno da parte dell aumento del camp Schema riassuntivo della regolazione del glicogeno da parte della diminuzione del camp Il circuito fondamentale di feedback tra calcio, PTH e calcitriolo
9 Elenco delle figure ix 3.1 Surrene Struttura di catecolo e catecolamine Biosintesi delle catecolamine Schema semplificato dei pathway che portano alla degradazione delle catecolamine Schema dei pathway che portano alla degradazione delle catecolamine Schema delle reazioni degradative della dopamina Tiroide Struttura degli ormoni tiroidei Formazione di MIT e DIT Struttura di MIT e DIT Fusione di MIT e DIT La cellula tiroidea Struttura delle prostaglandine Eicosanoidi prodotti dall acido arachidonico Eicosanoidi prodotti dagli acidi linoleico e linoleico Eicosanoidi prodotti dall acido arachidonico Via delle lipossigenasi Biosintesi della vitamina D Struttura generale degli steroidi Conversione del colesterolo in pregnenolone Biosintesi dei corticosteroidi. Zona glomerulosa Biosintesi dei corticosteroidi. Zona fascicolata Biosintesi dei corticosteroidi. Zona reticolare Biosintesi degli androgeni Biosintesi degli estrogeni Conversione del testosterone in diidrotestosterone
10 1 Generalità 1.1 Il concetto di ormone Con l evoluzione si sono sviluppati e perfezionati numerosi meccanismi molecolari in grado di informare le cellule su cosa sta succedendo al loro esterno e su come modificare il proprio comportamento. Una delle caratteristiche peculiari degli organismi viventi è proprio la capacità di recepire stimoli provenienti dall ambiente extracellulare e di reagire a livello molecolare. Una cellula può così modulare il proprio metabolismo (per esempio regolando positivamente o negativamente certi enzimi), alterare l espressione genica (per esempio attivando o inibendo un promotore), o entrambi. Questa proprietà si rivela determinante in particolare negli organismi pluricellulari, dove è necessaria una fine coordinazione tra le cellule. Si pensi alla complessità insita nell armonizzare l attività delle cellule dell uomo, specializzate in almeno 210 differenti citotipi. Questi processi biochimici trovano il loro cardine negli ormoni, termine che fu coniato nel 1905 dall eminente fisiologo Ernest Starling [12]. Con il passare degli anni, il concetto di ormone si è modificato in maniera notevole rispetto all idea iniziale, dove il termine designava esclusivamente i messaggeri chimici secreti nel sangue dalle ghiandole endocrine. La definizione classica qualifica un ormone come una sostanza chimica prodotta in una ghiandola specializzata, rilasciata nel circolo sanguigno, che evoca una risposta fisiologica in tessuti distanti. Tuttavia, oggi è noto che [4]: Sono molte le molecole di valenza ormonale a non essere prodotte da ghiandole specializzate, bensì da cellule specializzate intersperse in un tessuto, o, in certi casi, da cellule considerate non specializzate ; Molti dei segnali che una cellula riceve provengono da cellule vicine o dalla cellula stessa; Si conoscono molti esempi in cui le molecole segnale sono rappresentate da semplici sostanze, a cui convenzionalmente non veniva dato valore di ormone (come lo ione calcio);
11 1 Generalità 2 Frequentemente, un recettore ormonale è espresso in cellule che non sono considerate tra i bersaglio classici di quell ormone. È divenuto evidente che molte altre molecole condividono la medesima funzione di segnali chimici, agiscono con le stesse modalità e attraverso gli stessi meccanismi biochimici fondamentali; così la denominazione è stata progressivamente estesa ad una pletora di fattori molto diversi tra loro (fattori umorali, paracrini, autocrini...) [4]. Ad oggi, nel mondo scientifico è sempre più diffusa la tendenza a considerare ormone qualunque segnale in grado di indurre una risposta in una cellula. Tale risposta è evocata grazie al legame dell ormone con un recettore, che è una molecola per mezzo della quale vengono espletati gli effetti biologici. Una cellula con cui l ormone interagisce tramite un legame con recettori è detta cellula bersaglio. Quindi, possiamo parlare di ormone a proposito, ad esempio, di insulina e glucagone, ma anche a proposito di citochine e interleuchine, o, estendendo al massimo il concetto, della luce. È importante sottolineare che di solito un ormone non agisce su un solo citotipo, ma su tipi cellulari differenti. Non viene perduta con ciò la capacità di evocare risposte tessuto-specifiche, grazie al fatto che ogni cellula risponde in modo diverso al segnale. Nella maggior parte dei casi questo è dovuto all espressione di recettori lievemente differenti. 1.2 Classificazione degli ormoni Gli ormoni sono classificabili secondo diversi criteri, i più comuni dei quali sono solubilità, natura chimica, e modalità di diffusione Classificazione degli ormoni in base alla solubilità Classificare gli ormoni in base alla solubilità consente di ripartirli in due grandi gruppi: ormoni idrosolubili e liposolubili. Questa suddivisione è molto importante perché riflette anche fondamentali differenze funzionali. Gli ormoni idrosolubili: vengono solubilizzati dai fluidi biologici, e tendono a non legarsi a trasportatori; non sono in grado di attraversare la membrana, ed hanno recettori sulla membrana cellulare, attraverso la cui mediazione il segnale viene trasdotto a livello intracellulare, sfruttando i cosiddetti secondi messaggeri;
12 1 Generalità 3 Gli ormoni liposolubili, al contrario: hanno bisogno di trasportatori, essendo poco o per niente solubili nel plasma; sono in grado di attraversare la membrana plasmatica, quindi hanno recettori intracellulari (in certi casi, non esclusivamente), legati ai quali si portano a livello nucleare per influenzare l espressione genica i recettori quindi agiscono come fattori di trascrizione attivati dal ligando; Classificazione degli ormoni in base alla natura chimica Classificare gli ormoni secondo la loro natura chimica permette di suddividerli in: rmoni proteici e peptidici. Costituiscono la maggior parte degli ormoni in circolo, e sono rappresentati da molecole le cui dimensioni vanno dai 3 ai 200 aminoacidi. Tipicamente subiscono alcune modifiche post-traduzionali; tra queste vi è la glicosilazione. Dunque, questa classe comprende anche ormoni glicoproteici. rmoni derivati dagli aminoacidi. Sono ottenuti modificando alcuni aminoacidi. Ne fanno parte le catecolammine, idrosolubili, e gli ormoni sintetizzati dalla tiroide, liposolubili. Derivano entrambi dalla tirosina. rmoni steroidei. Derivano tutti dal colesterolo, e sono lipofili. rmoni derivati dall acido arachidonico. Sono rappresentati dagli eicosanoidi, e sono lipofili. rmoni derivati dalla vitamina D. Derivano dal colesterolo, ma a rigore non possono esser considerati steroidi a causa della loro struttura chimica. Sono lipofili Classificazione degli ormoni in base alla modalità di diffusione Una distinzione degli ormoni sulla base della modalità di diffusione tiene conto di come l ormone raggiunge la cellula bersaglio e del raggio d azione (Fig 1.1). Comunemente, si parla di: rmoni endocrini. Raggiungono la cellula bersaglio attraverso il circolo sanguigno; sono potenzialmente in grado di agire a lungo raggio, e diffondersi in tutto il corpo.
13 1 Generalità 4 B) Modalità di diffusione paracrina A) Modalità di diffusione endocrina C) Modalità di diffusione autocrina Figura 1.1: Le tre principali modalità di diffusione con cui un ormone raggiunge le cellule bersaglio: A) modalità endocrina; B) modalità paracrina; C) modalità autocrina. rmoni paracrini. Sono rilasciati nello spazio extracellulare, e raggiungono la cellula bersaglio per diffusione; agiscono sulle cellule circostanti alla cellula secernente. rmoni autocrini. Agiscono sulla stessa cellula che ha secreto l ormone. Alcuni testi parlano anche di una modalità iustacrina (dal latino juxta, accanto). Queste modalità d azione non si escludono mutualmente: un ormone può, per esempio, essere sia paracrino che autocrino, oppure paracrino ed endocrino, etc. Quest ultimo è il caso, ad esempio, del testosterone: sintetizzato dalle cellule di Leydig nel testicolo (e in piccola parte a livello della zona corticale delle ghiandole surrenali) ha numerosi effetti a livello endocrino, come il mantenimento del trofismo muscolare, ma agisce anche a livello paracrino sulle cellule del Sertoli dei tubuli seminiferi, stimolando la spermatogenesi. Ad oggi sono note decine di ormoni, e ne vengono scoperti continuamente di nuovi. Esplorare la biosintesi di ciascuno va oltre gli scopi di queste pagine; per questo motivo nei prossimi capitoli esamineremo nel dettaglio solo la biosintesi degli ormoni più significativi.
14 1 Generalità Chi sintetizza gli ormoni? Una cellula sintetizza un ormone se esprime gli enzimi necessari, e/o se esprime il gene relativo all ormone in questione (nel caso degli ormoni peptidici). Nel caso di molti ormoni che prenderemo in considerazione, la sintesi avviene esclusivamente o quasi in tessuti specializzati, che possono costituire ghiandole. Un esempio sono gli ormoni tiroidei, sintetizzati esclusivamente dalle cellule follicolari della tiroide. Talora, se la sintesi dell ormone è molto complessa, può essere necessaria la collaborazione di tessuti diversi: è il caso del calcitriolo o degli estrogeni. Tuttavia, alcune molecole di valore ormonale sono sintetizzate da quasi tutte le cellule del corpo; un esempio importante sono gli eicosanoidi.
15 2 rmoni proteici e peptidici La grande maggioranza degli ormoni sintetizzati dall uomo sono di natura proteica/peptidica. In questo gruppo, come si può immaginare, sono dunque comprese molecole segnalatorie estremamente diverse, sintetizzate da una varietà di organi e cellule, e dalle funzioni più disparate. A causa dell ampiezza dell argomento, non saranno trattati tutti gli ormoni conosciuti, ma solo quelli più importanti. In particolare, esamineremo a grandi linee gli ormoni dell asse ipotalamo-ipofisario, di fondamentale importanza per comprendere le relazioni che intercorrono tra sistema nervoso ed apparato endocrino, e le modalità con cui questi ormoni esercitano il loro controllo sul resto del corpo. Esamineremo poi due dei tre ormoni importanti per l omeostasi del calcio e del fosfato (PTH e calcitonina) 1. Infine, tratteremo due importanti ormoni che ricoprono un ruolo centrale nel metabolismo energetico dell organismo umano: insulina e glucagone. Un tema ricorrente nella trattazione di questi messaggeri chimici, su cui il lettore è invitato a fare attenzione, è che gli ormoni peptidici e proteici sono sintetizzati spesso come precursori più grandi, che vengono attivati mediante proteolisi limitata. 2.1 rmoni dell asse ipotalamo-ipofisi Dove siamo? Ipotalamo e ipofisi L ipofisi, o ghiandola pituitaria, è una piccola ghiandola rotondeggiante che sporge dalla base dell encefalo. È accolta nella sella turcica dell osso sfenoide, ed è collegata al resto dell encefalo da un peduncolo che si estende posteriormente al chiasma ottico, l infundibolo. Consta di due parti, dette lobi: un lobo anteriore (adenoipofisi) e un lobo posteriore (neuroipofisi). Tra le due è interposta la pars intermedia, una regione che nell uomo è scarsamente sviluppata. 1 Il terzo, il calcitriolo, sarà trattato con gli ormoni derivati dalla vitamina D, a pagina 132.
16 2 rmoni proteici e peptidici 7 L ipotalamo è una regione encefalica (in particolare, diencefalica) connessa all ipofisi per mezzo dell infundibulo. L ipotalamo è in pratica un insieme di nuclei, cioè aggregati di corpi neuronali, immersi nella sostanza bianca. Sono proprio gli assoni che si dipartono dai corpi neuronali che formano alcuni di questi nuclei che costituiscono l infundibolo Generalità L ipofisi secerne due tipi fondamentali di ormoni: 1. molecole segnale la cui funzione fisiologica è controllare e modulare la secrezione di altri ormoni (a livello dell adenoipofisi); 2. molecole segnale la cui funzione fisiologica è regolare direttamente alcune funzioni omeostatiche (soprattutto a livello della neuroipofisi). Nel primo caso, gli ormoni liberati dall ipofisi raggiungono le ghiandole endocrine periferiche con il circolo sanguigno e regolano il rilascio di altri ormoni; in generale, sono messaggeri chimici piuttosto specifici nella loro azione, nel senso che ciascuno regola il rilascio di un ormone o di un gruppo di ormoni funzionalmente correlati. Nel secondo caso, l azione fisiologica dei messaggeri elaborati dall asse ipotalamoipofisario non è di regolare il rilascio di altri ormoni, bensì di agire direttamente come ormoni, regolando varie funzioni corporee. L adenoipofisi è responsabile della sintesi di (Fig. 2.1): ACTH, ormone adenocorticotropo - Stimola la sintesi degli ormoni corticosteroidi, a livello della ghiandola surrenale (trattati nella sezione a pagina 142); FSH, ormone follicolostimolante - Stimola la sintesi degli ormoni sessuali, a livello delle gonadi maschili e femminili (trattati nella sezione 6.3 a pagina 155); GH (Growth Hormone), ormone della crescita - Promuove l accrescimento del corpo (trattato in questo capitolo, pag. 29); LH, ormone luteinizzante - Come l FSH, stimola la sintesi degli ormoni sessuali (trattati nella sezione 6.3 a pagina 155); PRL, prolattina - Agisce a livello della ghiandola mammaria (pag. 29); TSH, ormone tireostimolante - Stimola la sintesi degli ormoni tiroidei a livello della ghiandola omonima (trattati nella sezione 3.3 a pagina 102);
17 2 rmoni proteici e peptidici 8 lobo anteriore dell'ipofisi lobo posteriore dell'ipofisi ACTH GH ADH (vasopressina) LH ed FSH TSH PRL (endorfine e lipotropine) ssitocina Figura 2.1: I principali ormoni secreti dal lobo anteriore e dal lobo posteriore dell ipofisi Endorfine e lipotropine - Molecole coinvolte in numerose funzioni fisiologiche, tra le quali (particolarmente interessante per gli studenti di medicina) il dolore (pag. 24). Collettivamente ACTH, FSH, LH e TSH sono detti ormoni tropinici perché agiscono su altre ghiandole endocrine; come abbiamo detto sono molecole segnale la cui funzione fisiologica è controllare e modulare la secrezione di altri ormoni. A livello della neuroipofisi vengono secreti ormoni che agiscono come tali (Fig. 2.1): ssitocina - Esplica numerose funzioni nel parto e non solo; Vasopressina o ADH - Interviene nella regolazione del bilancio idrico, dell osmolarità e della pressione del plasma; Anche senza una specifica conoscenza della fisiologia di questi ormoni, appare chiaro che l ipofisi nel suo complesso abbia il ruolo di direttore d orchestra nei confronti dell apparato endocrino e, più in generale, nell omeostasi del corpo umano. È legittimo chiedersi, a questo punto, come vengano regolate le funzioni ormonali dell ipofisi, e a quali segnali risponda. La risposta sta nell ipotalamo, che si trova nelle vicinanze della ghiandola, e nel concetto di feedback. A livello dell ipotalamo avviene l integrazione tra i segnali provenienti da altre aree dell SNC e recettori sensoriali; complessivamente, questa struttura è raggiunta da una serie molto ampia di stimoli (relativi ad es. alla sensibilità viscerale, oppure stimoli sensoriali esterni, etc.). È noto che l ipotalamo riceve afferenze da praticamente tutte le
18 2 rmoni proteici e peptidici 9 Neuroni parvocellulari Neuroni magnocellulari CRH GHRH GnRH TRH Somatostatina Dopamina Circolo portale ipofisario lobo anteriore dell'ipofisi lobo posteriore dell'ipofisi ACTH GH ADH (vasopressina) LH ed FSH TSH PRL (endorfine e lipotropine) ssitocina Figura 2.2: Le influenze ipotalamiche sulla secrezione dei principali ormoni secreti dal lobo anteriore e dal lobo posteriore dell ipofisi altre regioni dell encefalo: è quindi perfettamente integrato nel sistema nervoso, ed è costantemente raggiunto da numerose informazioni. I neuroni che lo compongono ricevono segnali attraverso neurotrasmettitori, esattamente come tutti gli altri neuroni. Tuttavia, piuttosto che propagare un potenziale d azione e rilasciare un neurotrasmettitore, alcuni neuroni ipotalamici sintetizzano e rilasciano molecole di valenza ormonale (Fig. 2.2): i neuroni magnocellulari (appartenenti ai nuclei sopraottico e paraventricolare) sintetizzano ossitocina e vasopressina. Gli assoni di questi neuroni percorrono l infundibulo, il peduncolo che connette l ipotalamo all ipofisi, e si portano a livello della neuroipofisi: in effetti, la neuroipofisi può esser considerata una estensione dell ipotalamo. Qui mettono in circolo ossitocina e vasopressina, che agiscono come ormoni endocrini. i neuroni parvocellulari sintetizzano molecole segnale che inibiscono o promuovono la secrezione degli ormoni adenoipofisari che, a loro volta, dirigono le ghiandole endocrine periferiche.
19 2 rmoni proteici e peptidici 10 Quindi: a livello dell ipotalamo arrivano diversi stimoli, della cui natura adesso non ci preoccupiamo, in base ai quali vengono inviati segnali all ipofisi o vengono liberati ormoni endocrini; l ipofisi, in base agli stimoli ricevuti, secerne o meno ormoni che poi andranno a regolare la sintesi di altri, ulteriori ormoni, per esempio a livello della ghiandola surrenale o delle gonadi. Per avere il quadro completo dobbiamo sovrapporre a questo scenario, già abbastanza articolato, un intricato sistema di feedback. In sostanza, la biosintesi o la secrezione di un ormone può essere influenzata dalla concentrazione di certi ioni, di altri ormoni, o dell ormone stesso: si ha feedback negativo quando il risultato di questa regolazione è una inibizione, feedback positivo quando il risultato è un aumento; il primo è decisamente comune. L ipotalamo può subire una regolazione a feedback da parte (Fig. 2.3): 1. di un ormone secreto dall ipotalamo stesso; 2. di un ormone secreto dall ipofisi; 3. di un ormone secreto da una ghiandola endocrina in risposta ad un ormone tropinico dell ipofisi. Allo stesso modo, l ipofisi, oltre a sottostare alla regolazione (non di tipo feedback) dell ipotalamo, può subire regolazione feedback da parte di un ormone secreto da una ghiandola endocrina perifica (in risposta ad un ormone tropinico ipofisario). È molto comune la situazione in cui l ormone periferico inibisce sia l ormone ipofisario che l ormone ipotalamico. L asse ipotalamo-ipofisario è costituito proprio dai complessi e intimi rapporti regolativi che si instaurano tra questi due organi, che collaborano nella direzione di molti processi fisiologici del corpo. È frequente che tale denominazione venga estesa anche alle ghiandole endocrine terminali (per cui si parla anche di asse ipotalamo-ipofisario-gonadico, o asse ipotalamoipofisario-surrenale), così come alle aree cerebrali che stanno a monte (asse limbicoipotalamo-ipofisi-adrenocorticale). Adesso esamineremo brevemente gli ormoni secreti dall ipotalamo, trattando prima i neurormoni dei neuroni magnocellulari (e quindi neuroipofisi posteriore), poi dei neuroni parvocellulari (che controllano la secrezione adenoipofisaria). Successivamente esamineremo l adenoipofisi, soffermandoci sulla biosintesi solo quando questa presenti aspetti insoliti o di interesse clinico e biochimico. I neuroni magnocellulari dell ipotalamo, come abbiamo accennato, sintetizzano ossitocina e vasopressina. Questi vengono poi secreti a livello dell ipofisi posteriore, che in effetti rappresenta un estensione dell ipotalamo.
20 - 2 rmoni proteici e peptidici 11 Ipotalamo + Ipofisi + - Ghiandola periferica - Figura 2.3: Questo schema illustra un tipico circuito di feedback tra ipotalamo, ipofisi, e una ghinadola periferica.
21 2 rmoni proteici e peptidici Tyr 1 Cys Ile Cys 4 5 Gln Asn Pro Leu Gly NH 2 Figura 2.4: La struttura dell ossitocina. Si tratta di un peptide composto da 9 aminoacidi, con un ponte disolfuro che crea un ciclo intramolecolare. Risulta molto simile all ADH ssitocina Struttura L ossitocina è un peptide di 9 aminoacidi con struttura ad anello (data da un ponte disolfuro intramolecolare tra due Cys, fig. 2.4). Sede di elaborazione Viene sintetizzata e secreta dai neuroni magnocellulari dei nuclei sopraottico e paraventricolare, i cui assoni si estendono nella neuroipofisi (ipofisi posteriore). A livello della terminazione assonica l ormone viene immagazzinato in vescicole, per poi essere secreto per esocitosi in risposta ad una depolarizzazione, che provoca un aumento intracellulare di Ca 2+. Quest ultimo innesca la liberazione delle vescicole. Biosintesi L ossitocina è sintetizzata nel reticolo endoplasmatico come pre-ormone; passa poi nel Golgi, e viene in seguito impacchettata in grossi granuli secretori, che vengono trasportati lungo l assone dei neuroni magnocellulari (a livello macroscopico, dobbiamo immaginarli viaggiare lungo il peduncolo ipofisario). Durante il trasporto, all interno dei granuli, il pre-ormone subisce modifiche post-traduzionali, in seguito alle quali si produce l ormone attivo e un peptide derivato dal processamento del pre-ormone, la neurofisina I. Quindi, durante il trasporto assonale, l ossitocina si trovava legata alla neurofisina I e collettivamente formavano il pre-ormone; in seguito a taglio proteolitico, queste vengono separate in due frammenti peptidici distinti. Al momento della secrezione ossitocina e neurofisina I vengono liberate insieme. Secrezione e regolazione La secrezione di ossitocina avviene per esocitosi, ed è innescata da una depolarizzazione. L attività elettrica delle cellule ipotalamiche è condizionata da una varietà di stimoli: in generale, l ormone viene immesso in circolo durante l allattamento e il parto. In particolare:
22 2 rmoni proteici e peptidici 13 per quanto riguarda il ruolo dell ossitocina nel parto, la distensione della cervice uterina al termine della gravidanza, provocata dal feto, e la contrazione dell utero durante il parto stesso inducono il rilascio di ossitocina; durante l allattamento la suzione del capezzolo induce il rilascio di ossitocina attraverso la stimolazione di recettori sensoriali. il rilascio di ossitocina è stimolato dall ossitocina stessa (feedback positivo!); questo avviene con un meccanismo di tipo autocrino pare che una parte dell ossitocina sia secreta a livello dell ipotalamo; la secrezione di ossitocina è inibita dal dolore, dall aumento della temperatura corporea e dal rumore. Trasporto nel plasma e degradazione Nel plasma, l ossitocina ha emivita breve (pochi minuti), e viene rimossa dalla circolazione soprattutto dal rene. Circola essenzialmente in forma libera. Recettori L ossitocina esplica la sua azione biologica tramite recettori accoppiati a proteine G, che stimolano l adenilato ciclasi, innalzando la concentrazione di camp, che è quindi il secondo messaggero. Nel miometrio, il pathway più sfruttato è tuttavia quello della fosfolipasi C-Ca 2+ -PKC. Questi recettori sono espressi soprattutto dalle cellule uterine e mammarie. Effetti fisiologici A livello dell utero, induce contrazioni ritmiche che favoriscono il parto o la mestruazione. Dato che la secrezione di ossitocina è stimolata dalle contrazioni uterine, siamo in presenza di un meccanismo di tipo feedback positivo notare peraltro che durante le fasi terminali della gravidanza, gli ormoni sessuali determinano un incremento esponenziale dell espressione dei recettori per l ossitocina a livello uterino. Questo rende l utero molto più ricettivo all ormone. A livello della mammella, induce la contrazione delle cellule mioepiteliali che si trovano a livello degli alveoli che compongono il tessuto ghiandolare mammario, provocando la fuoriuscita del latte materno. Si ipotizza che l ossitocina influenzi il comportamento, in particolare il comportamento materno, il comportamento sociale e il comportamento sessuale, anche se l attività nell uomo non è stata dimostrata in modo convincente.
23 2 rmoni proteici e peptidici Tyr Cys Phe Cys Pro Arg Gly NH Gln Asn Figura 2.5: La struttura dell ADH. Si tratta di un peptide composto da 9 aminoacidi, con un ponte disolfuro che crea un ciclo intramolecolare. Risulta molto simile all ossitocina Vasopressina (ADH, ormone antidiuretico) L arginina vasopressina (sinonimi: vasopressina, argipressina, AVP, ADH - da antidiuretic hormone, ormone antidiuretico) è un ormone peptidico che entra in gioco nella regolazione del bilancio idrico, dell osmolarità plasmatica e degli elettroliti plasmatici. Struttura è un peptide di 9 aminoacidi, strutturalmente molto simile all ossitocina (Fig. 2.5). In particolare, è estremamente simile la composizione aminoacidica, e presenta una simile struttura ciclica dovuta ad un anello intramolecolare, formato da un ponte disolfuro tra due cisteine. Sede di elaborazione Come l ossitocina, viene sintetizzato dai neuroni magnocellulari dell ipotalamo, e rilasciato dai loro assoni a livello della neuroipofisi. Biosintesi La biosintesi della vasopressina segue le stesse tappe della biosintesi dell ossitocina; anche l ADH viene immagazzinato in granuli secretori, dove il taglio proteolitico del pre-ormone produce la vasopressina o ADH e la neurofisina II. Secrezione e regolazione Una depolarizzazione del neurone promuove il rilascio per esocitosi di ormone e neurofisina II. L ADH regola il bilancio idroelettrolitico dell organismo modulando il riassorbimento dell acqua da parte del rene: in pratica, è un ormone che evita una disidratazione eccessiva. La regolazione della secrezione avviene ad opera: dell aumento dell osmolarità plasmatica (l osmolarità aumenta se il plasma diviene più concentrato, cioè se il contenuto di acqua diminuisce). Specifici osmocettori, estremamente sensibili, sono presenti nell ipotalamo, nell organo subfornicale, nel nucleo preottico mediano e nell organum vascolosum della lamina terminalis; quando vi è perdita di liquidi, con alterazione anche minima dell osmolarità plasmatica, anche questi recettori perdono liquido intracellulare
24 2 rmoni proteici e peptidici 15 per motivi osmotici. La conseguente riduzione del volume cellulare innesca il segnale che porterà alla sintesi e alla secrezione di ADH. Allo stesso modo, quando vi è eccessiva diluizione del plasma, gli osmocettori aumentano di volume e riducono la secrezione di ADH. della riduzione della pressione sanguigna (la pressione diminuisce se diminuisce il volume plasmatico). Barocettori sensibili alla pressione si trovano negli atri del cuore, nell aorta, nelle carotide, nelle vene. Questi barocettori inviano al sistema nervoso degli impulsi che inibiscono tonicamente (cioè continuamente) la secrezione di ADH. Se stimolati meccanicamente dalle variazioni della tensione delle pareti vascolari in seguito alla diminuzione di pressione, riducono i loro impulsi, e la secrezione di ADH cessa di essere inibita. La sensibilità alle variazioni di pressione sanguigna è minore rispetto alla sensibilità alle variazioni di osmolarità. Parallelamente, a livello renale si può avere la secrezione di renina in risposta a stimoli correlati ad una diminuzione della pressione sanguigna. La renina effettua un taglio proteolitico che converte l angiotensinogeno, prodotto dal fegato in angiotensina I, che dopo ulteriori modifiche diventa angiotensina II. Quest ultima molecola concerta la modulazione di un gran numero di processi fisiologici, che hanno come risultato ultimo l incremento della pressione sanguigna; tra questi vi è l aumento della secrezione di ADH. La secrezione di ADH può essere influenzata anche da altri stimoli e sostanze: dolore, stress, ipoglicemia, nicotina, esercizio fisico intenso etc. Correlazioni cliniche: Alcool e ADH L etanolo è una sostanza che molte persone hanno assunto almeno una volta nella vita (e qualcuno tante volte). Un fenomeno che si accompagna al consumo di bevande alcoliche è, notoriamente, l effetto diuretico. L etanolo inibisce la secrezione di ADH, diminuendo il riassorbimento di acqua da parte del rene. Il rene quindi produce più urina, e questo sembra essere il principale meccanismo dell effetto diuretico associato all ingestione di alcool [34, 35]. Trasporto nel plasma e degradazione Come l ossitocina, anche l emivita dell ADH è breve. L ormone circola prevalentemente in forma libera, in concentrazioni dell ordine dei ng/l, e viene massicciamente escreto con le urine: dato che la principale azione dell ormone è a livello renale, filtra direttamente attraverso i capillari glomerulari.
25 2 rmoni proteici e peptidici 16 Recettori L azione biologica dell ormone antidiuretico è mediata da recettori accoppiati a proteine G. Sono noti tre tipi di recettori dell ADH: V 1A (noto anche come V 1 ): è espresso in molti tessuti, tra cui fegato, muscolatura liscia, piastrine e miometrio; è accoppiato alla proteina Gq, che attiva soprattutto le fosfolipasi C e A 2, determinando nel primo caso un aumento del calcio intracellulare attraverso il pathway dell IP 3, nel secondo caso la sintesi di eicosanoidi. V 1B (noto anche come V 3 ) è considerato un recettore minore, ed è espresso soprattutto nelle cellule dell adenoipofisi che secernono ACTH. Agisce come il V 1A, attivando cioè la fosfolipasi C. V 2 : è espresso nei tessuti renali; è accoppiato a una proteina Gs, che attiva l adenilato ciclasi, incrementando i livelli intracellulari di camp. Effetti fisiologici Gli effetti più importanti dell ADH si apprezzano soprattutto nel rene e nella muscolatura liscia dei vasi. Rene L ADH controlla il riassorbimento dell acqua a livello dei dotti collettori distali nella quota del 10% circa. Il 90% circa dell acqua è invece riassorbito in maniera ormone-indipendente nei tubuli prossimali, dove le cellule esprimono in maniera costitutiva l acquaporina-1, un proteina integrale di membrana che forma dei canali per l acqua. La vasopressina legandosi al recettore V 2 aumenta i livelli di camp nelle cellule dei dotti collettori distali, attivando quindi una PKA che fosforila l acquaporina-2. La fosforilazione provoca lo spostamento dell acquaporina-2 dal citosol alla membrana. In definitiva, l ADH aumenta il numero di canali per l acqua attivi, permettendo un maggior riassorbimento di acqua libera da soluti. Questo provoca una maggiore concentrazione delle urine, e una maggiore conservazione di liquidi. Può sembrare strano che l ADH controlli solo il 10% dell acqua riassorbita, ma considerando che in un uomo adulto si formano 180 litri di filtrato glomerulare ogni giorno, se l ormone non controllasse quel 10%, avremmo l escrezione di ben 18 litri di urina al giorno! Muscolatura liscia dei vasi A livello della muscolatura liscia dei vasi, l ADH determina vasocostrizione (da qui il nome di vasopressina).
26 2 rmoni proteici e peptidici 17 Correlazioni cliniche: Diabete insipido Storicamente, due grandi malattie sono state denominate come diabete : il diabete mellito ed il diabete insipido. La parola diabete deriva probabilmente dal greco διαβαίνω (pronuncia: diabàino), scorrere, passare attraverso, in riferimento alla marcata emissione di urine (poliuria) che caratterizza queste due malattie. Tuttavia, a parte la poliuria, il diabete mellito ed insipido non hanno praticamente niente in comune, e sono due malattie sostenute da meccanismi diversi. Il diabete mellito è la malattia a cui di solito ci si riferisce quando si parla di diabete senza specificare altro: la poliuria qui è causata da un eccesso di glucosio ematico (iperglicemia). Quando il glucosio è in quantità tali da superare le capacità di riassorbimento del rene e passa nelle urine, si porta dietro acqua per osmosi e provoca quindi un aumento del volume di urine emesse (diuresi osmotica). Nel diabete insipido la poliuria deriva da un meccanismo completamente diverso: il rene non riceve o non è in grado di rispondere al segnale ormonale per il riassorbimento di acqua. I termini insipido e mellito derivano dal fatto che i medici del passato erano soliti assaggiare le urine dei loro pazienti: se le urine erano dolci il diabete era mellito (cioè dolce, per il glucosio - Willis nel 1674 definiva le urine dei diabetici sorprendentemente dolci, come fossero miscelate con miele o zucchero ; gli credo sulla parola); se le urine erano insapori (perché molto diluite) il diabete era insipido. Il diabete insipido può essere causato da una insufficiente secrezione di ADH (diabete insipido centrale ), oppure dalla mancata risposta del rene allo stimolo della vasopressina (diabete insipido nefrogenico ). L insufficiente secrezione di ADH è la causa più frequente: si può realizzare in seguito a tumori, traumi, infezioni, autoimmunità o cause più rare. Talvolta non si riesce a trovare una causa, e quindi il diabete insipido è idiopatico. Il diabete insipido nefrogenico è raro e insorge in seguito a mutazioni dei recettori V 2 dell ADH o mutazioni dell acquaporina; talvolta è secondario a patologie renali. Dal punto di vista clinico, il diabete insipido si manifesta con poliuria (la produzione di grandi quantità di urine molte diluite, giorno e notte, fino a diversi litri al giorno) e polidipsia (una sete insopprimibile, per compensare alla perdita di liquidi con le urine) Releasing hormones ipotalamici I neuroni parvocellulari dell ipotalamo sintetizzano e rilasciano, a livello dell eminenza mediana, neuropeptidi che controllano la secrezione dell ipofisi anteriore (Fig. 2.6). I neuropeptidi giungono all adenoipofisi attraverso un sistema venoso portale, e
27 2 rmoni proteici e peptidici 18 Neuroni parvocellulari dell'ipotalamo TRH GnRH CRH Somatostatina GHRH Dopamina Recettori accoppiati a proteine G PLC PLC AC AC AC AC cellule tireotrope cellule gonadotrope cellule corticotrope cellule somatotrope cellule lattotrope TSH LH FSH ACTH GH PRL Recettori accoppiati a proteine G Recettori delle citochine classe 1 AC AC AC AC diversi meccanismi di trasduzione del segnale Figura 2.6: I releasing hormones ipotalamici. PLC: fosfolipasi C; AC: adenilato ciclasi. esercitano la loro attività biologica mediante recettori accoppiati a proteine G; la maggior parte della trasduzione intracellulare del segnale è mediata dalla stimolazione della adenilato ciclasi; in altri casi (TRH e GnRH), si ha l attivazione del pathway della fosfolipasi C. I neurormoni sono: CRH, ormone di rilascio delle corticotropine agisce sulle cellule che rilasciano ACTH (cellule corticotrope) e altre molecole segnale derivate dal un grande pro-ormone chiamato propriomelanocortina; TRH, ormone di rilascio della tireotropina agisce sulle cellule che rilasciano l ormone tireostimolante (cellule tireotrope); GHRH, ormone di rilascio dell ormone della crescita agisce sulle cellule che rilasciano l ormone della crescita (cellule somatotrope); GnRH, ormone di rilascio delle gonadotropine agisce sulle cellule che rilasciano LH e FSH (cellule gonadotrope); Dopamina agisce sulle cellule che rilasciano prolattina (cellule lattotrope); Somatostatina ha molti effetti biologici; tra quelli che ci interessano adesso, l inibizione della secrezione di GH, TSH e prolattina.
28 2 rmoni proteici e peptidici 19 Come si può intuire, praticamente tutta la secrezione ipofisaria è sotto il controllo dei neurormoni ipotalamici. La liberazione di questi neurormoni da parte dell ipotalamo sottostà a diversi tipi di regolazione, come abbiamo accennato parlando dell asse ipotalamo ipofisario. Si tratta di: 1. una massiccia regolazione di tipo feedback (negativo o positivo) da parte di altri ormoni endocrini; 2. l influenza dei segnali provenienti dall ambiente esterno e da altre aree cerebrali. Per esempio, il rilascio del TRH, che promuove la secrezione di TSH, è influenzato dai livelli plasmatici degli ormoni tiroidei di cui il TSH stimola l immissione in circolo (vedi anche fig. 2.10, pag. 37). Esistono sistemi di feedback similari (in cui cioè l ormone ipotalamico risente con un meccanismo feedback della concentrazione dell ormone ipofisario, che a propria volta risente con un altro circuito di feedback della concentrazione dell ormone periferico) per ciascuno degli ormoni ipotalamici: quindi, il GnRH sarà regolato mediante feedback dalla concentrazione di LH e FSH, che saranno regolati dalla concentrazione degli ormoni sessuali, etc. A questi si possono sovrapporre altri feedback: per esempio, CRH stimola a livello ipofisario la secrezione di ACTH, il quale a propria volta stimola la secrezione di alcuni ormoni, detti adrenocorticoidi, tra cui il cortisolo; il cortisolo poi, oltre ad inibire l ACTH, inibisce direttamente il CRH. Quando un ormone periferico inibisce un ormone ipotalamico si parla di feedback lungo. Per quanto riguarda il controllo da parte di altre aree cerebrali sulla attività secretoria ipotalamica, è importante menzionare il nucleo soprachiasmatico: si tratta di un nucleo ipotalamico, situato superiormente al chiasma ottico, sincronizzato con l alternanza giorno-notte; regola, attraverso gli ormoni ipotalamici, i ritmi pulsatili circadiani con cui alcuni ormoni ipofisari sono rilasciati. Altri ormoni ipofisari, sempre attraverso la mediazione degli ormoni ipotalamici, sono rilasciati secondo ritmi collegati ai cicli di sonno-veglia, e la combinazione di ritmi circadiani e ritmi sonno-veglia è responsabile della ciclicità che si osserva nella secrezione ormonale rmoni dell adenoipofisi Abbiamo quindi visto, in generale, che tipo di ormoni sono secreti dall ipotalamo (prima da parte dei neuroni magnocellulari: ossitocina e vasopressina; poi da parte dei parvocellulari: releasing hormones), e come molti di questi controllino la secrezione adenoipofisaria; adesso andiamo ad esaminare proprio gli ormoni della adenoipofisi.
29 2 rmoni proteici e peptidici 20 Queste molecole, come ormai abbiamo avuto modo di ripetere più volte, vanno ad agire sulle altre ghiandole endocrine del corpo, promuovendo la sintesi di ormoni periferici; a loro volta, questi regolano tramite feedback gli ormoni adenoipofisari che, riassumendo, si adeguano da una parte alla regolazione periferica, dall altra alla regolazione ipotalamica. Sulla base di omologie strutturali e di azione, gli ormoni della adenoipofisi sono classificabili in tre gruppi: Il gruppo degli ormoni glicoproteici, composto da: ormone tireostimolante, TSH; ormone luteinizzante, LH; ormone follicolo-stimolante, FSH; gonadotropina corionica umana, hcg (attenzione: non è un ormone secreto dall adenoipofisi; viene trattato in questa sede per convenienza, dato che ha una importante omologia strutturale con TSH, LH e FSH.); Il gruppo dei peptidi derivati dalla pro-opiomelanocortina (PMC), che comprende una serie di molecole derivate da un unico precursore: ormone adrenocorticotropo, ACTH; β-lipotropine β-endorfine Il gruppo composto da ormone della crescita (GH), prolattina (PRL). Il gruppo degli ormoni glicoproteici Fanno parte del gruppo degli ormoni glicoproteici l ormone tireostimolante (TSH), l ormone luteinizzante (LH), l ormone follicolo-stimolante (FSH). Nonostante non sia sintetizzato né secreto dall adenoipofisi, bensì dalla placenta, tratteremo la gonadotropina umana corionica (hcg) insieme a questi ormoni, poiché ne condivide struttura e modalità d azione. Struttura Gli ormoni glicoproteici sono quelli più grandi e complessi: sono glicoproteine eterodimeriche, costituite da: una subunità α (92 a.a.), N-glicosilata a livello di due residui di asparagina. È identica per TSH, LH, FSH e hcg ed è molto conservata tra specie diverse;
30 2 rmoni proteici e peptidici 21 una subunità β, che conferisce l azione biologica e che può essere glicosilata. È la subunità che differenza tra di loro gli ormoni glicoproteici e che conferisce la specificità di azione. Entrambe le subunità sono necessarie perché l ormone sia attivo, ed il pentapeptide C-terminale della subunità α sembra essenziale per il legame al recettore. In definitiva, gli ormoni che fanno parte di questo gruppo sono caratterizzati da una grande omologia strutturale; la probabile causa è l origine dei loro geni da un unico gene ancestrale comune. Si pensa che un gene iniziale codificasse per la subunità α; sarebbe poi andato incontro a duplicazione genica, producendo il gene per la subunità β, che avrebbe dato origine alla diversità tra le subunità per un fenomeno di divergenza genica. Questi ormoni hanno un peso molecolare di circa 30 kda. Sede di sintesi Mentre l espressione del gene per la subunità α è comune ai diversi citotipi che sintetizzano gli ormoni glicoproteici (le due popolazioni ipofisarie di cellule gonadotrope e tireotrope e le cellule placentari), l espressione del gene per la subunità β è specifica del citotipo che produce l ormone corrispondente, mentre i geni per le subunità degli altri ormoni non sono normalmente espressi. le cellule tireotrope dell ipofisi esprimono il gene per la specifica subunità β del TSH; le cellule gonadotrope dell ipofisi esprimono il gene per la subunità β di FSH ed LH; le cellule trofoblastiche della placenta durante la gravidanza esprimono il gene per la subunità β della hcg [16]. 2 Biosintesi Le subunità α e β sono tradotte da mrna separati. Si ritiene che la sintesi delle due subunità sia regolata in maniera indipendente, e, poiché sono state trovate libere nel citoplasma soltanto subunità α, sembra probabile che la disponibilità di subunità β sia limitante per la produzione dell ormone completo. Le subunità sono tradotte come pro-pre-ormoni, che poi vanno incontro a diverse modifiche post-traduzionali: proteolisi limitata per rimuovere il peptide segnale; glicosilazione a livello dei residui di asparagina; 2 Anche alcuni tumori esprimono hcg.
31 2 rmoni proteici e peptidici 22 formazione di ponti disolfuro tra residui di cisteine. Vi sono cinque ponti disolfuro nella subunità α e sei nella subunità β. Non ci sono ponti disolfuro intermolecolari, solo intramolecolari: le subunità sono associate non covalentemente! Secrezione e regolazione La regolazione del rilascio, nonché della biosintesi, è effettuata dai releasing hormones ipotalamici corrispondenti e dagli ormoni periferici: il TRH (ormone di rilascio della tireotropina) ipotalamico regola il TSH (ormone tireostimolante o tireotropina) ipofisario. Anche gli ormoni tiroidei regolano il TSH con un feedback negativo; il GnRH (ormone di rilascio delle gonadotropine) ipotalamico regola LH ed FSH ipofisari. FSH ed LH sono coinvolti a loro volta, insieme a GnRH, agli ormoni sessuali, e ad altre molecole regolatorie, in uno dei loop di feedback più complessi del corpo umano. Maggiori informazioni su questo aspetto saranno fornite nel Capitolo 6. la regolazione della hcg non è chiara: sono state individuate numerose molecole con azione paracrina in grado di regolare la sintesi dell ormone, e sembra sia coinvolta anche una regolazione autocrina; alcuni studiosi hanno invece ipotizzato una regolazione da parte del GnRH, mentre altri hanno provato a correlarne la secrezione allo stadio di sviluppo della placenta. Ricordiamo che TRH e GnRH agiscono, rispettivamente sulle cellule tireotrope e gonadotrope, tramite il pathway della fosfolipasi C-IP 3 -Ca 2+, a differenza degli altri releasing hormones, che sfruttano l adenilato ciclasi. Trasporto nel plasma e degradazione Questi ormoni vengono secreti nel sistema portale ipofisario, dove circolano prevalentemente in forma non legata. Da lì passano alla circolazione sistemica. Una volta legati al recettore vengono probabilmente internalizzati e degradati. Recettori La trasduzione del segnale di TSH, FSH, LH e hcg è mediata da recettori accoppiati a proteine G. In tutti i casi, viene attivata la adenilato ciclasi tramite la subunità G αs. Il secondo messaggero è quindi camp, che vede aumentare la propria concentrazione. Effetti fisiologici degli ormoni del gruppo delle glicoproteine
32 2 rmoni proteici e peptidici 23 TSH Il TSH ha come azione generica quella di stimolare la secrezione degli ormoni elaborati dalle cellule della tiroide. Si ritiene che agisca sui tireociti con effetti a breve e lungo termine: Effetti a breve termine: Stimola la biosintesi e la secrezione degli ormoni tiroidei a diversi livelli: 1. aumenta l attività di una pompa che promuove l ingresso all interno delle cellule dello ione iuduro, che è essenziale per la biosintesi degli ormoni; 2. promuove l incorporazione dello iodio all interno della molecola che ha il ruolo di preormone; 3. stimola il processamento di tale preormone per ottenere l ormone maturo. Tutti questi effetti saranno più chiari dopo lo studio degli ormoni tiroidei (sezione 3.3 a pagina 102) Effetti a lungo termine: aumenta il flusso ematico che giunge alla tiroide, modula l espressione genica nelle cellule e ne promuove il trofismo (sia in termini di aumento di dimensioni, sia aumento di numero). FSH ed LH FSH ed LH sono prodotte dalle cellule gonadotrope dell ipofisi anteriore, che sono il citotipo più rappresentato. Molte di queste cellule sintetizzano entrambe le molecole, mentre sono poche a sintetizzare uno soltanto dei due. Le cellule bersaglio delle gonadotropine LH ed FSH si trovano a livello dell apparato riproduttore: cellule follicolari dell ovaio (cioè, le cellule della teca e della granulosa), cellule del Sertoli e cellule del Leydig nel testicolo. FSH ed LH sono essenziali per la riproduzione: Stimolano la gametogenesi (soprattutto FSH): spermatogenesi e follicologenesi; Nella donna, regolano l ovulazione; durante le varie fasi del ciclo si osserva uno schema di secrezione pulsatile molto complesso, in cui la secrezione di un ormone prevale sull altro a seconda del momento fisiologico; Regolano la sintesi degli ormoni sessuali, che fanno parte degli ormoni steroidei (vedi sezione 6.3 a pagina 155). Il colesterolo è utilizzato come precursore per la biosintesi di questi ormoni: FSH ed LH promuovono la maggior parte delle reazioni della biosintesi del colesterolo (che portano, nel complesso, alla condensazione dell acetato in squalene), e la reazione di commissionamento del colesterolo alla biosintesi degli ormoni steroidei, che come vedremo è la conversione del colesterolo in un composto chiamato pregnenolone. Il pregnenolone viene poi utilizzato per sintetizzare tutti gli altri ormoni steroidei, compresi gli ormoni sessuali, sia androgeni che estrogeni (es. progesterone, testosterone, etc.).
33 2 rmoni proteici e peptidici 24 N Pre-PMC 267 a.a. C Figura 2.7: Rappresentazione schematica del PMC completo del peptide segnale, per un totale di 267 aminoacidi. Le linee tratteggiate rappresentano i principali siti di taglio. hcg La hcg è sintetizzata negli stadi precoci della gravidanza dalle cellule del sinciziotrofoblasto, che con il procedere della gestazione diventerà placenta. È molto simile all LH, e, poiché i suoi livelli nelle urine e nel sangue aumentano immediatamente dopo l impianto dell embrione, è alla base dei comuni test di gravidanza. Si ritiene che il suo ruolo sia quello di avvertire il sistema materno della presenza dell embrione, in modo da salvare il corpo luteo ed evitare la mestruazione. Dopo il terzo mese di gestazione, i suoi livelli decrescono. È ritenuto responsabile della nausea e del vomito mattutino che interessano comunemente le donne durante la prima fase della gravidanza, ma le prove a sostegno di questa ipotesi non sono conclusive [22, 8]. Il gruppo degli ormoni derivati dalla pro-opiomelanocortina (PMC) Il gruppo dei peptidi derivati dalla pro-opiomelanocortina (PMC) comprende diversi ormoni e neuroormoni, tutti derivati dallo stesso precursore, la PMC. Questo peptide viene tagliato in maniera differente a seconda del tessuto, con produzione di queste molecole segnale: ACTH; lipotropine; melanotropine; endorfine. Collettivamente, queste molecole sono note con il nome di melanocortine. Sede di elaborazione Vedi il paragrafo successivo Biosintesi. Biosintesi Il gene della PMC viene trascritto nel nucleo, quindi trasferito nel citoplasma, dove inizia la traduzione. Il peptide continua la traduzione nel lume del reticolo endoplasmatico come pre-pmc (267 aminoacidi, vedi fig. 2.7). Qui, prima ancora della fine della traduzione, il peptide segnale viene rimosso (-26 aminoacidi), e viene quindi prodotta proopiomelanocortina, di 241 aminoacidi. Questo polipeptide
34 2 rmoni proteici e peptidici 25 andrà incontro a numerose modifiche post-traduzionali: alcune sono modifiche a livello di singoli aminoacidi, ma quelle più evidenti consistono in estesi tagli proteolitici, che frammentano la PMC in una serie di molecole segnale in modo tessuto-specifico (Fig. 2.8). Vi sono 8 potenziali siti di taglio all interno della sequenza della PMC, che possono divenire substrato di specifiche endopeptidasi a serina (simili alla tripsina), le proormone convertasi. I siti di taglio sono costituiti da coppie di aminoacidi basici (Lys-Arg, Arg-Lys, Arg-Arg, Lys-Lys). A seconda di quali peptidasi vengono espresse in un tessuto dove è stata tradotta la PMC, e quindi in base a quali siti di taglio sono sfruttati, si possono avere frammenti diversi. Inoltre, i peptidi ottenuti sono ulteriormente processati con numerose modifiche spesso a carico di aminoacidi (molto frequente è l acetilazione). Nelle cellule corticotrope dell adenoipofisi vengono prodotti soprattutto ACTH (ormone adrenocorticotropo) e β-lipotropina il tutto sotto il controllo del CRH ipotalamico. Viene prima effettuato un primo taglio sul PMC con il quale si produce la β-lipotropina, poi con un secondo taglio viene rilasciato l ACTH. Talora, la β- lipotropina può venire ulteriormente tagliata in queste cellule, ma dà origine a prodotti che sono rilasciati in quantità trascurabili. Nelle cellule melanotrope della pars intermedia dell ipofisi e in altri tessuti periferici dove viene espresso il gene del PMC (intestino, placenta, organi riproduttivi maschili, melanociti dell epidermide, alcune cellule del sistema nervoso in particolare a livello ipotalamico) sia ACTH che β-lipotropina sono ulteriormente frammentate con un terzo e un quarto taglio: l ACTH viene spezzato in α-msh (ormone melanotropo α) e CLIP (peptide della pars intermedia corticotropino-simile); la β-lipotropina in γ-lipotropina e β-endorfina. La γ-lipotropina, se ulteriormente frammentata, dà origine a β-msh - questo avviene nei tessuti diversi dall ipofisi. Anche la β-endorfina può poi andare incontro ad ulteriori tagli proteolitici che la trasformano in altre endorfine. In alcune cellule nervose, anche la parte N-terminale del PMC viene processata, con rilascio di γ-msh. Secrezione e regolazione La sintesi e il rilascio di questi ormoni sono regolati dal CRH ipotalamico, che agisce legandosi ad un recettore, chiamato CRH-1, accoppiato ad una proteina G, con attivazione dell adenilato ciclasi e quindi del pathway camp, come avviene per molti degli ormoni ipofisiotropi. CHR-1 è espresso nelle cellule dell encefalo, dell ipofisi, della cute. Esiste anche un recettore CHR-2, espresso in molti altri tessuti, ma il suo ruolo non è chiaro.
35 2 rmoni proteici e peptidici 26 Pre-PMC 267 a.a. PMC 241 a.a. γ-msh (a.a ) ACTH (a.a ) β-lipotropina (a.a ) α-msh (a.a ) CLIP (a.a ) γ-lipotropina (a.a ) β-endorfina (a.a ) β-msh (a.a ) γ-endorfina (a.a ) α-endorfina (a.a ) Figura 2.8: Rappresentazione schematica delle modalità di elaborazione del PMC. Sono indicati i principali peptidi che originano dalla frammentazione della molecola
36 2 rmoni proteici e peptidici 27 Trasporto nel plasma e degradazione La molecola meglio studiata in merito al suo destino nel plasma è l ACTH, che, essendo secreto in maniera episodica ed avendo una emivita di alcuni minuti, risulta avere livelli plasmatici molto variabili. Viene degradato da diverse aminopeptidasi plasmatiche [31]. Recettori ed effetti fisiologici Le melanocortine esercitano la loro azione ormonale principalmente tramite il gruppo dei recettori delle melanocortine MCR, di cui si conoscono 5 membri. Sono tutti recettori accoppiati a proteine G (quindi con 7 dominî transmembrana): MCR-1: vi si lega MSH; è espresso a livello della cute; MCR-2: è il recettore a cui si lega l ACTH, è espresso a livello della corteccia surrenale ed è coinvolto nella regolazione della biosintesi degli ormoni steroidei; MCR-3: il suo ruolo biologico non è chiaro; MCR-4: espresso a livello dell encefalo, ed è coinvolto nella regolazione dell appetito; MCR-5: è coinvolto nella termoregolazione; Le lipotropine esplicano attività biologica su diversi di tessuti, ma i loro effetti non sono del tutto chiari. Sono state così chiamate quando è stato notato che nel coniglio provocano lipolisi e mobilizzazione degli acidi grassi, ma nell uomo apparentemente hanno altri effetti, e quello della lipolisi sembra essere trascurabile. Per quanto riguarda gli ormoni melanotropi (MSH, Melanocyte Stimulating Hormone), come abbiamo visto le forme conosciute sono tre: α-, β-, γ-. Sono prodotte, soprattutto la α-msh (che è la più abbondante e la più importante), dalla pars intermedia dell ipofisi. Per quanto riguarda la β-msh, si hanno evidenze di una sua produzione durante la vita fetale, ma non è chiaro se venga prodotta nella vita postnatale dell uomo. La loro funzione è quella stimolare la biosintesi e la secrezione di melanina da parte dei melanociti a livello della cute in poche parole, sono responsabili della pigmentazione cutanea. L MSH sembra non essere unicamente un ormone endocrino, ma pare che abbia anche un azione paracrina: alcuni studi suggeriscono che venga sintetizzato anche dai melanociti, con azione locale. Le endorfine invece sono ormoni molto noti anche al di fuori dell ambiente scientifico, soprattutto per il loro coinvolgimento nella sensazione del dolore. La β-endorfina, che è la principale e la più importante, è prodotta dal taglio proteolitico della β- lipotropina questo avviene soprattutto (ma non solo) a livello della pars intermedia dell ipofisi. La β-endorfina viene poi rapidamente acetilata, una modifica post-
37 2 rmoni proteici e peptidici 28 traduzionale che si pensa la inattivi, e messa in circolo. In diverse regioni del sistema nervoso (centrale e periferico) viene poi deacetilata, oppure sintetizzata in loco e secreta direttamente non acetilata, e sembra utilizzata come neurotrasmettitore o neuro modulatore. Inoltre, la β-endorfina può andare incontro a tagli ulteriori a livello della regione C-terminale per dare origine a γ- e α-endorfina. Le endorfine sono dei cosiddetti oppioidi endogeni, ovvero molecole sintetizzate dal nostro stesso organismo che sono in grado, legandosi a specifici recettori, di evocare risposte fisiologiche che mediano l analgesia e altre risposte che hanno a che fare con il comportamento, come la modulazione dell euforia o delle dipendenze. I recettori oppioidi sono accoppiati a proteine G. Correlazioni cliniche: I recettori oppioidi Si legano agli stessi recettori delle endorfine anche i potenti analgesici oppioidi, di cui l esponente più noto è la morfina. L eroina (o diamorfina) è un altra sostanza oppiode molto nota come stupefacente. Sintetizzata nella seconda metà dell 800, paradossalmente all inizio venne pubblicizzata dalla casa farmaceutica produttrice come un farmaco alternativo alla morfina che non induceva dipendenza (addiction). I principali recettori degli oppiodi sono tre: κ, δ e μ (ne esiste anche un quarto, ma non ne parleremo). Questi recettori influenzano la conduttanza di alcuni ioni: δ e μ: mediano la risposta fisiologica agli oppioidi attivando la subunità G i. Il pathway porta ad una stimolazione della fosfolipasi C e dei canali del K +. κ: mediano la risposta fisiologica agli oppiodi inibendo direttamente i canali del calcio. In questo modo, condizionano il rilascio di neurotrasmettitori da parte dei neuroni su cui agiscono. L azione del CLIP (Corticotropin-Like Intermediate Lobe Peptide, peptide simile alla corticotropina del lobo intermedio) non è chiara. Per quanto riguarda l ACTH (ormone adrenocorticotropo), la sua azione è meglio caratterizzata, e si esplica soprattutto a livello della ghiandola surrenale, dove stimola la produzione di alcuni ormoni steroidei, come il cortisolo. Viene rilasciato in risposta a condizioni di stress (inteso in senso ampio: stress fisico, come una ferita, o stress psicologico, come una forte emozione). In effetti, il cortisolo è spesso definito l ormone dello stress proprio perché media l adattamento a situazioni di questo tipo.
38 2 rmoni proteici e peptidici 29 La secrezione di ACTH segue un ritmo circadiano, con un picco intorno alle 4-5 del mattino. Gli effetti dell ACTH sono mediati da recettori accoppiati a proteine G; viene stimolata la subunità G αs, che porta ad un aumento di camp con attivazione della PKA. La principale azione biologica dell ACTH consiste nell incrementare la steroidogenesi (sintesi degli ormoni steroidei) soprattutto a livello della zona corticale della ghiandola surrenale, in particolare glucocorticoidi e mineralcorticoidi. Anche l ACTH, come FSH ed LH, promuove la maggior parte delle reazioni della biosintesi del colesterolo (che portano, nel complesso, alla condensazione dell acetato in squalene), nonché la reazione di commissionamento del colesterolo alla biosintesi degli ormoni steroidei, la conversione in pregnenolone. Il cortisolo, il principale glucocorticoide, regola con feedback negativo sia la secrezione di ACTH (a livello ipofisario) che di CRH (a livello ipotalamico). rmone della crescita e prolattina L ormone della crescita (GH) promuove l accrescimento corporeo, mentre la prolattina (PRL) ha attività lattogenica. Si pensa che GH e PRL (insieme ad un altra molecola segnalatoria, la somatomammotropina corionica) siano originati da uno stesso gene ancestrale. Struttura GH e PRL sono ormoni peptidici accomunati da similitudini strutturali: le loro dimensioni sono comparabili (circa 190 aminoacidi). L ormone della crescita è un peptide di 191 aminoacidi e 22 kda di peso molecolare. La prolattina ha un peso molecolare di 23kDa; hanno un singolo residuo di triptofano in posizioni simili (85 per il GH, 91 per PRL); entrambi presentano due legami disolfuro nella stessa posizione; hanno un omologia di sequenza del 35%. Sede di sintesi Il GH è sintetizzato dalle cellule somatotrope, che sono uno dei citotipi più abbondanti nell ipofisi, mentre il PRL dalle cellule lattotrope, che sono meno rappresentate. Biosintesi La biosintesi non presenta aspetti particolari in nessuno dei due casi.
39 2 rmoni proteici e peptidici 30 La sintesi e la secrezione del GH sono regolate principal- Secrezione e regolazione mente: positivamente dal GHRH ipotalamico, attraverso la classica attivazione della adenilato ciclasi, incremento del camp, attivazione della PKA; il pathway risulta nella sintesi di alcuni fattori di trascrizione che regolano positivamente l espressione del gene del GH e del recettore per il GHRH; negativamente dalla somatostatina, sintetizzata dall ipotalamo e altre aree cerebrali, nonché a livello periferico (es. dal pancreas endocrino); esplica la regolazione attraverso recettori accoppiati a proteina G, e stimolando la subunità inibitoria, che inibisce l adenilato ciclasi; il pathway risulta in una diminuzione della concentrazione di camp. attraverso feedback negativo, dall Insulin-like Growth Factor 1 (IGF-1), che è una molecola che media l azione del GH a livello periferico; Da una varietà di altre molecole segnale (peptidi ipotalamici, ormoni, neurotrasmettitori), che esplicano la loro azione intervenendo sulla secrezione di GHRH o di somatostatina, oppure modulando la sensibilità delle cellule somatotrope a questi due regolatori. Da notare che anche il glucosio, in questo caso, si comporta come un ormone: l ipoglicemia stimola la secrezione di GH, l iperglicemia la inibisce. Anche alcuni aminoacidi (arginina in particolare) sono in grado di aumentare la secrezione di GH. Segnaliamo infine la regolazione positiva da parte della grelina, ormone secreto dallo stomaco. La sintesi e la secrezione della PRL sono regolate in maniera piuttosto complessa. La secrezione è influenzata da molti tipi di stimoli, alcuni interni e altri esterni. Esiste una regolazione negativa costitutiva da parte della dopamina, secreta dall ipotalamo questa agisce tramite recettori dopaminergici accoppiati a proteine G inibitorie, che sopprimono l attività della adenilato ciclasi; La prolattina inibisce la propria secrezione stimolando il rilascio di dopamina ipotalamica, il che è un meccanismo di tipo feedback negativo; promuove la secrezione di PRL lo stimolo della suzione del capezzolo materno, tramite un riflesso neuroendocrino che riduce la secrezione di dopamina a livello ipotalamico; anche ossitocina e vasopressina contribuiscono alla mediazione di questo effetto; Promuovono la secrezione di PRL il sistema serotininergico e altri ormoni circolanti;
40 2 rmoni proteici e peptidici 31 Quindi, lo stato normale della secrezione di prolattina è l inibizione tramite la dopamina; quando giunge lo stimolo della suzione, la secrezione di dopamina decresce, e la prolattina entra in circolo da una parte, mediando i propri effetti fisiologici, dall altra ritornando a incrementare la secrezione di dopamina ed esercitando così un feedback negativo sulla propria secrezione. Trasporto nel plasma e degradazione L emivita del GH è di minuti. Circa il 50% del GH è legato a specifiche GH Binding Proteins (GHBP), che ne limitano le oscillazioni nella concentrazione plasmatica agendo da buffer e ne prolungano l emivita. La PRL permane nel plasma per un tempo maggiore, con una emivita di minuti. Sono degradati a livello di fegato e rene. Recettori I recettori del GH appartengono alla superfamiglia dei recettori delle citochine di classe 1 (noti anche come recettori dell ematopoietina). Mediano risposte intracellulari tramite l attivazione di protein chinasi. Il GH, legandosi ad un recettore, provoca un cambiamento conformazionale che ne innesca la dimerizzazione con un altro. La dimerizzazione attiva una delle cosiddette Janus chinasi (JAK-2), particolari chinasi che fosforilano su residui di tirosina sia il recettore che loro stesse. Il recettore fosforilato innesca una serie di pathway di trasduzione del segnale, utilizzati anche da altri recettori: 1. reclutando proteine STAT (Signal Transducers and Activator of Transcription) e facilitando la loro fosforilazione da parte di JAK. La fosforilazione attiva le proteine STAT, che dimerizzano tra loro, per poi entrare nel nucleo, dove agiscono come fattori di trascrizione, modulando l espressione genica della cellula bersaglio (Fig. 2.9); 2. il pathway delle MAP chinasi (che coinvolge le proteine adattatrici Shc/Grb2); 3. fosforilazione della proteina IRS-1 (substrato del recettore dell insulina) che attiva la fosfainositide 3-chinasi (il nome è dovuto al fatto che questo pathway è utilizzato anche dall insulina); 4. Pathway della fosfolipasi C-DAG-PKC. Questi recettori si trovano per esempio a livello degli adipociti. I recettori della PRL sono anche in questo caso recettori della superfamiglia dei recettori delle citochine di classe 1, espressi in ovaie, ghiandole mammarie e alcune aree cerebrali. In seguito al legame, i recettori dimerizzano, e mediano una trasduzione intracellulare del segnale analoga a quella vista per l ormone della crescita (JAK-STAT).
41 2 rmoni proteici e peptidici 32 GH 1 2 Recettore JAK P P Stat 3 4 P P P P P P Nucleo Figura 2.9: 1. Recettore in assenza di GH. 2. Il recettore dimerizza, JAK si attiva e lo fosforila. 3. La fosforilazione permette il reclutamento delle STAT protein, che giungono a portata delle JAK, e vengono fosforilate. 4. Le STAT fosforilate dimerizzano e migrano nel nucleo. Effetti fisiologici Il GH esplica la sua azione: direttamente, legandosi ai propri recettori sulle cellule bersaglio. indirettamente, stimolando in alcuni citotipi la sintesi e la secrezione di due fattori di crescita, Insulin-like Growth Factor-1 e 2 (IGF-1 e IGF-2) o somatomedine. Si tratta di peptidi di circa 7,5 kda simili, come dice il nome, all insulina. Tuttavia, gli IGF mantengono una porzione della catena polipeptidica, chiamata peptide C, che nell insulina viene tagliata proteoliticamente. Mediano molti degli effetti anabolici e mitogenici del GH. Sono sintetizzati in seguito a stimolazione del GH soprattutto nel fegato, da dove vengono rilasciati nel sangue, agendo quindi con modalità endocrina. Circolano in forma libera solo in piccola parte, mentre la quota maggiore si trova legata a proteine di trasporto (dette IGFBP, IGF Binding Proteins, a loro volta sintetizzate nel fegato), in particolare alla isoforma IGBF-3. Le IGF sono prodotte anche da altri citotipi, ma con valenza paracrina ed autocrina. In questo caso non entrano in circolo, ma agiscono localmente, sulle cellule circostanti: un esempio è dato dai condrociti. A livello delle cartilagini metafisarie, queste cellule secernono IGF-1, che agisce localmente promuovendone l espansione clonale, in sinergia con il GH, così da stimolare la crescita in lunghezza delle ossa. Anche gli osteoblasti sintetizzano IGF, con funzione simile. La regolazione della biosintesi di questi peptidi è affidata, come si è detto, al GH ed in parte agli ormoni steroidei. Le proteine di trasporto
42 2 rmoni proteici e peptidici 33 IGFBP sono importanti per quanto riguarda la regolazione a livello periferico: in molti casi, oltre a prolungarne l emivita, modulano la biodisponibilità di questi fattori; inoltre, permettono un trasporto tessuto-specifico. La regolazione della biodisponibilità tramite le proteine di trasporto è mediata dall intervento di specifiche proteasi, che sono in grado di tagliare le IGFBP in modo da ridurne l affinità con gli IGF, innescandone il rilascio. Per quanto riguarda l azione biologica, sembra che quasi tutti i tessuti siano potenzialmente in grado di divenire bersaglio degli IGF. Gli IGF-1 e 2 si legano ai rispettivi recettori, delle tirosin chinasi di membrana eterotetrameriche che si autofosforilano in seguito al legame con il recettore. Attivano quindi un esteso pathway di trasduzione intracellulare del segnale, che inizia con la fosforilazione della proteina IRS-1 (substrato del recettore dell insulina, Insulin Receptor Substrate) con attivazione della fosfatidilinositolo-3-chinasi (PI3K), Grb2 etc, e termina con l attivazione di numerose chinasi (Raf, MAPK...). IGF-1 è in grado inoltre di legarsi ai recettori dell insulina. Gli IGF hanno molti effetti: stimolano la sintesi di DNA, RNA e proteine; modulano la crescita, la proliferazione cellulare, la differenziazione e l apoptosi; stimolano la condrogenesi e l osteogenesi (sono molto importanti per l accrescimento lineare delle ossa lunghe); inibiscono la degradazione proteica a livello muscolare e del collagene; stimolano l assunzione del glucosio nelle cellule. La maggior parte di questi effetti sono stati dimostrati per IGF-1; nonostante i livelli di IGF-2 nel plasma siamo molto maggiori, il suo ruolo non è stato definito chiaramente, ma sembra che sia solo parzialmente correlato al GH. Possiamo così riassumere gli effetti (diretti e indiretti) del GH: a partire dai due anni di età (e in particolare durante la pubertà) assume un ruolo critico per il normale sviluppo dell individuo: stimola la crescita corporea nella fase postnatale della vita, soprattutto nell infanzia e nella pubertà. Durante il periodo prenatale non ha grande importanza; influenza il metabolismo glicidico, lipidico e proteico; Ha effetti sul sistema immunitario e sul sistema nervoso. È importante sottolineare ancora una volta che molti degli effetti anabolici e somatotropici attribuiti al GH sono in realtà dovuti agli IGF, di cui il GH stimola la sintesi. Tuttavia, è vero che in genere l ormone della crescita coopera con l azione delle IGF. Vediamo più in dettaglio le principali azioni del GH.
43 2 rmoni proteici e peptidici 34 ssa e cartilagini Stimola la condrogenesi, promuovendo quindi l aumento in lunghezza delle ossa lunghe durante la pubertà, e l osteogenesi, regolando il turnover osseo; raggiunge questi effetti sia stimolando direttamente la proliferazione e la differenziazione delle cellule secernenti matrice cartilaginea ed ossea, ma soprattutto indirettamente, grazie alla mediazione degli IGF. Effetti sul metabolismo il GH modula il metabolismo glicidico, lipidico e proteico, in alcuni casi direttamente, in altri attraverso la mediazione degli IGF, in altri casi ancora sia direttamente che indirettamente. 1. Carboidrati: ha effetti anti-insulinici, e determina un incremento della glicemia inducendo gluconeogenesi nel fegato e glicogenolisi; interferisce con l azione dell insulina, riducendo l utilizzo periferico del glucosio ma induce iperinsulinemia Lipidi: stimola la lipolisi negli adipociti, inibisce l accumulo di trigliceridi e l enzima lipoproteinlipasi, incrementando quindi gli acidi grassi liberi circolanti; promuove l ossidazione degli acidi grassi, soprattutto nel fegato; 3. Proteine: stimola l uptake degli aminoacidi e la sintesi proteica, inibisce la degradazione proteica e l ossidazione degli aminoacidi, soprattutto a livello di tessuto muscolare scheletrico. Equilibrio idroelettrolitico Il GH promuove la ritenzione idrica e il riassorbimento di diversi ioni (calcio, magnesio, fosfato, potassio, sodio cloro), influenzando in questo modo anche il metabolismo dei minerali. Effetti sul sistema immunitario e sul sistema nervoso modula molte delle funzioni del sistema immunitario (produzione di anticorpi, attività delle cellule, etc) e a livello dell SNC modula l umore e il comportamento; Inoltre, il GH presenta anche una limitata attività lattogenica, in analogia alla prolattina. La prolattina nella donna promuove la sintesi e la secrezione del latte a livello della ghiandola mammaria. La sua secrezione aumenta molto durante la gravidanza, in risposta agli alti livelli di estrogeni. Non si conosce invece quale sia il ruolo della prolattina nell uomo. 3 Almeno, in seguito a somministrazione esogena. È possibile che il significato biologico di questa azione sia da inquadrare come una sorta di effetto feedback negativo: forse questa azione è stata selezionata nel corso dell evoluzione perché impedisce oscillazioni troppo brusche della glicemia.
44 2 rmoni proteici e peptidici 35 La PRL: Stimola la crescita e lo sviluppo della ghiandola mammaria, soprattutto a livello degli acini ghiandolari; Induce la sintesi del latte e la sua secrezione. Per espletare questa funzione, promuove l uptake di glucosio e aminoacidi, oltre che l espressione e la produzione di proteine del latte come lattoalbumina e caseina; stimola inoltre la biosintesi di lattosio e acidi grassi nelle cellule bersaglio; Mantiene il corpo luteo durante la gravidanza questo avviene sicuramente in alcune specie di mammiferi, e probabilmente anche nell uomo; inoltre, la prolattina esplica altre regolazioni nell ambito della riproduzione e della gravidanza, come la modulazione della sintesi di progesterone e GnRH. Almeno negli animali, influenza alcuni aspetti della vita sessuale e sociale, come l istinto materno; ci sono opinioni discordi riguardo l esistenza di un effetto simile sull uomo. È ormai accertato il ruolo della prolattina come mediatore endocrino, paracrino ed autocrino nelle risposte immunitarie e nell infiammazione. Correlazioni cliniche: Nanismo e gigantismo Nanismo è un termine usato per indicare tutte quelle condizioni in cui l accrescimento somatico è patologicamente ridotto; gli individui affetti risultano di statura molto inferiore alla norma. Si distingue il nanismo armonico, in cui pur essendo la statura ridotta sono mantenute le normali proporzioni del corpo, dal nanismo disarmonico, in cui una o più parti corporee sono sproporzionate. La deficienza di GH è una possibile causa di nanismo (cosiddetto nanismo ipofisario) quando insorge prima del termine dell accrescimento; quindi in caso di deficit di GH insorto nell età adulta, essendo l accrescimento ormai terminato, non si ha nanismo. Sono note cause congenite di deficit di GH (per lo più su base genetica), e cause acquisite (tra cui tumori, traumi, e radioterapia a livello encefalico). Non raramente, non si riesce a determinare la causa della disfunzione (deficit idiopatico). Il gigantismo è una condizione di esagerato accrescimento somatico, da cui risulta una statura molto superiore alla norma, che può superare i 2,50 m.
45 2 rmoni proteici e peptidici 36 Il gigantismo è di solito dovuto ad una abnorme secrezione di GH durante il periodo della crescita (cioè prima della fusione delle cartilagini di accrescimento). Un eccessiva secrezione di GH nell adulto dà invece origine al quadro dell acromegalia. In quest ultima condizione, c è accrescimento osseo (specie a carico di alcuni distretti, come il cranio) ma non aumento di statura. Si verificano anche un aumento di volume dei tessuti molli (labbra, mani, piedi, lingua), visceromegalia (aumento di volume di alcuni organi come fegato e tiroide), cardiomegalia ed alterazioni metaboliche (soprattutto del metabolismo del glucosio, fino al diabete). I tratti del volto divengono grossolani, e con il tempo i pazienti assumono una facies particolare (facies acromegalica). Acromegalia e gigantismo sono praticamente sempre conseguenti ad adenomi ipofisari che secernono GH in maniera incontrollata. Vediamo adesso in generale e in modo schematico i principali esempi di asse ipotalamo-ipofisi-ormone periferico. Non c è bisogno di imparare adesso questi schemi, perché la regolazione sarà trattata per ciascun ormone. L importante è capire il quadro generale. Sarà più utile ritornare su questi schemi una volta studiati gli ormoni periferici relativi. L asse ipotalamo-ipofisi-tiroide Gli ormoni tiroidei e la loro regolazione sono trattati in maggiore dettaglio alla sezione 3.3 (pag. 101). Qui viene illustrato a grandi linee l asse ormone ipotalamico-ormone ipofisario-ormone periferico per quanto riguarda la tiroide (Fig. 2.10, pag. 37). L asse ipotalamo-ipofisi-tiroide è così strutturato [39]: TRH è il releasing hormone ipotalamico, che stimola il rilascio di TSH da parte della ipofisi; il TSH ipofisario stimola il rilascio degli ormoni periferici T 3 e T 4 da parte della tiroide; T 3 rappresenta l ormone tiroideo più attivo. Viene rilasciato dalla tiroide come tale oppure viene ottenuto dal T 4 per conversione ad opera di particolari enzimi
46 - 2 rmoni proteici e peptidici 37 Ipotalamo TRH + TSH Ipofisi + - T 4 T 3 Tiroide (forma libera) (forma libera) T 4 T 3 (forma legata alle proteine plasmatiche) Figura 2.10: In questa figura sono mostrati i rapporti di feedback che caratterizzano l asse ipotalamoipofisi-tiroide.
47 2 rmoni proteici e peptidici 38 (deiodinasi; sono trattati nella sezione dedicata agli ormoni tiroidei). Entrambi gli ormoni possono esistere in forma libera oppure in forma legata a proteine di trasporto. Le due forme sono in equilibrio tra loro, e solo la forma libera è in grado di interagire con i recettori. La forma legata può essere considerata inattiva. T 3 con un loop di feedback inibisce la secrezione sia del TSH che del TRH. L asse ipotalamo-ipofisi-gonadi Gli ormoni sessuali e la loro regolazione sono trattati nel capitolo 6 (pag. 140). Qui viene illustrato a grandi linee l asse ormone ipotalamico-ormone ipofisario-ormone periferico per quanto riguarda le gonadi (Fig. 2.11, pag. 39). L asse ipotalamo-ipofisi-gonadi è diverso nei due sessi. Nel sesso femminile è molto complesso perché entra in gioco il ciclo mestruale. Una trattazione più completa verrà presentata nel capitolo relativo. A grandi linee, l asse è così strutturato: Il GnRH è il releasing hormone ipotalamico, che stimola il rilascio di FSH ed LH da parte della ipofisi. A seconda della fase del ciclo mestruale, può essere favorita la secrezione dell uno o dell altro; FSH ed LH ipofisari stimolano il rilascio da parte dell ovaio di ormoni sessuali (principalmente estrogeni, in particolare estradiolo) e di inibina, una proteina eterodimerica membro della famiglia dei TGF- β; L estradiolo con un loop di feedback inibisce la secrezione di GnRH; non è chiaro se inibisce direttamente anche la secrezione di FSH. Questo cambia durante la fase follicolare (non mostrato in figura), quando l estradiolo con un feedback positivo stimola la secrezione di GnRH e ne modifica il ritmo di secrezione. Questo diverso pattern di secrezione del GnRH favorisce la secrezione di LH, che incrementa sempre di più (per il feedback positivo) fino ad arrivare ad un picco in corrispondenza del quale si verifica l ovulazione. Successivamente, viene prodotto progesterone dal corpo luteo, che modifica il pattern di secrezione del GnRH favorendo nuovamente l FSH. l inibina inibisce la secrezione di FSH (viene secreta soprattutto durante la fase follicolare). Nel sesso maschile il circuito è più semplice. A grandi linee, l asse è così strutturato:
48 rmoni proteici e peptidici 39 Ipotalamo GnRH + LH FSH Ipofisi +? Estrogeni Gonadi femminili Inibina Ipotalamo GnRH + FSH LH Ipofisi + - Inibina Estradiolo Gonadi maschili Testosterone Figura 2.11: In questa figura sono mostrati i rapporti di feedback che caratterizzano l asse ipotalamoipofisi-gonadi.
49 - 2 rmoni proteici e peptidici 40 Ipotalamo CRH + ACTH + - Glucocorticoidi Surrene Figura 2.12: In questa figura sono mostrati i rapporti di feedback che caratterizzano l asse ipotalamoipofisi-surrene. Il GnRH è il releasing hormone ipotalamico, che stimola il rilascio di FSH ed LH da parte della ipofisi; LH ipofisario stimola il rilascio da parte delle cellule di Leydig, che si trovano nel testicolo, di ormoni sessuali (androgeni, principalmente testosterone); l FSH si lega alle cellule del Sertoli e stimola la spermatogenesi 4 e la secrezione di diverse sostanze, tra cui inibina B (la cui secrezione potrebbe non essere esclusiva delle cellule del Sertoli [23]). I testicoli producono anche piccole quantità di estrogeni, che partecipano alla regolazione dell asse (inoltre è possibile che gli androgeni inibiscano l asse non in quanto tali, ma per mezzo di una conversione a estrogeni che avverrebbe localmente, cioè a livello cerebrale). Gli androgeni inibiscono la secrezione di GnRH e di LH, mentre l inibina B inibisce la secrezione di FSH [23]. L asse ipotalamo-ipofisi-surrene Gli ormoni secreti dalla zona corticale della ghiandola surrenale e la loro regolazione sono trattati nel capitolo 6 (pag. 140); la loro regolazione viene presa in esame in 4 la spermatogenesi è anche stimolata dal testosterone prodotto dalle cellule del Leydig.
50 2 rmoni proteici e peptidici 41 modo meno schematico in quel capitolo. Vediamo, sempre a grandi linee, l asse ipotalamo-ipofisi-surrene (Fig. 2.11, pag. 39): CRH è il releasing hormone ipotalamico, che stimola il rilascio di ACTH da parte della ipofisi; l ACTH ipofisario stimola il rilascio di diversi ormoni steroidei da una parte della ghiandola surrenale chiamata corteccia, principalmente glucocorticoidi; I glucocorticoidi (il glucocorticoide per antonomasia è il cortisolo) inibiscono a feedback il rilascio di CRH e ACTH. Abbiamo quindi terminato di vedere gli ormoni dell asse ipotalamo-ipofisi. Passiamo adesso ai restanti ormoni proteici periferici. 2.2 rmoni dell apparato digerente Dove siamo? Pancreas Il pancreas è una ghiandola anficrina (cioè con funzioni sia esocrine che endocrine), di forma allungata, annessa all apparato digerente. È situata nella cavità addominale tra i due reni, posteriormente allo stomaco. Istologicamente e funzionalmente è caratterizzata dalla presenza di diverse popolazioni cellulari. La grande maggioranza è costituita da cellule esocrine, che sintetizzano ormoni proteolitici necessari alla digestione; in mezzo al parenchima esocrino sono presenti aggregati formati da cordoni cellulari di cellule endocrine, che appaiono come isole endocrine in mezzo ad un mare di cellule esocrine: da qui il nome di isole di Langerhans. gni isola è composta da tre tipi fondamentali di cellule: le cellule α, che sintetizzano glucagone, le cellule β, che sintetizzano insulina, e le cellule δ, che secernono somatostatina Insulina Il ruolo dell insulina è rivolto principalmente alla regolazione del metabolismo di carboidrati e lipidi in senso anabolico. Si tratta di un ormone che viene tipicamente (ma non solo) secreto in condizioni di iperglicemia, che possono essere pensate come situazioni di abbondanza di sostanze nutritive e di benessere. Le sue funzioni sono rivolte ad abbassare la concentrazione di glucosio nel sangue per ristabilire la normoglicemia. Questo viene ottenuto stimolando l assunzione del glucosio in alcuni
51 2 rmoni proteici e peptidici 42 Figura 2.13: Struttura tridimensionale dell insulina porcina, che differisce da quella umana per un solo aminoacido (una treonina presente nell insulina umana è sostituita da una alanina nell insulina porcina). La struttura è stata ottenuta dall RCBS Protein Data Bank (id: 4INS) e l immagine realizzata con QuteMol [40]. citotipi (come il muscolo), mentre il metabolismo energetico viene indirizzato verso la sintesi di glicogeno e lipidi, le forme classiche con cui l organismo immagazzina energia per un uso futuro, approfittando della temporanea disponibilità di substrati energetici. Struttura L insulina è un ormone costituito da 2 catene polipeptidiche, chiamate A e B, unite da due ponti disolfuro. La catena A è composta da 21 aminoacidi e presenta un ponte disolfuro intracatena; la catena B è formata da 30 aminoacidi. La figura 2.13 mostra una immagine della struttura tridimensionale dell insulina porcina (molto simile a quella umana). Sede di elaborazione L insulina viene secreta dalle cellule β del pancreas. Biosintesi L insulina viene tradotta dal relativo gene, situato sul cromosoma 11, come pre-pro-insulina; in seguito all ingresso nel lume del RER, si formano i ponti disolfuro; nel passaggio successivo il peptide segnale (una sequenza idrofobica di 23 aminoacidi) viene staccato enzimaticamente, generando proinsulina (figura 2.14, pag. 43). Può essere considerata il peptide precursore vero e proprio (inattivo). A livello di questa catena peptidica si possono già evidenziare le due future catene che andranno a costituire l ormone attivo: la catena A (21 aminoacidi al C-terminale), e la catena B (30 aminoacidi all N-terminale); queste sono unite da un tratto polipeptidico di connessione detto catena C. Quindi, la sequenza del proormone è: ( 2 HN)-B-C-A- (C - ). Nonostante la catena C non sia presente nell ormone attivo, è molto importante
52 2 rmoni proteici e peptidici 43 Peptide C Peptide C SH SH S S Sequenza segnale Peptide A SH SH CH SH SH Peptide B Peptide A S S CH S S Peptide B NH3 NH3 Preproinsulina Proinsulina Peptide C S S Peptide A S S CH S S Peptide B NH3 Insulina e peptide C Figura 2.14: Struttura della preproinsulina, della proinsulina e della insulina. La proinsulina si forma quando dalla preproinsulina si distacca il peptide segnale e si formano i legami disolfuro; l insulina si forma con la rimozione del peptide C. per il corretto ripiegamento del polipeptide: si tratta un requisito indispensabile per la già menzionata formazione dei ponti disolfuro che uniscono le catene A e B 5. La conversione da pro-ormone ad ormone attivo avviene nel reticolo endoplasmatico ad opera di alcune endopeptidasi chiamate proormone convertasi, le quali operano il taglio proteolitico che rilascia il peptide C. L insulina e la catena C sono immagazzinate in vescicole secretorie, che si accumulano nel citoplasma in attesa del segnale che produrrà il rilascio. Il peptide C è presente nelle vescicole in quantità stechiometriche con l insulina, e viene anch esso rilasciato nel sangue; ha un emivita maggiore dell insulina, il che equivale a dire che permane nel sangue per più tempo. Queste caratteristiche consentono di poter utilizzare la determinazione della concentrazione ematica della catena C per stimare 5 Questo è il motivo per cui i primi tentativi di sintetizzare insulina in laboratorio a partire dalle catene A e B non andarono a buon fine.
53 2 rmoni proteici e peptidici 44 l entità della secrezione insulinica in un soggetto. La regolazione del rilascio di insulina avviene grazie a diversi meccanismi. Poiché nelle cellule pancreatiche vi è una grande quantità di insulina già sintetizzata, depositata in attesa di essere rilasciata, il controllo principale è esercitato a livello della secrezione: La secrezione avviene in risposta ad un innalzamento della glicemia, con meccanismi non del tutto chiari. La concentrazione di glucosio nel sangue a digiuno tende ad essere mantenuta intorno ai 90 mg/dl ( mg/dl); l aumento di questo valore scatena il rilascio di insulina. Si ritiene che l aumento della concentrazione plasmatica di glucosio provochi con qualche meccanismo un innalzamento del Ca 2+ intracellulare, che innesca l esocitosi delle vescicole. Il modello che ha ricevuto più consensi è questo: il glucosio, divenuto abbondante, penetra all interno delle cellule β del pancreas grazie al trasportatore GLUT-2, e viene fosforilato dalla glucochinasi. Viene poi commissionato alla glicolisi e al ciclo di Krebs, con incrementata produzione di ATP, che chiude alcuni canali ionici del K + ATP sensibili; la membrana plasmatica si depolarizza, con apertura dei canali del calcio voltaggiodipendenti. Il calcio avvia il pathway della fosfolipasi C, e l IP 3 che si libera attiva canali del calcio presenti sulla membrana del reticolo endoplasmatico. Questo porta ad un ulteriore incremento di calcio, che innesca la secrezione. Anche gli aminoacidi innescano la secrezione di insulina, probabilmente attraverso la generazione di ATP a partire dal loro catabolismo o una depolarizzazione diretta della membrana plasmatica. Altre sostanze che si sono dimostrate in grado di stimolare la secrezione di insulina sono: la acetilcolina (occorre ricordare che è un neurotrasmettitore utilizzato dai nervi del sistema nervoso autonomo), la colecistochinina, il peptide gastrointestinale e il glucagon-like peptide 1 (GLP-1). Le cellule β esprimono recettori per queste molecole, ed i pathway che entrano in gioco sono quelli della fosfolipasi C e della adenilato ciclasi. Nel caso della PLC, analogamente a quanto visto per il glucosio si ha liberazione di Ca 2+. Nel caso della attivazione della adenilato ciclasi, si ha un aumento della concentrazione di camp con attivazione della PKA camp-dipendente; a questo fa seguito una complessa serie di eventi che culmina con la fosforilazione e l attivazione di proteine implicate nell esocitosi. Ad inibire la secrezione di insulina a livello della secrezione provvedono catecolammine e somatostatina. Queste due molecole hanno recettori accoppiati a proteine G e inibiscono l adenilato ciclasi, disattivando il pathway visto poc anzi. Le catecolammine sono ormoni che hanno la funzione di preparare l organismo a situazioni di emergenza ( fight or flight, combatti o fuggi), e come tali una
54 2 rmoni proteici e peptidici 45 parte delle loro funzioni è volta a garantire disponibilità di substrati energetici ai tessuti, per far sì che siano pronti a fronteggiare una intensa attività. Risulta quindi intuitivo che inibiscano l azione dell insulina, che invece sequestra il glucosio nelle cellule. Una parte della regolazione si esplica anche attraverso una modulazione dell espressione genica. Il glucosio aumenta infatti la trascrizione dell mrna della proinsulina, e sembra essere in grado di stabilizzare quello già esistente. Ne risulta che il glucosio regola il rilascio di insulina a due livelli: provoca la secrezione dell insulina già sintetizzata (regolazione immediata, a breve termine), e indirettamente stimola la sua produzione agendo sulla quantità di mrna disponibile (regolazione a lungo termine). Recettore ed effetti fisiologici dell insulina Come abbiamo avuto modo di accennare, l azione dell insulina è complessivamente di tipo anabolico e ipoglicemizzante. Alcuni degli effetti dell ormone sono eclatanti e si verificano a breve termine, con rapide variazioni nel metabolismo; altri si manifestano a lungo termine, con alterazioni della differenziazione e della crescita cellulare. Il recettore insulinico, che media questi potenti effetti, è un recettore ad attività tirosin chinasica (Receptor Tyrosin Kinase, RTK). Appartiene ad una famiglia di recettori molto importanti, coinvolti tra le altre cose nella crescita e nel differenziamento cellulare. 6 È formato da due subunità, ciascuna delle quali è un eterodimero composto da una subunità α e una subunità β; quindi in totale abbiamo due subunità α e due subunità β ( α 2 β 2 ). Il recettore quindi è costituzionalmente in forma dimerica (o meglio tetramerica, dato che ogni subunità è un eterodimero), anche in assenza del suo ligando [30], a differenza del recettore del GH che dimerizza dopo il legame con l ormone. La subunità α è esclusivamente extracellulare, e contiene il dominio con il sito di legame per l insulina. La β è in posizione transmembrana e comprende il dominio intracellulare tipico di questa classe di recettori, dotato di una attività tirosin chinasica intrinseca. Il legame dell insulina porta ad un cambiamento conformazionale che attiva il recettore, e le due subunità β si fosforilano a vicenda sui residui di tirosina che si trovano nel dominio intracitoplasmatico (autofosforilazione), per poi fosforilare le tirosine di altre proteine intracellulari. I residui di tirosina del recettore, ora fosforilati, vengono legati da specifiche proteine che possiedono un dominio SH2: i substrati del recettore insulinico (IRS, Insulin Receptor Substrate). Ad oggi se ne conoscono quattro, chiamati IRS-1, IRS-2, IRS-3, IRS-4. 6 Membri importanti di questo gruppo di recettori sono i recettori per gli IGF (Insulin-Like Growth Factor).
55 2 rmoni proteici e peptidici 46 In seguito all interazione con il recettore, gli IRS sono a loro volta fosforilati a livello delle proprie tirosine. A questo punto, le varie proteine IRS attivano differenti pathway, che amplificano il segnale dell insulina. Le principali vie segnalatorie attivate in questo modo sono la via della fosfoinositide-3 chinasi (PI3K) e delle MAP chinasi (MAPK). La sequenza precisa di eventi è meglio conosciuta nel caso di IRS-1, quindi descriveremo solo questa. La via PI3K è un pathway attivato da molti recettori RTK, implicato nella mediazione di segnali che regolano la sopravvivenza, la longevità, la crescita e la proliferazione della cellula e, nel caso dell insulina, il metabolismo. L enzima chiave da cui prende origine la via è la fosfoinositide-3 chinasi (PI-3K): questo enzima si lega a IRS-1 mediante un dominio SH2, attivandosi. La PI-3K trova il suo substrato tra i fosfolipidi della cellula, in particolare nel fosfatidil-inositolo. L enzima attivato fosforila l anello dell inositolo a livello del terzo carbonio. A seconda del fosfolipide substrato possono essere generati PIP 3 (fosfatidilinositolo-3,4,5-trifosfato), PIP 2 (fosfatidilinositolo-3,4-difosfato) o PIP (fofatidilinositolo-3-p): collettivamente queste molecole sono chiamate fosfoinositidi. È a questi ultimi che è affidato il ruolo di secondi messaggeri, in particolare a PIP 3. Il fosfatidilinositolo trifosfato attiva a propria volta altre tirosin-chinasi e serina/treonina chinasi (tra cui Atk, una importante isoforma PKB), determinando in molti casi la loro traslocazione alla membrana. Gli effetti a valle di queste chinasi in molti casi consistono in attivazione di protein fosfatasi o inattivazione di chinasi. Dato che viene anche attivata la camp fosfodiesterasi (antagonizzando quindi le protein chinasi camp-dipendenti), si conclude che questo ormone tende a portare e mantenere molte proteine cellulari allo stato defosforilato. Questa affermazione non è in contraddizione con quanto abbiamo appena visto: continua a essere vero che l insulina attiva delle chinasi, in particolare PKB, le quali ovviamente per svolgere la loro funzione fosforilano altre proteine; tuttavia, a valle di queste chinasi, l effetto consiste spesso in defosforilazione di proteine importanti. Questo pathway media i principali effetti metabolici dell insulina, ma è anche coinvolto, come si è detto, nella proliferazione, nella crescita e nella sopravvivenza delle cellule. Anomalie in questa via segnalatoria sono state osservate in molti tumori. La via MAPK è una via molto sfruttata dai fattori di crescita e dalle sostanze mitogene: mentre la via PI3K media soprattutto gli effetti metabolici dell insulina, questa via media soprattutto gli effetti sulla proliferazione cellulare. Questa via è il modello tipico della cascata di chinasi che si attivano a vicenda. La via comincia con SS, noto anche come fattore di scambio del nucleotide guanina, che viene attivato da IRS-1 con la mediazione di una proteina adattatrice avente un dominio SH2, Grb2. SS consente ad una proteina Ras (K-Ras, frequentemente) di rilasciare GDP e legarsi a GTP, attivandosi. Ras fosforila e attiva RAF, una Ser/Thr chinasi, che fosforila e attiva
56 2 rmoni proteici e peptidici 47 NH3 S S S S S S CH NH3 NH3 1 S S S S S S 2 S S S S S S CH CH 3 P P RAS GDP GTP P IRS-1 P IRS-1 SS GRB-2 P IRS-1 P P P 4 RAS 5 P IRS-1 P P GTP 6 P PI3-K RAF-1 RAF-1 P IP 3 MEK PKB P IP 3 MEK P PKB MAPK MAPK P Figura 2.15: Principali pathway di trasduzione del segnale innescati dal recettore insulinico. 1) Il recettore si attiva in seguito al legame con l ormone. 2) Il recettore si autofosforila e 3) fosforila IRS-1. 4) IRS-1 attiva principalmente due vie: la via delle MAP chinasi e la via PI3K. 5) La via delle MAPK: con la mediazione di GRB-2, IRS-1 attiva SS, che facilita il rilascio di GDP da parte di Ras, e il legame con GTP. Poi Ras fosforila e attiva Raf, che fosforila e attiva MEK, che fosforila e attiva MAPK - il quale agisce poi a livello nucleare. 6) La via PI3K: La PI3 chinasi converte un fosfolipide di membrana; PIP 3 determina l attivazione di varie chinasi, soprattutto PKB.
57 2 rmoni proteici e peptidici 48 la Ser/Thr chinasi MEK, che fosforila e attiva la chinasi MAPK (Mitogen Activated Protein Kinase). MAPK a sua volta fosforila un grande numero di proteine, che in ultimo influenzano la trascrizione e l espressione genica. Dopo aver brevemente descritto il recettore dell insulina e le vie da esso attivate, esaminiamo quali sono gli effetti di questo ormone sui tessuti bersaglio. Uno degli aspetti più sorprendenti dell insulina è la sua capacità di influenzare in maniera importante il metabolismo pur giocando con l attivazione o l inattivazione di relativamente pochi enzimi chiave. I tessuti su cui l azione dell insulina è più rilevante sono il tessuto muscolare, il tessuto adiposo e il fegato. L azione metabolica dell insulina si concentra su tre fronti: regolazione del metabolismo del glucosio e del glicogeno, regolazione del metabolismo degli acidi grassi, regolazione della sintesi proteica. Metabolismo del glucosio Uno dei primi cambiamenti di cui si rende responsabile l insulina consiste in un abbassamento della glicemia plasmatica: il muscolo, il fegato e il tessuto adiposo sono responsabili di gran parte di questo abbassamento, in quanto, sotto l effetto di questo ormone: incrementano significativamente il proprio uptake del glucosio (solo muscolo e tessuto adiposo, l assunzione di glucosio da parte del fegato è insulinoindipendente!); incrementano il consumo dello zucchero per le proprie esigenze energetiche, indirizzandolo verso la glicolisi; incrementano il consumo dello zucchero indirizzandolo alla sintesi del glicogeno; diminuscono la sintesi di glucosio de novo inibendo la gluconeogenesi; diminuiscono la demolizione del glicogeno. Il glucosio penetra nelle cellule mediante specifici trasportatori denominati GLUT. Se ne conoscono diverse isoforme, la cui espressione può essere o meno tessutospecifica. Il trasportatore GLUT-1 ad esempio è espresso praticamente da tutti i tessuti, ed è responsabile del trasporto basale del glucosio in eritrociti, muscolo scheletrico, tessuto adiposo, etc.; GLUT-2 ha una espressione limitata a pochi tessuti (principalmente epatici) e caratteristiche cinetiche particolari che consentono alle cellule che lo esprimono di avere una concentrazione intracellulare di glucosio che riflette strettamente la concentrazione plasmatica; GLUT-3 è espresso dai neuroni, etc. Il trasportatore che media gli effetti dell insulina sull uptake del glucosio è il GLUT-4, e il meccanismo con il quale viene reclutato è peculiare. In assenza di
58 2 rmoni proteici e peptidici 49 stimolazione insulinica, questo recettore non è esposto sulla superficie della cellula, ma si trova per lo più sequestrato in vescicole intracellulari. In altre parole, è inattivo, in attesa all interno della cellula. In seguito al segnale dell insulina, il recettore viene prontamente trasferito alla membrana mediante esocitosi, dove entra in azione incrementando l uptake di glucosio da parte del muscolo e del tessuto adiposo. È importante ribadire che le cellule epatiche non risentono di questo effetto dell insulina poiché esprimono, come già accennato, il trasportatore GLUT-2. Questo fa sì che le cellule epatiche assumano glucosio in maniera costitutiva. ltre all incremento dell uptake, che in pratica trasferisce il glucosio in eccesso dal sangue alle cellule, l insulina influenza vistosamente il metabolismo del fegato e del tessuto adiposo, attivando tutte le vie metaboliche in grado di ridurre la concentrazione di glucosio libero. È importante tenere presente che una delle funzioni principali dell insulina è quella di sequestrare e immagazzinare il glucosio, rimuovendolo dal sangue. Nel fegato, questo scopo viene raggiunto: 1. attivando la glicolisi; 2. attivando la glicogenosintesi; 3. inibendo la gluconeogenesi; 4. inibendo la glicogenolisi; 5. stimolando la sintesi di alcune proteine. Nel caso di 1 e 2, entrambe le vie consumano glucosio; nel caso di 3 e 4, il prodotto finale, cioè altro glucosio, è indesiderato. Le vie coinvolte nel metabolismo epatico del glucosio possono essere regolate indipendemente in maniera conveniente attraverso un intervento dell insulina sullo stato di fosforilazione degli enzimi regolatorî delle diverse vie metaboliche. Il quadro complessivo è concettualmente ostico, e può generare confusione, ma cercheremo di rendere il più semplice possibile la comprensione di questi meccanismi prendendo in esame i cambiamenti indotti dall insulina da una prospettiva particolare. Ci chiederemo cioè quali sono le modifiche sullo stato di fosforilazione delle proteine necessarie per ottenere determinati effetti; quindi, cercheremo di spiegare in che modo l insulina arriva a determinare i cambiamenti opportuni. Iniziamo prendendo in considerazione i due processi speculari della glicogenolisi e della glicogenosintesi. L enzima chiave della glicogenolisi è la glicogeno fosforilasi; l effetto finale dell attività della glicogenolisi è un aumento della concentrazione del glucosio, in quanto monomeri di glucosio vengono staccati dal polimero più
59 2 rmoni proteici e peptidici 50 ATP Glicogeno fosforilasi chinasi P PKA ADP ATP P Glicogeno fosforilasi chinasi PP1 H 2 ADP Glicogeno fosforilasi (inattiva) Glicogeno fosforilasi (attiva) P Glicogeno (integro) P PP1 H 2 Glicogeno (in degradazione) Figura 2.16: Regolazione della glicogeno fosforilasi. grande. La glicogeno fosforilasi dovrà quindi essere inibita. L enzima chiave della glicogenosintesi è invece la glicogeno sintasi; l effetto finale di questa via metabolica è una diminuzione del glucosio libero, in quanto viene polimerizzato a glicogeno. La glicogeno sintasi dovrà quindi essere attivata. La regolazione di questi due enzimi è complessa. Per questo è necessario soffermarsi e illustrarne la regolazione (Fig. 2.16). Per quanto riguarda la glicogeno fosforilasi, questo enzima esiste in due forme: la forma a, che rappresenta la forma attiva dell enzima, e la forma b, che invece è la forma meno attiva. La conversione da una forma all altra si esplica tramite fosforilazione/defosforilazione. L enzima defosforilato è in forma b (meno attiva); in seguito a fosforilazione assume la forma a (più attiva). La conversione tra le due forme avviene ad opera di due enzimi: la fosforilasi a fosfatasi 1 (PP1) defosforila l enzima, rendendolo meno attivo e di conseguenza diminuendo l attività della glicogenolisi. È un enzima centrale per l azione dell insulina, e lo reincontreremo. La fosforilasi b chinasi fosforila l enzima, rendendolo più attivo e incrementando l attività della glicogenolisi.
60 2 rmoni proteici e peptidici 51 Per completezza dobbiamo sottolineare che la regolazione della glicogeno fosforilasi non si esaurisce qui, poiché entrano in gioco anche dei regolatori allosterici, il cui effetto si integra a quello della regolazione covalente in maniera complessa. Uno dei principali regolatori allosterici in senso attivante per la glicogeno fosforilasi è l AMP, che però ha effetti importanti solo sull enzima non fosforilato (quindi sulla forma b) 7. Viceversa, l ATP è un regolatore allosterico in senso inibitorio, ma solo per la glicogeno fosforilasi attivata (quindi sulla forma a) 8. Tornando alla regolazione che è sotto controllo ormonale (Fig.2.17, pag. 53), l enzima che è attivato dall insulina è ovviamente la PP1, poiché porta ad un decremento della glicogenolisi defosforilando e inattivando la glicogeno fosforilasi. L insulina però non si limita a questo. La fosforilasi b chinasi infatti è a propria volta soggetta a un controllo che in parte si esplica tramite fosforilazione/defosforilazione. Viene fosforilata, e parzialmente attivata, da una PKA camp-dipendente, mentre una fosfatasi la defosforila e la inattiva. Sia per completezza, sia perché queste informazioni saranno importanti quando confronteremo l azione di insulina, glucagone e adrenalina, dobbiamo chiarire meglio come avviene la regolazione di questo enzima. La fosforilasi b chinasi è composta infatti da quattro subunità (dette α, β, γ, δ), che si associano ciascuna in quattro copie: quindi la composizione dell enzima è α4 β4 γ4 δ4. Queste quattro differenti subunità hanno ruoli molto precisi: la subunità γ è responsabile dell attività catalitica, mentre le altre subunità consentono la regolazione di questo enzima. La subunità β viene fosforilata dalla PKA e in seguito a questa modifica viene parzialmente attivata. Da questo si può intuire che gli ormoni che innalzano la concentrazione di camp (come glucagone e adrenalina) attivano questo enzima. La subunità β viene defosforilata da una fosfatasi, che altri non è che la PP1. Questa fosfatasi quindi inattiva per defosforilazione sia la glicogeno fosforilasi chinasi sia la glicogeno fosforilasi stessa. la subunità δ è particolare in quanto ha una struttura molto simile alla calmodulina. In altre parole, questa subunità è in grado di legare il calcio; questo ione esplica una azione regolatoria, attivando parzialmente la fosforilasi chinasi. Quindi, in tutte le situazioni in cui la concentrazione intracellulare di Ca 2+ aumenta (ad esempio durante una contrazione muscolare), la fosforilasi chinasi 7 Poiché un alta concentrazione di AMP nella cellula è sintomo di una penuria energetica, non sorprende che questa molecola attivi un enzima che porta ad una liberazione di glucosio. 8 La situazione è l esatto opposto di quella dell AMP: un alta concentrazione di ATP significa una grande disponibilità energetica, e quindi viene meno la necessità per la cellula di una glicogeno fosforilasi attiva.
61 2 rmoni proteici e peptidici 52 viene parzialmente attivata; questo consente all enzima di fosforilare la glicogeno fosforilasi, attivandola. Perché l enzima sia totalmente attivo è necessaria la compresenza di calcio e fosforilazione; uno solo di questi due regolatori provoca un attivazione solo parziale dell enzima. Prima di proseguire lo studente dovrebbe assicurarsi di aver compreso bene la regolazione della glicogeno fosforilasi chinasi, perché è un enzima su cui ritorneremo. Tornando all insulina (Fig.2.17), la sua azione attiva la fosfatasi che defosforila la glicogeno fosforilasi chinasi (oltre ad accellerare la degradazione di camp, il che ostacola la PKA camp-dipendente), inattivando quindi l enzima, che non può più fosforilare e attivare la glicogeno fosforilasi. Quindi, l insulina neutralizza a due livelli l azione della fosforilasi: in primo luogo stimolando la sua defosforilazione, in secondo luogo impedendo la sua fosforilazione. E importante notare come questa regolazione sia reciproca: abbiamo una attivazione di fosforilasi e una contemporanea inibizione di chinasi. Dopo aver esaminato la regolazione della glicogeno fosforilasi passiamo alla glicogeno sintasi (Fig. 2.18). Anche questo enzima è soggetto ad una regolazione tramite fosforilazione/defosforilazione, ed è attivo nello stato defosforilato. L insulina, evidentemente, dovrà agire in modo tale da promuovere la defosforilazione della glicogeno sintasi. Quindi, considerando glicogeno sintasi e glicogeno fosforilasi, l insulina fa sì che entrambi vengano defosforilati. Tuttavia, la stessa modifica regolatoria ha effetti opposti nei due enzimi: l uno viene attivato, l altra è reso inattivo. In questo modo si ottiene rispettivamente una attivazione della glicogenosintesi ed una inibizione della glicogenolisi. Il quadro della regolazione della glicogeno sintasi è molto complesso (Fig. 2.19). L insulina giunge alla defosforilazione della glicogeno sintasi attivando la fosfoproteina fosfatasi-1, o PP1, che incontriamo per la terza volta. Rivediamo brevemente le funzioni di questo importante enzima: Abbiamo appena visto che catalizza la defosforilazione diretta della glicogeno sintasi; Prima abbiamo esaminato il suo ruolo nella defosforilazione diretta della glicogeno fosforilasi; Infine abbiamo visto che catalizza anche la defosforilazione della glicogeno fosforilasi chinasi, l enzima che, quando è fosforilato e attivo, catalizza la fosforilazione della glicogeno fosforilasi, attivandola. Abbiamo imparato che la PP1
62 + 2 rmoni proteici e peptidici 53 ATP Glicogeno fosforilasi chinasi P Insulina + PKA PP1 Insulina ADP ATP P Glicogeno fosforilasi chinasi H 2 ADP Glicogeno fosforilasi (inattiva) Glicogeno fosforilasi (attiva) P Glicogeno (integro) Glicogeno (in degradazione) P PP1 H 2 + Insulina Figura 2.17: Regolazione della glicogeno fosforilasi quando è presente l insulina. GSK3 diverse chinasi ATP ADP Glicogeno sintasi (attiva) Glicogeno sintasi (inattiva) P Glicogeno (in attiva sintesi) P PP1 H 2 Glicogeno (non in attiva sintesi) Figura 2.18: Regolazione della glicogeno sintasi.
63 2 rmoni proteici e peptidici 54 Insulina + GSK3 diverse chinasi ATP ADP Glicogeno sintasi (attiva) Glicogeno sintasi (inattiva) P Glicogeno (in attiva sintesi) P PP1 H 2 Glicogeno (non in attiva sintesi) + Insulina Figura 2.19: Regolazione della glicogeno sintasi quando è presente l insulina.
64 2 rmoni proteici e peptidici 55 Insulina + - PP1 + - Glicogeno sintasi Glicogeno fosforilasi - - GSK3 PKA + - Glicogeno fosforilasi chinasi + Figura 2.20: Schema riassuntivo della regolazione del glicogeno da parte dell insulina. previene questo defosforilando la glicogeno fosforilasi chinasi e inattivandola, e quindi assicurando che la glicogeno fosforilasi rimanga inattiva. Anche in questo caso, però, l azione dell insulina non si ferma qui. Infatti, l insulina non solo defosforila la glicogeno sintasi, ma inattiva anche uno degli inzimi responsabili della sua fosforilazione. In questo modo previene l inattivazione della glicogeno sintasi abbiamo visto che l ormone fa una cosa simile anche nel caso della glicogeno fosforilasi. Sono state identificate diverse proteine in grado di fosforilare e inattivare la glicogeno sintasi: attualmente se ne conoscono undici, ma è possibile che ne vengano identificate altre. Alcune di queste chinasi sono controllate dai livelli di camp, altre dai livelli di calcio, altre dal diacilglicerolo o fosfolipidi. La principale chinasi regolata dall insulina è la glicogeno sintasi chinasi 3 (GSK3). Abbiamo visto che la via PI3K culminava con l attivazione di diverse chinasi, in particolare PKB. Ed è proprio una PKB che, fosforilando la GSK3, la inattiva. Questo impedisce all enzima di fosforilare la glicogeno sintasi e di inattivarla. Questo è un esempio che illustra molto bene in che senso l insulina promuove lo stato defosforilato delle proteine. Attivando la PKB, l insulina provoca la fosforilazione della glicogeno sintasi chinasi 3; tuttavia, questa fosforilazione è diretta a favorire la defosforilazione della glicogeno sintasi, che è uno degli enzimi-chiave dell azione dell insulina. In fig viene riassunta l azione dell insulina sul metabolismo del glicogeno.
65 2 rmoni proteici e peptidici 56 Esaminiamo ora le due vie speculari della gluconeogenesi e della glicolisi (Fig. 2.21). L enzima chiave della glicolisi è la fosfofruttochinasi-1 (PFK-1). L effetto finale della glicolisi è un abbassamento della concentrazione di glucosio, perché lo zucchero che viene indirizzato in questa via viene ossidato a piruvato. La PFK-1 dovrà quindi essere attivata per incrementare il flusso di metaboliti attraverso la glicolisi. L enzima chiave della gluconeogenesi è invece la fruttosio-1,6-bisfosfatasi. Poiché questa via metabolica produce nuovo glucosio, la fruttosio-1,6-bisfosfatasi dovrà essere inibita. Questi due enzimi non sono regolati direttamente tramite fosforilazione; hanno invece una pluralità di regolatori allosterici. Tra i diversi regolatori, il fruttosio-2,6-bisfosfato agisce, con effetti opposti, su entrambi gli enzimi; la sua influenza sulla attività enzimatica è piuttosto marcata. Si tratta quindi di un candidato ideale per l azione dell insulina, ed infatti è proprio su questo metabolita che agisce l ormone. L azione del fruttosio-2,6-bisfosfato è relativamente semplice: l aumento della sua concentrazione favorisce la PFK-1 e inibisce la fruttosio-1,6-bisfosfatasi. Quindi: più è alta la concentrazione di fruttosio-2,6-bisfosfato, più la glicolisi è attiva e più la gluconeogenesi è inibita. Ci aspettiamo dunque che l insulina incrementi la produzione di questo regolatore allosterico. La concentrazione di fruttosio-2,6-bisfosfato è determinata dall attività relativa di due enzimi: la fosfofruttochinasi-2 (PFK-2) lo sintetizza a partire dal fruttosio-6-fosfato, mentre la fruttosio-2,6-bisfosfatasi lo degrada. Queste due attività enzimatiche sono situate sulla stessa proteina. La stessa molecola presenta quindi due funzioni enzimatiche: con una attività produce fruttosio-2,6-bisfosfato, con l altra lo degrada. La concentrazione di questo modulatore in un dato momento dipende da quanto è attiva una attività enzimatica rispetto all altra. Nel fegato si è sviluppato un sistema molto efficiente per regolare entrambe le attività enzimatiche in maniera coordinata: quando la proteina bifunzionale è fosforilata, la fruttosio-2,6-bisfosfatasi è attivata e la PFK-2 è meno attiva; quando l enzima è defosforilato, la situazione si inverte: la fruttosio-2,6-bisfosfatasi diviene meno attiva mentre la PFK-2 è attivata. Per avere un incremento nella sintesi di fruttosio-2,6-bisfosfato, l insulina dovrà far sì che l enzima sia defosforilato. Questo è in effetti quello che accade, in quanto i pathway segnalatori intracellulari dell insulina negli epatociti attivano una fosfatasi che rimuove il gruppo fosfato dall enzima bifunzionale, incrementando la sintesi di fruttosio-2,6-bifosfato. Quindi: l insulina attiva una fosfoproteina fosfatasi; la fosfoproteina fosfatasi defosforila la PFK-2/fruttosio-2,6-bisfosfatasi;
66 rmoni proteici e peptidici 57 PFK-1 fruttosio-2,6-bp - FBPasi-1 aumento glicolisii PFK-2 (attiva) diminuzione gluconeogenesi P FBPasi-2 (inattiva) ATP fosfatasi PKA H 2 PFK-2 (inattiva) ADP diminuzione glicolisi P FBPasi-2 (attiva) - aumento gluconeogenesi PFK-1 fruttosio-2,6-bp - FBPasi-1 Figura 2.21: Regolazione della glicolisi e della gluconeogenesi nel fegato. L insulina induce la defosforilazione dell enzima bifunzionale, che porta all aumento di fruttosio-2,6-bisfosfato, inibendo la gluconeogenesi e attivando la glicolisi. rmoni come il glucagone e l adrenalina esercitano effetti opposti attivando la PKA. Questo è il meccanismo con cui durante il digiuno il glucagone blocca la glicolisi epatica e promuove la gluconeogenesi. Notare che in tessuti diversi dal fegato la regolazione è diversa.
67 2 rmoni proteici e peptidici 58 l attività di PFK-2 è incrementata rispetto a quella fosfatasica; La concentrazione di fruttosio-2,6-bisfosfato aumenta, e regola allostericamente PFK-1 e fruttosio1,6-bisfosfatasi; PFK-1 è attivata dal regolatore allosterico, e con essa anche la glicolisi; la fruttosio-1,6-bisosfatasi è inibita dal regolatore allosterico, e con essa la gluconeogenesi. Questo meccanismo di fosforilazione/defosforilazione invece non si verifica nel muscolo. In tessuti diversi dal fegato vengono infatti espressi altri isoenzimi della PKA [33] dotati di differenti caratteristiche strutturali e funzionali. Nel muscolo e nel cuore l insulina (ma ad esempio anche l adrenalina) stimola la glicolisi con altri meccanismi non del tutto chiari [15]. Infine, la regolazione del metabolismo glucidico da parte dell insulina si esplica anche nel lungo termine: a fianco degli effetti che abbiamo appena visto, l insulina incrementa l espressione di molti dei geni coinvolti a vario livello nel consumo di glucosio, in particolare sul fronte ossidativo (enzimi glicolitici etc.). Tra questi, è importante ricordare che la glucochinasi, l enzima che fosforila il glucosio non appena penetra nelle cellule. L aumento dell espressione della glucochinasi interessa principalmente gli epatociti. Inoltre, sembra che molti enzimi coinvolti nelle vie metaboliche indesiderate (es. gluconeogenesi) vedano una diminuzione della propria sintesi. Infine, ricordiamo che ormai da tempo è noto che l insulina attivi anche la piruvato deidrogenasi per defosforilazione - il meccanismo preciso però non è chiaro. Ad ogni modo, questo serve per ricordarci che l aumentato catabolismo del glucosio porta alla formazione di acetil-coa, che, nelle cellule in grado di farlo, possono servire per la sintesi degli acidi grassi. Metabolismo lipidico. La principale regolazione del metabolismo dei lipidi avviene a livello del tessuto adiposo e del fegato. Nel tessuto adiposo l insulina 1. stimola la lipogenesi, trasformando il glucosio in eccesso in una riserva energetica conveniente; 2. inibisce la lipolisi e la chetogenesi, in quanto rappresentano fonti energetiche che non è conveniente usare in condizioni di abbondanza di glucosio. La regolazione si esplica a diversi livelli: La mobilizzazione degli acidi grassi nel tessuto adiposo ha due attori: la lipasi ormone sensibile e le perilipine. La lipasi ormone sensibile è l enzima che
68 2 rmoni proteici e peptidici 59 partecipa alla mobilizzazione degli acidi grassi; la sua fosforilazione ha significato attivante. Le perilipine sono proteine che negli adipociti circondano, rivestendole, le gocce lipidiche. Si ritiene che proteggano la goccia lipidica dalle lipasi, impedendo agli enzimi di accedere ai trigliceridi. La loro fosforilazione determina cambiamenti conformazionali che espongono la goccia lipidica all azione lipasica. La lipolisi è quindi attivata da due meccanismi camp dipendenti (Fig. 2.22): da una parte, la fosforilazione delle perilipine, che rendono la goccia lipidica accessibile all azione enzimatica; dall altra fosforilazione della lipasi che attiva l enzima. In entrambi i casi la fosforilazione è da imputare alla PKA. Non è tuttora chiaro come avvenga la regolazione, ma si ritiene che che l insulina blocchi questa attivazione facendo precipitare la concentrazione di camp. Alcuni studi tuttavia lasciano supporre che questo effetto potrebbe essere da imputare anche ad una fosfatasi, che agirebbe in antagonismo alla fosforilazione delle perilipine e della lipasi. Ad ogni modo, il risultato è che la lipasi si trova defosforilata e inattivata, e la lipolisi viene dunque inibita. Grazie a questa regolazione, l adipocita cessa di immettere acidi grassi nel circolo sanguigno. Questa è la principale modifica metabolica responsabile della inibizione della lipolisi. Regolazione della acetil-coa carbossilasi (ACC), l enzima regolatore della biosintesi degli acidi grassi. La ACC è un enzima biotina-dipendente che indirizza gli acetil-coa, carbossilandoli a malonil-coa, verso la biosintesi degli acidi grassi. Le unità di malonil-coa sono infatti utilizzate dal grande complesso della acido grasso sintasi come punto di partenza per la biosintesi e l allungamento degli acidi grassi. La ACC esiste in uno stato fosforilato, nel quale è inattiva, ed uno stato defosforilato nel quale è attiva. Mentre la fosforilazione è promossa da una PKA, che media l azione di ormoni come glucagone o adrenalina, l insulina promuove la defosforilazione per mezzo di una fosfatasi. Questo rende la ACC più attiva, permettendole di sintetizzare più malonil-coa. Ricordiamo che l acetil-coa in questo momento metabolico è fornito in abbondanza dal catabolismo del glucosio (sia grazie alla stimolazione della glicolisi che grazie alla attivazione della piruvato deidrogenasi). Questo intervento metabolico ha una doppia valenza: 1. è un modo per attivare la biosintesi degli acidi grassi, in quanto fornisce materia prima per questa via metabolica. E soprattutto a causa di questa regolazione che l insulina stimola la conversione dei carboidrati in grassi; 2. è un modo per inattivare la beta-ossidazione. Un alta concentrazione di malonil-coa infatti va ad inibire la carnitina aciltransferasi I, componente fondamentale del cosiddetto shuttle della carnitina. In questo modo, l insu-
69 2 rmoni proteici e peptidici 60 Vaso sanguigno Perilipina Lipasi Goccia lipidica P P PKA P P P Figura 2.22: Regolazione della lipasi ormone sensibile. In alto, le perilipine ricoprono la goccia lipidica impedendo l accesso alla lipasi, che è inattiva (è quello che si verifica in presenza di insulina). In basso, la fosforilazione da parte della PKA (es. in presenza di glucagone) provoca il distacco delle perilipine e l attivazione della lipasi ormone sensibile che ora può accedere alla goccia lipidica.
70 2 rmoni proteici e peptidici 61 lina riesce a impedire agli acidi grassi di accedere alla matrice mitocondriale, dove avviene la beta-ossidazione. L insulina, sul lungo periodo, incrementa l espressione di molti degli enzimi chiave nel metabolismo lipidico: acil-coa carbossilasi, acido grasso sintasi, enzima malico, etc. Peraltro, è bene prestare attenzione al fatto che l insulina inibisce indirettamente la chetotgenesi. Da una parte, abbassando il rate della lipolisi, fa sì che vi siano meno acidi grassi liberi in circolo che, come è noto, favoriscono la formazione dei corpi chetonici. Dall altra parte, l insulina ostacola l ingresso degli acidi grassi nel mitocondrio, e anche questo è un fattore limitante per la chetogenesi. Nel fegato, l insulina partecipa alla regolazione del metabolismo del colesterolo. L insulina incrementa l espressione della HMG-CoA reduttasi di ben dieci volte [29]. In passato si riteneva che l insulina (così come il glucagone) regolassero questo enzima principalmente attraverso cambiamenti dello stato di fosforilazione (l insulina promuoverebbe la defosforilazione dell enzima). ggi tuttavia si ritiene che la fosforilazione/defosforilazione abbiano un ruolo limitato e che la regolazione dell espressione genica sia la principale modalità con cui l insulina regola l enzima [28]. Metabolismo proteico. L insulina attiva la sintesi proteica in parecchi tessuti per questo è considerata un ormone anabolico. Il muscolo e il tessuto epatico sono i tessuti a livello dei quali l azione dell insulina è più marcata a livello di sintesi proteica. vviamente, si tratta di un effetto che si manifesta nel lungo termine (ore, giorni). Correlazioni cliniche: Diabete mellito Il diabete mellito è una patologia cronica del metabolismo, caratterizzata da un deficit della azione o della secrezione di insulina, o entrambi. Poiché l insulina è il principale ormone che promuove l ingresso di glucosio nelle cellule, il deficit insulinico porta all iperglicemia, che può essere considerata l elemento distintivo della malattia diabetica. Dal punto di vista classificativo, si distinguono diverse forme di diabete mellito sulla base della patogenesi. Diabete mellito di tipo 1: in questo caso il diabete deriva della distruzione delle beta-cellule pancreatiche; c è un deficit assoluto di insulina. Nel 95% dei casi la distruzione è autoimmune (tipo 1a); in circa il 5% dei casi, è idiopatica (cioè da causa sconosciuta; tipo 1b). In passato il diabete mellito di tipo 1 era chiamato diabete
71 2 rmoni proteici e peptidici 62 giovanile perché nella maggior parte dei casi insorge nell infanzia o nell adolescenza; veniva anche chiamato diabete insulino-dipendente perché i soggetti affetti si basano completamente sull insulina esogena per sopperire alla loro carenza assoluta di ormone. ggi questi termini sono scoraggiati. Diabete mellito di tipo 2: la patogenesi è più complessa; è caratterizzato da un variabile grado di resistenza all azione dell insulina, associato ad una insufficiente secrezione compensatoria dell ormone. Il contributo relativo di questi due fattori è variabile: in alcuni soggetti prevale l insulino-resistenza, mentre in altri l insulinoresistenza è minima ed il diabete deriva soprattutto da una insufficiente secrezione. È la forma più frequente di diabete mellito, ed è una delle malattie croniche più comuni della popoplazione adulta e anziana. In passato era anche noto come diabete non insulino-dipendente o diabete dell adulto. Questa terminologia è oggi scoraggiata, anche perché qualunque forma di diabete può richiedere prima o poi un trattamento con insulina. Diabete gestazionale: è una condizione di alterato metabolismo glicidico che si verifica durante la gravidanza in donne senza precedente diagnosi di diabete mellito; Altri tipi particolari di diabete: in questa categoria vengono inserite tutte le altre forme di diabete mellito, a varia patogenesi: diabete da difetti genetici, associato ad altre endocrinopatie, infezioni etc. Il diabete mellito di tipo 1 ha spesso un esordio acuto o subacuto (talora drammatico), mentre il diabete mellito di tipo 2 ha generalmente un esordio più insidioso, e spesso è diagnosticato in soggetti apparentemente asintomatici, quando viene rilevata un iperglicemia a controlli di routine. In linea di massima, una modesta iperglicemia può essere totalmente asintomatica. L iperglicemia si manifesta clinicamente quando raggiunge valori elevati (> ). Tra i sintomi più caratteristici c è la poliuria (dovuta al fatto che il glucosio passa nelle urine quando è in quantità tali da superare le capacità di riassorbimento del rene, portandosi dietro l acqua per osmosi), che causa disidratazione e quindi, come meccanismo di compenso, polidipsia (sete intensa). Molto frequente è l astenia (cioè mancanza di forze, fatica eccessiva rispetto allo sforzo compiuto), verosimilmente legata alla disidratazione che porta ad ipotensione. Un altro sintomo dell iperglicemia sono le alterazioni visive transitorie (visione sfocata); sembrano dovute a cambiamenti di forma del cristallino, causate da alterazioni del contenuto di acqua, che ne alterano il potere rifrattivo. Sarebbero secondarie a disturbi osmotici indotti
72 2 rmoni proteici e peptidici 63 dall iperglicemia. Il diabete è anche in grado di accelerare la formazione di cataratta, cosa che può contribuire ai disturbi visivi. Il diabete di tipo 2 è spesso diagnosticato quando è ancora asintomatico. In ogni caso tutti questi sintomi si manifestano in maniera graduale e insidiosa perché i fenomeni responsabili dell iperglicemia in questa forma di diabete (un variabile grado di insulino-resistenza con un deficit relativo di insulina) si instaurano lentamente. C è sempre un certo grado di secrezione di insulina, solo che non è sufficiente a controllare la glicemia. Insulino-resistenza significa che i tessuti rispondono in maniera ridotta allo stimolo ormonale: una certa quantità di insulina produce effetti inferiori rispetto a quanto ci aspetteremmo. Una risposta inferiore significa che, per esempio, i tessuti bersaglio dell insulina (es. muscolo e tessuto adiposo) non effettuano un adeguato uptake di glucosio; a livello epatico non viene correttamente soppressa la gluconeogenesi e l immissione di glucosio nel torrente ematico, e così via. I meccanismi che portano all insulino-resistenza rimangono misteriosi. Sembra che si instauri fino a anni prima dell insorgenza del diabete. La patogenesi appare molto complessa, ma sembra esserci un legame molto forte con l obesità. Per chi fosse interessato, ci sono molti articoli che affrontano l argomento in dettaglio [37, 19, 36]. Comunque si origini l insulino-resistenza, inizialmente il pancreas riesce a compensare secernendo una maggiore quantità di insulina che permette, almeno in un primo tempo, di normalizzare la glicemia (c è uno stato di iperinsulinismo, cioè una secrezione di insulina sovrafisiologica). Con il tempo la capacità di compenso pancreatica si esaurisce e la situazione sfugge progressivamente al controllo omeostatico. Si manifestano delle alterazioni del metabolismo glicidico che inizialmente non sono marcate, ma che tuttavia non possono essere considerate normali. Queste situazioni prediabetiche di alterato metabolismo glicidico che si trovano nell area grigia tra la normalità e il diabete franco sono note come impaired glucose tolerance (IGT) e impaired fasting glucose (IFG) [1, 32]. Alla fine, l insulina secreta non è più sufficiente per impedire l instaurarsi di un iperglicemia franca. Non sono noti i fattori che determinano questo esaurimento funzionale delle beta-cellule. Nel diabete di tipo 1, l esordio spesso è drammatico perché il pancreas esaurisce rapidamente la propria capacità di produrre insulina. Gli eventi che portano dall inizio dell autoimmunità alle manifestazioni cliniche e la loro successione cronologica sono oggetto di discussione (anche recentemente [2]), ma secondo la visione tradizionale il processo autoimmune distruggerebbe progressivamente le beta cellule nel corso della fase preclinica (probabilmente della durata di alcuni anni). Il diabete si manifesterebbe quando circa l 80% 90% delle cellule sono distrutte. L iperglicemia si instaura bruscamente, e quindi i sintomi insorgono improvvisamente (giorni o poche settimane) in bambini o adolescenti precedentemente in buona salute. La poliuria e
73 2 rmoni proteici e peptidici 64 la sete sono intense; il soggetto si disidrata e perde elettroliti con le urine (soprattutto sodio e potassio, con conseguenti squilibri elettrolitici). Sintomi comuni sono anche la polifagia (fame intensa) e l astenia. Poiché le cellule non ricevono il segnale insulinico, il metabolismo si regola come se l organismo stesse affrontando un digiuno: vi è una elevata increzione di glucagone, il tessuto adiposo va incontro a lipolisi (aumento di acidi grassi liberi e glicerolo), ed il muscolo viene catabolizzato; gli acidi grassi liberi vengono convertiti in corpi chetonici a livello epatico. La lipolisi e la disidratazione rendono conto della marcata perdita di peso che si osserva poco prima dell esordio clinico del diabete di tipo 1. I corpi chetonici hanno un pka acido, e quindi la loro sintesi porta ad una condizione di acidosi metabolica (chetoacidosi). La presenza di corpi chetonici può essere sospettata sulla base di un caratteristico odore che conferiscono all alito del paziente (soprattutto l acetone, che è il più volatile), descritto come simile a quello della frutta matura. L acidosi, la disidratazione e gli squilibri elettrolitici provocano nausea, vomito, confusione, poi sonnolenza/letargia, e infine il coma. Prima dell introduzione della terapia con insulina purificata (1922), il diabete di tipo 1 era una malattia invariabilmente fatale. Questa scoperta è valsa un premio Nobel per Banting, Best, MacLeod e altri ricercatori. Superata la fase acuta, il diabete di tipo 1 ha sostanzialmente gli stessi problemi a lungo termine del diabete di tipo 2. La relativa povertà di segni e sintomi derivanti dall iperglicemia non deve indurre a sottovalutare il diabete mellito. L aspetto più temibile del diabete mellito sono le complicanze a lungo termine. L iperglicemia, a lungo termine, risulta tossica per l organismo, provocando lesioni a carico di molti organi e tessuti, che si manifestano in genere dopo anni di malattia. Le persone affette da diabete mellito di tipo 1 quasi sicuramente svilupperanno queste complicanze, perché si ammalano giovani e quindi sono esposte all iperglicemia per molti anni. I meccanismi con cui il glucosio risulta tossico sono diversi: uno dei più caratterizzati consiste nella formazione di advanced glycation end products (AGEs). Se esposte ad alte concentrazioni di glucosio, le proteine plasmatiche e tissutali vengono glicate e ossidate tramite una reazione non enzimatica, conosciuta come reazione di Maillard. Inizialmente si forma una base di Schiff tramite reazione del gruppo aldeidico dello zucchero con un gruppo amminico di un amminoacido; successivamente avviene un riarrangiamento che porta alla formazione di un composto di Amadori, che poi viene ossidato formando un AGE [11]. Gli AGE, oltre ad alterare la strutture delle proteine di partenza, possono generare RS, formare cross-link, e legarsi ad alcuni recettori coinvolti nella risposta infiammatoria. Le principali complicanze sono rappresentate da: complicanze macrovascolari: il diabete accelera il processo aterosclerotico a carico dei grandi vasi, con aumentato rischio di infarto e stroke.
74 2 rmoni proteici e peptidici 65 complicanze microvascolari: il diabete danneggia i piccoli vasi della retina (è una delle principali cause di cecità nei paesi sviluppati!), del rene (con danni variabili fino all insufficienza renale con necessità di dialisi), e dei nervi (neuropatia diabetica). maggiore suscettibilità alle infezioni (l iperglicemia sembra in qualche modo ostacolare la funzione dei granulociti e dei linfociti T); piede diabetico: è un termine che si usa per indicare le consequenze dell interessamento del piede da parte delle complicanze del diabete mellito (essenzialmente, l ischemia e la neuropatia). Sono molto frequenti le ulcere, le infezioni e le deformazioni articolari. Non raramente si deve ricorrere all amputazione delle dita o dell intero piede. Correlazioni cliniche: l insulina rapida L introduzione di analoghi dell insulina ottenuti tramite tecnologie di ingegneria genetica ha avuto un grande impatto nel trattamento del diabete. I primi passi in questo senso sono stati compiuti intorno ai primi anni 80, quando furono introdotte le prime insuline umane sintetiche. Uno dei primi prodotti fu commercializzato con il nome di Humulin. Questo tipo di insuline (come del resto le insuline porcine e bovine che erano utilizzate precedentemente) si aggregano in esameri complessandosi con lo zinco; poiché l interazione con il recettore è possibile solo per la forma monomerica dell insulina, questo fenomeno interferisce con la biodisponibilità dell insulina, che, in seguito ad iniezione sottocutanea, viene rilasciata con una velocità che non sempre corrisponde a quella desiderata. Per esempio, l insulina naturale iniettata per via sottocutanea viene rilasciata dopo circa 90 minuti dall iniezione, troppo lentamente per coprire il fabbisogno dell organismo dopo un pasto. A partire dalla metà degli anni 90 furono introdotte sul mercato delle insuline sintetiche leggermente modificate in modo da alterarne le proprietà, soprattutto in relazione alla rapidità d azione. Attualmente, esistono insuline rapide e insuline lente. Le insuline rapide hanno un assorbimento cutaneo più veloce, ed entrano in circolo già dopo pochi minuti dall iniezione; in questo modo possono essere iniettate subito prima o subito dopo un pasto e fornire la quota di insulina adatta. La loro azione si esaurisce dopo poche ore: in definitiva queste insuline riproducono più fedelmente le modalità di secrezione fisiologica dell insulina. Sono ottenute tramite una modifica a livello dell estremità C-terminale della catena B, invertendo la posizione di due aminoacidi, una lisina e una prolina (per questo sono note anche come insuline lispro ). Questa modifica non interferisce con il legame con
75 2 rmoni proteici e peptidici 66 il recettore, ma impedisce la formazione degli esameri. Le insuline lente sono di molti tipi, ma si caratterizzano per un tempo di rilascio e una durata d azione molto prolungate. Sono adatte ad essere utilizzate come terapia di fondo, cioè per generare un livello di insulinemia basale. In generale, le terapie moderne prevedono l associazione di diversi tipi di insulina, in modo da avere un controllo della glicemia il più possibile simile a quello fisiologico Glucagone Generalità Il glucagone è un ormone polipeptidico i cui effetti sono essenzialmente antagonisti a quelli dell insulina: si tratta cioè di un ormone iperglicemizzante. In altre parole, in condizioni in cui la concentrazione di glucosio nel sangue non è sufficiente, il glucagone ha la funzione di coordinare alcuni tessuti per ristabilire la glicemia e mantenere l omeostasi del glucosio. La situazione tipica in cui viene rilasciato glucagone è il digiuno: il glucagone in questi casi è fondamentale per assicurare un apporto di glucosio continuo a quei tessuti che non utilizzano altri substrati per l approvvigionamento energetico. Struttura Il glucagone è un ormone polipeptidico di 29 aminoacidi. Sede di elaborazione Viene sintetizzato e secreto principalmente dalle cellule α del pancreas (vedi anche il paragrafo Biosintesi ). Biosintesi Il glucagone viene sintetizzato sotto forma di pre-ormone di 158 aminoacidi (pro-glucagone) dalle cellule α del pancreas endocrino. Il gene del glucagone tuttavia è espresso in diversi altri tessuti, tra cui alcune popolazioni neuronali del sistema nervoso centrale e a livello intestinale. Immagazzinato all interno di vescicole secretorie, il pro-glucagone va incontro a proteolisi limitata, che dà origine a diversi frammenti peptidici. In generale, il proglucagone può essere suddiviso in una porzione N-terminale, che prende il nome di glicentina (aminoacidi 1 69), e una C-terminale (70 158), che invece prende il nome di MPGF, Major ProGlucagon Fragment.
76 2 rmoni proteici e peptidici 67 C è una certa tessuto-specificità nel processo di proteolisi, il che fa sì che i frammenti che si generano siano diversi a seconda della sede di espressione del gene. Nelle cellule α del pancreas, il frammento di glicentina viene ulteriormente tagliato in due frammenti: l estremità che va dal N-terminale della glicentina al sito di taglio prende il nome di GRPP (Glicentin-Related Polypeptide), mentre il glucagone è formato dagli aminoacidi che vanno dal sito di taglio della glicentina al C-terminale. L MPGF non va incontro ad altre modifiche, cosicché le cellule pancreatiche rilasciano glucagone, GRPP e MPGF. Tra questi, il glucagone ha gli effetti biologici più importanti. Nelle cellule intestinali, il frammento della glicentina non viene processato, mentre l MPGF viene tagliato producendo principalmente tre frammenti: IP-2, GLP-1 e GLP-2 (GLP sta per Glucagon-Like Peptide). Nel tessuto nervoso, il processo di elaborazione è vario. Non vedremo la funzione degli altri peptidi prodotti dal pro-glucagone; accenniamo soltanto al fatto che GLP-1 è rilasciato dall intestino in risposta ad alte concentrazioni di glucosio, e ha la funzione di potenziare il rilascio dell insulina. Secrezione e regolazione La regolazione del rilascio di glucagone presenta ancora diversi punti poco chiari. In generale, si osserva che la secrezione di glucagone: È innescata da basse concentrazioni ematiche di glucosio; È innescata dalle catecolamine attraverso stimolazione β-adrenergica; È innescata da pasti molto proteici; È inibita da alte concentrazioni ematiche di glucosio; È inibito da somatostatina e insulina. Sono documentati anche gli effetti del sistema nervoso autonomo sul rilascio di glucagone, ma le conclusioni dei diversi studi sono contrastanti e non definitive. Il glucagone può essere degradato per proteo- Trasporto nel plasma e degradazione lisi da numerose proteasi plasmatiche. Recettore Il recettore del glucagone è un classico recettore accoppiato a proteine G. Il legame con l ormone attiva l adenilato ciclasi e innalza la concentrazione di camp; a valle si ha attivazione della PKA con fosforilazione di alcuni enzimi chiave
77 2 rmoni proteici e peptidici 68 in generale, la fosforilazione è a carico di quegli enzimi che l insulina tendeva a defosforilare. Questo spiega perché l azione del glucagone abbia effetti antagonisti a quelli dell insulina. Effetti biologici del glucagone Il glucagone agisce soprattutto su due tessuti: fegato e tessuto adiposo. I recettori del glucagone sono espressi anche in altri tessuti (cuore, alcune popolazioni di neuroni nell encefalo, alcune cellule delle ghiandole surrenali e dello stomaco), ma il loro ruolo biologico non è stato ancora caratterizzato con precisione. L effetto del glucagone nei tessuti bersaglio si può riassumere affermando che il glucagone tende a incrementare la concentrazione di glucosio nel sangue. Questa funzione viene assolta principalmente agendo su due tessuti. Metabolismo del glucosio Nel fegato, viene stimolata la gluconeogenesi e la glicogenolisi, mentre la glicolisi e la glicogenosintesi vengono inibite. Ci si potrebbe chiedere perché il glucagone abbia questi effetti solo sul fegato. La risposta è che si tratta dell unico organo in grado di secernere glucosio nel sangue: è l unico tessuto che può innalzare la glicemia. Come nel caso dell insulina, la regolazione metabolica coinvolge la modifica dello stato di fosforilazione di pochi enzimi, ma il tipo di modifica in genere è esattamente opposto. vverosia: dove l insulina defosforila, il glucagone fosforila. Se gli effetti dell insulina sono stati compresi, capire quelli del glucagone dovrebbe essere semplice. Incremento della glicogenolisi: è basato sulla fosforilazione della glicogenofosforilasi, che la converte dalla forma b (defosforilata e inattiva) alla forma a (fosforilata e attiva) (Fig. 2.23). Il glucagone innesca questa fosforilazione attraverso la glicogeno fosforilasi chinasi. Quindi: il glucagone attiva la PKA, che fosforila e attiva la glicogeno fosforilasi chinasi, che a propria volta fosforila e attiva la glicogeno fosforilasi. Quest ultima inizia a distaccare unità di glucosio dal glicogeno. Inoltre, il glucagone inibisce la fosfoproteina fosfatasi, che potrebbe defosforilare la glicogeno fosforilasi e la glicogeno fosforilasi chinasi. Inibizione della glicogenosintesi: è basata sulla fosforilazione della glicogeno sintasi, che converte l enzima nella sua forma inattiva (Fig. 2.24). Sono numerose le chinasi in grado di fosforilare la glicogeno sintasi; si ritiene che nel caso del glucagone sia coinvolta essenzialmente la PKA. È bene precisare però che alcune prove sperimentali sembrano suggerire che il glucagone possa attivare, con meccanismi sconosciuti, delle chinasi camp-indipendenti.
78 + 2 rmoni proteici e peptidici 69 ATP Glicogeno fosforilasi chinasi P Glucagone + + PKA PP1 Glucagone ADP ATP P Glicogeno fosforilasi chinasi H 2 ADP Glicogeno fosforilasi (inattiva) Glicogeno fosforilasi (attiva) P Glicogeno (integro) Glicogeno (in degradazione) P PP1 H 2 + Glucagone Figura 2.23: Regolazione della glicogeno fosforilasi quando è presente il glucagone. Confrontare con le figg e 2.17
79 2 rmoni proteici e peptidici 70 Incremento della gluconeogenesi e inibizione della glicolisi: si verificano per lo più attraverso un decremento del fruttosio-2,6-bisfosfato, a propria volta indotto dalla fosforilazione dell enzima bifunzionale fruttosio-2,6-bisfosfatasi/fosfofruttochinasi- 2. La fosforilazione inattiva l attività chinasica e attiva quella fosfatasica. L enzima chiave della gluconeogenesi, la fruttosio-1,6-bisfosfatasi, è più attivo in presenza di scarse quantità del modulatore allosterico, così che il flusso complessivo attraverso la via è aumentato. Viceversa, la PFK-1 è meno attiva, e l entità del flusso attraverso la glicolisi diminuisce. Un altro effetto mediato dal glucagone che contribuisce alla regolazione è la fosforilazione della piruvato chinasi, l enzima glicolitico che converte il fosfoenolpiruvato in piruvato. La modifica covalente inattiva l enzima e riduce il flusso metabolico della glicolisi; inoltre, il fosfoenolpiruvato già prodotto viene indirizzato verso la gluconeogenesi. È bene ricordare che anche l aumentata disponibilità di acidi grassi liberi (determinata dalla stimolazione della lipolisi a livello del tessuto adiposo) contribuisce a indirizzare il metabolismo epatico verso la sintesi del glucosio. Infine, il glucagone influenza anche l espressione genica, aumentando o riducendo l espressione degli enzimi chiave. L effetto è mediato dalla fosforilazione di una proteina chiamata CREB (camp Response Element Binding protein), che agisce da fattore di trascrizione, legandosi ai camp response elements a livello del DNA. Per avere un quadro completo, in fig è illustrato l effetto dell incremento del camp (che è un effetto del glucagone e anche dell adrenalina) sul metabolismo del glicogeno, e in fig l effetto della diminuzione del camp (come avviene con l insulina). Metabolismo lipidico Nel tessuto adiposo, il glucagone essenzialmente promuove la lipolisi. Questo effetto viene ottenuto con la mediazione della PKA, che fosforila le perilipine e la lipasi ormone-sensibile (Fig. 2.22, pag. 60). Il glucagone regola inoltre la acetil-coa carbossilasi (ACC), stimolando la sua fosforilazione e inibendola. L enzima non è noto con certezza, ma probabilmente si tratta di una PKA. Nel fegato, il glucagone regola il metabolismo del colesterolo con effetti opposti a quelli dell insulina, cioè diminuendo l espressione della HMG-CoA reduttasi. In passato si riteneva che la regolazione avvenisse attraverso cambiamenti dello stato di fosforilazione, ma oggi si pensa che il glucagone agisca principalmente tramite la modulazione dell espressione genica [28].
80 2 rmoni proteici e peptidici 71 Glucagone ? PKA diverse chinasi ATP ADP Glicogeno sintasi (attiva) Glicogeno sintasi (inattiva) P Glicogeno (in attiva sintesi) P PP1 H 2 Glicogeno (non in attiva sintesi) + Glucagone Figura 2.24: Regolazione della glicogeno sintasi quando è presente il glucagone. Confrontare con le figg e 2.19.
81 rmoni proteici e peptidici 72 camp + + PKA Glicogeno fosforilasi chinasi Glicogeno fosforilasi chinasi PP1 PP1 Glicogeno fosforilasi + Glicogeno fosforilasi Glicogeno sintasi Glicogeno sintasi Figura 2.25: Schema riassuntivo degli effetti dell incremento della concentrazione di camp sulla regolazione del metabolismo del glicogeno. I principali ormoni in grado di aumentare il camp sono l adrenalina e il glucagone. camp - PP1 + Glicogeno fosforilasi chinasi Glicogeno fosforilasi chinasi Glicogeno sintasi Glicogeno sintasi Glicogeno fosforilasi Glicogeno fosforilasi Figura 2.26: Schema riassuntivo degli effetti del decremento della concentrazione di camp sulla regolazione del metabolismo del glicogeno. Il principale ormone in grado di diminuire il camp è l insulina.
82 2.3 rmoni della tiroide e delle paratiroidi 2 rmoni proteici e peptidici 73 Dove siamo? Paratiroidi Le paratiroidi sono delle piccole ghiandole situate nel collo. Hanno una forma rotondeggiante, le dimensioni di un chicco di riso, e in genere sono situate a contatto con la superficie posteriore della tiroide (vedi il box Dove siamo? sulla tiroide, pag. 101), in numero di tre o quattro (due superiori e due inferiori). C è comunque una certa variabilità nel numero (alcuni soggetti hanno 6 o 8 ghiandole paratiroidi) e nella posizione (possono ad esempio essere incluse nel contesto del parenchima tiroideo o essere dislocate nel mediastino). Istologicamente, le paratiroidi hanno una struttura più compatta della tiroide. Ci sono due principali citotipi: cellule principali: sono numericamente le cellule più rappresentate, e sono le cellule che sintetizzano l ormone PTH. cellule ossifile: sono caratterizzate da un citoplasma acidofilo e dalle grandi dimensioni; sono quantitativamente meno rappresentate, e la loro funzione non è chiara Paratormone (PTH) Generalità Il paratormone, o ormone paratiroideo (PTH), ha un ruolo centrale nell omeostasi del calcio, insieme a calcitonina 9 e il metabolita attivo della vitamina D, il calcitriolo. Struttura Il paratormone, è un polipeptide di 84 aminoacidi con una massa molecolare di circa 9,5 kda. Sede di Sintesi Viene sintetizzato e secreto dalle cellule principali delle paratiroidi. Biosintesi Come accade per diversi altri ormoni peptidici, anche il PTH non viene tradotto direttamente, ma è parte di un precursore più grande e inattivo (pre-propeptide), da cui vengono via via eliminati frammenti, fino ad ottenere l ormone vero 9 In realtà, come vedremo, il ruolo della calcitonina nell omeostasi del calcio è quantomeno dubbio.
83 2 rmoni proteici e peptidici 74 e proprio. Probabilmente, processi come questo si sono evoluti e conservati non per rispondere ad esigenze strutturali, ma regolative. Il pre-proormone (che rappresenta l immediato prodotto genico) è di 115 aminoacidi, e comprende un peptide segnale (la breve sequenza amino-terminale idrofobica che consente il trasferimento del peptide nel lume del RE) di 25 aminoacidi. Il peptide segnale viene rimosso per proteolisi a livello del RE stesso (quindi cotraduzionalmente), con produzione di proparatormone. 10 Sembra che gran parte del pro-pth sintetizzato venga degradato a questo livello. Nel Golgi vengono rimossi altri 6 aminoacidi per lo più basici (la cui funzione è ignota), convertendo il pro-pth che non è stato degradato in PTH, 11 che viene accumulato in granuli di secrezione. A questo punto, i possibili destini per il PTH sono due: può essere liberato; può andare incontro a diverse reazioni proteolitiche di degradazione, prima di essere secreto. La sintesi di PTH infatti è continua, e così la regolazione viene effettuata tramite processi degradativi. L attività biologica risiede soprattutto nel primo terzo della molecola (34 aminoacidi), a partire dall estremità N-terminale, che è responsabile per il legame al recettore. Secrezione, trasporto nel plasma e degradazione Il peptide di 84 aminoacidi è la forma intatta di PTH, ed è soprattutto in questa forma che l ormone viene secreto dalle paratiroidi. Tuttavia, il PTH può andare incontro a proteolisi in diversi momenti, dando origine ad alcuni frammenti specifici che si ritrovano poi in circolo. Sul totale di metaboliti associabili al paratormone in circolo, il PTH intatto rappresenta il 10%; il 90% è costituito dai frammenti. 12 I processi proteolitici che danno origine a questi metaboliti avvengono: 1. in parte nelle parotidi stesse, mentre il PTH è ancora all iterno della cellula - prima della secrezione; 10 Il pro-pth è quindi composto da = 90 aminoacidi. 11 Questo porta il PTH a 90-6 = 84 aminoacidi 12 Questo non è in contraddizione con il dato che il PTH intatto è la principale forma nella quale l ormone viene secreto: il PTH viene secreto per lo più intatto, ma in circolo sono più numerosi i frammenti, che vengono prodotti anche dalla proteolisi periferica del PTH intatto.
84 2 rmoni proteici e peptidici in parte in sede periferica, dopo la secrezione: soprattutto nel fegato, a livello delle cellule del Kupfer, e in minor quantità nel rene. I frammenti originati dal PTH constano di: frammenti amino-terminali, contenenti gli aminoaciddi 1-34 o In circolo si ritrovano solo i PTH 1-34, perché i PTH 1-36 vengono subito degradati ulteriormente in di- e tri-peptidi. I PTH 1-34 rappresentano il 10% dei metaboliti circolanti associabili al paratormone. Hanno attività biologica, ma emivita breve. frammenti carbossi-terminali, contenenti gli aminoacidi o Rappresentano l 80% dei metaboliti circolanti associabili al paratormone; non hanno attività biologica, ma emivita più lunga. Riassumendo, il PTH in circolo è così distribuito: 10% PTH intatto, l ormone vero e proprio; 10% frammenti amino-terminali; 80% frammenti carbossi-terminali. Questo 90% di frammenti è prodotto, come abbiamo visto, da una degradazione del PTH in parte nelle paratiroidi stesse, in parte a livello periferico, mentre l ormone circola dopo che è stato secreto. Gli enzimi che catalizzano questi processi di frammentazione sono le catepsine B e D, presenti sia nella paratiroidi che perifericamente. Le catepsine sono una famiglia di proteasi, di cui fanno parte circa 15 enzimi; alcune sono proteasi a serina, altre a cisteina, altre ancora ad asparato. In genere raggiungono la massima attività a bassi ph, infatti sono frequentemente presenti nei lisosomi. 13 La catepsina B taglia il PTH in due frammenti tra gli aminoacidi 36 e 37, producendo i frammenti PTH 1-36 e PTH Il frammento contenente gli aminoacidi 1-36 viene subito degradato ulteriormente, per cui dall azione di questo enzima si ottiene solo PTH La catepsina D taglia il PTH tra gli aminoacidi 34 e 35, producendo i frammenti PTH 1-34 e PTH Ricapitolando: il PTH viene sintetizzato ed impacchettato in vescicole secretorie; già a questo livello si hanno intensi processi degradativi (prima a livello del pro-pth, poi a livello del PTH). Viene rilasciato soprattutto PTH intatto, mentre la quota maggiore dei frammenti sono conservati nelle cellule delle paratiroidi, e solo una minor parte passa nel sangue. 13 Potrebbero essere clinicamente importanti in quanto sono maggiormente espresse in alcuni tumori, e sembrano implicate in altre patologie.
85 2 rmoni proteici e peptidici 76 diminuzione della calcemia aumento concentrazione PTH aumento della calcemia aumento sintesi di calcitriolo (1,25-diidrossi-vitamina D ) 3 ritorno alla normalità Figura 2.27: La diminuzione della concentrazione plasmatica di calcio incrementa la secrezione di PTH; il PTH da una parte aumenta direttamente la concentrazione plasmatica di calcio, dall altra favorisce la produzione di calcitriolo, il quale partecipa all azione ipercalcemizzante. Il calcio, aumentando, inibisce la secrezione di PTH con un circuito a feedback; un altra inibizione a feedback è esercitata dal calcitriolo. Alla fine, si ha il ritorno alla normalità. Il PTH intatto, attraverso la circolazione, giunge al fegato, dove avviene la proteolisi periferica. Sulla membrana plasmatica delle cellule del Kupfer è esposta una catepsina (la B), che produce i frammenti; questi poi continuano a circolare. Sembra che anche il rene partecipi a questa proteolisi, ma verosimilmente i frammenti vengono escreti e non reimmessi in circolo. Regolazione Per quanto riguarda la regolazione di questo ormone, si sono evoluti meccanismi di regolazione che intervengono a diversi livelli nel metabolismo. Abbiamo: una regolazione a livello della biosintesi; una regolazione post-traduzionale una regolazione a livello della secrezione; una regolazione tramite degradazione periferica; Regolazione a livello della biosintesi Si esplica sia a livello dell espressione del gene, sia con modifiche post-traduzionali (trattate separatamente), sia attraverso una
86 2 rmoni proteici e peptidici 77 regolazione del numero e delle dimensioni delle cellule che lo sintetizzano. Dato che la funzione del paratormone è, in buona sostanza, quella di innalzare la concentrazione plasmatica di calcio, una regolazione da parte del calcio stesso è intuitiva (Fig 2.27). I meccanismi con cui questo avviene sono piuttosto complessi, e in parte da chiarire, ma è dimostrato che un decremento della concentrazione plasmatica di Ca 2+ porta ad un incremento dell mrna del PTH e della sintesi del relativo peptide. Si pensa che questo avvenga tramite una regolazione della trascrizione, della stabilità dell mrna e della traduzione. La regolazione a livello genico avviene anche ad opera del calcitriolo (1 α,25- diidrossicolecalciferolo), un ormone lipofilo derivato dalla vitamina D che, complessatosi con il proprio recettore, si lega ai response elements della vitamina D nella regione del promotore del gene del PTH decrementandone la trascrizione. La relazione che lega PTH e calcitriolo sarà illustrata meglio più avanti (vedi paragrafo a pagina 132); per il momento, ciò che occorre sapere è che questa rappresenta una inibizione a feedback. Uno degli effetti del PTH infatti è quello di stimolare la produzione di calcitriolo, che da un lato partecipa nell aumento della calcemia, dall altro con un loop di feedback negativo va ad inibire la produzione del PTH stesso. Regolazione a livello post traduzionale Come abbiamo accennato, gran parte del propth sintetizzato viene degradato immediatamente nel RE, e questo processo è indipendente dal calcio; invece, la calcemia sembra influenzare il processo proteolitico che interessa il PTH nelle vesciole secretorie, rallentando la degradazione in risposta ad una diminuzione di calcio plasmatico, incrementandola in caso contrario. Questo avviene grazie ad un recettore sensore del calcio parotideo (Calcium Sensing Receptor), in grado di percepire anche piccole variazioni della calcemia. La scoperta di questo importantissimo recettore ha rappresentato una tappa fondamentale per la comprensione della omeostasi del calcio. Si tratta di un recettore accoppiato alle proteine G esposto sulla membrana di alcuni citotipi, tra cui le cellule parotidee. Quando il calcio è legato al recettore (perché è abbondante) 14, questo è attivato, e media una complessa serie di segnali intracellulari che coinvolgono diverse fosfolipasi, tra cui la fosfolipasi A 2. Conosceremo meglio la fosfolipasi trattando la biosintesi degli eicosanoidi, per adesso ci basti sapere che grazie a questo enzima si ha la sintesi di leucotrieni, che inibiscono la secrezione di PTH attraverso una attivazione massiccia della sua degradazione. Quando il calcio non è legato a questo recettore (perché è scarso), questo passa allo stato inattivo: i leucotrieni non sono prodotti, la degradazione diminuisce, e la secrezione di PTH non è più tenuta a freno. È piuttosto interessante il fatto che si sia evoluto un 14 Il calcio è presente, nel plasma, in tre forme: ionizzato, cioè come Ca 2+ libero; complessato con altri ioni; complessato con le proteine. Il calcium sensing receptor avverte solo il calcio ionizzato.
87 2 rmoni proteici e peptidici 78 meccanismo di regolazione per cui la sintesi è costitutiva, mentre l inibizione avviene modulando l intensità dei processi proteolitici (pur tenendo presente che il calcio ha effetti sull mrna del PTH). Infine, in specie in caso di prolungata ipocalcemia o di deficienza di calcitriolo, la sintesi di PTH viene incrementata attraverso un aumento del numero e delle dimensioni delle cellule produttrici. Regolazione a livello della secrezione Abbiamo visto come il calcio serico contribuisca a regolare la biosintesi, sia determinando un incremento dell mrna del gene del PTH, sia inibendo la degradazione del PTH intatto nelle vescicole. La regolazione a feedback negativo esplicata dal calcio plasmatico però non si ferma qui, ma si estende anche a livello della secrezione. Dato che il PTH ha la funzione di innalzare la calcemia, la secrezione deve avvenire quando il calcio diminuisce. Di nuovo, a mediare questo processo, è il Calcium Sensing Receptor. ltre ad attivare la fosfolipasi A 2, attiva anche la fosfolipasi C, con produzione di diacilglicerolo (DAG) e IP 3 ; il risultato è un aumento della concentrazione intracellulare di calcio. Al contrario degli altri meccanismi di esocitosi conosciuti, che sono attivati da un aumento della concentrazione intracellulare di calcio, nelle cellule delle paratiroidi la secrezione delle vescicole è inibita da alte concentrazioni di calcio intracellulare. Quando il calcio si dissocia dal calcium sensing receptor, questo è inattivato, e la concentrazione intracellulare di calcio precipita, innescando il rilascio delle vescicole. Regolazione tramite degradazione periferica Avviene per lo più nel fegato ad opera delle catepsine B e D, e di questa abbiamo già parlato: vengono prodotti per lo più frammenti carbossi-terminali, inattivi. In definitiva, la principale regolazione è affidata alla calcemia. Recettori Sono stati identificati tre tipi di recettori per il PTH: PTHR1, PTHR2 e PTHR3. Di questi, il PTHR1 è il mediatore degli effetti fisiologici più importanti. È espresso dagli osteoblasti e dalle cellule del rene. Sono tutti recettori accoppiati a proteine G. Gli effetti del PTH sono mediati attraverso l attivazione della adenilato ciclasi e quindi del camp; si ha quindi l attivazione della PKA, con fosforilazione di proteine specifiche. La cascata segnalatoria promuove l attivazione di geni ed enzimi. Effetti fisiologici del paratormone Il PTH viene spesso definito come un ormone ipercalcemizzante, intendendo con questo che le sue azioni biologiche hanno, come ultimo risultato, quella di innalzare la concentrazione plasmatica di Ca 2+. Il paratormone influenza anche la concentrazione plasmatica di fosfato e promuove l attivazione
88 2 rmoni proteici e peptidici 79 della vitamina D. Del resto, calcemia e fosfatemia sono correlate tra loro, poiché i sali di calcio e fosfato sono i componenti principali del tessuto osseo, e la vitamina D attivata ha un ruolo nell omeostasi calcica. Le cellule bersaglio sulle quali il paratormone esercita la sua azione si trovano essenzialmente a livello renale ed osseo. Azione sui tubuli renali. Stimola il riassorbimento del Ca 2+ a livello della porzione distale dei tubuli, il che consente al PTH di influire sul 40% del totale di calcio riassorbito a livello renale. 15 Come agisce esattamente il PTH? L ormone promuove l esposizione e l apertura di canali per il calcio a livello della membrana apicale delle cellule. Penetrato nell ambiente intracellulare, il calcio si lega alla calbindina-d 28K, che facilita la diffusione dello ione dalla membrana apicale (rivolta verso il lume del tubulo) a quella basolaterale (rivolta verso l interstizio renale), dove il calcio fuoriesce nello spazio interstiziale grazie ad un trasportatore ATP-dipendente. Si stabilisce quindi un flusso unidirezionale di calcio attraverso la cellula, dalla membrana apicale a quella basolaterale. Inoltre, il PTH riduce il riassorbimento di ioni fosfato, agendo a livello dei suoi trasportatori Na + /P i di tipo II, esposti sulla membrana. 16 L ormone induce la loro internalizzazione e, una volta racchiusi in vescicole, la loro distruzione. Sintesi della vitamina D L azione del PTH sul rene non si limita soltanto ai tubuli renali. A livello del rene, si ha l induzione della 1 α-calcidiolo-idrossilasi, l enzima responsabile della formazione del calcitriolo. Come abbiamo accennato (e come 15 Non tutto il riassorbimento del calcio è sotto controllo ormonale. Vi sono due modalità con le quali avviene tale riassorbimento: la via transcellulare e la via paracellulare. Nella porzione prossimale dei tubuli, il trasporto del calcio avviene con la via paracellulare, che rappresenta un processo passivo, correlato al riassorbimento di sodio, e non regolabile. Nella porzione distale, il riassorbimento avviene invece mediante la via transcellulare, attiva e regolabile da ormoni come il PTH (o farmaci). Nella porzione ascendente dell ansa di Henle, il riassorbimento avviene con entrambe le modalità. 16 È interessante chiedersi perché l evoluzione abbia selezionato questa azione, che apparentemente sembra avere poco a che vedere con il calcio. In realtà calcio e fosfato sono intimamente connessi, entrando nella costituzione della componente minerale delle ossa. Quando la fosfatemia plasmatica si abbassa, a causa della aumentata escrezione dello ione, i cristalli di idrossiapatite solubilizzano più facilmente, rendendo più agevole il richiamo di calcio dalle ossa (una delle azioni del paratormone è quella di incrementare il riassorbimento della matrice ossea, con liberazione degli ioni contenuti nei sali che formano la matrice inorganica). Inoltre, il fatto di aumentare l escrezione di fosfato permette di contenere l innalzamento della fosfatemia che consegue al riassorbimento della matrice minerale ossea.
89 2 rmoni proteici e peptidici 80 vedremo meglio più avanti, pag. 132), il calcitriolo esercita un azione sinergica a quella del PTH. Si può pensare che il PTH deleghi alcuni compiti al calcitriolo. Azione a livello osseo Il PTH agisce a livello osseo stimolandone il riassorbimento, con rilascio di Ca 2+ dalla matrice. Ad operare la degradazione della matrice extracellulare sono gli osteoclasti. Il paratormone non li stimola direttamente, ma agisce sugli osteoblasti. Sono questi ultimi che esprimo i recettori per l ormone, e che provvedono a reclutare gli osteoclasti, mediando quindi l azione del PTH. Il paratormone stimola negli osteoblasti la sintesi di RANKL 17 (sinonimi: DF, fattore differenziante gli osteoclasti), un recettore che le cellule espongono sulla loro membrana. RANKL si lega a RANK, che invece è espresso sulla membrana dei precursori osteoclastici. Il legame determina un cambiamento conformazionale di RANK, che media effetti intracellulari, ed in ultimo determina l espressione dei geni che promuvono il differenziamento dei precursori in osteoclasti maturi. Inoltre, il PTH riduce la secrezione di osteoprotegerina (una proteina che inibisce il differenziamento degli osteoclasti) da parte degli osteoblasti e stimola la sintesi di fattori di crescita e interleuchina, il cui effetto è quello di attivare gli osteoclasti. Tutti questi effetti si risolvono in un aumento della calcemia Calcitonina Generalità La calcitonina è un ormone coinvolto nell omeostasi del calcio, insieme a PTH e calcitriolo. Mentre questi due hanno effetto ipercalcemizzante, la calcitonina ha un effetto opposto, di tipo ipocalcemizzante. Struttura La calcitonina è un ormone peptidico di 32 aminoacidi. L attività biologica è posseduta dall intero peptide, e quindi la frammentazione dell ormone porta alla sua inattivazione. In particolare, sembra essere importante la parte N-terminale della molecola, che è costituita da un ciclo di 7 aminoacidi, uniti attraverso un ponte disolfuro Cys-Cys. La prolina C-terminale è inoltre amidata. Una caratteristica curiosa dell ormone sta nella incredibile variabilità che si osserva tra ormoni di specie diverse (per esempio, nel caso della calcitonina umana e suina, gli aminoacidi differenti sono circa la metà); tuttavia, questo non sembra pregiudicare l attività biologica interspecie tant è che la calcitonina di salmone è più attiva di quella umana, e viene utilizzata in terapia. 17 Sta per RANK Ligand, cioè ligando di RANK.
90 2 rmoni proteici e peptidici 81 Sede di sintesi Viene sintetizzata principalmente dalle cellule C della tiroide sembra tuttavia che la biosintesi possa avvenire anche in altri distretti corporei (encefalo, paratiroidi, timo, cellule di bronchi e polmoni, prostata), ma non si conosce il ruolo fisiologico dell ormone in questi distretti. Biosintesi La calcitonina si forma, come accade per molti altri ormoni peptidici, in seguito alla proteolisi limitata di un precursore più grande. Il trascritto primario del gene della calcitonina contiene l informazione per la traduzione sia della procalcitonina sia di un altra proteina, il peptide correlato al gene della calcitonina (CGRP), potente vasodilatatore; lo splicing alternativo del trascritto consente alle cellule di produrre l uno o l altro, in maniera tessuto-specifica. La pro-calcitonia viene convertita in calcitonina nel Golgi, quindi immagazzinata in vescicole. Secrezione e regolazione Il rilascio della calcitonina è sotto il controllo della calcemia plasmatica: quando questa supera i 9-10 mg/100 ml, viene innescata l esocitosi. Questo effetto è mediato da un recettore sensibile al calcio. Notare che, pur trovandosi nella tiroide, le cellule C, il citotipo responsabile della secrezione di calcitonina, non sono in alcun modo sotto il controllo dell ipofisi, al contrario dei tireociti, che sono regolati dal TSH. Trasporto nel plasma e degradazione La calcitonina viene rapidamente eliminata dal rene per degradazione proteolitica. I suoi metaboliti sono privi di attività. Effetti fisiologici e recettori Gli effetti biologici della calcitonina sono conosciuti ma non è chiaro quale sia il peso effettivo della calcitonina sulla regolazione della calcemia. Per esempio, nei due casi estremi di tiroidectomia (rimozione chirurgica della intera tiroide), e di carcinoma della tiroide (con ipersecrezione di calcitonina), non si osservano alterazioni rilevanti nell omeostasi calcica. 18 In un certo senso, la calcitonina è un ormone in cerca di una funzione [10]. È possibile che l ormone abbia un ruolo nell omeostasi del calcio, ma che non sia necessario perché il calcio sia regolato correttamente. 18 Nel caso della tiroidectomia, una possibilità è che la sintesi extratiroidea di ormone sia sufficiente a garantirne le funzioni.
91 2 rmoni proteici e peptidici 82 La calcitonina produce un abbassamento della calcemia si tratta quindi di un ormone ipocalcemizzante. Le cellule bersaglio di questo ormone si trovano a livello di tessuto osseo e rene, e presentano recettori accoppiate a proteine G: Azione sulle ossa. Agisce sugli osteoclasti, inibendone la motilità, l attività ed il numero. Il riassorbimento osseo quindi viene ad essere inibito, ed il calcio cessa di essere immesso nel torrente plasmatico. L azione sugli osteoclasti avviene grazie ai recettori esposti sulla superficie cellulare, ed il segnale intracellulare è mediato attraverso i pathway camp-pka e Ca 2+ -PKC; gli effetti principali consistono in una disorganizzazione del citoscheletro, che causa una perdità di polarità delle cellule e smantella l orletto increspato (ruffled borders). Azione sul rene A livello dei tubuli renali, la calcitonina inibisca il riassorbimento del Ca 2+ e altri ioni (sodio, fosfato), favorendo la loro escrezione con le urine, e quindi sottraendo ioni al pool plasmatico. Anche in questo caso, si ha l attivazione della adenilato ciclasi. Una overview della regolazione ormonale dell omeostasi calcica sarà presentata al momento di esaminare l azione fisiologica del calcitriolo.
92 3 rmoni derivati da aminoacidi 3.1 Generalità Gli ormoni derivati dagli aminoacidi sono rappresentati principalmente dalle catecolamine e dagli ormoni tiroidei. Sono sintetizzati a partire dall aminoacido tirosina. Le catecolamine principali sono adrenalina (o epinefrina), noradrenalina (o norepinefrina) e dopamina. Il loro nome deriva dal fatto che sono strutturalmente correlate al catecolo. Sono sintetizzate a livello della zona midollare della ghiandola surrenale con valenza di ormoni endocrini (cioè sono secrete nel circolo sanguigno), e a livello neuronale con valenza di neurotrasmettitori (soprattutto a livello del sistema nervoso simpatico). 1 È interessante notare come a livello embriologico i due tessuti siano fortemente correlati: la midollare surrenale deriva da cellule delle creste neurali, che si distaccano dal tubo neurale. Le catecolamine sono idrofile, e nel sangue hanno un emivita estremamente breve. Gli ormoni tiroidei sono la triiodotironina (T 3 ) e la tetraiodotironina (T 4 ); sono sintetizzate nei follicoli tiroidei, e sono ormoni lipofili con lunga emivita. Nel gruppo degli ormoni derivati dagli aminoacidi possono essere inclusi anche l ossido nitrico (N), la melatonina, la serotonina (5-HT) e l istamina. Le catecolamine, la serotonina e spesso l istamina vengono indicate collettivamente come "amine biogene" [20]. 1 Si tratta probabilmente di una precisazione superflua, in quanto, come abbiamo già avuto modo di rilevare, è difficile, oltre che artificioso, separare nettamente il neurotrasmettitore dall ormone.
93 3 rmoni derivati da aminoacidi 84 Figura 3.1: La ghiandola surrenale (in rosso) incappuccia il polo superiore di ciascun rene. La surrenale di destra è tradizionalmente descritta come a forma di "cappello frigio". Probabilmente per alcune persone è più familiare se descritta come a forma di "cappello dei puffi" :) 3.2 rmoni della zona midollare della ghiandola surrenale Dove siamo? Surrene Le ghiandole surrenali (vedi figura 3.1) sono piccole strutture di forma piramidale che incappucciano il polo superiore di ciascun rene. Funzionalmente ed anatomicamente possono essere suddivise in una regione corticale (esterna) ed una midollare (interna). Zona corticale: conferisce alle surrenali un colore giallastro a causa della grande presenza lipidica; questa zona infatti sintetizza ormoni steroidei. Procedendo dall esterno verso l interno è suddivisibile in tre zone: 1. zona glomerulare, 2. zona fascicolata 3. zona reticolata. Zona midollare: popolata da cellule cromaffini, che secernono catecolamine.
94 3 rmoni derivati da aminoacidi 85 CH 2 CH 2 NH 2 Catecolo Dopamina H C H C H N H CH 3 H H C C NH 2 H Adrenalina Noradrenalina Figura 3.2: Le tre principali catecolamine (adrenalina, noradrenalina e dopamina) sono dotate di un nucleo catecolico a cui è legato un gruppo aminico Catecolamine Struttura Il nome di "catecol-amine" rispecchia piuttosto bene la struttura di questi composti, che sono dotati di un nucleo catecolico (cioè un anello benzenico diidrossilato in posizione 1 e 2) a cui è legato un gruppo aminico (vedi figura 3.2, pag. 85). Sede di elaborazione La noradrenalina è il principale neurotrasmettitore sintetizzato dai neuroni postgangliari del sistema simpatico e alcuni neuroni del SNC [5]. 2 L adrenalina è il principale ormone secreto dalla zona midollare della ghiandola surrenale (ammonta a circa l 80% delle catecolamine della midollare del surrene; il restante 20% è rappresentato da noradrenalina). Le cellule cromaffini sintetizzano anche altre molecole (encefaline, cromoganina, adrenomedullina) che non prenderemo in considerazione. 3 L adrenalina viene anche sintetizzata da alcune popolazioni neuronali del sistema nervoso centrale [21, 24]. La dopamina è un neurotrasmettitore utilizzato da alcune popolazioni neuronali del sistema nervoso centrale. Questi neuroni vanno a costituire le cosiddette "vie dopaminergiche". 4 2 In particolare, i neuroni del locus ceruleus [20]. 3 Inoltre, la corteccia della ghiandola surrenale sintetizza ormoni steroidei, come avremo modo di vedere (vedi sezione "Corticosteroidi: mineralcorticoidi e glucocorticoidi", pag. 142). 4 Le principali vie dopaminergiche sono la via nigrostriatale, la via mesocorticale e la via tuberoinfundibolare [5].
95 3 rmoni derivati da aminoacidi 86 Biosintesi Le catecolamine vengono sintetizzate con la stessa sequenza di reazioni (Fig. 3.3, pag. 87.). Questa via è comune a tutte le catecolamine, ma una cellula può non esprimere tutti gli enzimi, il che determina quali catecolamine la cellula è in grado di produrre. Ad esempio, i neuroni postgangliari del sistema simpatico non esprimono l ultimo enzima della via biosintetica, la fenoletanolammina-n-metiltransferasi (PNMT, di cui parleremo tra poco), che consentirebbe la conversione della noradrenalina in adrenalina; quindi la sintesi, non potendo proseguire, si ferma con la noradrenalina. Le cellule cromaffini della midollare del surrene esprimono la PNMT, quindi la noradrenalina può essere convertita in adrenalina con l ultima reazione della via. Il precursore diretto per le catecolamine è l aminoacido L-tirosina. Le cellule si procurano questo aminoacido precursore: Dall ambiente extracellulare, con meccanismi di trasporto attivo; A partire dalla fenilalanina. La conversione è effettuata dall enzima fenilalanina idrossilasi, una monossigenasi. La fenilalanina è un aminoacido essenziale. La tirosina viene convertita in adrenalina tramite quattro reazioni a sede citosolica: 1. Tirosina idrossilasi. L enzima coinvolto è una ossigenasi che utilizza 2 per idrossilare la tirosina a livello dell anello benzenico, convertendola in L-3,4- diidrossifenilalanina (L-DPA). L enzima necessita di tetraidrobiopterina come cofattore; durante la reazione la tetraidrobiopterina viene ossidata a diidrobiopterina. 5 Questa è la reazione limitante la velocità, e di conseguenza l enzima rappresenta un punto di regolazione. 2. DPA decarbossilasi (sinonimi: aminoacido aromatico decarbossilasi). L enzima che catalizza questo secondo passaggio decarbossila la L-DPA a dopamina, utilizzando piridossal fosfato come cofattore. Come succede per ogni decarbossilazione, la C 2 diffonde facilmente e si allontana dall ambiente di reazione, spingendo l equilibrio verso i prodotti per il principio di azione di massa. Per i neuroni dopaminergici del sistema nervoso centrale la via si ferma qui. Questi neuroni rilasciano direttamente dopamina (sono i neuroni delle vie dopaminergiche di cui sopra). 3. Dopamina β idrossilasi. L enzima coinvolto è una monossigenasi a rame che utilizza come cofattore acido ascorbico e 2 per idrossilare la dopamina e produrre noradrenalina. È interessante notare come questo enzima sia stato ritrovato nella frazione particolata delle cellule impegnate nella sintesi di adrenalina. In altre 5 In particolare, la reazione catalizzata dalla tirosina idrossilasi produce 4-H-tetraidrobiopterina, che si disidrata spontaneamente o enzimaticamente a diidrobiopterina. Il cofattore viene riciclato grazie all enzima diidropteridina reduttasi (NADH dipendente), che rigenera tetraidrobiopterina.
96 3 rmoni derivati da aminoacidi 87 CH 2 CH CH H 2 N L-Tirosina Tetraidrobiopterina + 2 Tirosina idrossilasi Diidrobiopterina CH 2 CH H 2 N CH L-DPA DPA decarbossilasi Piridossal fosfato C 2 CH 2 CH 2 NH 2 Dopamina Acido ascorbico + 2 Dopamina β idrossilasi Acido deidroascorbico HC CH 2 NH 2 Noradrenalina S-adenosil-metionina Feniletanolammina N-metiltransferasi S-adenosil-omocisteina HC CH 2 NH CH 3 Adrenalina Figura 3.3: Per le spiegazioni delle singole reazioni si rimanda al testo.
97 3 rmoni derivati da aminoacidi 88 parole, si pensa che sia incorporato all interno dei granuli secretori, associato alla membrana, e che l enzima venga secreto insieme alle catecolamine. Per quanto esistano sistemi di recupero dell enzima, le cellule devono comunque tradurlo in continuazione. La singolare localizzazione dell enzima implica che la conversione della dopamina a noradrenalina avvenga all interno dei granuli secretori. La dopamina, che viene prodotta nel citosol, viene concentrata nelle vescicole secretorie con trasporto attivo. 4. Fenoletanolammina-N-metiltransferasi (PNMT). L ultima reazione prevede la N-metilazione della noradrenalina ad adrenalina; il donatore del metile è la S-adenosilmetionina. La transmetilasi che catalizza questa tappa è idrosolubile, e si ritiene si trovi nel citoplasma: la noradrenalina esce quindi dai granuli con trasporto passivo, viene convertita in adrenalina, e viene reimmessa nei granuli con un trasporto attivo ATP-dipendente; in questo processo sono coinvolti trasportatori monoaminici delle vescicole. L attività di PNMT è regolata da un imponente flusso di steroidi surrenalici, che giungono alle cellule della zona midollare attraverso il sistema di sinusoidi che mette in comunicazione le due zone. Si invita il lettore a prestare attenzione al fatto che ogni enzima di questa via utilizza un cofattore diverso. Secrezione e regolazione Abbiamo un sistema di regolazione a livello della biosintesi, un sistema di regolazione a livello della secrezione, e un sistema a livello recettoriale. Il principale sito di regolazione della biosintesi è rappresentato dall enzima tirosina idrossilasi. I sistemi di regolazione sono essenzialmente tre: una regolazione a feedback negativo da parte dei prodotti finali, la più importante; regolazione positiva dal camp; regolazione positiva da parte di stimoli nervosi. Le catecolamine, una volta sintetizzate secondo questo processo, vengono accumulate in granuli secretori, il cui rilascio è ovviamente controllato. Le cellule cromaffini rilasciano tre tipi di granuli: granuli contenenti adrenalina; granuli contenenti noradrenalina; granuli contenenti adrenalina e noradrenalina.
98 3 rmoni derivati da aminoacidi 89 Questi granuli vengono secreti per esocitosi. Il segnale che induce il rilascio delle vescicole da parte delle cellule cromaffini della midollare surrenale è impartito da fibre nervose di neuroni pregangliari simpatici (nervo splancnico), che rilasciano acetilcolina. Legandosi a recettori sulle cellule cromaffini, si innesca una depolarizzazione della cellula che porta all aumento di concentrazione di Ca 2+. L aumento delle concentrazioni di Ca 2+ plasmatico provoca l esocitosi dei granuli. La secrezione di catecolamine è una risposta allo stress in senso lato: può essere innescata da una ferita, una emorragia, paura, etc. Il processo è simile anche per i neuroni che secernono noradrenalina o dopamina; il segnale è impartito da impulsi nervosi che, propagandosi lungo l assone fino alle sinapsi, depolarizzano la cellula innescando l ingresso di Ca 2+ e quindi l esocitosi. Una parte della regolazione degli effetti delle catecolamine avviene a livello dei recettori. Si può avere una regolazione negativa ed una regolazione positiva. La regolazione negativa corrisponde al processo di desensibilizzazione recettoriale: quando i recettori delle catecolamine vengono esposti in modo persistente e prolungato all azione di una sostanza che li attiva (catecolamine o farmaci), subentrano dei fenomeni per cui la durata e l efficacia della risposta sono progressivamente ridotte. La regione C-terminale intracellulare dei β recettori presenta dei siti di fosforilazione che sono fondamentali per questo processo di desensibilizzazione: il fenomeno è mediato dalla fosforilazione del recettore, che viene legato da una proteina inibitoria detta β-arrestina; agisce impedendo al recettore di attivare Gs. In altri casi, si ha l internalizzazione dei recettori, o la inibizione della loro espressione genica. La regolazione positiva invece corrisponde ad un incremento della espressione di questi recettori; è indotto, per esempio, dagli ormoni tiroidei e dai glucocorticoidi Trasporto nel plasma e degradazione I neuroni che utilizzano le catecolammine come neurotrasmettitori rilasciano le molecole nello spazio sinaptico, quindi localmente dopo essersi legate ai loro recettori vengono per lo più ricaptate (cioè riassorbite) dal neurone che le ha rilasciate, anche se una piccola parte sfugge e passa in circolo [10]. Le cellule della midollare surrenale invece rilasciano le catecolammine sintetizzate nella circolazione plasmatica, con valenza di ormoni endocrini. Nel plasma, le catecolamine hanno un emivita estremamente breve (nell ordine delle decine di secondi). Una frazione delle catecolamine che rappresenta circa la metà del totale circola associata all albumina.
99 3 rmoni derivati da aminoacidi 90 H H C C NH 2 H C H C N H H H CH 3 Noradrenalina Adrenalina CMT MA MA CMT AR AR CH 3 H C H C NH 2 H C H C H CH 3 H C H C N H H H H CH 3 Normetanefrina DPEG Metanefrina MA CMT MA PST PST ADH ADH ADH CH 3 S 4 H C H C NH 2 H Normetanefrina solfato CH 3 H C VMA C H CH 3 H H H S 4 C C N H CH 3 Metanefrina solfato Urine Figura 3.4: Schema semplificato dei pathway che portano alla degradazione delle catecolamine. DPEG: 3,4-diidrossi-fenilglicole (sinonimi: DHPG); VMA: acido 3-metossi-4-idrossi-mandelico (sinonimi: acido vanillil mandelico); CMT: catecol--metiltransferasi; MA: monoaminoossidasi; ADH: Aldeide deidrogenasi; AR: aldeide reduttasi; PST: fenol sulfotransferasi. La degradazione delle catecolamine non è semplice. In figura 3.4 (pag. 90) ne viene presentato uno schema semplificato. 6 Le reazioni avvengono in parte nei siti stessi dove le catecolamine sono sintetizzate, in parte nei tessuti bersaglio, ma soprattutto nel fegato, ad opera di due enzimi: la catecol--metiltransferasi (CMT) e la monoamina ossidasi (MA). catecol--metiltransferasi (CMT). Catalizza una reazione di -metilazione; il donatore di metili è la S-adenosilmetionina. monoamina ossidasi (MA). Catalizza una reazione di deaminazione ossidativa, ed ha come suoi principali substrati metanefrina, normetanefrina, adrenalina o noradrenalina. 6 Chi ha i nervi saldi può dare un occhiata alla figura 3.5 a pag. 91 che non risparmia i dettagli più cruenti...
100 3 rmoni derivati da aminoacidi 91 H H C C NH 2 H C H C N H H H CH 3 Noradrenalina Adrenalina CMT MA MA CMT CH 3 H C Normetanefrina H C NH 2 H H C DPGAL C H CH 3 H H C C H Metanefrina N H CH 3 AR ADH H H H C C H C C H H DPEG DMA CMT CH 3 H H C C H H MPEG ADH CMT MA CH 3 H C C H MA MPGAL PST ADH PST CH 3 H C C H CH 3 S 4 H H C C NH 2 VMA CH 3 S 4 H C H C N H H H CH 3 Normetanefrina solfato Metanefrina solfato Urine Figura 3.5: Schema dei pathway che portano alla degradazione delle catecolamine. DP- GAL: 3,4-diidrossi-fenilglicolaldeide (sinonimi: 3,4-diidrossi-mandelaldeide); DMA: acido 3,4- diidrossi-mandelico; DPEG: 3,4-diidrossi-fenilglicole (sinonimi: DHPG); MPEG: 3-metossi-4- idrossi-feniletilenglicole; MPGAL: 3-metossi-4-idrossifenilglicolaldeide; VMA: acido 3-metossi-4- idrossi-mandelico (sinonimi: acido vanillil mandelico); CMT: catecol--metiltransferasi; MA: monoaminoossidasi; ADH: Aldeide deidrogenasi; AR: aldeide reduttasi; PST: fenol sulfotransferasi.
101 3 rmoni derivati da aminoacidi 92 Questi due enzimi entrano in gioco in diverse tappe delle vie degradative. La sequenza esatta di reazioni è in parte tessuto-specifica (vedi dopo). Adrenalina e noradrenalina possono essere deaminate ossidativamente (MA) a un intermedio a breve emivita, che viene metabolizzato a composti alcolici o acidi più stabili. Per lo più viene prodotto DPEG(3,4-diidrossi-fenilglicole). Queste reazioni avvengono già nei siti di produzione delle catecolamine (neuroni del simpatico, midollare del surrene), e la DPEG poi passa in circolo. Raggiunge il fegato e altri tessuti e qui proseguono le reazioni. Questa molecola diviene substrato delle CMT e viene convertita in una aldeide instabile, che successivamente, con l intervento dell aldeide deidrogenasi che nel processo riduce NAD + a NADH, porta alla formazione di acido vanillilmandelico (VMA), il principale prodotto dei pathway degradativi delle catecolamine. Viene poi escreto con le urine. Una parte del DPEG (non mostrato in figura) può essere coniugata a solfato ed escreta in questa forma. Adrenalina e noradrenalina possono essere metilate dalla CMT rispettivamente a metanefrina e normetanefrina. Successivamente: possono essere coniugate da solfatasi a metanefrina e normetanefrina solfato, e poi escrete con le urine; possono essere metabolizzate a VMA con l intervento delle MA e dell aldeide deidrogenasi. La cosa più importante da ricordare è che esistono diversi possibili pathway che convergono su VMA e metanefrine, che sono i principali prodotti che si ritrovano nelle urine. La sequenza preferenziale di tappe metaboliche con cui questi metaboliti sono prodotti è diversa a seconda del sito di produzione [10]: Catecolamine prodotte nella midollare del surrene: una parte delle catecolamine prodotte sono metabolizzate a metanefrine già nelle cellule midollari. Le metanefrine poi passano in circolo; Catecolamine prodotti dai neuroni del simpatico: Il 10% delle catecolamine rilasciate nel terminale sinaptico passa in circolo; la restante parte viene ricaptata (riassorbita) dal terminale sinaptico e metabolizzata a DPEG. Il DPEG passa in circolo, raggiunge il fegato e altri tessuti e viene convertito in VMA che viene escreto con le urine; oppure viene coniugato a solfato ed escreto con le urine. Le catecolamine rilasciate in circolo (sia quelle sfuggite dalle sinapsi che quelle rilasciate in circolo come ormoni endocrini dalla midollare surrenale) vengono
102 3 rmoni derivati da aminoacidi 93 CH 2 CH 2 NH 2 Dopamina MA CMT H 3 C CH 2 CH CH 2 CH 2 NH 2 DPAC CMT MA ADH 3-Metossitiramina H 3 C CH 2 CH HVA Figura 3.6: Schema delle reazioni degradative della dopamina. DPAC: acido 3,4- diidrossifenilacetico; HVA: acido omovanillico; CMT: catecol--metiltransferasi; MA: monoaminoossidasi; ADH: Aldeide deidrogenasi. per la maggior parte convertite in DPEG e poi in VMA che viene escreto con le urine. Una minor parte è convertita in metanefrine da una forma circolante di CMT, che però è poco attiva. Le metanefrine in circolo (rilasciate dalla midollare surrenale o prodotte dalle catecolamine) vengono soprattutto coniugate con gruppi solfato e poi escrete con le urine. La dopamina produce, con reazioni simili, acido omovanillico, HVA (fig. 3.6). La sua degradazione avviene principalmente nei neuroni, attraverso le MA, producendo DPAC e poi acido omovanillico. Il DPAC e l HVA sono poi escreti con le urine. Recettori ed effetti fisiologici La risposta biologica evocata dalle catecolamine è mediata da recettori accoppiati a proteine G. La trasduzione del segnale di adrenalina e noradrenalina (e la risultante azione fisiologica) è sicuramente tra le più complesse che vedremo, poiché esistono diversi recettori, che in alcuni casi mediano effetti opposti, e che sono espressi in maniera tessuto-specifica. Si distinguono innanzi tutto:
103 3 rmoni derivati da aminoacidi 94 Recettori adrenergici: vi si legano tendenzialmente epinefrina e norepinefrina; sono espressi in moltissimi tessuti, tra cui miocardio, tessuto muscolare striato scheletrico e liscio (in specie nel tratto digerente), fegato, tessuto adiposo, tessuto nervoso, rene. È opportuno ricordare che le catecolamine rilasciate dalla midollare del surrene hanno una valenza endocrina, e non agiscono a livello encefalico (a causa della barriera emato-encefalica); viceversa, le catecolamine rilasciate a livello encefalico hanno valenza di neurotrasmettitori. recettori dopaminergici: vi si lega tendenzialmente la dopamina; sono espressi a livello encefalico e da alcuni tessuti periferici. I recettori adrenergici sono ulteriormente suddivisi sulla base del tipo di subunità della proteina G che presentano e della capacità di legare alcune molecole agoniste e antagoniste in diversi tipi e sottotipi. 7 recettori α recettori α 1 ; recettori α 2 ; recettori β recettori β 1 ; recettori β 2 ; recettori β 3. Gli effetti che mediano sono eterogenei, talora ridondanti e talora contrastanti, ma si può vedere negli effetti scatenati dalla secrezione di catecolamine un significato biologico: in generale siamo in presenza di effetti che hanno la funzione di predisporre l organismo al combattimento, o, in alternativa, a fuggire il più velocemente possibile (reazioni "fight or flight"). Si può cioè pensare che questi ormoni abbiano il ruolo di preparare l organismo ad affrontare situazioni di "emergenza", inducendo uno stato di allerta, predisponendo a prestazioni psicofisiche intense e mobilizzando riserve a livello di fegato e tessuto adiposo, per assicurare la disponibilità di substrati energetici rapidamente utilizzabili. 7 Nell ambito dei recettori α 1 e α 2, grazie allo sviluppo della biologia molecolare, sono stati riconosciuti ulteriori sottotipi ( α 1A, α 1B, α 1D e α 2A, α 2B, α 2C ) tuttavia non ne parleremo molto. Chi fosse interessato può consultare un testo di farmacologia, per esempio: L. Brunton, B. Chabner e B. Knollman. Goodman and Gilman s The Pharmacological Basis of Therapeutics. Twelfth Edition. McGraw-Hill, 2010.
104 3 rmoni derivati da aminoacidi 95 Recettori Potenza relativa dell agonista Proteine G α 1 Noradrenalina > adrenalina G α q α 2 Noradrenalina adrenalina G α i o G0 β 1 Adrenalina noradrenalina G αs β 2 Adrenalina >>> noradrenalina G αs β 3 Noradrenalina > adrenalina G αs Tabella 3.1: Affinità dei recettori adrenergici per adrenalina e noradrenalina. Alcuni tra questi recettori mediano effetti opposti, pur essendo espressi nello stesso tessuto. La presenza dei recettori con effetti opposti serve per modulare la risposta biologica, in base (1) all affinità del singolo ormone per i diversi recettori (tabella 3.1) e (2) alla quantità di recettori presenti in un dato tessuto. Per esempio, i recettori α 1 (che provocano vasocostrizione) hanno più affinità per la noradrenalina che per l adrenalina, mentre per i recettori β 2 (che provocano vasodilatazione) è vero il contrario: sono più affini per l adrenalina che per la noradrenalina. Quindi, quando l adrenalina è secreta nel circolo sanguigno in basse concentrazioni, si legherà preferenzialmente ai β 2 e non agli α 1, e quindi prevarrà la vasodilatazione (infatti l adrenalina in basse concentrazioni provoca vasodilatazione, con un lieve abbassamento della pressione arteriosa). Tuttavia, quando l adrenalina è presente in alte concentrazioni, si lega anche agli α 1, che essendo più numerosi, vedono il loro effetto prevalere (vasocostrizione). Un terzo fattore che contribuisce alla modulazione della risposta biologica (oggettivamente complessa) è la diversa proporzione di catecolamine nel sangue: la noradrenalina costituisce circa il 10% delle catecolamina secrete nel sangue dalla midollare nel surrene. Tutti i recettori adrenergici sono GPCR, recettori accoppiati a proteine G eterotrimeriche. Ciascun sottotipo è connesso preferenzialmente a una classe di G proteine. Strutturalmente, i varii recettori sono relativamente simili tra loro (tra i recettori α e β c è il 30-40% di omologia di sequenza). Nell elenco qui di seguito prenderemo in esame i loro effetti principali tenendo presente che non sono gli unici. Recettori α 1 adrenergici presentano subunità G α q. Attivano la fosfolipasi C, sfruttando il pathway DAG-PKC-IP 3 -Ca 2+. Attivano anche la fosfolipasi A 2, e modulano alcuni trasportatori ionici (es. canali del K +, scambiatori Na + /H +, pompe del Ca probabilmente attraverso la fosforilazione da parte della PKC) [5]. Presentano maggiore affinità per la noradrenalina rispetto alla adrenalina. Si ammette l esistenza di almeno tre sottotipi di recettori α 1 ( α 1A, α 1B e α 1D ), con
105 3 rmoni derivati da aminoacidi 96 alcune differenze nella distribuzione tissutale. 8 Sono espressi soprattutto da muscolatura liscia, dalle cellule epatiche e dalle cellule cardiache. Quando vi si lega un agonista innescano: la contrazione del muscolo liscio a livello di vasi (vasocostrizione) e bronchi, e in tutto il tratto genito-urinario: sono i recettori in gran parte responsabili della contrazione della muscolatura liscia a seguito di una stimolazione simpatica. Questo può essere spiegato dall aumento di concentrazione del Ca 2+ intracellulare, che, attivando proteine calcio-dipendenti (su tutte, la chinasi delle catene leggere della miosina calmodulina-dipendente), avviano la contrazione muscolare; rilasciamento muscolare a livello del muscolo liscio del tratto gastrointestinale [25]; 9 dilatazione della pupilla (midriasi); 10 Nel fegato mediano un aumento della glicogenolisi e della gluconeogenesi, che rende disponibile glucosio [41, 9]; promuovono la crescita delle cellule cardiache e influenzano la struttura del miocardio. Recettori α 2 adrenergici Sono caratterizzati da una subunità G αi o G0. Possono attivare diversi pathway: tendenzialmente mediano l inattivazione della adenilato ciclasi, e quindi un decremento della concentrazione intracellulare di camp con inattivazione della PKA. Possono anche attivare o inibire diversi canali ionici, nonché la via delle MAPK, ma il significato fisiologico di questi pathway non è chiaro. Hanno maggiore affinità per la noradrenalina. Sono espressi soprattutto dai neuroni (in particolare, neuroni facenti parte del sistema simpatico, dove si trovano a livello presinaptico), dalla muscolatura liscia del tratto gastrointestinale e dei vasi, dalle cellule β del pancreas, dagli adipociti e dalle piastrine. Provocano: 8 Per esempio, nel miocardio sono espressi prevalentemente gli α 1A e α 1B, mentre gli α 1D sono espressi dalle cellule delle arterie coronariche) [17, 18]. 9 Forse provocata da una iperpolarizzazione della cellula, innescata dall attivazione di canali del K + Ca 2+ dipendenti. 10 In questo modo la funzione visiva è permessa anche in condizioni di scarsa luminosità.
106 3 rmoni derivati da aminoacidi 97 rilassamento della muscolatura del tratto gastrointestinale (tranne che a livello degli sfinteri), con una maggiore potenza rispetto ai recettori α 1 [25, 6]; vasocostrizione a livello della muscolatura liscia dei vasi; inibizione della lipolisi nel tessuto adiposo; inibizione della secrezione di insulina pancreatica; incremento dell aggregazione piastrinica; induzione del rilascio di glucagone [14]; influenzano il rilascio di neurotrasmettitori. Sembrano inibire il rilascio di noradrenalina, riducendo quindi il tono simpatico un meccanismo di feedback negativo. Recettori β 1 adrenergici Sfruttano una subunità G αs. Il pathway che viene attivato dunque è quello della stimolazione della adenilato ciclasi, con aumento di camp intracellulare e attivazione della PKA, che fosforila molte proteine intracellulari. Questi recettori sono espressi in particolare a livello miocardico, ma anche da adipociti, rene, muscolo scheletrico, neuroni del sistema nervoso centrale. Sembrano avere una affinità simile per adrenalina e noradrenalina. Promuovono i seguenti effetti: incremento della forza e della frequenza di contrazione cardiaca; incremento della velocità di conduzione cardiaca; incremento della velocità di rilassamento. 11 Questo effetto è molto importante: vediamo come avviene [3]. L aumento della concentrazione di camp attiva la PKA, che fosforila una proteina sarcolemmale chiamata p27. Questo porta ad un aumentato ingresso di calcio attraverso i canali del calcio voltage-gated di tipo L; a sua volta questo porta a un incremento del rilascio di calcio dai recettori della rianodina a livello del reticolo sarcoplasmatico, che vengono inoltre fosforilati (calcium-induced calcium release). Dunque la concentrazione di calcio intracitoplasmatica raggiunge un picco più elevato e sale più rapidamente. Questo consente un maggior numero di interazioni calcio-troponina C, che inducono un maggior numero di molecole di tropomiosina a cambiare 11 In fisiologia cardiovascolare, si parla di inotropismo quando ci si riferisce alla forza di contrazione cardiaca, cronotropismo quando si parla della frequenza di contrazione, dromotropismo per la velocità di conduzione, e lusitropismo quando si parla della velocità di rilasciamento. Quindi gli effetti dei recettori β 1 possono essere descritti anche come effetto inotropo positivo, cronotropo positivo, dromotropo positivo e lusitropo positivo.
107 3 rmoni derivati da aminoacidi 98 conformazione e diventare permissive per l interazione di actina e miosina. Questo si traduce in un maggior numero di cross bridge, ed è il corrispettivo molecolare dell effetto inotropo positivo. L effetto cronotropo positivo è mediato dall aumento di velocità della depolarizzazione spontanea delle cellule del nodo del seno, che raggiungono più rapidamente la soglia per l inizio del potenziale d azione. L effetto lusitropo (aumento della velocità di rilassamento) è mediato dalla fosforilazione (da parte della PKA) del fosfolambano e della troponina I. stimolazione della lipolisi a livello del tessuto adiposo; questo effetto è dovuto alla fosforilazione delle perilipine, che espongono la goccia lipidica, e fosforilazione della lipasi, che incrementa la propria attività. incremento del rilascio di renina, che attiva il sistema renina angiotensina. Il sistema renina-angiotensina è un sistema omeostatico che contribuisce a regolare la pressione sanguigna. La renina è in grado di tagliare l angiotensinogeno, prodotto dal fegato, e convertirlo in angiotensina I, che viene ulteriormente processata ad angiotensina II. Quest ultima molecola concerta la modulazione di un gran numero di processi fisiologici, che hanno come risultato ultimo l incremento della pressione sanguigna. incremento della velocità di conduzione nervosa nei neuroni [10]. Recettori β 2 adrenergici Come gli altri recettori β sono dotati di una subunità G αs. Presentano una spiccata affinità per l adrenalina. Sono espressi a livello della muscolatura liscia dei bronchi e del tratto gastrointestinale, nonché dei vasi; si trovano anche nel fegato, in alcune aree cerebrali, e nelle cellule di cuore, rene, muscolatura scheletrica. Mediano: Rilassamento della muscolatura liscia (con vaso- e broncodilatazione, rilassamento della muscolatura gastrointestinale, etc.) sono i principali recettori coinvolti nel miorilassamento a livello di questi distretti. Sono responsabili di vasodilatazione delle arteriole della muscolatura scheletrica, dell arteria epatica e delle coronarie [10]. Stimolazione della glicogenolisi associata ad inibizione della glicogenosintesi nel muscolo scheletrico; Induzione della gluconeogenesi e della glicogenolisi nel fegato, con inibizione di glicogenosintesi e glicolisi [7].
108 3 rmoni derivati da aminoacidi 99 Recettori β 3 Sfruttano lo stesso pathway degli altri β recettori (subunità G αs). Sono espressi principalmente a livello del tessuto adiposo, del muscolo scheletrico, del cuore, e in minor misura altri tessuti (es. tratto gastrointestinale). regolano la termogenesi nel muscolo scheletrico; incrementano la lipolisi nel tessuto adiposo. Cerchiamo di ricapitolare l espressione di questi recettori a livello dei varii tessuti: Miocardio: esprime prevalentemente recettori β 1, che ne stimolano la forza, la frequenza di contrazione e la velocità di conduzione; c è anche una popolazione di altri recettori (es. β 2 ) ma sono meno importanti. Muscolatura liscia di vasi: questo tessuto esprime prevalentemente recettori α 1 ; i recettori α 2 e β 2 sono espressi soprattutto sui vasi dei muscoli scheletrici e delle coronarie. In caso di attivazione degli α 1, abbiamo vasocostrizione (con conseguente effetto ipertensivo); nel caso degli α 2 e dei β 2, vasodilatazione (che porta ad un aumento di irrorazione sanguigna). Muscolatura liscia del tratto gastrointestinale: esprime α 1, α 2 e β 2, che quando attivati provocano rilasciamento della muscolatura. Questo fa sì che la digestione si arresti temporaneamente; la funzione di questo effetto fisiologico è quella di impedire l utilizzo di risorse metaboliche in processi che non sono essenziali (o quantomeno, non essenziali di fronte ad un pericolo mortale). Notare che gli sfinteri esprimono recettori α 1, che in queste strutture portano a contrazione. Muscolatura liscia dei bronchi: esprime soprattutto il recettore β 2, che porta a rilasciamento muscolare (broncodilatazione). Fegato: Gli epatociti espongono sulle loro membrane soprattutto i recettori α 1 e β 2, che in questo tessuto determinano principalmente effetti sul metabolismo glucidico. In particolare, inibiscono la sintesi del glicogeno (inibendo la glicogeno sintasi) e ne promuovono la degradazione per rilasciare glucosio (attivando la glicogeno fosforilasi). Inibiscono anche la glicolisi e stimolano la gluconeogenesi. Il perché l evoluzione abbia selezionato questo effetto è intuitivo: in momenti di pericolo, cioè quando si deve essere pronti a fuggire oppure combattere, il glucosio deve essere disponibile. L adrenalina influenza anche il metabolismo lipidico, agendo (come l altro principale ormone catabolico, il glucagone) tramite la fosforilazione di diversi enzimi chiave. Tra questi, la acetil-coa carbossilasi (che viene inibita, arrestando la sintesi degli acidi grassi). Rene: in questo organo si osserva una espressione prevalente del recettore β 1, attraverso il quale lo stimolo ormonale induce secrezione di renina. Attraverso
109 3 rmoni derivati da aminoacidi 100 una serie di reazioni che complessivamente sono parte del cosiddetto "sistema renina-angiotensina", viene attivata l angiotensina II. Questo è di fatto un ormone che produce una serie di effetti volti ad incrementare la pressione sanguigna. Tratto genitourinario: esprime recettori α 2 (stimolano la contrazione di uretra e vescica) e β 2 (provocano il rilassamento della vescica). Tessuto adiposo: viene espresso soprattutto il recettore β 3, che quando attivato dal legame con l ormone media segnali intracellulari che culminano nella attivazione della lipolisi. Esprime anche gli α 1, i β 1 ed i β 2 (che incrementano la lipolisi) e gli α 2 (che la inibiscono). cchio: esprime recettori α 1, che portano a dilatazione pupillare (midriasi). Per quanto riguarda i recettori della dopamina, attualmente se ne conoscono 5 (D 1, D 2, D 3, D 4, D 5 ); sono solitamente suddivisi in due gruppi sulla base di affinità nella sequenza aminoacidica e delle loro proprietà farmacologiche: D 1 -like D 1 ; D 5 ; D 2 -like D 2 ; D 3 ; D 4. Sono tutti GPCR, ma i D 1 -like attivano proteine G S (aumento dell camp), mentre i D 2 -like attivano proteine G I/ e varii sistemi segnalatori (portano ad una diminuzione del camp e alla modulazione di diversi canali ionici). Sono espressi nel sistema nervoso centrale e in alcuni tessuti periferici (cuore e vasi, rene, retina). Non parleremo delle loro funzioni e della loro distribuzione nell SNC, che sono molto complesse. 12 Tra gli effetti più importanti della dopamina al di fuori del sistema nervoso centrale: modula la perfusione e la funzione renale; incrementa la secrezione di renina (attivazione del sistema renina-angiotensina!) modula la secrezione di catecolamine dalla midollare surrenale; 12 Chi fosse interessato può consultare un testo di neurofisiologia. Un classico è E. Kandel et al. Principles of Neural Science. Fifth Edition. McGraw-Hill, 2012.
110 3 rmoni derivati da aminoacidi 101 è il principale regolatore della secrezione di prolattina, attraverso recettori D 2 espressi dalle cellule lattotrope. Viene secreto dall ipotalamo, e inibisce tonicamente il rilascio di questo ormone. Ad alte concentrazioni, la dopamina è in grado di attivare i recettori β e α adrenergici. Nel sistema nervoso centrale, la dopamina è coinvolta nella regolazione del movimento, nella generazione della sensazione di gratificazione, e in alcune funzioni cognitive. Si ritiene coinvolta nella genesi di diverse patologie neurologiche e psichiatriche come il morbo di Parkinson, la schizofrenia, la dipendenza da sostanze. Correlazioni cliniche: Feocromocitoma Il feocromocitoma è un tumore delle cellule cromaffini della midollare del surrene (può insorgere anche dalle cellule dei paragangli del sistema simpatico, e in tal caso viene chiamato paraganglioma). Il feocromocitoma può produrre e rilasciare in circolo catecolammine, di solito in maniera episodica. Questo può portare a una sintomatologia molto varia che richiama ad una iperattività del simpatico: da una ipertensione costante e resistente alle terapie a crisi ipertensive episodiche; palpitazioni; irrequietezza; sudorazione; cefalea; insonnia; iperglicemia; può anche simulare degli attacchi di panico. 3.3 rmoni della tiroide Dove siamo? Tiroide La tiroide è una ghiandola situata nel collo (figura 3.7, pag. 102). Avvolge la parte anteriore della trachea, al di sotto della cartilagine tiroidea. È composta da due lobi uniti da una porzione ristretta detta istmo. Microscopicamente è composta da follicoli, formazioni sferoidali di cellule disposte a circondare una cavità follicolare, che può essere, a seconda del momento fisiologico, colma di una sostanza detta colloide. La tiroide può essere dunque immaginata come composta da tante piccole cisti. Le popolazioni cellulari essenzialmente sono:
111 3 rmoni derivati da aminoacidi 102 Figura 3.7: La tiroide è una ghiandola situata a livello del collo, composta da due lobi collegati da un istmo. Microscopicamente, è composta da piccole strutture grossolamente sferoidali (follicoli), contenenti un materiale PAS positivo noto come colloide. Le cellule follicolari delimitano il lume dei follicoli. Cellule follicolari: delimitano il lume dei follicoli, sono coinvolte nella sintesi della colloide e degli ormoni tiroidei; Cellule C: non sono in contatto con il lume dei follicoli, sono coinvolte nella sintesi di calcitonina. Altri citotipi: cellule endoteliali che delimitano i vasi, fibroblasti, adipociti, etc Triiodotironina e tetraiodotironina Struttura Gli ormoni tiroidei sono la triiodotironina (T 3 ) e la tetraiodotironina (T 4 ). Lipofili, derivano anch essi, come le catecolamine, dall aminoacido tirosina (o, indirettamente, dalla fenilalanina), e nella loro costituzione entra a far parte in maniera significativa lo iodio (Fig. 3.8, pag. 103). Sede di elaborazione Gli ormoni tiroidei vengono sintetizzati dalle cellule follicolari tiroidee (sinonimi: tireociti).
112 3 rmoni derivati da aminoacidi 103 H H I I I H I I I I CH 2 HC NH 2 CH CH 2 HC NH 2 CH CH 2 HC NH 2 CH Tirosina T 3 T 4 Figura 3.8: Struttura degli ormoni tiroidei; da notare le somiglianze con la struttura del loro precursore, l aminoacido tirosina. Biosintesi Per formare gli ormoni tiroidei i tireociti devono combinare due molecole di tirosina iodinate in posizioni particolari. Per le cellule follicolari dunque si presentano diverse necessità, peculiari rispetto ad altre cellule nel corpo umano: devono raccogliere e concentrare in gran quantità lo iodio, che è un elemento relativamente poco abbondante, se non raro in alcune parti del mondo; devono modificare la tirosina e iodinarla; devono complessare tra loro diverse tirosine modificate e iodate a formare i due ormoni tiroidei. Durante l evoluzione si è sviluppato un processo di sintesi piuttosto peculiare. Le cellule follicolari accumulano grandissime quantità di iodio; sintetizzano poi una proteina, la tiroglobulina, molto ricca di residui di tirosina, che viene sfruttata come un supporto o una impalcatura molecolare per effettuare le modifiche alla tirosina a livello del versante extracellulare della membrana plasmatica apicale 13 e successivamente l unione dei residui di tirosina modificati. Queste reazioni rappresentano i primi passaggi della biosintesi. Il processo viene interrotto, e la tiroglobulina rimane nelle cavità follicolari, conservata sotto forma di colloide; quando arriva lo stimolo per la secrezione, la colloide viene riassorbita, e la tiroglobulina ritorna ad essere il supporto molecolare dove si completano gli ultimi passaggi della biosintesi con i quali i due ormoni vengono liberati. La tiroglobulina deve essere degradata perché i due ormoni siano liberati. 13 Cioè il versante rivolto verso la cavità follicolare.
113 3 rmoni derivati da aminoacidi 104 L ormone TSH (Thyroid Stimulating Hormone) controlla sia la sintesi che il rilascio degli ormoni tiroidei; ne esamineremo l azione più avanti. La figura 3.12 (pag. 108) riassume la biosintesi nel suo complesso. Sarà più facile comprendere il procedimento biosintetico facendo riferimento allo schema. Abbiamo detto che l impalcatura molecolare a livello della quale avviene gran parte della biosintesi degli ormoni tiroidei è la tiroglobulina. Si tratta di una glicoproteina composta da due subunità, del peso molecolare di 660 kda; è formata da circa 5000 residui aminoacidi, di cui 115 sono costituiti da tirosina. Ciascuno di questi 115 residui è virtualmente nelle condizioni di essere iodinato. La tiroglobulina viene tradotta a livello della porzione basale delle cellule follicolari. Successivamente, passa attraverso RER e Golgi, dove subisce la glicosilazione (la componente carboidratica al termine delle modifiche post traduzionali rappresenta circa il 10% del peso molecolare della proteina). Racchiusa in vescicole che gemmano dal Golgi, viene esocitata a livello della porzione apicale delle cellule, cioè nel lume follicolare. È qui che avviene la iodinazione dei residui di tirosina. Da dove proviene lo iodio? Le cellule follicolari si sono specializzate nel concentrare al loro interno lo iodio: si stima che la concentrazione dello ione ioduro nel loro citoplasma sia volte maggiore della concentrazione plasmatica. 14 Lo iodio deriva: in parte dalla dieta: sale, alimenti marini, piante cresciute in terreni ricchi di iodio...; in parte dal riciclaggio dello iodio che le cellule non sono riuscite ad incorporare negli ormoni (questo processo sarà esaminato successivamente). Lo iodio esogeno viene concentrato nelle cellule con un sistema di trasporto attivo, sfruttando una pompa di trasporto Na + -K + ATP-dipendente, associata ad un simporto Na + -I - chiamato NIS. Questa proteina è espressa tipicamente dalle cellule tiroidee ed esposta a livello della membrana basolaterale. 15 Il meccanismo con cui si attua questo trasporto ( intrappolamento dello ioduro ) è il seguente: lo iodio entra nella cellula contro gradiente (lo iodio è più concentrato dentro la cellula che fuori), a livello della membrana basolaterale, insieme a due ioni Na + che invece si muovono secondo gradiente (il Na + è più concentrato nel liquido extracellulare che all interno della cellula). Il gradiente di sodio che sostiene il processo 14 Un fatto peraltro sfruttato per la valutazione della tiroide in medicina nucleare. È possibile visualizzane le alterazioni funzionali tramite un radioisotopo dello iodio, che viene concentrato esclusivamente nella ghiandola e può essere tracciato perché emette radiazioni. Si possono così mettere in evidenza regioni della ghiandola che non concentrano correttamente lo iodio o che viceversa lo concentrano eccessivamente. 15 Ma viene espresso anche da altri tessuti, a bassi livelli (placenta, ghiandole salivari, mammella).
114 3 rmoni derivati da aminoacidi 105 è mantenuto grazie alla Na + -K + ATP-dipendente. L espressione del gene di NIS è inibita dallo iodio e promossa dal TSH. Una volta nel citoplasma, lo iodio appena trasportato, insieme allo iodio riciclato, si sposta verso la membrana apicale, dove viene trasportato nel lume grazie ad un canale per lo iodio che aumenta la permeabilità della membrana per questo ione. Abbiamo quindi visto come lo ioduro sia stato trasportato nel lume del follicolo, dove sono presenti anche le tiroglobuline, con i loro residui di tirosina esposti. Può avvenire quindi l organicazione dello iodio. L organicazione dello iodio richiede la sua ossidazione, perché I - ha gli orbitali completi e non forma legami. La reazione è catalizzata dall enzima tireoperossidasi, una proteina tetramerica contenente un gruppo eme, localizzata a livello del versante extracellulare della membrana apicale delle cellule follicolari. Questo enzima ossida lo ioduro riducendo H 2 2 ad H 2. Il perossido di idrogeno necessario per questa reazione è fornito da una flavoproteina NADPH-dipendente. 16 Lo iodio ossidato viene legato al carbonio 3 oppure sia al carbonio 3 sia al carbonio 5 dell anello fenilico dei residui di tirosina, producendo rispettivamente 3-monoiodotirosina (MIT) o 3,5-diiodotirosina (DIT) (Fig. 3.9, pag. 106; fig. 3.10, pag. 106.). Lo stesso enzima tireoperossidasi è in grado di condensare tra loro MIT e DIT in due diverse combinazioni, a produrre triiodotironina (T 3 ) e tetraiodotironina (T 4 ) (Fig. 3.11, pag. 107). Tironina identifica il composto originatosi dalla unione di due molecole di tirosina. La reazione consiste nel trasferimento di gruppi monoiodofenolici o diiodofenolici, provenienti rispettivamente da una MIT o una DIT, sui gruppi monoe diiodofenolici di altri residui di MIT e DIT. Quindi, prima le tirosine vengono iodinate, e poi complessate insieme. Queste condensazioni possono avvenire tra MIT e DIT nell ambito della stessa tiroglobulina, o tra MIT e DIT di tiroglobuline vicine. Notare che sia T 3 che T 4 rimangono in questa fase covalentemente legati alla tireoglobulina. Non tutte le MIT e le DIT riescono ad essere condensate, cosìcché le tiroglobuline del lume follicolare, che costituiscono la colloide, tipicamente contengono MIT, DIT (il 70% circa delle tirosine è in una di queste due forme), T3 e T4 (30%). La tetraiodotironina è molto più abbondante della triiodotironina (il rapporto è di circa 7:1). Gli ormoni tiroidei sono conservati in questa forma fino a che non giunge lo stimolo del TSH ipofisario. A questo punto, le cellule follicolari riassorbono la colloide mediante endocitosi. Le vescicole così formatesi, contenenti tiroglobulina, si fondono all interno della cellula con lisosomi, le cui proteasi degradano la tiroglobulina nei suoi aminoacidi costituenti, e quindi rilasciando MIT, DIT, T 3 e T 4. Questi ultimi vengono 16 Questo è, peraltro, un esempio di una condizione fisiologica in cui per la cellula si rende necessario produrre RS.
115 3 rmoni derivati da aminoacidi 106 R CH 2 I I H R CH 2 H + I - + H H tireoperossidasi 3,5-diiodotirosina (DIT) R + H H Residuo di tirosina CH 2 H I 3-monoiodotirosina (MIT) Figura 3.9: Formazione di MIT e DIT. Lo ioduro viene ossidato e poi legato al carbonio 3 oppure sia al carbonio 3 sia al carbonio 5 dell anello fenilico dei residui di tirosina della tireoglobulina, producendo rispettivamente 3-monoiodotirosina (MIT) o 3,5-diiodotirosina (DIT). Questa reazione è extracellulare ed avviene a livello del versante apicale delle cellule follicolari tiroidee (cioè il lato che aggetta nel lume del follicolo). H H I I I CH 2 HC NH 2 CH CH 2 HC NH 2 CH 3-monoiodotirosina (MIT) 3,5-diiodotirosina (DIT) Figura 3.10: Struttura di MIT e DIT.
116 3 rmoni derivati da aminoacidi 107 NH NH NH NH CH 2 CH 3 H I I H 3-monoiodotirosina (MIT) + I H I + I I tireoperossidasi NH CH 2 NH CH 2 NH NH 3,5-diiodotirosina (DIT) Triiodotirosina (T ) 3 Figura 3.11: Fusione di MIT e DIT. La reazione consiste nel trasferimento di gruppi monoiodofenolici o diiodofenolici, provenienti rispettivamente da una MIT o una DIT, sui gruppi mono- e diiodofenolici di altri residui di MIT e DIT. Questa reazione, che forma T 3 e T 4, è extracellulare ed avviene a livello del versante apicale delle cellule follicolari tiroidee (cioè il lato che aggetta nel lume del follicolo). secreti a livello della membrana basolaterale, mentre MIT e DIT vengono deiodinati. questo è il processo di riciclaggio che consente alle cellule di riutilizzare lo iodio per iodinare nuove tiroglobuline. La reazione è catalizzata dall enzima deiodinasi, che utilizza NADPH. Secrezione e regolazione La regolazione è essenzialmente a carico del TSH ipofiario, o ormone tireostimolante. Quest ultimo è un ormone glicoproteico dell asse ipotalamoipofisi, ed è stimolato a sua volta dal releasing hormone ipotalamico. Il TSH agisce legandosi a recettori accoppiati a proteine G; a valle, avviene la stimolazione della adenilato ciclasi, con aumento della concentrazione di camp. La regolazione esplicata dal TSH si evidenzia con effetti a breve e a lungo termine. Gli effetti a breve termine prevedono una stimolazione di tutte le tappe della biosintesi: aumento dell uptake di iodio e della sua organicazione; promozione del trasporto intracellulare e dell attività degli enzimi coinvolti; stimola la secrezione ed il processamento della tiroglobulina. Con gli effetti a lungo termine, il TSH upregola l espressione genica: del simporto Na/I, responsabile della concentrazione dello iodio nei tireociti; della tireoglobulina e della perossidasi tiroidea;
117 3 rmoni derivati da aminoacidi 108 I - TYR TYR TYR TYR TYR TYR TYR I - DIT TYR DIT DIT MIT MIT DIT 4 5 MIT T 4 TYR T 3 DIT TYR Tireoperossidasi Pendrina Tireoglobulina Residuo di tirosina Na + K + I - I - I - Na + K + Na + + -K ATPasi I - Na + NIS I - Na I I - Na + K + MIT DIT 8 MIT DIT T 3 T 4 9 I - Na + K + T 3 T 4 Figura 3.12: La figura mostra una tipica cellula follicolare tiroidea. (1) La tireoglobulina viene sintetizzata e, dopo essere passata dal RER e dall apparato del Golgi, (2) viene esocitata nel lume follicolare, dove forma la colloide. (3) Nel frattempo anche lo iodio viene trasportato nel lume follicolare. (4) L organicazione dello iodio produce MIT e DIT a partire dai residui di tirosina, (5) che vengono fusi a formare T 3 e T 4 ; entrambi i processi sono catalizzati dalla tireoperossidasi. Nel riquadro sono illustrati a maggior ingrandimento. Quando le cellule tiroidee ricevono lo stimolo a secernere gli ormoni, (6) la colloide viene riassorbita. (7) All interno della cellula avviene la fusione con i lisosomi, in seguito alla quale la tireoglobulina viene degradata, liberando i residui di MIT e DIT non fusi, T 3 e T 4. I primi sono degradati, e lo iodio viene riciclato (8);gli ormoni sono secreti (9).
118 3 rmoni derivati da aminoacidi 109 Inoltre, aumenta il flusso ematico che giunge alla tiroide e promuove il trofismo dei tireociti. Gli ormoni tiroidei, in particolare la T 3 originata a livello ipofisario, inibiscono tramite feedback negativo la secrezione di TSH; a livello dell ipotalamo, inibiscono la secrezione di TRH. Un meccanismo di regolazione TSH-indipendente che è importante citare consiste nel cosiddetto effetto Wolff-Chaikoff. Quando la concentrazione di iodio circolante è estremamente elevata, l organicazione dello iodio nel follicolo tiroideo viene autoinibita per downregolazione dell espressione della tireoperossidasi, e con essa la secrezione degli ormoni. In genere, l attività riprende dopo alcuni giorni in seguito a fenomeni non del tutto chiari. Trasporto nel plasma e degradazione A livello della tiroide viene prodotto molto più T 4 che T 3. Considerando i livelli totali, T 4 ha una concentrazione 40 volte maggiore rispetto a T 3. È necessario comunque tener presente che quasi tutte le molecole di ormone in circolo, essendo lipofile, risultano legate a tre proteine. Ciò condiziona la loro concentrazione effettiva, in quanto solo l ormone libero è in grado di interagire con i recettori e quindi esercitare un effetto biologico. Solo lo 0,3% degli ormoni tiroidei circola libero. Gli ormoni tiroidei risultano legati nel sangue: Ad una globulina detta TBG (Thyroxine Binding Protein), che lega con grandissima affinità la T 4 e con minore affinità T 3. Circa il 70% delle molecole sono legate alla TBG. Questo fa sì che, considerando la frazione di molecole libere, non vi sia una differenza così marcata tra la concentrazione plasmatica dei due ormoni, che è comune estremamente bassa. Ad una prealbumina 17 detta TBPA (Thyroxine Binding Pre-Albumin), o transtiretina, in grado di legare entrambi gli ormoni, ma soprattutto T 4, anche se con minore affinità rispetto alla precedente All albumina, con scarsa affinità; è in grado di legare entrambe, ma soprattutto T 3. Il fatto che quasi tutto l ormone in circolo sia legato a proteine ne prolunga in maniera sostanziale l emivita. T 4, che complessivamente tra i due si lega alle proteine con più affinità, ha una emivita di ben 7 giorni, mentre T 3 di 1 giorno. Il rilascio degli ormoni tiroidei dalle proteine di trasporto è in equilibrio dinamico: via via che questi ormoni vengono degradati o si legano ai recettori a livello delle cellule bersaglio esplicando la loro azione, l equilibrio si sposta, e gradualmente gli ormoni 17 Il termine prealbumina non sta a significare che questa molecola sia un precursore dell albumina. Si riferisce al fatto che, eseguendo un elettroforesi delle proteine plasmatiche, la banda della prealbumina si pone davanti alla banda dell albumina, quindi è prima dell albumina.
119 3 rmoni derivati da aminoacidi 110 si distaccano dalle proteine di trasporto. Dunque, oltre a prolungarne l emivita, il legame alle proteine plasmatiche costituisce anche una riserva di ormone. Il metabolismo periferico degli ormoni tiroidei consiste di una serie di deiodinazioni sequenziali. T 4 viene deiodinata nei tessuti periferici per produrre T 3, che è circa 10 volte più attivo dunque T 4 può essere considerato un pro-ormone. In altre parole, T 3 è più attivo ma è presente in bassa concentrazione; T 4 è il suo precursore ed è più abbondante nel plasma. In un certo numero di casi (all incirca il 30%), la deiodinazione di T 4 non produce T 3, ma rt 3 (reverse T 3 ). Questo accade quando viene eliminato lo iodio in posizione 5 dell anello più interno. L rt 3 ha una scarsissima attività biologica, a differenza del T 3, e può essere considerato come un suo antagonista. Le deiodinazioni successive non hanno significato attivatorio, e producono forme inattive, che vengono solfatate e glucuronidate per poi essere escrete con le urine o con la bile. T 3 e rt 3 vengono convertiti in diiodotironina (T 2 ), del tutto inattivo. Gli enzimi che catalizzano queste reazioni sono le deiodinasi, che utilizzano il raro elemento selenio nella loro attività catalitica; sono stati identificati diversi tipi di deiodinasi: Deiodinasi I: catalizza soprattutto le deiodinazione di T 4 e di rt 3. È l enzima responsabile della gran parte delle deiodinazioni che portano alla conversione di T 4 nel più attivo T 3, ed è espressa in tiroide, rene e fegato. Deiodinasi II: catalizza la deiodinazione di T 4 a T 3 nel tessuto nervoso, adiposo, muscolare scheletrico, muscolare cardiaco, e ipofisi questo enzima è molto importante soprattutto a livello di quest ultima, dove riveste un ruolo nell inibizione a feedback del T 3 sul TSH, producendo una quota dell ormone direttamente a livello ipofisario. Deiodinasi III: è in grado di convertire T 4 in rt 3 e T 3 in T 2. È espressa a livello del tessuto nervoso, oltre che nell epidermide e nella placenta. In quest ultimo tessuto è importante perché riduce la quota di T 3 che passa dalla madre al feto, proteggendolo dall eccesso di ormoni. Questi processi di inattivazione, come già detto, si concludono con la solfatazione e la glucuronazione, che si svolgono soprattutto nel rene e nel fegato. Il rene è anche in grado di eliminare direttamente le forme libere di T 4 e T 3. Recettori
120 3 rmoni derivati da aminoacidi 111 I recettori (intracellulari) per gli ormoni tiroidei sono espressi in quasi tutti i citotipi umani; gli ormoni tiroidei agiscono principalmente tramite effetti a livello genico, ma anche a livello metabolico anche se non è chiaro attraverso quali processi sia esplicata questa azione non genica. I recettori nucleari sono molto simili ai recettori degli ormoni steroidei, e sono chiamati α e β. Il recettore β, in particolare, sembra molto importante, e mutazioni a suo carico determinano resistenza agli ormoni tiroidei. Di solito si trovano associati alla cromatina a livello di specifici response elements, legati a diversi repressori. Il legame con l ormone, che avviene con più affinità per T 3 che per T 4, determina la dissociazione dei repressori e il legame di attivatori. I recettori attivati agiscono, analogamente a quanto accade per i recettori intracellulari degli altri ormoni lipofili, come fattori di trascrizione. In genere attivano o inibiscono la trascrizione di un gene legandosi a livello del promotore, o comunque a zone del gene dette Thyroid Response Elements identificate dalla sequenza nucleotidica 3 -AGGTCANNNNAGGTCA-5. Effetti fisiologici degli ormoni tiroidei Le risposte fisiologiche evocate dagli ormoni tiroidei sono estremamente eterogenee, ed hanno come bersaglio una ampia serie di tessuti. Alcuni geni la cui trascrizione è attivata dagli ormoni tiroidei sono: La ATPasi Na + -K + (questo aumenta indirettamente il consumo di ossigeno); proteine disaccoppianti, con aumento di produzione di calore; ltre a questo, gli ormoni tiroidei aumentano il metabolismo basale e intermedio; promuvono la sintesi proteica; incrementano la glicogenolisi e la gluconeogenesi; favoriscono la sintesi del colesterolo. A livello del tessuto osseo, stimolano la crescita e il riassorbimento osseo attivando osteoblasti e osteoclasti; Negli adipociti, stimolano l accumulo di lipidi intracellulari e attivano le proteine disaccoppianti; Nel fegato, stimolano il metabolismo lipidico e glicidico;
121 3 rmoni derivati da aminoacidi 112 A livello dell ipofisi e dell ipotalamo inibiscono la secrezione, rispettivamente, di TSH e TRH; inoltre, stimolano la sintesi ed il rilascio dell ormone della crescita. Correlazioni cliniche: Ipotiroidismo ed ipertiroidismo L ipotiroidismo è il quadro clinico provocato da una ridotta funzione tiroidea, con deficit di ormoni circolanti. Il quadro clinico da manuale è caratterizzato da un generale rallentamento del metabolismo, con astenia (debolezza), difficoltà di concentrazione o sonnolenza, raucedine, bradicardia, intolleranza al freddo, aumento di peso ed alterazioni del ciclo mestruale. Si può anche osservare mixedema (un turgore del sottocute dovuto a deposizione di mucopolisaccaridi nel derma, per ridotto catabolismo). L ipotiroidismo viene classificato in: primario: dovuto cioè ad una insufficienza della tiroide, che non riesce a produrre ormoni; tra le cause più comuni, la tiroidite di Hashimoto, la rimozione chirurgica della tiroide, la carenza di iodio, e alcuni farmaci (per esempio amiodarone o litio). Sono inoltre descritte patologie genetiche in cui vi sono dei difetti nella biosintesi degli ormoni tiroidei. secondario: il deficit di ormoni tiroidei è provocato da un deficit di TSH. La tiroide non viene stimolata e quindi non produce ormoni. È dovuto a lesioni ipofisarie di vario tipo (traumi, lesioni chirurgiche, tumori che comprimono l ipofisi). terziario (molto raro): per patologie ipotalamiche che compromettono la produzione di TRH; ipotiroidismo dovuto a resistenza periferica agli ormoni tiroidei. La tiroidite di Hashimoto è una malattia autoimmune in cui si sviluppano anticorpi contro la TP e la tireoglobulina, con una distruzione (più o meno rapida, più o meno estesa) della ghiandola. L ipertiroidismo è una condizione di esaltata funzione della ghiandola tiroide, che può condurre a tireotossicosi, cioè il quadro clinico provocato da un eccesso di ormoni tiroidei circolanti. I due termini sono spesso usati come sinonimi; in senso stretto, si riferiscono a concetti differenti: una condizione di tireotossicosi può non coincidere con una condizione di ipertiroidismo (es. nelle tiroiditi si verifica un danno delle cellule tiroidee che rilasciano ormoni in circolo, ma non c è iperfunzione; la stessa considerazione vale per chi, intenzionalmente o accidentalmente, assume eccessive quantità di ormoni tiroidei).
122 3 rmoni derivati da aminoacidi 113 La tireotossicosi è caratterizzata clinicamente da sintomi opposti a quelli dell ipotiroidismo, cioè segni e sintomi che richiamano ad un aumento generale del metabolismo: palpitazioni ed aritmie cardiache, irrequietezza ed agitazione, diarrea, sudorazione ed intolleranza al caldo, perdita di peso, aumento dell appetito. La forma più comune di tireotossicosi (e di ipertiroidismo) è la malattia di Graves, una malattia autoimmune in cui vengono prodotti anticorpi diretti contro il recettore del TSH, e che lo legano in maniera tale da stimolarlo. Il recettore quindi si attiva come se venisse stimolato, ma, a differenza del TSH, gli anticorpi ovviamente non rispondono ad un circuito di feedback, quindi anche con elevate quantità di ormoni circolanti, gli autoanticorpi continuano a stimolare il recettore (ed il TSH viene soppresso). Altre forme di tireotossicosi sono rappresentate da condizioni in cui una o più aree della tiroide si svincolano dal controllo del TSH, acquisendo la capacità di secernere ormoni tiroidei autonomamente (es. adenoma tossico di Plummer); situazioni in cui le cellule tiroidee sono danneggiate e rilasciano in circolo ormoni (es. tiroiditi); alcuni farmaci. Ci sono poi diverse cause rare; tra queste, condizioni di secrezione inappropriata di TSH (es. per adenomi ipofisari), in cui il TSH non risponde correttamente al feedback negativo e viene secreto anche quando c è una elevata concentrazione di ormoni tiroidei circolanti.
123 4 rmoni derivati dall acido arachidonico 4.1 rigine degli eicosanoidi Gli ormoni derivati dagli acidi grassi sono chiamati collettivamente eicosanoidi. Il nome deriva dal greco antico εικοσα- (eicosa-), che significa 20, ad indicare che queste molecole tipicamente sono sintetizzate a partire dall ossidazione di acidi grassi a 20 atomi di C, soprattutto dall acido arachidonico. L acido arachidonico, o acido 5,8,11,14-eicosatetraenoico, è un acido grasso essenziale (20:4 Δ 5,8,11,14 ) che si trova per lo più nei fosfolipidi della membrana cellulare, esterificato al glicerolo, solitamente in posizione 2. Costituisce da solo dal 5% al 15% degli acidi grassi dei fosfolipidi. Per essere impiegato nella sintesi, l arachidonato deve essere prima liberato questa reazione è catalizzata dalla fosfolipasi A 2. Altri due acidi grassi sono utilizzati come substrato per la sintesi degli eicosanoidi: l acido diomo γ-linolenico (20:3 Δ 8,11,14 ), o acido 8,11,14-eicosatrieonico: è ottenuto a partire dall elongazione dell acido γ-linoleico, quest ultimo sintetizzato desaturando l acido linoleico (18:2 Δ 9,12 ), un altro acido essenziale assunto con la dieta. L acido 5,8,11,14,17-eicosapentaenoico (20:5 α-linolenico (18:3 Δ 9,12,15 ), 1 essenziale. Δ 5,8,11,14,17 ), ottenuto dall acido 4.2 Classificazione e nomenclatura Abbiamo detto che gli eicosanoidi derivano da acidi grassi a 20 C con 3, 4, o 5 doppi legami, essenziali (e dunque assunti con la dieta) o sintetizzati a partire da acidi grassi essenziali. Sono di un importanza biologica notevole: agendo come ormoni autocrini e 1 Attenzione a non confondere l acido linolenico con l acido linoleico!
124 4 rmoni derivati dall acido arachidonico 115 paracrini, entrano in gioco in processi molto diversi (in certi casi con ruoli antagonisti) come l infiammazione, il controllo della vasocostrizione, o l emostasi. Poiché sono così numerosi, è importante avere ben chiara la classificazione di questi composti per poterne comprendere al meglio la biosintesi e l azione fisiologica. Gli eicosanoidi sono divisi in classi su base strutturale: Prostaglandine (PG); Prostacicline (PGI); Trombossani (TX); Leucotrieni (LT); Lipossine (LX). PG e PGI sono detti collettivamente prostanoidi alcuni autori includono in questo gruppo anche i trombossani. In genere, il termine eicosanodi è utilizzato per riferirsi ad un composto facente parte di una di queste classi si parla, soprattutto nella letteratura anglosassone, di eicosanoidi classici. Tuttavia, diversi altri composti possono essere ricondotti alla famiglia si parla allora di eicosanoidi non classici o novel eicosanoids. Si tratta solitamente di metaboliti e intermedi degli stessi acidi grassi da cui derivano gli eicosanoidi, in alcuni casi originatisi da vie ossidative alternative o reazioni di ossidazione spontanee, e dotati di attività biologica. idroperossidi di acidi eicosatetraenoici (HPETE, HydroPeroxyEicosaTetraEnoic acids) idrossidi di acidi eicosatetraenoici (HETE, da HydroxyEicosaTetraEnoic acids) epossidi di acidi eicosatrienoici (EET, da EpoxyEicosaTrienoic acids) diidrossidi di acidi eicosatetraenoici (dihete, da dihydroxyeicosatetraenoic acids) Le varie classi di eicosanoidi hanno strutture molto variabili: in generale, prostaglandine, prostacicline e trombossani sono formati da un anello a cui sono legate due catene laterali; leucotrieni e lipossine hanno invece struttura lineare. gni ecosanoide si identifica tramite: Due lettere che indicano la classe (es. PG per le prostaglandine);
125 4 rmoni derivati dall acido arachidonico 116 Una lettera, stabilita in modo arbitrario, che indica il tipo e la posizione di certi sostituenti. (es. PGE indica la serie E della classe delle prostaglandine, i cui composti sono caratterizzati dalla presenza di un gruppo β-idrossi-chetonico); Queste tre lettere sono accompagnate da un indice sottoscritto (es. PGE 2 ) che si riferisce al numero di doppi legami nelle catene laterali. È molto comune raggruppare gli eicosanoidi in serie sulla base del numero di doppi legami (per esempio, prostaglandine della serie 2 si riferisce a tutte le prostaglandine con il numero 2 come pedice, e dunque con due doppi legami nelle catene laterali). Una lettera greca indica la configurazione stereochimica dell H legato in C9, quando presente: α indica che il gruppo H si proietta sotto il piano dell anello, β che si proietta sopra. Esaminiamo rapidamente le caratteristiche delle classi principali. Prostaglandine (PG). Strutturalmente assimilabili all acido prostanoico (vedi figura 4.1), mediano la risposta infiammatoria. Le contraddistingue un anello a cinque termini ciclopentanico. Come abbiamo accennato, a seconda dei sostituenti e delle caratteristiche di questo anello sono divise in 9 sottoclassi: PGA, PGB, PGC, PGE, PGF, PGG, PGH, PGI. Ciascuna classe è ulteriormente divisa in sottogruppi, identificati da un numero sottoscritto (PGA 1, PGA 2, etc) sulla base del numero di doppi legami della catena laterale. Le prostaglandine più comuni sono quelle dei gruppi A, E ed F. ltre ad intervenire nei processi infiammatori, queste molecole hanno un ruolo nella regolazione della temperatura corporea quando agiscono a livello ipotalamico, e nella contrazione o nel rilassamento della muscolatura liscia di vasi, bronchi e della muscolatura uterina. Prostacicline (PGI). Sono spesso considerate come un gruppo di eicosanoidi a sé stante, ma in realtà sono una sottoclasse delle prostaglandine (le PGI, appunto). Come tali, anche queste sono strutturalmente assimilabili all acido prostanoico. La loro caratteristica distintiva è la presenza di due anelli: l anello a 5 termini tipico delle prostaglandine, più un secondo anello, pentagonale ed eterociclico. Quando si parla di prostaciclina, senza specificare, ci si riferisce di solito alla PGI 2. Promuovono la vasodilatazione e inibiscono l aggregazione piastrinica. Trombossani (TX). Nei trombossani, l anello ciclopentanico è sostituito da un anello eterociclico a sei termini contenente ossigeno. Sono divisi in due sottoclassi: TXA e TXB. I trombossani promuovono il processo della aggregazione piastrinica nonché la vasocostrizione; trombossani e prostacicline hanno quindi azione antagonista.
126 H 4 rmoni derivati dall acido arachidonico 117 Catena laterale a 7 C Anello a 5 C 1 CH CH catena laterale a 8 C Acido prostanoico Struttura generale di una prostaglandina (PGE ) 2 Le 8 serie di prostaglandine: caratteristiche dell'anello H R 7 R 7 R 7 R 7 R 8 R 8 R 8 R 8 PGA PGB PGD PGE H R 7 R 7 R R 8 R 7 R R R 8 PGFα PGH PGG PGI Figura 4.1: La struttura delle prostaglandine. In alto a destra è mostrata la prostaglandina PGE 2, al fine di illustrare la struttura generale di una prostaglandina (un anello a 5 C, due catene laterali di 7 e 8 C); confrontare con l acido prostanoico, in alto a sinistra, da cui queste molecole prendono il nome. In basso sono mostrate le strutture dell anello a 5 C. È in base a questo anello che le prostaglandine sono suddivise in varie classi.
127 4 rmoni derivati dall acido arachidonico 118 Leucotrieni (LT). Caratterizzati dall assenza di anelli (sono quindi molecole lineari), e dalla presenza di tre doppi legami coniugati il nome infatti deriva dall unione di leuco-, perché queste molecole sono state isolate dai leucociti, e -trieni, che secondo la nomenclatura della chimica organica indica tre insaturazioni. Spesso è presente un ulteriore doppio legame, non coniugato, per un totale di quattro. Sono divisi nelle sottoclassi A, B, C, D, E. I leucotrieni entrano in gioco nei processi infiammatori, nelle reazioni anafilattiche, nell asma, e nella chemiotassi delle cellule del sistema immunitario. Lipossine (LX). Caratterizzate dall assenza di anelli, come i leucotrieni, e dalla presenza di quattro legami insaturi coniugati. Sono di due tipi: A 4 e B 4. Hanno azione vasocostrittrice e ruolo immunodepressivo. 4.3 Sede di elaborazione Gli eicosanoidi vengono virtualmente sintetizzati da tutti i tessuti (in specie le prostaglandine), fatta eccezione per gli eritrociti, anche se vi sono delle specificità tissutali per quanto riguarda il tipo e la quantità di ormoni prodotti. 4.4 Biosintesi Vediamo come vengono sintetizzati questi composti, In questa sezione esamineremo in maniera schematica le vie metaboliche che consentono di sintetizzare questa vastissima rosa di composti a partire da tre acidi grassi, cercando di averne una visione generale. Le vie metaboliche preponderanti sono due, e prendono il nome dai due enzimi coinvolti: Prostaglandine, prostacicline e trombossani sono ottenuti quando gli acidi grassi precursori diventano substrato della via della ciclossigenasi; Leucotrieni e lipossine sono ottenuti quando gli acidi grassi precursori diventano substrato della via delle lipossigenasi. Attraverso una di queste due vie (in realtà ne esiste anche una terza, di cui parleremo più avanti, che ha un ruolo minoritario) gli acidi grassi precursori danno origine a varii composti (Figg. 4.2, pagina 120 e 4.3, pagina 121):
128 4 rmoni derivati dall acido arachidonico 119 Gli eicosanoidi derivati dall acido arachidonico attraverso la via della ciclossigenasi sono prostaglandine, prostacicline e trombossani con due doppi legami (PG 2, PGI 2, e TXA 2 ). La via della lipossigenasi produce leucotrieni e lipossine con 4 doppi legami (LT 4 e LX 4 ). Gli eicosanoidi derivati dall acido diomo γ-linolenico tramite la via della ciclossigenasi sono prostaglandine e trombossani con un doppio legame (PG 1, TXA 1 ), mentre la via della lipossigenasi dà origine a leucotrieni con tre doppi legami (LT 3 ). Gli eicosanoidi derivati dall acido eicosapentaenoico sono prostaglandine, prostacicline e trombossani con tre doppi legami (PG 3, PGI 3, e TXA 3 ), prodotti attraverso la via della ciclossigenasi, e leucotrieni con cinque doppi legami (LT 5 ) prodotti attraverso la via della lipossigenasi. Esamineremo in modo più approfondito il destino dell acido arachidonico, poiché dà origine agli ecoisanoidi più comuni nel corpo umano (le prostaglandine della serie 2), nonché alcuni tra i più importanti. Abbiamo visto che l acido arachidonico si trova esterificato al glicerolo in posizione 2 a formare i fosfolipidi di membrana; poiché le reazioni con cui vengono prodotti eicosanoidi avvengono solo sull acido grasso libero, questo viene innanzi tutto staccato. L enzima fosfolipasi A 2 è in grado di idrolizzare il legame estere tra l acido arachidonico ed il glicerolo in risposta ad uno stimolo che può essere di varia natura. Questa è considerata la rezione velocità limitante, in quanto influenza la disponibilità di substrato. Altre fonti quantitativamente meno importanti di acido arachidonico sono rappresentate da: Esteri del colesterolo con acido arachidonico; Insaturazione dell acido diomo γ-linolenico da parte della Δ 5 desaturasi; Azione della fosfolipasi C, che produce diacilglicerolo e inositolo trifosfato; il diacilglicerolo diviene poi substrato della diacilglicerolo lipasi ed eventualmente della monogliceride lipasi. Liberato l acido arachidonico, come abbiamo accennato, questo può entrare in tre diverse vie, che dunque competono per lo stesso substrato: via della ciclossigenasi: l arachidonato subisce una reazione catalizzata dal complesso della prostaglandina G/H sintasi (o ciclossigenasi, CX), che produce PGH 2, un endoperossido. A partire da questo composto, si possono produrre, a seconda di quale enzima subentri: altri PG 2 (delle serie D, E ed F);
129 4 rmoni derivati dall acido arachidonico 120 CH Membrana plasmatica C-R diomo γ-linolenato Esteri dell'acido arachidonico Fosfolipasi A 2 Diacilglicerolo lipasi Δ 5 desaturasi CH Acido arachidonico Via delle lipossigenasi Via delle ciclossigenasi Prostaglandina G/H sintasi (CX) 12-LX 5-LX 15-LX PGG 2 12-HPETE 15-HPETE Prostaglandina G/H sintasi (perossidasi) leucotrieni della serie B Lipossine PGH 2 5-HETE LTA 4 5,12-HPETE PGD 2 PGE 2 TXA 2 PGI 2 5,15-HPETE PGF 2 TXB 2 LTB 4 LTC 4 Prostaglandine e trombossani della serie 2 LTD 4 Leucotrieni della serie 4 LTE 4 Figura 4.2: Eicosanoidi prodotti a partire dall acido arachidonico.
130 4 rmoni derivati dall acido arachidonico :2 Δ 9,12 acido linoleico acido α-linolenico 18:3 Δ 9,12,15 6 Δ desaturasi 18:3 Δ 6,9,12 acido γ-linolenico Acido ottadecatetraenoico 18:4 Δ 6,9,12,15 Elongasi 20:3 Δ 8,11,14 Acido diomo γ-linolenico Acido eicosatetraenoico 20:4 Δ 8,11,14,17 5 Δ desaturasi Via delle lipossigenasi Via delle ciclossigenasi Acido eicosapentaenoico 20:5 Δ 5,8,11,14,17 LTA 3 LTC 3 LTD 3 Leucotrieni della serie 3 PGH 1 PGE 1 PGF 1 TXA 1 Prostaglandine e trombossani della serie 1 Via delle lipossigenasi LTA 5 LTB 5 PGE 3 LTC 5 Leucotrieni della serie 5 Via delle ciclossigenasi PGD 3 PGF 3 TXA 3 PGI 3 Prostaglandine e trombossani della serie 3 Figura 4.3: Eicosanoidi prodotti a partire dagli acidi linoleico e linoleico.
131 4 rmoni derivati dall acido arachidonico 122 La prostaciclina PGI 2 ; il trombossano TXA 2. L espressione degli enzimi responsabili di queste conversioni varia con il citotipo, dunque il destino della PGH 2 è tessuto-specifico. Via della lipossigenasi: l arachidonato diviene substrato di tre diverse lipossigenasi, ciascuna in grado di introdurre ossigeno in tre differenti posizioni: 12, 5, e 15. In seguito all azione combinata di questi tre enzimi, vengono prodotti leucotrieni, lipossine, HPETE ed HETE. Una terza via, molto meno attiva delle prime due, produce dihete ed HETE; la catalisi è affidata soprattutto a citocromo P450. Via delle ciclossigenasi : l enzima cardine su cui si basa questa via è la prostaglandina G/H sintasi (PGS), che si trova per lo più a livello del reticolo endoplasmatico. Si tratta di un omodimero: ciascuna delle due subunità presenta tre dominî: un dominio con l attività di ciclossigenasi (CX); un dominio con attività idroperossidasica (PG idroperossidasi); un dominio di legame con la membrana, attraverso il quale l enzima è ancorato al reticolo endoplasmatico o, più raramente, alla membrana nucleare esterna. L enzima è spesso chiamato semplicemente CX. Nella prima tappa, l acido arachidonico subisce una ciclizzazione intramolecolare data dal legame tra C8 e C12; allo stesso tempo, due molecole di 2 vengono introdotte a formare un endoperossido (tra C9 e C11) ed un idroperossido in C15. Il meccanismo di reazione che è stato proposto per l enzima prevede la rimozione stereospecifica dell idrogeno prochiralico-s dal C13 da parte della tirosina 385 del sito attivo; questo dà origine ad un carbonio radicalico. Segue l ossigenazione in C11, con formazione dell endoperossido e dell anello a 5 termini. Una seconda molecola di 2 viene poi introdotta in C15, cui segue la formazione dell idroperossido. La molecola formata in questa prima tappa è la PGG 2 ; l attività perossidasica, glutatione ridotto dipendente, il cui sito attivo si trova nelle vicinanze dell attività CX, converte il gruppo idroperossido in gruppo idrossilico, producendo PGH 2, H 2 e glutatione ossidato. L attività della CX ha la peculiarità di essere discontinua, perché l enzima si autoinattiva dopo circa 30 secondi di attività. Poiché l enzima di fatto si autodistrugge fa parte dei cosiddetti enzimi suicidi. Queste prime fasi della sintesi di prostaglandine e trombossani sono effettuate virtualmente in tutti i tessuti (tranne che negli eritrociti). Ciò significa che tutti i tessuti
132 4 rmoni derivati dall acido arachidonico 123 CH Acido arachidonico CX CH H PGG 2 CH H CH CH H H H H PGD 2 PGH 2 PGI 2 CH CH H H H TXA 2 PGE 2 H H CH CH H H H PGF 2α TXB 2 Figura 4.4: Eicosanoidi prodotti a partire dall acido arachidonico.
133 4 rmoni derivati dall acido arachidonico 124 esprimono CX. È però necessario precisare che di CX si conoscono, ad oggi, tre isoenzimi: CX-1, CX-2 e CX-3; quest ultimo tuttavia viene considerato come una variante di CX-1 (i loro mrna sono frutto dello splicing alternativo del trascritto dello stesso gene) espressa a livello della corteccia cerebrale e del miocardio, il cui ruolo non è stato chiarito. CX-1 e CX-2 sono meglio conosciuti e considerati più importanti: hanno circa il 65% della sequenza aminoacidica in comune, e peso molecolare comparabile; anche gli aminoacidi a livello dei siti attivi sono molto conservati. Le due CX agiscono praticamente allo stesso modo a livello catalitico (ci sono piccole differenze di specificità, in realtà), tuttavia la loro inibizione differenziale porta a differenti conseguenze: CX-1 è un enzima costitutivo (o housekeeper), espresso in quasi tutti i tessuti. Le prostaglandine sintetizzate da queste cellule sono coinvolte in molti processi fisiologici e in generale nell omeostasi; per esempio, a livello di mucosa gastrica, dove regolano la secrezione di muco, che protegge le pareti dello stomaco dall azione dei succhi gastrici. Un altro esempio è dato dalla regolazione del flusso renale. Dunque, l inibizione di questo enzima è in grado, potenzialmente, di creare dei problemi; per esempio, una maggiore vulnerabilità della parete gastrica nei confronti della erosione da parte degli acidi gastrici (con possibilità di sanguinamenti). CX-2 è un enzima inducibile, indotto durante l infiammazione soprattutto a livello di macrofagi, monociti e nei tessuti sede di infiammazione o esposti a fattori di crescita o altri mediatori dell infiammazione (interleuchina-1 o LPS, lipopolisaccaride batterico), oltre che nei neuroni, nelle cellule muscolari lisce e nelle cellule endoteliali; le prostaglandine sintetizzate da queste cellule sono coinvolte nella mediazione dell infiammazione, nel dolore, e nella febbre dunque un inibizione della sintesi di queste prostaglandine riduce anche l entità di questi processi. Correlazioni cliniche: gli enzimi CX ed i FANS Perché è importante conoscere la differenza tra i due isoenzimi CX? La sintesi degli eicosanoidi è un processo su cui il medico si trova spesso a dover intervenire farmacologicamente, ad esempio per tentare di modulare processi infiammatori. Questo avviene tramite due tipi di farmaci: da un lato, esistono i farmaci anti-infiammatori steroidei, dall altro i non steroidei (i cosiddetti FANS, o NSAID secondo l acronimo inglese).
134 4 rmoni derivati dall acido arachidonico 125 I farmaci antiinfiammatori steroidei (per es. prednisone) inibiscono la risposta infiammatoria in molti modi, come la regolazione dell espressione di geni coinvolti nell infiammazione (tra queste azioni, merita citare l inibizione della fosfolipasi A 2 ). Questi farmaci agiscono con le stesse modalità dei corticosteroidi (vedi sez. 6.1, pag. 140.). I FANS esplicano la loro azione a livello della CX. L aspirina (acido acetilsalicilico) è il prototipo dei FANS: agisce acetilando irreversibilmente una serina presente nel sito attivo della CX. Tuttavia l aspirina, così come molti altri FANS, agisce su entrambi gli isoenzimi (anzi, più efficaciemente sulla CX-1!). Quindi, nonostante si somministri il farmaco con lo scopo di inibire la CX-2 per eliminare dolore, infiammazione e febbre, si finisce con l inibire anche la CX-1, i cui effetti, al contrario, non sono indesiderati. Questo crea diversi problemi: per esempio, è noto che l utilizzo prolungato di FANS aumenta il rischio di ulcere gastriche e sanguinamenti. Questo perché la CX-1 è coinvolta nella sintesi di prostaglandine che regolano la secrezione di muco, che ha funzione gastroprotettiva. Un altro esempio classico di FANS è dato dall ibuprofene, che agisce però con un diverso meccanismo rispetto all aspirina. Grazie agli sforzi della ricerca, sono stati messi a punto nuovi anti-infiammatori non steroidei ( newer NSAIDs o coxib) più specifici verso la CX-2, ma non privi di effetti collaterali. Tra questi farmaci, il celecoxib, etoricoxib ed il refecoxib (ora ritirato dal mercato) sono i più noti. In ricerca, sono disponibili inibitori della CX volte più specifici, ma, per varii motivi, non possono essere usati come farmaci. Il PGH 2, a seconda del citotipo, può essere substrato di diversi enzimi che portano alla sintesi di prostaglandine diverse e trombossani (figura 4.4, pagina 123). PGE 2 e PGF 2 α : prodotte soprattutto in milza e reni per l intervento prima di una isomerasi (o PGE sintasi), che produce PGE 2, e poi di una reduttasi, che porta a PGF 2 α. PGI 2 : prodotta dalla prostaciclina sintasi. PGD 2 : prodotta dalla PGD sintasi. TXA 2 : prodotta dalla trombossano sintasi. È un potente vasocostrittore, sintetizzato soprattutto dalle piastrine, che viene rapidamente inattivato a TXB 2. Ha una emivita estremamente breve. Via delle lipossigenasi. Se la via delle ciclossigenasi produce composti ciclici, la via delle lipossigenasi converte l acido arachidonico in leucotrieni e lipossine (figura 4.5),
135 4 rmoni derivati dall acido arachidonico 126 CH Acido arachidonico 12-LX 5-LX 15-LX CH H CH CH H 5-HPETE H 12-HPETE 15-HPETE CH CH 12-HETE 15-HETE Leucotrieni della serie B Lipossine H CH Leucotrieni della serie 4 H CH 5-HETE 5,15-HPETE H CH 5,12-HPETE Figura 4.5: La via delle lipossigenasi. L acido arachidonico può divenire substrato di almeno 3 differenti enzimi lipossigenasi (LX), con produzione di numerosi leucotrieni e lipossine.
136 4 rmoni derivati dall acido arachidonico 127 composti lineari. Gli enzimi coinvolti in questo pathway sono le lipossigenasi, enzimi citosolici con attività di diossigenasi, che catalizzano l incorporazione di entrambi gli atomi di ossigeno di una molecola di 2 a livello di uno dei doppi legami dell acido arachidonico, producendo idroperossidi (HPETE); gli intermedi successivi porteranno alla sintesi di leucotrieni della serie 4 e lipossine. Sono tre le lipossigenasi principali che entrano in gioco in questa via, ognuna delle quali è specifica per uno dei doppi legami dell arachidonato: 5-lipossigenasi (5-LX). Molto espressa in leucociti (granulociti neutrofili e basofili, linfociti B), macrofagi e mastociti, dà origine ai leucotrieni più importanti nella mediazione dei processi infiammatori, ed è bersaglio di diversi farmaci. Introduce un gruppo idroperossido a livello del carbonio 5 dell acido arachidonico producendo 5(S)-HPETE 2. La catalisi avviene con la collaborazione della FLAP, acronimo inglese per Proteina Attivante la Lipossigenasi, che sembra in qualche modo presentare il substrato all enzima. Sia come sia, è pacifico che la FLAP sia essenziale per una catalisi efficiente e corretta. Il 5-HPETE, come tutti gli altri HPETE, è un intermedio estremamente reattivo, occupante una posizione centrale nel metabolismo dei leucotrieni, che qui si fa straordinariamente complesso. Il 5-HPETE infatti: 1. può ridursi al corrispondente HETE, spontaneamente (spesso ossidando glutatione) o tramite la catalisi di una perossidasi; 2. può divenire substrato di una delle altre due lipossigenasi, con produzione di 5,12-diHPETE o 5,15-diHPETE; 3. oppure può dare origine al leucotriene LTA 4, in grado di essere convertito in altri leucotrieni. Il 5-HPETE è quindi un intermedio estremamente importante. 12-lipossigenasi (12-LX). Molto espressa in piastrine, cellule delle isole pancreatiche, cellule muscolari lisce dei vasi. Introduce l ossigeno a livello del carbonio 15 dell arachidonato e produce così 12(S)-HPETE. Come succedeva per il 5-HPETE, anche questo idroperossido ha molti possibili destini. Viene soprattutto ridotto, con modalità simili al precedente, al corrispondente 12-HETE, che esplica funzioni biologiche, e in parte dà origine ad alcuni leucotrieni della serie B. 15-lipossigenasi (15-LX). Espressa soprattutto in reticolociti, granulociti eosinofili, linfociti T, cellule dell epitelio della trachea. Produce 15(S)-HPETE, che, come il precedente, non dà origine a leucotrieni, e può essere convertito in 2 Il carbonio ossigenato diviene asimmetrico; la idroperossidazione è specifica per lo stereoisomero S.
137 4 rmoni derivati dall acido arachidonico HETE. Tuttavia, il destino principale di questo intermedio è quello di produrre lipossine antiinfiammatorie. In realtà vi è anche una 8-lipossigenasi, ma non la prenderemo in considerazione in quanto non partecipa alla biosintesi degli eicosanoidi. Inoltre, è da sottolineare il fatto che non sono state presentate tutte le possibili interrelazioni metaboliche tra i composti visti fino ad adesso, per non complicare ulteriormente (e con il probabile effetto di rendere il tutto molto più arido e sterile) un quadro già complesso tuttavia, è bene tener presente che il metabolismo di questi composti è molto più articolato e tortuoso di quello che abbiamo visto! Riassumendo, abbiamo illustrato come l arachidonato venga idroperossidato a 5(S)-HPETE dall attività diossigenasi della 5-lipossigenasi, che fa parte della via delle lipossigenasi. La stessa 5-lipossigenasi presenta anche l attività di deidrasi che può convertire il 5(S)-HPETE a leucotriene LTA 4. Sarà questo il pathway metabolico lungo il quale proseguiremo adesso. Questa attività deidrasica è chiamata spesso LTA 4 sintasi. Il leucotriene A 4 è un epossido (dunque un composto abbastanza instabile) che può essere convertito in: LTB 4 da una idrolasi, che idrata (aggiunge una molecola d acqua) l LTA 4, aprendo il suo anello epossido. In questa reazione avviene un riarrangiamento dei doppi legami, ma il numero totale rimane invariato. LTC 4, dalla LTC 4 sintasi, che coniuga l LTA 4 ad una molecola di glutatione ridotto in posizione 6 per questo motivo, l enzima è anche chiamato glutatione-s transferasi II. In ogni caso, la reazione apre l anello epossido. L LTC 4 è un leucotriene molto importante, poiché a partire da questo composto la cellula è in grado di sintetizzare i cosiddetti cisteinil-leucotrieni, così denominati in quanto contenenti cisteina. Ne fanno parte LTD 4, LTE 4 e lo stesso LTC 4 (il glutatione contiene cisteina). Poiché il LTC 4 è secreto dalla cellule mediante un trasportatore, queste reazioni di conversione avvengono nell ambiente extracellulare. La conversione avviene grazie alla rimozione sequenziale, per idrolisi, di glutammato (che produce LTD 4 ) e poi di glicina (LTE 4 ). La produzione di leucotrieni in quantità importanti avviene soprattutto ad opera dei leucociti. Via dei citocromi P450. Non ci resta che esaminare brevemente la terza via con la quale vengono prodotti eicosanoidi, catalizzata da citocromi P450, soprattutto a funzione idrossilasica, epossigenasica e idrolasica. Il substrato è nuovamente l acido arachidonico, grande protagonista di queste vie metaboliche, e, come abbiamo visto,
138 4 rmoni derivati dall acido arachidonico 129 a capo della biosintesi di una serie incredibilmente ampia di composti con funzioni segnalatorie tanto da far parlare gli studiosi di cascata dell acido arachidonico. I prodotti a cui dà origine attraverso questo pathway sono 19,20-diHETE, 20-HETE, 19-HETE, EET. Le funzioni biologiche di questi composti sono eterogenee ed entrano in gioco nei sistemi vascolare, renale, polmonare e cardiaco in processi molto diversi (proliferazione cellulare, apoptosi, infiammazione, etc.). Ricordiamo tra tutti il 20- HETE, potente vasocostrittore; gli EET, di contro, hanno azione vasodilatatrice. 4.5 Secrezione e regolazione La regolazione della biosintesi di questi composti si esplica soprattutto a livello della fosfolipasi, e quindi attraverso una modulazione della disponibilità di substrato. In generale, l azione della fosfolipasi A 2 e la sua traslocazione a livello della membrana: sono promosse dalla sua fosforilazione e dall aumento di concentrazione del calcio; sono inibite dagli steroidi, in particolare dai corticosteroidi. Nonostante siano molecole lipofile, è stato dimostrato che la secrezione e l uptake di questi composti da parte delle cellule sono mediati, almeno nel caso delle prostaglandine, da dei trasportatori. In particolare, un trasportatore ABC chiamato MRP4 (o trasportatore delle prostaglandine ) ne promuove il rilascio. 4.6 Secrezione, trasporto nel plasma e degradazione I composti di cui abbiamo esaminato la biosintesi fino ad adesso sono ormoni di tipo paracrino ed autocrino. Come tali, agiscono nelle immediate vicinanze della cellula da cui sono stati secreti, ed hanno emivita tendenzialmente breve (decine di secondi, minuti nel caso di prostaglandine e trombossani, poche ore nel caso dei leucotrieni). Sono inattivati in situ oppure, se entrano nel circolo sanguigno, soprattutto a livello polmonare. Le prostaglandine sono inattivate mediante ossidazione del gruppo -H in posizione 15, o β-ossidazione del carbossile terminale.
139 4 rmoni derivati dall acido arachidonico 130 Il trombossano A 2 ha una emivita biologica brevissima; è inattivato in pochi secondi a TXB 2 (Fig. 4.4, pag. 123) quando entra in contatto con molecole di acqua. Per quanto riguarda i leucotrieni, il LTB 4 è inattivato mediante ω-ossidazione del gruppo metile (cioè, ossidazione del carbonio più distante dal gruppo carbossilico), seguita da β-ossidazione. LTC 4 è convertito in LTD 4 e LTE 4, dopodiché quest ultimo subisce inattivazione con le stesse modalità del LTB4. Altri eicosanoidi vengono inattivati mediante riduzione dei doppi legami. 4.7 Recettore Gli eicosanoidi si legano rapidamente dalle cellule mediante un recettore accoppiato ad una proteina G. Spesso viene attivato il pathway dell adenilato ciclasi-campproteinchinasi oppure DAG-IP 3 -Ca Effetti fisiologici degli eicosanoidi Gli eicosanoidi agiscono tendenzialmente in maniera paracrina ed autocrina. Non tratteremo in maniera approfondita le risposte biologiche mediate dagli eicosanoidi, in quanto questi composti sono numerosissimi, e le azioni da loro promosse sono ancora di più inoltre, in certi casi si tratta di azioni contrastanti. Le prostaglandine: mediano la risposta infiammatoria. In questo ambito, possono essere coinvolte in deviazioni patologiche di questi processi, ad esempio a carico di articolazioni (artrite reumatoide), pelle (psoriasi), occhi, etc.; contribuiscono alla regolazione della temperatura corporea, e hanno a che fare con l insorgere della febbre; esercitano un controllo sulla muscolatura liscia, in specie quella vascolare, con numerose conseguenze: provocano ad esempio vasocotrizione (PGF) o vasodilatazione (PGE, PGA, PGI); stimolano le contrazioni uterine in diversi momenti fisiologici; sono mediatori del dolore;
140 4 rmoni derivati dall acido arachidonico 131 sono modulatori del processo dell emostasi (in particolare, le prostacicline sono antiaggreganti e antagonisti dei trombossani: inibiscono l attivazione delle piastrine e vasodilatano). I trombossani promuovono l aggregazione piastrinica e la vasocotrizione, e operano in maniera antagonista alle prostacicline. Sono potenti ipertensivi. Sfruttano recettori accoppiati a G proteine, con attivazione della fosfolipasi C, e sfruttano quindi il pathway segnalatorio DAG-IP 3 -Ca 2+. Leucotrieni e lipossine sono sintetizzate principalmente dalle cellule del sangue della serie bianca, ma anche a livello encefalico, polmonare e miocardico. Modulano: la chemotassi e attivazione di leucociti (per esempio, la degranulazione); processi infiammatori; risposte allergiche; presentano inoltre azione bronco- e vasocostrittrice; sono in grado di incrementare la permeabilità vascolare, provocando edema.
141 5 rmoni derivati dalla vitamina D Il termine vitamina D è utilizzato per indicare una serie di composti: i due principali sono ergocalciferolo, o vitamina D 2, e colecalciferolo, o vitamina D 3. Entrambi sono, di fatto, dei pro-ormoni: subiscono alcune reazione per dare origine infine all ormone calcitriolo. Il calcitriolo è un ormone lipidico coinvolto soprattutto nell omeostasi del Ca 2+, come paratormone e calcitonina, ma esplica anche altre funzioni. 5.1 rmoni del rene Calcitriolo Struttura Il calcitriolo (1 α,25-diidrossicolecolaciferolo) è il solo ormone derivante dalle vitamina D. Come tale, è assimilabile da un certo punto di vista anche al colesterolo, poiché il composto precursore della vitamina D è un intermedio della biosintesi del colesterolo. Tuttavia il calcitriolo non può a rigore essere considerato un ormone steroideo in quanto ha perduto la struttura tetraciclica. 1 Viene per questo fatto rientrare nella classe dei secosteroidi, termine che designa composti nei quali uno dei quattro anelli tipici degli steroidi è aperto, solitamente l anello B. Sede di elaborazione La tappa principale della sintesi del calcitriolo avviene a livello renale, che può essere considerato la sede di sintesi dell ormone. Biosintesi Se è vero che la tappa principale della sintesi del calcitriolo avviene nel rene, a monte di questa vi sono altre tappe che hanno luogo in diversi distretti del corpo, e che da un precursore del colesterolo portano alla vitamina D (figura 5.1, pagina 133): 1 Gli steroidi sono composti formati da quattro anelli ciclici: tre molecole di cicloesano (peridrofenantrene), e un ciclopentano. Vedi la sezione 6.1, pag. 140.
142 5 rmoni derivati dalla vitamina D 133 Fegato Cute CH 3 CH 2 Colecalciferolo Previtamina D 7-deidrocolesterolo H CH 2 H 1,25-diidrossicolecalciferolo (Calcitriolo) H H H CH 2 CH 2 H 25-idrossicolecalciferolo 1,24,25-triidrossicolecalciferolo H H CH 2 Rene 24,25-diidrossicolecalciferolo Figura 5.1: Biosintesi della vitamina D. Le reazioni avvengono a livello di cute, fegato e rene. I nomi degli enzimi non sono mostrati (dettagli nel testo).
143 5 rmoni derivati dalla vitamina D 134 La sintesi del colesterolo prevede la condensazione di diverse molecole di acetil- CoA, fino ad ottenere squalene. Questo composto viene poi rimaneggiato a formare lanosterolo, la cui struttura tetraciclica ricorda quella del colesterolo. Altre modifiche convertono il lanosterolo in composti intermedi, fino ad ottenere 7-deidrocolesterolo. 2 Questo composto può subire una riduzione per essere convertito a colesterolo, oppure divenire il substrato per la sintesi della vitamina D. A livello della cute (soprattutto nello strato dell epidermide), i raggi UVB provenienti dal sole innescano la fotolisi non enzimatica del 7-deidrocolesterolo nella provitamina D 3. La reazione consiste nella rottura del legame tra C9 e C10. La provitamina D 3, composto biologicamente inattivo, isomerizza spontaneamente (anche questa reazione non è catalizzata, ed in effetti è molto lenta) in colecalciferolo, o vitamina D 3. Questa viene trasportata nel plasma dalla proteina legante la vitamina D. La vitamina D 3 può anche essere ottenuta direttamente con la dieta, o a partire dall ergocalciferolo (vitamina D 2 ). Quetst ultimo composto viene sintetizzato a partire dall egosterolo da piante, funghi e invertebrati; al giorno d oggi, viene prodotto a livello industriale irradiando lieviti, e poi aggiunto a molti cibi. È nel fegato che avviene la tappa successiva: ergocalciferolo e colecalciferolo vengono qui idrossilati in posizione 25; la reazione, scarsamente regolata, avviene a livello del RE, e richiede NADPH, ossigeno molecolare e magnesio. Gli enzimi coinvolti sono due: una citocromo P450 reduttasi NADPH-dipendente e la 25-idrossilasi, un citocromo P450. I prodotti sono 25-idrossicolecalciferolo e 25-idrossiergocalciferolo, che vengono entrambi reimmessi nel circolo sanguigno. Il 25-H-D 3 (chiamato anche calcidiolo) risulta la forma più abbondante di vitamina D che si ritrova nel sangue anche a causa della sua lunga emivita, dell ordine di giorni. Dal circolo i composti passano nel rene, dove possono essere sottoposti a due idrossilazioni, con diverso significato: un idrossilazione in posizione 24, con significato inattivatorio, e una idrossilazione in posizione 1, con significato attivatorio, che porta all attivazione definitiva della vitamina D con la formazione (nel caso della D 3 ) di 1 α,25-diidrossicolecalciferolo, o calcitriolo, depositario della massima attività biologica. L ercalcidiolo (25-idrossiergocalciferolo) forma 1,25- diidrossiergocalciferolo o ercalcitriolo. 2 Una spiegazione più dettagliata della sintesi del colesterolo può essere trovata in qualunque testo di biochimica.
144 5 rmoni derivati dalla vitamina D 135 Questa reazione di idrossilazione in posizione 1, che avviene nei mitocondri delle cellule della porzione convoluta del tubulo prossimale renale, richiede tre enzimi: 1. ferredossina reduttasi renale, una flavoproteina; 2. ferredossina renale, una proteina ferro-zolfo; 3. 1 α-idrossilasi, un citocromo P450. Sono richiesti come cofattori NADPH, Mg 2+ e ossigeno molecolare. Il citocromo catalizza una classica reazione di tipo monossigenasi sfruttando l ossigeno molecolare. A differenza della reazione precedente, questa è strettamente regolata. La regolazione negativa di questo enzima favorisce l idrossilazione inattivatoria in posizione 24 da parte della 24-idrossilasi (vedi il paragrafo "Regolazione".). Dopo la sintesi, il calcitriolo viene quindi rilasciato in circolo dove svolge le sue funzioni come un ormone endocrino. Secrezione e regolazione Il principale punto regolativo è l enzima 1 α-idrossilasi, che attiva definitivamente la vitamina D 3. Questo enzima, e con esso l intera via biosintetica, è regolato: positivamente dal PTH, che aumenta l attività dell enzima; negativamente dal calcitriolo, con un feedback negativo che influenza l espressione genica e la biosintesi dell enzima; inoltre il calcitriolo riduce anche la sintesi del PTH. negativamente dai livelli plasmatici di calcio. Anche questa può essere considerata una forma di feedback negativo (il calcitriolo porta all incremento della calcemia); Si ritiene che anche calcitonina, prolattina e gli ormoni sessuali (estrogeni in particolare) contribuiscano alla regolazione, ma rivestono in ogni caso un ruolo minore. Il calcitriolo inoltre upregola l enzima che idrossila in posizione 24. Come gli altri ormoni liposolubili il calcitriolo non viene accumulato nelle cellule in vescicole secretorie, ma viene rilasciato in circolo via via che viene sintetizzato. Trasporto nel plasma e degradazione Il calcitriolo in circolo si trova legato, così come i suoi metaboliti idrossilati, alla proteina legante la vitamina D (VDBP), una
145 5 rmoni derivati dalla vitamina D 136 glicoproteina (in particolare, si tratta di una globulina) del peso molecolare di circa 52 kda. Presenta tre dominî, uno dei quali in grado di legare secosteroli. 3 Presenta forti omologie con l albumina. Per quanto riguarda la degradazione, avevamo visto come nel rene le reazioni a cui poteva andare incontro il calcidiolo (o l ercalcidiolo) erano due: una idrossilazione in posizione 1 e una in posizione 24. Quest ultima produce un metabolita inattivo, il 24,25-diidrossicolecalciferolo. Anche l 1,25-diidrossicolecalciferolo può subire questa reazione, dando origine, parimenti, ad un metabolita inattivo, il 1,24,25-triidrossi-D 3. Il 24,25-diidrossicolecalciferolo si forma quando l idrossilazione in posizione 1 (attivatoria) viene inibita. Il 1,24,25-triidrossi-D 3 si forma quando l idrossilazione in posizione 1 è avvenuta, il calcitriolo ha adempito alle sue funzioni e deve essere degradato. Questi due prodotti vengono poi trasportati al fegato ed eliminati con la bile, oppure con le urine nel rene stesso. Recettore Gli effetti biologici sono raggiunti per mezzo di: una azione a livello genico (tipica degli ormoni lipofili). È lenta e presuppone l interazione con un recettore citosolico (VDR, Vitamin D Receptor) che in seguito al legame con il ligando si sposta nel nucleo e agisce come fattore di trascrizione; con meccanismi che hanno effetto a breve termine, e coinvolgono recettori sulla membrana plasmatica e un processo di trasduzione del segnale. 4 Il VDR, estremamente specifico nel suo legame, è molto simile ai recettori per gli ormoni steroidei: entrambi contengono, ad esempio, il motivo zinc-finger, con il quale si legano al DNA. Effetti fisiologici del calcitriolo L 1,25-diidrossicolecalciferolo è un ormone ipercalcemizzante: la sua azione produce un aumento del calcio plasmatico. Le cellule bersaglio del calcitriolo si trovano a livello intestinale e nelle paratiroidi, ma anche nel tessuto osseo e nel rene. Azione a livello intestinale. Questa è l azione più importante. Il sito d azione è il duodeno e parte del digiuno. L 1,25-didrossicolecalciferolo stimola l assorbimento 3 È stato riportato che questa stessa proteina lega l actina che riesce a penetrare nel circolo sanguigno (in seguito ad un danno cellulare, per esempio). 4 Tuttavia anche questo secondo pathway va ad influenzare, come parte dei suoi effetti, l espressione genica.
146 5 rmoni derivati dalla vitamina D 137 del calcio da parte degli enterociti. Questo è ottenuto incrementando l espressione di proteine di trasporto, come il canale del calcio TRPV6, che permette il trasporto intracellulare del calcio a livello della membrana apicale delle cellule, o di proteine leganti il calcio, come la calbindina, che promuove il trasporto del calcio dalla porzione apicale della cellula a quella basolaterale. Una pompa ATP-dipendente a livello della membrana basolaterale pompa il calcio fuori dall enterocita, nel circolo sanguigno. Il trasporto del calcio stimolato dal calcitriolo è di tipo attivo, ed chiamato "via transcellulare". Nelle altre porzioni dell intestino avviene un trasporto di calcio di tipo passivo ("via paracellulare"), indipendente dalla regolazione ormonale. Azione a livello delle paratiroidi. Riduce la trascrizione del gene del PTH. Poiché la sintesi del calcitriolo è fortemente attivata dal paratormone (vedi anche sez , pag. 73), questo rappresenta una sorta di feedback negativo indiretto, ed evita fluttuazioni eccessive della calcemia. Azione sui tubuli renali. Stimola il riassorbimento del calcio e del fosfato nella porzione distale dei tubuli renali, facendo sì che un maggior numero di ioni calcio vengano reimmessi nella circolazione. Azione sul rene. Il calcitriolo, con un meccanismo di feedback negativo diretto, diminuisce l espressione della 1-idrossilasi, ed aumenta l espressione della 24-idrossilasi, inibendo quindi la propria sintesi e promuovendo la formazione di metaboliti inattivi. Azione a livello osseo. Il calcitriolo stimola gli osteoclasti nella loro produzione di idrolasi acide, e stimola il loro differenziamento, incrementandone quindi il numero. Questo fa sì che il riassorbimento osseo aumenti, con innalzamento di calcemia e fosfatemia. Per quanto riguarda il metabolismo del calcio, nonostante l 1,25-colecalciferolo contribuisca a promuovere il riassorbimento osseo, in caso di una deficienza di vitamina D si osservano patologie a carico del sistema scheletrico (come il rachitismo nei bambini), perché il calcio non può essere assorbito in maniera adeguata, e la disponibilità di calcio è un presupposto per la deposizione di matrice inorganica nelle ossa. Altri effetti. Il calcitriolo ha anche altri effetti, solo in parte conosciuti, che vanno molto al di là del metabolismo del calcio. Sono stati dimostrati effetti a livello della
147 5 rmoni derivati dalla vitamina D 138 proliferazione e del differenziamento di diversi citotipi, molti dei quali correlati al sistema immunitario, oltre che azione anti-infiammatoria. Inoltre, è stato osservato che il calcitriolo è necessario per la normale secrezione dell insulina. Correlazioni cliniche: ipocalcemia ed ipercalcemia L ipocalcemia si instaura quando la concentrazione di calcio totale plasmatico scende al di sotto di mg/dl (in presenza di una concentrazione normale di proteine plasmatiche) o mg/dl se si considera solo la frazione libera (calcio ionizzato). Tra le cause di ipocalcemia: l ipoparatiroidismo (deficit di secrezione di PTH; può verificarsi nel corso di malattie autoimmuni o in seguito a danneggiamento accidentale delle paratiroidi nel corso di interventi chirurgici sulla tiroide), lo pseudoipoparatiroidismo (in cui la secrezione di PTH è normale, ma i tessuti sono resistenti all azione dell ormone), deficit di vitamina D, malattie renali che portano a perdita di calcio con le urine. Ci sono poi altre cause, più o meno rare (es. pancreatite, farmaci). L ipocalcemia può essere asintomatica; quando è evidente, il quadro clinico dell ipocalcemia è dominato dalle manifestazioni neurologiche: crampi muscolari e spasmi fino alla tetania, iperreflessia, convulsioni, parestesie, sintomi psichiatrici (depressione o irritabilità, psicosi), aritmie cardiache. Il meccanismo della tetania non è chiaro; sembra che l ipocalcemia incrementi la permeabilità delle membrane delle cellule eccitabili al sodio, facilitandone la depolarizzazione. L ipercalcemia è definita come una concentrazione di calcio totale superiore a 10.5 mg/dl o superire a 5.2 mg/dl se si considera solo il calcio ionizzato. Le cause più frequenti sono rappresentate da iperparatiroidismo (eccessiva secrezione di PTH), eccesso di vitamina D e tumori. L iperparatiroidismo è primitivo quando la secrezione abnorme di PTH è causata da una malattia delle paratiroidi (genetica o acquisita, es. un adenoma delle paratiroidi), secondario quando le paratiroidi sono stimolate eccessivamente da un ipocalcemia cronica e si sviluppa un iperplasia ghiandolare, che porta ad una secrezione di PTH inappropriata rispetto ai livelli di calcemia. L ipercalcemia nei tumori è causata dalla stimolazione del riassorbimento osseo con varii meccanismi, ad esempio la secrezione di PTH-related peptide (PTHrP); si tratta di una proteina il cui frammento N-terminale è simile a quello del PTH, e che ne mima gli effetti. Anche l ipercalcemia può essere asintomatica. Le manifestazioni cliniche salienti sono riassunte nello mnemonic "stones, bones, groans, moans, thrones and psychiatric overtones", ovverosia: calcoli (soprattutto renali); dolori ossei; letargia, debolezza muscolare, anoressia, nausea, vomito, dolori addominali, stipsi (groans e moans = lamenti); poliuria (throne = il
148 5 rmoni derivati dalla vitamina D 139 trono, cioè la toilette...); confusione, depressione, ansia, allucinazioni. A questo si devono aggiungere le possibili aritmie.
149 6 rmoni steroidei 6.1 Struttura e generalità Il termine steroidi designa una pletora di composti strutturalmente correlati al ciclopentanoperidrofenantrene, uno sterano. Questa struttura è formata dalla fusione di quattro anelli ciclici alifatici: tre molecole di cicloesano, a cui ci si riferisce con le lettere A B e C e note collettivamente come peridrofenantrene, e un ciclopentano, identificato dalla lettera D (fig. 6.1). È una struttura condivisa da tutti gli steroidi, che si differenziano essenzialmente per gruppi funzionali sostituiti agli idrogeni. La sostituzione di uno o più idrogeni con gruppi -H dà origine per esempio agli steroli. Nell uomo, quando si parla di steroidi ci si riferisce agli ormoni steroidei. Questi sono generalmente suddivisi in due gruppi: ormoni adrenocorticoidi: comprendono mineralcorticoidi (il cui principale rappresentante è l aldosterone) e glucocorticoidi (cortisolo e corticosterone). Sono composti a 21 atomi di carbonio. ormoni sessuali e progestinici: comprendono gli androgeni (androstenedione, testosterone, diidrotestosterone), a 19 C, e gli estrogeni (estradiolo, estriolo, estrone), a 18 C. Tra i progestinici, a 21 C, il principale è il progesterone. Sono tutti sintetizzati a partire dal colesterolo, uno sterolo caratterizzato da: un -H in posizione 3; A B 8 C D Figura 6.1: Struttura generale degli steroidi e nomenclatura.
150 6 rmoni steroidei 141 un doppio legame tra le posizioni 5 e 6; due gruppi metilici in posizione 10 e 13; una catena laterale in posizione 17. Le fonti del colesterolo utilizzato per sintetizzare gli ormoni sono in parte di origine esogena (colesterolo introdotto con l alimentazione, in particolare con alimenti di origine animale), in parte di origine endogena (colesterolo sintetizzato ex novo). Rivediamo sinteticamente i processi con cui questo composto si rende disponibile alle cellule. 1 Il colesterolo esogeno, alimentare, viene assorbito a livello dell intestino (insieme ai triacilgliceroli) all interno dei chilomicroni, che circolano nel sistema linfatico, per poi venire immessi nel circolo sanguigno, quindi trasportati al fegato. Qui il colesterolo viene impacchettato nelle lipoproteine LDL (a bassa densità), e inviato ai tessuti periferici. Il colesterolo entra nelle cellule con endocitosi mediata dal recettore per le LDL; a questo punto può andare incontro a diversi destini: per esempio, può entrare a far parte della membrana plasmatica, oppure - ed è il destino che prenderemo in esame tra poco - in alcuni tessuti (gonadi, corteccia della ghiandola surrenale, placenta) può essere utilizzato come precursore per la sintesi degli ormoni steroidei. Per quanto riguarda il colesterolo endogeno, rivediamo il processo a grandi linee: 1. A partire da acetil-coa viene sintetizzato mevalonato; 2. Il mevalonato viene decarbossilato per formare delle unità isoprenoidi; 3. Sei di queste unità vengono condensate nello squalene; 4. Lo squalene viene ciclizzato a formare lanosterolo; 5. Il lanosterolo è ulteriormente modificato in colesterolo; La biosintesi del colesterolo avviene soprattutto nel fegato (20-25%), a livello dell intestino, nella zona corticale della ghiandola surrenale, negli organi dell apparato riproduttore; notare come questi ultimi due organi siano proprio quelli maggiormente coinvolti nella steroidogenesi. Qualunque sia la fonte del colesterolo, nelle gonadi (ovaie o testicoli), nella zona corticale della ghiandola surrenale e (almeno in alcuni momenti fisiologici) placenta, questo viene utilizzato come precursore per la sintesi degli ormoni steroidei. Esiste 1 Per i dettagli, si rimanda ad un testo di biochimica, ad esempio: D. L. Nelson e M. M. Cox. Lehninger Principles of Biochemistry. Sixth Edition. W. H. Freeman, 2012, Chapter 21.
151 6 rmoni steroidei 142 anche una sintesi di ormoni steroidei in organi diversi da questi: ne parleremo dopo. Comunque sia, in ciascuno di questi organi, il colesterolo viene innanzi tutto convertito in pregnenolone in seguito alla rimozione della catena laterale in C17. Questa è la reazione di commissionamento del colesterolo verso la biosintesi degli ormoni steroidei. Il pregnenolone, a seconda del tessuto e delle esigenze, potrà poi subire diverse reazioni (che avranno luogo nei mitocondri oppure nel reticolo endoplasmatico) che porteranno alla sintesi dei varii ormoni. Adesso vedremo la sintesi di ciascuno, esaminando un tessuto alla volta. 6.2 rmoni della corteccia della ghiandola surrenale Per un breve cenno all anatomia e alla struttura delle ghiandole surrenali, si veda il box Dove siamo? a pagina Corticosteroidi: mineralcorticoidi e glucocorticoidi Sede di elaborazione La ghiandola surrenale sintetizza, a livello della zona corticale, gli ormoni adrenocorticoidi più una piccola quantità di androgeni (ma non il testosterone). Schematicamente: zona glomerulosa: mineralcorticoidi (es. aldosterone); zona fascicolata: glucocorticoidi (es. cortisolo), e corticosterone; zona reticolata: androgeni (es. androstenedione), e glucocorticoidi. Un modo per ricordarsi gli ormoni prodotti dalle zone della surrenale è tenere a mente la frase: Go Find Rex, Make Good Sex. 2 Biosintesi La prima reazione che incontriamo è la conversione del colesterolo in pregnenolone. Ricordiamo che questo è lo step di commissionamento, oltre che la reazione velocità-limitante. L enzima che catalizza la reazione si trova all interno dei mitocondri. Vediamo più in dettaglio come si svolge questa tappa. Il colesterolo nelle cellule delle ghiandole surrenali si trova esterificato in gocce lipidiche nel citoplasma (apprezzabili in microscopia elettronica). È evidente che uno 2 Go Find Rex aiuta a ricordarsi le zone della corticale, dall esterno all interno (Glomerulosa, Fascicolata, Reticolata); Make Good Sex indica i principali ormoni che vengono rispettivamente sintetizzati dalle tre zone (Mineralcorticoidi, Glucocorticoidi, ormoni Sessuali).
152 6 rmoni steroidei 143 H 3 C 2 NADPH NADP + CH + Colesterolo CYP450 11A1 Pregnenolone Isocaproaldeide Figura 6.2: Reazione di conversione del colesterolo in pregnenolone. Il pregnenolone è il precursore di molti ormoni che saranno illustrati in seguito. dei prerequisiti per il procedere della via biosintetica sia la disponibilità di substrato, dunque il colesterolo deve innanzi tutto essere liberato e trasportato dove si svolge la reazione, cioè all interno del mitocondrio. La mobilizzazione del colesterolo è una tappa regolata da segnali differenti nella zona glomerulosa (dove è stimolata dall angiotensina II) e nelle zone fascicolata e reticolata (dove è stimolata dall ACTH) (vedi Secrezione e Regolazione). Entrambi i segnali comunque attivano una esterasi, la quale agisce sulle gocce lipidiche e promuove la mobilizzazione del colesterolo. Il colesterolo penetra nella membrana esterna dei mitocondri, e viene traslocato a livello della membrana interna del mitocondrio da una proteina detta StAR (Steroidogenic Acute Regulatory protein), anche questa regolata. All interno della matrice mitocondriale si trova un importante membro della numerosa famiglia dei citocromi P450 (che conta più di 4500 membri!), CYP11A1. Come altri citocromi, il CYP450 11A1 catalizza una reazione monossigenasi: utilizzando un ossigeno a partire dall 2, l attività enzimatica catalizza l idrossilazione di un substrato. L altro ossigeno invece è ridotto ad H 2 utilizzando il potere riducente del NADPH. Questo tipo di reazione merita attenzione per diverse ragioni: un buon motivo è rappresentato dal fatto che questo è un potenziale luogo metabolico dove può avvenire formazione di RS (Reactive xygen Species) per incompleta riduzione dell ossigeno. Nel caso del colesterolo, la reazione che avviene è illustrata in figura 6.2. Il meccanismo di reazione comporta due idrossilazioni sequenziali, realizzate secondo le modalità appena viste, sul C22 e sul C20. Si formano quindi, come intermedi di reazione, prima 22-idrossicolesterolo, poi 20,22-diidrossicolesterolo. Infine, avviene il taglio ossidativo della catena laterale, con formazione di isocaproaldeide e pregnenolone (21 C). Il pregnenolone ha a questo punto diversi possibili destini. In generale, si tratta di reazioni a livello del mitocondrio o del REL che coinvolgono numerose idrossilasi (che richiedono 2 e NADPH), alcune deidrogenasi, una isomerasi e una liasi. Queste
153 6 rmoni steroidei 144 reazioni sono diverse a seconda della zona della corticale. Le diverse sequenze di reazioni portano ai composti che sono secreti dalle zone della corticale. Riferendoci agli schemi delle pagine 145, 146 e 147 esaminiamo come procede la sintesi. Il punto di partenza è il pregnenolone, in alto a sinistra. Zona glomerulosa. sserviamo la figura 6.3 (pagina 145). Le cellule di questa zona della corteccia non esprimono l enzima 17 α-idrossilasi, dunque la biosintesi procedere verso il progesterone (21 C). La catalisi è a carico di due enzimi del REL: 3 β-idrossisteroide deidrogenasi (ossida il gruppo -H sul C3 a gruppo chetonico); Δ 5,4 -isomerasi (sposta il doppio legame dalle posizioni 5,6 a 4,5). In generale, tutte le idrossilasi del REL che incontreremo sono citocromi. Un altra idrossilasi del REL converte il progesterone in 11-deossicorticosterone (DC). Questo è un mineralcorticoide, ma ha scarsa attività e non viene secreto in quantità apprezzabili: il suo ruolo metabolico è essenzialmente di fungere da precursore dell aldosterone. I successivi enzimi sono mitocondriali. L 11- β-idrossilasi catalizza la sintesi del corticosterone, che presenta attività mineralcorticoide e glucocorticoide. L azione sequenziale delle attività enzimatiche 18-idrossilasi e deidrogenasi, che complessivamente inseriscono un gruppo aldeidico in C18, portano alla sintesi dell aldosterone. Zona fascicolata. Le reazioni sono illustrate nella figura 6.4 (pagina 146). A livello della zona fascicolata avviene gran parte della sintesi dei glucocorticoidi (in parte avviene anche nella zona reticolata), che viene condotta da tre idrossilasi, in grado di inserire gruppi -H a livello di C17, C21, C11. Come prima, il composto di partenza è il pregnenolone. Nella maggior parte dei casi, questo diviene substrato della 17- α-idrossilasi (REL) ottenendo 17-idrossipregnenolone, che viene poi trasformato in 17-idrossiprogesterone, per subire le altre due idrossilazioni in sequenza. Infine, si ottiene cortisolo. Una minor quota di pregnenolone viene convertito prima in progesterone e poi idrossilato in 17. ccasionalmente, una parte del pregnenolone viene indirizzata alla sintesi dei mineralcorticoidi, ma le cellule della zona fascicolata non esprimono né la 18-idrossilasi, né la 18-idrossisteroide deidrogenasi, dunque si arriva al massimo fino al corticosterone.
154 6 rmoni steroidei 145 H 3C C Pregnenolone H 3C C Progesterone 17α-Idrossilasi 17α-Idrossilasi H 3C C H 17-Idrossipregnenolone 3β-Idrossisteroide deidrogenasi - Δ H 3C C H 17-Idrossiprogesterone 5,4 17,20-Liasi -Isomerasi 17,20-Liasi Deidroepiandrosterone Δ 4 Androstene-3,17-dione 21 C Idrossilasi CH 2 C CH 2 C H 11-Deossicorticosterone 11-Deossicortisolo 11β-Idrossilasi CH 2H C H CH 2 C H Corticosterone Cortisolo 18-Idrossilasi Zona glomerulosa 18-Idrossisteroide deidrogenasi Zona fascicolata CH 2H C CH Zona reticolare Aldosterone Zona midollare Zona corticale Figura 6.3: Biosintesi degli ormoni corticosteroidei. Nella zona glomerulosa (in rosso nel riquadro grande) avvengono le reazioni evidenziate.
155 6 rmoni steroidei 146 H 3C C Pregnenolone H 3C C Progesterone 17α-Idrossilasi 17α-Idrossilasi H 3C C H 17-Idrossipregnenolone 3β-Idrossisteroide deidrogenasi - Δ H 3C C H 17-Idrossiprogesterone 5,4 17,20-Liasi -Isomerasi 17,20-Liasi Deidroepiandrosterone Δ 4 Androstene-3,17-dione 21 C Idrossilasi CH 2 C CH 2 C H 11-Deossicorticosterone 11-Deossicortisolo 11β-Idrossilasi CH 2H C H CH 2 C H Corticosterone Cortisolo 18-Idrossilasi Zona glomerulosa 18-Idrossisteroide deidrogenasi Zona fascicolata CH 2H C CH Zona reticolare Aldosterone Zona midollare Zona corticale Figura 6.4: Biosintesi degli ormoni corticosteroidei. Nella zona fascicolata (in rosso nel riquadro grande) avvengono le reazioni evidenziate.
156 6 rmoni steroidei 147 H 3C C Pregnenolone H 3C C Progesterone 17α-Idrossilasi 17α-Idrossilasi H 3C C H 17-Idrossipregnenolone 3β-Idrossisteroide deidrogenasi - Δ H 3C C H 17-Idrossiprogesterone 5,4 17,20-Liasi -Isomerasi 17,20-Liasi Deidroepiandrosterone Δ 4 Androstene-3,17-dione 21 C Idrossilasi CH 2 C CH 2 C H 11-Deossicorticosterone 11-Deossicortisolo 11β-Idrossilasi CH 2H C H CH 2 C H Corticosterone Cortisolo 18-Idrossilasi Zona glomerulosa 18-Idrossisteroide deidrogenasi Zona fascicolata CH 2H C CH Zona reticolare Aldosterone Zona midollare Zona corticale Figura 6.5: Biosintesi degli ormoni corticosteroidei. Nella zona reticolare (in rosso nel riquadro grande) avvengono le reazioni evidenziate.
SISTEMA NEUROENDOCRINO ASSE IPOTALAMO -IPOFISI
 SISTEMA NEUROENDOCRINO ASSE IPOTALAMO -IPOFISI 1 Indice degli argomenti Che cos è il sistema neuroendocrino Asse ipotalamo-ipofisi Ipotalamo: Anatomia Ormoni dei neuroni magnocellulari : OSSITOCINA E ADH
SISTEMA NEUROENDOCRINO ASSE IPOTALAMO -IPOFISI 1 Indice degli argomenti Che cos è il sistema neuroendocrino Asse ipotalamo-ipofisi Ipotalamo: Anatomia Ormoni dei neuroni magnocellulari : OSSITOCINA E ADH
Cascate ormonali. Stimoli iniziali neuro-sensoriali Anelli di retroazione negativa (feedback) (ng) ( g) (mg)
 Ipotalamo-Ipofisi Cascate ormonali Stimoli iniziali neuro-sensoriali Anelli di retroazione negativa (feedback) (ng) ( g) (mg) 3 Nuclei sopra ottico e para ventricolare Ipofisi Anteriore Adenoipofisi
Ipotalamo-Ipofisi Cascate ormonali Stimoli iniziali neuro-sensoriali Anelli di retroazione negativa (feedback) (ng) ( g) (mg) 3 Nuclei sopra ottico e para ventricolare Ipofisi Anteriore Adenoipofisi
COMUNICAZIONE INTERCELLULARE
 COMUNICAZIONE INTERCELLULARE TRASFERIMENTO DIRETTO DI SEGNALI CHIMICI E ELETTRICI ATTRAVERSO GIUNZIONI COMUNICANTI COMUNICAZIONE CHIMICA LOCALE (SOSTANZE PARACRINE E AUTOCRINE) COMUNICAZIONE A LUNGA DISTANZA
COMUNICAZIONE INTERCELLULARE TRASFERIMENTO DIRETTO DI SEGNALI CHIMICI E ELETTRICI ATTRAVERSO GIUNZIONI COMUNICANTI COMUNICAZIONE CHIMICA LOCALE (SOSTANZE PARACRINE E AUTOCRINE) COMUNICAZIONE A LUNGA DISTANZA
IPOFISI (ghiandola pituitaria)
 IPOFISI (ghiandola pituitaria) Asse ipotalamo-ipofisario L ipotalamo è connesso all ipofisi posteriore per via nervosa neurosecrezione neuroipofisi L ipotalamo è connesso all ipofisi anteriore per via
IPOFISI (ghiandola pituitaria) Asse ipotalamo-ipofisario L ipotalamo è connesso all ipofisi posteriore per via nervosa neurosecrezione neuroipofisi L ipotalamo è connesso all ipofisi anteriore per via
Il sistema endocrino
 Il sistema endocrino (Pelle) (Cuore) (Rene) 1 Comunicazione intercellulare Autocrina La molecola segnale agisce sulla cellula che la secerne Paracrina La molecola segnale agisce sulle cellule vicine a
Il sistema endocrino (Pelle) (Cuore) (Rene) 1 Comunicazione intercellulare Autocrina La molecola segnale agisce sulla cellula che la secerne Paracrina La molecola segnale agisce sulle cellule vicine a
Ipotalamo ed ipofisi posteriore
 Ipotalamo ed ipofisi posteriore Regolazione neuroendocrina della omeostasi L Ipotalamo fa parte del diencefalo, è localizzato al di sotto del talamo tra lamina terminalis e corpi mammillari formando la
Ipotalamo ed ipofisi posteriore Regolazione neuroendocrina della omeostasi L Ipotalamo fa parte del diencefalo, è localizzato al di sotto del talamo tra lamina terminalis e corpi mammillari formando la
Sistema Endocrino 2. Adenoipofisi. Fisiologia Generale e dell Esercizio Prof. Carlo Capelli Facoltà di Scienze Motorie, Università di Verona
 Sistema Endocrino 2. Adenoipofisi Fisiologia Generale e dell Esercizio Prof. Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Neuroipofisi e adeno ipofisi: unità funzionale ipotalamo
Sistema Endocrino 2. Adenoipofisi Fisiologia Generale e dell Esercizio Prof. Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Neuroipofisi e adeno ipofisi: unità funzionale ipotalamo
IPOTALAMO e IPOFISI Berne & Levy cap. 45
 IPOTALAMO e IPOFISI Berne & Levy cap. 45 Ipotalamo E parte del Sistema Nervoso Centrale, dove, alla base dell encefalo, forma il pavimento del terzo ventricolo. Connette e integra le risposte del sistema
IPOTALAMO e IPOFISI Berne & Levy cap. 45 Ipotalamo E parte del Sistema Nervoso Centrale, dove, alla base dell encefalo, forma il pavimento del terzo ventricolo. Connette e integra le risposte del sistema
APPARATO TEGUMENTARIO. APPARATO LOCOMOTORE: scheletrico e muscolare APPARATO CARDIO-VASCOLARE SISTEMA IMMUNITARIO APPARATO DIGERENTE
 APPARATO TEGUMENTARIO APPARATO LOCOMOTORE: scheletrico e muscolare APPARATO CARDIO-VASCOLARE SISTEMA IMMUNITARIO APPARATO DIGERENTE APPARATO RESPIRATORIO APPARATO URINARIO APPARATO GENITALE APPARATO ENDOCRINO
APPARATO TEGUMENTARIO APPARATO LOCOMOTORE: scheletrico e muscolare APPARATO CARDIO-VASCOLARE SISTEMA IMMUNITARIO APPARATO DIGERENTE APPARATO RESPIRATORIO APPARATO URINARIO APPARATO GENITALE APPARATO ENDOCRINO
FEGATO. GHIANDOLA ENDOCRINA - Fibrinogeno - Protrombina - Lipoproteine - Colesterolo. GHIANDOLA ESOCRINA - Bile
 FEGATO GHIANDOLA ENDOCRINA - Fibrinogeno - Protrombina - Lipoproteine - Colesterolo GHIANDOLA ESOCRINA - Bile Vena epatica Vena porta Vena splenica (gastro-lienale) (stomaco-milza) Vena mesenterica sup.
FEGATO GHIANDOLA ENDOCRINA - Fibrinogeno - Protrombina - Lipoproteine - Colesterolo GHIANDOLA ESOCRINA - Bile Vena epatica Vena porta Vena splenica (gastro-lienale) (stomaco-milza) Vena mesenterica sup.
Il sistema endocrino
 Il sistema endocrino Indice delle lezioni: i LEZIONE 1 : Il sistema endocrino LEZIONE 2: Il sistema neuroendocrino: asse ipotalamo ipofisi Le ghiandole surrenali L asse ipotalamo-ipofisi-gonadi LEZIONE
Il sistema endocrino Indice delle lezioni: i LEZIONE 1 : Il sistema endocrino LEZIONE 2: Il sistema neuroendocrino: asse ipotalamo ipofisi Le ghiandole surrenali L asse ipotalamo-ipofisi-gonadi LEZIONE
Gli ormoni sono : peptidi o glicoproteine steroidi
 L apparato endocrino insieme al sistema nervoso coordina e controlla le attività cellulari e il metabolismo, ma con meccanismi e tempi diversi: veloci per il nervoso, più lenti e di lunga durata per l
L apparato endocrino insieme al sistema nervoso coordina e controlla le attività cellulari e il metabolismo, ma con meccanismi e tempi diversi: veloci per il nervoso, più lenti e di lunga durata per l
Omeostasi e coordinamento funzioni di un organismo
 Omeostasi e coordinamento funzioni di un organismo Organismi unicellulari Organismi pluricellulari Scambi attivi con l ambiente esterno Comunicazione elettrica Comunicazione chimica Meccanismi di comunicazione
Omeostasi e coordinamento funzioni di un organismo Organismi unicellulari Organismi pluricellulari Scambi attivi con l ambiente esterno Comunicazione elettrica Comunicazione chimica Meccanismi di comunicazione
CORSO DI ENDOCRINOLOGIA SCIENZE INFERMIERISTICHE UNIVERSITA DEGLI STUDI DI NAPOLI
 CORSO DI ENDOCRINOLOGIA SCIENZE INFERMIERISTICHE UNIVERSITA DEGLI STUDI DI NAPOLI DR. R. GIANNATTASIO ASL NA1 CENTRO LEZIONE 1 ENDOCRINOLOGIA E ORMONI NAPOLI, 01/03/2011 ORMONI SOSTANZE PRODOTTE DALLE
CORSO DI ENDOCRINOLOGIA SCIENZE INFERMIERISTICHE UNIVERSITA DEGLI STUDI DI NAPOLI DR. R. GIANNATTASIO ASL NA1 CENTRO LEZIONE 1 ENDOCRINOLOGIA E ORMONI NAPOLI, 01/03/2011 ORMONI SOSTANZE PRODOTTE DALLE
Biochimica Umana. Margherita Ruoppolo BDF56731
 Biochimica Umana Margherita Ruoppolo margherita.ruoppolo@unina.it www.federica.unina.it www.federica.eu BDF56731 BIOCHIMICA DEGLI ORMONI Testi consigliati: I PRINCIPI di BIOCHIMICA di LEHNINGER D.L. Nelson
Biochimica Umana Margherita Ruoppolo margherita.ruoppolo@unina.it www.federica.unina.it www.federica.eu BDF56731 BIOCHIMICA DEGLI ORMONI Testi consigliati: I PRINCIPI di BIOCHIMICA di LEHNINGER D.L. Nelson
Apparato endocrino. Sistema di comunicazione che utilizza messaggi chimici a conduzione lenta
 Apparato endocrino Sistema di comunicazione che utilizza messaggi chimici a conduzione lenta Ipofisi (ghiandola pituitaria) Adenoipofisi Neuroipofisi Neuroipofisi - fibre amieliniche+ pituiciti - nuclei
Apparato endocrino Sistema di comunicazione che utilizza messaggi chimici a conduzione lenta Ipofisi (ghiandola pituitaria) Adenoipofisi Neuroipofisi Neuroipofisi - fibre amieliniche+ pituiciti - nuclei
il lobo anteriore o ghiandolare (adenoipofisi) un lobo intermedio (pars intermedia) il lobo posteriore o nervoso (neuroipofisi).
 L ipofisi L ipofisi ècostituita da tre parti, strutturalmente e funzionalmente diverse, che controllano attraverso la secrezione di numerosi ormoni l attività endocrina e metabolica di tutto l organismo.
L ipofisi L ipofisi ècostituita da tre parti, strutturalmente e funzionalmente diverse, che controllano attraverso la secrezione di numerosi ormoni l attività endocrina e metabolica di tutto l organismo.
Sistema Endocrino 1. Principi generali. Fisiologia Generale e dell Esercizio Prof. Carlo Capelli Facoltà di Scienze Motorie, Università di Verona
 Sistema Endocrino 1. Principi generali Fisiologia Generale e dell Esercizio Prof. Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Principi generali di fisiologia endocrina Meccanismi
Sistema Endocrino 1. Principi generali Fisiologia Generale e dell Esercizio Prof. Carlo Capelli Facoltà di Scienze Motorie, Università di Verona Obiettivi Principi generali di fisiologia endocrina Meccanismi
LA SEGNALAZIONE CELLULARE
 LA SEGNALAZIONE CELLULARE Le cellule degli organismi pluricellulari più complessi sono specializzate e svolgono funzioni specifiche. Molti processi biologici richiedono che le cellule lavorino in modo
LA SEGNALAZIONE CELLULARE Le cellule degli organismi pluricellulari più complessi sono specializzate e svolgono funzioni specifiche. Molti processi biologici richiedono che le cellule lavorino in modo
Una risposta cellulare specifica può essere determinata dalla presenza di mediatori chimici (ormoni o altre molecole), dall interazione con altre
 Una risposta cellulare specifica può essere determinata dalla presenza di mediatori chimici (ormoni o altre molecole), dall interazione con altre cellule (contatto cellula-cellula) o con strutture extracellulari
Una risposta cellulare specifica può essere determinata dalla presenza di mediatori chimici (ormoni o altre molecole), dall interazione con altre cellule (contatto cellula-cellula) o con strutture extracellulari
OMEO= identico STASIS = stabile
 OMEOSTASI L'omeostasi è la condizione di stabilità interna degli organismi che deve mantenersi anche al variare delle condizioni esterne attraverso meccanismi autoregolatori. È il mantenimento della costanza
OMEOSTASI L'omeostasi è la condizione di stabilità interna degli organismi che deve mantenersi anche al variare delle condizioni esterne attraverso meccanismi autoregolatori. È il mantenimento della costanza
Regolazione metabolica: ruolo degli ormoni
 pag. 1 Regolazione metabolica: ruolo degli ormoni La regolazione del metabolismo avviene per azione degli ormoni L effetto degli ormoni si esplica su un numero limitato di proteine: prevalentemente enzimi
pag. 1 Regolazione metabolica: ruolo degli ormoni La regolazione del metabolismo avviene per azione degli ormoni L effetto degli ormoni si esplica su un numero limitato di proteine: prevalentemente enzimi
una cavità corporea, nel lume di un organo oppure sulla superficie esterna del
 Il sistema endocrino è costituito da diverse ghiandole endocrine e da molte cellule secretrici di ormoni, localizzate in organi che hanno anche altre funzioni. Vi sono due tipi di ghiandole le ghiandole
Il sistema endocrino è costituito da diverse ghiandole endocrine e da molte cellule secretrici di ormoni, localizzate in organi che hanno anche altre funzioni. Vi sono due tipi di ghiandole le ghiandole
Apparato Endocrino. Corso di Laurea in Farmacia AA
 Apparato Corso di Laurea in Farmacia AA 2011-2012 Prof. Eugenio Bertelli Professore associato di Anatomia Umana Università degli Studi di Siena Dipt. di Fisiopatologia, Medicina Sperimentale e Sanità Pubblica
Apparato Corso di Laurea in Farmacia AA 2011-2012 Prof. Eugenio Bertelli Professore associato di Anatomia Umana Università degli Studi di Siena Dipt. di Fisiopatologia, Medicina Sperimentale e Sanità Pubblica
Cellule e Ghiandole Endocrine
 Ghiandole Endocrine Cellule e Ghiandole Endocrine Ormoni nel sangue. Ghiandole singole. Tiroide, Ipofisi, Surreni In altre ghiandole Isole di Langerhans nel Pancreas. Cellule singole (Sistema Neuroendocrino
Ghiandole Endocrine Cellule e Ghiandole Endocrine Ormoni nel sangue. Ghiandole singole. Tiroide, Ipofisi, Surreni In altre ghiandole Isole di Langerhans nel Pancreas. Cellule singole (Sistema Neuroendocrino
CORSO DI ENDOCRINOLOGIA SCIENZE INFERMIERISTICHE UNIVERSITA DEGLI STUDI DI NAPOLI
 CORSO DI ENDOCRINOLOGIA SCIENZE INFERMIERISTICHE UNIVERSITA DEGLI STUDI DI NAPOLI DR. R. GIANNATTASIO ASL NA1 CENTRO LEZIONE 1 ENDOCRINOLOGIA E ORMONI NAPOLI, 09/05/2012 ENDOCRINOLOGIA E LA BRANCA DELLA
CORSO DI ENDOCRINOLOGIA SCIENZE INFERMIERISTICHE UNIVERSITA DEGLI STUDI DI NAPOLI DR. R. GIANNATTASIO ASL NA1 CENTRO LEZIONE 1 ENDOCRINOLOGIA E ORMONI NAPOLI, 09/05/2012 ENDOCRINOLOGIA E LA BRANCA DELLA
il sistema endocrino
 il sistema endocrino Funzioni del sistema endocrino Il sistema endocrino comprende ghiandole e cellule che secernono ormoni, la sua funzione di regolazione ormonale agisce su: crescita, riproduzione, difesa
il sistema endocrino Funzioni del sistema endocrino Il sistema endocrino comprende ghiandole e cellule che secernono ormoni, la sua funzione di regolazione ormonale agisce su: crescita, riproduzione, difesa
Mantenimento dell omeostasi
 Sistema Endocrino Ruolo nell omeostasi Ruolo nell esercizio fisico 1. Regolazione del metabolismo 2. Induzione di risposte adattative allo stress 3. Promozione della crescita e dello sviluppo sequenziale
Sistema Endocrino Ruolo nell omeostasi Ruolo nell esercizio fisico 1. Regolazione del metabolismo 2. Induzione di risposte adattative allo stress 3. Promozione della crescita e dello sviluppo sequenziale
Ormoni. Ghiandola endocrina
 Apparato Endocrino Ghiandola endocrina Ormone Ormoni Un ormone è una sostanza prodotta in piccola quantità da una ghiandola endocrina che trasportata nella circolazione sanguigna raggiunge un tessuto bersaglio
Apparato Endocrino Ghiandola endocrina Ormone Ormoni Un ormone è una sostanza prodotta in piccola quantità da una ghiandola endocrina che trasportata nella circolazione sanguigna raggiunge un tessuto bersaglio
Concetti chiave Cascata ormonale Ormoni derivati da amminoacido Tirosina (catecolammine: adrenalina, noradrenalina, o.tiroidei) Ormoni peptidici e
 ORMONI Concetti chiave Cascata ormonale Ormoni derivati da amminoacido Tirosina (catecolammine: adrenalina, noradrenalina, o.tiroidei) Ormoni peptidici e proteici: -trasmettono il loro segnale legando
ORMONI Concetti chiave Cascata ormonale Ormoni derivati da amminoacido Tirosina (catecolammine: adrenalina, noradrenalina, o.tiroidei) Ormoni peptidici e proteici: -trasmettono il loro segnale legando
Mantenimento dell omeostasi
 Sistema Endocrino Ruolo nell omeostasi Ruolo nell esercizio fisico 1. Regolazione del metabolismo 2. Induzione di risposte adattative allo stress 3. Promozione della crescita e dello sviluppo sequenziale
Sistema Endocrino Ruolo nell omeostasi Ruolo nell esercizio fisico 1. Regolazione del metabolismo 2. Induzione di risposte adattative allo stress 3. Promozione della crescita e dello sviluppo sequenziale
IL SISTEMA ENDOCRINO composizione
 IL SISTEMA ENDOCRINO composizione Le ghiandole endocrine sono importanti organi dislocati in varie sedi del nostro corpo che, attraverso la produzione di ormoni, ne controllano alcune funzioni fondamentali.
IL SISTEMA ENDOCRINO composizione Le ghiandole endocrine sono importanti organi dislocati in varie sedi del nostro corpo che, attraverso la produzione di ormoni, ne controllano alcune funzioni fondamentali.
LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE
 LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE 1 ALDOSTERONE Ormone steroideo rilasciato dalla corticale surrenale l aldosterone stimola: riassorbimento di Na +
LEZIONE 29: REGOLAZIONE NEUROORMONALE MECCANISMI NEUROORMONALI DI REGOLAZIONE DEL RENE 1 ALDOSTERONE Ormone steroideo rilasciato dalla corticale surrenale l aldosterone stimola: riassorbimento di Na +
Le ghiandole endocrine centrali
 Le ghiandole endocrine centrali Ipotalamo e ipofisi (ghiandola pituitaria) ghiandole endocrine centrali 1 Ipotalamo e neuroipofisi agiscono come unità per secernere vasopressina e ossicitina La secrezione
Le ghiandole endocrine centrali Ipotalamo e ipofisi (ghiandola pituitaria) ghiandole endocrine centrali 1 Ipotalamo e neuroipofisi agiscono come unità per secernere vasopressina e ossicitina La secrezione
Modalità di trasmissione di segnali chimici tra cellule
 Modalità di trasmissione di segnali chimici tra cellule secrezione autocrina messaggero chimico secrezione paracrina messaggero chimico secrezione endocrina secrezione sinaptica cellule bersaglio messaggero
Modalità di trasmissione di segnali chimici tra cellule secrezione autocrina messaggero chimico secrezione paracrina messaggero chimico secrezione endocrina secrezione sinaptica cellule bersaglio messaggero
1) Comunicazione diretta attraverso giunzioni comunicanti 2) Comunicazione tramite messaggeri chimici
 Una complessa rete di comunicazione tra cellule coordina la crescita, il differenziamento e il metabolismo in tutti gli organismi pluricellulari. Si riconoscono due tipologie di comunicazione intercellulare:
Una complessa rete di comunicazione tra cellule coordina la crescita, il differenziamento e il metabolismo in tutti gli organismi pluricellulari. Si riconoscono due tipologie di comunicazione intercellulare:
Gli organismi multicellulari si devono adattare ad un ambiente esterno che cambia continuamente. A tale scopo operano due sistemi, il sistema nervoso
 Gli organismi multicellulari si devono adattare ad un ambiente esterno che cambia continuamente. A tale scopo operano due sistemi, il sistema nervoso ed il sistema endocrino. Il sistema nervoso gestisce
Gli organismi multicellulari si devono adattare ad un ambiente esterno che cambia continuamente. A tale scopo operano due sistemi, il sistema nervoso ed il sistema endocrino. Il sistema nervoso gestisce
Nei metazoi l integrazione delle funzioni di organi e tessuti è realizzata dal sistema nervoso e dal sistema endocrino
 Nei metazoi l integrazione delle funzioni di organi e tessuti è realizzata dal sistema nervoso e dal sistema endocrino Il sistema nervoso e il sistema endocrino sono dei sistemi di comunicazione I due
Nei metazoi l integrazione delle funzioni di organi e tessuti è realizzata dal sistema nervoso e dal sistema endocrino Il sistema nervoso e il sistema endocrino sono dei sistemi di comunicazione I due
IL SISTEMA ENDOCRINO S I L V I A G O R I G I O R G I A F A Z I O S U S A N N A D I L E O G I U L I A C O N T E A N N A M I C C O L I
 IL SISTEMA ENDOCRINO S I L V I A G O R I G I O R G I A F A Z I O S U S A N N A D I L E O G I U L I A C O N T E A N N A M I C C O L I INTRODUZIONE La funzione del sistema endocrino è quella di coordinare
IL SISTEMA ENDOCRINO S I L V I A G O R I G I O R G I A F A Z I O S U S A N N A D I L E O G I U L I A C O N T E A N N A M I C C O L I INTRODUZIONE La funzione del sistema endocrino è quella di coordinare
iridologica classica Il sistema endocrino Cell /
 iridologica classica Il sistema endocrino Dr Giuseppe Tagliente Statte-Taranto Cell 330331304 / 3287791833 taglientegiuseppe@hotmail.com www.taglientegiuseppe.it 1. Panoramica dell apparato endocrino 2.
iridologica classica Il sistema endocrino Dr Giuseppe Tagliente Statte-Taranto Cell 330331304 / 3287791833 taglientegiuseppe@hotmail.com www.taglientegiuseppe.it 1. Panoramica dell apparato endocrino 2.
Modalità di trasmissione di segnali chimici tra cellule
 Modalità di trasmissione di segnali chimici tra cellule secrezione autocrina messaggero chimico secrezione paracrina messaggero chimico secrezione endocrina secrezione sinaptica cellule bersaglio messaggero
Modalità di trasmissione di segnali chimici tra cellule secrezione autocrina messaggero chimico secrezione paracrina messaggero chimico secrezione endocrina secrezione sinaptica cellule bersaglio messaggero
T corporea, pressione sanguigna, ritmo cardiaco insulina, calcio)
 SISTEMA ENDOCRINO Che cos'è? Sistema di controllo dell'organismo che affianca e integra il SN Com'è la sua azione rispetto a quella del SN? + lenta ma altrettanto efficiente: interviene nelle attività
SISTEMA ENDOCRINO Che cos'è? Sistema di controllo dell'organismo che affianca e integra il SN Com'è la sua azione rispetto a quella del SN? + lenta ma altrettanto efficiente: interviene nelle attività
I GLUCOCORTICOIDI. il principale glucocorticoide è il CORTISOLO
 I GLUCOCORTICOIDI Chi sono e biosintesi: il principale glucocorticoide è il CORTISOLO ACTH svolge la sua azione sulla corticale stimolando la biosintesi della: 1. PROTEINA ATTIVATRICE DELLA STEROIDOGENESI:
I GLUCOCORTICOIDI Chi sono e biosintesi: il principale glucocorticoide è il CORTISOLO ACTH svolge la sua azione sulla corticale stimolando la biosintesi della: 1. PROTEINA ATTIVATRICE DELLA STEROIDOGENESI:
Salvatore Fedele Ass. Studenti per Medicina
 Salvatore Fedele Ass. Studenti per Medicina SISTEMA ENDOCRINO L'apparato endocrino o sistema ormonale è rappresentato da un insieme di ghiandole (dette ghiandole endocrine) le quali secernono delle sostanze
Salvatore Fedele Ass. Studenti per Medicina SISTEMA ENDOCRINO L'apparato endocrino o sistema ormonale è rappresentato da un insieme di ghiandole (dette ghiandole endocrine) le quali secernono delle sostanze
Relazioni tra sistema endocrino e sistema nervoso
 Relazioni tra sistema endocrino e sistema nervoso Meccanismi di comunicazione cellulare Classificazione degli ormoni Tipologie di recettori ghiandola ormone/i principali azioni fisiologiche ipotalamo
Relazioni tra sistema endocrino e sistema nervoso Meccanismi di comunicazione cellulare Classificazione degli ormoni Tipologie di recettori ghiandola ormone/i principali azioni fisiologiche ipotalamo
1) Sostanze liberate A B Recettori ormoni altre 2) Conduzione di segnali elettrici
 MECCANISMI DI TRASMISSIONE DEI MESSAGGI LA COMUNICAZIONE CELLULARE 1) Sostanze liberate A B Recettori ormoni altre 2) Conduzione di segnali elettrici CONDUZIONE SALTATORIA PROPAGAZIONE DI UN PdA LUNGO
MECCANISMI DI TRASMISSIONE DEI MESSAGGI LA COMUNICAZIONE CELLULARE 1) Sostanze liberate A B Recettori ormoni altre 2) Conduzione di segnali elettrici CONDUZIONE SALTATORIA PROPAGAZIONE DI UN PdA LUNGO
SECONDI MESSAGGERI. Ca++
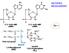 SECONDI MESSAGGERI Ca++ Recettori di membrana associati a proteine G che attivano la fosfolipasi C II messaggeri: - derivati del fosfatidil inositolo - Ca ++ Sintesi dei secondi messaggeri DAG e IP dal
SECONDI MESSAGGERI Ca++ Recettori di membrana associati a proteine G che attivano la fosfolipasi C II messaggeri: - derivati del fosfatidil inositolo - Ca ++ Sintesi dei secondi messaggeri DAG e IP dal
ENDOCRINOLOGIA RIPRODUTTIVA NEL MASCHIO
 ENDOCRINOLOGIA RIPRODUTTIVA NEL MASCHIO Una normale spermatogenesi dipende dal corretto funzionamento dell asse ipotalamoipofisi-gonadi Presenza di un meccanismo endocrino con l azione delle gonadotropine
ENDOCRINOLOGIA RIPRODUTTIVA NEL MASCHIO Una normale spermatogenesi dipende dal corretto funzionamento dell asse ipotalamoipofisi-gonadi Presenza di un meccanismo endocrino con l azione delle gonadotropine
Alberts et al., L ESSENZIALE DI BIOLOGIA MOLECOLARE DELLA CELLULA, Zanichelli editore S.p.A. Copyright 2005
 La conversione dell informazione da una forma ad un altra è il punto critico della trasmissione e prende il nome di: TRASDUZIONE DEL SEGNALE Nella comunicazione cellulare: Molecola segnale Proteina recettore
La conversione dell informazione da una forma ad un altra è il punto critico della trasmissione e prende il nome di: TRASDUZIONE DEL SEGNALE Nella comunicazione cellulare: Molecola segnale Proteina recettore
Il sistema endocrino
 Il sistema endocrino 0 I messaggeri chimici 0 I messaggeri chimici coordinano le diverse funzioni dell organismo Gli animali regolano le proprie attività per mezzo di messaggeri chimici. Un ormone è una
Il sistema endocrino 0 I messaggeri chimici 0 I messaggeri chimici coordinano le diverse funzioni dell organismo Gli animali regolano le proprie attività per mezzo di messaggeri chimici. Un ormone è una
IL SISTEMA ENDOCRINO 1
 IL SISTEMA ENDOCRINO 1 I messaggeri chimici I messaggeri chimici coordinano le diverse funzioni dell organismo Gli animali regolano le proprie attività per mezzo di messaggeri chimici. Un ormone è una
IL SISTEMA ENDOCRINO 1 I messaggeri chimici I messaggeri chimici coordinano le diverse funzioni dell organismo Gli animali regolano le proprie attività per mezzo di messaggeri chimici. Un ormone è una
ENDOCRINOLOGIA RIPRODUTTIVA NEL MASCHIO
 ENDOCRINOLOGIA RIPRODUTTIVA NEL MASCHIO Una normale spermatogenesi dipende dal corretto funzionamento dell asse ipotalamoipofisi-gonadi Presenza di un meccanismo endocrino con l azione delle gonadotropine
ENDOCRINOLOGIA RIPRODUTTIVA NEL MASCHIO Una normale spermatogenesi dipende dal corretto funzionamento dell asse ipotalamoipofisi-gonadi Presenza di un meccanismo endocrino con l azione delle gonadotropine
IL SISTEMA ENDOCRINO UNIVERSITA DEGLI STUDI URBINO FACOLTA DI SCIENZE MOTORIE. Prof.Mauro Andreani 08/marzo/2016
 UNIVERSITA DEGLI STUDI URBINO FACOLTA DI SCIENZE MOTORIE Prof.Mauro Andreani 08/marzo/2016 SECERNERE ALL INTERNO ORMONI(stimolare eccitare) Messaggeri chimici RECETTORE ORMONE-RECETTORE Essenza del sistema
UNIVERSITA DEGLI STUDI URBINO FACOLTA DI SCIENZE MOTORIE Prof.Mauro Andreani 08/marzo/2016 SECERNERE ALL INTERNO ORMONI(stimolare eccitare) Messaggeri chimici RECETTORE ORMONE-RECETTORE Essenza del sistema
APPARATO ENDOCRINO. Scambio di informazioni : SISTEMA NERVOSO : mezzo di comunicazione/selettività: assoni e dendriti
 APPARATO ENDOCRINO Un sistema di comunicazione tra cellule deputato al controllo ed alla regolazione di numerose funzioni essenziali per la sopravvivenza : omeostasi, crescita, riproduzione Scambio di
APPARATO ENDOCRINO Un sistema di comunicazione tra cellule deputato al controllo ed alla regolazione di numerose funzioni essenziali per la sopravvivenza : omeostasi, crescita, riproduzione Scambio di
CONTROLLO DELL OSMOLALITA DEI LIQUIDI CORPOREI
 CONTROLLO DELL OSMOLALITA DEI LIQUIDI CORPOREI Il rene è responsabile del controllo dell escrezione di acqua. Altre vie che consentono l eliminazione di acqua dall organismo includono sudorazione, feci
CONTROLLO DELL OSMOLALITA DEI LIQUIDI CORPOREI Il rene è responsabile del controllo dell escrezione di acqua. Altre vie che consentono l eliminazione di acqua dall organismo includono sudorazione, feci
APPARATO ENDOCRINO. Bortolami et al. Capitolo IX
 APPARATO ENDOCRINO o composto da ghiandole a secrezione interna queste ghiandole sono prive di condotti escretori o i prodotti delle gh. endocrine (ormoni) sono versati direttamente nel circolo sanguigno
APPARATO ENDOCRINO o composto da ghiandole a secrezione interna queste ghiandole sono prive di condotti escretori o i prodotti delle gh. endocrine (ormoni) sono versati direttamente nel circolo sanguigno
Io Non sono un recettore!
 I recettori portano il messaggio extracellulare direttamente nel citoplasma (recettori di membrana) o nel nucleo (recettori nucleari) Io Non sono un recettore! È essenziale per la loro sopravvivenza che
I recettori portano il messaggio extracellulare direttamente nel citoplasma (recettori di membrana) o nel nucleo (recettori nucleari) Io Non sono un recettore! È essenziale per la loro sopravvivenza che
IL SISTEMA ENDOCRINO
 IL SISTEMA ENDOCRINO LA FUNZIONE DEL SISTEMA ENDOCRINO Per coordinare tutte le attività del nostro organismo e mantenere una condizione di equilibrio interno (detta omeostasi) ci serviamo di due sistemi
IL SISTEMA ENDOCRINO LA FUNZIONE DEL SISTEMA ENDOCRINO Per coordinare tutte le attività del nostro organismo e mantenere una condizione di equilibrio interno (detta omeostasi) ci serviamo di due sistemi
Mediatore chimico. Recettore. Trasduzione del segnale. Risposta della cellula
 Mediatore chimico Recettore Trasduzione del segnale Risposta della cellula I mediatori chimici sono prodotti da cellule specializzate e sono diffusi nell organismo da apparati di distribuzione Sistemi
Mediatore chimico Recettore Trasduzione del segnale Risposta della cellula I mediatori chimici sono prodotti da cellule specializzate e sono diffusi nell organismo da apparati di distribuzione Sistemi
SISTEMA ENDOCRINO. Prof.ssa S. Di Giulio
 Prof.ssa S. Di Giulio Il Sistema Endocrino svolge, insieme al sistema nervoso, un azione di controllo e regolazione delle funzioni del corpo Mentre però il sistema nervoso opera in maniera rapida, il sistema
Prof.ssa S. Di Giulio Il Sistema Endocrino svolge, insieme al sistema nervoso, un azione di controllo e regolazione delle funzioni del corpo Mentre però il sistema nervoso opera in maniera rapida, il sistema
Utilizzazione metabolica dei nutrienti
 Utilizzazione metabolica dei nutrienti Il rifornimento di substrati è discontinuo Fase postprandiale utilizzazione dei nutrienti esogeni e messa in riserva Fase postassorbitiva (digiuno) mobilizzazione
Utilizzazione metabolica dei nutrienti Il rifornimento di substrati è discontinuo Fase postprandiale utilizzazione dei nutrienti esogeni e messa in riserva Fase postassorbitiva (digiuno) mobilizzazione
Modulo 11 biosegnalazione
 Modulo 11 biosegnalazione La trasduzione del segnale Capacità di ricevere e rispondere a segnali esterni alla membrana è un processo fondamentale per la vita. Organismi pluricellulari si scambiano informazioni:
Modulo 11 biosegnalazione La trasduzione del segnale Capacità di ricevere e rispondere a segnali esterni alla membrana è un processo fondamentale per la vita. Organismi pluricellulari si scambiano informazioni:
DIENCEFALO. PROF. ALESSANDRO MALFATTI Corso di fisiologia generale veterinaria IL TALAMO
 IL TALAMO Struttura di materia grigia sottocorticale che fa parte del diencefalo È fondamentalmente un organo con funzioni di STAZIONE SENSITIVA interposta fra la corteccia e le strutture sottostanti È
IL TALAMO Struttura di materia grigia sottocorticale che fa parte del diencefalo È fondamentalmente un organo con funzioni di STAZIONE SENSITIVA interposta fra la corteccia e le strutture sottostanti È
l origine del problema
 l origine del problema fin dall antichità l uomo si chiede se gli animali abbiano pensieri e emozioni fino all 800 gran parte degli allevamenti richiede agli animali produzioni in quantità poco più che
l origine del problema fin dall antichità l uomo si chiede se gli animali abbiano pensieri e emozioni fino all 800 gran parte degli allevamenti richiede agli animali produzioni in quantità poco più che
Modulo 11 biosegnalazione
 Modulo 11 biosegnalazione La trasduzione del segnale Capacità di ricevere e rispondere a segnali esterni alla membrana è un processo fondamentale per la vita. Organismi pluricellulari si scambiano informazioni:
Modulo 11 biosegnalazione La trasduzione del segnale Capacità di ricevere e rispondere a segnali esterni alla membrana è un processo fondamentale per la vita. Organismi pluricellulari si scambiano informazioni:
TRASDUZIONE DEL SEGNALE CELLULARE
 TRASDUZIONE DEL SEGNALE CELLULARE RECETTORI I recettori ormonali sono proteine (spesso glicoproteine) capaci di riconoscere e legare l ormone L interazione tra ormone e recettore è estremamente specifica
TRASDUZIONE DEL SEGNALE CELLULARE RECETTORI I recettori ormonali sono proteine (spesso glicoproteine) capaci di riconoscere e legare l ormone L interazione tra ormone e recettore è estremamente specifica
Apparato endocrino. Controllo della calcemia. Effetti delle variazioni della concentrazione di calcio. 9.4 mg/100 ml Calcemia normale
 Università degli Studi di Perugia Dipartimento di Medicina Sperimentale Sezione di Fisiologia e Biochimica Apparato endocrino Controllo della calcemia Effetti delle variazioni della concentrazione di calcio
Università degli Studi di Perugia Dipartimento di Medicina Sperimentale Sezione di Fisiologia e Biochimica Apparato endocrino Controllo della calcemia Effetti delle variazioni della concentrazione di calcio
FISIOLOGIA MOLECOLARE ormoni: messaggeri chimici (coordinano le attività cellulari negli organismi multicellulari) sangue
 FISIOLOGIA MOLECOLARE ormoni: messaggeri chimici (coordinano le attività cellulari negli organismi multicellulari) 1. molecole sintetizzate da tessuti specifici (ghiandole a secrezione interna), 2. secreti
FISIOLOGIA MOLECOLARE ormoni: messaggeri chimici (coordinano le attività cellulari negli organismi multicellulari) 1. molecole sintetizzate da tessuti specifici (ghiandole a secrezione interna), 2. secreti
Ghiandole endocrine centrali
 Ghiandole endocrine centrali Ipotalamo e ipofisi: ghiandole endocrine centrali Ipotalamo e neuroipofisi agiscono come unità per secernere vasopressina e ossicitina 1 La secrezione di ormoni dell adenoipofisi
Ghiandole endocrine centrali Ipotalamo e ipofisi: ghiandole endocrine centrali Ipotalamo e neuroipofisi agiscono come unità per secernere vasopressina e ossicitina 1 La secrezione di ormoni dell adenoipofisi
Dotto escretore: trasporta il secreto all esterno. Non c è dotto escretore; il secreto (ormoni) è riversato nel circolo sanguigno
 Sono organi formati da una parte secernente (il parenchima ghiandolare) che è tessuto epiteliale specializzato nella produzione di molecole: il secreto ghiandolare una parte di sostegno (lo stroma ghiandolare)
Sono organi formati da una parte secernente (il parenchima ghiandolare) che è tessuto epiteliale specializzato nella produzione di molecole: il secreto ghiandolare una parte di sostegno (lo stroma ghiandolare)
ORMONI. Sostanze presenti nel sangue a concentrazioni molto basse ( M)
 ORMONI Sostanze presenti nel sangue a concentrazioni molto basse (10-15 -10-9 M) Classificazione funzionale: Endocrino: origina in una ghiandola e agisce su una cellula-bersaglio distante. Paracrino: origina
ORMONI Sostanze presenti nel sangue a concentrazioni molto basse (10-15 -10-9 M) Classificazione funzionale: Endocrino: origina in una ghiandola e agisce su una cellula-bersaglio distante. Paracrino: origina
Livelli gonadotropici durante la vita
 Livelli gonadotropici durante la vita? Secrezione delle gonadotropine e degli estrogeni durante la pubertà FSH 10 LH E 2 LH FSH In una ragazzina di 13 anni, le gonadotropine vengono liberate ogni 20 minuti
Livelli gonadotropici durante la vita? Secrezione delle gonadotropine e degli estrogeni durante la pubertà FSH 10 LH E 2 LH FSH In una ragazzina di 13 anni, le gonadotropine vengono liberate ogni 20 minuti
Il pancreas endocrino
 Il pancreas endocrino 1 Indice degli argomenti Che cos è il pancreas endocrino??? Funzioni principali degli ormoni pancreatici Anatomia del pancreas endocrino Innervazione nervosa Cellule β : INSULINA
Il pancreas endocrino 1 Indice degli argomenti Che cos è il pancreas endocrino??? Funzioni principali degli ormoni pancreatici Anatomia del pancreas endocrino Innervazione nervosa Cellule β : INSULINA
ORMONE DELLA CRESCITA (GH, o somatotropina)
 ORMONE DELLA CRESCITA (GH, o somatotropina) Caratteristiche Polipeptide a catena singola di 191 aa con pm 21.500 D Prodotto dalle cellule somatotrope dell ipofisi anteriore In circolo è legato per l 85-90%
ORMONE DELLA CRESCITA (GH, o somatotropina) Caratteristiche Polipeptide a catena singola di 191 aa con pm 21.500 D Prodotto dalle cellule somatotrope dell ipofisi anteriore In circolo è legato per l 85-90%
SISTEMA ENDOCRINO LA RETE DI INFORMAZIONE ENDOCRINA E ESTREMAMENTE COMPLESSA
 SISTEMA ENDOCRINO IL SISTEMA ENDOCRINO INSIEME AL SISTEMA NERVOSO ED AL SISTEMA IMMUNITARIO, CON CUI INTERAGISCE, FORNISCE, ATTRAVERSO MESSAGGI CHIMICI, GLI ORMONI, IL COORDINAMENTO FUNZIONALE FRA I TESSUTI
SISTEMA ENDOCRINO IL SISTEMA ENDOCRINO INSIEME AL SISTEMA NERVOSO ED AL SISTEMA IMMUNITARIO, CON CUI INTERAGISCE, FORNISCE, ATTRAVERSO MESSAGGI CHIMICI, GLI ORMONI, IL COORDINAMENTO FUNZIONALE FRA I TESSUTI
ORMONI. Sostanze presenti nel sangue a concentrazioni molto basse ( M)
 ORMONI Sostanze presenti nel sangue a concentrazioni molto basse (10-15 -10-9 M) Classificazione funzionale: Endocrino: origina in una ghiandola e agisce su una cellula-bersaglio distante. Paracrino: origina
ORMONI Sostanze presenti nel sangue a concentrazioni molto basse (10-15 -10-9 M) Classificazione funzionale: Endocrino: origina in una ghiandola e agisce su una cellula-bersaglio distante. Paracrino: origina
COSA DOBBIAMO RICORDARE: 19. FUNZIONE OMEOSTATICA DEL RENE
 COSA DOBBIAMO RICORDARE: 19. FUNZIONE OMEOSTATICA DEL RENE 1. La Concentrazione delle urine 2. La creazione del gradiente osmotico nella midollare del rene da parte del meccanismo controcorrente: acquaporine
COSA DOBBIAMO RICORDARE: 19. FUNZIONE OMEOSTATICA DEL RENE 1. La Concentrazione delle urine 2. La creazione del gradiente osmotico nella midollare del rene da parte del meccanismo controcorrente: acquaporine
Tutor Pietro Bortoluzzi Cell
 Prof.ssa Paola Guandalini ---------------------------------------------------- Università degli Studi di Ferrara Dipartimento di Scienze Biomediche e Chirurgico specialistiche Sezione di Fisiologia Umana
Prof.ssa Paola Guandalini ---------------------------------------------------- Università degli Studi di Ferrara Dipartimento di Scienze Biomediche e Chirurgico specialistiche Sezione di Fisiologia Umana
APPARATO ENDOCRINO. E costituito da GHIANDOLE ENDOCRINE, da GRUPPI di CELLULE o singole CELLULE ENDOCRINE
 APPARATO ENDOCRINO APPARATO ENDOCRINO E costituito da GHIANDOLE ENDOCRINE, da GRUPPI di CELLULE o singole CELLULE ENDOCRINE Produzione di ORMONI che agiscono a livello di ORGANI BERSAGLIO FUNZIONE REGOLA
APPARATO ENDOCRINO APPARATO ENDOCRINO E costituito da GHIANDOLE ENDOCRINE, da GRUPPI di CELLULE o singole CELLULE ENDOCRINE Produzione di ORMONI che agiscono a livello di ORGANI BERSAGLIO FUNZIONE REGOLA
TRASMISSIONE DEI SEGNALI E COMUNICAZIONE TRA LE CELLULE
 TRASMISSIONE DEI SEGNALI E COMUNICAZIONE TRA LE CELLULE GLI ORMONI SONO MESSAGGERI CHIMICI SINTETIZZATI DA CELLULE O GHIANDOLE DETTE ENDOCRINE POICHE RIVERSANO NEL SANGUE DIRETTAMENTE QUESTI LORO PRODOTTI.
TRASMISSIONE DEI SEGNALI E COMUNICAZIONE TRA LE CELLULE GLI ORMONI SONO MESSAGGERI CHIMICI SINTETIZZATI DA CELLULE O GHIANDOLE DETTE ENDOCRINE POICHE RIVERSANO NEL SANGUE DIRETTAMENTE QUESTI LORO PRODOTTI.
La trasduzione del segnale intracellulare
 La trasduzione del segnale intracellulare Chemical signaling mechanisms I RECETTORI Farmaci antagonisti I beta-bloccanti per l ipertensione competono con adrenalina e noradrenalina per il recettore beta-adrenergico.
La trasduzione del segnale intracellulare Chemical signaling mechanisms I RECETTORI Farmaci antagonisti I beta-bloccanti per l ipertensione competono con adrenalina e noradrenalina per il recettore beta-adrenergico.
BCM NOME COGNOME MATRICOLA
 BCM COG 1 1 Trasporti attivi e trasporti passivi attraverso la membrana plasmatica 2 Ruolo del calcio nella contrazione del muscolo striato scheletrico 3 Il ritorno venoso: fattori che lo determinano e
BCM COG 1 1 Trasporti attivi e trasporti passivi attraverso la membrana plasmatica 2 Ruolo del calcio nella contrazione del muscolo striato scheletrico 3 Il ritorno venoso: fattori che lo determinano e
Mediatore chimico. Recettore. Trasduzione del segnale. Risposta della cellula
 Mediatore chimico Recettore Trasduzione del segnale Risposta della cellula I mediatori chimici sono prodotti da cellule specializzate e sono diffusi nell organismo da apparati di distribuzione Sistemi
Mediatore chimico Recettore Trasduzione del segnale Risposta della cellula I mediatori chimici sono prodotti da cellule specializzate e sono diffusi nell organismo da apparati di distribuzione Sistemi
APPARATO RIPRODUTTORE MASCHILE
 APPARATO RIPRODUTTORE MASCHILE ORGANI DI RIPRODUZIONE ORGANI DI TRASPORTO ORMONI e CICLO ORMONALE APPARATO RIPRODUTTORE MASCHILE GONADI MASCHILI (testicoli) Definizione GRANDEZZA LOCALIZZAZIONE ghiandole
APPARATO RIPRODUTTORE MASCHILE ORGANI DI RIPRODUZIONE ORGANI DI TRASPORTO ORMONI e CICLO ORMONALE APPARATO RIPRODUTTORE MASCHILE GONADI MASCHILI (testicoli) Definizione GRANDEZZA LOCALIZZAZIONE ghiandole
Apparato endocrino. Controllo della glicemia. Il pancreas endocrino. Università degli Studi di Perugia
 Università degli Studi di Perugia Dipartimento di Medicina Sperimentale Sezione di Fisiologia e Biochimica Apparato endocrino Controllo della glicemia Il pancreas endocrino 1 Insulina: struttura e biosintesi
Università degli Studi di Perugia Dipartimento di Medicina Sperimentale Sezione di Fisiologia e Biochimica Apparato endocrino Controllo della glicemia Il pancreas endocrino 1 Insulina: struttura e biosintesi
scaricatoda Come è noto il SNC controlla i muscoli e gli altri organi attraverso la branca efferente del SNP.
 Come è noto il SNC controlla i muscoli e gli altri organi attraverso la branca efferente del SNP. Il sistema parasimpatico controlla la routine e le attività tranquille del vivere quotidiano, come per
Come è noto il SNC controlla i muscoli e gli altri organi attraverso la branca efferente del SNP. Il sistema parasimpatico controlla la routine e le attività tranquille del vivere quotidiano, come per
Jay Phelan, Maria Cristina Pignocchino. Scopriamo la biologia
 Jay Phelan, Maria Cristina Pignocchino Scopriamo la biologia Capitolo 13 Il sistema endocrino e la riproduzione 3 1. La struttura e le funzioni del sistema endocrino /1 Gli ormoni sono molecole di varia
Jay Phelan, Maria Cristina Pignocchino Scopriamo la biologia Capitolo 13 Il sistema endocrino e la riproduzione 3 1. La struttura e le funzioni del sistema endocrino /1 Gli ormoni sono molecole di varia
METABOLISMO DEL GLICOGENO
 METABOLISMO DEL GLICOGENO Il glicogeno muscolare serve come riserva di combustibile per la sintesi di ATP. Il glicogeno epatico serve come riserva di glucosio per mantenere i livelli glicemici. Demolizione
METABOLISMO DEL GLICOGENO Il glicogeno muscolare serve come riserva di combustibile per la sintesi di ATP. Il glicogeno epatico serve come riserva di glucosio per mantenere i livelli glicemici. Demolizione
Adenoipofisi: Ipotalamo: Neuroipofisi: LH*, FSH* GnRH. Vasopressina (ADH) TSH* Ossitocina TRH ACTH* CRH GH # GHRH. Prolattina # * Ormoni tropici
 MALATTIE DELL ASSE IPOTALAMO-IPOFISARIO IPOFISARIO Prof. Carlo Guglielmini Asse ipotalamo-ipofisario ipofisario Ipotalamo: GnRH TRH CRH GHRH Adenoipofisi: LH*, FSH* TSH* ACTH* GH # Prolattina # Neuroipofisi:
MALATTIE DELL ASSE IPOTALAMO-IPOFISARIO IPOFISARIO Prof. Carlo Guglielmini Asse ipotalamo-ipofisario ipofisario Ipotalamo: GnRH TRH CRH GHRH Adenoipofisi: LH*, FSH* TSH* ACTH* GH # Prolattina # Neuroipofisi:
FUNZIONE CELLULARE E TRAFFICO INTRACELLULARE
 FUNZIONE CELLULARE E TRAFFICO INTRACELLULARE Carboidrati proteine Glicolipide Regione ad a-elica di proteina transmembrana Acido grasso Doppio strato Fosfolipidico 5-8 nm Proteina integrale di membrana
FUNZIONE CELLULARE E TRAFFICO INTRACELLULARE Carboidrati proteine Glicolipide Regione ad a-elica di proteina transmembrana Acido grasso Doppio strato Fosfolipidico 5-8 nm Proteina integrale di membrana
Funzioni del sistema renale. I. Mantenimento della costanza del volume e della composizione elettrolitica del liquido extracellulare.
 APPARATO RENALE Funzioni del sistema renale. I Mantenimento della costanza del volume e della composizione elettrolitica del liquido extracellulare. Bilancio dell acqua corporea Funzioni del sistema renale:
APPARATO RENALE Funzioni del sistema renale. I Mantenimento della costanza del volume e della composizione elettrolitica del liquido extracellulare. Bilancio dell acqua corporea Funzioni del sistema renale:
Dotto escretore: trasporta il secreto all esterno. Non c è dotto escretore; il secreto (ormoni) è riversato nel circolo sanguigno
 Sono organi formati da una parte secernente (il parenchima ghiandolare) che è tessuto epiteliale specializzato nella produzione di molecole: il secreto ghiandolare una parte di sostegno (lo stroma ghiandolare)
Sono organi formati da una parte secernente (il parenchima ghiandolare) che è tessuto epiteliale specializzato nella produzione di molecole: il secreto ghiandolare una parte di sostegno (lo stroma ghiandolare)
CORSO DI LAUREA IN PSICOLOGIA A.A. 2015/2016
 CORSO DI LAUREA IN PSICOLOGIA A.A. 2015/2016 FISIOLOGIA DELLA RIPRODUZIONE Ormoni sessuali femminili Ciclo mestruale Fecondazione e Impianto 2 ORMONI SESSUALI FEMMINILI Estrogeni: ormoni steroidei prodotti
CORSO DI LAUREA IN PSICOLOGIA A.A. 2015/2016 FISIOLOGIA DELLA RIPRODUZIONE Ormoni sessuali femminili Ciclo mestruale Fecondazione e Impianto 2 ORMONI SESSUALI FEMMINILI Estrogeni: ormoni steroidei prodotti
17/05/2010. Equilibrio idrico. Variazioni del volume ematico indicono risposte omeostatiche
 Equilibrio idrico Variazioni del volume ematico indicono risposte omeostatiche 1 Ruolo del rene nel bilancio idrico Variazioni dell osmolarità attraverso la midollare 2 Scambio per controcorrente nella
Equilibrio idrico Variazioni del volume ematico indicono risposte omeostatiche 1 Ruolo del rene nel bilancio idrico Variazioni dell osmolarità attraverso la midollare 2 Scambio per controcorrente nella
Leptina. Proteina di 167 aa per circa 16 kda
 Leptina e grelina Leptina Proteina di 167 aa per circa 16 kda La leptina viene prodotta soprattutto negli adipociti del tessuto adiposo bianco. Inoltre è prodotta da tessuto adiposo bruno, placenta, ovaie,
Leptina e grelina Leptina Proteina di 167 aa per circa 16 kda La leptina viene prodotta soprattutto negli adipociti del tessuto adiposo bianco. Inoltre è prodotta da tessuto adiposo bruno, placenta, ovaie,
Sono vietati forme e modi di diffusione, gratuite od onerose, diverse da quelle stabilite dal compilatore.
 Apparato endocrino Il presente materiale didattico e ciascuna sua componente sono protetti dalle leggi sul copyright, sono qui proposti in forma aggregata per soli fini di studio e per uso personale. Sono
Apparato endocrino Il presente materiale didattico e ciascuna sua componente sono protetti dalle leggi sul copyright, sono qui proposti in forma aggregata per soli fini di studio e per uso personale. Sono
Segnalazione cellulare e trasduzione del segnale. Comunicazione fra le cellule
 Segnalazione cellulare e trasduzione del segnale Comunicazione fra le cellule Le cellule comunicano e interagiscono tra loro tramite il fenomeno della segnalazione cellulare Una cellula segnalatrice produce
Segnalazione cellulare e trasduzione del segnale Comunicazione fra le cellule Le cellule comunicano e interagiscono tra loro tramite il fenomeno della segnalazione cellulare Una cellula segnalatrice produce
